Результат интеллектуальной деятельности: Способ прогнозирования развития нефрита в индуцированной модели системной красной волчанки
Вид РИД
Изобретение
Изобретение относится к способу прогнозирования системных воспалительных состояний у здоровых животных, способных привести к развитию нефрита в индуцированной модели системной красной волчанки (СКВ).
В последние годы активно развиваются исследования, связанные с изучением фенотипической разнородности аутоиммунных, аллергических, онкологических заболеваний для разработки подходов персонализированной терапии. Примером фенотипической гетерогенности системной красной волчанки (далее - СКВ) у людей является наличие нефрита (более чем у половины больных) или его отсутствие. Системная красная волчанка (СКВ) - системное аутоиммунное заболевание, при котором сочетание генетических и эпигенетических факторов дает гетерогенную клиническую картину: от кожных проявлений до поражения почек (у 50% больных). Волчаночный нефрит является одним из серьезных проявлений и одним из самых сильных предикторов неблагоприятного исхода СКВ. Актуальным является поиск ранних предикторов нефрита, когда у больных СКВ оценивают разнообразные параметры воспаления (US 2008187944, C12Q 1/46, 2008; КР 101320694, C12Q 1/37, 2013).
В настоящее время относительно лабораторных животных формируется взгляд, учитывающий то, что, несмотря на исходную генетическую идентичность, животные в процессе онтогенеза под действием различных факторов внешней среды приобретают стабильные отличающиеся признаки посредством эпигенетических механизмов. Известна фенотипическая разнородность не только по размерам, весу среди инбредных (чистолинейных) однопометных мышей, разводимых в контролируемых условиях, но они проявляют значительную вариабельность в сложных поведенческих проявлениях. Эпигенетические модификации (влияние внешней среды) не изменяя нуклеотидную последовательность в геноме, вносят коррективы в активность генов, причем изменения эти сохраняются в течение всей жизни индивидуума и могут быть переданы по наследству. Эпигенетические модификации влияют на развитие организма, на темпы старения, они могут провоцировать аутоиммунные и другие заболевания, которые сегодня обозначены как заболевания «образа жизни». Характер эпигенетических изменений во многом зависит от внешней среды.
Собственно, такие модификации - один из самых мощных рычагов влияния среды на организм (Оеу Н., Isbel L, Hickey P., Ebaid В., Whitelaw E. Genetic and epigenetic variation among inbred mouse littermates: identification of inter-individual differentially methylated regions. Epigenetics & Chromatin (2015) 8:54 DOI 10.1186/s13072-015-0047-z). Эпигенетические изменения могут быть связаны с увеличением уровня ЛПС в крови здоровых животных.
Известно, что причиной аутоиммунных заболеваний является наличие липополисахарида (далее - ЛПС) - эндотоксина - продукта бактерий из желудочно-кишечного тракта, который появляется в крови больных и определяет картину воспаления низкой степени выраженности (WO 2008029897, А61K 38/00, 2008). Для изучения механизмов такого воспаления в настоящее время апробируются разнообразные экспериментальные модели. К числу таких моделей относится модель экспериментальной низкодозовой эндотоксемии, когда здоровым людям-добровольцам внутривенно вводится липополисахарид (ЛПС). Ответ на введение ЛПС у части здоровых лиц выявляет отклонения, характерные для больных сердечно-сосудистыми заболеваниями. Реакция на внутривенное введение ЛПС, который активирует врожденный иммунитет и вызывает специфические метаболические последствия, расценивается как интегральный показатель сложных физиологических, молекулярных и генетических взаимодействий, определяющих воспаление у каждого конкретного индивидуума (Patel P.N., Shah R.Y., Ferguson J.F., Reilly M.P. Human Experimental Endotoxemia in Modeling the Pathophysiology, Genomics and Therapeutics of Innate Immunity in Complex Cardiometabolic Diseases. Arterioscler Thromb Vase Biol. 2015; 35(3): 525-534). Введение ЛПС внутривенно здоровым людям, для оценки их реагирования и выявления предрасположенности к системным воспалительным процессам, является более полноценной реакцией по сравнению с условиями in vitro.
Известна модель на мышах C57BL/6, которым производится трансфекция гена лимфопролиферации - Ipr. Введение гена лимфопролиферации Ipr неизбежно вызывает развитие поликлональной активации В-клеток, нарастание титра антиДНК антител, т.е. развитию системной красной волчанки. Модель используется как способ тестирования терапевтических агентов для лечения системной красной волчанки по измерению средней продолжительности жизни, изменению в тканях, органах, клетках, изменению титра антиДНК антител в сыворотке крови (US 2005066378, А61K 67/027, 2005).
Описанные способы не позволяют прогнозировать предрасположенность к системным воспалительным заболеваниям у потенциально здоровых организмов.
Известен способ создания модели СКВ в полуаллогенной модели: перенос клеток селезенки от самок мышей DBA/2 ->самкам (C57BL/6 х DBA2) F1 гибридам. После индукции модели через 12 недель в популяции генетически однородных F1 гибридов у всех мышей имеются признаки СКВ: спленомегалия, гипергаммаглобулинемия, продукция аутоантител к ДНК, при этом у части мышей с более выраженными симптомами СКВ развивается нефрит (СКВнефрит+), а у мышей с менее выраженными симптомами СКВ нефрит отсутствует - сквнефрит-(Колесникова О.П., Кудаева О.Т., Вольский Н.Н., Гойман Е.В., Гаврилова Е.Д., Перминова О.М., Демченко Е.Н., Козлов В.А. Экспериментальная модель аутоиммунного процесса: роль эпигенетической изменчивости в популяции мышей-гибридов. Вестник РАМН 2015; 70 (2): 152-158). Оценка развития нефрита производится через 12 недель после индукции модели по уровню белка в моче. Можно предполагать, что разделение мышей на группы СКВнефрит- и СКВнефрит+, равное примерно 50/50 при индукции модели СКВ, обусловлено у части мышей эпигенетическими изменениями в системе врожденного иммунитета, определяющими более сильный воспалительный ответ, что в дальнейшем приведет к формированию группы СКВнефрит+.
Недостатком способа являются длительные сроки определения развития нефрита при СКВ по уровню белка в моче.
Задачей изобретения является создание способа более раннего прогнозирования развития нефрита в индуцированной модели системной красной волчанки in vivo.
Поставленная задача решается тем, что в способе прогнозирования развития нефрита в индуцированной модели системной красной волчанки (СКВ), здоровым самкам мышам-гибридам (C57BL/6 х DBA2)F1 внутрибрюшинно вводят липополисахарид в дозе 0,5 мкг/кг, затем через 24 часа индуцируют модель СКВ путем внутривенного введения клеток селезенки мышей самок линии DBA/2, на 4-й и 8-й неделе от момента индукции СКВ определяют индекс соотношения нейтрофилов к лимфоцитам крови (N/L) и при достоверном увеличении значения N/L на 8-й неделе относительно 4-й недели от момента индукции СКВ прогнозируют развитие нефрита.
Изобретение, на наш взгляд, является новым и обладает изобретательским уровнем.
Способ осуществляется следующим образом.
1) 27 здоровым самкам мышам - гибридам (C57BL/6 х DBA/2)F1 вводим ЛПС в дозе 0,5 мкг/кг внутрибрюшинно;
2) через 24 часа этим мышам вводим внутривенно клетки селезенки мышей самок линии DBA/2, индуцируя таким образом модель СКВ;
3) на 4-й и 8-й неделе от момента индукции модели определяем индекс N/L (соотношения нейтрофилов к лимфоцитам крови); оцениваем изменение индекса на 8 неделе относительно 4 недели у каждой мыши индивидуально.
4) у части мышей выявлено увеличение индекса N/L на 25%, а у другой части мышей - не установлено изменений индекса (увеличение составило 1,5% - в пределах ошибки);
5) через 12 недель после индукции модели у всех 27 мышей измеряем белок в моче для установления развития нефрита;
6) установлено, что у 14 мышей имеется нефрит (белок больше или равен 3 мг/мл), а у 13 - нефрита нет (белок меньше 3 мг/мл);
Важно, что увеличение индекса N/L выявляет подгруппу мышей СКВнефрит+ до выявления протеинурии, которая начинает определяться у мышей этой группы на 12 неделе от момента индукции модели. Опыт показывает, что через 8 недель можно прогнозировать развитие нефрита в индуцированной модели системной красной волчанки in vivo, а не через 12 недель - как при известных способах.
Пример. Доза ЛПС - 0,5 мкг/кг и индекс N/L как ранний маркер развития нефрита.
Ретроспективный анализ средних значений лейкоцитов, нейтрофилов, лимфоцитов в группе СКВнефрит- и СКВнефрит+ на 4 и 8 неделе от момента индукции модели не выявляет каких-либо существенных различий. При этом средние значения и индивидуальные колебания индекса N/L выявляют тенденцию его увеличения в группе СКВнефрит+ по сравнению с группой СКВнефрит- на 8 неделе по сравнению с 4 неделей от момента индукции модели. Для нормирования колебаний индекса N/L у каждого отдельного животного было подсчитано изменение (увеличение/уменьшение) индекса N/L к восьмой неделе относительно четвертой недели и было установлено, что изменения индекса N/L в группах СКВнефрит- и СКВнефрит+ достоверно отличаются: у мышей СКВнефрит+ выявляется существенное и достоверное увеличение индекса N/L - он составляет в среднем 25,1%, у мышей СКВнефрит- не выявляется существенных изменений индекса (увеличение 1,5% - в пределах ошибки измерения). Эти изменения в группах касаются и частотных характеристик: увеличение индекса N/L выявляется у 10 из 14 мышей СКВнефрит+ и только у 4 из 13 мышей СКВнефрит- (уровень статистической значимости различий индекса с наличием протеинурии по критерию Пирсона х2 соответствует р<0.05).
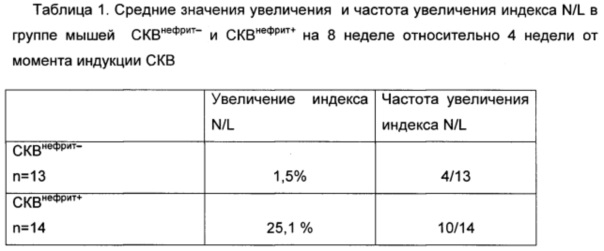
Примечания к таблице 1: n - количество мышей в группе;
в числителе - количество мышей с протеинурией в знаменателе - количество мышей в группе
Мы полагаем, что достоверное увеличение индекса N/L связано с началом развития нефрита в группе мышей CRDнефрит+, что согласуется с данными у человека [Li L, Xia Y., Chen С, Cheng P., Peng C. Neutrophil-lymphocyte ratio in systemic lupus erythematosus disease: a retrospective study. Int J Clin Exp Med. 2015; 8(7): 11026-31]. Возможность выявить группу мышей CRDнефрит+ на сроке 8 недель по увеличению индекса N/L относительно 4 недели представляется важным, т.к. в этот срок у мышей не выявляется протеинурия, на основании которой мы разделяем мышей на фенотипически разнородные группы СКВнефрит+ и СКВнефрит-.
Важно, что введение ЛПС здоровым мышам в дозе 0,5 мкг/кг не провоцирует развитие нефрита, т.к. известно, что введение ЛПС мышам с генетически обусловленной СКВ убыстряет и утяжеляет развитие нефрита. Пример 2. Было обнаружено, что после введения интактным реципиентам ЛПС в дозе 0,5 мкг/кг за сутки до индукции модели, через 12 недель у 20 мышей из 38 развился нефрит, у 18 мышей нефрита не было, т.е. процентное соотношение мышей СКВнефрит+/СКВнефрит- составило 53/47.
Введение ЛПС в дозе 0,5 мкг/кг за сутки до индукции процесса не изменяет частоты вариантов СКВнефрит+/СКВнефрит-, которое при стандартных условиях опыта в среднем также примерно равно 50/50. Таким образом, уже через 8 недель можно прогнозировать развитие нефрита в индуцированной модели системной красной волчанки in vivo, а не через 12 недель - как при известных способах.

