Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ
Вид РИД
Изобретение
Настоящее изобретение относится к медицине, в частности к клинической иммунологии и аллергологии, и касается способа лечения бронхиальной астмы. Бронхиальная астма (БА) является одним из самых распространенных аллергических заболеваний в мире, и с каждым годом наблюдается рост частоты заболеваемости (GINA Report, Global Strategy for Asthma Management and Prevention. 2014). В России по данным статистики Министерства здравоохранения ежегодный прирост числа больных с диагнозом бронхиальная астма составляет 7%. Поскольку бронхиальная астма характеризуется как хроническое воспалительное заболевание дыхательных путей, сопровождающееся обструкцией бронхов и их гиперреактивностью, то результатом является значительное снижение социальной и физической активности, качества жизни. Тяжелые формы заболевания сопровождаются нарушениями органов дыхания и других систем организма, высокой частотой утраты трудоспособности, требуют длительного приема лекарственных средств, и в конечном итоге приводят к инвалидизации пациентов и ранней смертности (Асанов А.Ю., Намазова Л.С, Пинелис В.Г. и др. Генетические основы бронхиальной астмы. Педиатрическая фармакология, 2008, т. 5, №4, стр. 31-37).
Пациенты с БА характеризуются увеличением в дыхательных путях активированных CD4+ лимфоцитов, причем их количество четко связано с тяжестью заболевания (Larche М., Robinson D.S., Kay А.В. The role of Т lymphocytes in the pathogenesis of asthma. J. Allergy. Clin. Immunol., 2003, vol. 111, N. 3, p. 450-463). Большинство из СD4+-клеток продуцирует цитокины IL-4, IL-5 и IL-13, которые обуславливают привлечение эозинофилов и тучных клеток к месту воспаления, переключению синтеза иммуноглобулинов на продукцию IgE и ремоделированию ткани (Finkelman F.D., Hogan S.P., Hershey G.K. et al. Importance of cytokines in murine allergic airway disease and human asthma. J. Immunol., 2010, vol. 184, N. 4, p. 1663-1674).
В основе патогенеза БА лежит дисбаланс Th-1 и Th2-клеток с преобладанием последних, что отчасти связано с дисфункцией Т-регуляторных клеток (Трег) (Palomares О., Martin-Fontecha М., Lauener R. et al. Regulatory T cells and immune regulation of allergic diseases: roles of IL-10 and TGF-β. Genes and Immunity, 2014, vol. 15 (8), p. 511-520). Поскольку, как отмечает ряд авторов, в норме Трег способны подавлять активность как Th1, так и Th2 клеток, причем их действие проявляется сильнее на те субпопуляции, функция которых повышена (Sakaguchi S. Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses. Annu. Rev. Immunol., 2004, vol. 22, p. 531-562; Shevach E.M. CD4+ CD25+ suppressor T cells: more questions than answers. Nat. Rev. Immunol., 2002, vol. 2, p. 389-400).
Свою функцию супрессорные Трег осуществляют различными способами: путем секреции цитокинов (IL-10, TGF-β), прямых контактов с основными участниками иммунной реакции, и даже реализацией цитолиза (Akdis С.А. and Akdis М. Mechanisms and treatment of allergic disease in the big picture of regulatory T cells. J. Allergy ClinImmunol., 2009, vol. 123 (4), p. 735-746; Palomares O., Yaman G., Azkur A.K., et al. Role of Treg in immune regulation of allergic diseases. Eur. J. Immunol., 2010, vol. 40, p. 1232-1240; Fujita H., Meyer N., Akdis M., Akdis C.A. Mechanisms of Immune Tolerance to Allergens. ChemImmunol Allergy, 2012, vol. 96, p. 30-38).
Известны физические способы лечения бронхиальной астмы. Например, известны: способ лечения в условиях высокогорного климата с предварительным определением в крови больных количества Т-розеткообразующих лимфоцитов и иммуноглобулинов класса IgG (SU 1228862, А61K 39/00, 1986); способ лечения, основанный на комплексном воздействии на организм больного и заключающийся в проведении курса рефлекторно-корригирующей терапии путем механического сдавливающего и разминающего воздействия на покровные ткани спины в области проекции симпатического ствола, в сочетании с воздействием ударами ладони на грудную клетку с последующим ее неоднократным сжатием на выходе (RU 2044533, A61H 23/00, 1995); способ лечения воздействием полупроводникового лазера с синхронизацией его с ритмами пульса и дыхания (RU 2114653, A61N 5/06, 1998); способ лечения, включающий неинвазивную передачу энергии отдельным нервным волокнам, при этом передаваемые импульсы энергии, содержащие магнитные и/или электрические, механические и/или акустическую и оптическую и/или тепловую энергии, стимулируют выбранные нервные волокна (SU 2016 243375, А61N 1/36, 2016).
Недостатком физических способа лечения является подбор оптимального физического воздействия, которое бы не оказывало повреждения и/или не осложняло течение заболевания и временного промежутка воздействия. В случае лечения в условиях высокогорного климата недостатком является смена места жительства, так как данный вид лечения может занимать длительное время.
Известны способы лечения бронхиальной астмы с помощью ингаляций, например, с использованием раствора эпсилон-аминокапроновой кислоты в качестве противоотечного средства (RU 2146926, А61K 31/195, 2000); способ при котором наряду с базисной терапией вводят ронколейкин одновременно в виде ингаляций и инъекций (RU 2348431, А61М 15/00, 2009).
Недостатком ингаляционных способов является частота применения ингалятора, который необходимо постоянно носить с собой, а также привыкание к препаратам и необходимость индивидуального подбора лечения.
Известны способы лечения бронхиальной астмы с помощью химических веществ, например, введением индометацина (SU 1388047, А61K 31/405, 1988); включением в схему традиционной терапии пероральное введение левамизола и введение параллельно и внутримышечно рузама (RU 2288715, А61K 31/425, 2006); включение в схему традиционной терапии внутривенное введение гемодеза и введение параллельно внутримышечно рузама (RU 2288741, A61K 39/085, 2006); в схему базисной терапии дополнительно вводят тимоген в сочетании с препаратом рузам (RU 2309755, А61K 35/26, 2006); введение в базисную терапию рузама и дополнительным приемом нуклеинат натрия и гипоксена в капсулах (RU 2360698, А61K 39/085, 2009); введения интраназально агониста TLRS-рецептора бензо[b]азепина VTX-378 в лекарственной форме по определенной схеме (RU 2587061, А61K 31/5513, 2016); введение PPAR-γ-агониста всеми способами (US 2004122059, A61K 31/00, 2004); введение препарата, имеющего иммуностимулирующую активность для лечения бронхиальной астмы, содержащего ингредиенты: борнеол, фенолы, терпинеол, борниловый ацетат, бициклические терпены, продукт полимеризации уксусной кислоты и воду (DE 3045483, А61K 31/045, 1982); введение сахар-фосфатного соединения в качестве лекарственного средства для ингаляции, либо самого по себе или в качестве компонента смешанного состава (US 5858985, А61K 31/70, 1999); введение рибавирина в качестве противовирусного агента (US 5767097, А61K 31/7056, 1998; US 6150337, А61K 31/7056, 2000; US 2003212015, А61K 31/7056, 2003).
Недостатком лечения бронхиальной астмы с помощью химических веществ является наличие побочных эффектов на другие органы и жизненноважные системы организма.
Известны способы лечения бронхиальной астмы с помощью ДНК-вакцин (WO 2004019974, А61K 39/00, 2004; CN 103157113, А61K 48/00, 2013; US 2006147417, А61K 38/20, 2006). При данном способе лечения осуществляют модификацию клеток организма, предназначенных для лечения in vitro, и затем вводят пациенту.
Недостатком способа является риск развития онкозаболеваний.
Известны способы лечения бронхиальной астмы с помощью аллергенов, например, введением пациенту постепенно возрастающей дозы композиции, содержащей аллерген (US 6488937, А61K 31/00, 2002); введением причинно-значимого аллергена и дополнительно янтарной кислоты перорально (RU 2236849, А61K 31/194, 2004); на фоне проведения подкожной аллергенспецифической иммунотерапии причинно-значимыми аллергенами, дополнительно вводят интраназально «Гриппферон» с одновременным проведением гирудотерапии (RU 2533284, A61K 35/62, 2014);одновременно с введением аллергена больному назначают терапию радоновыми ваннами (SU 1695925, А61Н 33/04, 1991); введением вакцины, содержащей эпитопы аллергенов (CN 101318017, А61K 39/35, 2008); введением аллергена с добавлением адъюванта (US 7214380, А61K 38/00, 2007).
Недостатком способа является необходимость выявления конкретного аллергена, что связно с большими затратами. Кроме того, это не всегда возможно, поскольку может существовать несколько аллергенов, вызывающих астму (поливалентная сенсибилизация).
Известен способ лечения и профилактики астмы с помощью толерогенных дендритных клеток, индуцированных in vitro высокими дозировками интерферона-гамма (IFN-γ) с последующим введением в организм пациента (SI 23342, А61K 35/00, 2011).
Недостатком способа является сложность подготовки толерогенных дендритных клеток, а также возможное изменение свойств клеток при введении их в организм.
Известны способы лечения бронхиальной астмы с использованием Т-лимфоцитов. Такое лечение приводит, в частности, к индукции Т-регуляторных клеток, которые подавляют Тh2-ответ на аллерген (JP 2006254759, А61K 31/7088, 2006; RU 2277422, А61K 35/12, 2006; ЕР 2687593, А61K 35/12, 2014).
Недостатком способа является применение определенного антигена или ДНК-конструкции, кодирующей антигенный эпитоп, для получения вакцины, поскольку не всегда удается выявить причинный аллерген. Кроме того, вследствие индивидуальных особенностей пациентов представляется сложным процесс индукции функционально активных Т-регуляторных клеток в организме.
Используемые в настоящее время стандартные методы лечения являются недостаточно эффективными, что послужило основанием для поиска новых направлений системной терапии бронхиальной астмы.
Известен способ лечения аллергических заболеваний, в том числе бронхиальной астмы, заключающийся в том, что больному вводят шестикратно подкожно в латеральную поверхность предплечья аутолимфоциты в постепенно возрастающих дозах от двух до шести миллионов клеток с интервалом между инъекциями 2-4 дня за один курс лечения (SU 1793923, А61K 35/14, 1992).
Недостатком способа является частота введения клеток, а также развитие аллергических симптомов непосредственно после инъекции примерно в 30% случаев. Введение неактивированных лимфоцитов не гарантирует длительную коррекцию патологических иммунных реакций. Это приводит к необходимости проведения многократных курсов лечения.
Наиболее близким к заявляемому является способ лечения бронхиальной астмы методом аутолимфоцитотерапии, заключающийся в предварительном получении аутологичных лимфоцитов из венозной крови больного, получение взвеси аутологичных лимфоцитов в физиологическом растворе и последующее их подкожное введение в латеральную поверхность плеча. Введение взвеси аутологичных лимфоцитов в физиологическом растворе осуществляют в дозах от 0,1 до 1,0 мл взвеси при концентрации аутологичных лимфоцитов 105-107 клеток/мл, введение проводят от 4 до 10 раз с интервалом между ними от 2 до 6 дней (RU 2395305, А61М 1/38, 2010).
Недостатком способа является - неспецифическое воздействие на измененный иммунный ответ у больных бронхиальной астмой, что может приводить к усилению аллергических реакций.
Задачей изобретения является создание способа лечения бронхиальной астмы посредством специфического воздействия на измененный иммунный ответ путем индукции антиэрготипического ответа аутологичными активированными Т-лимфоцитами.
Поставленная задача решается тем, что в способе лечения бронхиальной астмы методом аутолимфоцитотерапии, заключающемся в предварительном получении аутологичных лимфоцитов из венозной крови больного, получении взвеси аутологичных лимфоцитов в физиологическом растворе и последующем их подкожном введении в латеральную поверхность плеча, после выделения аутологичных лимфоцитов из венозной крови больного их активируют анти-CD3 антителами и рекомбинантным человеческим интерлейкином - 2, затем культивируют в течение не менее 10 суток, а подкожное введение осуществляют инициирующим курсом 1 раз в неделю в течение 4 недель, последующий поддерживающий курс состоит из 6 месяцев по одной инъекции в месяц, причем одна доза содержит от 30 млн до 60 млн аутологичных активированных Т-лимфоцитов в двух миллилитрах физиологического раствора, лечение проводят одновременно с базисной терапией ингаляционными препаратами.
В качестве ингаляционного препарата используют глюкокортикостероиды, например, будесонид, бекламетазон, а также селективные бета2-адреномиметики, например, фенотерол, формотерол и их комбинации.
Данное изобретение, на наш взгляд, является новым. Выделение аутологичных лимфоцитов из венозной крови больного и их активация анти-CD3 антителами и рекомбинантным человеческим интерлейкином - 2 с последующим культивированием в течение не менее 10 суток позволяет получить более 80% активированных Т-лимфоцитов. Полученные активированные Т-лимфоциты могут представлять активационные маркеры (эрготопы) Т-лимфоцитам, находящимся в организме пациента, и индуцировать в организме антиэрготипический ответ. Затем пациенту вводят эффективную дозу аутологичных активированных Т-лимфоцитов. Предпочтительные дозировки клеточного препарата содержат от 30 до 60 млн аутологичных активированных Т-лимфоцитов в двух миллилитрах физиологического раствора. Дозу выбирали экстраполяцией доз Т-лимфоцитов, эффективных у экспериментальных животных, исходя из относительных площадей кожной поверхности (Ben-Nun A., Wekerle Н., Cohen I.R. Vaccination against autoimmune encephalomyelitis (EAE): attenuated autoimmune T lymphocytes confer resistance to induction of active EAE but not to EAE mediated by the intact T lymphocyte line. Eur J. Immunol. 1981, vol. 11 (11), p. 949-52). Опытным путем было установлено, что введение дозы менее 30 млн аутологичных активированных Т-лимфоцитов в двух миллилитрах физиологического раствора является неэффективным, т.е является недостаточным для развития антиэрготипического ответа. Введение дозы свыше 60 млн аутологичных активированных Т-лимфоцитов в двух миллилитрах физиологического раствора вызывает развитие местных и системных побочных реакций (в виде покраснения, припухлости и пр.), а в ряде случаев вызывает обострение бронхиальной астмы.
Инициирующий курс, состоящий из 1 инъекции клеточного препарата в неделю в течение месяца, направлен на формирование и активацию в организме больного бронхиальной астмой достаточного количества антиэрготипических Т-лимфоцитов, представленных как CD4+, так и CD8+ лимфоцитами. Антиэрготипические Т-лимфоциты способны распознавать активированные Т-лимфоциты, в том числе клоны, участвующие в патогенезе бронхиальной астмы. В индукции антиэрготпического ответа не задействованы механизмы распознавания антиген-специфичных областей Т-клеточных рецепторов, а участвуют детерминанты активированных антигенном/аллергеном Т-лимфоцитов, или эрготопы, являющиеся общими для всех активированных клеток и появляющиеся на их поверхности исключительно после активации. Результатом антиэрготипического ответа является клеточно-опосредованный лизис активированных Т-лимфоцитов в организме. Поддерживающий курс, состоящий из 1 инъекции 1 раз в месяц, направлен на поддержание индуцированного антиэрготипического ответа и стабилизацию состояния пациента с бронхиальной астмой.
Способ осуществляется следующим образом.
Периферическую кровь, стабилизированную гепарином (10 ед/мл), объемом 200 мл инкубируют 45 минут в термостате при 37°С. В асептических условиях полученную в результате лейковзвесь собирают, разбавляют забуференным физиологическим раствором с ЭДТА (ЗФР-ЭДТА), содержащим 25 мкг/мл тиенама, 50 мкг/мл гентамицина и 0,5% фетальной сыворотки телят FCS; затем наслаивают в стерильные пластиковые пробирки типа Falcon на 50 мл на 10 мл среды для выделения лимфоцитов LSM и центрифугируют в течение 40 минут при 1,5 тыс. об/мин в центрифуге СМ-6МТ. Образовавшееся кольцо мононуклеарных клеток собирают и отмывают дважды ЗФР-ЭДТА при 1,5 тыс.об/мин в течение 15 минут. Клеточный осадок ресуспендируют в 10 мл среды RPMI-1640, содержащей 25 мкг/мл тиенама, 50 мкг/мл гентамицина, и подсчитывают количество клеток в камере Горяева.
Все полученные МНК садят в культуральные флаконы 150 см2 из расчета 2 млн клеток на 1 мл полной среды с 10% FCS и активаторами: 1 мкг/мл анти-CD3 антител и 100 ед/мл человеческого рекомбинантного интерлейкина-2 (IL-2). На 7 день заменяют 50% среды на новую с таким же составом. На 10 день культивирования активированные Т-лимфоциты собирают в стерильные пластиковые пробирки типа Falcon на 50 мл, осаждают при 1,5 тыс.об/мин в течение 15 минут, ресуспендируют в 10 мл 10% раствора человеческого альбумина и подсчитывают количество клеток.
Добавляют диметилсульфоксид из расчета, чтобы в результате получить от 30 до 60 млн клеток в 1 мл. После чего клетки переносят (аликвотируют) в криопробирки по 1 мл. Клетки перед введением хранили в морозильной камере при -80°С.
Перед введением в асептических условиях клетки переносят в стерильные пластиковые пробирки на 15 мл, к ним добавляют 10 мл стерильного физиологического раствора и центрифугируют в течение 5 минут при 1,2 тыс. об/мин в центрифуге СМ-6МТ. Для получения клеточного препарата осадок ресуспендируют в 2 мл физиологического раствора и в таком виде вводят подкожно пациентам в латеральную поверхность плеча.
Предложенный способ лечения был проверен в клинических условиях. Клинические испытания проводились на базе отделения аллергологии клиники иммунопатологии ФГБНУ «Научно-исследовательского института фундаментальной и клинической иммунологии», г. Новосибирск. Его применяли для лечения пациентов с бронхиальной астмой (БА). Пациентов в исследования включали согласно следующим критериям.
Критерии включения:
1. Мужчины и женщины в возрасте от 18 до 65 лет включительно
2. Диагноз астмы верифицирован не менее, чем за 12 месяцев до включения пациента в исследование согласно критериям NIH, 2007.
3. Пациенты должны принимать базисную терапию ИГКС не менее 12 недель до включения в исследование.
4. Отсутствие полного контроля астмы.
5. Значение ОФВ1 от 50 до 90% перед включение в исследование.
6. В анамнезе должно быть не менее 1 обострения астмы за последний год.
7. Мужчины и женщины детородного возраста не должны планировать деторождение на период исследования, а при включении в исследование должны использовать адекватные меры контрацепции (кроме приема оральных контрацептивов).
8. Пациенты должны быть в достаточной степени мобильными, чтобы следовать графику визитов.
9. Больные должны быть в состоянии дать информированное согласие, и это согласие должно быть получено до начала какой-либо скрининговой процедуры.
Критерии исключения
1. Одновременное участие в другом клиническом исследовании
2. Несоответствие критериям включения
3. Наличие серьезных инфекций типа гепатита, пневмонии, пиелонефрита, герпес зостер в предшествующие скринингу 3 месяца
4. Тяжелое соматическое состояние, обусловленное прогрессирующими заболеваниями печени, сердечно-сосудистой системы, почек, органов дыхания, системы крови, а также эндокринного или церебрального происхождения
5. Любое известное злокачественное заболевание или наличие анамнеза рака в течение предшествующих 5 лет
6. Наличие активного алкоголизма или признаков алкогольного поражения печени
7. Наличие острого инфекционного заболевания
8. Любая вакцинация в предшествующие 3 месяца
На основании данных критериев в исследование были включены 15 больных бронхиальной астмой (5 мужчин и 10 женщин). Возраст пациентов составлял от 20 до 59 лет (средний возраст 36,8±3,4 лет). По тяжести заболевания практически всем пациентам была определена средняя тяжесть бронхиальной астмы (14 человек) и у 1 пациента классифицирована тяжелая степень тяжести. У 10 пациентов диагностирована атопическая форма бронхиальной астмы и у 5 пациентов - инфекционно-зависимая.
Полученные в процессе активации in vitro клетки фенотипировали по экспрессии основных маркеров Т-лимфоцитов (CD3, 4, 8) и эрготоп-ассоциированных маркеров (CD25, HLA-DR) с помощью моноклональных антител, конъюгированных с флуорохромами, методом проточной цитометрии. Культивированные в течение 10 суток клетки преимущественно были представлены CD3+-лимфоцитами (более 85% из лимфоцитарного гейта). При этом содержание CD4+ лимфоцитов составляло 34±4,0%, СD8+-клеток - 58±2,0%, т.е. в культуре количество СD8+-лимфоцитов было достоверно больше в 1,7 раза, чем CD4+ (табл.1). В процессе активации происходило достоверное увеличение числа клеток, позитивных по эрготоп-ассоциированным маркерам (табл. 1). Увеличение популяции CD4+25+клеток происходило преимущественно за счет активированных, а не регуляторных Т-клеток. Так как число Т-регуляторных клеток CD4+25+127low в культуре составляло 5,6±0,8% и не отличалось от исходного значения 5,8±1,08%.
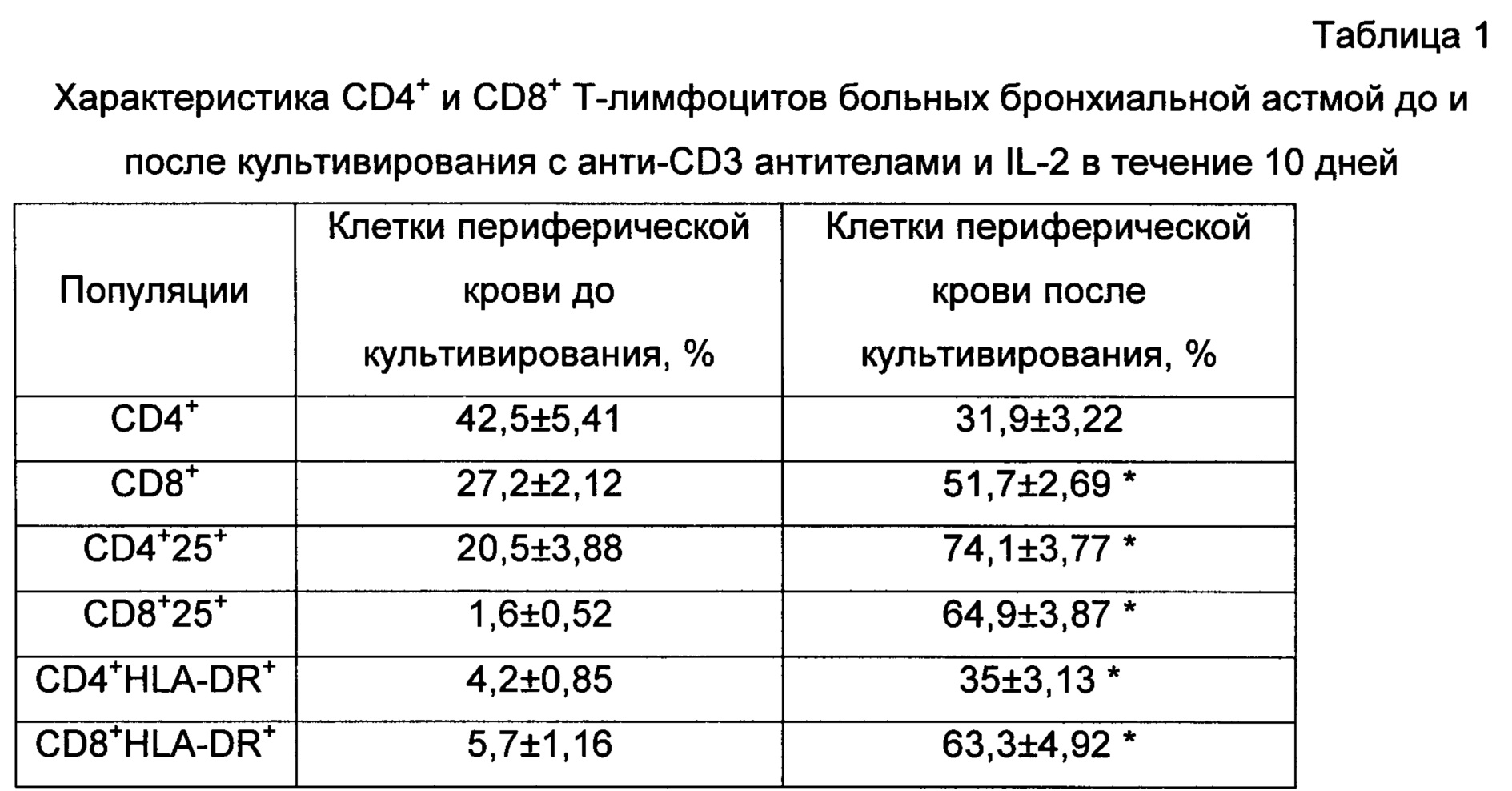
* - достоверное отличие между группами до и после культивирования, р<0,05, критерий Вилкоксона
Данные представлены в виде среднего и ошибки среднего.
Таким образом, Т-лимфоциты пациентов с бронхиальной астмой в процессе культивирования приобрели статус активированных клеток, с экспрессией маркеров активации CD25, выступающего в роли эрготопа, и HLA-DR, необходимого для презентации данных эрготопов на поверхности лимфоцитов. Полученные активированные Т-лимфоциты при введении в организм будут индуцировать антиэрготипические регуляторы, которые, учитывая особенности их механизма действия, потенциально способны контролировать аллергическое воспаление при бронхиальной астме.
Проведенные методы исследования для выявления клинической эффективности применения аутологичных активированных Т-лимфоцитов включали:
- оценку качества жизни больных бронхиальной астмой по стандартизированному опроснику Asthma Quality of Life Questionaire (AQLQ(S)), включающему разделы «симптомы», «ограничение активности», «эмоциональная сфера», «влияние окружающей среды»;
- определение функции внешнего дыхания: уровня объема форсированного выдоха за 1 секунду (ОФВ1), жизненной емкости легких (ЖЕЛ), форсированной жизненной емкости легких (ФЖЕЛ), индекса Тиффно;
- оценку показателей иммунного статуса.
Оценка состояния пациентов и исследование клиническо-иммунологических параметров проводилась перед введением аутологичных активированных Т-лимфоцитов, через 2 месяца (5 введение) и через 7 месяцев (10 введение) от начала иммунотерапии. Отслеживалось возникновение местных и системных побочных реакций на введение клеток.
Однократно у 3 из 15 пациентов (20% случаев) были отмечены местные побочные реакции в виде гиперемии, припухлости, болезненности в месте инъекции, у остальных 12 пациентов местные побочные реакции отсутствовали. Системных проявлений в виде субфебрилитета, астенического синдрома или обострения заболевания ни у одного пациента зафиксировано не было.
К концу лечения (10 введение) значительного клинического улучшения (снижения симптомов более чем на 85%) достигли 8 пациентов (53,3%), улучшения (уменьшения симптомов на 50-85%) - 4 пациента (26,7%), незначительного улучшения (уменьшение симптомов менее чем на 50%) - 2 пациента (13,3%), без изменений - 1 пациент (6,7%). Таким образом, уменьшение симптомов бронхиальной астмы более чем на 50% в ходе лечения аутологичными активированными Т-лимфоцитами было достигнуто в 80% случаев, ухудшения состояния не было выявлено ни в одном случае, и только в 6,7% случаев не было получено изменений.
Для оценки качества жизни больных бронхиальной астмой использовали один из самых апробированных высоковалидных, чувствительных и воспроизводимых опросников AQLQ(S), который пациенты заполняли самостоятельно. Опросник содержит 32 вопроса, сгруппированных в 4 блока, которые затрагивают такие значимые для больных БА области жизни, как выраженность симптомов болезни, ограничение активности, эмоциональное состояние и зависимость от влияния окружающей среды. Шкала ответов оценивается по 7-балльной шкале, где 1 балл - это максимальное влияние БА, а 7 баллов - отсутствие такового.
Перед проведением иммунотерапии исследование качества жизни больных БА выявило низкие значения во всех блоках, что говорит о существенном влиянии заболевания на жизнь пациентов (табл. 2). Через 2 месяца после начала иммунотерапии аутологичными активированными Т-лимфоцитами в блоке «Ограничение активности» наблюдалось достоверное увеличение на 10 баллов в сравнении с исходным значением. Рост остальных показателей был недостоверным по сравнению с первоначальным уровнем. Через 7 месяцев от начала лечения наблюдалось достоверное улучшение практически во всех блоках опросника, в блоке «Симптомы» прирост составил в среднем 8 баллов и носил характер тенденции. Таким образом, в процессе иммунотерапии аутологичными активированными Т-лимфоцитами отмечено улучшение клинических симптомов, возрастание физической активности (блок «Ограничение активности»), повысилось настроение, уменьшились озабоченность по поводу болезни, тревога из-за приступов удушья и опасение остаться без необходимых лекарств (блок «Эмоциональная сфера»), а также понизилась чувствительность к негативным факторам окружающей среды: табачному дыму, пыли, резким запахам, средствам парфюмерии и т.д.
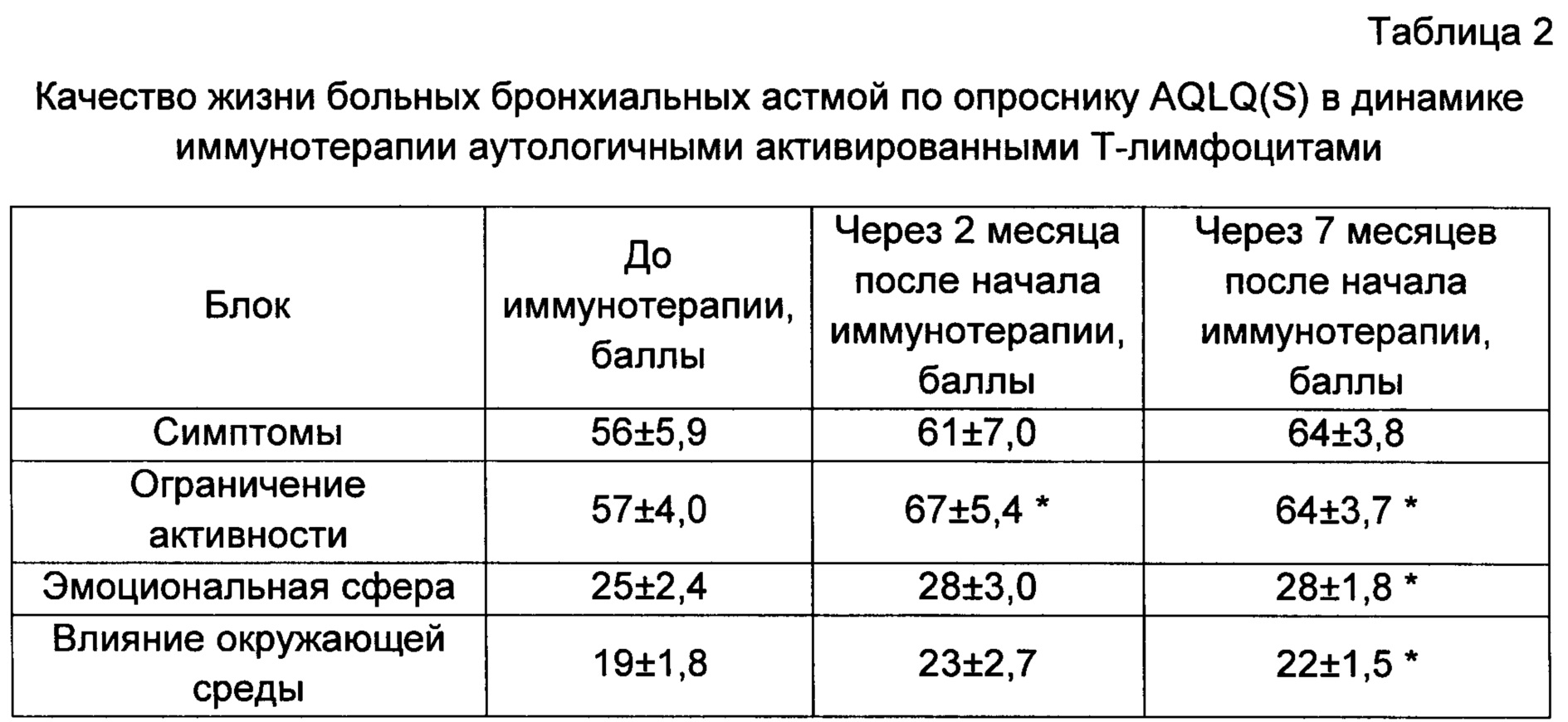
* - достоверные отличия при сравнении с показателями до иммунотерапии, р<0,05.
Данные представлены в виде среднего и ошибки среднего.
Функция внешнего дыхания у пациентов с БА перед включением в исследование характеризовалась низкими показателями: ОФВ1 составлял 85±7,0% от должного, ФЖЕЛ - 97±5,6%, индекс Тиффно - 86±7,5% (табл. 3). В ходе иммунотерапии наблюдалось увеличение исследуемых показателей.
Достоверное отличие по сравнению с исходным уровнем было выявлено по показателю форсированной жизненной емкости легких через 7 месяцев (10 введение) после начала иммунотерапии. То есть, на протяжении 7 месяцев проведения иммунотерапии аутологичными активированными Т-лимфоцитами у пациентов с БА наблюдалось улучшение показателей функции внешнего дыхания, что является важным критерием эффективности лечения данного заболевания.
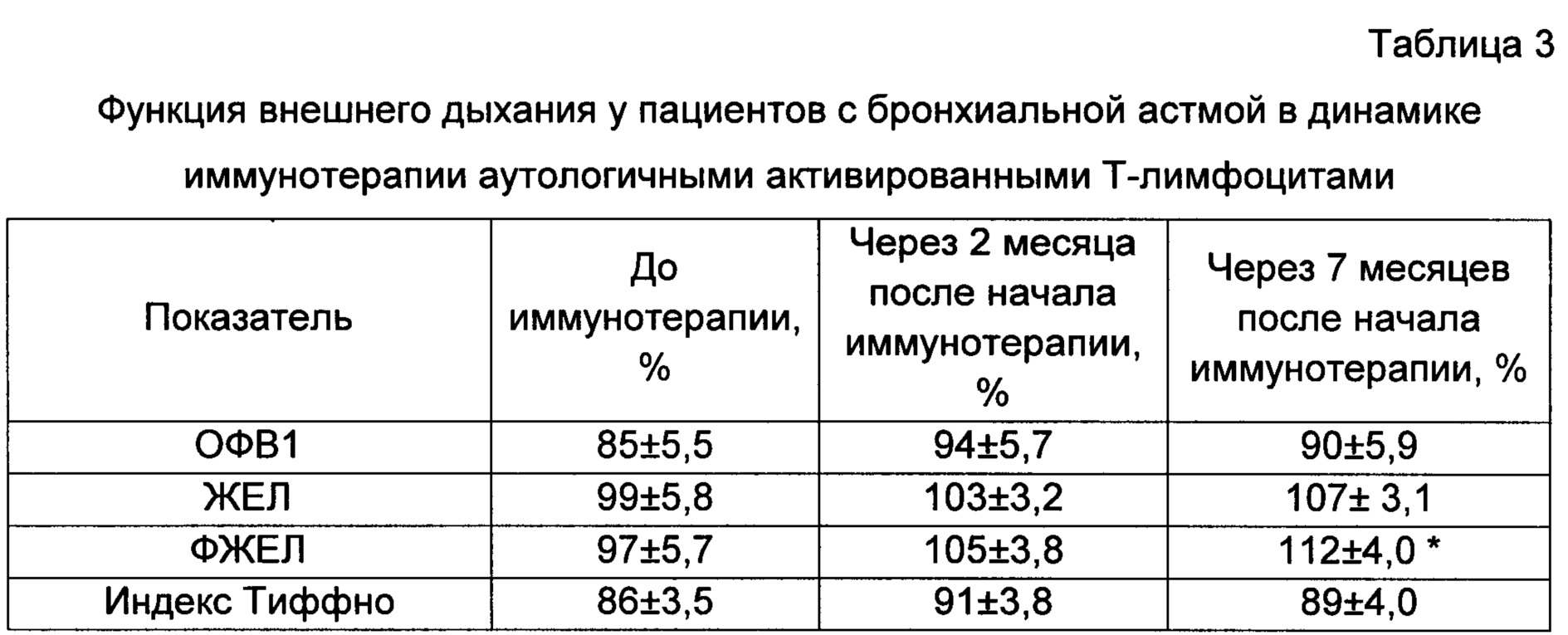
* - достоверные отличия при сравнении с показателями до иммунотерапии, р<0,05.
Данные представлены в виде среднего и ошибки среднего.
При проведении иммунотерапии аутологичными активированными Т-лимфоцитами изучали также динамику показателей иммунного статуса, чтобы установить иммунокоррегирующее действие данного вида лечения (табл. 4).
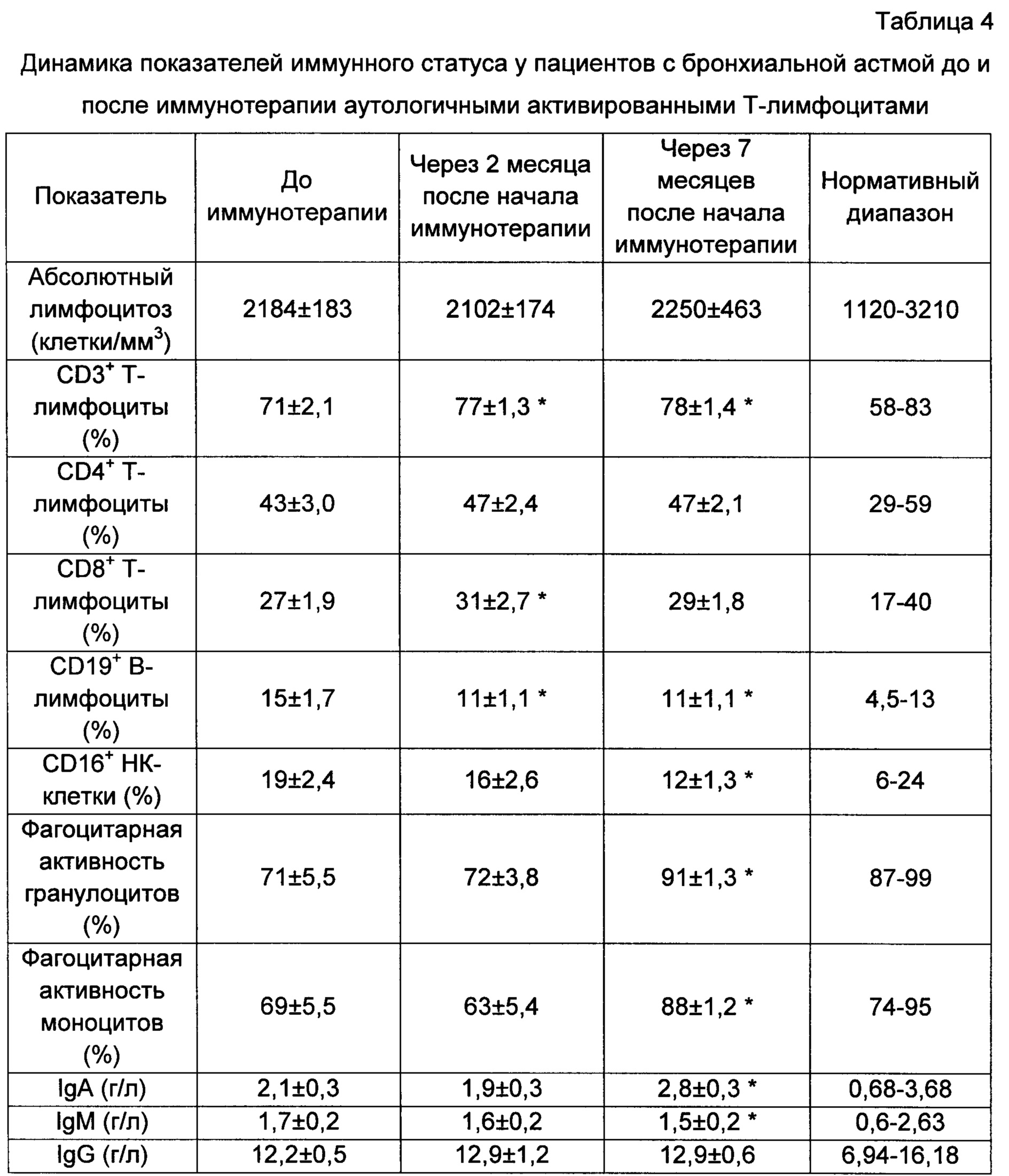
* - достоверные отличия при сравнении с показателями до иммунотерапии, р<0,05.
Данные представлены в виде среднего и ошибки среднего.
До проведения иммунотерапии аутологичными активированными Т-лимфоцитами пациенты с БА характеризовались повышенным числом CD19+В-лимфоцитов и сниженным количеством фагоцитирующих гранулоцитов и моноцитов по сравнению с нормативными показателями. Через 2 месяца после начала лечения наблюдалось достоверное увеличение CD3+ и CD8+ Т-лимфоцитов в периферической крови, что может свидетельствовать об индукции антиэрготипического ответа. Так как эффекторные антиэрготипические клетки преимущественно представляют собой цититотксические CD8+ лимфоциты, действующие в отношении активированных Т-лимфоцитов не зависимо от их антигенной специфичности.
Одним из проявлений БА является активация гуморального звена иммунной системы, в ходе иммунотерапии на 5 и 10 введение достоверно снизилось число CD19+ В-лимфоцитов, оно достигло пределов нормы. Возможно, в основе механизмов снижения числа В-лимфоцитов лежит уменьшение числа CD23+ активированных В-лимфоцитов, несущих низкоаффинный рецептор IgE. На численность В-лимфоцитов при индукции антиэрготипического ответа может влиять способность антиэрготипических регуляторных клеток ингибировать хелперную активность Т-лимфоцитов, а также продукция эффекторными антиэрготипическими клетками Thl-цитокинов, в том числе IFN-y, которые снижают число CD23+ активированных В-лимфоцитов (Leung D.Y.M., Boguniewicz М., Howell M.D., Nomura I., Hamid Q.A. New insights into atopic dermatitis. // J. Clin. Invest., 2004, vol. 113 (5), p. 651-657.).
К концу поддерживающего курса (10 введение) наблюдалось снижение не только CD19+ В-лимфоцитов, но и CD16+ натуральных киллерных (НК) клеток, что может быть связано с уменьшением воспаления в легочной ткани и предрасположенности к бактериальным и вирусным инфекциям. Об этом же свидетельствует увеличение иммунглобулина (Ig) А, который осуществляет защитную функцию слизистых оболочек дыхательной и других систем от инфекций. У пациентов с БА после иммунотерапии усилилась фагоцитарная активность моноцитов и гранулоцитов, она достигла нормативного диапазона. В экспериментах доказано, что иммунизация активированными антигенспецифичными клонами Т-лимфоцитов приводит к появлению эффекторных клеток реакции гиперчувствительности замедленного типа (ГЗТ), при этом была зафиксирована выраженная реакция ГЗТ и на введение активрованных Т-лимфоцитов другой антигенной специфичности, и на покоящиеся клетки. Поэтому увеличение числа фагоцитирующих гранулоцитов и моноцитов может свидетельствовать о реализации антиэрготпического ответа у пациентов с БА.
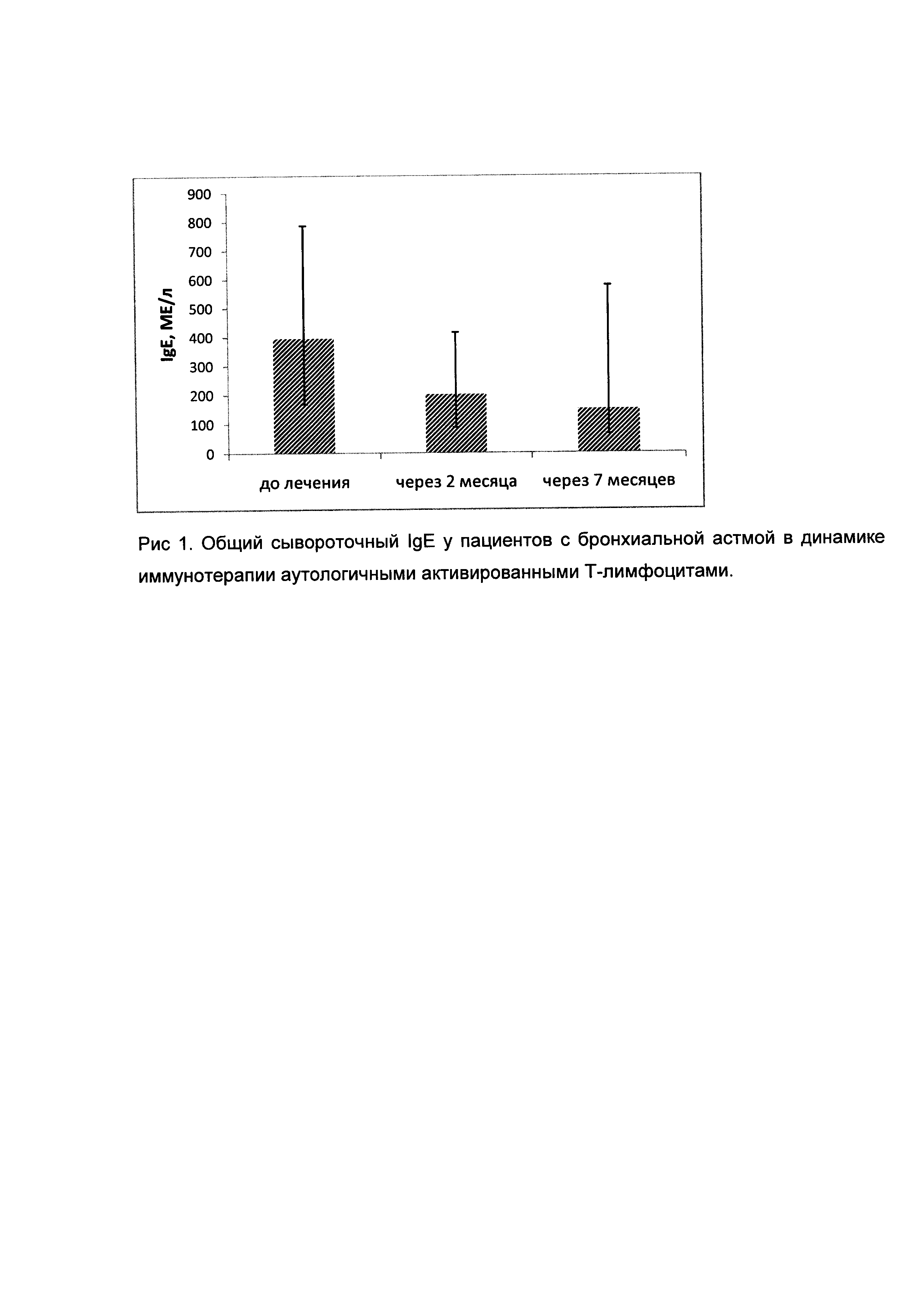
На рисунке 1 приведены значения общего сывороточного IgE у пациентов с бронхиальной астмой в динамике иммунотерапии аутологичными активированными Т-лимфоцитами. Через 2 месяца (5 введение), в ходе иммунотерапии аутологичными активированными Т-лимфоцитами наблюдалось достоверное снижение общего сывороточного IgE у пациентов с БА, что, учитывая снижение симптомов и проявлений заболевания, говорит о клинической эффективности данного способа лечения.
Пример 1
Больная С, 42 лет, с диагнозом: Бронхиальная астма, атопическая, персистирующее течение средней степени тяжести, неконтролируемая, обострение. Поступила в аллергологическое отделение в связи с ухудшением состояния, частыми приступами удушья, сопровождающимся кашлем с трудно отделяемой мокротой, выраженной одышкой с преимущественно затрудненным выдохом. Считает себя больной с 18-летнего возраста, когда впервые появилась необычная реакция: каждую весну во время цветения растений у больной в течение 1-2-х месяцев наблюдался выраженный насморк и слезотечение, сухой кашель. Через 4-5 лет впервые без видимой причины неожиданно возник приступ удушья, после этого приступы удушья стали беспокоить больную 1-2 раза в месяц. Одновременно с этим стала замечать, что приступы провоцировались различными внешними причинами: некоторыми запахами, косметическими средствами, духами, дезодорантами. Как и раньше, состояние ухудшалось весной, в периоды цветения растений. Последние 10 лет находится на диспансерном учете, неоднократно лечилась стационарно, получает базисную терапию препаратом Беклазон ЭКО (Беклометазон 250 мкг). Последние 2 года приступы удушья возникали не реже 1-2 раз в неделю, появились ночные приступы удушья, для купирования которых пользовалась специальными ингаляционными препаратами (Сальбутамол, Беротек). В отделении проведено стандартное лечение направленное на снятие обострения БА (Пульмикорт (Будесонид), Беродуал (Ипратропия Бромид + Фенотерол), Амброксол, Дексаметазон). Далее пациентке в комплексе со стандартной базисной терапией (Симбикорт (Будесонид + Формотерол) 160/4,5 мкг) проводилась терапия аутологичными активированными Т-лимфоцитами. Побочных реакций при введении клеточного препарата не отмечалось. После инициирующего курса у пациентки субъективно отмечалось улучшение состояния, снизилась выраженная гиперреактивность на провоцирующие факторы. В период поддерживающего курса иммунотерапии снижалась частота приступов астмы, а после окончания поддерживающего курса (10-го введения) отмечалась явная положительная динамика в виде контроля над частотой приступов астмы, выражающегося в отсутствии дневных и ночных приступов удушья в течение месяца. Оценка эффективности проводилась по опроснику о качестве жизни больных бронхиальной астмой со стандартными категориями видов деятельности AQLQ(S), также оценивался уровень общего IgE, оценка иммунного статуса, уровня ОФВ1, во всех параметрах наблюдалось объективное улучшение показателей, тем самым у пациентки отмечалось значительное улучшение состояния.
Пример 2
Больной Г., 36 лет, с диагнозом: Бронхиальная астма, атопическая, персистирующее течение средней степени тяжести, неконтролируемая, обострение. Поступил в аллергологическое отделение в связи с ухудшением состояния, частыми приступами удушья, выраженной одышкой. Считает себя больным с раннего детского возраста, когда впервые появилась реакция при контакте с животными, наблюдался выраженный насморк и слезотечение, сухой кашель, одышка, затрудненное дыхание. С этого времени находится на диспансерном учете, неоднократно лечился стационарно, получает базисную терапию препаратом Беклазон ЭКО (Беклометазон 250 мкг), Назонекс (Мометазон) интраназально. Последние 2 года приступы удушья участились, появились ночные приступы удушья, для купирования которых пользуется специальными ингаляционными препаратами (Сальбутамол, Вентолин). В отделении проведено стандартное лечение направленное на снятие обострения БА (Пульмикорт (Будесонид), Беродуал (Ипратропия Бромид + Фенотерол), Амброксол, Дексаметазон). Далее пациенту в комплексе со стандартной базисной терапией (Зенхейл (Мометазон + Формотерол) 200/5 мкг) проводилась терапия активированными аутологичными Т-лимфоцитами. Побочных реакций при введении клеточного препарата не отмечалось. После инициирующего курса наблюдалось ухудшение состояния в связи с перенесенным ОРВИ. После окончания поддерживающего курса (10 введения), отмечалась явная положительная динамика в виде субъективного улучшения самочувствия. Оценка эффективности проводилась по опроснику о качестве жизни больных бронхиальной астмой со стандартными категориями видов деятельности AQLQ(S), по данным которого отмечается достоверная положительная динамика, также снизился уровень общего IgE, повысился уровень ОФВ1, проводилась оценка иммунного статуса, во всех параметрах наблюдалось объективное улучшение показателей, тем самым у пациента отмечалось значительное улучшение состояния.
Пример 3.
Больная К., 58 лет, с диагнозом: Бронхиальная астма, эндогенная, средней степени тяжести. Госпитализирована в аллергологическое отделение в связи с недостаточной эффективностью терапии, проводимой на амбулаторном этапе, для проведения обследования, адекватного лечения. Впервые жалобы на затрудненное свистящее дыхание, чувство сдавления в груди, одышку при незначительной нагрузке появились осенью 2015 года после перенесенного острого бронхита, ОФВ1 на тот период составлял 62% от должного. Был поставлен диагноз БА, назначен Симбикорт (Будесонид + Формотерол) 160/4,5 мкг, который пациентка принимала в течение 2 недель, а затем отказалась от препарата из-за улучшения состояния. Возвращение симптомов произошло в январе 2016 г, присоединились приступы ночного кашля. Возобновила прием Симбикорта 160/4,5 по 2 дозы 2 раза в сутки с частичным положительным эффектом, приступы ночного кашля сохраняются. В марте была консультирована пульмонологом, в терапию добавлен Монтеласт (Монтелукаст) 10 мг, Тафен-Назаль (Будесонид) по 2 дозы 2 раза в день в каждый носовой ход. После проведенного стационарного лечения (Пульмикорт (Будесонид), Беродуал (Ипратропия Бромид + Фенотерол), Амброксол, Дексаметазон), на фоне базисного лечения в течении 12 недель, пациентка включена в поисково-научное исследование с введением активированных аутологичных Т-лимфоцитов. Побочных реакций при введении клеточного препарата не отмечалось. В период поддерживающего курса иммунотерапии снижалась частота приступов астмы, а после окончания инициирующего и поддерживающего курсов (10 введений) отмечалась субъективная положительная динамика в виде контроля над приступами астмы, что проявлялось отсутствием дневных и ночных приступов удушья в течение месяца. Оценка эффективности проводилась по опроснику о качестве жизни больных бронхиальной астмой со стандартными категориями видов деятельности AQLQ(S), по данным которого у пациентки отмечается достоверная положительная динамика, также снизился уровень общего IgE, повысился уровень ОФВ1, тем самым у пациента отмечалось значительное улучшение состояния.
Включение в стандартное лечение пациентов с бронхиальной астмой введения активированных аутологичных Т-лимфоцитов характеризуется клинической эффективностью в 80,0% случаев и снижением общего сывороточного IgE. Качество жизни пациентов, согласно опроснику AQLQ(S), улучшается (таблица 1), что позволяет применять данный способ в клинической практике для лечения пациентов с бронхиальной астмой.