Результат интеллектуальной деятельности: СПОСОБ СТИМУЛЯЦИИ НЕЙРОГЕНЕЗА В ГИППОКАМПЕ
Вид РИД
Изобретение
Настоящее изобретение относится к медицине, касается способа стимуляции регенеративных процессов в гиппокампе и может быть использовано с целью стимуляции гиппокампального нейрогенеза при депрессивно-подобных состояниях у млекопитающих.
Одним из возможных факторов возникновения разнообразных когнитивных нарушений при депрессивных расстройствах, вызванных хроническим психологическим стрессом, являются атрофические и нейродегенеративные изменения в головном мозге. Эти изменения заключаются, в частности, в апоптозе нейронов и глиальных клеток мозга, что приводит к необратимому нарушению нейрональных и нейро-глиальных взаимодействий. При депрессивных расстройствах, вызванных хроническим стрессом, регистрируется достоверное уменьшение объема гиппокампа, обусловленное снижением плотности пирамидных нейронов СА1 и СА3 полей. Апоптоз нейронов указанных зон считается одним из патогенетических механизмов когнитивных нарушений при депрессии. (Изнак А.Ф. Нейрональная пластичность как один из аспектов патогенеза и терапии аффективных расстройств. Ж. Психиатрия и психофармакотерапия, 2005, Т. 7, №1, стр. 24-27; Wainwright S.R., Galea L.A.M. The Neural Plasticity Theory of Depression. Assessing the Roles of Adult Neurogenesis and PSA-NCAM within the Hippocampus. J.Neural Plasticity, 2013, Article ID 805497, p. 14). Нейроны гиппокампа позиционируются в качестве стресс-лимитирущей системы организма, минимизирующей повреждающее действие стресса; гиппокамп играет важную роль в процессах снижения ответа гипоталамо-гипофизарно-надпочечниковой системы при стрессе; атрофия нейронов гиппокампа ухудшает его ограничительные влияния и ведет к более длительному ответу со стороны гипотоламо-гипофизарно-надпочечниковой системы (ГГНС) на психологические стрессоры. (Elenkov I.J., Chrousos G.P. Stress system-organization, physiology and immunoregulation. J.Neuroimmunomodulation, 2007, vol. 13, N 5-6, p. 257-267). В исследованиях на экспериментальных моделях животных в депрессивно-подобном состоянии, индуцированном воздействием хронического социального стресса, показаны аналогичные изменения в структуре гиппокампа, касающиеся редукции нейрональной пластичности, в том числе снижении нейрогенеза и экспрессии белков, ассоциированных с нейрональной, пластичностью. (L. Santarelli, М. Saxe, С.Gross et al., Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants. Science, 2003, vol. 301, N 5634, p. 805-809; Wainwright S.R., Galea L.A.M. The Neural Plasticity Theory of Depression: Assessing the Roles of Adult Neurogenesis and PSA-NCAM within the Hippocampus. J. Neural Plasticity, 2013, Article ID 805497, p. 14; David D.J., Samuels B.A., Rainer Q. et al. Neurogenesis dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron, 2009, vol. 62, N 4, p. 479-493; Sawamoto A., Okuyama S., Yamamoto K., et al. 3,5,6,7,8,3',4'-heptamethoxyflavone, a citrus flavonoid, ameliorates corticosterone-induced depression-like behavior and restores brain-derived neurotrophic factor expression, neurogenesis, and neuroplasticity in the hippocampus. Molecules, 2016, vol. 21, N 4, p. 541).
Хроническое воздействие стресса также уменьшает длину и спрутинг дендритов (Watanabe Y., Gould Е., S. McEwen В. Stress induces atrophy of apical dendrites of hippocampal CA3 pyramidal neurons. Brain Research, 1992, vol. 588, N 2, p. 341-345; Galea L. A.M., McEwen B.S., Tanapat P., Deak Т., Spencer R.L, Dhabhar F.S. Sex differences in dendritic atrophy of CA3 pyramidal neurons in response to chronic restraint stress. J. Neuroscience, 1997, vol. 81, N 3, p. 689-697), экспрессию NCAM-молекул (Hill A. S, Sahay A., Hen R. Increasing adult hippocampal neurogenesis is sufficient to reduce anxiety and depression-like behaviors. J. Neuropsychopharmacology, 2015, vol. 40, p. 2368-2378.) и синаптических SNARE - белков в гиппокампе. (Muller Н.K., Wegener G., Popoli M., and Elfving В. Differential expression of synaptic proteins after chronic restraint stress in rat prefrontal cortex and hippocampus. Brain Research, 2011, vol. 1385, p. 26-37).
Цитокины, являясь как иммунорегуляторами так и нейромодуляторами, обладая выраженными психо- и нейротропными свойствами, вовлекаются в механизмы формирования депрессивного состояния вследствие длительного стрессорного воздействия. При депрессии провоспалительные цитокины изменяют нейрохимическую установку мозга, снижают нейротрофический фактор мозга (BDNF) и посредством связывания с TrkB рецепторами могут неблагоприятно влиять на нейрогенез и нейропластичность. Это объясняет связь между депрессией, воспалением, психоэмоциональным стрессом и нейродегенеративными процессами, преимущественно регистрируемыми в гиппокампе. (Miller А.Н., Maletic V., Raison C.L. Inflammation and Its Discontents: The Role of Cytokines in the Pathophysiology of Major Depression. J. Biological Psychiatry,. 2009, №9 (65), p. 732-741).
При этом установлено, что нейродегенеративные процессы, происходящие при депрессивных расстройствах, являются частично обратимыми под влиянием успешной терапии препаратами, проявляющими нейротрофические и нейропротективные свойства, причем эффективность указанной терапии зависит от степени восстановления гиппокампального нейрогенеза (L. Santarelli, М. Saxe, С.Gross et al. Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants, Science, 2003, vol. 301, N 5634, p. 805-809; David D.J., Samuels B.A., Rainer Q. et al. Neurogenesis dependent and - independent effects of fluoxetine in an animal model of anxiety/depression. Neuron, 2009, vol. 62, N 4, p. 479-493; Wainwright S.R., Galea L.A.M. The Neural Plasticity Theory of Depression: Assessing the Roles of Adult Neurogenesis and PSA-NCAM within the Hippocampus. J. Neural Plasticity, 2013, Article ID 805497, p. 14; Sawamoto A., Okuyama S., Yamamoto K., et al. 3,5,6,7,8,3',4'-heptamethoxyflavone, a citrus flavonoid, ameliorates corticosterone-induced depression-like behavior and restores brain-derived neurotrophic factor expression, neurogenesis, and neuroplasticity in the hippocampus. Molecules, 2016, vol. 21, N 4, p. 541). Восстановление ткани мозга и его функций связывают с реорганизацией и формированием новых синапсов, удлинением дендритов и аксонов и с нейрогенезом посредством образованием новых нейронов из стволовых клеток, которые в настоящее время обнаружены даже у взрослых людей, по крайней мере, в зубчатой извилине гиппокампа (DeCarolis N.A., Eisch A.J. Hippocampal neurogenesis as a target for the treatment of mental illness: a critical evaluation. J. Neuropharmacology, 2010, vol. 58, N 6, p. 884-893). У взрослых особей нейрогенез снижается при старении, стрессе и депривации сна. Гиппокампальный нейрогенез повышается в ответ на ряд стимулов, включая введение антидепрессантов.
Известен способ лечения или предотвращения дефицита и стимуляции нейрогенеза с помощью перорального введения котинина. При введении в организм мышей, подвергнутых воздействию хронического стресса, котинина, - уменьшилось депрессивное поведение, усилилась экспрессия факторов нейрогенеза и снизилась экспрессия многих нейровоспалительных факторов в гиппокампе (WO 2016070181, А61Р 25/26, 2016).
Известен способ перорального введения в организм мыши экстракта физалиса, что обеспечивает усиление нейрогенеза в клетках и тканях. Экстракт физалиса усиливает пролиферацю нервных стволовых клеток, дифференцировку., предшественников нейронов в отдельных областях головного мозга, например, в гиппокампе (US 2014187618, A61K 31/35, 2014).
Известен способ усиления нейрогенеза с помощью перорального введения млекопитающему олигопептидов общей формулы (Gly-X-Y)n, где X и Y - любые аминокислотные остатки. Данные вещества являются промотором нейрогенеза в гиппокампе головного мозга млекопитающих (JP 4433082, A61K 38/00, 2010).
Недостатком перорального введения вещества в организм является его недифференцированное воздействие на все органы и ткани организма.
Известен способ внутрибрюшинного введения млекопитающим, имеющим ишемическое повреждение головного мозга, средства, стимулирующего нейрогенез. В качестве такого средства применяют, например, п-тиразол. В качестве млекопитающих использовали крыс-самцов Wistar. Описанный способ обеспечивает стимуляцию нейрогенеза и восстановление исходного уровня нейронов в гиппокампе в условиях тотальной ишемии головного мозга экспериментальных животных (RU 2585094, A61K 31/05, 2016).
Недостатком способа является то, что внутрибрюшинное введение вещества в организм носит также общий характер и воздействует не только на нейрогенез в гиппокампе, но и на функции других органов и тканей.
Известен способ стимуляции регенеративных процессов в ишемизированных тканях, включающий подкожное, либо внутривенное введение в организм млекопитающего среды культивирования стромальных клеток из жировой ткани человека, содержащей факторы роста VEGF, HGF, ангиопоэтин и ангиогенин. В качестве экспериментальных животных использовали мышей линии Balb/c. В первых трех примерах мышам вводились мезенхимальные стромальные клетки жировой ткани (далее МСК-ЖТ) мыши инъекционными способами. В примере 4 мыши вводились МСК-ЖТ человека. В примере 5 описан способ усиления пролиферации человеческих эндотелиальных клеток линии HUVEC путем добавления в среду культивирования данных клеток кондиционированной среды после культивирования МСК-ЖТ человека. Культивирование клеток линии HUVEC, содержащей 50% среды МСК-ЖТ приводило к полному выживанию и пролиферации клеток линии HUVEC (115%). А в среде без добавления среды МСК-ЖТ приводило к выживанию только 32% клеток. Данные опыты проводились in vitro (RU 2497529, A61K 35/12, 2013).
Недостатком способа является необходимость проведения у человека,, травмирующей процедуры липосакции, причем выход МСК-ЖТ достаточно низкий (на 1 мл жировой ткани - 104-105 клеток).
Известен способ и композиции для стимулирования нейрогенеза и ингибирования дегенерации нейронов с использованием изотиазолопиримидинонов. Тест in vitro на нейрогенез осуществляли, используя клетки-предшественники нейронов человека. Клетки-предшественники нейронов человека могут быть выращены в среде, и иметь возможность вырабатывать зрелые функциональные нейроны. Фактор нейрогенеза в культуральной среде может активировать ряд клеток-предшественников, которые дифференцируются в нейроны. Это широко распространенная in vitro модель для исследования нейрогенного свойства химических веществ. Изобретение может быть использовано при лечении заболеваний и состояний, характеризующихся потерей нейронов и пониженным нейрогенезом, включая болезнь Альцгеймера, инсульт, травматическое повреждение головного мозга, травматическое повреждение нервов и депрессию (RU 2521333, A61K 31/429, 2014).
Известен способ стимуляции нейрогенеза, опосредованного производным 4-ациламинопиридина. Изобретение относится к медицине, а именно к неврологии, и касается стимуляции нейрогенеза и лечения депрессивных состояний. Для этого вводят 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил) ацетамида в количествах, эффективных для образования новых нервных клеток. Эксперименты проводились in vitro на культурах нейрональных клеток-предшественников человека и in vivo - на крысах (RU 2451512, A61K 31/44, 2012).
Недостатком введения химических веществ в организм как животного, так и человека является его недифференцированное воздействие на все органы и ткани организма, вызывающее ряд побочных эффектов препарата.
Известен психостимулирующий препарат - кофеин, являющийся психоактивным веществом, достаточно широко применяемым в мировой медицинской практике для повышения умственной и физической работоспособности, снятия чувства усталости, уменьшения потребности во сне и пр. Действие кофеина смещает равновесие между инактивационной и активационной системами головного мозга в пользу последней. В механизме активирующего действия кофеина важную роль играет его способность связываться с аденозиновыми рецепторами на поверхности клеток. В механизме действия кофеина существенную роль играет его угнетающее влияние на, фермент фосфодиэстеразу, что ведет к внутриклеточному накоплению циклического аденозинмонофосфата. Кофеин дозозависимым образом влияет на пролиферацию нейрональных предшественников, дифференцировку и выживание новых генерированных нейронов гиппокампа взрослых мышей (Wentz С.Т., Magavi S.S.P. Caffeine alters proliferation of neuronal precursors in the adult hippocampus.J. Neuropharmacology, 2009, N 6-7 (56), p. 994-1000).
Среди побочных эффектов препарата со стороны центральной нервной системы выделяют возбуждение, тревогу, тремор (дрожание пальцев рук и ног), беспокойство, головную боль, головокружение, судороги, усиление рефлексов, повышение мышечного тонуса, тахипноэ, бессоницу; при внезапной отмене - усиление процессов торможения центральной нервной системы (утомление и сонливость). Со стороны желудочно-кишечного тракта (ЖКТ) наблюдается тошнота, рвота, обострение язвенной болезни. Со стороны сердечно-сосудистой системы - усиленное сердцебиение, тахикардия, аритмия, вазоконстрикция, повышение артериального давления (Регистр лекарственных средств России. Энциклопедия лекарств. М., 2002, стр. 1520). Кроме того, в мужском организме кофеин неблагоприятно влияет на репродуктивную функцию (Кирющенков А.П., Тараховский М.Л. Влияние лекарственных средств на плод. М., Медицина, 1990, стр. 272).
Наличие указанных побочных эффектов, несомненно, ограничивает возможности системного введения кофеина в организм, что требует поиска новых подходов к его использованию в качестве психостимулятора.
Недостатком системного введения кофеина в организм является его недифференцированное воздействие на органы и ткани организма, как было указано выше. При этом кофеин быстро выводится из организма, что обуславливает его многократное введение для получения психостимулирующего эффекта, приводящее к формированию привыкания и зависимости. Существенным недостатком системного многократного введения кофеина является также нарушение пролиферации нейрональных предшественников и подавление нейрогенеза во взрослом гиппокампе, что, в свою очередь, усиливает патогенетический механизм формирования депрессивных расстройств (Wentz С.Т., Magavi S.S.P. Caffeine alters proliferation of neuronal precursors in the adult hippocampus. J. Neuropharmacology, 2009, N 6-7 (56), p. 994-1000; Han M.E., Park K.H., Baek S.Y., et al. Inhibitory effects of caffeine on hippocampal neurogenesis, and function. J. Biochem Biophys Res Commun, 2007, vol. 356, p. 976-980).
Задачей изобретения является получение стимулирующего эффекта кофеина на нейрогенез в гиппокампе без непосредственного введения кофеина в организм.
Указанная задача решается тем, что в способе стимуляции нейрогенеза в гиппокампе, с применением кофеина, у млекопитающего в депрессивно-подобном состоянии производят забор зрелых периферических иммунных клеток, которые затем подвергают in vitro экспозиции с кофеином, либо фармакологически активными солями кофеина в действующих концентрациях 100-500 мкг на 15×106 клеток в течение 10-25 минут затем отмывают от препарата, и вводят в кровоток млекопитающего в депрессивно-подобном состоянии.
В качестве солей кофеина используют гидрохлорид кофеина, сульфат кофеина, кофеина натрия бензоат и другие водорастворимые соли.
Если млекопитающие-животные, применяются сингенные монуклеарные клетки селезенки (спленоциты), если млекопитающее - человек применяются аутологичные мононуклеарные клетки периферической крови.
Предложенное изобретение, на наш взгляд, является новым. Существенные признаки изобретения направлены на достижение указанной цели. Внутривенное введение млекопитающим в депрессивно-подобном состоянии прекультивированных определенным способом с кофеином зрелых периферических иммунных клеток способствует у реципиентов увеличению количества и плотности пирамидных нейронов в гиппокампе, а также стимуляции локомоторной активности и других поведенческих и иммунологических показателей, свидетельствующих о позитивном патогенетическом эффекте модулированных кофеином иммунных клеток при указанной патологии (снижение ангедонии, повышение мобильности в тесте Порсолта, стимуляция ориентировочно-исследовательской активности в «открытом поле», модуляция содержания цитокинов в гиппокампе и других патогенетически значимых для депрессивного состояния структурах головного мозга).
Изобретение позволяет провести направленное воздействие на функциональную активность периферических зрелых иммунных клеток ex vivo кофеином, не подвергая негативному избыточному стрессу остальные системы организма, а затем воздействовать модулированными кофеином сингенными иммунными клетками после их внутривенного введения на процессы нейрогенеза в гиппокампе.
Сущность изобретения поясняется следующим.
Ранее нами была продемонстрирована способность иммунных клеток (спленоцитов), выделенных у здоровых млекопитающих с пассивным типом поведения и обработанных in vitro кофеином, после внутривенного введения сингенным здоровым млекопитающим-реципиентам с указанным типом поведения, дозозависимо изменять у них параметры ориентировочно-исследовательского поведения (ОИП). В результате многочисленных экспериментов был установлен действующий диапазон доз кофеина 10-500 мкг на 15×106 клеток, вводимых одному млекопитающему. Доза кофеина, оптимально стимулирующая параметры указанного поведения здоровой мыши - 100 мкг на. 15×106 клеток, вводимых одному млекопитающему. (Княжева М.А., Маркова Е.В. Влияние трансплантации спленоцитов, обработанных кофеином, на параметры поведения экспериментальных животных в тесте «открытое поле». Вестник уральской медицинской академической науки, 2011, №1(35), стр. 36-37; Маркова Е.В., Княжева М.А., Шушпанова Т.В., Козлов В.А. Стимуляция пассивного поведения трансплантацией иммунокомпетентных клеток, экстракорпорально обработанных психоактивным препаратом. Сибирский вестник психиатрии и наркологии, 2015, №4(89), стр. 5-9; Маркова Е.В., Княжева М.А. Продукция цитокинов клетками головного мозга животных с пассивным типом поведения после трансплантации модулированных кофеином иммунокомпетентных клеток. Российский иммунологический журнал, 2015, Т. 9 (18), №2(1), стр. 88-90).
В приведенных ниже примерах отбирали здоровых животных с пассивным типом поведения с помощью теста «открытого поля» (Маркель А.Л., Хусаинов Р.А. Метод комплексной регистрации поведенческих и вегетативных реакций у крыс при проведении теста открытого поля. Журнал высшей нервной деятельности 1976, Т. 26, №6, стр. 1314; Буреш Я. и др. Методики и основные эксперименты по изучению мозга и поведения. Высшая школа, 1991). Затем у всех отобранных животных индуцировали длительным социальным стрессом депрессивно-подобное состояние по известной методике (Kudryavtseva N.N. The sensory contact model for the study of aggressive and submissive behaviors in male mice. Aggress. Behav. 1991, vol. 17, N5, p. 285-291; Кудрявцева H.H. и др. Экспериментальная модель депрессии: нейрохимические изменения, эффекты имипрамина и циталопрама. Журнал невропатологии и психиатрии им. С.С. Корсакова, 1992, Т. 2, №1, стр. 106-109.). Согласно этой методике мыши - самцы с пассивным типом поведения в «открытом поле» подвергались длительному парному дистантному сенсорному контакту с опытом 10-кратных ежедневных поражений в межсамцовых, конфронтациях с агрессивным партнером. В результате чего, у них формируется депрессивно-подобное состояние, характеризующееся:
а) ангедонией, считающейся главным признаком депрессии в экспериментальных моделях;
б) существенным снижением мобильности в тесте принудительного плавания по П ореол ту;
в) нейродегенеративными изменениями в гиппокампе;
(Кудрявцева Н.Н. и др. Развитие патологических форм поведения у субмиссивных самцов мышей линии C57B L/6J в процессе агонистических зоосоциальных. взаимодействий. Журнал высшей нервной деятельности, 1989, Т. 39, Вып. 6, стр. 1134-1141).
г) снижением интенсивности иммунного ответа;
д) снижением пролиферативной активности спленоцитов;
(Идова Г.В. и др. Нейроиммунные взаимодействия при психоэмоциональном напряжении (экспериментальное исследование) Сибирский научный медицинский журнал. 2010, Т. 30, №4, стр. 31-37; Девойно Л.В., Идова Г.В., Альперина Е.Л. Психонейроиммуномодуляция: поведение и иммунитет. Роль «нейромедиаторной установки мозга». Изд-во «Наука», Новосибирск 2009; Glaser R., Kiecolt-Glaser J.K. Stress-induced immune dysfunction: implications for health. J. Nature Reviews Immunology, 2005, vol. 5, N 3, p. 243-251)
е) изменением продукции ряда регуляторных цитокинов клетками селезенки и их содержания в патогенетически значимых структурах головного мозга (гиппокамп, гипоталамус, префронтальная кора) в сторону количественного увеличения провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИНФγ). (Miller А.Н., Maletic V., Raison C.L. Inflammation and Its Discontents: The Role of Cytokines in the Pathophysiology of Major Depression. J. Biological Psychiatry, 2009, N 9 (65), p. 732-741).
Пример 1
У млекопитающего в депрессивно-подобном состоянии производили забор зрелых периферических иммунных клеток в стерильных условиях путем перфузии селезенки (в данном примере экспериментальное млекопитающее - мышь). После чего выделенные клетки подвергали in vitro экспозиции с кофеином, в концентрации 100 мкг на 15×106 клеток на мышь в течение 20 минут. Затем производили трехкратную отмывку иммунных клеток от кофеина в физиологическом растворе и вводили обработанные кофеином клетки в кровоток сингенным млекопитающим-реципиентам в депрессивно-подобном состоянии. На третьи сутки после внутривенного введения клеток, обработанных in vitro кофеином, производилась перфузия с 4% параформальдегидом, извлечение головного мозга, его обезвоживание с 40% раствором сахарозы в 1×PBS с 4% параформальдегидом и замораживание в среде О.С.Т. Криосрезы гиппокампа толщиной 30 мкм были получены при помощи криотома HistoSafe MicroCut - SADV (Китай) и окрашены по методу Ниссля. Микрофотографии срезов, полученные при помощи микроскопа Nikon Eclipse Ci, соединенного с видеокамерой Nikon DS-Fi2, были обработаны в программе для оцифровки микроскопических изображений Image Pro Plus Software 6.0 (MediaCybernetics, CA, USA).. Нейродегенеративные изменения в гиппокампе оценивались по общему количеству нейронов.
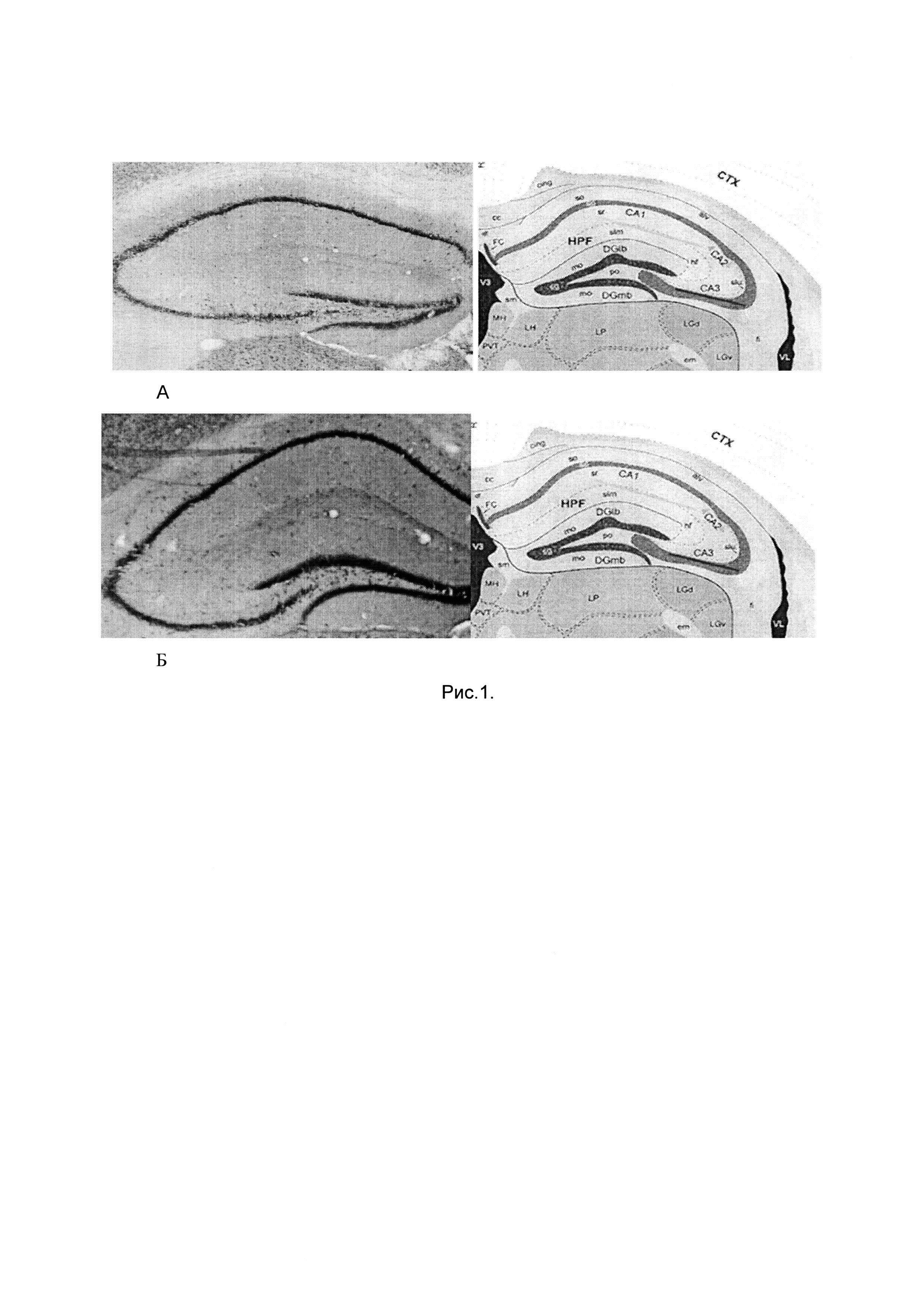
После внутривенного введения, обработанных in virto кофеином сингенных иммунных клеток у мышей в депрессивно-подобном состоянии существенно увеличивалось количество нейронов в полях СА1, СА3 гиппокампа (рис. 1, табл 1).
Таблица 1. Плотность пирамидных нейронов (%) полей СА1, СА3 гиппокампа в правом и левом полушариях головного мозга мышей-реципиентов (СВА × C57BI/6)F1 в индуцированном хроническим социальным стрессом депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, in vitro обработанных кофеином.
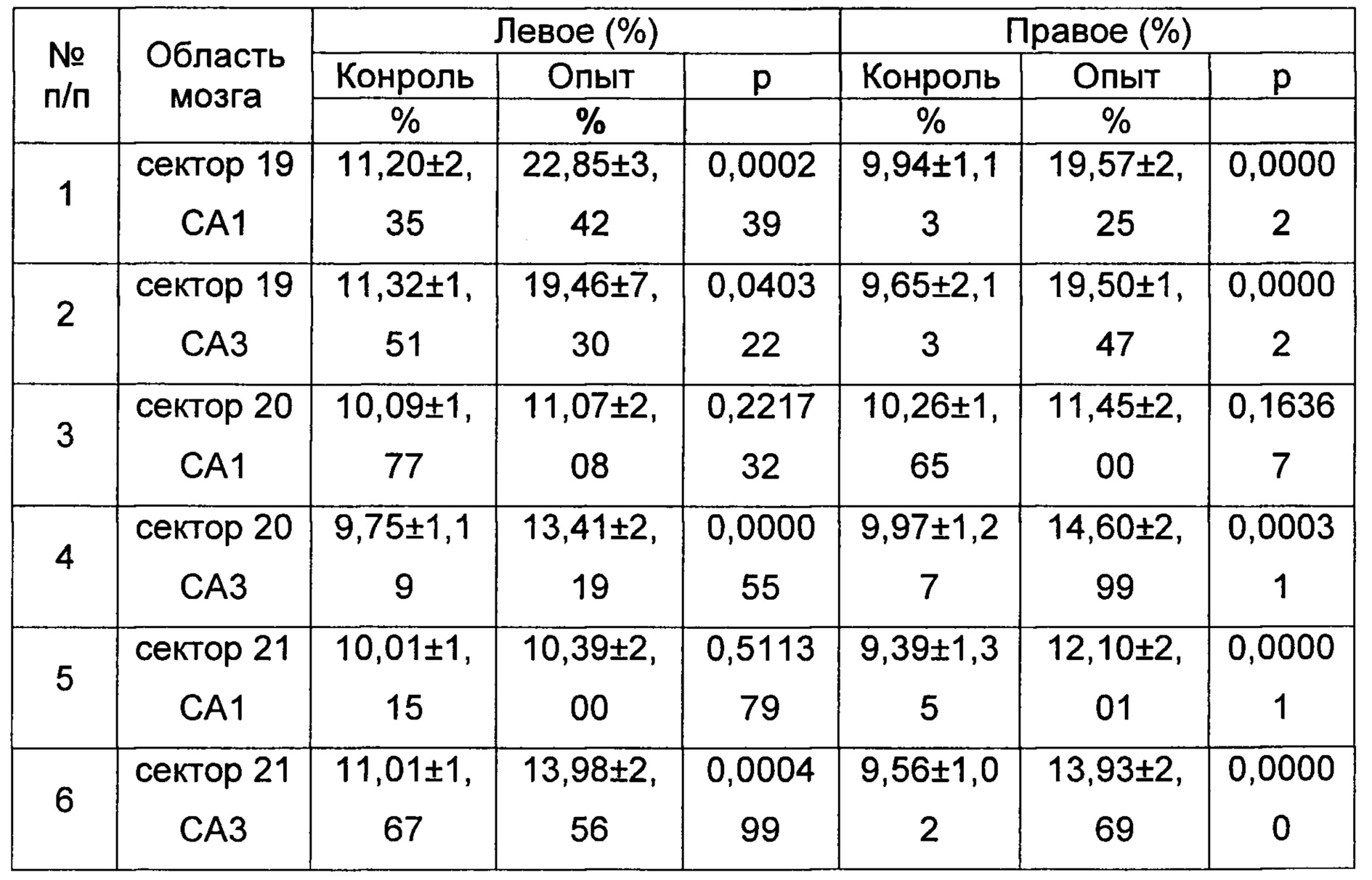
Примечание к таблице 1: цифровое обозначение, секторов полей СА1, СА3, гиппокампа соответствует уровням срезов относительно брегмы, согласно гистологическому атласу мозга мыши (Franklin K.В.J., Paxinos G. The mouse brain in stereotaxic coordinates, San Diego: Academic Press, 1997, p. 186). Контрольный образец - гиппокамп мышей в депрессивно-подобном состоянии; опытный образец - гиппокамп мышей в депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеином; количество мышей (n) составляло 10-18 в каждой группе.
На рисунке 1 справа - схематическое изображение срезов гиппокампа согласно гистологическому атласу мозга мыши (Franklin К.В.J., Paxinos G. The mouse brain, in stereotaxic coordinates, San Diego: Academic Press, 1997, p. 186) с указанием расположения полей СА1, СА3; слева представлены срезы гиппокампа мышей (СВА × C57BI/6)F1 в индуцированном хроническим социальным стрессом депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеином (окрашивание по методу Ниссля):
А - срез контрольного образца (левый гиппокамп мышей в депрессивно-подобном состоянии);
Б - срез опытного образца (левый гиппокамп мышей в депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеином).
Пример 2.
У млекопитающего в депрессивно-подобном состоянии, индуцированном длительным социальным стрессом, производили забор зрелых периферических иммунных клеток в стерильных условиях, после чего выделенные клетки подвергали in vitro экспозиции с кофеина натрия бензоатом в действующей концентрации 100 мкг на 15×106 клеток на одно животное в течение 20 минут. Затем производили трехкратную отмывку спленоцитов от препарата в физиологическом растворе и вводили обработанные кофеином клетки в кровоток сингенным животным-реципиентам в депрессивно-подобном состоянии. Через 48 часов после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом, производили оценку поведения реципиентов в тесте принудительного плавания по Порсолту с использованием компьютеризованного оборудования фирмы Noldus International Technology.
Тест является чувствительным к действию антидепрессантов (Porsolt RD, Bertin A. Behavioral despair in mice: A primary screening test for antidepressants. Arch. Int. Pharmacodyn, 1977, vol. 229, p. 327-336; Dalvi A., Lucki I. Murine models of depression. Psychopharmacology (Berl), 1999, vol. 147(1), p. 14-16) и используется для оценки состояния депрессивности у животных (Kudryavtseva N.N. The sensory contact model for the study of aggressive and submissive behaviors in male mice. Aggress. Behav., 1991, vol. 17, N5, p. 285-291; Cryan JF, Page ME, Lucki I. Noradrenergic lesions differentially alter the antidepressant-like effects of reboxetine in a modified forced swim test. Eur. J. Pharmacol., 2002, Feb 2, 436(3):197-205; Cryan JF, Mombereau C. In search of a depressed mouse: utility of models for studying, depression-related behavior in genetically modified mice. Mol Psychiatry, 2004, vol. 9(4), p. 326-357).
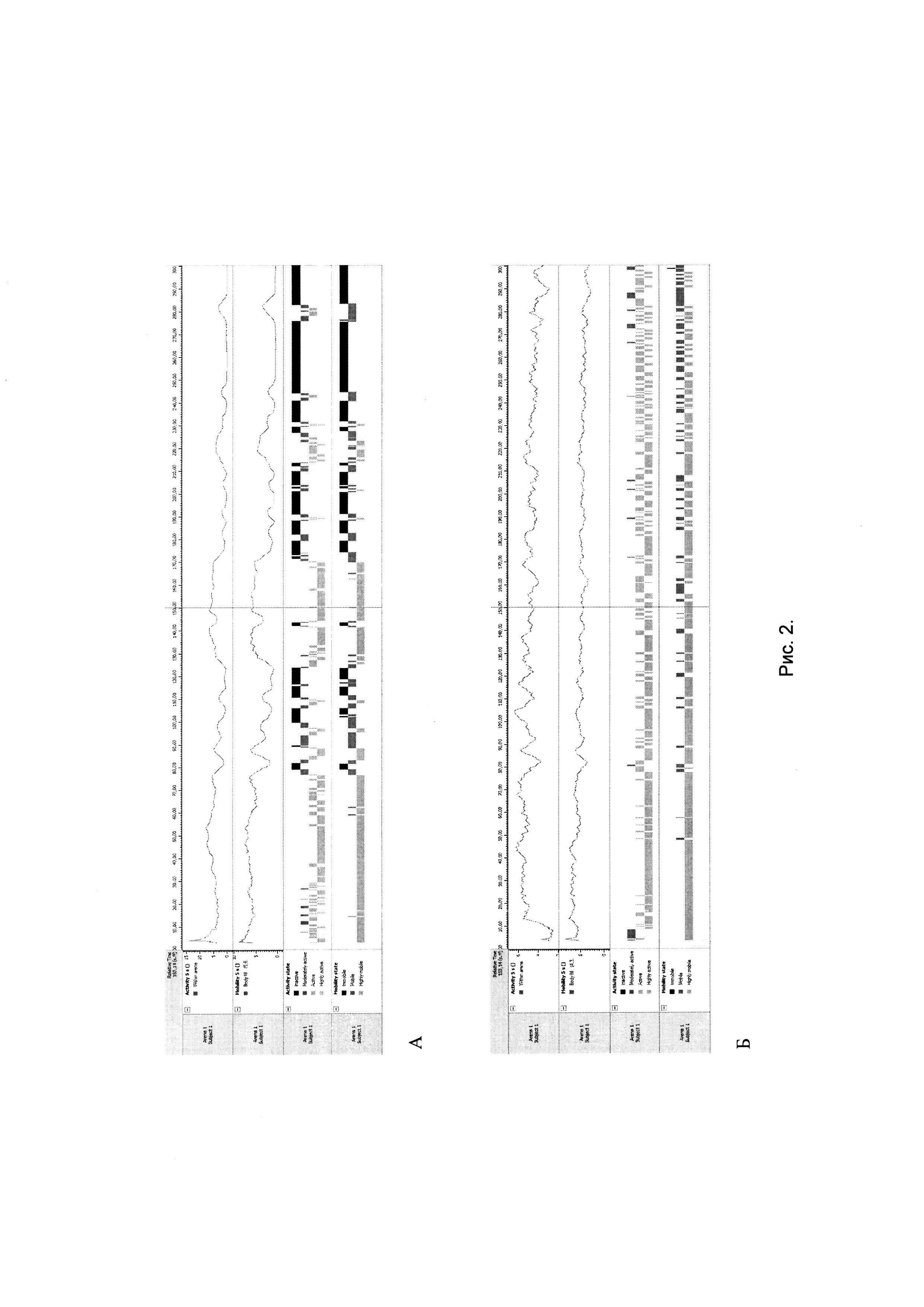
Наиболее релевантным показателем в данном тесте является мобильность животных. У мышей в депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом, в тесте принудительного плавания по Порсолту регистрировали существенное увеличение временных периодов мобильности и высокой мобильности при снижении периодов пассивного плавания (дрейф + полная неподвижность) с исчезновением периодов полной неподвижности в воде. На рисунке 2 представлено поведение мышей - реципиентов (СВА × C57BI/6)F1 в индуцированном хроническим социальным стрессом депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом в тесте принудительного плавания по Порсолту:
А - контрольная группа (мыши в депрессивно-подобном состоянии);
Б - экспериментальная группа (мыши в депрессивно-подобном состоянии после внутривенного введения сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом).
Тестирование проводилось через 48 часов после введения иммунных клеток; время тестирования - 5 минут; черным цветом отмечены периоды полной неподвижности, серым - периоды мобильности, светло-серым - периоды высокой мобильности.
Пример 3.
У млекопитающего, мыши, в депрессивно-подобном состоянии, производили забор зрелых периферических иммунных клеток в стерильных условиях; выделенные клетки культивировали с кофеина натрия бензоатом в действующей, концентрации 300 мкг на 15×106 клеток на одно животное в течение 25 минут. Затем производили трехкратную отмывку клеток от кофеина натрия бензоата в физиологическом растворе и вводили обработанные иммунные клетки в кровоток сингенным животным-реципиентам (мышам в депрессивно-подобном состоянии). После введения иммунных клеток, обработанных in vitro кофеина натрия бензоатом, у реципиентов оценивали выраженность ангедонии.
Ангедония (отсутствие способности переживать удовольствие, снижение интересов, недостаток энергии, аппатия, аффективное уплощение) считается одним из главных симптомов большой депрессии у людей. (Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр. Изд-во «Медицина», 1995, Т. 1, стр. 337; Diagnostic and statistical manual of mental disorders, 4th ed. Washington: American Psychiatric Association, 1994).
Ангедония считается также главным признаком депрессии в экспериментальных моделях (Moreau J.L. Simulating the anhedonia symptom of depression in animals. Dialogues Clin Neurosci., 2002, vol. 4(4), p. 351-360, Лунен A. Дж.М. Иванова C.A. Механизм ангедонии. Лекция. Сибирский вестник психиатрии и наркологии, 201,. №1(76) стр. 30-34) и оценивается по снижению потребления животными раствора сахарозы.
Индивидуальное потребление (слизывание) 1% раствора сахарозы и воды млекопитающими в условиях свободного выбора регистрировали в течение 14 дней методом автоматизированного круглосуточного мониторинга с помощью мультифункциональной системы, поведенческого фенотипирования лабораторных животных Intelli Cage (New Behavior).
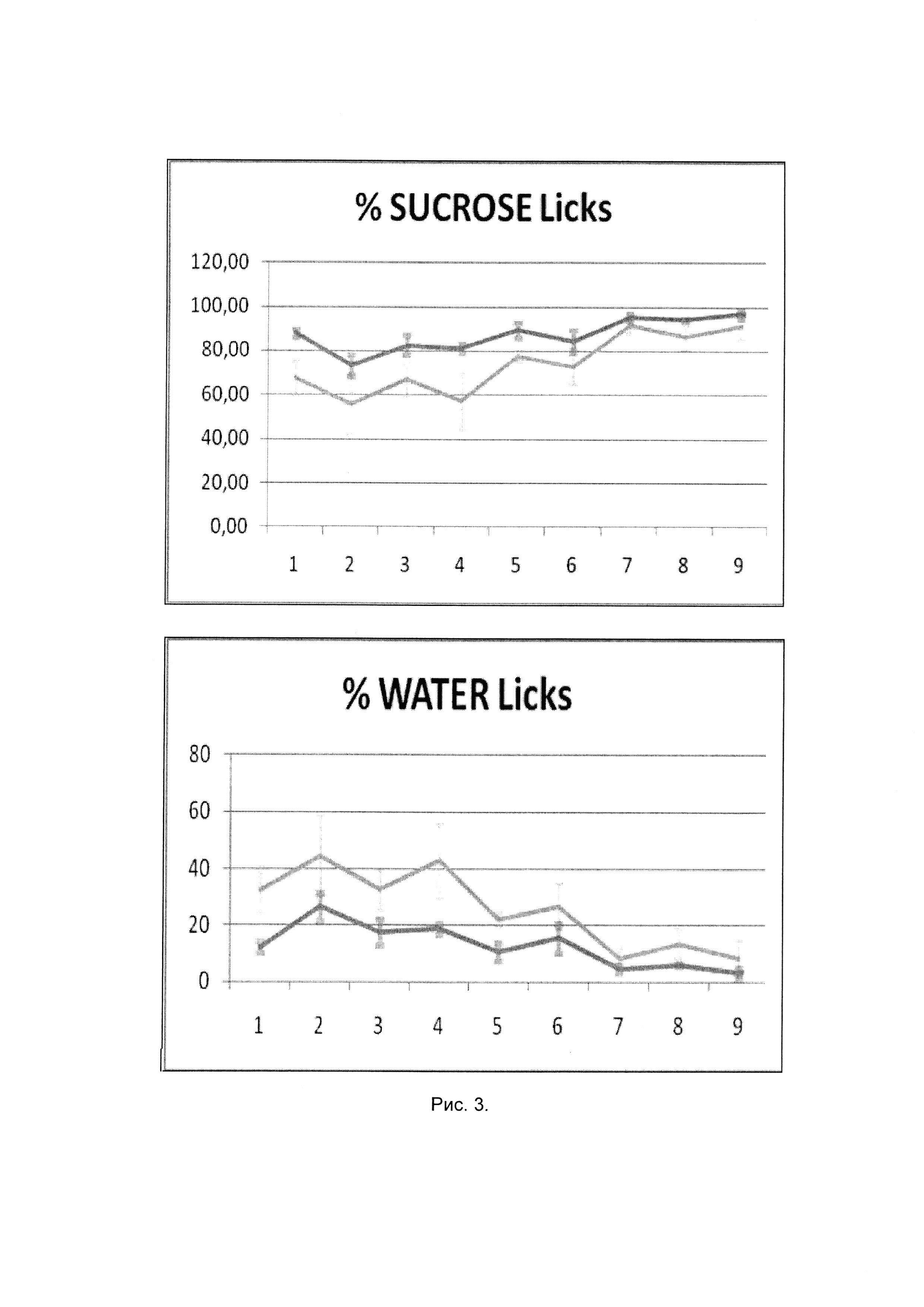
У мышей в депрессивно-подобном состоянии и животных-реципиентов после внутривенного введения иммунных клеток, прекультивированных с кофеина натрия бензоатом, наблюдалось предпочтение потребления раствора сахарозы (в процентном отношении от общего количества потребляемой жидкости) по сравнению с контрольной группой животных (87,8±2,0 и 67,5±4,8 соответственно; р<0,05). Различия по данному показателю между указанными группами животных регистрировались также в течение 7-ми дней последующего тестирования.
На рисунке 3 представлено относительное потребление раствора сахарозы и воды мышами - реципиентами (СВА × C57BI/6)F1 в индуцированном хроническим социальным стрессом депрессивно-подобном состоянии после внутренного, введения иммунных клеток, прекультивированных с кофеина натрия бензоатом, где линиями светло-серого цвета обозначены указанные показатели в контрольной группе животных (мыши в депрессивно-подобном состоянии); линиями темно-серого цвета - экспериментальной группы животных (мыши в депрессивно-подобном состоянии после введения иммунных клеток, обработанных in vitro кофеина натрия бензоатом); количество мышей (n) составляло 10 в каждой группе. По оси абсцисс - дни тестирования (1-й день - спустя 48 часов после введения иммунных клеток).
Пример 3 иллюстрирует, что у млекопитающих в депрессивно-подобном, состоянии после внутривенного введения иммунных клеток, обработанных кофеина натрия бензоатом, регистрируется снижение проявления ангедонии, свидетельствующее о позитивном влиянии иммунных клеток с модулированной психоактивным веществом функциональной активностью.
Пример 4.
У млекопитающего в депрессивно-подобном состоянии производили забор зрелых периферических иммунных клеток в стерильных условиях. В данном примере производили забор иммунных клеток у мыши; после чего выделенные клетки подвергали in vitro экспозиции с кофеина натрия бензоатом в действующей концентрации 100-500 мкг на 15×106 клеток на одну мышь в течение 20 минут. Затем производили трехкратную отмывку иммунных клеток от кофеина натрия бензоата в физиологическом растворе и вводили обработанные кофеина натрия бензоатом иммунные клетки в кровоток сингенным животным-реципиентам (мышам в депрессивно-подобном состоянии).
После введения сингенных иммунных клеток с модулированной in vitro кофеина натрия бензоатом функциональной активностью у реципиентов регистрировали стимуляцию ориентировочно-исследовательского поведения в тесте «открытое поле», выражающуюся в повышении локомоторной активности (табл. 2).
Таблица 2. Показатели ориентировочно-исследовательского поведения в тесте «открытое поле» мышей (СВА × C57BI/6)F1 в индуцированном хроническим социальным стрессом депрессивно-подобном состоянии после внутривенное введение сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом (М±SD).
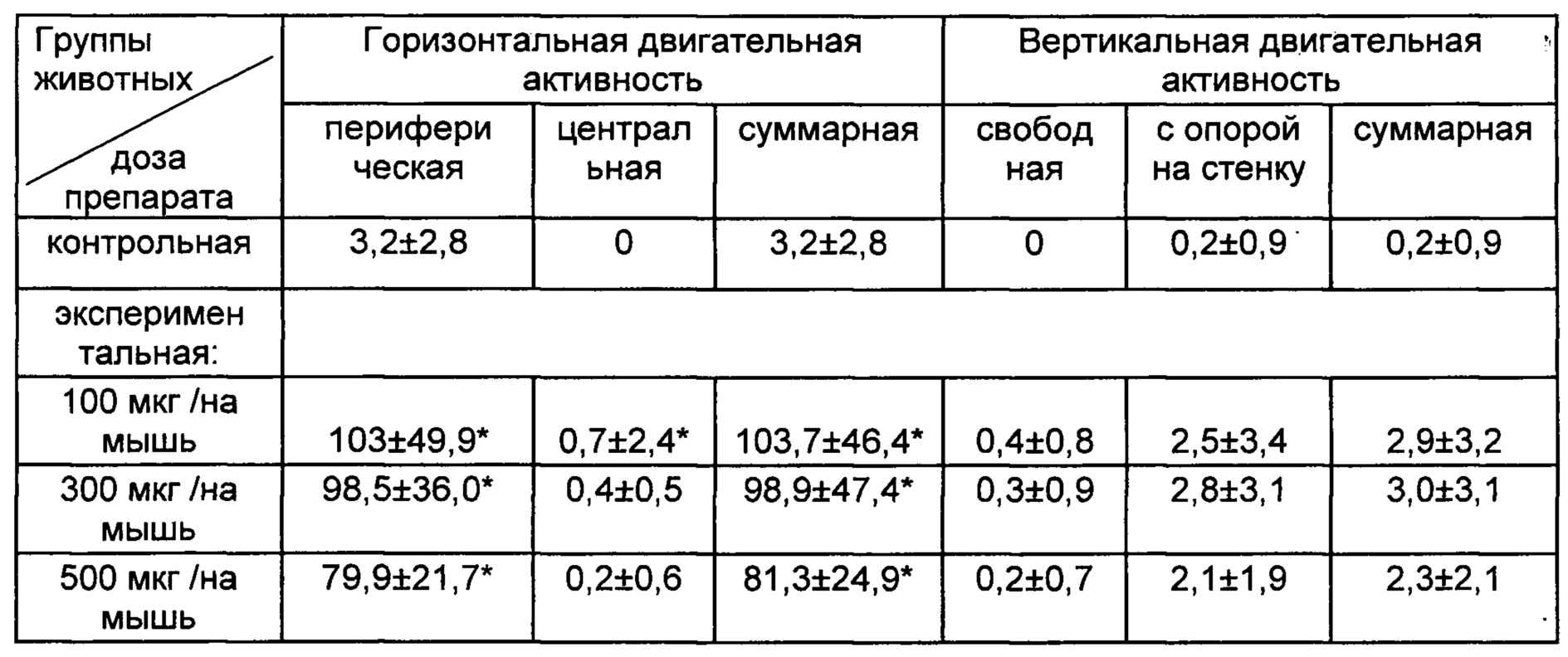
Примечание к таблице 2: контрольная группа животных - мыши в депрессивно-подобном состоянии; экспериментальная группа животных - мыши в депрессивно-подобном состоянии после трансплантации иммунных клеток, обработанных in vitro кофеина натрия бензоатом; количество мышей (n) составляло 61-68 в каждой группе животных; * - р<0,01 между соответствующими показателями в контрольной и экспериментальной группах животных.
Продемонстрированная в настоящем примере стимуляция поведенческой активности у мышей-реципиентов в депрессивно-подобном состоянии после введения сингенных иммунных клеток, обработанных in vitro кофеина натрия бензоатом, ассоциирована со стимуляцией нейрогенеза в гиппокампе (Wentz С.Т., Magavi S.S.P. Caffeine alters proliferation of neuronal precursors in the adult hippocampus.J. Neuropharmacology, 2009, N 6-7 (56), p. 994-1000). Пример 5.
У животного в депрессивно-подобном состоянии производили забор зрелых периферических иммунных клеток, в стерильных условиях выделенные клетки обрабатывали in vitro кофеином из расчета 15×10 6 клеток / 200 мкг/кофеина в присутствии 3% FCS (Hyclone) в течение 10 минут. Затем, после 3-кратного отмывания, прекультивированные с указанным ПАВ иммунные клетки внутривенно вводили сингенным реципиентам в депрессивно - подобном состоянии в концентрации 15×106 клеток в объеме 0,3 мл физиологического раствора на одно животное. После введения сингенных иммунных клеток с модулированной in vitro кофеином функциональной активностью у реципиентов регистрировали количественное содержание цитокинов в образцах гиппокампа и других патогенетически значимых для депрессивного состояния структурах, головного мозга. Лизаты отдельных структур головного мозга животных получали путем гомогенизирования тканей в среде RPMI-1640 с добавлением 0,1% Triton X - 100 (GERBU Biotechnik GmbH), с последующим центрифугированием в течение 3 минут при 10000 об/мин. Надосадочную жидкость использовали для исследования. Содержание цитокинов в исследуемых образцах оценивали методом ИФА (ELISA) с использованием соответствующих тест - систем ("R&D Systems", Великобритания) в соответсвии с инструкцией фирмы-производителя. Статистическую обработку полученных результатов проводили с применением компьютерной программы "Statistica 6.0". Различия считали достоверными при р<0,05.
В данном примере у животных в депрессивно-подобном состоянии после внутривенного введения иммунных клеток, обработанных in vitro кофеином, демонстрируется изменение содержания регуляторных цитокинов в гиппокампе и других патогенетически значимых для депрессивно-подобного состояния структурах головного мозга в сторону снижения ряда провоспалительных цитокинов: в гиппокампе регистрировалось снижение ИЛ-6, ИНФγ и повышение ИЛ-10; в гипоталамусе - снижение ИЛ-1β, ИЛ-6, ИНФγ; в префронтальной коре - снижение ИНФγ.
Повышенная продукция указанных провоспалительных цитокинов клетками головного мозга у животных в депрессивно - подобном состоянии ассоциирована со снижением нейрогенезе в гиппокампе (Miller А.Н., Maletic V., Raison C.L. Inflammation and Its Discontents: The Role of Cytokines in the Pathophysiology of Major Depression. J. Biological Psychiatry, 2009, N 9 (65), p. 732-741). Снижение содержания указанных цитокинов в гиппокампе и других патогенетически значимых структурах головного мозга у мышей в депрессивно-подобном состоянии после внутривенного введения иммунных клеток с модулированной психоактивным веществом функциональной активностью, может быть существенным звеном в механизмах стимуляции гиппокампального нейрогенеза и купирования представленных в вышеприведенных примерах поведенческих паттернов депрессивно-подобного состояния.
Указанная выше модуляция продукции ряда регуляторных цитокинов в патогенетически значимых для депрессивно-подобного состояния структурах головного мозга после внутривенного введения иммунных клеток, обработанных in vitro кофеином представлена в таблице 3.
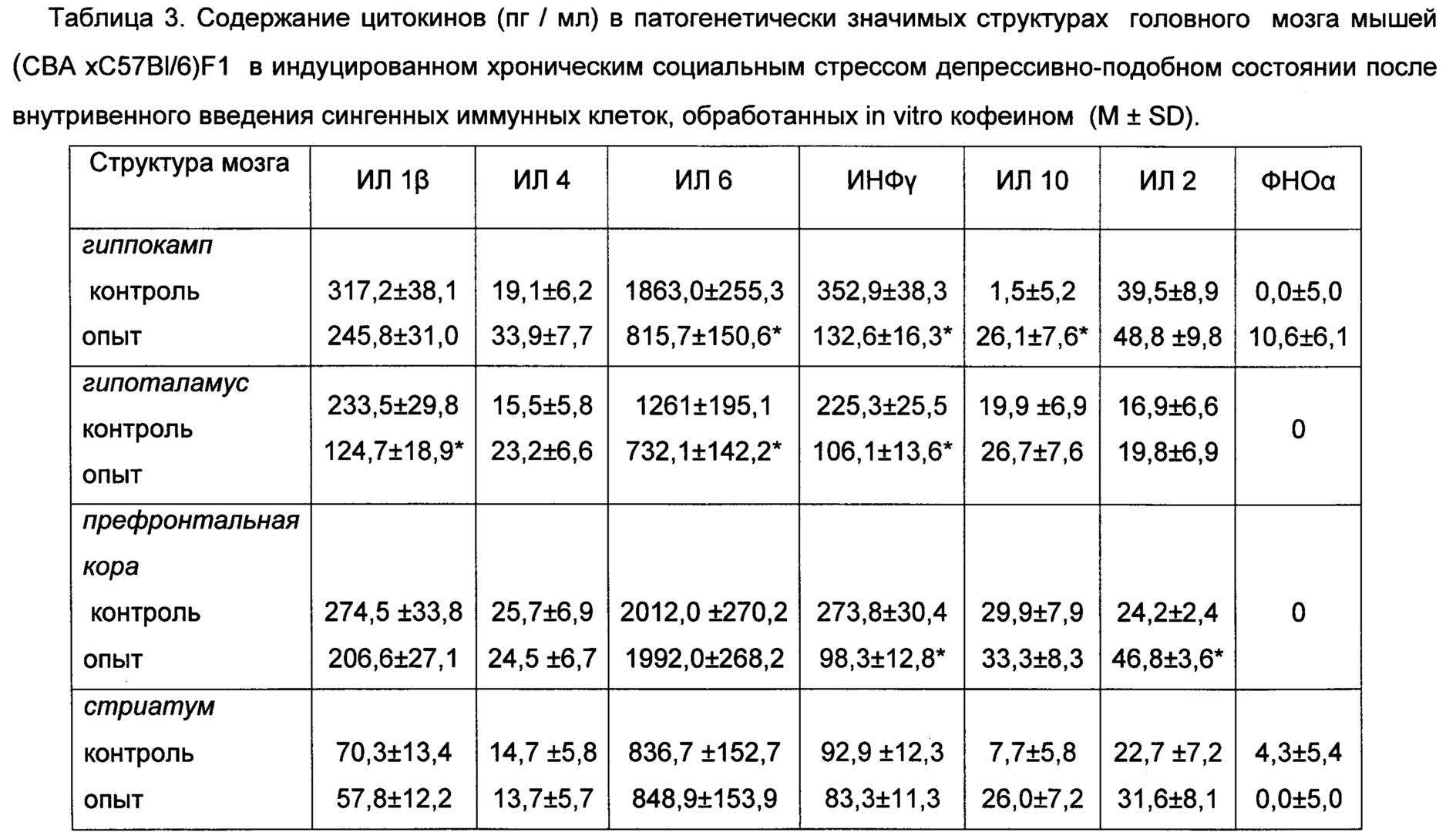
Примечание: контроль - супернатанты лизатов соответствующей структуры головного мозга мышей в депрессивно-подобном состоянии; опыт - супернатанты лизатов соответствующей структуры головного мозга мышей-реципиентов после внутривенного введения иммунных клеток, обработанных in vitro кофеином; n=10 в каждой группе; * - р<0,05 между соответствующими показателями в контрольном и опытном образцах.
Предложенное изобретение позволяет исключить непосредственное введение в. организм млекопитающего химических веществ, в частности кофеина, которые воздействуют на все органы и ткани организма. Обработка периферических зрелых иммунных клеток кофеином или его солями ex vivo, а затем внутривенное введение модулированных кофеином сингенных иммунных клеток - воздействует на процессы нейрогенеза в гиппокампе. Таким образом, изобретение позволяет получить стимулирующий эффект кофеина на нейрогенез в гиппокампе без непосредственного введения кофеина в организм. Предложенное изобретение позволяет исключить непосредственное введение в организм млекопитающего химических веществ, в частности кофеина, которые воздействуют на все органы и ткани организма. Обработка периферических зрелых иммунных клеток кофеином или его солями ex vivo, а затем внутривенное введение модулированных кофеином сингенных иммунных клеток - воздействует на процессы нейрогенеза в гиппокампе. Таким образом, изобретение позволяет получить стимулирующий эффект кофеина на нейрогенез в гиппокампе без непосредственного введения кофеина в организм.