Результат интеллектуальной деятельности: Способ получения синтез-газа из CO
Вид РИД
Изобретение
Изобретение относится к технологии переработки газового сырья, а также к области теплотехники, в частности к способу получения синтез-газа (СГ) из парникового газа - диоксида углерода, путем каталитической конверсии его в синтез-газ и горючий газ.
Синтез-газ используется как восстановитель в металлургической промышленности и исходное сырье для проведения синтеза аммиака, жидких углеводородов по Фишеру-Тропшу, а также для производства многих органических соединений, таких как спирты С1-С4, уксусную и муравьиную кислоту, формальдегид и диметиловый эфир. На сегодняшний день используются четыре основные способа получения синтез-газа, а именно газификация угля, паровая конверсия метана, автотермическая конверсия и парциальное окисление углеводородов. Эти процессы являются энергозатратными - в случае паровой конверсии либо недостаточно селективными, в связи с этим повышаются затраты на разделение продуктов и в них используются катализаторы на основе благородным металлов (в парциальном окилении, реализуемом в промышленности нет катализатора, а в паровой конверсии используется никель), что в конечном счете определяет большую часть стоимости этих химических продуктов.
Наиболее выгодным способом утилизации CO2 представляется его прямое превращение в спирты и углеводороды, однако на сегодняшний день такие процессы остаются малоизученными. Процесс гидрогенизационной конверсии CO2 в метан на сегодняшний день не представляет интереса в России из-за имеющихся залежей природного газа на ее территории. Еще одним способом утилизации CO2 является конверсия парафинов C1-C3, требующая наличия катализатора на основе благородных металлов. Существенными недостатками этого метода является использование высоких температур, около 1000°С, и интенсивное отложение кокса, вследствии чего резко уменьшается срок работы катализаторов, используемых в этих процессах.
Реакция обратного водяного сдвига (RSWR) на сегодняшний день является одним из перспективных направлений утилизации CO2 и получения синтез-газа. В последние десятилетия она стала одной из основных тем многих исследований в связи с возрастающей потребностью разработки методов снижения выбросов и утилизации парниковых газов, а также рассмотрением СО2 в виде нового источника сырья для получения синтез-газа. Она протекает в любой системе, где присутствуют углекислый газ и водород.
CO2+H2→CO+H2O ΔН298=41,2 кДж/моль. (1)
Эта реакция является обратимой. При протекании в обратном направлении она называется реакцией конверсии водяного пара (WGS). Катализаторы на основе меди, наиболее изученные для реакции WGS, так же с успехом применяются и для обратной реакции RWGS. Например, в [Liu Y. and Liu D. Z., Int. J. // Study of bimetallic Cu-Ni/γ-Al2O3 catalysts for carbon dioxide hydrogenation // Hydrogen Energy, - 1999, - V. 24, P. - 351-354 название статей во всех ссылках обязательно] изучена серия биметаллических Cu-Ni катализаторов на носителе из гамма-оксида алюминия γ-Аl2O3. Показано, что соотношение Cu/Ni имеет существенную роль на результат протекания реакции. С увеличением количества меди возрастает селективность катализатора для образования СО, в то время, как увеличения количества никеля ведет к изменению селективности в сторону образования метана. Катализаторы Cu/ZnO и Cu-Zn/Al2O3 для синтеза метанола и реакции WGS также были исследованы для конверсии углекислого газа в СО. Наиболее активными оказались образцы с отношением Cu/Zn>3 на носителе из глинозема. Была получена линейная зависимость между активностью катализатора и площадью поверхности меди [F. S. Stone and D. Waller // Cu-ZnO and Cu-ZnO/Al2O3 catalysts for the reverse water-gas shift reaction. The effect of the Cu/Zn ratio on precursor characteristics and on the activity of the derived catalysts // Top. Catal. -2003 -V. 22. - P. 305-318].
Реакция RWGS является эндотермической, следовательно, увеличение температуры может сдвигать равновесие в сторону образования СО. Однако вследствие высокой активности меди, возникает проблема дезактивации катализатора. Для ее решения предлагается вводить термические стабилизаторы. Например, небольшое количество железа повышает термическую стабильность и каталитические свойства Cu/SiO2 при высоких температурах [Chen С.S., Cheng W.Н. and Lin S.S., // Enhanced activity and stability of a Cu/SiO2 catalyst for the reverse water gas shift reaction by an iron promoter // Chem. Commun. - 2001. - P. 1770-1771], [Chen C.S., Cheng W.H. and Lin S.S., // Study of iron-promoted Cu/SiO2 catalyst on high temperature reverse water gas shift reaction // Appl. Catal. A, -2004. - V. 257. - P. 97-106]. Каталитическую активность и площадь поверхности обеспечивают Cu-Fe катализаторы, даже при их использовании в области высоких температур. Например, эти катализаторы стабильны и активны в течение 120 часов при температуре 600°С и атмосферном давлении, в то время как катализаторы без добавки железа деактивируются из-за спекания частиц меди и их окисления. Вероятно, это объясняется предотвращением спекания частиц меди образованием вокруг них мелких железных частиц.
В настоящее время рассматриваются два принципиальных механизма протекания реакции RWGS на медных катализаторах: окислительно восстановительный и разложение формиатов. Окислительно-восстановительный механизм довольно легко смоделировать:
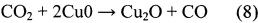
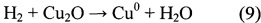
По всей видимости, CO2 активно диссоциирует на атомах меди, которые затем восстанавливаются водородом. В этом случае восстановление должно идти быстрее окисления. Другая модель, основанная на разложении формиатов, говорит о том, что СО образуется при разложении муравьиной кислоты, которая играет роль промежуточного соединения.
При исследовании Fe/AlO3 катализаторов модифицированные калием было отмечено, что с увеличение отношения K/Fe во всем диапазоне наблюдается значительное увеличение адсорбции CO2 (практически в два раза при K/Fe→1) и резкое уменьшение адсорбции водорода (более чем в три раза при K/Fe→1) [Р.Н. Choi, K. - W. Jun, S. - J. Lee, M. - J. Choi, K. - W. Lee // Hydrogenation of carbon dioxide over alumina supported Fe-K catalysts // Cat. Lett., - 1996, - V. 40, - P. 115-118]. Судя по всему, это связано с уменьшением кислотности катализатора, т.к. углекислый газ имеет большее сродство к основным адсорбентам, в то время как водород, наоборот, к кислотным. Также отмечено, что добавка калия блокирует поверхность железа и усложняет удаление образующегося на поверхности углерода. Также с увеличением содержания калия увеличивается селективность процесса. Содержание калия также сильно влияет на распределение образования побочных продуктов. Так, авторами замечено, что низкое содержания калия (уменьшение кол-ва адс. СO2 и увеличение кол-ва адс. H2) способствует образованию метана как побочного продукта, а увеличение содержании калия (уменьшение кол-ва адс. Н2 и увеличение кол-ва адс. СO2) способствует образованию С-С связей.
Исследована размерная зависимость катализаторов на основе наночастиц кобальта, полученных коллоидным методом и высаженных на мезопористый кремний [Iablokov V., Beamont S.K., Alayoglu S., Pushkarev V.V. // _Size-Controlled Model Co Nanoparticle Catalysts for CO2 Hydrogenation: Synthesis, Characterization, and Catalytic Reactions // Nano Lett. - 2012 - V. 12. - P. 3091-3096]. С уменьшением размера частиц снижается и каталитическая активность. Авторы полагают, что это связано с уменьшением площади поверхности. Селективность образования СО уменьшается с ростом температуры. В работе [Suslova E.V., Chernyak S.A., Egorov A.V., Savilov S.V., Lunin V.V. // Hydrogenation of CO2 in the presence of cobalt-containg catalysts // Kin. i Kat. - 2015. - V. 56. - №5. - P. 655-662] представлены исследования каталитической активности наночастиц кобальта на различных углеродных наноматериалах. Селективность по СО падает при увеличении размера частиц. Так, при частицах размером 20 нм единственным продуктом конверсии CO2 является метан. При увеличении содержания кобальта преимущественным продуктом остается метан. Катализаторы с содержанием кобальта менее 5 масс% вообще не проявляют активность в реакции гидрирования углекислого газа.
Катализаторы с носителями на основе оксида церия показывают довольно интересную картину. Так, Ni/CeO2 (2 масс% Ni) имеет неплохие свойства с точки зрения активности, селективности и стабильности [Trovarelli А. // Catalytic properties of ceria and CeO2-containing materials // Catal. Rev. - 1996. - V. 38. - P. 439-520], [Wang L.H., Zhang S.X. and Liu Y.A. // Reverse water gas shift reaction over Co-precipitated Ni-CeO2 catalysts // J. Rare Earths. - 2008. - V. 26. - P. 66-70]. Выход CO составляет порядка 35% при достаточно большой продолжительности работы. Кислородные вакансии, формируемые в решетке оксида церия, и высокая дисперсность никеля дают прекрасную возможность для адсорбции CO2 и протекания реакции на поверхности. Однако никель, в силу своей основности, способствует образованию метана. Стоит заметить, что дезактивации оксида церия, вследствие отложения на его поверхности даже небольшого количества углерода, может свидетельствовать о том, что в реакции участвует только та часть поверхности носителя, которая находится рядом с металлом. В работе [Tidona В., Urakawa A., Rohr P. R. // High pressure plant for heterogeneous catalytic CO2 hydrogenation reactions in a continuous flow microreactor // Chem. Eng. And Process. - 2013. - V. 65. - P. 53-57] исследовались Pt/CeO, которые показали высокие характеристики работы в области высоких давлений. Авторы указывают на проблему дезактивации катализатора из-за диспропорционирования СО или разложения метана. Для ее решения было принято повышать температуру процесса. Кроме этого, проведение процесса в газовой фазе способствует отложению твердых продуктов реакции на поверхности активных центров катализатора, что приводит к снижению срока работы катализатора (Hughes R. Deactivation of catalysts / Academic Press (London), 1984).
Известен способ получения синтез-газа путем каталитического селективного гидрирования диоксида углерода в монооксид углерода (патент RU 2395340 С1, опубл. 27.07.10) с использованием катализатора, содержащего в своем составе химический элемент II или III групп Периодической системы и представляющий собой Cu-Fe-M1-M2 -оксидную систему, где M1 - химический элемент II или III группы Периодической системы, преимущественно Са, Sr, Zn, La, Y, Се, Sm, a M2 - химический элемент III или IV группы Периодической системы, преимущественно Аl, С, Si, Ti, Zr.
Процесс проводят при температуре 150-800°С и давлении не ниже 0,1 атм.
Объемную скорость варьируют в интервале 10000-15000 ч-1.
Существенными недостатками этого изобретение является недостаточно высокая производительность процесса, проведение процесса в газовой фазе, способствующее отложению твердых продуктов реакции на поверхности активных центров катализатора, что приводит к частичной и полной дезактивации катализатора, проведение процесса при высокой температуре (свыше 600°С) для получения оптимального соотношения Н2 : СО в продуктовой смеси, а также использование в составе катализатора дорогостоящих компонентов, таких как Sr, La, Y, Се, Sm, что значительно повышает себестоимость целевого продукта.
Известен также способ получения синтез-газа (патент US 2010/0190874 А1), в котором предлагается процесс аналогичный предыдущему. Основным отличием является то, что процесс гидрирования диоксида углерода проводят на оксидных катализаторах, содержащих оксид Mn и по крайней мере один выбранный компонент из группы Cr, Ni, La, Се, W, и Pt на выбранном носителе из ряда Аl2О3, MgO, SiO2, TiO2 и ZrO2. Общим основным недостатком двух выше рассмотренных изобретений является интенсивное отложение твердых продуктов реакции на поверхности активных центров катализаторов, что приводит к снижению срока работы катализатора, и, как следствие, отмечается низкая производительность по целевым продуктам. Кроме этого, как и в предыдущем случае, в этом изобретении используются дорогостоящие металлы в катализаторе, такие как цезий и стронций.
Известен способ получения синтез-газа из СO2 в ходе гидрогенизационной конверсии CO2, принятый за прототип (патент WO 2016176105 А1), путем контактирования реакционной смеси, содержащей Н2 и СO2, с неподвижным слоем катализатора, включающим Cu и Mn в мольном соотношении около 1 : 1, на твердом носителе, выбранный из группы, состоящей из А1203, MgO, Si02, Ti02, в проточном реакторе при температуре реакции выше 600°С, преимущественно 670-730°С, при молярном соотношении Н2 : СO2 1,6 : 1 с получением смеси продукта, который включает в себя Н2 и СО в мольном соотношении от 1 : 1 до 3 : 1 при объемной скорости подачи сырья в интервале от 200 до 5000 ч-1.
В некоторых вариантах катализатор может включать в себя один или несколько дополнительных металлов, выбранных из группы, состоящей из La, Ca, K, W и Аl.
Существенными недостатками этого изобретение является недостаточно высокая производительность процесса, проведение процесса в газовой фазе, способствующее отложению твердых продуктов реакции на поверхности активных центров катализатора, что приводит к частичной и полной дезактивации катализатора и снижению срока его службы, а также проведение процесса при высокой температуре.
Технической задачей предлагаемого изобретения является создание способа получения синтез-газ из углекислого газа, позволяющего значительно повысить производительность процесса и увеличить срок работы катализатора без регенерации.
Поставленная техническая задача достигается предлагаемым способом получения синтез газа из CO2 в ходе гидрогенизационной конверсии CO2 путем контактирования при повышенной температуре исходного газового сырья, содержащего смесь H2 и CO2, с катализатором, представляющим собой металл, нанесенный на носитель, отличающийся тем, что в качестве металла катализатор содержит железо в количестве 0,5-15% масс., и процесс осуществляют в сверхкритических условиях для CO2 при давлении выше 73,8 атмосфер и температуре от 450°С до 600°С при подаче в реактор реакционной смеси, содержащей смесь Н2 и СO2, взятых в мольном соотношении 0,25÷1:1, соответственно, и объемной скорости от 5500 ч-1 до 45000 ч-1.
Процесс проводят в проточном реакторе.
Используемый в процессе катализатор содержит переходный металл, например, Fe в дисперсной металлической распределенный на поверхности пористого носителя. Железо может быть распределено на поверхности пористого носителя и в оксидной фазе.
Используемый в процессе катализатор содержит носитель, выбранный из группы, включающей, например, SiO2, Al2O3, ZrO2, TiO2, MgO, активированные угли.
Существенным отличием предлагаемого изобретения является проведение процесса в условиях сверхкритического состояния CO2. Проведение процесса под давлением позволяет существенно увеличить плотность реакционной среды, тем самым увеличивая нагрузку на катализатор, повысить производительность процесса. Кроме того, использование сверхкритического CO2 позволяет интенсифицировать диффузионные процессы у поверхности активных центров, такие как более быстрое удаление твердых продуктов реакции, что существенно увеличивает срок работы катализатора.
Существенным отличием данного изобретение является также выбор железосодержащего катализатора, обеспечивающего максимальные конверсию и производительность процесса в предлагаемых условиях. Существенным достоинством данного катализатора является его низкая стоимость и простота изготовления. Использование железа в качестве активной фазы катализатора дает экономическое преимущество перед катализаторами, предложенными в аналогичном изобретении, в котором используются такие дорогостоящие металлы, как La и W.
В соответствии с настоящим изобретением катализаторы для прямого гидрирования CO2 в CO получают методом пропитки носителя нитратным раствором соответствующего металла с добавлением комплексообразователя, например, мочевины, или без него.
Предлагаемые носители обеспечивают оптимальную пористость катализатора, для преодоления диффузионных процессов при протекании реакции, максимальную поверхность катализатора и оптимальную дисперсность нанесенной фазы, для достижения максимальной производительности процесса.
Исходное соотношение Н2 : CO2 в исходной смеси имеет важное значение в представленном способе, поскольку изменение этого соотношения приводит к изменению производительности и селективности процесса. Конечные продукты могут содержать побочные продукты реакции, такие как метан, легкие углеводороды и спирты С1-С4. Регенерация катализатора после цикла работы производится путем удаления твердых продуктов реакции растворением в чистом CO2 в сверхкритическом состоянии при давлениях больше 73,8 атмосфер и температурах от 450°С до 600°С.
Предлагаемый способ обеспечивает утилизацию парникового газа CO2.
Техническим результатом настоящего изобретения является создание способа получения синтез-газ из углекислого газа, позволяющего значительно повысить производительность процесса переработки и утилизации CO2, увеличить срок службы катализатора, за счет снижения влияния процессов дезактивации и увеличения нагрузки на катализатор, при одновременном уменьшении материальных затрат за счет снижения температуры процесса. Предлагаемый способ обеспечивает переработку являющегося парниковым углекислого газа в ценные продукты, что так же является его преимуществом.
Катализаторы, используемые в процессе, получали методом пропитки носителя по влагоемкости растворами нитрата железа в воде.
Для приготовления образцов катализаторов использовали носители диоксид титана TiO2 и оксид кремния SiO2. Фракция катализатора 0,25-0,5 мм пропитывалась по влагоемкости водным раствором девятиводной соли нитрата железа Fe(NO3)3⋅9H2O с соответствующей концентрацией и высушивалась при комнатной температуре на воздухе в течении нескольких суток при периодическом перемешивании до полного высыхания. Навеску образца загружали в кварцевый реактор внутренним диаметром 9 мм и прокаливали в токе воздуха 100 мл/мин при температуре 300°С в течение 4 часов для разложения нитратов и удаления оксидов азота. После этого навеску загружали в реактор для проведения каталитических испытаний и активировали в токе водорода 30 мл/мин (н. у.) при температуре 500°С и атмосферном давлении в течение 4 часов.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1.
Навеску катализатора 0,5% Fe/TiO2 массой 1 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 4 мм. Поток водорода составлял 60 мл/мин. Поток жидкого CO2 при давлении 95,1 атмосфер составлял 0,15 мл. Объемная скорость равнялась 5500 ч-1. Соотношение Н2:CO2 0,96. Измерения проводили при температуре 585°С и при давлении 95,1 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 2.
Навеску катализатора 1% Fe/TiO2 массой 1 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 4 мм. Поток водорода составлял 60 мл/мин. Поток жидкого СO2 при давлении 89,9 атмосфер составлял 0,15 мл. Объемная скорость равнялась 5500 ч-1. Соотношение Н2:CO2 0,96. Измерения проводили при температуре 550°С и при давлении 89,9 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 3.
Навеску катализатора 5% Fe/TiO2 массой 1 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 4 мм. Поток водорода составлял 60 мл/мин. Поток жидкого CO2 при давлении 92,7 атмосфер составлял 0,15 мл. Объемная скорость равнялась 5500 ч-1. Соотношение Н2:CO2 0,96. Измерения проводили при температуре 600°С и при давлении 92,7 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 4.
Навеску катализатора 15% Fe/SiO2 массой 0,5535 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 9 мм. Поток водорода составлял 94 мл/мин. Поток жидкого CO2 при давлении 94.8 атмосфер составлял 0,453 мл. Объемная скорость равнялась 10000 ч-1. Соотношение Н2:CO2 равнялось 0,5. Измерения проводили при температуре 500°С и при давлении 94.8 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 5.
Навеску катализатора 15% Fe/SiO2 массой 0,5535 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 9 мм. Поток водорода составлял 94 мл/мин. Поток жидкого CO2 при давлении 96,1 атмосфер составлял 0,453 мл. Объемная скорость равнялась 10000 ч-1. Соотношение Н2:CO2 равнялось 0,5. Измерения проводили при температуре 450°С и при давлении 96,1 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 6.
Навеску катализатора 15% Fe/SiO2 массой 0,2288 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 9 мм. Поток водорода составлял 144 мл/мин. Поток жидкого CO2 при давлении 93,6 атмосфер составлял 1,392 мл. Объемная скорость равнялась 45000 ч-1. Соотношение Н2:CO2 равнялось 0,25. Измерения проводили при температуре 450°С и при давлении 93,6 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4. Результаты приведены в таблице.
Пример 7.
Навеску катализатора 15% Fe/SiO2 массой 0,2288 грамм загружали в проточный реактор с неподвижным слоем и внутренним диаметром 9 мм. Поток водорода составлял 188 мл/мин. Поток жидкого CO2 при давлении 94,9 атмосфер составлял 0,907 мл. Объемная скорость равнялась 45000 ч-1. Соотношение Н2:CO2 равнялось 0,5. Измерения проводили при температуре 450°С и при давлении 94,9 атмосфер. В качестве побочных продуктов образовывались вода, легкие углеводороды и спирты С1-С4.
Результаты приведены в таблице.
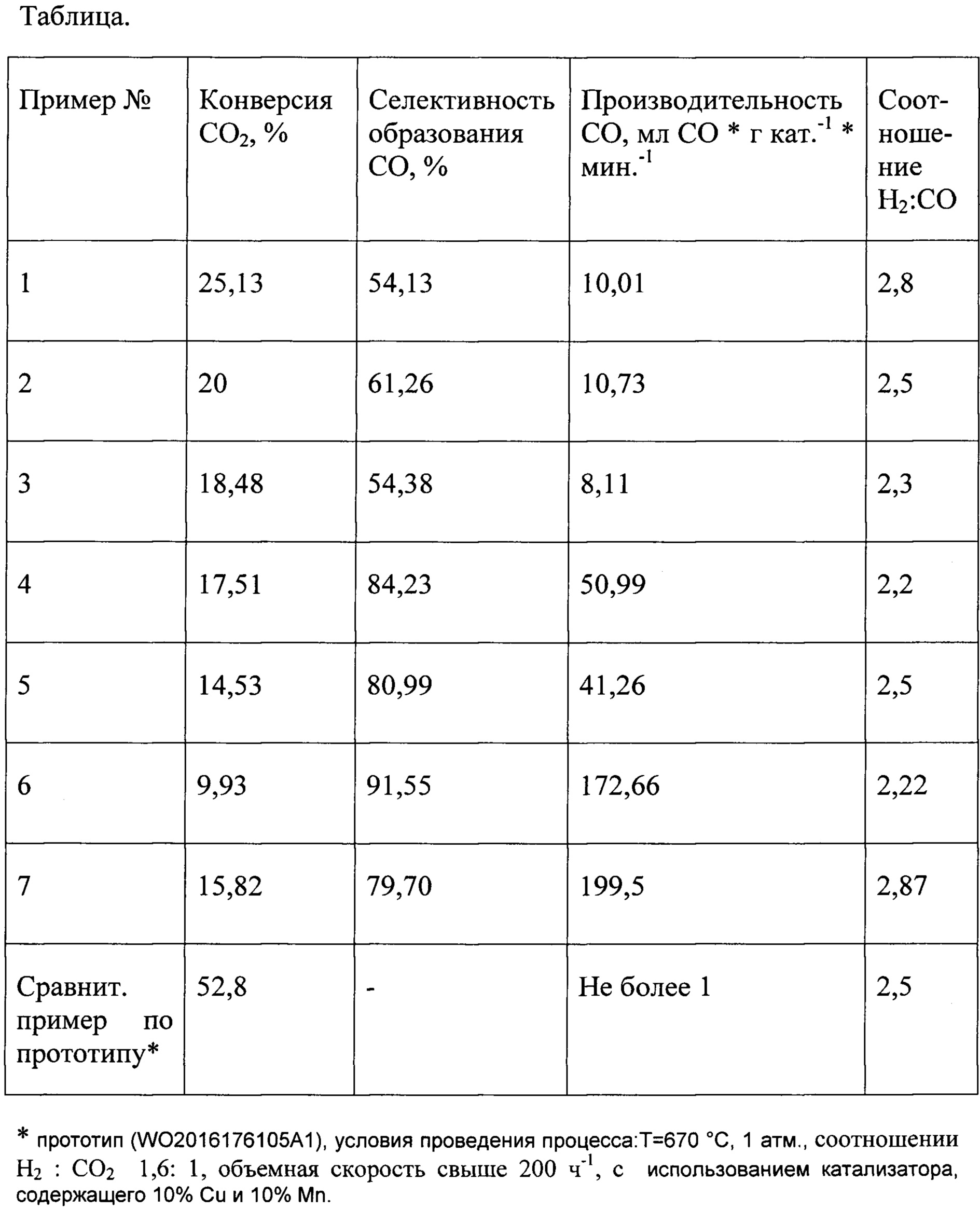
Как видно из таблицы, при проведении процесса в условиях предлагаемого изобретения по сравнению с прототипом удается значительно повысить производительность процесса, до ≈200 мл СО * г кат.-1 * мин.-1. При этом достигаются требуемые значения соотношения Н2:СО от 2,2 до 2,87, сохраняется высокая селективность и конверсия процесса. Катализатор в сверхкритических условиях для CO2 практически не теряет своей активности в отличие от проведения процесса в газовой фазе (прототип).

