Результат интеллектуальной деятельности: N-ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БОРНИЛАМИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ОРТОПОКСВИРУСОВ
Вид РИД
Изобретение
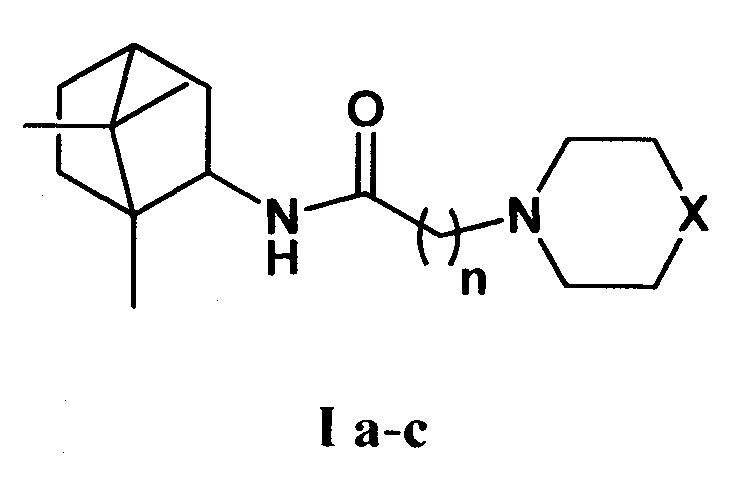
Изобретение относится к химии и медицине, а именно к лекарственным средствам, конкретно, к соединениям общей формулы I а-с (включая их пространственные изомеры, в том числе оптически активные формы):
где Х=CHCH3, n=1 Ia; Х=O, n=2 Ib; X=NCH3, n=2 Ic. Данные соединения I а-с могут использоваться в качестве ингибитора репродукции ортопоксвирусов и могут быть применены в медицине, вирусологии и фармакологии.
Благодаря программе глобальной ликвидации вирус натуральной оспы (ВНО) был элиминирован из окружающей среды. При этом в связи с прекратившейся с 1980 г. всеобщей вакцинацией против ВНО в настоящее время более половины населения Земли лишено противооспенного иммунитета. Вместе с тем, угроза возникновения оспы существует, поскольку невозможно исключить наличие нелегального хранения ВНО и преднамеренного использования против населения природных или рекомбинантных штаммов ВНО, а также распространения ВНО из мерзлотных грунтов с останками умерших от оспы. Кроме того, опасность для человека представляют и другие ортопоксвирусы, например, вирусы оспы обезьян и оспы коров, которые циркулируют в популяциях животных, эволюционируют, распространяются и периодически вызывают вспышки заболеваний среди людей.
В настоящее время в мире нет официально зарегистрированных химиопрепаратов для защиты людей от ВНО и других патогенных для человека ортопоксвирусов. В настоящее время проводятся клинические испытания на территории США два перорально биодоступных противооспенных препарата: ST-246 (Tecovirimat, ТРОХХ®, N-(6,8-диоксо-7-азатрицикло[3.3.2.02,4]дец9-ен-7-ил)-4-(трифторметил)бензамидметил) и СМХ001 (Brincidofovir, 3-(пентадецилокси)пропил((S)-1-(4-амино-2оксопиримидин-1(2Н)-ил)-3-гидроксипропан-2-илокси)метилфосфонат). Препарат СМХ001 представляет собой липофильный нуклеотидный аналог Цидофовира (Cidofovir CDV) (рисунок 1). CDV (Vistide®) является противовирусным препаратом, используемым для лечения цитомегаловирусного ретинита, и показал активность в летальных моделях поксвирусной инфекции с использованием мышей и обезьян. Хотя CDV является единственным противовирусным препаратом, который в настоящее время доступен для использования в случае вспышки оспы, он не зарегистрирован как препарат, разрешенный для лечения ортопоксвирусных инфекций. Кроме того, Cidofovir имеет низкую иероральную биодоступность и может быть токсичным для почек. ST-246 был разработан SIGA Technologies Inc. (США). Его механизм действия отличается от механизма CDV, который ингибирует репликацию вирусной ДНК. Мишенью ST-246 является высококонсервативный вирусный кодируемый белок р37, присутствующий во всех ортопоксвирусах.
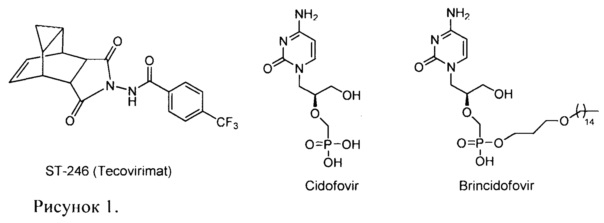
Таким образом, наиболее близким к заявляемому соединению - прототипом, является цидофовир. Недостатком указанного препарата является не высокая активность в отношении вируса осповакцины.
Задачей изобретения является создание нового класса эффективных ингибиторов репродукции вирусов из рода Orthopoxvirus.
Технический результат: расширение ассортимента ингибиторов репродукции ортопоксвирусов.
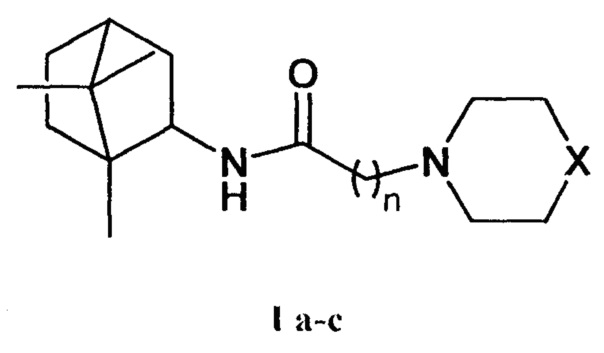
Поставленная задача решается новыми соединениями общей формулы I а-с, обладающими выраженными свойствами ингибиторов репродукции вируса осповакцины.
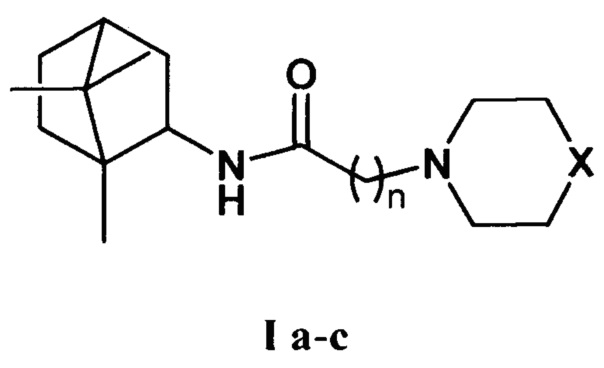
где X=CHCH3, n=1 Ia; X=О, n=2 Ib; X=NCH3, n=2 Ic.
Соединения общей формулы I, после проведения углубленных фармакологических исследований, могут использоваться, как в чистом виде, так и в качестве компонента новых низкотоксичных высокоэффективных против вируса осповакцины лекарственных форм.
Цитотоксичность и противовирусную активность синтезированных производных в отношении VV оценивали с использованием адаптированного колориметрического метода в культуре клеток Vero (Селиванов Б.А., Тихонов А.Я., Веланов Е.Ф., Бормотов Н.И., Кабанов А.С., Мазурков О.Ю., Серова О.А., Шишкина Л.Н., Агафонов А.П., Сергеев А.Н. Синтез и противовирусная активность 1-арил-3-{3,5-диоксо-4-азатетрацикло-[5.3.2.02,6.08,10]додец-11-ен-4-ил}мочевин. Химико-фармацевтический журнал. 2017. Т. 51. №6. С. 13-17]. В качестве положительного контроля использовался коммерчески доступный препарат Cidofovir (Heritage Consumer Products, LLC, США).
Синтез соединений I а-с по схеме 1. Взаимодействие изоборниламина 3, полученного из оксима камфоры 2, с соответствующим хлорангидридами 2-хлоруксуной и 3-хлорпропионовой кислоты привело к образованию ключевых промежуточных продуктов 3 и 4. Полученные амиды нуклеофильным замещением соответствующими гетероциклами были трансформированы в целевые продукты I а-с.
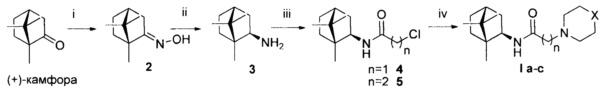
Схема 1. Реагенты и условия: (i) NH2OH⋅HCl, NaOAc, микроволновой нагрев; (ii) NiCl2, NaBH4, MeOH, -30°C; (iii) 2-хлорацетил/3-хлорпропаноил хлорид, CH2Cl2, Et3N, 25°C; (iv) соответствующий гетероцикл, CH2Cl2, Et3N, кипячение.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Величины удельного вращения определяли на спектрометре PolAAr 3005. Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker AV-400 (1Н: 400.13 МГц, 13С: 100.61 МГц. В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (1Н 7.24, 13С 76.90 м.д.). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS ThermoScientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 μ, Masherey-Nagel). Хромато-масс-спектры записывали на газовом хроматографе Agilent 7890 А с квадрупольным масс-спектрометром Agilent 5975С в качестве детектора, кварцевая колонка HP-5MS 30000 0.25 мм, газ-носитель гелий. Удельное вращение выражено в (град⋅мл)⋅(г⋅дм)-1, концентрация раствора (г)⋅(100 мл)-1. Растворители перед использованием сушились и перегонялись. Изобретение иллюстрируется следующими примерами:
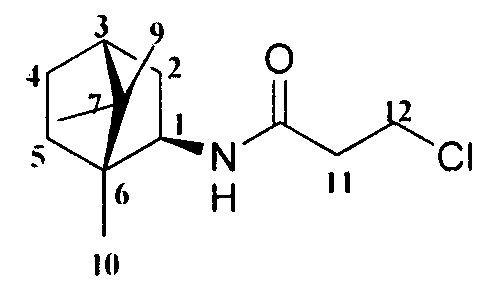
Пример 1. Синтез 2-Хлор-N-((1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил)ацетамида 4.
К смеси амина 3 (0,012 моль), который был синтезирован по методике, описанной в работе [Sokolova AS, Pavlova A, Komarova NI, Ardashov OV, Shernyukov AV, Gatilov YV, Yarovaya OI, Tolstikova TG, Salakhutdinov NF. Synthesis and analgesic activity of new α-truxillic acid derivatives with monoterpenoid fragments. Med Chem Res 2016; 25:1608-1615] и Et3N (0,012 моль) в 20 мл сухого CH2Cl2 при 15-18°С в атмосфере Ar добавляли хлорацетилхлорид (0,017 моль), и смесь перемешивали при комнатной температуре в течение 24 часов. Органический слой промывали насыщенным раствором NaCl и экстрагировали CHCl3. Объединенную органическую фазу сушили над безводным Na2SO4 и растворитель удаляли. Полученный остаток использовали на следующей стадии без дополнительной очистки.
2-Хлор-N-((1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил)ацетамид 4.
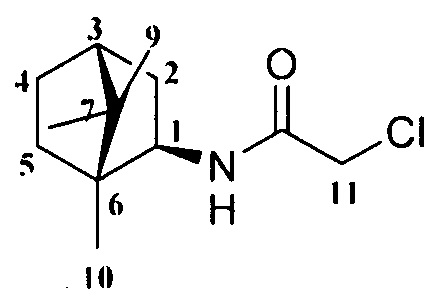
Выход 65%. ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 0.82 (6Н, с, Ме-8, Ме-10), 0,92 (3Н, с, Ме-9), 1.10-1.18 (1Н, м, Н-4эндо), 1.23-1.30 (1Н, м, Н-5эндо), 1.55-1.63 (2Н, м, Н-5экзо, Н-4экзо), 1.65-1.72 (1Н, м, Н-4экзо), 1.76 (1Н, т, J3,2экзо=J3,4экзо=4.3, Н-3), 1.85 (1Н, дд, J-9.0, 14.0, Н-2экзо), 3.86 (1Н, дт, J=4.9, 9.2, Н-1экзо), 4.02 (2Н, АВ-д, J=2.7, Н-11), 6.27 (1Н, N-H). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 164.73 с (С-11), 56.85 д (С-1), 48.42 с (С-6), 46.96 с (С-7), 44.73 д (C-3), 42.75 д (С-12), 38.74 т (С-2), 35.68 т (С-5), 26.84 т (С-4), 20.07 к, 19.93 к (Ме-8, Ме-9), 11.59 к (Me-10). 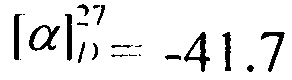 (CHCl3, с=0.6). Найдено: m/z 229.1228 [М]+ C12H20O1N1C1. Вычислено: М=229.1225.
(CHCl3, с=0.6). Найдено: m/z 229.1228 [М]+ C12H20O1N1C1. Вычислено: М=229.1225.
Пример 2. Синтез 3-Хлор-N-((1R,2R,4R)-1,7,7-триметилбицикло [2.2.11 гептан-2-ил)пропанамида 5.
К раствору 3-хлорпропановой кислоты в сухом CH2Cl2 добавели избыток оксалилхлорида и N,N-диметилформамид (одна капля). Смесь перемешивали при комнатной температуре в течение 4 ч в атмосфере Ar. Избыток оксалилхлорида удаляли на роторном испарителе. Полученный 3-хлорпропаноилхлорид использовали в следующей реакции без дополнительной очистки. К раствору амина 3 (15 ммоль) в CH2Cl2 добавили 3-хлорпропаноилхлорид (20 ммоль) в CH2Cl2 (5 мл) и Et3N (15 ммоль) при 0-5°С. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч в атмосфере Ar. Органический слой промывали насыщенным раствором NaCl и экстрагировали CH2Cl2. Объединенную органическую фазу сушили над безводным Na2SO4, растворитель удаляли. Полученный остаток использовали на следующей стадии без дополнительной очистки.
3-Хлор-N-((1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил)пронанамид 5.
Выход 62%. ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 0.80 (3Н, с, Ме-9), 0.82 (3Н, с, Me-10), 0.89 (3Н, с, Ме-8), 1.08-1.15 (1Н, м, Н-4эндо), 1.20-1.28 (1Н, м, Н-5эндо), 1.49-1.61 (2Н, м, Н-2эндо, Н-5экзо), 1.62-1.69 (1Н, м, Н-4экзо), 1.70-1.74 (1Н, м, Н-3), 1.83 (1Н, дд, J=9.0, 14.0, Н-2экзо), 2.81 (2Н, т, J=6.7, Н-12), 3.72 (2Н, т, J=6.7, H-13), 3.88 (1Н, дт, J=5.0, 9.2, Н-1экзо). ЯМР 13С (100 МГц, CDC13, δ, м.д.): 174.49 с (С-11), 57.01 д (С-1), 48.36 с (С-6), 46.93 с (С-7), 44.61 д (С-3), 40.38 т (С-13), 39.71 д (С-12), 38.72 т (С-2), 35.69 т (С-5), 26.77 т (С-4), 20.11 к, 20.05 к (Ме-8, Ме-9), 11.59 к (Ме-10).  (CHCl3, с=0.7). Найдено: m/z 243.1384 [M]+ C13H22O1N1C1. Вычислено: М=243.1385.
(CHCl3, с=0.7). Найдено: m/z 243.1384 [M]+ C13H22O1N1C1. Вычислено: М=243.1385.
Пример 3. Общая синтетическая методика для соединений I а-с.
Смесь ацетамида 6 или 7 (2 ммоль), соответствующего амина (2,2 ммоль), Et3N (2,2 ммоль) и 10 мл CH2Cl2 кипятили в течение 12 часов. После завершения реакции реакционную смесь промывали насыщенным раствором NaCl и дважды экстрагировали CHCl3. Объединенный органический слой сушили безводным Na2SO4 и упарили. Остаток хроматографировали на SiO2, используя в качестве элюента гексан/этилацетат (100:0→0:100) + метанол (1%).
2-(4-Метилпиперидин-1-ил)-N-((1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил)ацетамид Ia
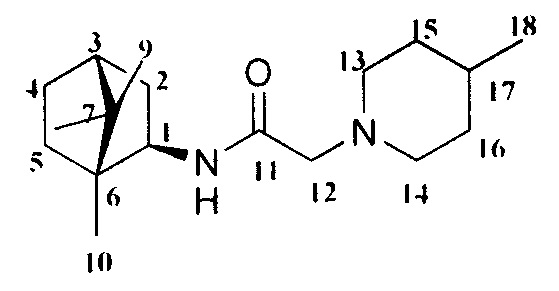
Выход 45%. ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 0.79 (3H, с, Ме-10), 0.82 (3H, с, Ме-8), 0,89 (3Н, д, J=6.3, Ме-18), 0.91 (3Н, с, Ме-9), 1.08-1.4 (5Н, м, Н-4эндо, Н-5эндо, Н-14а, Н-15, Н-16а), 1.49-1.67 (4Н, м, Н-5экзо, Н-4экзо, Н-14е, Н-16е), 1.72 (1Н, м, Н-3), 1.82 (1Н, дд, J=9.0, 14.0, Н-2экзо), 1.85-1.94 (2Н, Н-13е, Н-17е), 2.68-2.80 (2Н, м, Н-13е, Н-17е), 2.90 (2Н, АВ-д, Н-12), 3.84 (1Н, м, Н-1экзо), 7.49 (1Н, N-H). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 169.56 с (С-11), 61.61 т (С-12), 55.57 д (С-1), 54.24 т (С-13, С-17), 48.24 с (С-6), 46.89 с (С-7), 44.71 д (С-3), 39.06 т (С-2), 35.70 т (С-5), 34.60 т (С-14, С-16), 29.88 д (С-15), 26.88 т (С-4), 21.67 к (Ме-18), 20.08 к, 19.90 к (Ме-8, Me-9), 11.84 к (Ме-10).  (CHCl3, с=1.1). Найдено: m/z 292.2514 [M]+ C18H32O1N2. Вычислено: М=292.2509.
(CHCl3, с=1.1). Найдено: m/z 292.2514 [M]+ C18H32O1N2. Вычислено: М=292.2509.
3-Морфолино-N-((1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил)пропанамид Ib.
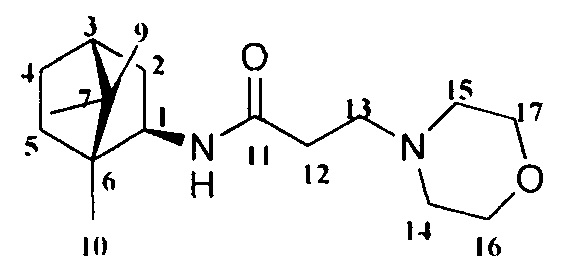
Выход 43%. ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 0.80 (3H, с, Ме-10), 0.81 (3Н, с, Ме-8), 0.91 (3Н, с, Ме-9), 1.07-1.15 (1Н, м, Н-4эндо), 1.20-1.29 (1Н, м, Н-5эндо), 1.45-1.56 (2Н, м, Н-5экзо, Н-2эндо), 1.61-1.71 (2Н, м, Н-4экзо, Н-3), 1.82 (1Н, дд, J=9.0, 14.0, Н-2экзо), 2.33-2.37 (2Н, м, Н-12), 2.40-2.47 (4Н, уш. с, Н-14, Н-15), 2.50-2.57 (2Н, м, Н-13), 3.63-3.73 (4Н, м, Н-16, Н-17), 3.84 (1Н, дт, J=4.9, 9.2, Н-1экзо), 8.10 (1H, N-H). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 171.2 с (С-11), 66.37 т (С-16, С-17), 55.96 д (С-1), 54.78 т (С-13), 52.93 т (С-14, С-15), 48.10 с (С-6), 46.86 с (С-7), 44.68 д (С-3), 39.16 т (С-2), 35.81 т (С-5), 31.27 т (С-12), 26.83 т (С-4), 20.56 к, 20.03 к (Ме-8, Ме-9), 11.81 к (Ме-10). 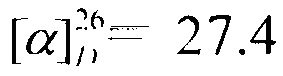 (CHCl3, с=0.6). Найдено: m/z 294.2300 [M]+ C17H30O2N2. Вычислено: М=294.2302.
(CHCl3, с=0.6). Найдено: m/z 294.2300 [M]+ C17H30O2N2. Вычислено: М=294.2302.
2-(4-Метилпиперазин-1-ил)-N-((1R,2R,4R)-1,7,7-триметилбицикло|2.2.1]гептан-2-ил)ацетамид Ic
Выход 63%. ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 0.75 (3Н, с, Ме-10), 0.78 (3Н, с, Ме-8), 0.86 (3Н, с, Ме-9), 1.05-1.12 (1Н, м, Н-4эндо), 1.19-1.27 (1Н, м, Н-5эндо), 1.45-1.54 (2Н, м, Н-5экзо, Н-2эндо), 1.59-1.66 (1Н, м, Н-4экзо), 1.66-1.70 (1Н, м, Н-3), 1.78 (1Н, дд, J=9.0, 14.0, Н-2экзо), 2.21 (3Н, с, Ме-17), 2.29-2.55 (8Н, м, Н-13, Н-14, Н-15, Н-16), 2.91 (2Н, АВ-д, J=3.8, Н-12), 3.80 (1Н, дт, J=4.9, 9.2, Н-1экзо), 7.33 (1Н, N-H). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 168.89 с (С-11), 60.99 т (С-12), 55.58 д (С-1), 55.16 т (С-13, С-14), 53.19 т (С-16, С-15), 48.18 с (С-6), 46.86 с (С-7), 45.74 к (Me-17), 44.64 д (С-3), 39.01 т (С-2), 35.62 т (С-5), 26.80 т (С-4), 20.00 к, 19.98 к (Ме-8, Ме-9), 11.83 к (Ме-10).  (CHCl3, с=0.9). Найдено: m/z 293.2460 [М]+ C17H31O1N3. Вычислено: М=293.2462.
(CHCl3, с=0.9). Найдено: m/z 293.2460 [М]+ C17H31O1N3. Вычислено: М=293.2462.
Определение противовирусного действия соединений I а-с в отношении вирусов осповакцины (штамм Копенгаген) и оспы мышей (штамм К-1) в культуре клеток Vero
В работе были использованы типичные представители ортопоксвирусов - вирус осповакцины (штамм Копенгаген) и эктромелии (оспы мышей, штамм К-1), полученные из Государственной коллекции возбудителей вирусных инфекций и риккстсиозов ФБУН ГНЦ БВ «Вектор» Роспотребнадзора.
Вирусы нарабатывали в культуре клеток Vero. Концентрацию вирусов в культуральной жидкости определяли путем титрования методом бляшек в культуре клеток Vero, рассчитывали и выражали в десятичных логарифмах бляшко-образующих единиц в 1 мл (lg БОЕ/мл). Концентрация вирусов в использованных в работе образцах составляла от 5,6 до 6,1 lg БОЕ/мл. Наработанные и использованные в работе серии вирусов с указанным титром хранили при -70°С.
Оценку противовирусной эффективности препаратов проводили по адаптированной и модифицированной нами методике [Селиванов Б.А., Тихонов А.Я., Беланов Е.Ф., Бормотов Н.И., Кабанов А.С., Мазурков О.Ю., Серова О.А., Шишкина Л.Н., Агафонов А.П., Сергеев А.Н. Синтез и противовирусная активность 1-арил-3-{3,5-диоксо-4-азатетрацикло-[5.3.2.02,6.08,10|додец-11-ен-4-ил}мочевин // Химико-фармацевтический журнал. 2017. Т. 51. №6. С. 13-17]. В качестве препарата сравнения использовали коммерчески доступный препарат Цидофовир (Cidofovir, Vistide) производства Gilead Sciences Inc. (США).
В лунки 96-луночных планшетов, содержащих монослой клеток Vero в 100 мкл среды DMEM с 2% эмбриональной сыворотки, сначала вносили по 50 мкл серийных разведений исследуемых соединений, а потом по 50 мкл разведения ортопоксвируса в дозе 1000 БОЕ/лунку. Токсическая активность соединений определялась по гибели клеток под воздействием препарата в лунках планшета, в которые вирус не вносили. В качестве контролей использовали монослои клеток в лунках планшета, в которые вносили вирус без соединений (контроль вируса) и монослои клеток в лунках, в которые не вносили ни вирус, ни соединения (контроль культуры клеток). После инкубирования в течение 4 сут, монослой клеток окрашивали витальным красителем нейтральным красным в течение 2 ч. После удаления красителя и отмывки лунок от его несвязавшейся фракции добавляли лизирующий буфер.
Примечание:
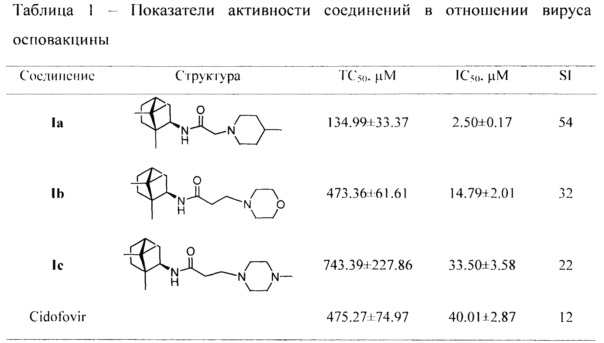
ТС50 - токсическая концентрация препарата, при которой разрушается 50% клеток в неинфицированном монослое;
IC50 - ингибирующая концентрация препарата, при которой не разрушается 50% клеток в инфицированном монослое;
SI - индекс селективности препарата (TC50/IC50); данные представлены в виде М±I95, где М среднее значение; I95 - 95%-й доверительный интервал; n=3 количество повторов измерения ТС50 и IC50.
Количество красителя, адсорбированное живыми клетками монослоя, оценивали по оптической плотности (ОП), которая является показателем количества неразрушенных под влиянием вируса клеток в монослое. ОП измеряли на спектрофотометре Emax (Molecular Devices, США) при длине волны 490 нм. Учет результатов проводили с использованием планшетного спектрофотометра Emax и программы SoftMax 4.0 (Molecular Devices, США), которая автоматически рассчитывала 50% токсическую концентрацию (ТС50 в μМ) и 50% ингибирующую (эффективную) концентрацию (IC50 в μМ) препаратов. По соотношению 50% токсической и эффективной концентраций определяли индекс селективности (SI) препарата в отношении вируса: SI=TC50/IC50 (таблицы 1 и 2).

Примечание: см. примечание к таблице 1.
Таким образом, заявленные соединения обладают противовирусной активностью в отношении вирусов осповакцины и оспы мышей (эктромелии) типичных представителей ортопоксвирусов.