Результат интеллектуальной деятельности: АМИНОТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК НОВЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической химии и касается производных усниновой кислоты, содержащих тиазольный цикл. Указанные соединения могут быть использованы в качестве веществ, активных в отношении Mycobacterium tuberculosis.
Уровень техники
Повышение эффективности лечения больных туберкулезом - важнейшая социальная задача в России и мире. Ежегодно эти заболевания уносят более 2 миллионов жизней. Улучшение результатов лечения туберкулеза зависит от развития современной фармацевтики, главным в котором является разработка новых технологических подходов к созданию новых лекарственных средств путем воздействия на мишени, важные для жизнедеятельности возбудителя туберкулеза - Mycobacterium tuberculosis. Одной из причин трудности лечения туберкулеза является массовое возникновение множественной лекарственной устойчивости (МЛУ или MDR - Multiple Drug Resistance) у возбудителя туберкулеза, как к традиционным противотуберкулезным лекарствам так называемого первого ряда (особенно к рифампицину и изониазиду), так и к препаратам второго ряда (фторхинолонам и аминогликозидам) (Zhang Y, Yew WW. Mechanisms of drug resistance in Mycobacterium tuberculosis. Int J Tuberc Lung Dis. 2009 Nov; 13(11):1320-30; Chiang CY, Centis R, Migliori GB. Drug-resistant tuberculosis: past, present, future. Respirology. 2010 Apr; 15(3):413-32. Epub, 2010, Mar 19). Среди устойчивых штаммов особенно опасны штаммы с широкой лекарственной устойчивостью (ШЛУ или XDR - Extensively Drug-Resistant); они устойчивы к 4-9 препаратам первого и второго ряда. Поэтому преодоление проблем, стоящих перед фтизиатрией в связи с появлением MDR, является задачей первостепенной важности (Tomioka H. Prospects for the development of new antituberculous drugs putting our hopes on new drug targets. Kekkaku. 2010; 85(11):815-22, Shi R, Sugawara I. Development of new anti-tuberculosis drug candidates.Tohoku J Exp Med. 2010; 221(2):97-106; Koul A, Arnoult E, Lounis N, Guillemont J, Andries K The challenge of new drug discovery for tuberculosis. Nature. 2011; 469(7331):483-90; Прозоров А.А., Зайчикова M.B., Даниленко В.Н. Мутанты Mycobacterium tuberculosis с множественной лекарственной устойчивостью: история появления, генетические и молекулярные механизмы устойчивости, возникающие проблемы. / Генетика. 2012. Т.48. №1. С.5-20; Butler MS, Cooper MA. Antibiotics in the clinical pipeline in 2011. J Antibiot (Tokyo). 2011 Jun; 64(6):413-25. doi: 10.1038/ja.2011.44. Epub 2011, May 18).
Сформулирована необходимость разработки новых кандидатов в лекарства в первую очередь, полусинтетических, на базе природных веществ новых классов, показавших в предыдущих исследованиях новый механизм действия и прошедших исследования на безопасность для человека. Природная усниновая кислота ранее использовалась в качестве противотуберкулезного препарата, однако, ее недостатками являются относительно низкая эффективность по сравнению с существующими препаратами первого ряда и низкая водорастворимость. Перспективными полусинтетическими производными усниновой кислоты являются соединения, содержащие в своей структуре тиазольный цикл. Известно, что тиазольный цикл входит в структуру многих биологически активных соединений (например, витамин В1) и лекарств с противомикробным действием (норсульфазол, фталазол), а также соединений, обладающих противотуберкулезной активностью (L.G.Dover, G.D.Coxon, J. Med. Chem., 54, 6157 (2011)). Кроме того, предлагаемые полусинтетические производные усниновой кислоты, содержащие тиазольный цикл, более эффективны и обладают бактерицидным действием.
Решаемая проблема. Поиск антибактериальных средств нового механизма действия, в том числе противотуберкулезных, активных в отношении штаммов с множественной лекарственной устойчивостью.
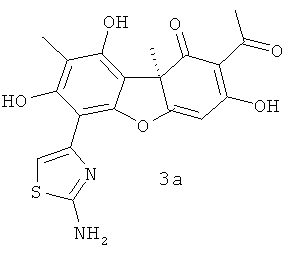
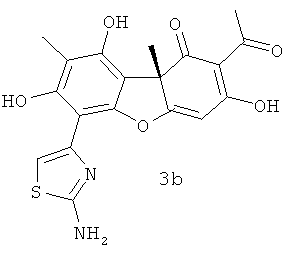
Соединения, раскрываемые в настоящем изобретении, являются производными (R)- и (S)-усниновой кислоты, содержащими тиазольный цикл, соединения 2а, b и 3а, b являются новыми, не описанными ранее.
Раскрытие изобретения
Задача изобретения - использование в качестве противотуберкулезных средств впервые синтезированных производных усниновой кислоты, обладающих бактерицидным действием в отношении Mycobacterium tuberculosis.
(S)-Усниновую кислоту 1а выделяли из лишайника Cladonia stellaris, (R)-усниновую кислоту 1b из смеси лишайников рода Usnea по методике [Н.Ф.Салахутдинов, М.П.Половинка, М.Ю.Панченко, Пат. РФ №2317076 C1; Бюл. Изобр. 2008, №5].
Соединения 2а, b могут быть получены взаимодействием соответственно соединений 1а и 1b с двукратным избытком брома в диоксане. Соединения 3а, b могут быть получены взаимодействием соответственно соединений 2а и 2b с тиомочевиной.
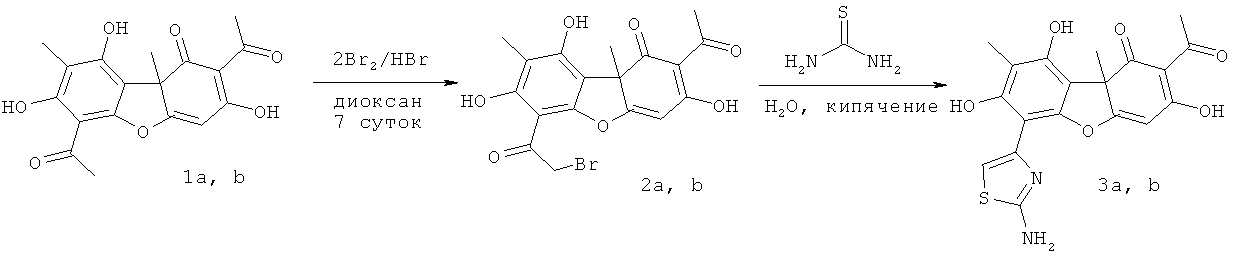
Пример 1. Синтез 2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-онов 2а,b
К 1 ммоль (R)- или (S)-усниновой кислоты (344 мг) добавляли заранее приготовленный комплекс бромдиоксана (2 ммоль брома (0.10 мл) растворяли в 14 мл диоксана), несколько капель HBr и оставили на 7 суток при комнатной температуре. После концентрирования реакционной смеси на ротационном испарителе хроматографировали полученный остаток на силикагеле (60-200 µ), элюент - CH2Cl2.
(S)-2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 2а. Выход 283 мг (67%). Т.пл. 97-100°C. [α]20 D -349 (с 0.5; CHCl3). ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.75 (3Н, с, Н-15), 2.08 (3Н, с, Н-10), 2.64 (3Н, с, Н-12), 4.52 (2Н, дд, J=12.4, J=14.0, Н-14), 6.00 (1Н, с, Н-4), 11.17 (1Н, с, ОН-9), 12.68 (1Н, с, ОН-7), 18.81 (1Н, с, ОН-3). ЯМР 13С (CDCl3, δ, м.д.): 7.5 (С-10), 27.7 (С-12), 31.9 (С-15), 34.5 (С-14), 61.6 (C-9b), 98.7 (С-4), 99.0 (С-6), 104.3 (C-9a), 105.1 (C-2), 109.6 (C-8), 154.3 (C-5a), 158.4 (C-9), 164.1 (C-7), 178.5 (C-4a), 191.5 (C-3), 192.7(C-13). 197.7 (C-1), 201.7 (C-11). ИК спектр (ν, см-1): 842, 1140, 1292, 1458, 1628, 3013, 3497. Найдено: m/z 421.9976 [M]+ C18H15O7Br. Вычислено: М=421.9996.
(R)-2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 2b. Т.пл. 98-100°C. [α]D -346 (с 0.5; CHCl3).
Пример 2. Синтез 2-ацетил-6-(2-аминотиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-онов 3а, b
Навески 1 ммоль соединения 2а или 2b (423 мг) и 1.2 ммоль (91 мг) тиомочевины кипятили в 25 мл дистиллированной воды в течение 2.5 часов. Затем экстрагировали охлажденную реакционную смесь хлористым метиленом (×3). Экстракт сушили над MgSO4, концентрировали и хроматографировали на SiO2 (элюент CH2Cl2 + 5% CH3OH).
(S)-2-ацетил-6-(2-аминотиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 3а. Выход 208 мг (52%). Т.пл. 220°C с разложением, [α]25 D -128 (с 0.15; CHCl3). ЯМР 1Н (DMSO-d6, δ, м.д., J Гц): 1.70 (3Н, с, Н-15), 2.02 (3Н, с, Н-10), 2.58 (3Н, с, Н-12), 6.18 (1Н, с, Н-4), 6.96 (1Н, Н-14), 7.63 (2Н, NH2), 10.24 (1Н, с, ОН-9), 13.30 (1Н, с, ОН-7), 18.78 (1Н, с, ОН-3). ЯМР 13С (DMSO-d6, δ, м.д.): 8.45 (С-10), 27.63 (С-12), 31.73 (С-15), 59.14 (C-9b), 97.63 (С-6), 97.32 (С-4), 101.77 (С-14), 103.25 (C-9a), 105.16 (C-2), 107.22 (C-8), 141.87 (C-13), 150.32 (C-9), 151.21 (C-7), 156.54 (C-5a), 167.81 (C-16), 180.60 (C-4a), 191.34 (C-3), 198.22 (C-l), 201.00 (C-11). ИК спектр (ν, см-1): 540, 831, 950, 1026, 1083, 1178, 1548, 1624, 1679, 3076, 3141, 3224, 3334, 3417. Найдено: m/z 400.0723
[M]+ C19H16N2O6S. Вычислено: М=400.0724.
(R)-2-ацетил-6-(2-аминотиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 3b. Т.пл. 220°C с разложением, [α]25 D -131 (с 0.17; CHCl3).
Пример 3.
Антибактериальная активность веществ 3а и 3b в тест-системе Mycobacterium smegmatis ATCC-607.
Mycobacterium smegmatis - модельная тест-система, используемая на первой стадии скрининга потенциальных противотуберкулезных средств (K.E.A.Lougheed, S.А.Osborne, B.Saxty, et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents. Tuberculosis (Edinb). 2011 July; 91(4):277-286; S.R.García, C.Ng, Н.Anderson, J.D.Chao, X.Zheng, T.Pfeifer, Y.Av-Gay, M.Roberge, C.J.Thompson. Synergistic Drug Combinations for Tuberculosis Therapy Identified by a Novel High-Throughput Screen. Antimicrobial Agents and Chemotherapy, Aug. 2011, p.3861-3869, vol.55, No.8).
Определение активности вещества проводилось методом бумажных дисков. Метод заключается в определении величины зоны подавления роста штамма, засеянного газоном на агаризованной среде №36 (Himedia, India), вокруг бумажных дисков, содержащих вещество в различных концентрациях.
|
Штамм Mycobacterium smegmatis ATCC-607 чувствителен к 7.5 нмоль/диск вещества 3а, к 10 нмоль/диск вещества 3b.
Пример 4.
Определение бактерицидного действия соединения 3а на M. tuberculosis.
Определение минимальной ингибирующей концентрации (МИК) производного усниновой кислоты 3а на M. tuberculosis проведено методом измерения оптической плотности бактериальной суспензии в присутствии тестируемого соединения.
Клетки M. tuberculosis были посеяны на бульон Дюбо. О наличии роста M. tuberculosis судили по увеличению оптической плотности суспензии. Рост в контрольной пробирке отмечался на 13 день исследования. Одновременно начался рост культуры в присутствии 0.2 мкг/мл препарата. Начиная с 13 дня, фиксировался рост М. tuberculosis в пробирках с препаратом в концентрации 1 и 5 мкг/мл. По достижении стационарной фазы роста оптическая плотность контрольной пробирки составила 1.2, а при эскпозиции с соединением 3а в концентрациях 0.2-5 мкг/мл составила 0.9-0.95. При воздействии соединения в концентрациях 25, 50 и 100 мкг/мл роста культуры не было получено на протяжении всего эксперимента (42 дня). Таким образом, минимальная ингибирующая концентрация составила менее 25 мкг/мл.
В системе in vitro определяли минимальную бактерицидную концентрацию (МБК). Определение МБК поводили подсчетом микроколоний после пересева с жидкой среды на чашке Петри с агаризованной средой. С жидкой питательной среды Дюбо с отсутствием роста M. tuberculosis (МБТ) под воздействием препарата пересевали микобактериальную суспензию на агаризованную среду Дюбо и подсчитывали выросшие микроколонии. Также проводили пересев и с пробирок с наличием роста, чтобы определить число живых МБТ в суспензии и определить негативное влияние препарата на культуру МБТ. Пересевали бактериальную суспензию на 20 и 40 сутки эксперимента.
Рост культур после пересева на агар Дюбо
|
При пересеве на свежую агаризованную среду Дюбо культур M. tuberculosis, инкубировавшихся с соединением 3а в течение 20 и 40 суток, МБК составила менее 25 мкг/мл. Таким образом, вещество 3а обладает ярковыраженным бактерицидным действием, что делает его перспективным для использования в качестве антимикобактериального препарата.
Ингибиторы роста Mycobacterium tuberculosis, производные усниновой кислоты, представляющие собой (S)-2-ацетил-6-(2-аминотиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 3a и (R)-2-ацетил-6-(2-аминотиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 3b