Результат интеллектуальной деятельности: АЛКИЛИРУЮЩИЕ ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ 1,4-НАФТОХИНОНА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ
Вид РИД
Изобретение
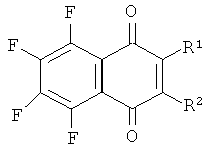
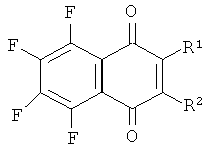
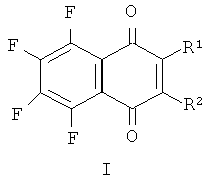
Изобретение относится к области биоорганической химии и молекулярной биологии, а именно к алкилирующим аналогам фторированных производных 1,4-нафтохинона общей формулы (I):
где:
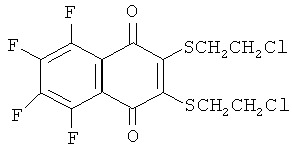
1) R1, R2=SCH2CH2Cl,
2) R1, R2=OCH2CH2Cl,
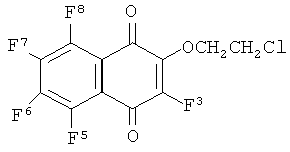
3) R1=OCH2CH2Cl, R2=F,
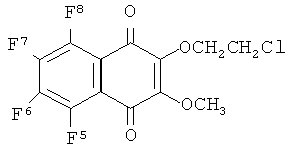
4) R1=SCH2CH2Cl, R2=OCH3,
обладающих цитотоксической активностью по отношению к раковым клеткам человека в культуре.
Для передачи внеклеточного сигнала к внутриклеточным мишеням клетки человека и млекопитающих обычно используют обратимое фосфорилирование остатков тирозина в белках. Известно, что нарушение медиаторов передачи сигнала через фосфорилирование белков, а именно протеинкиназ и фосфатаз, связано с развитием большого числа заболеваний человека, включая раковые заболевания. Так, Cdc25A и Cd25B фосфатазы активируют циклинзависимые киназы, которые играют важную роль в регуляции пролиферации клеток. Эти ферменты важны для контроля клеточного цикла человека; они обладают онкогенными свойствами и гиперэкспрессированы в различных раковых клетках человека. Учитывая это, они представляют интерес как мишени для антираковых препаратов [Boutros R., Dosier C., Ducommun B. Curr. Opin. Cell. Biol. 2006. V.18, P.185; Kristjansdottir К., Rudolf J. J. Chem. Biol., 2004. V.11. P.1043].
Было исследовано большое число различных соединений. Однако только некоторые производные нафтохинона обладали способностью эффективно ингибировать Cdc25A фосфатазу [Eckstein J.W. Invest. New. Drugs. 2000. V.18, P.149; Pesttell К.Е., Ducruet A.P., Wipf P., et al. Oncogene., 2002. V.19. P.6607] и особенно нафтохинон NSC 95397 из National Cancer Institute library [Lazo J.S., Nemoto K., Pestell K.E. et al., Mol. Pharmacol., 2002. V.61. P.720].
В зависимости от структуры различные соединения, включая ингибиторы Cdc25 фосфатаз, могут быть полифункциональными и взаимодействовать не только с основной мишенью, но и с другими компонентами клеток, а также проявлять общую цитотоксичность, быть мутагенами, канцерогенами или проявлять защитно-антиокислительные свойства. Кроме того, они могут различаться по способности проникать в различные органы, ткани, клетки, клеточные органеллы (митохондрии, ядра). В этой связи совершенно очевидно, что одним из перспективных направлений развития терапии раковых заболеваний является создание новых соединений, проявляющих высокую активность при минимальных концентрациях в отношении основной мишени, но с низкой общей цито- и генотоксичностью. Еще одним преимуществом антираковых препаратов является их способность не только подавлять рост раковых клеток, но и параллельно служить антиоксидантами, подавляющими окислительный стресс, который, как считается, является одним из основных путей появления раковых клеток.
Известен 2-(2-меркаптоэтанол)-3-метил-5,6,7,8-тетрафтор-1,4-нафтохинон (фторированный Cpd 5), который обладает более высокой активностью в подавлении роста Нер3В клеток, чем нефторированный аналог Cpd 5 (Ham W.Н. et al., 2004, Bioorg. Med. Chem. Lett., 2004, V.14. Р.4103-4105). Фторированный Cpd 5 был получен по реакции 2-метил-3,5,6,7,8-пентафтор-1,4-нафтохинона (II) с 2-меркаптоэтанолом.
Недостатками известных Cpd 5 и фторированного Cpd 5 являются их высокая токсичность.
Известны фторированные производные 1,4-нафтохинона, содержащие аминокислотные фрагменты, общей формулы (III):
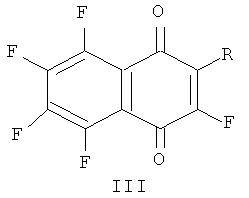
где:
1) R=NHCH2COOH,
2) R=NHCH2COOC2H5,
3) R=NH(CH2)5COOH,
4) R=NH(CH2)3COOH,
5) R=NH(CH2)2COOH,
6) R=OOC(CH2)3NH2,
обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре, а также в меньшей степени подверженные реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса (патент RU 2443678 С1, 27.02.2012).
Приведенные выше соединения получают взаимодействием гексафтор-1,4-нафтохинона или хинона (II) с азот- и кислородцентрированными нуклеофилами, соответствующими заместителям, вводимым вместо атома фтора в исходный нафтохинон.
Ближайшими к заявляемым соединениям (прототипом) являются фторированные производные 1,4-нафтохинона общей формулы (IV):
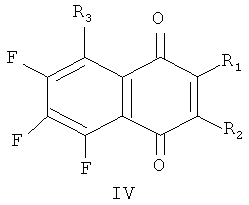
где: 1) NHC(CH3)3, R2, R3=F; 2) R1=NHCH2CH2SCH3, R2, R3=F; 3) R1=N(CH2CH3)2, R2, R3=F; 4) R1=N(CH2CH2)2O, R2, R3=F; 5) R1=NHCH2CH2CH2CH3, R2, R3=F; 6) R1=NHC6H5, R2, R3=F; 7) R1=N(CH3)CH2CH2OH, R2, R3=F; 8) R1, R3=NHCH2CH2CH2CH3, R2=F; 9) R1=N(CH2CH2OH)2, R2, R3=F; 10) R1=NHC6H5, R2=CH3, R3=F; 11) R1=OCH3, R2, R3=F; 12) R1=NH(CH2)2SS(CH2)2NH(2-пентафтор-1,4-нафтохинонил), R2, R3=F; 13) R1=NHC2H5, R2, R3=F; 14) R1=N+C5H5, R2=О-, R3=F; 15) R1=NHCH2CH2OH, R2, R3=F; 16) R1, R2=OCH3, R3=F, обладающее цитотоксической активностью по отношению к раковым клеткам человека в культуре (патент RU 2387635 С1, 27.04.2010).
Известные соединения получают взаимодействием гексафтор-1,4-нафтохинона или хинона (II) (для соединения 10) с азот- и кислородцентрированными нуклеофилами.
Недостатком известных соединений является то, что они сильно различаются по эффективности ингибирования роста раковых клеток разных типов и некоторые из них подавляют рост раковых и обычных клеток при близких концентрациях. Кроме того, эти соединения взаимодействуют с фосфатазами обратимо и не способны модифицировать их необратимо.
Задачей данного изобретения является создание фторированных производных 1,4-нафтохинона, содержащих алкилирующие группы, способные модифицировать белки, к которым они имеют сродство типа Cdc25A и Cd25B фосфатаз, и обладающие цитотоксичностью по отношению к раковым клеткам человека в культуре, а также антиоксидантными свойствами.
Технический результат - повышение эффективности ингибирования роста раковых клеток.
Поставленная задача достигается предлагаемыми алкилирующими фторированными производными 1,4-нафтохинона общей формулы (I), где:
1) R1, R2=SCH2CH2Cl,
2) R1, R2=OCH2CH2Cl,
3) R1=OCH2CH2Cl, R2=F,
4) R1=SCH2CH2Cl, R2=OCH3.
Предлагаемые соединения получают взаимодействием гексафтор-1,4-нафтохинона (для 1-3) или 2-метоксипентафтор-1,4-нафтохинона (для 4) с хлорэтилмеркаптаном (для 1 и 4) или этиленхлоргидрином (для 2 и 3) и характеризуют с помощью методов элементного анализа или масс-спектроскопии высокого разрешения, спектров ЯМР 1Н и 19F.
Предлагаемые фторированные производные 1,4-нафтохинона, содержащие алкилирующие группы, способные модифицировать белки, к которым они имеют сродство, в меньшей степени подвергаются реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса за счет индукционного эффекта электроотрицательных атомов фтора. Поэтому они могут быть более перспективными соединениями для направленного подавления развития раковых клеток, синтезирующих в повышенных количествах онкогенные протеинкиназы и фосфатазы. Кроме того, в отличие от ранее описанных соединений, эффективность воздействия алкилирующих производных фторированных нафтохинонов может быть усилена за счет возможности их взаимодействия с Cdc25A и Cd25B фосфатазами с образованием неактивных ковалентных аддуктов.
В таблице 1 представлены заявляемые фторированные производные 1,4-нафтохинона, содержащие алкилирующие группы, и их структурные формулы.
Изобретение иллюстрируется следующими примерами конкретного получения предлагаемых соединений.
Пример 1. Получение 2,3-бис(2-хлорэтилтио)-5,6,7,8-тетрафтор-1,4-нафтохинона (1)
Смесь гексафтор-1,4-нафтохинона (0.050 г, 0.179 ммоль), 2-хлорэтилмеркаптана (0.052 г, 0.537 ммоль), Et3N (0.036 г, 0.358 ммоль) и хлороформа (10 мл) перемешивали 1 ч при комнатной температуре в атмосфере аргона. Добавляли воду (~10 мл), органический слой отделяли, растворитель удаляли в вакууме, очищали колоночной хроматографией (CH2Cl2), после чего осаждали из CH2Cl2 гексаном. Выход хинона (1) 0.06 г (71%), желтые кристаллы, т. пл. 114.3°С. Найдено, %: С 40.13; Н 1.91; S 15.23. C14H8Cl2F4O2S2. Вычислено, %: С 40.11; Н 1.92; S 15.30. Спектр ЯМР, δ/м.д. (J/Гц): 19F 24.6 м (F5, F8), 17.6 м (F6, F7); 1H 3.76 т (4Н, 2СН2, 6.8), 3.55 т (4Н, 2СН2, 6.8).
Пример 2. Получение 2,3-бис(2-хлорэтокси)-5,6,7,8-тетрафтор-1,4-нафтохинона (2)
Смесь гексафтор-1,4-нафтохинона (0.100 г, 0.376 ммоль), этиленхлоргидрина (0.061 г, 0.752 ммоль), Et3N (0.076 г, 0.752 ммоль) и ацетонитрила (2 мл) перемешивали 5 ч при комнатной температуре. Добавляли воду (8 мл), осадок отделяли на центрифуге, промывали водой (2×4 мл) и сушили в вакууме (0.03 мм рт. ст.). Кристаллизовали из гексана с добавлением нескольких капель CH2Cl2 Выход хинона (2) 0.106 г (73%), желтые кристаллы, т. пл. 124.2°С. Найдено, %: С 43.94; Н 2.23. C14H8Cl2F4O4. Вычислено, %: С 43.44; Н 2.08. Спектр ЯМР, δ/м.д. (J/Гц): 19F 24.3 м (F5, F8), 17.8 м (F6, F7); 1Н 4.63 т (4Н, 2СН2, 5.5), 3.86 т (4Н, 2СН2, 5.5).
Пример 3. Получение 2-(2-хлорэтокси)-3,5,6,7,8-пентафтор-1,4-нафтохинона (3)
Смесь гексафтор-1,4-нафтохинона (0.100 г, 0.376 ммоль), этиленхлоргидрина (0.030 г, 0.376 ммоль), Et3N (0.038 г, 0.376 ммоль) и ацетонитрила (2 мл) перемешивали 30 мин при комнатной температуре. Добавляли воду (10 мл), осадок отделяли на центрифуге, промывали водой (2×2 мл). Переосаждали из CH2Cl2 гексаном. Выход хинона (3) 0.096 г (78%), желтые кристаллы, т. пл. 168.8°С. Найдено [М-Cl, - H]+ 290.0005. Вычислено [М-Cl, - H] 289.9997. Спектр ЯМР, δ/м.д. (J/Гц): 19F 22.5 м (F3), 25.7 или 26.0 д.д.д (J5,6 19.5, J5,7, J5,8 11-12) (F5), 19.4 д.д.д.д (J5,6, /6,7 -19.5, J^ 12.0, J^ 3.9) (F6), 18.9 д.д.д J6,7~19.5, J6,8 12.0, J3,6 3.9) (F6), 18.9 д.д.д (J6,7, J7,8~19.5, J5,7 11.5) (F7), 26.0 или 25.7 д.д.д (J7,8 19.5, J5,8, J6,8 11-12) (F8); 1Н 4.68 т.д (2Н, СН2, 5.5, JH,F 2.1,), 3.82 т (2Н, СН2, 5.5).
Пример 4. Получение 2-(2-хлорэтилтио)-3-метокси-5,6,7,8-тетрафтор-1,4-нафтохинона (4)
Смесь 2-метоксипентафтор-1,4-нафтохинона (0.050 г, 0.179 ммоль), 2-хлорэтилмеркаптана (0.069 г, 0.716 ммоль) и ацетонитрила (~2 мл) перемешивали 8 суток при комнатной температуре в атмосфере аргона. Добавляли воду (~5 мл), экстрагировали хлористым метиленом и очищали методом ТСХ (пластины «MERCK» на алюминиевой подложке, хлороформ). Выход хинона (4) 0.05 г (80%), оранжевые кристаллы, т. пл. 91.0°С. Найдено [M]+ 353.9747. C13H7F4ClO3S. Вычислено М353.9735. Спектр ЯМР, δ/м.д. (J/Гц): 19F 24.2 д.д.д, 24.4 д.д.д (J5,6, J7,8,~19, J5,8~13, J5,7, J6,8~11) (F5, F8), 18.0 или 17.2 д.д.д (J5,6, J6,7~19, J6,8~11) (F6), 17.2 или 18.0 д.д.д (J5,7~11, J6,7, J7,8~19) (F7); 1H 4.20 с (3Н, СН3), 3.73-3.66 м (2Н, СН2, 0.7), 3.48-3.40 м (2Н, СН2, 0.7).
Пример 5
Проводили испытание влияния предлагаемых соединений на рост различных линий раковых клеток в культуре. Клетки аденокарциномы молочной железы человека MCF-7 выращивали в среде IMDM, клетки миеломы человека (линия RPMI 6228) выращивали с использованием среды RPMI 1640 с 40 мкг/мл гентамицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% СО2 в 96-луночных планшетах.
Для сравнения относительной активности всех соединений в одинаковых условиях их растворяли в ДМСО в высокой концентрации (10 мг/мл), а затем стоковый раствор разбавляли ДМСО для получения серии растворов с нужной концентрацией. При использовании клеток аденокарциномы молочной железы после формирования 50-70% монослоя в культуральную среду добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема) и следили за ростом клеточной культуры в течение 3-х суток.
При использовании клеток линии миеломы человека, которая является суспензионной культурой, клетки рассевали в 96-луночный планшет в количестве 100 мкл на лунку, концентрация 2×105 клеток/мл; через 12-24 ч добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема смеси в лунке).
Действие фторированных производных 1,4-нафтохинона на клетки MCF-7 и RPMI 6228 в культуре и подавление их роста проводили с помощью теста, основанного на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан (МТТ-тест), который кристаллизуется внутри клетки. Так как у нежизнеспособных клеток ферменты не функционируют и отсутствуют кофакторы этого превращения, они не окрашиваются МТТ. Образовавшийся осадок формазана в жизнеспособных клетках растворяли в изопропаноле и его количество определяли спектрофотометрически по поглощению на длине волны λ=560 нм.
В качестве положительного контроля использовали клетки, которые выращивали в отсутствие фторированных производных 1,4-нафтохинона. Было установлено, что ДМСО в использованной концентрации (1%) заметного влияния на рост раковых клеток не оказывает. Кроме того, установлено, что исследуемые соединения не влияют на окраску клеток в МТТ-тесте, если они добавлены в лунки с клетками непосредственно перед проведением теста.
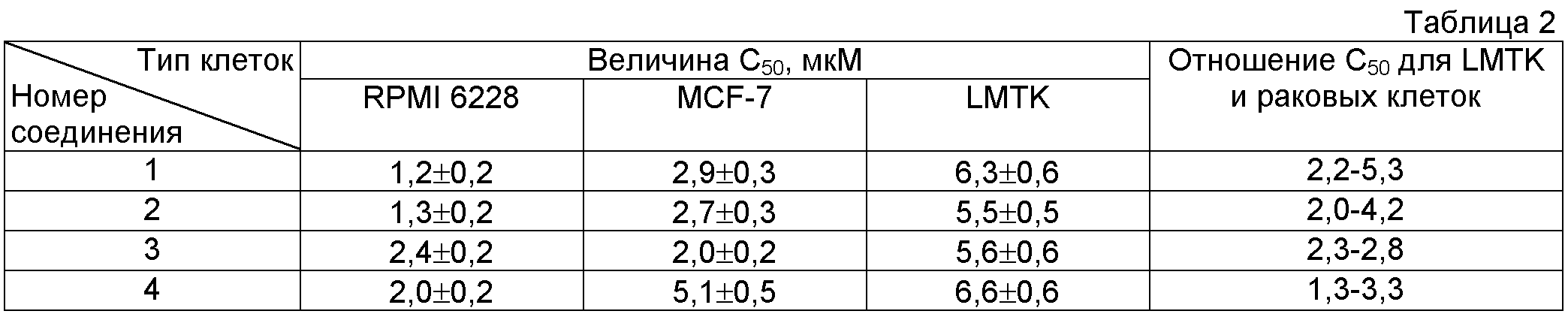
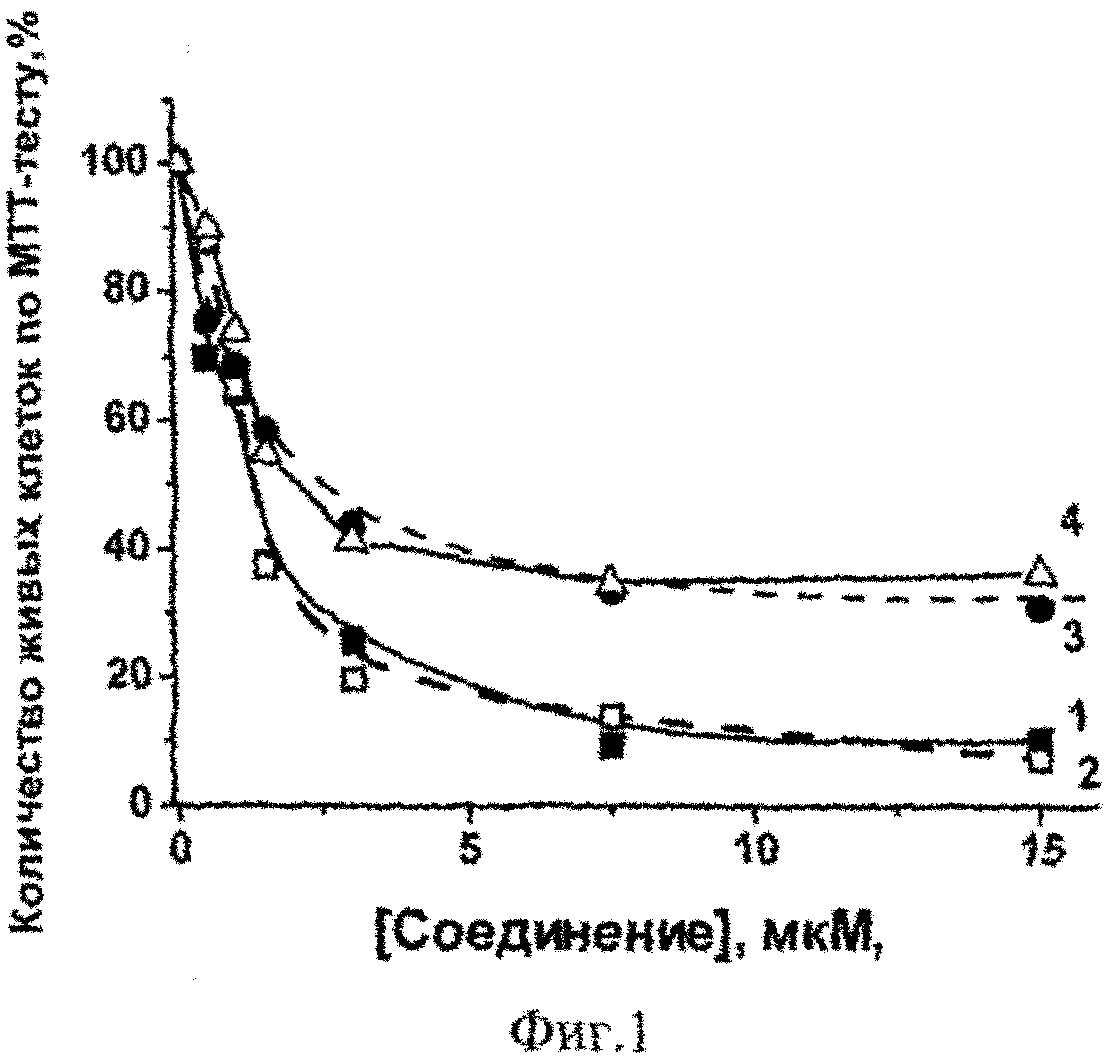
Для оценки относительной активности всех предлагаемых соединений в подавлении роста раковых клеток были исследованы зависимости количества живых клеток от концентрации этих соединений. В качестве примера на фиг.1 приведены данные для четырех исследованных соединений. Определение концентрации соединений (C50), при которой происходит подавление (ингибирование) роста клеток на половину (50%), проводили с помощью МТТ-теста. Количество живых клеток в контроле (инкубация клеток без соединений) принимали за 100%.
С помощью таких кривых определяли концентрацию соединения (С50), при которой происходит подавление (ингибирование) роста клеток наполовину. Данные по влиянию заявляемых соединений (ингибирование на 50%, С50) на рост раковых клеток миеломы человека (RPMI 6228) и аденокарциномы человека (MCF-7), а также контрольных клеток мышиных фибробластов линии LMTK после инкубации в течение 48 ч приведены в таблице 2.
Из таблицы 2 видно, что предлагаемые соединения подавляют рост раковых клеток миеломы (RPMI 6228) и аденокарциномы человека (MCF-7) в культуре при концентрациях 1,2-5,1 мкМ.
Фторированные производные 1,4-нафтохинона являются ингибиторами Cdc25A и Cd25B фосфатаз, которые играют важную роль в регуляции пролиферации клеток и гиперэкспрессированы в различных раковых клетках человека. Поскольку модификация киназ должна вести к гибели клеток, фторированные производные 1,4-нафтохинона проявляют цитотоксичность (как и другие известные антираковые препараты) как по отношению к раковым, так и по отношению к нормальным соматическим клеткам млекопитающих. Однако фторированные 1,4-нафтохиноны в большей степени ингибируют именно раковые клетки, а не обычные клетки млекопитающих.
Из табл.2 также видно, что подавление роста раковых клеток на 50% с помощью соединений 1-4 происходит при концентрациях в 1,3-5,3 раз более низких, чем клеток нормальных фибробластов. Большая часть описанных ранее фторированных производных нафтохинона (Патенты RU 2387635 С1, 27.04.2010 и RU 2443678 С1, 27.02.2012) проявляют сильное ингибирование роста раковых клеток (за исключением нескольких соединений) при относительно высоких концентрациях (6-60 мкМ), проявляя небольшое различие в ингибировании роста различного типа раковых и обычных клеток. Как видно из табл.2, четыре новых полифторированных производных нафтохинона ингибируют рост RPMI 6228 и MCF-7 раковых клеток при существенно более низких и сопоставимых концентрациях. Это может указывать в пользу более выраженной универсальности алкилирующих фторированных нафтохинонов по отношению к раковым клеткам различных типов. Кроме того, соединения 1-4 могут необратимо алкилировать Cdc25A и Cd25B фосфатазы и лишать их ферментативной активности за счет химической модификации этих ферментов.
Таким образом, предлагаемые новые алкилирующие фторированные производные 1,4-нафтохинона являются более эффективными ингибиторами роста раковых клеток, чем описанные ранее соединения, и являются потенциально перспективными для их использования в антираковой терапии.
Алкилирующие фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре
|