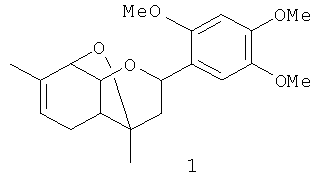
Результат интеллектуальной деятельности: 4,7-ДИМЕТИЛ-2-(2,4,5-ТРИМЕТОКСИФЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2H-4,8-ЭПОКСИХРОМЕН, ОБЛАДАЮЩИЙ АНАЛЬГЕЗИРУЮЩЕЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области фармацевтики, конкретно к новому 4,7-диметил-2-(2,4,5-триметоксифенил)-3,4,4а,5,8,8а-гексагидро-2H-4,8-эпоксихромену общей формулы 1 (включая его пространственные изомеры, в том числе оптически активные формы):
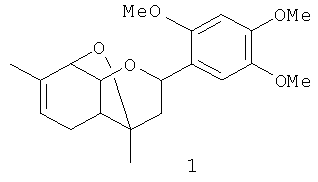
обладающему анальгезирующей активностью.
Известны анальгезирующие средства, являющиеся по фармакологическому действию ненаркотическими анальгетиками, такие как ацетилсалициловая кислота, анальгин и другие [Машковский М.Д. Лекарственные средства. Т.1. М.: Медицина. 2007]. Данные по активности на модели «уксусные корчи» (ЕД50), острой токсичности (ЛД50) и индексу селективности (SI=ЛД50/ЭД50) ряда известных лекарственных средств приведены в [Сюбаев Р.Д., Машковский М.Д., Шварц Г.Я., Покрышкин В.И. Сравнительная фармакологическая активность современных нестероидных противовоспалительных препаратов. Хим.-фарм. журн. 1986. Т.20. №1. С.33-39] и отражены в таблице 1.
|
Недостатками ацетилсалициловой кислоты являются низкое селективное обезболивающее действие и гастротоксичность; анальгина - возможное угнетение кроветворения, вплоть до полного агранулоцитоза.
Наиболее близким аналогом по фармакологическому действию к заявляемому средству, является диклофенак натрия [Справочник Видаль. Лекарственные препараты в России: Справочник. М: АстраФармСервис. 2002. 3-90.].
Недостатками диклофенака натрия являются желудочно-кишечные расстройства и гастротоксичность.
Задача, на решение которой направлено изобретение, заключается в создании нового соединения, обладающего анальгезирующей активностью.
Поставленная задача решается 4,7-диметил-2-(2,4,5-триметоксифенил)-3,4,4a,5,8,8a-гексагидро-2H-4,8-эпоксихроменом общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы:

Соединение 1 не было ранее описано в литературе, оно может быть синтезировано в соответствии со схемой 1 взаимодействием 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 3 с 2,4,5-триметоксибензальдегидом 2 в присутствии кислотного катализатора, например монтмориллонитовой глины, с использованием растворителя, предпочтительно хлористого метилена, или в отсутствие растворителя. В качестве еще одного межмолекулярного продукта в этой реакции образуется соединение 4.
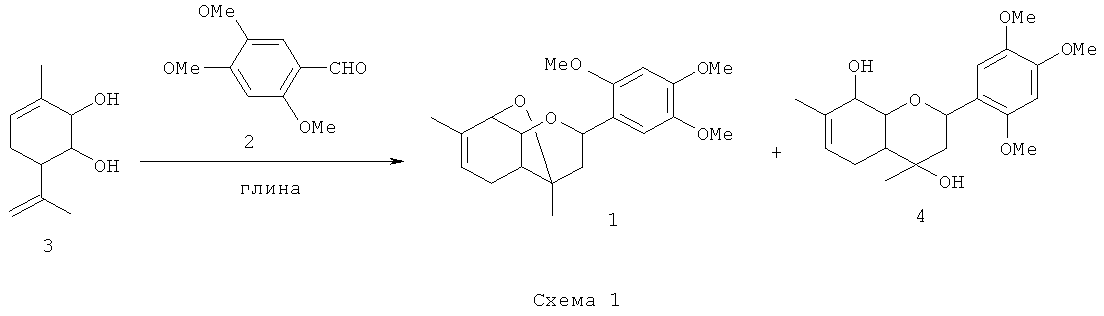
Для получения соединения 1 в виде различных стереоизомеров, в том числе и в оптически активном виде, можно использовать в качестве исходных веществ различные пространственные изомеры соединения 3, в том числе и обладающие оптической активностью.
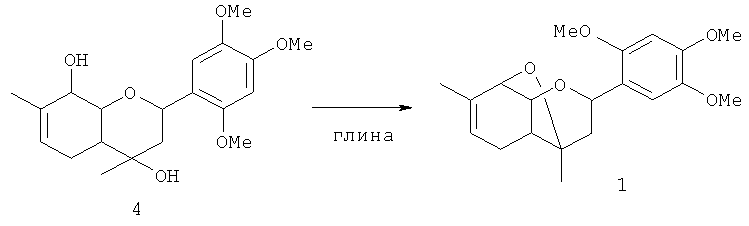
Соединение 4 также может быть превращено в соединение 1 выдерживанием соединения 4 в присутствие кислотного катализатора, например монтмориллонитовой глины, предпочтительно в присутствии альдегида 2.
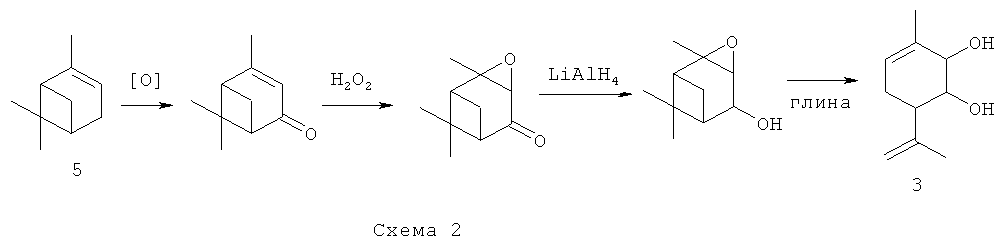
Соединение 3, в том числе и в оптически активном виде, может быть синтезировано в соответствии со схемой 2 исходя из монотерпена α-пинена 5, широко распространенного в отечественном растительном сырье, с использованием доступных реагентов по ранее описанным методикам [Ardashov O.V., Pavlova A.V., Il'ina I.V., Morozova E.A., Korchagina D.V., Karpova E.V., Volcho K.P., Tolstikova T.G., Salakhutdinov N.F. Highly potent activity of (1R,2R,6S)-3-methyl-6-(prop-1-en-2-yl)cyclohex-3-ene-1,2-diol in animal models of Parkinson's disease. J. Med. Chem. 2011, 54, 3866-3874].
Острая токсичность соединения 1 определялась на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера. Показано, что соединение 1 является низкотоксичным веществом, его ЛД50 превышает 1500 мг/кг.
Анальгетическая активность соединения 1 изучалась на моделях висцеральной боли «уксусные корчи» и термического раздражения «горячая пластинка» путем однократного введения в дозах 10, 20 и 30 мг/кг.
«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
«Горячая пластинка» - тест, характеризующий термическое раздражение. Животных помещали на медную пластину, T=54°C. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации» в секундах.
Из данных таблицы 2 видно, что соединение 1 проявляет высокую анальгетическую активность на обеих моделях. Соединение 1 блокирует развитие болевого эффекта, вызванного введением уксусной кислоты, и увеличивает время до первой «вокализации» в тесте «горячая пластинка» по сравнению с контролем.
|
Установлено, что ЭД50 соединения 1 в тесте «горячая пластинка» составляет 25 мг/кг, а в тесте «уксусные корчи» - 22 мг/кг. Учитывая, что ЛД50 соединения 1 превышает 1500 мг/кг, индекс селективности SI соединения 1 превышает 60 в тесте «горячая пластинка» и 68 - в тесте «уксусные корчи».
Исходя из вышесказанного можно заключить, что соединение 1 сочетает высокую анальгетическую активность с низкой токсичностью и может после проведения соответствующих испытаний использоваться как в чистом виде, так и в качестве компонента низкотоксичных высокоэффективных анальгезирующих лекарственных форм.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез (2S,4R,4aR,8S,8aR)-4,7-диметил-2-(2,4,5-триметоксифенил)-3,4,4а,5,8,8а-гексагидро-2H-4,8-эпоксихромена 1 по схеме 1.
К суспензии 3 г глины в 10 мл CH2Cl2 прибавили 0.8 г 2,4,5-триметоксибензальдегида 2, затем раствор 0.7 г (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 3 в 20 мл CH2Cl2. Реакционную смесь выдержали в течение 10 мин, растворитель отогнали, выдержали 7 суток при комнатной температуре. Добавили 20 мл этилацетата, катализатор отфильтровали, растворитель отогнали. Остаток делили на колонке с 12 г силикагеля, элюент - градиент этилацетата в гексане, содержащий от 0 до 100% этилацетата. Получили 0.217 г (15%) соединения 1 и 0.616 г (40%) (2S,4S,4aR,8aR)-2-(2,4,5-триметоксифенил)-4,7-диметил-3,4,4а,5,8,8а-гексагидро-2Н-хромен-4,8-диола 4.
Соединение 1. Спектр ЯМР 1H (CDCl3): 1.36 (с, Ме(17)); 1.52 (дд, J(4a,4e)=13.1 Гц, J(4a,3a)=10.6 Гц, Ha-C(4)); 1.75 (м, все J≤2.5 Гц, Me(18)); 1.91 (дд, J(4е,4a)=13.1 Гц; J(4e,3a)=4.2 Гц, He-C(4)); 2.08 (ш.д, J(6,7)=5.6 Гц; H-C(6)); 2.37 (д.д.д.к, J(7,7′)=18.6 Гц, J(7,6)=5.6 Гц, J(7,8)=3.0 Гц, J(7,18)=2.2 Гц, H-C(7)); 2.53 (дм, J(7,7′)=18.6 Гц, H′-C(7)); 3.77 (c, ОМе(19)); 3.84 (c, ОМе(21)); 3.85 (с, OMe(20)); 4.25 (ш.с, H-C(10)); 4.44 (д, J(1,6)=1.2 Гц, H-C(1)); 5.13-5.17 (м, H-C(8)); 5.42 (дд, J(3a,4а)=10.6 Гц; J(3a,4e)=4.2 Гц, Ha-C(3)); 6.47 (c, H-C(13)); 7.01 (c, H-C(16)). Спектр ЯМР 13С (CDCl3): 81.07 (д, C(1)); 68.21 (д, C(3)); 45.69 (т, C(4)); 83.33 (c, C(5)); 45.66 (д, C(6)); 28.20 (т, C(7)); 120.66 (д, C(8)); 139.86 (c, C(9)); 80.21 (д, C(10)); 122.15 (c, C(11)); 150.31 (c, C(12)); 97.44 (д, C(13)); 148.54 (c, C(14)); 143.20 (c, C(15)); 110.67 (д, C(16)); 21.48 (к, C(17)); 20.91 (к, C(18)); 56.27 (к, C(19)); 56.07 (к, C(20)); 56.51 (к, C(21)). HR-MS: 346.1774 (M+, C20H26O5, расчетное значение 346.1774).
Соединение 4. Спектр ЯМР 1H (CDCl3): 1.52 (с, Me(17)); 1.68 (ддд, J(4е,4a)=13.2 Гц, J(4e,3a)=2.7 Гц, J(4e,6)=1.1 Гц, He-C(4)); 1.77-1.85 (м, H-C(6), Ha-C(4)); 1.81 (м, все J≤2.5 Гц, Me(18)); 2.15-2.20 (м, 2Н-C(7)); 3.78 c, 3.79 c, 3.84 c, (3 OCH3); 3.81 (дд, J(1e,6)=2.4 Гц, J(1e,10е)=2.0 Гц, He-C(1)); 3.90 (ш.с, He-C(10)); 4.76 (дд, J(3a,4а)=11.4 Гц, J(3a,4e)=2.7 Гц, Ha-С(3)); 5.63-5.67 (м, H-C(8)); 6.46 (c, H-C(13)); 6.88 (c, H-C(16)). Спектр ЯМР 13C (CDCl3): 77.72 (д, C(1)); 71.58 (д, C(3)); 41.87 (т, C(4)); 71.16 (с, C(5)); 38.50 (д, C(6)); 22.71 (т, C(7)); 124.58 (д, C(8)); 131.43 (с, C(9)); 70.61 (д, C(10)); 122.09 (с, C(11)); 150.24 (с, C(12)); 97.67 (д, C(13)); 149.03 (с, C(14)); 143.31 (с, C(15)); 111.10 (д, C(16)); 27.00 (к, C(17)); 20.67 (к, C(18)); 56.49 (к, C(19)); 56.07 (к, C(20)); 56.77 (к, C(21)).
Пример 2. Получение соединения 1 циклизацией соединения 4.
К суспензии 0.8 г глины в 15 мл CH2Cl2 прибавили 0.2 г альдегида 2, затем раствор 0.2 г соединения 4 в 15 мл CH2Cl2, растворитель отогнали, реакционную смесь выдержали в течение 3 дней при комнатной температуре. Добавили 20 мл этилацетата, катализатор отфильтровали, получили смесь, соотношение соединений 4 и 1 составило 4:1 (данные ГЖХ-МС).
Пример 3. Исследование анальгетической активности соединения 1 в тесте «уксусные корчи».
Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Исследуемые агенты вводили однократно внутрижелудочно в дозах 10, 20 и 30 мг/кг за час до воспроизведения модели. Контролем являлись животные с введением только уксусной кислоты. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Результаты приведены в таблице 2.
Установлено, что соединение 1 проявляет высокую анальгетическую активность на модели «уксусные корчи», блокируя развитие болевого эффекта, вызванного введением уксусной кислоты. ЭД50 соединения 1 в тесте «уксусные корчи» составляет 22 мг/кг.
Пример 4. Исследование анальгетической активности соединений общей формулы 1 в тесте «горячая пластинка».
Опыты проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. Животных помещали на медную пластину T=54°C. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации», в секундах.
Исследуемые агенты вводились однократно внутрижелудочно в дозах 10, 20 и 30 мг/кг за час до воспроизведения модели. Контрольным животным вводили соответствующий растворитель. Результаты приведены в таблице 2.
В тесте «горячая пластинка» соединение 1 проявило высокий анальгетический эффект, его ЭД50 составляет 25 мг/кг.
4,7-Диметил-2-(2,4,5-триметоксифенил)-3,4,4а,5,8,8а-гексагидро-2Н-4,8-эпоксихромен общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы: обладающий анальгезирующей активностью.