Результат интеллектуальной деятельности: Способ оценки антимикобактериального действия противотуберкулезных препаратов с использованием биологического материала пациентов, больных туберкулезом легких
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности, фтизиатрии, и может быть использовано при оценке антимикобактериального действия различных концентраций как известных, так и новых противотуберкулезных препаратов на антимикобактериальную активность с использованием биологического материала пациентов, подвергшихся оперативному вмешательству в результате неэффективно проведенной противотуберкулезной терапии и развития туберкулеза легких, в том числе с множественной и широкой лекарственной устойчивостью.
Туберкулез на протяжении столетий был и остается одним из наиболее опасных заболеваний человека (1). Несмотря на огромный прогресс в его профилактике и лечении, примерно треть населения Земли инфицирована микобактериями туберкулеза (M. tuberculosis) - этиологическим агентом заболевания, а смертность от туберкулеза достигает более 1.5 млн. человек в год, из которых 80% случаев приходится на легочный туберкулез (1-2). Во второй половине ХХ-го века были созданы наиболее эффективные противотуберкулезные препараты (ПТП), до сих пор входящие в общепринятые схемы лечения туберкулеза, одобренные Всемирной организацией здравоохранения (ВОЗ). Однако в настоящее время терапия туберкулеза осложняется возникновением лекарственно-устойчивых штаммов М. tuberculosis и их распространением во многих странах мира, в том числе и в Российской Федерации (3). На штаммы М. tuberculosis, характеризующиеся множественной и широкой лекарственной устойчивостью (МЛУ и ШЛУ, соответственно), стандартные схемы химиотерапии практически не действуют. У штаммов М. tuberculosis с МЛУ имеется устойчивость, по меньшей мере, к изониазиду и рифампицину одновременно, независимо от резистентности к другим ПТП. При ШЛУ у штаммов М. tuberculosis имеется устойчивость, помимо изониазида и рифампицина, еще к фторхинолонам и к одному из трех инъекционных препаратов (капреомицину или канамицину или амикацину). Заболевание, вызванное лекарственно-устойчивыми штаммами М. tuberculosis, имеет, как правило, остро прогрессирующий характер, что приводит к необходимости оперативного вмешательства в организм пациентов и хирургическому удалению тканей, сегментов, долей, а то и целых легких, пораженных туберкулезом (4). Для послеоперационного периода с целью сокращения риска рецидива заболевания существует острая потребность в корректировке схем лечения пациентов с использованием как известных, так и новых лекарственных препаратов, которые были бы активны в отношении именно тех штаммов микобактерий, которые инфицируют организм и клетки легких прооперированных пациентов. Также необходимо подобрать такие дозы ПТП, которые при эффективном антимикобактериальном действии обладали бы пониженной токсичностью с целью минимизировать развитие как некротической, так и воспалительной реакций в организме пациентов в послеоперационный период лечения.
Развитие лекарственной устойчивости М. tuberculosis изначально связано с их селекцией в присутствие ПТП и с преимущественным выживанием части микробной популяции, имеющей механизмы защиты против антибактериального агента, которые, как правило, обусловлены или появлением новой генетической информации (мутаций) или изменениями в экспрессии генов микобактерий (4-5).
Известны многочисленные способы выявления мутаций в ДНК микобактерий, связанных с устойчивостью к определенным ПТП, например, точечных мутаций в гене rpoB, ответственном за устойчивость к рифампицину, и в гене katG, ответственном за устойчивость к изониазиду.
Например, известен способ обнаружения ДНК микобактерий туберкулезного комплекса с одновременным установлением генотипа возбудителя и определением генетических детерминант устойчивости к широкому спектру противотуберкулезных препаратов, включая рифампицин, изониазид, фторхинолоны, канамицин, капреомицин, амикацин, этамбутол, в клиническом образце на дифференцирующем олигонуклеотидном микрочипе. Метод основан на мультиплексной ПЦР (МПЦР) с одновременным флуоресцентным маркированием ПЦР-продуктов и последующей гибридизацией полученных продуктов на олигонуклеотидном микрочипе, содержащем набор специфичных дискриминирующих олигонуклеотидов. Изобретение позволяет сделать заключение об антимикобактериальном действии указанных ПТП с учетом обнаруженных мутаций в ДНК микобактерий конкретного пациента, ответственных за устойчивость к ПТП (6).
Известен также способ определения устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда - фторхинолонам, аминогликозидам и капреомицину, включающий одновременную детекцию мутаций в ДНК микобактерий туберкулеза биологического образца, приводящих к устойчивости микроорганизмов к противотуберкулезным препаратам второго ряда в участках гена gyrA (кодоны 89, 90, 91, 94), гена gyrB (кодоны 538, 539, 540), гена rrs (позиции 1401, 514, 517) и промоторной области гена eis (позиции -10, -12, -37), посредством МПЦР в режиме реального времени с использованием праймеров для амплификации и зондов детекции, комплементарных указанным участкам генов. Способ обеспечивает одновременное и быстрое определение вышеперечисленных мутаций в ДНК микобактерий, что позволяет сделать заключение об антимикобактериальном действии ПТП второго ряда с учетом полученных результатов тестирования ДНК микобактерий, выделенных из биологического материала пациента (7).
Общим недостатком способов, основанных на ПЦР, является то, что при высокой разрешающей способности они могут приводить к ложноположительным результатам, что ограничивает достоверность исследования. Кроме того, известно, что все известные молекулярные механизмы формирования устойчивости микобактерий к ПТП, обеспечивают разную степень устойчивости и резистентности к разным концентрациям ПТП, поэтому, появление у микобактерий мутаций устойчивости не всегда сопровождается снижением клинической эффективности антимикобактериальных средств (4). Также хорошо известно, что из материала пациентов, больных туберкулезом, могут выделяться неоднородные по лекарственной устойчивости штаммы микобактерий туберкулеза (4, 8). В результате, широко применяемые в настоящее время молекулярно-генетические методы анализа М. tuberculosis не позволяют выявить ту часть популяции микобакетрий в биологическом материале, которая не имеет мутаций и может быть элиминирована при использовании традиционных ПТП. Следовательно, культуральные способы персонифицированного определения спектра и дозы ПТП с антимикобактериальной активностью по-прежнему имеют важное клиническое значение.
Известен способ определения антимикобактериального действия ПТП, получивший название метода абсолютных концентраций, включающий забор мокроты у пациента, больного туберкулезом, посев мокроты на питательную среду Левенштейна-Йенсена, культивирование в течение 1.5-2.5 мес. для получения чистой культуры микобактерий туберкулеза, пересев ее на питательную среду, содержащую ПТП в критической концентрации и культивирование от 2 до 4 недель, подсчет числа колоний микобактерий; при появлении более 20 колоний делают заключение о неэффективности ПТП. Критические концентрации противотуберкулезных препаратов на среде Левенштейна-Йенсена составляют для: изониазида - 1 мкг/мл; рифампицина - 40 мкг/мл; пиразинамида - 200 мкг/мл; этамбутола - 2 мкг/мл; стрептомицина - 10 мкг/мл; канамицина - 30 мкг/мл; капреомицина - 30 мкг/мл; протионамида (этионамида) - 30 мкг/мл; циклосерина - 30 мкг/мл; ПАСК - 1 мкг/мл; офлоксацина - 2 мкг/мл (8). Недостатком известного способа является его длительность: результаты определения антимикобактериальной активности ПТП могут быть получены не ранее чем через 2-2.5 месяца после начала работы с биологическим материалом от пациента. Другим недостатком является его недостаточная диагностическая значимость, обусловленная тем, что свойства микобактерий пациента при длительном культивировании и пересеве изменяются. Кроме того, использование мокроты пациента в качестве биологического материала не позволяет оценить действие ПТП по отношению к микобактериям, находящимся в альвеолярных макрофагах и являющихся источником дальнейшего развития туберкулеза.
Известен способ диагностики чувствительности М. tuberculosis к ПТП, включающий забор мокроты от пациента, больного туберкулезом легких, ее обработка раствором трехзамещенного фосфата натрия (Na3PO4) в течение 18-20 часов при температуре +37°C, получение микобактерий из раствора путем осаждения с помощью центрифугирования, культивирование микобактерий в опытных пробирках с питательной средой Левенштейна-Йенсена, дополнительно содержащей нитрат натрия или калия и ПТП, и в контрольных пробирках с той же средой без ПТП в течение 10-21 дня, внесение в опытные и контрольные пробирки реактива Грисса в качестве индикатора роста микобактерий туберкулеза; при изменении окраски в контрольной и опытной пробирках делают заключение об устойчивости микобактерий туберкулеза к ПТП, при наличии окраски только в контрольной пробирке - о чувствительности микобактерий туберкулеза к ПТП и, следовательно, об антимикобактериальном действии ПТП (9). Недостатком известного способа является его длительность: 11-21 день. Другим недостатком является его недостаточная диагностическая значимость, обусловленная тем, что свойства микобактерий, выделенных из биологического материала пациента, при длительном культивировании и пересеве изменяются и что использование мокроты пациента не позволяет оценить действие ПТП по отношению к микобактериям, находящимся в альвеолярных макрофагах и являющихся источником дальнейшего развития туберкулеза.
Известен способ оценки антимикобактериального действия ПТП, включающий забор биологического материала в виде мокроты или биопсии или резецированной ткани легкого пациента, больного туберкулезом; получение культуры микобактерий, внесение ее в опытные пробирки, содержащие питательную среду, ПТП и флуоресцентный индикатор размножения микобактерий, и в контрольные пробирки, содержащие те же компоненты без ПТП; культивирование микобактерий до 4 недель, определение УФ-свечения культуры микобактерий; при наличии УФ-свечения в контрольных пробирках и его отсутствии в опытных пробирках делают положительное заключение об антимикобактериальном действии ПТП (8). Способ осуществляют с помощью автоматизированной системы ВАСТЕС MGIT 960 (компания «BD Biosciences)), США). С использованием этой системы можно определить антимикобактериальную активность ПТП только 1-го ряда: стрептомицина, изониазида, рифампицина, этамбутола и пиразинамида. Недостатком известного способа является длительность его осуществления, большая стоимость автоматизированной системы и материалов для его осуществления, что значительно мешает широкому применению. Другим недостатком аналога является то, что в организме человека, больного туберкулезом легких, микобактерий туберкулеза находятся либо внутри альвеолярных макрофагов, либо располагаются в воспаленной и некротизированной ткани легкого, то есть в условиях, существенно отличающихся от лабораторных тестов, основанных на выделении и анализе культуры микобактерий. Отличие фармакодинамики и фармакокинетики лекарственных средств в тканях и клетках пациентов с туберкулезом от наблюдаемых при лабораторном тестировании ПТП на культурах микобактерий может приводить к искажению результатов оценки антимикобактериального действия ПТП (10).
Наиболее близким к заявленному является способ определения лекарственной чувствительности микобактерий туберкулеза, включающий забор биологического материала в виде мокроты из легких пациента, получение из него культуры микобактерий, их культивирование в жидкой питательной среде Школьниковой при +37°C в течение 3 суток, смену питательной среды Школьниковой, культивирование микобактерий на опытной среде с противотуберкулезными препаратами и на такой же контрольной среде без указанных препаратов; через 3 недели определяют рост микобактерий туберкулеза на опытной и контрольной средах; при наличии роста микобактерий на контрольной среде и отсутствии роста на опытной среде делают заключение о чувствительности микобактерий туберкулеза к лекарственному препарату и, следовательно, о наличии его антимикобактериального действия (11). Недостатками прототипа является длительность осуществления более трех недель и недостаточная диагностическая значимость, обусловленная теми же причинами, что у предыдущего аналога. Кроме того, способ не предусматривает выявление минимальных доз ПТП, достаточных для достижения антимикобактериального действия, что имеет важное значение для снижения побочного эффекта токсического действия ПТП.
Задачей, на решение которой направлено изобретение, является сокращение срока осуществления способа, повышение его эффективности.
Техническим результатом является сокращение срока осуществления способа до 4 дней от момента получения биологического материала, обеспечение условий для оценки действия противотуберкулезных препаратов на микобакетрии туберкулеза, находящиеся в альвеолярных макрофагах из операционного материла легких пациента, определение противотуберкулезного препарата и его концентрации, достаточной для достижения антимикобактериального действия на микобактерий пациента при отсутствии цитотоксического эффекта на альвеолярные макрофаги.
Решение поставленной задачи достигается тем, что в качестве биологического материала используют образцы ткани легкого из операционного материала; получают из него ex vivo культуру альвеолярных макрофагов; культивируют ее в течение 1 суток в питательной среде, заменяют питательную среду на свежую в контрольной культуре клеток и на такую же среду с добавлением противотуберкулезного препарата в опытных культурах клеток, различающихся концентрациями одного и того же противотуберкулезного препарата, продолжают культивирование в течение трех дней, фиксируют клетки на покровных стеклах; окрашивают по методу Циля-Нильсена; проводят цитологический анализ на наличие признаков цитотоксического воздействия противотуберкулезного препарата на альвеолярные макрофаги; определяют доли альвеолярных макрофагов, содержащих микобактерий туберкулеза, от общего числа альвеолярных макрофагов в контрольной и опытной культурах клеток; при отсутствии признаков цитотоксического воздействия противотуберкулезного препарата на альвеолярные макрофаги в опытной культуре, отсутствии микобактерий в альвеолярных макрофагах или снижении доли альвеолярных макрофагов, содержащих микобактерий туберкулеза, в 2 и более раз в опытной культуре относительно контрольной, делают положительное заключение об антимикобактериальном действии противотуберкулезного препарата и минимальной концентрации, достаточной для достижения антимикобактериального эффекта.
Раскрытие изобретения
Способ оценки антимикобактериального действия противотуберкулезных препаратов включает забор биологического материала в виде образцов ткани легкого из операционного материала пациентов, больных туберкулезом легких, получение из него ex vivo культуры альвеолярных макрофагов; культивирование ее в течение 1 суток в питательной среде, замену питательной среды на свежую в контрольной культуре клеток и на свежую среду с добавлением противотуберкулезного препарата в различных концентрациях в опытных культурах клеток с последующим культивированием в течение трех дней, фиксацию клеток на покровных стеклах; окрашивание по методу Циля-Нильсена; проведение цитологического анализа на наличие признаков цитотоксического воздействия противотуберкулезного препарата на альвеолярные макрофаги; определение доли альвеолярных макрофагов, содержащих микобактерий туберкулеза, от общего числа альвеолярных макрофагов в контрольной и опытной культурах клеток; при отсутствии признаков цитотоксического воздействия противотуберкулезного препарата на альвеолярные макрофаги в опытной культуре, отсутствии микобактерий в альвеолярных макрофагах или снижении доли альвеолярных макрофагов, содержащих микобактерий туберкулеза, в 2 и более раз в опытной культуре относительно контрольной культуры, делают положительное заключение об антимикобактериальном действии противотуберкулезного препарата и его минимальной концентрации, достаточной для достижения антимикобактериального эффекта.
Способ позволяет оценить антимикобактериальное действие известных и новых противотуберкулезных препаратов в различных концентрациях, определить минимальную концентрацию ПТП, достаточную для достижения антимикобактериального действия.
Для известных противотуберкулезных препаратов при реализации способа могут быть использованы, например, установленные ВОЗ критическая и предельная концентрации (4), а также промежуточная между ними концентрация. Для новых препаратов концентрации устанавливаются произвольно для поиска концентраций, обеспечивающих антимикобактериальное действие.
Подсчет макрофагов, содержащих микобактерий, производят под микроскопом.
О цитотоксичности противотуберкулезных препаратов в использованных концентрациях судят по появлению следующих морфологических признаков гибели альвеолярных макрофагов: наличие ядра с признаками конденсации хроматина, отсутствие целостности плазматической мембраны, образование апоптозных телец, разрушение клеток до отдельных участков цитоплазмы, появление клеток без ядер. При наличии хотя бы одного из указанных признаков делают заключение о цитотоксичности ПТП в изученной концентрации.
Для получения ex vivo культуры альвеолярных макрофагов из резецированного материала легкого пациента, больного туберкулезом, может быть использован способ по патенту РФ на изобретение №2593725 (12). Способ включает получение образцов ткани легкого из операционного материала (Фиг. 1 и 2, Таблица 1), измельчение образца ткани легкого, проведение последующей гомогенизации измельченной ткани легкого с получением клеточной взвеси в физиологически приемлемом растворе. После осаждения клеток из клеточной взвеси путем центрифугирования при скорости 800-1200 об/мин в течение 4-5 мин. при комнатной температуре, их высаживают на покровные стекла в полной питательной среде, например, DMEM/F12 с 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина в емкости для культивирования клеток, например, 24-луночные планшеты. Культивирование клеток осуществляют стандартно при температуре +37°C в атмосфере 5% CO2. Жизнеспособность альвеолярных макрофагов, составляющих 90-95% клеточной популяции, в течение указанного периода культивирования составляет 97-100%.
После суток культивирования клеток питательную среду удаляют, клеточный монослой на покровных стеклах промывают двукратно фосфатно-солевым раствором (pH 7.4). Затем к альвеолярным макрофагам в контрольную культуру вносят свежую питательную среду без добавок, а в опытную культуру - питательную среду с противотуберкулезным препаратом в критической, предельной или промежуточной между ними концентрации для известных ПТП 1-го или 2-го ряда или в произвольных концентрациях для нового ПТП с неустановленными критическими и предельными концентрациями для поиска концентраций, необходимых для достижения антимикобактериального действия.
Все процедуры по получению ex vivo культур клеток выполняют с соблюдением норм стерильности в соответствии с санитарными правилами работы с патогенными биологическими объектами (13,14).
Фиксацию клеток на покровных стеклах осуществляют через 3 суток культивирования после замены питательной среды. Для фиксации клеток используют 4%-й раствор формалина, приготовленного на фосфатно-солевом буфере (pH 7.4).
Для окраски клеток покровные стекла отмывают от фиксатора в фосфатно-солевом буферном растворе (pH 7.4) при комнатной температуре. Окраску методом Циля-Нильсена осуществляют согласно (15) для идентификации кислотоустойчивых и, соответственно, жизнеспособных микобактерий М. tuberculosis. Используют набор реагентов для окраски по методу Циля-Нильсена, например, производства ООО «Первая Лабораторная Компания» (г. Санкт-Петербург, Россия). В результате жизнеспособные микобактерий в альвеолярных макрофагах человека с туберкулезной инфекцией окрашиваются в красный цвет, ядра макрофагов-носителей возбудителя инфекции - в синий цвет, а их цитоплазма - в светло-голубой цвет (черно-белый вариант изображения с соответствующими обозначениями представлен на Фиг. 3-6). Для осуществления способа достаточно 4 дней.
Повышение эффективности способа достигается тем, что он позволяет через 4 дня получить персонифицированную оценку эффективности антимикобактериального действия как известных противотуберкулезных препаратов, так и новых испытуемых на антимикобактериальную активность веществ у пациентов, подвергшихся оперативному вмешательству в результате предшествующей неэффективно проведенной противотуберкулезной терапии и развития туберкулеза легких, в том числе с множественной и широкой лекарственной устойчивостью. Важное значение имеет использование ex vivo культур альвеолярных макрофагов из операционного материала пациентов вместо культур микобактерий, выделенных из биологического материала. Способ позволяет подобрать минимальную концентрацию ПТП, достаточную для достижения антимикобактериального эффекта и не вызывающую цитотоксического воздействия на альвеолярные макрофаги.
Заключения, полученные по заявленному способу, имеют большое значение для индивидуальных пациентов в послеоперационный период для корректировки схем лечения с целью повышения его эффективности (10, 16, 17), а также могут быть использованы для выявления перспективных в плане антимикобактериальной активности веществ для последующей их разработки в качестве противотуберкулезных препаратов (18, 19).
Результаты осуществления способа с использованием операционного материала пациентов, больных туберкулезом легких, представлены в таблицах 1-5.
Перечень фигур, чертежей и иных материалов
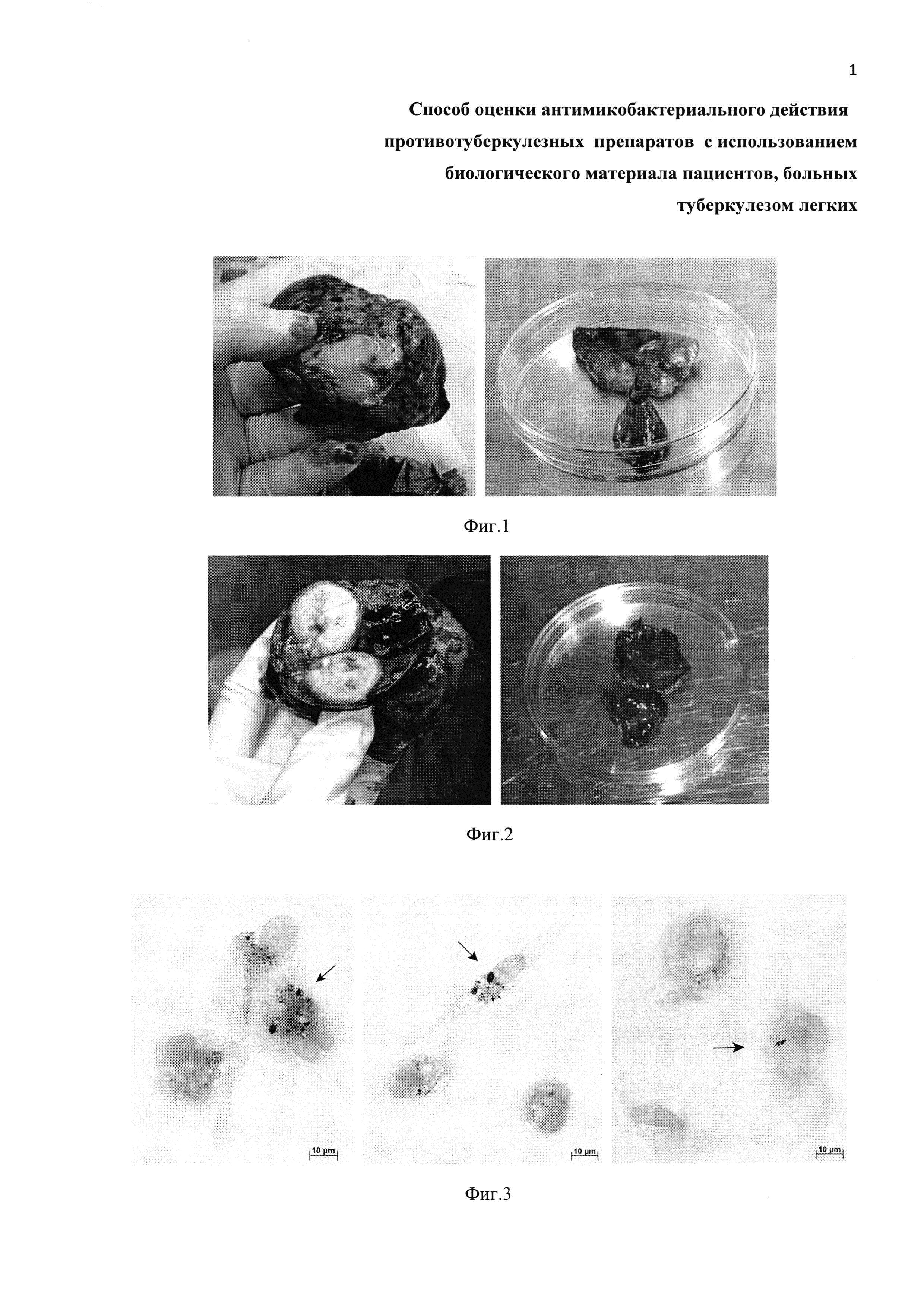
Фиг. 1. Вырезание кусочка ткани (правая панель) из удаленного в ходе операции сегмента левого легкого пациента Б. (левая панель) для последующего получения ex vivo культур альвеолярных макрофагов.
Фиг. 2. Вырезание кусочка ткани (правая панель) из удаленной в ходе операции доли левого легкого пациента В. (левая панель) для последующего получения ex vivo культур альвеолярных макрофагов.
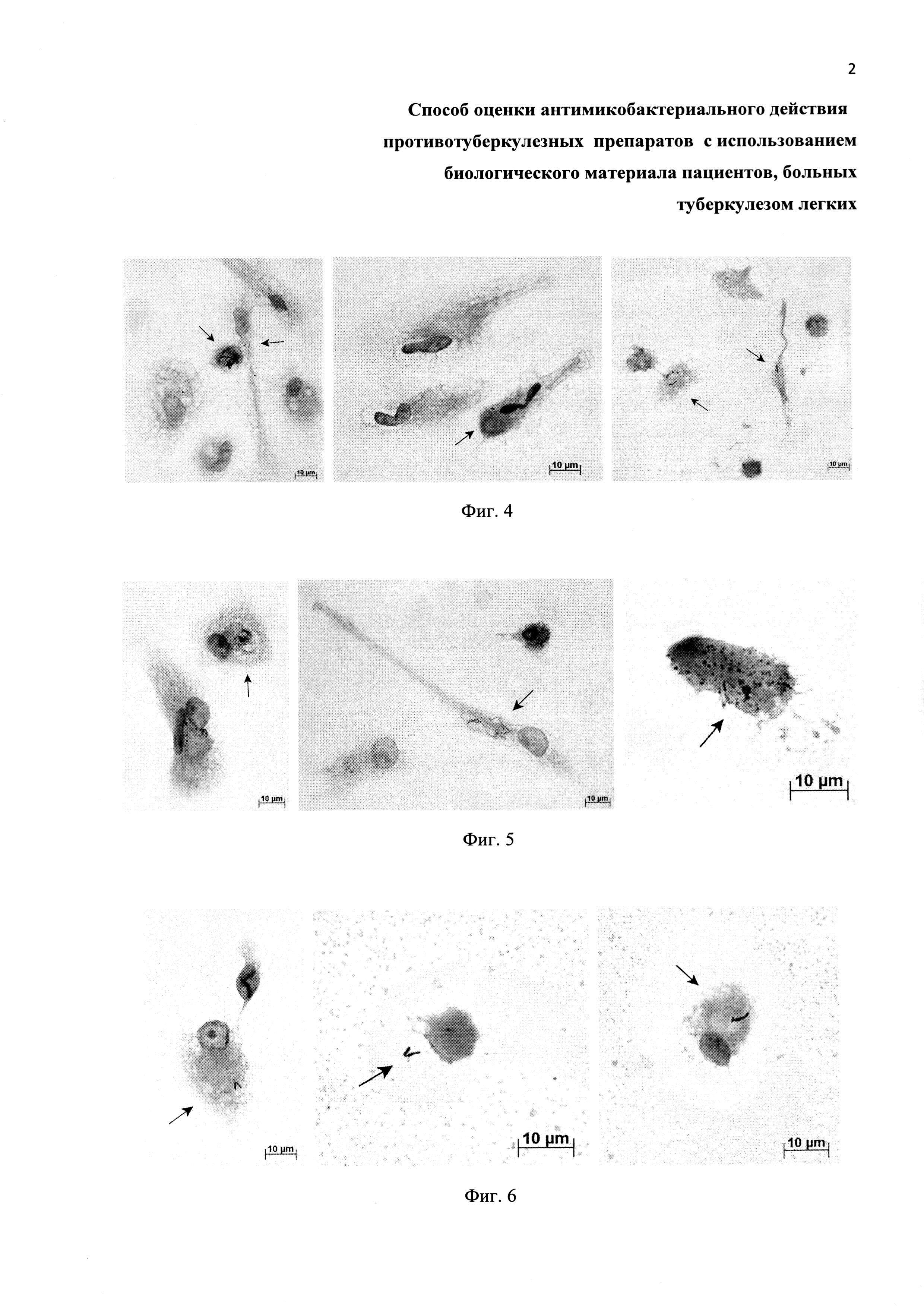
Фиг. 3. Примеры культур клеток, полученных из операционного материала легкого пациента Б. и ex vivo культивируемых в течение 3 дней на питательной среде с 10 мкг/мл изониазида (левая панель), 40 мкг/мл рифампицина (центральная панель) или 50 мкг/мл канамицина (правая панель). Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 4. Примеры культур клеток, полученных из операционного материала легкого пациента В. и ex vivo культивируемых в течение 3 дней на питательной среде с 0.7 мкг/мл изониазида (левая панель) или испытуемыми на антимикобактериальную активность препаратами наночастиц серебра Ag(0) размером 2 нм (центральная панель) и 15 нм (правая панель). Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки -альвеолярные макрофаги, не содержащие микобактерий.
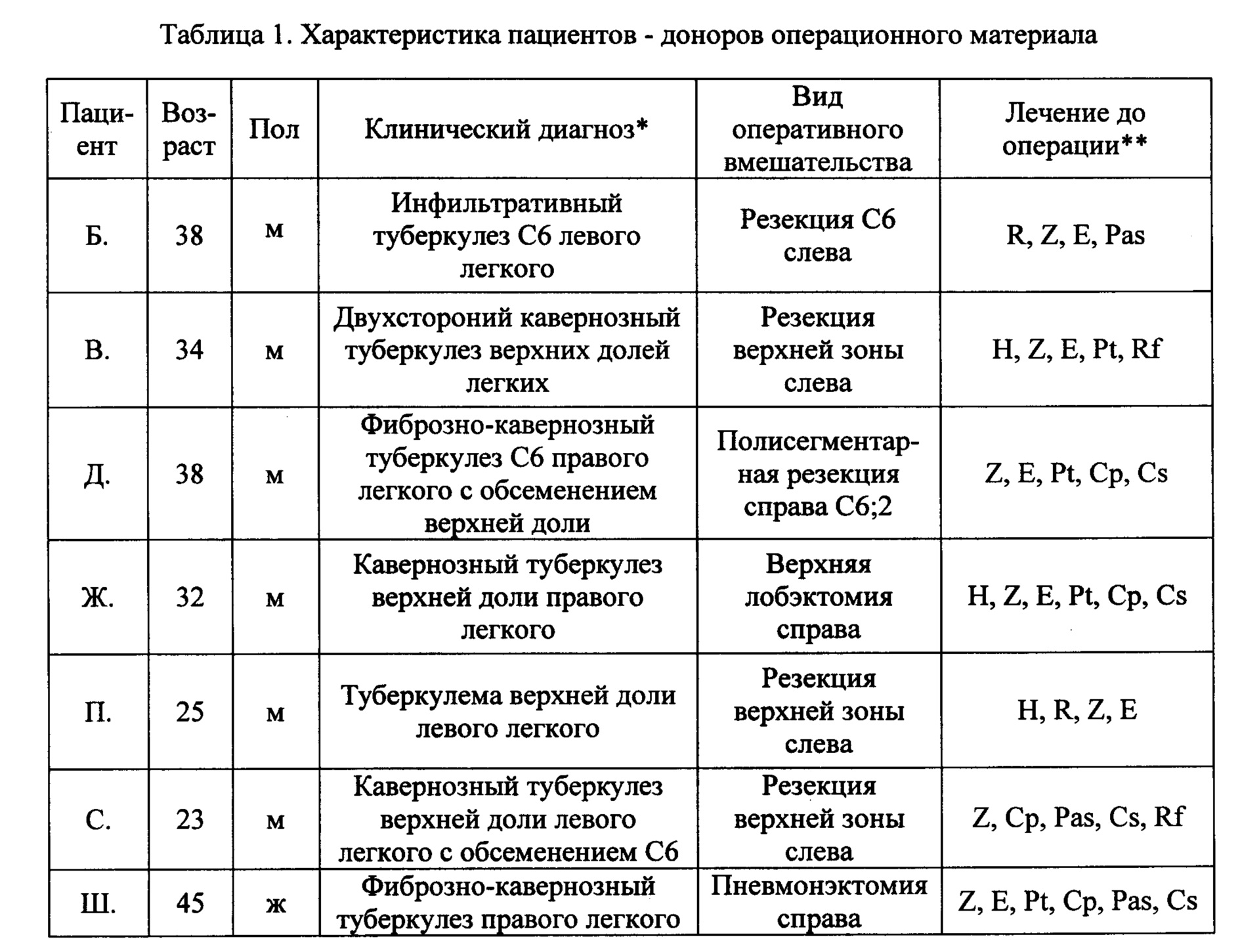
Фиг. 5. Примеры культур клеток, полученных из операционного материала легкого пациента Ж. и ex vivo культивируемых в течение 3 дней на питательной среде с 0.7 мкг/мл изониазида (левая панель) или испытуемыми на антимикобактериальную активность препаратами наночастиц серебра Ag(0) размером 2 нм (центральная панель) и 36 нм (правая панель). Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 6. Примеры культур клеток, полученных из операционного материала легкого пациента С.и ex vivo культивируемых в течение 3 дней на питательной среде с 0.7 мкг/мл изониазида (левая панель) или испытуемыми на антимикобактериальную активность препаратами наночастиц серебра Ag(0) размером 36 нм (центральная панель) и S1 (правая панель). Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Таблица 1. Характеристика пациентов - доноров операционного материала.
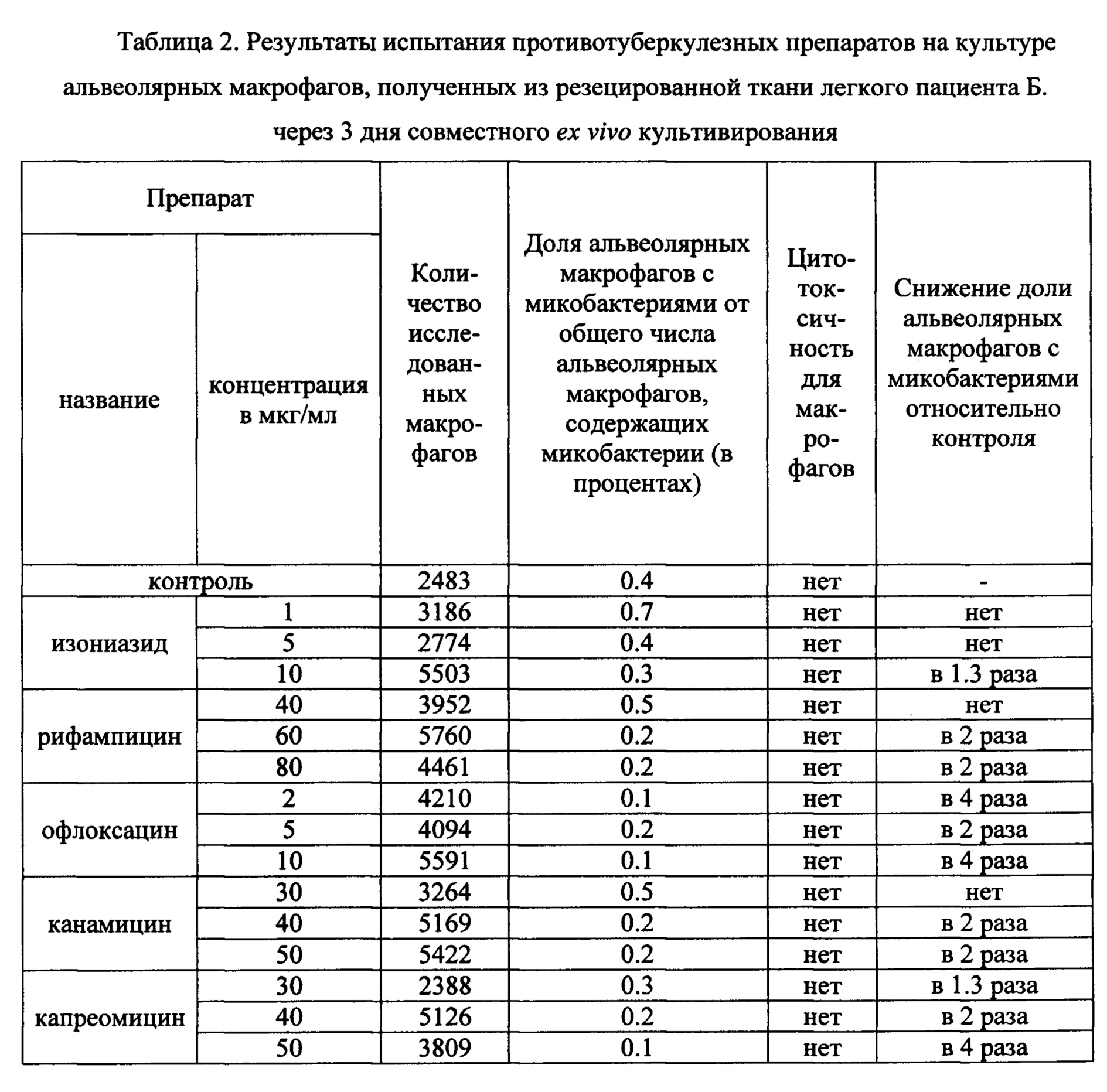
Таблица 2. Результаты испытания противотуберкулезных препаратов на культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациента Б. через 3 дня совместного ex vivo культивирования.
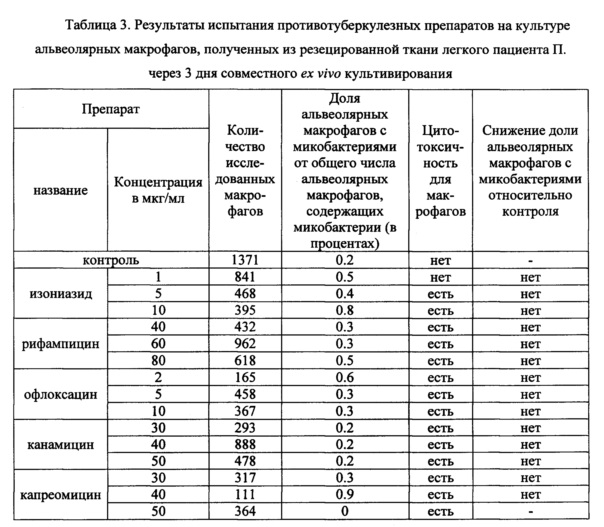
Таблица 3. Результаты испытания противотуберкулезных препаратов на культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациента П. через 3 дня совместного ex vivo культивирования.
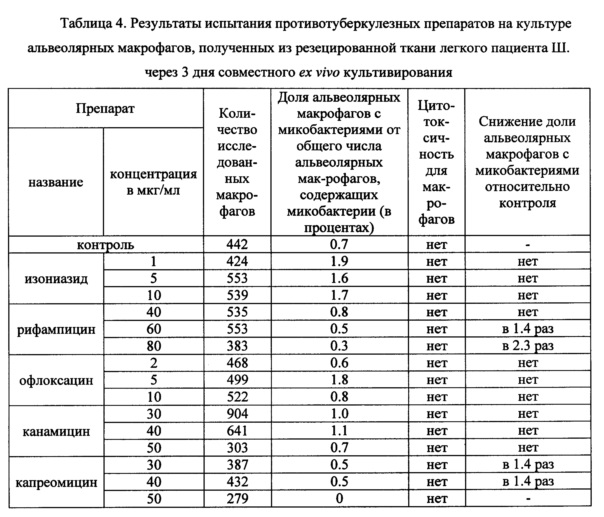
Таблица 4. Результаты испытания противотуберкулезных препаратов на культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациента Ш. через 3 дня совместного ex vivo культивирования.
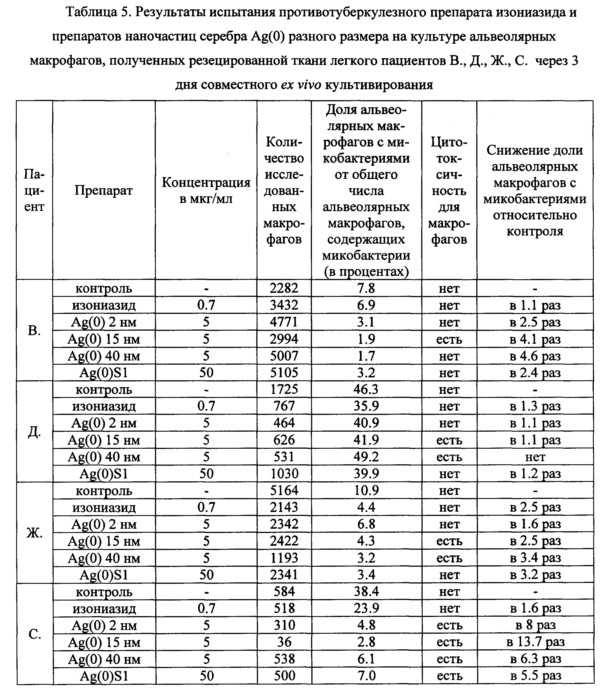
Таблица 5. Результаты испытания противотуберкулезного препарата изониазида и препаратов наночастиц серебра Ag(0) разного размера на культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациентов В., Д., Ж., С.через 3 дня совместного ex vivo культивирования.
Осуществление изобретения
Результаты осуществления заявленного способа представлены в таблицах 1-5.
Для осуществления способа использовали известные противотуберкулезные препараты изониазид, рифампицин, офлоксацин, канамицин, капреомицин в критической, предельной и промежуточной между ними концентрациях (таблицы 2-4). Проведено также испытание на антимикобактериальную активность новых препаратов, содержащих наночастицы серебра Ag(0) размером 2, 15, 40 нм, предоставленных к.б.н. И.Д. Ивановым (НИИ молекулярной биологии и биофизики, г. Новосибирск, Россия), описание которых дано в (20), а также препаратом наночастиц серебра с арабиногалактанами Ag(0)S1, предоставленного д.х.н. Б.Г. Суховым (Иркутский институт химии им. А.Е. Фаворского СО РАН, г. Иркутск, Россия), описание которого дано в (21). Для испытания новых препаратов использовали концентрации 5 и 50 мкг/мл (таблица 5).
В таблице 1 представлены данные о возрасте и поле 7 пациентов, их клиническом диагнозе, виде оперативного вмешательства и перечне противотуберкулезных препаратов, использованных для лечения пациентов до операции.
В таблицах 2-4 представлены данные о результатах оценки антимикобактериального действия указанных выше известных противотуберкулезных препаратов по заявленному способу с применением биологического материала пациентов Б., П. и Ш., соответственно. Заключение по заявленному способу относительно антимикобактериального действия противотуберкулезных препаратов сопоставляли с результатами описанного выше анализа в автоматизированной системе ВАСТЕС (8) и с результатами определения мутаций в ДНК микобактерий, связанных с их устойчивостью к действию ПТП, с использованием набора «ТБ-тест» (ООО «Биочип-ИМБ», г. Москва, Россия) (22).
Пример 1. Пациент Б. (38 лет) с инфильтративным туберкулезом сегмента 6 левого легкого (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме рифампицина, пиразинамида, этамбутола, пара-амино-салициловой кислоты. По окончании курса лечения был поставлен диагноз -туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства был удален сегмент C6 левого легкого (Фиг. 1).
Оценку антимикобактериального действия противотуберкулезных препаратов изониазида, рифампицина, офлоксацина, канамицина и капреомицина согласно заявленному способу проводили в трех концентрациях - критической, предельной и промежуточной между ними. Результаты анализа представлены в таблице 2. Примеры культур клеток, полученных из операционного материала легкого пациента Б. и ex vivo культивируемых в течение 3 дней на питательной среде с 10 мкг/мл изониазида (левая панель), 40 мкг/мл рифампицина (центральная панель) или 50 мкг/мл канамицина (правая панель) представлены на Фиг. 3.
По результатам анализа согласно заявленному способу установлено снижение в 2 и более раз доли альвеолярных макрофагов с микобактериями туберкулеза в опытных культурах, проинкубированных 3 дня на питательной среде с 60 и 80 мкг/мл рифампицина, 40 и 50 мкг/мл канамицина, 40 и 50 мкг/мл капреомицина соответственно, а также со всеми тремя концентрациями офлоксацина, относительно контрольной культуры (Таблица 2). Не обнаружено значимого снижения доли альвеолярных макрофагов с М. tuberculosis в опытных культурах, инкубированных с изониазидом в трех концентрациях, что позволяет сделать заключение об отсутствии антимикобактериального действия изониазида по отношению к микобактериям пациента Б. Все протестированные ПТП в исследованных концентрациях не оказывали цитотоксического эффекта на альвеолярные макрофаги пациента Б., поскольку морфологические признаки гибели клеток отсутствовали (Фиг. 3).
Сделано заключение о наличии антимикобактериального действия рифампицина в концентрациях 60 и 80 мкг/мл, офлоксацина в трех изученных концентациях, канамицина в концентрациях 40 и 50 мкг/мл и капреомицина в концентрациях 40 и 50 мкг/мл для пациента Б.. Отсутствие цитотоксического действия на альвеолярные макрофаги данных ПТП в указанных концентрациях позволяет не только рекомендовать их к лечению данного пациента, но и выбрать минимальные из указанных концентраций для снижения побочного эффекта, а именно: рифампицин - 60 мкг/мл, офлоксацин - 2 мкг/мл, канамицин - 40 мкг/мл, капреомицин - 40 мкг/мл.
Антимикобактериальная активность ПТП в системе ВАСТЕС не была исследована из-за отсутствия клинического изолята М. tuberculosis из резецированных тканей легкого пациента Б..
В наборе «ТБ-тест» в ДНК микобактерий пациента Б. выявили мутации устойчивости к изониазиду и не обнаружили к рифампицину, офлоксацину и аминогликозидам (канамицин и капреомицин). На основе проведенного анализа сделано заключение об антимикобактериальном действии офлоксацина, а также рифампицина, канамицина и капреомицина для данного пациента из-за отсутствия мутаций устойчивости к этим препаратам в ДНК микобактерий, что позволяет рекомендовать применение этих ПТП в курсе химиотерапии на послеоперационном этапе лечения пациента Б.
Сравнение результатов ТБ-теста с заключением по заявленному способу показывает, что последний позволил не только выявить антимикобактериальную активность вышеперечисленных ПТП на альвеолярные макрофаги с М. tuberculosis, но и определить минимальную концентрацию, достаточную для достижения антимикобактериального действия при отсутствии цитотоксического эффекта ПТП.
Пример 2. Пациент П. (38 лет) с туберкулемой верхней доли левого легкого (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающий прием по утвержденной схеме изониазида, рифампицина, пиразинамида, этамбутола. По окончании курса был поставлен диагноз - туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства была удалена верхняя зона левого легкого.
На культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациента П., проведена оценка антимикобактериального действия изониазида, рифампицина, офлоксацина, канамицина и капреомицина в трех концентрациях -критической, предельной и промежуточной между ними по заявленному способу. Результаты представлены в таблице 3. Как следует из таблицы 3, не выявлено снижения доли альвеолярных макрофагов с М. tuberculosis в опытных культурах, проинкубированных в течение 3 дней на питательной среде с изониазидом или рифампицином или офлоксацином или канамицином во всех исследованных концентрациях, относительно контрольной культуры. Это свидетельствует об отсутствии антимикобактериального действия данных ПТП по отношению к микобактериям пациента П.
В опытной культуре, проинкубированной на питательной среде с предельной концентрацией капреомицина 50 мкг/мл не выявлено альвеолярных макрофагов с микобактериями, что свидетельствует об антимикобактериальном действии капреомицина в данной концентрации по отношению к микобактериям пациента П. Однако капреомицин, как и другие протестированные ПТП в исследованных концентрациях, кроме изониазида в критической концентрации 1 мкг/мл, были токсичны для макрофагов пациента П., что привело к значительному снижению их количества в опытных культурах и появлению морфологических признаков гибели клеток. Это не позволяет сделать положительное заключение по заявленному способу относительно капреомицина в концентрации 50 мкг/мл.
Антимикобактериальная активность ПТП в системе ВАСТЕС не была исследована из-за отсутствия клинического изолята М. tuberculosis из резецированных тканей легкого пациента П.
На основании набора «ТБ-тест» в ДНК микобактерий пациента П. выявили мутации устойчивости к изониазиду и рифампицину и не обнаружили к офлоксацину и аминогликозидам (канамицин и капреомицин). Сделано заключение об отсутствии антимикобактериального действия у изониазида и рифампицина на альвеолярные макрофаги пациента П. в результате сформировавшихся мутаций устойчивости к этим препаратам в ДНК микобактерий.
Расхождение заключения по заявленному способу и набору «ТБ-тест» относительно канамицина и офлоксацина подтверждает отсутствие прямой связи между мутациями в ДНК микобактерий и их чувствительностью к антимикобактериальному действию ПТП. Возникновение устойчивости к этим препаратам в альвеолярных макрофагах с микобактериями у пациента П. может быть объяснено либо появлением других мутаций устойчивости к этим ПТП, не выявляемых в наборе «ТБ-тест», либо включением других молекулярных механизмов, связанных, например, с изменением экспрессии генов микобактерий или активизацией стрессорных систем защиты, активно выводящих ПТП из микробной клетки (4). Кроме того, в отличие от набора «ТВ-тест» заявленный способ позволил выявить токсичность одобренных по набору «ТВ-тест» офлоксацина, канамицина и капреомицина во всех изученных концентрациях, что подтверждает его более высокую эффективность.
Заключение по заявленному способу не позволяет рекомендовать изученные ПТП для противотуберкулезной терапии пациента П. в послеоперационный период лечения.
Пример 3. Пациентка Ш. (45 лет) с фиброзно-кавернозным туберкулезом правого легкого (таблица 1). До операции пациентка прошла курс противотуберкулезной терапии, включающей прием по утвержденной схеме пиразинамида, этамбутола, протионамида, капреомицина, пара-амино-салициловой кислоты, циклосерина. По окончании курса был поставлен диагноз - туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства было удалено правое легкое.
На культуре альвеолярных макрофагов, полученных из резецированной ткани легкого пациента Ш., проведена оценка антимикобактериального действия изониазида, рифампицина, офлоксацина, канамицина и капреомицина в трех концентрациях -критической, предельной и промежуточной между ними по заявленному способу. Результаты представлены в таблице 4. Как следует из таблицы 4, установлено снижение в 2 и более раз доли альвеолярных макрофагов с М. tuberculosis в опытных культурах, проинкубированных в течение трех дней на питательной среде с предельной концентрацией рифампицина 80 мкг/мл относительно контрольной культуры. Кроме того, показано отсутствие микобактерий в культуре альвеолярных макрофагов, проинкубированной с предельной концентрацией капреомицина 50 мкг/мл. Не обнаружено значимого снижения доли альвеолярных макрофагов с микобактериями в опытных культурах, проинкубированных на питательной среде с изониазидом, офлоксацином и канамицином во всех исследованных концентрациях. Все протестированные ПТП в исследованных концентрациях не оказывали цитотоксического эффекта на альвеолярные макрофаги пациентки Ш., поскольку морфологические признаки гибели клеток отсутствовали. Испытание по заявленному способу позволяет сделать заключение об антимикобактериальном действии рифампицина и капреомицина в предельных концентрациях по отношению к микобактериям у пациентки Ш.
В системе ВАСТЕС не установили антимикобактериального действия изониазида, рифампицина и канамицина в критических концентрациях 1, 40 и 30 мкг/мл, соответственно, на клинический штамм М. tuberculosis, изолированный из операционного материала легких пациентки Ш. Эти данные подтверждают результаты по заявленному способу для критических концентраций ПТП, но при анализе в системе ВАСТЕС не учтены предельные концентрации ПТП, которые позволили получить положительную оценку ПТП по заявленному способу.
На основании «ТБ-теста» выявили мутации устойчивости к изониазиду, рифампицину и офлоксацину в ДНК микобактерий пациентки Ш. Эти результаты расходятся с заключением относительно рифампицина и канамицина по заявленному способу, и объяснение аналогично представленному в примере 2.
Заключение по заявленному способу позволяет рекомендовать рифампицин и капреомицин в предельных концентрациях для противотуберкулезной терапии пациентки Ш. в послеоперационный период лечения.
Пример 4. Пациент В. (34 года) с двухсторонним кавернозным туберкулезом верхних долей легких (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающий прием по утвержденной схеме изониазида, пиразинамида, этамбутола, протионамида, рифабутина. По окончании курса был поставлен диагноз - туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства была удалена верхняя зона левого легкого (Фиг. 2).
На культуре альвеолярных макрофагов, полученной из резецированной ткани легкого пациента В., проведена оценка по заявленному способу антимикобактериального действия изониазида в концентрации 0.7 мкг/мл, близкой к критической, а также испытуемых на антимикобактериальную активность препаратов наночастиц серебра Ag(0) размером 2, 15 и 40 нм в концентрации 5 мкг/мл, определенной ранее в (20), и препарата наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл, установленной ранее в (21). Результаты представлены в таблице 5.
При отсутствии цитотоксического действия на альвеолярные макрофаги установлено снижение в 2 и более раз доли альвеолярных макрофагов с микобактериями М. tuberculosis в опытных культурах, проинкубированных с препаратами наночастиц серебра Ag(0) размером 2 и 40 нм в концентрации 5 мкг/мл и наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл, относительно контрольной культуры, что позволяет сделать заключение об антимикобактериальном действии данных препаратов в указанных концентрациях в отношении микобактерий у пациента В..
Не обнаружено значимого изменения доли альвеолярных макрофагов с М. tuberculosis в опытной культуре, проинкубированной на питательной среде с изониазидом, где она составила 6.9%, тогда как в контрольной культуре - 7.8%. Из всех протестированных средств только препарат серебра Ag(0) с размером частиц 15 нм оказал токсическое действие на альвеолярные макрофаги пациента В. с появлением морфологических признаков гибели клеток (Фиг. 4), что позволяет заключить о нецелесообразности его применения в концентрации 5 мкг/мл в качестве противотуберкулезного средства.
В системе ВАСТЕС выявили недостаток антимикобактериального действия изониазида в критической концентрации 1 мкг/мл на клинический штамм микобактерий М. tuberculosis, изолированный из операционного материала легких пациента В. Эти данные подтверждают результат, полученный с изониазидом по заявленному способу.
На основе системы «ТБ-тест» выявили мутации устойчивости к изониазиду в ДНК микобактерий, возможно, определившие их резистентность к действию этого препарата.
Данные, полученные на основе двух вышеупомянутых тестов, подтверждают результат, полученный с изониазидом по заявленному способу.
Сделанное заключение позволяет поставить вопрос об исключении изониазида из курса лечения пациента В. в послеоперационный период.
Результаты испытаний по заявленному способу препаратов наночастиц серебра Ag(0) размером 2 и 40 нм в концентрации 5 мкг/мл и наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл в отношении микобактерий пациента В. позволяет рекомендовать продолжение исследования их антимикобактериального действия.
Пример 5. Пациент Д. (38 лет) с фиброзно-кавернозным туберкулезом сегмента 6 правого легкого с обсеменением верхней доли (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающий прием по утвержденной схеме пиразинамида, этамбутола, протионамида, капреомицина, циклосерина. По окончании курса был поставлен диагноз - туберкулез легких с широкой лекарственной устойчивостью. В ходе оперативного вмешательства были удалены сегменты С2 и C6 правого легкого.
На культуре альвеолярных макрофагов, полученной из резецированной ткани легкого пациента Д., проведена оценка по заявленному способу антимикобактериального действия препаратов, указанных в примере 4. Результаты представлены в таблице 5.
По результатам анализа по заявленному способу не установлено снижение в 2 и более раз доли альвеолярных макрофагов с микобактериями М. tuberculosis ни в одной из опытных культур, проинкубированных в течение трех дней на питательной среде с изониазидом и всеми исследованными препаратами наночастиц серебра, относительно контрольной культуры в концентрациях, указанных в таблице 5. Наночастицы серебра Ag(0) размером 15 и 40 нм в использованной концентрации были токсичны для альвеолярных макрофагов пациента Д. с появлением морфологических признаков гибели клеток. Это позволяет сделать заключение об отсутствии антимикобактериального действия изученных препаратов на микобактерий пациента Д.
Результаты тестирования изониазида в системе ВАСТЕС подтвердили заключение по заявленному способу.
На основе набора «ТБ-тест» выявили мутации устойчивости к изониазиду в ДНК микобактерий, возможно, определившие их резистентность к действию этого препарата.
Сделано заключение о неэффективности использования изученных препаратов в качестве противотуберкулезного препарата для данного пациента.
Пример 6. Пациент Ж. (32 года) с кавернозным туберкулезом верхней доли правого легкого (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме изониазида, пиразинамида, этамбутола, протионамида, капреомицина, циклосерина. По окончании курса был поставлен диагноз - туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства была удалена верхняя доля правого легкого.
На культуре альвеолярных макрофагов, полученной из резецированной ткани легкого пациента Ж., проведена оценка по заявленному способу антимикобактериального действия препаратов, указанных в примере 4. Результаты представлены в таблице 5.
По результатам анализа по заявленному способу установлено снижение относительно контрольной культуры в 2 и более раз доли альвеолярных макрофагов с М. tuberculosis в опытных культурах, проинкубированных в течение трех дней на питательной среде с изониазидом в концентрации ниже критической (0.7 мкг/мл) и препаратами наночастиц серебра Ag(0) с размером 15 и 40 нм в концентрации 5 мкг/мл и наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл. Однако препараты наночастиц серебра Ag(0) с размером 15 и 40 нм в концентрации 5 мкг/мл были токсичны для альвеолярных макрофагов пациента Ж. с появлением морфологических признаков гибели клеток (Фиг. 5). Препарат наночастиц серебра Ag(0) размером 2 нм не обладал значимой антимикобактериальной активностью.
Результаты испытаний по заявленному способу позволяют сделать заключение о наличии значимой антимикобактериальной активности по отношению к микобактериям пациента Ж. без признаков цитотоксичности альвеолярных макрофагов у изониазида в концентрации 0.7 мкг/мл и наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл.
Антимикобактериальная активность изониазида в системе ВАСТЕС не была исследована из-за отсутствия клинического изолята М. tuberculosis из резецированных тканей легкого пациента Ж..
На основе набора «ТБ-тест» в ДНК микобактерий выявили мутации устойчивости к изониазиду. Объяснение причин несовпадения с заключением по заявленному способу аналогично представленному в примере 2.
Таким образом, на основе тестирования по заявленному способу изониазид в концентрации ниже критической (0.7 мкг/мл) может быть рекомендован для продолжения приема этого препарата пациентом Ж. в послеоперационный период лечения, несмотря на обнаружение мутаций устойчивости к этому препарату у микобактерий.
Препарат наночастиц серебра с арабиногалактанами Ag(0)S1 в концентрации 50 мкг/мл заслуживает дальнейшего исследования. Проявление значительной цитотоксичности наночастиц серебра Ag(0) с размером 15 и 40 нм в концентрации 5 мкг/мл одновременно с установленным антимикобактериальным действием на микобактерий пациента Ж. указывает на необходимость поиска более оптимальных концентраций этих препаратов для дальнейшего исследования их противотуберкулезной активности.
Пример 7. Пациент С. (23 года) с кавернозным туберкулезом верхней доли левого легкого с обсеменением сегмента (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме пиразинамида, капреомицина, пара-амино-салициловой кислоты, циклосерина, рифабутина. По окончании курса был поставлен диагноз - туберкулез легких с множественной лекарственной устойчивостью. В ходе оперативного вмешательства была удалена верхняя зона левого легкого.
На культуре альвеолярных макрофагов, полученной из резецированной ткани легкого пациента С, проведена оценка по заявленному способу антимикобактериального действия препаратов, указанных в примере 4. Результаты представлены в таблице 5.
По результатам анализа по заявленному способу относительно контрольной культуры установлено снижение в 2 и более раз доли альвеолярных макрофагов с М. tuberculosis в опытных культурах, проинкубированных в течение трех дней с препаратами наночастиц серебра в использованных концентрациях, относительно контрольной культуры (Таблица 5). Однако все исследованные препараты наночастиц серебра в использованных концентрациях были токсичны для альвеолярных макрофагов пациента С.с появлением морфологических признаков гибели клеток (Фиг. 6), что не позволяет сделать положительное заключение об их антимикобактериальном действии по заявленному способу. Не обнаружено значимого изменения доли альвеолярных макрофагов с М. tuberculosis в опытной культуре, проинкубированной на питательной среде с изониазидом (Таблица 5, Фиг. 6). Сделано заключение об отсутствии антимикобактериального действия изониазида в концентрации 0.7 мкг/мл на микобактерий в альвеолярных макрофагах пациента С.
Антимикобактериальная активность изониазида в системе ВАСТЕС не была исследована из-за отсутствия клинического изолята М. tuberculosis из резецированных тканей легкого пациента С.
На основе набора «ТБ-тест» выявили мутации устойчивости к изониазиду в ДНК микобактерий. Сделано заключение о неспособности изониазида снижать количество альвеолярных макрофагов с М. tuberculosis у пациента С, что согласуется с заключением по заявленному способу. Значительная цитотоксичность препаратов наночастиц серебра в использованных концентрациях одновременно с установленным антимикобактериальным действием на альвеолярные макрофаги с микобактериями М. tuberculosis у пациента С.указывает на необходимость поиска более оптимальных концентраций этих препаратов для дальнейшего исследования их противотуберкулезной активности.
Список литературы
1. S.D. Lawn, A. Zumla. Tuberculosis. Lancet, 2011, vol. 378, no. 1, 57-72;
2. World Health Organization. Global tuberculosis report 2014. Geneva. Switzerland: WHO, 2014. www.who.int/tb/publications/global_report/en/;
3. World Health Organization. Drug-resistant ТВ: surveillance & response. Supplement Global tuberculosis report 2014. Geneva. Switzerland: WHO, 2014;
4. Фтизиатрия. Национальное руководство. Под ред. М.И. Перельмана. М: ГЭОТАР-Медиа, 2007, 512 с.;
5. А.А. Прозоров, М.В. Зайчикова, В.Н. Даниленко. Мутанты Mycobacterium tuberculosis с множественной лекарственной устойчивостью: история появления, генетические и молекулярные механизмы устойчивости, возникающие проблемы. Генетика, 2012, том 48, №1, 5-20;
6. Патент на изобретение РФ №2562866 Способ обнаружения ДНК возбудителя туберкулеза с одновременным установлением его генотипа и определением генетических детерминант множественной и широкой лекарственной устойчивости, олигонуклеотидный микрочип, набор праймеров и набор олигонуклеотидных зондов, используемые в способе. Дата публикации 10.09.2015, Бюлл. №25. МПК C120Q 1/68.
7. Патент на изобретение РФ №2633507 Способ молекулярно-генетической детекции устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда (фторхинолонам, аминогликозидам и капреомицину). Дата публикации 12.10.2017, Бюлл. №29. МПК C12Q 1/68, C12N 15/09.
8. Культуральные методы диагностики туберкулеза. Под ред. В.В. Ерохина. М. - Тверь: ООО «Издательство «Триада», 2008, 208 с.
9. Патент на изобретение РФ №2315113 Способ диагностики чувствительности Mycobacterium tuberculosis к противотуберкулезным препаратам. Дата публикации 20.01.2008, Бюлл. №2. МПК C12Q 1/04, C12N 1/20.
10. V. Dartois. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Reviews Microbiology, 2014, vol. 12, no. 3, 159-167.
11. Патент на изобретение РФ №2244927 Способ определения лекарственной чувствительности микобактерий туберкулеза. Дата публикации 20.01.2005, Бюлл. №2. МПК G01N 33/48.
12. Патент на изобретение РФ №2593725 Способ получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких и способ оценки вирулентности Mycobacterium tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов. Дата публикации 10.08.2016, Бюлл. №22. МПК C12N 5/0786, C12Q 1/02, C12R 1/32.
13. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогености (опасности) и возбудителями паразитарных болезней». Утверждены постановлением Главного государственного санитарного врача от 28 января 2008 года №4, Бюллетень нормативных актов федеральных органов исполнительной власти, №19, 12.05.08. www.niiot.rii/doc/bank00/doc253/doc.htm
14. СП 2.1. 7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». Утверждены постановлением Главного государственного санитарного врача от 09 декабря 2010 года №163, Бюллетень нормативных актов федеральных органов исполнительной власти, №13, 28.03.11. www.medothod.ru/medicinskie-othody-SANPIN
15. Е.Д. Гольдберг, A.M. Дыгай, В.П. Шахов. Методы культуры ткани в гематологии. Томск, Изд-во Томского университета, 1992, стр. 77.
16. R.S. Wallis, R. Hafner. Advancing host-directed therapy for tuberculosis. Nature Reviews Immunology, 2015, vol. 15, no. 4, 255-263;
17. A. Zumla, M. Rao, S.K. Parida, S. Keshavjee, G. Cassell, R. Wallis, R. Axelsson-Robertsson, M. Doherty, J. Andersson, M. Maeurer. Inflammation and tuberculosis: host-directed therapies. Journal of Internal Medicine, 2015, vol. 277, no. 3, 373-387.
18. S.G. Franzblau, M.A. DeGroote, S.H. Cho, K. Andries, E. Nuermberger, I.M. Orme, K. Mdluli, I. Angulo-Barturen, T. Dick, V. Dartois, A.J. Lenaerts. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis, 2012, vol. 92, no. 5, 453-488.
19. K. Mdluli, T. Kaneko, A. Upton. The tuberculosis drug discovery and development pipeline and emerging drug targets. Cold Spring Harbor Perspectives in Medicine, 2015, 124.
20. Е.Г. Уфимцева, A.B. Попов, И.Д. Иванов. Биологическая активность наночастиц металлического серебра разного размера в клетках костного мозга и перитонеальной полости мышей, инфицированных вакциной БЦЖ in vitro. Биофармацевтический журнал, 2016, Т. 8, №2, стр. 52-60.
21. I.A. Shurygina, B.G. Sukhov, T.V. Fadeeva, V.A. Umanets, M.G. Shurygin, T.V. Ganenko, Y.A. Kostyro, E.G. Grigoriev, B.A. Trofimov. Bactericidal action of Ag(0)-antithrombotic sulfated arabinogalactan nanocomposite: coevolution of initial nanocomposite and living microbial cell to a novel nonliving nanocomposite. Nanomedicine: Nanotechnology, Biology, and Medicine, 2011, vol. 7, 827-833.
22. E.Ю. Носова, M.А. Краснова, К.Ю. Галкина, М.В. Макарова, В.И. Литвинов, А.М. Мороз. Сравнительная оценка эффективности молекулярных тест-систем "ТБ-БИОЧИП", "Xpert MTB/RIF" и "GenoType MTBDRplus" для быстрого определения мутаций, ответственных за лекарственную устойчивость Mycobacterium tuberculosis complex (в респираторном материале пациентов московского региона). Молекулярная биология, 2013, том 47, №2, с. 267-274.
* Туберкулез с широкой (пациент Д.) и множественной (все остальные пациенты) лекарственной устойчивостью.
** Сокращенные названия противотуберкулезных препаратов - изониазид (Н), рифампицин (R), пиразинамид (Z), этамбутол (Е), протионамид (Pt), капреомицин (Ср), пара-амино-салициловая кислота (Pas), циклосерин (Cs), рифабутин (Rf).