Результат интеллектуальной деятельности: N-(2-АМИНОПУРИН-6-ИЛ)ГЛИЦИЛ-(S)-ГЛУТАМИНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ПРОТИВОТУБЕРКУЛЁЗНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области органической химии, а именно к новому производному пурина - N-(2-аминопурин-6-ил)глицил-(S)-глутаминовой кислоте, которая обладает противотуберкулезной активностью и может найти применение в медицине и ветеринарии.
На сегодняшний день самой распространенной инфекцией-убийцей является туберкулез (http://www.who.int/tb/en (2009); Global Tuberculosis Control: Surveillance, Planning, Financing; WHO Report 2009; World Health Organization: Geneva, 2009). Статистика показывает, что в 2013 г. в мире им заболело 8 млн человек и умерло 1,5 млн, из них 360000 ВИЧ-инфицированных. В России в 2013 г. зарегистрировано 142000 случаев заболевания туберкулезом. Эти данные свидетельствуют, насколько велико социально-экономическое значение туберкулеза, соизмеримое по своим негативным последствиям с любым стихийным бедствием или биологической катастрофой. К сожалению, борьба с туберкулезом методами современной химиотерапии должного эффекта не имеет. Основной причиной является то, что микобактерия туберкулеза (МБТ) гипермутабельна - при попадании внутрь клетки начинаются ее многочисленные мутации, ведущие к ее резистентности, повышению скорости роста и других неприятных качеств этого патогена.
В 2013 г. зарегистрировано 480000 случаев заболеваний, вызванных резистентными штаммами микобактерий с множественной лекарственной устойчивостью (MDR), в том числе почти 44000 случаев в России. Заболевания, вызванные MDR-штаммами Mycobacterium tuberculosis, имеют остро прогрессирующий характер и плохо поддаются лечению существующими препаратами. Поэтому имеется острая необходимость в разработке новых противотуберкулезных средств, обладающих нетрадиционным механизмом действия на патоген.
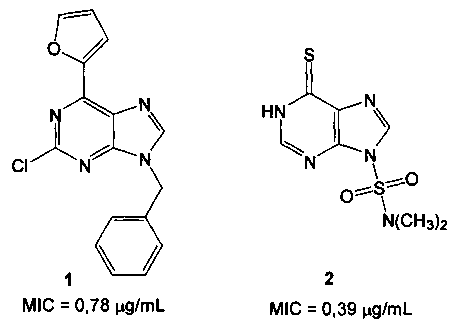
Среди производных пурина найдены соединения, обладающие противотуберкулезной активностью, например соединения 1 и 2 [Scozzafava, А.; Mastrolorenzo, A.; Supuran, С.Т. Antimycobacterial activity of 9-sulfonylated/sulfenylated-6-mercaptopurine derivatives. Bioorg. Med. Chem. Lett. 2001, 11, 1675-1678; Gundersen, L.-L.; Nissen-Meyer, J.; Spilsberg, В. Synthesis and antimycobacterial activity of 6-arylpurines: the requirements for the N-9 substituent in active antimycobacterial purines. J. Med. Chem. 2002, 45, 1383-1386; Pathak, A.K.; Pathak, V.; Seitz, L.E.; Suling, W.J.; Reynolds, R.C. 6-Oxo and 6-thio purine analogs as antimycobacterial agents. Bioorg. Med. Chem. 2013, 21, 1685-1695]:
О противотуберкулезной активности ближайших структурных аналогов N-(2-аминопурин-6-ил)глицил-(S)-глутаминовой кислоты, таких, например, как пептиды на основе N-(пурин-6-ил)глицина (общей формулы 3) [Matsubara, S.; Fujii, Т.; Nishitani, Т. Cytokinin activities of N-(purin-6-yl)amino acids, N-(purin-6-yl)peptidesand related compounds. Sci. Rep. Kyoto Prefect. Univ., Nat. Sci. Living Sci. 1988, 39, 1-6] и его гомологов (общей формулы 4) [ , K.;
, K.;  , Е.Е.;
, Е.Е.;  , P.; Zahn, Н. The synthesis and some biological properties of N-(6-purinyl)peptides. Biol. Chem. Hoppe-Seyler 1986, 367, 757-768], сведения отсутствуют.
, P.; Zahn, Н. The synthesis and some biological properties of N-(6-purinyl)peptides. Biol. Chem. Hoppe-Seyler 1986, 367, 757-768], сведения отсутствуют.
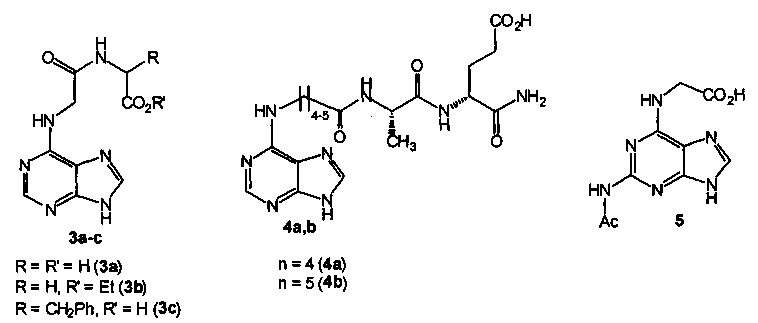
Наиболее близким аналогом (прототипом) предлагаемого технического решения является соединение 5, обладающее противотуберкулезной активностью [Заявка №2014149139/04(079066), положительное решение от 08.10.2015]. Характеристика бактериостатической активности соединения 5 в отношении различных штаммов М. tuberculosis, приведена в таблице 1.
В литературе отмечалось, что механизм туберкулостатического действия производных пурина невозможно предсказать, поскольку метаболизм пурина в микобактериях не вполне изучен [Pathak, А.K.; Pathak, V.; Seitz, L.Е.; Suling, W.J.; Reynolds, R.С. 6-Oxo and 6-thio purine analogs as antimycobacterial agents. Bioorg. Med. Chem. 2013, 21, 1685-1695].
Задача предлагаемого изобретения - новое соединение с высокой антимикобактериальной активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, расширяющее арсенал известных противотуберкулезных средств.
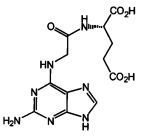
Техническим результатом данного изобретения является создание нового химического соединения - N-(2-аминопурин-6-ил)глицил-(S)-глутаминовой кислоты формулы (6):
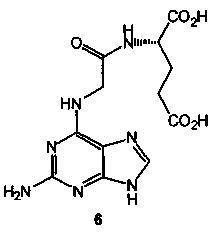
Соединение 6, его физико-химические характеристики, а также способ его получения в литературе не описаны.
Соединение формулы (6) может быть получено в две стадии из доступного N-(2-ацетамидопурин-6-ил)глицина (5) [Заявка №2014149139/04(079066), положительное решение от 08.10.2015]:
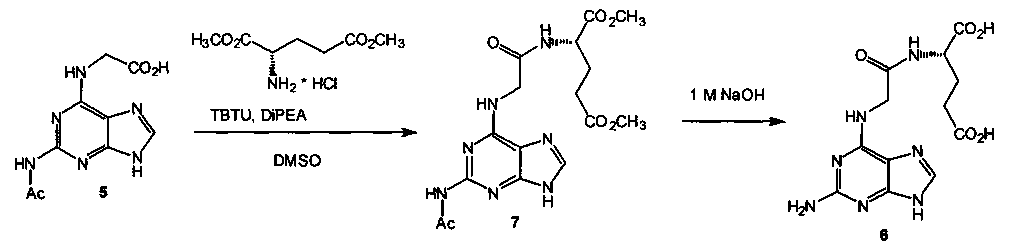
Соединение 5 вводят в реакцию с гидрохлоридом диметилового эфира (S)-глутаминовой кислоты в диметилсульфоксиде (ДМСО) в присутствии тетрафторбората О-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилмочевины (TBTU) и диизопропилэтиламина (DiPEA). В результате выделяют диметиловый эфир N-(2-ацетамидопурин-6-ил)глицил-(S)-глутаминовой кислоты (7), щелочной гидролиз которого приводит к целевому соединению 6.
Характеристики новых соединений 6 и 7 приведены в примерах конкретного выполнения.
Структуры полученных соединений подтверждают методами спектроскопии ЯМР 1Н и 13С, элементного анализа и масс-спектрометрии высокого разрешения. Индивидуальность соединений подтверждают методами ТСХ и ОФ ВЭЖХ.
Температуры плавления соединений определены на приборе Stuart SMP3 (Barloworld Scientific).
Элементный анализ выполнен на автоматическом CHNS-O анализаторе РЕ 2400 серия II (Perkin Elmer).
Спектры ЯМР 1Н зарегистрированы на приборе Bruker DRX-400 (400 МГц) в ДМСО-d6 с Si(CH3)4 в качестве внутреннего стандарта при 24°С. Химические сдвиги (δ) приведены в миллионных долях (м.д.), а константы спин-спинового взаимодействия (J) в герцах (Гц).
Спектры ЯМР 13С зарегистрированы на приборе Bruker Avance 500 (125 МГц) в ДМСО-d6 с Si(CH3)4 в качестве внутреннего стандарта при 24°С. Химические сдвиги (δ) приведены в миллионных долях (м.д.).
Аналитическая обращенно-фазовая ВЭЖХ (ОФ ВЭЖХ) выполнена на жидкостном хроматографе «Agilent-1100» (Agilent Technologies), колонка Phenomenex Luna C(18), 250×4,6 мм, сорбент 5 мкм, детектирование при длинах волн 230 и 254 нм, элюирование в градиенте от ацетонитрил-0,2% водная трифторуксусная кислота, от 1: 9 до 9: 1 за 30 мин. Скорость потока 0,8 мл/мин.
Масс-спектр высокого разрешения зарегистрирован на масс-спектрометре MicrOTOF-Q II (Bruker Daltonics), оснащенном устройством прямого ввода kd Scientific (скорость потока 180 мкл/ч). Ионизация электрораспылением (ESI). Программное обеспечение micrOTOFcontrol 2.3 patch 1 и HyStar 3.2 (Bruker Daltonics). Номинальное разрешение прибора 17500. Масс-спектрометр работал в режиме регистрации отрицательных ионов в диапазоне масс m/z=50-900 Да. Напряжение на капилляре источника ионизации 3000 В, а на выходе из стеклянного капилляра потенциал напряжения 166 В. Давление распылительного газа 0,4 бар, скорость потока газа-осушителя 4 л/мин. Температура нагревателя газа 180°С. Время транзита ионов 70 микросекунд, радиочастота гексаполя 150 Vpp. Калибровка прибора внешняя, по 6 реперным точкам пиков кластеров формиата лития при введении в прибор 10 ммоль/л раствора LiOH в смеси изопропиловый спирт - 0,2% водная муравьиная кислота, 1: 1.
Для ТСХ использованы пластинки Sorbfil (ООО «Имид», Россия). Проявление в УФ свете.
Примеры конкретного выполнения.
Пример 1
Синтез N-(2-аминопурин-6-ил)глицил-(S)-глутаминовой кислоты (6)
Суспензию 1,00 г (4,0 ммоля) N-(2-ацетамидопурин-6-ил)глицина (5) и 2,79 мл (16,0 ммоля, 4,0 экв.) DiPEA перемешивают в 12 мл ДМСО в течение 15 минут (комнатная температура) при обработке ультразвуком (50 W). Прибавляют 1,27 г (6,0 ммоля, 1,5 экв.) гидрохлорида диметилового эфира (S)-глутаминовой кислоты и порциями при перемешивании в течение 30 минут прибавляют 1,93 г (6,0 ммоля, 1,5 экв.) TBTU. Перемешивают при комнатной температуре в течение 1 суток, при этом происходит растворение исходных соединений, затем образуется осадок. Реакционную смесь выливают в 300 мл дистиллированной воды, осадок отфильтровывают, промывают водой и сушат в вакууме. Получают 1,12 г (69%) диметилового эфира N-(2-ацетамидопурин-6-ил)глицил-(S)-гаутаминовой кислоты (7) в виде светло-розового твердого вещества. Т пл.=279-281°С (с разл.). [α]D 25=-15,4 (с 0,3; ДМСО). Найдено: С 47,22; Н 5,10; N 23,95. Вычислено для C16H21N7O6 (М=407,39): С 47,17; Н 5,20; N 24,07.
Спектр ЯМР 1Н (400 МГц, ДМСО-d6, 24°С): 1,85 (м, 1Н, С3НВ Glu); 2,00 (м, 1Н, С3НА Glu); 2,20 (с, 3Н, СН3-Ас); 3,34 (с, 2Н, С4Н2 Glu, J=6,6); 3,56 (с, 3Н, CO2CH3); 3,60 (с, 3Н, CO2CH3); 4,06 (с, 2Н, СН2 Gly); 4,32 (м, 1H, С2Н Glu); 7,85 (с, 1H, С6′′NH); 8,01 (с, 1H, С8′′Н); 8,46 (с, 1Н, NH Glu); 9,83 (с, 1Н, NH Ас); 12,80 (уш.с, 1Н, N9′′Н).
Спектр ЯМР 13С (125 МГц, ДМСО-d6, 24°С): 24,53 (СН3-Ас); 25,96 (С-3 Glu); 29,43 (С-4 Glu); 43,34 (С-2′ Gly); 51,01 и 51,23, и 51,79 (2 CO2CH3 и С-2 Glu); 114,93 (С-5′′); 138,80 (С-8′′); 151,19 и 152,29, и 153,75 (С-4′′, С-2′′, С-6′′); 169,35 и 169,55 (СО Ас и СО Gly); 171,89 и 172,52 (2 CO2CH3).
ОФ ВЭЖХ: τR=9,8 мин.
К 2,0 г (4,91 ммоля) диметилового эфира N-(2-ацетамидопурин-6-ил)глицил-(S)-глутаминовой кислоты (7) приливают 30,4 мл (6,2 экв.) 1 М водного NaOH. Перемешивают при комнатной температуре в течение трех суток, фильтруют, фильтрат подкисляют 1 М водным HCl до рН~5, выпавший осадок отфильтровывают, промывают водой, сушат в вакууме. Получают 1,46 г (87%) соединения 5 в виде бесцветного твердого вещества. Т пл=206-210°С (с разл.). [α]D 25=-6,7 (с 0,3; 1 М NaOH). Найдено: С 42,28; Н 4,52; N 28,91. Вычислено для C12H15N7O5×0,2 H2O (М=340,90): С 42,28; Н 4,55; N 28,76.
Спектр ЯМР 1Н (400 МГц, ДМСО-d6, 24°С): 1,80 (м, 1Н, С3НВ Glu); 1,98 (м, 1Н, С3НА Glu); 2,28 (м, 2Н, С4Н2 Glu); 4,09 (уш.с, 2Н, СН2 Gly); 4,28 (д.д.д, 1Н, С2Н Glu, J=8,4; 8,0; 5,1); 5,85 (уш.с, 2Н, NH2); 7,26 (уш.с, 1H, C6′′NH); 7,72 (с, 1H, С8′′Н); 8,18 (д, 1Н, NH Glu, J=7,8); 12,30 (уш.с, 2Н, N9′′Н и CO2H).
Спектр ЯМР 13С (125 МГц, ДМСО-d6, 24°С): 26,56 (С-3 Glu); 29,96 (С-4 Glu); 42,99 (С-2′ Gly); 51,08 (С-2 Glu); 112,68 (С-5′′); 135,87 (С-8′′); 152,32 (С-4′′); 154,24 (С-2′′); 159,75 (С-6′′); 169,58 (СО Gly); 173,15 и 173,75 (2 CO2H).
Масс-спектр высокого разрешения: m/z: 338,1245 [М+Н]+. Расчет для C12H15N7O5: 338,1207 [М+Н]+.
ОФ ВЭЖХ: τR=4,8 мин.
Биологическая активность
Соединения исследовались в лаборатории экспериментальных и диагностических методов исследований ФГБУ «УНИИФ» Минздрава России, г. Екатеринбург.
Изучение туберкулостатической активности соединений проводили методом вертикальной диффузии с использованием лабораторного штамма H37Rv на плотной питательной среде «Новая».
Питательную среду разливали в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевали по 0,1 мл взвеси микобактерий туберкулеза (МБТ) штамма H37Rv, разведенного по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещали в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставили в вертикальное положение и по свободному краю закапывали по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,2; 0,6; 0,3 мкг/мл. Затем пробирки помещали в термостат при температуре 37°С и инкубировали в течение 10 суток. Оценку роста МБТ проводили по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствовало о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Соединение 6 проявило высокую бактериостатическую активность в отношении лабораторного штамма H37Rv (таблица 1).
Изучение туберкулостатической активности в отношении резистентных штаммов проводили методом вертикальной диффузии на плотной питательной среде «Новая» с использованием лабораторных и клинических штаммов микобактерий туберкулеза с множественной лекарственной устойчивостью (МЛУ и XDR), выделенных от больных, находящихся на лечении в клинике ФГБУ «УНИИФ».
Питательную среду разливали в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевали по 0,1 мл суспензией микобактерий различных штаммов, разведенных по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещали в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставили в вертикальное положение и по свободному краю закапывали по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,5; 0,7 мкг/мл. Затем пробирки помещали в термостат при температуре 37°С и инкубировали в течение 10 суток. Оценку роста МБТ проводили по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствовало о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Данные представлены в таблице 1.

Из данных таблицы 1 следует, что соединение 6 проявляет высокую туберкулостатическую активность как в отношении лабораторного штамма H37Rv (МИК 0,7 мкг/мл), так и в отношении ряда лекарственно устойчивых штаммов МБТ, причем активность соединения 6 превосходит активность известного соединения 5. Соединение 6 проявило активность в отношении штамма МЛУ, в отношении которого известный противотуберкулезный препарат, изониазид, не активен.
Токсичность соединения 6 в опытах in vivo (мыши, перорально), проведенных в ФГБУ «УНИИФ», оказалась существенно ниже, чем у препарата сравнения - изониазида (таблица 1).
Низкая цитотоксичность соединения 6 подтверждается и в опытах in vitro (МТТ-тест [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods 1983, 65, 55-63]) на фибробластах эмбриона человека (кожно-мышечная ткань), проведенных в Институте общей генетики им. Н.И. Вавилова РАН. Соединение 6 является практически нетоксичным. (IC50>50 мкМ).
N-(2-аминопурин-6-ил)глицил-(S)-глутаминовая кислота формулы обладающая противотуберкулезной активностью.