Результат интеллектуальной деятельности: Способ получения производного окисленного декстрана, пригодного для его визуализации в сыворотке крови
Вид РИД
Изобретение
Изобретение относится к медицине, экспериментальной и клинической фармакологии, в частности, оно может быть использовано при исследовании фармакокинетики окисленных декстранов, а именно исследовании фармакокинетики их липосомальных форм.
В экспериментальной медицине широко используются флуоресцентно меченные модифицированные производные полисахаридов, в частности декстрана, для изучения транспорта биологически активных веществ через клеточные мембраны (1).
Особый интерес для фармакологии представляют окисленные декстраны, так как они обладают высокой биосовместимостью, иммуномодулирующей активностью и могут использоваться в качестве перспективной матрицы для иммобилизации биологически активных веществ с целью их адресной доставки в различные клетки-мишени (2). Окисленные декстраны представляют собой производные декстрана, полученные путем его химического или радиационного окисления и содержащие карбонильные группы. С помощью окисленных декстранов получены перспективные лекарственные композиции (конъюгаты) для лечения туберкулеза (3), системных микозов (4) и вирусных заболеваний (5). Однако механизм действия окисленных декстранов до настоящего времени изучен недостаточно, так как отсутствуют способы получения их меченных производных с сохраненными карбонильными группами, образующимися при окислении декстранов и обусловливающих их специфические биологические свойства. Особенно малоизучены липосомальные формы окисленного декстрана и его коньюгатов с лекарственными субстанциями, так как спецификой липосомальных форм является экранирование окисленного декстрана внутри липосом, затрудняющее его визуализацию, например, методом иммуноферментного анализа, так как липосомальная мембрана мешает взаимодействию окисленного декстрана и его коньюгатов, например биотинилированных коньюгатов, с антителами и стрептавидин-пероксидазным комплексом.
Известно, что для визуализации окисленных декстранов используют различные метки, например флуоресцентные красители.
Известен способ получения флуоресцентного производного декстрана, включающий активацию декстрана путем реакции с бромпропиламином, осаждение полученного аминопроизводного декстрана этанолом; очистку аминопроизводного декстрана диализом; проведение реакции аминопроизводного декстрана с 5-([4,6-дихлоротриазин-2-ил]амино)-флуоресцеином путем конденсации в буферном растворе; отделение полученного флуоресцентного производного декстрана от свободного 5-([4,6-дихлоротриазин-2-ил]амино)-флуоресцеина ультрафильтрацией, в частности, диализом; очистку флуоресцентного аминопроизводного декстрана путем хроматографического разделения (6). Недостатком известного способа является его непригодность для получения флуоресцентных производных окисленных декстранов, т.к. это может привести к полной потере карбонильных групп, обусловливающих специфические биологические свойства окисленных декстранов.
Известен способ получения флуоресцентного производного окисленного декстрана, включающий проведение реакции флуоресцентного красителя с активированным окисленным декстраном с последующей очисткой конечного продукта от примесей путем ультрафильтрации. В качестве флуоресцентного красителя используют флуоресцеин, в качестве активирующего реагента - 1,1'-карбонилдиимидазол и активацию окисленного декстрана производят путем добавления 1,1'-карбонилдиимидазола в реакционную смесь окисленного декстрана с флуоресцеином (7). Недостатком известного способа является низкая емкость (низкая визуализирующая способность) получаемого флуоресцентного производного окисленного декстрана, поскольку в него можно ввести ограниченное количество молекул флуоресцеина, при этом на сравнительно большой молекуле декстрана (около 250 глюкопиранозных звеньев для м.М. 40 кДа) будет находиться до 10 остатков флуоресцеина. Кроме этого, большинство биологических объектов (клетки, тканевые гомогенаты, компоненты крови и др.) обладают весьма интенсивной собственной флуоресценцией, которая совпадает со спектральными характеристиками флуоресцеина, что не позволяет определить содержание в сыворотке крови как липосомальные, так и нелипосомальные формы окисленного декстрана.
Наиболее близким к заявляемому является способ получения биотинилированного производного окисленного декстрана, включающий проведение реакции окисленного декстрана с гидразидом биотина, используемого в качестве метки для визуализации в сыворотке крови; биотинилирование окисленного декстрана проводят путем добавления в реакционную смесь гидразида биотина в соотношении гидразид биотина - окисленный декстран, равном 1:(20-25), а реакцию проводят при 80-90°С в течение 30-60 минут (8). Способ позволяет визуализировать в сыворотке крови нелипосомальную форму биотинилированного производного окисленного декстрана. Недостатком способа-прототипа является непригодность биотинилированного производного окисленного декстрана для определения содержания его липосомальных форм в сыворотке крови ввиду экранирующих свойств липосомальной мембраны.
Задачей, на решение которой направлено изобретение, является получение производного окисленного декстрана, обеспечивающего определение содержания его липосомальных форм в сыворотке крови.
Решение поставленной задачи достигается тем, что в качестве метки для визуализации в сыворотки крови используют гидразид акридонуксусной кислоты; реакцию проводят при соотношении компонентов гидразид акридонуксусной кислоты - окисленный декстран 1:10 в пересчете на массу сухого вещества в течение 90 минут, фильтруют полученную суспензию, охлаждают ее до комнатной температуры, добавляют липосомообразующий агент, выдерживают полученную липосомальную форму окисленного декстрана при температуре 4-6°С в течение не менее 24 часов, затем фильтруют ее с помощью микрофильтра; окисленный декстран предварительно растворяют в дистиллированной воде до концентрации 1-2%; липосомальную форму окисленного декстрана фильтруют не менее 5 раз с помощью микрофильтра с диаметром пор 0,45 мкм.
Использование гидразида акридонуксусной кислоты в качестве метки для визуализации окисленного декстрана позволяет визуализировать липосомальную форму окисленного декстрана в спектре, отличном от спектра собственной флуоресценции биологических объектов (клетки, тканевые гомогенаты, компоненты крови и др.), а именно при длине волны возбуждения 390 нм, длине волны эмиссии 445 нм, в то время как собственная флуоресценция биологических объектов выявляется при длине волны возбуждения 400 нм, длине волны эмиссии 455 нм.
Раскрытие сущности изобретения
Способ получения производного окисленного декстрана, пригодного для его визуализации в сыворотке крови, включает проведение реакции окисленного декстрана с гидразидом акридонуксусной кислоты, используемым в качестве метки для его визуализации в сыворотке крови, при соотношении компонентов гидразид акридонуксусной кислоты - окисленный декстран 1:10 в пересчете на массу сухого вещества в течение 90 минут при температуре 80-90°С. Затем полученную суспензию фильтруют, охлаждают ее до комнатной температуры, добавляют липосомообразующий агент, выдерживают полученную липосомальную форму производного окисленного декстрана при температуре 4-6°С в течение не менее 24 часов, затем фильтруют ее с помощью микрофильтра. Окисленный декстран до проведения реакции с гидразидом акридонуксусной кислоты предварительно растворяют в дистиллированной воде до концентрации 1-2%. Липосомальную форму производного окисленного декстрана фильтруют не менее 5 раз с помощью микрофильтра с диаметром пор 0,45 мкм.
Для осуществления способа используют окисленный декстран молекулярной массы 40-60 кДа.
В качестве липосомоообразующего агента используют, например, фосфатидилхолин.
Полученную липосомальную форму производного окисленного декстрана хранят в холодильнике не более 14 дней. Для ее калибровки рассчитывают коэффициент флуоресценции в стандартной концентрации. Для этого полученную липосомальную форму производного окисленного декстрана разводят до стандартной суммарной концентрации сухих веществ 600 мкг/мл. Затем измеряют флуоресценцию ее образца на спектрофлуориметре, длина волны возбуждения 390 нм, длина волны эмиссии 445 нм. Коэффициент флуоресценции липосомальной формы производного окисленного декстрана в стандартном разведении 600 мкг/мл должен быть не менее 0,9 о.е.
Определяющим отличием предлагаемого способа от прототипа является то, что в качестве метки для визуализации в сыворотке крови используют гидразид акридонуксусной кислоты, что позволяет определять в крови содержание липосомальных форм окисленного декстрана и в перспективе открывает возможности исследования фармакокинетики коньюгатов липосомальных форм окисленного декстрана с лекарственными субстанциями.
Экспериментальным путем обнаружено, что именно совокупность предложенных существенных признаков способа позволяет получать целевой продукт высокого качества, обеспечивающий высокую точность определения содержания липосомальной формы производного окисленного декстрана в сыворотке крови при проведении флуоресцентного анализа. При понижении количества гидразида акридонуксусной кислоты в реакционной смеси и при уменьшении температуры и времени реакции понижается выход получения производного окисленного декстрана. При повышении количества гидразида акридонуксусной кислоты в реакционной смеси и при увеличении температуры и времени реакции выход заявленного производного окисленного декстрана не увеличивается.
Осуществление изобретения
Заявляемое изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Точную навеску окисленного декстрана со средней м.М. 40 к Да массой 1,0 г помещают в мерную колбу вместимостью 100 см3, добавляют 100 мл дистиллированной воды, выдерживают раствор до полного растворения навески, затем добавляют 0,1 г гидразида акридонуксусной кислоты, перемешивают, закрывают неплотно стеклянной пробкой и ставят на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. После чего суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор производного окисленного декстрана охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике в течение 24 часов для набухания фосфатидилхолина, после чего полученную липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,9 о.е.
Пример 2. Точную навеску окисленного декстрана со средней м.М. 40 кДа массой 2,0 г помещают в мерную колбу вместимостью 100 см3, добавляют 100 мл дистиллированной воды, выдерживают раствор до полного растворения навески, затем добавляют 0,2 г гидразида акридонуксусной кислоты, перемешивают, закрывают неплотно стеклянной пробкой и ставят на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. Затем суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике при температуре 5°С в течение 24 часов для набухания фосфатидилхолина, после чего липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы флуоресцентного производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,95 о.е.
Пример 3. Точную навеску окисленного декстрана со средней м.М. 60 кДа массой 1,0 г помещают в мерную колбу вместимостью 100 см3, добавляют 100 мл дистиллированной воды, выдерживают до полного растворения навески, затем добавляют 0,1 г гидразида акридонуксусной кислоты, перемешивают, закрывают неплотно стеклянной пробкой и ставить на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. После чего суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор производного окисленного декстрана охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике при температуре 5°С в течение 24 часов для набухания фосфатидилхолина, после чего липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы флуоресцентного производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,9 о.е.
Пример 4. Точную навеску окисленного декстрана со средней м.М. 60 кДа массой 2,0 г помещают в мерную колбу вместимостью 100 см, добавляют 100 мл дистиллированной воды, выдерживают до полного растворения навески, затем добавляют 0,2 г гидразида акридонуксусной кислоты перемешивают, закрывают неплотно стеклянной пробкой и ставят на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. После чего суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор производного окисленного декстрана охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике в течение 24 часов для набухания фосфатидилхолина, после чего липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы флуоресцентного производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,95 о.е.
Пример 5. Точную навеску окисленного декстрана со средней м.М. 60 кДа массой 1,0 г помещают в мерную колбу вместимостью 100 см3, добавляют 100 мл дистиллированной воды, выдерживают до полного растворения навески, затем добавляют 0,2 г гидразида акридонуксусной кислоты, перемешивают, закрывают неплотно стеклянной пробкой и ставят на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. После чего суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор производного окисленного декстрана охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике в течение 24 часов для набухания фосфатидилхолина, после чего липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,9 о.е.
Пример 6. Точную навеску окисленного декстрана со средней м.М. 40 кДа массой 2,0 г помещают в мерную колбу вместимостью 100 см, добавляют 100 мл дистиллированной воды, выдерживают до полного растворения навески, затем добавляют 0,1 г гидразида акридонуксусной кислоты, перемешивают, закрывают неплотно стеклянной пробкой и ставят на водяную баню при температуре 80-90°С на 90 минут, периодически перемешивая суспензию. Затем суспензию фильтруют через обеззоленные бумажные фильтры синяя лента. Полученный прозрачный раствор производного окисленного декстрана охлаждают до комнатной температуры и добавляют в него 1,0 г липосомообразующего компонента - фосфатидилхолина. Смесь выдерживают в холодильнике в течение 24 часов для набухания фосфатидилхолина, после чего липосомальную форму производного окисленного декстрана не менее 5 раз пропускают через микрофильтр с диаметром пор 0,45 мкм. Коэффициент флуоресценции полученной липосомальной формы производного окисленного декстрана в стандартном разведении 600 мкг/мл составляет 0,9 о.е.
Полученная по заявленному способу липосомальная форма производного окисленного декстрана позволяет исследовать ее фармакокинетику. В таблицах 1 и 2 представлены данные по сравнительному исследованию фар-макокинетики смеси нелипосомальных и липосомальных форм производного окисленного декстрана с м.М. 40 кДа по заявленному способу и биотинилированного производного окисленного декстрана по прототипу. Мышам внутрибрюшинно однократно вводили 0,5 мл тестируемого вещества в виде комбинированной эмульсии, содержащей 50% липосомальной и 50% нелипосомальной форм производного окисленного декстрана. Дозы эквивалентны по количеству производного окисленного декстрана и размеру липосом.
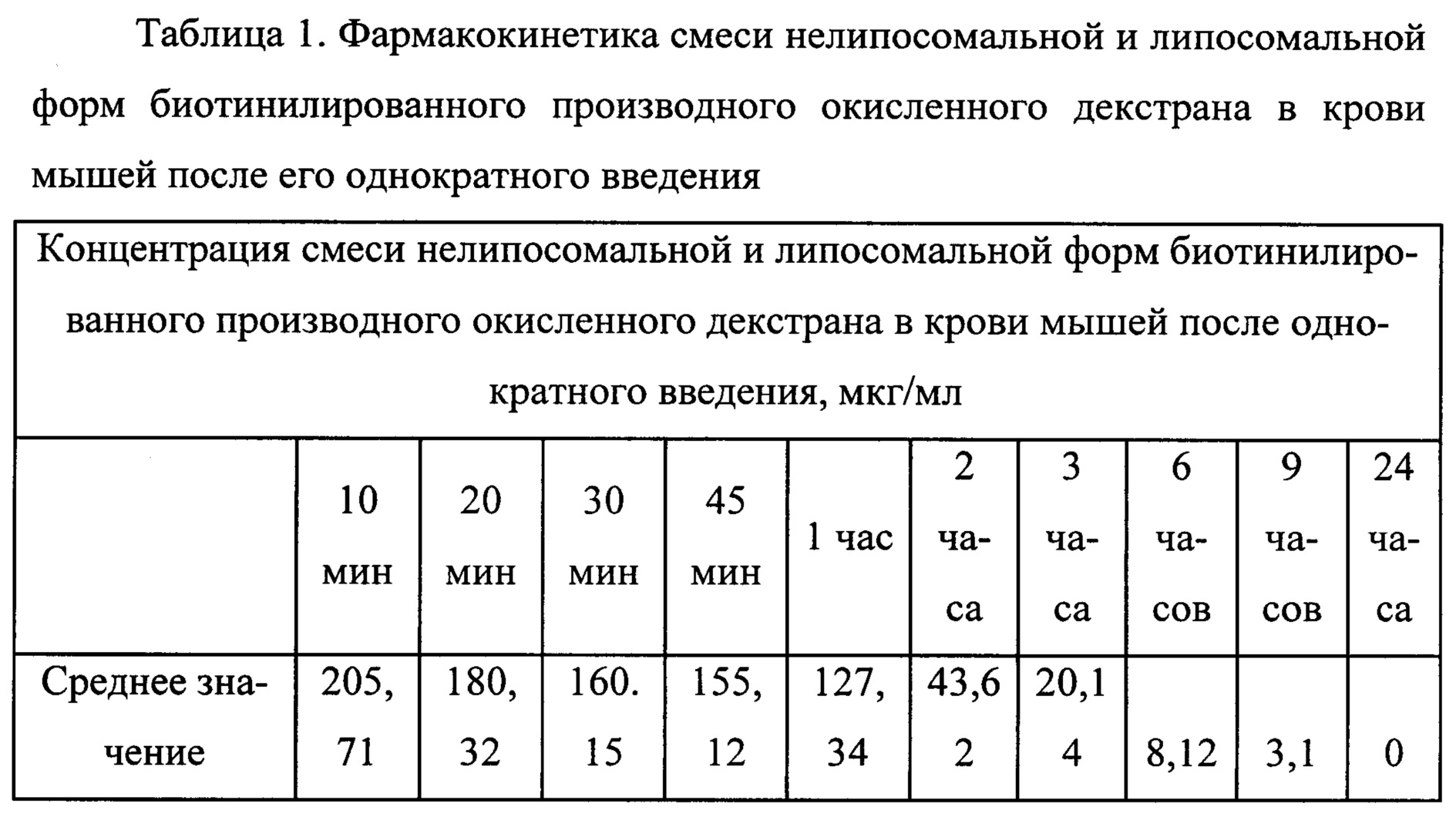
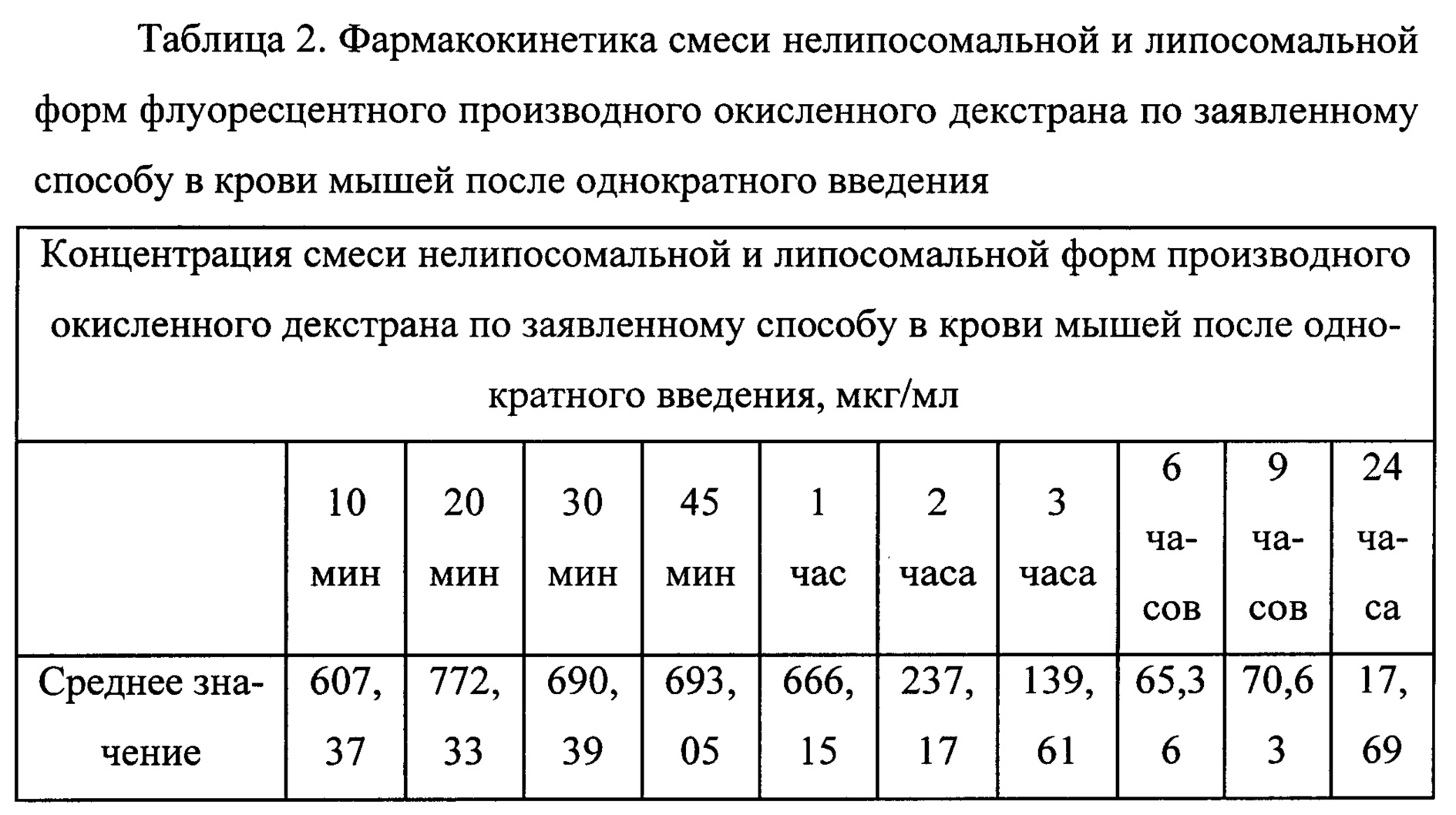
Как видно из данных, представленных в таблицах 1 и 2, концентрации смеси нелипосомальной и липосомальной форм биотинилированного производного окисленного декстрана имеют заниженные значения, так как биотинилированное производное окисленного декстрана, находящееся внутри липосом, за счет экранирующего эффекта липосомальной мембраны, не выявляется в условиях иммуноферментного анализа. При использовании смеси нелипосомальной и липосомальной форм производного окисленного декстрана по заявленному способу более высокие значения концентрации отражают суммарное содержание в крови обеих форм производного окисленного декстрана, включая липосомальную.
Таким образом, заявленный способ позволяет получить производное окисленного декстрана, которое может быть успешно использовано в липосомальной форме для определения его содержания в сыворотке крови при изучении его фармакокинетики.
Источники информации
1. Shimizu N, Kawazoe Y. - A new method for permeabilization of the plasma membrane of cultured mammalian cells. III. Internalization of fluorescent dextrans into cultured mammalian cells by vortex-stirring in the presence of high molecular weight polyacrylic acid. - Biol Pharm Bull. 1996 Aug; 19(8); 1023-5.
2. Shkurupii V.A., Arkhipov S.A., Troitskii A.V., Luzgina N.G., Zaikovskaja M.V., Gulyaeva E.P., Bystrova T.N., Ufimtseva E.G., Il'in D.A., Akhramenko E.S. In vitro effect of oxidizeg dextrans of peritoneal cells // Bulletin of Experimental Biology and Medicine, Supplement 1. - 2008. - P. 120-122.
3. Shkurupii V.A., Archipov S.A., Tkachev V.O., Troitskii A.V, Luzgina N.G., Zaikovskaya M.V.,. Gulyaeva E.P, Bystrova T.N., Ufimtseva E.G. In Vitro Effects of Molecular Nanosomal Hybrid Compositions with Oxidized Dextrans, Conjugated with Isonicotinic Acid Hydrazine on Peritoneal Macrophages // Bulletin of Experimental Biology and Medicine - 2008 - Vol. 146. - No. 5 - P. 627-629.
4. Шкурупий B.A., Селятицкая В.Г., Цырендоржиев Д.Д., Пальчикова Н.А., Курилин В.В., Травин М.А., Надев А.П., Троицкий А.В. Эффекты модифицированного амфотерицина В при системном кандидозе в эксперименте. // Бюллетень экспериментальной биологии и медицины. - 2007 - Т. 143. - №4 - С. 367-370.
5. Шкурупий В.А., Шаркова Т.В., Потапова О.В., Шестопалов A.M. Регенераторно-пластические процессы в печени млекопитающих при гриппе птиц A/H5N1 и его профилактике модифицированным декстраном. // IV Всероссийская научно-практическая конференция «Фундаментальные аспекты компенсаторно-приспособительных процессов». - Новосибирск, 2009. - С. 289.
6. Prigent-Richard S., Cansell М., Vassy J., Viron A., Puvion E., Jozefonvicz J., Letourneur D. - Fluorescent and radiolabeling of polysaccharides: Binding and internalization experiments on vascular cells. - J Biomed Mater Res, 1998, 40, 275-281.
7. Патент RU 2426545 «Способ получения флуоресцентных производных декстранов», опубл. 20.08.2011, МПК A61K 31/721, C08L 5/02, С07С 245/12, A61J 3/00.
8. Патент РФ №2537246 «Способ получения биотинилированного производного окисленного декстрана», опубл. 31.10.2014, МПК G01N 33/533, A61K 31/721.

