Результат интеллектуальной деятельности: Способ определения способности микобактерий туберкулеза к размножению в альвеолярных макрофагах пациентов, прошедших курс противотуберкулезной терапии
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности, фтизиатрии, и может быть использовано при оценке риска реактивации туберкулезного процесса у пациентов, прошедших курс противотуберкулезной терапии.
Известно, что до 80% случаев заболевания туберкулезом приходится на легочный туберкулез (1). Проникая в альвеолярный макрофаг в результате фагоцитоза, микобактерии туберкулеза М. tuberculosis могут блокировать созревание фагосомы и ее слияние с лизосомами, создавая благоприятную нишу для своего выживания и размножения (2-7). В результате исход взаимодействия между клеткой-хозяином и возбудителем туберкулеза зависит от функционального состояния и макрофага и микобактерии.
Важным биологическим признаком М. tuberculosis является их способность размножаться внутри клетки-хозяина (в основном альвеолярного макрофага), вызывая туберкулезное заболевание у человека. Проявление этого признака, характеризующего функциональное состояние М. tuberculosis, зависит как от генотипа возбудителя заболевания, так и от условий окружающей среды, в том числе от состояния иммунной системы организма человека, его способности сопротивляться развитию инфекции с возможностью нейтрализации патогена и остановки его размножения, а также от эффективности действия лекарственных средств (1, 8, 9). В настоящее время, несмотря на широкое распространение микобактерий с множественной лекарственной устойчивостью, химиотерапия туберкулеза занимает ведущее место в излечении большинства больных туберкулезом (8-10).
Важной остается проблема реактивации туберкулезного процесса у пациентов, прошедших курс противотуберкулезной терапии. Хотя механизмы реактивации изучаются (11), задача ее ранней диагностики не решена. Известно, что при благоприятном ходе терапии туберкулеза легких у человека чаще всего выделяют микобактерии со сниженной вирулентностью, не способные вызывать туберкулез у морских свинок (1, 8, 12). Остается неясным, способны ли такие микобактерии туберкулеза к реактивации размножения в организме пациента, прошедшего курс химиотерапии, в будущем. Для раннего выявления реактивации туберкулезного процесса на первый план выдвигается задача определения способности М. tuberculosis к размножению в клетках-хозяевах, что необходимо как для составления прогноза заболевания, так и для корректировки тактики лечения каждого больного на конкретном этапе терапии туберкулеза легких.
Известен способ определения способности М. tuberculosis к размножению in vitro, включающий забор образцов ткани легкого больного туберкулезом путем биопсии или из операционного материала, приготовление гомогената тканей легкого, посев его на специальные плотные питательные среды (например, среда Левенштейна-Йенсена) для культивирования микобактерий, определение количества колоний микобактерий, выросших на среде через 1-3 месяца, заключение о способности микобактерий к размножению (12). Недостатком известного способа является то, что он не позволяет определить насколько необратимым становится снижение способности микобактерий к размножению после лечения пациента, возможна ли в последующем реактивация размножения. Другим недостатком способа является длительность его осуществления (1-3 месяца). Кроме того, как известно, в организме человека микобактерии находятся либо внутри клеток-хозяев, либо располагаются в воспаленной и некротизированной ткани, то есть в условиях, существенно отличающихся от хорошо аэрируемых жидких или плотных питательных сред, используемых для выращивания микобактерий. Следовательно, способность М. tuberculosis к размножению в организме больного может существенно отличаться от наблюдаемой при длительном культивировании микобактерий на питательных средах in vitro.
Известен способ определения способности М. tuberculosis к размножению in vitro, включающий забор образцов ткани легкого больного туберкулезом из операционного материала, приготовление гомогената тканей легкого, посев его на специальные плотные питательные среды, культивирование микобактерий в течение 1-3 месяцев, выделение чистых культур М. tuberculosis, заражение ими культуры макрофагов, полученных из моноцитов крови здоровых доноров, культивирование в течение 4-7 дней, приготовление гомогенатов инфицированных клеток на определенных сроках инфекции, посев их на специальные плотные питательные среды для культивирования микобактерий, определение количества колоний микобактерий, выросших на среде через 1-3 месяца, заключение о способности микобактерий к размножению (13). Недостатком известного способа является то, что он не позволяет определить способность микобактерий к активации размножения. Другим недостатком способа является длительность его осуществления (3-6 месяцев). Кроме того, полученные данные о способности М. tuberculosis разных клинических изолятов к размножению при использовании для заражения клеток здоровых людей мало коррелируют с клинической картиной, наблюдающейся у пациентов, больных туберкулезом легких, на момент взятия материала (14). Это обусловлено тем, что длительное многомесячное проведение микобактерий через благоприятные условия хорошо аэрируемых плотных питательных сред, затем, клеточных культур макрофагов от здоровых доноров и вновь плотных питательных сред неизбежно влияет на функциональное состояние микобактерий и, в результате, искажает истинную картину способности микобактерий к размножению в альвеолярных макрофагах в организме определенного пациента на момент забора материала для исследования. Это подтверждается данными (15, 16), свидетельствующими о зависимости полученных результатов от многих параметров, связанных с инфицированием клеток: от использованных доноров для выделения у них моноцитов крови, от разных индукторов и времени дифференцировки моноцитов в макрофаги для их заражения, от разных доз микобактерий, использованных для инфицирования клеток.
Известен способ оценки вирулентности микобактерий туберкулеза у пациентов, прошедших курс противотуберкулезной терапии (17). Поскольку вирулентность микобактерий определяли по их способности к размножению, данный способ может быть принят в качестве ближайшего аналога (прототипа) в качестве способа определения способности микобактерий к размножению в альвеолярных макрофагах у указанных выше пациентов. Способ включает забор образцов ткани легкого из операционного материала, получение из него ex vivo культур альвеолярных макрофагов, культивирование клеток в течение 12-20 часов, фиксацию клеток на покровных стеклах, окрашивание клеток по методу Циля-Нильсена, после чего оценивают долю альвеолярных макрофагов, содержащих микобактерии, от общего числа альвеолярных макрофагов, наличие альвеолярных макрофагов, содержащих колонии размножающихся микобактерий без корд-морфологии роста, долю альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста от общего числа альвеолярных макрофагов, содержащих микобактерии; при доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов, отсутствии в них колоний размножающихся микобактерий делают заключение о невирулентности микобактерий (т.е. отсутствию способности к размножению) у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, менее 1% от общего числа альвеолярных макрофагов и наличии в них колоний размножающихся микобактерий, не содержащих корд-морфологии роста, делают заключение о слабой вирулентности микобактерий (слабой способности микобактерий к размножению) у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, от 1 до 10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста менее 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о средней вирулентности микобактерий (т.е. средней способности к размножению) у данных больных; при доле альвеолярных макрофагов, содержащих микобактерии, более 10% от общего числа альвеолярных макрофагов и доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий с корд-морфологией роста, более или равно 10% от общего числа альвеолярных макрофагов, содержащих микобактерии, делают заключение о высокой вирулентности микобактерий (т.е. высокой способности к размножению) у данных больных. Однако исследования авторов заявляемого изобретения показали, что при дальнейшем относительно непродолжительном культивировании альвеолярных макрофагов происходит разнонаправленное изменение первоначальных показателей способности микобактерий к размножению: в одних случаях высокие показатели снижаются, в других - низкие показатели повышаются, в третьих случаях остаются на неизменном уровне, что может свидетельствовать о разной эффективности лечения пациентов, когда снижение способности микобактерий к размножению в альвеолярных макрофагах у одних пациентов носит относительно необратимый характер, у других - временный с последующей активацией размножения, что в дальнейшем оказывает большое влияние на выбор тактики лечения. Таким образом, недостатком способа по прототипу является его недостаточная диагностическая значимость.
Задачей, на решение которой направлено изобретение, является повышение диагностической значимости способа.
Техническим результатом является определение ex vivo степени способности микобактерий к активации размножения в альвеолярных макрофагах пациентов, больных туберкулезом легких, прошедших курс противотуберкулезной терапии.
Решение поставленной задачи достигается тем, что дополнительно определяют способность микобактерий туберкулеза к размножению в альвеолярных макрофагах пациентов через 5-8 дней после начала культивирования, оценивают долю альвеолярных макрофагов, содержащих колонии размножающихся микобактерий от общего числа альвеолярных макрофагов, содержащих микобактерии; сравнивают данный показатель, полученный через 12-20 часов и 5-8 дней после начала культивирования; при повышении в процессе культивирования доли альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, равно или более чем на 10% делают заключение о высокой способности микобактерий к активации размножения в альвеолярных макрофагах пациента; при повышении данного показателя менее чем на 10% делают заключение о средней способности микобактерий к активации размножения в альвеолярных макрофагах пациента; при отсутствии в процессе культивирования изменений в доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, или при ее снижении делают заключение о низкой способности микобактерий к активации размножения.
Раскрытие изобретения
Способ определения способности микобактерий туберкулеза к размножению в альвеолярных макрофагах пациентов, прошедших курс противотуберкулезной терапии включает получение ex vivo культур клеток альвеолярных макрофагов из операционного материала больных туберкулезом легких, фиксацию клеток на покровных стеклах через 12-20 часов и 5-8 дней после начала культивирования, окраску клеток на покровных стеклах по методу Циля-Нильсена; затем оценивают долю альвеолярных макрофагов, содержащих колонии размножающихся микобактерий от общего числа альвеолярных макрофагов, содержащих микобактерии, сравнивают данный показатель, полученный через 12-20 часов после начала культивирования с показателем, полученным через 5-8 дней после начала культивирования; при повышении в процессе культивирования доли альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, равно или более чем на 10% делают заключение о высокой способности микобактерий к активации размножения в альвеолярных макрофагах пациента; при повышении данного показателя менее чем на 10% делают заключение о средней способности микобактерий к активации размножения в альвеолярных макрофагах пациента; при отсутствии в процессе культивирования изменений в доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, или при ее снижении делают заключение о низкой способности микобактерий к активации размножения.
Для получения ex vivo культур клеток альвеолярных макрофагов из операционного материала больных туберкулезом легких может быть использован способ по патенту РФ на изобретение №2593725 (17). Способ включает получение образцов ткани легкого из операционного материала (Фиг. 1-3), измельчение образца ткани легкого, проведение последующей гомогенизации измельченной ткани легкого с получением клеточной взвеси в физиологически приемлемом растворе. После осаждения клеток из клеточной взвеси путем центрифугирования при скорости 800-1200 об/мин в течение 4-5 мин. при комнатной температуре, их высаживают на покровные стекла в полной ростовой среде, например, DMEM/F12 с 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина в емкости для культивирования клеток, например, 24-луночные планшеты. Культивирование клеток осуществляют в течение 5-8 дней стандартно при температуре +37°C в атмосфере 5% СO2. Жизнеспособность альвеолярных макрофагов в течение указанного периода культивирования составляет 97-100% (Фиг. 4-6).
Все процедуры по получению ex vivo культур клеток выполняют с соблюдением норм стерильности в соответствии с санитарными правилами работы с патогенными биологическими объектами (18, 19).
Фиксацию клеток на покровных стеклах осуществляют через 12-20 часов и через 5-8 дней после начала культивирования. Для фиксации клеток используют 4%-й раствор формалина, приготовленного на фосфатно-солевом буфере (pН 7.4).
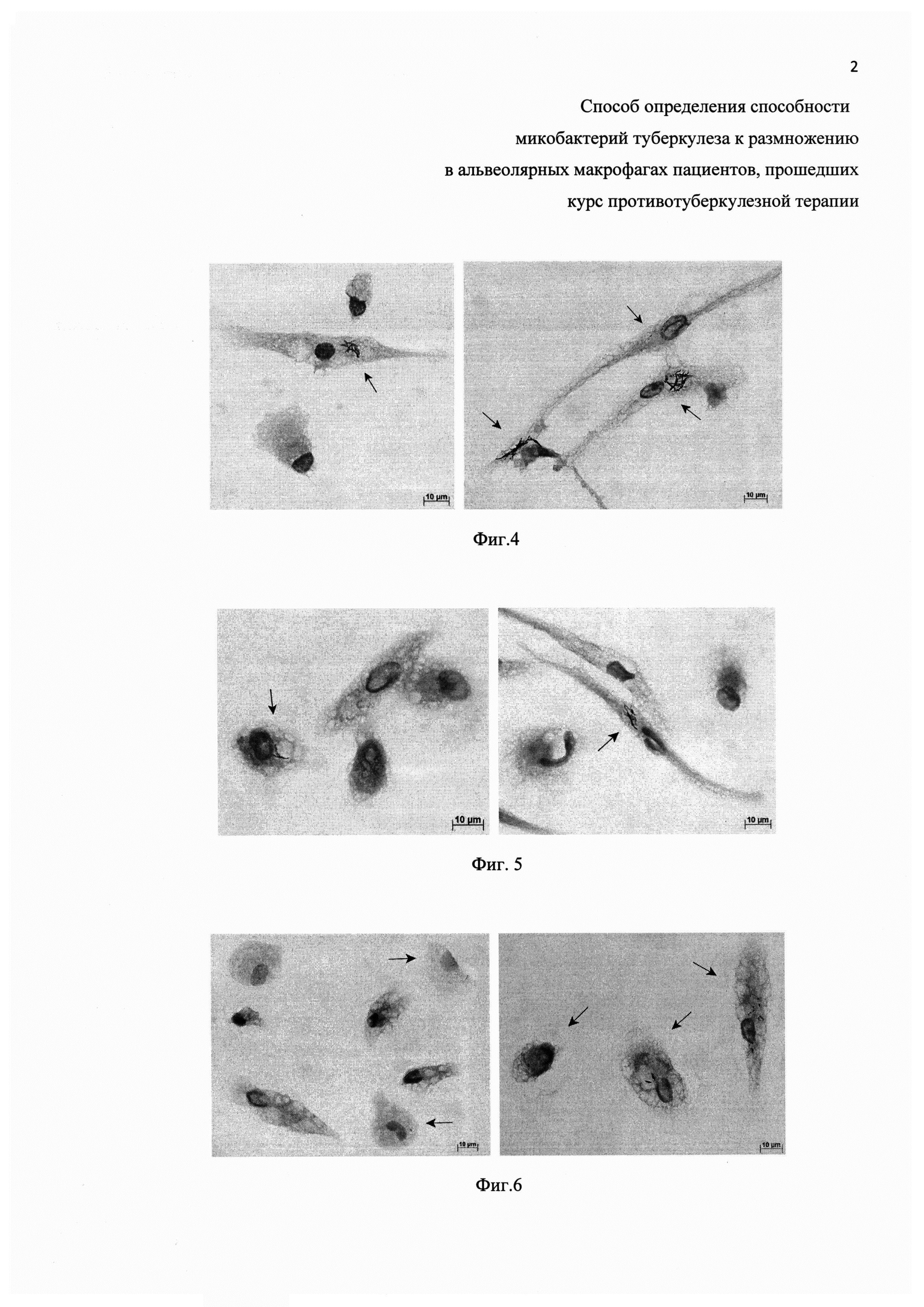
Для окраски клеток покровные стекла отмывают от фиксатора в фосфатно-солевом буферном растворе (pН 7.4) при комнатной температуре. Затем их окрашивают методом Циля-Нильсена (20) для идентификации кислотоустойчивых и, соответственно, жизнеспособных М. tuberculosis. Используют набор реагентов для окраски по методу Циля-Нильсена, например, производства ООО «Первая Лабораторная Компания» (Санкт-Петербург, Россия). В результате, М. tuberculosis с неповрежденной клеточной стенкой в альвеолярных макрофагах человека с туберкулезной инфекцией окрашиваются в красный цвет, ядра клеток-носителей возбудителя - в синий цвет, а их цитоплазма - в светло-голубой цвет (черно-белый вариант изображения с соответствующими обозначениями представлен на Фиг. 4-6).
Подсчет макрофагов, содержащих колонии микобактерий, производят под микроскопом.
В оптимальных условиях интервал удвоения М. tuberculosis составляет 22-24 ч. Следовательно, характеристики, получаемые при первичном анализе на 12-20 ч ex vivo культивирования, соответствуют содержанию микобактерий в макрофагах легких в организме пациента на момент оперативного вмешательства. При повторном тестировании макрофагов на 5-8 сутки ex vivo культивирования выявляемые характеристики соответствуют функциональному состоянию М. tuberculosis в клетках-хозяевах на фоне благоприятных условий в культуре клеток с отсутствием антимикобактериальных средств в культуральной среде и лимфоцитов в составе полученных культур (Таблицы 1 и 2). Сравнение полученных показателей позволяет сделать выводы о способности микобактерий к активации размножения в альвеолярных макрофагах прооперированных пациентов, прошедших курс противотуберкулезной терапии (Таблица 3). Для осуществления способа достаточно 5-8 дней.
Заключения, полученные по заявленному способу, имеют большое значение для индивидуальных пациентов в послеоперационный период для корректировки схем лечения с целью повышения его эффективности (21-22), а также могут быть использованы для контроля за эпидемиологически опасными формами туберкулезного заболевания (1, 4, 5, 10, 23, 24).
Перечень фигур, чертежей и иных материалов
Фиг. 1. Вырезание кусочка ткани по краю каверны (правая панель) из удаленного в ходе операции сегмента легкого пациента №6 (левая панель) для последующего получения ex vivo культур альвеолярных макрофагов.
Фиг. 2. Вырезание кусочка ткани (правая панель) из удаленной в ходе операции доли легкого пациента №9 (левая панель) для последующего получения ex vivo культур альвеолярных макрофагов.
Фиг. 3. Вырезание кусочка ткани (правая панель) из удаленного в ходе операции сегмента легкого пациента №19 (левая панель) для последующего получения ex vivo культур альвеолярных макрофагов.
Фиг. 4. Примеры культуры клеток, полученной из операционного материала легкого пациента №6 на первые (левая панель) и шестые (правая панель) сутки культивирования ex vivo. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 5. Примеры культуры клеток, полученной из операционного материала легкого пациента №8 на первые (левая панель) и шестые (правая панель) сутки культивирования ex vivo. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 6. Примеры культуры клеток, полученной из операционного материала легкого пациента №9 на первые (левая панель) и пятые (правая панель) сутки культивирования ех vivo. Окраска по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Таблица 1. Характеристика пациентов - доноров операционного материала.
Таблица 2. Состав ex vivo клеточных культур, полученных из операционного материала легких пациентов, больных туберкулезом.
Таблица 3. Сравнительные показатели способности микобактерий к размножению через 12-20 часов и 5-8 дней ex vivo культивирования альвеолярных макрофагов.
Осуществление изобретения
Результаты анализа по заявленному способу ex vivo культур альвеолярных макрофагов, полученных из послеоперационного материала двадцати одного пациента, прошедшего курс противотуберкулезной терапии, через 12-20 ч и 5-8 дней после начала культивирования представлены в таблице 3. Таблица содержит данные о доле альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, оценку характера ее изменений, а также заключение о способности М. tuberculosis к активации размножения в альвеолярных макрофагах у конкретного пациента. Результаты заключения по заявленному способу сопоставляли с результатами анализа по методу биологической пробы при заражении морских свинок гомогенатом тканей резецированного легкого этого пациента и клиническими данными пациентов в послеоперационный период, отражающими наличие или отсутствие активного туберкулезного процесса.
Пример 1. Пациент №6 (38 лет) с фиброзно-кавернозным туберкулезом сегмента 6 правого легкого с обсеменением верхней доли (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме пиразинамида, этамбутола, протионамида, капреомицина, циклосерина. В ходе оперативного вмешательства были удалены сегменты С2 и С6 правого легкого (Фиг. 1). Оценку способности М. tuberculosis к активации размножения в альвеолярных макрофагах пациента №6 с использованием полученных ex vivo культур альвеолярных макрофагов осуществляют согласно заявленному способу. Ex vivo культуру альвеолярных макрофагов, полученную из операционного материала пациента №6, фиксировали на покровных стеклах через 12 часов и 6 дней после начала культивирования (Фиг. 4). Для фиксации клеток на покровных стеклах в лунки планшета для культивирования клеток на 10 мин приливали по 1 мл 4% раствора формалина, приготовленного на фосфатно-солевом буфере (pН 7.4). Затем раствор формалина удаляли из каждой лунки.
Для окраски клеток покровные стекла отмывали от фиксатора в 4 мл фосфатно-солевого буфера (pH 7.4) в течение 10 мин при комнатной температуре. Затем их окрашивали методом Циля-Нильсена (20) для идентификации кислотоустойчивых микобактерий. Использовали набор реагентов для окраски по методу Циля-Нильсена производства ООО «Первая Лабораторная Компания» (Санкт-Петербург, Россия).
По результатам цитологического анализа согласно заявленному способу установлено, что доля альвеолярных макрофагов, содержащих колонии размножающихся М. tuberculosis, от общего числа альвеолярных макрофагов, содержащих микобактерий, для пациента №6 составила 72% через 12 ч и увеличилась на 14% через 6 дней после начала культивирования альвеолярных макрофагов. Сделано заключение о высокой способности М. tuberculosis у данного пациента к активации размножения в альвеолярных макрофагах, что позволяет сделать неблагоприятный прогноз течения заболевания пациента на данном этапе.
В анализе по методу биологической пробы (23) при заражении морских свинок гомогенатом тканей резецированного легкого этого пациента наблюдали скоротечное развитие туберкулезного процесса у животных с их гибелью задолго до окончания эксперимента. Патоморфологическое и гистологическое исследование органов павших морских свинок выявило наличие некротических туберкулезных очагов в тканях нескольких органов: легких, печени и селезенки животных. Следовательно, в проведенном эксперименте подтверждена способность микобактерий - возбудителей заболевания пациента №6 к быстрому размножению в органах и тканях инфицированных животных, закончившемуся летальным исходом задолго до планового окончания эксперимента. Однако для осуществления указанной биологической пробы потребовалось более 2 месяцев после проведенной операции.
При патоморфологическом исследовании тканей удаленного в ходе операции легкого пациента №6 по линии резекции органа не было обнаружено признаков туберкулезного заболевания. Однако в течение первого послеоперационного месяца на фоне продолжения противотуберкулезной терапии было клинически установлено прогрессирование туберкулезного процесса у этого пациента в виде появления бронхоплеврального свища и туберкулезной эмпиемы плевральной полости. Следовательно, выше приведенные данные подтверждают сделанное уже через 6 дней после операции заключение по заявленному способу о высокой способности микобактерий к активации размножения в альвеолярных макрофагах пациента №6.
Пример 2. Пациент №10 (45 лет) с фиброзно-кавернозным туберкулезом правого легкого, удаленного в результате операции.
Ex vivo культуру альвеолярных макрофагов, полученную из операционного материала пациента №10, фиксировали на покровных стеклах через 16 часов и 6 дней после начала культивирования. Оценку способности М. tuberculosis к активации размножения в альвеолярных макрофагах осуществляли согласно способу, описанному выше.
По результатам анализа по заявленному способу установлено, что через 6 дней культивирования альвеолярных макрофагов из операционного материала пациента доля альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерий, увеличилась с 40% до 67%, т.е. на 27%. Сделано заключение о высокой способности М. tuberculosis у данного пациента к активации размножения в альвеолярных макрофагах.
В анализе по методу биологической пробы при заражении морских свинок гомогенатом тканей резецированного легкого этого пациента наблюдали постепенное развитие туберкулезного процесса у животных в течение эксперимента. Плановое патоморфологическое и гистологическое исследование органов морских свинок через 3 месяца после начала эксперимента выявило наличие некротических туберкулезных очагов в тканях нескольких органов: легких, печени и селезенки животных. Следовательно, в проведенном эксперименте подтверждена способность микобактерий - возбудителей заболевания пациента №10 к размножению в органах и тканях животных, достаточная для развития у морских свинок туберкулезного процесса.
При патоморфологическом исследовании тканей удаленного в ходе операции легкого пациента №10 по линии резекции органа не выявили признаков туберкулезного поражения. Однако, в течение двух месяцев после оперативного вмешательства на фоне проводимой противотуберкулезной терапии клинически было обнаружено прогрессирование туберкулезного заболевания у этого пациента в виде появления бронхоплеврального свища, туберкулезной эмпиемы плевральной полости и наличия кислотоустойчивых микобактерий в мазках мокроты. Приведенные данные подтверждают сделанное в более ранние сроки заключение по заявленному способу о высокой способности микобактерий к активации размножения в альвеолярных макрофагах пациента №10. Это позволяет более оперативно вносить корректировку в дальнейшую схему противотуберкулезной терапии.
Пример 3. Пациент №19 (36 лет) с множественными туберкулемами верхней доли правого легкого. В ходе оперативного вмешательства были удалены сегменты С1 и С2 правого легкого (Фиг. 3).
Ex vivo культуру альвеолярных макрофагов, полученную из операционного материала пациента №19, фиксировали на покровных стеклах через 18 часов и 5 дней после начала культивирования. Оценку способности М. tuberculosis к активации размножения в альвеолярных макрофагах осуществляли согласно способу, описанному выше.
По результатам цитологического анализа согласно заявленному способу установлено, что у пациента №19 через 5 дней культивирования клеток наблюдали снижение доли альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерии, с 60% до 29%, т.е. на 31%. Сделано заключение о низкой способности М. tuberculosis у данного пациента к активации размножения в альвеолярных макрофагах.
В анализе по методу биологической пробы при заражении морских свинок гомогенатом тканей резецированного легкого этого пациента, содержавшим достаточное количество кислотоустойчивых микобактерий для успешного инфицирования этих животных, не наблюдали развития туберкулезного заболевания у морских свинок в течение всего эксперимента (3 месяца). Патоморфологическое и гистологическое исследование органов животных, проведенное после планового окончания эксперимента, не выявило признаков туберкулезного поражения в органах и тканях на гистологических срезах. Следовательно, в проведенном эксперименте продемонстрирована неспособность микобактерий - возбудителей заболевания пациента №19 к размножению в органах и тканях морских свинок.
При патоморфологическом исследовании тканей, удаленных в ходе операции сегментов легкого пациента №19, по линии резекции не выявили признаков туберкулезного поражения. Проведенная послеоперационная терапия пациента №19 характеризовалась благоприятной динамикой излечения туберкулезного заболевания.
Приведенные данные биологической пробы при заражении морских свинок, результаты патоморфологического исследования тканей удаленных сегментов легкого пациента подтверждают заключение согласно заявленному способу о низкой способности микобактерий к активации размножения в альвеолярных макрофагах пациента №19 и указывают на благоприятный прогноз исхода заболевания.
Пример №4. Пациент №18 (28 лет) с туберкулемами верхней доли левого легкого. В ходе оперативного вмешательства были удалены сегменты С1 и С2 левого легкого.
Ex vivo культуру альвеолярных макрофагов, полученную из операционного материала больного №18, фиксировали на покровных стеклах через 20 часов и 8 дней после начала культивирования. Оценку способности М. tuberculosis к активации размножения в альвеолярных макрофагах осуществляли согласно способу, описанному выше.
По результатам цитологического анализа установлено увеличение через 8 дней доли альвеолярных макрофагов, содержащих колонии размножающихся микобактерий, от общего числа альвеолярных макрофагов, содержащих микобактерий, с 33% до 42%, т.е. на 9%. Сделано заключение о средней способности М. tuberculosis у данного пациента к активации размножения в альвеолярных макрофагах.
В анализе по методу биологической пробы при заражении морских свинок гомогенатом тканей резецированного легкого этого пациента наблюдали признаки развития туберкулезного заболевания у животных в течение трех месяцев эксперимента. Патоморфологическое и гистологическое исследование органов морских свинок, проведенное после окончания эксперимента, выявило наличие на гистологических срезах единичных очагов туберкулезных инфильтратов мононуклеарных клеток без некроза только в тканях легких с отсутствием признаков туберкулезного поражения в тканях печени и селезенки животных. Следовательно, в проведенном эксперименте подтверждена умеренная способность микобактерий - возбудителей заболевания пациента №18 к размножению в органах и тканях инфицированных животных.
При патоморфологическом исследовании тканей удаленных в ходе операции сегментов легкого пациента №18 по линии резекции органа обнаружили туберкулезный фиброзно-казеозный очаг. Тем не менее, в послеоперационный период на фоне принимаемой противотуберкулезной терапии у пациента №18 клинически не было выявлено активации туберкулезного процесса. Несмотря на это, приведенные данные по результатам биологической пробы на морских свинках подтверждают заключение по заявленному способу о средней способности микобактерий к активации размножения в альвеолярных макрофагах пациента №18. Это может свидетельствовать о риске реактивации туберкулезного процесса у пациента №18, что требует своевременной корректировки схем противотуберкулезной терапии в послеоперационный период.
Список литературы
1. World Health Organization. Global tuberculosis report 2014. Geneva. Switzerland: WHO, 2014. www.who.int/tb/publications/global_report/en/;
2. S.D. Lawn, A. Zumla. Tuberculosis. Lancet, 2011, vol. 378, no. 1, 57-72;
3. Фтизиатрия. Национальное руководство. Под ред. М.И. Перельмана. М.: ГЭОТАР-Медиа, 2007, 512 с.;
4. I. Smith. Mycobacterium tuberculosis pathogenesis and molecular determinants of virulence. Clinical Microbiology Reviews, 2003, vol. 16, no. 3, 463-496;
5. A.A. Прозоров, И.А. Федорова, О.Б. Беккер, В.Н. Даниленко. Факторы вирулентности Mycobacterium tuberculosis: генетический контроль, новые концепции. Генетика, 2014, том 50, №8, 885-908;
6. G. Weiss, U.S. Schaible. Macrophage defense mechanisms against intracellular bacteria. Immunological Reviews, 2015, vol. 264, no. 1, 182-203;
7. Z. Hmama, S.  , S. Josehp, Y. Av-Gay. Immunoevasion and immunosuppression of the macrophage by Mycobacterium tuberculosis. Immunological Reviews, 2015, vol. 264, no. 1, 220-232;
, S. Josehp, Y. Av-Gay. Immunoevasion and immunosuppression of the macrophage by Mycobacterium tuberculosis. Immunological Reviews, 2015, vol. 264, no. 1, 220-232;
8. C.N. Cheallaigh, C.P. de Castro, M.M. Coleman, J.C. Hope, J. Harris. Macrophages and tuberculosis. In: Handbook of macrophages. Ed.: R. Takahashi, H. Kai, Nova Science Publishers, 2012, 1-41;
9. G. Xu, J. Wang, G.F. Gao, C.H. Liu. Insights into battles between Mycobacterium tuberculosis and macrophages. Protein & Cell, 2014, vol. 5, no. 10, 728-736.
10. Клеточная биология легких в норме и при патологии: Руководство для врачей. Под ред. В.В. Ерохина, Л.К. Романовой. М.: Медицина, 2000, 496 с.;
11. Hunter R.L., Jagannath С, Actor J.K. Pathology of postprimary tuberculosis in humans and mice: contradiction of long-held beliefs // Tuberculosis (Edinb). 2007. Vol.87. No. 4. P. 267-78.
12. Туберкулез. Патогенез, защита, контроль. Под ред. Б.Р. Блума. М.: Медицина, 2002, 696 с.;
13. Q. Li, С.С. Whalen, J.M. Albert, R. Larkin, L. Zukowski, M.D. Cave, R.F. Silver. Differences in rate and variability of intracellular growth of a panel of Mycobacterium tuberculosis clinical isolates within a human monocyte model. Infection and Immunity, 2002, vol. 70, no. 11, 6489-6493.
14. S.A. Theus, M.D. Cave, K. Eisenach, J. Walrath, H. Lee, W. Mackay, C. Whalen, R.F. Silver. Differences in the growth of paired Ugandan isolates of Mycobacterium tuberculosis within human mononuclear phagocytes correlate with epidemiological evidence of strain virulence. Infection and Immunity, 2006, vol. 74, no. 12, 6865-6876.
15. E.G. Hoal-van Helden, D. Hon, L.A. Lewis, N. Beyers, P.D. van Helden. Mycobacterial growth in human macrophages: variation according to donor, inoculum and bacterial strain.. Cell Biology International, 2001, vol. 25, no. 1, 71-81.
16. O.M. Rivero-Lezcano. In vitro infection of human cells with Mycobacterium tuberculosis. Tuberculosis, 2013, vol. 93, no. 2, 123-129.
17. Патент на изобретение РФ №2593725 Способ получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких и способ оценки вирулентности Mycobacterium tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов. Дата публикации 10.08.2016, Бюлл. №22. МПК C12N 5/0786, C12Q 1/02, C12R 1/32.
18. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогености (опасности) и возбудителями паразитарных болезней». Утверждены постановлением Главного государственного санитарного врача от 28 января 2008 года №4, Бюллетень нормативных актов федеральных органов исполнительной власти, №19, 12.05.08. www.niiot.ru/doc/bank00/doc253/doc.htm
19. СП 2.1. 7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». Утверждены постановлением Главного государственного санитарного врача от 09 декабря 2010 года №163, Бюллетень нормативных актов федеральных органов исполнительной власти, №13, 28.03.11. www.medothod.ru/medicinskie-othody-SANPIN
20. Гольдберг Е.Д., Дыгай A.M. Шахов В.П. Методы культуры ткани в гематологии. Томск, Изд-во Томского университета, 1992, стр. 77.
21. R.S. Wallis, R. Hafner. Advancing host-directed therapy for tuberculosis. Nature Reviews Immunology, 2015, vol. 15, no. 4, 255-263;
22. A. Zumla, M. Rao, S.K. Parida, S. Keshavjee, G. Cassell, R. Wallis, R. Axelsson-Robertsson, M. Doherty, J. Andersson, M. Maeurer. Inflammation and tuberculosis: host-directed therapies. Journal of Internal Medicine, 2015, vol. 277, no. 3, 373-387.
23. Ю.К. Вейсфейлер. Биология и изменчивость микобактерий туберкулеза и атипичные микобактерии. Будапешт: Издательство Академии наук Венгрии, 1975, 335 с;
24. Туберкулез. Патогенез, защита, контроль. Под ред. Б.Р. Блума. М.: Медицина, 2002, 696 с.