Результат интеллектуальной деятельности: Способ получения 2,2,5,5-тетраэтил-3-карбоксипирролидин-1-оксила
Вид РИД
Изобретение
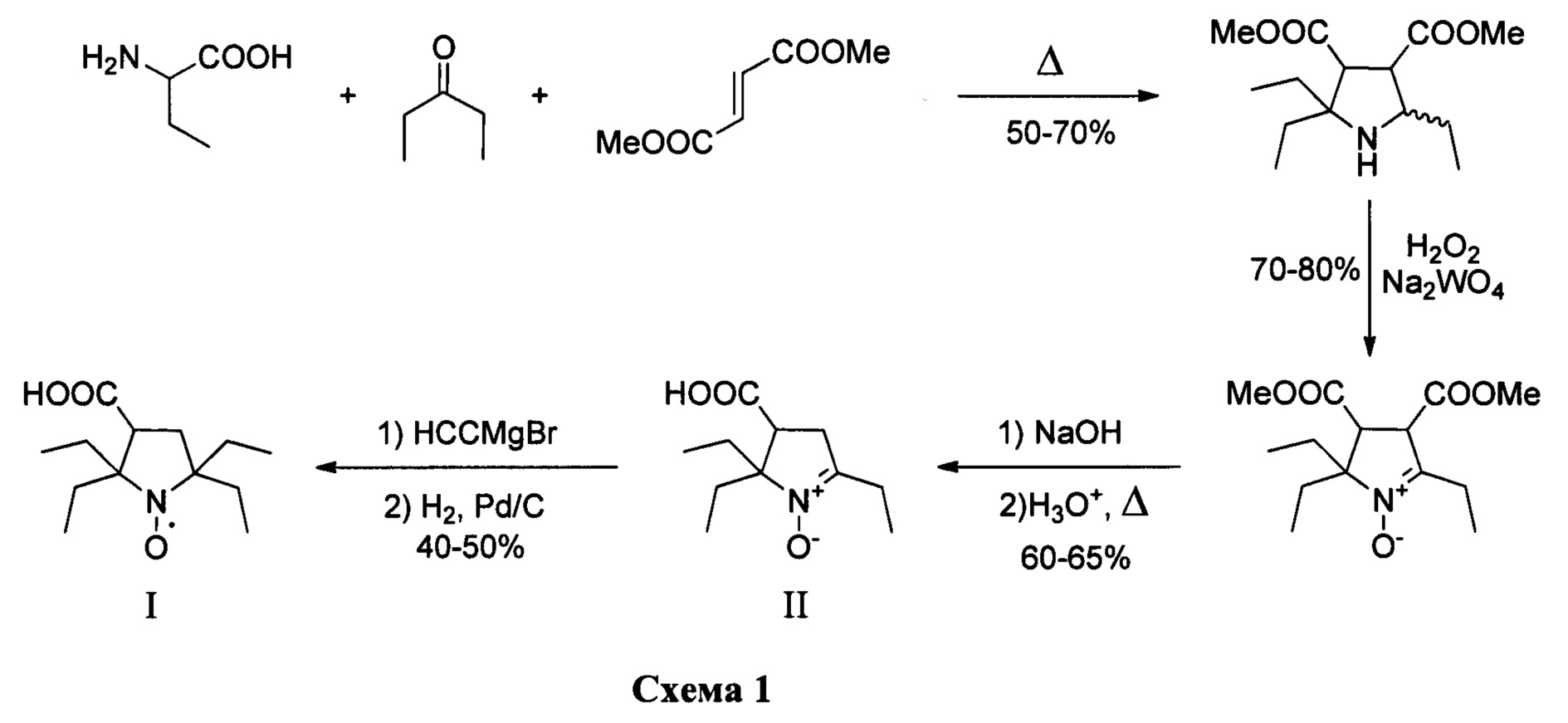
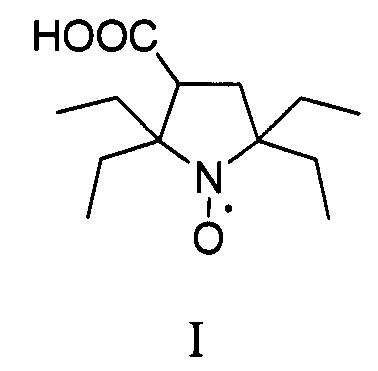
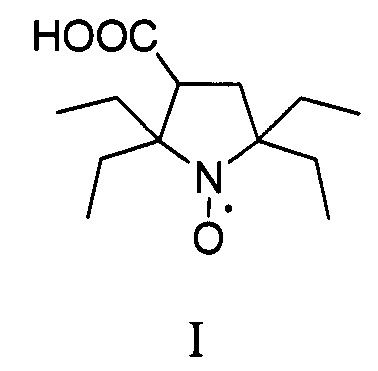
Изобретение относится к органической химии и медицине, а именно к способу синтеза 2,2,5,5-тетраэтил-3-карбоксипирролидин-1-оксила, формулы I в два этапа.
Нитроксильные радикалы уже давно рассматриваются в качестве потенциальных контрастных агентов для магниторезонансной томографии, как в виде малых молекул моно радикалов [Rosen G.М. 2, 2, 5, 5-Tetrasubstituted-pyrrolidine-1-oxyl compounds useful as MRI agents: пат. 5256397 США. - 1993.], так и в виде полирадикальных частиц [Rosen G.М. Use of dendrimers polyl-functionalized with nitroxide groups as contrast enhancing agents in MRI imaging of joints and injectable compositions comprising them: пат. 6991778 США. - 2006.; Rosen G.M. DAB-4 linked nitroxide citrate, useful as MRI contrast agent: пат. 9943613 США. - 2018.], где нитроксильные радикалы выступают в виде парамагнитных блоков, пришитых к полимерной основе, или в виде эмульсий.
В последнее время предпочтения в выборе радикалов отдают нитроксильным радикалам пирролидинового ряда с заместителями во 2 и 5 положении гетероцикла большими чем метил, которые отличаются исключительной устойчивостью в живых системах [Rajca A. et al. Organic radical contrast agents for magnetic resonance imaging // Journal of the American Chemical Society. - 2012. - T. 134. - №.38. - C. 15724-15727.; Nguyen H.V.T. et al. Nitroxide-based macromolecular contrast agents with unprecedented transverse relaxivity and stability for magnetic resonance imaging of tumors //ACS central science. - 2017. - T. 3. - №. 7. - C. 800-811.; Sowers M.A. et al. Redox-responsive branched-bottlebrush polymers for in vivo MRI and fluorescence imaging //Nature communications. - 2014. - T. 5. - C. 5460]. Одним из рекордсменов по устойчивости в живых системах является 2,2,5,5-тетраэтил-3-карбоксипирролидин-1-оксил [Jagtap А.P. et al. Sterically shielded spin labels for in-cell EPR spectroscopy: analysis of stability in reducing environment //Free radical research. - 2015. - T. 49. - №. 1. - C. 78-85.], синтез которого значительно упрощается в этом изобретении.
В литературе известен только один способ синтеза 2,2,5,5-тетраэтил-3-карбоксипирролидин 1-оксила (I) с использованием бромирования 2,2,6,6-тетраэтилпиперидин-4-он 1-оксила (IV) с последующим сужением цикла через перегруппировку Фаворского, с выходом целевого нитроксильного радикала (I) не превышающим 30% [Paletta J.Т. et al. Synthesis and reduction kinetics of sterically shielded pyrrolidine nitroxides //Organic letters. - 2012. - T. 14. - №. 20. - C. 5322-5325.].
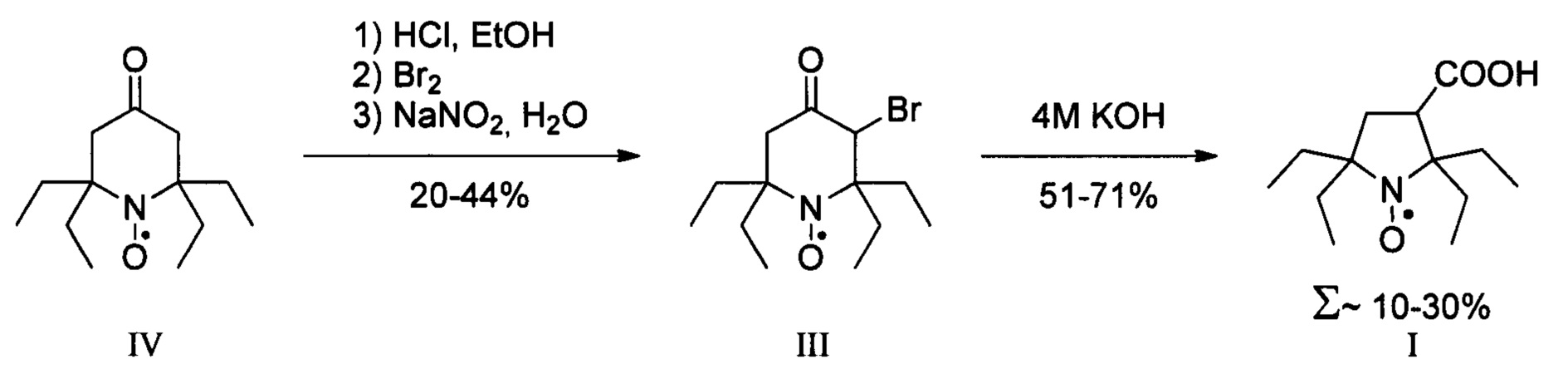
Однако сам 2,2,6,6-тетраэтилпиперидин-4-он 1-оксил (IV) не является коммерчески доступным соединением и требует предварительного получения. Всего известно три принципиально различающихся подхода к его синтезу.
Первый заключается в конденсации тетраэтильного аналога ацетонина (VI) с диэтилкетоном, с последующим окислением амина (V) перекисью водорода в присутствии вольфрамата натрия. В свою очередь тетраэтильный аналог ацетонина (VI) синтезируется с выходом 50% в 4 стадии из 1,1-диэтилэтилена (VII), который хоть и коммерчески доступен, но весьма недешев. Суммарный же выход 2,2,6,6-тетраэтилпиперидин-4-он 1-оксила (IV) не превышает 17%, что дает чуть более 5% выход целевого 2,2,5,5-тетраэтил-3-карбоксипирролидин 1-оксила (I) [Schulte Т. et al. Nitroxide-mediated polymerization of N-isopropylacrylamide: Electrospray ionization mass spectrometry, matrix-assisted laser desorption ionization mass spectrometry, and multiple-angle laser light scattering studies on nitroxide-terminated poly-N-isopropylacrylamides // Macromolecules. - 2005. - T. 38. - №. 16. - C. 6833-6840.]
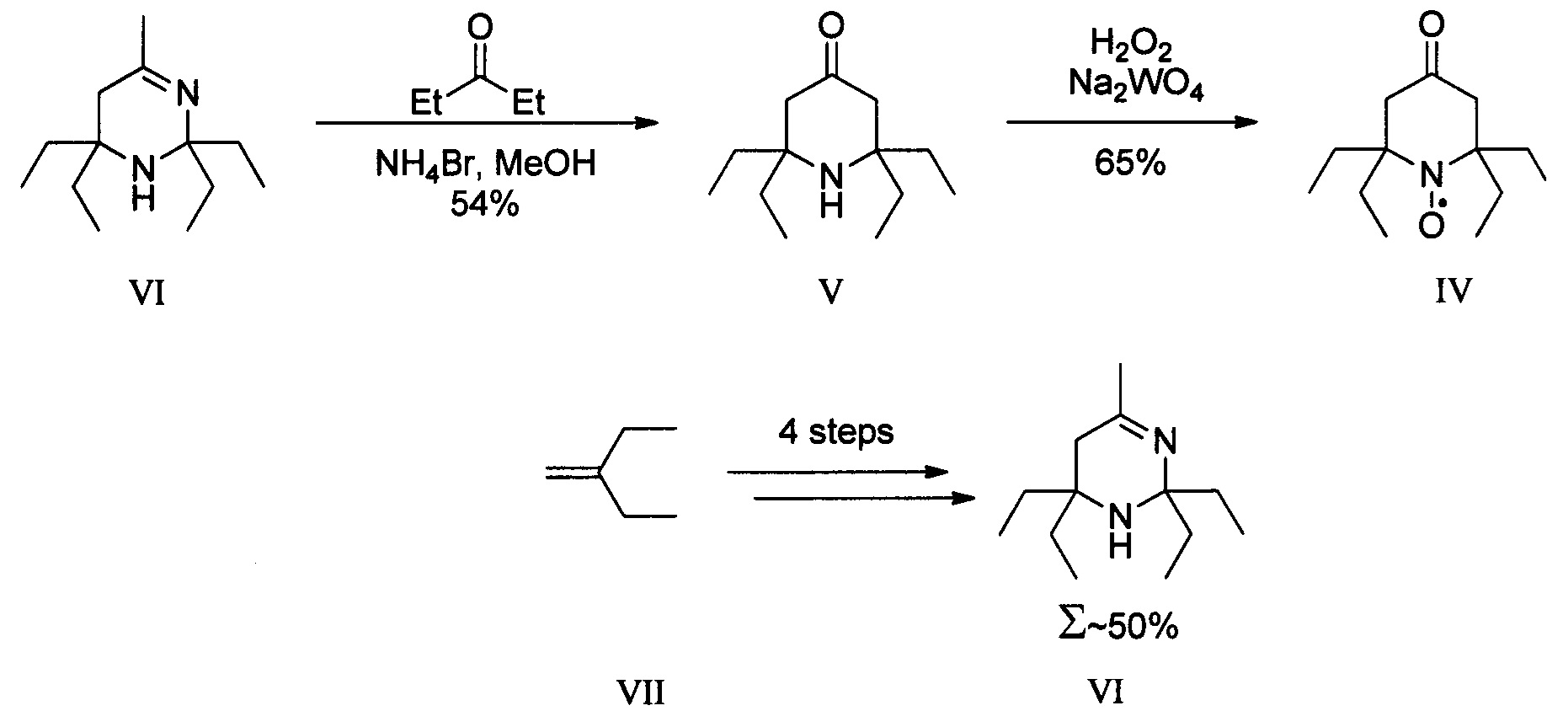
Второй способ основан на конденсации тетраэтильного аналога форона (VIII)c хлористым аммонием с образованием 2,2,6,6-тетраэтилпиперидин-4-она (V), последующее окисление которого приводит к 2,2,6,6-тетраэтилпиперидин-4-он 1-оксилу (IV) с выходом 35%). Тетраэтильный аналог форона (VIII) получают в четыре стадии из пропаргилбромида и диэтилкетона с выходом 43%, что дает 2,2,6,6-тетраэтилпиперидин-4-он 1-оксил (IV) и 2,2,5,5-тетраэтил-3-карбоксипирролидин 1-оксил (I) с суммарным выходом 15% и 4% соответственно [Wang X. et al. Synthesis of 15N-labeled 4-oxo-2,2,6,6-tetraethylpiperidine nitroxide for EPR brain imaging // Tetrahedron Letters. - 2014. - T. 55. - №. 13. - C. 2146-2149.].

Третий подход заключается в конденсации 2,3,5,6-тетрагидротиопиран-4-она (IX) с ацетонином (X) или 1,2,2,6,6-пентаметилпиперидин-4-оном (XI) в присутствии хлористого аммония с образованием 3,11-дитиа-7-азадиспиро[5.1.5.3]гескадекан-15-она (XII), который затем различными способами с вовлечением процессов десульфирования и окисления превращают в 2,2,6,6-тетраэтилпиперидин-4-он 1-оксил (IV) с суммарным выходом не превышающим 30% исходя из 2,3,5,6-тетрагидротиопиран-4-она (IX), что даст суммарный выход целевого 2,2,5,5-тетраэтил-3-карбоксипирролидин 1-оксила (I) около 9%. До настоящего момента этот подход считался самым эффективным способом синтеза 2,2,5,5-тетраэтил-3-карбоксипирролидин 1-оксила (I), что однако нивелируется высокой стоимостью 2,3,5,6-тетрагидротиопиран-4-она. [Kinoshita Y. et al. Development of novel nitroxyl radicals for controlling reactivity with ascorbic acid // Free radical research. - 2009. - T. 43. - №. 6. - C. 565-571.; Sakai K. et al. Effective 2, 6-substitution of piperidine nitroxyl radical by carbonyl compound // Tetrahedron. - 2010. - T. 66. - №. 13. - C. 2311-2315.; Paletta J.T. et al. Synthesis and reduction kinetics of sterically shielded pyrrolidine nitroxides // Organic letters. - 2012. - T. 14. - №. 20. - C. 5322-5325].
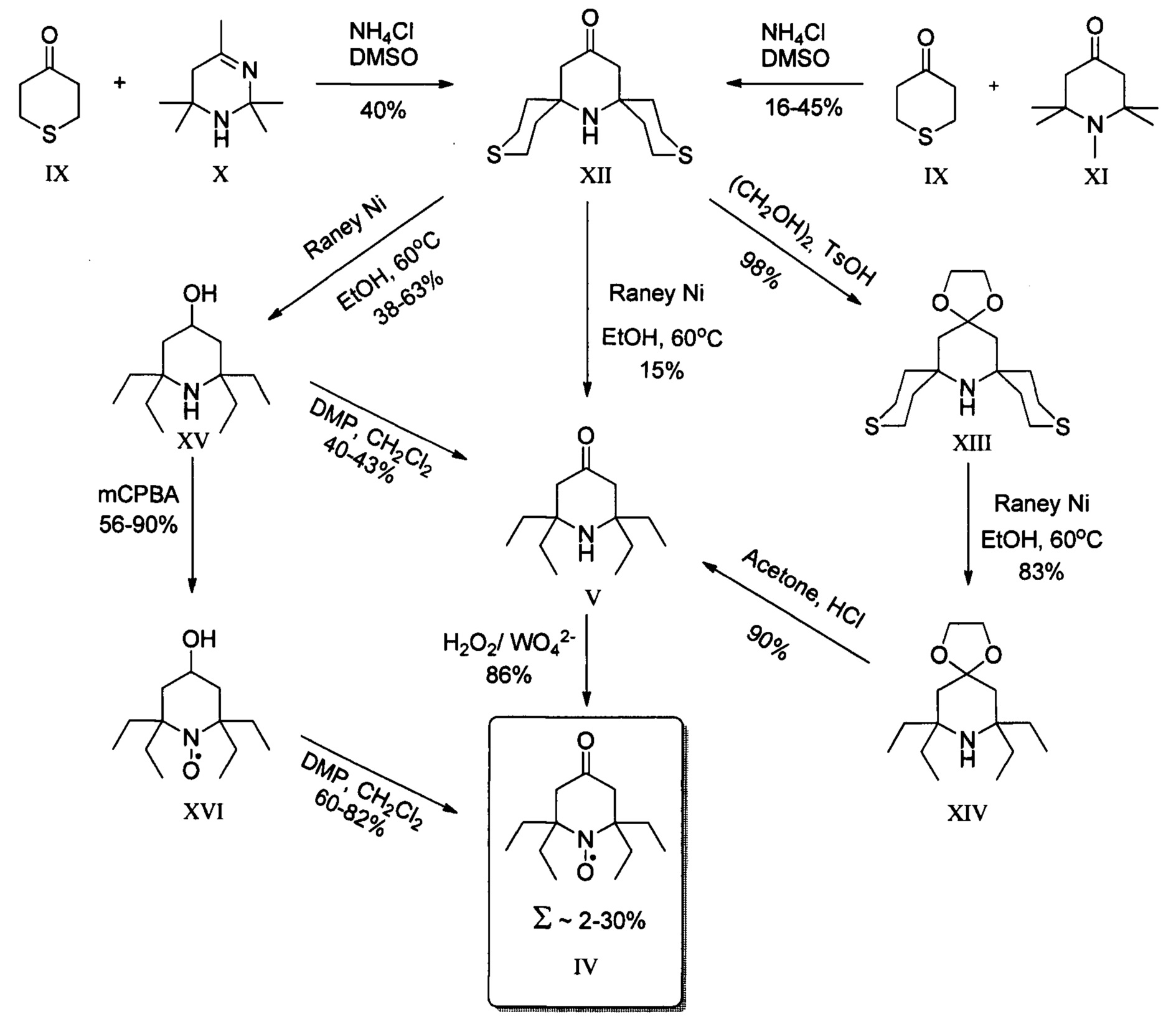
Изобретение относится к новому способу синтеза 2,2,5,5-тетраэтилпирролидин-1-оксила в два этапа. На первом этапе используется трехкомпонентный домино процесс с участием α-аминомаслянной кислоты, диэтилкетона и диметилфумарата, в смеси ДМФА/толуол при температуре кипения, с последующим окислением перекисью водорода в присутствии катализатора и декарбоксилированием с последующим получением 2,5,5-триэтил-4-карбокси-1-пирролин-1-оксида. Такой подход позволяет конструировать гетероцикл с тремя этильными заместителями на первой стадии, что существенно сокращает суммарное количество стадий и увеличивает выход продукта. На втором этапе 2,5,5-триэтил-4-карбокси-1-пирролин-1-оксид превращается в 2,2,5,5-тетраэтил-3-карбоксипирролин-1-оксил путем взаимодействия с этинилмагний бромидом с последующим гидрированием. Использование последовательности: введение этинильного фрагмента - гидрирование, позволяет вводить этильный заместитель без затрагивания карбоксильной группы с существенно более высоким выходом который не реализуется в случае использования этилмагний бромида. Предложенный способ очень эффективен и позволяет получать 2,2,5,5-тетраэтилпирролидин 1-оксил с суммарным выходом около 17% за 5 стадий из легкодоступных α-аминомаслянной кислоты, диэтилкетона и диметилфумарата, и дает суммарно более высокий выход 2,2,5,5-тетраэтил-3-карбоксипирролин-1-оксила чем все известные подходы к его синтезу.
Схема синтеза приведена на схеме 1.
Изобретение иллюстрируется следующими примерами:
Пример 1. Получение 2,5,5-триэтил-4-карбокси-1-пирроли-1-оксида (II)
Суспензию α-аминомаслянной кислоты (103 г, 1 моль), диметилфумарата (144 г, 1 моль) в растворе диэтилкетона (0.5 л, 5 моль), ДМФА (0.5 л) и толуола (0.5 л) кипятят с насадкой Дина-Старка до растворения аминокислоты и образования прозрачного раствора. Отгоняют ДМФА, толуол и избыток диэтилкетона при пониженном давлении. Полученную в результате смесь изомерных аминов растворяют в этилацетате и экстрагируют 1М раствором серной кислоты (0.5 л), органическую фазу отбрасывают. Водную фазу подщелачивают 1М раствором гидроксида натрия (1 л), экстрагируют этилацетатом и сушат при помощи безводного карбоната натрия при интенсивном перемешивании около 1 ч. Затем осушитель отфильтровывают, растворитель отгоняют при пониженном давлении. Остаток растворяют в метаноле (1 л) и прибавляют раствор вольфрамата натрия (3.3 г, 0,01 моль) и трилона Б (3.4 г, 0,01 моль) в воде (0.5 л). Затем к раствору прибавляют 30% перекись водорода (0.2 л, 2 моль) и оставляют на 4 дня в темном месте следя за тем, чтобы температура не поднималась выше 50°С. Раствор разбавляют водой (0.5 л), метанол отгоняют. Остаток экстрагируют хлороформом и осушают при помощи безводного сульфата натрия при интенсивном перемешивании около 1 ч. Затем осушитель отфильтровывают, растворитель отгоняют при пониженном давлении. Остаток растворяют в метаноле (0.5 л), прибавляют ЮМ раствор гидроксида натрия (0.2 л) и оставляют на 1 день. Затем метанол отгоняют, нейтрализуют при охлаждении раствором 3М раствором серной кислоты (0.33 л), экстрагируют этилацетатом (3×0.2 л) и сушат при помощи безводного сульфата натрия при интенсивном перемешивании около 1 ч. Осушитель отфильтровывают, раствор кипятят в атмосфере аргона 4 часа, после чего охлаждают до -20°С и выдерживают 24 ч. Выпавшие кристаллы отфильтровывают, промывают холодным этилацетатом и используют далее без дополнительной очистки. Получают 75 г. продукта, выход составляет 35%.
1H ЯМР (400 MHz, CDCl3): δ=0.70 (t, Jt=7.4, 3Н), 0.83 (t, Jt=7.4, 3Н), 1.08 (t, Jt=7.7, 3H), 1.72-1.90 (m, 3H), 1.99 (dt, Jd=14.3, Jt=7.4, 1H), 2.49 (dt, Jd=15.8, Jt=7.7, 1H), 2.64 (dt, Jd=15.8, Jt=7.7, 1H), 2.66 (dd, Jd1=18.7, Jd2=9.6, 1H), 3.06 (dd, Jd1=18.7, Jd2=8.9, 1H), 3.19 (dd, Jd1=9.6, Jd2=8.9, 1H), 13.14-13.42 (уширенный, 1H); 13C ЯМР (100 MHz, CDCl3): δ=7.35, 7.92, 9.35, 20.21, 27.99, 29.51, 31.44, 41.41, 81.86, 155.03, 171.89.
Пример 2. Получение 2,2,5,5-тетраэтил-3карбоксипирролидин-1-оксила (I)
К 1М раствору этинилмагнийбромида в ТГФ (1 л) прибавляют 2,5,5-триэтил-4-карбокси-1-пиролин-1-оксид (21.3 г. 0.1 моль) и перемешивают в плотно закрытой колбе 24 часа. Реакционную массу разлагают водой и нейтрализуют раствором гидросульфата натрия до рН<3. Органическую фазу отделяют, сушат сульфатом магния при интенсивном перемешивании около 1 ч. Затем осушитель отфильтровывают, растворитель отгоняют при пониженном давлении. Остаток растворяют в метаноле (0.1 л), добавляют 4% палладий на угле (0.5 г) и гидрируют при атмосферном давлении. После гидрирования, к смеси прибавляют 1М раствор гидроксида натрия до рН>10 (0.11 л), катализатор отфильтровывают, к раствору прибавляют метиленовый синий (0.01 г) и продувают воздухом до появления интенсивной синей окраски. Метанол упаривают при пониженном давлении, остаток нейтрализуют 1М раствором серной кислоты (0.06 л), экстрагируют этилацетатом и осушают при помощи безводного сульфата натрия при интенсивном перемешивании около 1 ч. Затем осушитель отфильтровывают, растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из толуола. Получают 12 г. желтых кристаллов, выход продукта 50%.
ИК (KBr): 1730 см-1 (С=O); ЭПР (вода) g=2,0054, aN=1.48 мТ.
Способ получения 2,2,5,5-тетраэтил-3-карбоксипирролин-1-оксила