Результат интеллектуальной деятельности: ТВЕРДАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АМЛОДИПИН И ЛОЗАРТАН
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к твердой фармацевтической композиции, содержащей амлодипин и лозартан в качестве активных ингредиентов, которая имеет улучшенные скорости растворения и стабильность при их хранении.
Уровень техники
При лечении гипертензии важно поддерживать артериальное давление в пределах нормального диапазона, а не просто контролировать ее симптомы, тем самым предотвращая опасные для жизни заболевания, такие как инсульт, сердечная недостаточность и коронарные болезни сердца (например, инфаркт миокарда) и сердечно-сосудистые осложнения, такие как почечная недостаточность. Поскольку для контроля артериального давления требуется длительное применение гипотензивного средства, следует тщательно подбирать лекарственное средство. Кроме того, современная терапия с использованием комбинации двух или более лекарственных средств, имеющих фармакологические действия, отличающиеся друг от друга, позволяет улучшить профилактические или терапевтические эффекты, уменьшая при этом побочные эффекты, связанные с долгосрочным введением лекарственного средства за счет снижения количеств отдельных лекарственных средств.
Обычно используемые гипотензивные средства можно разделить на три основные категории, такие как диуретические средства, симпатолитические средства и сосудорасширяющие средства, основываясь на их механизмах действия. Сосудорасширяющие средства, являющиеся наиболее часто выписываемыми гипотензивными средствами, могут быть дополнительно разделены на несколько групп, таких как ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина II и блокаторы кальциевых каналов, основываясь на их фармакологических действиях.
Амлодипин является международным непатентованным наименованием для 3-этил-5-метил-2-(2-аминоэтоксиметил)-4-(2-хлорфенил)-6-метил-1,4-дигидро-3,5-пиридина дикарбоксилата, и амлодипина безилат в настоящее время продается как Норваск®. Амлодипин блокирует кальциевые каналы и используется для лечения сердечно-сосудистых нарушений, таких как стенокардия, гипертензия и застойная сердечная недостаточность.
Лозартан является международным непатентованным наименованием для 2-бутил-4-хлор-1-[[2'-(1Н-тетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанола, который был раскрыт в патенте США № 5,608,075; 5,138,069; и 5,153,197 и т. д. Лозартан калия в настоящее время доступен как Козаар®. Лозартан блокирует связывание ангиотензина II, вазоконстриктора, с его рецептором. Он используется для лечения гипертензии, сердечной недостаточности, ишемического нарушения периферического кровообращения, ишемии миокарда (стенокардии), диабетической невропатии и глаукомы и также используется для предотвращения прогрессирования сердечной недостаточности после инфаркта миокарда.
Авторы настоящего изобретения обнаружили, что комбинированный состав амлодипина и лозартана, имеющий два различных механизма фармакологического действия, полезен для лечения гипертензии, и проводили интенсивные исследования такого комбинированного состава. Однако при получении комбинированного состава амлодипина и лозартана наблюдалось нежелательное гелеобразование лозартана. В частности, лозартан легко растворяется в очищенной воде или при относительно высоком рН (например, рН 6,8 и т.д.), демонстрируя хорошие модели растворения, но очень медленно растворяется при низком рН (например, рН 1,2 или 2,0) вследствие его гелеобразования. Таким образом, в комбинированном составе амлодипина и лозартана амлодипин может быть также захвачен лозартановым гелем вследствие гелеобразования лозартана, приводя к снижению скорости растворения.
Состав для перорального применения обычно подвергается разложению и растворению в желудке, который имеет низкое содержание рН. Соответственно, низкая скорость растворения активного ингредиента при низком рН (например, рН 1 или 2) может существенно влиять на его биодоступность.
Кроме того, учитывая, что рН желудка нормального взрослого варьируется в широких пределах от 1,0 до 3,5 и Cmax лозартана после потребления пищи снижается приблизительно на 10% (PDR), разработка состава, способного поддерживать относительно постоянную скорость растворения, несмотря на такие изменения рН желудка, необходима для достижения максимального эффекта лекарственного средства за счет максимальной абсорбции лекарственного средства и сведения к минимуму различий в абсорбции лекарственного средства у объекта или среди объектов. В данном контексте в случае комбинированного состава амлодипина и лозартана требуется большое количество, по меньшей мере, одного типа разрыхлителя для разработки состава, который показывает незначительные различия в скорости растворения при нормальном диапазоне изменения рН желудка и показывает высокую скорость растворения с помощью предотвращения гелеобразования лозартана в условиях низкого рН. Однако состав, использующий относительно высокое содержание разрыхлителя, может иметь проблемы с его стабильностью при хранении вследствие гигроскопичности разрыхлителя. В частности, при воздействии влаги фармацевтическая композиция, использующая большое количество разрыхлителя, вероятно, покажет изменения в ее свойстве и снижение ее эффективности. Таким образом, существовала потребность в разработке фармацевтической композиции с улучшенной стабильностью при хранении, чтобы предотвратить снижение скорости растворения.
По этой причине авторы настоящего изобретения стремились разработать комбинированный состав, содержащий лозартан и амлодипин, для профилактики или лечения сердечно-сосудистых нарушений в виде твердого состава, который имеет улучшенную скорость растворения, стабильность и терапевтическую эффективность. В результате авторы настоящего изобретения обнаружили, что при использовании разрыхлителя и покрывающего агента в композиции в определенном соотношении может быть значительно улучшена низкая скорость растворения, обусловленная гелеобразованием лозартана в кислой среде, в то время как изменения в свойствах композиции под воздействием влаги могут быть предотвращены, обеспечивая эффективную доставку ее активных ингредиентов и улучшенную стабильность при хранении.
В настоящей патентной заявке будут сделаны ссылки на статьи и патентные документы вместе с их цитированием. Содержание статей и патентных документов включено в настоящее описание в полном объеме посредством ссылки, и, следовательно, уровень области техники, к которой относится настоящее изобретение, и раскрытие настоящего изобретения объясняются с большей ясностью.
Раскрытие изобретения
Техническая проблема
Таким образом, целью настоящего изобретения является предоставление фармацевтической композиции для профилактики или лечения сердечно-сосудистых нарушений.
Решение проблемы
В соответствии с одной из целей настоящего изобретения предложена фармацевтическая композиция для профилактики или лечения сердечно-сосудистых нарушений, содержащая (А) лозартан или его фармацевтически приемлемую соль; (В) амлодипин или его фармацевтически приемлемую соль; (C) разрыхлитель в количестве от 3 до 10 масс.% из расчета общей массы композиции; и (D) покрывающий агент.
Полезные эффекты изобретения
Композиция настоящего изобретения, которая имеет наилучшую комбинацию и оптимальное соотношение разрыхлителя и покрывающего агента, демонстрирует достаточную прочность и высокие скорости растворения при различных условиях рН, и, следовательно, она является пригодной для получения превосходного твердого состава, проявляющего улучшенную эффективность доставки лекарственного средства и стабильность при хранении.
Краткое описание чертежей
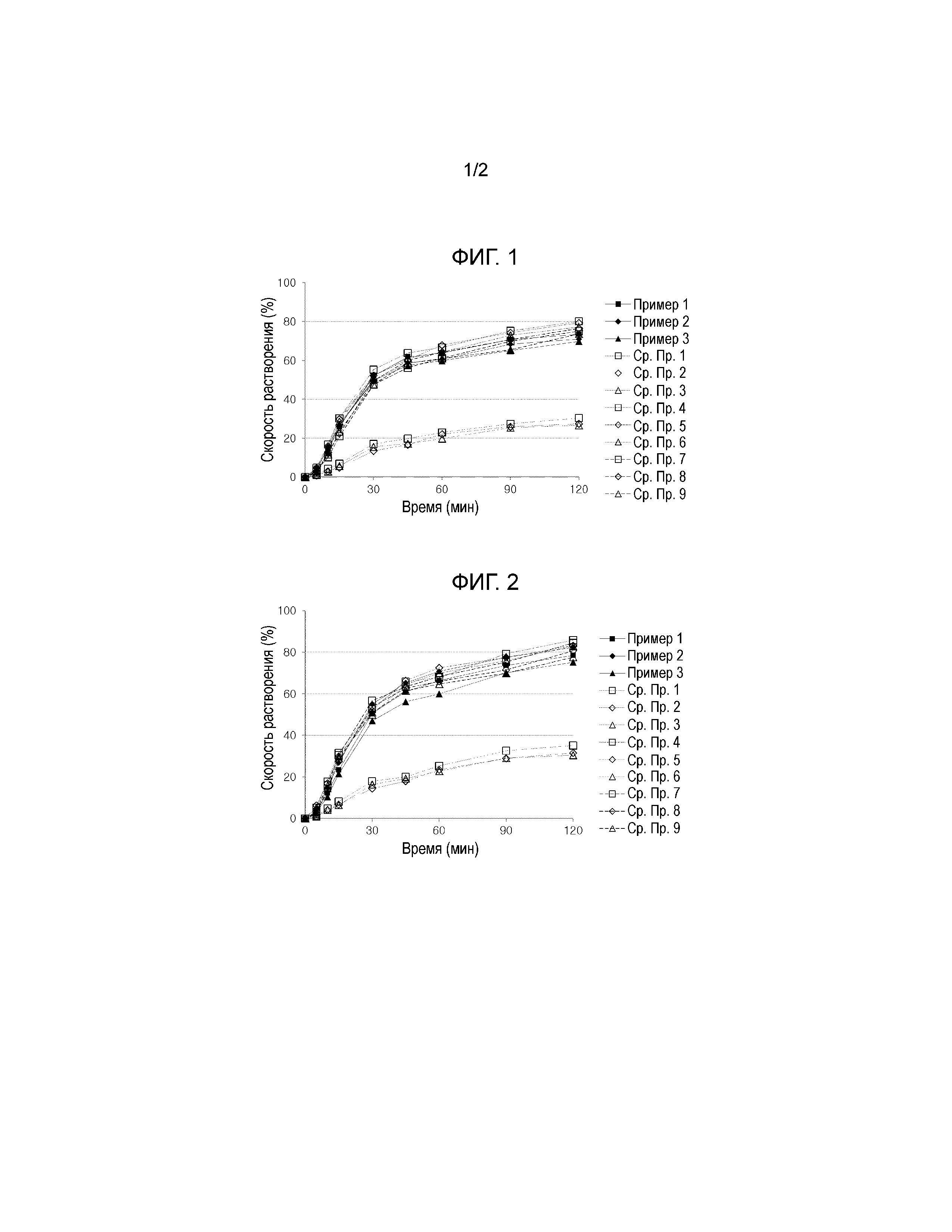
Фиг. 1 представляет собой график, показывающий скорости растворения амлодипина из комбинированных таблеток, содержащих лозартан и амлодипин из Примеров 1-3 и Сравнительных Примеров 1-9.
Фиг. 2 представляет собой график, показывающий скорости растворения лозартана калия из комбинированных таблеток, содержащих лозартан и амлодипин из Примеров 1-3 и Сравнительных Примеров 1-9.
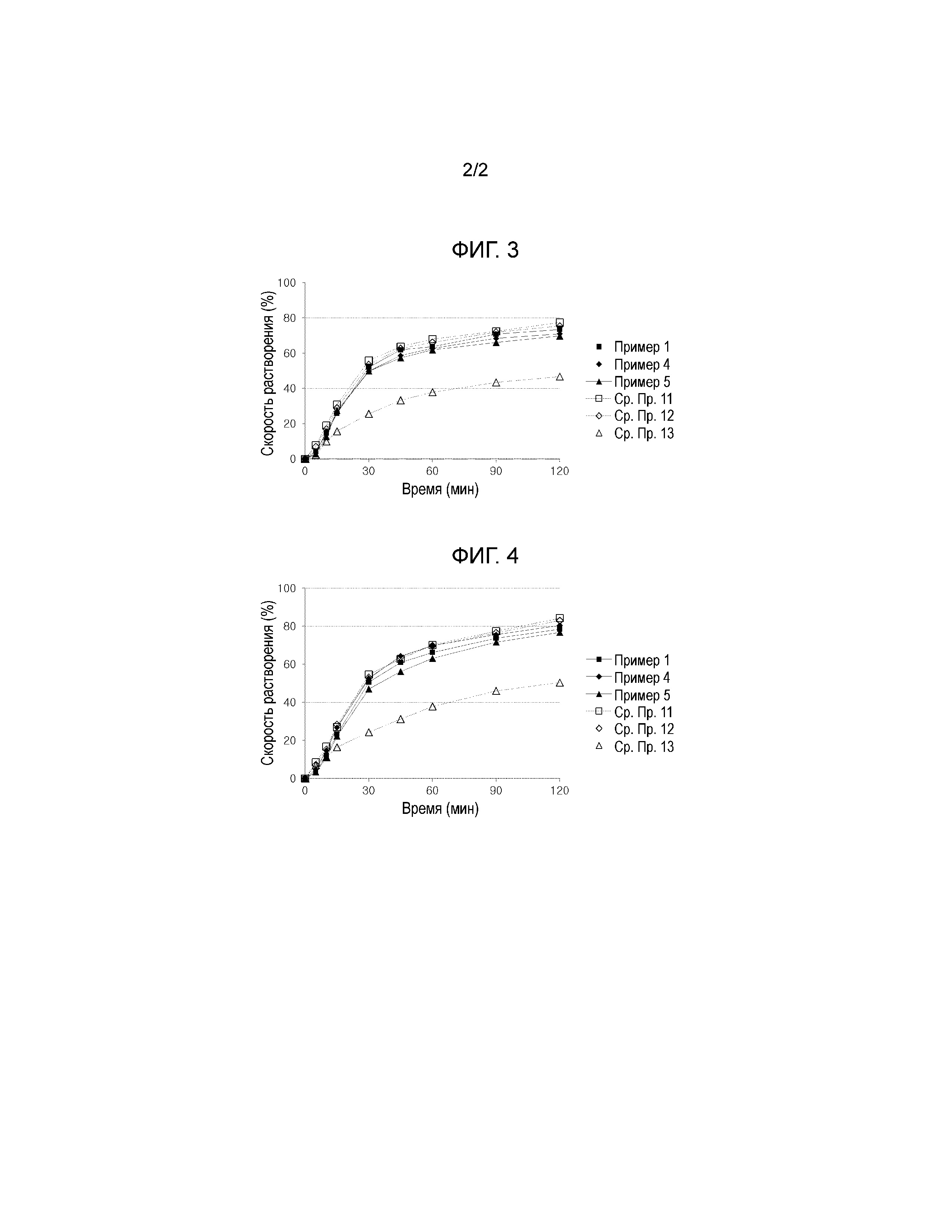
Фиг. 3 представляет собой график, показывающий скорости растворения амлодипина из комбинированных таблеток, содержащих лозартан и амлодипин из Примеров 1, 4 и 5 и Сравнительных Примеров 11-13.
Фиг. 4 представляет собой график, показывающий скорости растворения лозартана калия из комбинированных таблеток, содержащих лозартан и амлодипин из Примеров 1, 4 и 5 и Сравнительных Примеров 11-13.
Лучший вариант осуществления изобретения
В соответствии с одним вариантом осуществления настоящего изобретения предложена фармацевтическая композиция для профилактики или лечения сердечно-сосудистых нарушений, содержащая:
(А) лозартан или его фармацевтически приемлемую соль;
(В) амлодипин или его фармацевтически приемлемую соль;
(C) разрыхлитель в количестве от 3 до 10 масс.% из расчета общей массы композиции; и
(D) покрывающий агент.
Используемый в настоящем описании термин «сердечно-сосудистое нарушение» относится к нарушению, вызванному повышенным артериальным давлением или уменьшенным притоком крови к сердечным мышцам вследствие сужения или закупорки коронарной артерии, которая поставляет кровь к сердцу. В частности, сердечно-сосудистое нарушение, которое следует предотвратить или лечить с помощью композиции настоящего изобретения, может быть выбрано из группы, состоящей из стенокардии, гипертензии, артериального вазоспазма, аритмии сердца, гипертрофии сердца, церебрального инфаркта, застойной сердечной недостаточности и инфаркта миокарда.
Используемый в настоящем описании термин «лечение» относится к (а) ингибированию развития нарушения, заболевания или симптома; (b) облегчению нарушения, заболевания или симптома; или (с) устранению нарушения, заболевания или симптома. Лозартан и амлодипин, фармакологические ингредиенты, применяемые в композиции настоящего изобретения, ингибируют, устраняют или облегчают развитие сердечно-сосудистого нарушения или его симптомов с помощью блокирования рецепторов ангиотензина II и кальциевых каналов, соответственно. Следовательно, композиция настоящего изобретения самостоятельно может быть терапевтической композицией для сердечно-сосудистого нарушения и может также быть терапевтическим адъювантом для совместного введения с другими фармакологическими ингредиентами для улучшения сердечно-сосудистой функции или кровотока. Таким образом, используемый в настоящем описании термин «лечение» или «терапия» подразумевает включение значения «адъювант для лечения» или «терапевтический адъювант».
Используемый в настоящем описании термин «профилактика» относится к ингибированию возникновения нарушения или заболевания у субъекта, у которого не было диагностировано наличие нарушения или заболевания, но есть возможность развития такого нарушения или заболевания.
В соответствии с определенным вариантом осуществления настоящего изобретения лозартан или его фармацевтически приемлемую соль применяют в количестве от 15 до 30 масс.% из расчета общей массы композиции. Более конкретно, его используют в количестве от 17 до 25 масс.% и наиболее конкретно от 18 до 22 масс.%.
Лозартан, используемый в настоящем изобретении, может представлять собой одну из различных форм фармацевтически приемлемых солей. Подходящий пример фармацевтически приемлемых солей представляет собой кислотно-аддитивную соль, образованную с помощью фармацевтически приемлемой свободной кислоты. Свободная кислота может представлять собой органическую или неорганическую кислоту.
Примеры фармацевтически приемлемых солей лозартана могут включать лозартан натрия, лозартан калия, лозартан стронция, лозартан кальция, лозартан магния, лозартан аммония или их смесь, но не ограничиваются ими, и может быть использована любая форма солей, обычно используемая для получения фармацевтической композиции в данной области техники. В частности, фармацевтически приемлемая соль лозартана, используемая в настоящем изобретении, может представлять собой лозартан калия.
Исходя из стандартной дозированной формы (твердая форма для введения) лозартан или его фармацевтически приемлемую соль обычно применяют в количестве, например, от 10 до 500 мг, определенно от 25 до 250 мг, более определенно от 50 до 200 мг и наиболее определенно от 50 до 100 мг.
В соответствии с определенным вариантом осуществления настоящего изобретения амлодипин или его фармацевтически приемлемую соль применяют в количестве от 3 до 20 масс.% из расчета массы лозартана или его фармацевтически приемлемой соли. Более определенно, его используют в количестве от 5 до 15 масс.%, еще более определенно от 6 до 12 масс.% и наиболее определенно от 7 до 9 масс.%.
Амлодипин, используемый в настоящем изобретении, может представлять собой одну из различных форм фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей амлодипина могут включать соль хлорида, гидробромида, сульфата, фосфата, ацетата, малеата, фумарата, лактата, тартрата, цитрата, глюконата, безилата и камзилата, но не ограничиваются ими, и может быть использована любая форма солей, образованная с помощью различных неорганических или органических кислот, обычно используемых в данной области техники. В частности, фармацевтически приемлемая соль амлодипина может представлять собой амлодипина безилат или амлодипина камзилат и более определенно амлодипина камзилат. Также амлодипин, 3-этил-5-метил-2-(2-аминоэтоксиметил)-4-(2-хлорфенил)-6-метил-1,4-дигидро-3,5-пиридина дикарбоксилат, используемый в настоящем изобретении, охватывает все его стереоизомеры.
Исходя из стандартной дозированной формы (твердая форма для введения) амлодипин обычно используют в количестве, например, от 1,25 до 20 мг, определенно от 1,875 до 15 мг, более определенно от 2,5 до 10 мг и наиболее определенно от 5 до 10 мг. Количество амлодипина, описанное выше, относится к количеству свободного амлодипина, присутствующего в его твердой дозированной форме.
Используемый в настоящем описании термин «разрыхлитель» относится к материалу, который ускоряет распадаемость твердого состава, в частности, таблетки, с помощью улучшения его растворимости, что позволяет растворять активный ингредиент состава в терапевтически эффективном количестве. Термин «терапевтически эффективное количество» относится к достаточному количеству фармакологического ингредиента для обеспечения терапевтического или профилактического эффекта у объекта, которое, таким образом, предназначено для охвата значения «профилактически эффективное количество».
Задержка растворения, возникающая в результате задержки распадаемости, может быть улучшена путем увеличения количества разрыхлителя, но чрезмерное применение разрыхлителя может привести к образованию твердого состава (например, таблетки), который не проявляет достаточной прочности для сохранения своей формы/свойства во время процесса получения, упаковки, транспортировки или хранения. Разрыхлитель настоящего изобретения может быть использован в количестве от 2,5 до 30 масс.% из расчета общей массы композиции, определенно от 3 до 10 масс.% и более определенно от 5 до 9 масс.%.
В соответствии с определенным вариантом осуществления настоящего изобретения разрыхлитель, используемый в настоящем изобретении, может быть, по меньшей мере, одним из выбранных из группы, состоящей из натрия крахмала гликолята, кроскармеллозы натрия и кросповидона.
Используемый в настоящем описании термин «покрывающий агент» относится к материалу, который снижает водопроницаемость и улучшает механическую прочность и стабильность при хранении с помощью изменения поверхности твердого состава с образованием внешней оболочки. При использовании разрыхлителя в определенном соотношении в твердом составе, содержащем амлодипин и лозартан в качестве фармакологических ингредиентов, скорость растворения состава может быть улучшена, но его стабильность может ухудшиться при воздействии влаги. Таким образом, покрывающий агент может быть дополнительно использован для увеличения прочности и стабильности состава.
Используемый в настоящем описании термин «покрытие» относится к связыванию с поверхностью материала, который должен быть покрыт (модифицирован) без изменения основного физического свойства материала. Например, выражение «поверхность твердого состава покрывают покрывающим агентом» означает, что молекулы покрывающего агента прямо или косвенно связаны с делокализованной площадью поверхности твердого состава. Следовательно, было бы очевидно, что используемое в настоящем описании «покрытие» не ограничивается случаями, когда образуется слой, который полностью покрывает поверхность материала, который должен быть покрыт. В частности, используемый в настоящем описании термин «покрытие» относится к связыванию с поверхностью материала, занимая достаточную площадь поверхности, чтобы получить желаемую прочность и стабильность.
В соответствии с определенным вариантом осуществления настоящего изобретения покрывающий агент применяют в количестве от 1 до 10 масс.% из расчета общей массы композиции, более определенно от 1 до 5 масс.% и наиболее определенно от 2 до 4 масс.%.
В соответствии с определенным вариантом осуществления изобретения покрывающий агент, используемый в настоящем изобретении, представляет собой, по меньшей мере, один полимер, выбранный из группы, состоящей из покрывающего агента, содержащего поливиниловый спирт (например, Опадрай), гипромеллозу и гидроксипропилцеллюлозу.
В соответствии с определенным вариантом осуществления изобретения гипромеллоза имеет вязкость от 10 до 30 мПа⋅с, более определенно от 10 до 20 мПа⋅с и еще более определенно от 10 до 15 мПа⋅с. В соответствии с настоящим изобретением было обнаружено, что стабильность при хранении уменьшалась при воздействии влаги, если вязкость покрывающего агента составляла менее 10 мПа⋅с.
В соответствии с определенным вариантом осуществления настоящего изобретения массовое соотношение разрыхлителя и покрывающего агента в композиции находится в диапазоне от 1,5:1 до 4,0:1. В соответствии с настоящим изобретением в отношении твердого состава, в котором в качестве фармакологических ингредиентов применяют амлодипин и лозартан, растворение фармакологических ингредиентов может быть улучшено с помощью применения разрыхлителя, и также снижение прочности, стабильности и способности к консервированию состава может быть предотвращено с помощью применения покрывающего агента. Следовательно, соотношение между данными двумя ингредиентами, которые играют взаимодополняющие роли друг с другом, является важным для достижения эффективной доставки лекарственного средства и стабильности лекарственного средства. В частности, массовое соотношение разрыхлителя и покрывающего агента в композиции настоящего изобретения может находиться в диапазоне от 1,9:1 до 3,0:1, еще более определенно от 2,2:1 до 3,0:1 и наиболее определенно от 2,2:1 до 2,5:1.
В соответствии с определенным вариантом осуществления настоящего изобретения композиция настоящего изобретения может быть приготовлена в виде покрытой оболочкой таблетки, которая демонстрирует увеличение толщины на 3% или менее при воздействии условий ускоренных испытаний 40°C и 75% относительной влажности в течение 5 часов.
В соответствии с определенным вариантом осуществления настоящего изобретения композиция настоящего изобретения может быть приготовлена в виде покрытой оболочкой таблетки, которая демонстрирует увеличение массы на 5% или менее при воздействии условий ускоренных испытаний 40°C и 75% относительной влажности в течение 5 часов
В соответствии с настоящим изобретением твердый состав, приготовленный с использованием композиции настоящего изобретения, демонстрирует увеличение толщины и увеличение массы на 3% или менее и 5% или менее соответственно при воздействии среды с высокой влажностью 75% относительной влажностью, поскольку абсорбция воды блокируется, таким образом достигая превосходную стабильность при хранении.
По этой причине благодаря наилучшей комбинации и оптимальному соотношению разрыхлителя и покрывающего агента твердый состав, приготовленный с использованием композиции настоящего изобретения, демонстрирует превосходную скорость растворения и стабильность при хранении.
Композиция настоящего изобретения может быть составлена в виде различных форм твердых составов, таких как, например, таблетка, капсула или мультичастицы и может вводиться различными путями, такими как, например, пероральный или подъязычный путь. В частности, композиция настоящего изобретения может быть составлена в виде таблетки и введена перорально. Ингредиенты композиции настоящего изобретения, отличные от покрывающего агента, могут быть просто смешаны и таблетированы, чтобы получить не покрытую оболочкой таблетку, которая может быть покрыта покрывающим агентом для получения конечной таблетки. Таблетке необходима соответствующая твердость, и средняя твердость в диапазоне от 5 кп до 30 кп является предпочтительной. Измерение средней твердости проводят перед нанесением покрывающего слоя на таблетку.
Вариант осуществления изобретения
В дальнейшем настоящее изобретение подробно объясняется с помощью Примеров. Следующие Примеры предназначены для дополнительной иллюстрации настоящего изобретения без ограничения его объема.
Примеры 1-3 и Сравнительные Примеры 1-9: Получение комбинированных таблеток I
Пример 1
-Часть влажных гранул-
амлодипина камзилат 7,84 мг (амлодипин 5 мг)
бутилированный гидрокситолуол (БГТ) 0,1 мг
маннит 27 мг
микрокристаллическая целлюлоза 61 мг
натрия крахмала гликолят 17 мг
поливинилпирролидон 3,2 мг
-Часть уплотнения-
лозартан калия 100 мг
микрокристаллическая целлюлоза 260 мг
кросповидон 18 мг
-Часть конечного смешивания-
стеарат магния 3,2 мг
-Покрывающий агент-
тальк 0,25 мг
оксид титана 2,25 мг
гидроксипропилцеллюлоза 2,5 мг
гипромеллоза (15 мПа⋅с) 10 мг
этанол 325 мг
очищенная вода 85 мг
*Этанол и очищенная вода испаряются во время процесса покрытия.
В соответствии с вышеописанными композициями в высокоскоростную мешалку вводили амлодипина камзилат, бутилированный гидрокситолуол, маннит, микрокристаллическую целлюлозу и натрия крахмала гликолят; объединяли в течение 7 минут при подаче в высокоскоростную мешалку поливинилпирролидона, растворенного в соответствующем количестве воды, в качестве связующего раствора; и высушивали в течение 30 минут с использованием сушилки с псевдоожиженным слоем. Полученные таким образом высушенные материалы сортировали по размеру с использованием мельницы Фитца для получения влажных гранул. Кроме того, сухие гранулы получали с помощью смешивания лозартана калия, микрокристаллической целлюлозы и кросповидона, которые затем подвергали процессу уплотнения с использованием роликового пресса.
Влажные и сухие гранулы смешивали и затем смазывали с помощью смешивания со стеаратом магния, частью конечного смешивания. Полученную смесь таблетировали с усилием прессования приблизительно 20 кН с использованием роторного таблеточного пресса (Sejong Pharmatech, MRC-45) для получения комбинированной таблетки лозартана 100 мг-амлодипина 5 мг. После получения покрывающего раствора в соответствии с указанными покрывающими композициями комбинированную таблетку покрывали пленкой при температуре входящего воздуха 50°C и температуре выходящего воздуха 40°C с использованием автоматического устройства для нанесения покрытия (Sejong Pharmatech, SFC-30) и полученную таблетку высушивали при 35°C в течение 30 минут для получения таблетки с пленочным покрытием.
Пример 2
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Примере 1
-Покрывающий агент-
Опадрай 85f18422 15 мг
(поливиниловый спирт 40%, оксид титана 25%, полиэтиленгликоль 20,2% и тальк 14,8%)
очищенная вода 100 мг
*Очищенная вода испаряется во время процесса покрытия.
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Пример 3
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Примере 1
-Покрывающий агент-
Опадрай 80W AMB 15 мг
(поливиниловый спирт 40~50%, оксид титана 20~30%, тальк приблизительно 20%, лецитин приблизительно 2%, ксантановая камедь приблизительно 1%)
очищенная вода 100 мг
*Очищенная вода испаряется во время процесса покрытия.
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 1
-Часть влажных гранул-
амлодипина камзилат 7,84 мг (амлодипин 5 мг)
бутилированный гидрокситолуол 0,1 мг
маннит 27 мг
микрокристаллическая целлюлоза 61 мг
натрия крахмала гликолят 6 мг
поливинилпирролидон 3,2 мг
-Часть уплотнения-
лозартан калия 100 мг
микрокристаллическая целлюлоза 260 мг
кросповидон 6 мг
-Часть конечного смешивания-
стеарат магния 3,2 мг
-Покрывающий агент-
такой же, как в Примере 1
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 2
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Сравнительном Примере 1
-Покрывающий агент-
такой же, как в Примере 2
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 3
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Сравнительном Примере 1
-Покрывающий агент-
такой же, как в Примере 3
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 4
-Часть влажных гранул-
амлодипина камзилат 7,84 мг (амлодипин 5 мг)
бутилированный гидрокситолуол 0,1 мг
маннит 27 мг
микрокристаллическая целлюлоза 61 мг
натрия крахмала гликолят 30 мг
поливинилпирролидон 3,2 мг
-Часть уплотнения-
лозартан калия 100 мг
микрокристаллическая целлюлоза 260 мг
кросповидон 30 мг
-Часть конечного смешивания-
стеарат магния 3,2 мг
-Покрывающий агент-
такой же, как в Примере 1
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 5
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Сравнительном Примере 4
-Покрывающий агент-
такой же, как в Примере 2
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 6
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Сравнительном Примере 4
-Покрывающий агент-
такой же, как в Примере 3
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 7
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Примере 1
-Покрывающий агент-
тальк 0,25 мг
оксид титана 2,25 мг
гидроксипропилцеллюлоза 2,5 мг
гипромеллоза (3 мПа⋅с) 10 мг
этанол 325 мг
очищенная вода 85 мг
*Этанол и очищенная вода испаряются во время процесса покрытия.
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 8
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Примере 1
-Покрывающий агент-
тальк 0,25 мг
оксид титана 2,25 мг
гидроксипропилцеллюлоза 2,5 мг
гипромеллоза (4,5 мПа⋅с) 10 мг
этанол 325 мг
очищенная вода 85 мг
*Этанол и очищенная вода испаряются во время процесса покрытия.
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Сравнительный Пример 9
-Часть влажных гранул, часть уплотнения и часть конечного смешивания-
такие же, как в Примере 1
-Покрывающий агент-
тальк 0,25 мг
оксид титана 2,25 мг
гидроксипропилцеллюлоза 2,5 мг
гипромеллоза (6 мПа⋅с) 10 мг
этанол 325 мг
очищенная вода 85 мг
*Этанол и очищенная вода испаряются во время процесса покрытия.
Комбинированную таблетку получали с помощью повторения методики Примера 1.
Композиции комбинированных составов, полученные в Примерах 1-3 и Сравнительных Примерах 1-9, показаны в Таблице 1 ниже.
[Таблица 1]
|
Пример исследования 1: Исследование растворимости амлодипина
Комбинированные таблетки лозартана калия и амлодипина, полученные в Примерах 1-3 и Сравнительных Примерах 1-9, подвергали испытанию на растворимость амлодипина при следующих условиях. Результаты показаны на Фиг. 1.
-Условия растворения-
Элюент: искусственный желудочный сок (pH 1,2) 900 мл
Способ (устройство): способ с использованием лопастной мешалки USP, 50 об/мин
Температура: 37°C
-Условия анализа-
Колонка: колонка из нержавеющей стали (внутренний диаметр: 4,6 мм, длина: 15 см), заполненная октадецилсилил-силикагелем для жидкостной хроматографии (диаметр 5 мкм)
Подвижная фаза: метанол: 0,03 М раствор дигидрофосфата калия (600:400, об./об.)
Детектор: ультрафиолетовый спектрофотометр (длина волны 350 нм)
Скорость потока: 1,5 мл/мин.
Объем вводимой пробы: 20 мкл
В результате, Примеры 1, 2 и 3 и Сравнительные Примеры 4-9, в которых соотношение разрыхлителя или соотношение разрыхлителя и композиции составляло 6,0% или выше, показали превосходные скорости растворения амлодипина, тогда как Сравнительные Примеры 1, 2 и 3, в которых соотношение разрыхлителя составляло менее 3,0%, показали низкие скорости растворения (см. Фиг. 1).
Пример исследования 2: Исследование растворимости лозартана калия
Комбинированные таблетки лозартана калия и амлодипина, полученные в Примерах 1-3 и Сравнительных Примерах 1-9, подвергали испытанию на растворимость лозартана калия при следующих условиях. Результаты показаны на Фиг. 2.
-Условия растворения-
Элюент: искусственный желудочный сок (pH 1,2) 900 мл
Способ (устройство): способ с использованием лопастной мешалки USP, 50 об/мин
Температура: 37°C
-Условия анализа-
Колонка: колонка из нержавеющей стали (внутренний диаметр: 4,6 мм, длина: 15 см), заполненная октадецилсилил-силикагелем для жидкостной хроматографии (диаметр 5 мкм)
Подвижная фаза:
подвижная фаза А - фосфатный буфер:ацетонитрил (850:150, об./об.)
подвижная фаза В - ацетонитрил
[Таблица 2]
Градиентная система
|
Детектор: ультрафиолетовый спектрофотометр (длина волны 250 нм)
Скорость потока: 1,5 мл/мин
Объем вводимой пробы: 10 мкл
В результате, Примеры 1, 2 и 3 и Сравнительные Примеры 4-9, в которых соотношение разрыхлителя составляло 6,0% или выше, показали превосходные скорости растворения лозартана калия, тогда как Сравнительные Примеры 1, 2 и 3, в которых соотношение разрыхлителя составляло менее 3,0%, показали низкие скорости растворения (см. Фиг. 2).
Пример исследования 3: Исследование воздействия влажности
Комбинированные таблетки лозартана калия и амлодипина, полученные в Примерах 1-3 и Сравнительных Примерах 4-9, подвергали исследованию воздействия влажности при следующих условиях. Результаты показаны в Таблице 3 ниже.
[Таблица 3]
Результаты исследования воздействия влажности для покрытых оболочкой таблеток Примеров 1-3 и Сравнительных Примеров 4-9.
|
Покрытые оболочкой таблетки Примеров 1-3, в которых применяли, по меньшей мере, один тип высокомолекулярного соединения, выбранного из группы, состоящей из поливинилового спирта, гипромеллозы (вязкость: 10 мПа⋅с или выше) и гидроксипропилцеллюлозы в качестве покрывающего агента, показали превосходную стабильность при хранении. Напротив, покрытые оболочкой таблетки Сравнительных Примеров 7-9, в которых применяли два типа высокомолекулярного соединения в качестве покрывающего агента, гипромеллозу (вязкость: 10 мПа⋅с или менее) и гидроксипропилцеллюлозу, показали низкую стабильность при хранении под воздействием влажности по сравнению с Примерами 1-3. В то же время покрытые оболочкой таблетки Сравнительных Примеров 4-6 по сравнению с Примерами 1-3 имели одинаковые композиции покрывающих агентов, но соотношение разрыхлителя составляло 11,2%, что выше приблизительно на 65%, и, следовательно, увеличение толщины, увеличение массы и число поврежденных таблеток было значительно выше при воздействии влажности.
Пример исследования 4: Ускоренное исследование стабильности
Основываясь на результатах Примеров исследования 1-3, комбинированные таблетки лозартана калия и амлодипина, полученные в Примерах 1-3, которые показали высокие скорости растворения и стабильность при хранении при воздействии влажности, подвергали исследованию стабильности при условиях ускоренных испытаний, описанных ниже. Результаты показаны в Таблице 4 ниже.
<Условия ускоренных испытаний камеры для хранения>
(1) Температура: 50°C±2°C
(2) Упаковка: упаковочные бутылки ПЭНД
Время исследования - исходное и после 28 дней хранения
Условия анализа
Родственные примеси амлодипина: то же, что и в условиях анализа Примера исследования 1.
Родственные примеси лозартана: то же, что и в условиях анализа Примера исследования 2.
[Таблица 4]
|
Как показано в Таблице 4, количества получения родственных примесей находились в допустимых пределах в Примерах 1-3. Но таблетки Примеров 2 и 3, в которых применяли поливиниловый спирт, показали более значительные увеличения получения родственных примесей по сравнению с покрытыми оболочкой таблетками Примера 1, в которых в качестве покрывающего агента применяли гипромеллозу.
Результаты Примеров исследования 1-4 показали, что среди композиций покрывающего агента, указанных для Примеров 1-3 и Сравнительных Примеров 1-9, таких как гипромеллоза с различной вязкостью и Опадрай 58F18422 и 80W AMB, которые содержат поливиниловый спирт, наиболее предпочтительной являлась гипромеллоза с вязкостью 15 мПа⋅с, что позволило Примеру 1 продемонстрировать лучшую стабильность при хранении при воздействии влажности и лучшую стабильность при условиях ускоренных испытаний.
Примеры 4 и 5 и Сравнительные Примеры 10-13: Получение комбинированных составов II
Комбинированные составы получали в соответствии с композициями части влажных гранул, части уплотнения и части конечного смешивания, которые были такими же, как в Примере 1. Кроме того, их получали в соответствии с композициями покрывающего агента, как показано в Таблице 5 ниже, в которых применяли те же самые компоненты, что и в Примере 1, но количество каждого компонента было или увеличено, или уменьшено на конкретное соотношение относительно Примера 1.
[Таблица 5]
Композиция комбинированных составов Примеров 4 и 5 и Сравнительных Примеров 10-13
|
[Таблица 6]
Соотношения разрыхлителя и покрывающего агента в комбинированных составах Примеров 1, 4 и 5 и Сравнительных Примеров 10-13.
|
Пример исследования 5: Исследование воздействия влажности
Таблетки Примеров 1, 4 и 5 и Сравнительных Примеров 10-13 подвергали исследованию воздействия влажности, повторяя методику Примера исследования 4. Результаты показаны в таблице 7.
[Таблица 7]
Результаты исследования воздействия влажности для комбинированных составов Примеров 1, 4 и 5 и Сравнительных Примеров 10-13.
|
Покрытые оболочкой таблетки Примеров 1, 4 и 5 и Сравнительного Примера 13, в которых соотношение разрыхлителя и покрывающего агента составляло 3,0:1 или ниже, показали высокую стабильность при хранении, но не покрытые оболочкой таблетки Сравнительного Примера 10 и покрытые оболочкой таблетки Сравнительных Примеров 11 и 12, в которых соотношение разрыхлителя и покрывающего агента составляло 3,9:1 или выше, показали увеличение массы и увеличение толщины на 5,0% или более и 3,0% или более, соответственно. В частности, в отношении таблеток, имеющих разрыхлитель, к разрыхлителю покрытых оболочкой таблеток 3,9:1 или выше, как в случае покрытых оболочкой таблеток Сравнительных Примеров 11 и 12, чем выше соотношение, тем больше таблеток разбухает и разрушается, проявляя низкую стабильность при хранении.
Пример исследования 6: Исследование растворимости амлодипина
Таблетки Примеров 1, 4 и 5 и Сравнительных Примеров 11-13 подвергали испытанию на растворимость, повторяя методику Примера исследования 1. В результате, Примеры 1, 4 и 5 и Сравнительные Примеры 11 и 12, в которых соотношение разрыхлителя и покрывающего агента составляло 1,9:1 или выше, показали высокие скорости растворения, тогда как Сравнительный Пример 13, в котором соотношение разрыхлителя и покрывающего агента составляло 1,5:1, показал низкую скорость растворения (см. Фиг. 3).
Пример исследования 7: Исследование растворимости лозартана калия
Таблетки Примеров 1, 4 и 5 и Сравнительных Примеров 11-13 подвергали испытанию на растворимость, повторяя методику Примера исследования 2. В результате, Примеры 1, 4 и 5 и Сравнительные Примеры 11 и 12, в которых соотношение разрыхлителя и покрывающего агента составляло 1,9:1 или выше, показали высокие скорости растворения, тогда как Сравнительный Пример 13, в котором соотношение разрыхлителя и покрывающего агента составляло 1,5:1, показал низкую скорость растворения (см. Фиг. 4).
Результаты Примеров исследования 5-7 показали, что покрытые оболочкой таблетки Примеров 1, 4 и 5, в которых соотношение разрыхлителя и покрывающего агента находилось в диапазоне от приблизительно 1,9:1 до приблизительно 2,9:1, показали лучшую стабильность при хранении при воздействии влажности и лучшие скорости растворения амлодипина и лозартана калия.
Промышленная применимость
Композиция настоящего изобретения является пригодной для получения превосходного твердого состава, проявляющего улучшенную эффективность доставки лекарственного средства и стабильность при хранении.