Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЙ КОМБИНИРОВАННЫЙ СОСТАВ КАПСУЛЫ, СОДЕРЖАЩИЙ ТАДАЛАФИЛ И ТАМСУЛОЗИН
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В общем, настоящее изобретение относится к комбинированному составу капсулы, содержащему тадалафил и тамсулозин, для предотвращения или лечения эректильной дисфункции и доброкачественной гиперплазии предстательной железы, и способу его получения.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Эректильная дисфункция и доброкачественная гиперплазия предстательной железы представляют собой заболевания, свойственные мужчинам в возрасте 50 лет или старше. Эректильная дисфункция представляет собой сексуальную дисфункцию, характеризуемую неспособностью иметь или сохранять эрекцию пениса в процессе половой активности из-за различных причин, включая сердечнососудистые заболевания, диабет, недостаток гормонов и т.д. Доброкачественная гиперплазия предстательной железы представляет собой увеличение размера предстательной железы, которое вызывает дизурию, с сопутствующим или последующим возникновением осложнений, таких как инфекции мочевыводящих путей, мочекаменная болезнь, гематурия, почечная недостаточность и т.д.
Тадалафил представляет собой вещество, принадлежащее к ингибиторам фосфодиэстеразы 5 (PDE 5), таким как сильденафил и варденафил. Тадалафил имеет время разложения, по меньшей мере, в 3 раза большее, чем сильденафил и варденафил. Тадалафил был первоначально разработан Icos Corporation. Eli Lilly and Company в настоящее время предлагает на рынке Cialis®, терапию эректильной дисфункции, включающую тадалафил, и Adcirca®, терапию для легочной артериальной гипертензии. Cialis® был одобрен в 2011 управлением по контролю за продуктами питания и лекарственными средствами США в качестве терапии доброкачественной гиперплазии предстательной железы.
Тамсулозин представляет собой α1a блокатор, эффективный в лечении симптомов доброкачественной гиперплазии предстательной железы, хронического простатита и хронической боли в животе. Кроме того, тамсулозин является также эффективным в лечении уролитиаза посредством механизма расслабления скелетных мышц блокированием α1a. Тамсулозин был впервые разработан Yamanouchi Pharmaceutical Co., Ltd. в 1996, и известны различные продукты, содержащие гидрохлорид тамсулозина (выложенная корейская патентная публикация No. 2006-105976 и т.д.).
Эректильная дисфункция и доброкачественная гиперплазия предстательной железы могут возникать отдельно и независимо друг от друга. Однако, эректильная дисфункция и доброкачественная гиперплазия предстательной железы, вероятно, возникают у одного пациента, и, согласно одному из исследований, 8,5 пациентов из 10 пациентов с эректильной дисфункцией также имеют заболевания предстательной железы. Соответственно, существует необходимость в разработке терапевтического способа одновременного лечения данных двух заболеваний с превосходной стабильностью и эффективностью.
В частности, хотя механизм действия тадалафила отличается от механизма действия тамсулозина, они оба являются эффективными в лечении доброкачественной гиперплазии предстательной железы. Следовательно, более превосходный терапевтический эффект можно получить одновременным введением и тадалафила и тамсулозина или через интервалы времени комбинированной терапии, и также неблагоприятные эффекты в результате длительного введения можно облегчить снижением дозы каждого отдельного лекарственного средства. Однако, комбинированная терапия, которая требует введения, по меньшей мере, двух лекарственных средств в качестве отдельных частей может ухудшать соблюдение режима приема препарата, и, таким образом, может вызывать немало неудобств у пациентов, которые находятся на непрерывном лечении. Кроме того, комбинированная терапия может вызывать немало неудобств у пациентов, которые постоянно ведут общественную деятельность, требуя, чтобы они носили лекарственные средства с собой и вводили несколько отдельных лекарственных единиц.
Соответственно, существует неотложная необходимость в разработке комбинированного состава (также называемого комбинированным препаратом), содержащего, по меньшей мере, два активных ингредиента, требующих комбинированной терапии. Однако, разработка комбинированного состава, содержащего, по меньшей мере, два активных ингредиента, приводит к следующим проблемам. Во-первых, комбинированный состав требует, чтобы различные активные ингредиенты, которые будут в нем применять, легко и свободно комбинировались, но неожиданные затруднения могут возникать из-за различных проблем, вызванных фармакокинетическими и фармацевтическими характеристиками лекарственных средств. Во-вторых, количество композиции, содержащей активные ингредиенты и фармацевтически приемлемое вспомогательное вещество, должно быть в диапазоне, подходящем для лекарственного препарата. Следовательно, когда количество активных ингредиентов, которые комбинируют, является избыточным или слишком маленьким, может быть трудно получить их в виде композиции с подходящей массой. В-третьих, при получении комбинированного лекарственного средства, скорость растворения и стабильность комбинированного состава могут ухудшаться за счет взаимодействия между различными активными ингредиентами комбинированного состава, таким образом, делая трудным получение фиксированного комбинированного состава для введения в виде физико-химически стабильной формы. Комбинированный состав можно получить в виде двухслойной или трехслойной таблетки, отделяя каждый активный ингредиент в каждом отдельном слое. Однако приведенный выше способ будет требовать специального производственного оборудования, такого как таблетирующая машина для получения двухслойных или трехслойных таблеток, и также между ингредиентами в соседних областях таблеток могут возникать взаимодействия. На современном уровне техники, можно получить превосходное разделение между ингредиентами.
Соответственно, существует необходимость в разработке нового комбинированного состава с очень удобным способом проведения терапии и превосходной стабильностью, при этом способного обеспечивать эффекты предотвращения и лечения эректильной дисфункции и доброкачественной гиперплазии предстательной железы.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Соответственно, цель настоящего изобретения заключается в обеспечении комбинированного состава с очень удобным способом проведения терапии, превосходными скоростью растворения и стабильностью, при этом способного обеспечивать эффекты предотвращения и лечения и эректильной дисфункции, и доброкачественной гиперплазии предстательной железы.
Для того чтобы достигнуть указанной выше цели (целей), настоящее изобретение обеспечивает комбинированный состав капсулы для предотвращения или лечения эректильной дисфункции и доброкачественной гиперплазии предстательной железы, содержащий: независимую часть тадалафила, содержащую тадалафил или его фармацевтически приемлемую соль; и независимую часть тамсулозина, содержащую тамсулозин или его фармацевтически приемлемую соль, в раздельном состоянии.
Для того чтобы достигнуть другой цели, настоящее изобретение также обеспечивает способ получения приведенного выше комбинированного состава капсулы, включающий: a) смешение тадалафила или его фармацевтически приемлемой соли с фармацевтически приемлемой добавкой, и гранулирование смеси или таблетирование таким образом полученных гранул до таблеток; b) смешение тамсулозина или его фармацевтически приемлемой соли с фармацевтически приемлемой добавкой, и гранулирование смеси или таблетирование таким образом полученных гранул до таблеток; и c) загрузка в твердую капсулу гранул или таблеток тадалафила, полученных на стадии a), и гранул или таблеток тамсулозина, полученных на стадии b), в разделенном состоянии.
Комбинированный состав капсулы настоящего изобретения эффективно получают загрузкой фармацевтической композиции в ограниченную внутреннюю емкость капсулы. Следовательно, комбинированный состав капсулы настоящего изобретения обладает преимуществами, заключающимися в том, что он может давать высокие дозы активных ингредиентов в небольшой по размеру капсуле, посредством этого обладая высокой продуктивностью и обеспечивая пациентов более удобным способом введения лекарственного препарата. Кроме того, комбинированный состав капсулы настоящего изобретения обладает превосходной скоростью растворения, поскольку фармацевтически активные ингредиенты в капсулы разделены, таким образом, оказывая небольшое влияние на скорость растворения фармацевтически активных ингредиентов. Кроме того, комбинированный состав капсулы настоящего изобретения обладает минимальной реакционноспособностью между активными ингредиентами, таким образом обеспечивая превосходную стабильность продукта во времени и способен доводить до максимума терапевтический эффект фармацевтически активных ингредиентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенные выше и другие цели и отличительные признаки настоящего изобретения будут более понятны из следующего описания настоящего изобретения, когда они берутся вместе с прилагаемыми чертежами:
Фигура 1 представляет собой рисунок комбинированного состава капсулы, полученного согласно примерному варианту осуществления настоящего изобретения;
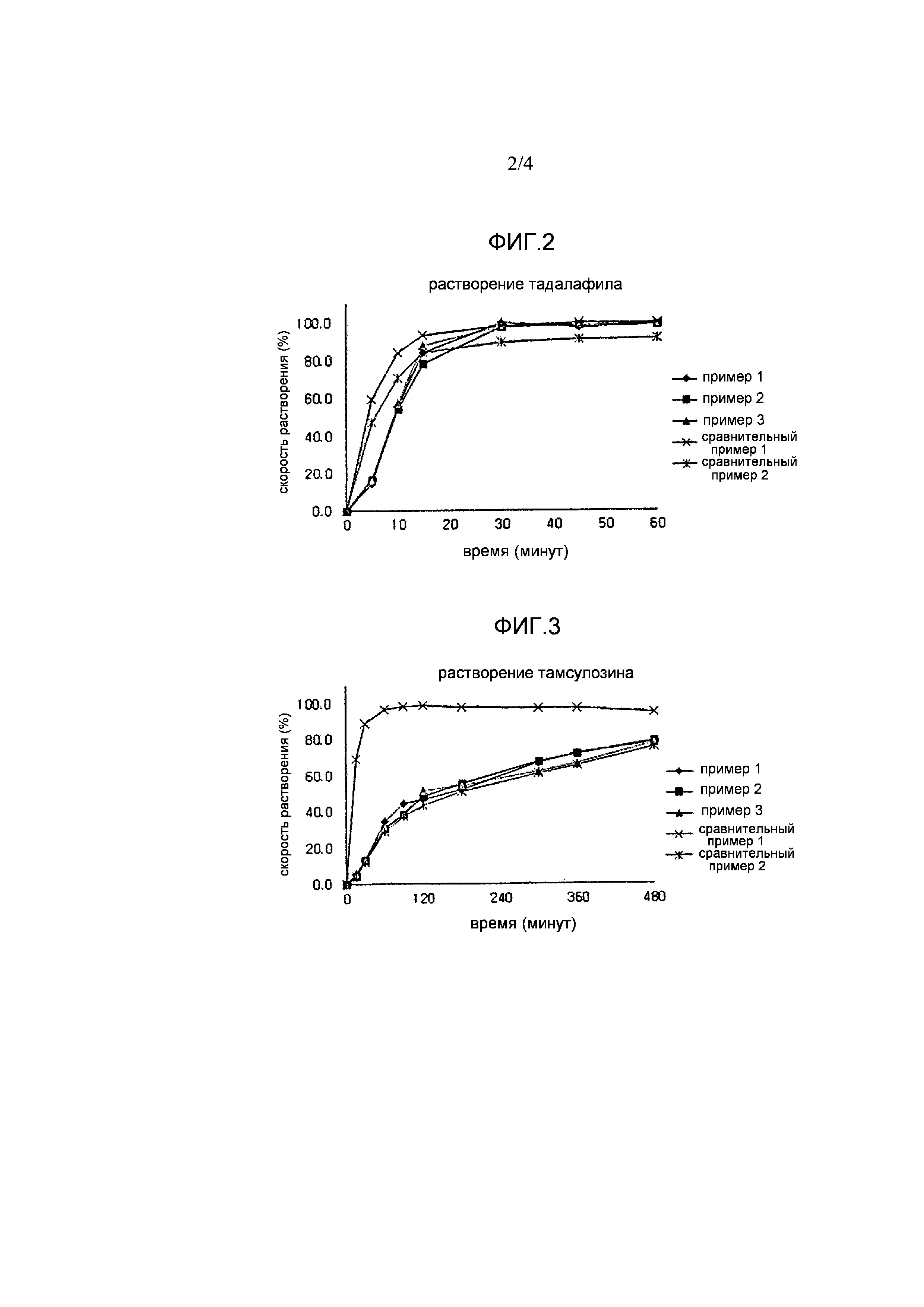
Фигура 2 и фигура 3, соответственно, показывают результаты испытания на растворения для тадалафила и тамсулозина, проведенного согласно примеру испытания 1;
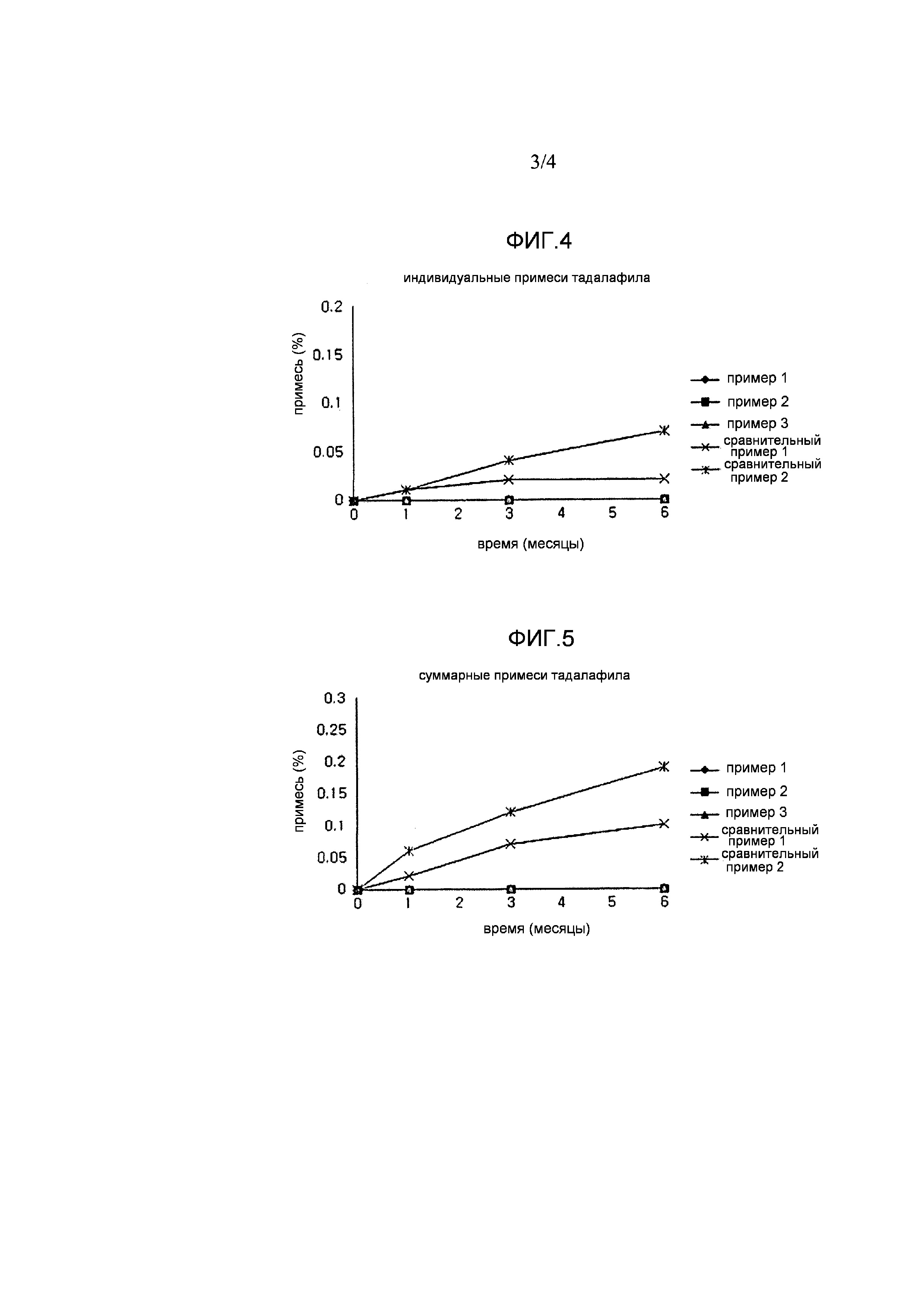
Фигура 4 и фигура 5, соответственно, показывают индивидуальные примеси и суммарные примеси тадалафила согласно примеру испытания 2; и
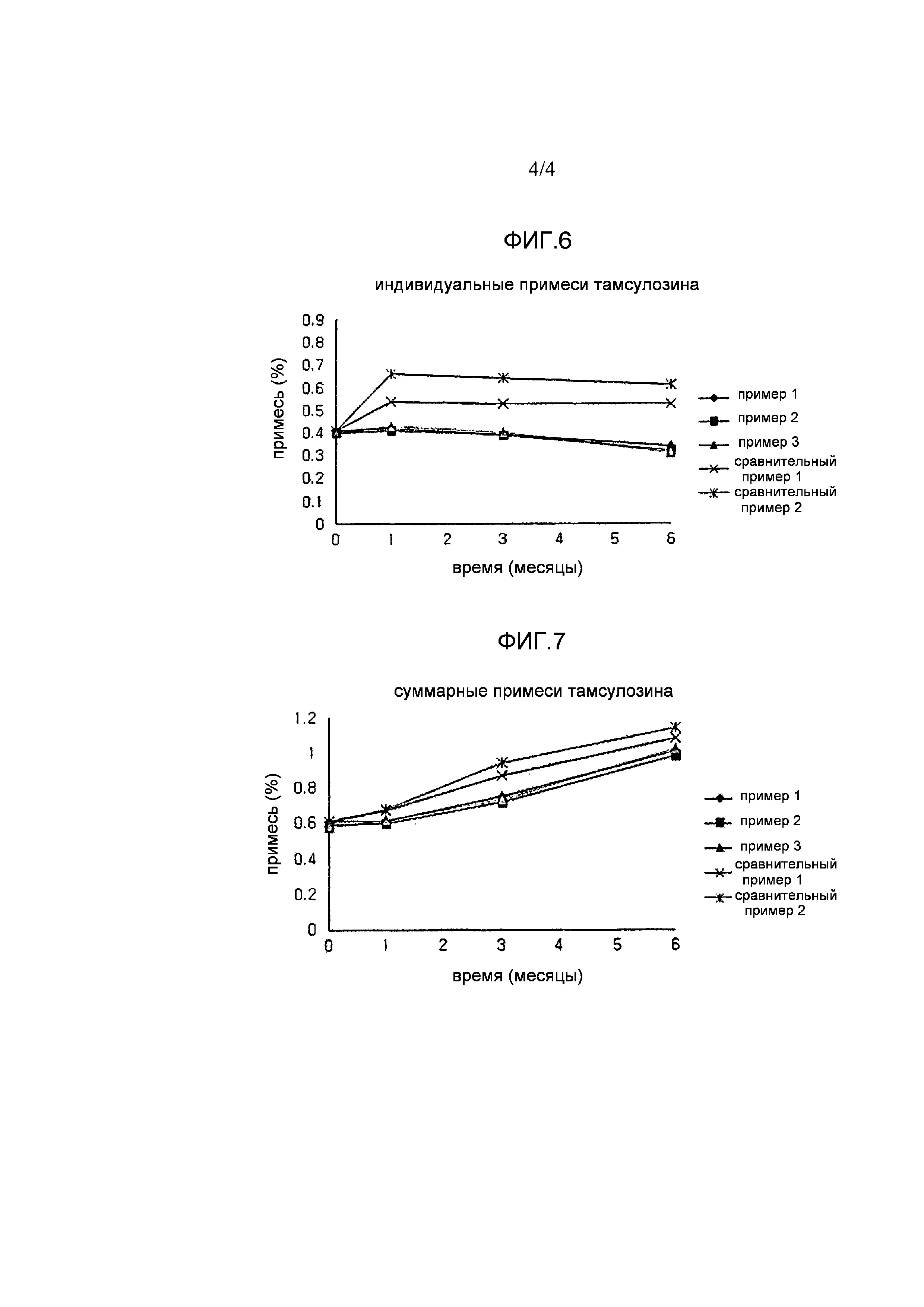
Фигура 6 и фигура 7, соответственно, показывают индивидуальные примеси и суммарные примеси тамсулозина согласно примеру испытания 2.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение описано более подробно ниже.
Термин “комбинированный состав”, применяемый в настоящем изобретении, относится к составу, который содержит, по меньшей мере, два типа лекарственных средств или активных ингредиентов в единичной лекарственной форме, такой как таблетка или капсула.
Комбинированный состав капсулы настоящего изобретения содержит i) независимую часть тадалафила, содержащую тадалафил или его фармацевтически приемлемую соль; и ii) независимую часть тамсулозина, содержащую тамсулозин или его фармацевтически приемлемую соль, в разделенном состоянии.
Фигура 1 представляет собой рисунок, иллюстрирующий комбинированный состав капсулы согласно примерному варианту осуществления настоящего изобретения, в котором независимая часть тадалафила и независимая часть тамсулозина, соответственно, образуют отдельный независимый слой в твердой капсуле, которую заполняют. Более конкретно, в примерном варианте осуществления, комбинированный состав капсулы может содержать i) независимый слой тадалафила, содержащий тадалафил или его фармацевтически приемлемую соль; и ii) независимый слой тамсулозина, содержащий тамсулозин или его фармацевтически приемлемую соль, в разделенном состоянии.
Комбинированный состав капсулы настоящего изобретения обладает терапевтическим эффектом предотвращения или лечения эректильной дисфункции и доброкачественной гиперплазии предстательной железы.
Независимая часть тадалафила и независимая часть тамсулозина может содержать воду в диапазоне 5% или меньше, соответственно.
Фармацевтически приемлемая соль тамсулозина может представлять собой, например, гидрохлорид тамсулозина.
В комбинированном составе капсулы настоящего изобретения, независимая часть тадалафила и независимая часть тамсулозина могут быть, соответственно, в виде гранулы, таблетки или их комбинации.
Другими словами, комбинированный состав настоящего изобретения может содержать i) гранулу тадалафила или таблетку тадалафила, содержащую тадалафил или его фармацевтически приемлемой соли; и ii) гранулу тамсулозина или таблетку тамсулозина или его фармацевтически приемлемой соли, в разделенном состоянии.
Предпочтительно, по меньшей мере, одна из независимой части тадалафила и независимой части тамсулозина может быть в форме таблетки. Например, комбинированный состав капсулы может содержать a) таблетку тадалафила и гранулу тамсулозина, b) гранулу тадалафила и таблетку тамсулозина, или c) таблетку тадалафила и таблетку тамсулозина, загруженные в твердую капсулу. Рисунок комбинированного состава капсулы согласно одному варианту осуществления настоящего изобретения, который содержит таблетку тадалафила и гранулу тамсулозина, загруженные в твердую капсулу, показан на фигуре 1.
Тадалафил или его фармацевтически приемлемая соль может содержаться в диапазоне 3-7% по массе относительно суммарной массы независимой части тадалафила. Предпочтительно, тадалафил или его фармацевтически приемлемую соль можно вводить взрослому человеку при приблизительно 5 мг ежедневно.
Тамсулозин или его фармацевтически приемлемая соль может содержаться в диапазоне 0,1-0,2% по массе относительно суммарной массы независимой части тамсулозина. Тамсулозин или его фармацевтически приемлемую соль можно вводить взрослому человеку, например, при приблизительно 0,2 мг или 0,4 мг ежедневно.
В комбинированном составе капсулы настоящего изобретения, каждая из независимой части тадалафила и независимой части тамсулозина может содержать фармацевтически приемлемую добавку, соответственно, например, разбавитель, разрыхлитель, связующее, стабилизирующий агент, смазывающее вещество, краситель или их смеси.
Примеры разбавителя могут включать микрокристаллическую целлюлозу, лактозу, лудипресс, маннит, фосфат монокальция, крахмал, низкозамещенную гидроксипропилцеллюлозу и их смеси. Разбавитель можно применять в количестве приблизительно 1-95% по массе относительно суммарной массы каждой из независимой части, и предпочтительно приблизительно 5-95% по массе.
Примеры разрыхлителей могут включать кросповидон, крахмалгликолят натрия, кроскармелозу натрия, низкозамещенную гидроксипропилцеллюлозу, крахмал, альгиновую кислоту или ее натриевую соль, и их смеси, которые могут служить для стабильного распада активного ингредиента. Разрыхлитель можно применять в количестве приблизительно 0,1-30% по массе относительно суммарной массы каждой независимой части и предпочтительно приблизительно 2-15% по массе.
Примеры связующего могут включать гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гипромеллозу, поливинилацетат, поливинилпирролидон, коповидон, макрогол, лаурилсульфат натрия, неуплотненную безводную кремниевую кислоту, синтетический силикат алюминия, силикатное производное, такое как силикат кальция или метасиликат алюминат магния, фосфат, такой как гидрофосфат кальция, карбонат, такой как карбонат кальция, предварительно желатинизированный крахмал, камеди, такие как аравийская камедь, желатин, производные целлюлозы, такие как этилцеллюлоза, и их смеси. Связующее можно применять в количестве приблизительно 0,1-30% по массе относительно суммарной массы каждой независимой части, и предпочтительно приблизительно 2-20% по массе.
Примеры смазывающего вещества могут включать стеараты металлов, такие как стеариновая кислота, стеарат кальция или стеарат магния; тальк; коллоидный диоксид кремния; эфир сахарозы и жирной кислоты; гидрированное растительное масло; высокоплавкий воск; сложные эфиры глицерина и жирных кислот; дибегенат глицерина; и их смеси. Смазывающее вещество можно применять в количестве приблизительно 0,3-5% по массе относительно суммарной массы каждой независимой части, и предпочтительно приблизительно 0,5-3% по массе.
В настоящем изобретении, каждую из независимой части тадалафила и независимой части тамсулозина можно независимо покрывать фармацевтически приемлемым покрывающим материалом. Покрывающий материал, который будут применять, может включать любой полимер, обычно применяемый на предшествующем уровне техники. Например, независимую часть тадалафила можно покрывать имеющимся в продаже опадрай®, полученным Colorcon Ltd., или подобным в качестве покрывающего материала. Примеры покрывающего материала для независимой части тамсулозина могут включать, например, метилцеллюлозу, этилцеллюлозу, поливинилацетат, поливиниловый спирт, поливинилпирролидон, повидон, метакрилатэтилакрилатный сополимер, триацетин, пропиленгликоль, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу и т.д., но не ограничиваются ими.
Предпочтительно, количество покрывающего материала следует сохранять при минимальном значении для получения составов оптимального размера и их эффективного получения. Например, покрывающий материал можно применять в количестве приблизительно 0,1-20% по массе относительно суммарной массы каждой независимой части и предпочтительно приблизительно 2-10% по массе.
Капсулы, которые будут применять для получения комбинированного состава капсулы настоящего изобретения, конкретно не ограничены, но можно применять любые стандартные твердые капсулы, применяемые в медицинских продуктах. Например, можно применять любую твердую капсулу, содержащую гипромеллозу, пуллулан, желатин, поливиниловый спирт или их смеси.
Размер твердой капсулы, которую будут применять в комбинированном составе капсулы настоящего изобретения, конкретно не ограничен, но можно применять любую капсулу со стандартным размером, применяемым в медицинских продуктах. Каждый размер капсулы может иметь изменяющуюся величину внутренней емкости, в зависимости от номера размера, например, размер No. 0 имеет приблизительно 0,68 мл, размер No. 1 приблизительно 0,47 мл, размер No. 2 приблизительно 0,37 мл, размер No. 3 приблизительно 0,27 мл, размер No. 4 приблизительно 0,20 мл и т.д. Предпочтительно, размер капсулы должен быть как можно меньшим для удобства приема пациентом комбинированного состава настоящего изобретения. Однако, из-за ограничения на количество, которое будут загружать в капсулу, можно применять капсулы № 0, 1, 2, 3 и 4, и предпочтительно, капсулу № 0, 1, 2 и 3.
В комбинированном составе капсулы настоящего изобретения применяют тадалафил, PDE 5 ингибитор, в качестве первого активного ингредиента, посредством этого обеспечивая терапевтические эффекты предотвращения и лечения эректильной дисфункции и доброкачественной гиперплазии предстательной железы, тогда как в нем применяют тамсулозин, α1a блокатор, в качестве второго активного ингредиента, посредством этого обеспечивая постоянные терапевтические эффекты предотвращения и лечения дизурических заболеваний, таких как доброкачественная гиперплазия предстательной железы, хронический простатит, хроническая боль в животе, уролитиаз и т.д.
Подходящие пути введения комбинированного состава капсулы настоящего изобретения могут включать пероральный, буккальный и сублингвальный пути.
В комбинированном составе капсулы настоящего изобретения, фармацевтическую композицию эффективно загружают в капсулу, имеющую ограниченную внутреннюю емкость, и таким образом, можно загрузить высокие дозы активных ингредиентов в капсулу небольшого размера. Соответственно, комбинированный состав капсулы настоящего изобретения можно получить с высокой производительностью, и он также обеспечивает пациентов более удобным способом приема лекарственных средств. Кроме того, два активных ингредиента, тадалафил и тамсулозин, включены в твердую капсулу в разделенном состоянии и, таким образом, два ингредиента можно полностью разделить. Следовательно, два активных ингредиента имеют небольшое взаимное влияние на их скорость растворения, таким образом, обеспечивая превосходную общую скорость растворения.
Кроме того, сниженная до минимума реакционноспособность между активными ингредиентами делает вклад в стабильность продукта с течением времени, посредством этого делая максимальным терапевтический эффект, и также можно применять имеющийся способ анализа для оценки стабильность с течением времени единичного состава, без необходимости разрабатывать дополнительные способы.
Комбинированный состав капсулы настоящего изобретения можно получить способом, включающим: a) смешение тадалафила или его фармацевтически приемлемой соли с фармацевтически приемлемой добавкой и гранулирование или таблетирование смеси; b) смешение тамсулозина или его фармацевтически приемлемой соли с фармацевтически приемлемой добавкой и гранулирование или таблетирование смеси; и c) загрузка гранул или таблеток тадалафила, полученных на стадии a), и гранул или таблеток тамсулозина, полученных на стадии b), в твердую капсулу, в разделенном состоянии.
На стадии a) и стадии b), таблетки можно получить таблетированием гранул, полученных гранулированием. Более конкретно, таблетки можно получить, применяя машину для таблетирования согласно общепринятому способу. Предпочтительно, таким образом полученные таблетки могут иметь подходящую твердость, например, среднюю твердость в диапазоне 1-30 единица твердости по Кнупу после таблетирования.
Предпочтительно, по меньшей мере, одна из стадии a) и стадии b) может включать таблетирование, и таким образом, по меньшей мере, один из тадалафила и тамсулозина можно загружать в капсулу в форме таблетки. Например, комбинированный состав капсулы можно получить проведением таблетирования на стадии a), проведением гранулирования на стадии b) и загрузкой таблетки тадалафила и гранулы тамсулозина, в разделенном состоянии, в твердую капсулу.
Кроме того, способ получения комбинированного состава капсулы может дополнительно включать нанесение покрытия на гранулы или таблетки, полученные гранулированием или таблетированием на стадии a) и стадии b), из фармацевтически приемлемого покрывающего материала. Например, комбинированный состав капсулы можно получить осуществлением нанесения покрытия после таблетирования тадалафила на стадии a), осуществления нанесения покрытия после гранулирования тамсулозина на стадии b), и загрузкой таблетки тадалафила с покрытием и гранулы тамсулозина с покрытием, в разделенном состоянии, в твердую капсулу. Примеры покрывающего материала, подходящего для тадалафила и тамсулозина, являются такими же, как описано выше.
Настоящее изобретение дополнительно описано и проиллюстрировано в примерах, приведенных ниже, которые, однако, не предполагаются ограничивающими объем настоящего изобретения.
Пример 1: комбинированный состав капсулы
<Независимая часть тадалафила>
|
<Независимая часть тамсулозина>
|
Ингредиенты в порошкообразной форме, соответствующие независимой части тадалафила, смешивали, и смесь таблетировали цилиндрическим пуансоном, имеющим диаметр 5,5 мм. Полученные в результате таблетки тадалафила покрывали раствором для нанесения покрытия, т.е., раствором опадрай® желтого (Colorcon Ltd.) в очищенной воде.
Кроме того, ингредиенты, соответствующие независимой части тамсулозина, смешивали в порошкообразной форме, и смесь получали в виде гранул. Полученные в результате гранулы тамсулозина покрывали раствором для нанесения внутреннего покрытия, т.е., раствором повидона, пропиленгликоля и поливинилацетата в воде, и затем дополнительно покрывали раствором для нанесения внешнего покрытия, т.е., раствором метакрилатэтилакрилатного сополимера и триацетина в воде.
Таким образом, покрытые таблетки тадалафила и гранулы тамсулозина загружали в твердые капсулы No. 1, содержащие гипромеллозу в качестве материала капсул, и получали в виде комбинированного состава капсулы, содержащей 5 мг тадалафила и 0,2 мг гидрохлорида тамсулозина.
Пример 2: комбинированный состав капсулы II
Комбинированный состав капсулы, содержащий 5 мг тадалафила и 0,2 мг гидрохлорида тамсулозин, получали тем же способом, как в примере 1, за исключением того, что применяемая твердая капсула содержала пуллулан в качестве материала для капсулы.
Пример 3: комбинированный состав капсулы III
Комбинированный состав капсулы, содержащий 5 мг тадалафила и 0,2 мг гидрохлорида тамсулозина, получали тем же способом, как в примере 1, за исключением того, что применяемая твердая капсула содержала желатин в качестве материала для капсулы.
Сравнительный пример 1: комбинированный состав в виде таблетки с простым смешением
|
Смесь приведенных выше ингредиентов подвергали влажному гранулированию, применяя связующее, т.е., раствор гидроксипропилцеллюлозы и лаурилсульфата натрия в воде, и затем просеивали через сита 30 мэш и сушили.
К полученному в результате высушенному материалу добавляли маннитол, микрокристаллическую целлюлозу, крахмалгликолят натрия и стеарат магния, и затем таблетировали машиной для таблетирования.
Затем, таким образом полученную таблетку, которая содержит тадалафил и тамсулозин, покрывали раствором для нанесения покрытия, т.е., раствором опадрай® желтого в очищенной воде. В результате, получали комбинированный состав в виде таблетки с простым смешением, содержащий 5 мг тадалафила и 0,2 мг гидрохлорида тамсулозин.
Сравнительный пример 2: комбинированный состав в виде двухслойной таблетки
<Слой, содержащий тадалафил>
|
<Cлой, содержащий тамсулозин>
|
Во-первых, для того чтобы получить слой, содержащий тадалафил, тадалафил подвергали влажному гранулированию, применяя связующее, т.е., раствор гидроксипропилцеллюлозы и лаурилсульфата натрия в воде, и затем просеивали через сита 30 мэш и сушили. К полученному в результате высушенному материалу добавляли маннитол, микрокристаллическую целлюлозу, крахмалгликолят натрия и стеарат магния, и затем таблетировали машиной для таблетирования.
Кроме того, ингредиенты для слоя, содержащего тамсулозин, смешивали, и затем таблетировали вместе с таблеткой тадалафила, полученной заранее, получая двухслойную таблетку.
Затем, таким образом полученную двухслойную таблетку покрывали раствором для нанесения покрытия, т.е., раствором опадрай® желтого в очищенной воде. В результате, получали комбинированный состав в виде двухслойной таблетки, содержащий 5 мг тадалафила и 0,2 мг гидрохлорида тамсулозина.
Пример испытания 1: оценка растворения
Комбинированные составы тадалафила и гидрохлорида тамсулозина, полученные в примерах 1-3 и сравнительных примерах 1 и 2, оценивали на растворение согласно условиям, описанным ниже.
<Условия для растворения тадалафила>
Испытание на растворимость проводили согласно способу с применением лопастной мешалки испытания на растворимость фармакопеи США (USP), применяя 1000 мл 0,5% лаурилсульфата натрия (SLS). Образцы для испытания на растворимость собирали на начальной стадии и через 5 минут, 10 минут, 15 минут, 30 минут, 45 минут и 60 минут, соответственно, и скорость растворения тадалафила измеряли жидкостной хроматографией в условиях, описанных ниже.
- колонка: колонку, в которой трубку из нержавеющей стали имела внутренний диаметр приблизительно 4,6 мм и длину приблизительно 5 см, заполняли октадецилсилил (ODS)-силикагелем для жидкостной хроматографии, имеющим размер частиц 3,5 мкм (Zorbax SB-C8, Agilent Zorbax)
- детектор: УФ спектрофотометр (измерение при длине волны 225 нм)
- скорость потока: 2,0 мл/мин
- вводимый объем: 50 мкл
- температура колонки: 40°C
- подвижная фаза: вода/метанол (50:50, об./об.)
- среда для растворения: 1000 мл 0,5% лаурилсульфата натрия (SLS)
<Условия для растворения тамсулозина>
Испытание на растворимость проводили согласно способу с применением лопастной мешалки испытания на растворимость USP с встряхивающим устройством при 100 об/мин, применяя 500 мл второй жидкости для испытания на распад, т.е., буфер с pH 6,8. Образцы для испытания на растворимость собирали в количестве 10 мл на первоначальной стадии и через 15 минут, 30 минут, 60 минут, 90 минут, 120 минут, 180 минут, 300 минут, 360 минут и 480 минут, соответственно. Скорость растворения тамсулозина таким образом полученных образцов измеряли жидкостной хроматографией в условиях, описанных ниже.
- колонка: колонку, в которой трубка из нержавеющей стали имела внутренний диаметр приблизительно 4,6 мм и длину приблизительно 15 см, заполняли октадецилсилил (ODS)-силикагелем для жидкостной хроматографии, имеющим размер частиц 5 мкм (Zorbax SB-C8, Agilent Zorbax)
- детектор: УФ спектрофотометр (измерение при длине волны 225 нм)
- скорость потока: регулировали для удерживания тамсулозина в течение приблизительно 6 минут
- вводимый объем: 500 мкл
- температура колонки: 40°C
- подвижная фаза: 8,7 мл перхлорной кислоты и 3,0 г гидроксида натрия растворяли в 1900 мл воды. Смесь доводили до pH 2,0 гидроксидом натрия, и затем добавляли к ней воду до 2000 мл. К 1400 мл полученного в результате раствора добавляли 600 мл ацетонитрила, получая подвижную фазу.
- среда для растворения: 500 мл второй жидкости для испытания на распад (17 г KH2PO4 и 16,75 г Na2HPO4 растворяли в 10 л очищенной воды, получая буфер с pH 6,8).
Результат растворения тадалафила показан в таблице 1 и на фигуре 2, и результат растворения тамсулозина показан в таблице 2 и на фигуре 3.
|
Как показано в таблице 1 и на фигуре 2, комбинированные составы капсулы, полученные в примерах 1-3, и комбинированные составы в виде таблетки с простым смешением, полученные в сравнительном примере 1, показали превосходные скорости растворения тадалафила. Однако, в случае комбинированного состава в виде двухслойной таблетки, полученного в сравнительном примере 2, скорость растворения тадалафила снижалась на приблизительно 5% или более, поскольку часть тадалафила контактировала с агентом, замедляющим высвобождение, требуемым для тамсулозина.
|
Как показано в таблице 2 и на фигуре 3, комбинированные составы капсулы, полученные в примерах 1-3, и двухслойный комбинированный состав, полученный в сравнительном примере 2, показали превосходные скорости растворения тамсулозина. Однако в случае комбинированного состава в виде таблетки с простым смешением, полученного в сравнительном примере 1, тамсулозин быстро растворялся из-за отсутствия агента, замедляющего высвобождение, но состав не подходил для терапевтического лечения из-за короткого времени полуразложения тамсулозина.
В свете результатов испытаний на растворимость выше, комбинированные составы капсулы настоящего изобретения могут давать превосходное растворение и тадалафила и тамсулозина из-за отсутствия взаимодействия между ними, поскольку два активных ингредиента, тадалафил и тамсулозин, загружают в капсулу в разделенном состоянии. Напротив, в случае комбинированного состава в виде таблетки с простым смешением и двухслойного комбинированного состава, растворение тадалафила или тамсулозина было плохим из-за взаимодействия между ингредиентами или проблем при получении комбинированных составов.
Пример испытания 2: испытание на примеси
Комбинированные составы, содержащие тадалафил и гидрохлорид тамсулозина, полученные в примерах 1-3 и сравнительных примерах 1 и 2, испытывали на их примеси согласно условиям, описанным ниже.
<Условия ускоренного хранения>
Условия ускоренного хранения: при 40°C при 75% относительной влажности
Временной график испытания: первоначальная стадия, через 1 месяц, 3 месяца и 6 месяцев
<Условия испытания на примеси тадалафила>
Испытания проводили согласно испытанию на примеси фармакопеи США. Состав, соответствующий 100 мг тадалафила, добавляли в 100 мл колбу, которую, затем, заполняли наполовину подвижной фазой и встряхивали в течение 15 минут. Полученный в результате материал растворяли ультразвуковой вибрацией в течение приблизительно 2 минут, смешивали с подвижной фазой, регулируя ее объем, и затем фильтровали. Полученный в результате материал в количестве 5 мл смешивали снова с 20 мл подвижной фазы, получая жидкость образца, имеющую конечную концентрацию 0,25 мг/мл, и примеси тадалафила измеряли жидкостной хроматографией согласно условиям, описанным ниже.
- колонка: колонку, в которой трубка из нержавеющей стали имела внутренний диаметр приблизительно 4,6 мм и длину приблизительно 15 см, заполняли октадецилсилил (ODS)-силикагелем для жидкостной хроматографии, имеющим размер частиц 3,5 мкм (Zorbax SB-C8, Agilent Zorbax)
- детектор: УФ спектрофотометр (измерение при длине волны 285 нм)
- скорость потока: 1,0 мл/мин
- вводимый объем: 10 мкл
- температура колонки: 40°C
- подвижная фаза: 0,1% трифторусксуная кислота-ацетонитрил/очищенная вода (35:65, об./об.)
- продолжительность анализа: 30 мин
<Условия испытания на примеси тамсулозина>
Испытания проводили согласно испытанию на примеси фармакопеи США. Состав, соответствующий 4 мг тамсулозина, добавляли в 25 мл колбу, который, затем, разбавляли подвижной фазой. Точно 10 мл полученного в результате раствора отбирали и добавляли в 25 мл колбу, получая разбавленный образец. Примеси тамсулозина измеряли жидкостной хроматографией в условиях, описанных ниже.
Перед основным пиком
- колонка: колонку, в которой трубка из нержавеющей стали имела внутренний диаметр приблизительно 4,6 мм и длину приблизительно 15 см, заполняли октадецилсилил (ODS)-силикагелем для жидкостной хроматографии, имеющим размер частиц 3,5 мкм (Zorbax SB-C8, Agilent Zorbax)
- детектор: УФ спектрофотометр (измеряли при длине волны 225 нм)
- скорость потока: регулировали для удерживания тамсулозина в течение приблизительно 8 мин
- вводимый объем: 100 мкл
- температура колонки: 40°C
- подвижная фаза: ацетонитрил/буферный раствор=3:7 (буферный раствор получали растворением 8,7 мл 70% перхлорной кислоты и приблизительно 3,0 г NaOH в 1900 мл очищенной воды, доводя pH смеси до pH 2,0 1N NaOH, и затем разбавляя ее 2000 мл очищенной воды)
- продолжительность анализа: 25 мин
После основного пика
- колонка: колонку, в которой трубка из нержавеющей стали имела внутренний диаметр приблизительно 4,6 мм и длину приблизительно 15 см, заполняли октадецилсилил (ODS)-силикагелем для жидкостной хроматографии, имеющим размер частиц 5 мкм (Zorbax SB-C8, Agilent Zorbax)
- детектор: УФ спектрофотометр (измеряли при длине волны 225 нм)
- скорость потока: 1,0 мл/мин
- вводимый объем: 100 мкл
- температура колонки: 40°С
- подвижная фаза: ацетонитрил/буферный раствор=1:1 (буферный раствор получали растворением 8,7 мл 70% перхлорной кислоты и приблизительно 3,0 г NaOH в 1900 мл очищенной воды, доводя pH смеси до pH 2,0 1N NaOH, и затем разбавляя ее 2000 мл очищенной воды)
- продолжительность анализа: 15 мин
Количество примесей тадалафила показано в таблицах 3 и 4 и на фигурах 4 и 5. Количество примесей тамсулозина показано в таблицах 5 и 6 и на фигурах 6 и 7.
|
|
Как показано в таблицах 3 и 4 и на фигурах 4 и 5, комбинированные составы капсулы, полученные в примерах 1-3, показывали превосходные количества примесей тадалафила и удовлетворяли стандартам фармакопеи США для индивидуальных примесей и суммарных примесей, т.е., 0,2% или меньше и 0,3% или меньше, соответственно. Однако в случае комбинированных составов в виде таблетки с простым смешением, полученных в сравнительном примере 1, и комбинированных составов в виде двухслойной таблетки, полученных в сравнительном примере 2, количество примесей увеличивалось, поскольку часть тадалафила контактировала с тамсулозином или его вспомогательными веществами.
|
|
Как показано в таблицах 5 и 6 и на фигурах 6 и 7, комбинированные составы капсулы, полученные в примерах 1-3, показывали превосходные количества примесей тамсулозина и удовлетворяли стандартам фармакопеи США для индивидуальных примесей и суммарных примесей, т.е., 0,9% или меньше и 1,1% или меньше, соответственно. Однако в случае комбинированных составов в виде таблетки с простым смешением, полученных в сравнительном примере 1, и комбинированных составов в виде двухслойной таблетки, полученных в сравнительном примере 2, количество примесей увеличивалось, поскольку часть тамсулозина контактировала с тадалафилом или его вспомогательными веществами.
Тогда как настоящее изобретение описано относительно приведенных выше конкретных вариантов осуществления, ясно, что специалист в данной области техники может осуществлять различные модификации и изменения в настоящем изобретении, которые также попадают в объем настоящего изобретения, как определено формулой изобретения.