Результат интеллектуальной деятельности: КОМПОЗИЦИОННЫЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ СЛОЙ ПЛЕНОЧНОГО ПОКРЫТИЯ, СОДЕРЖАЩИЙ АКТИВНЫЙ ИНГРЕДИЕНТ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композиционному препарату, включающему слой пленочного покрытия, содержащий активный ингредиент, и к способу его получения, и, в частности, к композиционному препарату, включающему слой пленочного покрытия, содержащий активный ингредиент, который может иметь устойчивую форму и стойкость по отношению к обычным внешним воздействиям, а также высокую скорость растворения активного ингредиента, и к способу получения данного композиционного препарата.
УРОВЕНЬ ТЕХНИКИ
Размер предстательной железы (простаты) здорового молодого человека приблизительно равен размеру грецкого ореха, и с возрастом предстательная железа постепенно увеличивается. Гипертрофия предстательной железы представляет собой заболевание, характеризующееся значительным увеличением предстательной железы, при котором происходит пережатие уретры, проходящей через предстательную железу, что приводит к возникновению различных симптомов.
Несмотря на то, что причины возникновения гипертрофии предстательной железы до сих пор точно не установлены, известно, что они включают комплекс различных факторов, как и в случае других хронических заболеваний. Признанной в настоящее время причиной гипертрофии предстательной железы является старение нормальных яичек. Предстательная железа представляет собой орган, зависимый от андрогенного гормона (мужского полового гормона), и нуждается в постоянной подпитке андрогенным гормоном для нормального роста и функционирования. Предстательная железа может уменьшаться в размерах, когда перестает вырабатываться андрогенный гормон, вследствие кастрации.
Симптомы гипертрофии предстательной железы включают симптомы нижних мочевыводящих путей (СНМП), включающие симптомы, вызванные нарушениями удержания мочи в мочевом пузыре, такими как частое мочеиспускание, до восьми или более раз в сутки, никтурия, экстренное мочеиспускание, сопровождаемое сильным, неожиданным и непреодолимым позывом к мочеиспусканию, экстренное недержание мочи и болезненное мочеиспускание (дизурия); и симптомы, вызванные нарушениями опорожнения мочевого пузыря, такие как замедленное мочеиспускание (при котором пациент должен ожидать начала мочеиспускания), перерывы мочеиспускания (при прерывающемся потоке мочи), напряженное мочеиспускание (при котором пациент должен напрягаться для мочеиспускания), слабый поток мочи, ощущение неполного опорожнения и задержка мочеиспускания.
Ингибиторы 5-α-редуктазы представляют собой лекарственные средства, обычно применяемые для лечения гипертрофии предстательной железы, и их можно применять отдельно, хотя также известно, что для более эффективного лечения гипертрофии предстательной железы их применяют совместно с тамсулозином или ингибитором фосфодиэстеразы-5 (например, тадалафилом, варденафилом или уденафилом).
Ингибиторы 5-α-редуктазы могут ингибировать превращение тестостерона в дигидротестостерон, который дополнительно способствует увеличению предстательной железы и, таким образом, могут блокировать увеличение простаты и освобождать мочевыводящие пути от физического сдавливания.
Тамсулозин представляет собой лекарственное средство, которое селективно блокирует α-адренорецепторы мочеполовых органов и, как известно, облегчает мочеиспускание за счет релаксации простаты и гладких мышц, окружающих мочевой пузырь, что облегчает симптомы доброкачественной гипертрофии предстательной железы.
Тадалафил (Сиалис, Lilly ICOS) и варденафил (Левитра, GSK), которые представляют собой ингибиторы фосфодиэстеразы-5, изначально были разработаны как лекарственные средства для лечения импотенции. Однако эти лекарственные средства все чаще применяют при большем количестве показаний, например, при гипертрофии предстательной железы и гиперактивном мочевом пузыре (Euro. Urol. 2008; 1236-44; J. Uro. 2007; 1401-7).
Комбинации лекарственных средств, такие как сочетание ингибитора 5-α-редуктазы и тамсулозина или сочетание ингибитора 5-α-редуктазы и ингибитора фосфодиэстеразы-5, имеют преимущества, благодаря повышенной эффективности, создаваемой за счет различающихся механизмов воздействия двух активных ингредиентов, введенных в виде комбинации (ЕР 1501517; BJU Int. 2006 Apr. 97 Suppl. 2:39-43; обсуждение 44-5).
Однако при получении композиционного препарата, включающего два или более активных ингредиента, такого как рассмотренные выше комбинации лекарственных средств, могут возникать проблемы, связанные со стабильностью этих активных ингредиентов, из-за взаимодействия двух или более различных активных ингредиентов. Для обеспечения стабильности такого композиционного препарата был создан композиционный препарат, который включает внутреннюю часть (core), содержащую активный ингредиент, и слой пленочного покрытия, содержащий другой активный ингредиент, в котором два активных ингредиента разделены и находятся в различных слоях (ЕР 1830820; US 6682759).
Если в таком композиционном препарате, включающем слой пленочного покрытия, содержащий активный ингредиент, слой пленочного покрытия имеет недостаточную прочность на растяжение, то слой пленочного покрытия может отделяться или разрушаться при обычных воздействиях во время хранения продукта, что может приводить к невозможности обеспечения достаточной эффективности композиционного препарата и поддержания пригодного для продажи качества продукта из-за изменений его внешнего вида и других свойств, что, в конечном итоге, приводит к невозможности использования препарата в виде коммерческого продукта. Для того, чтобы такой композиционный препарат был пригоден для перорального введения, требуется высокая скорость растворения активных ингредиентов, содержащихся в слое пленочного покрытия, что обеспечивает достаточную биодоступность и быстрое наступление эффекта.
ПОДРОБНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Настоящее изобретение обеспечивает композиционный препарат, включающий слой пленочного покрытия, содержащий активный ингредиент, который может иметь устойчивую форму и стойкость по отношению к обычным внешним воздействиям, а также обеспечивать высокую скорость растворения активного ингредиента.
Настоящее изобретение обеспечивает способ получения композиционного препарата, который включает слой пленочного покрытия, содержащего активный ингредиент.
Решение технической задачи
Один из аспектов настоящего изобретения относится к композиционному препарату, включающему: внутреннюю часть, содержащую первый активный ингредиент; и слой пленочного покрытия, содержащий второй активный ингредиент, где слой пленочного покрытия включает графт-сополимер поливинилового спирта и полиэтиленгликоля и поливиниловый спирт.
Другой аспект настоящего изобретения относится к способу получения рассмотренного выше композиционного препарата, включающему: получение внутренней части, содержащей первый активный ингредиент; получение раствора для нанесения покрытия, содержащего второй активный ингредиент, в котором второй активный ингредиент, графт-сополимер поливинилового спирта и полиэтиленгликоля и поливиниловый спирт растворены в растворителе; и нанесение на внутреннюю часть покрытия из раствора для нанесения покрытия, содержащего второй активный ингредиент.
Полезные эффекты
Согласно одному или более воплощениям настоящего изобретения, композиционный препарат может включать слой пленочного покрытия, содержащий активный ингредиент, имеющий высокую прочность на растяжение, устойчивый к обычным внешним воздействиям и обеспечивающий высокую скорость растворения активных ингредиентов, содержащихся в слое пленочного покрытия. Таким образом, композиционный препарат может представлять собой продукт высокого коммерческого качества, поскольку его внешний вид и свойства не меняются в результате внешних воздействий, и он может обеспечивать достаточную биодоступность и быстродействие и не теряет эффективности. Композиционный препарат, содержащий два или более различных активных ингредиента, может быть применен в качестве эффективного композиционного препарата, имеющего хорошее коммерческое качество продукта, и может улучшать соблюдение пациентом режима лечения с комбинированным введением лекарственных средств. Кроме того, благодаря включению слоя пленочного покрытия в композиционный препарат, объем композиционного препарата может быть значительно снижен по сравнению с композиционным препаратом, полученным простым смешиванием композиции каждого из отдельных препаратов, то есть препарат может быть изготовлен в виде достаточно малой по размеру лекарственной формы, такой как таблетка или капсула, что повышает удобство пациента при приеме медикамента.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
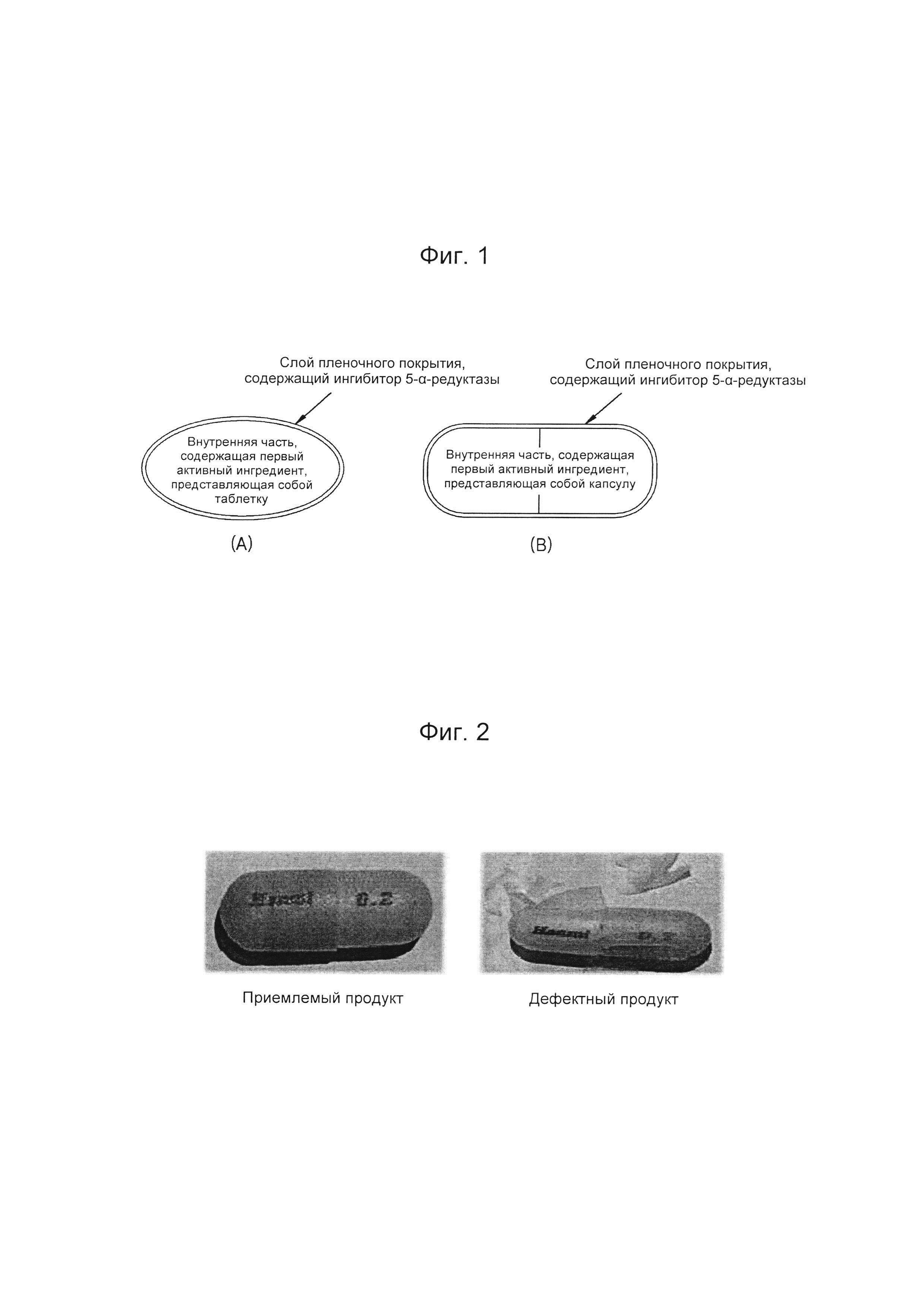
На Фиг. 1 схематично представлен композиционный препарат (а), включающий слой пленочного покрытия, содержащий второй активный ингредиент и нанесенный на поверхность внутренней части, представляющей собой таблетку и содержащей первый активный ингредиент, и композиционный препарат (b), включающий слой пленочного покрытия, содержащий второй активный ингредиент и нанесенный на поверхность внутренней части, представляющей собой твердую капсулу и содержащей первый активный ингредиент;
На Фиг. 2 представлены фотографические изображения композиционных препаратов, один из которых признан приемлемым продуктом (а), а другой -дефектным продуктом (b);
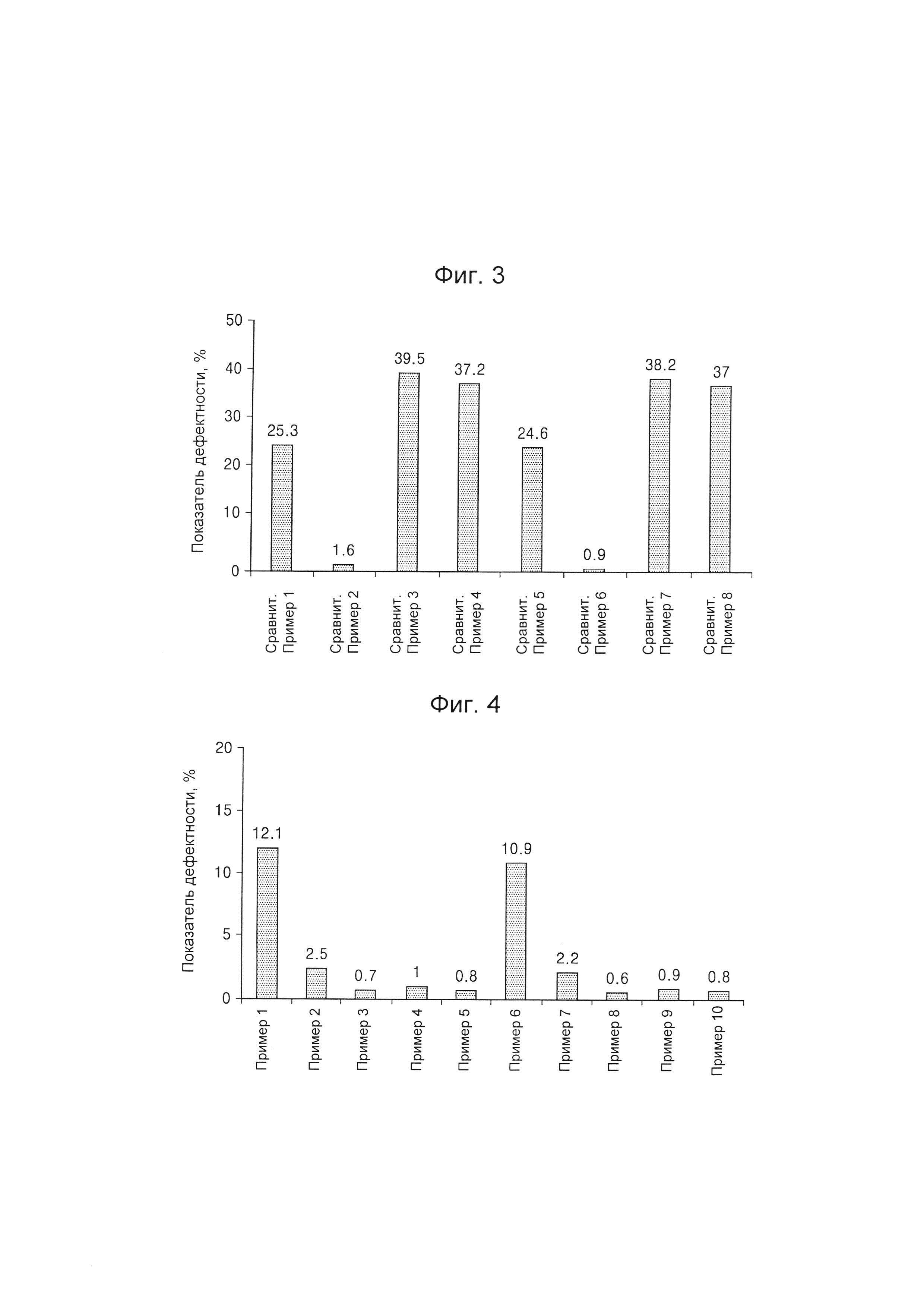
На Фиг. 3 представлен график, на котором приведены показатели дефектности композиционных препаратов, полученных согласно Сравнительным Примерам 1-8, определенные после их извлечения из блистерных упаковок (push-through pack (РТР));
На Фиг. 4 представлен график, на котором приведены показатели дефектности композиционных препаратов, полученных согласно Примерам 1-10, определенные после их извлечения из блистерных упаковок;
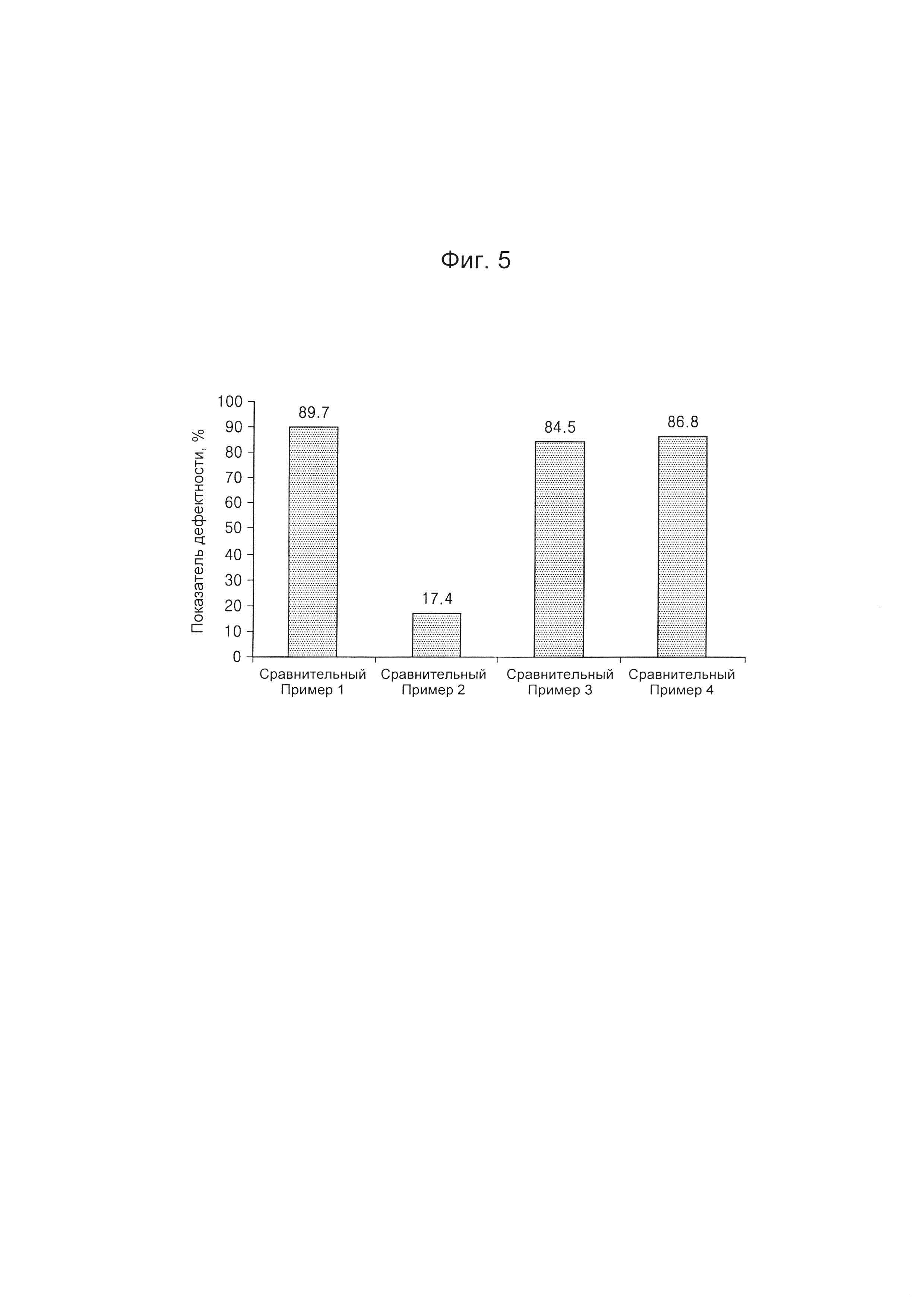
На Фиг. 5 представлен график, на котором приведены показатели дефектности по оценкам материалов покрытия композиционных препаратов, полученных согласно Сравнительным Примерам 1-4, определенные после их извлечения из блистерных упаковок после хранения в течение одной недели при приблизительно 60°С и относительной влажности (отн. вл.) 0%;
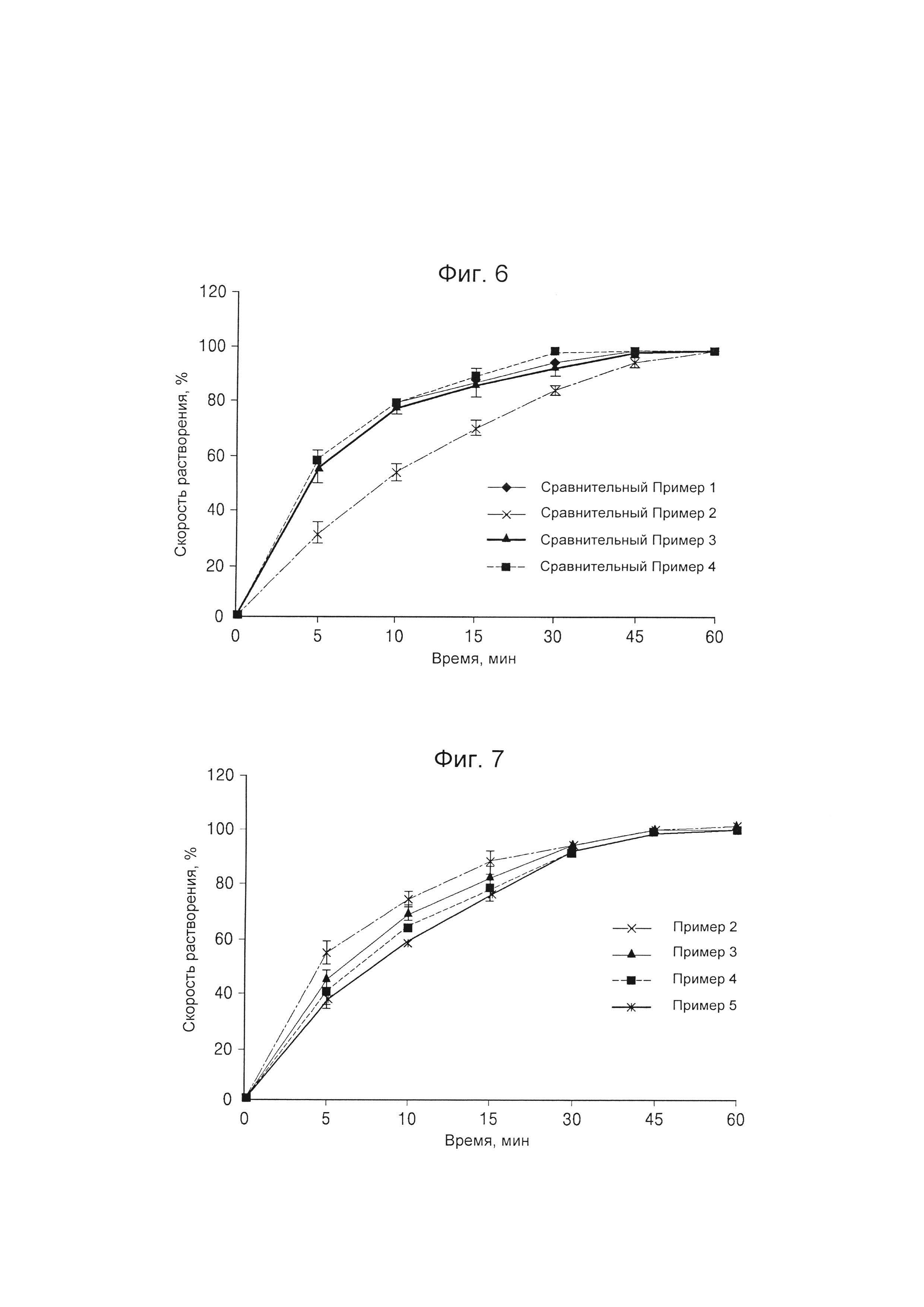
На Фиг. 6 представлен график, на котором приведены скорости растворения финастерида из композиционных препаратов, полученных согласно Сравнительным Примерам 1-4;
На Фиг. 7 представлен график, на котором приведены скорости растворения финастерида из композиционных препаратов, полученных согласно Примерам 2-5; и
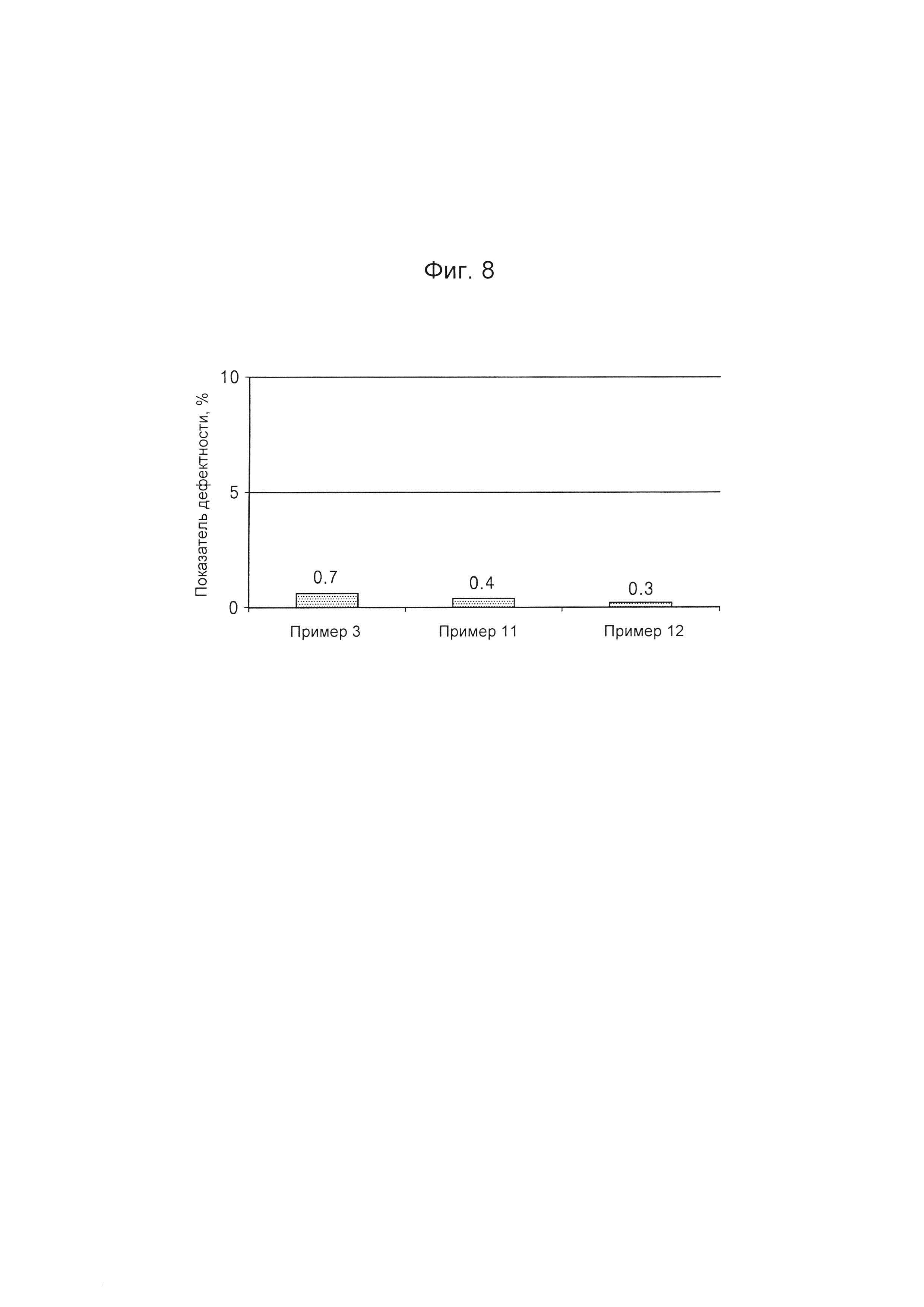
На Фиг. 8 представлен график, на котором приведены показатели дефектности композиционных препаратов с различными типами внутренней части, полученных согласно Примерам 3, 11 и 12, определенные после их извлечения из блистерных упаковок.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Если не указано иное, то все термины (включая технические и научные термины), употребляемые в настоящем описании, имеют значения, обычно понятные специалистам в области техники, к которой относится настоящее изобретение. Хотя в настоящем описании приведены примеры способов или материалов, другие подобные или эквивалентные способы или материалы также включены в объем настоящего изобретения. Все цитируемые публикации во всей их полноте включены в настоящее описание посредством ссылки.
В результате тщательного исследования материалов покрытий для композиционного препарата, включающего слой пленочного покрытия, содержащий активный ингредиент, с целью обнаружения материала покрытия, обеспечивающего достаточную прочность на растяжение слоя пленочного покрытия, содержащего активный ингредиент, и высокую скорость растворения активного ингредиента, содержащегося в слое пленочного покрытия, авторы настоящего изобретения обнаружили, что применение в качестве материала слоя пленочного покрытия, содержащего активный ингредиент, комбинации графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом позволяет получить слой пленочного покрытия, содержащий активный ингредиент, который, по сравнению с другими применяемыми материалами пленочного покрытия, может иметь достаточно высокую прочность на растяжение, предотвращающую его отделение или разрушение во время хранения при обычных внешних воздействиях, и высокую скорость растворения активного ингредиента, содержащегося в слое пленочного покрытия.
Один из аспектов настоящего изобретения относится к композиционному препарату, включающему: внутреннюю часть, содержащую первый активный ингредиент, и слой пленочного покрытия, содержащий второй активный ингредиент, причем слой пленочного покрытия включает графт-сополимер поливинилового спирта и полиэтиленгликоля и поливиниловый спирт.
Внутренняя часть, содержащая первый активный ингредиент, может представлять собой любую фармацевтическую композицию, обычно применяемую в области фармацевтики. Например, внутренняя часть может быть в виде таблетки, твердой капсулы или мягкой капсулы. Однако воплощения настоящего изобретения не ограничены ими. Наполнитель твердой капсулы или мягкой капсулы может быть в виде любой фармацевтической композиции, обычно применяемой в области фармацевтики, например, в виде гранул, драже, порошка, таблеток, жидкости или любой комбинации перечисленных форм.
Внутренняя часть может составлять приблизительно от 20% масс. до 99,5% масс. от общей массы композиционного препарата.
Слой пленочного покрытия, содержащий второй активный ингредиент, может быть нанесен на поверхность внутренней части. Слой пленочного покрытия может включать в качестве материала покрытия комбинацию графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом.
Авторы настоящего изобретения получали композиционные препараты, используя различные материалы покрытия, которые наносили на внутреннюю часть, представляющую собой таблетку или капсулу, содержащую первый активный ингредиент, в виде слоя пленочного покрытия, включающего второй активный ингредиент и различные материалы покрытия, после чего проводили испытание на наличие дефектов с оценкой различных материалов покрытия и испытание на растворение второго активного ингредиента с течением времени. В результате было обнаружено, что при использовании в качестве материала покрытия одного из следующих материалов: графт-сополимера поливинилового спирта и полиэтиленгликоля, поливинилового спирта, повидона или гипромеллозы (гидроксипропилметилцеллюлозы), показатель дефектности слоя пленочного покрытия композиционного препарата, обусловленный, например, отделением покрытия от внутренней части или разрушением покрытия, составлял от 20 до 40%, и только при использовании поливинилового спирта достигал величины менее 2% (см. Примеры испытаний 1 и 3). Однако, когда в качестве материала покрытия применяли поливиниловый спирт, композиционный препарат имел низкую скорость растворения второго активного ингредиента, которая составляла менее 75% за 15 минут, что было показано в Испытании на Растворение, проведенном согласно Общим Испытаниям Корейской Фармакопеи (Korean Pharmacopoeia) (см. Пример испытания 4). Соответственно, было сложно получить слой пленочного покрытия, обеспечивающий как высокую прочность на растяжение, так и достаточно высокую скорость растворения. С другой стороны, когда применяли комбинацию графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом, показатель дефектности слоя пленочного покрытия, обусловленный, например, отделением покрытия от внутренней части или разрушением покрытия, значительно снижался и составлял менее 10% (см. Примеры испытаний 2 и 6), а второй активный ингредиент имел достаточно высокую скорость растворения, составляющую приблизительно 75% или более за 15 минут (см. Пример испытания 5); полученные хорошие результаты указывают на то, что были достигнуты как низкий показатель дефектности пленочного покрытия, так и высокая скорость растворения.
В некоторых воплощениях массовое отношение количества графт-сополимера поливинилового спирта и полиэтиленгликоля к количеству поливинилового спирта может составлять от приблизительно 8:2 до приблизительно 4:6, в некоторых воплощениях от приблизительно 7:3 до приблизительно 4:6, а в некоторых других воплощениях оно может составлять приблизительно 6:4.
Графт-сополимер поливинилового спирта и полиэтиленгликоля может состоять из звеньев поливинилового спирта в количестве от приблизительно 65% до приблизительно 85% и звеньев полиэтиленгликоля в количестве приблизительно от 15 до 35%, может содержать от приблизительно 0,01% до приблизительно 0,5% коллоидного диоксида кремния и может иметь среднемассовую молекулярную массу, составляющую от приблизительно 35000 до приблизительно 55000 Дальтон. Графт-сополимер поливинилового спирта и полиэтиленгликоля коммерчески доступен, например, под наименованием Kollicoat® IR (поставляет BASF), который состоит из приблизительно 75% звеньев поливинилового спирта и приблизительно 25% звеньев полиэтиленгликоля, содержит приблизительно 0,3% коллоидного диоксида кремния и имеет среднемассовую молекулярную массу, составляющую приблизительно 45000 Дальтон.
Поливиниловый спирт, который является водорастворимым полимером, может иметь молекулярную массу, составляющую от приблизительно 20000 до приблизительно 200000 Дальтон; причем, чем больше молекулярная масса поливинилового спирта, тем выше его вязкость.
Слой пленочного покрытия может составлять от приблизительно 0,5 масс. части до приблизительно 80 масс. частей на 100 масс. частей внутренней части.
В некоторых воплощениях графт-сополимер поливинилового спирта и полиэтиленгликоля, используемый в композиционном препарате, может включать от приблизительно 65% до приблизительно 85% звеньев поливинилового спирта и от приблизительно 15% до приблизительно 35% звеньев полиэтиленгликоля, может содержать от приблизительно 0,01 до приблизительно 0,5% масс. коллоидного диоксида кремния и может иметь среднемассовую молекулярную массу, составляющую от приблизительно 35000 до приблизительно 55000 Дальтон; поливиниловый спирт может иметь молекулярную массу, составляющую от приблизительно 20000 до приблизительно 200000 Дальтон; а массовое отношение количества графт-сополимера поливинилового спирта и полиэтиленгликоля к количеству поливинилового спирта может составлять от приблизительно 7:3 до приблизительно 4:6.
На Фиг. 1 схематично представлены изображения композиционных препаратов согласно воплощениям изобретения.
На Фиг. 1 (а) схематично представлено изображение композиционного препарата, в котором слой пленочного покрытия, содержащий второй активный ингредиент, нанесен на поверхность внутренней части, представляющей собой таблетку и включающей первый активный ингредиент; а на Фиг. 1 (b) схематично представлено изображение композиционного препарата, в котором слой пленочного покрытия, содержащий второй активный ингредиент, нанесен на поверхность внутренней части, представляющей собой твердую капсулу и содержащей первый активный ингредиент.
В некоторых воплощениях композиционный препарат может дополнительно включать внутренний слой покрытия, который отделяет внутреннюю часть и слой пленочного покрытия друг от друга, более эффективно предотвращая взаимодействие между активными ингредиентами. Внутренний слой покрытия может составлять от приблизительно 0,01 масс. части до приблизительно 60 масс. частей на 100 масс. частей внутренней части. Например, пленкообразующий материал (пленкообразующий агент и/или покрывающий агент), который можно применять для получения внутреннего слоя покрытия, может представлять собой гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, ацетатфталат целлюлозы, этил целлюлозу, метилцеллюлозу, полиметакрилат, полиэтиленгликоль, тальк, диоксид титана или их смесь. Однако воплощения настоящего изобретения не ограничены перечисленными материалами. Можно применять любые пленкообразующие материалы, которые обычно используют в области фармацевтики при получении твердых композиций для перорального или парентерального введения.
В некоторых воплощениях композиционный препарат может дополнительно включать внешний слой покрытия, окружающий слой пленочного покрытия, содержащего активный ингредиент, для дополнительной защиты композиционного препарата от воздействий окружающей среды. Внешний слой покрытия может представлять собой слой любого покрытия, которое не оказывает существенного влияния на высокую прочность на растяжение слоя пленочного покрытия, содержащего активный ингредиент, и высокую скорость растворения второго активного ингредиента, для которых был разработан настоящий композиционный препарат. Такой внешний слой покрытия может быть получен нанесением влагостойкого покрытия или глянцевого покрытия. Подходящий материал может быть выбран специалистом в данной области техники в зависимости от типа покрытия, на основании известных в данной области техники данных.
Внешний слой покрытия может составлять от приблизительно 0,01 масс. частей до приблизительно 60 масс. частей на 100 масс. частей внутренней части.
В некоторых воплощениях внутренняя часть композиционного препарата и слой пленочного покрытия, содержащий активный ингредиент, могут дополнительно включать фармацевтически приемлемую добавку, помимо рассмотренных выше ингредиентов. Добавка может быть выбрана из группы, состоящей из разбавителя, разрыхлителя, связующего вещества, стабилизатора, смазочного вещества, и любых их комбинаций.
Разбавитель может быть выбран из группы, состоящей из микрокристаллической целлюлозы, лактозы, пресса Руди (Rudy press), маннита, дигидрофосфата кальция, крахмала, гидроксипропилцеллюлозы с низкой степенью замещения, и любых комбинаций перечисленных веществ. Однако воплощения изобретения не ограничены перечисленными веществами.
Разрыхлитель может быть выбран из группы, состоящей из кросповидона, натрий-крахмалгликолята, натрий-кроскармеллозы, гидроксипропилцеллюлозы с низкой степенью замещения, крахмала, альгиновой кислоты, альгината натрия, и любых комбинаций перечисленных веществ. Однако воплощения изобретения не ограничены перечисленными веществами.
Связующее вещество может быть выбрано из группы, состоящей из гидроксипропилцеллюлозы, гидроксипропил метил целлюлозы, поливинилпирролидона, коповидона, макрогола, неуплотненной безводной кремниевой кислоты, силикатных производных, таких как синтетический силикат алюминия, силикат кальция и метасиликат-алюминат магния, фосфатов, таких как гидрофосфат кальция, карбонатов, таких как карбонат кальция, и любых комбинаций перечисленных веществ. Однако воплощения изобретения не ограничены перечисленными веществами.
Стабилизатор может быть выбран из группы, состоящей из карбоната магния, бикарбоната натрия, карбоната натрия, карбоната кальция, и любых комбинаций перечисленных веществ. Однако воплощения изобретения не ограничены перечисленными веществами.
Смазочное вещество может быть выбрано из группы, состоящей из стеариновой кислоты, солей металлов и стеариновой кислоты, таких как стеарат кальция или стеарат магния, талька, коллоидного диоксида кремния, сложного эфира жирной кислоты и сахарозы, гидрированного растительного масла, воска с высокой температурой плавления, сложных эфиров глицерина и жирных кислот, дибегената глицерина, и любых комбинаций перечисленных веществ. Однако воплощения изобретения не ограничены перечисленными веществами.
Употребляемый в настоящем описании термин "активный ингредиент" означает не только любой фармакологический активный агент, применяемый для лечения, но и любой реагент или любой медицинский агент, который может быть введен в организм человека с диагностическими или профилактическими целями. В более широком смысле "активный ингредиент" может представлять собой любой материал, ингредиент или лечебный функциональный пищевой продукт в обработанном виде, который может быть принят в целях здравоохранения для поддержания питательных регуляторных функций или физиологических функций, влияющих на структуру и функции организма.
Употребляемые в настоящем описании термины "первый активный ингредиент" и "второй активный ингредиент" применяют для того, чтобы отличить друг от друга по меньшей мере два активных ингредиента композиционного препарата, причем, для легкости распознавания, активный ингредиент, содержащийся во внутренней части композиционного препарата, назван первым активным ингредиентом, а активный ингредиент, содержащийся в слое пленочного покрытия, назван вторым активным ингредиентом.
Первый активный ингредиент и второй активный ингредиент могут представлять собой любые лекарственные средства, которые необходимо вводить в комбинации, например, метформин и розувастатин, фенофибриновая кислота и розувастатин, омега-3 и розувастатин, амлодипин и лозартан, клопидогрель и аспирин, метформин и глибенкламид, налоксон и оксикодон, фексофенадин и монтелукаст, бринзоламид и тимолол, лерканидипин и эналаприл, тамсулозин и ингибитор 5-α-редуктазы, ингибитор фосфодиэстеразы-5 и ингибитор 5-α-редуктазы, напроксен и эзомепразол или метформин и глибенкламид. При необходимости, как первый активный ингредиент, так и второй активный ингредиент может включать единственный ингредиент или множество ингредиентов.
В некоторых воплощениях композиционный препарат может представлять собой лекарственную форму для перорального введения.
В некоторых воплощениях второй активный ингредиент может представлять собой ингибитор 5-α-редуктазы, а первый активный ингредиент может представлять собой любые активные ингредиенты, которые требуется ввести в комбинации с ингибитором 5-α-редуктазы. Например, первый активный ингредиент может включать тамсулозин или ингибитор фосфодиэстеразы-5 (например, тадалафил, варденафил, уденафил или силденафил).
Известно, что комбинация ингибитора 5-α-редуктазы и тамсулозина и комбинация ингибитора 5-α-редуктазы и ингибитора фосфодиэстеразы-5 также эффективны в лечении гипертрофии предстательной железы и, кроме того, предпочтительны, благодаря усилению эффективности из-за различных механизмов воздействия индивидуальных активных ингредиентов (ЕР 1501517; BJU Int. 2006 Apr. 97 Suppl 2:39-43; обсуждение 44-5). Таким образом, если композиционный препарат согласно любому из воплощений изобретения включает тамсулозин или ингибитор фосфодиэстеразы-5 в качестве первого активного ингредиента и ингибитор 5-α-редуктазы в качестве второго активного ингредиента, то его можно применять в качестве эффективной композиции для лечения предстательной железы.
В некоторых воплощениях первый активный ингредиент может представлять собой тамсулозин или его фармацевтически приемлемую соль, а второй активный ингредиент может представлять собой ингибитор 5-α-редуктазы.
Ингибитор 5-α-редуктазы может быть выбран из группы, состоящей из финастерида, дутастерида, альфатрадиола и любых комбинаций перечисленных веществ. Измеренная согласно Испытанию на Растворение в соответствии с Общими Испытаниями Корейской Фармакопеи скорость растворения за 15 минут ингибитора 5-α-редуктазы, находящегося в композиционном препарате, может составлять приблизительно 75% или более.
В некоторых воплощениях, учитывая известные суточные дозировки, композиционный препарат может включать от приблизительно 0,1 мг до приблизительно 0,8 мг, а в некоторых других воплощениях от приблизительно 0,2 мг до приблизительно 0,6 мг тамсулозина или его фармацевтически приемлемой соли, в пересчете на количество свободного основания, в качестве первого активного ингредиента, и от приблизительно 1 мг до приблизительно 10 мг финастерида в качестве второго активного ингредиента.
В некоторых воплощениях, учитывая известные суточные дозировки, композиционный препарат может включать от приблизительно 0,1 мг до приблизительно 0,8 мг, а в некоторых других воплощениях от приблизительно 0,2 мг до приблизительно 0,6 мг тамсулозина или его фармацевтически приемлемой соли, в пересчете на количество свободного основания, в качестве первого активного ингредиента, и от приблизительно 0,2 мг до приблизительно 0,6 мг дутастерида в качестве второго активного ингредиента.
В некоторых воплощениях первый активный ингредиент может представлять собой ингибитор фосфодиэстеразы-5, а второй активный ингредиент может представлять собой ингибитор 5-α-редуктазы. Ингибитор фосфодиэстеразы-5 может представлять собой тадалафил, варденафил, уденафил, силденафил или любые комбинации перечисленных веществ. Например, ингибитор фосфодиэстеразы-5 может представлять собой тадалафил. Тадалафил можно применять в виде свободного основания тадалафила или в виде его фармацевтически приемлемой соли, например, гидробромида, фосфата, сульфата, гидрохлорида, малеата, фумарата, лактата, тартрата, цитрата, безилата, камсилата или глюконата. Например, тадалафил может представлять собой тадалафил в виде свободного основания. Однако воплощения изобретения не ограничены перечисленными веществами.
Ингибитор 5-α-редуктазы может быть выбран из группы, состоящей из финастерида, дутастерида, альфатрадиола и любых комбинаций перечисленных веществ. Определяемая с помощью Испытания на Растворение в соответствии с Общими Испытаниями Корейской Фармакопеи скорость растворения за 15 минут ингибитора 5-α-редуктазы, находящегося в композиционном препарате, может составлять приблизительно 75% или более.
В некоторых воплощениях, учитывая известные суточные дозировки, композиционный препарат может включать от приблизительно 5 мг до приблизительно 20 мг, а в некоторых других воплощениях от приблизительно 5 мг до приблизительно 10 мг тадалафила или его фармацевтически приемлемой соли, в пересчете на количество свободного основания, в качестве первого активного ингредиента, и от приблизительно 1 мг до приблизительно 10 мг финастерида в качестве второго активного ингредиента.
В некоторых воплощениях, учитывая известные суточные дозировки, композиционный препарат может включать от приблизительно 5 мг до приблизительно 20 мг, а в некоторых других воплощениях от приблизительно 5 мг до приблизительно 10 мг тадалафила или его фармацевтически приемлемой соли, в пересчете на количество свободного основания, в качестве первого активного ингредиента, и от приблизительно 0,2 мг до приблизительно 0,6 мг дутастерида в качестве второго активного ингредиента.
В некоторых воплощениях композиционный препарат может включать тамсулозин или его фармацевтически приемлемую соль в качестве первого активного ингредиента и ингибитор 5-α-редуктазы в качестве второго активного ингредиента; графт-сополимер поливинилового спирта и полиэтиленгликоля, содержащийся в слое пленочного покрытия, может состоять из звеньев поливинилового спирта в количестве от приблизительно 65% до приблизительно 85% и звеньев полиэтиленгликоля в количестве от приблизительно 15% до приблизительно 35%, может включать от приблизительно 0,01% масс. до приблизительно 0,5% масс. коллоидного диоксида кремния и может иметь среднемассовую молекулярную массу, составляющую от приблизительно 35000 Дальтон до приблизительно 55000 Дальтон; а поливиниловый спирт, содержащийся в слое пленочного покрытия, может иметь молекулярную массу, составляющую от приблизительно 20000 Дальтон до приблизительно 200000 Дальтон; причем массовое отношение количества графт-сополимера поливинилового спирта и полиэтиленгликоля к количеству поливинилового спирта может составлять от приблизительно 7:3 до приблизительно 4:6.
Композиционный препарат согласно одному из воплощений изобретения, включающий тамсулозин, его фармацевтически приемлемую соль или ингибитор фосфодиэстеразы-5 в качестве первого активного ингредиента и ингибитор 5-α-редуктазы в качестве второго активного ингредиента, может иметь улучшенные характеристики, относящиеся к форме и долговечности, благодаря повышенной прочности на растяжение слоя пленочного покрытия, и при этом обеспечивать быстрое высвобождение ингибитора 5-α-редуктазы. Кроме того, благодаря включению в одну композицию двух активных ингредиентов, эффективных для лечения гипертрофии предстательной железы с различными механизмами воздействия, композиционный препарат может обеспечивать синергический эффект при лечении и облегчении состояния при гипертрофии предстательной железы, а также может улучшать соблюдение пациентом режима приема медикамента.
Один из аспектов настоящего изобретения относится к способу получения композиционного препарата согласно любому из рассмотренных выше воплощений, который включает: получение внутренней части, содержащей первый активный ингредиент; получение раствора для нанесения покрытия, содержащего второй активный ингредиент, в котором второй активный ингредиент, графт-сополимер поливинилового спирта и полиэтиленгликоля и поливиниловый спирт растворены в растворителе; и нанесение на внутреннюю часть раствора для образования покрытия.
Рассмотренные выше характеристики композиционных препаратов согласно всем описанным выше аспектам могут быть отнесены к способам их получения согласно воплощениям изобретения.
При получении внутренней части, внутренняя часть может представлять собой любую внутреннюю часть, которую можно применять в качестве внутренней части в фармацевтике, в виде, например, таблетки, твердой капсулы или мягкой капсулы. Однако воплощения изобретения не ограничены перечисленными формами. При получении внутренней части, в качестве внутренней части может быть использована любая коммерчески доступная композиция, или внутренняя часть может быть непосредственно получена для использования в данном изобретении. Внутренняя часть может быть получена с помощью любой известной в фармацевтике методики, выбранной специалистом в данной области техники согласно типу внутренней части.
При получении раствора для нанесения покрытия, содержащего второй активный ингредиент, растворитель может представлять собой любой фармацевтически доступный растворитель, который может растворять второй активный ингредиент, графт-сополимер поливинилового спирта и полиэтиленгликоля и поливиниловый спирт. Например, растворитель может представлять собой воду, этанол, метанол, хлороформ, диметилсульфоксид (ДМСО) или любую комбинацию их растворов. В некоторых воплощениях растворитель может представлять собой воду, этанол или любую комбинацию их растворов. Однако воплощения изобретения не ограничены перечисленными веществами.
Нанесение покрытия на внутреннюю часть может быть выполнено любым доступным способом нанесения пленочного покрытия, применяемым в области фармацевтики, например, нанесением покрытия дражированием, нанесением покрытия в псевдоожиженном слое или нанесением покрытия с помощью пресса. Однако воплощения изобретения не ограничены перечисленными способами.
Если в качестве второго активного ингредиента применяют ингибитор 5-α-редуктазы, в частности, финастерид, который, как известно, обладает тератогенными свойствами, то требуется отдельная независимая технологическая линия, чтобы предотвратить смешивание финастерида с другими лекарственными препаратами в процессе получения композиции, содержащей финастерид, фармацевтической компанией. Например, при получении твердой композиции, содержащей финастерид, все операции, включая смешивание, гранулирование, таблетирование и нанесение покрытия, необходимо проводить в отделенной и изолированной зоне. Однако способ получения композиционного препарата согласно одному из воплощений изобретения включает нанесение финастерида из содержащего финастерид раствора для образования покрытия, так что в этом случае можно применять существующее оборудование для получения лекарственных средств, в которое дополнительно введено изолированное оборудование для нанесения покрытия, содержащего финастерид, и, таким образом, получение композиции, содержащей финастерид, может быть относительно удобным. Таким образом, применение способа получения композиционного препарата согласно одному из воплощений изобретения позволяет более экономично получать композиционный препарат, содержащий ингибитор 5-α-редуктазы.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже с помощью приведенных примеров будет более подробно рассмотрено одно или более воплощений настоящего изобретения. Однако эти примеры приведены только для иллюстрации изобретения и не ограничивают объем одного или более воплощений настоящего изобретения.
Примеры 1-10
Получение композиционных препаратов, включающих внутреннюю часть в виде капсулы, содержащей гидрохлорид тамсулозина, на которую нанесен слой (1) пленочного покрытия, содержащий ингибитор 5-α-редуктазы
Растворы для нанесения покрытия были получены смешиванием материалов покрытия, имеющих различные составы (Примеры 1-10), представленные в Таблице 1, со смесью этанола и воды (этанол : вода = 1:1 (об./об.)), а затем полученные растворы наносили на капсулы Тамсулозин®, содержащие гидрохлорид тамсулозина (поставляемые Hanmi Pharmaceutical Co., Ltd., Республика Корея), с применением дражировочного резервуара (SFC-30, Sejong Co., Ltd.). Полученные капсулы сушили при приблизительно 35°С в течение приблизительно 30 минут, таким образом получая композиционные препараты, включающие внутреннюю часть в виде капсулы, содержащей тамсулозин, на которую нанесен слой пленочного покрытия, содержащий ингибитор 5-α-редуктазы.
Сравнительные Примеры 1-8
Получение композиционных препаратов, включающих внутреннюю часть в виде капсулы, содержащей гидрохлорид тамсулозина, на которую нанесен слой (2) пленочного покрытия, содержащий ингибитор 5-α-редуктазы
Композиционные препараты, полученные согласно Сравнительным Примерам 1-8, включающие внутреннюю часть в виде капсулы, содержащей тамсулозин, на которую нанесен слой пленочного покрытия, содержащий ингибитор 5-α-редуктазы, были получены так же, как и в Примерах 1-10, за исключением того, что растворы для нанесения покрытия были получены в соответствии с рецептурами Сравнительных Примеров 1-8, представленных в Таблице 1.

Примеры 11 и 12
Получение композиционных препаратов, включающих внутреннюю часть в виде таблетки, содержащей тамсулозин OD, на которую нанесен слой пленочного покрытия, содержащий ингибитор 5-α-редуктазы
Растворы для нанесения покрытия были получены смешиванием материалов покрытия, имеющих различные составы (Примеры 11 и 12), представленные в Таблице 2, со смесью этанола и воды (этанол : вода = 1:1 (об./об.)), а затем полученные растворы наносили на таблетки, содержащие гидрохлорид тамсулозина Тамсулозин® OD (поставляемые Hanmi Pharmaceutical Co., Ltd., Республика Корея), с применением дражировочного резервуара (SFC-30, поставляемый Sejong Co., Ltd.). Полученные композиционные таблетки сушили при приблизительно 35°С в течение приблизительно 30 минут, таким образом получая композиционные препараты, включающие внутреннюю часть в виде таблетки, содержащей Тамсулозин® OD, на которую нанесен слой пленочного покрытия, содержащий ингибитор 5-α-редуктазы.

Пример испытания 1
Испытание на наличие дефектов при использовании различных материалов покрытия
Испытание на наличие дефектов для композиционных препаратов, полученных согласно Сравнительным Примерам 1-8, проводили для оценки прочности пленок на растяжение и показателей дефектности композиционных препаратов.
Каждый композиционный препарат упаковывали с помощью машины для блистерной упаковки (машина Lab-Blister, OMAR FANTASY PLUS), таким образом, чтобы алюминиевая форма, содержащая каждый композиционный препарат, была герметично закрыта алюминиевой пленкой. Были выбраны случайным образом десять обычных людей, которых просили открыть 100 блистерных упаковок так, чтобы распаковать каждый композиционный препарат, причем, как показано на Фиг. 2, композиционный препарат считали дефектным продуктом, если слой пленочного покрытия на препарате был отделен от внутренней части или был поврежден, или композиционный препарат считали приемлемым продуктом, если слой пленочного покрытия оставался таким же, как до упаковки, после чего вычисляли процент дефектных продуктов (далее называемый показателем дефектности). Фотографические изображения примеров композиционных препаратов, которые считали приемлемыми продуктами (а) и дефектными продуктами (b), представлены на Фиг. 2.
Полученные показатели дефектности композиционных препаратов представлены в Таблице 3 и на Фиг. 3.

Как видно из данных, представленных в Таблице 3 и на Фиг. 3, было обнаружено, что композиционные препараты, полученные согласно Сравнительным Примерам 1, 3, 4, 5, 7 и 8 с использованием в качестве материала покрытия только одного из следующих материалов: Kollicoat® IR, повидона или гипромеллозы, имели повреждения слоя пленочного покрытия, что проявляется в высоком показателе дефектности, составляющем от приблизительно 20% до приблизительно 40%, в то время как композиционные препараты Сравнительного Примера 2 и Сравнительного Примера 6, в которых в качестве материала покрытия использовали только поливиниловый спирт, имели низкий показатель дефектности, составляющий приблизительно 2% или менее.
Пример испытания 2
Испытание на наличие дефектов для композиционных препаратов, включающих в качестве материала покрытия комбинацию графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом
Испытание на наличие дефектов для композиционных препаратов, полученных согласно Примерам 1-10, выполняли таким же образом и при таких же условиях, как в Примере испытания 1. Результаты представлены в Таблице 4 и на Фиг. 4.
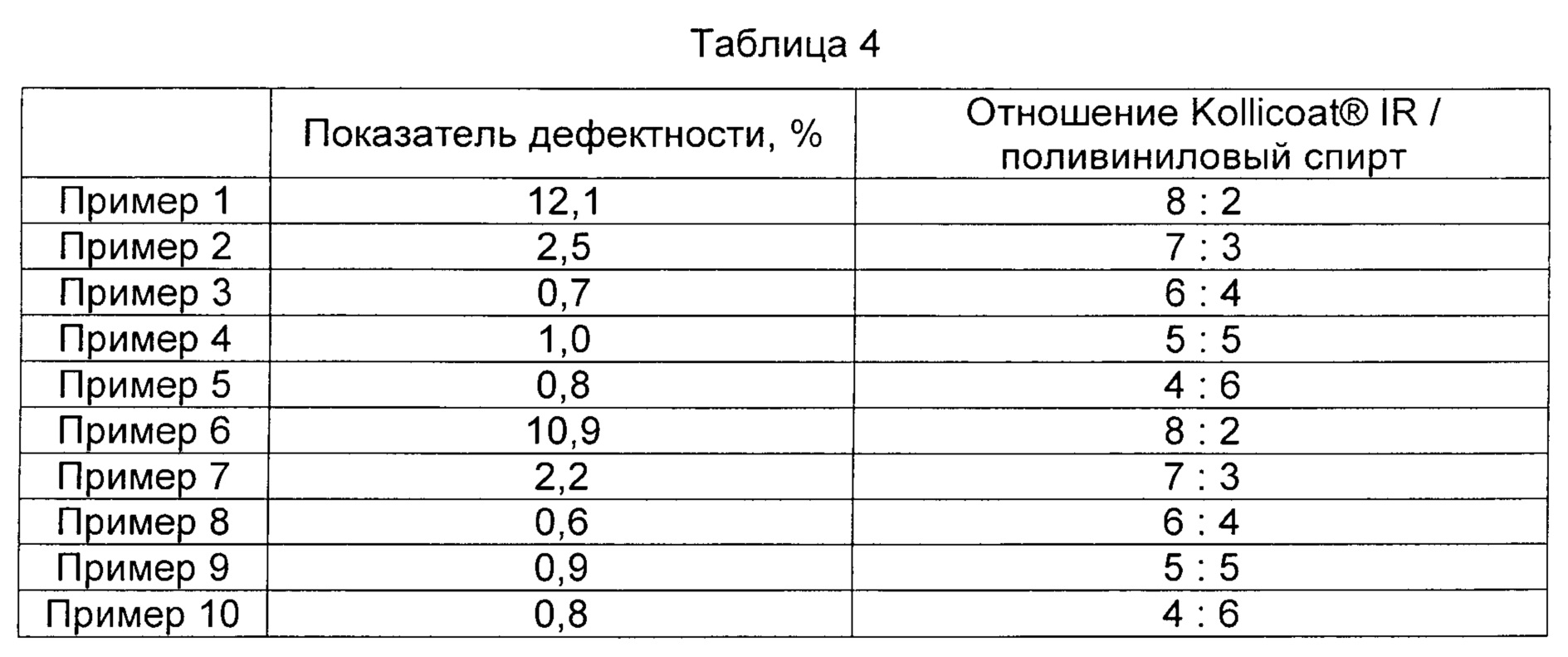
Как видно из данных, представленных в Таблицах 3 и 4, было обнаружено, что показатели дефектности композиционных препаратов Примеров 1-10, полученных с использованием в качестве материала покрытия комбинации Kollicoat® IR и поливинилового спирта, значительно понижены по сравнению с показателями дефектности композиционных препаратов, полученных согласно Сравнительным Примерам 1 и 5 с использованием в качестве материала покрытия только Kollicoat® IR.
Кроме того, было обнаружено, что показатели дефектности композиционных препаратов Примеров 2-5 и Примеров 7-10, полученных с использованием Kollicoat® IR и поливинилового спирта в отношениях от приблизительно 7:3 до приблизительно 4:6, были снижены по сравнению с показателями дефектности композиционных препаратов Примеров 1 и 6, полученных с использованием Kollicoat® IR и поливинилового спирта в отношении приблизительно 8:2.
Пример испытания 3
Испытание на наличие дефектов в стрессовых условиях при использовании различных материалов покрытия
Испытание на наличие дефектов для композиционных препаратов, полученных согласно Сравнительным Примерам 1-4, выполняли таким же образом, как в Примере испытания 1, после хранения в термостатической камере при приблизительно 60°С и при относительной влажности (отн. вл.) 0% в течение одной недели, для оценки стабильности каждого композиционного препарата в зависимости от продолжительности хранения. Результаты испытаний представлены в Таблице 5 и на Фиг. 5.

Как видно из данных, представленных в Таблице 5 и на Фиг. 5, было обнаружено, что все композиционные препараты, полученные согласно Сравнительным Примерам 1, 3 и 4, с использованием в качестве материала покрытия только одного из следующих материалов: Kollicoat® IR, повидона или гипромеллозы, имеют высокие показатели дефектности, составляющие приблизительно 80% или более. Однако было обнаружено, что композиционный препарат Сравнительного Примера 2, полученный с использованием в качестве материала покрытия поливинилового спирта, имеет показатель дефектности, составляющий приблизительно 17,4%, и этот препарат продемонстрировал улучшенную форму и стабильность по сравнению с композиционными препаратами Сравнительного Примера 1, Сравнительного Примера 3 и Сравнительного Примера 4.
Пример испытания 4
Испытание на растворение при использовании различных материалов покрытия
Испытание на растворение выполняли, как описано ниже, для оценки скорости растворения финастерида, находящегося в каждом из композиционных препаратов Сравнительных Примеров 1-4.
Испытание на растворение выполняли в соответствии со Способом II Растворения (способ с использованием лопастной мешалки), описанным в Общих Испытаниях Корейской Фармакопеи (10-е издание). Согласно Корейской Фармакопее (10-е издание), в качестве испытуемого раствора использовали 900 мл дистиллированной воды (ДВ), и, согласно общей процедуре способа высвобождения композиций, испытание на растворение выполняли при скорости, составляющей приблизительно 50 об/мин. Пробы испытуемого раствора отбирали спустя 0 минут, 5 минут, 10 минут, 15 минут, 30 минут, 45 минут и 60 минут после начала испытания, и проводили анализ методом жидкостной хроматографии в соответствии с Общими Испытаниями Корейской Фармакопеи (10-е издание), таким образом получая скорость растворения в каждый указанный момент времени путем сравнения с приготовленным ранее стандартным раствором. Результаты представлены в Таблице 6 и на Фиг. 6.

Как видно из данных, представленных в Таблице 6 и на Фиг. 6, было обнаружено, что композиционные препараты, полученные согласно Сравнительным Примерам 1, 3 и 4 с использованием только одного из следующих материалов: Kollicoat® IR, повидона или гипромеллозы, имели относительно высокую скорость растворения по сравнению с композиционным препаратом Сравнительного Примера 2, в котором применяли поливиниловый спирт.
Финастерид представляет собой лекарственное средство, которому для достижения высокой биодоступности требуется высокая скорость растворения. Соответственно, композиционный препарат Сравнительного Примера 2, в котором применяли поливиниловый спирт, может иметь более низкую биодоступность по сравнению с композиционными препаратами Сравнительных Примеров 1, 3 и 4.
Пример испытания 5
Испытание на растворение композиционных препаратов, включающих в качестве материала покрытия комбинацию графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом
Испытание на растворение композиционных препаратов, полученных согласно Примерам 2-5, выполняли при таких же условиях, как в Примере испытания 4. Результаты представлены в Таблице 7 и на Фиг. 7.

Как видно из данных, представленных в Таблице 7 и на Фиг. 7, было обнаружено, что композиционные препараты Примеров 2-5, в которых использовали Kollicoat® IR и поливиниловый спирт в массовых отношениях от приблизительно 7:3 до приблизительно 4:6, имели скорость растворения за 15 минут, составляющую приблизительно 75% или более.
Пример испытания 6
Испытание на наличие дефектов в зависимости от типа внутренней части композиционного препарата, включающего в качестве материала покрытия комбинацию графт-сополимера поливинилового спирта и полиэтиленгликоля с поливиниловым спиртом
Испытание на наличие дефектов для композиционных препаратов, полученных согласно Примерам 3, 11 и 12, выполняли таким же образом и при таких же условиях, как в Примере испытания 1. Результаты представлены в Таблице 8 и на Фиг. 8.

В результате испытаний на наличие дефектов было обнаружено, что композиционные препараты Примеров 11 и 12, полученные с использованием внутренней части в виде таблетки, содержащей тамсулозин, и такого же материала покрытия, как в композиционном препарате Примера 3 (с использованием внутренней части в виде капсулы, содержащей тамсулозин), который, как было обнаружено, обеспечивает улучшенную форму и стабильность покрытия при высокой скорости растворения, также имеют низкий показатель дефектности, составляющий приблизительно 1% или менее. Таким образом, было обнаружено, что слой пленочного покрытия, содержащий второй активный ингредиент, композиционного препарата согласно любому из воплощений изобретения, применим к внутренним частям различных типов, а не только к внутренним частям в виде твердых капсул.