Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЙ КОМБИНИРОВАННЫЙ СОСТАВ, СОДЕРЖАЩИЙ АМЛОДИПИН, ЛОЗАРТАН И РОЗУВАСТАТИН
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическому комбинированному составу, содержащему амлодипин, лозартан и розувастатин. Точнее, оно относится к фармацевтическому комбинированному составу, содержащему первую отдельную часть, содержащую амлодипин и розувастатин, и вторую отдельную часть, содержащую лозартан, которая проявляет улучшенную скорость растворения и стабильность.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Приблизительно 90–95% случаев гипертензии расцениваются как первичная гипертензия, что обозначает высокое артериальное давление без очевидной лежащей в основе медицинской причины. Точная причина первичной гипертензии неизвестна, однако считают, что ряд факторов, включая увеличение сердечного выброса (объема крови, прокачиваемой сердцем) или периферическую резистентность, участвуют в развитии заболевания. Факторы риска, которые связаны с гипертензией, включают психологические факторы и факторы окружающей среды, такие как злоупотребление алкоголем, курение, старение, отсутствие физических упражнений, ожирение, слишком большое содержание соли в диете, стресс и подобные. Генетически, когда у обоих родителей есть гипертензия, потомки имеют 80% шанс развития гипертензии, если один из родителей имеет гипертензию, потомки имеют 25-50% шанс развития гипертензии.
Конечной целью в лечении гипертензии является поддержание оптимального артериального давления для минимизации повреждения тканей, вызванного гипертензией. Следовательно, применение профилактического образа жизни является таким же важным, как прием лекарственных препаратов. Целью является поддержание артериального давления менее чем 140/90 мм рт. ст. для пациентов с гипертензией и менее чем 130/80 мм рт. ст. для пациентов с гипертензией и диабетическими или нефритическими осложнениями.
Если гипертензию лечат, это может снизить смертность, вызванную инсультом и сердечно-сосудистыми заболеваниями. Когда пациентов с гипертензией лечат правильно, считается, что риск развития инсульта, инфаркта миокарда и сердечной недостаточности снижается на приблизительно 35~40%, 20~25% и более чем 50% соответственно. Снижение систолического артериального давления на 5 мм рт. ст. снижает смертность от всех причин на 7% в популяции, тогда как смертность из-за ишемической болезни сердца и инсульта может быть снижена на 9% и 14% соответственно. Также артериальное давление тесно связано с болезнью Альцгеймера и, следовательно, поддержание артериального давления может снизить риск болезни Альцгеймера.
Так как избегание факторов риска сердечно-сосудистых осложнений является очень важным для пациентов с гипертензией, как объясняется выше, постоянное поддержание артериального давления является критическим для таких пациентов. Более того, так как требуется принимать лекарственные препараты в течение длительного периода времени в лечении гипертензии, комбинация лекарственных средств с различными механизмами имеет преимущество над отдельными лекарственными средствами в отношении профилактического и терапевтического эффектов. Также комбинированная терапия позволяет уменьшить дозы отдельных лекарственных средств, таким образом уменьшая побочные эффекты, которые могут развиться из-за длительного применения отдельных лекарственных средств.
В общем, лекарственные препараты, которые часто используют в лечении гипертензии, разделяют в соответствии с их механизмом действия на диуретики, симпатолитические средства и вазодилататоры; и вазодилататоры дополнительно разделяют в соответствии с их механизмом действия, как указано далее: ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы рецептора ангиотензина II и блокаторы кальциевых каналов.
Между тем, гиперлипидемия представляет собой расстройство, при котором избыточно высокий уровень липидов в крови вызывает образование бляшек на стенках артерий с последующим воспалением и, в конечном счете, сердечно-сосудистыми заболеваниями. В последние годы патологическое количество липидов в крови определяют как дислипидемию.
В лечении гиперлипидемии нелекарственная терапия, такая как изменение образа жизни (включая физические упражнения и диету) и поддержание идеальной массы тела, могут быть использованы в сочетании с лекарственными препаратами. Обычно используется терапия на основе статинов, и такие лекарственные средства действуют как ингибиторы HMG-CoA редуктазы, которые обладают способностью ингибировать синтез холестерина и таким образом вызывать достоверное снижение уровня ЛПНП-холестерина в плазме, и также приводить к частичному снижению уровня триглицеридов.
Амлодипин представляет собой международное непатентованное наименование 3-этил-5-метил-2-(2-аминоэтоксиметил)-4-(2-хлорфенил)-6-метил-1,4-дигидро-3,5-пиридина дикарбоксилата и, в частности, амлодипина безилат является коммерчески доступным под торговым наименованием Норваск®. Амлодипина камзилат, как описано в корейском патенте No. 452491, проявляет лучшую растворимость и стабильность относительно безилата амлодипина, и в настоящее время доступен под торговым наименованием Амодипин®. Амлодипин блокирует кальциевые каналы, и является применимым в лечении сердечно-сосудистых заболеваний, таких как стенокардия, гипертензия и застойная сердечная недостаточность.
Лозартан представляет собой международное непатентованное наименование для 2-бутил-4-хлор-1-[2'-(1H-тетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1H-имидазол-5-метан метанола, как описано в патентах США No. 5608075, 5138069 и 5153197. В настоящее время лозартан калия коммерчески доступен под торговым наименованием Козаар®. Путем блокады взаимодействия ангиотензина II и его рецептора лозартан главным образом используют для лечения гипертензии, сердечной недостаточности, ишемического периферического циркуляторного расстройства, ишемии миокарда (стенокардия напряжения), диабетической нейропатии и глаукомы, и также для профилактики прогрессирования сердечной недостаточности после инфаркта миокарда.
Комбинированный состав амлодипина и лозартана, которые имеют отличный друг от друга механизм действия, имеет преимущество над отдельными средствами в отношении профилактического и терапевтического эффекта. Кроме того, такой состав позволяет уменьшить дозы отдельных лекарственных средств, таким образом уменьшая побочные эффекты, которые могут развиться из-за длительного введения отдельных лекарственных средств. Комбинированный состав описан в корейских патентах No. 1160151, 1232296, и др., и в настоящее время продается под торговым наименованием Амосартан®.
Розувастатин представляет собой международное непатентованное наименование для (E)-7-[4-(4-фторфенил)-6-изопропил-2-[метил(метилсульфонил)амино]пиримидин-5-ил]-(3R,5S)-3,5-дигидроксигеп-6-еноевой кислоты, и в настоящее время доступен под торговым наименованием Крестор®. Такие лекарственные средства на основе статинов действуют как ингибитор HMG-CoA редуктазы, который ингибирует синтез холестерина и снижает концентрации холестерина ЛПНП плазмы и триглицеридов. Розувастатин является очень эффективным в лечении гиперхолестеринемии, гиперлипопротеинемии или атеросклероза.
Частота сосуществования гипертензии и гиперлипидемии составляет приблизительно 49%, и совместное введение Амосартана® и лекарственных средств на основе статинов составляет приблизительно 30% в лекарственной терапии сердечно-сосудистых заболеваний.
В клинических исследованиях существует нарастающая необходимость в комбинированном составе, содержащем амлодипин, лозартан и розувастатин, имеющих различные механизмы действия, для более эффективного лечения сердечно-сосудистых заболеваний. Однако трудно коммерциализировать такой состав из-за сложности создания и возможности ухудшения растворения и стабильности из-за взаимодействия между активными ингредиентами.
Приходя к настоящему изобретению, авторы настоящего изобретения провели интенсивные исследования для решения проблем обычных составов и обнаружили, что скорость растворения и стабильность активных ингредиентов варьируется в зависимости от структуры двухслойной таблетки и способа ее производства, и таким образом получили фармацевтические комбинированные составы, содержащие амлодипин, лозартан и розувастатин, имеющие улучшенную скорость растворения и стабильность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следовательно, целью настоящего изобретения является предоставление фармацевтического комбинированного состава для лечения сердечно-сосудистых заболеваний, содержащего амлодипин, лозартан и розувастатин, имеющие механизмы действия, отличные друг от друга, который проявляет превосходные свойства растворения и стабильности.
В соответствии с одним аспектом настоящего изобретения, предоставляют фармацевтический комбинированный состав для профилактики или лечения сердечно-сосудистых заболеваний, содержащий: (1) первую отдельную часть, содержащую амлодипин и его фармацевтически приемлемую соль, розувастатин или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку; и (2) вторую отдельную часть, содержащую лозартан или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку, где указанные отдельные части физически отделены друг от друга.
Фармацевтический комбинированный состав, содержащий амлодипин, лозартан и розувастатин, может быть эффективно использован для профилактики или лечения сердечно-сосудистого нарушения. Созданный для минимизации взаимодействия между активными ингредиентами, фармацевтический комбинированный состав проявляет превосходную стабильность при хранении и скорости растворения амлодипина, лозартана и розувастатина и, следовательно, может быть применим в фармацевтической промышленности.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеуказанные и другие задачи и характеристики настоящего изобретения будут более четко понятны из следующего подробного описания в сочетании с сопутствующими чертежами, в которых:
Фиг. 1 представляет собой схематический вид, показывающий двухслойную таблетку по одному варианту осуществления настоящего изобретения.
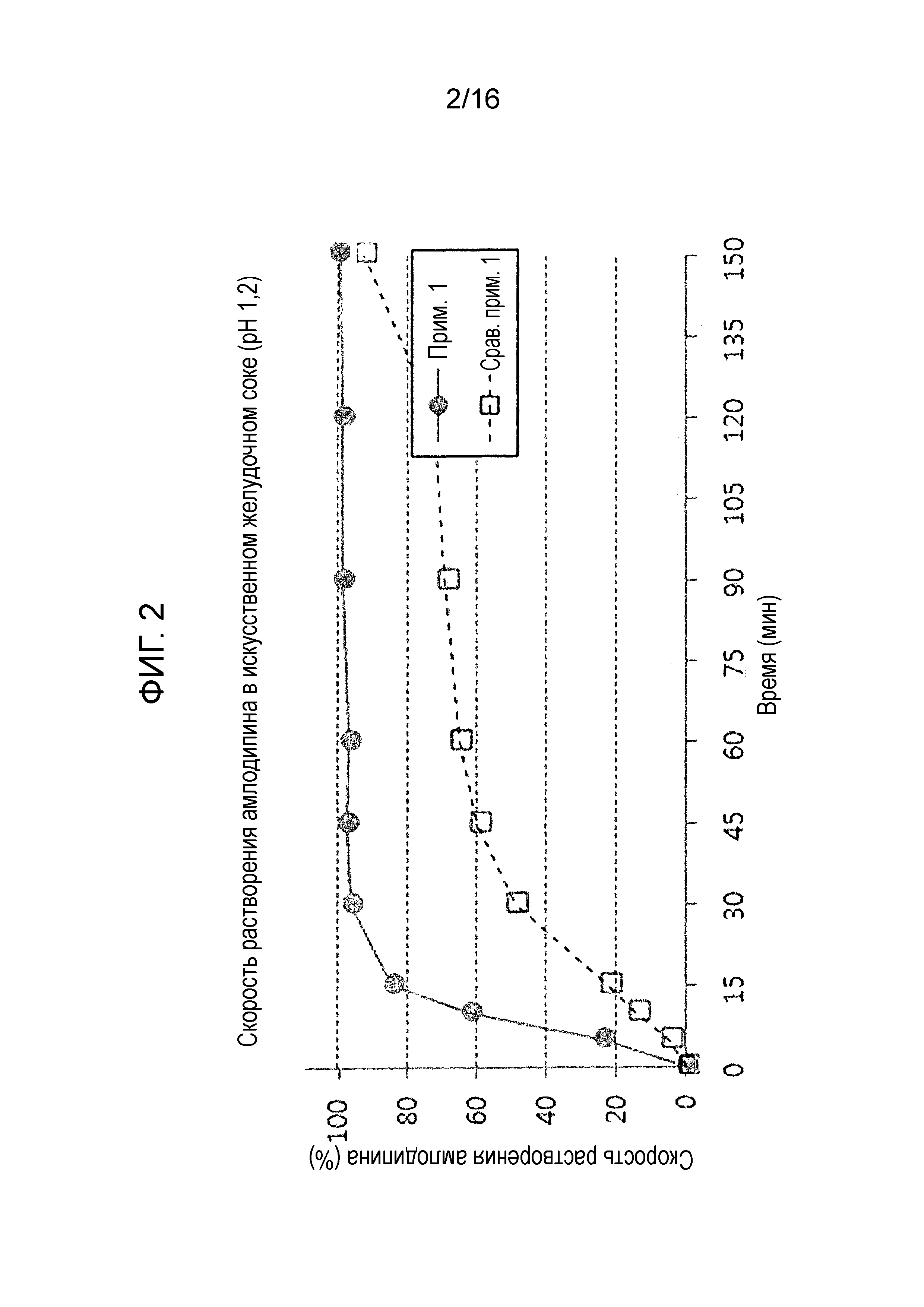
Фиг. 2 представляет собой график, показывающий скорость растворения амлодипина в составах примера 1 и сравнительного примера 1.
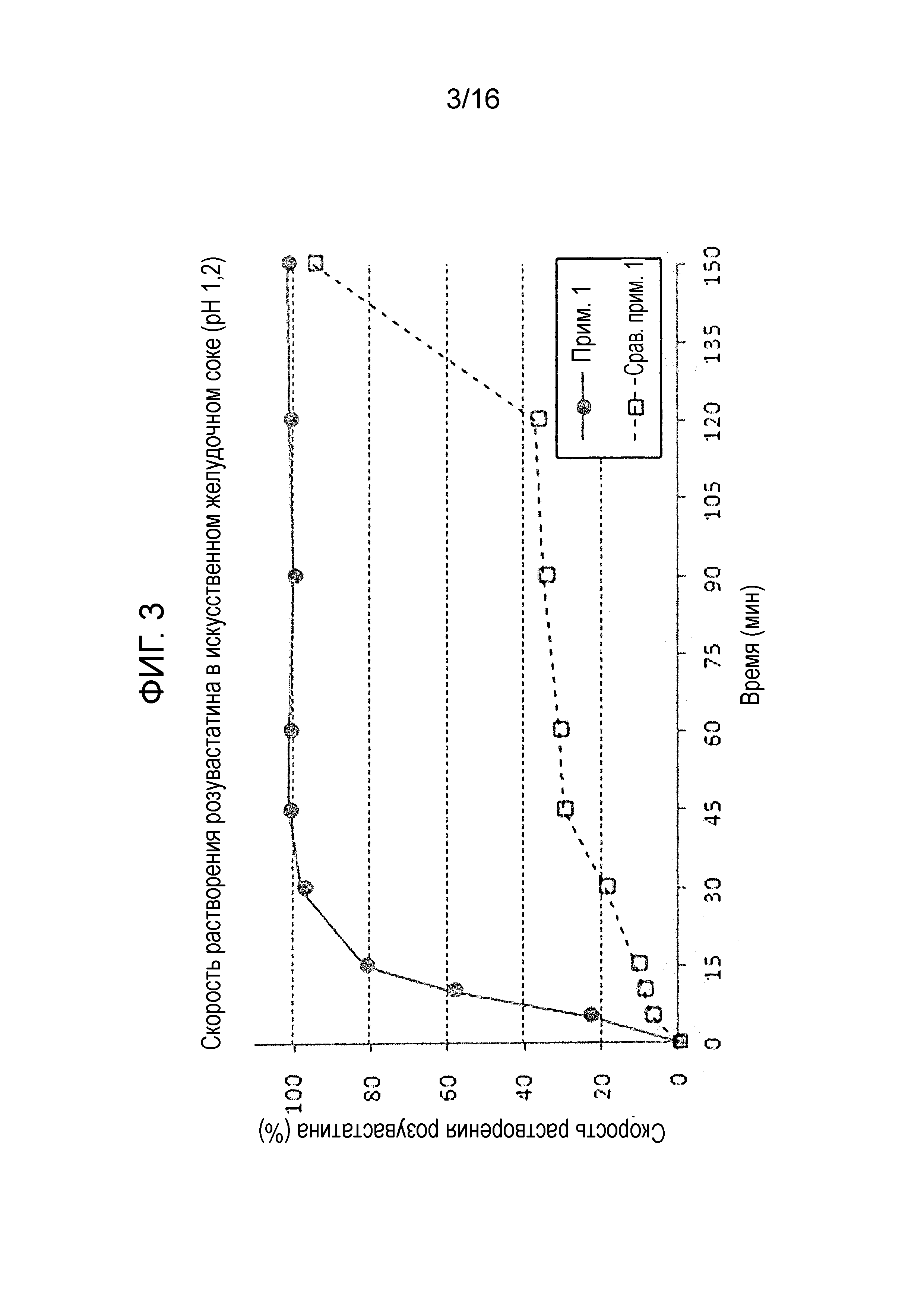
Фиг. 3 представляет собой график, показывающий скорость растворения розувастатина в составах примера 1 и сравнительного примера 1.
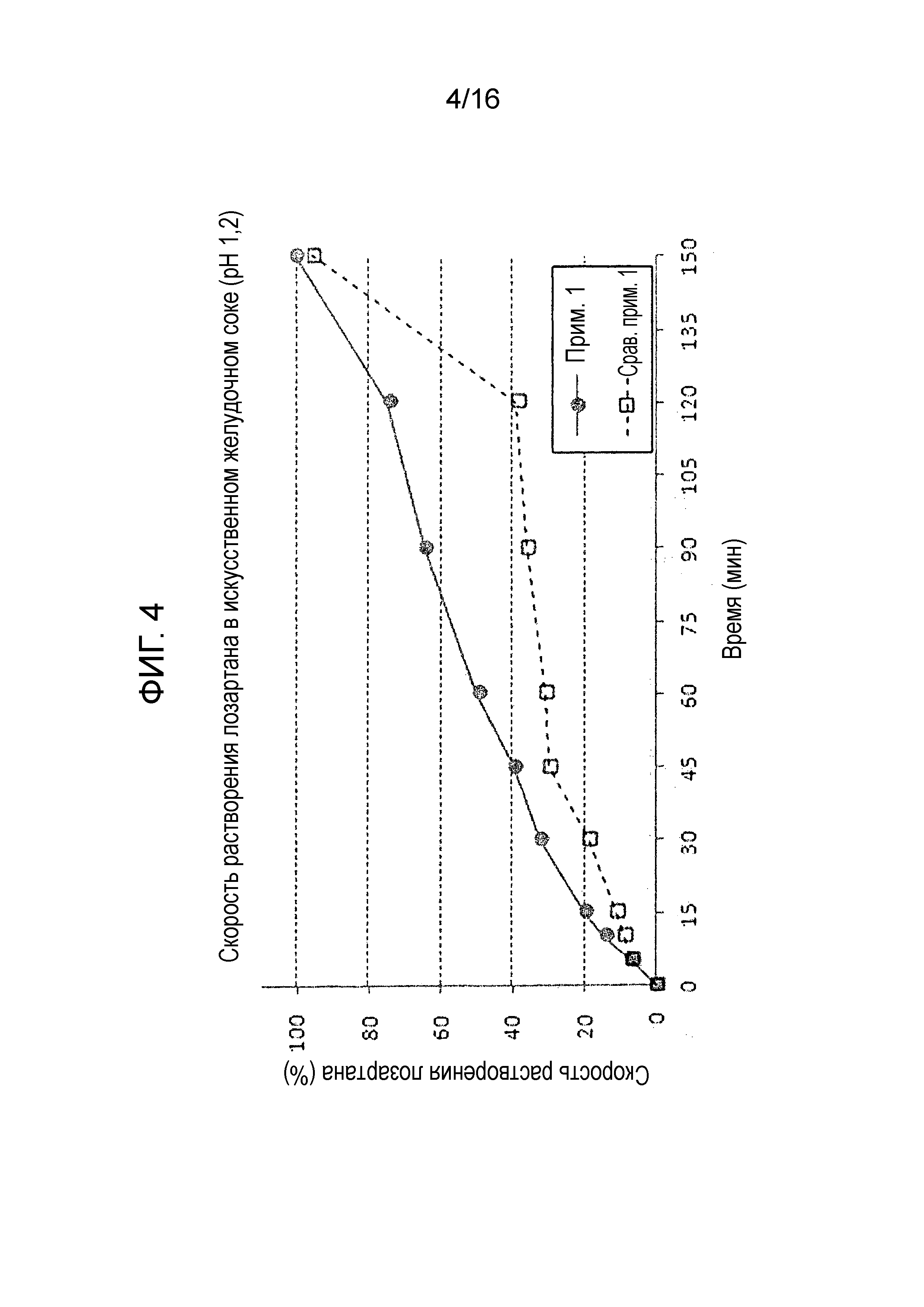
Фиг. 4 представляет собой график, показывающий скорость растворения лозартана в составах примера 1 и сравнительного примера 1.
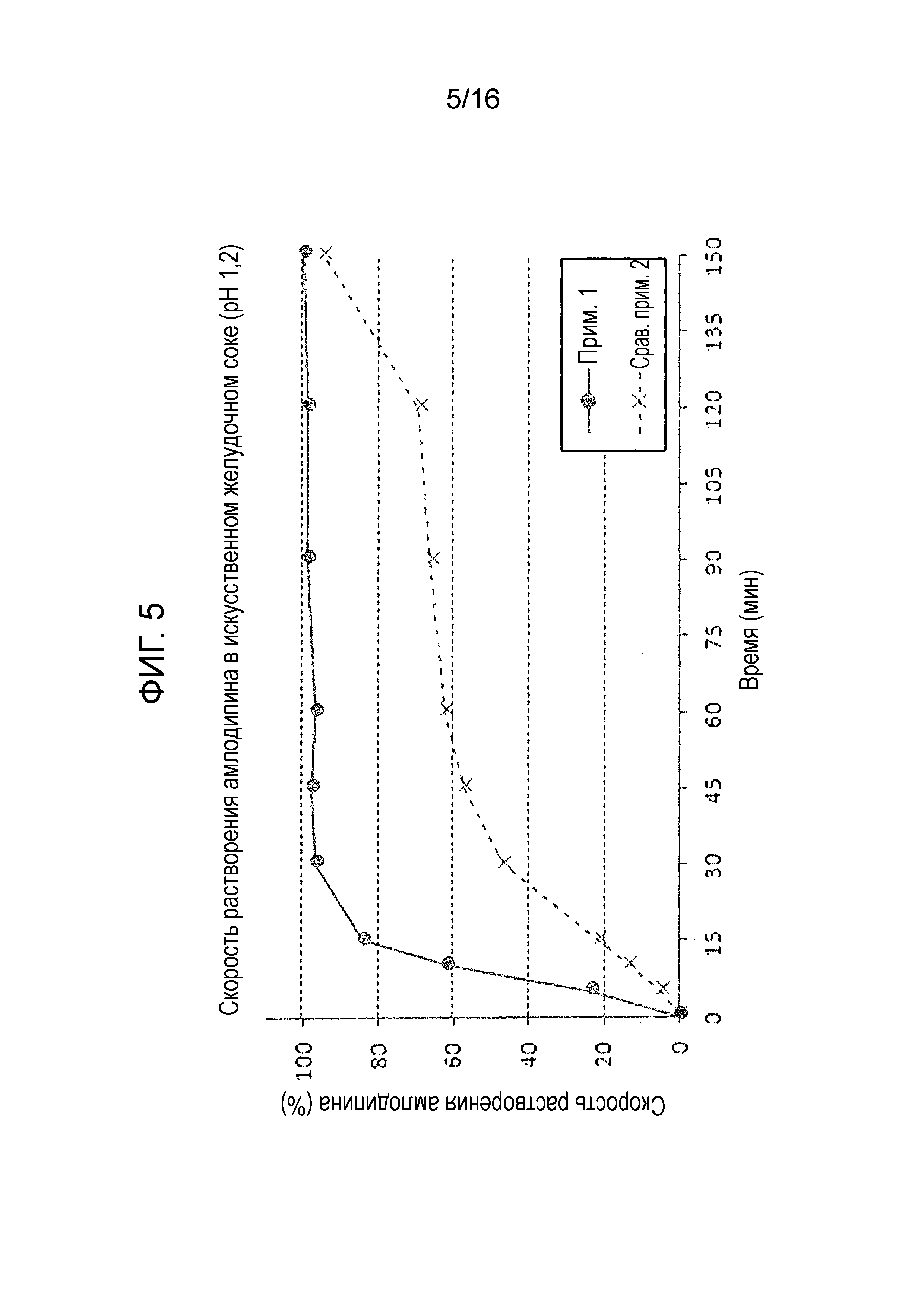
Фиг. 5 представляет собой график, показывающий скорость растворения амлодипина в составах примера 1 и сравнительного примера 2.
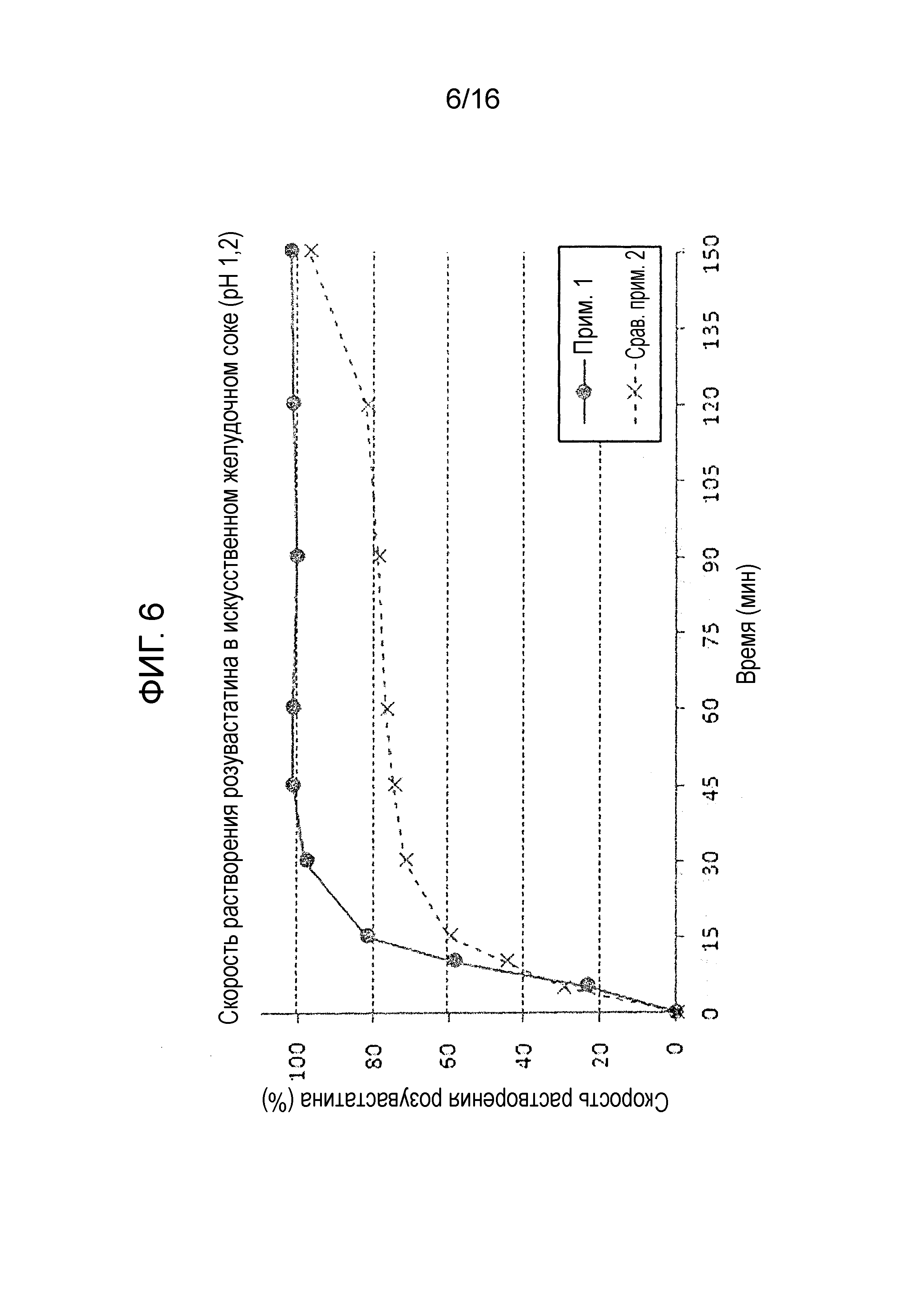
Фиг. 6 представляет собой график, показывающий скорость растворения розувастатина в составах примера 1 и сравнительного примера 2.
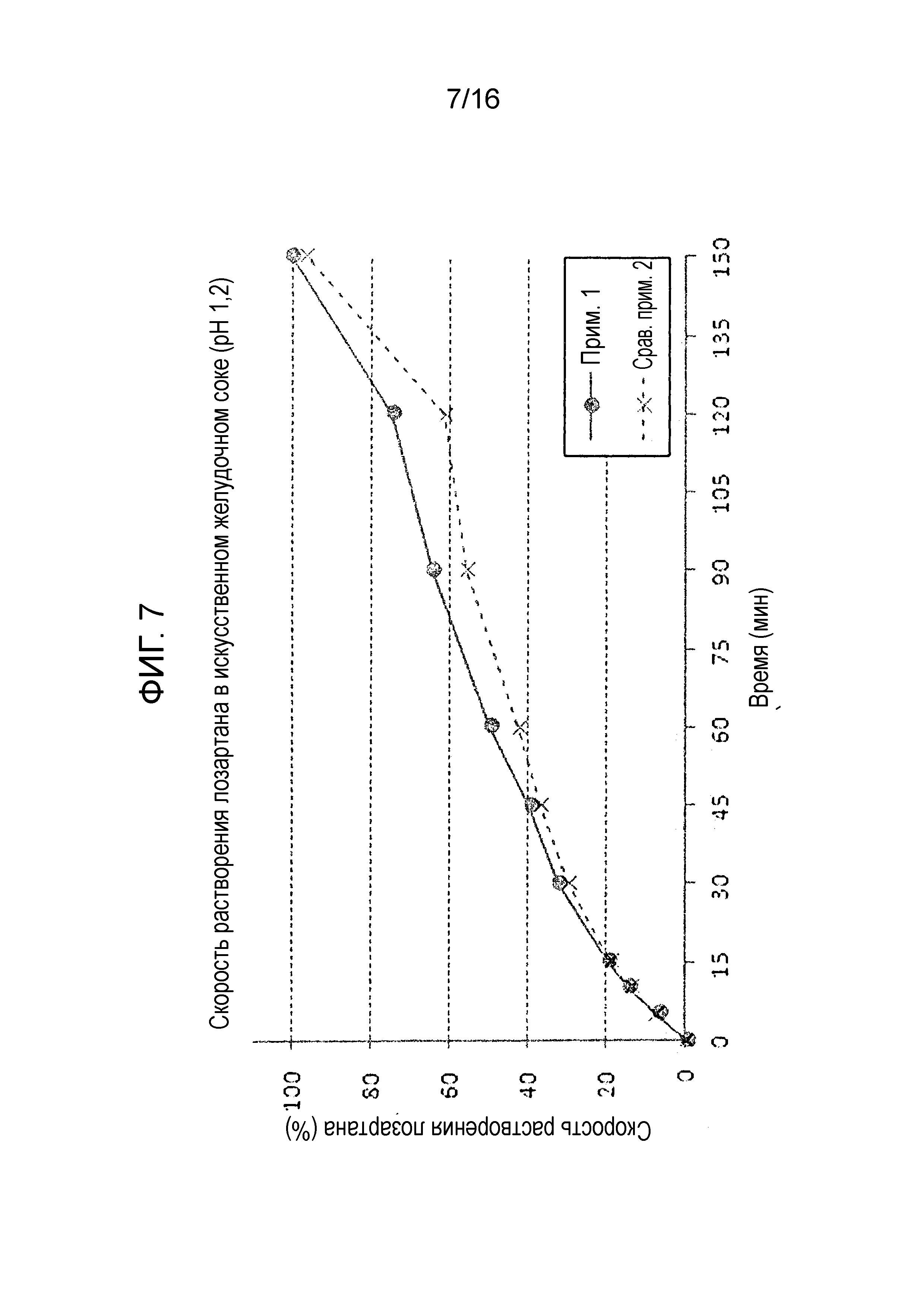
Фиг. 7 представляет собой график, показывающий скорость растворения лозартана в составах примера 1 и сравнительного примера 2.
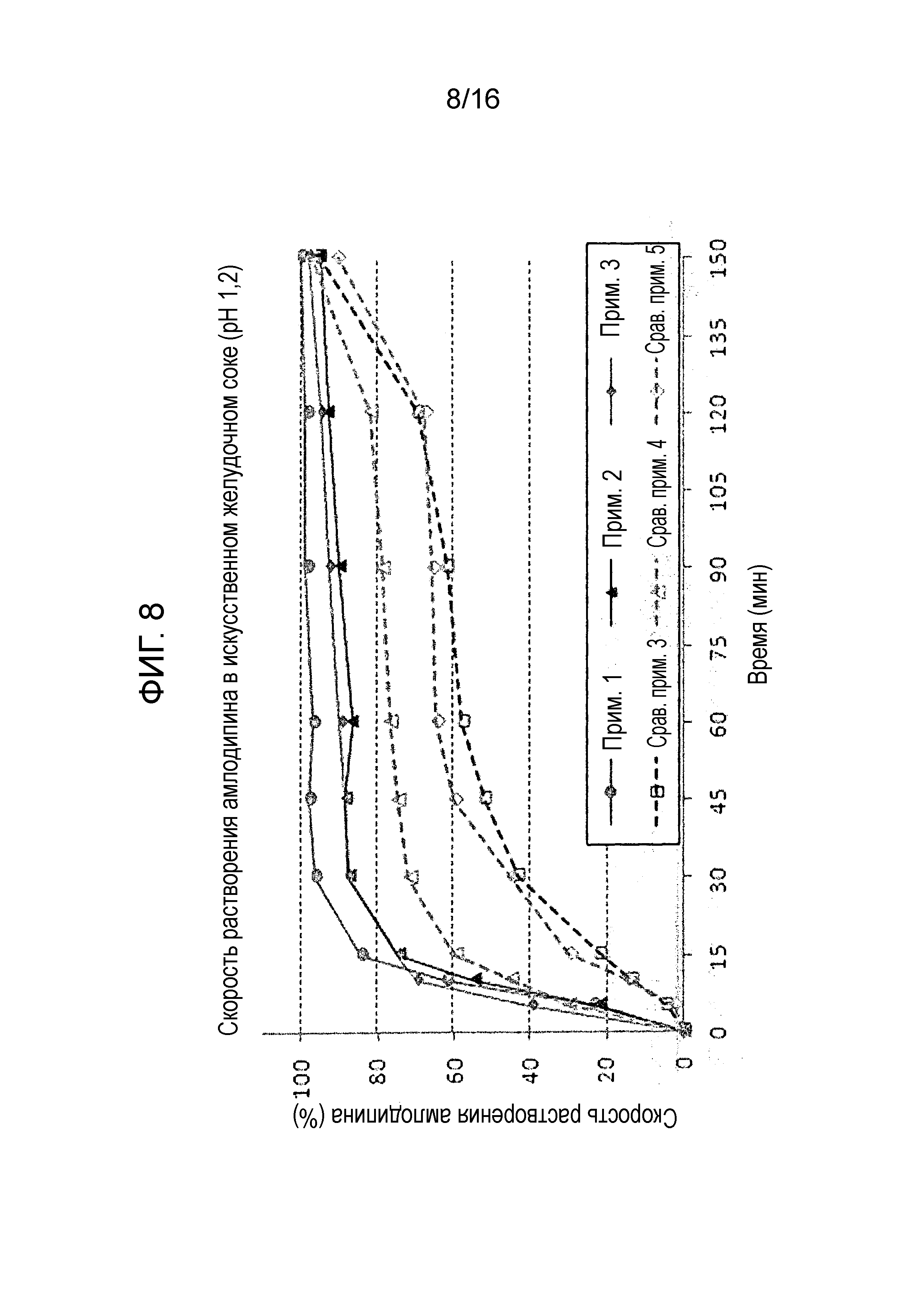
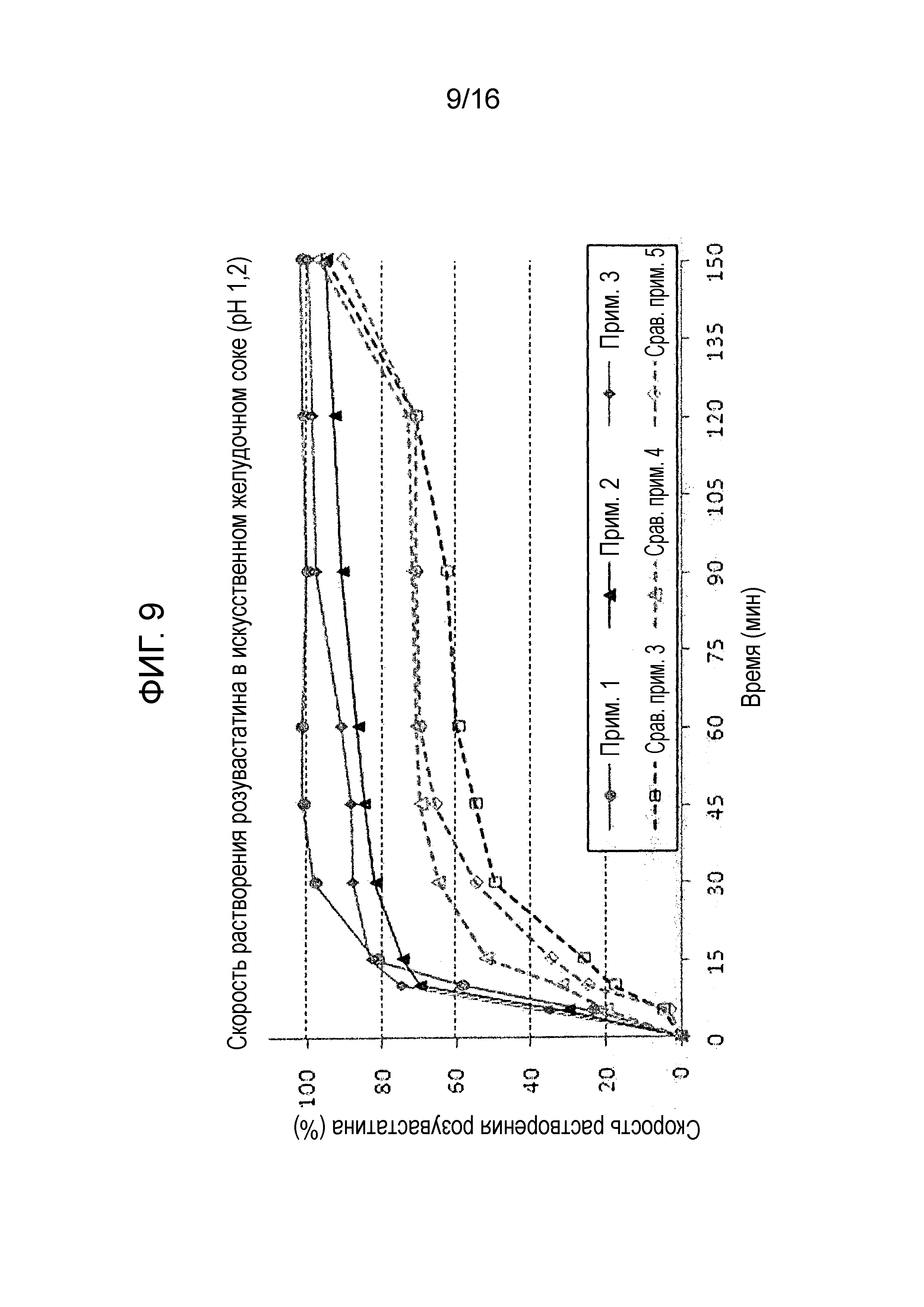
Фиг. 8 представляет собой график, показывающий скорость растворения амлодипина в составах примеров 1-3 и сравнительных примеров 3-5.
Фиг. 9 представляет собой график, показывающий скорость растворения розувастатина в составах примеров 1-3 и сравнительных примеров 3-5.
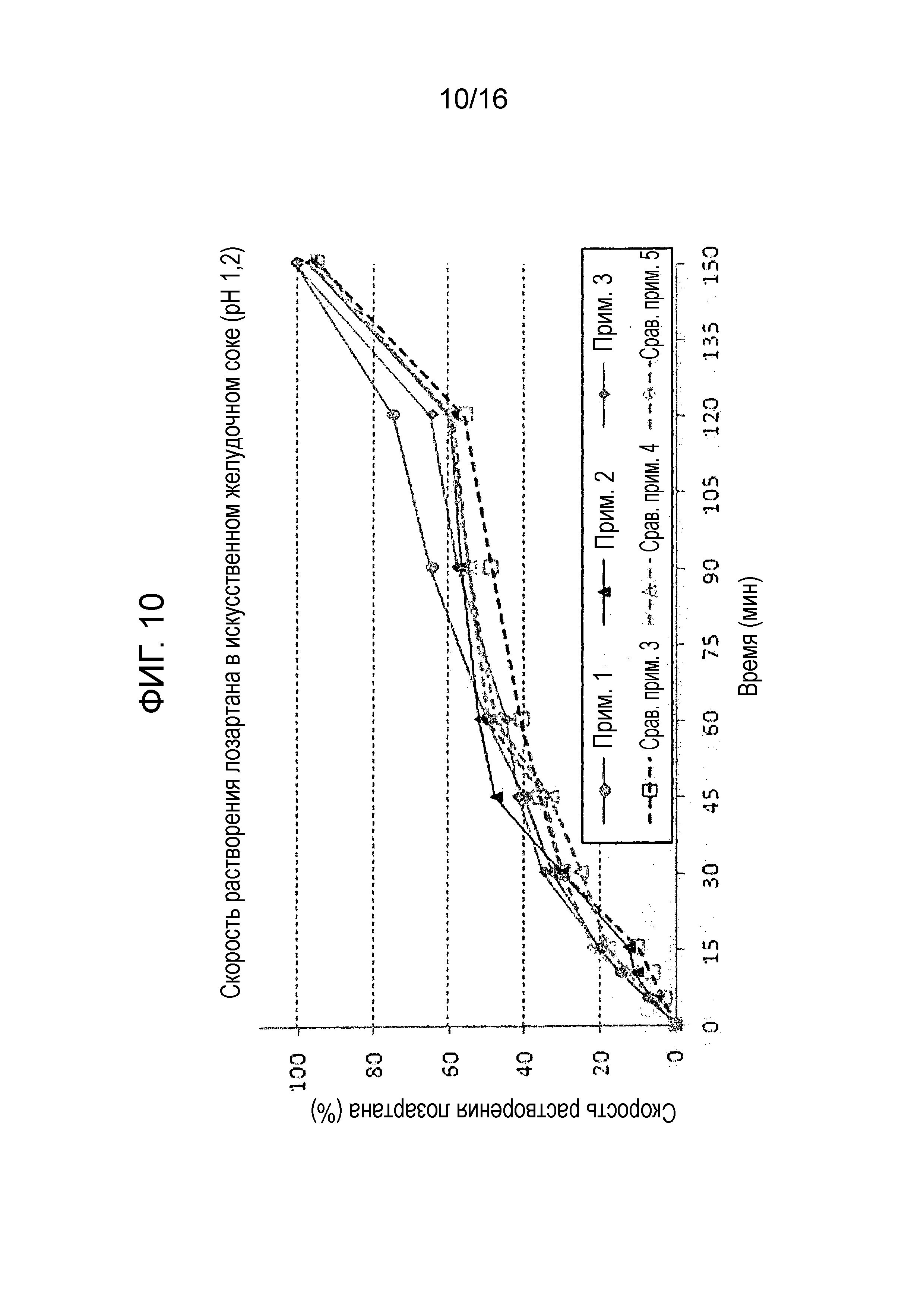
Фиг. 10 представляет собой график, показывающий скорость растворения лозартана в составах примеров 1–3 и сравнительных примеров 3-5.
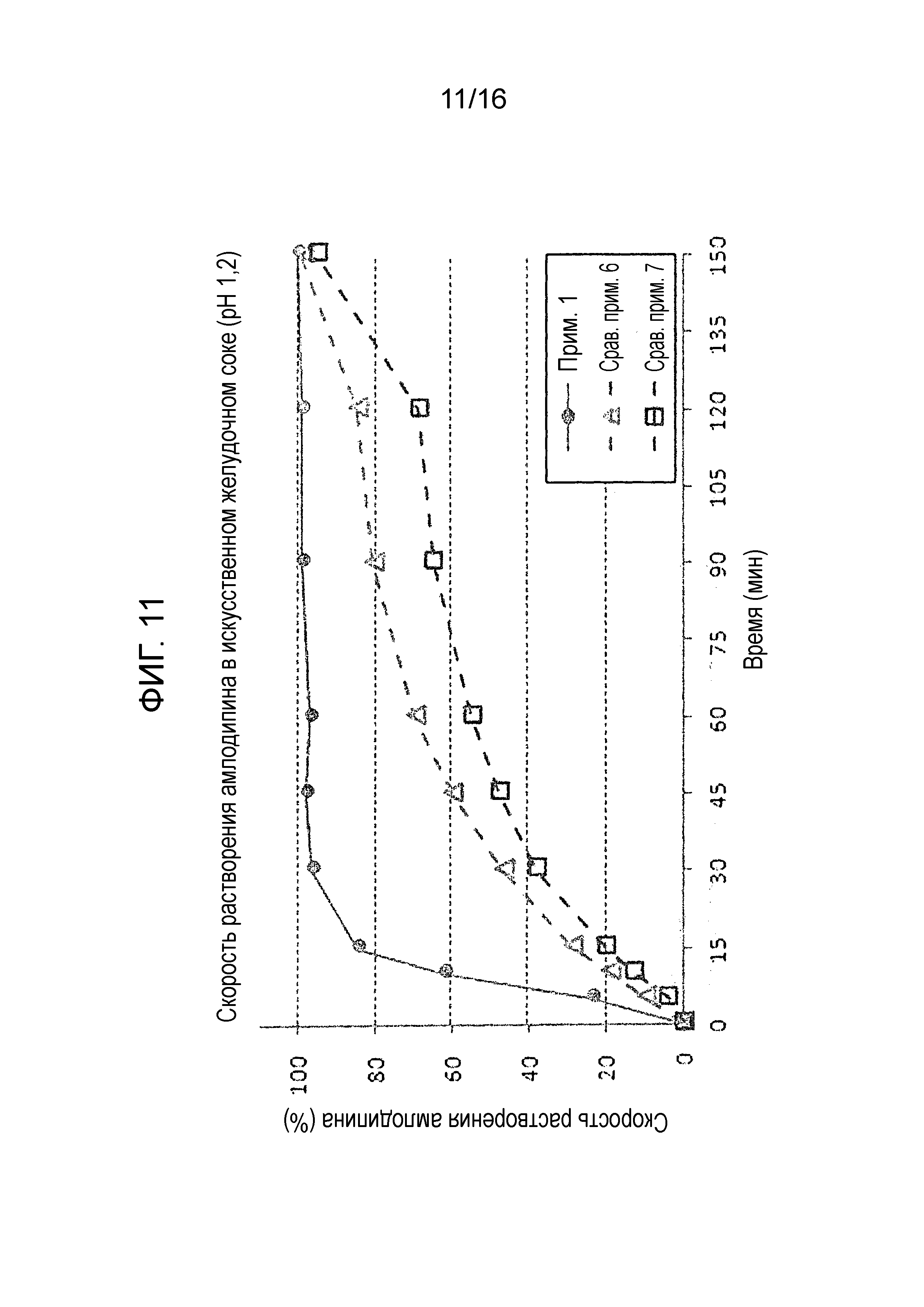
Фиг. 11 представляет собой график, показывающий скорость растворения амлодипина в составах примера 1 и сравнительных примеров 6 и 7.
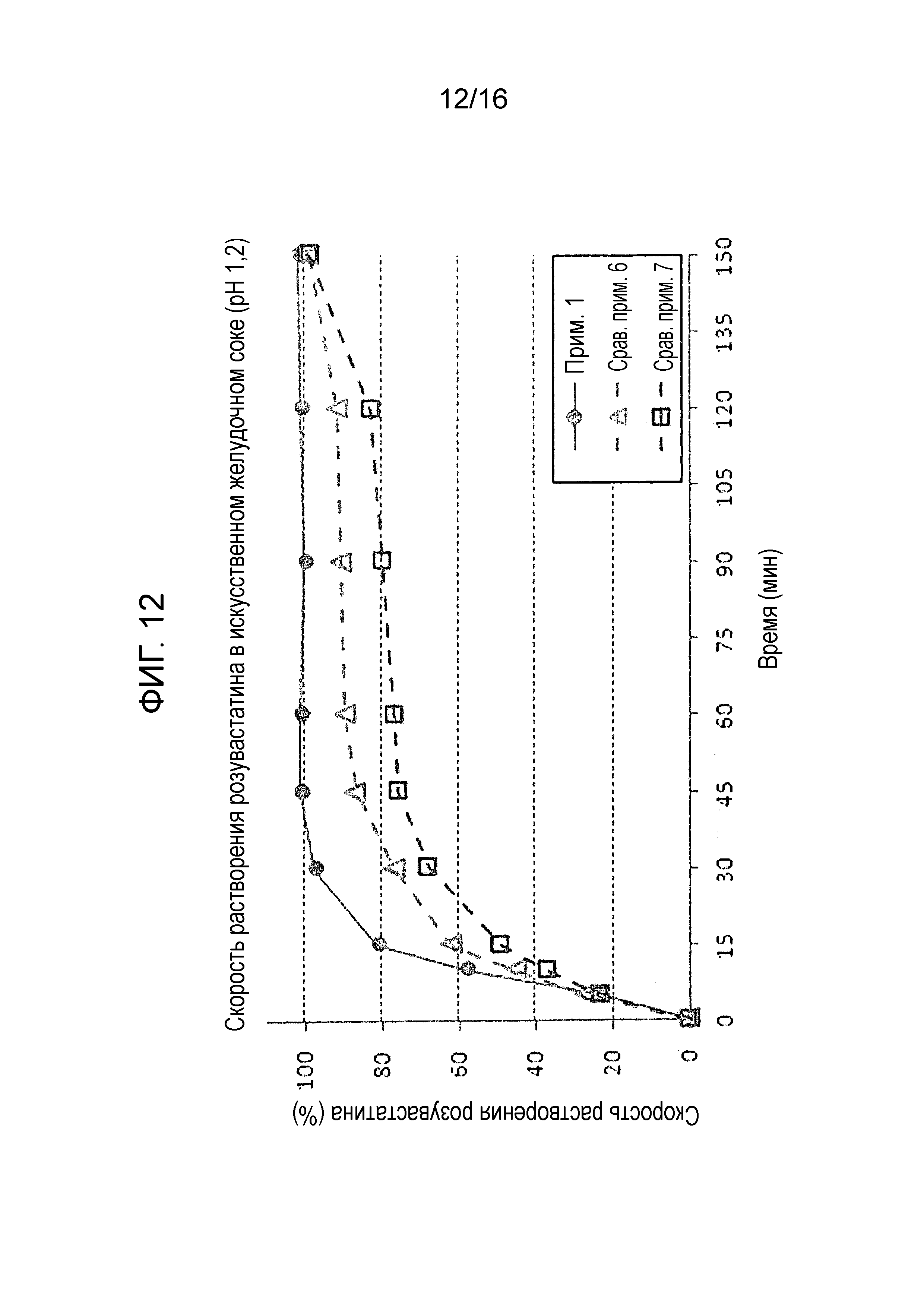
Фиг. 12 представляет собой график, показывающий скорость растворения розувастатина в составах примера 1 и сравнительных примеров 6 и 7.
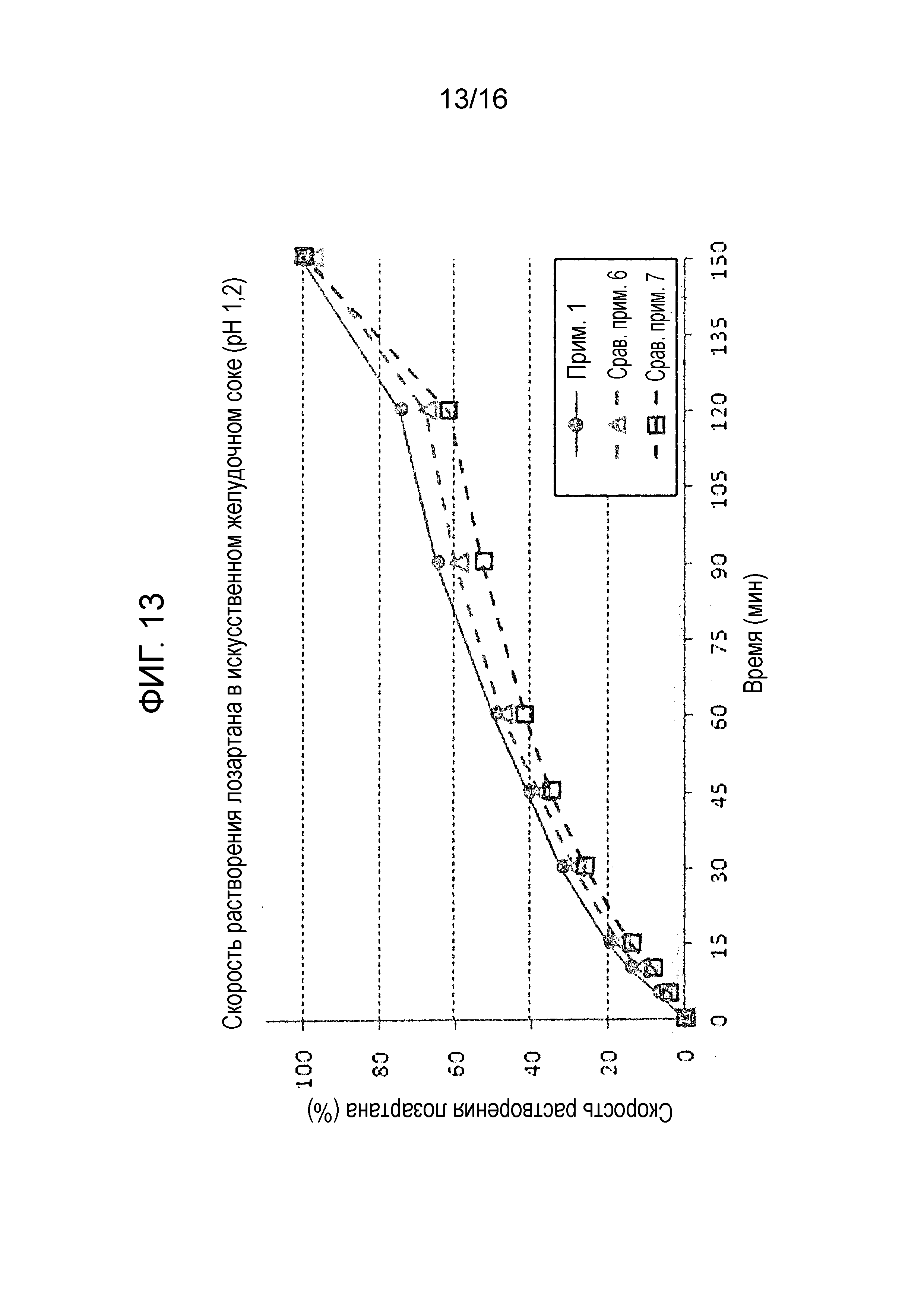
Фиг. 13 представляет собой график, показывающий скорость растворения лозартана в составах примера 1 и сравнительных примеров 6 и 7.
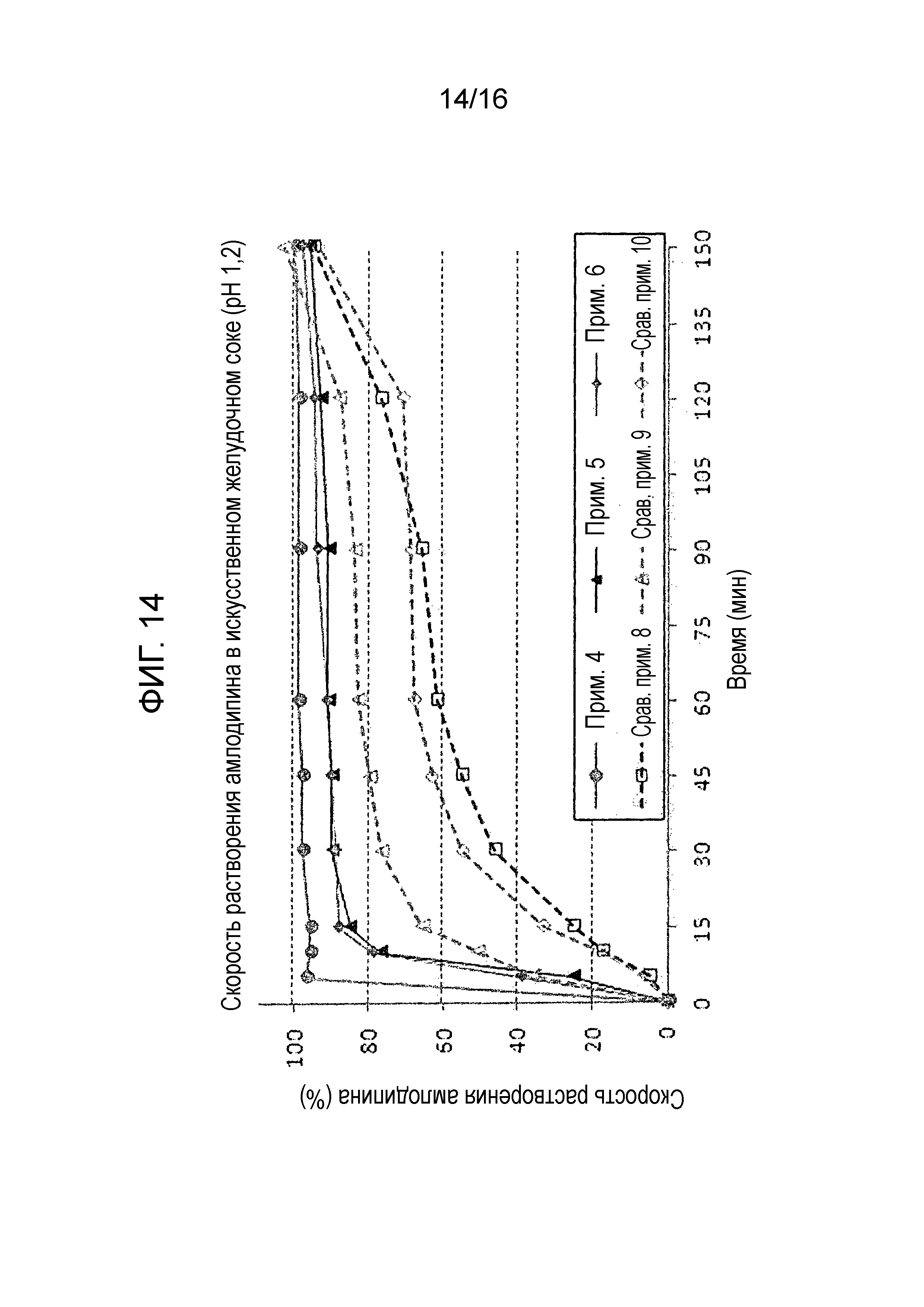
Фиг. 14 представляет собой график, показывающий скорость растворения амлодипина в составах примеров 4-6 и сравнительных примеров 8-10.
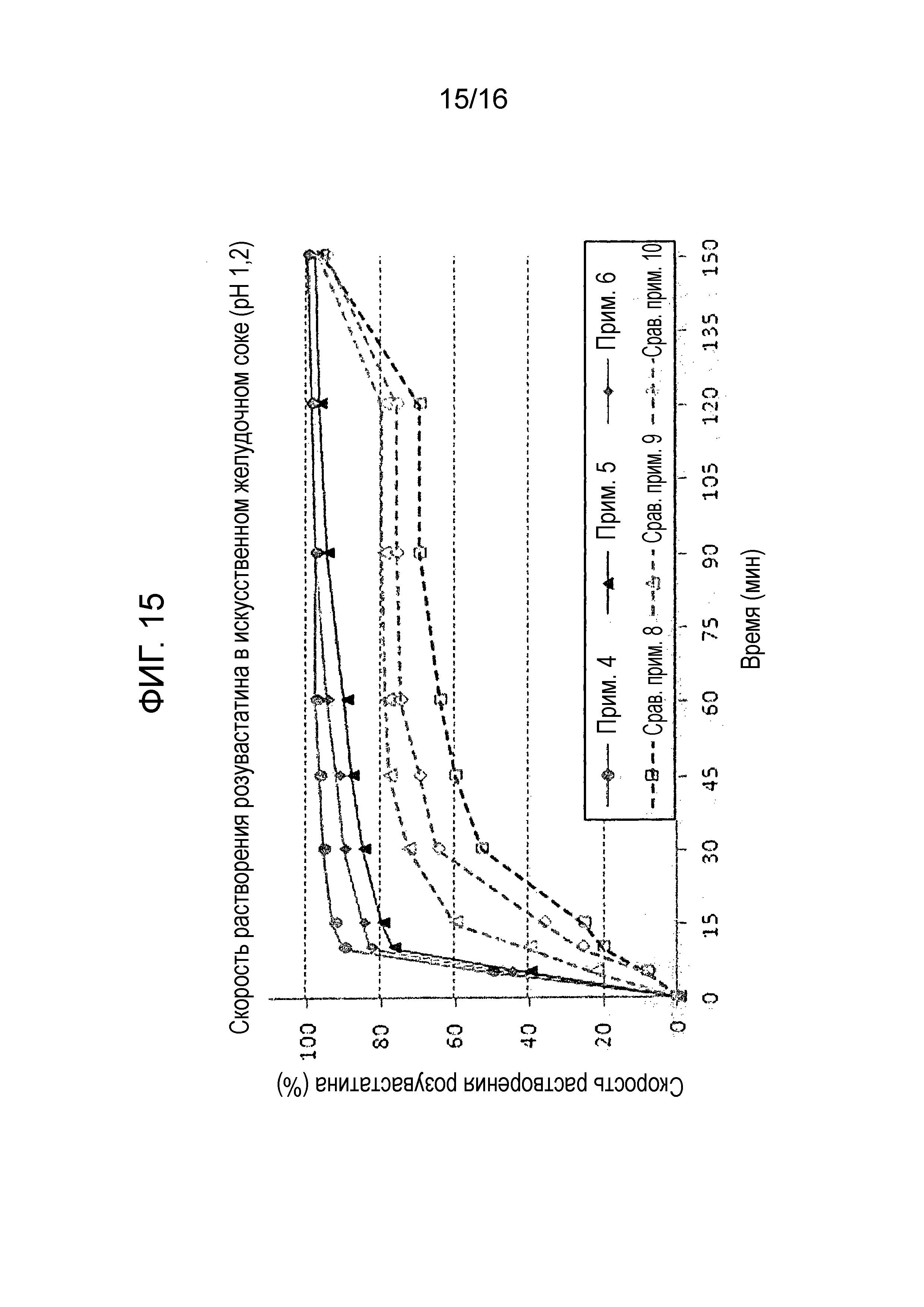
Фиг. 15 представляет собой график, показывающий скорость растворения розувастатина примеров 4-6 и сравнительных примеров 8-10.
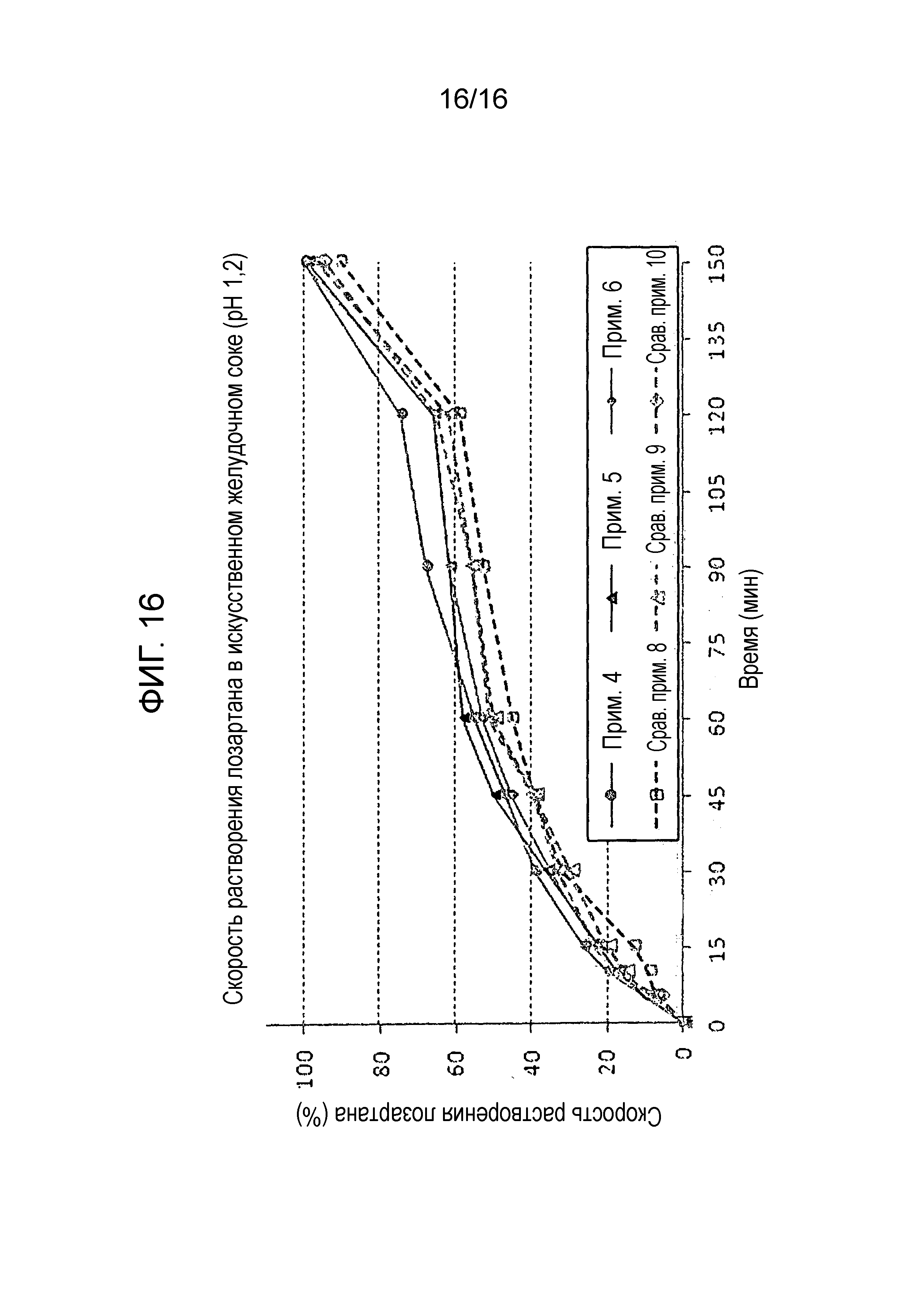
Фиг. 16 представляет собой график, показывающий скорость растворения лозартана в составах примеров 4-6 и сравнительных примеров 8-10.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет фармацевтический комбинированный состав для профилактики или лечения сердечно-сосудистого заболевания, содержащий: (1) первую отдельную часть, содержащую амлодипин или его фармацевтически приемлемую соль, розувастатин или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку; и (2) вторую отдельную часть, содержащую лозартан или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку, где указанные отдельные части физически отделены друг от друга.
Комбинированный состав по настоящему изобретению содержит первую или вторую отдельные части, в которых указанные отдельные части являются физически разделенными, т.е. амлодипин и лозартан содержатся отдельно. Следовательно, предотвращается взаимодействие между амлодипином и лозартаном, таким образом обеспечивая улучшенную стабильность.
В одном варианте осуществления настоящего изобретения первая отдельная часть и вторая отдельная часть в комбинированном составе могут быть первым и вторым слоем соответственно. Иными словами, комбинированный состав может быть в форме двухслойной таблетки, содержащей: (1) первый слой, содержащий амлодипин или его фармацевтически приемлемую соль, розувастатин или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку; и (2) второй слой, содержащий лозартан или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку (см. фиг. 1). В отличие от двухслойной таблетки в другом варианте осуществления настоящего изобретения комбинированный состав может быть получен в различных формах, где первая отдельная часть и вторая отдельная часть являются физически отделенными друг от друга (например, структура ядро-оболочка).
Комбинированный состав по настоящему изобретению содержит амлодипин или его фармацевтически приемлемую соль в первой отдельной части (или первом слое). Фармацевтически приемлемая соль амлодипина, используемая в настоящем изобретении, может быть получена с использованием кислоты, содержащей фармацевтически приемлемый анион, который может образовывать нетоксичную аддитивную соль кислоты, например гидрохлорид, гидробромид, сульфат, фосфат, ацетат, малат, фумарат, лактат, тартрат, цитрат, глюконат, безилат и камзилат, но не ограничиваясь ими. Предпочтительно фармацевтически приемлемой солью амлодипина является амлодипина безилат и камзилат, более предпочтительно камзилат. Также амлодипин по настоящему изобретению содержит рацемическую смесь и (S)-амлодипин. Амлодипин или его фармацевтически приемлемая соль могут вводиться в суточной дозе от 5 до 10 мг.
Комбинированный состав по настоящему изобретению содержит розувастатин или его фармацевтически приемлемую соль в первой отдельной части (или первом слое). Примеры фармацевтически приемлемой соли розувастатина содержат неорганические соли, имеющие поликатион, предпочтительно розувастатин кальция, но без ограничения. Розувастатин или его фармацевтически приемлемую соль можно вводить в суточной дозе от 10 до 20 мг.
Комбинированный состав по настоящему изобретению содержит лозартан или его фармацевтически приемлемую соль во второй отдельной части (или втором слое). Примеры фармацевтически приемлемой соли лозартана содержат лозартан калия, не ограничиваясь им. Лозартан или его фармацевтически приемлемую соль можно вводить в суточной дозе от 45 до 100 мг.
В комбинированном составе по настоящему изобретению амлодипин или его фармацевтически приемлемая соль, розувастатин или его фармацевтически приемлемая соль и лозартан или его фармацевтически приемлемая соль могут быть смешаны в массовом соотношении 1:1~4:10~20, без ограничения.
В настоящем изобретении первая отдельная часть (или первый слой) и вторая отдельная часть (или второй слой) комбинированного состава могут дополнительно включать фармацевтически приемлемую добавку, например фармацевтически приемлемый носитель или вспомогательное вещество. Примеры фармацевтически приемлемых носителей или вспомогательных веществ включают лактозу (гидрат лактозы), микрокристаллическую целлюлозу, маннит, цитрат натрия, цитрат кальция, фосфат кальция, глицин и крахмал, дезинтегрирующее вещество (например, кросповидон, коповидон, натрия крахмала гликолят, кроскармеллозу натрия и комбинированные силикаты) и вяжущее вещество (например, поливинилпирролидон, гидроксипропилметилцеллюлозу (HPMC), гидроксипропилцеллюлозу (HPC), сахарозу, желатин и гуммиарабик).
В одном варианте осуществления изобретения комбинированный состав по настоящему изобретению содержит гидрат лактозы и микрокристаллическую целлюлозу в первой отдельной части (или первом слое) в качестве добавок. Гидрат лактозы может содержаться в количестве от 20 до 40 мас.% на основании общей массы первой отдельной части (или первого слоя). Микрокристаллическая целлюлоза может содержаться в количестве от 50 до 70 мас.% на основании общей массы первой отдельной части (или первого слоя). В другом варианте осуществления изобретения гидрат лактозы и микрокристаллическая целлюлоза могут использоваться в соотношении 1:1,5 до 1:3.
Когда гидрат лактозы используют в указанном диапазоне, гидрат лактозы может образовывать гидрофильные каналы, которые обеспечивают растворение активных ингредиентов, таким образом, обеспечивая быстрое растворение. Профиль быстрого растворения не может быть получен, когда количество падает ниже указанного диапазона, и если количество превосходит указанный диапазон, время, требуемое для полного растворения гидрата лактозы, увеличивается и посредством этого замедляет растворение активных ингредиентов. В случае микрокристаллической целлюлозы процесс получения таблеток становится проще, если микрокристаллическую целлюлозу используют в указанном диапазоне. Однако количество, меньшее, чем указанный диапазон, может вызывать некоторые затруднения в течение процесса получения таблеток, тогда как избыточное количество может приводить к чрезмерно крупному размеру состава.
Соответственно скорости растворения амлодипина, розувастатина и лозартана могут быть достоверно улучшены с использованием гидрата лактозы и микрокристаллической целлюлозы в указанном диапазоне.
В одном варианте осуществления изобретения вторая отдельная часть (или второй слой) комбинированного состава по изобретению может быть получена обычным образом, например прессованием гранул с последующим таблетированием. В другом варианте осуществления изобретения вторая отдельная часть находится в форме гранул, полученных процессом сухого роллерного прессования. В соответствии с результатами эксперимента настоящего изобретения комбинированный состав проявлял улучшенную скорость растворения амлодипина, розувастатина и лозартана, а также превосходные профили растворения амлодипина и розувастатина, когда комбинированный состав получали таблетированием просто смешанной первой отдельной части и второй отдельной части, полученных гранулированием прессованием.
Проблема гелеобразования лозартана возникает, когда комбинированный состав получают путем простого смешивания амлодипина, розувастатина и лозартана. Лозартан легко растворяется в очищенной воде и легко высвобождается при относительно высоком pH (например, pH 4,0, pH 6,8), но очень медленно высвобождается при низком pH (например, pH 1,2, pH 2,0) из-за гелеобразования. Такая проблема достоверно оказывает нежелательные эффекты на скорость растворения и биодоступность состава, так как при пероральном введении состав сначала подвергается воздействию кислого желудочного сока, имеющего низкое значение pH. Когда гелеобразование лозартана прогрессирует в составе, амлодипин и розувастатин захватываются в гель лозартана и плохо растворяются, что продемонстрировано в сравнительном примере 1. Результат растворения однослойной таблетки сравнительного примера 1, полученной путем простого смешивания указанных трех ингредиентов, был достоверно ниже чем “80% растворения в момент времени 30 минут при pH 1,2.”
При сравнении комбинированный состав по настоящему изобретению отделяет первую отдельную часть, содержащую амлодипин и розувастатин, от второй отдельной части, содержащей лозартан, посредством этого уменьшая контактную площадь лозартана. В результате, в условиях низкого pH гелеобразование лозартана может быть предотвращено и таким образом имеет место улучшенная стабильность и скорость растворения амлодипина, розувастатина и лозартана.
Между тем, настоящее изобретение также предоставляет комбинированный состав с фиксированной дозой для профилактики или лечения сердечно-сосудистого заболевания, содержащий: (1) первую отдельную часть, содержащую амлодипин или его фармацевтически приемлемую соль, розувастатин или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку; и (2) вторую отдельную часть, содержащую лозартан или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку, где указанные отдельные части физически отделены друг от друга.
В одном варианте осуществления комбинированного состава с фиксированной дозой количество амлодипина или его фармацевтически приемлемой соли в пересчете на свободное основание амлодипина составляет 5-10 мг. В одном варианте осуществления комбинированного состава с фиксированной дозой количество розувастатина или его фармацевтически приемлемой соли в пересчете на свободную кислоту розувастатина составляет от 10 до 20 мг. Также в одном варианте осуществления комбинированного состава с фиксированной дозой количество лозартана или его фармацевтически приемлемой соли в пересчете на свободное основание лозартана составляет от 45 до 100 мг.
Более того, в соответствии с другим аспектом настоящее изобретение предоставляет способ получения фармацевтического комбинированного состава для профилактики или лечения сердечно-сосудистого заболевания, содержащий: a) смешивание амлодипина или его фармацевтически приемлемой соли, розувастатина или его фармацевтически приемлемой соли и фармацевтически приемлемой добавки; b) смешивание лозартана или его фармацевтически приемлемой соли и его фармацевтически приемлемой соли; и c) загрузку отдельной части, полученной на стадии a), и отдельной части, полученной на стадии b), в составе, где указанные отдельные части являются физически отделенными друг от друга.
В одном варианте осуществления изобретения стадия b) дополнительно содержит стадию гранулирования, и на стадии c) отдельную часть, полученную на стадии a), и гранулы, полученные на стадии b), таблетировали для получения двухслойной таблетки.
В настоящем изобретении сердечно-сосудистое заболевание выбирают из группы, состоящей из стенокардии, гипертензии, артериоспазма, сердечной аритмии, кардиомегалии, инфаркта головного мозга, застойной сердечной недостаточности и инфаркта миокарда, но не ограничиваясь ими.
Далее настоящее изобретение описано точнее следующими примерами. Однако такие примеры предоставлены только с целью иллюстрации и настоящее изобретение ими не ограничено.
Примеры 1-3: Получение комбинированной двухслойной таблетки путем использования гранулирования прессованием
В соответствии с ингредиентами, как описано в таблице 1 ниже, амлодипина камзилат, розувастатин кальция, гидрат лактозы, микрокристаллическую целлюлозу и кросповидон смешивали, просеивали через сито с размером ячеек 30, добавляли стеарат магния и, наконец, смешивали в смесителе для получения отдельной части, содержащей амлодипин и розувастатин.
Между тем, лозартан калия, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и кросповидон смешивали и просеивали через сито с размером ячеек 30. Затем просеянный порошок прессовали с использованием роллерного пресса (WP200, Alexanderwerk) с минимальным усилием прессования 20 кН со скоростью роллера 2 до 10 об/мин для получения гранул в форме хлопьев. Полученные таким образом гранулы распыляли с использованием мельницы Fitz (BAS 06, Fitzpatrick, USA), просеивали через сито с размером ячеек 20, добавляли стеарат магния и, наконец, смешивали в смесителе для получения отдельной части, содержащей лозартан.
Впоследствии отдельные части рецептировали в комбинированную двухслойную таблетку, включающую отдельную часть, содержащую амлодипин и розувастатин (первый слой, верхний слой), и отдельную часть, содержащую лозартан (второй слой, нижний слой), с использованием таблетировочного пресса (Kilian Synthesis 700, Germany).
[Таблица 1]
|
Сравнительный пример 1: Получение однослойной таблетки с использованием сухого прямого таблетирования
В соответствии с ингредиентами, как описано в таблице 2 ниже, амлодипина камзилат, розувастатин кальция, лозартан калия, гидрат лактозы, микрокристаллическую целлюлозу и кросповидон и гидроксипропилцеллюлозу смешивали, просеивали через сито с размером ячеек 30, добавляли стеарат магния и, наконец, перемешивали в смесителе. Смешанный порошок рецептировали для получения однослойной таблетки.
[Таблица 2]
|
Сравнительный пример 2: Получение двухслойной таблетки с использованием сухого прямого таблетирования
В соответствии с ингредиентами, как описано в таблице 3 ниже, амлодипина камзилат, розувастатин кальция, гидрат лактозы, микрокристаллическую целлюлозу и кросповидон смешивали, просеивали через сито с размером ячеек 30, добавляли стеарат магния и, наконец, смешивали в смесителе для получения отдельной части, содержащей амлодипин и розувастатин.
Между тем, лозартан калия, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и кросповидон смешивали, просеивали через 30 сито, добавляли стеарат магния и, наконец, смешивали в смесителе для получения отдельной части, содержащей лозартан.
Впоследствии отдельные части рецептировали в комбинированную двухслойную таблетку, содержащую отдельную часть, включающую амлодипин и розувастатин (первый слой, верхний слой) и отдельную часть, включающую лозартан (второй слой, нижний слой) с использованием таблетировочного пресса.
[Таблица 3]
|
Сравнительные примеры 3-5: Получение двухслойной таблетки с использованием гранулирования прессованием
Методику примера 1 повторяли, за исключением изменения соотношения лактозы и целлюлозы в соответствии с ингредиентами, как описано в таблице 4 ниже, для получения комбинированной двухслойной таблетки.
[Таблица 4]
|
Сравнительный пример 6: Получение комбинированной двухслойной таблетки, имеющей различную комбинацию активных ингредиентов в отдельной части
Методику примера 1 повторяли, за исключением использования ингредиентов, как описано в таблице 5 ниже, для получения комбинированной двухслойной таблетки, которая включает амлодипин и лозартан в первой отдельной части и розувастатин во второй отдельной части.
[Таблица 5]
|
Сравнительный пример 7: Получение комбинированной двухслойной таблетки, имеющей различные комбинации активных ингредиентов в отдельной части
Методику примера 1 повторяли, за исключением использования ингредиентов, как описано в таблице 6 ниже, для получения комбинированной двухслойной таблетки, которая содержит амлодипин в первой отдельной части и лозартан и розувастатин во второй отдельной части.
[Таблица 6]
|
Примеры 4-6: Получение комбинированной двухслойной таблетки, имеющей различные количества активных ингредиентов
В соответствии с ингредиентами, как описано в таблице 7 ниже, получали комбинированные двухслойные таблетки, которые имеют другие количества активных ингредиентов, чем в примерах 1-3.
[Таблица 7]
|
Сравнительные примеры 8-10: Получение комбинированной двухслойной таблетки, имеющей различные количества активных ингредиентов
В соответствии с ингредиентами, как описано в таблице 8 ниже, комбинированные двухслойные таблетки получали путем повтора методики примера 1.
[Таблица 8]
|
Экспериментальный пример 1: Испытание на растворимость однослойной таблетки и двухслойной таблетки
Таблетки, полученные в примере 1 и сравнительном примере 1, каждую подвергали испытанию на растворимость лекарственного средства в следующих условиях.
- Условия тестирования-
Среда для растворения: искусственный желудочный сок 900 мл (pH 1,2)
Прибор: USP лопастной метод, 50 об/мин
Температура: 37°C
Образцы: среду для растворения брали через 5, 10, 15, 30, 45, 60, 90 и 120 минут после начала теста. Скорость лопастей повышали от 50 об/мин до 150 об/мин и через 30 минут, т.е. 150 минут после начала теста, среду для растворения брали для конечного анализа.
- Аналитические условия-
Колонка: колонка из нержавеющей стали (внутренний диаметр: приблизительно 4,6 мм, длина: 15 см), упакованная с 3 мкм октадецилсилилированного силикагеля для жидкостной хроматографии
Подвижная фаза: 6 мM моногидрата гексансульфоната натрия/0,05% об/об фосфорной кислоты: ацетонитрил (60:40, об/об)
(аккуратно добавляли 6 мM моногидрата гексансульфоната натрия/0,05% об/об фосфорной кислоты: 1,24 г моногидрата 1-гексансульфоната натрия добавляли в 1 л колбу и 0,5 мл фосфорной кислоты. Добавляли дистиллированную воду и тщательно перемешивали)
Детектор: ультрафиолетовый спектрофотометр (поглощение при 254 нм)
Скорость тока: 1,3 мл/мин
Объем инъекции: 10 мкл
Температура колонки: 45°C
- Критерии исследования-
Скорость растворения 80% или более через 30 минут (амлодипин, розувастатин)
Результаты испытания на растворимость показаны на фиг. 2-4. Как показано на фиг. 2 и 3, двухслойная таблетка примера 1, в которой отдельная часть, содержащая амлодипин и розувастатин, и отдельная часть, содержащая лозартан, являются физически отделенными друг от друга, проявляет высокую скорость растворения по сравнению с однослойной таблеткой сравнительного примера 1 полученной путем сухого прямого таблетирования. Также в отличие от однослойной таблетки сравнительного примера 1, двухслойная таблетка примера 1 показала хороший профиль растворения амлодипина и розувастатина, удовлетворяя критериям исследования.
Более того, как показано на фиг. 4, двухслойная таблетка примера 1 показала достоверно высокую скорость растворения лозартана по сравнению с однослойной таблеткой сравнительного примера 1, которая имела скорость растворения 40% или меньше через 60 минут.
Выше представленные результаты показывают, что гелеобразование лозартана замедляет растворение амлодипина или розувастатина, когда лозартан присутствует с амлодипином или розувастатином в одном слое.
Экспериментальный пример 2: Испытание на растворимость двухслойной таблетки с гранулированной прессованием частью лозартана и двухслойной таблетки, полученной посредством сухого непосредственного таблетирования
Двухслойную таблетку примера 1, полученную путем гранулирования прессованием, и двухслойную таблетку сравнительного примера 2, полученную простым смешиванием с последующим сухим непосредственным прессованием, каждую подвергали испытанию на растворимость с использованием тех же условий, как описано в экспериментальном примере 1, для оценки скорости растворения амлодипина, розувастатина и лозартана. Результаты показаны на фиг. 5-7.
Как показано на фиг. 7, двухслойная таблетка примера 1, которую получали с использованием роллерного пресса, и двухслойная таблетка сравнительного примера 2, которую получали без использования роллерного пресса, не показали существенных различий в скорости растворения лозартана.
Однако, как показано на фиг. 5 и 6, двухслойная таблетка сравнительного примера 2, которую получали путем простого смешивания и сухого прямого таблетирования без использования роллерного пресса, проявляла большие отклонения в растворимости и относительно низкую скорость растворения. Также двухслойная таблетка сравнительного примера 2 не удовлетворяла критериям исследования (скорость растворения 80% или более через 30 минут) в отношении амлодипина и розувастатина. Более того, слой лозартана сравнительного примера 2, который получали без проведения процесса гранулирования прессованием, страдал от низкой продуктивности из-за проблем, ассоциированных с покрытием таблетки. С другой стороны, двухслойная таблетка примера 1, полученная с использованием роллерного пресса, показала превосходную скорость растворения амлодипина и розувастатина, и также удовлетворяла критерию исследования.
Вышеуказанные результаты демонстрируют, что процесс роллерного прессования гранул лозартана не только влияет на профили растворения трех активных ингредиентов, но также может влиять на продуктивность процесса таблетирования.
Экспериментальный пример 3: Изменения скорости растворения в зависимости от соотношения добавок в слое амлодипина-розувастатина
Испытание на растворимость проводили с использованием тех же условий, как описано в экспериментальном примере 1, на двухслойных таблетках примеров 1-3 и сравнительных примеров 3-5 для оценки скорости растворения амлодипина, розувастатина и лозартана. Результаты показаны на фиг. 8-10.
Как показано на фиг. 10, двухслойные таблетки примеров 1-3 и сравнительных примеров 3-5 не показали существенных различий в скорости растворения лозартана.
Однако, как показано на фиг. 8 и 9, двухслойные таблетки примеров 1-3 проявляли хорошие профили растворения, которые удовлетворяли критериям исследования, тогда как двухслойные таблетки сравнительных примеров 3-5 не смогли удовлетворить критериям исследования.
Результаты теста предполагают, что предпочтительно в отношении скорости растворения использовать гидрат лактозы и микрокристаллическую целлюлозу в массовых соотношениях 20-40 мас.% и 50-70 мас.% соответственно в слое амлодипина-розувастатина.
Экспериментальный пример 4: Испытание на растворимость сравнительных примеров 6 (таблетки, содержащие слой амлодипина-лозартана и слоя розувастатина) и 7 (таблетки, содержащие слой амлодипина и слой лозартана-розувастатина)
Испытание на растворимость проводили с использованием тех же условий, как описано в экспериментальном примере 1 на двухслойной таблетке примера 1 и двухслойных таблетках сравнительных примеров 6 и 7 для оценки скорости растворения амлодипина, розувастатина и лозартана. Результаты показаны на фиг. 11-13.
Как показано на фиг. 11-13, двухслойная таблетка примера 1, которая содержит слой амлодипина-розувастатина и слой лозартана, проявляла быструю и высокую скорость растворения и показала хороший профиль растворения амлодипина и розувастатина, соответствуя критериям исследования. Наоборот, двухслойная таблетка сравнительного примера 6, имеющая слой амлодипина-лозартана и слой розувастатина, и двухслойная таблетка сравнительного примера 7, имеющая слой амлодипина и слой лозартана-розувастатина, не смогла пройти критерии теста в отношении скорости растворения всех трех ингредиентов.
Вышеуказанные результаты демонстрируют, что предпочтительно получать двухслойную таблетку, содержащую слой амлодипина-розувастатина и слой лозартана, так как ожидается отсрочка растворения из-за гелеобразования лозартана, когда двухслойная таблетка содержит слой амлодипина-лозартана и слой розувастатина или слой амлодипина и слой лозартана-розувастатина. Следовательно, результаты также показывают, что тип разделения указанных трех лекарственных средств является критическим в отношении скорости растворения.
Экспериментальный пример 5: Исследование стабильности в условиях ускоренного хранения
Исследование стабильности проводили для таблеток примеров 1-3 в следующих условиях для оценки стабильности таблеток путем анализа изменений содержания амлодипина, розувастатина и лозартана. Результаты показаны в таблице 9.
-Условия теста ускоренного хранения-
Условия хранения: хранили в бутыли HDPE при 40°C, 75% ОВ
Время исследования: исходно, через 1, 2, 4 и 6 месяцев
Цель анализа: амлодипин, розувастатин и лозартан
- Аналитические условия-
Колонка: колонка из нержавеющей стали (внутренний диаметр: приблизительно 4,6 мм, длина: 15 см), упакованная с 3 мкм октадецилсилилированного силикагеля для жидкостной хроматографии
Подвижная фаза: 6 мM моногидрата гексансульфоната натрия/0,05%(об/об) фосфорная кислота:ацетонитрил (6:4, об/об)
Детектор: ультрафиолетовый спектрофотометр (поглощение при 254 нм)
Скорость тока: 1,3 мл/мин
Объем инъекции: 10 мкл
Температура колонки: 45°C
[Таблица 9]
|
Как показано в таблице 9 выше, двухслойные таблетки примеров 1-3 проявляли недостоверные изменения содержимого амлодипина, розувастатина и лозартана при 6 месяцах ускоренного хранения, таким образом, показывая исключительно хорошую стабильность при хранении.
Экспериментальный пример 6: Исследование стабильности в условиях ускоренного светового и температурного режима
Исследование стабильности проводили для таблеток, полученных в примерах 1-3 и сравнительных примерах 1-7 в следующих условиях для анализа изменений в скорости продукции родственных соединений амлодипина, розувастатина и лозартана в условиях ускоренного светового и температурного режима. Результаты показаны в таблице 10.
- Условия ускоренного хранения (световая стабильность)-
(1) Прибор: Xe-3-HC (Q-Lab)
(2) Температура и влажность: 25°C±2°C/60%±5% ОВ
(3) Свет: 0,80 Вт/м2/нм, 18,44 часов
(1200000 люкс, метод в соответствии с руководством ICH)
(4) Образец: хранение в чашке Петри
(5) Время исследования: исходно и после воздействия
- Условия ускоренного хранения (температурная стабильность)-
(1) Температура и влажность: 50°C±2°C
(2) Образец: хранение в бутыли HDPE
(3) Время исследования: исходно и через 28 дней
- Аналитические условия-
Колонка: колонка из нержавеющей стали (внутренний диаметр: приблизительно 4,6 мм, длина: 25 см), упакованная с 5 мкм октадецилсилилированного силикагеля для жидкостной хроматографии
Подвижная фаза: 6 мM моногидрата гексансульфоната натрия/0,05%(об/об) фосфорная кислота: ацетонитрил (6:4, об/об)
Детектор: ультрафиолетовый спектрофотометр (поглощение при 254 нм)
Скорость тока: 1,0 мл/мин
Объем инъекции: 10 мкл
Температура колонки: 45°C
[Таблица 10]
|
Как показано в таблице 10 выше, таблетки примеров 1-3 проявляли высокую стабильность в условиях ускоренного светового и температурного режима, при этом давая очень небольшое количество родственных соединений амлодипина, розувастатина и лозартана. С другой стороны, таблетки, полученные в сравнительном примере 1, которые получали путем простого смешивания трех ингредиентов с последующим прямым прессованием, давали родственные соединения в по меньшей мере 5-10 раз больше, чем таблетки, полученные в примерах 1-3. Полученный результат показывает, что таблетки, полученные прямым прессованием, имеют плохую стабильность в условиях ускоренного светового и температурного режима.
Дополнительно, таблетки, полученные в сравнительных примерах 6 и 7, давали родственные соединения, как сравнительный пример 1. Результаты теста сравнительного примера 6 показали, что двухслойные таблетки, имеющие слой амлодипина-лозартана и слой розувастатина, проявляли плохую стабильность в условиях ускоренного светового и температурного режима. Сходным образом, результаты теста сравнительного примера 7 показывают, что двухслойная таблетка, имеющая слой амлодипина и слой лозартана розувастатина, также проявляет плохую стабильность в условиях ускоренного светового и температурного режима.
Полученный результат показывает, что двухслойная таблетка, имеющая слой амлодипина-розувастатина и слой лозартана, примеров 1-3 имеет достоверно улучшенную стабильность.
Экспериментальный пример 7: Исследование стабильности двухслойных таблеток, имеющих различные количества активного ингредиента
Исследование стабильности проводили для таблеток, полученных в примерах 4-6 и сравнительных примерах 8-10, которые имели различные количества активных ингредиентов, для оценки скорости растворения амлодипина, розувастатина и лозартана. Результаты показаны на фиг. 14-16.
Как показано на фиг. 14-16, таблетки примеров 4-6, которые содержали 50 мг лозартана и 10 мг розувастатина, проявляли сходные профили растворения, как таковые примеров 1-3 и удовлетворяли критериям теста.
С другой стороны таблетки сравнительных примеров 8-10 не смогли пройти критерии теста в отношении скорости растворения амлодипина и розувастатина.
Полученный результат показывает, что таблетка может поддерживать хорошую скорость растворения, даже если количество активного ингредиента изменяется, пока слой амлодипина-розувастатина содержит гидрат лактозы в количестве 20-40 мас.%, и микрокристаллическую целлюлозу в количестве 50-70 мас.%.