Результат интеллектуальной деятельности: КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ЭЗЕТИМИБ И РОЗУВАСТАТИН
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к комбинированной композиции для перорального введения, имеющей улучшенную стабильность и скорости растворения активных ингредиентов, содержащей эзетимиб и розувастатин или его фармацевтически приемлемую соль, и к способу получения комбинированной композиции.
Предшествующий уровень техники
Розувастатин и его фармацевтически приемлемые соли представляют собой один из ингибиторов HMG-CoA-редуктазы, который подавляет синтез холестерина для лечения дислипидемии. Таблетки Крестор (то есть кальциевые соли розувастатина, имеющиеся в наличии от AstraZeneca), содержащие розувастатин в качестве главного ингредиента, широко использовались как внутри страны, так и во всем мире для лечения дислипидемии и связанных с дислипидемией расстройств. В частности, в исследовании сообщается, что розувастатин обладает превосходным влиянием на снижение уровней холестерина ЛПНП в крови и на повышение уровней полезного холестерина ЛПВП в организме по сравнению с эффектами аторвастатина или симвастатина, который имеется в продаже в виде лекарственного средства, использующего одни и те же механизмы с розувастатином. Таким образом, имеет место растущий интерес к композиции розувастатина.
Ингибиторы HMG-CoA-редуктазы обычно применяют в комбинации с терапевтическим агентом для лечения дислипидемии, где терапевтический агент использует механизм, отличный от механизма ингибиторов HMG-CoA-редуктазы, чтобы ингибиторы HMG-CoA-редуктазы могли повышать терапевтические эффекты. Среди таких комбинаций, вследствие хорошего лекарственного взаимодействия между ингибитором HMG-CoA-редуктазы и эзетимибом, который представляет собой лекарственное средство, подавляющее повторную абсорбцию холестерина в тонком кишечнике, активно изучается комбинированная композиция, состоящая из этих двух ингредиентов. Например, препарат Vytorin™, который представляет собой комбинированную композицию, состоящую из симвастатина и эзетимиба, уже продемонстрировал превосходные фармакологические эффекты и их стабильность и в настоящее время имеется в продаже с превосходной характеристикой реализации.
Известно, что розувастатин или его фармацевтически приемлемая соль обычно являются нестабильными в сильнокислой среде, и таким образом, часто разрабатывается в виде фармацевтической композиции, которая включает основный стабилизатор. Однако в случае эзетимиба, который нестабилен в сильноосновной среде, образуется много родственных эзетимибу соединений. Кроме того, в среде с определенным основным рН родственные соединения из-за взаимодействия между эзетимибом и розувастатином нарастают так значительно, что комбинированная композиция розувастатина и эзетимиба не может быть запущена в серийное производство. Таким образом, в связи с тем, что розувастатин и эзетимиб имеют рН стабильных состояний, отличающиеся друг от друга, нелегко обеспечить стабильность активных ингредиентов, то есть розувастатина и эзетимиба, при получении комбинированной композиции розувастатина и эзетимиба.
Кроме того, с целью получения эффективной комбинированной композиции необходимо обеспечивать высокую биодоступность активных ингредиентов. Диаграмма растворения активных ингредиентов твердой композиции для перорального введения тесно связана с биодоступностью композиции, где высокая скорость растворения базируется на высокой биодоступности. В общем, чем меньше размер частиц активного ингредиента, тем выше скорости его растворения. Меньшие размеры частиц активных ингредиентов увеличивают площади поверхности. Однако, скорее всего на их стабильность оказывает воздействие окружающей среды (ссылка на WO 2010/056039). Поэтому, если активные ингредиенты комбинированной композиции имеют рН стабильных состояний, отличающиеся друг от друга, как в случае комбинированной композиции розувастатина и эзетимиба, уменьшение размера частиц может вызывать нарастание образования родственных соединений в комбинированной композиции. Таким образом, трудно рассчитывать на высокие скорости растворения только посредством уменьшения размера частиц активных ингредиентов.
Описание изобретения
Техническая задача
В настоящем изобретении предложена твердая комбинированная композиция для перорального введения, имеющая улучшенные стабильность и скорости растворения активных ингредиентов, содержащая эзетимиб и розувастатин или его фармацевтически приемлемую соль.
В настоящем изобретении предложен способ приготовления твердой комбинированной композиции для перорального введения.
Техническое решение
Согласно одному аспекту настоящего изобретения предложена твердая комбинированная композиция для перорального введения, содержащая:
часть на основе гранул эзетимиба, включающая эзетимиб, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
часть на основе смеси розувастатина, включающая розувастатин или его фармацевтически приемлемую соль.
Согласно другому аспекту настоящего изобретения предложена твердая комбинированная композиция для перорального введения, содержащая:
часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, включающая эзетимиб, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
часть на основе смеси розувастатина, включающую розувастатин или его фармацевтически приемлемую соль,
где часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, или часть на основе смеси розувастатина включает, исходя из 1 массовой части гранул эзетимиба, разбавитель в количестве от примерно 0,5 до примерно 50 массовых частей, связующее вещество в количестве от примерно 0,1 до примерно 20 массовых частей, разрыхлитель в количестве от примерно 0,1 до примерно 40 массовых частей, скользящее вещество в количестве от примерно 0,1 до примерно 3 массовых частей или любые их комбинации.
Согласно другому аспекту настоящего изобретения предложен способ приготовления твердой комбинированной композиции для перорального введения, где способ включает:
приготовление части на основе гранул эзетимиба, содержащей эзетимиб, где указанный эзетимиб имеет распределение частиц по размера, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
приготовление части на основе гранул эзетимиб и части на основе смеси розувастатина, включающей розувастатин или его фармацевтически приемлемую соль, в виде композиции.
Полезные эффекты изобретения
Комбинированная композиция для перорального введения по настоящему изобретению может включать активные ингредиенты, то есть эзетимиб и розувастатин или его фармацевтически приемлемую соль, где каждый из активных ингредиентов является стабильным и имеет высокую скорость растворения, имеющую результатом высокую биодоступность. Поэтому комбинированная композиция для перорального введения по настоящему изобретению может улучшать соблюдение больным режима и схемы лечения и, в конечном счете, может способствовать эффективному лечению дислипидемии.
Описание графических материалов
ФИГ. 1 представляет собой график, показывающий количества эзетимиба и основных продуктов его разложения, где количества анализируют после выполнения теста на форсированное разложение эзетимиба;
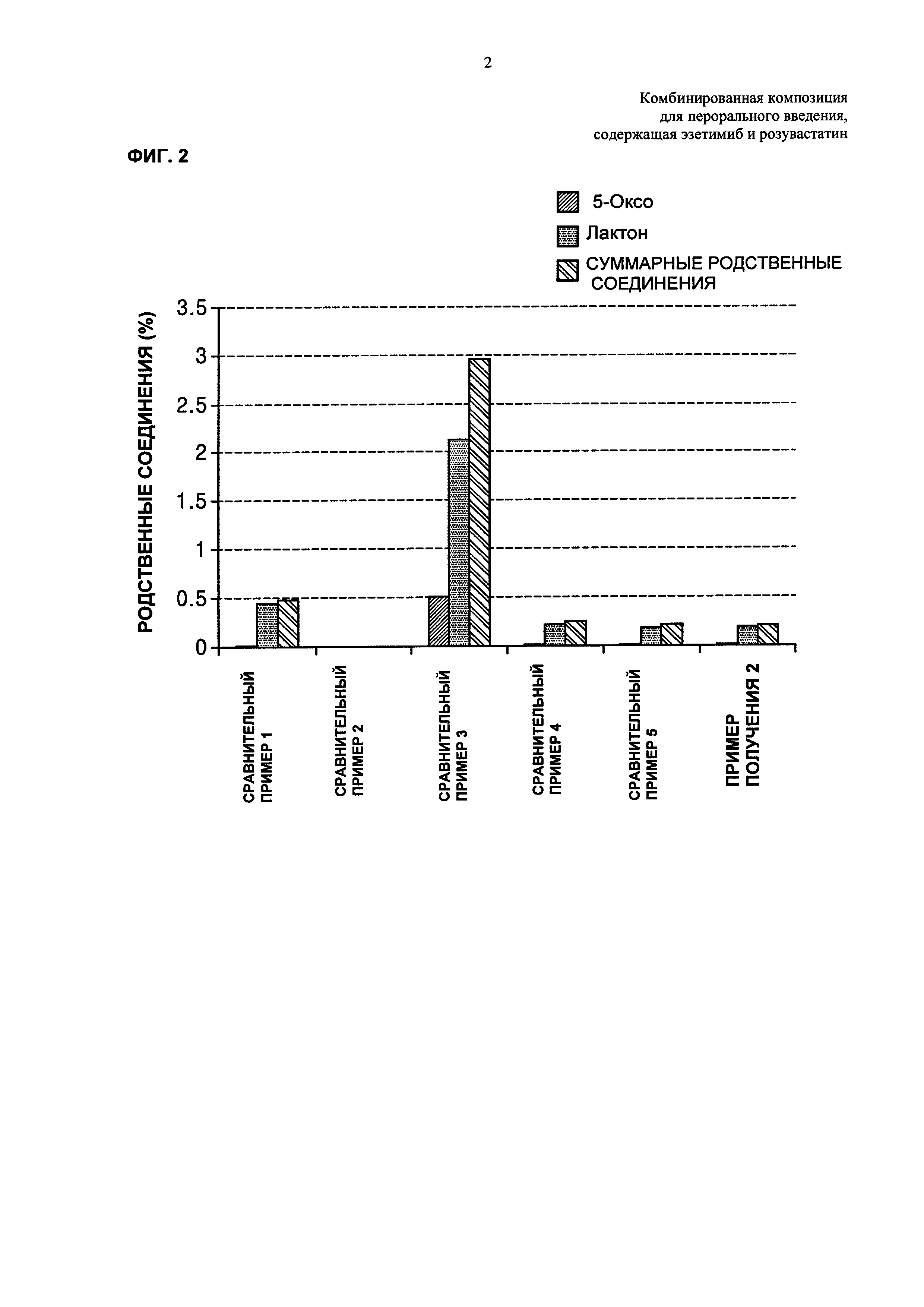
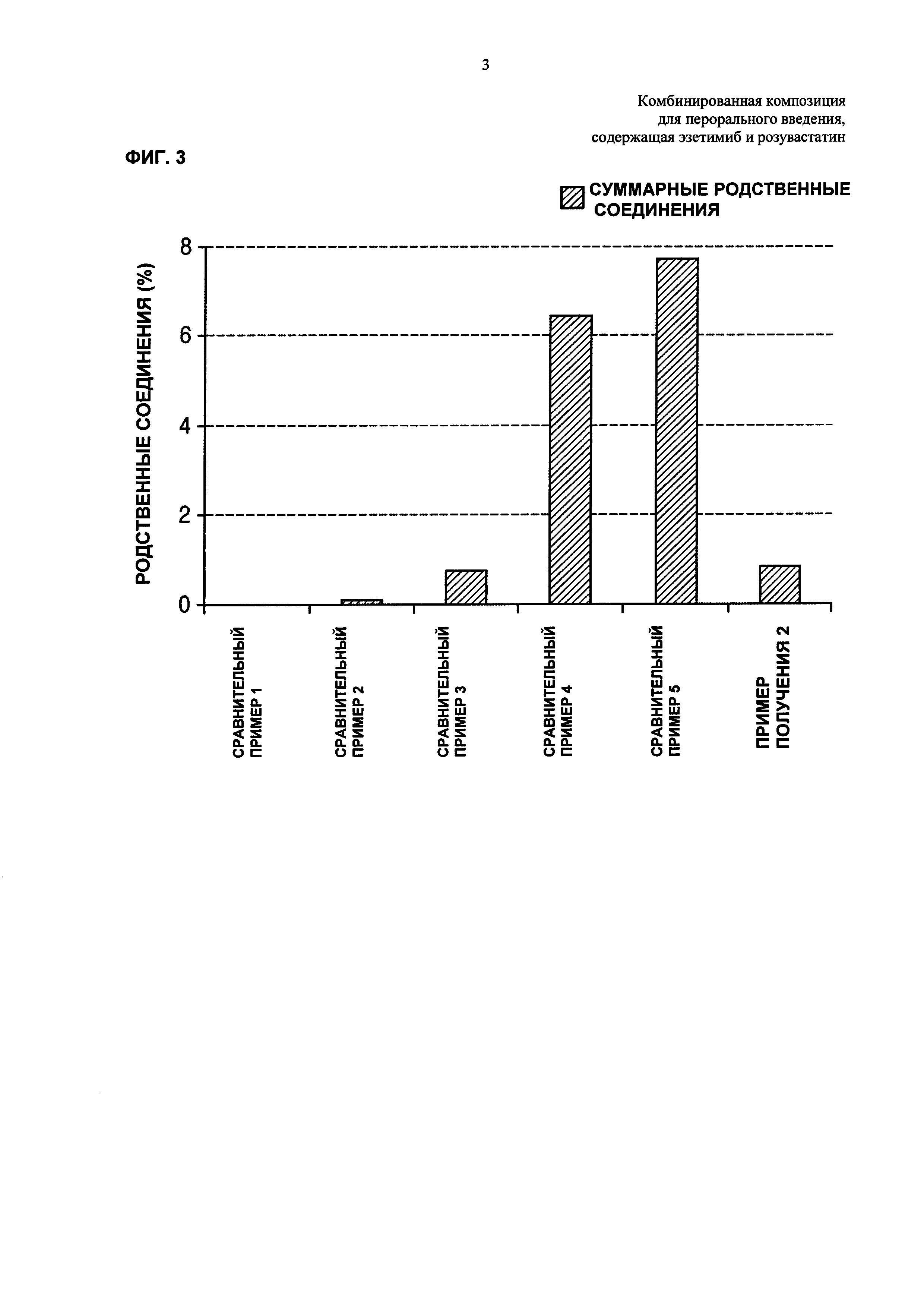
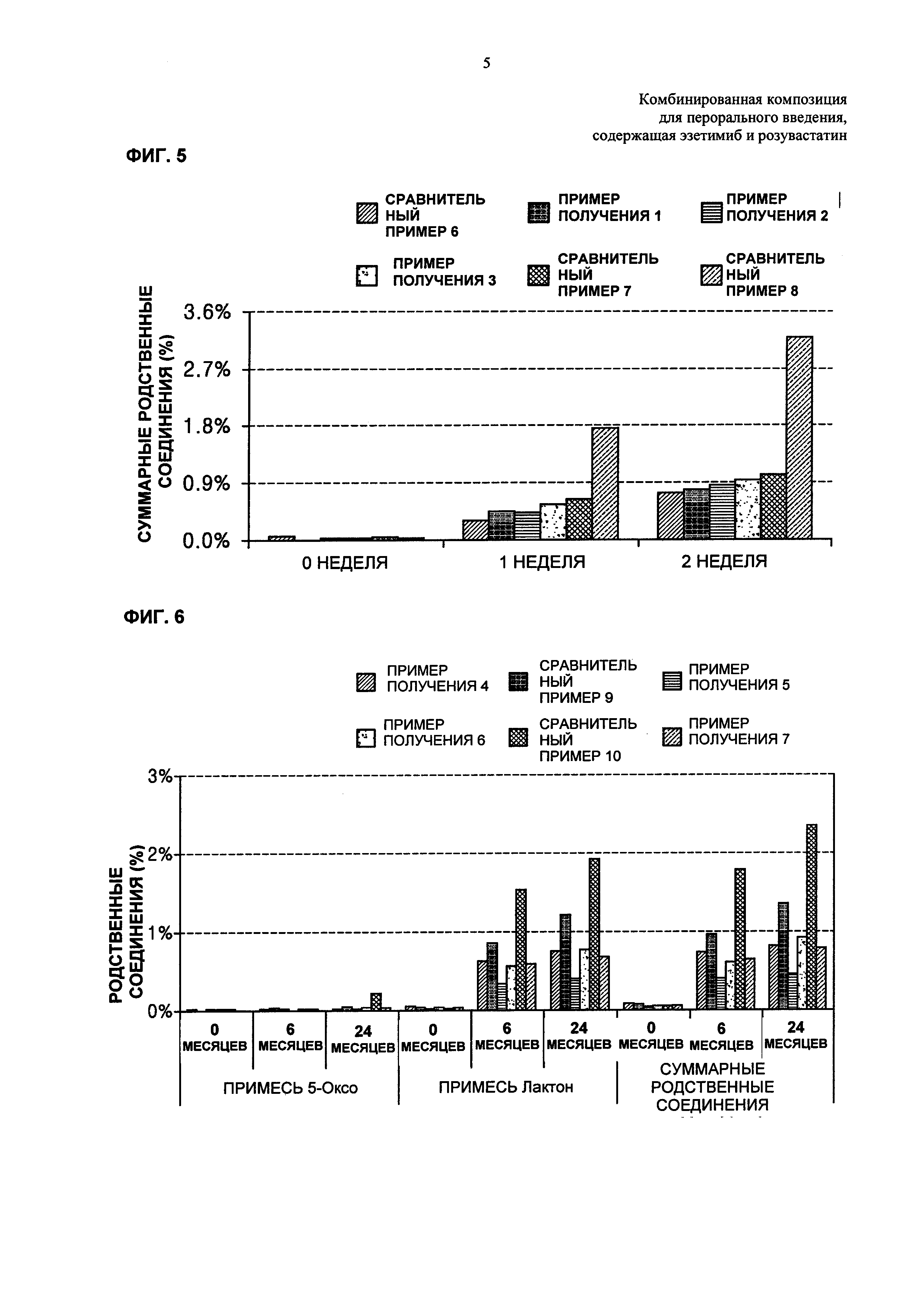
ФИГ. 2 и 3 каждая представляет собой график, показывающий количества родственных розувастатину соединений и всех родственных эзетимибу соединений, где количества измеряют после хранения дисков Сравнительных примеров 1-5 и Примера получения 2 в жестких условиях;
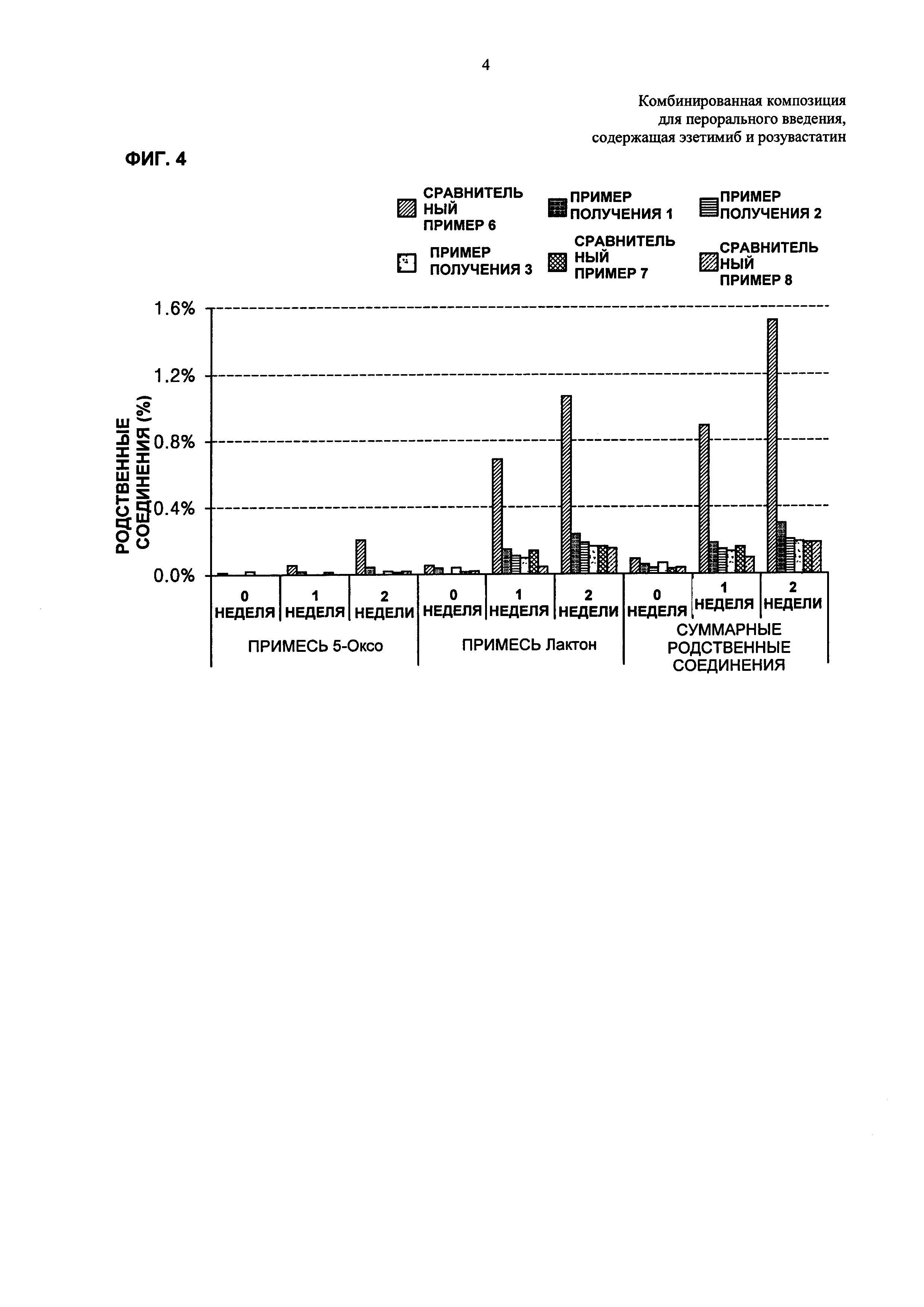
ФИГ. 4 и 5 каждая представляет собой график, показывающий количества родственных розувастатину соединений и всех родственных эзетимибу соединений в зависимости от количеств гидрокарбоната в дисках Примеров получения 1-3 и Сравнительных примеров 6-8;
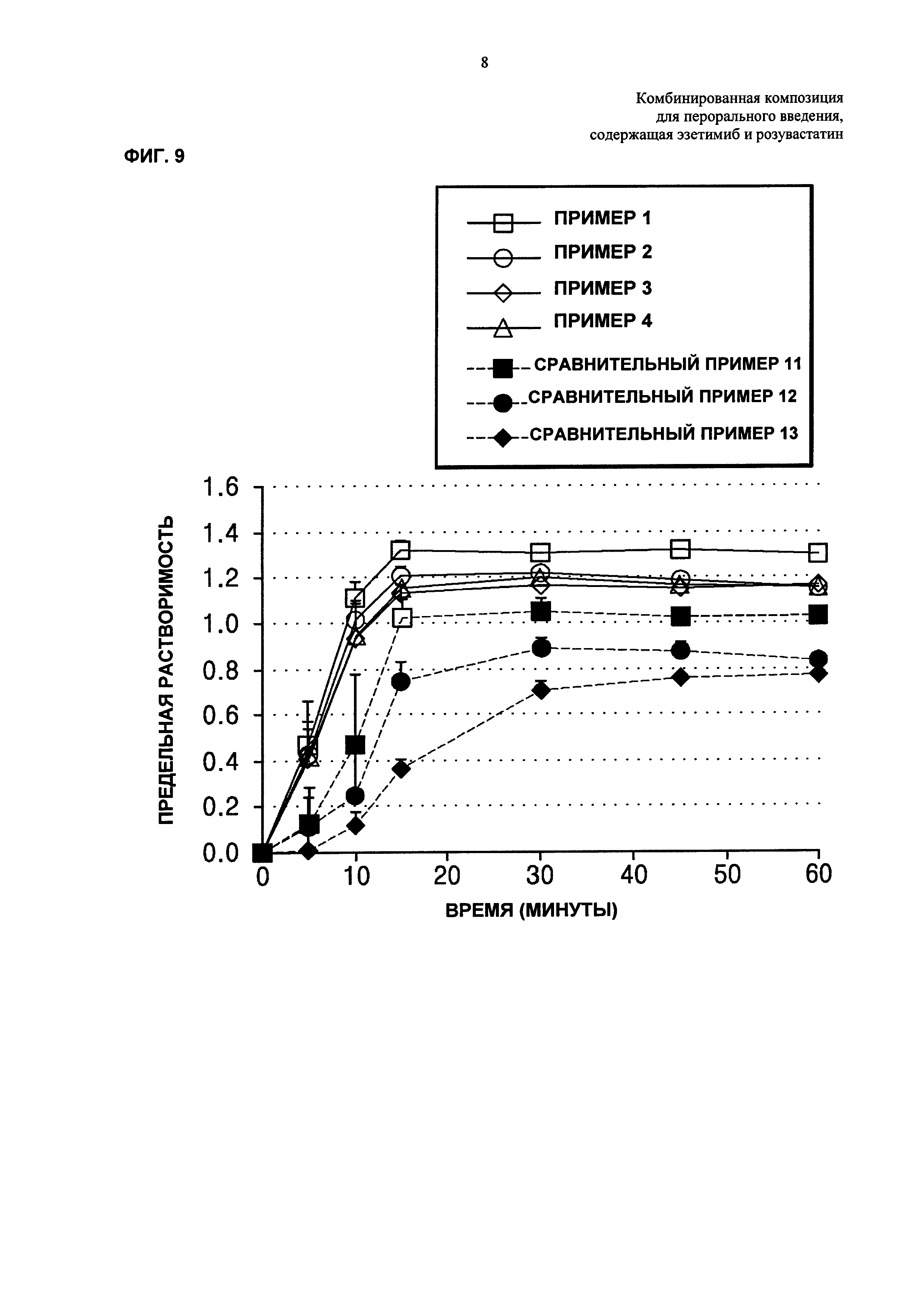
ФИГ. 6 и 7 каждая представляет собой график, показывающий количества родственных розувастатину соединений и всех родственных эзетимибу соединений, где количества измеряют после хранения комбинированных композиций Примеров получения 4-7 и Сравнительных примеров 9 и 10 в течение длительного периода;
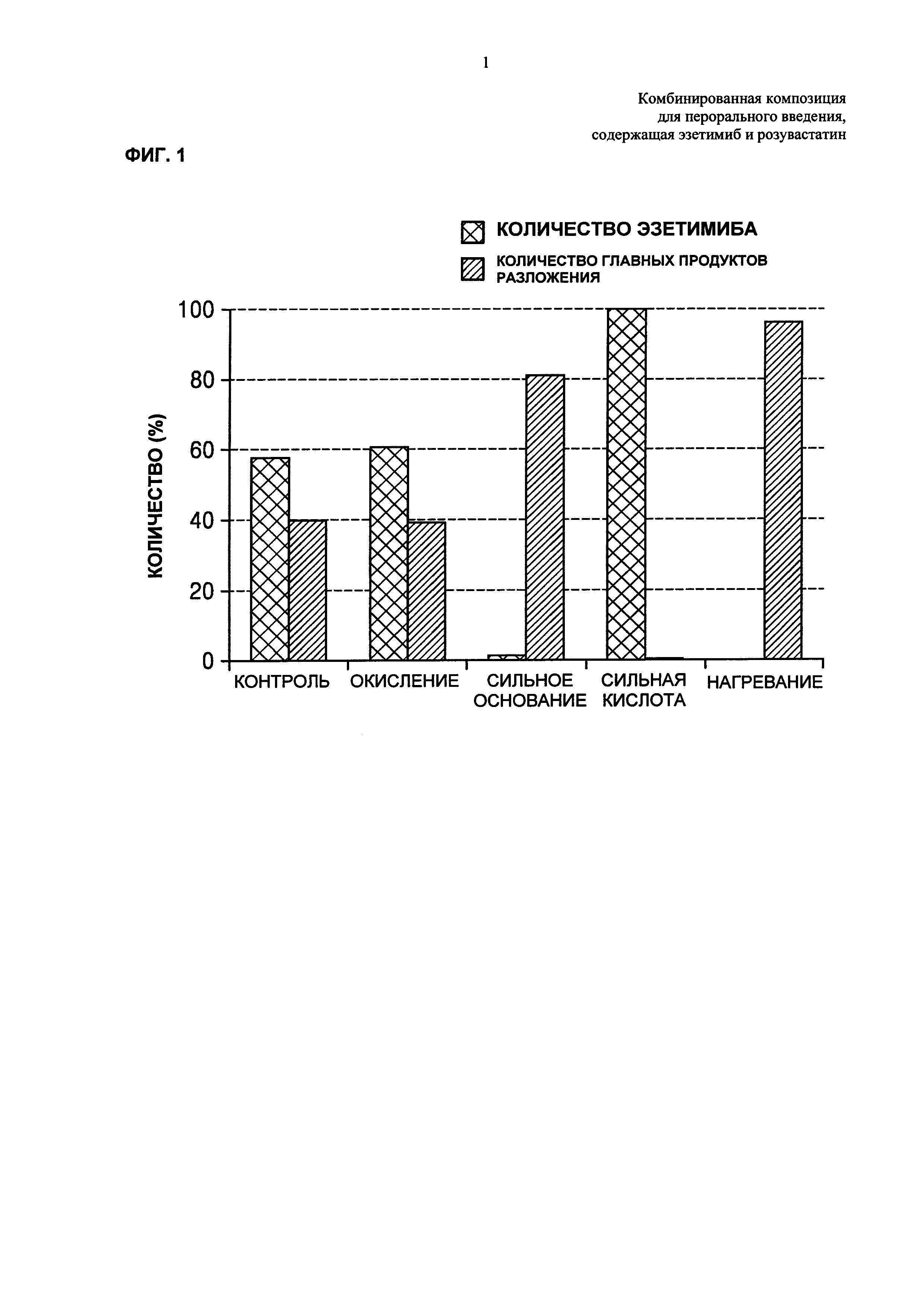
ФИГ. 8 представляет собой график, показывающий результаты теста на растворение в зависимости от размера частиц эзетимиба, где результаты получают посредстом растворения таблеток Примеров 1-4 и Сравнительных примеров 11-13 в буферном растворе с рН 4,5, содержащем 0,45% натрия лаурилсульфат, при скорости вращения лопастной мешалки примерно 50 об/мин, посредством использования способа растворения II в корейской фармакопее;
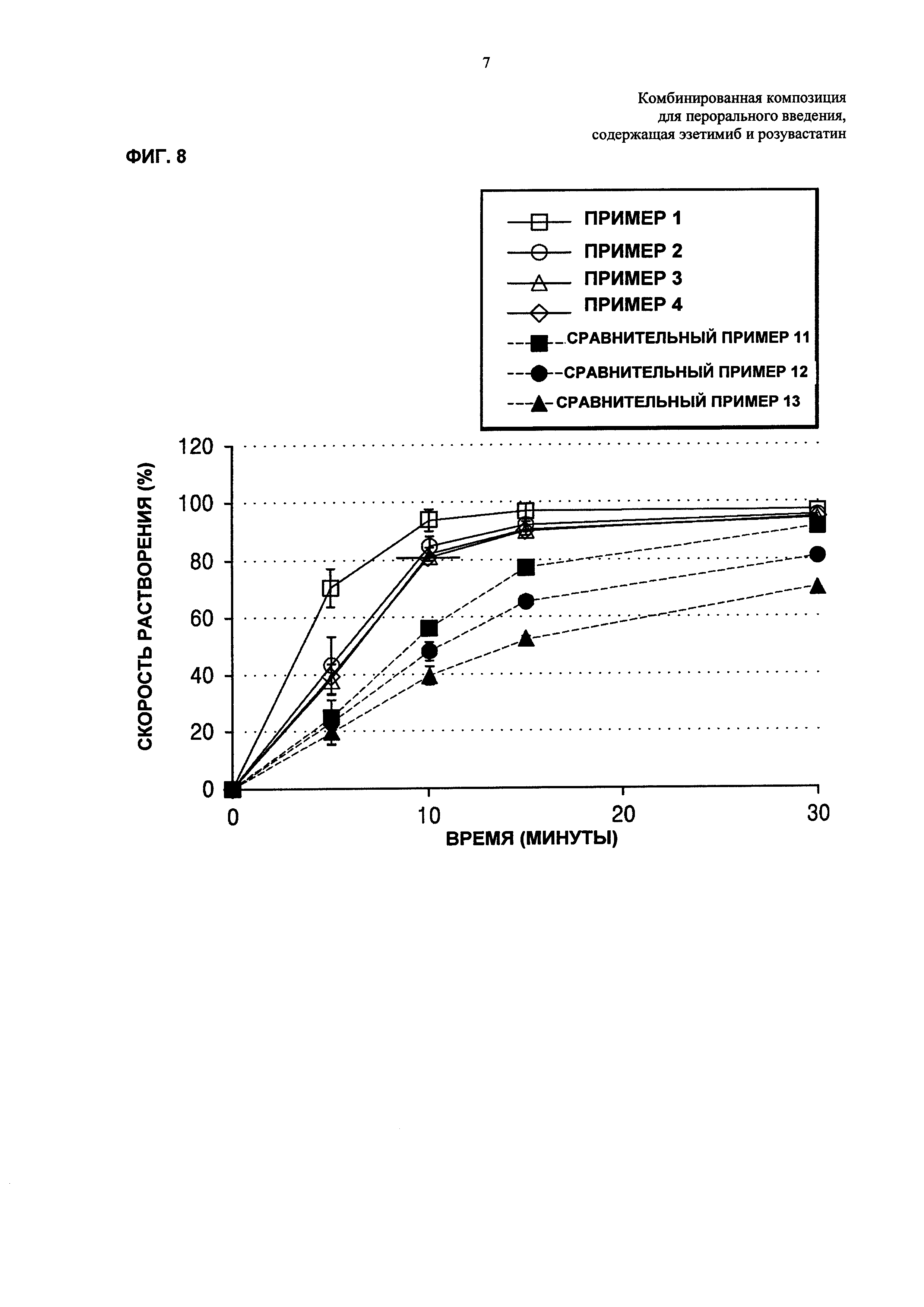
ФИГ. 9 представляет собой график, показывающий результаты теста на растворение в зависимости от размера частиц эзетимиба, где результаты получают посредством растворения таблеток Примеров 1-4 и Сравнительных примеров 11-13 в буферном растворе с рН 4,0, содержащем ацетат натрия, при скорости вращения лопастной мешалки примерно 50 об/мин, посредством использования способа растворения II в корейской фармакопее; и
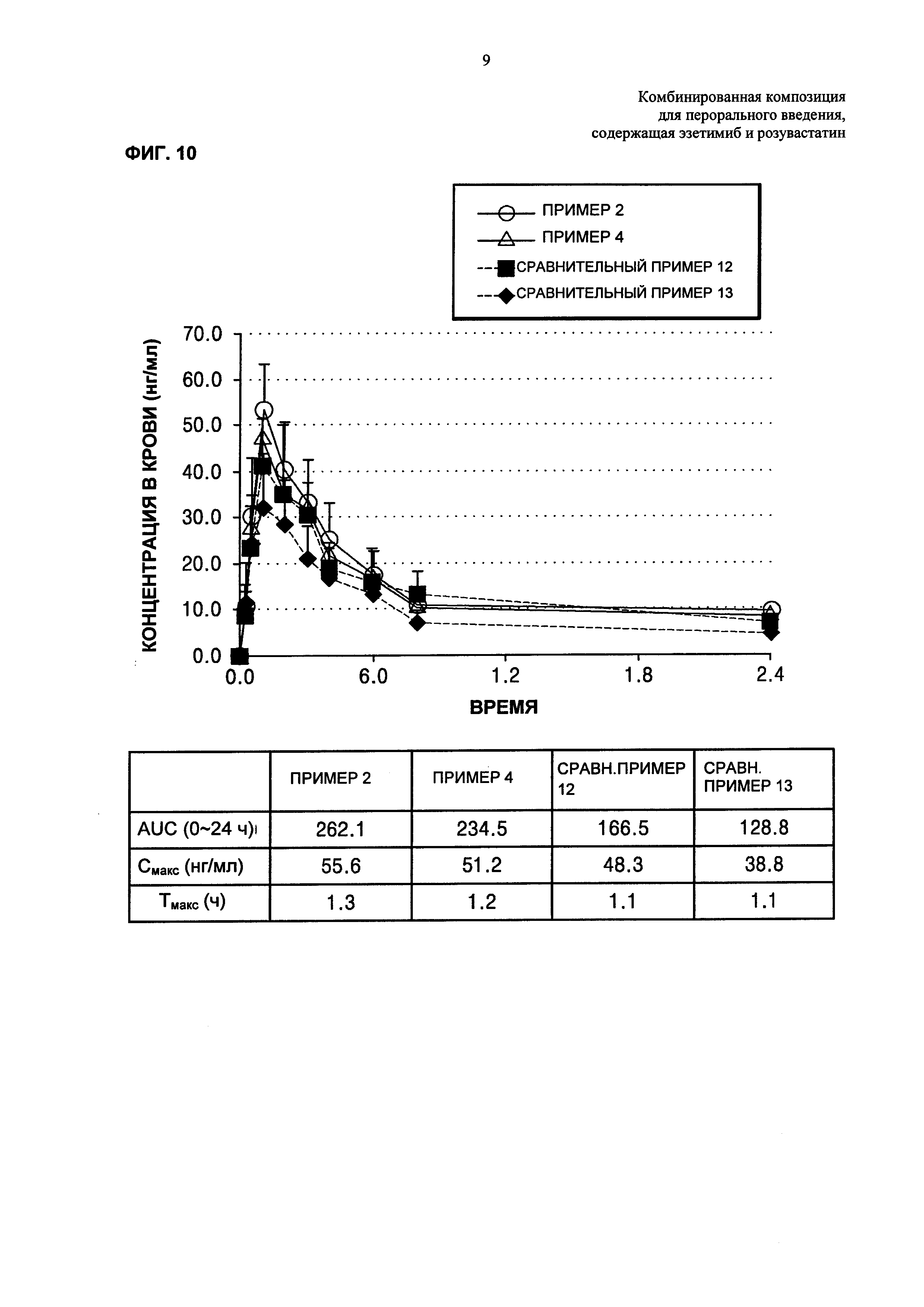
ФИГ. 10 представляет собой график, показывающий результаты биодоступности таблеток Примеров 2 и 4 и Сравнительных примеров 12-13, которые оценивают применительно к мужчинам в зависимости от размера частиц эзетимиба.
Осуществление изобретения
Если не определено иным образом, все термины (включая технические и научные термины), используемые в данном описании изобретения, имеют то же значение, которое обычно понимает специалист в данной области техники, к которой принадлежит данное изобретение. Хотя в данном описании изобретения перечислены типичные способы или вещества, другие похожие или эквивалентные способы или вещества также входят в объем настоящего изобретения. Все публикации, раскрытые в виде ссылок, включены в данное описание изобретения во всей их полноте посредством ссылки.
Эзетимиб и розувастатин в качестве фармакологически активных ингредиентов комбинированной композиции по настоящему изобретению могут иметь проблемы со стабильностью из-за увеличения образования родственных соединений эзетимиба и розувастатина при изготовлении комбинированной композиции эзетимиба и розувастатина, имеющих рН стабильных состояний, отличающиеся друг от друга. В случае розувастатина образование родственных соединений, таких как (3R,6Е)-7-[4-(4-фторфенил)-2-(N-метилметансульфонамидо)-6-(пропан-2-ил)пиримидин-5-ил]-3-гидрокси-5-оксо-гепт-6-еноат кальция (в дальнейшем называемый «5-оксо-родственное соединение»), и M-[4-(4-фторфенил)-6-(1-метилэтил)-5-[(1Е)-2-[(2S,4R)тетрагидро-4-гидрокси-6-оксо-2Н-пиран-2-ил]этенил]-2-пиримидинил]-N-метилметансульфонамид (в дальнейшем называемый «родственное лактону соединение»), которые являются основными метаболитами розувастатина, может быть повышенным. Авторы настоящего изобретения с целью изготовления твердой комбинированной композиции для перорального введения, содержащей эзетимиб и розувастатин, включали эзетимиб в виде отдельной части на основе гранул и розувастатин или его фармацевтически приемлемую соль в виде части на основе смеси розувастатина и доводили эзетимиб до получения распределения частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше, тем самым улучшая скорости растворения и обеспечивая стабильность комбинированной композиции.
Таким образом, в одном аспекте настоящего изобретения предложена твердая комбинированная композиция для перорального введения, содержащая:
часть на основе гранул эзетимиба, включающую эзетимиб, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
часть на основе смеси розувастатина, включающую розувастатин или его фармацевтически приемлемую соль.
При использовании в данном описании изобретения термин «средний размер частиц d(0,9) для нижнего предела 90%» относится к среднему размеру частиц, соответствующих 90% суммарного количества частиц, отсчитанным от наименьших частиц посредством применения устройства для измерения размера частиц, и в дальнейшем термин называется коротко «размер частиц d(0,9)».
Эзетимиб, включенный в качестве первого фармакологически активного ингредиента, может иметь размер частиц d(0,9) примерно 10 мкм или меньше, конкретно, примерно 7,5 мкм или меньше. В некоторых воплощениях размер частиц d(0,9) эзетимиба может находиться в диапазоне от примерно 0,8 мкм до примерно 10 мкм. При этом, трудно получать эзетимиб, имеющий размер частиц d(0,9) менее 0,8 мкм.
Обнаружено, что когда размер частиц d(0,9) эзетимиба больше 10 мкм, скорости растворения эзетимиба значительно понижаются. В предшествующем уровне техники, когда размер частиц активных ингредиентов комбинированной композиции эзетимиба и розувастатина уменьшают из-за разных рН стабильных состояний активных ингредиентов, взаимодействие активных ингредиентов в окружающей среде увеличивается, и таким образом, проблема в отношении стабильности активных ингредиентов в комбинированной композиции снижается. В настоящем изобретении скорость растворения эзетимиба, как обнаружено, значительно увеличивается в случае, когда размер частиц d(0,9) активного ингредиента, то есть эзетимиба, уменьшают до 10 мкм или меньше по сравнению со случаем, когда размер частиц d(0,9) эзетимиба больше примерно 10 мкм (ссылка на Экспериментальные Примеры 5 и 6). Кроме того, в результате действительного введения комбинированной композиции по настоящему изобретению взрослым биодоступность активного ингредиента, то есть эзетимиба, как обнаружено, значительно повышается в случае, когда размер частиц d(0,9) эзетимиба равен примерно 10 мкм или меньше по сравнению со случаем, когда размер частиц d(0,9) эзетимиба больше примерно 10 мкм (ссылка на Экспериментальный Пример 8). В соответствии с результатами, что значительно повышается скорость растворения эзетимиба, а не родственных эзетимибу соединений, обнаружили, что скорость растворения эзетимиба может быть увеличена без опасения снижения стабильности, которое может быть вызвано посредством уменьшения размера частиц. Таким образом, твердая комбинированная композиция для перорального введения по настоящему изобретению может иметь непредвиденные эффекты в плане решения проблемы ожидаемой пониженной стабильности, вызванной посредством уменьшения размера частиц активных ингредиентов, вследствие того, что они имеют рН стабильных состояний, отличающиеся друг от друга.
Кроме того, обнаружено, что повышение стабильности и скорости растворения активных ингредиентов приводит к повышению биодоступности активных ингредиентов после действительного введения комбинированной композиции по настоящему изобретению человеку, тем самым получая практически эффективную комбинированную композицию.
Комбинированная композиция по настоящему изобретению может включать от примерно 5 мг до примерно 20 мг эзетимиба в стандартной лекарственной форме и в некоторых воплощениях от примерно 5 мг до примерно 10 мг в стандартной лекарственной форме.
Комбинированная композиция по настоящему изобретению может включать часть на основе гранул эзетимиба в форме гранул, полученных посредством влажного гранулирования. Согласно одному экспериментальному примеру показано, что комбинированная композиция, включающая эзетимиб в форме гранул, полученных посредством влажного гранулирования, имеет низкое образование родственных эзетимибу соединений и превосходные характеристики таблетирования по сравнению с комбинированной композицией, включающей эзетимиб в форме гранул, полученных без влажного гранулирования (ссылка на Экспериментальный Пример 4).
При использовании в данном описании изобретения термин «часть на основе гранул, полученных посредством влажного гранулирования» относится к смешанным гранулам, полученным во влажном состоянии, и термин «часть на основе смеси» относится к смеси ингредиентов в негранулированной форме.
Комбинированная композиция по настоящему изобретению включает розувастатин или его фармацевтически приемлемую соль в качестве второго фармакологически активного ингредиента.
Розувастатин может находиться в форме свободного основания или в форме его фармацевтически приемлемой соли. Примеры фармацевтически приемлемой соли включают соль кальция, соль магния и соль стронция, и в одном воплощении кальциевую соль розувастатина, но фармацевтически приемлемая соль не ограничена этими.
Розувастатин или его фармацевтически приемлемая соль может подавлять HMG-CoA-редуктазу, которая является существенно необходимой для синтеза холестерина, для того чтобы понижать уровни ЛПНП-холестерина в крови и повышать уровни ЛПВП-холестерина в крови, тем самым способствуя лечению дислипидемии.
Комбинированная композиция по настоящему изобретению может включать розувастатин или его фармацевтически приемлемую соль в количестве от примерно 2,5 мг до примерно 40 мг в стандартной лекарственной форме и, в некоторых воплощениях, от примерно 5 мг до примерно 20 мг в стандартной лекарственной форме.
Комбинированная композиция по настоящему изобретению может дополнительно включать, в дополнение к фармакологически активному ингредиенту, по меньшей мере одну фармацевтически приемлемую добавку. Подробно, комбинированная композиция по настоящему изобретению может включать по меньшей мере одну из фармацевтически приемлемых добавок, выбранных из группы, состоящей из разбавителя, связующего вещества, разрыхлителя и скользящего вещества.
В другом аспекте настоящего изобретения предложена твердая комбинированная композиция для перорального введения, включающая:
часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, включающую эзетимиб, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
часть на основе смеси розувастатина, включающую розувастатин или его фармацевтически приемлемую соль,
где часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, или часть на основе смеси розувастатина включает, исходя из 1 массовой части гранул эзетимиба, разбавитель в количестве от примерно 0,5 до примерно 50 массовых частей, связующее вещество в количестве от примерно 0,1 до примерно 20 массовых частей, разрыхлитель в количестве от примерно 0,1 до примерно 40 массовых частей, скользящее вещество в количестве от примерно 0,1 до примерно 3 массовых частей или любые их комбинации.
Подробное описание выше одного аспекта настоящего изобретения можно применить к этим части на основе гранул, полученных посредством влажного гранулирования, и части на основе смеси розувастатина.
Разбавитель, связующее вещество, разрыхлитель и скользящее вещество могут включать любое вещество, применимое в качестве добавки в данной области техники. В некоторых воплощениях стабильность и скорости растворения активных ингредиентов можно дополнительно улучшать посредством надлежащим образом выбранных специальных добавок (ссылка на Экспериментальный Пример 7).
Например, разбавитель может быть выбран из группы, состоящей из лактозы, крахмала, маннита, микрокристаллической целлюлозы, карбоксиметилцеллюлозы и любых их комбинаций, но без ограничения. Например, связующее вещество может быть выбрано из группы, состоящей из повидона, гипромеллозы, гидроксипропилцеллюлозы, коповидона и любых их комбинаций, но без ограничения. Например, разрыхлитель может быть выбран из группы, состоящей из кросповидона, кроскармеллозы натрия, натрия крахмал гликолята, гидроксипропилцеллюлозы с низкой степенью замещения и любых их комбинаций, но без ограничения. Например, скользящее вещество может быть выбрано из группы, состоящей из стеарата магния, талька, легкой безводной кремниевой кислоты, натрия стеарилфумарата и любых их комбинаций, но без ограничения.
В некоторых воплощениях часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, или часть на основе смеси розувастатина может включать, исходя из 1 массовой части гранул эзетимиба, разбавитель в количестве от примерно 0,5 до примерно 50 массовых частей, связующее вещество в количестве от примерно 0,1 до примерно 20 массовых частей, разрыхлитель в количестве от примерно 0,1 до примерно 40 массовых частей и скользящее вещество в количестве от примерно 0,1 до примерно 3 массовых частей.
В некоторых воплощениях часть на основе смеси розувастатина может дополнительно включать слабоосновный стабилизатор.
При использовании в данном описании изобретения термин "слабоосновный стабилизатор" относится к любому веществу, приемлемому в качестве подщелачивающего агента, величина pKb которого находится в диапазоне от примерно 9 до примерно 11, и слабоосновный стабилизатор можно выбирать из группы, состоящей из гидрокарбоната натрия, гидрокарбоната калия, гидрокарбоната кальция, гидрокарбоната магния, гидрокарбоната аммония и любых их комбинаций, но без ограничения этими. Например, основный стабилизатор может представлять собой натрия гидрокарбонат.
Слабоосновный стабилизатор понижает количественные соотношения основных метаболитов розувастатина, то есть 5-оксо-родственного соединения и родственного лактону соединения, так что стабильность розувастатина или его фармацевтически приемлемой соли может быть улучшена. В то же время, также может быть обеспечена стабильность эзетимиба, который нестабилен в основной среде.
Количество гидрокарбоната натрия, используемого здесь, может находиться в диапазоне от примерно 0,05 до примерно 0,5 массовых частей, исходя из 1 массовой части розувастатина. Неожиданно обнаружили, что, если количество гидрокарбоната натрия находится в диапазоне от примерно 0,05 до примерно 0,5 массовых частей, исходя из 1 массовой части розувастатина, то количество родственных соединений розувастатина или его фармацевтически приемлемой соли, каждое из которых является стабильным в основной среде, и эзетимиба, который является стабильным в кислой или слабоосновной среде, снижается (ссылка на Экспериментальные Примеры 2 и 3).
При использовании в данном описании изобретения термин «твердая комбинированная композиция для перорального введения» относится к композиции, полученной посредством прессования или инкапсулирования лекарственных средств в заранее определенную форму. Твердая комбинированная композиция для перорального введения по настоящему изобретению может быть изготовлена в виде шарика, капсулы, таблетки (включая однослойную таблетку, двухслойную таблетку и прессованную таблетку-ядро (a pressed core tablet), порошков или гранул, но примеры твердой комбинированной композиции не ограничиваются этими. Например, твердая комбинированная композиция для перорального введения может быть в форме капсулы, однослойной таблетка или в форме двухслойной таблетки. Когда комбинированная композиция по настоящему изобретению находится в форме капсулы, капсула может быть изготовлена в форме, содержащей порошки, гранулы, таблетки, сироп или шарики в капсуле.
Согласно одному воплощению, комбинированная композиция по настоящему изобретению может показывать превосходную стабильность на основе родственных розувастатину соединений, таких как (3R,6E)-7-[4-(4-фторфенил)-2-(N-метилметансульфонамидо)-6-(пропан-2-ил)пиримидин-5-ил]-3-гидрокси-5-оксо-гепт-6-еноат кальция или N-[4-(4-фторфенил)-6-(1-метилэтил)-5-[(1Е)-2-[(2S,4R)тетрагидро-4-гидрокси-6-оксо-2Н-пиран-2-ил]этенил]-2-пиримидинил]-N-метилметансульфонамид1 образованных в количестве менее 1,0%, или родственных розувастатину соединений, образованных в суммарном количестве менее примерно 2,0%, например, менее примерно 1,0% во время длительного хранении в течение 24 месяцев в условиях температуры примерно 25°С и относительной влажности примерно 60%. Вследствие этого, комбинированная композиция по настоящему изобретению также может показывать превосходную стабильность на основе родственных эзетимибу соединений, образовавшихся в суммарном количестве менее примерно 1,0% во время длительного хранении в течение 24 месяцев в условиях температуры примерно 25°С и относительной влажности примерно 60% (ссылка на Экспериментальный Пример 4).
Согласно одному воплощению, скорости растворения эзетимиба из комбинированной композиции по настоящему изобретению могут составлять примерно 85% или более в течение 15 минут, согласно способу тестирования растворения с применением способа растворения II в корейской фармакопее со скоростью вращения лопастной мешалки примерно 50 об/мин применительно к буферному раствору рН 4,5, содержащему 0,45% натрия лаурилсульфата. Кроме того, комбинированная композиция по настоящему изобретению, согласно способу тестирования растворения с применением способа растворения II в корейской фармакопее со скоростью вращения лопастной мешалки примерно 50 об/мин применительно к буферному раствору уксусной кислоты рН 4,0, который не содержит натрия лаурилсульфат, показывает в значительной степени превосходящие скорости растворения эзетимиба по сравнению со скоростями растворения эзетимиба других композиций, в которых средний размер частиц d(0,9) частиц эзетимиб для нижнего предела 90% равен примерно 10 мкм или больше (ссылка на Экспериментальные Примеры 5 и 6). Поэтому ожидается, что комбинированная композиция по настоящему изобретению имеет высокую биодоступность на основании повышенных скоростей растворения (ссылка на Экспериментальный Пример 8).
Согласно другому аспекту настоящего изобретения, предложен способ приготовления твердой комбинированной композиции для перорального введения, включающий: приготовление части на основе гранул эзетимиба, содержащей эзетимиб, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d<o.9) для нижнего предела 90% равен примерно 10 мкм или меньше; и
приготовление части на основе гранул эзетимиба и части на основе смеси розувастатина, взятых вместе, в виде композиции, где часть на основе смеси розувастатина включает розувастатин или его фармацевтически приемлемую соль.
Подробное описание выше твердой комбинированной композиции для перорального введения согласно любым аспектам настоящего изобретения можно применить к этому способу получения твердой комбинированной композиции для перорального введения.
В одном воплощении часть на основе гранул эзетимиба можно получать посредством влажного гранулирования согласно способу по настоящему изобретению. Влажное гранулирование специально не ограничено и может представлять собой любое влажное гранулирование, известное в данной области техники.
В одном воплощении часть на основе гранул эзетимиба и часть на основе смеси розувастатина согласно способу по настоящему изобретению каждая может включать, исходя из 1 массовой части эзетимиба, разбавитель в количестве от примерно 0,5 до примерно 50 массовых частей, связующее вещество в количестве от примерно 0,1 до примерно 20 массовых частей, разрыхлитель в количестве от примерно 0,1 до примерно 40 массовых частей, скользящее вещество в количестве от примерно 0,1 до примерно 3 массовых частей или любые их комбинации.
В одном воплощении способ приготовления комбинированной композиции согласно любому из описанных выше воплощений, может включать:
1) приготовление части на основе гранул, полученных посредством влажного гранулирования, содержащей эзетимиб, путем влажного гранулирования, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d((0,9) для нижнего предела 90% равен примерно 10 мкм или меньше;
2) приготовление части на основе смеси розувастатина, включающей розувастатин или его фармацевтически приемлемую соль; и
3) смешивание части на основе гранул, полученных посредством влажного гранулирования, со стадии (1) и части на основе смеси со стадии (2) и изготовление однослойной таблетки согласно обычному способу изготовления таблеток.
В одном воплощении способ приготовления комбинированной композиции согласно любому из описанных выше воплощений может включать:
1) приготовление части на основе гранул, полученных посредством влажного гранулирования, содержащей эзетимиб, путем влажного гранулирования, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше, и затем таблетирование части на основе гранул, полученных посредством влажного гранулирования, для изготовления таблетки;
2) приготовление части на основе смеси розувастатина, включающей розувастатин или его фармацевтически приемлемую соль; и
3) изготовление двухслойной таблетки, включающей первый слой таблетки, изготовленной на стадии (1), и второй слой части на основе смеси стадии (2) с использованием таблеточной машины для двухслойных таблеток согласно обычному способу изготовления двухслойной таблетки.
В некоторых других воплощениях способ приготовления комбинированной композиции согласно любому из описанных выше воплощений может включать:
1) приготовление части на основе гранул, полученных посредством влажного гранулирования, содержащей эзетимиб, путем влажного гранулирования, где указанный эзетимиб имеет распределение частиц по размерам, где средний размер частиц d(0,9) для нижнего предела 90% равен примерно 10 мкм или меньше;
2) добавление части на основе смеси розувастатина, включающей розувастатин или его фармацевтически приемлемую соль, к части на основе гранул, полученных посредством влажного гранулирования, полученных на стадии (1); и
3) заполнение капсулы смесью из части на основе гранул, полученных посредством влажного гранулирования, и части на основе смеси розувастатина для изготовления комбинированной композиции в виде капсулы согласно обычному способу изготовления капсулы.
Пример
В дальнейшем одно или более воплощений настоящего изобретения будут описаны подробно со ссылкой на следующие примеры. Однако эти примеры не предназначены для ограничения объема одного или более воплощений настоящего изобретения.
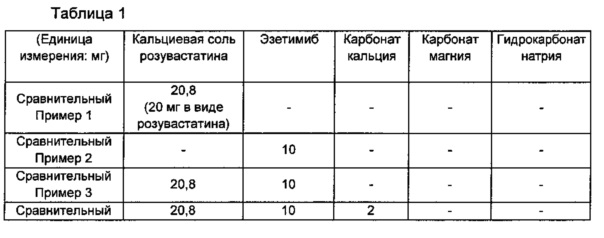
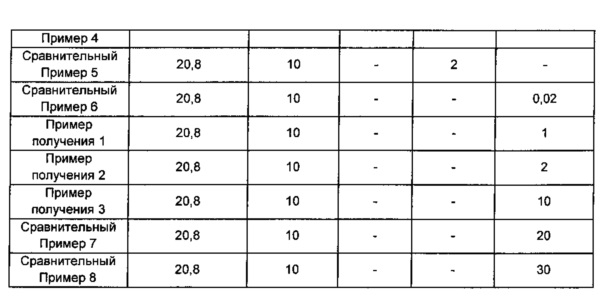
Примеры получения 1-3 и Сравнительные примеры 1-8: изготовление таблеток для идентификации взаимодействия между активными ингредиентами и взаимодействия между активными ингредиентами и основным стабилизатором
Основные ингредиенты смешивали в соответствии с ингредиентами и их количествами, как показано в Таблице 1 ниже, для образования смесей, и смеси прессовали согласно способу дисков по пунктам «ультрафиолетовой (УФ)-абсорбционной спектрофотометрии» в корейской фармакопее, посредством этого получая диски, каждый в форме таблетки. Поставщиками соответствующих основных ингредиентов являются:
карбонат кальция (Bihoku Funka Kogyo, Japan), карбонат магния (Tomita, Japan) и гидрокарбонат натрия (Penrice soda, Australia).
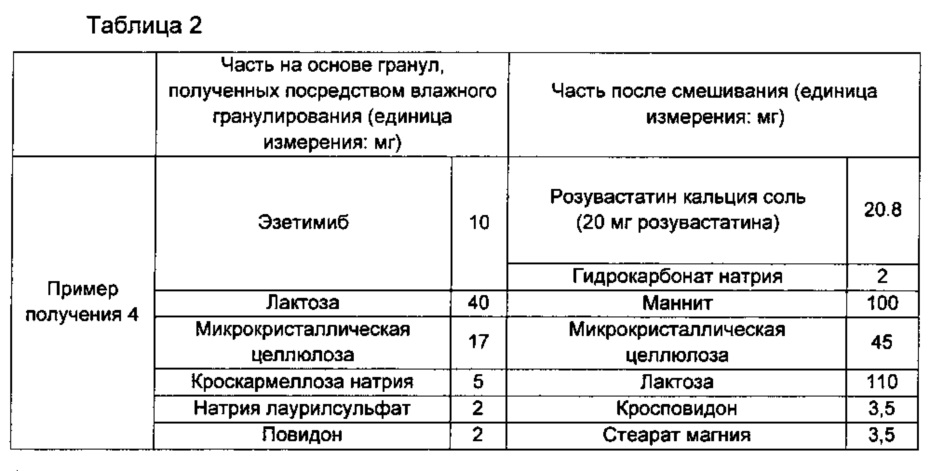
Пример получения 4: изготовление однослойной таблетки, включающей гранулы эзетимиба, полученные посредством влажного гранулирования, и кальциевую соль розувастатина
В соответствии с ингредиентами и их количествами, описанными в части на основе гранул, полученных посредством влажного гранулирования, в Таблице 2 ниже, эзетимиб смешивали с лактозой (DMV-Fonterra Excipients, New Zealand), микрокристаллической целлюлозой (FMC BioPolymer, USA), кроскармеллозой натрия (DMV-Fonterra Excipients B.V., Netherlands) и натрия лаурилсульфатом (Miwon Commercial Co., Ltd, Korea) с образованием части для получения гранул посредством влажного гранулирования. Затем смесь объединяли с гранулирующим раствором, для которого примерно 2 мг повидона (BASF, USA) растворяли примерно в 40 мг воды, сушили и просеивали с размером ячейки примерно 30, получая посредством этого часть на основе гранул эзетимиба, полученных посредством влажного гранулирования.
Кроме того, в соответствии с ингредиентами и их количествами, описанными в части после смешивания в Таблице 2, получали часть после смешивания, включающую кальциевую соль розувастатина и гидрокарбонат натрия. Поставщиками соответствующих основных ингредиентов являются:
маннит (ROQUETTE, France), кросповидон (ISP, USA) и стеарат магния (NOF CORPORATION, Japan).
Часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, и часть после смешивания, полученные выше, смешивали вместе и затем готовили в виде таблетки с использованием таблеточной машины.
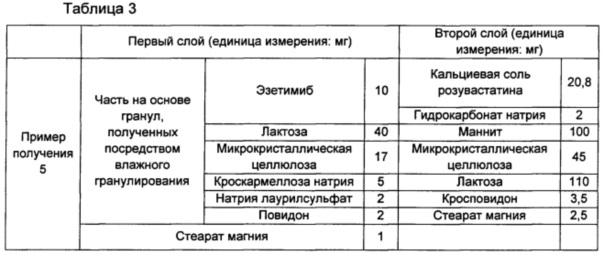
Пример получения 5: изготовление двухслойной таблетки, включающей гранулы эзетимиба, полученные посредством влажного гранулирования, и кальциевую соль розувастатина
В соответствии с ингредиентами и их количествами, описанными в части на основе гранул, полученных посредством влажного гранулирования, в Таблице 3 ниже, эзетимиб смешивали с лактозой, микрокристаллической целлюлозой, кроскармеллозой натрия и натрия лаурилсульфатом. Затем смесь объединяли с гранулирующим раствором, для которого примерно 2 мг повидона (BASF, USA) растворяли примерно в 40 мг воды, сушили и просеивали с размером ячейки примерно 30, получая посредством этого часть на основе гранул эзетимиба, полученных посредством влажного гранулирования. Часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, смешивали со стеаратом магния, находящемся в списке для первого слоя в Таблице 3 ниже, и затем готовили в виде таблетки, используя часть для изготовления однослойных таблеток таблеточной машины для производства двухслойных таблеток (часть в виде однослойной таблетки).
В соответствии с ингредиентами и их количествами, находящимися в списке для второго слоя в Таблице 3 ниже, получали часть на основе смеси для второго слоя, включающей кальциевую соль розувастатина, и затем готовили в виде двухслойной таблетки, состоящей из части в виде однослойной таблетки в качестве первого слоя и части на основе смеси для второго слоя в качестве второго слоя.
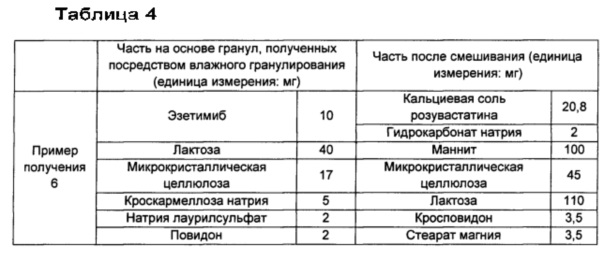
Пример получения 6: изготовление капсул, включающих гранулы эзетимиба, полученные посредством влажного гранулирования, и кальциевую соль розувастатина
В соответствии с ингредиентами и их количеством в части на основе гранул, полученных посредством влажного гранулирования, как показано в Таблице 4 ниже, эзетимиб смешивали с лактозой, микрокристаллической целлюлозой, кроскармеллозой натрия и натрия лаурилсульфатом. Затем смесь объединяли с гранулирующим раствором, для которого примерно 2 мг повидона (BASF, USA) растворяли примерно в 40 мг воды, сушили и просеивали с размером ячейки примерно 30, получая посредством этого часть на основе гранул эзетимиба, полученных посредством влажного гранулирования.
Часть на основе гранул эзетимиба, полученных посредством влажного гранулирования, смешивали с частью после смешивания, соответствующую ингредиентам и их количествам в части после смешивания, как показано в Таблице 4 ниже, и затем желатиновую капсулу «размера 1» (Suheung Capsule Co., Ltd) заполняли смесью, полученной из них.
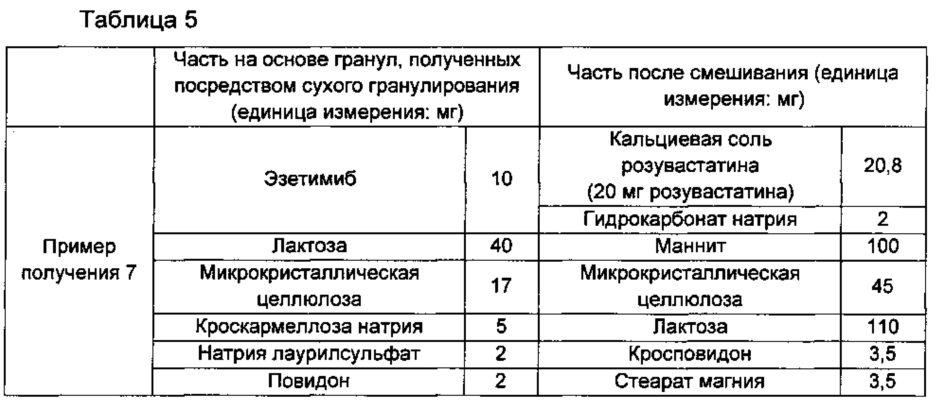
Пример получения 7: изготовление однослойных таолеток, включающих гранулы эзетимиба, полученные посредством сухого гранулирования, и кальциевые соли розувастатина
В соответствии с ингредиентами и их количествами, как показано в части на основе гранул, полученных посредством сухого гранулирования, в Таблице 5 ниже, эзетимиб смешивали с лактозой, микрокристаллической целлюлозой, кроскармеллозой натрия, натрия лаурилсульфатом и повидоном, и смесь подвергали сухому гранулированию с применением роликового пресса (Sejong, South Korea) и затем просеивали с размером ячейки примерно 30, получая посредством этого часть на основе гранул эзетимиба, полученных посредством сухого гранулирования.
Часть на основе гранул эзетимиба, полученных посредством сухого гранулирования, смешивали с частью после смешивания, соответствующую ингредиентам и их количествам, как показано в части после смешивания в Таблице 5 ниже, и затем прессовали в таблетки, используя таблеточную машину.
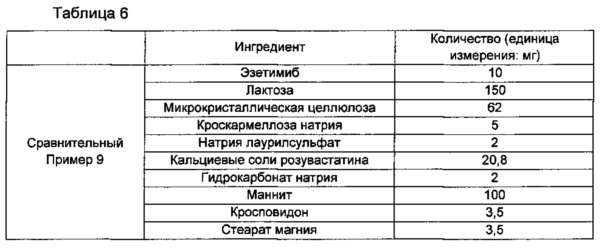
Сравнительный Пример 9: изготовление однослойных таблеток, включающих полученный без влажного гранулирования эзетимиб и кальциевую соль розувастатина
В соответствии с ингредиентами и их количествами, как показано в Таблице 6 ниже, эзетимиб смешивали с лактозой, микрокристаллической целлюлозой, кроскармеллозой натрия, натрия лаурилсульфатом, кальциевыми солями розувастатина, гидрокарбонатом натрия, маннитом, кросповидоном и стеаратом магния. Затем смесь просеивали с размером ячейки примерно 30 и в дальнейшем прессовали в таблетки, используя таблеточную машину.
Сравнительный Пример 10: изготовление капсул, включающих полученный без влажного гранулирования эзетимиб и кальциевую соль розувастатина
В соответствии с ингредиентами и их количеством, как показано в Таблице 7 ниже, эзетимиб смешивали с лактозой, микрокристаллической целлюлозой, кроскармеллозой натрия, натрия лаурилсульфатом, кальциевыми солями розувастатина, гидрокарбонатом натрия, маннитом, кросповидоном и стеаратом магния. Затем капсулу «размера 1» заполняли смесью, полученной из них.


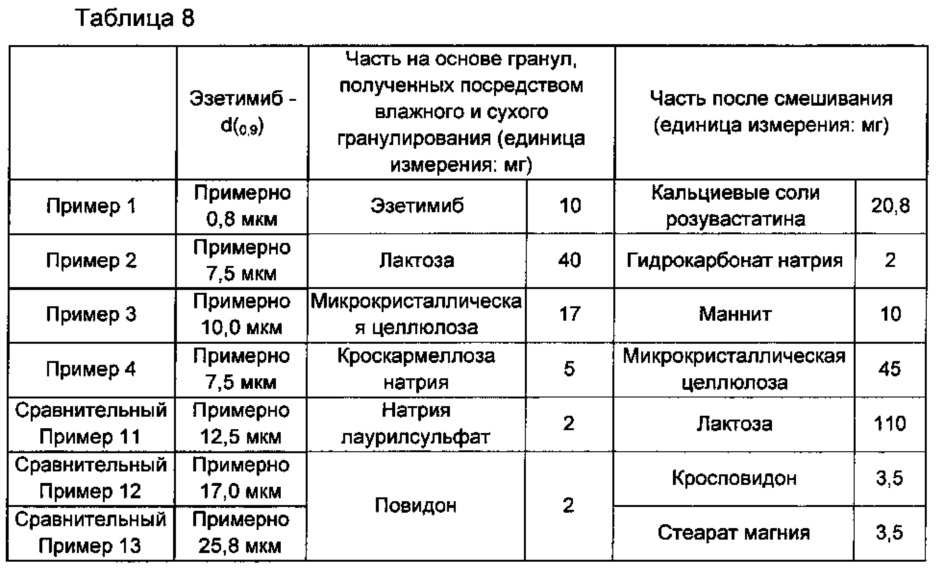
Примеры 1-4 и Сравнительные примеры 11-13: изготовление однослойных таблеток, включающих эзетимиб с разным размером частиц и кальциевую соль розувастатина
Однослойные таблетки Примеров 1-3 и Сравнительных примеров 11-13 готовили так же, как в Примере получения 4, и однослойные таблетки Примера 4 готовили так же, как в Примере получения 7, в соответствии с ингредиентами и их количествами, включая эзетимиб с разными размерами частиц, как показано в Таблица 8 ниже. При этом эзетимиб, применяемый в Примере 1, имел размер частиц примерно 1 мкм, который легко получить в данной области техники.
Экспериментальный Пример 1: тест форсированного разложения эзетимиба
Главный ингредиент эзетимиб точно взвешивали до примерно 100 мг и помещали в 200 мл мерную колбу. Затем туда добавляли примерно 20 мл 90% (об./об.) ацетонитрила (АЦН) и затем полностью растворяли посредством осуществления ультразвуковой экстракции в течение примерно 10 минут. Потом полученную смесь подвергали тесту форсированного разложения по каждому из условий, используя контроль, окисление, сильное основание, сильную кислоту и нагревание, как описано ниже.
1) Контроль: к смеси добавляли примерно 10 мл дистиллированной воды, и смесь оставляли в сушильном шкафу при температуре примерно 60°С примерно на 2 часа для взаимодействия, охлаждали до комнатной температуры и добавляли туда по каплям 10 мл дистиллированной воды.
2) Окисление: добавляли к смеси примерно 10 мл 0,5% (об./об.) раствора перекиси водорода и оставляли смесь в сушильном шкафу при температуре примерно 60°С примерно на 2 часа для взаимодействия, охлаждали до комнатной температуры и добавляли туда по каплям 10 мл дистиллированной воды.
3) Сильное основание: добавляли к смеси примерно 10 мл 0,1 н. NaOH и оставляли смесь в сушильном шкафу при температуре примерно 60°С примерно на 2 часа для взаимодействия, охлаждали комнатной температуры и добавляли туда по каплям 10 мл 0,1 н. HCl (нейтрализация).
4) Сильная кислота: добавляли к смеси примерно 10 мл 0,1 н. HCl и смесь оставляли в сушильном шкафу при температуре примерно 60°С примерно на 2 часа для взаимодействия, охлаждали до комнатной температуры и добавляли туда по каплям примерно 10 мл 0,1 н. NaOH 10 (нейтрализация).
5) Нагревание: добавляли к смеси примерно 10 мл дистиллированной воды и оставляли смесь в сушильном шкафу при температуре примерно 105°С примерно на 2 часа для взаимодействия, охлаждали до комнатной температуры и добавляли туда по каплям примерно 10 мл дистиллированной воды.
Затем каждый из образцов, полученных путем теста разложения, охлаждали до комнатной температуры и добавляли туда растворитель для экстракции (то есть смешанный раствор примерно 0,1 мл 85% фосфатного раствора и примерно 1000 мл ацетонитрила) для каждого условия, приведенного выше, посредством этого получая тестируемую жидкость в количестве 200 мл. Затем тестируемую жидкость анализировали посредством ВЭЖХ согласно общим тестам в порядке, установленном в корейской фармакопее, и вычисляли согласно «способу тестирования на основе количественного анализа» и «способу тестирования родственного соединения», и количества эзетимиба и его основных продуктов разложения, имеющих относительное время удерживания (ОВУ) 1,3 часа, вычисляли, как показано в Таблице 9 ниже и на ФИГ. 1.
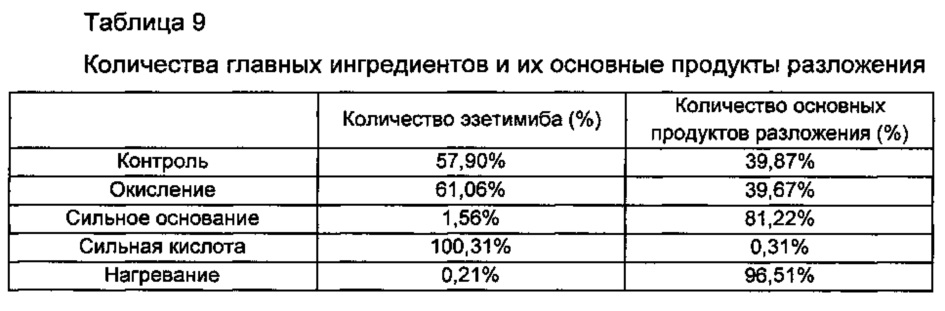
Со ссылкой на Таблицу 9 и ФИГ. 1, было обнаружено, что эзетимиб являлся стабильным в кислотных условиях. Однако в условиях нейтрального или основного рН скорость, при которой эзетимиб подвергался метаболизму до основных продуктов разложения, увеличивалась так, что большая часть эзетимиба метаболизировалась до продуктов разложения, особенно в сильноосновных условиях. То есть обнаружили, что эзетимиб разлагается в основных условиях и при жестких температурах нагревания.
Кроме того, количества родственных соединений каждой из тестируемых жидкостей вычисляли и затем анализировали с использованием ОВУ для соответствующих тестируемых жидкостей. Результаты показаны в Таблице 10 ниже.
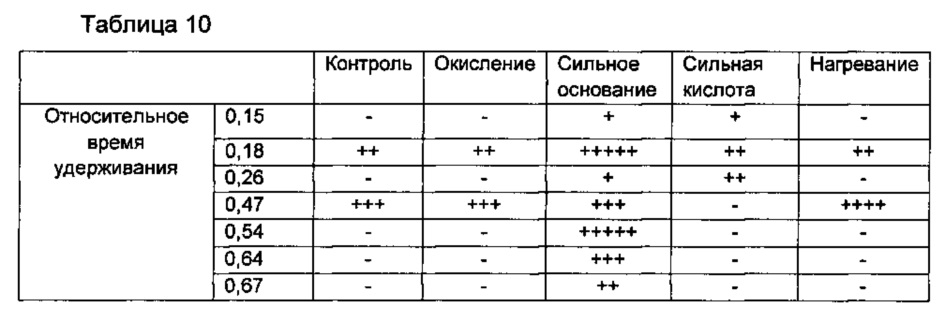
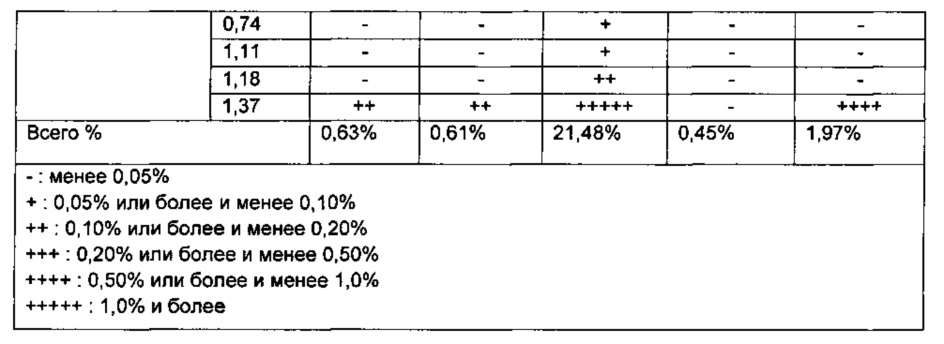
Со ссылкой на Таблицу 10, обнаружили, что образование разных типов родственных эзетимибу соединений резко увеличивалось в сильноосновных условиях.
В заключение, на основе Таблиц 9 и 10 и ФИГ. 1, было подтверждено, что эзетимиб является нестабильным в основной среде.
Экспериментальный Пример 2: Взаимодействие между главными ингредиентами и взаимодействие между розувастатином и основными стабилизаторами
Диски Примера получения 2 и Сравнительных примеров 1-5 хранили в течение 2 недель в жестких условиях при температуре 50°С и относительной влажности 75% и затем тонко измельчали. Отбирали оттуда количество измельченного диска, соответствующее 20 мг розувастатина, и помещали в 100 мл мерную колбу и затем подвергали анализу ВЭЖХ на розувастатин согласно корейской фармакопее. Результаты, вычисленные посредством «способа тестирования родственного соединения», показаны в Таблице 11 ниже и на ФИГ. 2.
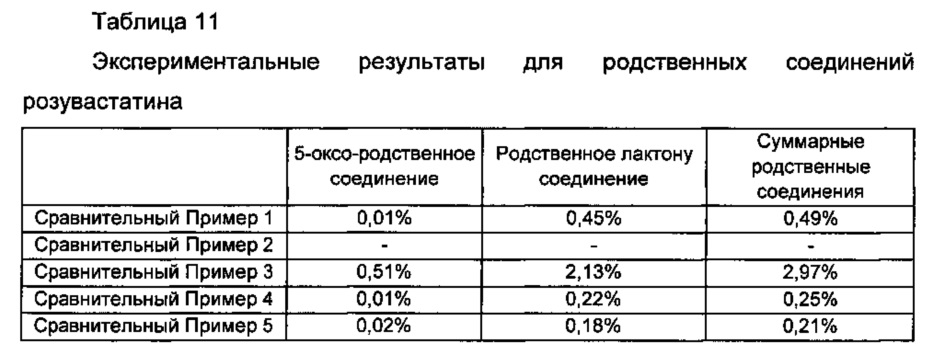

Со ссылкой на Таблицу 11 и ФИГ. 2, имеет место взаимодействие между розувастатином и эзетимибом, и таким образом обнаружили, что в диске Сравнительного Примера 3 увеличилось образование 5-оксо-родственного соединения и родственного лактону соединения в качестве главных метаболитов розувастатина по сравнению с диском Сравнительного Примера 1. Однако в случае смешивания эзетимиба с основными стабилизаторами, как в Сравнительных примерах 4 и 5 и в Примере получения 2, обнаружили, что количественное соотношение главных метаболитов розувастатина резко снижается.
Кроме того, тонко измельчали диски Примера получения 2 и Сравнительных примеров 1-5, хранившиеся и оставленные в жестких условиях. Количество измельченного диска, соответствующее 100 мг эзетимиба, отбирали и затем количество родственных соединений анализировали так же, как в Экспериментальном Примере 1. Результаты показаны в Таблице 12 ниже и на ФИГ. 3.
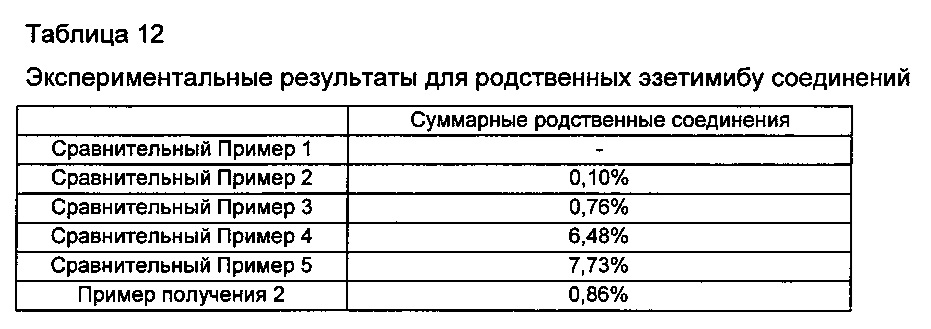
Со ссылкой на Таблицу 12 и ФИГ. 3, имеет место взаимодействие между розувастатином и эзетимибом, и таким образом обнаружили, что в диске Сравнительного Примера 3 увеличилось образование родственных эзетимибу соединений по сравнению с диском Сравнительного Примера 2. Кроме того, в случае смешивания эзетимиба с основными стабилизаторами, как в Сравнительных примерах 4 и 5, было подтверждено, что образование всех родственных соединений увеличивалось гораздо больше, чем образование всех родственных соединений Сравнительного Примера 3. В случае Примера 2 при использовании гидрокарбоната натрия в качестве основного стабилизатора образование родственных соединений Примера 2 мало увеличивалось по сравнению с образованием родственных соединений Сравнительного Примера 3. Однако такое увеличение было незначительным по сравнению с увеличением Сравнительных примеров 4 и 5 при использовании сильноосновных стабилизаторов.
В заключение, как следует из двух результатов, целесообразно использовать основный стабилизатор с учетом стабильности розувастатина, но в случае сильноосновных условий скорость метаболизма эзетимиба увеличивалась, тем самым вызывая резкое увеличение образования родственных соединений. Таким образом обнаружили, что применение гидрокарбоната натрия в качестве слабоосновного подщелачивающего агента может гарантировать стабильность обоих главных ингредиентов.
Экспериментальный Пример 3: тест на стабильность в зависимости от количеств гидрокарбоната натрия
Для того, чтобы узнать целесообразные количества гидрокарбоната натрия в комбинированной композиции по настоящему изобретению, каждый из дисков Примеров получения 1-3 и Сравнительных примеров 6-8 хранили в течение 0, 1 и 2 недель в жестких условиях температуры 50°С и относительной влажности 75%. Затем количества родственных розувастатину соединений анализировали так же, как в Экспериментальном Примере 2. Результаты показаны в Таблице 13 ниже и на ФИГ. 4.
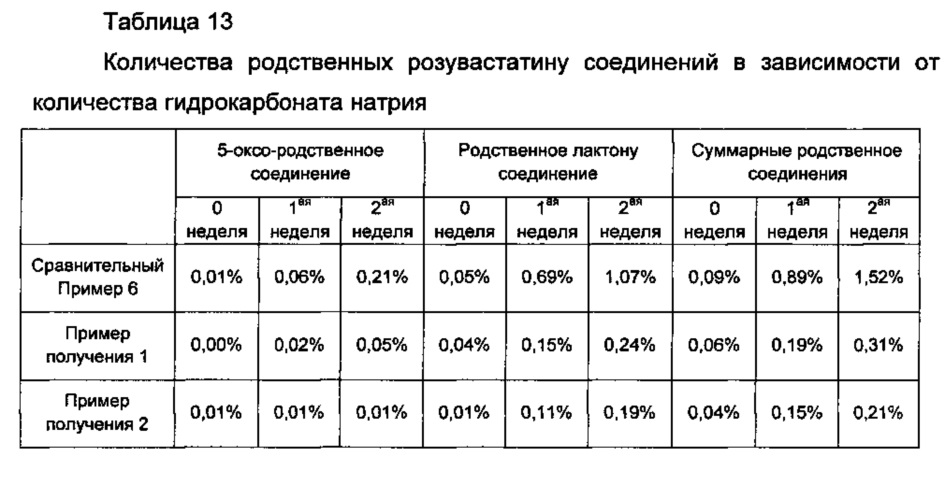
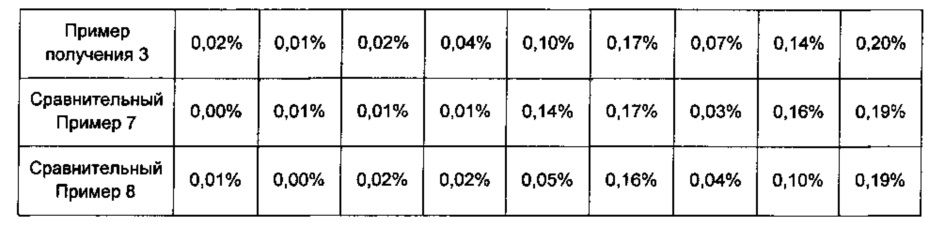
Со ссылкой на Таблицу 13 и ФИГ. 4, показано, что по сравнению со случаем, когда количество гидрокарбоната натрия составляло 0,001 массовой части, исходя из 1 массовой части розувастатина, как в Сравнительном Примере 6, в случае, когда количество гидрокарбоната натрия составляло 0,05 массовых частей или более, исходя из 1 массовой части розувастатина, как в Примерах получения 1-3 и Сравнительных примерах 7 и 8, значительно снижалась величина роста родственных соединений.
Кроме того, результаты анализа количеств родственных эзетимибу соединений в дисках Примеров получения 1-3 и Сравнительных примеров 6-8, которые хранили в жестких условиях, приведенных выше, показаны в Таблице 14 ниже и на ФИГ. 5.
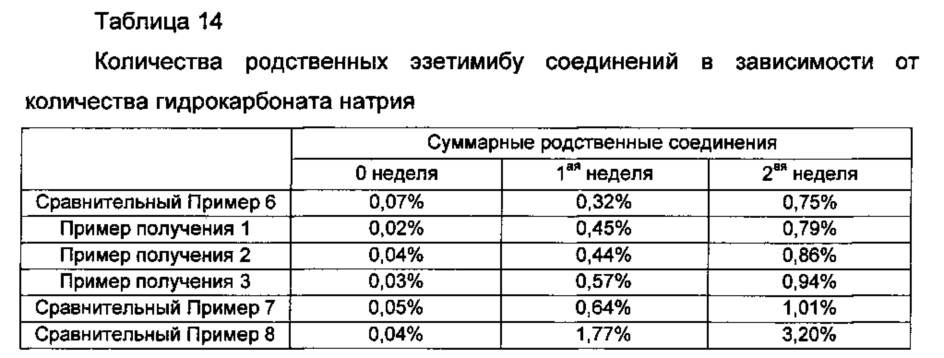
Со ссылкой на Таблицу 14 и ФИГ. 5, обнаружили, что количества суммарных родственных соединений в дисках Сравнительного Примера 6 и Примеров получения 1-3 составляли примерно 1,0% или менее, что представляло собой значительно снижение по сравнению со снижением суммарных родственных соединений в дисках Сравнительных примеров 7 и 8.
В заключение, исходя из этих результатов, для того, чтобы обеспечивать стабильность обоих главных ингредиентов, розувастатина и эзетимиба, одновременно, количество гидрокарбоната натрия может надлежащим образом находиться в диапазоне от примерно 0,05 массовых частей до примерно 0,5 массовых частей, исходя из 1 массовой части розувастатина.
Экспериментальный Пример 4: тест на стабильность в условиях длительного хранение
После длительного хранения таблеток и капсул Примеров получения 4-7 и Сравнительных примеров 9 и 10, каждую из которых хранили в течение 0, 6, и 24 месяцев в условиях при температуре 25°С и относительной влажности 60%, количества родственных розувастатину соединений анализировали так же, как в Экспериментальном Примере 2. Результаты показаны в Таблице 15 ниже и на ФИГ. 6.
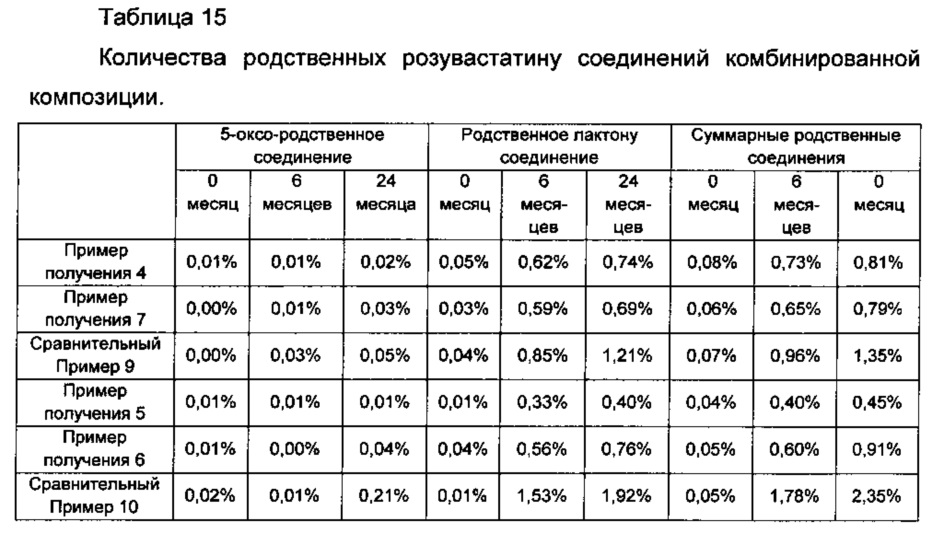
Со ссылкой на Таблицу 15 и ФИГ. 6, в показателях долгосрочной стабильности, случай включения гранул эзетимиба, полученных посредством влажного или сухого гранулирования, как в Примерах получения 4-7, показывал относительно более низкое увеличение родственных соединений, независимо от конкретных типов лекарственной формы, по сравнению со случаем без включения гранул эзетимиба, полученных посредством влажного или сухого гранулирования, как в Сравнительных примерах 9 и 10. Кроме того, в случае Примеров 4 и 7, которые представляют собой однослойные таблетки, включающие гранулы эзетимиба, полученные посредством влажного или сухого гранулирования, обнаружили, что эти однослойные таблетки показывали значительно разработанные характеристики таблетирования при их серийном производстве, так что была возможность производить каждый час 100000 или более таблеток (Т). В случае Сравнительного Примера 9, который представляет собой однослойную таблетку, не включающую гранулы эзетимиба, полученные посредством влажного или сухого гранулирования, было показано, что такая однослойная таблетка показывает низкие характеристики таблетирования, в соответствии с чем возможно было производить каждый час менее 20000 таблеток (Т) на одном и том же аппарате.
Кроме того, после длительного хранения таблеток или капсул Примеров получения 4-7 и Сравнительных примеров 9 и 10 анализировали количества родственных эзетимибу соединений и результаты представляли в Таблице 16 и на ФИГ. 7.
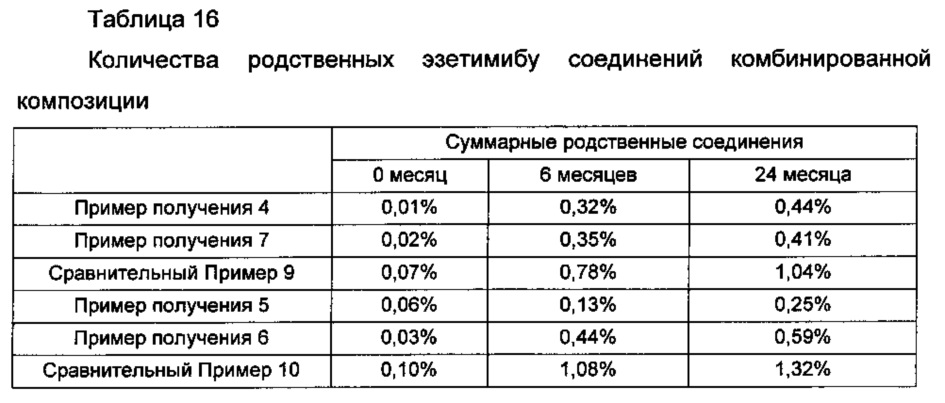
Как показано в Таблице 16 и ФИГ. 7, Примеры получения 4-7, включающие гранулы эзетимиба, полученные посредством влажного или сухого гранулирования, показывали значительно более низкую скорость увеличения родственных соединений по сравнению со Сравнительными примерами 9 и 10, не включающими гранулы эзетимиба, полученные посредством влажного или сухого гранулирования.
В заключение на основе этих результатов, ожидалось, что композиция, включающая гранулы эзетимиба, полученные посредством влажного или сухого гранулирования, имеет улучшенную стабильность, обусловленную по меньшей мере непосредственным контактом между эзетимибом и розувастатином и, как результат, уменьшенное взаимодействие между ними. Кроме того, было подтверждено, что физические свойства эзетимиба, который не является подходящим для таблетирования и серийного производства таблеток, значительно улучшались посредством влажного гранулирования.
Экспериментальный Пример 5: тест на растворение в зависимости от размера частиц эзетимиба (1)
Таблетки Примеров 1-4 и Сравнительных примеров 11-13 подвергали тесту на растворение эзетимиба согласно следующим условиям, и результаты представлены в Таблице 17 ниже и на ФИГ. 8.
<Тест на растворение>
1) Способ растворения: способ растворения II в корейской фармакопее (способ с лопастной мешалкой)
2) Среда для растворения: 0,45% натрия лаурилсульфат раствор (то есть хорошо перемешанный раствор, изготовленный путем растворения 3,9 г натрия дигидрофосфата в 900 мл воды, регулирования рН раствора до получения 4,5, используя 50%(масс./масс.) раствор гидроксида натрия или фосфата, и затем добавления в него воды до получения суммарного количества 1000 мл) в 0,025 М натрий-дигидрофосфатного NaH2PO4⋅2H2O) буфера (рН 4,5)
3) Количество среды для растворения: 500 мл
4) Температура в аппарате для растворения: 37,5°С
5) Скорость лопастной мешалки: 50 об/мин
6) Количество экспериментальных групп: б
7) Время отбора образца: 0, 5, 10, 15 и 30 минут
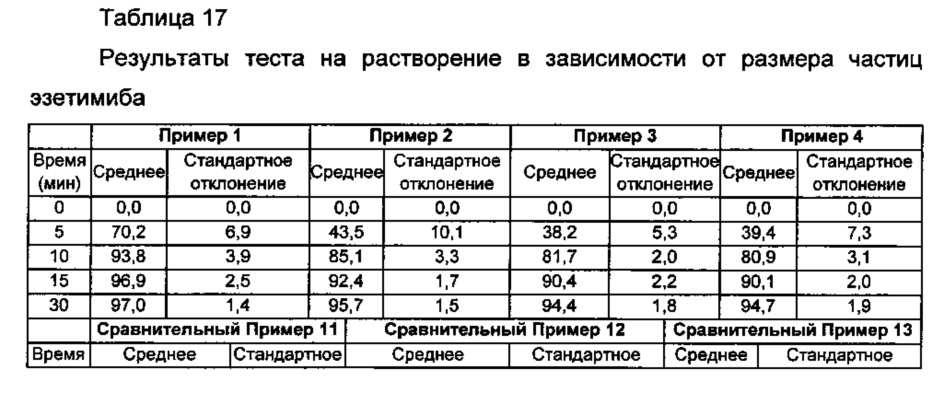
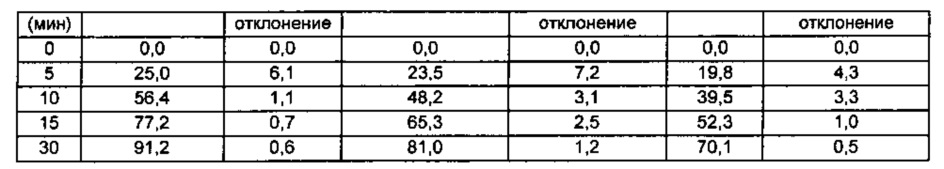
Со ссылкой на Таблицу 17 и ФИГ. 8, пкоазано, что имели место значительные различия скоростей растворения конечных комбинированных композиций в зависимости от среднего размера частиц для нижнего предела 90%. В случае Примеров 1-4, в которых средний размер частиц для нижнего предела 90% равнялся примерно 10,0 мкм или меньше, комбинированные композиции показывали скорости растворения примерно 85% или более в течение 15 минут, где скорости растворения являются значительно улучшенными по сравнению со скоростями растворения комбинированных композиций Сравнительных примеров 11-13. Для гарантирования высокой биодоступности фармацевтическая композиция, включающая эзетимиб, как правило должна обладать превосходным распределением при растворении, и в этом смысле представляется, что данные результаты достигают цели настоящего изобретения.
Экспериментальный Пример 6: тест на растворение в зависимости от размера частиц эзетимиба (2)
Таблетки Примеров 1-4 и Сравнительных примеров 11-13 подвергали тесту на растворение эзетимиба согласно условиям ниже и результаты представляли в Таблице 18 ниже и на ФИГ. 9.
<Тест на растворения>
1) Способ растворения: способ растворения II в корейской фармакопее (способ с лопастной мешалкой)
2) Среда для растворения: 10 издание в корейской фармакопее, уксусная кислота обычного способа тестирования, натрий-ацетатный буфер рН 4,0
3) Количество среды для растворения: 900 мл
4) Температура в аппарате для растворения: 37,5°С
5) Скорость лопастной мешалки: 50 об/мин
6) Количество экспериментальных групп: 6
7) Время отбора образца: 0, 5, 10, 15, 30, 45 и 60 минут
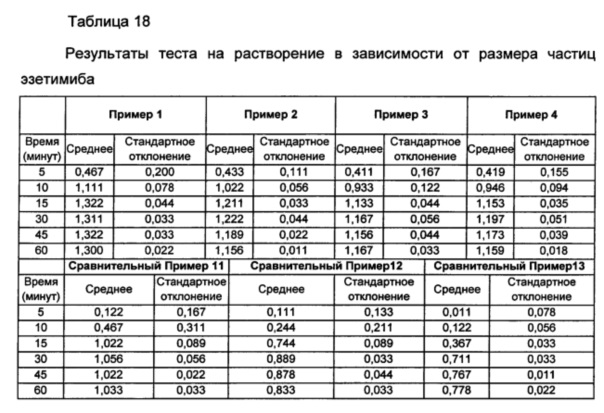
Со ссылкой на Таблицу 18 и ФИГ. 9, было подтверждено, что имели место значительные различия скоростей растворения конечных комбинированных композиций в зависимости от среднего размера частиц для нижнего предела 90%. В случае Примеров 1-4, в которых средний размер частиц для нижнего предела 90% равнялся примерно 10,0 мкм или менее, комбинированные композиции показывали скорости растворения, которые были значительно улучшенными по сравнению со скоростями растворения комбинированных композиций Сравнительных примеров 11-13. Кроме того показано, что комбинированные композиции Примеров 2 и 4, включающие эзетимиб с таким же размером частиц, имели превосходные скорости растворения с аналогичным уровнем. Для гарантирования высокой биодоступности фармацевтическая композиция, включающая эзетимиб, как правило должна обладать превосходным распределением при растворении, и в этом смысле представляется, что данные результаты демонстрируют достижение цели настоящего изобретения.
Экспериментальный Пример 7: тест на стабильность в зависимости от присутствия добавки
Количества суммарных родственных соединений измеряли в таблетках, которые готовили так же, как в Примере 3 и Сравнительном Примере 13, за исключением того, что каждую из таблеток готовили посредством включения добавки, представленной в Таблицах 19 и 20 ниже. Изготовленные таблетки оставляли на 2 недели в жестких условиях температуры 50°С и относительной влажности 75%, затем анализировали количества родственных розувастатину соединений и родственных эзетимибу соединений так же, как в Экспериментальном Примере 2, тем самым измеряя количества суммарных родственных соединений. Результаты показаны в Таблицах 19 и 20 ниже. 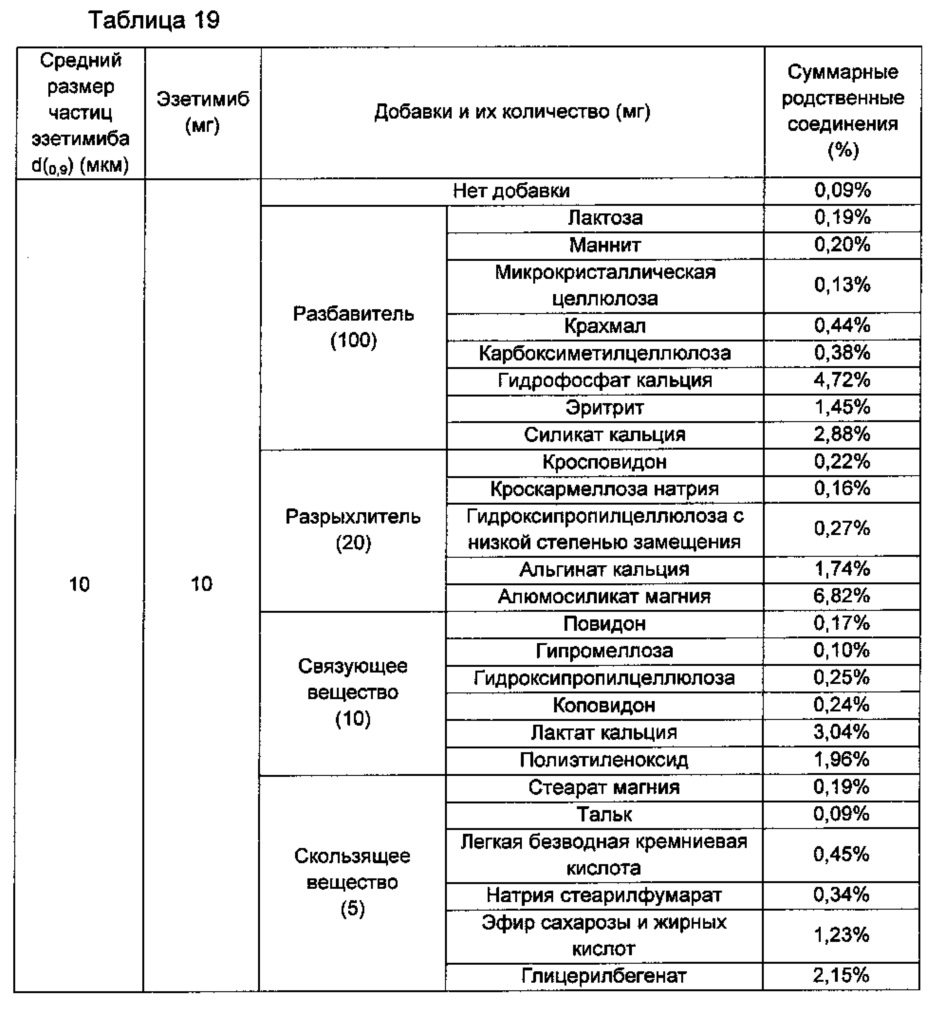
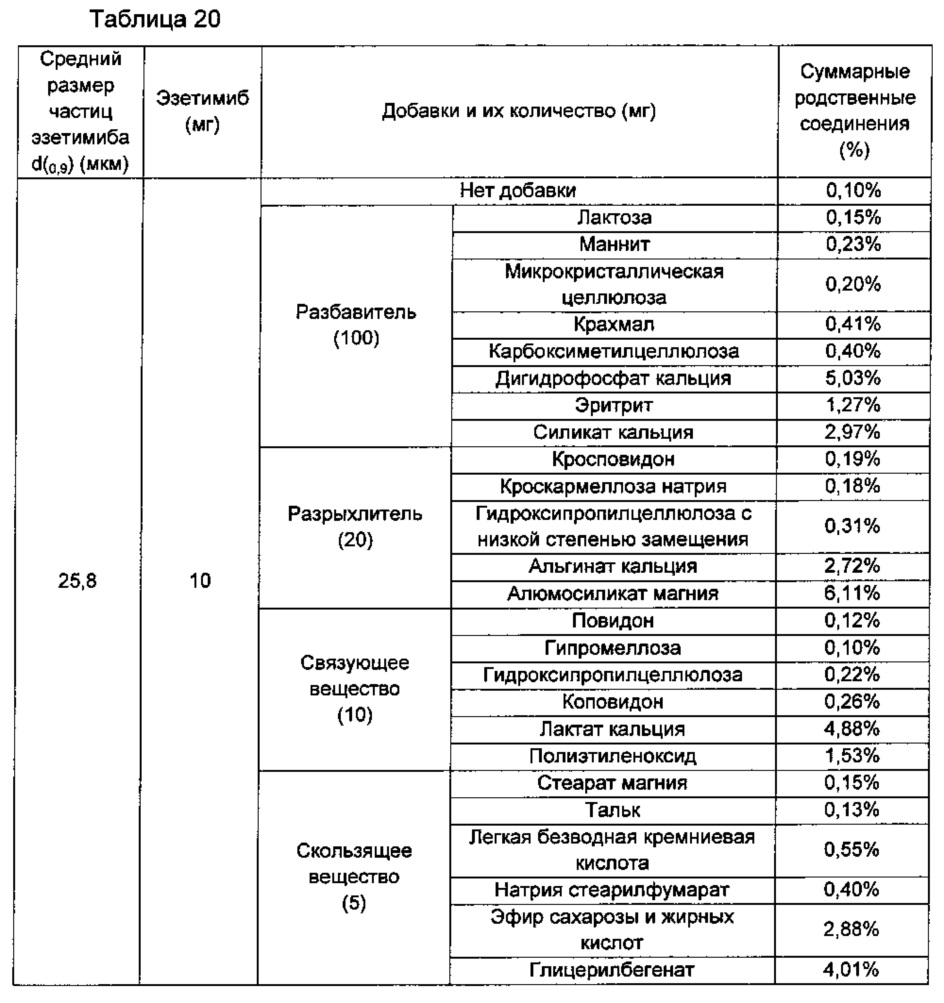
Согласно результатам приведенных выше экспериментов показано, что даже после длительного хранения в жестких условиях родственные соединения образовывались в меньшем количестве в комбинированной композиции, в которой средний размер частиц для нижнего предела 90% равнялся примерно 10,0 мкм или меньше, чем в комбинированной композиции, имеющей значительно больший средний размер частиц эзетимиба (случай, когда добавку не включали). Следовательно, эти данные подтверждают, что комбинированная композиция по настоящему изобретению не только имела улучшенную скорость растворения при уменьшении размера частиц, но также гарантируют ее стабильность.
Кроме того, когда комбинированные композиции получали посредством включения различных видов добавок, комбинированная композиция, включающая эзетимиб, имеющий средний размер частиц для нижнего предела 90% 10,0 мкм или менее, показывала более низкое образование родственных соединений или без значительной разницы по сравнению с комбинированной композицией, включающей эзетимиб, имеющий значительно больший средний размер частиц, даже после длительного хранения в жестких условиях, где и в той и в другой комбинированной композиции использовали одинаковые добавки. Когда средний размер частиц активного ингредиента понижается, его стабильность обычно снижается из-за высокой вероятности взаимодействия между активным ингредиентом и окружающими его добавками благодаря увеличившейся площади поверхности активного ингредиента. Однако, согласно приведенным выше результатам, не наблюдалось связи между пониженным размером частиц и повышенным образованием родственных соединений. Следовательно, эти данные подтверждают, что комбинированная композиция по настоящему изобретению не только имела повышенную скорость растворения из-за уменьшения размера частиц, но также гарантировала стабильность.
Кроме того, в случае включения добавок, таких как связующее вещество, включая повидон, гипромеллозу, гидроксипропилцеллюлозу или коповидон; разрыхлитель, включая кросповидон, кроскармеллозу натрия, натрия крахмал гликолят или гидроксипропилцеллюлозу с низкой степенью замещения; скользящее вещество, включая стеарат магния, тальк, легкую безводную кремниевую кислоту или натрия стеарилфумарат, показано, что образование родственных соединений было значительно низким по сравнению со случаем включения других добавок.
Следовательно, согласно данным результатам, было обнаружено, что комбинированная композиция по настоящему изобретению способна обеспечивать стабильность даже в случае уменьшения размера частиц активного ингредиента. Кроме того, стабильность комбинированной композиции по настоящему изобретению также можно дополнительно улучшать путем подбора добавки.
Экспериментальный Пример 8: тест на биодоступность
Для того, чтобы подтвердить, действительно ли биодоступность увеличивается в соответствии с ростом скоростей растворения, выполняли оценку концентрации эзетимиба в крови здоровых взрослых мужчин. При этом использовали таблетки Примеров 2 и 4 и Сравнительных примеры 12 и 13.
Количество тестируемых субъектов представляло собой 6 для каждой группы тестируемых образцов, то есть суммарное количество тестируемых субъектов представляло собой 18. Таблетку (10 мгЛГ) перорально вводили обычным способом каждому из тестируемых субъектов, которые воздерживались от пищи в течение 14 часов перед днем перорального введения. Потом каждому из тестируемых субъектов разрешали выпить 120 мл воды и во время отбора проб у каждого субъекта отбирали 2 мл крови из подкожной латеральной вены руки тестируемых субъектов. Образец крови, полученный посредством этого, предварительно обрабатывали в соответствии с обычным способом предварительной обработки образцов крови и, кроме того, предварительно обрабатывали путем добавления бета-глюкуронидазы к образцам крови, чтобы суммировать концентрацию эзетимиба в крови и концентрацию остаточных метаболитов эзетимиба в крови. Концентрацию эзетимиба в крови в динамике по времени после введения анализировали с использованием ЖХ/МС. Затем по программе WinNonlin анализировали фармакокинетический параметр эзетимиба.
Результаты показаны в Таблице 21 ниже и на ФИГ. 10.
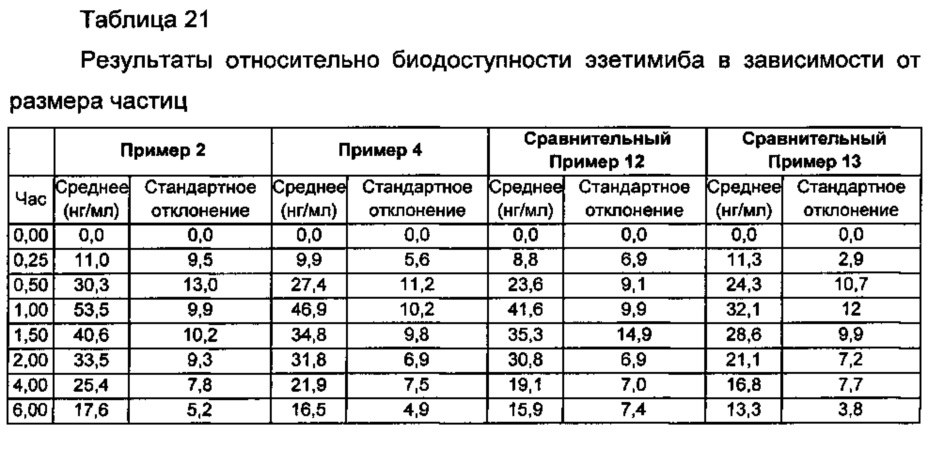

Из Таблицы 21 и ФИГ. 10 видно, что комбинированная композиция Примера 2, содержащая эзетимиб, который имеет средний размер частиц для нижнего предела 10,0 мкм или менее, имеет значительно более высокие AUC и Смакс по сравнению с AUC и Смакс комбинированных композиций Сравнительных примеров 12 и 13, содержащих эзетимиб, который имел относительно более крупный размер частиц. В частности, комбинированная композиция Сравнительного Примера 13 показывает половинный уровень AUC и примерно 70% Смакс по сравнению с AUC и Смакс Примера 2. Таким образом, подтверждается, что размер частиц эзетимиба значительно влияет на биодоступность комбинированной композиции. Кроме того обнаружили, что высокие скорости растворения действительно свидетельствуют о высокой биодоступности.
Следует понимать, что типичные воплощения, описанные здесь, следует рассматривать только в иллюстративном значении, а не для целей ограничения. Описания признаков или аспектов в каждом воплощении обычно следует рассматривать в качестве полезных для других похожих признаков или аспектов других воплощений.
Хотя одно или более воплощений настоящего изобретения были описаны со ссылкой на фигуры, специалисту в данной области техники понятно, что в нем могут быть выполнены различные изменения формы и деталей без выхода за пределы сущности и объема настоящего изобретения, как определено посредством следующей формулы изобретения.