Результат интеллектуальной деятельности: Способ диагностики злокачественных новообразований головного мозга
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к диагностике путем исследования физических и химических свойств крови и может быть использовано в клинической практике для диагностики злокачественных новообразований головного мозга.
На сегодняшний день распространенность опухолей головного мозга - от 5 до 14 случаев на 100 тысяч населения (Мацко Д.Е. Нейрохирургическая патология. Руководство. - СПб.: Б.И., 2012. - 405 с.). Во всем мире ежегодно фиксируется около 240000 новых случаев и около 175000 смертей от опухолей мозга. Глиальные опухоли относятся к наиболее часто встречающимся новообразованиям головного мозга и составляют в среднем от 50 до 55% от всех первичных церебральных новообразований (Зозуля Ю.А. Глиомы головного мозга. - Киев.: УИПК "ЕксОб", 2007. - 632 с.). Большая часть из них - злокачественные глиомы с высокой степенью анаплазии - grade III-IV, и составляют 55-60% от всех первичных глиальных опухолей (Олюшин В.Е. Глиальные опухоли головного мозга: краткий обзор литературы и протокол лечения больных // Нейрохирургия. - 2005. - №4. - С. 41-47.). Ранняя, достоверная информация о степени злокачественности опухоли позволит оптимизировать процесс лечения и существенно повысить его эффективность.
Известен способ диагностики степени анаплазии злокачественных и доброкачественных опухолей головного мозга с использованием протонной магнитно-резонансной спектроскопия (ПМРС) (Труфанов Г.Е., Тютин Л.А. Магнито-резонансная спектроскопия. - СПб.: ЭЛ-БИ-СПб, 2008. - 239 с.).
Способ основан на определении содержания некоторых метаболитов в опухолевых тканях и в перитуморальной зоне. Наиболее часто исследуют холин, лактат, креатин, фосфокреатинин, мио-инозин, глутамат, глутамин, липиды, N-ацетиласпартат и их соотношения.
Известный способ включает получение спектра из кубического участка (вокселя) вещества мозга или опухоли размером 2×2×2 см (8 см3) и анализ частот в регистрируемом от этого вокселе спектра, в результате чего получают распределение определенных метаболитов в ткани по шкале химического сдвига (ррт). Соотношение между пиками метаболитов в спектре, уменьшение или увеличение высоты отдельных пиков спектра позволяют неинвазивно оценивать биохимические процессы, происходящие в тканях. Злокачественные опухоли характеризуются низким соотношением N-ацетиласпартат / креатин, увеличением соотношения холин / креатин и, в некоторых случаях, появлением пика лактата.
Технический результат известного способа заключается в обеспечении возможности оценки различных объемных образований головного мозга и дифференциальной диагностике астроцитом, эпендимом и примитивных нейроэпителиальных опухолей, предположительно определяя тип опухолевой ткани. Известный способ позволяет диагностировать с высокой долей вероятности степень злокачественности процесса.
Однако, к недостаткам известного способа можно отнести недостаточную точность диагностики, так как исследуется только один участок ткани небольшого объема (воксель). При многовоксельной спектроскопии исследование осуществляют только в одной плоскости на относительно небольшом участке новообразования. Вместе с тем, известно, что опухоль неоднородна по своему строению и активности опухолевых клеток. И получить информацию об активности всей опухоли с применением данного способа не представляется возможным. Кроме того, расположение рядом с зоной исследования костных структур, ликворных пространств, крупных сосудов и очагов геморрагии приводит к появлению артефактов, искажающих результаты исследований (Подопригора A.Е. Протонная магнито-резонансная спектроскопия в диагностике объемных заболеваний головного мозга: автореф. дисс. … канд. мед. наук. - М., 2002. - 30 с.). Помимо этого, похожие изменения метаболитов выявляются при абсцессах, при пилоцитарных астроцитомах, что не позволяет с помощью ПМРС четко дифференцировать степень анаплазии, злокачественные и доброкачественные опухоли головного мозга (Корниенко, B.Н., Пронин И.Н. Диагностическая. - М.: ИП «Андреева Т.М.», 2006. - 1327 с.). Кроме того исследование противопоказано проводить при встроенном кардиостимуляторе, зажимах сосудов, металлических имплантах, кохлертарном протезе внутреннего уха, беременности, клаустрофобии и тяжелом общем состоянии пациента. Иногда для проведения ПМРС необходим наркоз (для детей младшего возраста, взрослых пациентов с психическими отклонениями или с болевым синдромом), так как во время проведения процедуры обследуемый должен быть абсолютно неподвижен на протяжении длительного времени.
За прототип предлагаемого изобретения выбран известный способ диагностики злокачественных новообразований головного мозга, включающий исследование биологического материала с помощью инструментальных методов исследования и постановку диагноза (Кошкин Ф.А., Чистяков Д.А., Никитин А.Г., Коновалов А.Н., Потапов А.А., Усачев Д.Ю., Пицхелаури Д.И., Кобяков Г.Л., Шишкина Л.В., Чехонин В.П. Изучение профиля экспрессии микроРНК в опухолях мозга разной степени злокачественности // Бюллетень экспериментальной биологии и медицины - 2014 - Т. 157. - No 6. - С. 794-797.)
Известный способ осуществляют следующим образом.
Тотальную РНК выделяют из плазмы крови с использованием реагента TriReagent (MRC, США). Осадок РНК растворяли в 12 мкл РНК-элюента (Интерлабсервис, Москва). Комплементарную ДНК (кДНК) получают на основе технологии «StemLoop» с использованием набора для обратной транскрипции «ОТ-1» (Синтол, Москва). Реакцию проводят раздельно с праймерами для гена микроРНК-21 и референтного гена U6 (малая ядерная РНК). Реакционная смесь содержит по 5 мкл реакционного буфера (2,5 X Реакционная смесь), 10 пМоль специфического праймера для обратной транскрипции (таблица 1), 0,5 мкл ингибитора РНКаз, 0,5 мкл фермента MMLV (Синтол, Москва) и 5 мкл раствора РНК. Реакцию проводят в амплификаторе ДТ-Лайт (ДНК-Технологии, Москва) по следующей программе: 16°С - 30 мин, 42°С - 30 мин, 85°С - 5 мин с последующим охлаждением смеси до 4°С. Исследование экспрессии гена микроРНК-21 проводят с помощью полимеразной цепной реакции (ПЦР) в реальном времени с использованием набора «2,5х Реакционная смесь для проведения ПЦР-РВ в присутствии красителя EVA Green» (Синтол, Москва) в конечном объеме 25 мкл. Смесь для ПЦР содержит: 10 мкл 2,5х ПЦР буфера Б (с SynTaq ДНК-полимеразой), по 10 пМолей прямого и обратного праймеров и 5 мкл соответствующего образца кДНК. Амплификация проводять на приборе ДТ-Lite (ДНК-Технологии, Москва) с учетом уровня флюоресценции по каналу FAM (470/525 нм). Программа амплификации следующая: 95°С - 5 мин, затем 45 циклов (95°С - 15 сек и 60°С - 1 минута). Расчет относительного уровня экспрессии гена микроРНК-21 проводят по стандартной методике ΔΔCt. Оценка уровня экспрессии микроРНК-21 полуколичественным методом основывается на его сравнении с экспрессией гена малой ядерной РНК (мяРНК) U6, используемого в качестве контроля благодаря стабильности уровня его экспрессии. Интенсивность сигнала выражают в относительных единицах флуоресценции (ОЕФ). Для каждого образца строят две кривые накопления флуоресцентного сигнала микроРНК-21 и мяРНК U6. Результатом ПЦР-РВ является значение Ct (пороговый цикл) - число циклов, необходимых для пересечения флуоресцентным сигналом порога (фонового уровня). Уровень Ct обратно пропорционален количеству целевой нуклеиновой кислоты в образце (чем ниже уровень Ct, тем выше количество нуклеиновой кислоты-мишени в образце). При более чем двукратном повышении уровня экспрессии микро-РНК-21 (по сравнению с практически здоровыми людьми) диагностируют III-IV степень злокачественности опухоли головного мозга.
Известный способ позволяет увеличить чувствительность и специфичность выявления злокачественных форм опухолей головного мозга и получить достоверные результаты, отражающие активность инвазивного роста и инфильтративного процесса данного новообразования.
К недостаткам способа можно отнести его сложность и трудоемкость выполнения. Известный способ ограничен в применении из-за отсутствия в больницах практического здравоохранения технического оснащения для его выполнения. Также существенным недостатком способа является возможность его применения только для глиом, а не для всех опухолей головного мозга.
Задачей предлагаемого изобретения является создание способа, лишенного недостатков прототипа.
Технический результат изобретения заключается в обеспечении ранней диагностики, не снижая ее точности, специфичности и объективности, обеспечение возможности скрининг-диагностики большой популяции людей, упрощение способа, сокращение времени исследования и себестоимости.
Технический результат достигается тем, что в известном способе диагностики злокачественных новообразований головного мозга, включающем исследование плазмы крови инструментальными методами исследования и постановку диагноза, исследуют свободнорадикальную активность и содержание миоглобина плазмы крови, каталазы эритроцитов, ацетилхолинэстеразы цельной крови и при увеличении свободнорадикальной активности плазмы крови более чем на 500% от физиологической нормы 1,25±0,12 mV, и увеличении содержания миоглобина более чем на 25% от физиологической нормы миоглобина плазмы крови 22,63±6,33 нг/мл, при одновременном снижении активности каталазы эритроцитов более чем на 33% от физиологической нормы 15,24±3,21 мМ/л и снижении активности ацетилхолинэстеразы цельной крови более чем на 35% от физиологической нормы 24,36±5,72 мг/мл/час/0,1 г Нв диагностируют злокачественное новообразование головного мозга.
Предлагаемое изобретение отвечает критерию «новизна», так как при проведении патентно-информационных исследований не выявлены источники научно-технической и патентной литературы, которые бы порочили новизну изобретения.
Из уровня техники известно, что нарушение свободнорадикальной активности при злокачественных новообразованиях имеет диагностический характер и повышение уровня свободных радикалов- один из пусковых механизмов канцерогенеза (Воейков В.Л. Благотворная роль активных форм кислорода // Биохимия, 2004. №1 С. 27-38.). Мозг особо уязвим для свободных радикалов из-за его высокого потребления кислорода и высоких концентраций легко окисляющихся полиненасыщенных жирных кислот. Поэтому мозг наиболее подвержен окислительному повреждению.
Миоглобин - мультифункциональный гемпротеин, экспрессируемый в норме в основном в миоцитах. Основная функция этого белка - обратимое связывание с кислородом, запасание и транспорт его от гемоглобина. Однако согласно последним литературным данным, миоглобин выявляется и в немышечных тканях, испытывающих недостаток кислорода (Kanatous S., MammenP., 2010). Так, Flonta с соавт. (2009) показали в своих работах высокий уровень миоглобина в злокачественных опухолях эпителиальных тканей человека (рак молочных желез, яичников, кишечника) уже на самых ранних стадиях развития заболевания. При этом обсуждается опухоль-подавляющая роль миоглобина за счет ингибирования активности митохондрий.
Каталаза - гемсодержащий фермент с молекулярной массой около 250 кДа, разрушающий пероксид водорода без участия акцепторов кислорода, а донором электронов служит сам пероксид водорода. По структуре фермент является тетрамером, содержащим по одной прочно связанной гемовой простетической группе на субъединицу. Функцией фермента является предотвращение накопления в клетках пероксида водорода, образующейся, в частности, при дисмутации супероксидного аниона и при аэробном окислении восстановленных флавопротеидов. Каталаза относится к ферментам, которые наиболее длительно сохраняют свою высокую активность, почти не требует энергии активации, а скорость реакции, катализируемой этим ферментом, лимитирует лишь скорость диффузии субстрата к активному центру каталазы (Павлова Р.Н., Голованова Н.Э. и др. Исследование адаптогенных и антиоксидантных свойств Трансфер Фактора Эдвэнсд // СПбГМА им. И.И. Мечникова, Санкт-Петербург, 2009).
В последнее время появляются работы, где обсуждаются холинэстеразы как потенциальные онкомаркеры и перспективы использования изменений в активности холинэстераз крови для прогнозирования судьбы больных после перенесенных онкологических заболевания (Moon J, Chun В. Utility of red blood cell acetylcholinesterase measurement in mechanically ventilated subjects after organophosphate poisoning. Respir Care. 2014; 59(9): 1360-1368). Получены отдельные данные о вовлечении ацетилхолинэстеразы в контроль пролиферации, переход клеток к апоптозу, развитие воспалительных реакций и формирование иммунитета (Campoy FJ, Vidal CJ,  Е, Montenegro MF, Cabezas-Herrera J. et al. Cholinergic system and cell proliferation. Chem. Biol. Interact. 2016; 259(Pt B): 257-265). Ацетилхолинэстераза выполняет роль опухолевого супрессора в культурах клеток опухолей даже при отсутствии ферментативной активности и может влиять на апоптоз раковых клеток негидролитическим путем, экспрессия и активность холинэстераз в тканях онкологических больных коррелирует с выживаемостью больных и связана со степенью злокачественности опухоли (Jin Q.H., Не H.Y., Shi Y.F., Lu Н., Zhang X.J. Overexpression of acetylcholinesterase inhibited cell proliferation and promoted apoptosis in NRK. Acta Pharmacol. Sin. 2004; 25(8): 1013-1021).
Е, Montenegro MF, Cabezas-Herrera J. et al. Cholinergic system and cell proliferation. Chem. Biol. Interact. 2016; 259(Pt B): 257-265). Ацетилхолинэстераза выполняет роль опухолевого супрессора в культурах клеток опухолей даже при отсутствии ферментативной активности и может влиять на апоптоз раковых клеток негидролитическим путем, экспрессия и активность холинэстераз в тканях онкологических больных коррелирует с выживаемостью больных и связана со степенью злокачественности опухоли (Jin Q.H., Не H.Y., Shi Y.F., Lu Н., Zhang X.J. Overexpression of acetylcholinesterase inhibited cell proliferation and promoted apoptosis in NRK. Acta Pharmacol. Sin. 2004; 25(8): 1013-1021).
Однако в научно-медицинской литературе сведений о возможности диагностики злокачественных новообразований головного мозга с помощью интегрального анализа активности каталазы, ацетилхолинэстеразы и содержания миоглобина и свободнорадикальной активности плазмы крови, не обнаруежено, что позволяет сделать вывод о соответствии предлагаемого изобретения критерию «изобретательский уровень».
Технический результат предлагаемого способа заключается в комплексной оценке физико-химических параметров крови с определением маркерных белков и свободнорадикадбной активности. Предлагаемое изобретение при использовании позволяет:
- обеспечить раннюю диагностику злокачественных новообразований на догоспитальном этапе;
- обеспечить возможность скрининг-диагностики во время профосмотров;
- в дооперационном периоде обеспечить прогноз доброкачественного или злокачественного характера опухолей;
- обеспечить высокую точность диагностического исследования; проведение мониторинга во время противоопухолевой терапии;
- обеспечить выявление метостазов в послеоперационном периоде и
- значительное снизить время и трудоемкость осуществления способа;
- снизить экономические затрат на осуществление диагностики, так как в отличие от прототипа не требуется наличие дорогостоящего оборудования и реактивов.
Технический результат подтвержден проведенными клинико-лабораторными испытаниями. В работе были исследованы кровь 12 пациентов со злокачественными опухолями головного мозга - глиобластомы, астроцитомы (Grade III-IV) - 6 женщин и 6 мужчин в возрастной категории от 39 до 53 лет. 7 пациентов с доброкачественными опухолями головного мозга - менингиомы, астроцитомы (Grade I-II) - 3 женщины и 4 мужчины в возрасте от 37 до 59 лет, до проведения лечения. В качестве контроля использовали кровь от 10 практически здоровых людей (5 мужчин и 5 женщин в возрастной категории от 35 до 65 лет).
Результаты исследования представлены с помощью графического материала.
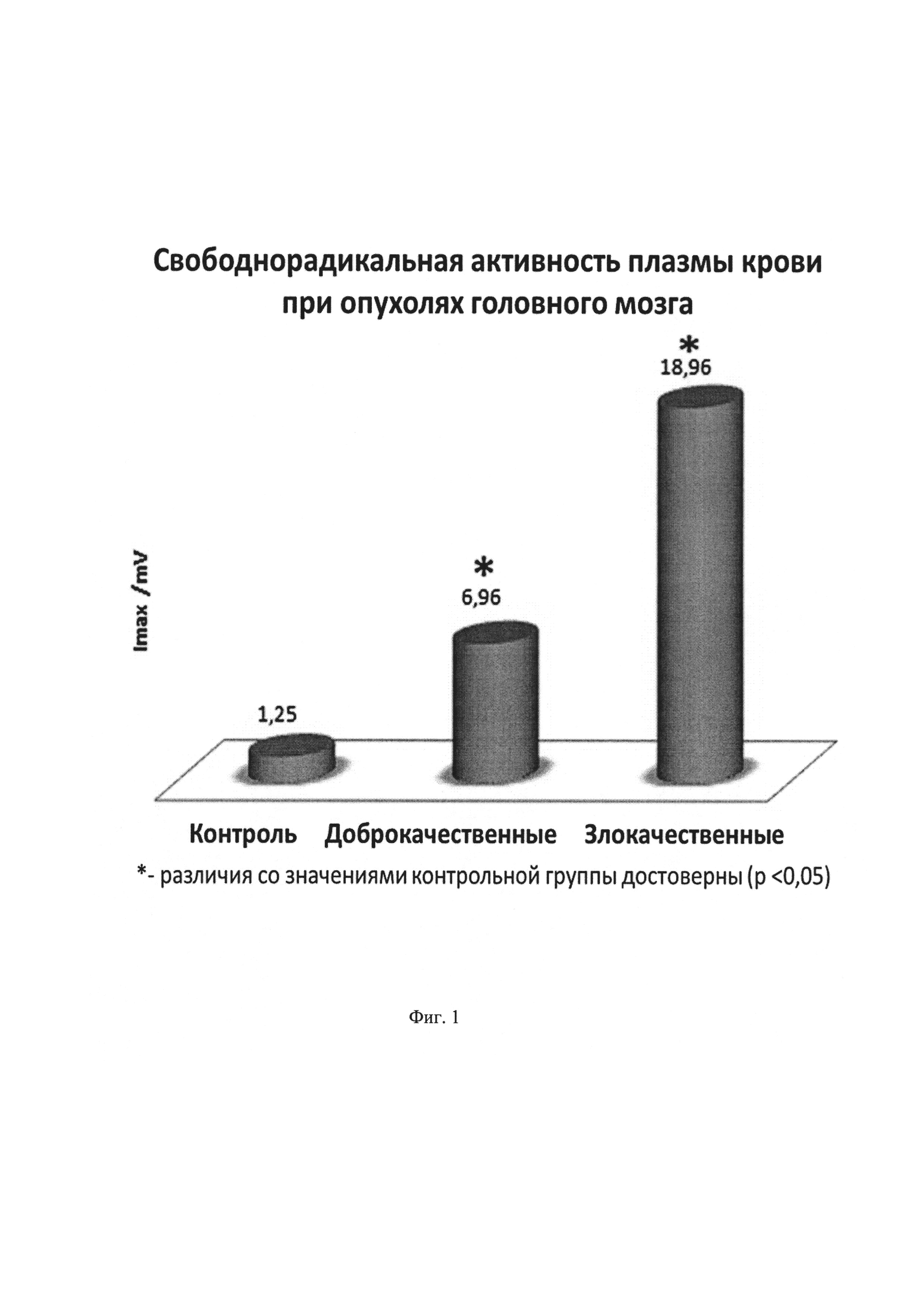
На фиг. 1 изображена диаграмма свободнорадикальной активности плазмы крови при опухолях головного мозга: с доброкачественными опухолями головного мозга, со злокачественными опухолями головного мозга, у практически здоровых людей (контроль). * - различия с показателями контрольной группы достоверны (р<0,05)
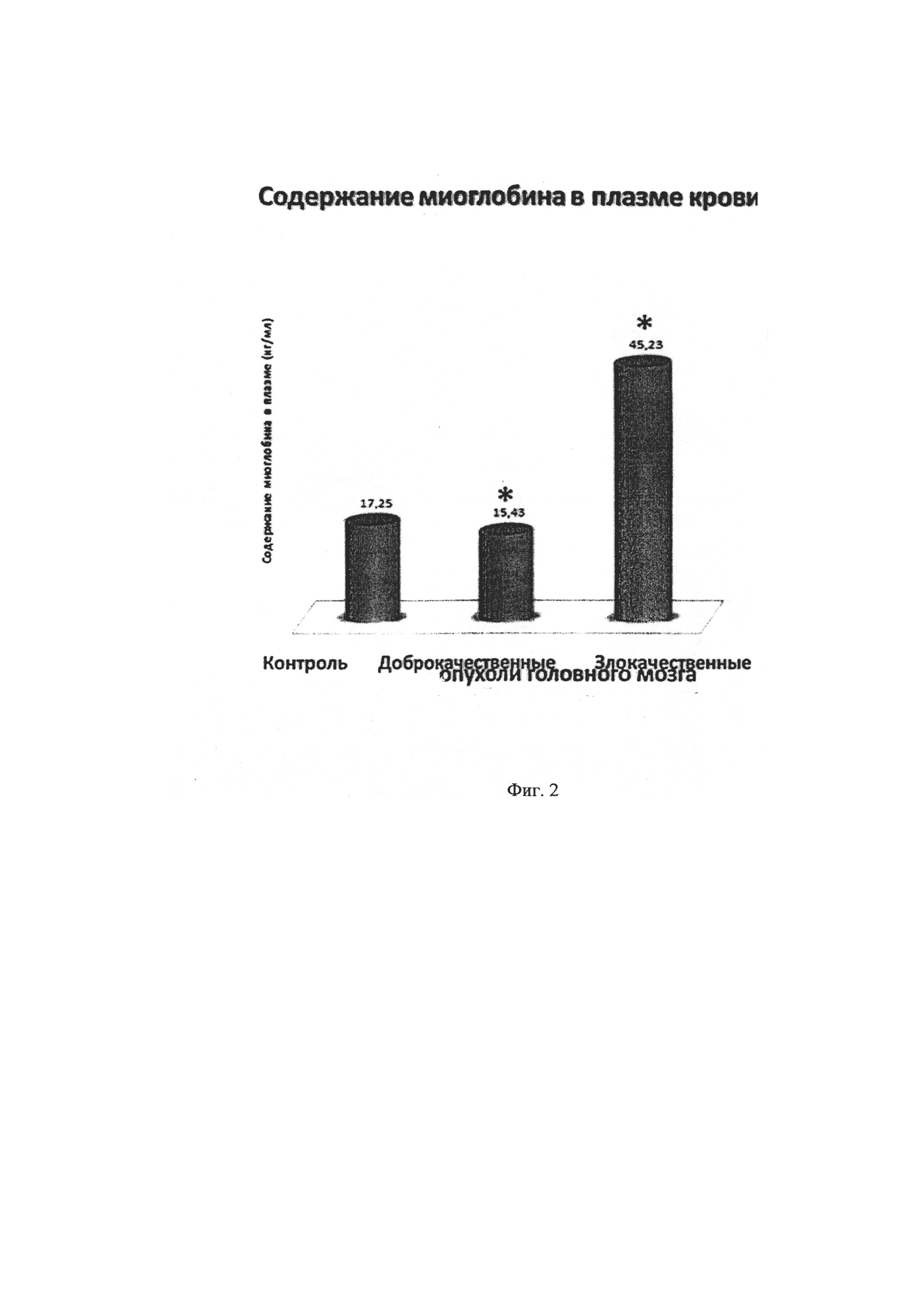
На фиг. 2. изображена диаграмма содержания миоглобина в плазме крови при опухолях головного мозга: с доброкачественными опухолями головного мозга, со злокачественными опухолями головного мозга, у практически здоровых людей (контроль)
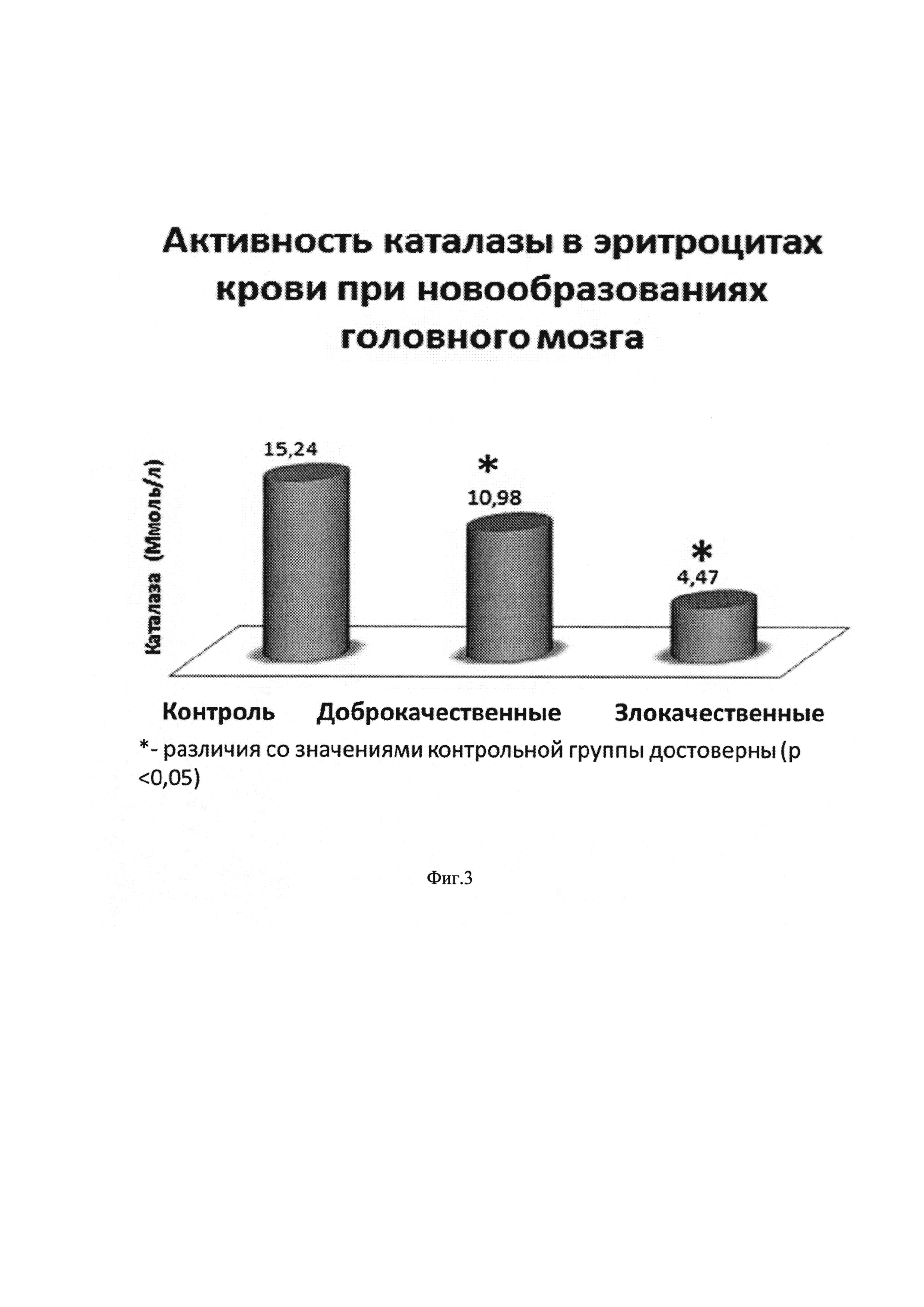
На фиг. 3 изображена диаграмма активности каталазы эритроцитов при опухолях головного мозга: с доброкачественными опухолями головного мозга, со злокачественными опухолями головного мозга, у практически здоровых людей (контроль). * - различия с показателями контрольной группы достоверны (p<0,05)
На фиг. 4 изображена диаграмма суммарной активности ацетилхолинэстеразы цельной крови при опухолях головного мозга: с доброкачественными опухолями головного мозга, со злокачественными опухолями головного мозга, у практически здоровых людей (контроль). * - различия с показателями контрольной группы достоверны (p<0,05)
Свободнорадикальная активность плазмы крови значимо возрастала при злокачественных новообразованиях головного мозга по сравнению с практически здоровыми людьми и людьми с доброкачественными новообразованиями более, чем в 15 и 2,5 раз соответственно (фиг. 1).
Уровень миоглобина в плазме крови при злокачественных опухолях головного мозга превышает таковые значения у практически здоровых людей контрольной группы на 24%. При этом количество гемпротеина в плазме при глиомах с низкой степенью анаплазии и доброкачественных новообразованиях значимо не отличается от нормальных показаний (фиг. 2)
Активность каталазы в эритроцитах была значимо ниже при опухолях головного мозга по сравнению с практически здоровыми людьми (фиг. 3). При злокачественных новообразованиях головного мозга активность каталазы снижалась более значительно - более, чем в 3 раза, чем при доброкачественных опухолях - в 1,4 раза.
Суммарная активность холинэстеразы крови была значимо ниже (на 29%) у пациентов со злокачественными опухолями головного мозга по сравнению с практически здоровыми людьми (24,36±5,72 мг/мл/час/0,1 г Нв) (фиг. 4).
Предлагаемый способ осуществляют следующим образом.
У больного из кубитальной вены берут кровь объемом 10 мл в пробирку с цитратом в качестве антикоагулянта. Определение активности ацетилхолинэстеразы осуществляют в цельной крови 0,5 мл крови разводят дистиллированной водой до общего объема 10 мл (разведение в 20 раз). В пробирки последовательно приливают по 1,5 мл 1/15М фосфатного буфера рН=7,8; 0,5 мл воды (в контроль на реактивы - 0,3 мл воды и 0,2 мл 1% раствора прозерина) и 1 мл крови, разведенной в 20 раз. Пробирки термостатируют 15 минут при 25°С, затем к ним приливают по 1 мл 0,4% ацетилхолингидрохлорида и вновь инкубируют 30 минут. По окончании добавляют по 1 мл 25% трихлоруксусной кислоты, содержимое перемешивают, центрифугируют 15 минут при 3000 об/мин. К 1 мл центрифугата приливают по 2 мл смеси равных количеств 2М гидроксиламингидрохлорида и 3,5Н едкого натра, 1 мл соляной кислоты (1:3) и 1 мл 0,37М хлорного железа. Оптическая плотность растворов измеряют на фотоэлектрокалориметре, длина волны 490 нм; кювета 5 мм против воды. Расчет производят по формуле.
Определение концентрации миоглобина свободнорадикальной активности осуществляют в плазме крови. Для этого цельную кровь центрифугируют при 3000 об/мин в течение 10 мин и разделяют эритроциты и плазму.
Определение миоглобина осуществляют эритроцитарным методом (для определения кратности разведения) и иммунотурбодиметрическим - для окончательного анализа концентрации миоглобина. В 24 лунки полистиролового планшета вносят по 50 мкл 0,9% раствора хлорида натрия. В первую лунку добавляют 50 мкл плазмы и последовательно переносят 50 мкл раствора образца из лунки в лунку, в результате чего получают разведения 1:2; 1:4; 1:8 и т.д. Последняя лунка контрольная, образец крови туда не добавляют. Потом в каждую лунку последовательно вносят по 25 мкл ресуспензированной взвеси формалинизированных эритроцитов, сенсибилизированных антителами против миоглобина. Затем содержимое лунок перемешивают и оставляют инкубироваться в течение 30 минут. Учет результатов проводят на основании визуальной оценки наличия гемагглютинации в зависимости от степени разведения исследуемого образца с использованием таблицы соответствия количества миоглобина и величины титра.
Определив концентрацию миоглобина полуколичественным способом, оценивают необходимость разведения образца и проводят иммунотурбидиметрический тест.
Для этого в пробирку наливают 60 мкл плазмы и добавляют 1800 мкл реагента 1, содержащего 1,5% раствор глицина в буфере рН 8,3, после чего тщательно перемешивают и инкубируют на водяной бане 5 минут. Затем добавляют 600 мкл реагента 2, содержащего латексные частицы, покрытые антителами к миоглобину, в 1,5% растворе глицина в буфере рН 7,3, тщательно перемешивают и в течение 30 секунд измеряют оптическую плотность на спектрофотометре при длине волны 580 нм.
Далее инкубируют на водяной бане 5 минут и снова измеряют оптическую плотность при длине волны 580 нм. Расчет разницы значений оптических плотностей производят по формуле: дельта D=D2-D1.
Для расчета концентрации миоглобина используют калибровочную кривую. Свободнорадикальную активность плазмы крови анализируют методом индуцированной биохемилюминесценции. Для этого в измерительную кювету вносят 0,1 мл плазмы крови; 0,4 мл фосфатного буфера (pH=7,5) и 0,4 мл раствора сульфата железа (0,05 мМ). В кювету, устанавленную в кюветодержателе биохемилюминометра вносят 0,2 мл 2% раствора перекиси водорода, затем поворачивают ручку кюветного блока на 180 градусов против часовой стрелки до упора. На дисплее появляется окно «Измерение» и начинается регистрация кинетической кривой сигнала хемилюминесценции. По окончании заданного времени (30 сек.), измерение прерывается и происходит обсчет необходимых параметров хемилюминесцентного сигнала. Программа переходит в окно обработки, на котором появляется карта опыта, на которой приведен нормированный график кинетики хемилюминесценции и рассчитанные параметры сигнала (Imax, S, a, Z, tg1, tg2, Inc, Dec). В данной работе рассматривают показатель Imax.
Активность каталазы определяют в эритроцитах. Эритроциты отмывают центрифугируя при 3000 об/мин с 0,9% раствором хлорида натрия.
С отмытыми эритроцитами/гомогенатом получают следующие разведения:
> I разведение - в пробирку наливают 0.2 мл «отмытых» эритроцитов / гомогената, добавляют 3.8 мл трис-ацетатного буфера (ТАЕ), рН=8,0
> II разведение - в пробирку наливают 0.1 мл I разведения и 4.9 мл фосфатного буфера, рН=7.5
Далее производят следующие измерения:
> В кювету для спектрофотометра наливают:
1. 1,0 мл II разведения и 2,0 мл фосфатного буфера. По прошествии 60 секунд фиксируют полученное значение активности каталазы Е1.
2. 1,0 мл заранее приготовленной перекиси водорода и 2,0 мл фосфатного буфера. Полученное численное значение Е2 должно находиться в диапазоне от 0,320 до 0,340 мкатмг/.
3. 1,0 мл I разведения, 1,0 мл фосфатного буфера и 1,0 мл H2O2 - результатом спектрофотометрии является полученное значение активности каталазы Е3.
После указанных измерений высчитывают значение каталазы по формуле:
Е=(Е1-E3)*V*t*K - для каталазы крови
Е=(Е1-E3)*V*t*Km - для каталазы тканей головного мозга,
где Е - активность каталазы (мкатмг/),
V - объем вносимой пробы (0,003 л), t - время инкубации (60 с), m - масса ткани во вносимой пробе (мг). K - коэффициент миллимолярной экстинции перекиси водорода (22.2⋅103 мМ-1⋅см-1).
Пересчет: 1 ммольмин/=0.01667 мкат.
Исследуют свободнорадикальную активность и содержание миоглобина в плазме крови, содержание каталазы эритроцитов и ацетилхолинэстеразы цельной крови и при увеличении свободнорадикальной активности плазмы крови более чем на 500% от физиологической нормы 1,25±0,12 mV, и увеличении содержания миоглобина более чем на 25% от физиологической нормы миоглобина плазмы крови 22,63±6,33 нг/мл, при одновременном снижении активности каталазы эритроцитов более чем на 33% от физиологической нормы 15,24±3,21 мМ/л и снижении активности ацетилхолинэстеразы цельной крови более чем на 35% от физиологической нормы 24,36±5,72 мг/мл/час/0,1 г Нв диагностируют злокачественное новообразование головного мозга.
Примеры конкретного исполнения даны в виде выписок из истории болезни
Пример 1
Пациент О., 43 года. Поступила в нейрохирургическую клинику с диагнозом: объемное образование (глиома?) левой лобно-теменно-височной доли.
Жалобы: слабость в конечностях справа, редкие приступы эпилепсии.
Анамнез: болеет около года. Когда впервые появились судороги. На протяжении последнего месяца присоединилась слабость в конечностях. После выявления опухоли на МРТ больной направлен к нейрохирургу.
Неврологически: сознание ясное, ориентирована, критична, анизорефлексия D>S, положителен симптом Барре справа, гемипарез справа до 4,5 баллов.
По данным МРТ с контрастным усилением от 07.12.16 опухоль 9X5 см в задне-лобной области с медиальным распространением.
При поступлении в стационар до начала терапевтических мероприятий осуществлен анализ биохимических параметров крови пациентки О., 43 года: активность каталазы = 10,98 мМ/л, ацетилхолинэстеразы = 19,2 мг/мл/час/0,1 гНв, концентрация миоглобина = 5 нг/мл и свободнорадикальная активность Imax = 6,96 mV. Таким образом:
- наблюдаемое снижение активности каталазы эритроцитов пациентки О. равно 27,95%, что менее 33%;
- наблюдаемое снижение активности ацетилхолинэстеразы крови пациентки О. равно 21,18%, что менее 35%;
- содержание миоглобина в плазме крови не увеличено;
- наблюдаемое увеличение свободнорадикальной активности плазмы крови пациентки О. равно 457%, что менее 500%;
что свидетельствует об отсутствии у нее опухоли высокой степени злокачественности.
Предварительный диагноз: опухоль (глиома) низкой степени анаплазии.
Больная оперирована 12.12.16 - удаление опухоли.
Гистологическое исследование от 21.12.16: гистологическая картина и иммунофенотип опухоли соответствуют фибриллярной астроцитоме, ICD-O code 9420/3, grade 2.
Таким образом, у больной на 9е сутки в послеоперационном периоде диагностирована глиома низкой степени злокачественности.
Пример 2.
Пациентка Б., 71 год. Поступила в клинику с диагнозом: объемное образование левой височной доли.
Жалобы: сильная головная боль, тошнота, нарушения речи.
Анамнез: болеет на протяжении 2 месяцев, когда стала беспокоить головная боль, нарушения речи присоединились около месяца. При МРТ выявлена опухоль височной доли.
Неврологически: сознание ясное, ориентирована, критична, элементы сенсорно-амнестической афазии, анизорефлексия D>S, положителен симптом Барре справа, падение в позе Ромберга.
По данным МРТ с контрастным усилением от 06.12.16 опухоль 6X6 см в задне-лобной области с распространениеним в направлении зоны Вернике с кистозным компонентом. При поступлении в стационар до начала терапевтических мероприятий осуществлен анализ биохимических параметров крови пациентки Б., 71 год: активность каталазы = 5,48 мМ/л, ацетилхолинэстеразы = 11,4 мг/мл/час/0,1 гНв, концентрация миоглобина = 67 нг/мл и свободнорадикальная активность Imax = 9,01 mV. Таким образом:
- наблюдаемое снижение активности каталазы эритроцитов пациентки Б. равно 64,05%, что более 33%;
- наблюдаемое снижение активности ацетилхолинэстеразы крови пациентки Б. равно 53,20%, что более 35%;
- наблюдаемое увеличение содержания миоглобина в плазме крови пациентки Б. равно 347%, что более 25%;
- наблюдаемое увеличение свободнорадикальной активности плазмы крови пациентки Б. равно 621%, что более 500%;
что свидетельствует о наличии у нее опухоли высокой степени злокачественности.
Предварительный диагноз: опухоль (глиома) высокой степени злокачественности.
Операция 20.12.16. - удаление опухоли. Послеоперационный период протекал без осложнений. Проводилась противовоспалительная, аналгезирующая терапия: Amoxiclavi 1,2 гр в/венно, Ketonali 2 мл в/м.
Гистологическое исследование от 29.12.16 гистологическая картина глиобластомы, ICD-O code 9440/3, grade 4.
Таким образом, у больной на 8е сутки в послеоперационном периоде диагностирована глиома высокой степени злокачественности.
Способ диагностики злокачественных новообразований головного мозга, включающий исследование плазмы крови инструментальными методами исследования и постановку диагноза, отличающийся тем, что исследуют свободнорадикальную активность и содержание миоглобина плазмы крови, каталазы эритроцитов, ацетилхолинэстеразы цельной крови и при увеличении свободнорадикальной активности плазмы крови более чем на 500% от физиологической нормы 1,25±0,12 mV и увеличении содержания миоглобина более чем на 25% от физиологической нормы миоглобина плазмы крови 22,63±6,33 нг/мл, при одновременном снижении активности каталазы эритроцитов более чем на 33% от физиологической нормы 15,24±3,21 мМ/л и снижении активности ацетилхолинэстеразы цельной крови более чем на 35% от физиологической нормы 24,36±5,72 мг/мл/час/0,1 г Нв диагностируют злокачественное новообразование головного мозга.