Результат интеллектуальной деятельности: АЗАКРАУНСОДЕРЖАЩИЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
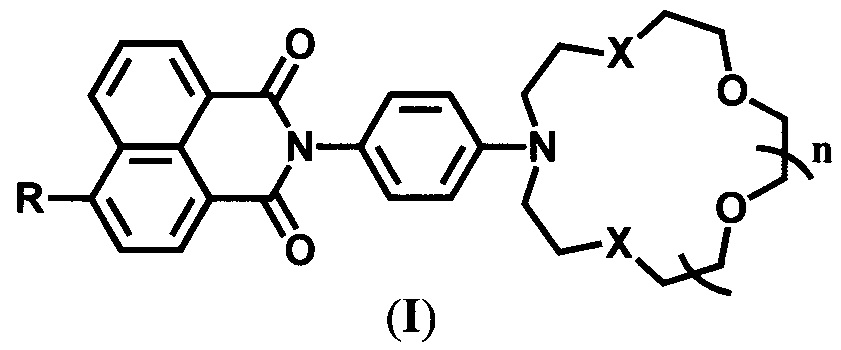
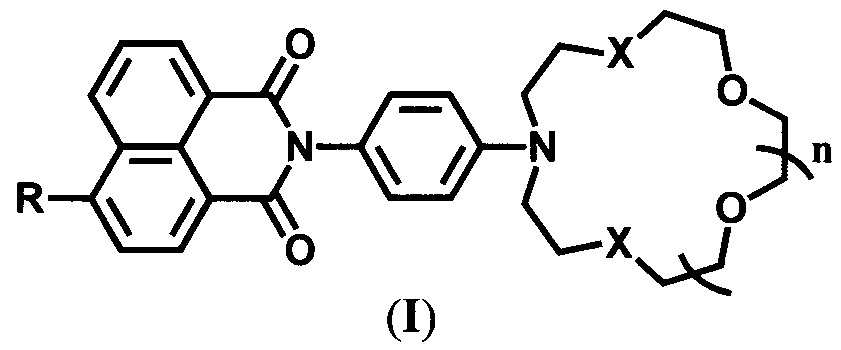
Настоящее изобретение относится к органической и аналитической химии, а именно к новым 4-замещенным N-арил-1,8-нафталимидам, содержащим в N-арильном заместителе остаток азакраун-эфира с различной комбинацией атомов кислорода и серы, общей формулы (I),
 ,
,
где R=NH2, NHCH2CH=CH2 при X=O и n=2 и R=NH2, OMe, NHCOCH3, NHCH2CH=CH2 при X=S и n=1, которые являются флуоресцентными сенсорами на катионы ряда металлов, и к способу их получения.
Заявляемые соединения и способ их получения в литературе не описаны.
Изобретение наиболее успешно может быть использовано для создания оптических хемосенсоров, позволяющих оперативно контролировать концентрации примесей в различных жидкостях, применимых на предприятиях, производящих или использующих опасные химические вещества, в пищевой промышленности, медицине и других областях, в частности для контроля за состоянием окружающей среды.
Оптические хемосенсоры - это соединения, молекулы которых состоят из двух принципиально важных частей: рецептора, который способен селективно связываться с субстратом, и сигнального фрагмента, который меняет свои спектральные характеристики при комплексообразовании.
Заявляемые соединения содержат азакраун-эфирный и 4-замещенный 1,8-нафталимидный фрагменты, связанные между собой через атомы азота 1,4-фениленовой группой.
Фотоактивной составляющей в заявляемых соединениях является N-арил-1,8-нафталимидная хромофорная система, которая представляет собой одну из наиболее популярных платформ для создания молекулярных оптических сенсоров на катионы металлов [Панченко П.А., Федорова О.А., Федоров Ю.В. Флуоресцентные и колориметрические хемосенсоры на катионы на основе производных 1,8-нафталимида: принципы дизайна и механизмы возникновения оптического сигнала. Успехи химии, 83 (2), 155-182], ионофорной составляющей, способной связывать катионы металлов, являются краун-эфирные группы.
Варьирование краун-эфирного заместителя (природы и количества гетероатомов) позволяет изменять селективность связывания, а изменение места введения краун-эфирной группы в фотоактивные производные 1,8-нафталимида - интенсивность оптического отклика при комплексообразовании. Однако в настоящее время отсутствуют подходы, позволяющие коррелировать интенсивность оптического отклика и другие свойства со структурой сенсоров на основе 1,8-нафталимидов.
Получать производные 1,8-нафталимида, содержащие краун-эфирные фрагменты, начали с конца 1990-х годов.
Так, для флуоресцентного определения катионов щелочных металлов были предложены иммобилизованные на аминомодифицированной целлюлозе 4-аралкиламино-N-(4-карбоксифенил)-1,8-нафталимиды, содержащие моноаза-15-краун-5-эфирный [патент США US 5952491 (1999)] или диазакриптандный [патент США US 6124135 (2000)] фрагмент в арильной группе заместителя при С-4.
Известны N-фенил-1,8-нафталимиды, содержащие аза-15-краун-5-эфирный или диаза-18-краун-6-эфирный рецептор, связанный атомом азота с атомом углерода в положении 4 нафталимидного ядра, и изучены их сенсорные свойства в отношении Ca2+ [Panchenko Р.А., Fedorov Y.V., Fedorova О.А., Jonusauskas G. Comparative analysis of the PET and ICT sensor properties of 1,8-naphthalimides containing aza-15-crown-5-ether moiety. Dyes and Pigments, 2013, 98 (3), 347-357; Ощепков A.C., Ощепков M.C., Панченко П.А., Анисимов А.В., Федоров Ю.В., Федорова О.А. Синтез и спектрально-люминесцентные свойства азакраунсодержащих нафталимидов и их комплексов с катионами металлов. Успехи в химии и химической технологии, 2011, 25, №4 (120), 69-74].
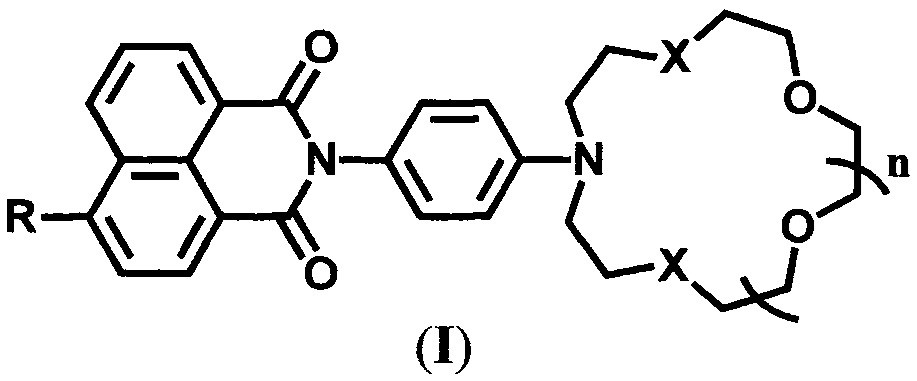
Известны 4-замещенные N-арил-1,8-нафталимиды, проявляющие свойства флуоресцентных сенсоров на катионы металлов, которые содержат краун-эфирные рецепторы в составе N-арильного фрагмента молекулы:
1) аннелированные с бензольным кольцом
 ,
,
где R=NH2, NHAc; X=O; n=1
[Панченко П.А., Федоров Ю.В., Федорова О.А., Перевалов В.П., Йонушаускас Г. Синтез и спектрально-люминесцентные свойства 4-(ацетил)амино-N-арилнафталимидов, содержащих электронодонорные группы в N-арильном заместителе. Изв. АН. Сер. хим., 2009, №6, 1199-12064; Panchenko Р.А., Fedorov Y.V., Perevalov V.P., Jonusauskas G., Fedorova O.A. Cation-dependent fluorescent properties of naphthalimide derivatives with N-benzocrown ether fragment. J. Phys. Chem. A, 2010, 114 (12), 4118-4122; Panchenko P.A., Fedorov Y.V., Fedorova O.A., Izmailov B.A., Vasnev V.A., Istratov V.V., Makeeva E.A., Rumyantseva M.N., Gaskov A.M. Hybrid sensor materials based on tin (IV) oxide and crown-containing 4-amino-1,8-naphthalimides. Mendeleev Commun., 2011, 21 (1), 12-14]; R=1,5-дифенил-Δ2-пиразолин-3-ил; X=O; n=1 [Sergeeva A.N., Panchenko P.A., Fedorov Y.V., Fedorova O.A. Synthesis and sensor properties of crown-containing derivatives of 4-(1,5-diphenyl-Δ2-pyrazolin-3-yl)-1,8-naphthalimide. Protection of Metals and Physical Chemistry of Surfaces, 2012, 48 (5), 524-533]; R=NH2, NHAc, OMe; X=S, n=1; X=NMe, n=1,2 [RU 2515195, Бюл. №13 (2014)], и
2) связанные с бензольным кольцом связью С-N
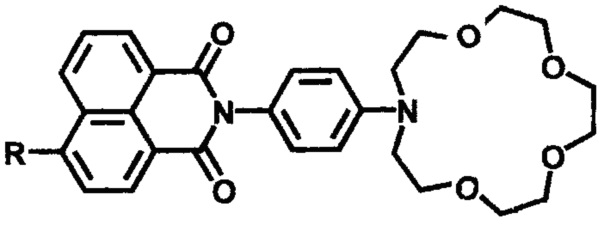 ,
,
где R=NH2 [Panchenko Р.А., Fedorov Y.V., Fedorova O.A., Izmailov B.A., Vasnev V.A., Istratov V.V., Makeeva E.A., Rumyantseva M.N., Gaskov A.M. Hybrid sensor materials based on tin (IV) oxide and crown-containing 4-amino-1,8-naphthalimides. Mendeleev Commun., 2011, 21 (1), 12-14]; R=NH2, NHAc [Panchenko P.A., Fedorov Y.V., Fedorova O.A., Jonusauskas G. Comparative analysis of the PET and ICT sensor properties of 1,8-naphthalimides containing aza-15-crown-5-ether moiety. Dyes and Pigments, 2013, 98 (3), 347-357]; R=1,5-дифенил-Δ2-пиразолин-3-ил [Sergeeva A.N., Panchenko P.A., Fedorov Y.V., Fedorova O.A. Synthesis and sensor properties of crown-containing derivatives of 4-(1,5-diphenyl-Δ2-pyrazolin-3-yl)-1,8-naphthalimide. Protection of Metals and Physical Chemistry of Surfaces, 2012, 48 (5), 524-533].
Однако известные сенсоры, представляющие собой 4-замещенные N-арил-1,8-нафталимиды с краун-эфирными группами, обеспечивают лишь незначительное увеличение интенсивности флуоресценции в видимой части спектра в процессе детектирования катионов металлов и, кроме того, они не могут быть введены в состав полимерной матрицы в целях создания оптических датчиков, применимых для оперативного контроля концентраций примесей в жидкостях.
Задача изобретения - создание новых соединений, являющихся эффективными флуоресцентными сенсорами на катионы металлов, разработка способа их получения и синтез полимерных сенсоров.
Поставленная задача решается новыми соединениями общей формулы (I)
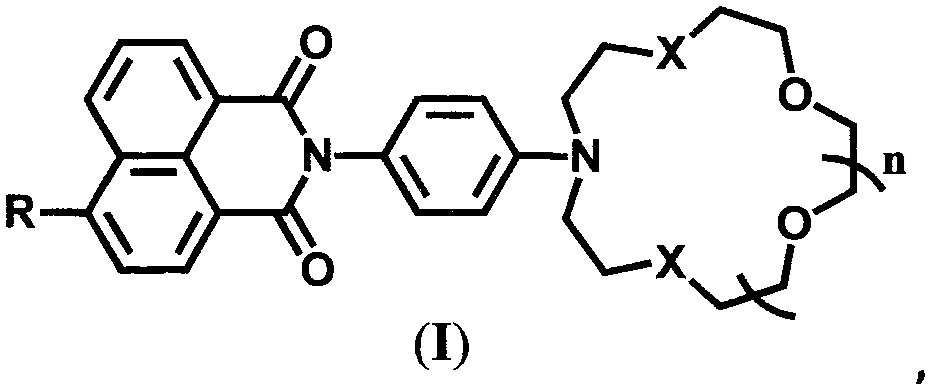
где R=NH2, NHCH2CH=CH2 при X=O и n=2 и R=NH2, OMe, NHCOCH3, NHCH2CH=CH2 при X=S и n=1, которые являются флуоресцентными сенсорами на катионы щелочно-земельных, переходных и тяжелых металлов, и способом их получения, включающим ацилирование N-(4-аминофенил)аза-18-краун-6-эфира или N-(4-аминофенил)азадитиа-15-краун-5-эфира 4-нитро-1,8-нафталевым ангидридом и либо восстановление нитрогруппы в образующемся 4-нитро-1,8-нафталимиде либо ее замещение нуклеофильным реагентом, причем ацилирование проводят в 80%-ной уксусной кислоте при кипячении, восстановление нитрогруппы осуществляют гидразингидратом в присутствии никеля Ренея, а качестве нуклеофильного реагента используют метилат натрия в метаноле или аллиламин. Заявляемые соединения формулы (I), в которых R=NHCH2CH=CH2, могут использоваться в качестве мономеров для получения флуоресцентных сенсорных полимеров.
Схема получения азакраунсодержащих 1,8-нафталимидов по настоящему изобретению представлена ниже.
Схема
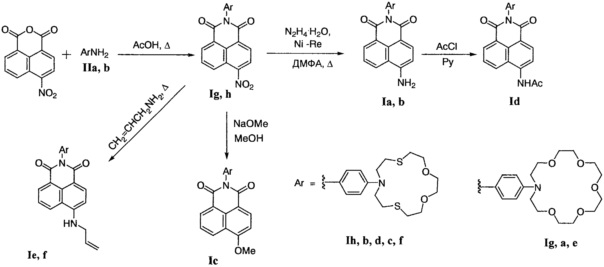
В качестве исходных соединений для получения нафталимидов формулы (I) используют 4-нитро-1,8-нафталевый ангидрид и ароматические амины формулы (II), которые содержат остаток соответствующего азакраун-эфира.
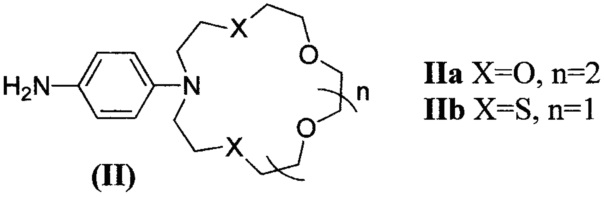
Ариламин IIa - N-(4-аминофенил)аза-18-краун-6-эфир - представляет собой известное соединение [Deveci Р., Taner B., 
 Solak А.О.,
Solak А.О.,  Synthesis, enhanced spectroscopic characterization and electrochemical grafting of N-(4-aminophenyl)aza-18-crown-6: Application of DEPT, HETCOR, HMBC-NMR and X-ray photoelectron spectroscopy // Journal of Molecular Structure, 2010, 982 (1-3), 162-168].
Synthesis, enhanced spectroscopic characterization and electrochemical grafting of N-(4-aminophenyl)aza-18-crown-6: Application of DEPT, HETCOR, HMBC-NMR and X-ray photoelectron spectroscopy // Journal of Molecular Structure, 2010, 982 (1-3), 162-168].
Ариламин IIb - N-(4-аминофенил)азадитиа-15-краун-5-эфир - также известное соединение [Tian М., Ihmels Н. Selective Colorimetric Detection of Hg2+ and Mg2+ with Crown Ether Substituted N-Aryl-9-aminobenzo[b]quinolizinium Derivatives // European Journal of Organic Chemistry, 2011, 2011 (22), 4145-4153].
Взаимодействие 4-нитро-1,8-нафталевого ангидрида с ариламином (IIa или IIb) проводят при 1.5-часовом кипячении в 80%-ной уксусной кислоте и получают соответствующий 4-нитро-1,8-нафталимид (Ig или Ih).
После введения азакраун-эфирного фрагмента в структуру флуорофора все последующие превращения затрагивают только заместители в положении 4 нафталимидного фрагмента.
Восстановление 4-нитро-1,8-нафталимида Ig или Ih гидразингидратом над никелем Ренея при нагревании в диоксане или этаноле приводит к образованию 4-амино-1,8-нафталимида Ia или Ib соответственно.
Из 4-аминопроизводного Ib действием хлористого ацетила в ДМФА в присутствии пиридина для связывания HCl с выходом 60% получают ацетамид Id.
4-Метокси-1,8-нафталимид Ic получают нуклеофильным замещением нитрогруппы в соединении If под действием метилата натрия в метаноле с выходом 90%.
Взаимодействие 4-нитро-1,8-нафталимида Ig или Ih с аллиламином при длительном нагревании при 60°C приводит к соответствующему 4-аллиламинопроизводному Ie или If с выходом 68-69%.
Строение всех полученных соединений доказано с помощью ЯМР- и УФ-спектроскопии, а также подтверждено данными элементного и масс-спектрометрического анализа.
Необходимые для осуществления заявляемого способа исходные соединения и реагенты, такие как 4-нитро-1,8-нафталевый ангидрид, аллиламин, гидразингидрат, метанол, металлический натрий, ацетилхлорид, уксусная кислота, сплав никеля с алюминием, N,N-диметилакриламид, персульфат аммония, тетраметилэтилендиамин, а также органические растворители и силикагель являются коммерчески доступными материалами.
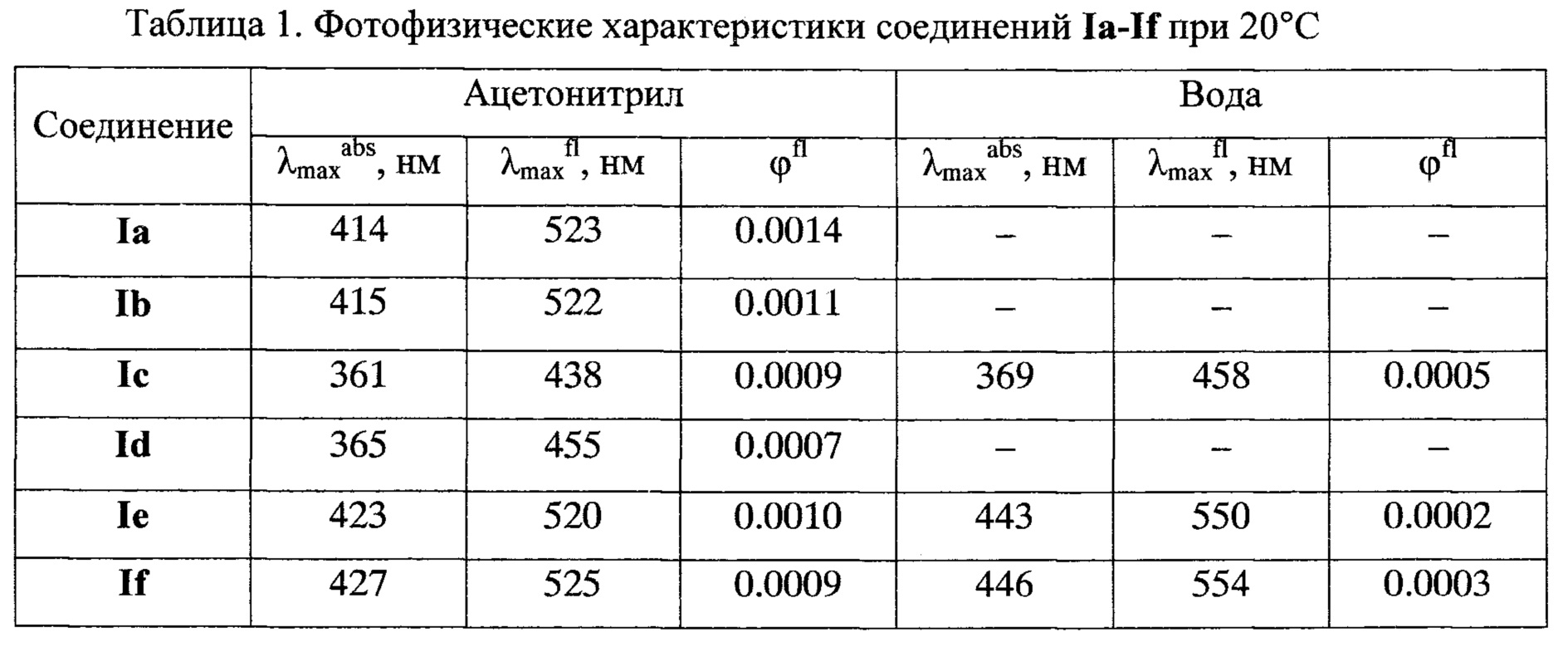
Исследование спектрального поведения заявляемых азакраунсодержащих N-арил-1,8-нафталимидов Ia-If показало, что эти соединения обладают флуоресцентными свойствами (см. табл. 1) и проявляют высокую сенсорную активность по отношению к катионам металлов как в ацетонитрильном, так и в водном растворе (см. табл. 2). За счет варьирования количества и природы гетероатомов в макроцикле достигается различная селективность к катионам металлов. Так, например, неожиданно оказалось, что для азадитиакраунсодержащего ацетамида Id в ацетонитриле интенсивность флуоресценции в присутствии катионов ртути увеличивается в 861 раз, влияние катионов серебра и меди проявляется существенно в меньшей степени, тогда как в отношении других катионов флуоресцентный отклик не наблюдается. Азадитиакраунсодержащий амин Ib в ацетонитриле селективно связывается с катионами ртути, интенсивность его флуоресценции при этом возрастает в 325 раз. Метоксипроизводное Ic азадитиакраунсодержащего нафталимида в ацетонитриле взаимодействует с катионами ртути, свинца и железа (II). При этом наблюдается увеличение интенсивности его флуоресценции в 511, 415 и 248 раз соответственно. Однако в воде соединение Ic демонстрирует селективность практически только к катионам ртути: интенсивность флуоресценции возрастает в 121 раз.
Значительное изменение интенсивности флуоресценции при комплексообразовании облегчает визуальное определение присутствия катионов при концентрациях до 10-6 моль/л.
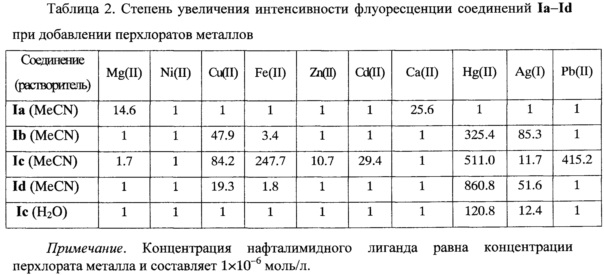
Селективный флуоресцентный отклик нафталимидов Ia-Id на катионы двухвалентных ртути, кадмия, железа, меди, кальция, свинца и одновалентного серебра, который был неожиданно обнаружен, позволяет использовать эти соединения при разработке флуоресцентных сенсоров на перечисленные выше катионы.
Заявляемые новые флуоресцентные сенсоры обладают близкими оптическими характеристиками (значения λmaxabs, λmaxfl в табл. 1), но различаются величиной флуоресцентного отклика при связывании катионов различных металлов. Это позволяет использовать их для построения химических чипов для мультиионного анализа в неводных и водных средах, предполагающего наличие линейки сенсоров различной селективности, но со сходными спектральными характеристиками, поскольку сканирование флуоресцентного сигнала удобно осуществлять с использованием одной постоянной длины волны возбуждения/регистрации. Мультиионные чипы имеют хорошо разработанную техническую базу, однако требуют широкого ассортимента разнообразных по селективности и оптическому отклику флуороионофоров.
Преимуществом предлагаемых новых сенсоров является увеличение степени интенсивности флуоресценции до 860 раз в видимой области спектра, возникающее в процессе детектирования катионов металлов, что почти на два порядка выше, чем в случае известных в настоящее время флуорофорных N-арил-1,8-нафталимидных сенсоров, содержащих краун-эфирные фрагменты [RU 2515195, Бюл. №13 (2014)]. Это обстоятельство облегчает визуальный способ определения катиона металла при концентрации 10-6 моль/л и делает его количественный анализ более точным.
Разработанные новые флуоресцентные соединения Ie, If, содержащие аллиламиногруппу в 4-м положении 1,8-нафталимидного ядра, были ковалентно введены в полимерные матрицы по реакции радикальной сополимеризации с N,N-диметилакриламидом с образованием как растворимых полимеров, так и полимерных гелей. Исследование полученных полимеров показало, что они обладают флуоресцентными свойствами и оптическим откликом на катионы металлов. В частности, образцы, полученные из соединения Ie в примере 9, демонстрируют увеличение интенсивности флуоресценции в присутствии катионов кальция в 3 раза, катионов бария - в 10 раз.
Техническим результатом настоящего изобретения являются новые азакраунсодержащие N-арил-1,8-нафталимиды, применимые в качестве флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов, а также в качестве мономеров для полимерных флуоресцентных сенсоров.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 2-[4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)фенил]-6-нитро-1H-бензо[d,e]изохинолин-1,3(2H)-диона (Ih). К суспензии 0.3 г (1.2 ммоль) 4-нитро-1,8-нафталевого ангидрида в 4 мл 80%-ной водной уксусной кислоты прибавляют 0.6 г (1.6 ммоль) азакраунсодержащего ариламина IIb. Реакционную массу нагревают до кипения, кипятят 1.5 ч, охлаждают до комнатной температуры. Выпавший осадок нитропроизводного N-арилнафталимида Ih отфильтровывают, промывают на фильтре 5%-ной соляной кислотой, горячим 10%-ным раствором Na2CO3, водой и этиловым спиртом, затем сушат при 80°C. Получают 0.53 г (76%) соединения Ih. Т. пл. 259-262°C.
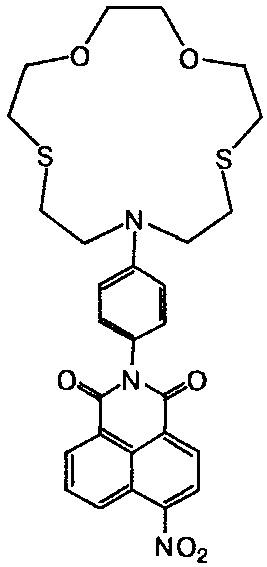
Спектр 1H ЯМР (300.13 МГц, ДМСО-d6, 24°C), δ, м.д. (J, Гц): 2.72-2.93 (м, 8Н, 16CH2, 17CH2, 22CH2, 23CH2), 3.56-3.77 (м, 12Н, 15CH2, 18CH2, 19CH2, 20CH2, 21CH2, 24CH2), 6.71 (д, 2Н, 11H, 13Н, 3J=8.9), 7.15 (д, 2Н, 10Н, 14Н, 3J=8.9), 8.12 (дд, 1Н, 6Н, 3J=7.3, 3J=6.8), 8.58 (д, 1H, 3H, 3J=8.1), 8.60 (д, 1H, 2Н, 3J=8.1), 8.63 (д, 1H, 7Н, 3J=7.3), 8.75 (д, 1H, 5Н, 3J=8.6). Спектр 13C ЯМР (100.62 МГц, ДМСО-d6, 27°C), δ, м.д.: 29.01 (2×CH2S), 30.58 (2×CH2S), 51.36 (2×CH2N), 70.04 (2×CH2O), 73.01 (2×CH2O), 111.30 (11C, 13C), 122.84 (4aC), 123.42 (9C или 8C), 123.47 (8C или 9С), 124.29 (3С), 127.40 (1C), 128.71 (5С, 8аС), 129.57 (2С, 10С, 14С), 130.14 (6С), 131.69 (7С), 146.53 (12С), 149.15 (4С), 162.73 (8bC), 163.53 (8сС). Масс-спектр (ESI), m/z: 568.04 [M+H]+, 590.06 [M+Na]+ (вычислено: M 568.16). Найдено, %: C 59.32; H 5.19; N 7.39. C28H29N3O6S2. Вычислено, %: C 59.24; H 5.15; N 7.40.
Пример 2. Получение 6-амино-2-[4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)фенил]-1H-бензо[d,е]изохинолин-1,3(2Н)-диона (Ib)
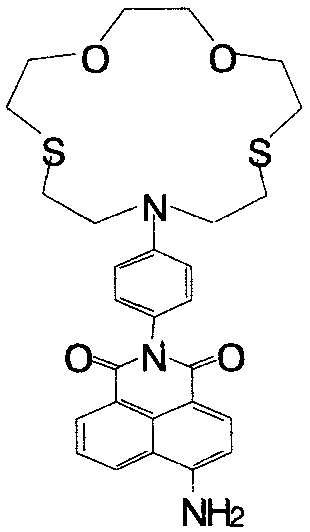
К раствору 0.35 ммоль нитросоединения Ih в 13 мл 1,4-диоксана, нагретого до 90°C, прибавляют 1.5 мл гидразингидрата. В полученный раствор при интенсивном перемешивании порциями в течение 30 мин вносят скелетный никелевый катализатор, приготовленный из 0.9 г сплава Ni-Al с массовой долей никеля 50%. Реакционную массу выдерживают при 90°C в течение 1 ч, затем охлаждают до комнатной температуры. Катализатор отфильтровывают, фильтрат упаривают в вакууме. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь бензол - этанол (градиентное элюирование). Выход соединения Ib 37%. Т. пл. 279°C (с разл). Спектр 1H ЯМР (300.13 МГц, ДМСО-d6, 24°C), δ, м.д. (J, Гц): 2.68-2.94 (м, 8Н, 16CH2, 17CH2, 22CH2, 23CH2), 3.52-3.79 (м, 12Н, 15CH2, 18CH2, 19CH2, 20CH2, 21CH2, 24CH2), 6.67 (д, 2Н, 11H, 13Н, 3J=8.7), 6.86 (д, 1H, 3Н, 3J=8.3), 7.04 (д, 2Н, 10Н, 14Н, 3J=8.7), 7.44 (уш.с, 2Н, NH2), 7.61-7.72 (м, 1H, 6Н), 8.18 (д, 1H, 2Н, 3J=8.3), 8.41 (д, 1H, 7Н, 3J=7.3), 8.64 (д, 1H, 5Н, 3J=8.5). Спектр 13C ЯМР (100.61 МГц, ДМСО-d6, 27°C), δ, м.д.: 29.03 (2×CH2S), 30.56 (2×CH2S), 51.38 (2×CH2N), 70.05 (2×CH2O), 73.04 (2×CH2O), 108.02 (1C), 108.18 (3С), 111.24 (11C, 13C), 119.49 (4аС), 122.39 (8С), 124.02 (6С), 124.62 (9С), 129.36 (5С), 129.81 (10С, 14С), 130.09 (8аС), 131.10 (7С), 133.99 (2С), 146.09 (12С), 152.69 (4С), 163.51 (8bC), 164.36 (8сС). УФ-спектр (CH3CN), λmax, нм (lg ε): 415 (4.07). Масс-спектр (ESI), m/z: 538.08 [M+H]+, 560.09 [M+Na]+ (вычислено: М 538.18). Найдено, %: C 62.61; H 5.83; N 7.76. C28H31N3O4S2. Вычислено, %: C 62.54; H 5.81; N 7.81.
Пример 3. Получение N-{2-[4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)фенил]-1,3-диоксо-2,3-дигидро-1H-бензо[d,e]изохинолин-6-ил}ацетамида (Id)
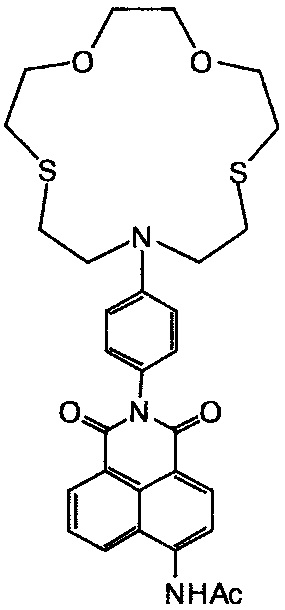
К перемешиваемой при комнатной температуре суспензии 0.03 г (0.056 ммоль) 4-аминопроизводного Ib в 0.4 мл безводного пиридина прибавляют 0.1 мл раствора ацетилхлорида в ДМФА, полученного смешением 1 мл ДМФА и 0.1 мл ацетилхлорида. Через некоторое время после прибавления ацетилхлорида образуется прозрачный раствор. Перемешивание при комнатной температуре продолжают в течение 2 ч, после чего реакционную массу разбавляют 1.0 мл этанола и оставляют на несколько часов в холодильнике. Выпавший осадок отфильтровывают и подвергают очистке методом колоночной хроматографии (носитель - силикагель, элюент - градиентная смесь бензол - этанол от 100:1 к 30:1). Масса полученного продукта Id 0.2 г (выход 60%). Т. пл. 244-246°C. Спектр 1H ЯМР (300.13 МГц, ДМСО-d6, 21°C), δ, м.д. (J, Гц): 2.30 (с, 3H, CH3), 2.68-2.94 (м, 8Н, 16CH2, 17CH2, 22CH2, 23CH2), 3.54-3.78 (м, 12Н, 15CH2, 18CH2, 19CH2, 20CH2, 21CH2, 24CH2), 6.69 (д, 2Н, 11H, 13Н, 3J=8.7), 7.11 (д, 2Н, 10Н, 14Н, 3J=8.7), 7.85-7.96 (м, 1Н, 6Н), 8.32 (д, 1H, 3Н, 3J=8.3), 8.47 (д, 1H, 2Н, 3J=8.3), 8.52 (д, 1H, 7Н, 3J=7.3), 8.74 (д, 1H, 5Н, 3J=8.5), 10.43 (уш.с, 1H, NHCO). Спектр 13C ЯМР (150.93 МГц, ДМСО-d6, 22°C), δ, м.д.: 24.11 (CH3CO), 29.03 (2×CH2S), 30.58 (2×CH2S), 51.38 (2×CH2N), 70.05 (2×CH2O), 73.01 (2×CH2O), 111.28 (11С, 13С), 118.12 (1С), 119.45 (3С), 122.96 (8С), 123.98 (9С), 124.17 (4аС), 126.42 (6С), 128.73 (8аС), 129.26 (5С), 129.72 (10С, 14С), 130.90 (7С), 131.63 (2С), 140.29 (4С), 146.34 (12С), 163.52 (8bC), 164.08 (8сС), 169.64 (CH3CO). УФ-спектр (CH3CN), λmax, нм (lg ε): 365 (4.08). Масс-спектр (ESI), m/z: 580.13 [M+H]+ (вычислено: М 580.19). Найдено, %: C 62.21; H 5.78; N 7.16. C30H33N3O5S2. Вычислено, %: C 62.15; H 5.74; N 7.25.
Пример 4. Получение 6-нитро-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадекан-16-ил)фенил]-1H-бензо[d,e]изохинолин-1,3(2H)-диона (Ig)
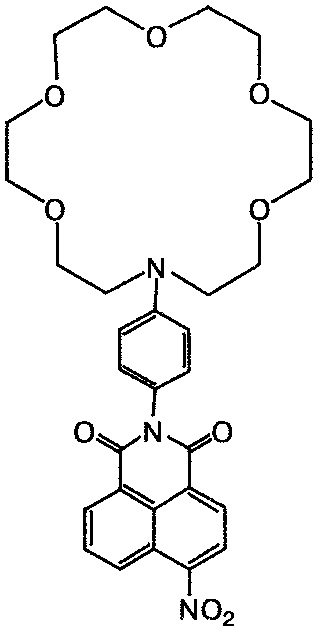
К суспензии 0.2 г (0.82 ммоль) 4-нитро-1,8-нафталевого ангидрида в 8 мл 80%-ной водной уксусной кислоты прибавляют 0.5 г (1.4 ммоль) ариламина IIa. Реакционную массу нагревают до кипения, кипятят 2,5 ч, охлаждают до комнатной температуры. Выпавший после добавления воды (50 мл) осадок соединения Ig отфильтровывают, промывают на фильтре горячим 10%-ным раствором Na2CO3, водой и этиловым спиртом. Продукт очищают колоночной хроматографией (носитель - силикагель, элюент - смесь бензол - этанол, 50:1) и получают соединение Ig в виде красноватого порошка с выходом 62%. Т. пл. 201-203°C. Спектр 1H ЯМР (CDCl3, 25°C), δ, м.д. (J, Гц): 3.66-3.74 (м, 24Н краун-эфирного фрагмента), 6.82 (д, 2Н, 11H, 13Н, J=7.6), 7.13 (д, 2Н, 10Н, 14Н, J=7.6), 8.01 (дд, 1H, 6Н, J=6.9, J=8.6), 8.43 (д, 1H, 3Н, J=8.0), 8.73 (д, 1H, 2Н, J=8.0), 8.78 (д, 1H, 7Н, J=6.9), 8.87 (д, 1H, 5Н, J=8.6). Спектр 13C ЯМР (CDCl3, 25°C), δ, м.д.: 68.1 (15С, 26С), 70.4 (16С, 18С, 23С, 25С), 76.3 (20С, 21С), 76.6 (17С, 24С), 76.9 (19С, 22С), 106.6 (1C), 108.5 (3С), 111.4 (11C), 111.5 (13С), 120.1 (4аС), 123.0 (8С), 123.4 (6С), 123.5 (9С), 128.45 (5С), 129.0 (10С), 129.6 (14С), 129.7 (8аС) 131.2 (7С), 132.3 (2С), 149.3 (12С), 157.4 (4С), 162.6 (8bC), 163.4 (8сС). Масс-спектр (ESI), m/z: 581.1 [M+H+]+ (вычислено: М 579.6). Найдено, %: C 61.14; H 6.29, N 7.05. C30H33N3O9. Вычислено, %: C 62.17; H 5.74, N 7.25.
Пример 5. Получение 6-амино-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадекан-16-ил)фенил]-1H-бензо[d,e]изохинолин-1,3(2H)-диона (Ia)
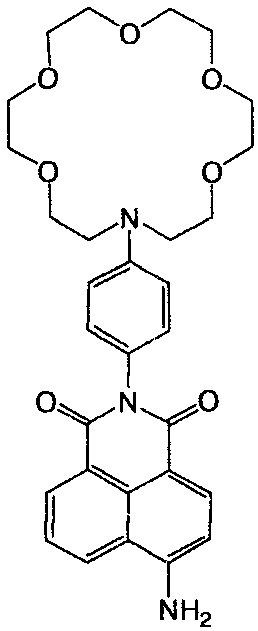
К нагретому до кипения раствору 0.1 г (0.17 ммоль) нитросоединения Ig в 20 мл этанола добавляют 0.5 мл гидразингидрата, после чего порциями при перемешивании вносят скелетный никелевый катализатор, приготовленный из 0.5 г сплава никеля с алюминием (массовая доля никеля 50%). После добавления всего катализатора реакционную массу выдерживают при кипении 2 ч, катализатор отфильтровывают, фильтрат упаривают в вакууме. Продукт Ia выделяют колоночной хроматографией (носитель - силикагель, элюент - смесь бензол - этанол, 10:1) в виде оранжево-желтого порошка с выходом 86%. Т. пл. 133-134°C. Спектр 1H ЯМР (CDCl3, 25°C), δ, м.д. (J, Гц): 3.63-3.71 (м, 24Н краун-эфирного фрагмента), 6.81 (д, 2Н, 11H, 13Н, J=7.9), 6.90 (д, 1H, 3Н, J=8.2), 7.14 (д, 2Н, 10Н, 14Н, J=7.9), 7.65 (дд, 1H, 6Н, J=7.9), 8.24 (д, 1H, 2Н, J=8.0), 8.43 (д, 1H, 5Н, J=8.0), 8.62 (д, 1H, 7Н, J=7.9). Спектр 13C ЯМР (CDCl3, 25°C), δ, м.д.: 68.6 (15С, 26С), 70.7 (16С, 18С, 23С, 25С), 76.7 (20С, 21С), 77.0 (17С, 24С), 77.4 (19С, 22С), 106.2 (1С), 109.5 (3С), 112.0 (11С), 112.2 (13С), 120.2 (4аС), 123.4 (8С), 124.2 (6С), 124.8 (9С), 129.23 (5С), 130.3 (10С), 131.2 (14С), 131.8 (8аС), 132.1 (7С), 134.2 (2С), 149.8 (12С), 150.7 (4С), 164.6 (8bC), 165.2 (8сС). Масс-спектр (ESI), m/z: 551.2 [M+H+]+ (вычислено: М 549.6). Найдено, %: C 64.43; H 6.89, N 7.45. C30H35N3O7. Вычислено, %: C 65.56; H 6.42, N 7.65.
Пример 6. Получение 2-[4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)фенил]-6-метокси-1H-бензо[d,e]изохинолин-1,3(2H)-диона (Ic). Раствор, содержащий 2.6 ммоль метилата натрия в 5 мл метанола, прибавляют к суспензии 0.2 ммоль N-арилнитронафталимида Ih в 7 мл метанола. Реакционную массу выдерживают при кипении в течение 10 ч, затем охлаждают до комнатной температуры. Метанол отгоняют на роторном испарителе, к остатку добавляют 7 мл воды. Выпавший продукт отфильтровывают, промывают на фильтре водой и этиловым спиртом. Получают 73 мг (выход 90%) соединения Ic. Т. пл. 233-235°C.
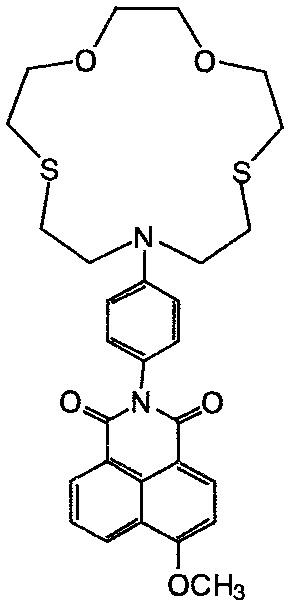
Спектр 1H ЯМР (600.22 МГц, ДМСО-d6, 20°C), δ, м.д. (J, Гц): 2.84-3.11 (м, 8Н, 16CH2, 17CH2, 22CH2, 23CH2), 3.65-3.81 (м. 4Н, 18CH2, 21CH2), 4.06-4.14 (м, 4Н, 19CH2, 20CH2), 4.16 (с, 3H, OCH3), 4.22-4.31 (м, 4Н, 15CH2, 24CH2), 6.89 (д, 2Н, 11H, 13H, J=8.6), 7.04 (д, 1H, 2H, J=8.2), 7.08 (д, 2Н, 10Н, 14Н, J=8.6), 7.81-7.90 (м, 1H, 6Н), 8.47 (д, 1Н, 3Н? J=8.2), 8.52 (д, 1H, 7Н, J=7.3), 8.58 (д, 1H, 5Н, J=8.5). Спектр 13C ЯМР (150.93 МГц, ДМСО-d6, 20°C), δ, м.д.: 32.30 (CH2S), 32.40 (CH2S), 32.73 (CH2S), 32.75 (CH2S), 57.02 (OCH3), 71.64 (CH2O), 71.69 (CH2O), 71.95 (CH2O), 71.97 (CH2O), 106.88 (3С), 113.86 (13С), 115.05 (10С), 115.50 (1C), 122.01 (14С), 123.00 (8С), 123.14 (4аС), 127.01 (6С), 129.21 (5С), 129.97 (8аС), 130.02 (9С), 131.97 (7С), 133.98 (2С), 147.52 (12С), 147.99 (11С), 160.06 (4С), 163.03 (8bC), 163.57 (8сС). Масс-спектр (ESI), m/z: 580.13 [M+H]+ (вычислено: М 580.19). Найдено, %: C 62.21; H 5.78; N 7.16. C30H33N3O5S2. Вычислено, %: C 62.15; H 5.74; N 7.25.
Пример 7. Получение 6-аллиламино-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадекан-16-ил)фенил]-1H-бензо[d,e]изохинолин-1,3(2H)-диона (Ie)
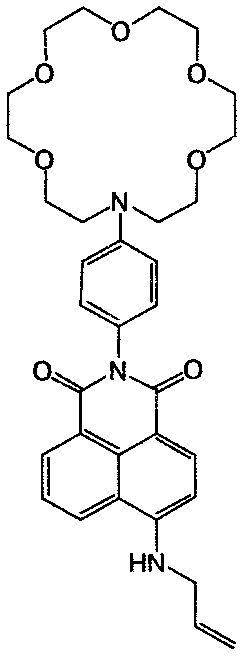
Суспендируют 50 мг (0.086 ммоль) нитропроизводного Ig в 5 мл аллиламина. Реакционную смесь при перемешивании нагревают до 60°C и выдерживают при этой температуре в течение 15 ч. По окончании реакции растворитель удаляют на роторном испарителе. Продукт очищают колоночной хроматографией (носитель - силикагель, элюент - смесь бензол - этанол, 10:1) и получают соединение Ie в виде оранжево-желтого вещества с выходом 0.035 г (69%). Т. пл. 174-176°C. Спектр 1H ЯМР (500 МГц, ДМСО-d6, 25°C), δ, м.д. (J, Гц): 3.57-3.65 (м, 24Н краун-эфирного фрагмента), 4.09 (с, 2Н, 1'Н), 5.20 (д, 1H, цис-3'Н, J=10.4), 5.27 (д, 1H, транс-3'Н, J=17.2), 5.96-6.03 (м, 1Н, 2'Н), 6.73 (д, 2Н, 11H, 13H, J=9.2), 6.75 (д, 1H, 3Н, J=8.6), 7.02 (д, 2Н, 10Н, 14Н, J=9.2), 7.72 (дд, 1H, 6Н, J=8.2, J=7.6), 8.08 (уш.с, 1H, NH), 8.24 (д, 1H, 2Н, J=8.6), 8.43 (д, 1H, 7Н, J=7.6), 8.74 (д, 1H, 5Н, J=8.2). Спектр 13C ЯМР (500 МГц, ДМСО-d6, 27°C), δ, м.д.: 45.4 (1'C), 51.3 (15С, 26С), 68.5 (16С, 18С, 23С, 25С), 70.5 (17С, 19С, 20С, 21С, 22С, 24С), 104.8 (1C), 108.9 (3C), 111.5 (11C, 13С), 116.5 (3'C), 120.7 (4аС), 123.2 (9С или 8C), 124.6 (8C или 9C), 129.9 (5C, 8аС), 130.2 (2С, 10С, 14С), 131.3 (6С), 134.4 (7С), 134.6 (2'С), 147.5 (12С), 150.9 (4С), 163.9 (8bC), 164.8 (8сС). Масс-спектр (ESI), m/z: 591.2 [M+H+]+ (вычислено: М 589.68). Найдено, %: C 68.08; H 6.54; N 6.83. C33H39N3O7. Вычислено, %: C 67.22; H 6.67; N 7.13.
Пример 8. Получение 6-аллиламино-2-(4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)-фенил)-1Н-бензо[d,e]изохинолин-1,3(2Н)-диона (If)
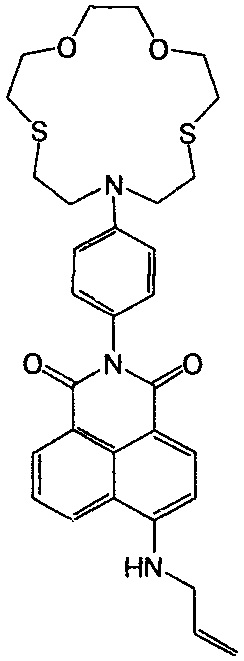
К 5 мл аллиламина добавляют при перемешивании 0.05 г (0.088 ммоль) соединения Ih. Реакционную смесь выдерживают при перемешивании и температуре 60°C в течение 15 ч, после чего растворитель удаляют на роторном испарителе. Продукт выделяют переосаждением из смеси вода - этанол (1:1) в виде желтого порошка. Выход 0.036 г (68%). Т. пл. 217- 219°C. Спектр 1H ЯМР (600 МГц, ДМСО-d6, 25°C), δ, м.д. (J, Гц): 2.75 (дд, 4Н, 16Н, 23Н, J=5.4, J=5.1), 2.85 (дд, 4Н, 17Н, 22Н, J=7.6), 3.58 (с, 4Н, 20Н, 19Н), 3.62 (дд, 4Н, 18Н, 21Н, J=7.6), 3.71 (дд, 4Н, 15Н, 24Н, J=5.4, J=5.1), 4.07 (с, 2Н, 1'Н), 5.18 (д, 1Н, цис-3'Н, J=10.2), 5.25 (д, 1H, транс-3'Н, J=17.2), 5.92-6.02 (м, 1Н, 2'Н), 6.66 (д, 2Н, 11Н, 13Н, J=9.2), 6.73 (д, 1H, 3Н, J=8.6), 7.03 (д, 2Н, 10Н, 14Н, J=9.2), 7.70 (дд, 1H, 6Н, J=8.0, J=7.6), 8.07 (уш.с, 1H, NH), 8.23 (д, 1H, 2Н, J=8.6), 8.42 (д, 1H, 7Н, J=7.6), 8.72 (д, 1Н, 5Н, J=8.0). Спектр 13C ЯМР (600 МГц, ДМСО-d6, 27°C), δ, м.д.: 29.3 (2×CH2S), 30.9 (2×CH2S), 45.2 (1'C), 51.7 (2×CH2N), 70.3 (2×CH2O), 73.3 (2×CH2O), 111.6 (11C, 13С), 116.4 (3'С), 120.6 (4аС), 122.8 (9С или 8С), 124.7 (8С или 9С), 124.8 (3С), 127.0 (1C), 128.8 (5С, 8аС), 130.1 (2С, 10С, 14С), 131.1 (6С), 134.3 (7С), 134.4 (2'С), 146.5 (12С), 150.8 (4С), 163.83 (8bC), 164.6 (8сС). Масс-спектр (ESI), m/z: 606.92 [M+H+]+ (вычислено: М 605.81). Найдено, %: C 65.38; H 6.52; N 6.89. C33H39N3O4S2. Вычислено, %: C 65.43; H 6.49; N 6.94.
Пример 9. Получение флуорофорсодержащего полимера
К 200 мкл 1М раствора N,N-диметилакриламида в формамиде добавляют 600 мкл 1 мМ раствора соединения Ie в формамиде. Через полученный раствор барботируют аргон в течение 15 мин, затем раствор охлаждают на ледяной бане и вносят инициатор (80 мкл 1%-ного раствора персульфата аммония и 2,5 мкл тетраметилэтилендиамина). Плотно закрытую пробирку с реакционной массой выдерживают 24 ч при 20°C. Образовавшийся растворимый полимер очищают диализом. Полученный продукт высушивают лиофильно с помощью сублимационной установки Alpha 1_2 LD plus (Martin Christ, Германия). Выход 88%. 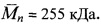
Пример 10. Получение флуорофорсодержащего полимерного геля
К 200 мкл 1М раствора N,N-диметилакриламида в формамиде добавляют сначала 600 мкл 1 мМ раствора соединения If в формамиде, а затем 0.00771 г N,N-метилен-бис-акриламида. Через полученный раствор барботируют аргон в течение 15 мин, затем раствор охлаждают на ледяной бане и вносят инициатор (80 мкл 1%-ного раствора персульфата аммония и 2,5 мкл тетраметилэтилендиамина). Плотно закрытую пробирку с реакционной массой выдерживают 24 ч при 20°C. Образовавшийся полимерный гель отмывают от низкомолекулярных и олигомерных фракций троекратной сменой формамида, а далее многократной сменой деионизованной воды. Полученный продукт высушивают лиофильно с помощью сублимационной установки Alpha 1_2 LD plus (Martin Christ, Германия) и затем в вакуум-эксикаторе над прокаленным гранулированным CaCl2. Выход 79%. Степень набухания сшитой полимерной сетки: 23 г/г формамида и 30,6 г/г H2O.
Методы исследования хемосенсорных свойств полученных азакраунсодержащих N-арил-1,8-нафталимидов
Оценку сенсорной способности соединений Ia-If по отношению к катионам Cu2+, Ag+, Hg2+, Ni2+, Fe2+, Zn2+, Cd2+, Mg2+, Ca2+, Pb2+ проводили по зависимости спектров флуоресценции нафталимидов от концентрации катионов. Для этого к раствору исследуемого соединения формулы I (c~1×10-6 моль/л) в ацетонитриле или воде порциями добавляли расчетное количество раствора перхлората соответствующего металла, записывая спектры флуоресценции исходного раствора и раствора после добавления соли металла в интервале длин волн 250-750 нм.
Сенсорную активность полимерного материала, полученного из нафталимида Ie, оценивали по изменению его спектра флуоресценции после выдерживания в специально приготовленных ацетонитрильных растворах перхлората кальция или бария с концентрацией 1×10-4 и 1×10-5 моль/л соответственно.
Возбуждение флуоресценции осуществляли светом с длиной волны 360 нм (для соединений Ic и Id) или 405 нм (для соединений Ia, Ib, Ie, If и полимера, полученного в примере 9). Съемку спектров флуоресценции проводили на спектрофлуориметре FluoroMax-3.
Для количественной оценки сенсорной активности полученных нафталимидов использовали степень увеличения интенсивности их флуоресценции FE (Fluorescence Enhancement) в ацетонитрильных и водных растворах в точке максимума при добавлении одного эквивалента катиона металла, рассчитываемую по следующей формуле:
FE=I/Io,
где Io - интенсивность флуоресценции исходного раствора исследуемого соединения; I - интенсивность флуоресценции раствора исследуемого соединения после добавления соли металла.