Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ ПРОИЗВОДНЫХ АДАМАНТАНОВ
Вид РИД
Изобретение
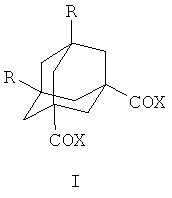
Изобретение относится к области органической химии, а именно к 1,3-дикарбонильным производным адамантанов с двумя одинаковыми функциональными группами в узловых положениях адамантанового ядра, конкретно - к способу получения адамантанов общей формулы
где R=Н, Х=ОН, ОМе, OEt, OPri; OBus, OCH2CH(Et)Bu, OCH2CF3, ОСН(СН3)CF3, OCH2CF2CF2H, OCH2CH2CH2Br, OCH2C≡CH, NEt2, NC5H10 (пиперидил), NC4H8O (морфолил), C6H5NH, C6H4OMe, С4Н3О-(фурил);
R=Me, Х=ОН, Me, ОМе, O-Pri, X=NC4H8O (морфолил), C4H3O (фурил), NEt2, C6H5NH, C6H4OMe.
Карбонильные производные адамантанов (AdCO), в частности 1,3-дикарбонильные производные адамантанов, представляют большой интерес для использования в различных областях, включая фармакологию, полимерную химию и материаловедение.
Введение AdCO группы в молекулы лекарственных и биологически активных соединений способствует их переносу через клеточные мембраны. Поэтому AdCO-модифицированные биологически активные соединения с улучшенными медикаментозными показателями перспективны в качестве лекарств нового поколения (В.Ю.Ковтун, Хим.-фарм. журн., 1987, 28, 931). Известно, что введение AdCO группы в молекулы полимеров увеличивает их термическую и химическую стабильность. (А.Р.Хардин и др., Успехи химии, 1982, 51, 480). Описано использование соединений, содержащих группу AdCO, в качестве краун-эфиров (А.Г.Юрченко и др. ЖОрХ, 1990, 26,1808), пептидных ионофоров (D.Ranganathan et al. J. Am. Chem. Soc., 1997, 119, 11578; Angew. Chem. Int. Ed., 1996, 35, 1105), пластификаторов (А.Г.Юрченко и др. ЖОрХ, 1990, 26, 1808), инсектицидов, пестицидов (S.Nakagawa et al. Agric. Biol. Chem, 1987, 51, 1355), оптических материалов (Y.Okada, WO 2007125829 A1), термозащитных покрытий (Т.Dang. J. Polymer Science, Part A. Polymer Chemistry, 2004, 42, 6134) и других ценных продуктов (О.Josto, et al. JP 2007332068 А20071227; H.Yamamoto et al. WO 2003081295), а также в качестве исходных соединений для получения биологически активных веществ, перспективных для фармацевтики (Y.He. Synthesis, 1994, 9, 989; В.Ю.Ковтун, Хим.-фарм. журн., 1987, 28, 931; М.-Г.А.Швейгеймер, Усп. химии, 1996, 65, 603). Соединения с анизильной группой, Ad'(COC6H4OMe)2, (где Ad' - моно- или дизамещенная адамантильная группа) легко могут быть превращены в диолы, Ad'(COC6H4OMe)2, являющиеся перспективными мономерами для синтеза ценных полимеров. (D.Thuy et al. Заявка на патент США US 2005043449 A1).
Особый интерес среди 1,3-дикарбонильных производных адамантанов представляют дикарбоновые кислоты, 1,3-Ad(COOH)2 и 1,3-Me2-5,7-Ad(COOH), которые являются основными синтонами для синтеза других 1,3-дикарбониладамантанов (эфиров, амидов, кетонов), а также полимеров, краун-эфиров, дендримеров, ионофоров. Способы получения 1,3-дикарбонильных производных адамантанов, известные в настоящее время, основаны на использовании дикарбоновых кислот 1,3-Ad(COOH)2 в качестве ключевых промежуточных соединений.
Известны различные способы получения l,3-Ad(COOH)2 из AdH с использованием муравьиной кислоты в среде сильных протонных кислот (смесь 60-65% азотной и 94% серной кислот) и 60%-ного олеума. Выходы составляют 65% (при 20°C за 1 ч) (J.Dohm et al. Chem. Ber. Ger. 1991, 124, 915) и 83% (при 28°C за 4 ч) (Л.Н.Бутенко и др. ЖОрХ, 1973, 9 (4), 728). Известен способ получения 1,3-Ad(COOH)2 из AdH в 20-кратном избытке 90-103% серной кислоты при давлении CO (6-150 атм) и температуре 90-160°C (A.Lamola. Пат. Франции №1353906, С.А. 1964, 61, 593). Недостатками этого способа является использование агрессивной среды, высокого давления и высокой температуры.
Известны другие способы получения Ad(COOH)2, основанные на карбонилировании 1,3-дизамещенных адамантанов с лабильными группами, например, 3-Br-1-AdCOOH (Н.Stetter and С.Wullf, Chem. Ber. Ger. 1962, 95, 667) или 3-(ONO)21-AdCOOH (И.К.Моисеев и др., ЖорХ, 1983, 19, 5) в концентрированной H2SO4. Недостатки перечисленных способов заключаются в необходимости проводить реакцию в жестких условиях: в агрессивной среде (серная кислота, азотная кислота, олеум), что требует специального оборудования, и использовании дорогой муравьиной кислоты.
Известен способ получения 1,3-дикарбонильных производных адамантанов из 1,3-дибромадамантана (AdBr2), включающий стадию образования 1,3-Ad(COOH)2 в результате карбонилирования AdBr2 под действием НСООН в менее агрессивной среде (в концентрированной H2SO4), но в присутствии Ag2SO4. Указанный способ включает следующие стадии:
(1) получение 1,3-Ad(COOH)2;
(2) выделение 1,3-Ad(COOH)2;
(3) получение и выделение 1,3-Ad(COCl)2;
(4) взаимодействие 1,3-Ad(COCl)2 с нуклеофильным субстратом.
Недостатки этого способа заключаются, во-первых, в том, что он является многостадийным; во-вторых, использует в качестве исходного соединения 1,3-AdBr2, который синтезируют с использованием сухого Br2 в присутствии крайне неудобного для работы и дорогого BBr3. Кроме того, реакцию проводят в агрессивной среде (концентрированной H2SO4) и применяют дорогую HCOOH.
Известный способ получения 1,3-Ad(COOH)2 из 1,3-Ad(OH)2 включает дополнительную стадию получения диола из 1,3-AdBr2 под действием AgNO3. (H.Stetter and C.Wullf, Chem. Ber. Ger. 1960, 93, 1366).
Известен способ получения 1,3-Ad(COOH)2 из 1-AdCOOH (L.N.Butenko et al. Synthetic Commun., 1984, 14,2, 113), одним из недостатков которого является проведение обеих стадий получения 1-AdCOOH и 13-Ad(COOH)2 в очень агрессивной среде, состоящей из смеси концентрированных HNO3 и H2SO4 и олеума. Способ включает следующие стадии:
(1) карбонилирование 1-AdCOOH муравьиной кислотой в смеси концентрированной азотной, серной кислот и олеума;
(2) выделение 1,3-Ad(COOH)2;
(3) получение дихлорангидрида адамантандикарбоновой кислоты 1,3-Ad(COCl)2 реакцией 1,3-Ad(COOH)2 с пентахлоридом фосфора и его выделение;
(4) взаимодействие 1,3-Ad(COCl)2 с нуклеофильным субстратом (спиртом, амином и др.).
К недостаткам указанного способа относится также многостадийность, необходимость использования агрессивных сред, специального оборудования и нетехнологичной процедуры выделения ключевого промежуточного продукта 1,3-Ad(COOH)2 из агрессивной среды.
Отметим, что в некоторых случаях последняя стадия получения 1,3-дикарбонильных соединений из дихлорангидрида 1,3-Ad(COCl)2 с нуклеофилом идет с плохой селективностью и низким выходом. Например, реакция 1,3-Ad(COCl)2 с анизолом и с хлористым алюминием в качестве катализатора проводит к смеси 1,3-алкилированного 1,3-Ас'(C6H4OMe)2 и ацилированного 1,3-Ad'(COC6H4OMe)2 продуктов с выходом последнего 30% (И.Н.Ягушкина и др., ЖОХ, 1994, 30, 6, 842).
Известен способ получения 1,3-дикарбонильных производных адамантанов из адамантана, который был выбран в качестве прототипа (Л.Н.Бутенко и др. ЖОрХ, 1973, 9 (4), 728), который включает:
(1) получение 1,3-Ad(COOH)2 карбонилированием адамантана под действием НСООН в среде, состоящей из смеси 60% азотной и 94% серной кислот и 60%-ного олеума;
(2) выделение 1,3-Ad(COOH)2 из вышеуказанной смеси концентрированных HNO3 и H2SO4 и олеума;
(3) получение 1,3-Ad(COCl)2 из 1,3-Ad(COOH)2 реакцией с пентахлоридом фосфора при 100°C и его выделение;
(4) взаимодействие 1,3-Ad(COCl)2 с нуклеофильным субстратом (спиртом, амином и др.).
Недостатками прототипа являются многостадийность, необходимость использования агрессивных сред (концентрированные кислоты, олеум), что требует специального оборудования для получения 1,3-Ad(COOH)2, необходимость проведения сложной процедуры выделения 1,3-Ad(COOH)2 из агрессивной среды.
Таким образом, все вышеупомянутые известные способы получения 1,3-дикарбонильных производных адамантанов являются многостадийными (причем необходимыми стадиями являются получение и выделение дикарбоновых кислот 1,3-Ad(COOH)2, используемых в качестве ключевых промежуточных соединений), получение 1,3-Ad(COOH)2 осуществляют в агрессивных средах, в качестве исходных соединений используют труднодоступные производные адамантана, за исключением способа-прототипа, в котором в качестве исходного соединения используют адамантан.
Задачей настоящего изобретения является разработка нового одностадийного способа получения 1,3-дикарбонильных производных адамантанов с двумя одинаковыми карбонилсодержащими группами в узловых положениях адамантанового ядра, в котором используют наиболее доступные соединения ряда адамантана в качестве исходных.
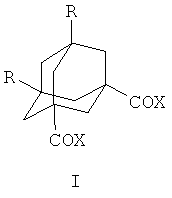
Поставленная задача решается созданием нового способа получения 1,3-дикарбонильных производных адамантанов с двумя одинаковыми карбонилсодержащими группами в узловых положениях адамантанового ядра общей формулы

где R=Н, X=ОН, ОМе, OEt, OPri; OBus, OCH2CH(Et)Bu, OCH2CF3, ОСН(СН3)CF3, OCH2CF2CF2H, OCH2CH2CH2Br, ОСН2С≡СН, NEt2, NC5H10 (пиперидил), NC4H8O (морфолил), C6H5NH, C6H4OMe, С4Н3О-(фурил);
R=Me, Х=ОН, Me, ОМе, O-Pri, X=NC4H8O (морфолил), С4Н3О(фурил), NEt2, C6H5NH, C6H4OMe,
который заключается в карбонилировании соединения адамантана в присутствии электрофильных катализаторов, отличающегося тем, что в качестве соединения адамантана используют адамантан или 1,3-диметиладамантан и карбонилирование осуществляют действием CO при атмосферном давлении в растворе CH2Br2 при 0-25°C в течение 0,5-3 часов, а в качестве катализатора используют суперэлектрофильный комплекс CBr4·2AlBr3, при мольном соотношении [CBr4·2AlBr3]:[соединение адамантана]=(1,5-2):1, и к in situ образовавшемуся карбонильному производному, не выделяя его, в атмосфере CO прибавляют нуклеофильный субстрат, а в качестве нуклеофилов используют: воду, спирт, содержащий алкильную, или полифторалкильную, или бромалкильную, или ацетиленовую группу (выбранный из группы: МеОН, EtOH, i-PrOH, втор-BuOH, 2-этилгексанол-1,1-трифторметилметанол, 1-метил-1-трифторметилметанол-1, 2,2-дифтор-3,3-дифторпропанол, 3-бромпропанол-1, пропаргиловый спирт), алифатический, циклический или ароматический амин (выбранный из группы: диэтиламин, морфолин, пиперидин, анилин), ароматический или гетероароматический углеводород (выбранный из группы: анизол, фуран); в случае 1,3-диметиладамантана в качестве нуклеофила используют воду, алифатический спирт (выбранный из группы: MeOH, iPrOH), амин алифатического или гетероциклического, или ароматического ряда (выбранный из группы: диэтиламин, морфолин, анилин), ароматический углеводород или ароматический гетероцикл (выбранный из группы: анизол, фуран).
Основными преимуществами заявляемого способа являются:
- получение целевых продуктов без выделения промежуточных соединений, по типу «one-pot» процесса, т.е. в одну технологическую стадию;
- способ не требует применения агрессивных сред;
- высокие выходы целевых продуктов и высокая селективность процесса;
- мягкие условия осуществления способа: температура 0-25°C и атмосферное давление CO вместо высоких температур и повышенного давления CO, необходимых для осуществления других способов;
- простота осуществления, способ не требует специального оборудования;
- заявляемый одностадийный способ является достаточно общим и может быть применен для получения широкого круга 1,3-дикарбонильных производных адамантана при использовании нуклеофилов, стабильных в условиях осуществления способа и отличающихся достаточной донорной способностью. В случае нуклеофилов, не удовлетворящих этим условиям, соответствующие 1,3-дикарбонилсодержащие адамантаны могут быть получены известными способами из 1,3-адамантандикарбоновых кислот, которые легко и с высоким выходом можно синтезировать заявляемым способом, при использовании воды в качестве нуклеофила.
Еще одним очень важным преимуществом заявляемого способа (и способа-прототипа) по сравнению с другими известными способами получения 1,3-дикарбонильных производных адамантанов, является использование в качестве исходных соединений адамантана или 1,3-диметиладамантана, которые являются наиболее доступными соединениями ряда адамантана.
Заявляемый способ получения 1,3-дикарбонильных производных адамантанов ранее известен не был. Применяемые в заявляемом способе катализаторы были ранее использованы для одностадийной функционализации алканов и циклоалканов (I.S.Akhrem et al. Chem. Rev. 2007, 707, 2037). Особенность данного процесса заключается в том, что в этом случае под действием катиона CBr3 + происходит расщепление двух инертных связей C-H и восстановлении двух молекул CBr4:
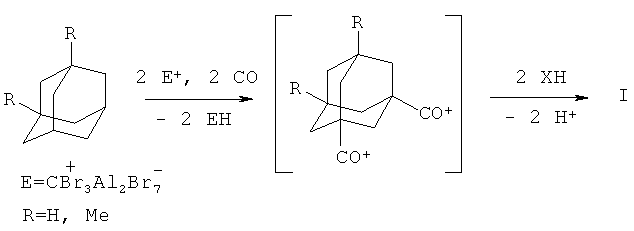
Схема превращения адамантана (или 1,3-диметиладамантана) в продукты формулы (I) включает отрыв двух гидрид-ионов от адамантанов с образованием в атмосфере СО сначала ацилий катиона AdCO+, а затем - интермедиата типа диацилий дикатиона Ad'(CO+)2, который при добавлении нуклеофильного субстрата образует соответствующие 1,3-дикарбонильные производные адамантанов.
Способ по изобретению осуществляют следующим образом. В круглодонной колбе, снабженной краном для проведения реакции в атмосфере СО, при температуре 15-25°C и перемешивании с помощью магнитной мешалки, готовят катализатор смешением CBr4 с двукратным мольным избытком бромистого алюминия в растворе дибромметана. При 0°C к полученному раствору катализатора в атмосфере CO прибавляют адамантан или 1,3-диметиладамантан и продолжают перемешивать реакционную смесь при той же температуре в течение 2,5-3 часов. К полученной смеси при 0°C, не прекращая подачу CO, прибавляют соответствующий нуклеофил (спирт или амин, или арен), позволяют температуре реакции подняться до комнатной и продолжают вести реакцию в течение 0,3-0,75 часа. Затем реакционную смесь осторожно, при охлаждении, обрабатывают водой и экстрагируют хлороформом. Отделяют органический слой, промывают водой до нейтральной реакции и сушат Na2SO4. В случае проведения карбонилирования при комнатной температуре (15-25°C) время реакции сокращается до 30-45 минут.
Реакции с водой проводят при 20-25°C в атмосфере CO с использованием 100-150 мольного избытка воды по отношению к суперэлектрофильному комплексу до прекращения образования осадка дикарбоновой кислоты. При этом дикарбоновые кислоты осаждаются из реакционных смесей в виде белых осадков, которые отделяют, тщательно промывают водой, сушат и перекристаллизовывают. В остальных случаях анализируют полученные смеси с помощью ГЖХ. После отгонки растворителя на роторном испарителе выделяют и очищают продукты перекристаллизацией или переосаждением. Выходы продуктов определяют методом 1Н ЯМР по внутреннему стандарту - мезитилену или путем взвешивания продукта после очистки и высушивания. Конверсии исходных адамантанов определяют методом ГЖХ. Строение полученных продуктов доказано 1Н, 19F и 13С ЯМР и масс-спектрами, а также данными элементного анализа. Спектры 19F ЯМР, а также 1Н ЯМР (для определения выхода продукта по внутреннему эталону) записывают на спектрометре Bruker AV-300), спектры 1Н и 13С ЯМР регистрируют на спектрометре Bruker AV-400). Все спектры записаны в CDCl3, если в примерах не указано иное. Химические сдвиги δ приведены в м.д. от Me4Si, константы спин-спинового взаимодействия (J) даны в герцах (Гц).
ПРИМЕРЫ
В скобках даны ссылки на публикации, в которых описаны данные соединения.
Пример 1. Получение 1,3-Ad(COOH)2
В сухой круглодонной колбе при комнатной температуре в атмосфере СО, при перемешивании с помощью магнитной мешалки, готовят суперэлектрофильный комплекс CBr4·2AlBr3 из CBr4 и AlBr3 при мольном отношении 1:2 в безводном CH2Br2. После образования гомогенного раствора доводят температуру в колбе до 0°С, и к свежеприготовленному суперэлектрофильному комплексу CBr4·2AlBr3 (2.50 г, 2.87 ммоль) в 3 мл безводного CH2Br2 прибавляют сухой AdH (0.20 г, 1.47 ммоль). Реакционную смесь перемешивают 3 ч. Затем в атмосфере СО, при охлаждении, медленно прибавляют в колбу 15 мл воды. При комнатной температуре и атмосферном давлении СО оставляют реакционную смесь до прекращения выпадения осадка (от нескольких часов до нескольких дней). Выпавшую в осадок 1,3-Ad(COOH)2 отделяют фильтрованием, промывают водой и высушивают, после чего перекристаллизовывают из СН3СООН. Выход аналитически чистого соединения 80%. Т.пл. 285-286°C. Вычислено