Результат интеллектуальной деятельности: 3,6-ДИМЕТОКСИ-17-МЕТИЛ-7АЛЬФА-(ТРИФТОРАЦЕТИЛ)-4,5АЛЬФА-ЭПОКСИ-6АЛЬФА,14АЛЬФА-ЭТЕНОИЗОМОРФИНАН И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
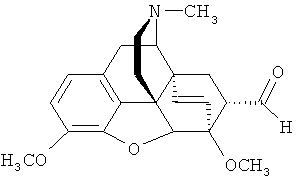
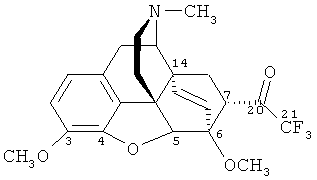
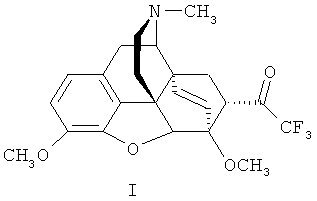
Изобретение относится к новому гетероциклическому соединению, содержащему циклическую систему 4aH-8,9c-иминоэтанфенантро[4,5-b,с,d]фурана, конденсированную с карбоциклическим кольцом, более точно, с мостиковой группой в положениях 6 и 14, состоящей только из двух атомов углерода, а именно к фторсодержащему производному тевинона, конкретно к 17-метил-3,6-диметокси-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинану) формулы
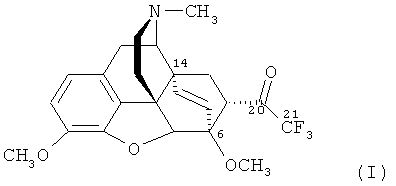
и к способу его получения.
Заявляемое соединение формулы (I) является фторпроизводным алкалоидов морфинанового типа и может использоваться в качестве предшественника фторсодержащих производных тевинолов и орвинолов, последние могут найти применение в качестве действующего начала лекарственных средств.
Заявляемое соединение, его свойства и способ получения в литературе не описаны.
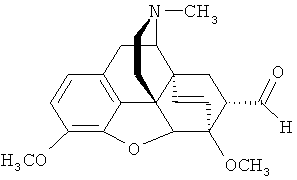
Наиболее близким по структуре к заявляемому соединению является его не содержащий фтора аналог - «тевинон» (или 17-метил-3,6-диметокси-7α-ацетил-4,5α-эпокси-6α,14α-этеноизоморфинан) - формулы
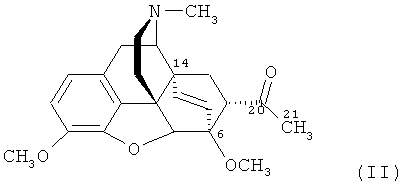
который представляет собой известный аддукт тебаина и винилметилкетона [В. Alien, Е.Т. Jarvi, D.J. Kalota, J.R. Meyer, K.G. Tomazi, A. Mannino, B. Orr. // WO 2010/039220 A1 (2010)], [В. Zhong, Z. Gong, Y. Wang, Y. Liu. // US 2005/70564 A1 (2005)]. Тривиальное название «тевинон» является основой краткой номенклатуры данного класса соединений [K.W. Bentley, D.G. Hardy, В. Meek. Novel Analgesics and Molecular Rearrangements in the Morphine-Thebaine Group. II. Alcohols Derived from 6,14-endo-Etheno- and 6,14-endo-Ethanotetrahydrothebaine. // J. Amer. Chem. Soc., 89 (13), 3273-3280 (1967)], согласно которой заявляемое соединение (I) следует называть 21,21,21-трифтортевинон.
Известно, что тевинон (II) является ключевым исходным соединением для получения ряда веществ, относящихся к классу тевинолов общей формулы
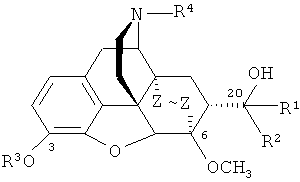 ,
,
где R1=СН3; R2=Н, алкильная, алкенильная, алкинильная, циклоалкильная, арильная или другая органическая группа; R=СН3; R4=СН3; Z~Z=CH=CH, CH2CH2) и к классу орвинолов общей формулы
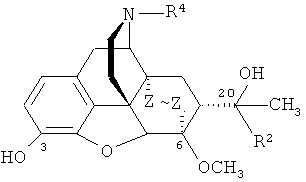 ,
,
где R2=Н, алкильная, алкенильная, алкинильная, циклоалкильная, арильная или другая органическая группа; R4=Н, алкильная, аллильная, пропаргильная, циклоалкилметильная, либо другая органическая группа; Z~Z=CH=CH, CH2CH2; [A.F. Casy, R.Т. Parfitt, Opioid Analgesics. Chemistry and Receptors, Plenum Press, New York, London, 1986], K.W. Bentley. Brit. Pat. 1136214 (1968). Chem. Abstr., 70: 78218s (1969)], [Н.S. Park, Н.Y. Lee, Y.Н. Kim, J.K. Park, E.E. Zvartau, Н. Lee. A highly selective κ-opioid receptor agonist with low addictive potential and dependence liability. // Bioorg. Med. Chem. Lett., 16, (13), 3609-3613 (2006)].
Известно, что тевинолы являются предшественниками орвинолов - соединений, которые представляют собой один из важнейших типов высокоэффективных лигандов опиоидных рецепторов и являются субстанциями лекарственных средств, широко применяемых в медицине (бупренорфин, дигидроэторфин) и ветеринарии (эторфин, дипренорфин) в качестве обезболивающих средств для лечения острых и хронических болей средней и высокой интенсивности и для лечения наркомании, а также для обездвиживания крупных животных, выведения их из этого состояния и лечения острых передозировок наркотических анальгетиков.
Орвинолы представляют собой деметилированные производные тевинолов и содержат гидроксильную группу в положении 3 гетероциклической системы.
В литературе не описаны производные тевинона, в которых какие-либо атомы водорода замещены на атомы фтора и фторсодержащие производные тевинола и орвинола.
Заявляемое соединение - 21,21,21-трифтортевинон (I) - является первым представителем фторсодержащих тевинонов, которое эффективно может быть использовано в качестве предшественника для получения фторсодержащих производных тевинола и орвинола.
Принимая во внимание тот факт, что известный тевинон (II) является ключевым предшественником для синтеза множества тевинолов и орвинолов, получение его фторсодержащего аналога (I) и использование последнего в качестве исходного соединения открывает широкие возможности для получения ряда фторсодержащих тевинолов и орвинолов.
Известно, что введение атомов фтора в молекулы фармакологически активных соединений влияет на их фармакологическую активность, в частности, за счет повышения липофильности молекул, улучшения их транспорта т vivo и большей устойчивости связей C-F к метаболизму [S.V. Druzhinin, E.S. Balenkova, V.G. Nenajdenko. Recent advances in the chemistry of α,β-unsaturated trifluoromethylketones. // Tetrahedron, 63 (33), 7753-7808 (2007)]. Кроме того, размеры атома фтора не очень значительно отличаются от размеров атома водорода, в частности, ван-дер-ваальсовы радиусы групп СН3 и CF3 равны 1.29 Å и 1.35 Å соответственно [S.V. Druzhinin, E.S. Balenkova, V.G. Nenajdenko. Recent advances in the chemistry of α,β-unsaturated trifluoromethylketones. // Tetrahedron, 63 (33), 7753-7808 (2007)]. Поэтому геометрические параметры биоактивной молекулы при частичной замене в ней атомов водорода на атомы фтора в значительной степени сохраняются, и в результате взаимодействие фторзамещенной биоактивной молекулы с биомишенью не затруднено стерически по сравнению с ее нефторированным аналогом.
Известен способ получения тевинона (II) (не содержащего фтор аналога заявляемого соединения) реакцией циклоприсоединения бутен-3-она-2 (СН3С(O)СН=СН2) к алкалоиду тебаину, но получить аналогичным образом фторпроизводное тевинона - заявляемое соединение (I) - не представляется возможным из-за малой доступности и низкой устойчивости соответствующего фторсодержащего кетона CF3C(O)СН=СН2 [М. Tordeux, С. Wakselman. Synthese de la trifluoromethyl-vinyl-cetone. // J. Fluor. Chem., 20, 301-306 (1982)].
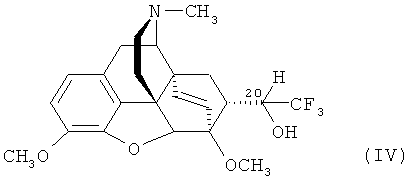
Известен способ получения аналога заявляемого соединения - тевинона (II) окислением вторичного спирта (тевинола) формулы
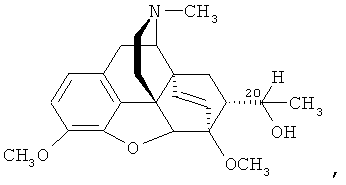
который получают присоединением MeMgI к соответствующему альдегиду формулы
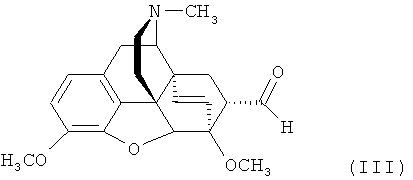
[Н. Саксена. Авт. свид. СССР 1362734 (1987)].
Однако получить аналогичный вторичный спирт (IV), содержащий 3 атома фтора в положении 21 вышеуказанным способом не представляется возможным из-за чрезвычайной нестабильности металлоорганических соединений CF3MgX (где Х = галоген) [R.N. Haszeldine. Neuere Chemie des Fluors. Organometall - und Organometalloid-Verbindungen des Fluors. Angew. Chem., 66, (22), 693-701 (1954)], [R.N. Hasseldine. Perfluoroalkyi Grignard and Grignard-type Reagents. Part IV. Trifluoromethylmagnesium Iodide. J. Chem. Soc., 1273-1279 (1954)], [E.Т. McBee, R.D. Battershell, Н.P. Braendlin. A New Synthesis of Perfluoroalkylmagnesium Halides. J. Org. Chem., 28, (4), 1131-1133 (1963)], [K.J. Klabunde, Н.F. Efner, L. Satek and W. Donley, Preparation of an extremely active magnesium slurry for Grignard reagent preparations by metal atom-solvent cocondensation. J. Organometal. Chem., 71, 309-313 (1974)] и CF3Li [R.N. Haszeldine. Neuere Chemie des Fluors. Organometall - und Organometalloid-Verbindungen des Fluors. Angew. Chem., 66, (22), 693-701 (1954)], [O.R. Pierce, E.T. McBee, G.F. Judd. Preparation and Reactions of Perfluoroalkyllithiums. J. Amer. Chem. Soc., 76, (2), 474-478 (1954)].
Кроме того, следует отметить, что при действии KMnO4 на фторсодержащий спирт формулы
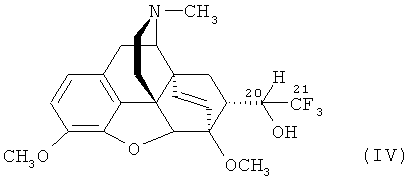
не происходит ожидаемое окисление спирта в соответствующий кетон (I).
Задачей настоящего изобретения является получение реакционноспособного фторсодержащего соединения, которое может быть общим предшественником для получения ряда фторсодержащих производных тевинола и орвинола, и разработка способа его получения.
Поставленную задачу решают новым соединением - 17-метил-3,6-диметокси-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинаном (21,21,21-трифтортевиноном) формулы
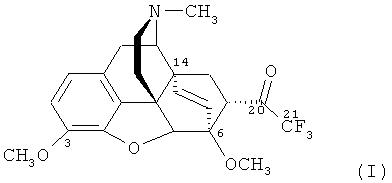
и способом его получения, включающим
- взаимодействие альдегида формулы (III) с реактивом Руперта-Пракаша [CF3Si(СН3)3] в присутствии источника F-, такого, как тетрабутиламмонийфторид, в растворителе, таком, как тетрагидрофуран, последующую обработку реакционной смеси кислотой, выделение фторсодержащего спирта формулы (IV) известными приемами и
- окисление полученного вторичного спирта (IV) продуктом взаимодействия оксалилхлорида и диметилсульфоксида при температуре от -70°C до -78°C с последующей обработкой реакционной смеси основанием, таким, как триэтиламин, и выделением целевого соединения (I) общепринятыми методами.
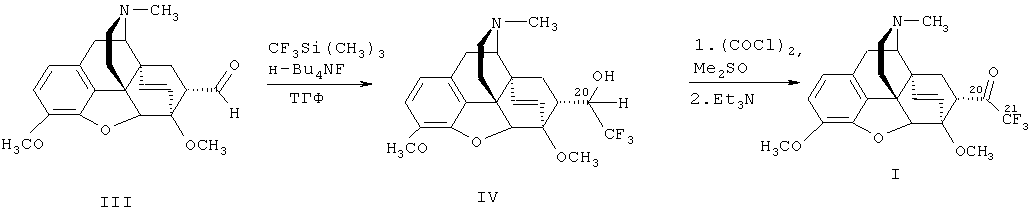
В качестве исходного соединения для окисления используют вторичный спирт (IV) в виде смеси (20R)- и (20S)-изомеров или любой из индивидуальных С(20)-изомеров
В качестве исходных веществ для получения целевого 21,21,21-трифтортевинола (1) используют коммерчески доступные Me3SiCF3 [I. Ruppert, K. Schlich, W. Volbach. Tetrahedron Lett., 25, (27), 2195-2198 (1984)], [G.K.S. Prakash, R. Krishnamurti, G.A. Olah. J. Amer. Chem. Soc., Ill, (7), 393-395 (1989)]), оксалилхлорид и диметилсульфоксид. Исходный альдегид (III) является доступным соединением: его легко и с высоким выходом получают в одну стадию из природного сырья (тебаина) [J.J. Kopcho, J.C. Schaeffer. Selective O-Demethylation of 7-α-(Aminomethyl)-6,14-endo-ethenotetrahydrothebaine. // J. Org. Chem., 51(9), 1620-1622 (1986)].
Заявляемое соединение (I) представляет собой кристаллическое вещество с т.пл. 118-120°C. Структура заявляемого соединения (I) подтверждена спектроскопически: ИК-, ЯМР (1H, 13C, 19F) и масс-спектрами.
Изобретение иллюстрируется конкретными примерами его осуществления.
Пример 1.
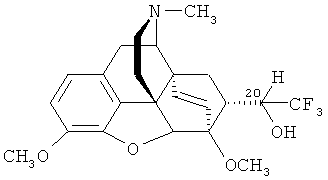
А. Получение 7α-(1-гидрокси-2,2,2-трифторэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинана формулы (IV).
К раствору 0.45 г (1.22 ммоль) альдегида формулы (III) в 10 мл безводного ТГФ добавляют 0.36 мл (2.45 ммоль) (СН3)3SiCF3. Реакционную смесь охлаждают до 0-10°C и при перемешивании прибавляют раствор 0.01 г тригидрата (н-Bu)4NF в 2 мл ТГФ. Охлаждающую баню удаляют, реакционной смеси позволяют нагреться до комнатной температуры, затем смесь выдерживают еще 1 час, прибавляют 5 мл 20% водного раствора HCl и интенсивно перемешивают в течение 20 минут. К смеси добавляют 15 мл хлороформа и доводят pH водного слоя до 10, прибавляя 25% водный раствор аммиака. Органический слой отделяют, водный слой экстрагируют хлороформом (3×10 мл). Органический слой и экстракты объединяют, сушат над безводным Na2SO4 и растворитель отгоняют в вакууме. Получают 0.36 г (67%) соединения формулы IV в виде смеси (20R)- и (20S)-изомеров в соотношении 17:1, представляющей собой прозрачное масло желтоватого цвета. Индивидуальные (20R)- и (20S)-изомеры из полученной смеси выделяют хроматографически на колонке с силикагелем [элюент - 25%-ный водный раствор аммиака:СН3ОН:CHCl3=1:15:1600 (по объему)]. Оба изомера представляют собой масла желтого цвета.
(20R)-изомер:
Масс-спектр (электроспрей) (m/z): 438 [M+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.51 (дд, 2J=13.2 Гц, 3J=6.7 Гц, 1Н, Н-8α), 1.86 (дд, 1Н, Н-15эк), 2.00-2.05 (м, 1Н, Н-15ак), 2.21 (м, 1Н, Н-7β), 2.39 (с, 3Н, NCH3), 2.35-2.44 (м, 2Н, Н-10α+Н-16ак), 2.56 (дд, 1Н, Н-16эк), 2.85 (дд, 2J=13.2 Гц, 3J=9.6 Гц, 1Н, H-8β), 3.21-3.24 (м, 2Н, Н-9, Н-10β), 3.59 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.45 (кв, 1Н, Н-20), 4.57 (д. 1Н, Н-5), 5.50 (д, J18,19=8.7 Гц, 1Н, Н-19), 5.83 (уш.д, 1Н, Н-18), 6.62+6.53 (АВ система, jab=8.3 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CFCl3): - 76.44 (д, J=8.0 Гц, 3F, CF3).
(20S)-изомер:
Масс-спектр (электроспрей) (m/z): 438 [М+1]+.
Спектр 1Н ЯМР (CDCl3, д, м.д., относительно (CH3)4Si): 1.00-1.07 (м, 1Н, Н-8α), 1.83 (дд, 1Н, Н-15эк), 1.95-2.06 (м, 1Н, Н-15ак), 2.11-2.19 (м, 1Н, Н-7β), 2.35 (с, 3Н, NCH3), 2.35-2.43 (м, 2Н, Н-10α+Н-16ак), 2.51 (дд, 1Н, Н-16эк), 2.89 (дд, 2J=13.5 Гц, 3J=9.1 Гц, 1Н, Н-8β), 3.14 (д, 1Н, Н-9), 3.21 (д, 1Н, 2J=18.5 Гц, Н-10β), 3.76 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 3.74-3.83 (м, 1Н, Н-20), 4.57 (д, 1Н, Н-5), 5.59 (д, J18,19=8.9 Гц, 1Н, Н-19), 5.95 (уш.д, 1Н, Н-18), 5.93 (уш.с., 1Н, ОН), 6.62+6.53 (АВ система, JAB=8.1 Гц, 2Н, Н-1+Н-2). Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CFCl3): - 76.71 (д, J=8.0 Гц, 3F, CF3).
Б. Получение 21,21,21-трифтортевинона [3,6-диметокси-17-метил-7α-(трифторацетил)-4,5а-эпокси-6α,14α-этеноизоморфинана] (I) из смеси (20R)- и (20S)-изомеров спирта IV.
К перемешиваемому раствору 0.42 мл (0.005 моль) оксалилхлорида в CH2Cl2 (6 мл) при температуре от -70°С до -78°С добавляют по каплям в течение 20 минут раствор 0.76 мл (0.010 моль) диметилсульфоксида в CH2Cl2 (1 мл). Смесь перемешивают 30 минут при той же температуре, добавляют к ней по каплям в течение 20 минут раствор 1.80 г (0.004 моль) смеси (20R)-и (20S)-изомеров спирта IV в CH2Cl2 (3 мл), перемешивают 30 минут при той же температуре, добавляют 2.86 мл (0.0205 моль) Et3N, и нагревают до температуры 20-25°С. К реакционной смеси добавляют воду (10 мл) и перемешивают в течение 10 минут. Органический слой отделяют, водный слой экстрагируют хлороформом (2×20 мл). Органический слой и экстракты объединяют и сушат над безводным Na2SO4. Растворитель отгоняют и остаток перекристаллизовывают из смеси бензол: гексан (1:3). Получают 1.48 г (85%) соединения (I).
Температура плавления: 118-120°С.
Масс-спектр (электроспрей) (m/z): 436 [M+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (СН3)4Si): 1.38 (дд, 2J=12.7 Гц, 3J=6.7 Гц, 1Н, Н-8α), 1.87-1.92 (м, 1Н, Н-15эк), 1.99-2.04 (м, 1Н, Н-15ак), 2.38 (с, 3Н, NCH3), 2.42-2.48 (м, 2Н, Н-10α+Н-16ак), 2.55 (дд, 1Н, 2J=12.1 Гц, 3J=5.2 Гц, Н-16эк), 3.08 (дд, 2J=12.6 Гц, 3J=9.5 Гц, 1Н, Н-8β), 3.22 (д, 3J=6.4 Гц, 1Н, Н-9), 3.27 (д, 2J=18.5 Гц, 1Н, Н-10β), 3.38 (дд, J7β,8α=6.7 Гц, J7β,8β=9.5 Гц, 1Н, Н-7β), 3.63 (с, 3Н, 6-ОСН3), 3.84 (с, 3Н, 3-ОСН3), 4.60 (д, 4J=1.2 Гц, 1Н, Н-5), 5.62 (д, J18,19=8.9 Гц, 1Н, Н-19), 6.01 (уш. д, 1Н, Н-18), 6.66+6.57 (АВ-система, JAB=8.1 Гц, 2Н. Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CFCl3): -78.83 (с, 3F, CF3).
Спектр 13С ЯМР (CDCl3, δ, м.д., относительно (СН3)4Si): 22.60 (С-10), 31.64 (С-8), 33.35 (С-15), 43.48 (NCH3), 44.79 (С-7), 45.41 (С-16), 47.48 (С-13), 54.45 (6-ОСН3), 56.72 (3-ОСН3), 59.90 (С-9), 82.22 (С-6), 95.85 (С-5), 113.83 (С-2), 115.24 (кв, CF3), 119.63 (C-1), 125.22 (С-18), 128.11 (C-11), 133.72 (С-12), 136.34 (С-19), 141.92 (С-3), 147.87 (С-4), 192.47 (кв, СО). ИК-спектр: νc=o 1760 см-1 (в таблетке с KBr).
Пример 2. Получение 21,21,21-трифтортевинона [3,6-диметокси-17-метил-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинана] (I) из (20R)-изомера соединения IV.
А. По методике, описанной в примере 1А получают смесь (20R)- и (20S)-изомеров соединения IV. Индивидуальные изомеры из смеси выделяют хроматографически на колонке с силикагелем [элюент - 25%-ный водный раствор аммиака:СН3ОН:CHCl3=1:15:1600 (по объему)]. Оба изомера представляют собой масла желтого цвета.
Б. По методике, описанной в примере 1Б из 0.23 мл (0.0028 моль) оксалилхлорида, 0.42 мл (0.0056 моль) диметилсульфоксида, 1.00 г (0.0023 моль) (20R)-изомера спирта (IV) и 1.59 мл (0.0114 моль) Et3N получают 0.82 г (82%) соединения (I), свойства которого идентичны свойствам продукта, получение которого описано в примере 1Б.
Пример 3. Получение 17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана (V).
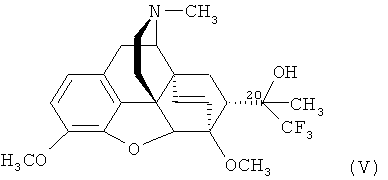
К раствору CH3MgI, полученному из 0,025 г (1,04 ммоль) магния в эфире (15 мл), прибавляют 0,20 г (0,46 ммоль) [3,6-диметокси-17-метил-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинана] формулы (I) и перемешивают при комнатной температуре в течение 15 мин. К реакционной смеси добавляют 25 мл насыщенного раствора NH4Cl, 25 мл воды и экстрагируют 25 мл диэтилового эфира. Органический слой отделяют и промывают водой (2×15 мл), сушат над безводным Na2SO4. Растворитель отгоняют в вакууме. Остаток в виде масла желтого цвета представляет собой смесь (20R)- и (20S)- изомеров 17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана формулы (V) в соотношении 3:2, которую разделяют хроматографией на колонке с силикагелем (элюент - хлороформ: СН3ОН: 25%-ный водный раствор NH3=1500:15:1).
(20R)-изомер: т.пл.: 162-163°С.
Масс-спектр (электроспрей) (m/z): 452 [М+1]+
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.24-1.32 (м, 1Н, Н-8а), 1.33 (с, 3Н, СН3), 1.82-1.88 (м, 1Н, Н-15эк), 1.88-1.99 (м, 1Н, Н-15ак), 2.10 (м, 1Н, Н-7β), 2.36 (с, 3Н, NCH3), 2.34-2.42 (м, 2Н, Н-10α+Н-16ак), 2.51 (дд, 1Н, Н-16эк), 2.86 (дд, 2J=12.5 Гц, 3J=9.8 Гц, 1Н, Н-8β), 3.14 (д, 3J=6.4 Гц, 1Н, Н-9), 3.20 (д, 2J=18.7 Гц, 1Н, Н-10β), 3.77 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.47 (д, 1Н, Н-5), 5.49 (д, J18,19=9.0 Гц, 1Н, Н-19), 5.94 (с, 1Н, ОН), 6.04 (уш. д., 1Н, Н-18), 6.62+6.52 (АВ-система, jab=8.1 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно (CFCl3): -74.49 (с, 3F, CF3).
(20S)-изомер: т.пл. 196-198°С (из метанола).
Масс-спектр (электроспрей) (m/z): 452 [M+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (СН3)4Si): 1.06 (м, 1Н, Н-8α), 1.18 (с, 3Н, СН3), 1.82-1.86 (м, 1Н, Н-15эк), 1.97 (м, 1Н, Н-15ак), 2.27 (m, 1Н, Н-7β), 2.35 (с, 3Н, NCH3), 2.33-2.41 (м, 2Н, Н-10α+Н-16ак), 2.50 (м, 1Н, Н-16эк), 2.90 (дд, 2J8β,8α=13.2 Гц, 3J8β,7β=9.0 Гц, 1Н, Н-8β) 3.13 (д, 3JH-9,H-10α=6.5 Гц, 1Н, Н-9), 3.21 (д, 2JH-10α,H-10β=18.6 Гц, 1Н, Н-10β), 3.80 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.54 (д, 4J=1.2 Гц, 1Н, Н-5), 5.52 (д, J18,19=8.9 Гц, 1Н, Н-19), 5.63 (с, 1Н, ОН), 5.95 (уш. д, 1Н, Н-18), 6.62+6.52 (АВ-система, jab=8.2 Гц, 2Н, Н-1+Н-2).
Спектр 19F ЯМР: -79.57 (с, CF3).
Пример 4. Получение (20R)-3,6-дигидрокси-17-метил-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана формулы (VI).
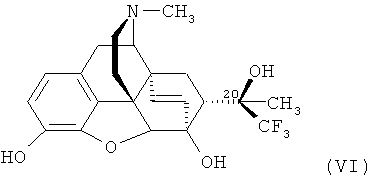
К раствору 1.00 г (2.22 ммоль) (20R)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана формулы (V), полученного в Примере 3, в дихлорметане (20 мл) при температуре от -70°C до -78°C в течение 10 минут добавляют 22.2 мл 1 М раствора BBr3 (22.2 ммоль) в дихлорметане. Реакционную смесь оставляют при постоянном перемешивании нагреваться до комнатной температуры, после чего добавляют метанол, доводят pH смеси до нейтральной реакции 25%-ным раствором аммиака и экстрагируют продукты хлороформом (3×50 мл). Органические экстракты объединяют, высушивают над безводным Na2SO4, растворитель отгоняют и остаток хроматографируют на колонке с силикагелем (элюент: NH4OH:СН3ОН:CHCl3=1:15:1600. Масс-спектр и ЯМР-спектры зарегистрированы для продукта формулы (VI) в виде основания, полученного непосредственно в результате хроматографии в виде масла желтого цвета.
Масс-спектр (электроспрей) (m/z): 424 [М+1]+.
Спектр 1H ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.31-1.35 (м, 1Н, Н-8α), 1.37 (с, 3Н, СН3), 1.88 (дд, 1Н, Н-15эк), 1.92-2.00 (м, 1Н, Н-15ак), 2.13 (м, 1Н, Н-7β), 2.36 (с, 3Н, NCH3), 2.34-2.42 (м, 2Н, Н-10α+Н-16ак), 2.53 (дд, 1Н, 2J=11.7 Гц, 3J=4.8 Гц, Н-16эк), 2.86 (дд, 2J=12.8 Гц, 3J=9.8 Гц, 1Н, Н-8β), 3.16 (д, 3J=7.4 Гц, 1Н, Н-9), 3.20 (д, 2J=19.3 Гц, 1Н, Н-10β), 4.33 (с, 1Н, Н-5), 4.59 (с, 1Н, ОН), 5.38 (д, J18,19=8.7 Гц, 1Н, Н-19), 5.51 (с, 1Н, ОН), 5.63 (уш. д, 1Н, Н-18), 6.59+6.49 (АВ-система, jab=8.1 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CDCl3): -74.36 (с, 3F, CF3).
В результате подкисления основания формулы (VI) соляной кислотой и осаждения из смеси этанол/эфир получают 0.43 г (46%) гидрохлорида продукта формулы (VI) с т.пл. 260°С (разл.).
Техническим результатом изобретения является новое вещество - 17-метил-3,6-диметокси-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинан (I), который является первым фторсодержащим производным тевинона. Наличие нескольких реакционноспособных групп в молекуле заявляемого соединения позволяет использовать его в качестве исходного соединения для получения ряда новых производных 6α,14α-этеноизоморфинанов, содержащих трифторметильную группу, в частности фторпроизводных тевинола и орвинола, что делает возможным синтез новых фторсодержащих лигандов опиоидных рецепторов.