Результат интеллектуальной деятельности: 7α-(1-ГИДРОКСИ-2,2,2-ТРИФТОРЭТИЛ)-17-МЕТИЛ-3,6-ДИМЕТОКСИ-4,5α-ЭПОКСИ-6α,14αЭТЕНОИЗОМОРФИНАН И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
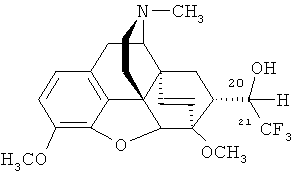
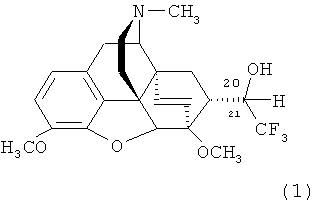
Изобретение относится к новому фторсодержащему гетероциклическому соединению, содержащему циклическую систему 4aH-8,9c-иминоэтанфенантро[4,5-b,с,d]фурана, конденсированную с карбоциклическим кольцом, более точно, с мостиковой группой в положениях 6 и 14, состоящей только из двух атомов углерода, а именно к 7α-(1-гидрокси-2,2,2-трифторэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинану формулы
 ,
,
и к способу его получения.
Заявляемое соединение является фторпроизводным алкалоидов морфинанового типа и может использоваться в качестве исходного соединения для получения фторсодержащих производных изоморфинанов - тевинона, тевинола и орвинола, последние могут найти применение в качестве действующего начала лекарственных средств.
Заявляемое соединение, его свойства и способ получения в литературе не описаны.
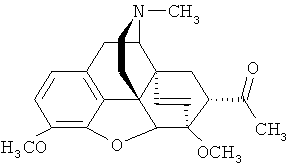
Наиболее близким по структуре к заявляемому соединению является его не содержащий фтора аналог - 7α-(1-гидроксиэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинан - формулы
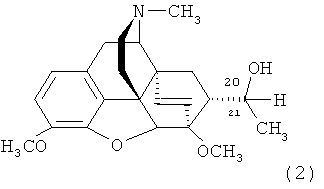 ,
,
для которого обычно используют название «тевинол», так как он является продуктом восстановления «тевинона», хорошо известного соединения, которое представляет собой аддукт тебаина и винилметилкетона формулы
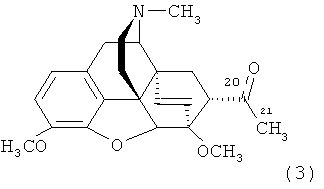 .
.
Тривиальное название «тевинон» было специально введено как основа существенно более краткой номенклатуры данного класса соединений [K.W. Bentley, D.G. Hardy, В. Meek. Novel Analgesics and Molecular Rearrangements in the Morphine-Thebaine Group. II. Alcohols Derived from 6,14-endo-Etheno- and 6,14-endo-Ethanotetrahydrothebaine. // J. Amer. Chem. Soc, 89 (13), 3273-3280 (1967)].
В соответствии с такой номенклатурой заявляемое соединение будет иметь название 21,21,21-трифтортевинол, а соответствующий ему фторсодержащий кетон формулы (4) - название 21,21,21-трифтортевинон.
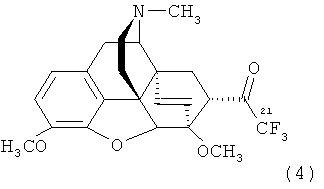 .
.
Далее в данной заявке для краткости будут использоваться вышеуказанные тривиальные названия.
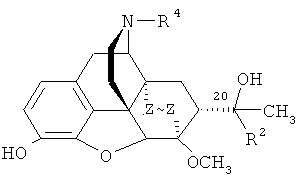
Известно, что тевинон (3) является ключевым исходным соединением для получения ряда веществ, относящихся к классу тевинолов общей формулы
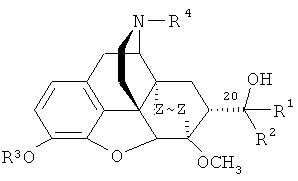 ,
,
где R1=СН3; R2=Н, алкильная, алкенильная, алкинильная, циклоалкильная, арильная или другая органическая группа; R3=СН3; R4=СНз; Z~Z=СН=СН, СН2СН2) и к классу орвинолов общей формулы
 ,
,
где R2=Н, алкильная, алкенильная, алкинильная, циклоалкильная, арильная или другая органическая группа; R4=Н, алкильная, аллильная, пропаргильная, циклоалкилметильная, либо другая органическая группа; Z~Z=СН=СН, СН2СН2) [A.F. Casy, R.Т. Parfitt, Opioid Analgesics. Chemistry and Receptors, Plenum Press, New York, London, 1986], [K.W. Bentley. Brit. Pat. 1136214 (1968). Chem. Abstr., 70: 78218s (1969)], [H.S. Park, H.Y. Lee, Y.H. Kim, J.K. Park, E.E. Zvartau, H. Lee. A highly selective κ-opioid receptor agonist with low addictive potential and dependence liability. // Bioorg. Med. Chem. Lett., 16, (13), 3609-3613 (2006)]
Известно, что тевинолы являются предшественниками орвинолов, которые представляют собой деметилированные производные тевинолов и содержат гидроксильную группу в положении 3 гетероциклической системы.
Известно, что орвинолы представляют собой один из важнейших классов лигандов опиоидных рецепторов. Орвинолы широко применяются в медицине в качестве обезболивающих средств для лечения острых и хронических болей средней и высокой интенсивности и для лечения наркомании (бупренорфин, дигидроэторфин), а также в ветеринарии для обездвиживания крупных животных (эторфин), выведения их из этого состояния (эторфин) и лечения острых передозировок наркотических анальгетиков (дипренорфин) (G.R. Lenz, S.М. Evans, D.Е. Walters, A.J. Hopfinger, in: Opiates, Academic Press, Orlando - London, 1986).
Ранее не были известны фторсодержащие производные тевинона, тевинолов и орвинолов.
Заявляемое соединение - 21,21,21-трифтортевинол (1) - является первым представителем фторсодержащих тевинолов и наиболее эффективно может быть использован в качестве исходного соединения для получения фторсодержащего тевинона (21,21,21-трифтортевинона) формулы (4), который является предшественником фторсодержащих тевинолов и орвинолов.
Принимая во внимание тот факт, что известный тевинон (3) является ключевым соединением для синтеза множества тевинолов и орвинолов, синтез его фторсодержащего аналога (4) и использование последнего в качестве исходного вещества открывает широкие возможности для получения тевинолов и орвинолов, в которых атомы водорода в положении 21 замещены на атомы фтора.
Известно, что введение атомов фтора в молекулы фармакологически активных соединений влияет на их активность, в частности, за счет повышения липофильности молекул, улучшения их транспорта in vivo и большей устойчивости связей C-F к метаболизму [S.V. Druzhinin, Е.S. Balenkova, V.G. Nenajdenko. Recent advances in the chemistry of α,β-unsaturated trifluoromethylketones. // Tetrahedron, 63 (33), 7753-7808 (2007)]. Кроме того, размеры атома фтора не сильно отличаются от размеров атома водорода, в частности, ван-дер-ваальсовы радиусы групп CH3 и CF3 равны 1.29 А и 1.35 А, соответственно [S.V. Druzhinin, Е.S. Balenkova, V.G. Nenajdenko. Recent advances in the chemistry of α,β-unsaturated trifluoromethylketones. // Tetrahedron, 63 (33), 7753-7808 (2007)]. Поэтому геометрические параметры биоактивной молекулы в значительной степени сохраняются при частичной замене в ней атомов водорода на атомы фтора, а ее взаимодействие с биомишенью не затрудняется стерически по сравнению с нефторированным аналогом.
Существует потребность в получении новых лигандов опиоидньгх рецепторов с заданным профилем связывания с рецепторами, в связи с этим получение фторсодержащих орвинолов и их предшественников является актуальной задачей.
Известен способ получения не содержащего фтор аналога заявляемого соединения - тевинола (2) - присоединением MeMgl к соответствующему альдегиду (5) [Н. Саксена. Авт. свид. СССР 1362734 (1987)].
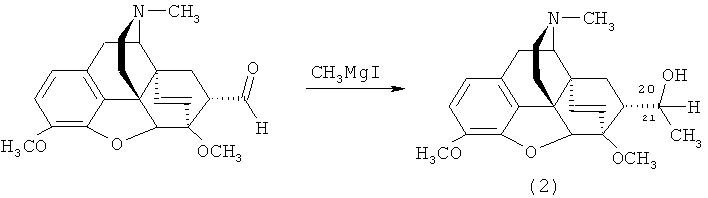
Получить заявляемое соединение (1) вышеуказанным способом не представляется возможным из-за чрезвычайной нестабильности металлоорганических соединений CF3MgX (где X = галоген) [R.N. Haszeldine. Neuere Chemie des Fluors. Organometall- und Organometalloid-Verbindungen des Fluors. Angew. Chem., 66, (22), 693-701 (1954)], [R.N. Hasseldine. Perfluoroalkyl Grignard and Grignard-type Reagents. Part IV. Trifluoromethylmagnesium Iodide. J. Chem. Soc, 1273-1279 (1954)], [E.T. McBee, R.D. Battershell, H.P. Braendlin. A New Synthesis of Perfluoroalkylmagnesium Halides. J. Org. Chem., 28, (4), 1131-1133 (1963)], [K.J. Klabunde, H.F. Efner, L. Satek and W. Donley, Preparation of an extremely active magnesium slurry for Grignard reagent preparations by metal atom-solvent cocondensation. J. Organometal. Chem., 71, 309-313 (1974)] и CF3Li [R.N. Haszeldine. Neuere Chemie des Fluors. Organometall- und Organometalloid-Verbindungen des Fluors. Angew. Chem., 66, (22), 693-701 (1954)], [O.R. Pierce, E.T. McBee, G.F. Judd. Preparation and Reactions of Perfluoroalkyllithiums. J. Amer. Chem. Soc, 76, (2), (1954)].
Задачей настоящего изобретения является получение ранее неизвестного реакционноспособного фторсодержащего производного тевинола, который можно использовать в качестве исходного соединения для получения фторсодержащих тевинона, тервинолов и орвинолов, и разработка способа его получения.
Поставленная задача решается новым соединением 7α-(1-гидрокси-2,2,2-трифторэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинаном (1) и способом его получения, который заключается в том, что альдегид формулы (5) подвергают взаимодействию с реактивом Руперта-Пракаша [CF3Si(CH3)3] в присутствии тригидрата тетрабутиламмонийфторида (в качестве источника фторид-иона) в растворителе, таком, как тетрагидрофуран, затем обрабатывают реакционную смесь соляной кислотой и выделяют целевой продукт известными приемами. Заявляемый способ представлен на следующей ниже схеме:
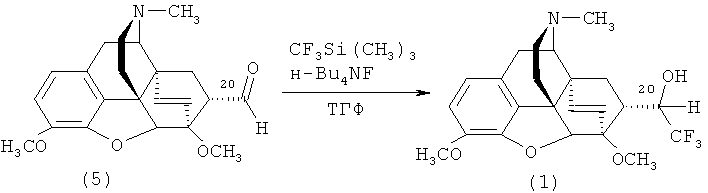
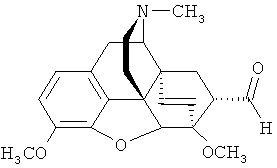
В качестве исходных веществ для получения целевого 21,21,21-трифтортевинола (1) используют коммерчески доступный Me3SiCF3 [I. Ruppert, K. Schlich,W. Volbach. Tetrahedron Lett., 25, (21), 2195-2198 (1984)], [G.K.S. Prakash, R. Krishnamurti, G.A. Olah. J. Amer. Chem. Soc, 111, (1), 393-395 (1989)]) и альдегид (5), который является доступным соединением: его легко и с высоким выходом получают в одну стадию из природного сырья (тебаина) [J.J. Kopcho, J.C. Schaeffer. Selective ODemethylation of 7-α-(Arninomethyl)-6,14-e«i/o-ethenotetrahydrothebaine. // J. Org. Chem., 51(9), 1620-1622 (1986)].
Предложенный способ позволяет получать заявляемое соединение (1) с высоким выходом в виде смеси (20i?)-H (205)-изомеров в соотношении 17:1, индивидуальные изомеры выделяют колоночной хроматографией. Структура заявляемого соединения подтверждена спектроскопически: ЯМР (19F и 1H) и масс-спектрами.
Заявляемое соединение является исходным веществом для получения трифторзамещенного тевинона (4) - предшественника фторсодержащих производных тевинолов и орвинолов:
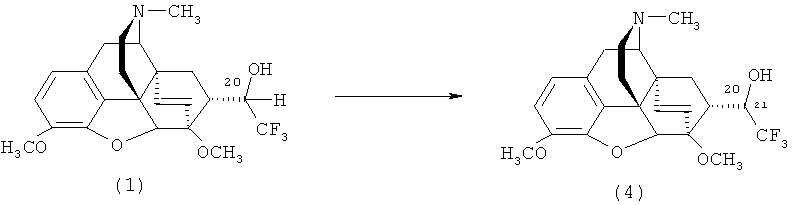
Изобретение иллюстрируется конкретными примерами его осуществления, приведенными ниже.
Пример 1. Получение 7α-(1-гидрокси-2,2,2-трифторэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинана формулы (1).

К раствору 0.45 г (1.22 ммоль) альдегида формулы (5) в 10 мл безводного ТГФ добавляют 0.36 мл (2.45 ммоль) (CH3)3SiCF3. Реакционную смесь охлаждают до 0-10°C и при перемешивании прибавляют раствор 0.01 г тригидрата (н-Bu)4NF в 2 мл ТГФ. Охлаждающую баню удаляют, реакционной смеси позволяют нагреться до комнатной температуры, затем смесь выдерживают еще 1 час, прибавляют 5 мл 20% водного раствора HCl и интенсивно перемешивают в течение 20 минут. К смеси добавляют 15 мл хлороформа и доводят pH водного слоя до 10, прибавляя 25% водный раствор аммиака. Органический слой отделяют, водный слой экстрагируют хлороформом (3×10 мл). Органический слой и экстракты объединяют, сушат над безводным Na2SO4 и растворитель отгоняют в вакууме. Получают 0.36 г (67%) соединения формулы (1) (где Z-Z=CH=CH) в виде смеси (20R)- и (20S)-изомеров в соотношении 17:1, представляющей собой прозрачное масло желтоватого цвета. Индивидуальные (20R)- и (20S)-изомеры из полученной смеси выделяют хроматографически на колонке с силикагелем [элюент - 25%-ный водный раствор аммиака: CH3OH:CHCl3=1:15:1600 (по объему)]. Оба изомера представляют собой масла желтого цвета.
(20R)-изомер:
Масс-спектр (электроспрей) (m/z): 438 [M+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.51 (дд, 2J=13.2 Гц, 3J=6.7 Гц, 1H, Н-8α), 1.86 (дд, 1H, Н-15эк), 2.00-2.05 (м, 1Н, Н-15ак), 2.21 (т, 1Н, Н-7β), 2.39 (с, 3Н, NCH3), 2.35-2.44 (м, 2Н, Н-10α+Н-16ак), 2.56 (дд, 1H, Н-16эк), 2.85 (дд, 2J=13.2 Гц, 3J=9.6 Гц, 1H, Н-8β, 3.21-3.24 (м, 2Н, Н-9, Н-10β), 3.59 (с, 3H, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.45 (кв, 1Н, Н-20), 4.57 (д, 1Н, Н-5), 5.50 (д, J18,19=8.7 Гц, 1Н, Н-19), 5.83 (уш. д, 1H, Н-18), 6.62+6.53 (АВ система, JAB=8.3 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CFCl3): - 76.44 (д, J=8.0 Гц, 3F, CF3).
(20S)-изомер:
Масс-спектр (электроспрей) (m/z): 438 [М+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.00-1.07 (м, 1Н, Н-8α), 1.83 (дд, 1Н, Н-15эк), 1.95-2.06 (м, 1H, Н-15ак), 2.11-2.19 (м, 1H, Н-7β), 2.35 (с, 3Н, NCH3), 2.35-2.43 (м, 2Н, Н-10α+Н-16ак), 2.51 (дд, 1Н, Н-16эк), 2.89 (дд, 2J=13.5 Гц, 3J=9.1 Гц, 1H, Н-1H, 3.14 (д, 1H, Н-9), 3.21 (д, 1H, 2J=18.5 Гц, Н-10β), 3.76 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 3.74-3.83 (м, 1H, Н-20), 4.57 (д, 1H, Н-5), 5.59 (д, J18,19=8.9 Гц, 1H, Н-19), 5.95 (уш. д, 1H, Н-18), 5.93 (уш. с, 1H, ОН), 6.62+6.53 (АВ система, JAB=8.1 Гц, 2Н, Н-1+Н-2). Спектр 19F-ЯМР (CDCl3, 8, м.д., относительно CFCl3): - 76.71 (д, J=8.0 Гц, 3F, CF3).
Пример 2. Получение 21,21,21 -трифтортевинона [3,6-диметокси-17-метил-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинана] (4).
К перемешиваемому раствору 0.42 мл (0.005 моль) оксалилхлорида в CH2Cl2 (6 мл) при температуре от -70°C до -78°C добавляют по каплям в течение 20 минут раствор 0.76 мл (0.010 моль) диметилсульфоксида в CH2Cl2 (1 мл). Смесь перемешивают 30 минут при той же температуре, добавляют к ней по каплям в течение 20 минут раствор 1.80 г (0.004 моль) смеси (20R)- и (20S)-изомеров спирта формулы (1), полученной в Примере 1, в CH2Cl2 (3 мл), перемешивают 30 минут при той же температуре, добавляют 2.86 мл (0.0205 моль) Et3N, и нагревают до температуры 20-25°C. К реакционной смеси добавляют воду (10 мл) и перемешивают в течение 10 минут. Органический слой отделяют, водный слой экстрагируют хлороформом (2×20 мл). Органический слой и экстракты объединяют и сушат над безводным Na2SO4. Растворитель отгоняют и остаток перекристаллизовывают из смеси бензол: гексан (1:3). Получают 1.48 г (85%) соединения (4).
Температура плавления: 118-120°C.
Масс-спектр (электроспрей) (m/z): 436 [М+1]+.
Спектр 1Н ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.38 (дд, 2J=12.7 Гц, 3J=6.7 Гц, 1Н, Н-8α), 1.87-1.92 (м, 1Н, Н-15эк), 1.99-2.04 (м, 1Н, Н-15ак), 2.38 (с, 3Н, NCH3), 2.42-2.48 (м, 2Н, Н-10α+Н-16ак), 2.55 (дд, 1Н, 2J=12.1 Гц, 3J=5.2 Гц, Н-16эк), 3.08 (дд, 2J=12.6 Гц, 3J=9.5 Гц, 1H, Н-8β), 3.22 (д, 3J=6.4 Гц, 1Н, Н-9), 3.27 (д, 2J=18.5 Гц, 1Н, Н-10β), 3.38 (дд, J7β,8a=6.7 Гц, J7β,8β=9.5 Гц, 1Н, H-7β), 3.63 (с, 3Н, 6-ОСН3), 3.84 (с, 3Н, 3-ОСН3), 4.60 (д, 4J=1.2 Гц, 1H, Н-5), 5.62 (д, J18,19=8.9 Гц, 1Н, Н-19), 6.01 (уш. д, 1Н, Н-18), 6.66+6.57 (АВ-система, Jab=8.1 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, д, м.д., относительно CFCl3): -78.83 (с, 3F, CF3).
Спектр 13С ЯМР (CDCl3, 3, м.д., относительно (CH3)4Si): 22.60 (С-10), 31.64 (С-8), 33.35 (С-15), 43.48 (NCH3), 44.79 (С-7), 45.41 (С-16), 47.48 (С-13), 54.45 (6-ОСН3), 56.72 (3-ОСН3), 59.90 (С-9), 82.22 (С-6), 95.85 (С-5), 113.83 (С-2), 115.24 (кв, CF3), 119.63 (С-1), 125.22 (С-18), 128.11 (С-11), 133.72 (С-12), 136.34 (С-19), 141.92 (С-3), 147.87 (С-4), 192.47 (кв, CO). ИК-спектр: νC=O 1760 см-1 (в таблетке с KBr).
Пример 3. Получение тевинола формулы (6) (17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана) формулы (6).
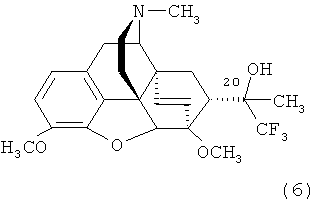
К раствору CH3MgI, полученному из 0,025 г (1,04 ммоль) магния в эфире (15 мл), прибавляют 0,20 г (0,46 ммоль) [3,6-диметокси-17-метил-7α-(трифторацетил)-4,5α-эпокси-6α,14α-этеноизоморфинана] формулы (4) и перемешивают при комнатной температуре в течение 15 мин. К реакционной смеси добавляют 25 мл насыщенного раствора NH4Cl, 25 мл воды и экстрагируют 25 мл диэтилового эфира. Органический слой отделяют и промывают водой (2×15 мл), сушат над безводным Na2SO4. Растворитель отгоняют в вакууме. Остаток в виде масла желтого цвета представляет собой смесь (20R)- и (20S)- изомеров 17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана формулы (6) в соотношении 3:2, которую разделяют хроматографией на колонке с силикагелем (элюент - хлороформ:СН3ОН:25%-ный водный раствор NH3=1500:15:1).
(20R)-изомер: т.пл.: 162-163°C.
Масс-спектр (электроспрей) (m/z): 452 [М+1]+
Спектр 1Н ЯМР (CDCL3, д, м.д., относительно (CH3)4Si): 1.24-1.32 (м, 1H, Н-8α), 1.33 (с, 3Н, СН3), 1.82-1.88 (м, 1H, Н-15эк), 1.88-1.99 (м, 1Н, Н-15ак), 2.10 (м, 1Н, H-7β), 2.36 (с, 3Н, NCH3), 2.34-2.42 (м, 2Н, Н-10α+Н-16ак), 2.51 (дд, 1Н, Н-16эк), 2.86 (дд, 2J=12.5 Гц, 3J=9.8 Гц, 1Н, Н-8β), 3.14 (д, 3J=6.4 Гц, 1H, Н-9), 3.20 (д, 2J=18.7 Гц, 1Н, Н-10β), 3.77 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.47 (д, 1H, Н-5), 5.49 (д, J18,19=9.0 Гц, 1Н, Н-19), 5.94 (с, 1H, ОН), 6.04 (уш. д., 1Н, Н-18), 6.62+6.52 (АВ-система, JAB=8.1 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, δ, м.д., относительно CFCl3): - 74.49 (с, 3F, CF3).
(20S)-изомер: т. пл. 196-198°C (из метанола).
Масс-спектр (электроспрей) (m/z): 452 [М+1]+.
Спектр 1H ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.06 (м, 1Н, Н-8α), 1.18 (с, 3Н, СН3), 1.82-1.86 (м, 1H, Н-15эк), 1.97 (м, 1H, Н-15ак), 2.27 (т, 1Н, Н-7β), 2.35 (с, 3Н, NCH3), 2.33-2.41 (м, 2Н, Н-10α+Н-16ак), 2.50 (м, 1H, Н-16эк), 2.90 (дд, 2J8β,8α=13.2 Гц, 3J8β,7β=9.0 Гц, 1Н, Н-8β), 3.13 (д, 3JH-9,H-10α=6.5 Гц, 1H, Н-9), 3.21 (д, 2JH-10α, H-10β=18.6 Гц, 1Н, Н-10β), 3.80 (с, 3Н, 6-ОСН3), 3.81 (с, 3Н, 3-ОСН3), 4.54 (д, 4J=1.2 Гц, 1H, Н-5), 5.52 (д, J18,19=8.9 Гц, 1H, Н-19), 5.63 (с, 1Н, ОН), 5.95 (уш. д, 1Н, Н-18), 6.62+6.52 (АВ-система, JAB=8.2 Гц, 2Н, Н-1+Н-2).
Спектр 19F ЯМР: -79.57 (с, CF3).
Пример 4. Получение орвинола формулы (7) (20R)-3,6-дигидрокси-17-метил-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана.
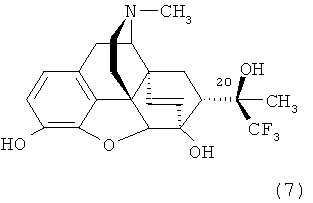
К раствору 1.00 г (2.22 ммоль) (20R)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этено-7α-(1-гидрокси-1-метил-2,2,2-трифторэтил)изоморфинана формулы (6), полученного в Примере 3, в дихлорметане (20 мл) при температуре от -70°C до -78°C в течение 10 минут добавляют 22.2 мл 1 М раствора BBr3 (22.2 ммоль) в дихлорметане. Реакционную смесь оставляют при постоянном перемешивании нагреваться до комнатной температуры, после чего добавляют метанол, доводят pH смеси до нейтральной реакции 25%-ным раствором аммиака и экстрагируют продукты хлороформом (3×50 мл). Органические экстракты объединяют, высушивают над безводным Na2SO4, растворитель отгоняют и остаток хроматографируют на колонке с силикагелем (элюент:NH4OH:CH3OH:CHCl3=1:15:1600. Масс-спектр и ЯМР-спектры зарегистрированы для продукта формулы (7) в виде основания, полученного непосредственно в результате хроматографии в виде масла желтого цвета.
Масс-спектр (электроспрей) (m/z): 424 [М+1]+.
Спектр 1Я ЯМР (CDCl3, δ, м.д., относительно (CH3)4Si): 1.31-1.35 (м, 1H, Н-8α), 1.37 (с, 3Н, СН3), 1.88 (дд, 1H, Н-15эк), 1.92-2.00 (м, 1Н, Н-15ак), 2.13 (м, 1Н, Н-7β), 2.36 (с, 3Н, NCH3), 2.34-2.42 (м, 2Н, Н-10α+Н-16ак), 2.53 (дд, 1H, 2J=11.7 Гц, 3J=4.8 Гц, Н-16эк), 2.86 (дд, 2J=12.8 Гц, 3J=9.8 Гц, 1H, H-8β), 3.16 (д, 3J=7.4 Гц, 1Н, Н-9), 3.20 (д, 2J=19.3 Гц, 1H, H-10β), 4.33 (с, 1Н, Н-5), 4.59 (с, 1Н, ОН), 5.38 (д, J18,19=8.7 Гц, 1Н, Н-19), 5.51 (с, 1H, ОН), 5.63 (уш. д, 1Н, Н-18), 6.59+6.49 (АВ-система, JAB=8.1 Гц, 2Н, Н-1+Н-2).
Спектр 19F-ЯМР (CDCl3, 5, м.д., относительно CFCl3): -74.36 (с, 3F, CF3).
В результате подкисления основания формулы (7) соляной кислотой и осаждения из смеси этанол/эфир получают 0.43 г (46%) гидрохлорида продукта формулы (7) с т.пл. 260°C (разл.).
Техническим результатом изобретения является новое вещество - 7α-(1-гидрокси-2,2,2-трифторэтил)-17-метил-3,6-диметокси-4,5α-эпокси-6α,14α-этеноизоморфинан, который является первым представителем фторсодержащих гетероциклических соединений, содержащих циклическую систему 4aH-8,9c-иминоэтанфенантро[4,5-b,c,e]фурана, конденсированную с карбоциклическим кольцом, более точно, с мостиковой группой в положениях 6 и 14, состоящей из двух атомов углерода. Заявляемое соединение является предшественником большой группы новых соединений: фторпроизводных тевинона, тевинола и орвинола, и может быть использовано в качестве исходного соединения для их получения.
Заявляемое соединение и предложенный способ его получения открывают широкие возможности для синтеза лигандов опиоидных рецепторов, содержащих атомы фтора.