Результат интеллектуальной деятельности: ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к аналогам пептида эксендина-4, которые активируют рецептор глюкагоноподобного пептида 1 (GLP-1) и глюкозозависимого инсулинотропного полипептида (GIP) и, необязательно, рецептор глюкагона (GCG), и к их использованию в медицине, например, при лечении нарушений метаболического синдрома, включая диабет и ожирение, так же как в снижении избыточного потребления пищи.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
Эксендин-4 представляет собой пептид, состоящий из 39 аминокислот, продуцируемый слюнными железами ядозуба (Heloderma suspectum) (Eng J. et al., J. Biol. Chem., 267:7402-05,1992). Эксендин-4 является активатором рецептора глюкагоноподобного пептида-1 (GLP-1), в то время как для него показана только очень низкая активация рецептора GIP, и он не активирует рецептор глюкагона (см. таблицу 1).
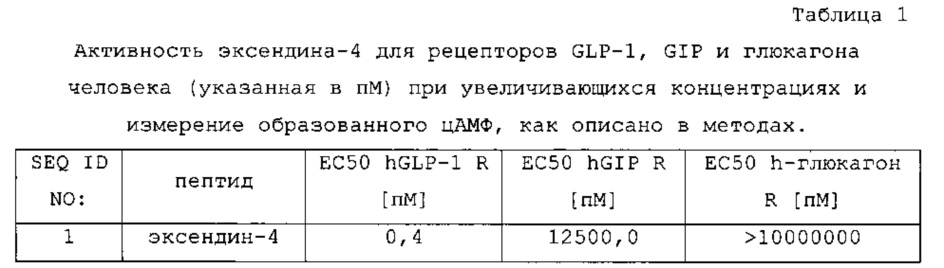
Эксендин-4 разделяет множество глюкорегуляторных действий, наблюдаемых для GLP-1. Клинические и неклинические исследования показали, что эксендин-4 обладает несколькими преимущественными противодиабетическими свойствами, включая глюкозозависимое усиление синтеза и секреции инсулина, глюкозозависимую супрессию секреции глюкагона, замедление опорожнения желудка, уменьшение потребления пищи и массы тела, и увеличение массы бета-клеток и маркеров функционирования бета-клеток (Gentilella R et al., Diabetes Obes Metab., 11:544-56, 2009; Norris SL et al., Diabet Med., 26:837-46, 2009; Bunck MC et al., Diabetes Care., 34:2041-7, 2011).
Эти эффекты являются преимущественными не только для пациентов с диабетом, но также для пациентов, страдающих от ожирения. Пациенты с ожирением обладают более высоким риском получения диабета, гипертензии, гиперлипидемии, сердечно-сосудистых и скелетно-мышечных заболеваний.
По сравнению с GLP-1 и GIP, эксендин-4 является более устойчивым к расщеплению дипептидил-пептидазой-4 (DPP4), что приводит к более длительному времени полужизни и продолжительности действия in vivo (Eng J., Diabetes, 45 (Suppl 2):152A (abstract 554), 1996; Deacon CF, Horm Metab Res, 36: 761-5, 2004).
Показано также, что эксендин-4 является намного более стабильным в отношении деградации нейтральной эндопептидазой (NEP), по сравнению с GLP-1, глюкагоном или оксинтомодулином (Druce MR et al., Endocrinology, 150(4), 1712-1721, 2009).
Тем не менее, эксендин-4 является химически лабильным из-за окисления метионина в положении 14 (Hargrove DM et al., Regul. Pept., 141: 113-9, 2007), так же как дезамидирования и изомеризации аспарагина в положении 28 (WO 2004/035623).
Аминокислотная последовательность эксендина-4 показана как SEQ ID NO: 1:
HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
Аминокислотная последовательность GLP-1(7-36)-амида показана как SEQ ID NO: 2:
HAEGTFTSDVSSYLEGQAAKEFIAWLVKGR-NH2
Лираглутид представляет собой продаваемый на рынке химически модифицированный аналог GLP-1, в котором, среди других модификаций, жирная кислота присоединена к лизину в положении 20, приводя к продленной продолжительности действия (Drucker DJ et al, Nature Drug Disc. Rev. 9, 267-268, 2010; Buse, JB et al., Lancet, 374:39-47, 2009).
Аминокислотная последовательность лираглутида показана как SEQ ID NO: 3:
HAEGTFTSDVSSYLEGQAAK((S)-4-карбокси-4-гексадеканоиламинобутирил-)EFIAWLVRGRG-OH
GIP (глюкозозависимый инсулинотропный полипептид) представляет собой пептид из 42 аминокислот, который высвобождается из K-клеток кишечника после приема пищи. GIP и GLP-1 представляют собой два гормона, происходящие из энтероэндокринных клеток кишечника, обеспечивающие инкретиновый эффект, обеспечивающий более 70% ответа инсулина на пероральный тест толерантности к глюкозе (Baggio LL, Drucker DJ. Biology of incretins: GLP-1 и GIP. Gastroenterology 2007; 132: 2131-2157).
Аминокислотная последовательность GIP показана как SEQ ID NO: 4:
YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ-OH
Глюкагон представляет собой пептид из 29 аминокислот, который высвобождается в кровоток, когда циркулирующий уровень глюкозы является низким. Аминокислотная последовательность глюкагона показана на SEQ ID NO: 5:
HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH
В ходе гипогликемии, когда уровни глюкозы в крови падают ниже нормы, глюкагон подает сигналы печени к разрушению гликогена и высвобождению глюкозы, что вызывает повышение уровня глюкозы в крови до достижения нормального уровня. Гипогликемия является распространенным побочным эффектом у подвергнутых лечению инсулином пациентов с гипергликемией (повышенными уровнями глюкозы в крови), обусловленной диабетом. Таким образом, наиболее преобладающей ролью глюкагона в регуляции глюкозы является противодействие действию инсулина и поддержание уровней глюкозы в крови.
Holst (Holst, J. J. Physiol. Rev. 2007, 87, 1409) и Meier (Meier, J. J. Nat. Rev. Endocrinol. 2012, 8, 728) описывают, что агонисты рецептора GLP-1, такие как GLP-1, лираглутид и эксендин-4, улучшают гликемический контроль у пациентов с T2DM посредством уменьшения уровней глюкозы при голодании и после приема пищи (FPG и PPG). Пептиды, которые связывают и активируют рецептор GLP-1, описаны в патентных заявках WO 98/08871 А1, WO 2008/081418 А1 и WO 2008/023050 А1, полное содержание которых приведено в настоящем документе в качестве ссылки.
Описано, что двойная активация рецепторов GLP-1 и GIP, например, посредством комбинации действий GLP-1 и GIP в одном препарате, приводит к терапевтическому принципу с значительно лучшим уменьшением уровней глюкозы в крови, увеличенной секрецией инсулина и сниженной массой тела у мышей с T2DM и ожирением по сравнению с продаваемым на рынке агонистом GLP-1 лираглутидом (например, VA Gault et al., Clin Sci (Lond), 121, 107-117, 2011). Доказано, что нативные GLP-1 и GIP у человека после совместной инфузии взаимодействуют аддитивным способом с значительно увеличенным инсулинотропным эффектом по сравнению с одним GLP-1 (MA Nauck et al., J. Clin. Endocrinol. Metab., 76, 912-917, 1993).
Разработка гибридных молекул, комбинирующих агонизм рецептора GLP-1, рецептора GIP и рецептора глюкагона, предлагает терапевтический потенциал для достижения значительно лучшего снижения уровней глюкозы в крови, увеличения секреции инсулина и даже более выраженного эффекта на снижение массы тела по сравнению с продаваемым на рынке агонистом GLP-1 лираглутидом (например, VA Gault et al., Clin Sci (Lond), 121, 107-117, 2011).
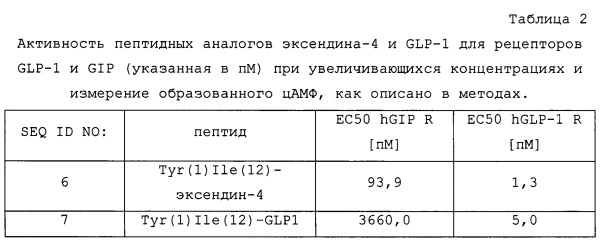
Соединения по этому изобретению представляют собой производные эксендина-4, для которых показана агонистическая активность для GLP-1 и рецептора GIP и, необязательно, рецептора глюкагона и которые обладают - среди прочих - предпочтительно, следующими модификациями: Tyr в положении 1 и Ile в положении 12.
Неожиданно, обнаружено, что модификация избирательного агониста GLP-1R эксендина-4 посредством Tyr в положении 1 и Ile в положении 12 приводит к пептиду с двойной активностью для рецепторов GLP-1 и GIP. Это наблюдение является неожиданным, поскольку такая же модификация в других агонистах GLP-1, таких как сам GLP-1, не приводит к высокой активности для рецептора GIP, как показано в таблице 2.
Пептиды, которые связывают и активируют рецептор как GIP, так и GLP-1, и необязательно, рецептор глюкагона, и улучшают гликемический контроль, супрессируют увеличение массы тела и уменьшают потребление пищи, описаны в патентных заявках WO 2011/119657 A1, WO 2012/138941 A1, WO 2010/011439 А2, WO 2010/148089 A1, WO 2011/094337 A1, WO 2012/088116 А2, содержание которых приведено в настоящем документе в качестве ссылки. В этих заявках описано, что смешанные агонисты рецептора GLP-1, рецептора GIP и, необязательно, рецептора глюкагона можно разрабатывать как аналоги нативных последовательностей GIP или глюкагона.
Соединения по этому изобретению представляют собой пептидные аналоги эксендина-4, содержащие лейцин в положении 10 и глутамин в положении 13. Krstenansky et al. (Biochemistry, 25, 3833-3839, 1986) показали важность остатков 10-13 глюкагона для его взаимодействий с рецептором и активации аденилатциклазы. В пептидных аналогах эксендина-4 по этому изобретению несколько из подчеркнутых остатков отличаются от указанных остатков глюкагона. В частности, остатки Tyr10 и Tyr13 заменены на лейцин в положении 10 и глутамин, неароматическую полярную аминокислоту, в положении 13. Эта замена, особенно в комбинации с изолейцином в положении 23 и глутаматом в положении 24 приводит к производным эксендина-4 с потенциально улучшенными биофизическими свойствами, такими как растворимость или поведение агрегации в растворе. Неконсервативная замена ароматической аминокислоты на полярную аминокислоту в положении 13 аналога эксендина-4 неожиданно приводит к пептидам с высокой активностью для рецептора GIP и, необязательно, для рецептора глюкагона.
Более того, соединения по этому изобретению представляют собой производные эксендина-4 с ацилированными остатками жирной кислоты в положении 14. Эта функционализация жирной кислоты в положении 14 приводит к улучшенному фармакокинетическому профилю. Неожиданно, функционализация жирной кислоты в положении 14 также приводит к пептидам с значительно более высокой активностью для GIPR, например, к пептидам, показанным в примере 5, таблице 8.
Соединения по этому изобретению представляют собой пептидные аналоги эксендина-4, содержащие альфа,альфа-диалкилированные аминокислоты с основной боковой цепью в положении 20. Неожиданно, модификация последовательности эксендина-4 с помощью одной из этих аминокислот приводит к соединениям с улучшенным биофизическим профилем, таким как растворимость (в частности, при низком рН, особенно при рН 4,5) или поведение агрегации в растворе, когда неприродную аминокислоту включают в положении 20. Полученные аналоги эксендина-4, таким образом, сохраняют их высокую активность для рецептора GLP-1, рецептора GIP и необязательно, для рецептора глюкагона. Включение этих неприродных аминокислот также увеличивает ферментативную стабильность пептидов, потенциально приводя к улучшенным фармакокинетическим свойствам.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе представлены аналоги эксендина-4, которые потенциально активируют рецептор GLP-1 и GIP и, необязательно, рецептор глюкагона. В этих аналогах эксендина-4 - среди других замен - метионин в положении 14 заменен на аминокислоту, несущую группу -NH2 в боковой цепи, которую далее замещают липофильной боковой цепью (например, жирной кислотой, необязательно, в сочетании с линкером).
Изобретение относится к пептидному соединению, обладающему формулой (I):

где Z представляет собой пептидную группу, обладающую формулой (II)

Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
X14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
X15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Ile, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Lys, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val, Gln и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Leu, Lys, His, Arg, Pip, (S)MeLys, (R)MeLys, (S)MeOrn и (R)MeOrn,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu, Leu и Tyr,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Arg, Lys, Aib и Ser,
X29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 отсутствует или представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи, необязательно, функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
R1 представляет собой NH2,
R2 представляет собой ОН или NH2.
или его соль или сольват.
Соединения по изобретению являются агонистами рецептора GLP-1 и GIP и, необязательно, агонистами рецептора глюкагона, как определено по наблюдению, что они являются способными стимулировать образование внутриклеточного цАМФ. Определение активности in vitro в клеточных анализах агонистов количественно оценивают посредством определения концентраций, вызывающих 50% активацию максимального ответа (ЕС50), как описано в методах.
В конкретных вариантах осуществления, изобретение, таким образом, относится к пептидному соединению, обладающему формулой (I):

где Z представляет собой пептидную группу, обладающую формулой (II)

Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 представляет собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Ile, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Lys, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val, Gln и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Leu, Lys, His, Arg, Pip, (S)MeLys, (R)MeLys, (S)MeOrn и (R)MeOrn,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu, Leu и Tyr,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Arg, Lys, Aib и Ser,
X29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 отсутствует или представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи, необязательно, функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
R1 представляет собой NH2,
R2 представляет собой ОН или NH2.
или его соль или сольват, где пептидное соединение обладает относительной активностью по меньшей мере 0,04%, предпочтительно по меньшей мере 0,08%, более предпочтительно, по меньшей мере 0,2% по сравнению с активностью природного GIP для рецептора GIP.
Кроме того, пептидное соединение, в частности, с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,07%, предпочтительно, по меньшей мере 0,1%, более предпочтительно, по меньшей мере 0,14%, более предпочтительно, по меньшей мере 0,35% и даже более предпочтительно, по меньшей мере 0,4% по сравнению с активностью GLP-1(7-36) для рецептора GLP-1.
Кроме того, пептидное соединение, в частности с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,04% (т.е. ЕС50<1000 пМ), более предпочтительно, 0,08% (т.е. ЕС50<500 пМ) и даже более предпочтительно, 0,2% (т.е. ЕС50<200 пМ) по сравнению с активностью природного GIP для рецептора GIP (ЕС50=0,4 пМ).
Необязательно, в некоторых вариантах осуществления, пептидное соединение, в частности, с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,1%, предпочтительно, по меньшей мере 0,2%, более предпочтительно, по меньшей мере 0,3%, более предпочтительно, по меньшей мере 0,4% и даже более предпочтительно, по меньшей мере 0,5% по сравнению с активностью природного глюкагона для рецептора глюкагона.
Термин «активность», как применяют в настоящем документе, предпочтительно относится к способности соединения активировать рецептор GLP-1 человека, рецептор GIP человека и, необязательно, рецептор глюкагона человека. Более предпочтительно, термин «активность», как применяют в настоящем документе, относится к способности соединения стимулировать образование внутриклеточного цАМФ. Термин «относительная активность», как применяют в настоящем документе, понимают как обозначающий способность соединения активировать рецептор в конкретном соотношении по сравнению с другим агонистом рецептора или по сравнению с другим рецептором. Активацию рецепторов агонистами (например, посредством измерения уровня цАМФ) определяют, как описано в настоящем документе, например, как описано в примерах.
В соответствии с одним из вариантов осуществления, соединения по изобретению обладают ЕС50 для рецептора hGLP-1 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с одним из вариантов осуществления, соединения по изобретению обладают ЕС50 для рецептора hGIP 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с другим вариантом осуществления, соединения по изобретению обладают, необязательно, ЕС50 для рецептора h-глюкагона 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с другим вариантом осуществления, соединения по изобретению обладают ЕС50 для рецептора hGLP-1 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее, и/или ЕС50 для рецептора hGIP 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее, и/или необязательно, ЕС50 для рецептора h-глюкагона 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В другом варианте осуществления ЕС50 для обоих рецепторов, т.е. для рецептора hGLP-1 и для рецептора hGIP, составляет 500 пМ или менее, более предпочтительно, 200 пМ или менее, более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, более предпочтительно, 20 пМ или менее.
В другом варианте осуществления, ЕС50 для всех трех рецепторов, т.е. для рецептора hGLP-1, для рецептора hGIP и для рецептора h-глюкагона, составляет 500 пМ или менее, более предпочтительно, 200 пМ или менее, более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, более предпочтительно, 20 пМ или менее.
ЕС50 для рецептора hGLP-1, рецептора hGIP и рецептора h-глюкагона можно определять, как описано в методах в настоящем документе и как использовали для получения результатов, описанных в примере 5.
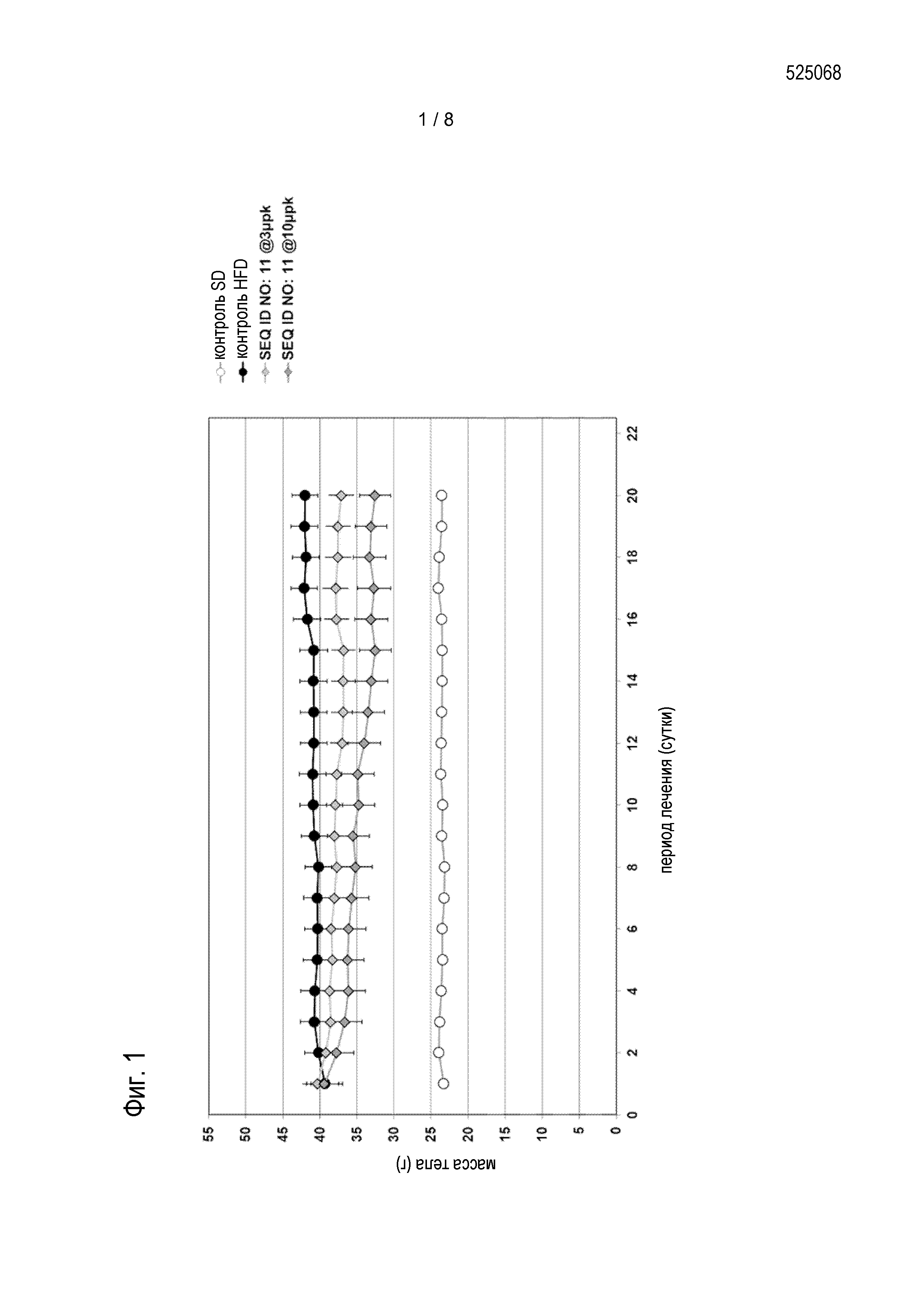
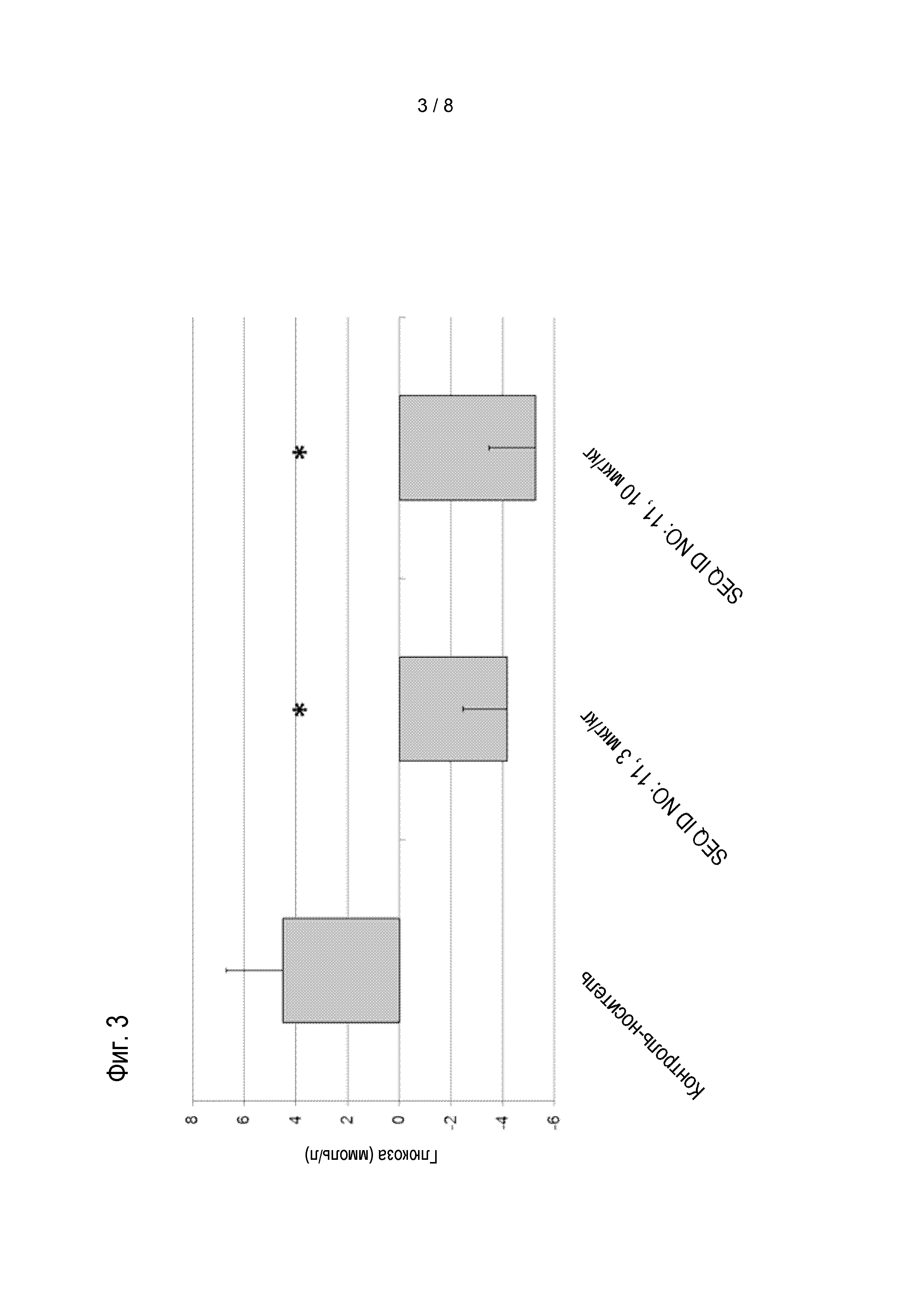
Соединения по изобретению обладают способностью снижать проходимость кишечника, увеличивать содержимое желудка и/или снижать потребление пищи пациентом. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах. Результаты этих экспериментов описаны в примере 10. Предпочтительные соединения по изобретению могут увеличивать содержимое желудка мышей, предпочтительно, самок NMRI-мышей, если введены в форме однократной дозы, предпочтительно, подкожной дозы, 0,02 мг/кг массы тела по меньшей мере на 25%, более предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 60%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%.
Предпочтительно, этот результат измеряют через 1 час после введения соответствующего соединения и через 30 мин после введения болюса, и/или оно снижает проходимость кишечника мышей, предпочтительно, самок NMRI-мышей, если введено в форме однократной дозы, предпочтительно, подкожной дозы, 0,02 мг/кг массы тела, по меньшей мере на 45%; более предпочтительно, по меньшей мере на 50%, более предпочтительно, по меньшей мере на 55%, более предпочтительно, по меньшей мере на 60%, и более предпочтительно, по меньшей мере 65%; и/или снижает потребление пищи мышами, предпочтительно, самками NMRI-мышей, в течение периода 22 час, если введены в форме однократной дозы, предпочтительно, подкожной дозы 0,01 мг/кг массы тела по меньшей мере на 10%, более предпочтительно, 15%, и более предпочтительно, 20%.
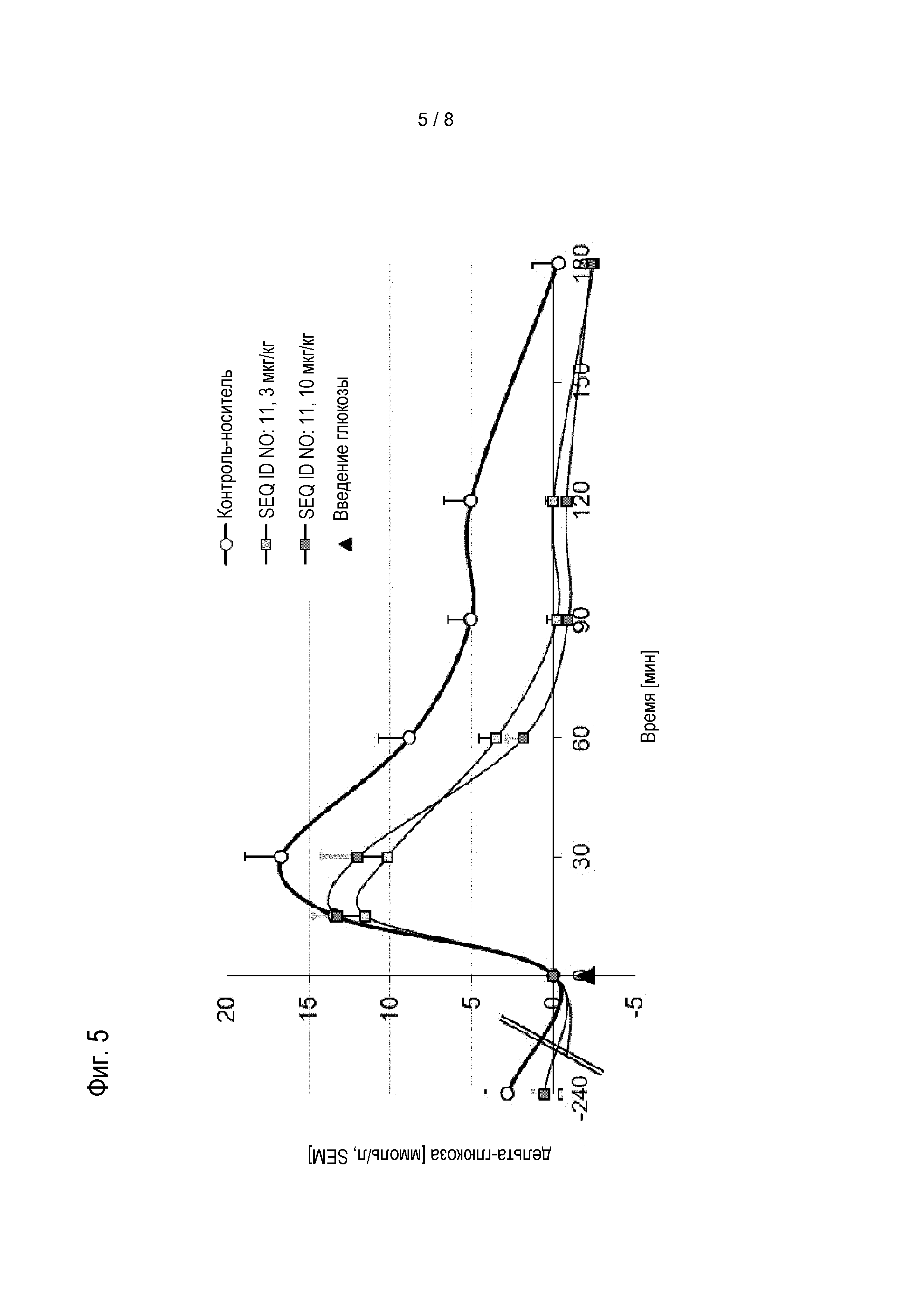
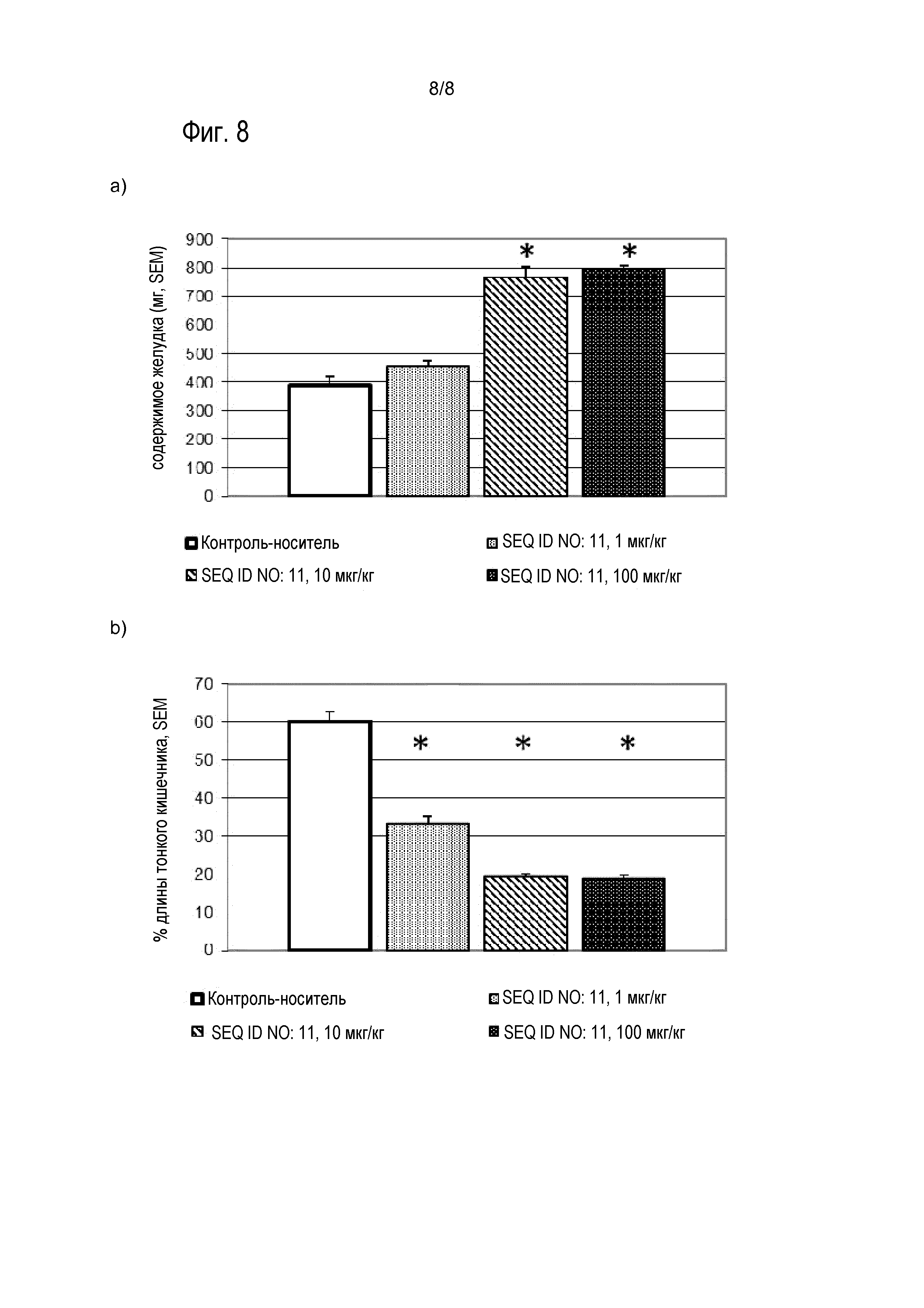
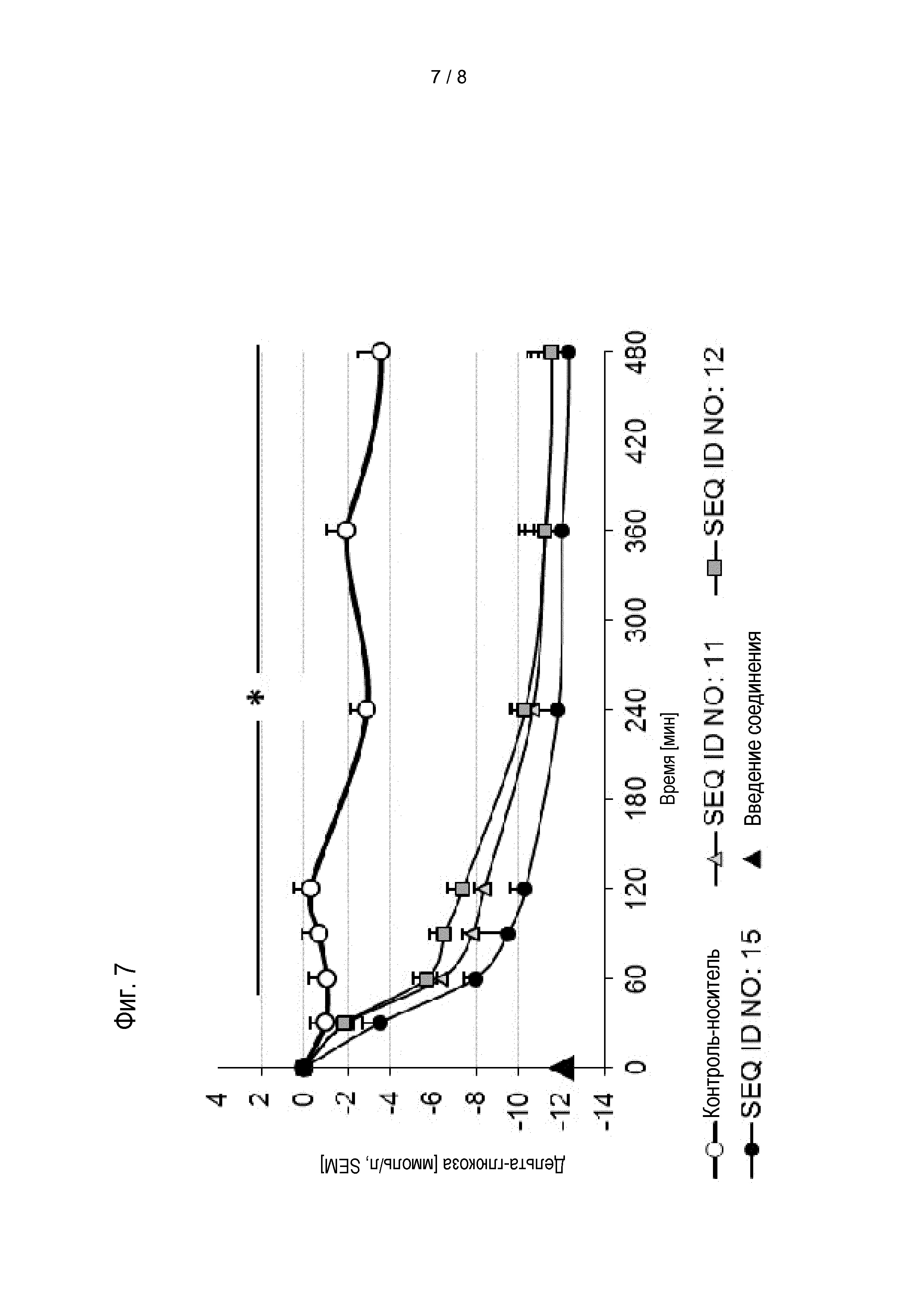
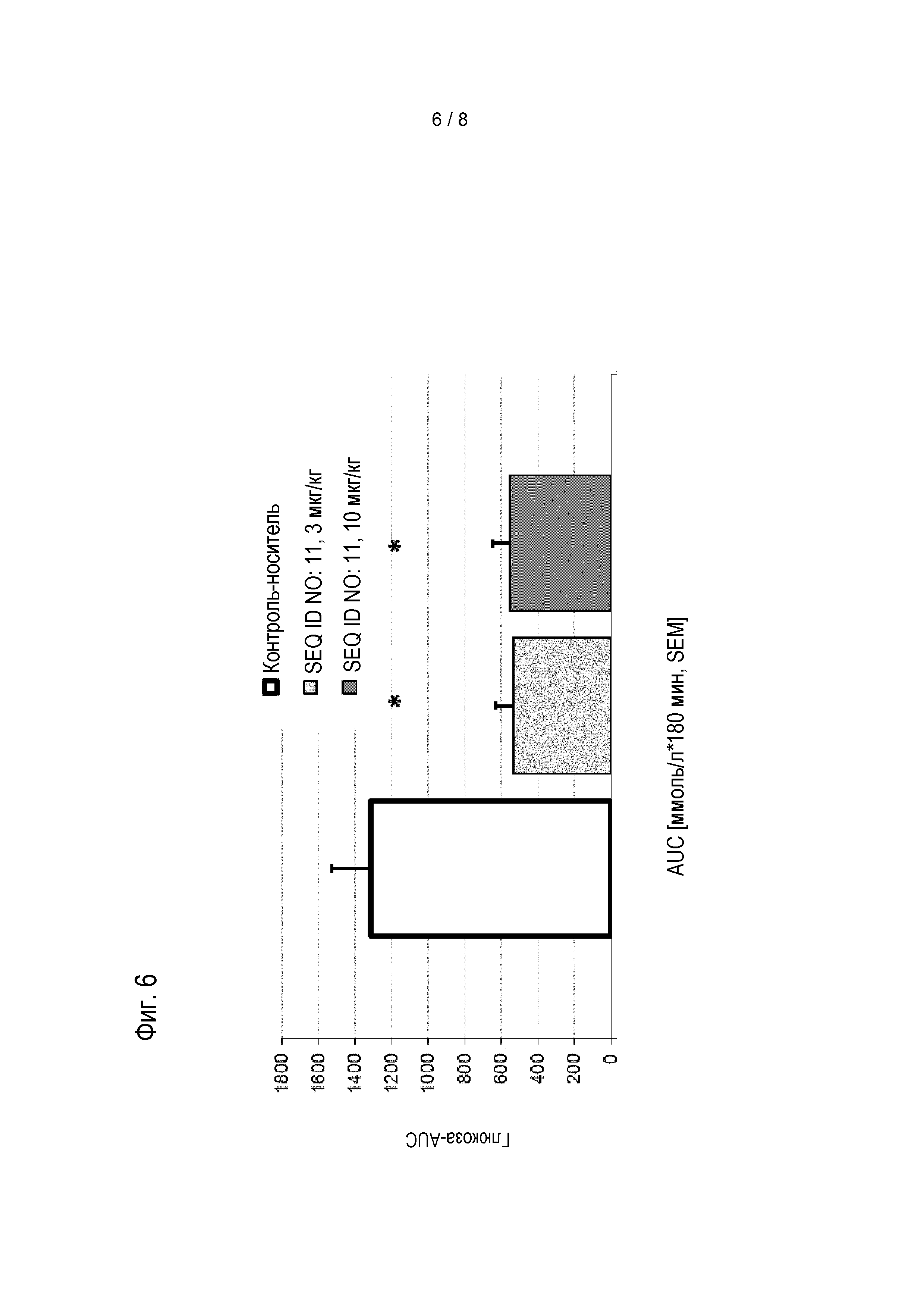
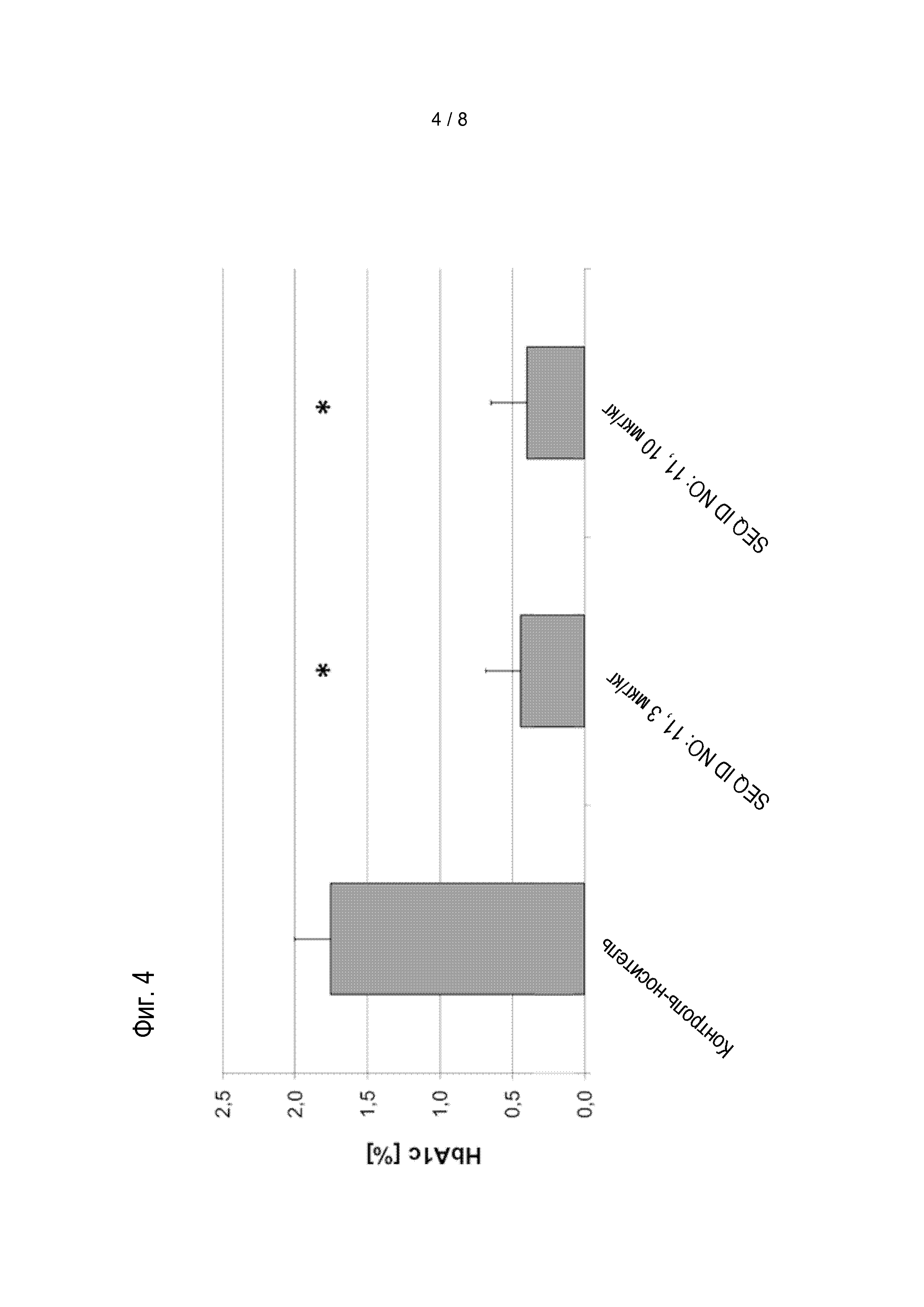
Соединения по изобретению обладают способностью снижать уровень глюкозы в крови, и/или снижать уровни HbA1c у пациента. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах. Результаты таких экспериментов описаны в примерах 8 и 9.
Предпочтительные соединения по изобретению могут снижать уровень глюкозы в крови мышей, предпочтительно, у самок дефицитных по рецептору лептина db/db мышей с диабетом в течение периода 24 час, если введены в форме однократной дозы, предпочтительно, подкожной дозы, 0,01 мг/кг массы тела, по меньшей мере на 4 нмоль/л; более предпочтительно, по меньшей мере на 6 нмоль/л, более предпочтительно, по меньшей мере на 8 нмоль/л. Если дозу увеличивают до 0,1 мг/кг массы тела, более выраженное снижение уровня глюкозы в крови можно наблюдать у мышей в течение 24 час, если она введена в форме однократной дозы, предпочтительно, подкожной дозы. Предпочтительно, соединения по изобретению приводят к снижению по меньшей мере на 7 нмоль/л/ более предпочтительно, по меньшей мере на 9 нмоль/л, более предпочтительно, по меньшей мере на 11 нмоль/л. Соединения по изобретению предпочтительно снижают увеличение уровней HbA1c у мышей в течение периода 4 недель, если введены в ежесуточной дозе от 0,01 мг/кг до приблизительно инициирующего количества.
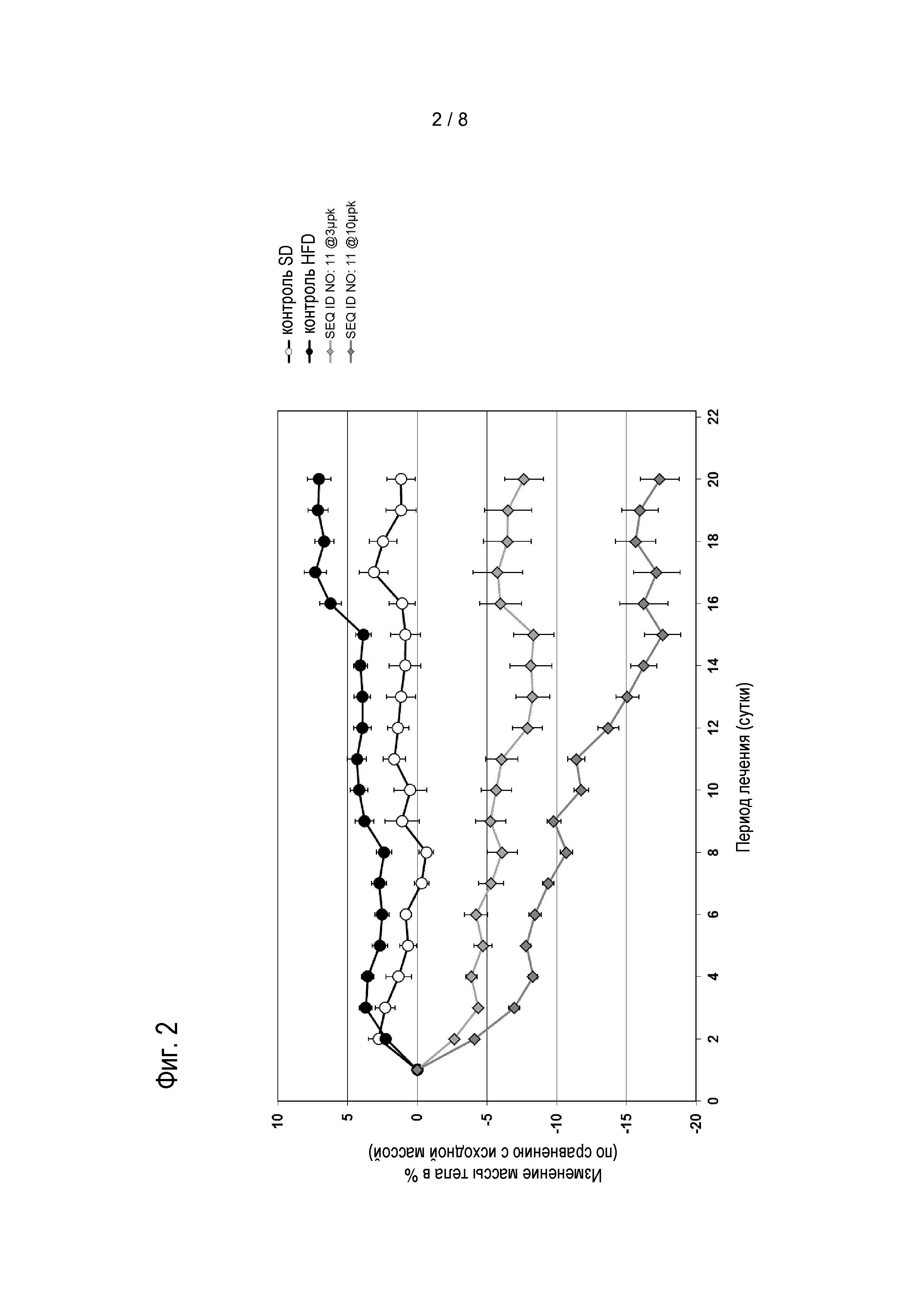
Соединения по изобретению также обладают способностью снижать массу тела пациента. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах и в примере 7.
Неожиданно, обнаружено, что пептидные соединения формулы (I), в частности, соединения с лизином (или близкими аналогами) в положении 14, который далее замещают липофильным остатком, обладают очень сильной активацией рецептора GLP-1 и GIP; кроме того, в комбинации с аминокислотами, подобными Gln в положении 3, также можно обеспечивать очень сильную активацию рецептора глюкагона.
В литературе (Murage EN et al., Bioorg. Med. Chem. 16 (2008), 10106-10112) описано, что для аналога GLP-1 с ацетилированным лизином в положении 14 показана значительно сниженная активность по сравнению с природным GLP-1.
Более того, окисление (in vitro или in vivo) метионина, присутствующего в коровой структуре эксендина-4, не является более возможным для пептидных соединений формулы (I).
Кроме того, соединения по изобретению предпочтительно обладают высокой растворимостью при кислых и/или физиологических значениях рН, например, при рН 4,5 и/или при рН 7,4 при 25°С, в другом варианте осуществления по меньшей мере 0,5 мг/мл и в конкретном варианте осуществления по меньшей мере 1,0 мг/мл.
Более того, в соответствии с одним из вариантов осуществления, соединения по изобретению предпочтительно обладают высокой стабильностью при хранении в растворе. Предпочтительными условиями анализа для определения стабильности при хранении в течение 7 суток при 25°С в растворе при рН 4,5 или рН 7,4. Оставшееся количество пептида определяют посредством хроматографических анализов, как описано в методах и примерах. Предпочтительно, через 7 суток при 25°С в растворе при рН 4,5 или рН 7,4, количество оставшегося пептида составляет по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, даже более предпочтительно, по меньшей мере 90% и даже более предпочтительно, по меньшей мере 95%.
Предпочтительно, соединения по настоящему изобретению содержат пептидную группу Z (формула II), представляющую собой линейную последовательность из 39-40 аминокарбоновых кислот, в частности α-аминокарбоновых кислот, соединенных пептидными, т.е. карбоксамидными, связями.
В одном варианте осуществления положение Х14 представляет собой аминокислотный остаток с функционализированной группой -NH2 боковой цепи, такой как функционализированный Lys, Orn, Dab или Dap, более предпочтительно, функционализированный Lys, и Х40 отсутствует или представляет собой Lys.
Аминокислотный остаток с группой -NH2 боковой цепи, например, Lys, Orn, Dab или Dap, может являться функционализированным в том отношении, что по меньшей мере один атом Н группы -NH2 боковой цепи заменен на -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, на -C(O)-R5, где R5 представляет собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р.
В конкретных вариантах осуществления R5 может содержать липофильную группу, например, ациклическую линейную или разветвленную насыщенную углеводородную группу, где R5 в частности содержит ациклическую линейную или разветвленную (С4-С30) насыщенную или ненасыщенную углеводородную группу, и/или циклическую насыщенную, ненасыщенную или ароматическую группу, в частности, моно-, би-, или трициклическую группу, содержащую 4-14 атомов углерода и 0, 1 или 2 гетероатомов, выбранных из N, О и S, например, циклогексил, фенил, бифенил, хроманил, фенантренил или нафтил, где ациклическая или циклическая группа может являться незамещенной или замещенной, например, галогеном, -ОН и/или CO2H.
Более предпочтительные группы R5 могут содержать липофильную группу, например, ациклическую линейную или разветвленную (C12-С22) насыщенную или ненасыщенную углеводородную группу. Липофильную группу можно присоединять к группе -NH2 боковой цепи посредством линкера во всех стереоизомерных формах, например, линкера, содержащего одну или несколько, например, 2, 3 или 4, аминокислотных линкерных групп, таких как γ-аминомасляная кислота (GABA), ε-аминогексановая кислота (ε-Ahx), γ-Glu и/или β-Ala. В одном варианте осуществления липофильная группа присоединена к группе -NH2 боковой цепи посредством линкера. В другом варианте осуществления липофильная группа напрямую присоединена к группе -NH2 боковой цепи. Конкретные примеры аминокислотных линкерных групп представляют собой (β-Ala)1-4, (γ-Glu)1-4, (ε-Ahx)1-4 или (GABA)1-4. Предпочтительные аминокислотные линкерные группы представляют собой β-Ala, γ-Glu, β-Ala-β-Ala и γ-Glu-γ-Glu.
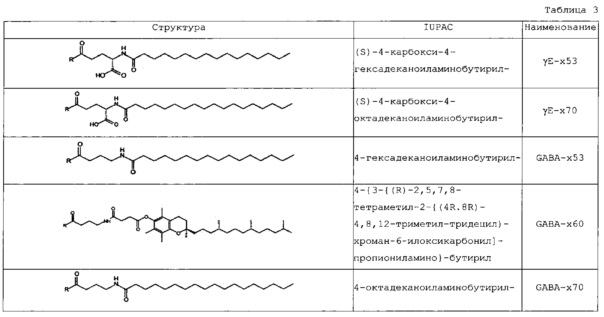
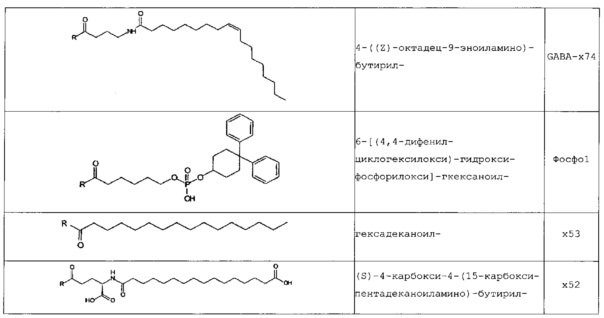
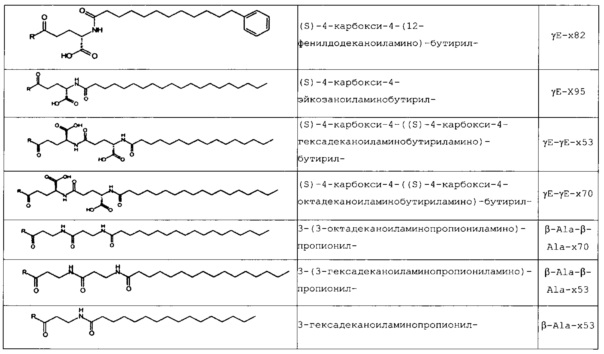
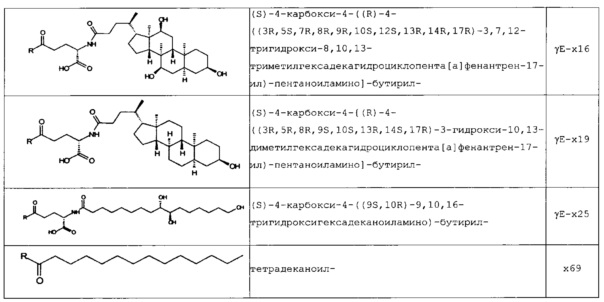
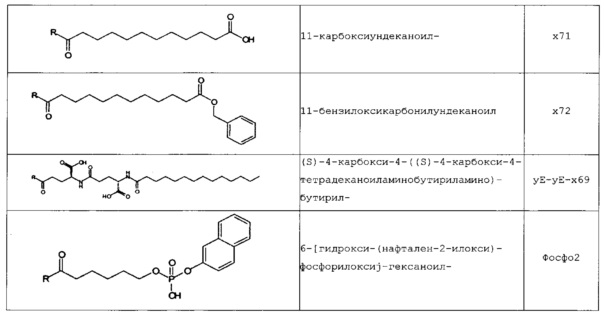
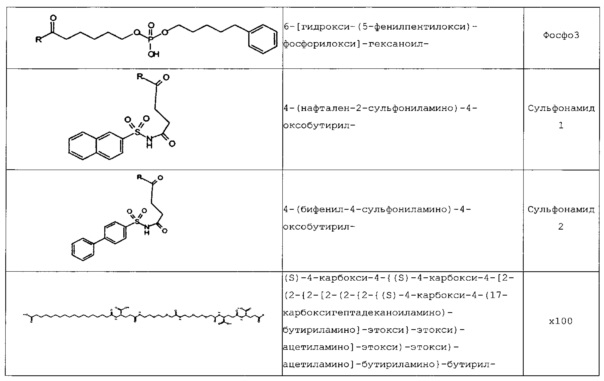
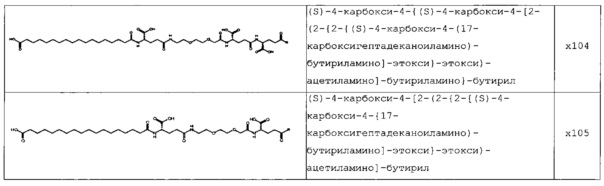
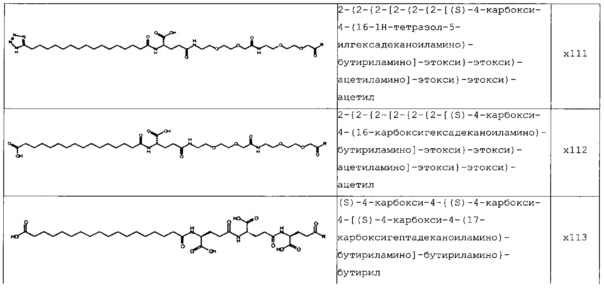
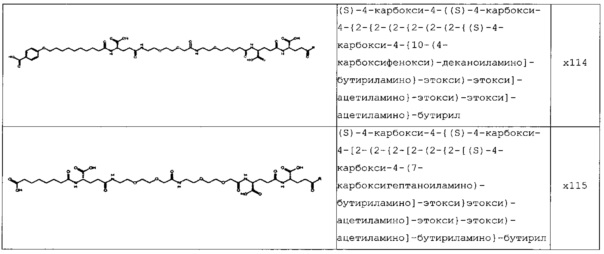
В следующей таблице 3 перечислены конкретные предпочтительные примеры групп -C(O)-R5, которые выбраны из группы, состоящей из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, 4-гексадеканоиламинобутирила-, 4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметил-тридецил)-хроман-6-илоксикарбонил]-пропиониламино}-бутирила-, 4-октадеканоиламинобутирила-, 4-((Z)-октадец-9-эноиламино)-бутирила-, 6-[(4,4-дифенилциклогексилокси)-гидроксифосфорилокси]-гексаноила-, гексадеканоила-, (S)-4-карбокси-4-(15-карбоксипентадеканоиламино)-бутирила-, (S)-4-карбокси-4-{3-[3-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидроксипентаноиламино)-пропиониламино]-пропиониламино}-бутирила-, (S)-4-карбокси-4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметилтридецил)-хроман-6-илоксикарбонил]-пропиониламино}-бутирила-, (S)-4-карбокси-4-((9Z,12Z)-октадека-9,12-диэноиламино)-бутирила-, (S)-4-карбокси-4-[6-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидрокси-пентаноиламино)-гексаноиламино]-бутирила-, (S)-4-карбокси-4-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидрокси-пентаноиламино)-бутирила-, (S)-4-карбокси-4-тетрадеканоиламинобутирила-, (S)-4-(11-бензилоксикарбонилундеканоиламино)-4-карбоксибутирила-, (S)-4-карбокси-4-[11-((2S,3R,4R,5R)-2,3,4,5,6-пентагидрокси-гексилкарбамоил)-ундеканоиламино]-бутирила-, (S)-4-карбокси-4-((Z)-октадец-9-эноиламино)-бутирила-, (S)-4-карбокси-4-(4-додецилоксибензоиламино)-бутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-, (S)-4-карбокси-4-докозаноиламинобутирила-, (S)-4-карбокси-4-((Z)-нонадец-10-эноиламино)-бутирила-, (S)-4-карбокси-4-(4-децилоксибензоиламино)-бутирила-, (S)-4-карбокси-4-[(4'-октилоксибифенил-4-карбонил)-амино]-бутирила-, (S)-4-карбокси-4-(12-фенилдодеканоиламино)-бутирила-, (S)-4-карбокси-4-эйкозаноиламинобутирила-, (S)-4-карбокси-4-((s)-4-карбокси-4-гексадеканоиламинобутириламино)-бутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила-, 3-(3-гексадеканоиламинопропиониламино)-пропионила-, 3-гексадеканоиламино-пропионила-, (S)-4-карбокси-4-[(R)-4-((3R,5S,7R,8R,9R,10S,12S,13R,14R,17R)-3,7,12-тригидрокси-8,10,13-триметилгексадекагидроциклопента[a]фенантрен-17-ил)-пентаноиламино]-бутирила-, (S)-4-карбокси-4-[(R)-4-((3R,5R,8R,9S,10S,13R,14S,17R)-3-гидрокси-10,13-диметилгексадекагидроциклопента[a]фенантрен-17-ил)-пентаноиламино]-бутирила-, (s)-4-карбокси-4-((9S,10R)-9,10,16-тригидроксигексадеканоиламино)-бутирила-, тетрадеканоила-, 11-карбоксиундеканоила-, 11-бензилоксикарбонилундеканоила-, (S)-4-карбокси-4-((S)-4-карбокси-4-тетрадеканоиламинобутириламино)-бутирила-, 6-[гидрокси-(нафталин-2-илокси)-фосфорилокси]-гексаноила-, 6-[гидрокси-(5-фенилпентилокси)-фосфорилокси]-гексаноила-, 4-(нафталин-2-сульфониламино)-4-оксобутирила-, 4-(бифенил-4-сульфониламино)-4-оксобутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-2-{(S)-4-карбокси-2-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-2-[2-(2-{2-[2-(2-{2-[(s)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-2-{(S)-4-карбокси-2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутирила-, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, 2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетил, (S)-4-карбокси-4-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)-бутириламино]-бутириламино}-бутириламино)-бутирила, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(16-1Н-тетразол-5-илгексадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(16-карбоксигексадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]-бутириламино}-этокси)-этокси]-ацетиламино}-этокси)-этокси]-ацетиламино}-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(7-карбоксигептаноиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (s)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(11-карбоксиундеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (s)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(13-карбокситридеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(s)-4-карбокси-4-(15-карбоксипентадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила- и (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-.
Еще более предпочтительными являются стереоизомеры, в частности, энантиомеры этих групп, либо S-, либо R-энантиомеры. Термин «R» в таблице 3 предназначен для обозначения участка присоединения -C(O)-R5 на пептидном остове, т.е., в частности, ε-аминогруппы Lys.
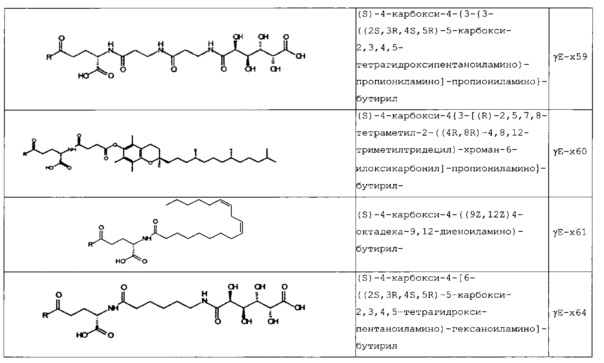
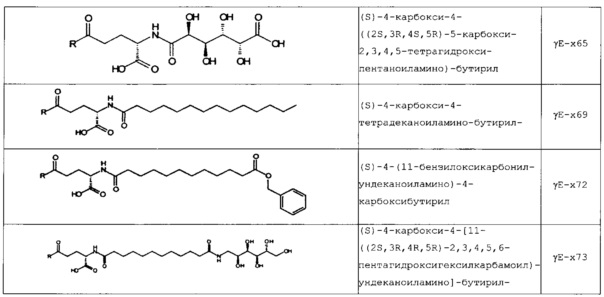
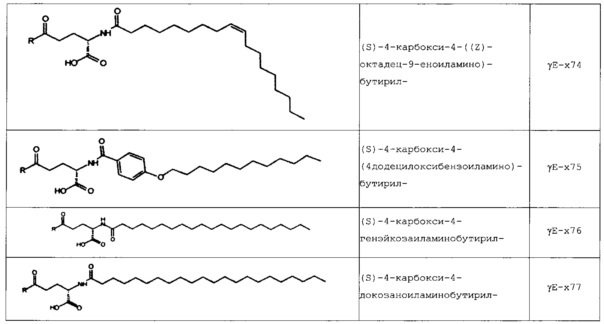
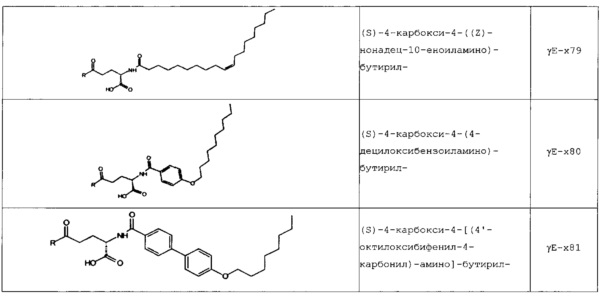



В некоторых вариантах осуществления изобретение относится к пептидным соединениям формулы (I), как определено выше, где Х14 представляет собой аминокислотный остаток, выбранный из Lys, Orn, Dab и Dap, где группа -NH2 боковой цепи функционализирована посредством -C(O)-R5, Х40 представляет собой аминокислотный остаток, выбранный из Lys, Orn, Dab и Dap, где группу -NH2 боковой цепи можно функционализировать посредством -C(O)-R5, и R5 представляет собой липофильную группу, выбранную из ациклической линейной или разветвленной (С4-С30) насыщенной или ненасыщенной углеводородной группы, и/или циклической насыщенной, ненасыщенной или ароматической группы, где липофильную группу можно присоединять к группе -NH2 боковой цепи посредством линкера, выбранного из (β-Ala)1-4, (γ-Glu)1-4, (ε-Ahx)1-4 или (GABA)1-4 во всех стереоизомерных формах.
В конкретных вариантах осуществления Х14 представляет собой аминокислотный остаток с функционализированной группой -NH2 боковой цепи, такой как функционализированный Lys, Orn, Dab или Dap, где по меньшей мере один атом Н из группы -NH2 боковой цепи заменен на -C(O)-R5, который выбран из группы, состоящей из заместителей согласно таблице 3 выше.
В некоторых вариантах осуществления Х14 представляет собой аминокислотный остаток, выбранный из Lys, Orn, Dab и Dap, где группа -NH2 боковой цепи функционализирована посредством -С(O)-R5, Х40 представляет собой аминокислотный остаток, выбранный из Lys, Orn, Dab и Dap, где группу -NH2 боковой цепи можно функционализировать посредством -C(O)-R5, и -C(O)-R5 выбран из группы, состоящей из заместителей согласно таблице 3 выше.
В некоторых вариантах осуществления изобретения положение Х14 и/или Х40 в формуле (II) представляет собой лизин (Lys). В соответствии с некоторыми вариантами осуществления, Lys в положении 14 и необязательно, в положении 40 является функционализированным, например, с помощью группы -C(O)R5, как описано выше. В других вариантах осуществления Х40 отсутствует, и X14 представляет собой Lys, функционализированный с помощью -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 является таким, как определено выше. В частности, Х14 представляет собой Lys, функционализированный с помощью C(O)-R5, выбранной из группы, состоящей из (S)-4-карбокси-4-гексадеканоиламинобутирила (γЕ-х53), (S)-4-карбокси-4-октадеканоиламинобутирила (γЕ-х70), 4-гексадеканоиламинобутирила (GABA-X53), 4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметилтридецил)-хроман-6-илохукарбонил]-пропиониламино}-бутирила- (GABA-х60), 4-октадеканоиламинобутирила (GABA-x70), 4-((Z)-октадец-9-эноиламино)-бутирила (GABA-x74), 6-[(4,4-дифенилциклогексилокси)-гидроксифосфорилокси]-гексаноила (Фосфо1), гексадеканоила (х53), (S)-4-карбокси-4-(15-карбоксипентадеканоиламино)-бутирила (х52), (S)-4-карбокси-4-{3-[3-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидроксипентаноиламино)-пропиониламино]-пропиониламино}-бутирила (γЕ-х59), (S)-4-карбокси-4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметилтридецил)-хроман-6-илоксикарбонил]-пропиониламино}-бутирила (γЕ-х60), (S)-4-карбокси-4-((9Z,12Z)-октадека-9,12-диэноиламино)-бутирила (γЕ-х61), (S)-4-карбокси-4-[6-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидроксипентаноиламино)-гексаноиламино]-бутирила (γЕ-х64), (S)-4-карбокси-4-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидрокси-пентаноиламино)-бутирила (γЕ-х65), (S)-4-карбокси-4-тетрадеканоиламинобутирила (γЕ-х69), (S)-4-(11-бензилоксикарбонилундеканоиламино)-4-карбоксибутирила (γЕ-х72), (S)-4-карбокси-4-[11-((2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексилкарбамоил)-ундеканоиламино]-бутирила (γЕ-х73), (S)-4-карбокси-4-((Z)-октадец-9-эноиламино)-бутирила (γЕ-х74), (S)-4-карбокси-4-(4-додецилокси-бензоиламино)-бутирила (γЕ-х75), (S)-4-карбокси-4-генэйкозаноиламинобутирила (γЕ-х76), (S)-4-карбокси-4-докозаноиламинобутирила (γЕ-х77), (S)-4-карбокси-4-((Z)-нонадец-10-эноиламино)-бутирила (γЕ-х79), (S)-4-карбокси-4-(4-децилоксибензоиламино)-бутирила (γЕ-х80), (S)-4-карбокси-4-[(4'-октилокси-бифенил-4-карбонил)-амино]-бутирила (γЕ-х81), (S)-4-карбокси-4-(12-фенилдодеканоиламино)-бутирила (γЕ-х82), (S)-4-карбокси-4-эйкозаноиламинобутирила (γЕ-х95), (S)-4-карбокси-4-((S)-4-карбокси-4-гексадеканоиламинобутириламино)-бутирила (γЕ-γЕ-х53), (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила (γЕ-γЕ-х70), и 3-(3-октадеканоиламинопропиониламино)-пропионила (β-Ala-β-Ala-х70).
В некоторых вариантах осуществления Х14 представляет собой Lys, функционализированный с помощью C(O)-R5, выбранной из группы, состоящей из (S)-4-карбокси-4-гексадеканоиламинобутирила (γЕ-х53) и (S)-4-карбокси-4-октадеканоиламинобутирила (γЕ-х70).
Следующий вариант осуществления относится к группе соединений, где
R1 представляет собой NH2,
R2 представляет собой NH2 или
R1 и R2 представляют собой NH2.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
X14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством - C(O)-R5, где R5 является таким, как описано выше,
X15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
X17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Glu, Ile, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Aib, Leu, Lys и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Gln, Val и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Arg, Leu, Lys и His,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu, Tyr и Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Aib, Arg и Lys,
X29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством - C(O)-R5, где R5 является таким, как описано выше,
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Leu, Lys, His, Pip, (S)MeLys, (R)MeLys и (S)MeOrn,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu и Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Aib и Ser,
Х29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой Ile,
Х14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством - C(O)-R5, где R5 является таким, как описано выше,
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala и Arg,
X19 представляет собой аминокислотный остаток, выбранный из Ala и Val,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Lys, Pip, (S)MeLys, (R)MeLys и (S)MeOrn и His,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu и Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly, Thr и D-Ala,
Х40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством - C(O)-R5, где R5 является таким, как описано выше,
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala и Arg,
X19 представляет собой аминокислотный остаток, выбранный из Ala и Val,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Lys и His,
Х21 представляет собой аминокислотный остаток, выбранный из Asp, Glu и Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly, Thr и D-Ala,
Х40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln и Glu,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила- и 4-октадеканоиламинобутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-,
X15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
X16 представляет собой аминокислотный остаток, выбранный из Ser и Lys,
Х17 представляет собой Arg,
Х18 представляет собой Ala,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Gln и Aib,
Х21 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой Glu,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила- и 4-октадеканоиламинобутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-,
Х15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
Х16 представляет собой аминокислотный остаток, выбранный из Ser и Lys,
Х17 представляет собой Arg,
Х18 представляет собой Ala,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Gln и Aib,
Х21 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой Gln,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила- и 4-октадеканоиламинобутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-,
Х15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
X16 представляет собой аминокислотный остаток, выбранный из Ser и Lys,
Х17 представляет собой Arg,
Х18 представляет собой Ala,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Gln и Aib,
Х21 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, 4-октадеканоиламинобутирила-, гексадеканоила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила-.
Следующий вариант осуществления относится к группе соединений, где
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-октадеканоиламинобутирила-, 4-октадеканоиламинобутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила-.
Следующий вариант осуществления относится к группе соединений, где
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln и Glu,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
Х15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
X16 представляет собой аминокислотный остаток, выбранный из Ser и Lys,
Х17 представляет собой Arg,
Х18 представляет собой Ala,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Gln и Aib,
Х21 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, His и Glu,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
Х15 представляет собой Glu,
Х16 представляет собой аминокислотный остаток, выбранный из Glu и Lys,
Х17 представляет собой Glu,
Х18 представляет собой Ala,
Х19 представляет собой Val,
Х20 представляет собой Arg,
Х21 представляет собой Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Aib и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой Glu,
Х12 представляет собой Ile,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
Х15 представляет собой Glu,
Х16 представляет собой аминокислотный остаток, выбранный из Glu и Lys,
Х17 представляет собой Glu,
Х18 представляет собой Ala,
Х19 представляет собой Val,
Х20 представляет собой Arg,
Х21 представляет собой Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Aib и Ala,
Х29 представляет собой Gly,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, His и Glu,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
X15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
Х16 представляет собой Glu,
X17 представляет собой аминокислотный остаток, выбранный из Arg и Gln,
X18 представляет собой аминокислотный остаток, выбранный из Ala и Arg,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Pip, (S)MeLys, (R)MeLys и (S)MeOrn,
Х21 представляет собой Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ser и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, His и Glu,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила-, гексадеканоила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
Х15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Leu, Aib, Tyr, Glu, Ala и Lys,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val и Aib,
Х20 represents Aib,
X21 представляет собой аминокислотный остаток, выбранный из Glu, Leu и Tyr,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Arg и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly, Ala, D-Ala и Thr,
Х40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln, His и Glu,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством одной из групп, выбранных из (S)-4-карбокси-4-гексадеканоиламинобутирила- и (S)-4-карбокси-4-октадеканоиламинобутирила-,
Х15 представляет собой аминокислотный остаток, выбранный из Glu и Asp,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys и Glu,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Ile, Glu и Gln,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg и Lys,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val и Gln,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Phe, Leu, Lys, His и Arg,
X21 представляет собой аминокислотный остаток, выбранный из Glu, Asp и Leu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Arg, Lys и Ala,
Х29 представляет собой аминокислотный остаток, выбранный из Gly, Aib и Thr,
Х40 либо отсутствует, либо представляет собой Lys.
Следующий вариант осуществления относится к группе соединений, где
Х12 представляет собой Ile.
Следующий вариант осуществления относится к группе соединений, где
Х19 представляет собой Ala.
Следующий вариант осуществления относится к группе соединений, где
Х16 представляет собой Glu,
Х20 представляет собой аминокислотный остаток, выбранный из Pip, (S)MeLys, (R)MeLys и (S)MeOrn.
Следующий вариант осуществления относится к группе соединений, где
Х28 представляет собой Ala,
Х29 представляет собой Gly.
Следующий вариант осуществления относится к группе соединений, где
Х28 представляет собой Asn,
Х29 представляет собой Thr.
Следующий вариант осуществления относится к группе соединений, где
Х3 представляет собой аминокислотный остаток, выбранный из Gln и Glu,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой Lys, где группа -NH2 боковой цепи функционализирована посредством - C(O)-R5, выбранной из (S)-4-карбокси-4-гексадеканоиламинобутирила- (γЕ-х53) и (S)-4-карбокси-4-октадеканоиламинобутирила- (γЕ-х70),
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
Х16 представляет собой Glu,
Х17 представляет собой аминокислотный остаток, выбранный из Arg и Gln,
X18 представляет собой аминокислотный остаток, выбранный из Ala и Arg,
Х19 представляет собой Ala,
Х20 представляет собой аминокислотный остаток, выбранный из Pip, (S)-MeLys, (R)-MeLys, и (S)-MeOrn,
Х21 представляет собой Glu,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala и Ser,
Х29 представляет собой аминокислотный остаток, выбранный из Gly и Thr,
Х40 отсутствует.
Конкретными примерами пептидных соединений формулы (I) являются соединения из SEQ ID NO: 8-16, так же как их соли и сольваты.
Конкретными примерами пептидных соединений формулы (I) являются соединения из SEQ ID NO: 8-13 и 15, так же как их соли и сольваты.
В конкретных вариантах осуществления, т.е. когда соединение формулы (I) содержит генетически кодированные аминокислотные остатки, изобретение, кроме того, относится к нуклеиновой кислоте (которая может представлять собой ДНК или РНК), кодирующей указанное соединение, к экспрессирующему вектору, содержащему такую нуклеиновую кислоту, и к клетке-хозяину, содержащей такую нуклеиновую кислоту или экспрессирующий вектор.
В следующем аспекте настоящее изобретение относится к композиции, содержащей соединение по изобретению в смеси с носителем. В предпочтительных вариантах осуществления композиция представляет собой фармацевтически приемлемую композицию, и носитель представляет собой фармацевтически приемлемый носитель. Соединение по изобретению может находиться в форме соли, например, фармацевтически приемлемой соли, или сольвата, например, гидрата. В следующем аспекте настоящее изобретение относится к композиции для использования в способе медицинского лечения, в частности, в медицине человека.
В конкретных вариантах осуществления нуклеиновую кислоту или экспрессирующий вектор можно использовать в качестве лекарственных средств, например, в генотерапии.
Соединения формулы (I) являются пригодными для терапевтического применения без дополнительного терапевтически эффективного средства. В других вариантах осуществления, однако, соединения используют вместе по меньшей мере с одним дополнительным терапевтически активным средством, как описано в «комбинированной терапии».
Соединения формулы (I) являются особенно пригодными для лечения или предотвращения заболеваний или нарушений, вызванных нарушениями, ассоциированных с нарушениями и/или сопровождающихся нарушениями углеводного и/или липидного метаболизма, например, для лечения или предотвращения гипергликемии, диабета 2 типа, нарушенной толерантности к глюкозе, диабета 1 типа, ожирения и метаболического синдрома. Кроме того, соединения по изобретению являются особенно пригодными для лечения или предотвращения дегенеративных заболеваний, в частности, нейродегенеративных заболеваний.
Описанные соединения находят применение, среди прочего, в предотвращении набора массы или в способствовании потере массы. Под «предотвращением» понимают ингибирование или снижение по сравнению с отсутствием лечения, и его необязательно понимают как подразумевающее полное прекращение нарушения.
Соединения по изобретению могут вызывать снижение потребления пищи и/или увеличение расхода энергии, приводящие к наблюдаемому эффекту на массу тела.
Независимо от их эффекта на массу тела, соединения по изобретению могут оказывать благоприятный эффект на уровни циркулирующего холестерина, являясь способными улучшать уровни липидов, в частности LDL, так же как уровни HDL (например, увеличивая соотношение HDL/LDL).
Таким образом, соединения по изобретению можно использовать для прямой или опосредованной терапии любого состояния, вызванного или характеризующегося избыточной массой тела, такой как лечение и/или предотвращение ожирения, патологического ожирения, связанного с ожирением воспаления, связанного с ожирением заболевания желчного пузыря, индуцированного ожирением апноэ во сне. Их можно также использовать для лечения и предотвращения метаболического синдрома, диабета, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, коронарной болезни сердца или инсульта. Их эффекты при этих состояниях могут являться результатом их эффекта или могут являться ассоциированными с их эффектом на массу тела, или могут являться не зависимыми от него.
Предпочтительные медицинские применения включают в себя задержку или предотвращение прогрессирования заболевания при диабете 2 типа, лечение метаболического синдрома, лечение ожирения или предотвращение избыточной массы, снижение потребления пищи, увеличение расхода энергии, снижение массы тела, задержку прогрессирования от нарушенной толерантности к глюкозе (IGT) до диабета 2 типа; задержку прогрессирования от диабета 2 типа до инсулинозависимого диабета; регулирование аппетита; индукцию насыщения; предотвращение набора массы после успешной потери массы; лечение заболевания или состояния, связанного с избыточной массой или ожирением; лечение булимии; лечение компульсивного переедания; лечение атеросклероза, гипертензии, диабета 2 типа, IGT, дислипидемии, коронарной болезни сердца, стеатоза печени, лечение отравления бета-блокаторами, использование для ингибирования подвижности желудочно-кишечного тракта, которое можно применять в сочетании с исследованиями желудочно-кишечного тракта с использованием таких способов, как рентгеновское, СТ- и ЯМР-сканирование.
Дополнительные медицинские применения включают в себя лечение или предотвращения дегенеративных нарушений, в частности нейродегенеративных нарушений, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, атаксия, например, спинально-церебеллярная атаксия, болезнь Кеннеди, миотоническая дистрофия, деменция с тельцами Леви, мультисистемная атрофия, боковой амиотрофический склероз, первичный боковой склероз, спинальная мышечная атрофия, ассоциированные с прионами заболевания, например, болезнь Крейцфельда-Якоба, рассеянный склероз, телеангиэктозия, болезнь Баттена, кортикобазальная дегенерация, подострая комбинированная дегенерация спинного мозга, сухотка спинного мозга, болезнь Тея-Сакса, токсическая энцефалопатия, детская болезнь Рефсума, болезнь Рефсума, нейроакантоцитоз, болезнь Ниманна-Пика, болезнь Лайма, болезнь Мачадо-Джозефа, болезнь Сандхоффа, синдром Шая-Дрейджера, синдром шатающегося ежа, протеинопатия, церебральная β-амилоидная ангиопатия, дегенерация ганглиозных клеток сетчатки при глаукоме, синуклеинопатии, таупатии, лобно-височная лобарная дегенерация (FTLD), деменция, синдром cadasil, наследственная церебральная геморрагия с амилоидозом, болезнь Александера, сейпинопатии, семейная амилоидотическая невропатия, старческий системный амилоидоз, серпинопатии, амилоидоз AL (легких цепей) (первичный системный амилоидоз), амилоидоз АН (тяжелых цепей), амилоидоз АА (вторичный), аортальный медиальный амилоидоз, амилоидоз ApoAI, амилоидоз АроАII, амилоидоз ApoAIV, семейный амилоидоз финского типа (FAF), лизоцимный амилоидоз, фибриногеновый амилоидоз, диализный амилоидоз, миозит/миопатия с тельцами включения, катаракты, пигментный ретинит с мутациями родопсина, медуллярная карцинома щитовидной железы, амилоидоз предсердий, пролактинома гипофиза, наследственная решетчатая дистрофия роговицы, кожный лишайный амилоидоз, тельца Меллори, лактоферриновый амилоидоз роговицы, легочный альвеолярный протеиноз, одонтогенная амилоидная опухоль (Пиндборга), кистозный фиброз, серповидно-клеточное заболевание или миопатия критических состояний (CIM).
Дополнительные медицинские применения включают в себя лечение связанных с костью нарушений, таких как остеопороз или остеоартрит и т.д., где увеличенное образование кости и уменьшенная резорбция кости может предоставлять преимущества.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Аминокислотные последовательности по настоящему изобретению содержат общепринятые однобуквенный и трехбуквенный коды для природных аминокислот, так же как общепринятые трехбуквенные коды для других аминокислот, такие как Aib (α-аминоизомасляная кислота), Orn (орнитин), Dab (2,4-диаминомасляная кислота), Dap (2,3-диаминопропионовая кислота), Nle (норлейцин), GABA (γ-аминомасляная кислота) или Ahx (ε-аминогексановая кислота).
Более того, следующие коды использовали для аминокислот, показанных в таблице 4:
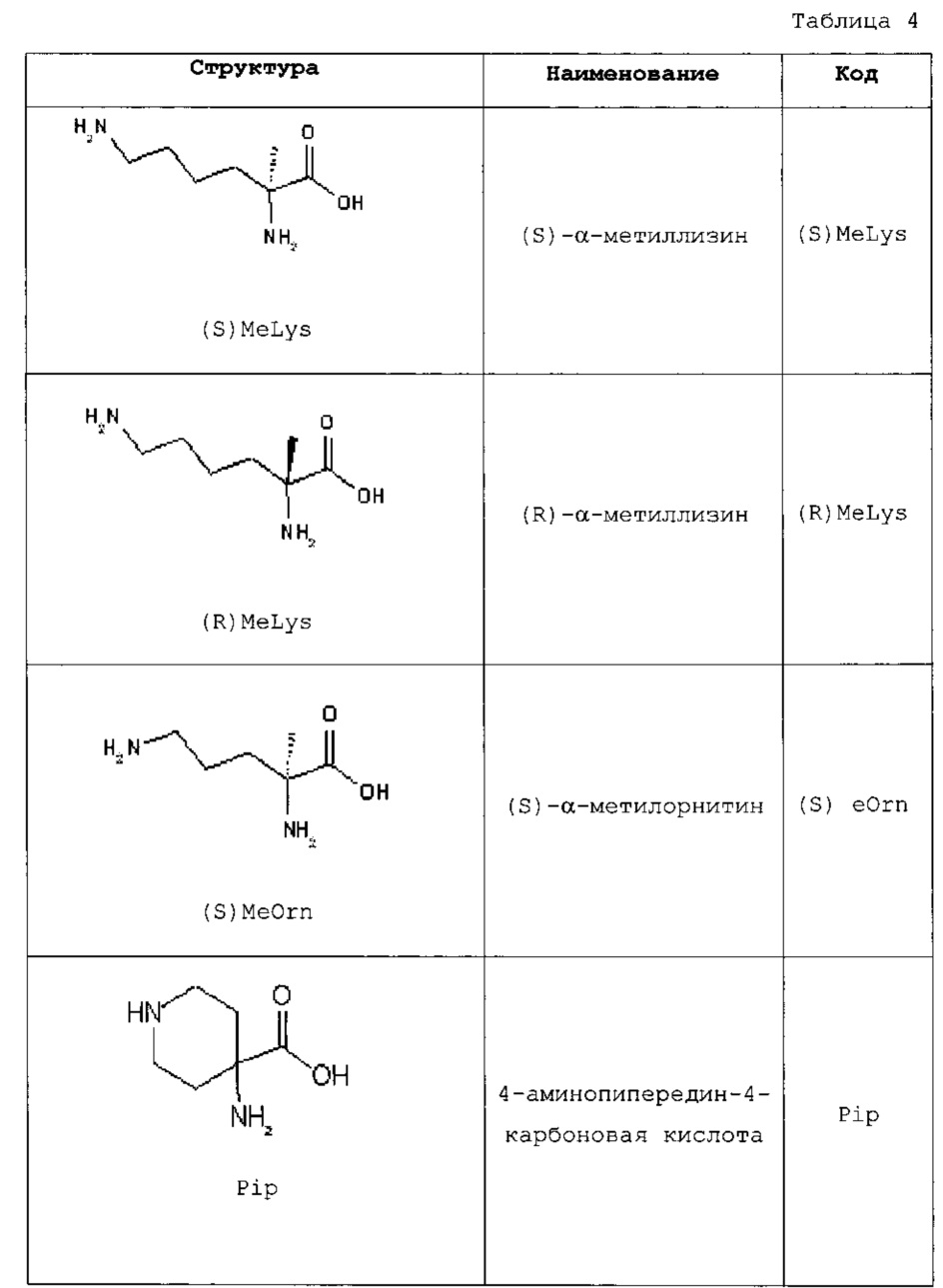
Термин «нативный эксендин-4» относится к нативному эксендину-4, обладающему последовательностью HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (SEQ ID NO: 1).
Изобретение относится к пептидным соединениям, как определено выше.
Пептидные соединения по настоящему изобретению содержат линейный остов аминокарбоновых кислот, соединенный пептидными, т.е. карбоксамидными связями. Предпочтительно, аминокарбоновые кислоты представляют собой α-аминокарбоновые кислоты и более предпочтительно, L-α-аминокарбоновые кислоты, если не указано иначе. Пептидные соединения предпочтительно содержат последовательность остова из 39-40 аминокарбоновых кислот.
Пептидные соединения по настоящему изобретению могут обладать немодифицированными боковыми цепями, но несут по меньшей мере одну модификацию на одной из боковых цепей.
Во избежание сомнений, в определениях, представленных в настоящем документе, как правило, подразумевают, что последовательность пептидной группы (II) отличается от нативного эксендина-4 по меньшей мере в одном из тех положений, которые указаны, как позволяющие варианты. Аминокислоты внутри пептидной группы (II) можно рассматривать как пронумерованные последовательно от 0 до 40 в общепринятом направлении от N-конца к С-концу. Ссылку на «положение» внутри пептидной группы (II) следует рассматривать соответственно, как следует рассматривать ссылку на положения внутри нативного эксендина-4 и других молекул, например, в эксендине-4, His находится в положении 1, Gly в положении 2, …, Met в положении 14, … и Ser в положении 39.
Аминокислотные остатки в положении 14 и необязательно, в положении 40, обладающие боковой цепью с группой - NH2, например, Lys, Orn, Dab или Dap, конъюгируют с функциональной группой, например, ацильными группами. Таким образом, одна или несколько избранных аминокислот пептидов по настоящему изобретению могут нести ковалентные присоединения на их боковых цепях. В некоторых случаях эти присоединения могут являться липофильными. Эти липофильные присоединения к боковым цепям обладают потенциалом уменьшать выведение пептидов in vivo, таким образом, увеличивая их время полужизни in vivo.
Липофильное присоединение может состоять из липофильной группы, которая может представлять собой разветвленную или неразветвленную, алифатическую или ненасыщенную ациклическую группу и/или циклическую группу, выбранную из одного или нескольких алифатических или ненасыщенных гомоциклов или гетероциклов, ароматических конденированных или неконденсированных гомоциклов или гетероциклов, эфирных связей, ненасыщенных связей и заместителей, например, гидрокси и/или карбоксигрупп. Липофильную группу можно присоединять к пептиду либо посредством алкилирования, восстановительного аминирования, либо посредством амидной связи, карбаматной или сульфонамидной связи в случае аминокислот, несущих аминогруппу на их боковой цепи.
Неограничивающие примеры липофильных групп, которые можно присоединять к боковым цепям аминокислот, включают в себя жирные кислоты, например, C8-30 жирные кислоты, такие как пальмитиновая кислота, миристиновая кислота, стеариновая кислота и олеиновая кислота, и/или циклические группы, как описано выше, или их производные.
Могут присутствовать один или несколько линкеров между аминокислотой пептида и липофильным присоединением. Неограничивающими примерами этих линкеров являются β-аланин, γ-глутаминовая кислота, α-глутаминовая кислота, γ-аминомасляная кислота и/или ε-аминогексановая кислота или дипептиды, такие как β-Ala-β-Ala (сокращенно обозначенный также βА-βА в настоящем документе) и/или γ-Glu-γ-Glu (сокращенно обозначенный также γЕ-γЕ в настоящем документе) во всех их стереоизомерных формах (энантиомеры S и R).
Таким образом, одним из неограничивающих примеров присоединения к боковой цепи является пальмитиновая кислота, которая ковалентно присоединена к α-аминогруппе глутаминовой кислоты, формируя амидную связь γ-карбоксигруппа этой замещенной глутаминовой кислоты может формировать амидную связь с боковой аминогруппой лизина внутри пептида.
В следующем аспекте настоящее изобретение относится к композиции, содержащей соединение по изобретению, как описано в настоящем документе, или его соль или сольват, в смеси с носителем.
Изобретение относится также к использованию соединения по настоящему изобретению для применения в качестве лекарственного средства, в частности, для лечения состояния, как описано ниже.
Изобретение относится также к композиции, где композиция является фармацевтически приемлемой композицией, и носитель является фармацевтически приемлемым носителем.
Синтез пептидов
Специалисту в данной области известно множество различных способов получения пептидов, описанных в этом изобретении. Эти способы включают в себя, но без ограничения, способы синтеза и рекомбинантную экспрессию гена. Таким образом, одним из способов получения этих пептидов является синтез в растворе или на твердой подложке и последующее выделение и очистка. Другим способом получения пептидов является экспрессия гена в клетке-хозяине, в которую введена последовательность ДНК, кодирующая пептид. Альтернативно, можно достигать экспрессии гена без использования клеточной системы. Способы, описанные выше, можно также комбинировать любым способом.
Предпочтительным способом получения пептидов по настоящему изобретению является твердофазный синтез на пригодной смоле. Твердофазный синтез пептидов является хорошо разработанным способом (см., например: Stewart and Young, Solid Phase Peptide Synthesis, Pierce Chemical Co., Rockford, Ill., 1984; E. Atherton and R.C. Sheppard, Solid Phase Peptide Synthesis. A Practical Approach, Oxford-IRL Press, New York, 1989). Твердофазный синтез начинают посредством присоединения защищенной по N-концу аминокислоты с ее карбокси-конца к инертной твердой подложке, несущей отщепляемый линкер. Эта твердая подложка может представлять собой любой полимер, позволяющий присоединение начальной аминокислоты, например, тритиловая смола, хлортритиловая смола, смола Ванга или смола Ринка, в которой связь карбокси-группы (или карбоксамида для смолы Ринка) со смолой является чувствительной к кислоте (при использовании способа Fmoc). Полимерная подложка должна являться стабильной в условиях, используемых для снятия защиты α-аминогруппы в ходе синтеза пептидов.
После присоединения первой аминокислоты к твердой подложке, защитную группу α-аминогруппы этой аминокислоты удаляют. Оставшиеся защищенные аминокислоты затем присоединяют одну за другой в порядке, представленном пептидной последовательностью, с использованием пригодных реагентов для амидного связывания, например, ВОР, HBTU, HATU или DIC (N,N'-диизопропилкарбодиимид)/HOBt (1-гидроксибензотриазол), где ВОР, HBTU и HATU используют с третичными аминовыми основаниями. Альтернативно, высвобожденный N-конец можно функционализировать с помощью групп, отличных от аминокислот, например, карбоновых кислот и т.д.
Обычно реакционноспособные группы боковых цепей аминокислоты защищают с помощью пригодных блокирующих групп. Эти защитные группы удаляют после сборки желательных пептидов. Их удаляют одновременно с отщеплением желательного продукта от смолы в тех же самых условиях. Защитные группы и способы введения защитных групп можно обнаружить в Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W. and Wuts, P.G.M., Wiley & Sons (New York: 1999).
В некоторых случаях может являться желательным иметь защитные группы боковых цепей, которые можно избирательно удалять, в то время как другие защитные группы боковых цепей остаются интактными. В этом случае высвобожденную функциональную группу можно избирательно функционализировать. Например, лизин можно защищать с помощью защитной группы ivDde ([1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)-3-метилбутил) (S.R. Chhabra et al., Tetrahedron Lett. 39, (1998), 1603) которая является неустойчивой к очень нуклеофильному основанию, например, 4% гидразину в DMF (диметилформамиде). Таким образом, если N-концевая аминогруппа и все функциональные группы боковых цепей защищены неустойчивыми к кислотам защитными группами, группу ivDde можно избирательно удалять с использованием 4% гидразина в DMF, и соответствующую свободную аминогруппу можно затем далее модифицировать, например, посредством ацилирования. Лизин можно альтернативно присоединять к защищенной аминокислоте, и с аминогруппы этой аминокислоты можно затем снимать защиту, получая свободную аминогруппу, которую можно ацилировать или присоединять к дальнейшим аминокислотам.
Наконец, пептид отщепляют от смолы. Этого можно достигать с использованием коктейля Кинга (D.S. King, С.G. Fields, G.В. Fields, Int. J. Peptide Protein Res. 36, 1990, 255-266). Неочищенный материал можно затем очищать посредством хроматографии, например, препаративной RP-HPLC, если необходимо.
Активность
Как применяют в настоящем документе, термин «активность» или «активность in vitro» является показателем способности соединения активировать рецепторы для GLP-1, GIP или глюкагона в анализе на основе клеток. Количественно, его выражают как «значение ЕС50», которое представляет собой эффективную концентрацию соединения, которая индуцирует половину максимального увеличения ответа (например, образования внутриклеточного цАМФ) в эксперименте зависимого от дозы ответа.
Терапевтические применения
Соединения по изобретению являются агонистами для рецепторов для GLP-1 и для GIP, так же как, необязательно, для рецептора глюкагона (например, «двойные или тройные агонисты»). Такие пептиды, которые являются совместными агонистами GIP/GLP-1, или тройными агонистами GIP/GLP-1/глюкагона, могут обеспечивать терапевтическое преимущество для удовлетворения клинической необходимости нацеливания на метаболический синдром посредством обеспечения возможности одновременного лечения диабета и ожирения.
Метаболический синдром представляет собой комбинацию медицинских нарушений, которые, когда возникают вместе, увеличивают риск развития диабета 2 типа, так же как атеросклеротического сосудистого заболевания, например, заболевания сердца и инсульта. Определяемые медицинские параметры для метаболического синдрома включают в себя сахарный диабет, нарушенную толерантность к глюкозе, повышенный уровень глюкозы при голодании, устойчивость к инсулину, секрецию альбумина в мочу, центральное ожирение, гипертензия, повышенный уровень триглицеридов, повышенный уровень холестерина LDL и пониженный уровень холестерина HDL.
Ожирение представляет собой медицинское состояние, при котором избыток жира организма накапливается до такой степени, что он может оказывать неблагоприятный эффект на состояние здоровья и продолжительность жизни и из-за его увеличивающейся распространенности у взрослых и детей оно стало одной из ведущих предотвращаемых причин смерти в современном мире. Оно увеличивает вероятность различных других заболеваний, включая заболевание сердца, диабет 2 типа, обструктивное апноэ во сне, конкретные типы злокачественных опухолей, так же как остеоартрит, и оно чаще всего вызвано комбинацией избыточного потребления пищи, сниженного расхода энергии, так же как генетической предрасположенности.
Сахарный диабет, часто называемый просто диабетом, представляет собой группу метаболических заболеваний, при которых лицо обладает высокими уровнями сахара в крови, либо из-за того, что организм не продуцирует достаточно инсулина, либо поскольку клетки не отвечают на инсулин, который он продуцирует. Наиболее распространенными типами диабета являются: (1) диабет 1 типа, когда организм не может продуцировать инсулин; (2) диабет 2 типа, когда организм не может продуцировать инсулин правильно, в сочетании с увеличением дефицита инсулина с течением времени, и (3) диабет при беременности, когда у женщин развивается диабет, обусловленный их беременностью. Все формы диабета увеличивают риск долговременных осложнений, которые, как правило, развиваются спустя много лет. Большинство из этих долговременных осложнений основаны на повреждении кровеносных сосудов и могут быть разделены на две категории «макрососудистое» заболевание, возникающее из-за атеросклероза более крупных кровеносных сосудов, и «микрососудистое» заболевание, возникающее из-за повреждения малых кровеносных сосудов. Примерами состояний макрососудистого заболевания являются ишемическая болезнь сердца, инфаркт миокарда, инсульт и заболевание периферических сосудов. Примерами микрососудистых заболеваний являются диабетическая ретинопатия, диабетическая нефропатия, так же как диабетическая невропатия.
Рецепторы для GLP-1 и GIP, так же как для глюкагона, являются членами семейства гетеротримерных сопряженных с G-белком рецепторов с 7 трансмембранными доменами. Они являются структурно родственными друг с другом и разделяют не только значительный уровень идентичности последовательности, но также обладают сходными механизмами узнавания лиганда и внутриклеточными путями передачи сигнала.
Подобным образом, пептиды GLP-1, GIP и глюкагон разделяют области высоких идентичности/сходства последовательности. GLP-1 и глюкагон происходят из общего предшественника, препроглюкагона, который подвергается дифференциальному процессингу тканеспецифическим образом с получением, например, GLP-1 в эндокринных клетках кишечника и глюкагона в альфа-клетках панкреатических островков. GIP происходит из более крупного предшественника прогормона проGIP и он синтезируется и высвобождается из K-клеток, локализованных в тонком кишечнике.
Пептидные инкретиновые гормоны GLP-1 и GIP секретируются эндокринными клетками кишечника в ответ на пищу и служат причиной вплоть до 70% стимулируемой пищей секреции инсулина. Свидетельства позволяют предполагать, что секреция GLP-1 снижена у субъектов с нарушенной толерантностью к глюкозе или диабетом 2 типа, поскольку способность отвечать на GLP-1 еще сохранена у этих пациентов. Таким образом, нацеливание на рецептор GLP-1 с помощью подходящих агонистов предлагает привлекательный способ лечения метаболических нарушений, включая диабет. Рецептор для GLP-1 является широко распространенным, обнаруженным в первую очередь в панкреатических островках, головном мозге, сердце, почке и желудочно-кишечном тракте. В поджелудочной железе GLP-1 действует сильно зависимым от глюкозы образом посредством увеличения секреции инсулина из бета-клеток. Эта зависимость от глюкозы показывает, что активация рецепторов GLP-1 маловероятно вызывает гипогликемию. Также рецептор для GIP широко экспрессируется в периферических тканях, включая панкреатические островки, жировую ткань, желудок, тонкий кишечник, сердце, кость, легкое, почку, яички, кору надпочечников, гипофиз, эндотелиальные клетки, трахею, селезенку, тимус, щитовидную железу и головной мозг. В соответствии с его биологической функцией как инкретинового гормона, панкреатическая β-клетка экспрессирует наиболее высокие уровни рецептора для GIP у человека. Существуют некоторые клинические доказательства того, что опосредованная GIP-рецептором передача сигнала может быть нарушена у пациентов с T2DM, однако, показано, что действие GIP является обратимым и может быть восстановлено с улучшением диабетического статуса. Следует отметить, что стимуляция секреции инсулина посредством обоих инкретиновых гормонов, GIP и GLP-1, является сильно зависимой от глюкозы, обеспечивая ассоциированный с ними бесперебойный механизм при низком риске гипогликемии.
На уровне бета-клеток показано, что GLP-1 и GIP стимулируют чувствительность к глюкозе, неогенез, пролиферацию, транскрипцию проинсулина и гипертрофию, так же как антиапоптоз. Можно ожидать, что пептид с двойной агонистической активностью для GLP-1 и рецептора GIP может оказывать аддитивное или синергическое противодиабетическое благоприятное действие. Другие относящиеся к делу эффекты GLP-1 за пределами поджелудочной железы включают в себя замедленное опорожнения желудка, увеличенное насыщение, уменьшенное потребление пищи, уменьшение массы тела, так же как нейропротективные и кардиопротективные эффекты. У пациентов с диабетом 2 типа, такие экстрапанкреатические эффекты могут являться особенно важными, принимая во внимание высокую частоту сопутствующих заболеваний, подобных ожирению и сердечно-сосудистому заболеванию. Дополнительные действия GIP в периферических тканях вне поджелудочной железы включают в себя увеличенное формирование кости и уменьшенную резорбцию кости, так же как нейропротективные эффекты, которые могут обеспечивать преимущество для лечения остеопороза и когнитивных нарушений, подобных болезни Альцгеймера.
Глюкагон представляет собой пептидный гормон из 29 аминокислот, который продуцируется панкреатическими альфа-клетками и высвобождается в кровоток, когда уровень циркулирующей глюкозы является низким. Важной физиологической ролью глюкагона является стимуляция выхода глюкозы в печени, который представляет собой процесс, обеспечивающий основной контррегуляторный механизм для инсулина при поддержании гомеостаза глюкозы in vivo.
Рецепторы глюкагона, однако, экспрессируются также в тканях вне печени, таких как почка, сердце, адипоциты, лнмфобласты, головной мозг, сетчатка, надпочечник и желудочно-кишечный тракт, что позволяет предполагать более широкую физиологическую роль помимо гомеостаза глюкозы. Соответственно, в недавних исследованиях опубликовано, что глюкагон оказывает терапевтически положительные эффектны на контроль расхода энергии, включая стимуляцию расхода энергии и термогенеза, сопровождающиеся снижением потребления пищи и снижением массы тела. Совместно, стимуляция рецепторов глюкагона может являться пригодной для лечения ожирения и метаболического синдрома.
Оксинтомодулин представляет собой пептидный гормон, состоящий из глюкагона с восемью аминокислотами, охватывающими С-концевое удлинение. Подобно GLP-1 и глюкагону, он предварительно формируется в препроглюкагон и расщепляется, и секретируется тканеспецифическим образом эндокринными клетками тонкого кишечника. Известно, что оксинтомодулин стимулирует оба рецептора для GLP-1 и глюкагона и является, таким образом, прототипом двойного агониста.
Поскольку GLP-1 и GIP известны по их противодиабетическим эффектам, GLP-1 и глюкагон оба известны по их супрессирующим эффектам на потребление пищи, и глюкагон также является медиатором дополнительного расхода энергии, можно предполагать, что комбинация активности двух или трех гормонов в одной молекуле может приводить к сильному лекарственному средству для лечения метаболического синдрома и в частности, его компонентов диабета и ожирения.
Соответственно, соединения по изобретению можно использовать для лечения нарушения толерантности к глюкозе, устойчивости к инсулину, преддиабета, увеличенного уровня глюкозы при голодании, диабета 2 типа, гипертензии, дислипидемии, артериосклероза, коронарной болезни сердца, заболевания периферических артерий, инсульта или любой комбинации этих отдельных компонентов заболеваний.
Кроме того, их можно использовать для контроля аппетита, питания и потребления калорий, увеличения расхода энергии, предотвращения набора массы, стимуляции потери массы, снижения избыточной массы тела и совокупного лечения ожирения, включая патологическое ожирение.
Дополнительные состояния заболевания и состояния здоровья, которые можно лечить с помощью соединений по изобретению, представляют собой связанное с ожирением воспаление, связанное с ожирением заболевание желчного пузыря и индуцированное ожирением апноэ во сне.
Хотя все эти состояния могут являться ассоциированными напрямую или опосредованно с ожирением, эффекты соединений по изобретению могут являться опосредованными, полностью или частично, через эффект на массу тела, или независимыми от нее.
Кроме того, заболевания, подлежащие лечению, представляют собой нейродегенеративные заболевания, такие как болезнь Альцгеймера или болезнь Паркинсона, или другие дегенеративные заболевания, как описано выше.
По сравнению с GLP-1, глюкагоном и оксинтомодулином, эксендин-4 обладает преимущественными физикохимическими свойствами, такими как растворимость и стабильность в растворе и в физиологических условиях (включая ферментативную стабильность по отношению к деградации посредством ферментов, таких как DPP-4 или NEP), что приводит к более длительной продолжительности действия in vivo. Таким образом, эксендин-4 может служить хорошим начальным каркасом для получения аналогов эксендина-4 с двойным или даже тройным фармакологическим действием, например, агонизмом GLP-1/GIP и необязательно, дополнительно глюкагона.
Тем не менее, показано, что эксендин-4 также является химически неустойчивым из-за окисления метионина в положении 14, так же как дезамидирования и изомеризации аспарагина в положении 28. Таким образом, стабильность можно далее улучшать посредством замены метионина в положении 14 и избегания последовательностей, как известно, подверженных деградации посредством образования аспартимида, особенно Asp-Gly или Asn-Gly в положениях 28 и 29.
Фармацевтические композиции
Термин «фармацевтическая композиция» обозначает смесь, содержащую ингредиенты, которые являются совместимыми при смешивании и которые можно вводить. Фармацевтическая композиция может включать одно или несколько лекарственных средств. Кроме того, фармацевтическая композиция может включать носители, буферы, подкисляющие средства, подщелачивающие средства, растворители, адъюванты, регуляторы тоничности, смягчающие средства, расширители, консерванты, физические и химические стабилизаторы, например, поверхностно-активные вещества, антиоксиданты и другие компоненты, несмотря на то, считают ли их активными или неактивными ингредиентами. Руководство для специалистов в данной области для получения фармацевтических композиций можно обнаружить, например, в Remington: The Science and Practice of Pharmacy, (20th ed.) ed. A.R. Gennaro A.R., 2000, Lippencott Williams & Wilkins и в R.C. Rowe et al (Ed), Handbook of Pharmaceutical Excipients, PhP, May 2013 update.
Пептидные производные эксендина-4 по настоящему изобретению, или их соли, вводят в сочетании с приемлемым фармацевтическим носителем, разбавителем или наполнителем в качестве части фармацевтической композиции. «Фармацевтически приемлемый носитель» представляет собой носитель, который является физиологически приемлемым (например, с физиологически приемлемым рН), в то же время сохраняя терапевтические свойства вещества, с которыми его вводят. Стандартные приемлемые фармацевтические носители и их составы известны специалисту в данной области и описаны, например, в Remington: The Science and Practice of Pharmacy, (20th ed.) ed. A.R. Gennaro A.R., 2000, Lippencott Williams & Wilkins и в R.C.Rowe et al (Ed), Handbook of Pharmaceutical excipients, PhP, May 2013 update. Одним из иллюстративных фармацевтически приемлемых носителей является физиологический солевой раствор.
В одном варианте осуществления носители являются выбранными из группы буферов (например, цитрата/лимонной кислоты), подкисляющих средств (например, соляной кислоты), подщелачивающих средств (например, гидроксида натрия), консервантов (например, фенола), сорастворителей (например, полиэтиленгликоля 400), регуляторов тоничности (например, маннита), стабилизаторов (например, поверхностно-активных веществ, антиоксидантов, аминокислот).
Используемые концентрации лежат в диапазоне, который является физиологически приемлемым.
Приемлемые фармацевтические носители или разбавители включают в себя носители или разбавители, используемые в составах, пригодных для перорального, ректального, назального или парентерального (включая подкожное, внутримышечное, внутривенное, внутрикожное и чрескожное) введение. Соединения по настоящему изобретению, как правило, вводят парентерально.
Термин «фармацевтически приемлемая соль» означает соли соединений по изобретению, которые являются безопасными и эффективными для использования у млекопитающих. Фармацевтически приемлемые соли могут включать в себя, но без ограничения, кислотно-аддитивные соли и основные соли. Примеры кислотно-аддитивных солей включают в себя соли хлорид, сульфат, гидросульфат, (гидро)фосфат, ацетат, цитрат, тозилат или мезилат. Примеры основных солей включают в себя соли с неорганическими катионами, например, соли щелочных или щелочноземельных металлов, такие как соли натрия, калия, магния или кальция и соли с органическими катионами, такие как соли амина. Дополнительные примеры фармацевтически приемлемых солей описаны в Remington: The Science and Practice of Pharmacy, (20th ed.) ed. A.R. Gennaro A.R., 2000, Lippencott Williams & Wilkins или в Handbook of Pharmaceutical Salts, Properties, Selection and Use, e.d. P.H. Stahl, C.G. Wermuth, 2002, совместная публикация Verlag Helvetica Chimica Acta, Zurich, Switzerland, и Wiley-VCH, Weinheim, Germany.
Термин «сольват» означает комплексы соединений по изобретению или их солей с молекулами растворителя, например, молекулами органического растворителя и/или воды.
В фармацевтической композиции производное эксендина-4 может находиться в мономерной или олигомерной форме.
Термин «терапевтически эффективное количество» соединения относится к нетоксичному, но достаточному количеству соединения для обеспечения желательного эффекта. Количество соединения формулы I, необходимое для достижения желательного биологического эффекта, зависит от ряда факторов, например, конкретного выбранного соединения, предназначенного применения, способа введения и клинического состояния пациента. Подходящее «эффективное» количество в любом индивидуальном случае может определять специалист в данной области с использованием общепринятых экспериментов. Например, «терапевтически эффективное количество» соединения формулы (I) составляет приблизительно 0,01-50 мг/дозу, предпочтительно 0,1-10 мг/дозу.
Фармацевтические композиции по изобретению представляют собой композиции, пригодные для парентерального (например, подкожного, внутримышечного, внутрикожного или внутривенного), перорального, ректального, местного и перорального (например, подъязычного) введения, хотя наиболее подходящий способ введения зависит в каждом индивидуальном случае от природы и тяжести состояния, подлежащего лечению, и от природы соединения формулы I, используемого в каждом случае.
Пригодные фармацевтические композиции могут находиться в форме отдельных единиц, например, капсул, таблеток и порошков во флаконах или ампулах, каждая из которых содержит определенное количество соединения; в форме порошков или гранул; в форме раствора или суспензии в водной или неводной жидкости; или в форме эмульсии масло-в-воде или вода-в-масле. Их можно предоставлять в пригодной для инъекции форме однократной или множественных доз, например, в форме ручки. Композиции можно, как уже упомянуто, получать любым пригодным фармацевтическим способом, который включает в себя стадию, на которой активный ингредиент и носитель (который может состоять из одного или нескольких дополнительных ингредиентов) приводят в контакт.
В конкретных вариантах осуществления фармацевтическую композицию можно предоставлять вместе с устройством для введения, например, вместе с шприцом, шприц-ручкой или автоинъектором. Такие устройства можно предоставлять отдельно от фармацевтической композиции или предварительно заполненными фармацевтической композицией.
Комбинированная терапия
Соединения по настоящему изобретению, двойные агонисты для рецепторов GLP-1 и GIP или тройные агонисты для рецепторов GLP-1, GIP и глюкагона, можно широко комбинировать с другими фармакологически активными соединениями, такими как все лекарственные средства, упомянутые в Rote Liste 2012 и/или Rote Liste 2013, например, со всеми противодиабетическими средствами, умомянутыми в Rote Liste 2012, chapter 12, и/или в Rote Liste 2013, chapter 12, всеми снижающими массу средствами или подавляющими аппетит средствами, упомянутыми в Rote Liste 2012, chapter 1, и/или в Rote Liste 2013, chapter 1, всеми снижающими уровень липидов средствами, упомянутыми в Rote Liste 2012, chapter 58, и/или в Rote Liste 2013, chapter 58, всеми антигипертензивными и нефропротективными средствами, упомянутыми в Rote Liste 2012 и/или в Rote Liste 2013, или всеми диуретиками, упомянутыми в Rote Liste 2012, chapter 36, и/или в Rote Liste 2013, chapter 36.
Комбинации активных ингредиентов можно использовать, особенно для синергического улучшения действия. Их можно вводить либо посредством отдельного введения активных ингредиентов пациенту, либо в форме комбинированных продуктов, в которых множество активных ингредиентов используют в одном фармацевтическом составе. Когда активные ингредиенты вводят посредством отдельного введения активных ингредиентов, это может быть выполнено одновременно или последовательно.
Большинство активных ингредиентов, упомянутых в настоящем документе ниже, описаны в USP Dictionary of USAN and International Drug Names, US Pharmacopeia, Rockville 2011.
Другие активные вещества, которые являются подходящими для таких комбинаций, включают в себя в частности те, которые, например, усиливают терапевтический эффект одного или нескольких активных веществ по отношению к одному из упомянутых показателей, и/или которые позволяют снижение дозы одного или нескольких активных веществ.
Лекарственные средства, пригодные для комбинаций, включают в себя, например, противодиабетические средства, такие как:
Инсулин и производные инсулина, например: гларгин/Lantus®, 270-330 ед./мл инсулина гларгин (ЕР 2387989 А), 300 ед./мл инсулина гларгин (ЕР 2387989 А), глулизин/Apidra®, детемир/Levemir®, лизпро/Humalog®/Liprolog®, деглюдек/деглюдек плюс, аспарт, базальный инсулин и аналоги (например, LY-2605541, LY2963016, NN1436), пэгилированный инсулин лизпро, Humulin®, Linjeta, SuliXen®, NN1045, инсулин плюс симлин, РЕ0139, быстродействующие и коротко действующие инсулины (например, Linjeta, РН20, NN1218, HinsBet), (АРС-002)гидрогель, пероральный, пригодный для ингаляций, чрескожный и подъязычный инсулины (например, Exubera®, Nasulin®, афреза, трегопил, ТРМ 02, капсулин, Oral-lyn®, пероральный инсулин Cobalamin®, ORMD-0801, NN1953, NN1954, NN1956, VIAtab, пероральный инсулин Oshadi). Кроме того, включены также те производные инсулина, которые связаны с альбумином или другим белком посредством бифункционального линкера.
GLP-1, аналоги GLP-1 и агонисты рецептора GLP-1, например: ликсисенатид/AVE0010/ZP10/ликсумия, эксенатид/эксендин-4/баета/бидуреон/ITCA 650/АС-2993, лираглутид/виктоза, семаглутид, таспоглутид, синкрия/альбиглутид, дулаглутид, р-эксендин-4, CJC-1134-PC, РВ-1023, ТТР-054, лангленатид/НМ-11260С, СМ-3, GLP-1 элиген, ORMD-0901, NN-9924, NN-9926, NN-9927, нодексен, виадор-GLP-l, CVX-096, ZYOG-1, ZYD-1, GSK-2374697, DA-3091, MAR-701, MAR709, ZP-2929, ZP-3022, ТТ-401, ВНМ-034 MOD-6030, САМ-2036, DA-15864, ARI-2651, ARI-2255, эксенатид-XTEN и глюкагон-Xten.
Ингибиторы DPP-4, например: алоглиптин/несина, тражента/линаглиптин/ВI-1356/ондеро/тражента/траджента/трайента/традзента, саксаглиптин/онглиза, ситаглиптин/янувия/кселевия/тесаве/янумет/вельметия, галвус/вилдаглиптин, анаглиптин, гемиглиптин, тенеглиптин, мелоглиптин, трелаглиптин, DA-1229, омариглиптин/МK-3102, KМ-223, эвоглиптин, ARI-2243, PBL-1427, пиноксацин.
Ингибиторы SGLT2, например: инвокана/канаглифлозин, форксига/дапаглифлозин, ремоглифлозин, серглифлозин, эмпаглифлозин, ипраглифлозин, тофоглифлозин, лусеоглифлозин, LX-4211, эртуглифлозин/PF-04971729, RO-4998452, EGT-0001442, KGA-3235/DSP-3235, LIK066, SBM-TFC-039,
Бигуаниды (например, метформин, буформин, фенформин), тиазолидиндионы (например, пиоглитазон, ривоглитазон, розиглитазон, троглитазон), двойные агонисты PPAR (например, алеглитазар, мураглитазар, тезаглитазар), сульфонилмочевины (например, толбутамид, глибенкламид, глимепирид/ амарил, глипизид), меглитиниды (например, натеглинид, репаглинид, митиглинид), ингибиторы альфа-глюкозидазы (например, акарбоза, миглитол, воглибоза), амилин и аналоги амилина (например, прамлинтид, симлин).
Агонисты GPR119 (например, GSK-263A, PSN-821, МВХ-2982, APD-597, ZYG-19, DS-8500), агонисты GPR40 (например, фазиглифам/ТАK-875, TUG-424, Р-1736, JTT-851, GW9508).
Другими пригодными партнерами для комбинации являются: циклозет, ингибиторы 11-бета-HSD (например, LY2523199, BMS770767, RG-4929, BMS816336, AZD-8329, HSD-016, BI-135585), активаторы глюкокиназы (например, ТТР-399, AMG-151, ТАK-329, GKM-001), ингибиторы DGAT (например, LCQ-908), ингибиторы протеинтирозинфосфатазы 1 (например, тродусквемин), ингибиторы глюкоза-6-фосфатазы, ингибиторы фруктоза-1,6-бисфосфатазы, ингибиторы гликоген-фосфорилазы, ингибиторы фосфоенолпируваткарбоксикиназы, ингибиторы киназы синтазы гликогена, ингибиторы киназы пируват-дегидрогеназы, альфа2-антагонисты, антагонисты CCR-2, ингибиторы SGLT-1 (например, LX-2761).
Одно или несколько снижающих уровень липидов средств также являются пригодными в качестве партнеров для комбинации, например, такие как: ингибиторы HMG-CoA-редуктазы (например, симвастатин, аторвастатин), фибраты (например, безафибрат, фенофибрат), никотиновая кислота и ее производные (например, ниацин), агонисты или модуляторы PPAR-(альфа, гамма или альфа/гамма) (например, алеглитазар), агонисты PPAR-дельта, ингибиторы АСАТ (например, авазимиб), ингибиторы абсорбции холестерина (например, эзетимиб), связывающие желчную кислоту вещества (например, холестирамин), ингибиторы транспорта желчной кислоты в повздошной кишке, ингибиторы МТР или модуляторы PCSK9.
Повышающие уровень HDL соединения, такие как: ингибиторы СЕТР (например, торцетрапиб, анацетрапиб, далцетрапиб, эвацетрапиб, JTT-302, DRL-17822, ТА-8995) или регуляторы АВС1.
Другими пригодными партнерами для комбинации являются одно или несколько активных веществ для лечения ожирения, например, таких как: сибутамин, тезофензин, орлистат, антагонисты рецептора каннабиноида-1, антагонисты рецептора МСН-1, агонисты рецептора МС4, антагонисты NPY5 или NPY2 (например, велнеперит), бета-3-агонисты, лептин или миметики лептина, агонисты рецептора 5НТ2 с (например, лоркасерин), или комбинации бупропиона/налтрексона, бупропиона/зонизамида, бупропиона/фентермина или прамлинтида/метрелептина.
Другими пригодными партнерами для комбинации являются:
Дополнительные желудочно-кишечные пептиды, такие как пептид YY 3-36 (PYY3-36) или его аналоги, панкреатический полипептид (РР) или его аналоги.
Агонисты или антагонисты рецептора глюкагона, агонисты или антагонисты рецептора GIP, антагонисты или обратные агонисты грелина, ксенин и его аналоги.
Более того, комбинации с лекарственными средствами для влияния на высокое кровяное давление, хроническую сердечную недостаточность или атеросклероз, например, такими как: антагонисты рецептора ангиотензина II (например, телмисартан, кандесартан, валсартан, лозартан, эпросартан, ирбесартан, олмесартан, тасосартан, азилсартан), ингибиторы АСЕ, ингибиторы ЕСЕ, диуретики, бета-блокаторы, антагонисты кальция, гипертензивные средства центрального действия, антагонисты альфа-2-адренергического рецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов и другие или их комбинации, являются пригодными.
В другом аспекте это изобретение относится к использованию соединения по изобретению или его физиологически приемлемой соли в комбинации по меньшей мере с одним из активных веществ, описанных выше, в качестве партнера для комбинации, для получения лекарственного средства, пригодного для лечения или предотвращения заболеваний или состояний, на которые можно влиять посредством связывания с рецепторами для GLP-1 и глюкагона и посредством модуляции их активности. Это предпочтительно представляет собой заболевание в контексте метаболического синдрома, в частности, одно из заболеваний или состояний, перечисленных выше, особенно диабет или ожирение, или их осложнения.
Использование соединений по изобретению или их физиологически приемлемых солей, в комбинации с одним или несколькими активными веществами, может иметь место одновременно, отдельно или последовательно.
Использование соединения по изобретению или его физиологически приемлемой соли, в комбинации с другим активным веществом может иметь место одновременно или в поочередные интервалы времени, но особенно в пределах короткого промежутка времени. Если их вводят одновременно, два активных вещества вводят пациенту вместе; если их используют в поочередные интервалы времени, два активных вещества вводят пациенту в пределах периода, меньшего или равного 12 часов, но особенно, меньшего или равного 6 часов.
Затем, в другом аспекте это изобретение относится к лекарственному средству, содержащему соединение по изобретению или физиологически приемлемую соль такого соединения и по меньшей мере одно из активных веществ, описанных выше, в качестве партнеров для комбинации, необязательно, вместе с одним или несколькими инертными носителями и/или разбавителями.
Соединение по изобретению или его физиологически приемлемая соль или сольват, и дополнительное активное вещество, подлежащее комбинации с ними, могут оба присутствовать вместе в одном составе, например, таблетке или капсуле, или по отдельности в двух идентичных или различных составах, например, в форме так называемого набора компонентов.
ПОДПИСИ К ФИГУРАМ
Фигура 1. Эффект s.c. введения соединения SEQ ID NO: 11 при 3 мкг/кг и 10 мкг/кг на массу тела у самок мышей C57BL/6NCrl с индуцированным диетой ожирением (DIO) после 3-недельного длительного лечения один раз в сутки. Данные представляют собой среднее ± SEM.
Фигура 2. Эффект s.c. введения соединения SEQ ID NO: 11 при 3 мкг/кг и 10 мкг/кг на массу тела у самок мышей C57BL/6NCrl с индуцированным диетой ожирением (DIO) после 3-недельного длительного лечения один раз в сутки. Изменения массы тела рассчитывали как относительное изменение от исходной. Данные представляют собой среднее ± SEM.
Фигура 3. Эффект 4 недель лечения с помощью SEQ ID NO: 11 при 3 и 10 мкг/кг, s.c., на уровень глюкозы без голодания у dbdb-мышей с диабетом, представленный как изменение от исходного (0 ммоль/л, сутки -7). Данные представляют собой среднее +SEM.
Фигура 4. Эффект 4 недель лечения с помощью SEQ ID NO: 11 при 3 и 10 мкг/кг, s.c., на HbA1c у dbdb-мышей с диабетом, представленный как изменение от исходного (0%, сутки -7). Данные представляют собой среднее +SEM.
Фигура 5. Эффект 4 недель лечения с помощью SEQ ID NO: 11 при 3 и 10 мкг/кг, s.c., на толерантность к пероральной глюкозе у dbdb-мышей с диабетом, представленный как изменение от исходного (t=0 мин, 0 ммоль/л, непосредственно перед введением глюкозы). Данные представляют собой среднее +SEM.
Фигура 6. Эффект 4 недель лечения с помощью SEQ ID NO: 11 при 3 и 10 мкг/кг, s.c., на толерантность к пероральной глюкозе у dbdb-мышей с диабетом, представленный как площадь под кривой концентрации глюкозы (Глюкоза-AUC). Данные представляют собой среднее +SEM.
Фигура 7. Эффект лечения с помощью SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 15 при 3 мкг/кг, s.c., на снижение концентрации глюкозы у dbdb- мышей с диабетом без голодания. Данные представляют собой среднее +SEM.
Фигура 8. Эффект s.c. введения соединения SEQ ID NO: 11 при 1, 10 и 100 мкг/кг на опорожнение желудка и прохождение кишечника у самок NMRI-мышей. Данные представляют собой среднее +SEM.
a) → Опорожнение желудка
b) → Прохождение тонкого кишечника относительно длины тонкого кишечника
МЕТОДЫ
Применяемые сокращения являются следующими:
АК аминокислота
цАМФ циклический монофосфат аденозина
Boc трет-бутилохукарбонил
ВОР гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония
BSA бычий сывороточный альбумин
tBu третичный бутил
Dde 1-(4,4-диметил-2,6-диоксоциклогексилиден)-этил
ivDde 1-(4,4-диметил-2,6-диоксоциклогексилиден)3-метилбутил
DIC N,N'-диизопропилкарбодиимид
DIPEA N,N-диизопропилэтиламин
DMEM среда Игла, модифицированная способом Дульбекко
DMF диметилформамид
EDT этандитиол
FA муравьиная кислота
FBS эмбриональная бычья сыворотка
Fmoc флуоренилметилоксикарбонил
HATU гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония
HBSS сбалансированный солевой раствор Хенкса
HBTU гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
HEPES 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновая кислота
HOBt 1-гидроксибензотриазол
HOSu N-гидроксисукцинимид
HPLC высокоэффективная жидкостная хроматография
HTRF гомогенная флуоресценция с временным разрешением
IBMX 3-изобутил-1-метилксантин
LC/MS жидкостная хроматография/масс-спектрометрия
Palm пальмитоил
PBS фосфатно-солевой буфер
PEG полиэтиленгликоль
РK фармакокинетика
RP-HPLC обращеннофазовая высокоэффективная жидкостная хроматография
Stea стеарил
TFA трифторуксусная кислота
Trt тритил
UV ультрафиолет
Общий синтез пептидных соединений
Материалы:
Различные смолы Ринка - амидные смолы (4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидонорлейциламинометильную смолк, Merck Biosciences; 4-[(2,4-диметоксифенил)(Fmoc-амино)метил]феноксиацетамидометильную смолу, Agilent Technologies) использовали для синтеза амидов пептидов с нагрузками лежит в диапазоне 0,3-0,4 ммоль/г.
Защищенные Fmoc природные аминокислоты закупали из Protein Technologies Inc., Senn Chemicals, Merck Biosciences, Novabiochem, Iris Biotech или Bachem. Следующие стандартные аминокислоты использовали в ходе синтеза: Fmoc-L-Ala-OH, Fmoc-Arg(Pbf)-OH, Fmoc-L-Asn(Trt)-ОН, Fmoc-L-Asp(OtBu)-OH, Fmoc-L-Cys(Trt)-OH, Fmoc-L-Gln(Trt)-OH, Fmoc-L-Glu(OtBu)-OH, Fmoc-Gly-OH, Fmoc-L-His(Trt)-OH, Fmoc-L-Ile-OH, Fmoc-L-Leu-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Met-OH, Fmoc-L-Phe-OH, Fmoc-L-Pro-OH, Fmoc-L-Ser(tBu)-OH, Fmoc-L-Thr(tBu)-OH, Fmoc-L-Trp(Boc)-OH, Fmoc-L-Tyr(tBu)-OH, Fmoc-L-Val-OH.
Кроме того, следующие специальные аминокислоты закупали у тех же поставщиков, что и выше: Fmoc-L-Lys(ivDde)-ОН, Fmoc-L-Lys(Mmt)-ОН, Fmoc-Aib-OH, Fmoc-D-Ser(tBu)-OH, Fmoc-D-Ala-OH, Boc-L-His(Boc)-ОН (доступен в форме сольвата толуола) и Boc-L-His(Trt)-ОН.
Твердофазный синтез пептидов проводили, например, на синтезаторе Prelude Peptide Synthesizer (Protein Technologies Inc) или сходном автоматическом синтезаторе с использованием стандартного химического реагента Fmoc и активации HBTU/DIPEA. DMF использовали в качестве растворителя. Снятие защиты: 20% пиперидин/DMF в течение 2×2,5 мин. Промывки: 7 × DMF. Присоединение 2:5:10 200 мМ АК/500 мМ HBTU/2M DIPEA в DMF 2 × в течение 20 мин. Промывки: 5 × DMF.
В случаях, когда боковая цепь Lys являлась модифицированной, Fmoc-L-Lys(ivDde)-ОН или Fmoc-L-Lys(Mmt)-ОН использовали в соответствующем положении. После завершения синтеза, группу ivDde удаляли в соответствии с модифицированным способом из литературы (S.R. Chhabra et al., Tetrahedron Lett. 39, (1998), 1603), с использованием 4% гидрата гидразина в DMF. Группу Mmt удаляли посредством повторяющейся обработки с помощью 1% TFA в дихлорметане. Последующие стадии ацилирования проводили посредством обработки смолы с помощью N-гидроксисукцинимидных сложных эфиров желательной кислоты или с использованием связывающих реагентов, подобных HBTU/DIPEA или HOBt/DIC.
Все пептиды, которые были синтезированы, отщепляли от смолы с помощью коктейля Кинга для отщепления, состоящего из 82,5% TFA, 5% фенол, 5% воды, 5% тиоанизола, 2,5% EDT. Неочищенные пептиды затем преципитировали в диэтиловом или диизопропиловом эфире, центрифугировали и лиофилизировали. Пептиды анализировали посредством аналитической HPLC и проверяли посредством ESI масс-спектрометрии. Неочищенные пептиды очищали общепринятым способом препаративной очистки HPLC.
Аналитическая HPLC/UPLC
Способ А: Аналитическую UPLC/MS проводили на системе Waters UPLC с колонкой Waters UPLC HSS 1,7 мкм С18 (2,1×100 мм) при 40°С с градиентной элюцией при скорости потока 0,5 мл/мин и мониторировали при 215 и 280 нм. Градиенты устанавливали как 10% В - 90% В в течение 15 мин и затем 90% В в течение 1 мин, или как 15% В - 50% В в течение 12,5 мин и затем 50% В - 90% В в течение 3 мин. Буфер А=0,1% муравьиная кислота в воде и В=0,1% муравьиная кислота в ацетонитриле.
Устройство Waters LCT Premier Time-of-Flight использовали в качестве анализатора масс, оборудованного электрораспылением в режиме положительных ионов.
Способ В: детекция при 210-225 нм, необязательно, с присоединением анализатора масс Waters LCT Premier, электрораспыление в режиме положительных ионов
колонка: Waters ACQUITY UPLC® CSH™ С18 1,7 мкм (150×2,1 мм) при 50°С
растворитель: Н2О+0,5%TFA:ACN+0,35%TFA (поток 0,5 мл/мин)
градиент: 80:20 (0 мин) - 80:20 (3 мин) - 25:75 (23 мин) - 2:98 (23,5 мин) - 2:98 (30,5 мин) - 80:20 (31 мин) - 80:20 (37 мин)
Способ С: детекция при 215 нм
колонка: Aeris Peptide, 3,6 мкм, ХВ-С18 (250×4,6 мм) при 60°С
растворитель: Н2О+0,1%TFA:ACN+0,1%TFA (поток 1,5 мл/мин)
градиент: 90:10 (0 мин) - 90:10 (3 мин) - 10:90 (43 мин) - 10:90 (48 мин) - 90:10 (49 мин) - 90:10 (50 мин)
Способ D: детекция при 214 нм
колонка: Waters X-Bridge С18 3,5 мкм 2,1×150 мм
растворитель: Н2О+0,5%TFA:ACN (поток 0,55 мл/мин)
градиент: 90:10 (0 мин) - 40:60 (5 мин) - 1:99 (15 мин)
Способ Е: детекция при 210 - 225 нм, необязательно, с присоединением анализатора масс Waters LCT Premier, электрораспыление в режиме положительных ионов
колонка: Waters ACQUITY UPLC® ВЕН™ С18 1,7 мкм (150×2,1 мм) при 50°С
растворитель: H2O+1%FA:ACN+1%FA (поток 0,9 мл/мин)
градиент: 95:5 (0 мин) - 95:5 (2 мин) - 35:65 (3 мин) 65:35 (23,5 мин) - 5:95 (24 мин) - 95:5 (26 мин) - 95:5 (30 мин)
Общий способ препаративной очистки HPLC:
Неочищенные пептиды очищали либо на системе  Purifier, либо на системе Jasco semiprep HPLC. Препаративные колонки RP-C18-HPLC различных размеров и с различными скоростями потока использовали в зависимости от количества неочищенного пептида, подлежащего очистке. Ацетонитрил + 0,05-0,1% TFA (В) и воду + 0,05-0,1% TFA (А) использовали в качестве элюентов. Альтернативно, использовали буферную систему, состоящую из ацетонитрила и воды с незначительными количествами уксусной кислоты. Содержащие продукт фракции собирали и лиофилизировали для получения очищенного продукта, как правило, в форме соли TFA или ацетата.
Purifier, либо на системе Jasco semiprep HPLC. Препаративные колонки RP-C18-HPLC различных размеров и с различными скоростями потока использовали в зависимости от количества неочищенного пептида, подлежащего очистке. Ацетонитрил + 0,05-0,1% TFA (В) и воду + 0,05-0,1% TFA (А) использовали в качестве элюентов. Альтернативно, использовали буферную систему, состоящую из ацетонитрила и воды с незначительными количествами уксусной кислоты. Содержащие продукт фракции собирали и лиофилизировали для получения очищенного продукта, как правило, в форме соли TFA или ацетата.
Тестирование растворимости и стабильности производных эксендина-4
Перед тестированием растворимости и стабильности партии пептида, определяли ее содержимое. Таким образом, исследовали два параметра, ее чистоту (HPLC-UV) и количество нагрузки соли на партию (ионная хроматография).
Для тестирования растворимости намеченная концентрация составляла 1,0 мг/мл чистого соединения. Таким образом, растворы твердых образцов получали в различных буферных системах с концентрацией 1,0 мг/мл соединения на основании предварительно определенного содержания. HPLC-УФ проводили после 2 час осторожного встряхивания, из супернатанта, который получали посредством 20 мин центрифугирования при 4000 об./мин.
Затем растворимость определяли посредством сравнения с площадями пиков УФ, полученных с помощью исходного раствора пептида в концентрации 2 мг/мл в чистой воде или в меняющемся количестве ацетонитрила (оптический контроль для всех растворенных соединений). Этот анализ также служил исходной точкой (t0) для тестирования стабильности.
Для тестирования стабильности аликвоту супернатанта, полученную для растворимости, хранили в течение 7 суток при 25°С. После этого периода времени, образец центрифугировали в течение 20 мин при 4000 об./мин, и супернатант анализировали с помощью HPLC-УФ.
Для определения количества оставшегося пептида, площади пиков намеченного соединения при t0 и t7 сравнивали, получая в результате «% оставшегося пептида», следуя уравнению
% оставшегося пептида=[(площадь пика пептида t7)×100]/площадь пика пептида t0. Количество растворимых продуктов деградации рассчитывали из сравнения суммы площадей пиков от всех наблюдаемых примесей за вычетом суммы площадей пиков, наблюдаемых на t0 (т.е. для определения количества вновь образованных родственных пептиду молекул). Это значение приведено в процентом отношении к исходному количеству пептида при t0, следуя уравнению:
% растворимых продуктов деградации={[(сумма площадей пиков примесей при t7)-(сумма площадей пиков примесей при t0)]×100}/площадь пика пептида при t0
Потенциальное отличие суммы «% оставшегося пептида» и «% растворимых продуктов деградации» от 100% отражает количество пептида, которое не остается растворимым в стрессовых условиях, следуя уравнению
% преципитата=100-([% оставшегося пептида]+[% растворимых продуктов деградации])
Этот преципитат включает в себя нерастворимые продукты деградации, полимеры и/или волокна, которые удалены из анализа посредством центрифугирования.
Химическую стабильность выражают как «% оставшегося пептида».
Анионная Хроматография
Устройство: Dionex ICS-2000, пре/колонка: Ion Рас AG-18 2×50 мм (Dionex)/
AS18 2×250 мм (Dionex), элюент: водный гидроксид натрия, поток: 0,38 мл/мин, градиент: 0-6 мин: 22 мМ КОН, 6-12 мин: 22-28 мМ КОН, 12-15 мин: 28-50 мМ КОН, 15-20 мин: 22 мМ КОН, супрессор: ASRS 300 2 мм, детекция: проводимость.
В качестве способа HPLC/UPLC использовали способ D или Е.
Клеточные анализы эффективности in vitro для рецептора GIP, рецептора GLP-1 и рецептора глюкагона
Агонизм соединений для рецепторов определяли посредством функциональных анализов, измеряющих ответ цАМФ линий клеток НЕK-293, стабильно экспрессирующих рецептор GIP, GLP-1 или глюкагона человека.
Содержание цАМФ в клетках определяли с использованием набора из Cisbio Corp. (кат. no. 62АМ4РЕС) на основе HTRF (гомогенной флуоресценции с временным разрешением). Для подготовки, клетки разделяли на Т175 культуральные флаконы и выращивали в течение ночи почти до конфлюэнтности в среде (DMEM/10% FBS). Затем среду удаляли, и клетки промывали с помощью PBS без кальция и магния, с последующей обработкой протеазами с помощью аккутазы (Sigma-Aldrich кат. no. А6964). Открепленные клетки промывали и ресуспендировали в буфере для анализа (1 × HBSS; 20 мМ HEPES, 0,1% BSA, 2 мМ IBMX), и определяли плотность клеток. Затем их разводили до 400000 клеток/мл и 25 мкл-аликвоты распределяли в лунки 96-луночных планшетов. Для измерения, 25 мкл тестируемого соединения в буфере для анализа добавляли в лунки, с последующей инкубацией в течение 30 минут при комнатной температуре. После добавления реагентов HTRF, разведенных в буфере для лизиса (компоненты набора), планшеты инкубировали в течение 1 час, с последующим измерением соотношения флуоресценции при 665/620 нм. Активность агонистов in vitro оценивали количественно посредством определения концентраций, вызывающих 50% активацию максимального ответа (ЕС50).
Способ биоаналитического скрининга для количественной оценки производных эксендина-4 у мышей и свиней
Мышам вводили дозы 1 мг/кг подкожно (s.c). Мышей умерщвляли, и образцы крови собирали через 0,25, 0,5, 1, 2, 4, 8, 16 и 24 часов после введения. Образцы плазмы анализировали после преципитации белка посредством жидкостной хроматографии - масс-спектрометрии (LC/MS). Параметры РK и время полужизни рассчитывали с использованием WinonLin версии 5.2.1 (модель без разделения на компартменты).
Самкам карликовых свиней Геттингер вводили дозы 0,1 мг/кг подкожно (s.c). Образцы крови собирали через 0,25, 0,5, 1, 2, 4, 8, 24, 32, 48, 56 и 72 часов после введения. Образцы плазмы анализировали после преципитации белка посредством жидкостной хроматографии - масс-спектрометрии (LC/MS). Параметры РK и время полужизни рассчитывали с использованием WinonLin версии 5.2.1 (модель без разделения на компартменты).
Опорожнение желудка и прохождение кишечника у мышей
Использовали самок NMRI-мышей с массой тела между 20 и 30 г. Мышей адаптировали к условиям содержания в течение по меньшей мере одной недели.
Мышей подвергали голоданию в течение ночи, в то время как вода оставалась доступной все время. На сутки исследования мышей взвешивали, помещали в отдельные клетки и позволяли доступ к 500 мг корма в течение 30 мин, в то время как воду удаляли. В конце периода кормления 30 мин, оставшийся корм удаляли и взвешивали. Затем тестируемое соединение/контрольное соединение или его носитель в контрольной группе вводили подкожно. Через 60 мин, чтобы позволить соединению достичь соответствующего содержания вещества в плазме крови, окрашенный, некалорийный болюс вводили через желудочный зонд в желудок. Через следующие 30 мин животных умерщвляли и желудок и тонкий кишечник подготавливали. Заполненный желудок взвешивали, опорожняли, осторожно очищали и высушивали, и повторно взвешивали. Содержимое желудка, рассчитанное как масса заполненного за вычетом массы опорожненного желудка, указывало на степень опорожнения желудка. Тонкий кишечник выпрямляли без усилий и измеряли в длину. Затем измеряли расстояние кишечника от начала желудка до края наиболее далеко прошедшего болюсного содержимого кишечника. Прохождение кишечника получали как соотношение в процентах последнего расстояния и общей длины тонкого кишечника.
Статистические анализы проводили с помощью Everstat 6.0 посредством 1-факторного-ANOVA, с последующим тестом Даннета в качестве апостериорного теста. Тест Даннета использовали для сравнения против контроля-носителя. Различия считали статистически значимыми на уровне р<0,05.
Автоматическая оценка потребления пищи у мышей
Использовали самок NMRI-мышей с массой тела между 20 и 30 г. Мышей адаптировали к условиям содержания в течение по меньшей мере одной недели, и в течение по меньшей мере одних суток содержали в отдельных клетках на оборудовании для анализа, когда одновременно регистрировали исходные данные. На сутки исследования, тестируемый продукт вводили подкожно около фазы выключения света (12 час выключения света), и оценку потребления пищи начинали непосредственно после этого. Оценка включала в себя непрерывное мониторирование в течение 22 часов, в то время как данные обрабатывали как среднее каждые 30 мин. Являлось возможным повторение этой процедуры в течение нескольких суток. Ограничение оценки 22 часами присутствовало по практическим соображением, чтобы позволять повторное взвешивание животных, пополнение корма и воды, и введение лекарственного средства между процедурами. Результаты можно было оценивать как суммарные данные в течение 22 часов или дифференцировать для 30 мин интервалов. Сравнимые данные можно было получать как для самок, так и для самцов мышей.
Статистические анализы проводили с помощью Everstat 6.0 посредством двухфакторного ANOVA для повторных измерений и апостериорных анализов Даннета. Различия считали статистически значимыми на уровне р<0,05.
Немедленные эффекты и эффекты средней длительности производных эксендина-4 после подкожной обработки на уровень глюкозы в крови и массу тела у самок мышей C57BL/6NCrl с индуцированным диетой ожирением (DIO)
18 недель на диете с высоким содержанием жира (способ 1)
Самок мышей C57BL/6NCrl содержали в группах в помещении с защитным сооружением, свободном от конкретных патогенов, с 12 час циклом свет/темнота с свободным доступом к воде и корму с высоким содержанием жира. Через 18 недель на диете с высоким содержанием жира, мышей распределяли по группам лечения (n=8), так чтобы каждая группа обладала сходной средней массой тела.
Совпадающую по возрасту группу со свободным доступом к стандартному корму включали в качестве стандартной контрольной группы.
Перед экспериментом, мышам подкожно (s.c.) инъецировали раствор носителя и взвешивали их в течение 3 суток для их привыкания к процедурам.
1) Немедленный эффект на уровень глюкозы в крови у сытых мышей DIO: начальные образцы крови отбирали непосредственно перед первым введением (s.c.) носителя (раствора фосфатного буфера) или производных эксендина-4 в дозах 10, 30 и 100 мкг/кг (растворенных в фосфатном буфере), соответственно. Объем введения составлял 5 мл/кг. Животные имели доступ к воде и их соответствующему корму на протяжении эксперимента, потребление пищи определяли во всех временных точках отбора образцов крови. Уровень глюкозы в крови измеряли на t=0,5 час, t=1 час, t=2 час, t=4 час, t=6 час, t=8 час, и t=24 час (способ: гексокиназа d-глюкозы, гемолизат, AU640 Beckman Coulter). Отбор образцов крови проводили посредством надреза хвоста без анестезии.
2) Эффекты средней длительности на массу тела: всех животных обрабатывали один раз в сутки s.c. во второй половине дня, в конце фазы света (12 час включенного света) либо носителем, либо производными эксендина-4 в вышеупомянутых дозах в течение 4 недель. Массу тела регистрировали ежесуточно. На сутки 6 и 28, общую массу жира измеряли посредством ядерного магнитного резонанса (NMR) с использованием Bruker minispec (Ettlingen, Germany).
14 недель предварительного кормления на диете с высоким содержанием жира (способ 2)
Самок мышей C57BL/6NCrl содержали в группах в помещении с защитным сооружением, свободном от конкретных патогенов, с 12 час циклом свет/темнота с свободным доступом к воде и корму с высоким содержанием жира. Через 14 недель на диете с высоким содержанием жира, мышей распределяли по группам лечения (n=8), так чтобы каждая группа обладала сходной средней массой тела.
Совпадающую по возрасту группу со свободным доступом к стандартному корму и воде включали в качестве стандартной контрольной группы.
Перед экспериментом, мышам подкожно (s.c.) инъецировали раствор носителя и взвешивали их в течение 3 суток для их привыкания к процедурам.
Эффект средней длительности на массу тела: всех животных обрабатывали один раз в сутки s.c. поздно во второй половине дня, в конце фазы света (LD 12:12) либо носителем, либо производными эксендина-4 в вышеупомянутых дозах в течение 3 недель. Массу тела регистрировали ежесуточно.
Статистические анализы проводили с помощью Everstat 6.0 посредством двухфакторного ANOVA для повторных измерений и апостериорных анализов Даннета (профиль глюкозы) и 1-факторного-ANOVA, с последующим апостериорным тестом Даннета (масса тела, содержание жира в организме). Различия по сравнению с обработанными носителем контрольными мышами DIO считали статистически значимыми на уровне р<0,05.
Немедленные эффекты и эффекты средней длительности производных эксендина-4 после подкожной обработки на уровень глюкозы и HbA1c в крови у самок дефицитных по рецептору лептина db/db мышей с диабетом (способ 3)
Самок мышей BKS.Cg-m +/+ Leprdb/J (db/db) и BKS.Cg-m +/+ Leprdb/+(контроль без избыточной массы тела) получали из Charles River Laboratories, Germany, в возрасте 9-10 недель. Животных содержали в группах в помещении с защитным сооружением, свободном от конкретных патогенов, с 12 час циклом свет/темнота с свободным доступом к воде и стандартному корму для грызунов. После 1 недели акклиматизации, образцы крови отбирали из хвоста без анестезии и определяли уровень глюкозы в крови (способ: гексокиназа d-глюкозы, гемолизат, AU640 Beckman Coulter) и уровень HbA1c (способ: гемолизат, Cobas6000 с501, Roche Diagnostics, Germany).
HbA1c представляет собой гликозилированную форму гемоглобина, уровень которого отражает средний уровень глюкозы, воздействию которого подвергался эритроцит в ходе продолжительности его жизни. У мышей, HbA1c представляет собой значимый биомаркер для среднего уровня глюкозы в крови на протяжении предшествующих 4 недель (продолжительность жизни эритроцита у мыши ~ 47 суток).
Db/db мышей распределяли по группам лечения (n=8), так что каждая группа обладала сходными исходными уровнями в крови глюкозы и HbA1c.
1) Немедленный эффект на уровень глюкозы в крови у сытых db/db мышей: начальные образцы крови отбирали непосредственно перед первым введением (s.c.) носителя (раствора фосфатного буфера) или производных эксендина-4 в дозах 3 10, и 100 мкг/кг (растворенных в фосфатном буфере), соответственно. Объем введения составлял 5 мл/кг. Животные имели доступ к воде и корму на протяжении эксперимента, потребление пищи определяли во всех временных точках отбора образцов крови. Уровень глюкозы в крови измеряли при t=0,5 час, t=1 час, t=2 час, t=4 час, t=6 час, t=8 час и t=24 час. Отбор образцов крови проводили посредством надреза хвоста без анестезии. Сравнимые данные можно было получать как для самок, так и для самцов мышей.
2) Эффекты средней длительности на уровни глюкозы и HbA1c в крови: всех животных обрабатывали один раз в сутки s.c. во второй половине дня, в конце фазы света (12 час включенного света) либо носителем, либо производными эксендина-4 в вышеупомянутых дозах в течение 4 недель. В конце исследования образцы крови (из хвоста, без анестезии) анализировали по глюкозе и HbA1c. Сравнимые данные можно было получать как для самок, так и для самцов мышей.
Статистические анализы проводили с помощью Everstat 6.0 посредством двухфакторного ANOVA для повторных измерений и апостериорных анализов Даннета. Различия против обработанных носителем контрольных db/db мышей считали статистически значимыми на уровне р<0,05.
Эффекты 4 недель лечения на уровни глюкозы, HbA1c и толерантность к пероральной глюкозе у самок dbdb-мышей с диабетом (способ 4)
Использовали самок dbdb-мышей с диабетом в возрасте 8 недель, со средним значением уровня глюкозы без голодания 14,5 ммоль/л и массой тела 37-40 г. Мышей индивидуально помечали и адаптировали к условиям содержания в течение по меньшей мере одной недели.
За 7 суток до начала исследования определяли исходные значения для глюкозы и HbA1c без голодания, за 5 суток до начала исследования мышей приписывали к группам и клеткам (5 мышей на клетку, 10 на группу) в соответствии с их значениями HbA1c для обеспечения равномерного распределения более низких и более высоких значений между группами (стратификация).
Мышей лечили в течение 4 недель, посредством подкожного введения один раз в сутки за 3 часа до фазы темноты (6 часов вечера - 6 часов утра). Образцы крови из надреза кончика хвоста получали для HbA1c на сутки исследования 21, и толерантность к пероральной глюкозе оценивали на 4-й неделе. Тест толерантности к пероральной глюкозе выполняли утром без предварительного введения дополнительного соединения, чтобы в основном оценивать эффект длительного лечения и менее - немедленный эффект введения соединения. Мышей подвергали голоданию 4 часа до перорального введения глюкозы (2 г/кг, t=0 мин). Образцы крови отбирали перед введением глюкозы и через 15, 30, 60, 90, 120 и 180 мин после. Корм возвращали после последнего отбора образцов крови. Результаты представлены как изменение от исходного, глюкозы в ммоль/л и HbA1c в %.
Статистические анализы проводили с помощью Everstat версии 6.0 на основе SAS посредством 1-факторного-ANOVA, с последующим апостериорным тестом Даннета против носителя-контроля. Различия считали статистически значимыми на уровне р<0,05.
Снижение уровня глюкозы у самок dbdb-мышей с диабетом без голодания
Использовали самок dbdb-мышей с диабетом со средним значением глюкозы без голодания 20-22 ммоль/л и массой тела 42 г +/- 0,6 г (SEM). Мышей индивидуально помечали и адаптировали к условиям содержания в течение по меньшей мере одной недели.
За 3-5 до начала исследования мышей приписывали к группам и клеткам (4 мышей на клетку, 8 на группу, контрольная группа 16) в соответствии с их значениями глюкозы без голодания для обеспечения равномерного распределения более низких и более высоких значений между группами (стратификация). На сутки исследования мышей взвешивали и вводили дозы (t=0). Непосредственно перед введением соединения корм удаляли, в то время как вода оставалась доступной, и отбирали первый образец крови при надрезе хвоста (исходный). Следующие образцы крови отбирали при надрезе хвоста через 30, 60, 90, 120, 240, 360 и 480 мин.
Статистические анализы проводили с помощью Everstat версии 6.0 на основе SAS посредством 2-факторного-ANOVA для повторных измерений, с последующим апостериорным тестом Даннета против носителя-контроля. Различия считали статистически значимыми на уровне р<0,05.
ПРИМЕРЫ
Изобретение далее проиллюстрировано посредством следующих примеров.
Пример 1:
Синтез SEQ ID NO: 8
Твердофазный синтез проводили на смоле Ринка-амидной смоле Novabiochem (4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометильная смола), 100-200 меш, загрузка 0,34 ммоль/г. Использовали способ Fmoc-синтеза с HBTU/DIPEA-активацией. N-Boc-4-(Fmoc-амино)пиперидин-4-карбоновую кислоту использовали в качестве аминокислоты в положении 20. В положении 1 Boc-Tyr(tBu)-ОН и в положении 14 Fmoc-Lys(ivDde)-ОН использовали в способе твердофазного синтеза. ivDde-группу отщепляли от пептида на смоле в соответствии с модифицированным способом из литературы (S.R. Chhabra et al., Tetrahedron Lett. 39, (1998), 1603), с использованием 4% гидрата гидразина в DMF. Далее Palm-Glu(γOSu)-OtBu присоединяли к высвобожденной аминогруппе. Пептид отщепляли от смолы с помощью коктейля Кинга (D.S. King, С.G. Fields, G.В. Fields, Int. J. Peptide Protein Res. 36, 1990, 255-266). Неочищенный продукт очищали посредством препаративной HPLC на колонке Waters (Sunfire, Prep С18) с использованием градиента ацетонитрила/воды (оба буфера с 0,05% TFA). Очищенный пептид анализировали посредством LCMS (способ В). Обнаружена деконволюция массовых сигналов под пиком с временем удержания 12,69 мин, выявляющая пептид массой 4618,71, что согласуется с ожидаемым значением 4619,21.
Пример 2:
Синтез SEQ ID NO: 11
Твердофазный синтез проводили на смоле Ринка-амидной смоле Novabiochem (4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометильная смола), 100-200 меш, загрузка 0,34 ммоль/г. Использовали способ Fmoc-синтеза с HBTU/DIPEA-активацией. В положении 1 Boc-Tyr(tBu)-ОН, в положении 14 Fmoc-Lys(ivDde)-ОН и в положении 20 Fmoc-(S)-MeLys(Boc)-ОН использовали в способе твердофазного синтеза. ivDde-группу отщепляли от пептида на смоле в соответствии с модифицированным способом из литературы (S.R. Chhabra et al., Tetrahedron Lett. 39, (1998), 1603), с использованием 4% гидрата гидразина в DMF. Далее Palm-Glu(γOSu)-OtBu присоединяли к высвобожденной аминогруппе. Пептид отщепляли от смолы с помощью коктейля Кинга (D.S. King, С.G. Fields, G.В. Fields, Int. J. Peptide Protein Res. 36, 1990, 255-266). Неочищенный продукт очищали посредством препаративной HPLC на колонке Waters (Sunfire, Prep С18) с использованием градиента ацетонитрила/воды (оба буфера с 0,05% TFA). Очищенный пептид анализировали посредством LCMS (способ В). Обнаружена деконволюция массовых сигналов под пиком с временем удержания 12,88 мин, выявляющая пептид массой 4634,66, что согласуется с ожидаемым значением 4635,25.
Пример 3:
Синтез SEQ ID NO: 15
Твердофазный синтез проводили на смоле Ринка-амидной смоле Novabiochem (4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометильная смола), 100-200 меш, загрузка 0,34 ммоль/г. Использовали способ Fmoc-синтеза с HBTU/DIPEA-активацией. В положении 1 Boc-Tyr(tBu)-ОН и в положении 14 Fmoc-Lys(ivDde)-ОН, и в положении 20 Fmoc-альфа-метил-орнитин(Boc)-ОН использовали в способе твердофазного синтеза. ivDde-группу отщепляли от пептида на смоле в соответствии с модифицированным способом из литературы (S.R. Chhabra et al., Tetrahedron Lett. 39, (1998), 1603), с использованием 4% гидрата гидразина в DMF. Далее Stea-Glu(γOSu)-OtBu присоединяли к высвобожденной аминогруппе. Пептид отщепляли от смолы с помощью коктейля Кинга (D.S. King, С.G. Fields, G.В. Fields, Int. J. Peptide Protein Res. 36, 1990, 255-266). Неочищенный продукт очищали посредством препаративной HPLC на колонке Waters (Sunfire, Prep С18) с использованием градиента ацетонитрила/воды (оба буфера с 0,1% TFA). Очищенный пептид анализировали посредством LCMS (способ В). Обнаружена деконволюция массовых сигналов под пиком с временем удержания 12,90 мин, выявляющая пептид массой 4603,64, что согласуется с ожидаемым значением 4604,24.
Аналогичным способом, следующие пептиды SEQ ID NO: 8-17 синтезировали и характеризовали (способ А-Е), см. таблицу 5.
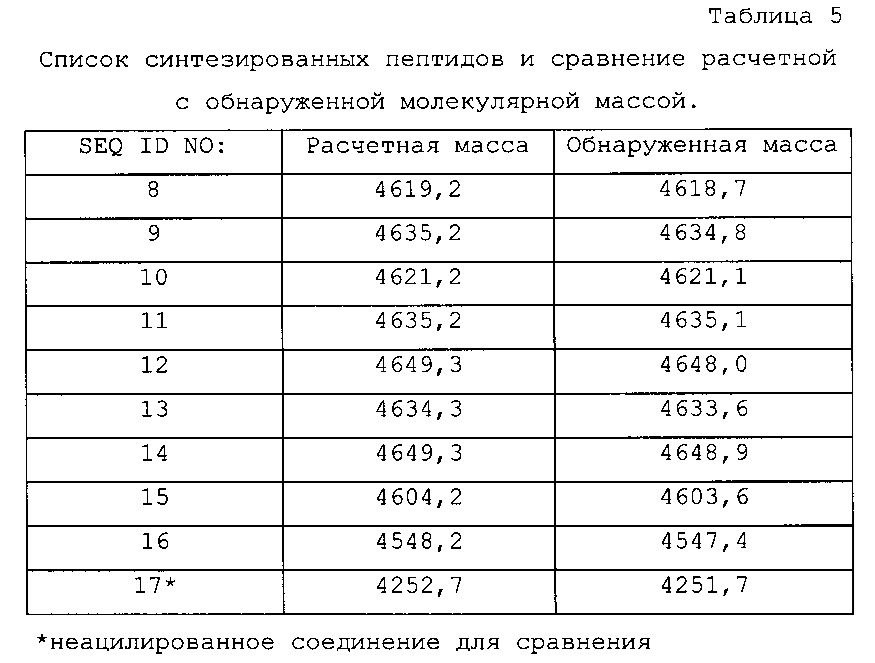
Пример 4: Химическая стабильность и растворимость
Растворимость и химическую стабильность пептидных соединений оценивали, как описано в методах. Результаты приведены в таблице 6.
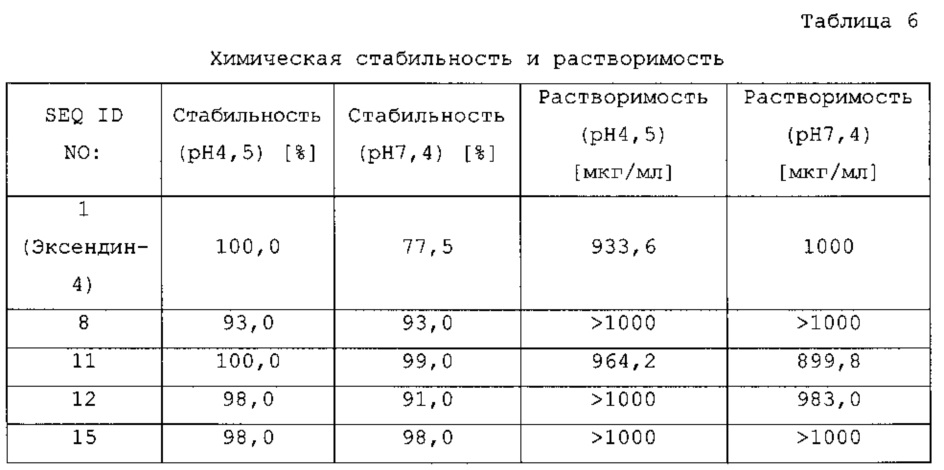
Пример 5: Данные in vitro для рецепторов GLP-1, GIP и глюкагона
Активность пептидных соединений для рецепторов GLP-1, GIP и глюкагона определяли посредством воздействия на клетки, экспрессирующие рецептор глюкагона человека (hGLUC R), GIP человека (hGIP R) и рецептор GLP-1 человека (hGLP-1 R), перечисленных соединений в увеличивающихся концентрациях и измерения образующегося цАМФ, как описано в методах.
Результаты для производных эксендина-4 с активностью для рецептора GIP человека (hGIP R), рецептора GLP-1 человека (hGLP-1 R) и рецептора глюкагона человека (hGLUC R) показаны в таблице 7.
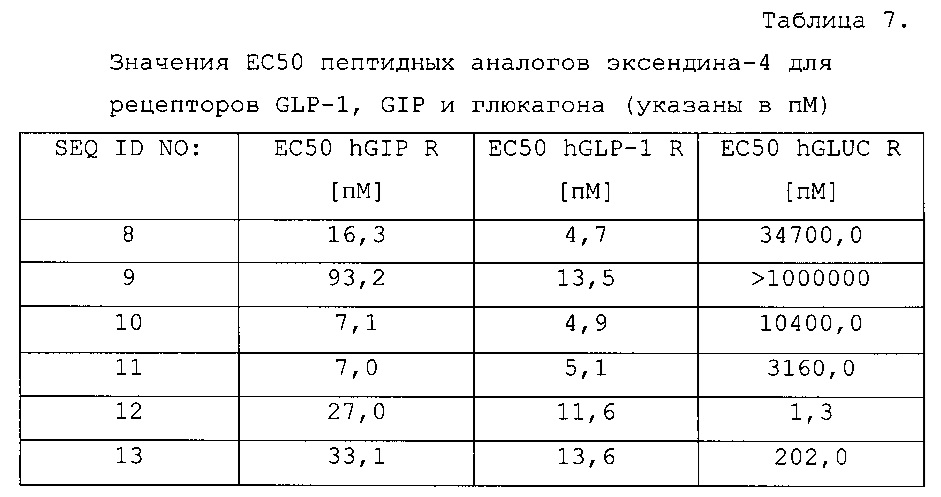
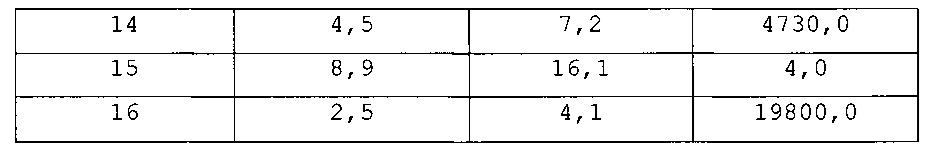
Сравнительное тестирование
Выборку производных эксендина-4 по изобретению, содержащих функционализированную аминокислоту в положении 14, тестировали по сравнению с соответствующими соединениями, обладающими в этом положении 14 «нефункционализированной» аминокислотой. Контрольные парные соединения и соответствующие значения ЕС50 для рецепторов GLP-1 и GIP (указанные в пМ) приведены в таблице 8. Как показано, для производных эксендина-4 по изобретению показана превосходящая активность по сравнению с соединениями с «нефункционализированной» аминокислотой в положении 14.
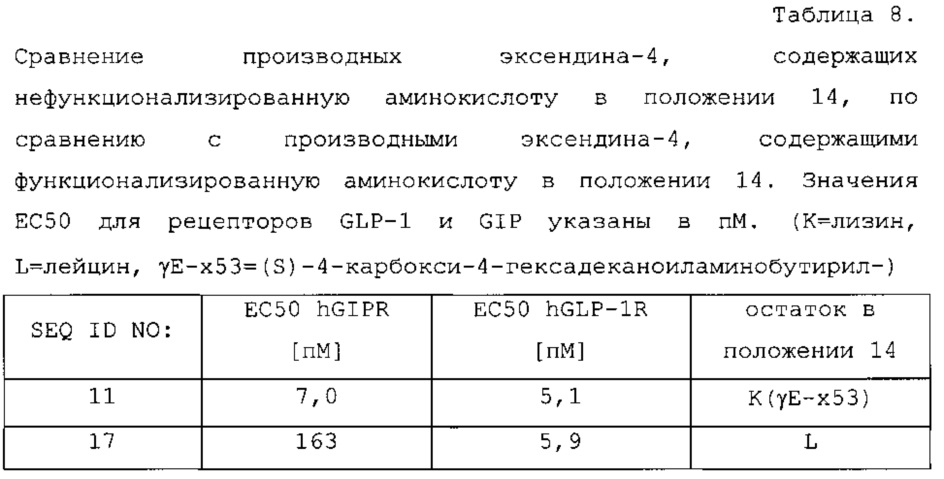
Пример 6: Фармакокинетическое тестирование
Фармакокинетические профили определяли, как описано в методах. Рассчитанные значения Т1/2 и смакс показаны в таблице 9.
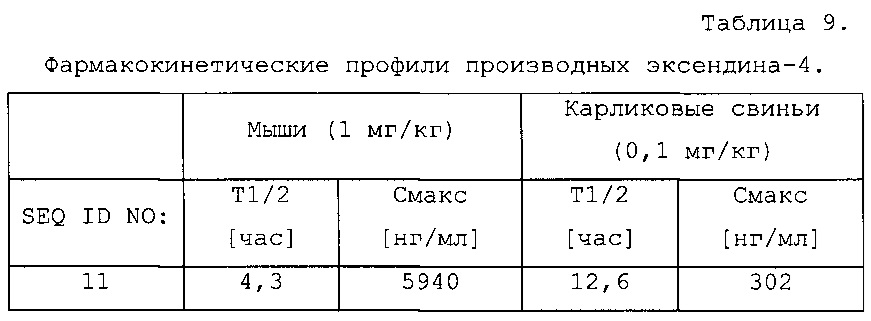

Пример 7:
Эффекты средней длительности SEQ ID NO: 11 после подкожного лечения на массу тела самок мышей C57BL/6NCrl с индуцированным диетой ожирением (DIO) (14 недель предварительного кормления с диетой с высоким содержанием жира, способ 2).
Самок мышей C57BL/6NCrl с ожирением обрабатывали в течение 3 недель один раз в сутки подкожно поздно во второй половине дня, перед концом фазы света (12 час включенного света) с помощью 3 мкг/кг и 10 мкг/кг SEQ ID NO: 11 или носителя. Массу тела регистрировали ежесуточно.
Лечение с помощью SEQ ID NO: 11 снижало массу тела, в то время как контрольная группа на диете с высоким содержанием жира равномерно набирала массу тела (фиг. 1 и таблица 10). Расчет относительного изменения массы тела от исходных значений выявил зависимое от дозы уменьшение массы тела, достигающее 7,6% при 3 мкг/кг и 17,4% при 10 мкг/кг (фиг. 2), соответственно.

Пример 8: Эффекты 4 недель лечения с помощью SEQ ID NO: 11 на глюкозу, HbA1c и толерантность к пероральной глюкозе у самок dbdb-мышей с диабетом (способ 4)
Самкам dbdb-мышей вводили 3 и 10 мкг/кг SEQ ID NO: 11 или фосфатно-солевого буфера (контроль-носитель) один раз в сутки, подкожно в течение четырех недель. SEQ ID NO: 11 статистически значимо снижал уровень глюкозы без голодания по сравнению с контролем-носителем в дозе 3 и 10 мкг/кг. (фиг. 3).
Также, SEQ ID NO: 11 предотвращал увеличение уровня HbA1c статистически значимым образом по сравнению с контролем-носителем в дозе 3 и 10 мкг/кг (фиг. 4; р<0,05, 1-факторный-ANOVA, с последующим апостериорным тестом Даннета). Лечение с помощью SEQ ID NO: 11 приводило к улучшенной толерантности к пероральной глюкозе (представлена как нормализованная по 0 ммоль/л на 0 мин; фиг. 5), и снижение AUC под кривой концентрации глюкозы достигало статистической значимости при 3 и 10 мкг/кг по сравнению с контролем-носителем (фиг. 6; р<0,05, 1-факторный-ANOVA, с последующим апостериорным тестом Даннета).
Пример 9: SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 15 для снижения уровня глюкозы у самок dbdb-мышей с диабетом без голодания
Самкам dbdb-мышей вводили 3 мкг/кг SEQ ID NO: 11, SEQ ID NO: 12, и SEQ ID NO: 15 или фосфатно-солевой буфер (контроль-носитель) подкожно, на время 0 мин. Все три соединения немедленно снижали значения глюкозы (исходно 20-22 ммоль/л), где с SEQ ID NO: 11 и SEQ ID NO: 12 достигнут максимальный эффект ~11 ммоль/л, и с SEQ ID NO: 15 ~12 ммоль/л снижения уровня глюкозы, соответственно, через 240 мин, и он сохранялся до конца наблюдения через 480 мин (фиг. 7).
Для всех трех соединений достигали статистически значимого снижения уровня глюкозы по сравнению с контролем-носителем от t=60 мин до конца наблюдения (р<0,05, 2-факторый-ANOVA для повторных измерений, с последующим апостериорным тестом Даннета).
Пример 2: Эффект SEQ ID NO: 11 на опорожнение желудка и прохождение кишечника у самок NMRI-мышей
Самкам NMRI-мышей, с массой в среднем 25-30 г вводили 1, 10 и 100 мкг/кг SEQ ID NO: 11, или фосфатно-солевой буфер (контроль-носитель) подкожно, за 30 мин до введения окрашенного болюса. Через 30 мин проводили оценку содержимого желудка и прохождения кишечника (фиг. 8).
Сравнимые данные можно было получать как для самок, так и для самцов мышей.
В этих исследованиях, SEQ ID NO: 11 снижал прохождение кишечника на 44, 68 и 69% (р<0,0001) и увеличивали оставшееся содержимое желудка на 17, 97 и 106% (р<0,0001 по сравнению с контролем-носителем, 1-W-ANOVA, с последующим апостериорным тестом Даннета) соответственно.