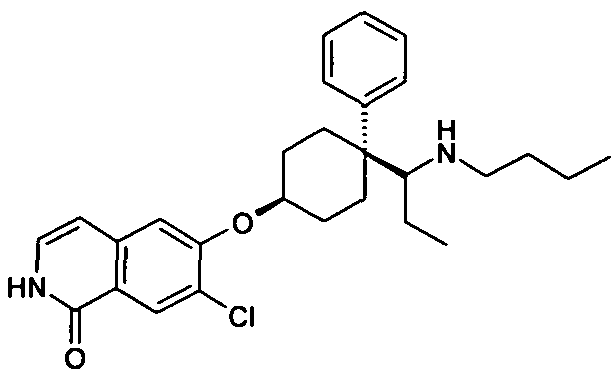
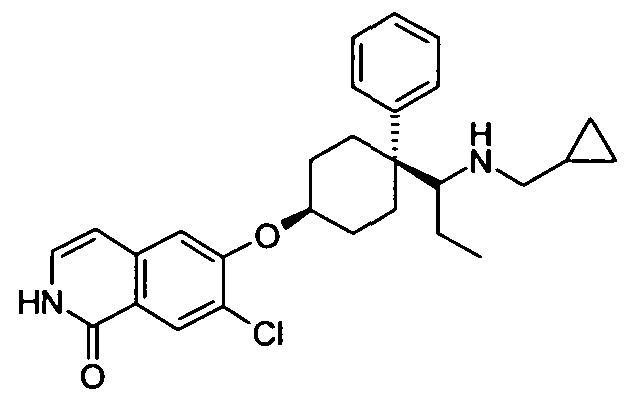
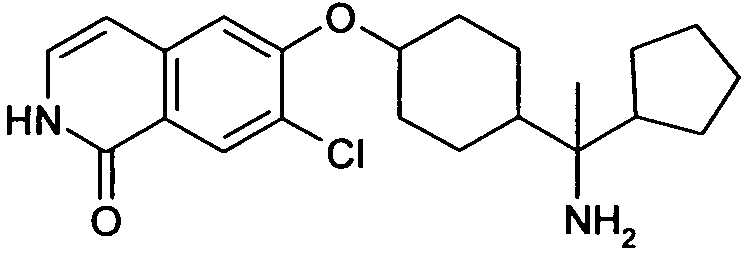
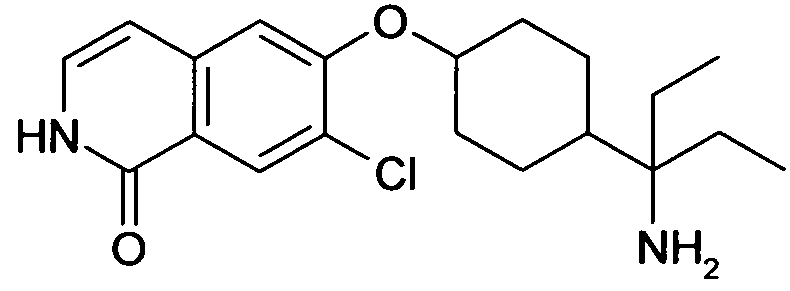
Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ИЗИХИНОЛИНЫ И ИЗОХИНОЛИНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ
Вид РИД
Изобретение
Настоящее изобретение относится к замещенным изохинолинам и изохинолинонам, к их получению и их применению для лечения и/или предотвращения заболеваний, связанных с ингибированием Rho-киназы и/или фосфорилирования фосфатазы легких цепей миозина, опосредованного Rho-киназой.
Активация малой ГТФазы RhoA при стимуляции агониста приводит к превращению RhoA из неактивной ГДФ-связанной формы в активную ГДФ-связанную форму с последующим связыванием с Rho-киназой и активацией Rho-киназы. Известны две изоформы: Rho-киназа 1 и Rho-киназа 2. Rho-киназа 2 экспрессируется в васкулярных гладкомышечных клетках и эндотелиальных клетках. Активация Rho-киназы 2 с помощью ГДФ-связанной RhoA приводит к сенсибилизации кальция гладкомышечных клеток в результате ингибирования активности фосфатазы легких цепей миозина, опосредованного фосфорилированием, и вследствие этого повышающей регуляции активности регуляторных легких цепей миозина (Uehata et al., Nature 1997, 389, 990-994).
Известно, что Rho-киназа вовлечена в вазоконстрикцию, включающую развитие миогенного тонуса и гиперсокращение гладкой мышцы (Gokina et al. J. Appl. Physiol. 2005, 98, 1940-1948), сокращение бронхиальной гладкой мышцы (Yoshii et al. Am. J. Resp. Cell Mol. Biol. 1999, 20, 1190-1200), астму (Setoguchi et al. Br. J. Pharmacol. 2001, 132, 111-118; Nakahara et al. Eur. J. Pharmac. 2000, 389, 103-106) и хроническое обструктивное заболевание легких (COPD, Maruoka et al. Nippon Rinsho, 1999, 57, 1982-1987), гипертензию, легочную гипертензию (Fukumoto et al. Heart 2005, 91, 391-392, Mukai et al. Nature 1997, 389, 990-994) и глазную гипертензию и регуляцию внутриглазного давления (Honjo et al. Invest. Ophthalmol. Visual Sci. 2001, 42, 137-144), эндотелиальную дисфункцию (Steioff et al. Eur. J. Pharmacol. 2005, 512, 247-249), стенокардию (Masumoto et al. Circulation 2002, 105, 1545-47, Shimokawa et al. J. Cardiovasc. Pharmacol. 2002, 40, 751-761), нефропатию, включая индуцированную гипертензией, неиндуцированную гипертензией и диабетические нефропатии, почечную недостаточность и окклюзионное поражение периферических артерий (PAOD) (Wakino et al. Drug News Perspect. 2005, 18, 639-643), инфаркт миокарда (Demiryurek et al. Eur. J. Pharmacol. 2005, 527, 129-140, Hattori et al. Circulation 2004, 109, 2234-2239), гипертрофию сердца и сердечную недостаточность (Yamakawa et al. Hypertension 2000, 35, 313-318; Liao et al. Am. J. Physiol. Cell Physiol. 2006, 290, C661-668; Kishi et al. Circulation 2005, 111, 2741-2747), ишемическую болезнь сердца, артериосклероз, рестеноз (Pacaud et al. Arch. Mal. Coeur 2005, 98, 249-254; Retzer et al. FEBS Lett. 2000, 466, 70-74; Negoro et al. Biochem. Biophys. Res. Commun. 1999, 262, 211-215), диабет, диабетические осложнения, утилизацию глюкозы и метаболический синдром (Sandu et al. Diabetes 2000, 49, 2178-2189; Maeda et al. Cell Metab. 2005, 2, 119-129), сексуальную дисфункцию, например, пенильную эректильную дисфункцию (Chitaley et al. Nature Medicine 2001, 7, 119-122), ретинопатию, воспаление, иммунопатологические заболевания, СПИД, остеопороз, нарушения функции желез внутренней секреции, например, гиперальдостеронизм, заболевания центральной нервной системы, такие как неврональная дегенерация и повреждение спинного мозга (Hara et al. J. Neurosurg. 2000, 93, 94-101), ишемию головного мозга (Uehara et al. Nature 1997, 389, 990-994; Satoh et al. Life Sci. 2001, 69, 1441-1453; Hitomi et al. Life Sci. 2000, 67, 1929-1939; Yamamoto et al. J. Cardiovasc. Pharmacol. 2000, 35, 203-211), спазм мозговых сосудов (Sato et al. Circ. Res. 2000, 87, 195-200; Kim et al. Neurosurgery 2000, 46, 440-447), боль, например, невропатическую боль (Tatsumi et al. Neuroscience 2005, 131, 491-498; Inoue et al. Nature medicine 2004, 10, 712-718), бактериальное заражение желудочно-кишечного тракта (WO 98/06433), развитие и прогрессирование рака, неоплазию, где было показано, что ингибирование Rho киназы подавляет рост опухолевых клеток и метастазирование (Itoh et al. Nature Medicine 1999, 5, 221-225; Somlyo et al. Biochem. Biophys. Res. Commun. 2000, 269, 652-659), ангиогенез (Uchida et al. Biochem. Biophys. Res. Commun. 2000, 269, 633-640; Gingras et al. Biochem. J. 2000, 348, 273-280), пролиферацию и подвижность васкулярных гладкомышечных клеток (Tammy et al. Circ. Res. 1999, 84, 1186-1193; Tangkijvanich et al. Atherosclerosis 2001, 155, 321-327), пролиферацию эндотелиальных клеток, ретракцию и подвижность эндотелиальных клеток (Oikawa et al. Biochem. Biophys. Res. Commun. 2000, 269, 633-640), образование стрессорного волокна (Kimura et al. Science 1997, 275, 1308-1311; Yamashiro et al. J. Cell Biol. 2000, 150, 797-806), тромботические заболевания (Kikkawa et al. FEBS Lett. 2000, 466, 70-74; Bauer et al. Blood 1999, 94, 1665-1672; Klages et al. J. Cell Biol. 1999,144, 745-754; Retzer et al. Cell Signal 2000,12, 645-648) и агрегацию лейкоцитов (Kawaguchi et al. Eur. J. Pharmacol. 2000, 403, 203-208; Sanchez-Madrid et al. J. Immunol. 2003, 171, 1023-1034; Sanchez-Madrid, et al. J. Immunol. 2002, 168, 400-410), биологию, относящуюся к стволовым клеткам и индуцированным полипотентным стволовым клеткам, например, межклеточное взаимодействие, пролиферацию, развитие клеточного цикла, генную регуляцию, миграцию, модуляцию актина клеточного скелета, и связанные с этим применения, например, такие как жизнеспособность, выживаемость, восстановление, рост, предрасположенность к апоптозу, дифференциация, развитие, генная модуляция, модуляция морфогенеза, организм хозяина и инвазии (Krawetz et al. BioEssay 2009, 31, 336-343; Claassen et al. Mol. Reprod. Dev. 2009, PMID: 19235204; Heng Tissue Cell 2009, PMID: 19261317; Arnsdorf et al. J. Cell. Sci. 2009, 122, 546-553, Kim et al. Stem Cells 2009, 27, 191-199), модуляцию эпителиально-мезенхимального перехода (Royal et al. Mol. Biol. Cell 2000, 11, 1709-1725; Zondag et al. J. Cell Biol. 2000, 149, 775-782; Masszi et al. Am. J. Physiol. Renal. Physiol. 2003, 284, 911-924; Smallhorn et al. Development 2004, 131, 2641-2651; Wells et al. Cell Motil. Cytoskeleton 2005, 62, 180-194; Wu et al. Cancer Res. 2006, 66, 9527-9534; Fan et al. Mol Biol Cell. 2007, 18, 1083-1097; Cho et al. Cell Biol. Int. 2007, 31, 1225-1230; Giehl et al. Cells Tissues Organs. 2007, 185, 123-130; Rodrigues-Díez et al. Pharm. Res. 2008, 25, 2447-2461), и резорбцию кости (Chellaiah et al. J. Biol. Chem. 2003, 278, 29086-29097), активацию системы обменного переноса Na/H (Kawaguchi et al. Eur. J. Pharmacol. 2000, 403, 203-208), болезнь Альцгеймера (Zhou et al. Science 2003, 302, 1215-1217), активацию аддуцина (Fukata et al. J. Biol. Chem., 1998, 273, 5542-5548), и при передаче сигнала SREB (связывающего элемента стерольного ответа) и его воздействии на липоидный обмен (Lin et al. Circ. Res. 2003, 92, 1296-304).
Поэтому, соединение, обладающее ингибирующим действием по отношению к Rho-киназе и/или к фосфорилированию фосфатазы легких цепей миозина, опосредованному Rho-киназой, применяют для лечения и/или предотвращения сердечнососудистых заболеваний и заболеваний, не являющихся сердечнососудистыми заболеваниями, в которых вовлечена Rho-киназа в качестве первичной или вторичной причины заболевания, такого как гипертензия, легочная гипертензия, глазная гипертензия, ретинопатия, и глаукома, расстройство периферического кровообращения, окклюзионное поражение периферических артерий (PAOD), ишемическая болезнь сердца, стенокардия, гипертрофия сердца, сердечная недостаточность, заболевания, связанные с ишемией, недостаточность органа, связанная с ишемией (повреждение окончания чувствительного нерва), пневмофиброз, фиброз печени, печеночная недостаточность, нефропатия, включая индуцированные гипертензией, неиндуцированные гипертензией, и диабетические нефропатии, почечная недостаточность, фиброз почек, гломерулосклероз почки, гипертрофия органа, астма, хроническое обструктивное заболевание легких (COPD), синдром расстройства дыхания у взрослых, тромботические заболевания, инсульт, спазм мозговых сосудов, ишемия головного мозга, боль, например, нервнопатическая боль, неврональная дегенерация, повреждение спинного мозга, болезнь Альцгеймера, преждевременный роды, эректильная дисфункция, нарушения функции желез внутренней секреции, артериосклероз, гипертрофия предстательной железы, диабет и осложнения диабета, метаболический синдром, рестеноз кровеносного сосуда, атеросклероз, воспаление, аутоиммунные заболевания, СПИД, остеопатия, такая как остеопороз, бактериальное заражение желудочно-кишечного тракта, сепсис, развитие и прогрессирование рака, например, рака грудной железы, толстой кишки, предстательной железы, яичников, мозга и легких и их метастазы.
Кроме того, такое соединение также применяют при клинических подходах, связанных с лечением с помощью стволовых клеток или индуцированных полипотентных стволовых клеток, улучшением распознавания или для лечения или предотвращения депрессии, эпилепсии, миокардиофиброза, медуллярного некроза почки, тубулоинтерстициальной дисфункции, рассеянного склероза, стеноза сосуда, например, стеноза сонной артерии, или липидных расстройств.
В патентом документе WO 2001/64238 описаны производные изохинолин-5-сульфонамида, необязательно замещенные с помощью -(CH2)1-6-O-(CH2)0-6-, -(CH2)0-6-S-(CH2)0-6- или -(CH2)0-6-связанной гетероциклической группой, используемые в качестве нейропротективных средств.
В патентом документе WO 2004/106325 (Schering AG) описаны пролекарства ингибитора Rho-киназы фасудила, имеющие группу простого или сложного эфира в 1-положении изохинолинового кольца.
В патентом документе WO 2001/039726 в общих чертах описаны циклогексильные производные, замещенные с помощью -O-(C0-C10)-алкилгетероарила, применяемые для лечения микробных инфекций.
В патентом документе JP 10087629 A описаны производные изохинолина, применяемые для лечения заболеваний, вызываемых бактерией Heliobacter pylori, таких как, например, гастрит, рак или язва. Производные изохинолина могут быть замещены с помощью OH в 1-положении и предпочтительно, чтобы они были замещены в 5-положении с помощью X-[(C1-C6)алкилен)]0-1-Y, где X может являться кислородом и Y может являться арилом или гетероциклической группой.
В публикации Hagihara et al., Bioorg. Med. Chem. 1999, 7, 2647-2666 раскрыт 6-бензилоксиизохинолин для лечения инфекций, вызываемых бактерией Heliobacter pylori.
В патентном документе US 5480883 в общих чертах раскрыты в качестве ингибиторов рецептора EGF (эпидермального фактора роста) и/или рецептора PDGF (фактора роста тромбоцитов), применяемых для ингибирования пролиферации клеток, соединения формулы “Ar I - X - Ar II” где X может являться (CHR1)m-Z-(CHR1)n, например, Z-CH2, где Z может являться O, R1 является водородом или алкилом, Ar I может являться, наряду с прочим, необязательно замещенным изохинолоном и Ar II может являться, наряду с прочим, необязательно замещенной C3-7 моноциклической насыщенной гетероциклической системой.
В патентном документе WO 2005/030791 (Merck & Co.) в общих чертах описаны в качестве ингибиторов калиевых каналов для лечения аритмий сердца, инсульта, застойной сердечной недостаточности и так далее, производные изохинолона, которые необязательно замещены в 6-положении с помощью группы (CReRf)pOR43, где p может быть равно нулю, и R43 является, например, (C3-C10)-циклоалкильным остатком, необязательно замещенным с помощью NR51R52, где R51 и R52 могут являться водородом, (C1-C6)алкилом и так далее; или R43 является группой R81, определяемой как 4-6 членное ненасыщенное или насыщенное моноциклическое гетероциклическое кольцо с 1, 2, 3 или 4 гетероатомами; и которые замещены с помощью непосредственной связи необязательно замещенным арильным или гетероарильным кольцом в 4-положении.
В патентном документе WO 2005/030130 (Merck & Co.) в общих чертах описаны в качестве ингибиторов калиевых каналов для лечения аритмий сердца, инсульта, застойной сердечной недостаточности и так далее, производные изохинолина, которые могут быть замещены с помощью гидрокси в 1-положении и которые необязательно замещены в 6-положении с помощью группы (CReRf)pOR43, где p может быть равно нулю, и R43 является, например, (C3-C10)циклоалкильным остатком, необязательно замещенным с помощью NR51R52, где R51 и R52 могут являться водородом, (C1-C6)алкилом и так далее; или R43 является группой R81, определяемой как 4-6 членное ненасыщенное или насыщенное моноциклическое гетероциклическое кольцо с 1, 2, 3 или 4 гетероатомами; и которые замещены в результате образования непосредственной связи необязательно замещенным арильным или гетероарильным кольцом в 4-положении.
В патентном документе WO2003/053330 (Ube) в общих чертах описаны производные изохинолона формулы

в качестве ингибиторов Rho-киназы.
В патентном документе WO 2007/012422 (Sanofi-Aventis) в общих чертах описаны производные изохинолина и изохинолона формулы
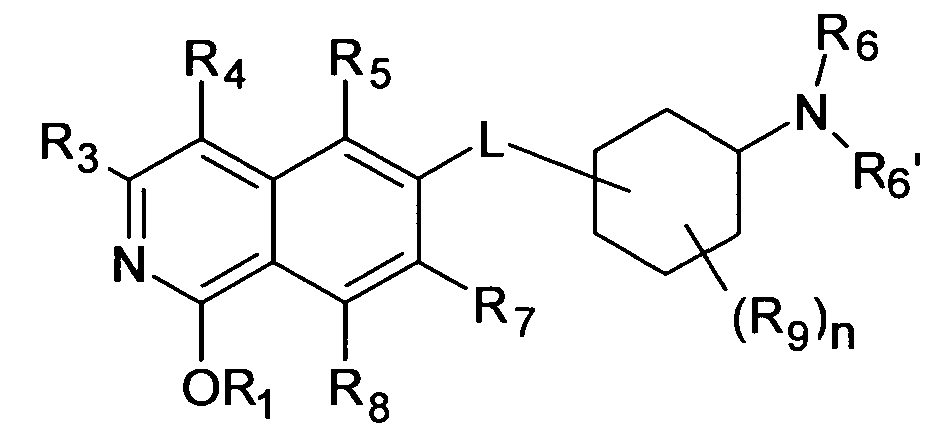
в качестве ингибиторов Rho-киназы.
Кроме того, в патентном документе WO2008/077556 (Sanofi-Aventis) описаны производные 6-замещенного изохинолина и изохинолона в качестве ингибиторов Rho-киназы.
В патентном документе WO 2008/020081 (Organon) описаны производные 6-замещенного изохинолин-1-она или изохинолин-1-амина в качестве ингибиторов Rho-киназы.
В публикации Iwakubo et al., Bioorganic & Med. Chemistry Vol. 15, № 1, 15. Nov. 2006, p. 350-364, описаны получаемые производные 5-замещенного изохинолина и индазола в качестве ингибиторов Rho-киназы.
В частности, необходимым условием для применения ингибиторов киназы в качестве терапевтических средств была названа селективность по отношению к другим киназам. Например, фасудил, широкопрофильный ингибитор Rho киназы, проявляет только невысокую селективность по отношению к некоторым другим киназам, например, к протеинкиназе А и протеинкиназе G (смотрите, например, Tamura et al., Biochimica et Biophysica Acta, Proteins и Proteomics (2005), 1754(1-2), 245-252. Аналогично, еще один ингибитор Y-27632 проявляет только 20-кратную селективность по отношению к протеинкиназе G.
Поэтому, несмотря на то что уже описаны различные ингибиторы Rho-киназы, тем не менее, все еще существует необходимость в синтезе дополнительных соединений, применяемых для лечения заболеваний, опосредованных Rho-киназой, в частности, соединений с повышенной селективностью.
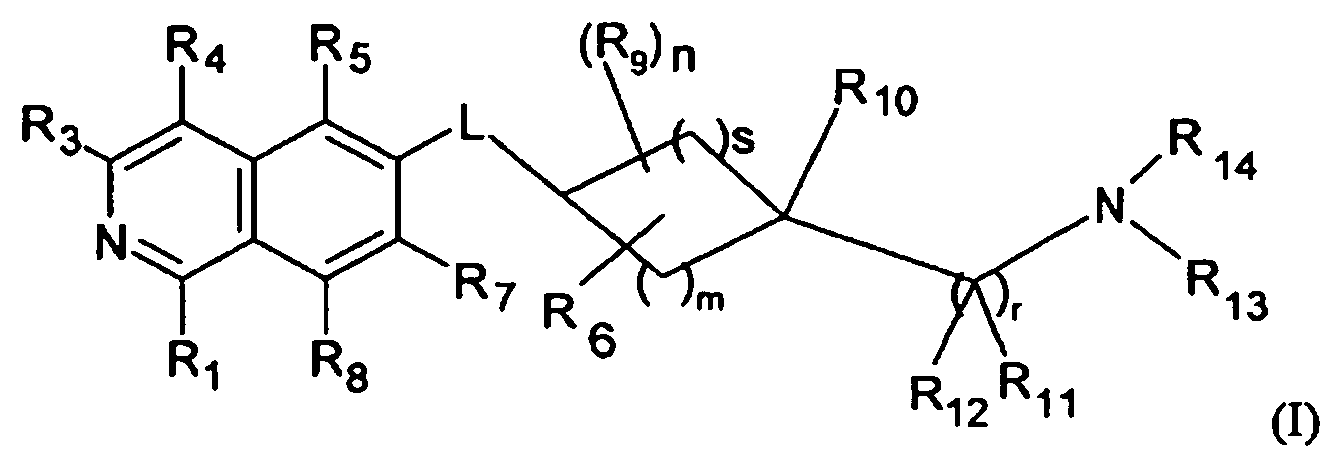
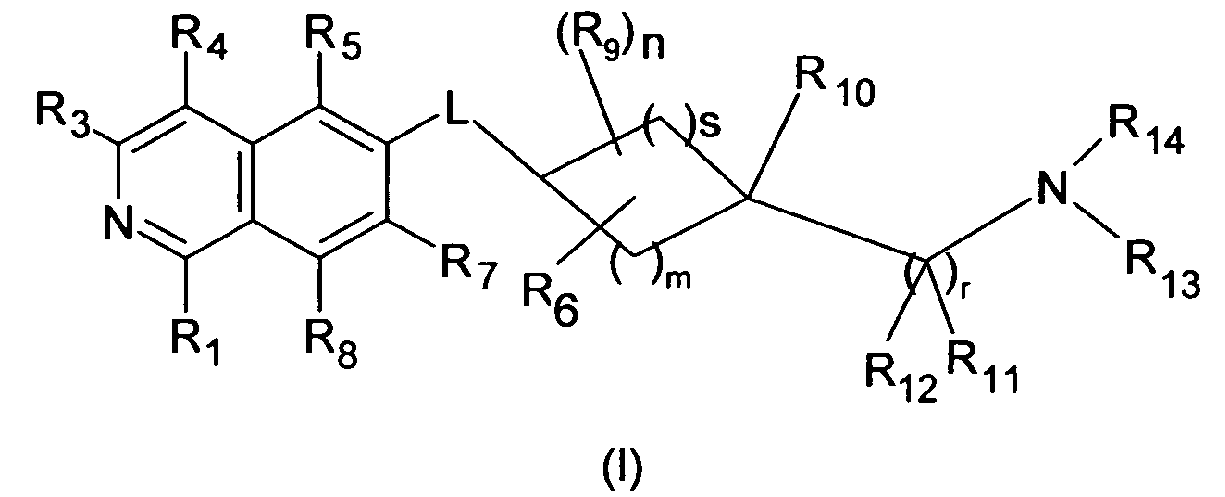
Вариантом осуществления настоящего изобретения является соединение формулы (I)
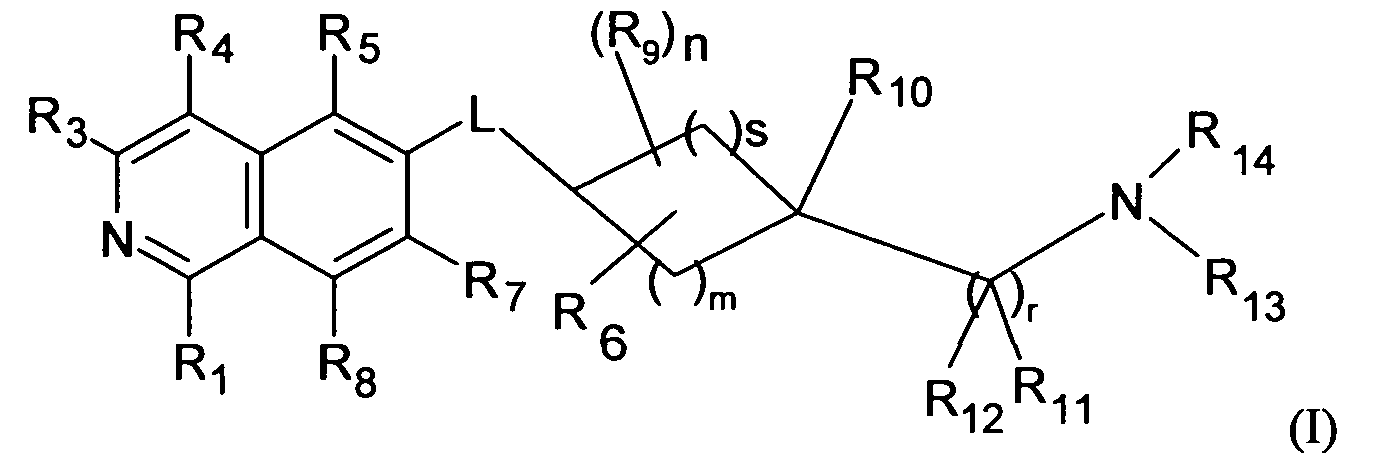
где
R1 является H, OH или NH2;
R3 является H, галогеном, CN, (C1-C6)алкилом, OH, NH2 или NHR';
R4 является H, галогеном, гидрокси, CN, (C1-C6)алкилом, R', или (C1-C6)алкилен-R';
R5 является H, галогеном, CN, (C1-C6)алкилом или R';
R7 является H, галогеном, CN, (C1-C6)алкилом, O-(C1-C6)-алкилом, R' или SO2-NH2;
R8 является H, галогеном или (C1-C6)алкилом;
R9 является
R',
OH,
галогеном,
(C1-C6)алкилом,
O-(C1-C6)алкилом,
(C1-C6)алкилен-R',
(C2-C6)алкенилом,
(C2-C6)алкинилом,
(C1-C6)алкилен-O-R',
(C1-C6)алкилен-CH[R']2,
(C1-C6)алкилен-C(O)-R',
(C1-C6)алкилен-C(O)NH2,
(C1-C6)алкилен-C(O)NH-R',
(C1-C6)алкилен-C(O)NH-(C1-C6)алкилом,
(C1-C6)алкилен-C(O)N[(C1-C6)алкил]2,
(C1-C6)алкилен-C(O)N[R']2,
(C1-C6)алкилен-C(O)O-(C1-C6)алкилом,
COOH,
C(O)O-(C1-C6)алкилом,
C(O)OR'
C(O)(C1-C6)алкилом,
C(O)R',
C(O)NH2,
C(O)-NH-(C2-C6)алкенилом,
C(O)-NH-(C2-C6)алкинилом,
C(O)NH-(C1-C6)алкилом,
C(O)NHR',
C(O)-NH(C1-C6)алкилен-R',
C(O)N[(C1-C6)алкил]R'
C(O)N[(C1-C6)алкил]2,
C(O)-(C1-C6)алкилен-R' или
C(O)O(C1-C6)алкилен-R';
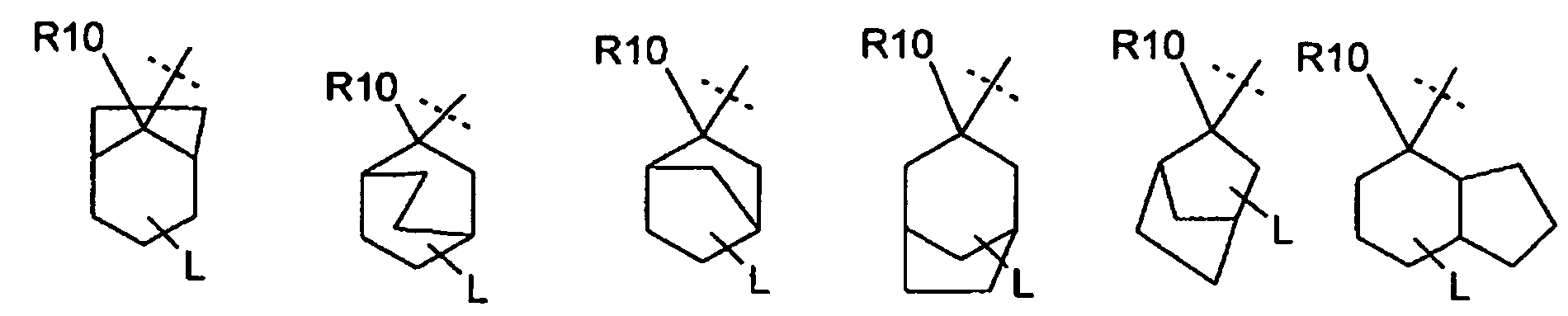
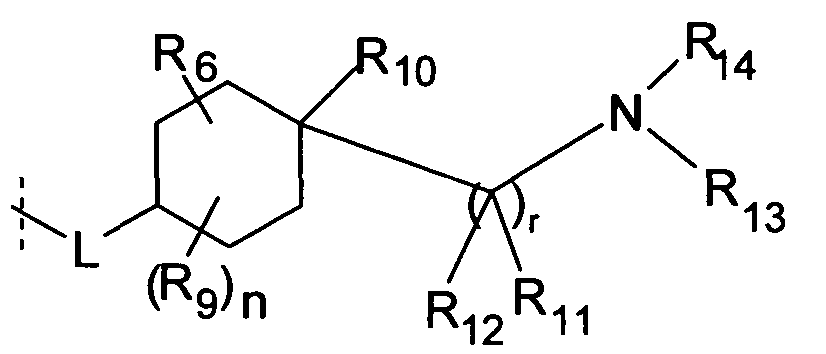
R6 отсутствует;
или является одним (C1-C4)алкиленом, связанным с циклоалкильным кольцом, в котором (C1-C4)алкилен образует вторую связь с другим углеродным атомом циклоалкильного кольца с образованием бициклической кольцевой системы,
где в бициклической кольцевой системы необязательно один или два углеродных атома заменены группой, независимо выбранной из O, N-R15, S, SO или SO2;
или, если m и s равны 2, m равно 3 и s равно 1, или m равно 4 и s равно 0,
то R6 является CH2-CH-(CH2)2, который связан с помощью одного CH2 с циклоалкильным кольцом и два других CH2 связаны с другими углеродными атомами циклоалкильного кольца;
и, если m равно 3 и s равно 3,
то R6 является двумя метиленовыми группами, связанными с различными углеродными атомами циклоалкильного кольца, где метиленовые группы или CH2-CH-(CH2)2 группа связаны с углеродными атомами циклоалкильного кольца, так что они образуют адамантановую систему формулы
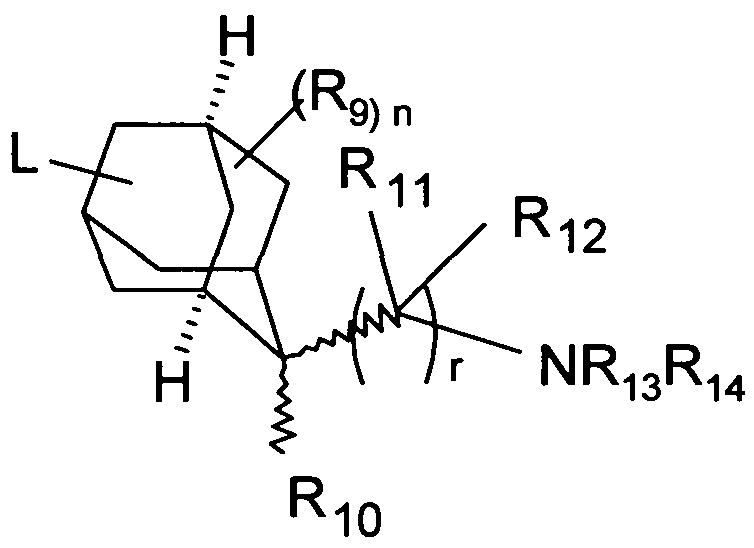
где L может быть связан с любым вторичным или третичным углеродным атомом и
где бициклическая кольцевая система или адамантановая система является незамещенной или необязательно замещенной с помощью R9.
R10 является
H,
(C6-C10)арилом,
O-(C6-C10)арилом,
O-(C1-C6)алкилен-(C6-C10)арилом, или
(C5-C10)гетероарилом, где (C6-C10)арил или (C5-C10)-гетероарил является незамещенным или замещенным,
R11 является
H,
(C1-C6)алкилом,
(C1-C6)алкилен-R',
(C3-C8)циклоалкилом,
(C5-C10)гетероарилом,
(C3-C8)гетероциклоалкилом,
(C6-C10)арилом;
или R11 и R12 вместе с углеродным атомом, к которому они присоединены, образуют (C3-C8)циклоалкил или (C3-C8)-гетероциклоалкильное кольцо;
R12 является
(C1-C6)алкилом,
(C3-C8)циклоалкилом,
(C5-C10)гетероарилом,
(C3-C8)гетероциклоалкилом или
(C6-C10)арилом;
или R12 является H, при условии, что r=2 и другой R12 не является H;
или R11 и R12 вместе с углеродным атомом, к которому они присоединены, образуют (C3-C8)циклоалкил или (C3-C8)-гетероциклоалкильное кольцо;
R13 и R14 являются независимо друг от друга
H,
R',
(C1-C6)алкилом,
(C1-C6)алкилен-R',
(C1-C6)алкилен-O-(C1-C6)алкилом,
(C1-C6)алкилен-O-R',
(C1-C6)алкилен-CH[R']2,
(C1-C6)алкилен-C(O)-R',
(C1-C6)алкилен-C(O)NH2,
(C1-C6)алкилен-C(O)NH-R',
(C1-C6)алкилен-C(O)NH-(C1-C6)алкилом,
(C1-C6)алкилен-C(O)N[(C1-C6)алкил]2,
(C1-C6)алкилен-C(O)N[R']2,
(C1-C6)алкилен-C(O)O-(C1-C6)алкилом,
C(O)O-(C1-C6)алкилом,
C(O)OR',
C(O)(C1-C6)алкилом,
C(O)R',
C(O)NH-(C1-C6)алкилом,
C(O)NHR',
C(O)N[(C1-C6)алкил]R'
C(O)N[(C1-C6)алкил]2,
C(O)-(C1-C6)алкилен-R',
C(O)O(C1-C6)алкилен-R', или
R13 и R14, вместе с N-атомом, к которому они присоединены, образуют (C3-C8) гетероциклоалкил;
R15 является H или (C1-C6)алкилом;
n равно 0, 1, 2, 3 или 4;
m равно 1, 2, 3 или 4;
s равно 0, 1, 2, или 3;
r равно 1 или 2;
L является O(CH2)p, S(CH2)p, S(O)(CH2)p, SO2(CH2)p, NH(CH2)p, N(C1-C6)алкил-(CH2)p, N(C3-C6)циклоалкил-(CH2)p; или N[(C1-C3)алкилен-R']-(CH2)p;
p равно 0, 1, 2, 3 или 4;
R' является
(C3-C8)циклоалкилом,
(C5-C10)гетероарилом,
(C3-C8)гетероциклоалкилом,
(C6-C10)арилом;
где в остатках R3-R15 алкил или алкилен является незамещенным или необязательно замещенным один или более раз с помощью OH, OCH3, C(O)OH, C(O)OCH3, NH2, NHCH3, N(CH3)2, C(O)NH2, C(O)NHCH3 или C(O)N(CH3)2;
где в остатках R3-R15 циклоалкил или гетероциклоалкил является незамещенным или необязательно замещенным один или более раз с помощью (C1-C6)алкила, галогена, OH, OCH3, C(O)OH, C(O)OCH3, NH2, NHCH3, N(CH3)2, C(O)NH2, C(O)NHCH3 или C(O)N(CH3)2;
где в остатках R3-R15 алкил или алкилен является незамещенным или необязательно замещенным один или более раз с помощью галогена;
где в остатках R3-R15 (C6-C10)арил и (C5-C10)гетероарил являются незамещенными или необязательно замещенными один или более раз с помощью группы, независимо выбранной из галогена, OH, NO2, N3, CN, C(O)-(C1-C6)алкила, C(O)-(C6-C10)арила, COOH, COO(C1-C6)алкила, CONH2, CONH(C1-C6)алкила, CON[(C1-C6)алкил]2, (C3-C8)циклоалкила, (C1-C6)алкила, (C1-C6)алкилен-NH(C1-C6)-алкила, (C1-C6)алкилен-N[(C1-C6)алкил]2, (C2-C6)алкенила, (C2-C6)алкинила, O-(C1-C6)алкила, O-C(O)-(C1-C6)алкила, PO3H2, SO3H, SO2-NH2, SO2NH(C1-C6)алкила, SO2N[(C1-C6)алкил]2, S-(C1-C6)алкила; SO-(C1-C6)алкила, SO2-(C1-C6)алкила, SO2-N=CH-N[(C1-C6)алкил]2, SF5, C(NH)(NH2), NH2, NH-(C1-C6)алкила, N[(C1-C6)алкил]2, NH-C(O)-(C1-C6)алкила, NH-C(O)O-(C1-C6)алкила, NH-SO2-(C1-C6)алкила, NH-SO2-(C6-C10)арила, NH-SO2-(C5-C10)-гетероарила, NH-SO2-(C3-C8)гетероциклоалкила, N(C1-C6)-алкил-C(O)-(C1-C6)алкила, N(C1-C6)алкил-C(O)O-(C1-C6)алкила, N(C1-C6)-алкил-C(O)-NH-(C1-C6)алкил], (C6-C10)арила, (C1-C6)-алкилен-(C6-C10)арила, O-(C6-C10)арила, O-(C1-C6)алкилен-(C6-C10)арила, (C5-C10)гетероарила, (C3-C8)гетероциклоалкила, (C1-C6)алкилен-(C5-C10)гетероарила, (C1-C6)алкилен-(C3-C8)-гетероциклоалкила, O-(C1-C6)алкилен-(C5-C10)гетероарила, O-(C1-C6)алкилен-(C3-C8)-гетероциклоалкила, где указанный (C6-C10)арил, (C5-C10)-гетероарил, (C3-C8)гетероциклоалкил или (C3-C8)циклоалкил могут быть замещены от одного до трех раз с помощью группы, независимо выбранной из галогена, OH, NO2, CN, O-(C1-C6)алкила, (C1-C6)-алкила, NH2, NH(C1-C6)алкила, N[(C1-C6)алкил]2, SO2CH3, COOH, C(O)O-(C1-C6)алкила, CONH2, (C1-C6)алкилен-O-(C1-C6)алкила, (C1-C6)алкилен-O-(C6-C10)арила или O-(C1-C6)алкилен-(C6-C10)-арила; или
где (C6-C10)арил вицинально замещен с помощью O-(C1-C4)алкилен-O группы, в результате чего образуется 5-8-членное кольцо вместе с углеродными атомами, к которым присоединены атомы кислорода; и
где арильные заместители (C6-C10)арильной, (C5-C10)гетероарильной, (C3-C8)гетероциклоалкильной или (C3-C8)циклоалкильной групп могут не быть дополнительно замещены с помощью группы, содержащей арил, гетероарил, гетероциклоалкил, или (C3-C8)циклоалкил;
их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В другом варианте осуществления, настоящее изобретение также относится к соединению формулы (I) и/или его фармацевтически приемлемой соли для применения в качестве лекарственного средства. Оно также относится к применению, по меньшей мере, одного соединения формулы (I) и/или его фармацевтически приемлемой соли для лечения и/или предотвращения заболеваний, опосредованных Rho-киназой, таких как гипертензия, легочная гипертензия, глазная гипертензия, ретинопатия, глаукома, расстройство периферического кровообращения, окклюзионное поражение периферических артерий (PAOD), ишемическая болезнь сердца, стенокардия, гипертрофия сердца, сердечная недостаточность, заболевания, связанные с ишемией, недостаточность органа, связанная с ишемией (повреждение окончания чувствительного нерва), пневмофиброз, фиброз печени, печёночная недостаточность, нефропатия, почечная недостаточность, фиброз почек, гломерулосклероз почки, гипертрофия органа, астма, хроническое обструктивное заболевание легких (COPD), синдром расстройства дыхания у взрослых, тромботические заболевания, инсульт, спазм мозговых сосудов, ишемия головного мозга, боль, неврональная дегенерация, повреждение спинного мозга, болезнь Альцгеймера, преждевременный роды, эректильная дисфункция, нарушения функции желез внутренней секреции, артериосклероз, гипертрофия предстательной железы, диабет и осложнения диабета, метаболический синдром, рестеноз кровеносного сосуда, атеросклероз, воспаление, аутоиммунные заболевания, СПИД, остеопатия, бактериальное заражение желудочно-кишечного тракта, сепсис или развитие и прогрессирование рака. Изобретение также относится к лекарственному средству, включающему эффективное количество, по меньшей мере, одного соединения формулы (I) и/или его фармакологически приемлемой соли. Еще одной целью настоящего изобретения является способ получения соединения формулы (I).
Термин «алкил», используемый в (C1-C2)алкиле, (C1-C4)алкиле, или (C1-C6)алкиле, и в соответствующих алкиленовых заместителях, означает углеводородный остаток, который может быть линейным, то есть с прямой цепью, или разветвленным и имеет 1, 2, 3, 4, 5, или 6 углеродных атомов, соответственно. Он также применяется, если алкильная группа присутствует в качестве заместителя в другой группе, например, в алкоксильной группе (O-алкил), S-алкил или -O(C1-C6)алкилен-O-, алкоксикарбонильной группе или арилалкилльной группе. Примерами алкильных групп являются метил, этил, пропил, бутил, пентил или гексил, н-изомеры всех этих групп, изопропил, изобутил, 1-метилбутил, изопентил, неопентил, 2,2-диметилбутил, 2-метилпентил, 3-метилпентил, изогексил, втор-бутил, трет-бутил или трет-пентил. Алкильные или алкиленовые группы могут необязательно быть галогенированы один раз или более, например, алкильные группы могут быть фторированы, например, перфторированы. Примерами галогенированных алкильных групп являются CH2F, CHF2, CF3 и CH2CF3, OCF3, SCF3, или -O-(CF2)2-O-.
Термин «(C2-C6)-алкенил» обозначает углеводородный остаток, углеродная цепь которого является линейной или разветвленной, и который включает от 2 до 6 углеродных атомов и имеет, в зависимости от длины цепи, 1, 2 или 3 двойные связи, например, винил, 1-пропенил, 2-пропенил (= аллил), 2-бутенил, 3-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 5-гексенил или 1,3-пентадиенил. Двойная связь, где это возможно, может иметь E или Z ориентацию. Двойные связи могут быть как внутренними, так и концевыми.
(C2-C6)-алкинильные группы являются углеводородным остатком, в котором углеродная цепь является линейной или разветвленной, и которые включают от 2 до 6 углеродных атомов и имеют, в зависимости от длины цепи, 1 или 2 тройные связи, например, этинил, 1-пропинил, 2-пропинил (= пропаргил) или 2-бутинил. Тройные связи могут быть как внутренними, так и концевыми.
Галоген обозначает фтор (F), хлор (Cl), бром (Br) или йод (I).
Термин «(C1-C8)гетероалкил или соответствующие (C1-C8)гетероалкиленовые заместители» обозначает (C1-C8)алкильные или (C1-C8)алкиленовые группы, в которых, по меньшей мере, один углеродный атом, предпочтительно, один или два углеродных атома, более предпочтительно, один углеродный атом, заменен группой, выбранной из O, NH, или S, и где атомы азота и серы могут необязательно быть окисленными. Гетероатом может быть расположен в любом месте алкильной или алкиленовой группы. Примеры (C1-C8)гетероалкильных групп включают -CH2-O-CH3, -CH2-CH2-O-CH2-CH3, -CH2-NH-CH2-CH3, -CH2-N(CH2-CH3)2, -CH2-CH2-CH2-O-CH3, -CH2-CH2-CH2-S-CH3, -CH2-O-CH(CH3)2 , -CH2-O-CH2-CH2-O-CH3 или O-CH2-CH3.
(C3-C8)циклоалкильные группы являются циклическими алкильными группами, содержащими 3, 4, 5, 6, 7 или 8 углеродных атомов в кольце, такими как циклопропил, циклобутил, циклопентил, циклогексил или циклооктил, которые могут быть также замещены и/или содержать 1 или 2 двойные связи (ненасыщенные циклоалкильные группы) такие как, например, циклопентил или циклогексенил, которые могут быть связаны через любой углеродный атом.
(C6-C10)арильная группа обозначает ароматическое кольцо или кольцевую систему, которая включает два ароматических кольца, которые являются конденсированными или же связанными, или которая включает два конденсированных ароматических кольца, где одно кольцо является насыщенным или частично насыщенным, то есть содержит, по меньшей мере, одну одинарную связь C-C, например, фенильная, нафтильная, бифенильная, тетрагидронафтильная, альфа- или бета-тетралон-, инданил- или индан-1-онильная группа. Предпочтительной (C6-C10)арильной группой является фенил.
(C3-C8)гетероциклоалкильная группа обозначает насыщенную (не содержащую двойные связи) моноциклическую углеродную кольцевую систему, содержащую 3, 4, 5, 6, 7 или 8 атомов в кольце, в которой один или более углеродных атомов могут быть заменены одним или более гетероатомами, такими как, например, 1, 2 или 3 атомами азота, 1 или 2 атомами кислорода, 1 или 2 атомами серы или комбинациями разных гетероатомов. Гетероциклоалкильные остатки могут быть связаны в любых местах, например, в 1-положении, 2-положении, 3-положении, 4-положении, 5-положении, 6-положении, 7-положении или 8-положении. Эта группа также включает соответствующие N-оксиды, сульфоксиды или сульфоны этих соединений.
Примерами (C3-C8)гетероциклоалкильных групп являются оксиранил, оксетанил, азиридинил, тетрагидрофуранил, тетрагидропиранил, диоксоланил, например, 1,3-диоксоланил, диоксанил, например, 1,4-диоксанил, пиперидинил, пирролидинил, имидазолидинил, триазолидинил, гексагидропиримидинил, пипаразинил, триазинанил, например, 1,3,5-триазинанил, 1,2,3-триазинанил или 1,2,4-триазинанил, тетрагидротиофенил, тетрагидротиопиранил, дитиоланил, например 1,3-дитиоланил, дитианил, тиазолидинил, оксазолидинил, оксатиоланил, например, 1,3-оксатиоланил, морфолинил или тиоморфолинил, диазепанил, например, 1,4-диазепанил.
Предпочтительной (C3-C8)гетероциклоалкильной группой является морфолинил, пирролидинил, пиперазинил, пиперидинил, оксетанил или тетрагидропиранил.
(C5-C10)гетероарил обозначает моно- или бициклическую кольцевую систему, в которой один или более углеродных атомов могут быть заменены одним или более гетероатомами, такими как, например, 1, 2, 3 или 4 атомами азота, 1 или 2 атомами кислорода, 1 или 2 атомами серы или комбинацией разных гетероатомов. Гетероарильные остатки могут быть связаны в любом месте, например, в 1-положении, 2-положении, 3-положении, 4-положении, 5-положении, 6-положении, 7-положении или 8-положении. (C5-C10)гетероарильные группы могут являться (1) ароматической моноциклической или бициклической кольцевой системой или (2) бициклической кольцевой системой, в которой одно кольцо является ароматическим, и второе кольцо является, по меньшей мере, частично насыщенным.
Эта кольцевая система также включает соответствующие N-оксиды, сульфоксиды или сульфоны этих соединений.
Подходящими (C5-C10)гетероарильными группами являются бензимидазолил, бензофурил, бензотиенил, азаиндолил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензизоксазолил, бензизотиазолил, карболинил, циннолинил, хроманил, хроменил, нафтиридинил, фталазинил, пиридоимидазолил, птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидроизохинолинил, тетрагидрохинолинил, индолинил, индолизинил, индолил, фурил, фуразанил, тиенил, имидазолил, имидазолинил, 1H-индазолил, пиразолил, оксазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, изоксазолил, тиазолил, изотиазолил, пиридил, триазолил, пиразинил, пиримидинил, пиридазинил, пиразолинил, пирролил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тетразолил.
Пиридил обозначает также и 2-, и 3- и 4-пиридил. Тиенил обозначает также и 2- и 3-тиенил. Фурил обозначает также и 2- и 3-фурил. Пиридил включает также соответствующие N-оксиды этих соединение, например, 1-окси-2-, 3- или 4-пиридил.
Заместители в (C5-C10)гетероарильных остатках могут присутствовать на свободных углеродных атомах или на атомах азота.
Предпочтительными примерами (C5-C10)гетероарильных остатков являются бензофурил, хинолинил, фурил, тиенил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, триазолил, оксадиазолил, пиразинил, пиримидинил, пиридазинил и тетразолил.
Предпочтительным (C5-C10)гетероарилом является (C5-C6)-гетероарильная группа. Предпочтительными (C5-C6)гетероарильными остатками являются фурил, тиенил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, триазолил, оксадиазолил, пиразинил, пиримидинил и пиридазинил. Предпочтительными примерами (C5-C6)гетероарильных остатков являются 2- или 3-тиенил, 2- или 3-фурил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3- или -5-ил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4-оксадиазол-2- или -5-ил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, 3- или 4-пиридазинил или пиразинил.
В остатках R3-R15, (C6-C10)арильные и (C5-C10)гетероарильные остатки являются незамещенными или, если не указано иначе, необязательно замещенными один или более раз, предпочтительно, от одного до трех раз, более предпочтительно, один раз, с помощью группы, независимо выбранной из галогена, OH, NO2, N3, CN, C(O)-(C1-C6)алкила, C(O)-(C6-C10)арила, COOH, COO(C1-C6)алкила, CONH2, CONH(C1-C6)алкила, CON[(C1-C6)алкил]2, (C3-C8)циклоалкила, (C1-C6)алкила, (C1-C6)алкилен-NH(C1-C6)-алкила, (C1-C6)алкилен-N[(C1-C6)алкил]2, (C2-C6)алкенила, (C2-C6)алкинила, O-(C1-C6)алкила, O-C(O)-(C1-C6)алкила, PO3H2, SO3H, SO2-NH2, SO2NH(C1-C6)алкила, SO2N[(C1-C6)алкил]2, S-(C1-C6)алкила, SO-(C1-C6)алкила, SO2-(C1-C6)алкила, SO2-N=CH-N[(C1-C6)алкил]2, SF5, C(NH)(NH2), NH2, NH-(C1-C6)алкила, N[(C1-C6)алкил]2, NH-C(O)-(C1-C6)алкила, NH-C(O)O-(C1-C6)алкила, NH-SO2-(C1-C6)алкила, NH-SO2-(C6-C10)арила, NH-SO2-(C5-C10)-гетероарила, NH-SO2-(C3-C8)гетероциклоалкила, N(C1-C6)алкил-C(O)-(C1-C6)алкила, N(C1-C6)алкил-C(O)O-(C1-C6)алкила, N(C1-C6)-алкил-C(O)-NH-(C1-C6)алкил], (C6-C10)арила, (C1-C6)алкилен-(C6-C10)арила, O-(C6-C10)арила, O-(C1-C6)алкилен-(C6-C10)арила, (C5-C10)гетероарила, (C3-C8)гетероциклоалкила, (C1-C6)алкилен-(C5-C10)гетероарила, (C1-C6)алкилен-(C3-C8)гетероциклоалкила, O-(C1-C6)алкилен-(C5-C10)гетероарила, O-(C1-C6)алкилен-(C3-C8)-гетероциклоалкила, где указанный (C6-C10)арил, (C5-C10)-гетероарил, (C3-C8)гетероциклоалкил или (C3-C8)циклоалкил могут быть замещены от одного до трех раз с помощью группы, независимо выбранной из галогена, OH, NO2, CN, O-(C1-C6)алкила, (C1-C6)-алкила, NH2, NH(C1-C6)алкила, N[(C1-C6)алкил]2, SO2CH3, COOH, C(O)O-(C1-C6)алкила, CONH2, (C1-C6)-алкилен-O-(C1-C6)алкила, (C1-C6)алкилен-O-(C6-C10)арила или O-(C1-C6)алкилен(C6-C10)арила; или
где (C6-C10)арил вицинально замещен с помощью группы O-(C1-C4)алкилен-O, в силу чего образуется 5-8-членное кольцо вместе с углеродными атомами, к которым присоединены атомы кислорода; и
где арильные заместители (C6-C10)арильных, (C5-C10)-гетероарильных, (C3-C8)гетероциклоалкильных или (C3-C8)-циклоалкильных групп могут не быть дополнительно замещены с помощью арила, гетероарила, гетероциклоалкила, или группы, содержащей (C3-C8)циклоалкил.
Предпочтительными заместителями для (C6-C10)арильных и (C5-C10)гетероарильных групп являются OH, (C1-C4)алкил, O-(C1-C4)алкил, O-фенил, фенил, C(O)O-(C1-C6)алкил, C(O)OH, C(O)-(C1-C4)алкил, галоген, NO2, SO2NH2, CN, SO2-(C1-C4)алкил, SO2-N=CH-N[(C1-C6)алкил]2, NH-SO2-(C1-C4)алкил, NH2, NH-C(O)-(C1-C4)алкил, (C3-C8)циклоалкил, (C1-C4)алкил-OH, C(O)N[(C1-C4)-алкил]2, C(O)NH(C1-C6)алкил, C(O)NH2, N[(C1-C4)-алкил]2, (C1-C4)алкилен-N[(C1-C4)алкил]2, (C1-C4)алкилен-O-(C1-C4)алкил, (C5-C6)гетероарил, (C3-C8)гетероциклоалкил, (C1-C4)алкилен-(C6-C10)арил, где (C6-C10)арил может быть дополнительно замещен от одного до трех раз, предпочтительно, один раз, с помощью галогена, (C1-C4)алкила, O-(C1-C4)алкила, (C1-C4)алкилен-O-(C1-C6)алкила, (C6-C10)арила, O-(C1-C6)алкилен-(C6-C10)арила,
или может быть вицинально замещен с помощью группы O-(C1-C4)алкилен-O, в силу чего образуется 5-8-членное кольцо вместе с углеродными атомами, к которым присоединены атомы кислорода.
Более предпочтительными заместителями для (C6-C10)арила и (C5-C10)гетероарила являются OH, галоген, CN, фенил, O-фенил, NH-C(O)-(C1-C4)алкил, C(O)-(C1-C4)алкил, C(O)-O(C1-C4)алкил, (C1-C4)алкил, O-(C1-C4)алкил, CONH2, SO2-NH2, SO2-(C1-C4)алкил или SO2-N=CH-N[(C1-C4)алкил]2, (C1-C4)алкиленфенил, (C1-C4)-алкилен-O-(C1-C4)алкил или (C5-C6)гетероарил, где фенил незамещен или необязательно замещен от одного до трех раз, предпочтительно, один раз, с помощью OH, галогена, (C1-C4)алкила или O-(C1-C4)алкила.
Еще более предпочтительными заместителями для (C6-C10)арила и (C5-C10)гетероарила являются OH, галоген, CN, фенил, O-фенил, NH-C(O)-(C1-C4)алкил, особенно NH-C(O)-CH3, C(O)-(C1-C4)алкил, особенно C(O)-CH3, C(O)-O(C1-C4)алкил, особенно C(O)-OCH3, (C1-C4)алкил, особенно CH3 или CF3, O-(C1-C4)алкил, особенно O-CH3, CONH2, SO2-NH2, SO2-(C1-C4)алкил, особенно SO2-CH3 или SO2-CF3; или SO2-N=CH-N[(C1-C4)алкил]2, особенно SO2-N=CH-N[(CH3)]2,
где фенил незамещен или необязательно замещен от одного до трех раз, предпочтительно, один раз, с помощью OH, галогена, (C1-C4)алкила или O-(C1-C4)алкила.
В частности, наиболее предпочтительными заместителями для (C6-C10)арильных и (C5-C10)гетероарильных групп являются OH, CN, (C1-C4)алкил, особенно CH3 или CF3, O(C1-C4)алкил, особенно O-CH3, галоген или фенил, где фенил может быть дополнительно замещен от одного до трех раз, предпочтительно, один раз, с помощью OH, галогена, (C1-C4)алкила, особенно CH3 или CF3, или O-(C1-C4)алкила, особенно O-CH3.
Самыми предпочтительными заместителями для (C6-C10)арильных и (C5-C10)гетероарильных групп являются OH, CN, галоген, (C1-C4)алкил, особенно CH3 или CF3, O(C1-C4)алкил, особенно O-CH3, или галоген.
В монозамещенных фенильных группах заместитель может быть расположен в 2-положении, 3-положении или 4-положении, при этом 3-положение и 4-положение являются предпочтительными. Если на фенильной группе имеются два заместителя, то они могут быть расположены в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. В фенильных группах с тремя заместителями, заместители могут быть расположены в 2,3,4-положении, 2,3,5-положении, 2,3,6-положении, 2,4,5-положении, 2,4,6-положении, или 3,4,5-положении.
Приведенные выше формулировки, относящиеся к фенильным группам, применяются соответственно к двухвалентным группам, получаемым из фенильных групп, то есть, к фенилену, который может быть незамещенным или замещенным 1,2-фениленом, 1,3-фениленом или 1,4-фениленом. Приведенные выше формулировки также применяются соответственно к арильной подгруппе в арилалкиленовых группах. Примерами арилалкиленовых групп, которые могут также быть незамещенными или замещенными, в арильной подгруппе, так же, как и в алкиленовой подгруппе, являются бензил, 1-фенилэтилен, 2-фенилэтилен, 3-фенилпропилен, 4-фенилбутилен, 1-метил-3-фенилпропилен.
В остатках R3-R15, алкил или алкилен является незамещенным или, если не указано иначе, необязательно замещенным один или более раз с помощью галогена. В случае замещенного алкила или алкилена, предпочтительно, чтобы алкил или алкилен был замещен от одного до трех раз с помощью галогена, выбранного из хлора или брома, но он может быть замещен один раз или более и с помощью фтора, например, может быть перфторированным. Предпочтительно, чтобы галоген являлся фтором. Предпочтительно, чтобы алкилен не являлся галогенированным. Более предпочтительно, чтобы алкил или алкилен не являлись галогенированными.
В остатках R3-R15, алкил или алкилен является незамещенным или, если не указано иначе, необязательно замещенным один или более раз с помощью группы, выбранной независимо из OH, OCH3, C(O)OH, C(O)OCH3, NH2, NHCH3, N(CH3)2, C(O)NH2, C(O)NHCH3 или C(O)N(CH3)2. В случае замещенного алкила или алкилена, предпочтительно, чтобы число заместителей составляло в интервале 1, 2, 3 или 4, более предпочтительно, 1 или 2, при этом 1 является еще более предпочтительным. Предпочтительно, чтобы алкилен не был замещен с помощью одной из этих групп. Более предпочтительно, чтобы алкил или алкилен не были замещены с помощью одной из этих групп. Предпочтительно, чтобы алкил или алкилен в R3, R4, R5, R7 и R8 не были замещены. В дополнительном варианте осуществления алкил или алкилен в R4-R15 не замещен с помощью одной из этих групп.
В остатках R3-R15 циклоалкил или гетероциклоалкил является незамещенным или, если не указано иначе, необязательно замещенным один или более раз с помощью (C1-C6)алкила, галогена, OH, OCH3, C(O)OH, C(O)OCH3, NH2, NHCH3, N(CH3)2, C(O)NH2, C(O)NHCH3 или C(O)N(CH3)2. В случае замещенного циклоалкила или гетероциклоалкила, предпочтительно, чтобы число заместителей составляло в интервале 1, 2, 3 или 4, более предпочтительно, 1 или 2, при этом 1 является еще более предпочтительным. Предпочтительно, чтобы циклоалкил или гетероциклоалкил в R3-R9 не были замещены. В дополнительном варианте осуществления, циклоалкил или гетероциклоалкил в R3-R15 являются незамещенными. В предпочтительном варианте осуществления, гетероциклоалкил является незамещенным. В другом варианте осуществления, циклоалкил является незамещенным.
Определенные выше общие и предпочтительные заместители (C6-C10)арильных, (C5-C10)гетероарильных, (C3-C8)гетероциклоалкильных и (C3-C8)циклоалкильных групп могут быть объединены с общими и предпочтительными определениями R1, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, n, s, m, r, p и L, приведенными в следующих вариантах осуществления соединения формулы (I).
Следующие варианты осуществления соединения формулы (I) дополнительно характеризуют настоящее изобретение и являются частью настоящего изобретения.
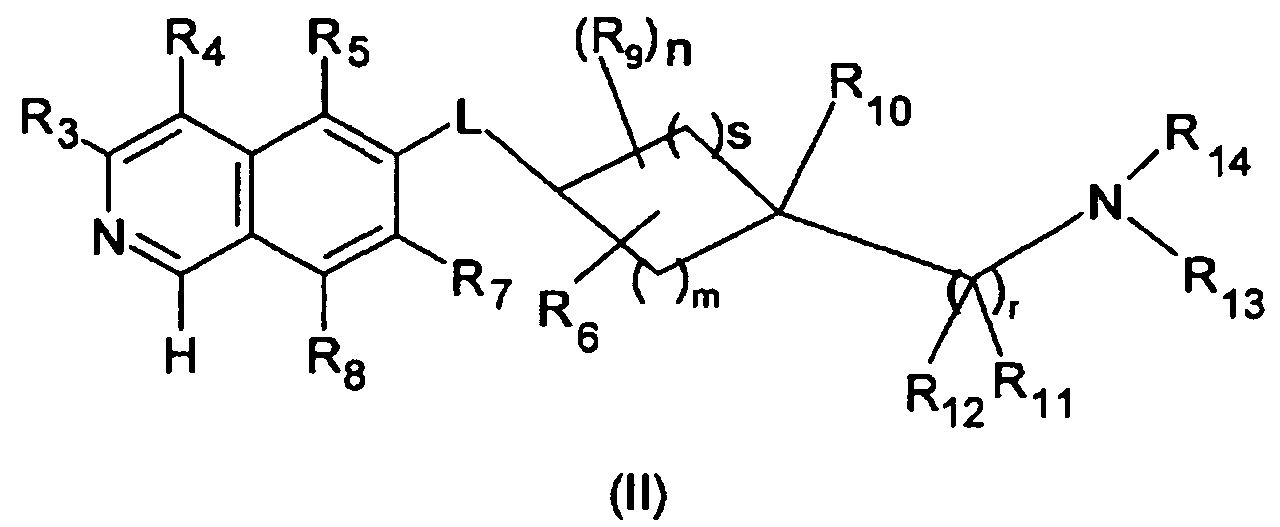
В одном варианте осуществления соединения формулы (I), R1 является H, и соединение описывается формулой (II)
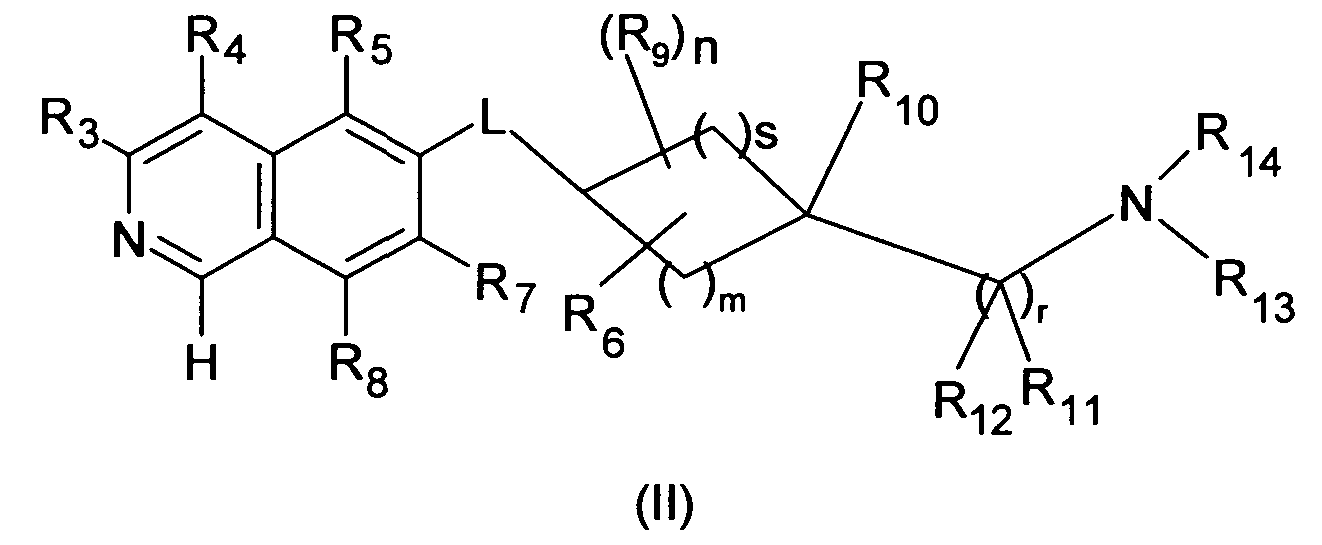
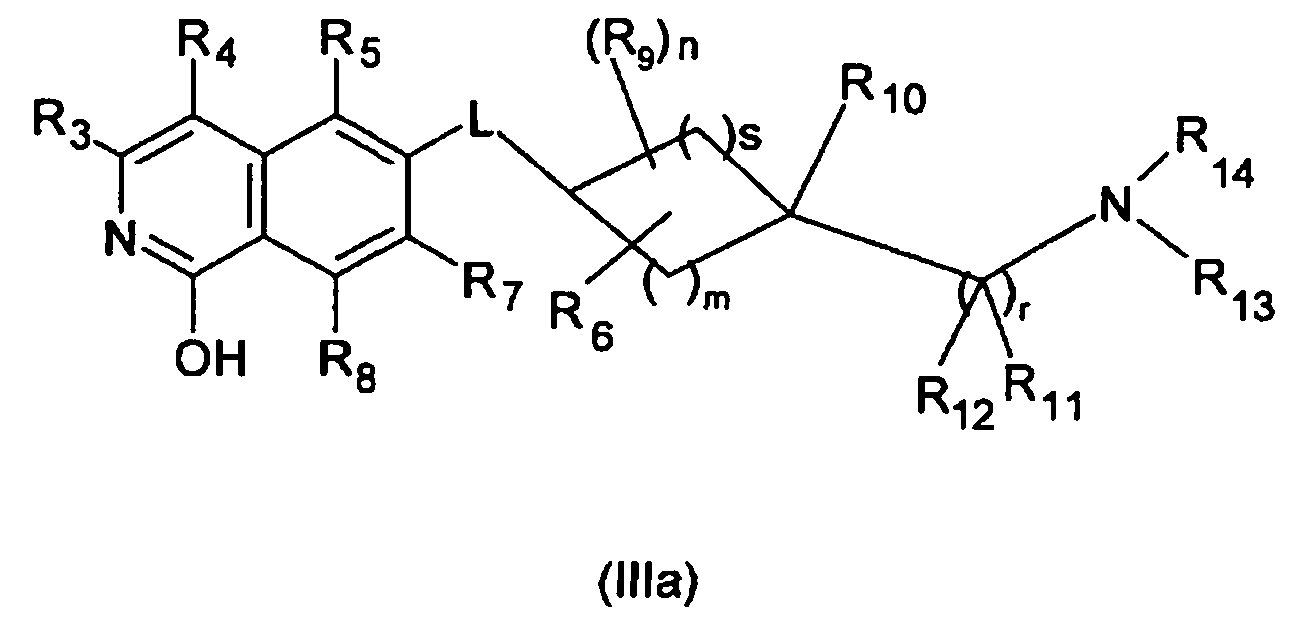
В другом варианте осуществления настоящего изобретения, R1 является OH и соединение описывается формулой (IIIa)
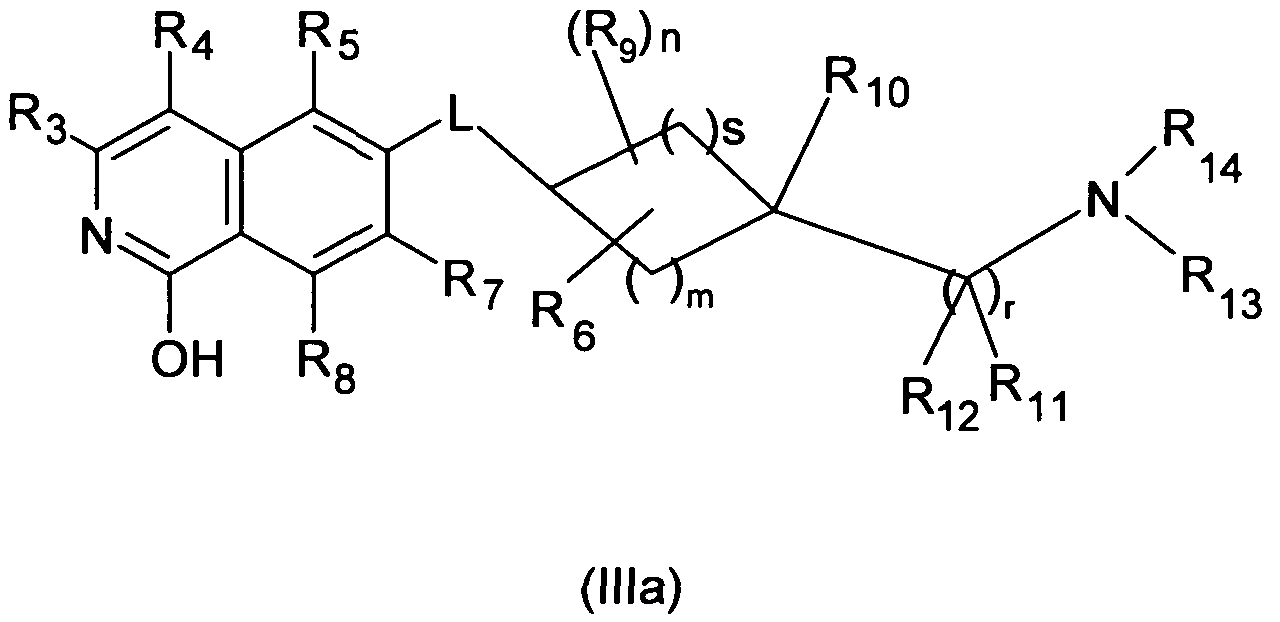
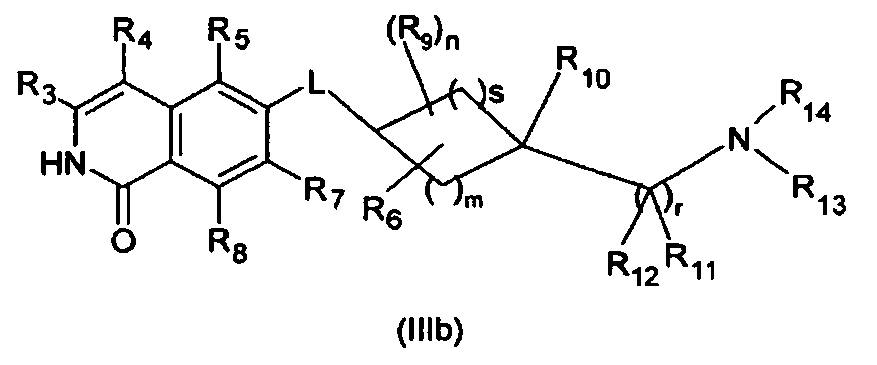
Производная изохинолина формулы (I), где R1 является OH, включает соответствующую таутомерную производную 1-изохинолона, которая описывается формулой (IIIb)
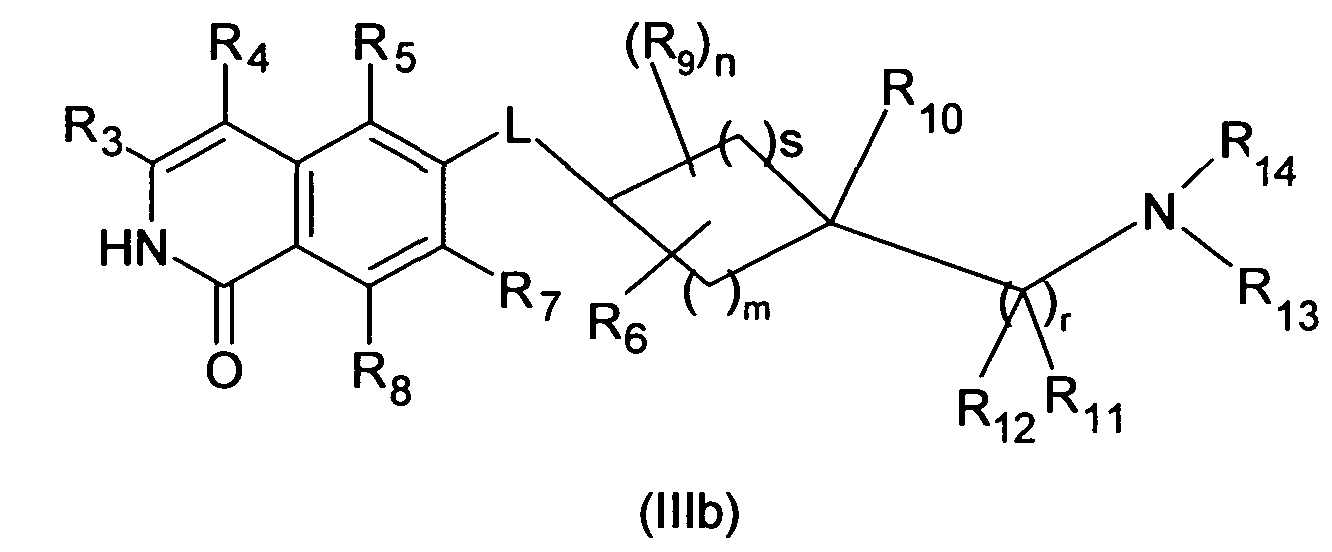
Эта таутомерная форма также является вариантом осуществления настоящего изобретения.
В дополнительном варианте осуществления, R1 является NH2, и соединение описывается формулой (IV)
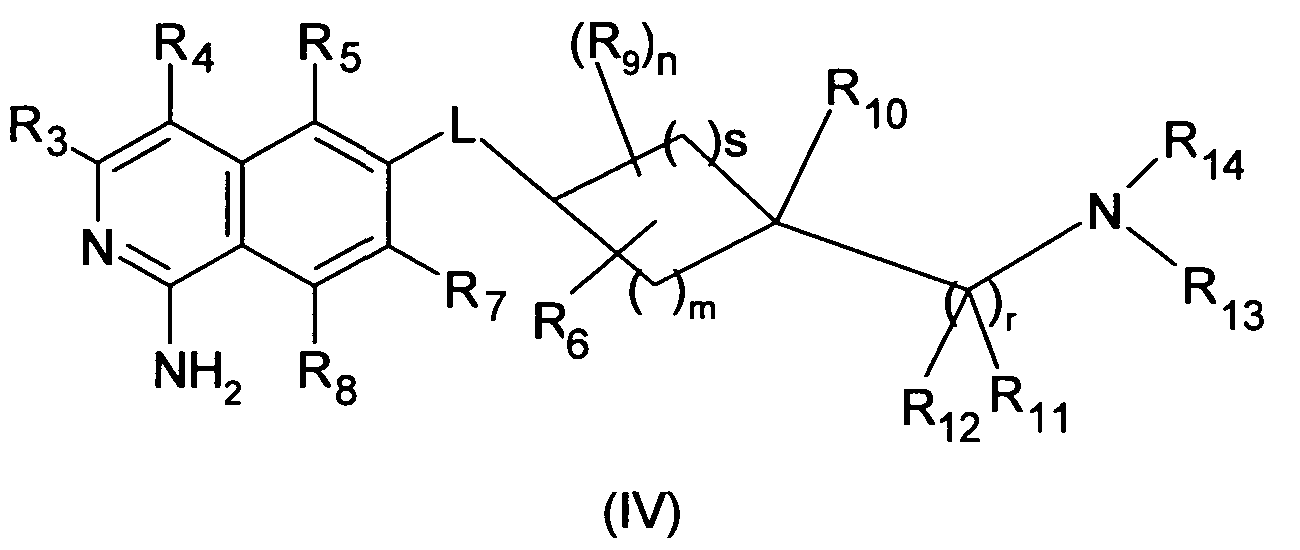
Следующие дополнительные варианты осуществления равным образом относятся к соединениям формулы (I), (II), (IIIa), (IIIb) и (IV).
В предпочтительном варианте осуществления, R1 является H или OH; более предпочтительно, чтобы R1 являлся OH.
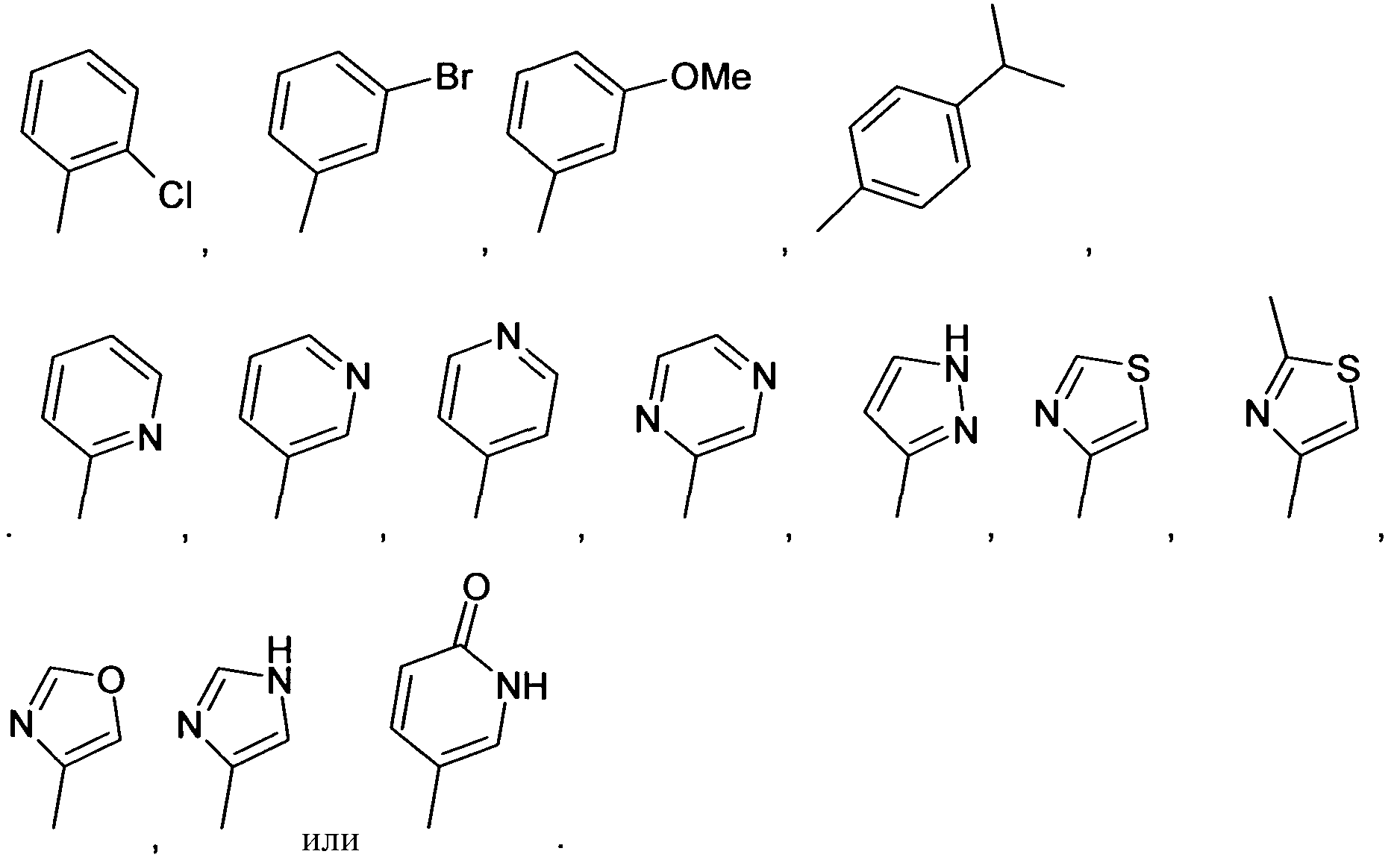
В одном варианте осуществления, предпочтительно, чтобы R3 являлся H, галогеном, (C1-C6)алкилом, или NHR'. В другом более предпочтительном варианте осуществления, R3 является H, галогеном, незамещенным или замещенным NH-(C5-C6)гетероарилом, незамещенным или замещенным NH-(C3-C8)гетероциклоалкилом или незамещенным или замещенным NH-фенилом. В еще более предпочтительном варианте осуществления, R3 является незамещенным или замещенным NH-(C5-C6)гетероарилом, содержащим один или более атомов N, или незамещенным или замещенным NH-фенилом. В наиболее предпочтительном варианте осуществления, R3 является H. Примерами NHR' заместителей в R3 являются
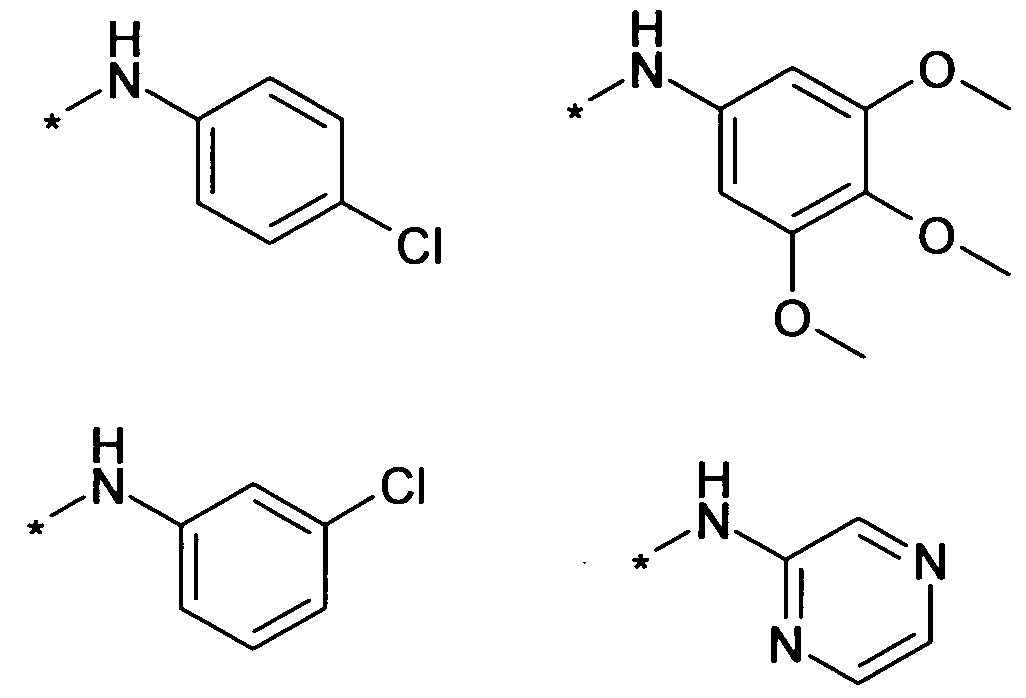
Знаком звездочки (*) обозначается связь, которая образуется с C-атомом кольца.
В предпочтительном варианте осуществления, R4 является H, галогеном, (C1-C6)алкилом, или (C1-C2)-алкиленфенилом. В более предпочтительном варианте осуществления, R4 является H, галогеном или незамещенным или замещенным (C1-C4)алкилом или (C1-C2)-алкиленфенилом, предпочтительно, незамещенным (C1-C4)-алкилом или (C1-C2)алкиленфенилом. Еще более предпочтительно, чтобы R4 являлся H или галогеном, при этом самым предпочтительным является H.
В предпочтительном варианте осуществления, R5 является H, CN, галогеном, незамещенным или замещенным (C1-C6)алкилом, незамещенным или замещенным (C6-C10)арилом, замещенным или незамещенным (C3-C8)циклоалкилом или незамещенным или замещенным (C5-C10)гетероарилом. Предпочтительно, чтобы (C6-C10)арил являлся фенилом. Примерами R5 являются водород, фтор, хлор, бром, йод, метил, этил, фенил, тиенил или пиридил, нитрил, (п-метокси)фенил, N-анилин, циклопропил, тетразол, 4-метокси-анилин. В более предпочтительном варианте осуществления, (C1-C6)алкил, (C6-C10)арил, (C3-C8)циклоалкил или (C5-C10)гетероарил являются незамещенными. В еще более предпочтительном варианте осуществления, R5 является H, галогеном, метилом, этилом, фенилом, тиенилом, или пиридилом, более конкретно, H, галогеном, метилом, или этилом. Наиболее предпочтительно, чтобы R5 являлся H.
В предпочтительном варианте осуществления, R7 является H, галогеном, нитрилом, незамещенным или замещенным (C1-C6)алкилом, незамещенным или замещенным O-(C1-C6)алкилом, или незамещенным или замещенным R'. В более предпочтительном варианте осуществления, R7 является H, галогеном, нитрилом, незамещенным или замещенным (C1-C4)алкилом, незамещенным или замещенным O-(C1-C4)алкилом, незамещенным или замещенным фенилом, незамещенным или замещенным (C5-C6)гетероарилом, или незамещенным или замещенным (C3-C6)циклоалкилом. Предпочтительно, чтобы алкил, фенил или (C5-C6)гетероарил были незамещенными.
В еще более предпочтительном варианте осуществления, R7 является H, фтором, хлором, бромом, метилом, этилом, метокси, фенилом, нитрилом, циклопропилом, или тиенилом. Более предпочтительно, чтобы R7 являлся H, фтором, хлором, бромом, метилом или метокси, в частности, H, метилом или хлором. Наиболее предпочтительно, чтобы R7 являлся хлором.
В предпочтительном варианте осуществления, R8 является H, Cl, F, метилом или этилом. В более предпочтительном варианте осуществления, R8 является H.
В предпочтительном варианте осуществления, R9 является R', OH, галогеном, (C1-C6)алкилом, (C1-C6)алкилен-R', (C2-C6)-алкенилом, (C1-C6)алкилен-C(O)NH-R', (C1-C6)алкилен-C(O)NH-(C1-C6)алкилом, COOH, CONH2, C(O)NH-(C1-C6)алкилом, C(O)NHR', C(O)-NH-(C1-C6)алкинилом, C(O)-NH(C1-C6)алкилен-R', или C(O)N[(C1-C6)алкил]2; где алкил, алкилен и R' являются незамещенными или замещенными. В более предпочтительном варианте осуществления R9 является OH, галогеном, (C1-C6)алкилом, (C1-C6)алкилен-R', (C2-C6)алкенилом, COOH, CONH2, C(O)NH-(C1-C6)алкилом, C(O)NHR', или C(O)N[(C1-C6)алкил]2, где алкил, алкилен и R' являются незамещенными или замещенными. Более предпочтительно, чтобы R9 являлся OH, галогеном, (C1-C6)алкилом, COOH, CONH2, или O-CH3, где алкил является незамещенным или замещенным. В еще более предпочтительном варианте осуществления R9 является незамещенным или замещенным (C1-C6)алкилом, предпочтительно, чтобы R9 являлся незамещенным (C1-C6)алкилом.
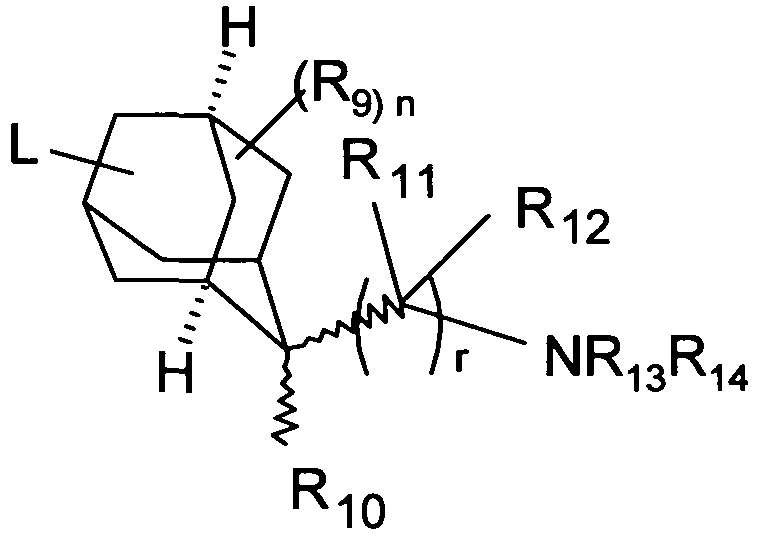
R9 может быть связан с любым углеродным атомом кольца, включая положение, где связана линкерная группа L.
В качестве примеров этих вариантов осуществления, R9 является метилом, этилом, пропилом, изопропилом,
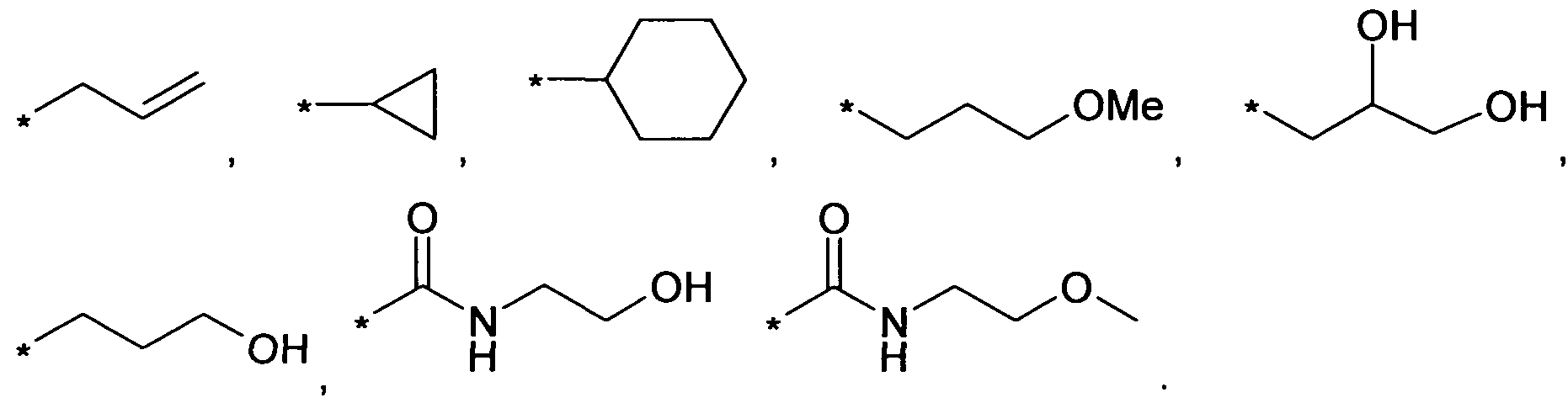
Знаком звездочки (*) обозначается связь, которая образуется с C-атомом кольца.
В предпочтительном варианте осуществления R10 является
H,
(C6-C10)арилом,
O-(C6-C10)арилом,
O-(C1-C2)алкилен-(C6-C10)арилом, или
(C5-C6)гетероарилом,
где (C6-C10)арил или (C5-C6)гетероарил являются незамещенными или замещенными. Предпочтительно, чтобы (C6-C10)арил являлся фенилом.
В более предпочтительном варианте осуществления, R10 является H, фенилом, O-фенилом, или (C5-C6)гетероарилом, где фенил или (C5-C6)гетероарил является незамещенным или замещенным.
В более предпочтительном варианте осуществления, R10 является H или фенилом, необязательно замещенным 1, 2 или 3 раза, предпочтительно, один раз, с помощью группы, независимо выбранной из C(O)NH2, OH, CN, галогена, (C1-C6)алкила или O-(C1-C6)алкила, где алкил является незамещенным или необязательно замещен один раз или более с помощью галогена.
В еще более предпочтительном варианте осуществления, R10 является H или фенилом, необязательно замещенным независимо с помощью группы, выбранной из (C1-C6)алкила, F, Cl, Br, OMe или CF3.
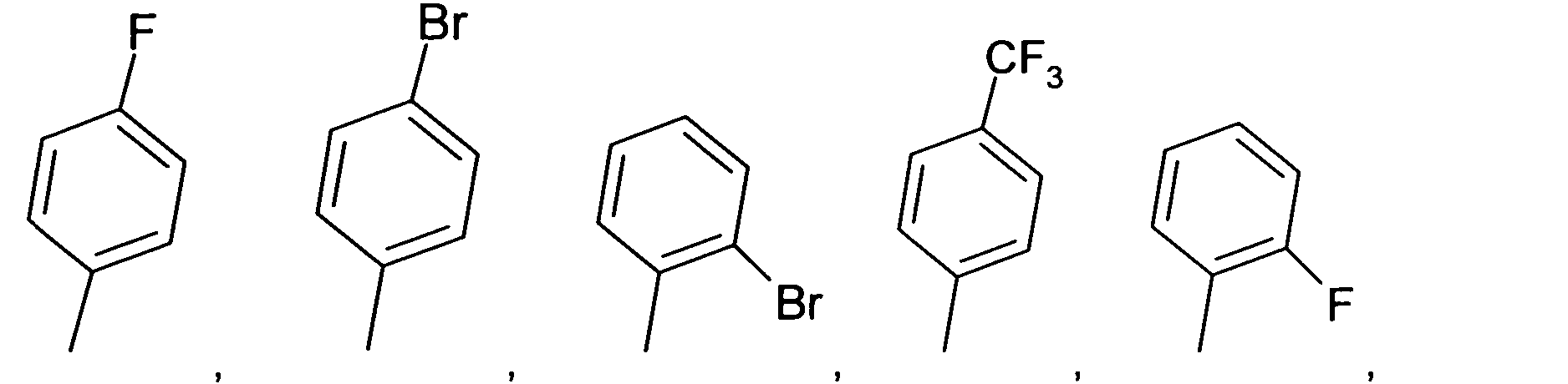
В наиболее предпочтительном варианте осуществления, R10 является H. В еще одном наиболее предпочтительном варианте осуществления, R10 является фенилом. Примерами вариантов осуществления R10 остатков являются
В предпочтительном варианте осуществления, R11 является
H,
(C1-C6)алкилом,
(C3-C8)циклоалкилом, или
(C5-C6)гетероарилом, предпочтительно H или (C1-C6)алкилом, где (C1-C6)алкил, (C3-C8)циклоалкил, или (C5-C10)гетероарил являются незамещенными или замещенными, предпочтительно, незамещенными.
В более предпочтительном варианте осуществления, R11 является H или (C1-C6)алкилом, где (C1-C6)алкил является незамещенным или замещенным, предпочтительно, незамещенным. Еще более предпочтительно, чтобы R11 являлся H или метилом. Наиболее предпочтительно, чтобы R11 являлся H.
В предпочтительном варианте осуществления, R12 является
(C1-C6)алкилом, где необязательно один или более водородов замещены с помощью фтора;
(C3-C8)циклоалкилом,
(C5-C6)гетероарилом, или
(C6-C10)арилом, где (C3-C8)циклоалкил, (C5-C6)гетероарил и (C6-C10)арил являются незамещенными или замещенными, предпочтительно, чтобы (C3-C8)циклоалкил, и (C5-C6)гетероарил были незамещенными. Предпочтительно, чтобы (C6-C10)арил являлся фенилом, который является незамещенным или необязательно замещен один раз или дважды с помощью группы, выбранной независимо друг от друга из галогена, (C1-C4)алкила или O-(C1-C4)алкила, где (C1-C4)алкил может быть необязательно замещен с помощью фтора.
В предпочтительном варианте осуществления, R12 является метилом, этилом, пропилом, изопропилом, изобутилом, циклопропилом, трифторметилом, тиазолилом или фенилом, незамещенным или замещенным с помощью (C1-C4)алкила или галогена. Более предпочтительно, чтобы R12 являлся метилом, этилом, пропилом, изопропилом, изобутилом, циклопропилом, или являлся фенилом, необязательно замещенным с помощью метила или галогена.
В другом варианте осуществления, R10 является H, R11 является H, и R12 является фенилом, необязательно замещенным 1, 2 или 3 раза, предпочтительно, один раз, с помощью группы, независимо выбранной из галогена, (C1-C6)алкила или O-(C1-C6)алкила, где алкил является незамещенным или необязательно замещен один или более раз с помощью галогена.
В другом варианте осуществления, R10 является фенилом, необязательно замещенным 1, 2 или 3 раза, предпочтительно, один раз, с помощью группы, независимо выбранной из галогена, (C1-C6)алкила или O-(C1-C6)алкила, где алкил является незамещенным или необязательно замещен один раз или более с помощью галогена; R11 является H, и R12 является незамещенным (C3-C8)циклоалкилом или (C1-C6)алкилом, где в алкиле необязательно один или более водородов замещены с помощью фтора; (C3-C8)циклоалкилом, или фенилом.
В дополнительном варианте осуществления, R11 и R12 вместе с углеродным атомом, с которым они соединены, образуют (C3-C8)-циклоалкильное кольцо, которое является незамещенным или замещенным, предпочтительно, незамещенным. Более предпочтительно, чтобы кольцо являлось циклопропилом.
В дополнительном варианте осуществления, R11 и R12 вместе с углеродным атомом, с которым они соединены, образуют (C3-C8)-гетероциклоалкильное кольцо, которое является незамещенным или замещенным. Предпочтительно, чтобы образующаяся гетероциклильная группа являлась оксетанилом, морфолинилом, пиперидинилом, пирролидинилом или пиперазинилом. Более предпочтительно, чтобы гетероциклильная группа являлась морфолинилом или пиперазинилом. Предпочтительно, чтобы образующаяся гетероциклоалкильная группа являлась незамещенной.
В одном варианте осуществления соединения формулы (I), R13 и R14 являются независимо друг от друга
H,
R',
(C1-C6)алкилом,
(C1-C6)алкилен-R',
(C1-C6)алкилен-O-(C1-C6)алкилом,
(C1-C6)алкилен-O-R',
C(O)(C1-C6)алкилом,
C(O)R',
C(O)(C1-C6)алкилен-R',
C(O)N[(C1-C6)алкил]2, где
R', (C1-C6)алкил и (C1-C6)алкилен являются незамещенными или замещенными.
В дополнительном варианте осуществления, R13 и R14 вместе с N-атомом, к которому они присоединены, образуют (C3-C8)-гетероциклоалкильное кольцо, которое является незамещенным или замещенным. Предпочтительно, чтобы (C3-C8)-гетероциклоалкил являлся незамещенным.
В предпочтительном варианте осуществления соединения формулы (I), R13 и R14 являются независимо друг от друга
H,
(C1-C6)алкилом,
(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C5-C10)гетероарилом,
(C1-C4)алкилен-(C3-C8)гетероциклоалкилом,
(C1-C4)алкилен-(C6-C10)арилом,
(C1-C4)алкилен-O-(C1-C6)алкилом,
C(O)(C1-C6)алкилом, или
R13 и R14, вместе с N-атомом, к которому они присоединены, образуют (C3-C8)гетероциклоалкильную группу,
где (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен, (C5-C10)гетероарил, (C3-C8)гетероциклоалкил, (C6-C10)арил являются незамещенными или замещенными.
Предпочтительно, чтобы образующаяся гетероциклильная группа в R13 и R14 являлась морфолинилом, пиперидинилом, пирролидинилом или пиперазинилом. Более предпочтительно, чтобы гетероциклильная группа являлась морфолинилом или пиперазинилом.
В более предпочтительном варианте осуществления соединения формулы (I)
R13 является H, (C1-C6)алкилом, (C3-C8)циклоалкилом, или (C1-C4)алкилен-(C3-C8)циклоалкилом; и
R14 является
H,
(C1-C6)алкилом,
(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C5-C10)гетероарилом,
(C1-C4)алкилен-(C3-C8)гетероциклоалкилом,
(C1-C4)алкилен-(C6-C10)арилом,
(C1-C4)алкилен-O-(C1-C6)алкилом, или
C(O)(C1-C6)алкилом,
где (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен, (C3-C8)гетероциклоалкил, (C6-C10)арил являются незамещенными или замещенными.
В еще более предпочтительном варианте осуществления соединения формулы (I)
R13 является H или (C1-C6)алкилом; и
R14 является
H,
(C1-C6)алкилом,
(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C3-C8)циклоалкилом,
(C1-C4)алкилен-(C5-C10)гетероарилом,
(C1-C4)алкилен-(C3-C8)гетероциклоалкилом,
(C1-C4)алкилен-(C6-C10)арилом, или
(C1-C4)алкилен-O-(C1-C6)алкилом,
где (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен, (C3-C8)гетероциклоалкил, (C6-C10)арил являются незамещенными или замещенными.
Более предпочтительно, чтобы R13 являлся H, (C1-C6)алкилом и
R14 являлся H, (C1-C6)алкилом или (C3-C8)циклоалкилом, где (C1-C6)алкил или (C3-C8)циклоалкил являются незамещенными или замещенными, предпочтительно незамещенными.
В дополнительном варианте осуществления, R13 является H и
R14 является H, (C1-C6)алкилом или (C3-C8)циклоалкилом,
где (C1-C6)алкил или (C3-C8)циклоалкил являются незамещенными.
Наиболее предпочтительно, чтобы R13 и R14 являлись H.
В качестве примеров упомянутых выше вариантов осуществления, R13 или R14 являются независимо друг от друга водородом, метилом, этилом, пропилом, изопропилом, 3-метил-бутилом, 2-метилпропилом, бутилом, пентилом, 3,3,3-трифторпропилом, 4,4,4-трифторбутилом или заместителем, выбранным из группы, состоящей из
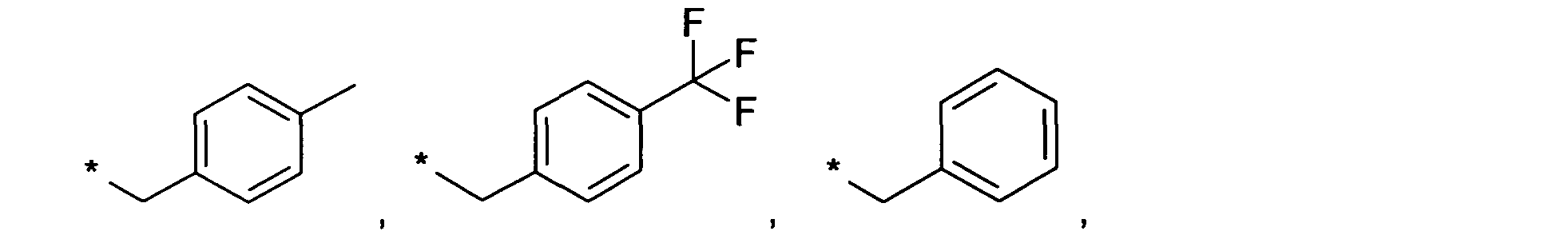
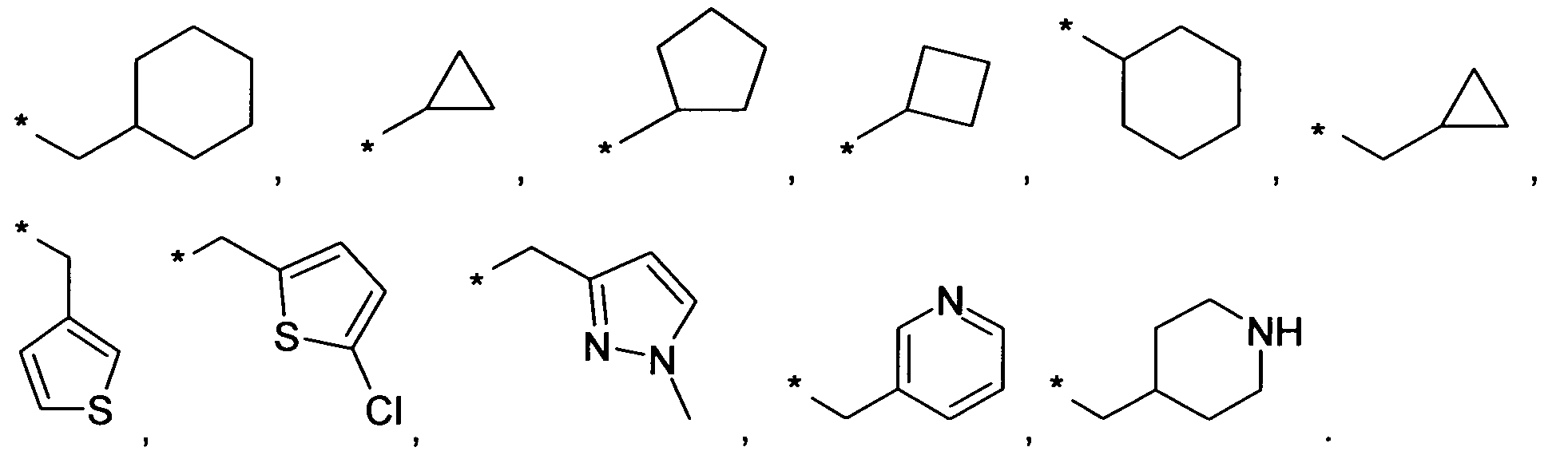
Знаком звездочки (*) обозначается связь, которая образуется с N-атомом амина.
В одном варианте осуществления, R15 является H или (C1-C6)-алкилом, который является незамещенным или необязательно замещенным, более предпочтительно, чтобы R15 являлся H или (C1-C4)алкилом, наиболее предпочтительно, H. Предпочтительно, чтобы алкил являлся незамещенным.
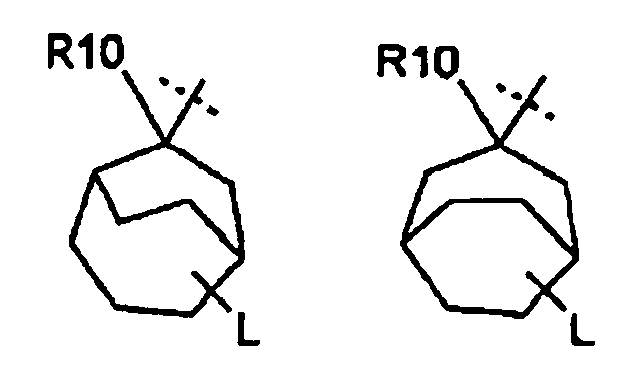
В одном варианте осуществления соединения формулы (I), R6 отсутствует или бицикл или адамантан, образующийся с R6, выбирают из группы
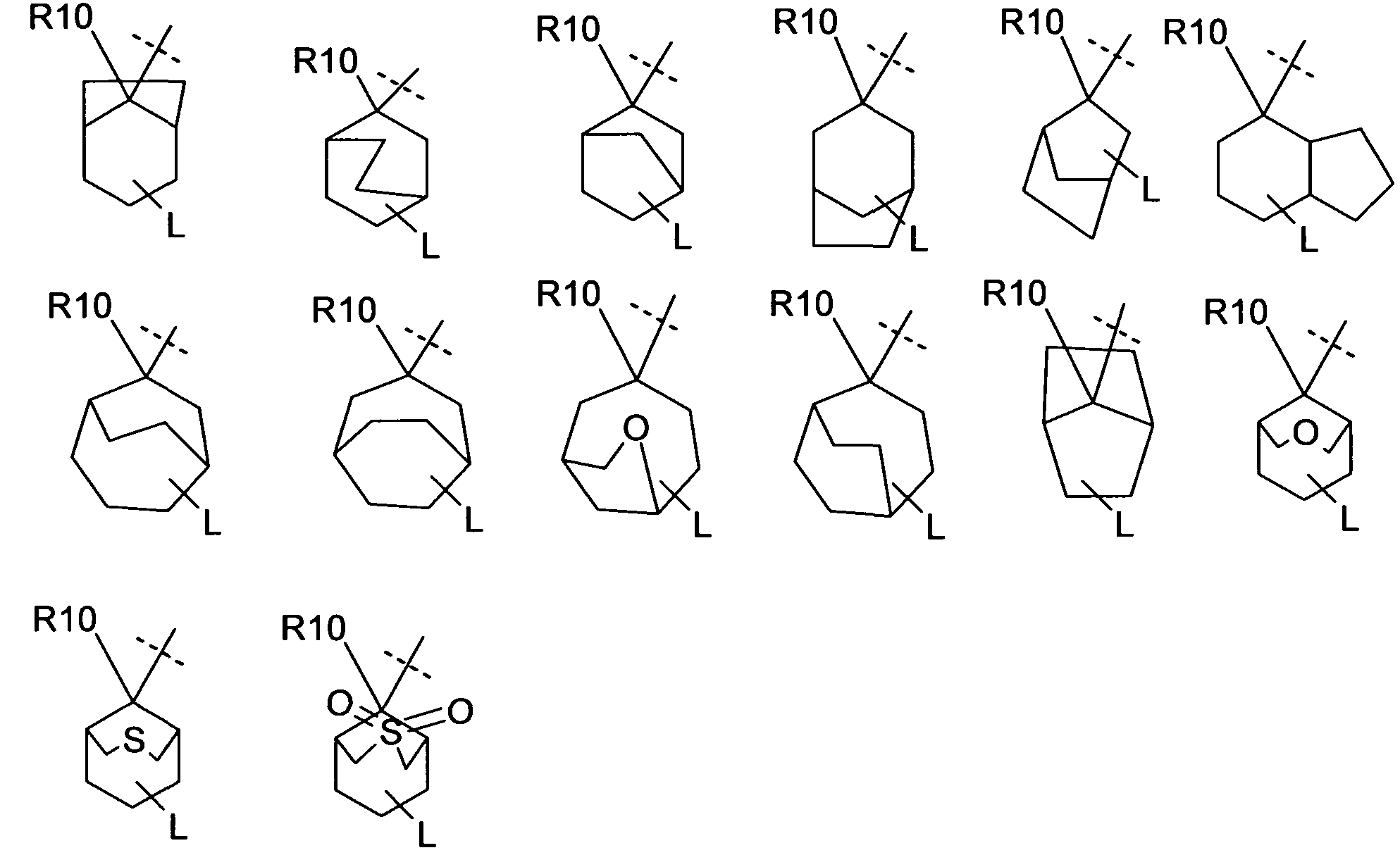
(связь с пунктирной линией указывает положение -(CR11R12)rNR13R14 остатка)
или
который является незамещенным или необязательно замещен с помощью R9. В предпочтительном варианте осуществления, бицикл или адамантан является незамещенным (n равно 0) или является замещенным один раз (n=1).
Предпочтительно, чтобы незамещенный или замещенный адамантан имел следующую структуру
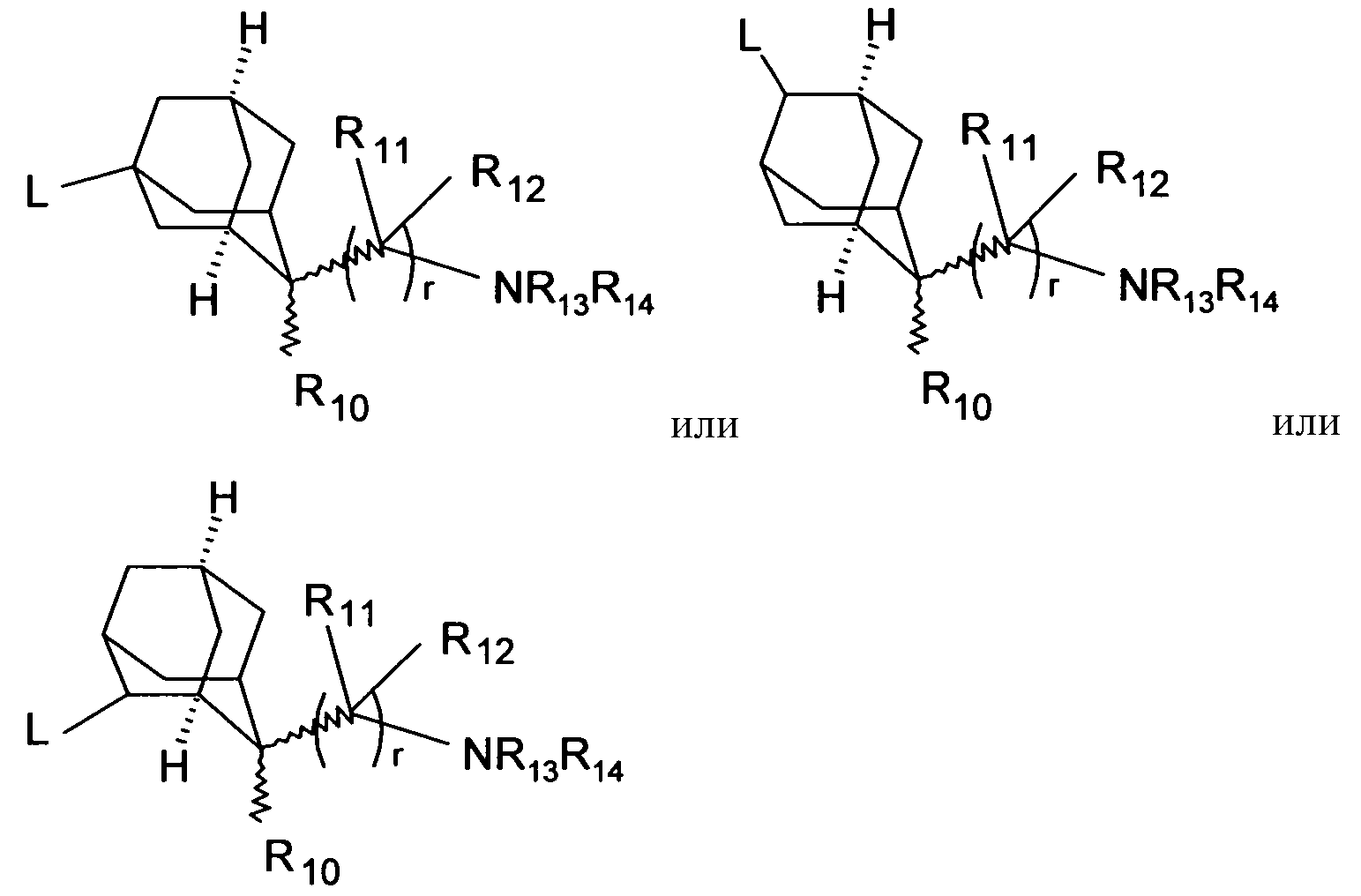
Включаются цис- и транс-изомеры в этих остатках адамантана, таких как, например, в структурах
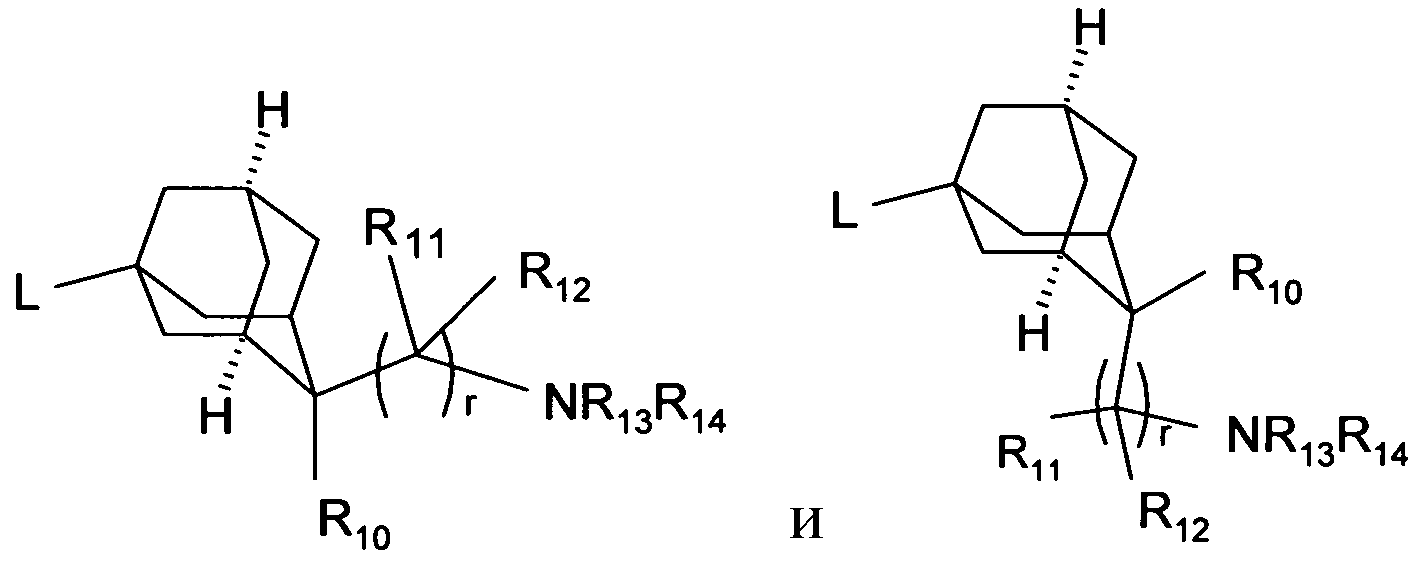
В одном варианте осуществления соединения формулы (I), R6 отсутствует, то есть бицикл или адамантан не образуется.
В одном варианте осуществления, m равно 2 и s равно 2, что приводит к остатку в соединение формулы (I) формулы
во всех их стереохимических формах.
В другом варианте осуществления, m равно 3 и s равно 1, что приводит в соединении формулы (I) к остатку формулы

В дополнительном варианте осуществления, m равно 2 и s равно 1. В еще одном варианте осуществления, m равно 3 и s равно 0. В еще одном варианте осуществления, m равно 4 и s равно 0.
В одном варианте осуществления соединения формулы (I), n равно 0, 1, или 2. Более предпочтительно, чтобы n равнялось 0 или 1. Наиболее предпочтительно, чтобы n равнялось 0.
В предпочтительном варианте осуществления, r равно 1.
В другом варианте осуществления, L является O(CH2)p. В дополнительном варианте осуществления, L является S(CH2)p, S(O)(CH2)p или SO2(CH2)p. В другом варианте осуществления, L является NH(CH2)p, N[(C1-C6)алкил](CH2)p, N[(C3-C6)циклоалкил]-(CH2)p, N[(C1-C3)алкиленарил](CH2)p или N[(C1-C3)алкилен-(C5-C6)гетероарил](CH2)p, при этом NH(CH2)p, N(C1-C6)алкил-(CH2)p являются более предпочтительными. Предпочтительным N(C1-C6)-алкилом является N(C1-C4)алкил, более предпочтительным, NCH3 или NCH2CH3, при этом NCH3 является более предпочтительным. В предпочтительном варианте осуществления, L является O(CH2)p. В другом предпочтительном варианте осуществления, L является S(CH2)p. В дополнительном варианте осуществления, L является NH(CH2)p. Наиболее предпочтительно, чтобы L являлся O, S или NH, при этом O является особенно предпочтительным.
Предпочтительно, чтобы p равнялось 0, 1, 2, или 3, более предпочтительно, 0 или 1, при этом 0 является наиболее предпочтительным;
Более предпочтительно, чтобы m равнялось 2 и s равнялось 2 и L являлся O, S или NH, предпочтительно O.
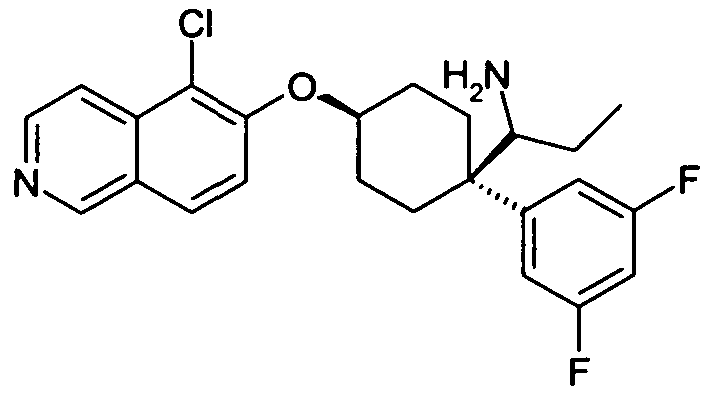
В дополнительном варианте осуществления, настоящее изобретение относится к соединению формулы (I), выбранному из группы, состоящей из следующих соединений
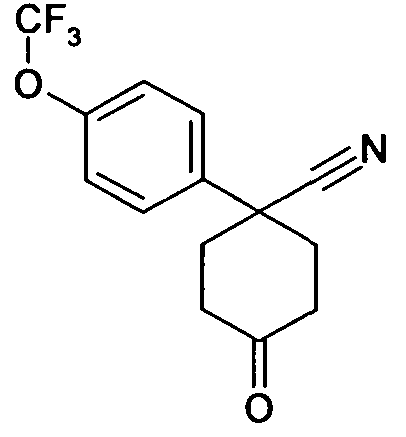
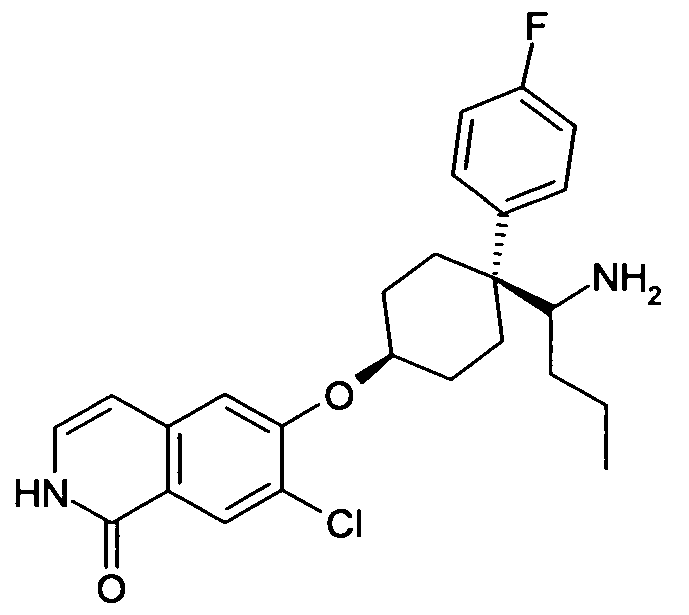
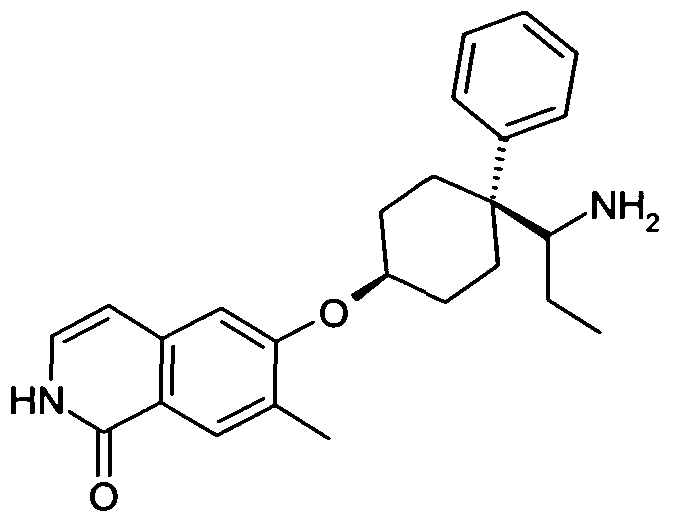
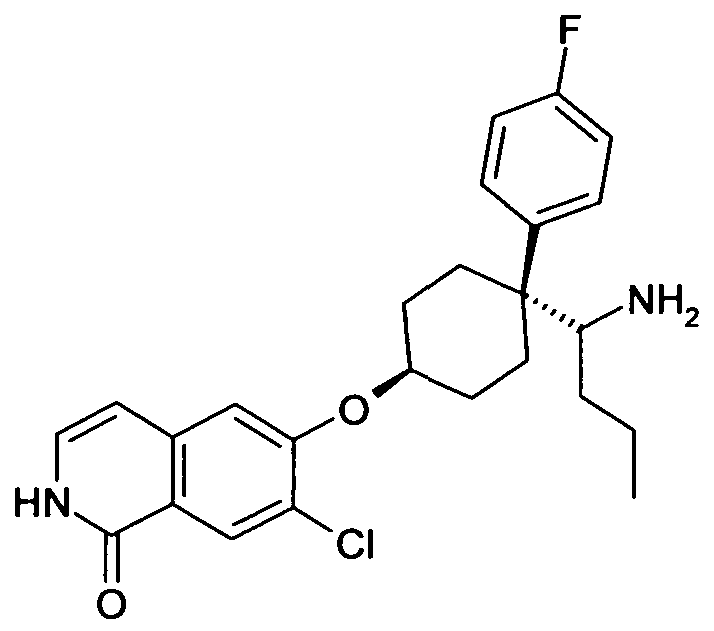
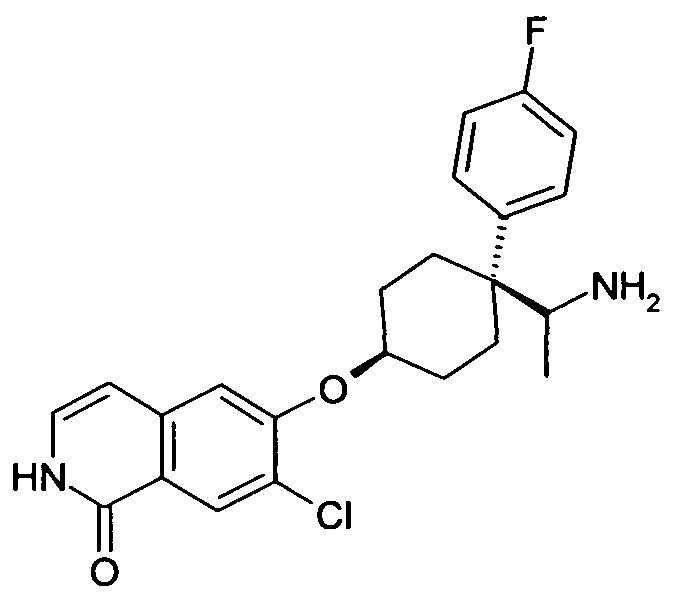
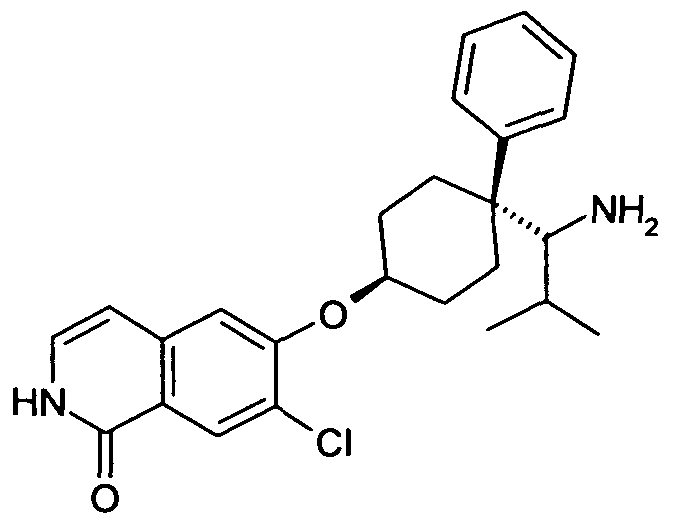
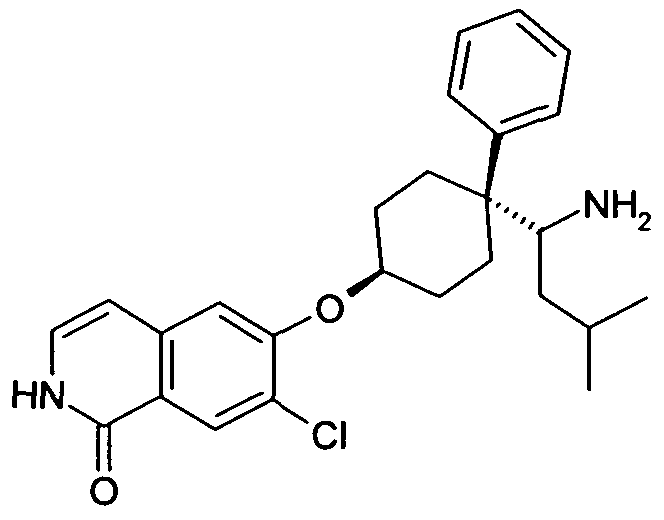
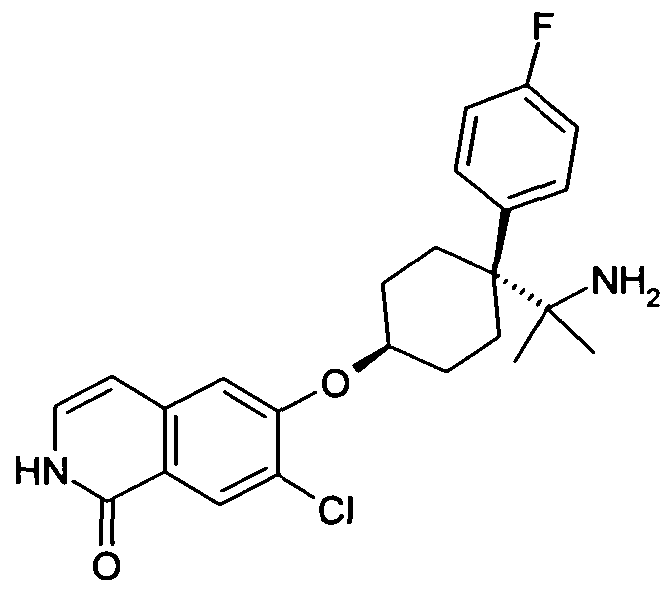
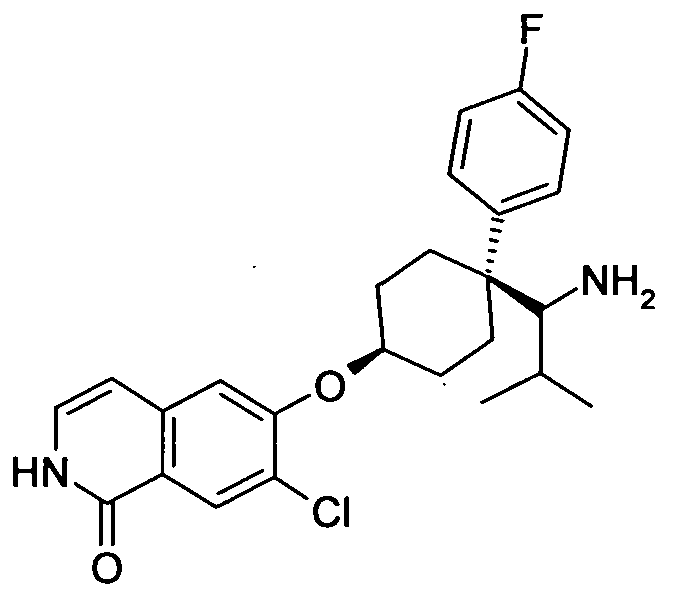
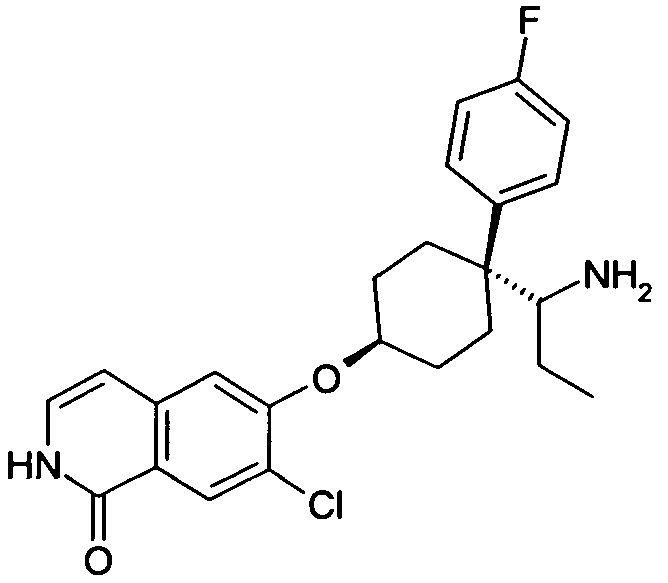
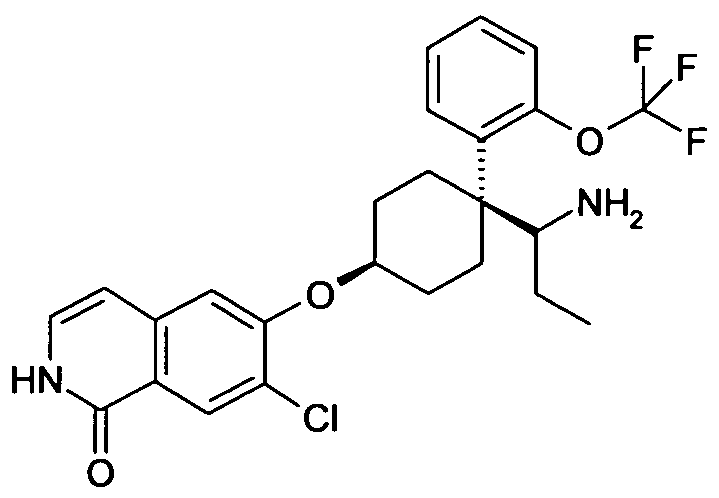
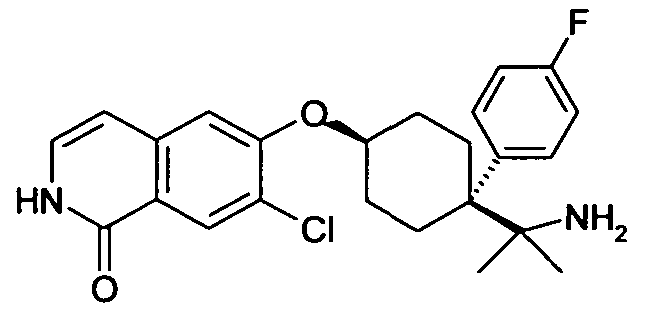
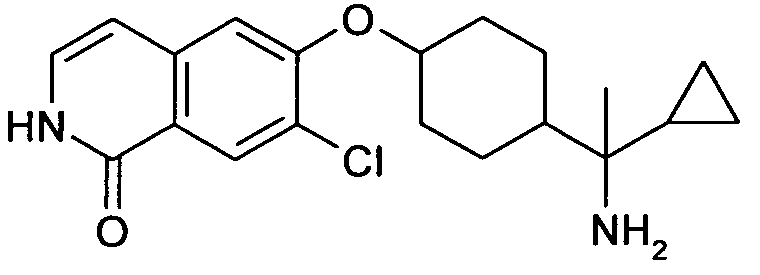
6-[4-(1-Аминопропил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминоциклопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
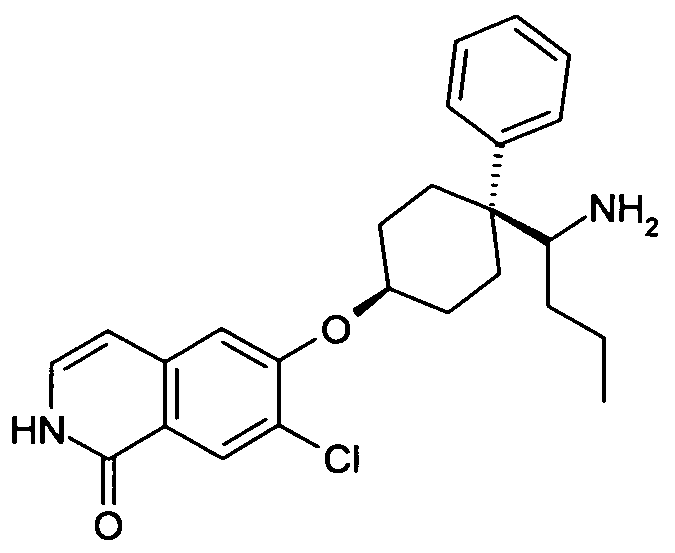
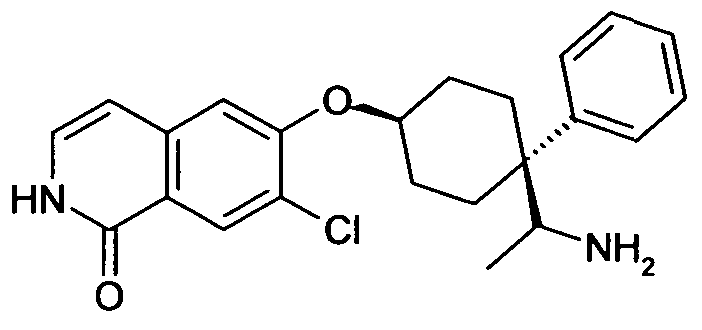
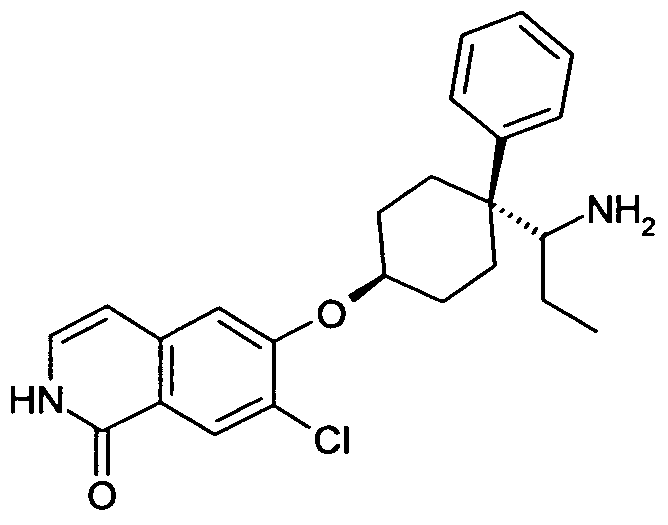
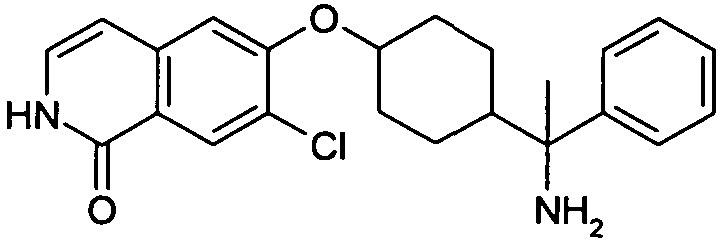
6-{[4-(1-аминопропил)-4-фенилциклогексил]окси}-7-хлор-изохинолин-1(2H)-он,
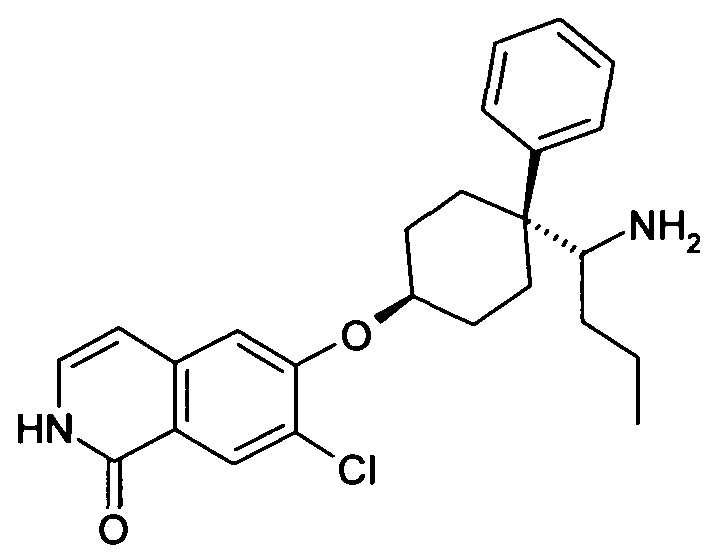
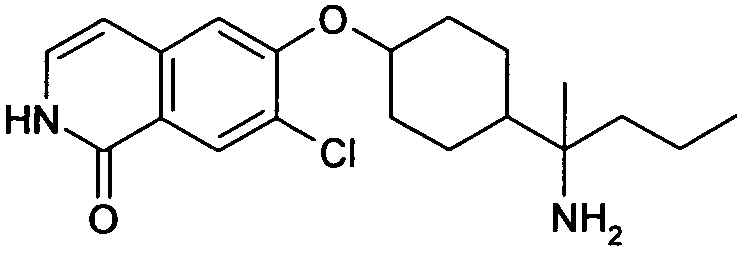
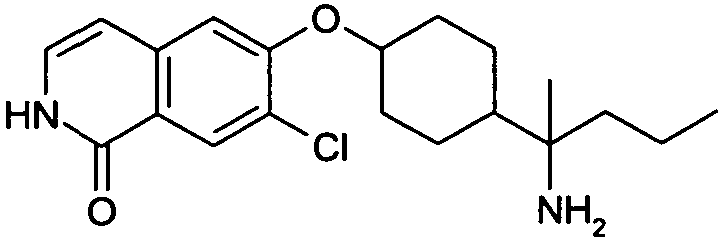
6-[4-(1-Аминобутил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминобутил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
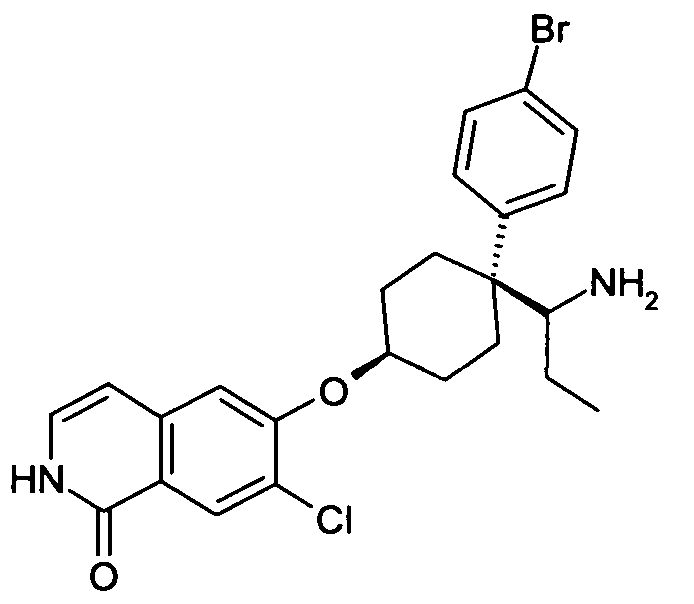
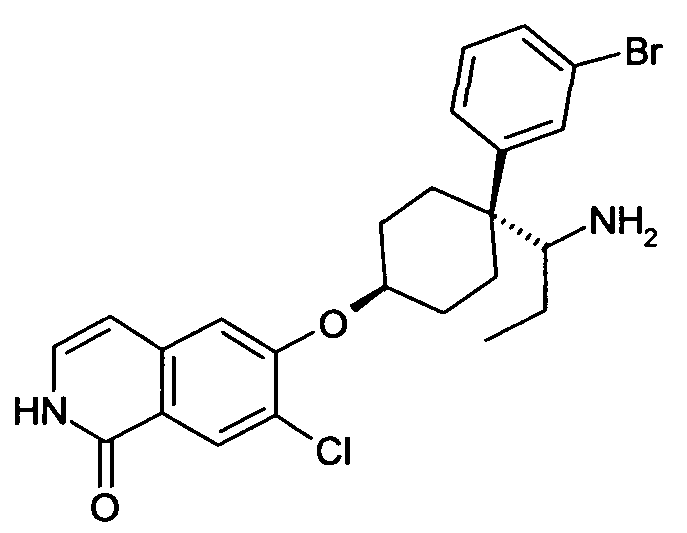
6-[4-(1-Аминопропил)-4-(4-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
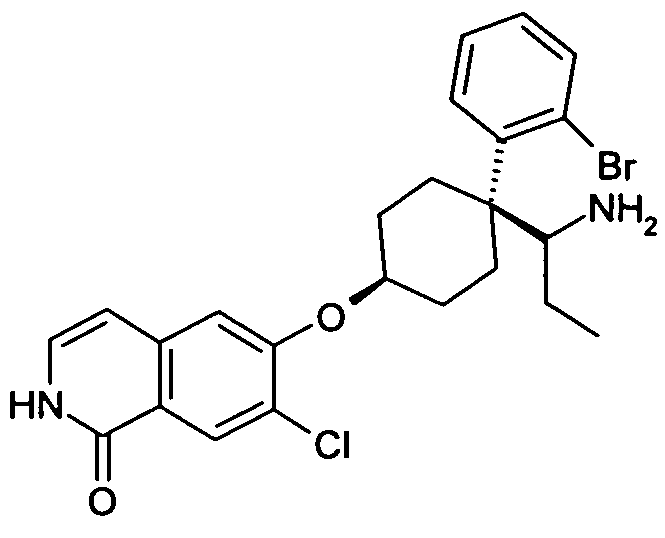
6-[4-(1-Аминопропил)-4-(2-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
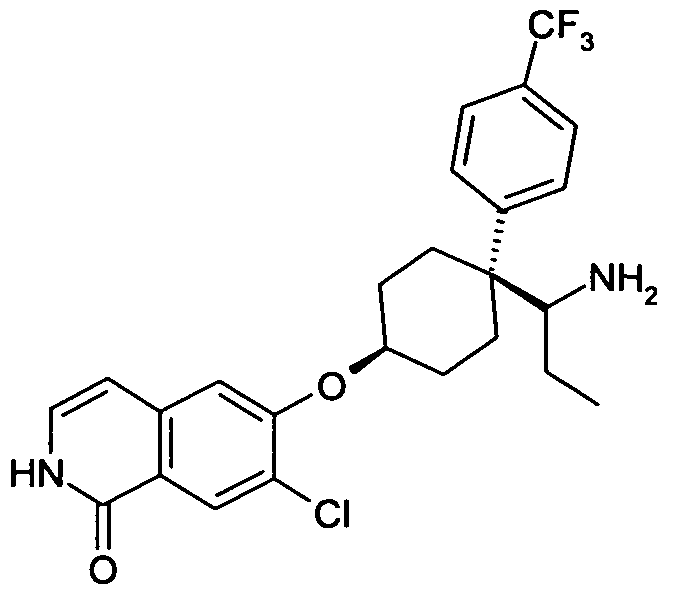
6-[4-(1-Аминопропил)-4-(4-трифторметилфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
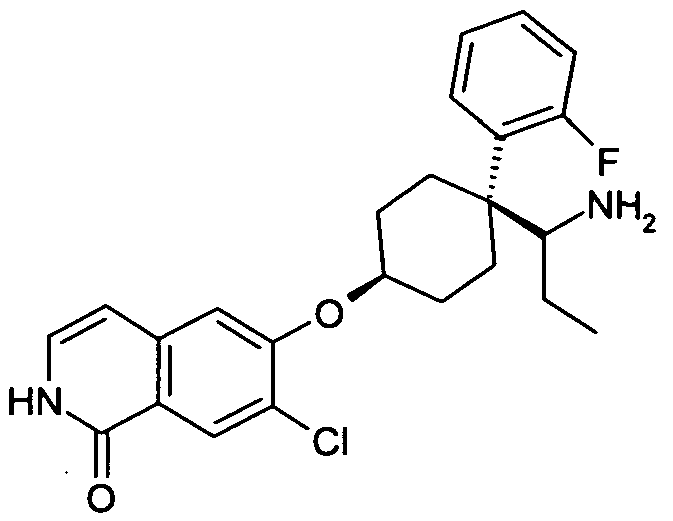
6-[4-(1-Аминопропил)-4-(2-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
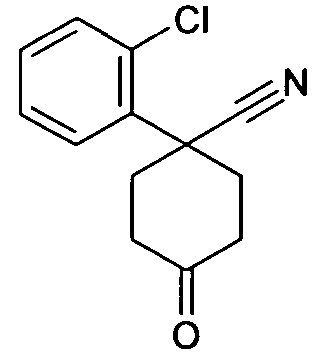
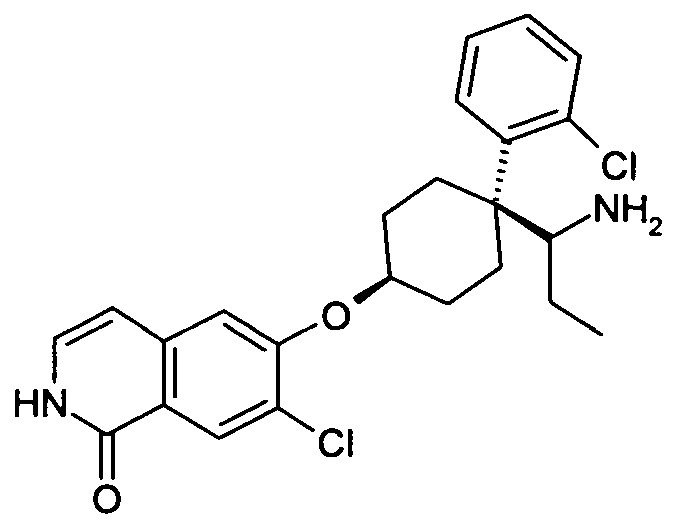
6-[4-(1-Аминопропил)-4-(2-хлорфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-7-метил-2H-изохинолин-1-он,
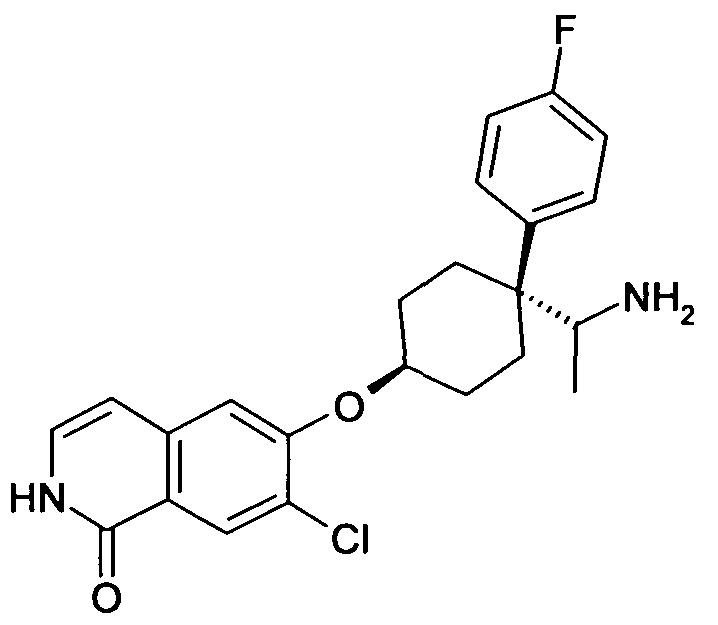
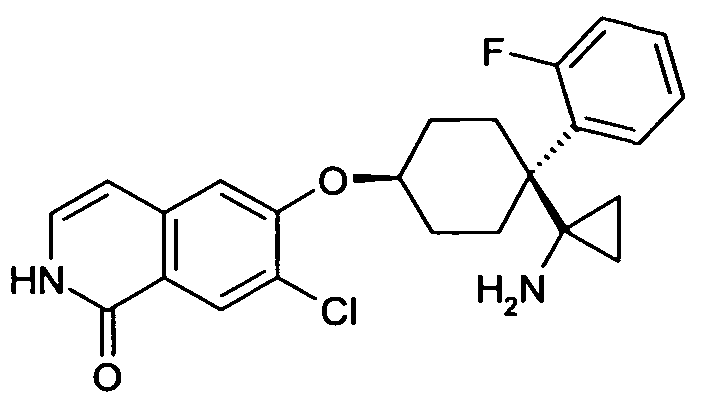
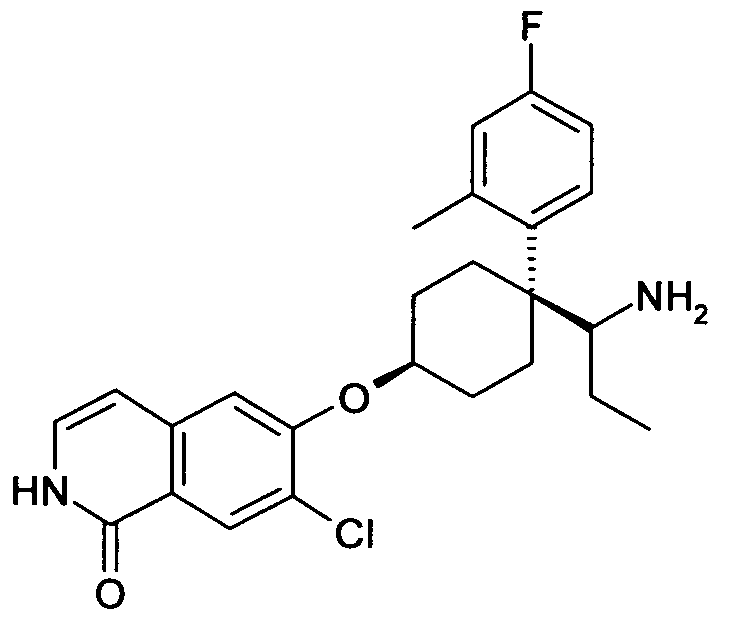
6-[4-(1-Аминоэтил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
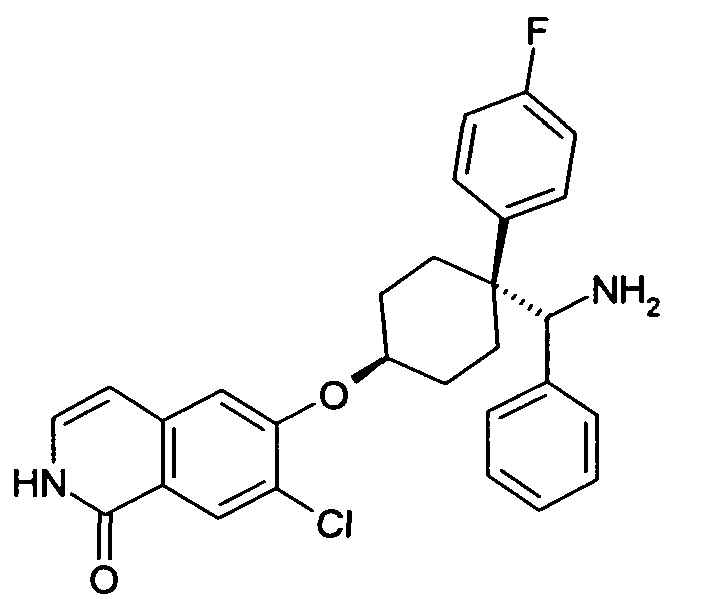
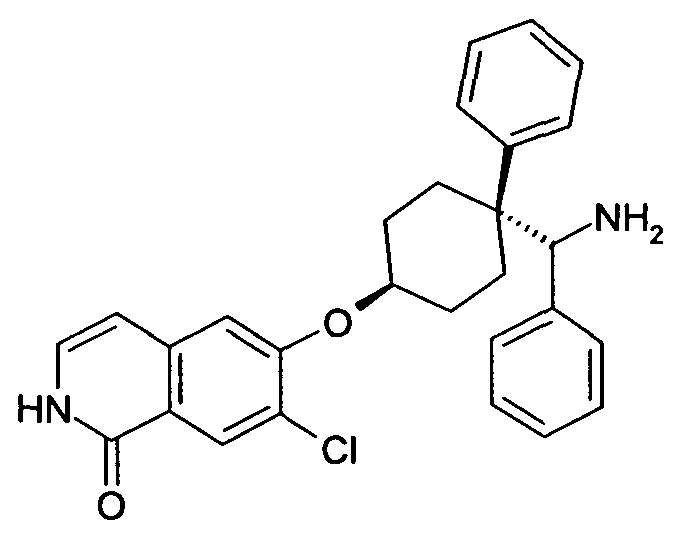
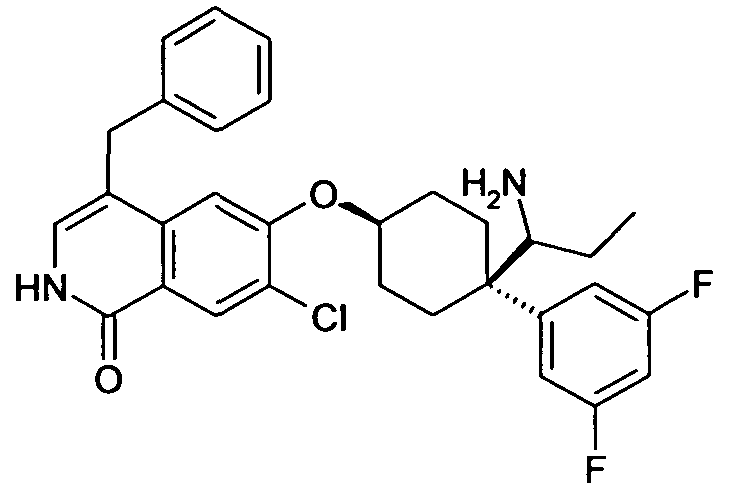
6-[4-(Аминофенилметил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Амино-2-метилпропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Амино-3-метилбутил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Амино-1-метилэтил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминоциклопропил)-4-(2-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
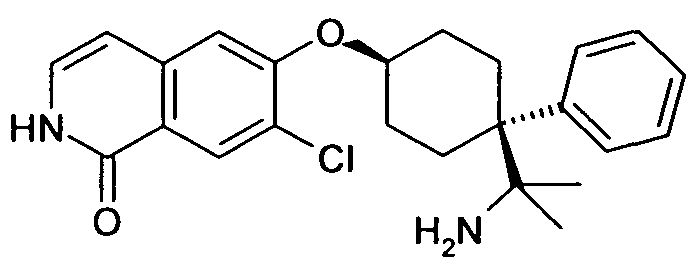
6-[4-(1-Амино-1-метилэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
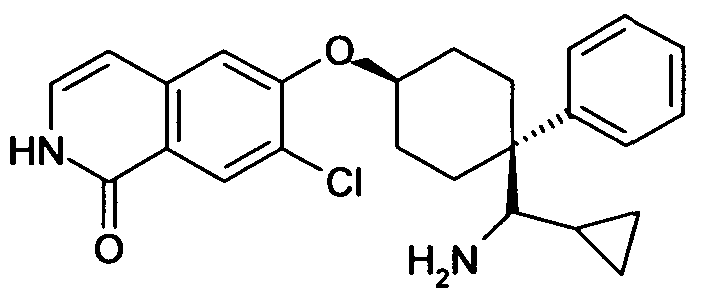
6-(4-[амино(циклопропил)метил]-4-фенилциклогексил}окси)-7-хлоризохинолин-1(2H)-он,
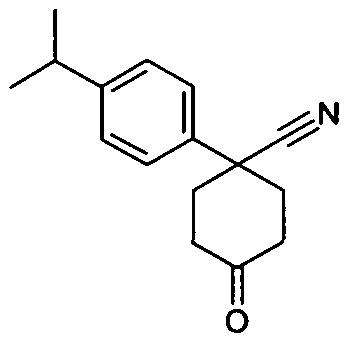
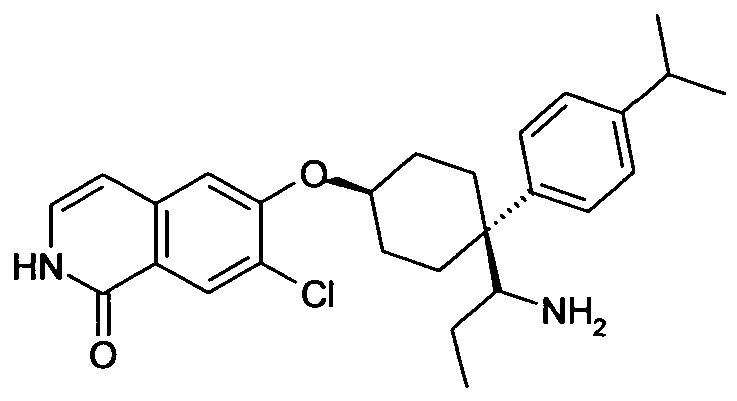
6-[4-(1-Аминопропил)-4-(4-изопропилфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
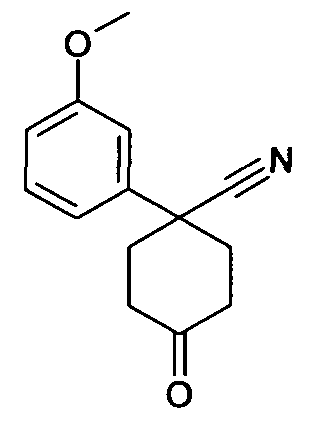
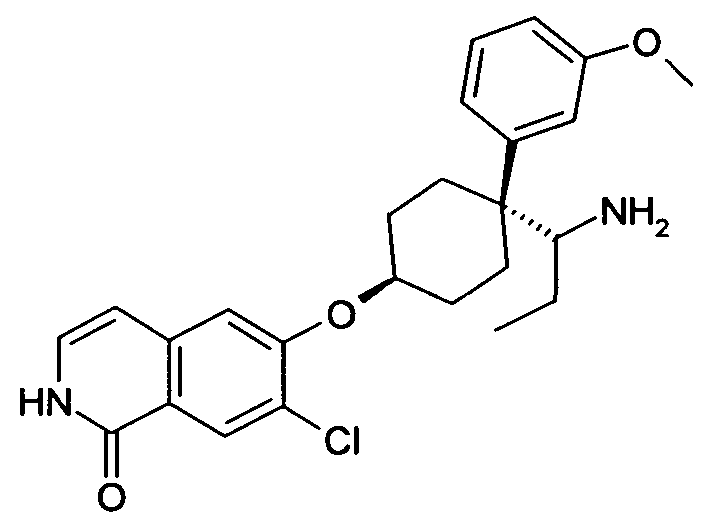
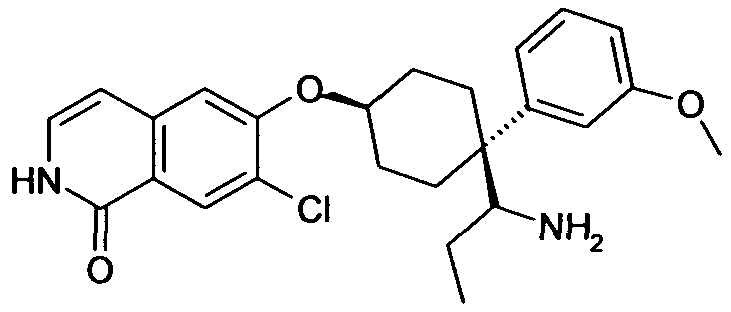
6-[4-(1-Аминопропил)-4-(3-метокси)фенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
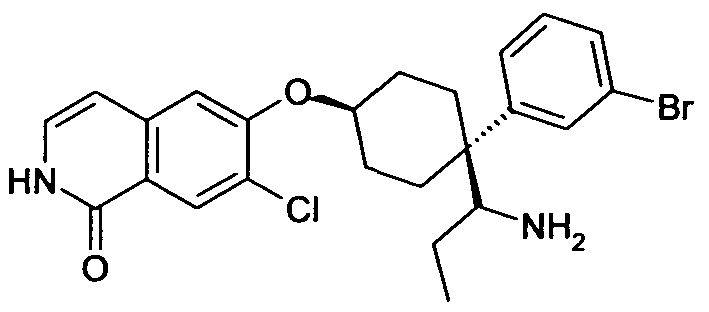
6-[4-(1-Аминопропил)-4-(3-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Амино-2-метилпропил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он, или
6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-4-бром-7-хлор-2H-изохинолин-1-он;
их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В дополнительном варианте осуществления, соединение формулы (I) выбирают из группы, состоящей из
цис-6-[4-(1-Аминопропил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-аминопропил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминоциклопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-{[4-(1-аминопропил)-4-фенилциклогексил]окси}-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-аминопропил)-4-фенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминобутил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Аминобутил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
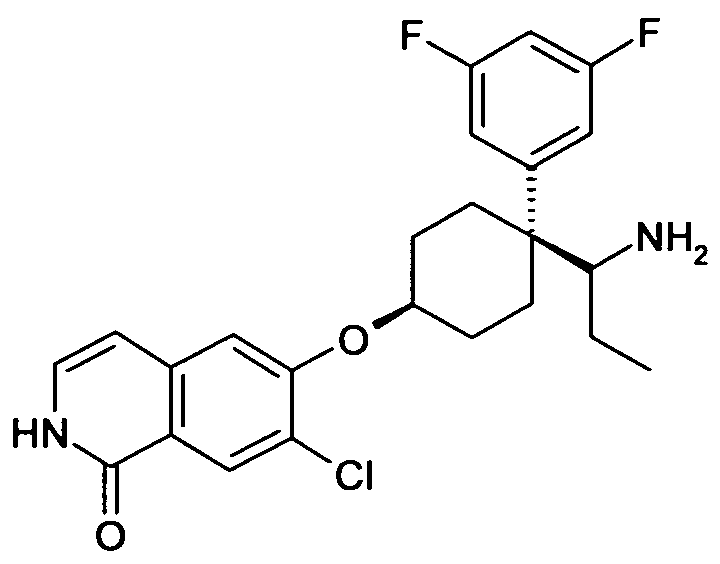
цис-6-[4-(1-Аминобутил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Аминобутил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(4-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(2-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(4-трифторметилфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(2-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(2-хлорфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-7-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминоэтил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Аминоэтил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-бромфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Аминопропил)-4-(3-бромфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-метокси)фенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Аминопропил)-4-(3-метоксифенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(Аминофенилметил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Амино-2-метилпропил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Амино-3-метилбутил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-(1-Амино-1-метилэтил)-4-(4-фторфенил)-циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминоциклопропил)-4-(2-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Амино-1-метилэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-(4-[амино(циклопропил)метил]-4-фенилциклогексил}-окси)-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(4-изопропилфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Амино-2-метилпропил)-4-(4-фторфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он, и
цис-6-[4-(1-Амино-пропил)-4-фенилциклогексилокси]-4-бром-7-хлор-2H-изохинолин-1-он
и их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В дополнительном варианте осуществления, соединение формулы (I) выбирают из группы
транс-6-[4-((S)-Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-((R)-Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-{4-[(S)-Амино-(4-фторфенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[(R)-Амино-(4-фторфенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он и
цис-6-[4-((S)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
их таутомерные формы и/или фармацевтически приемлемые соли.
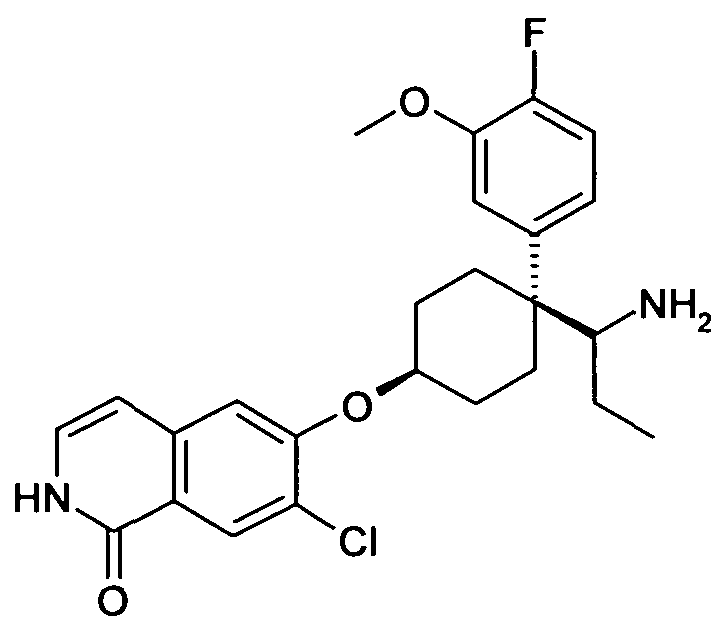
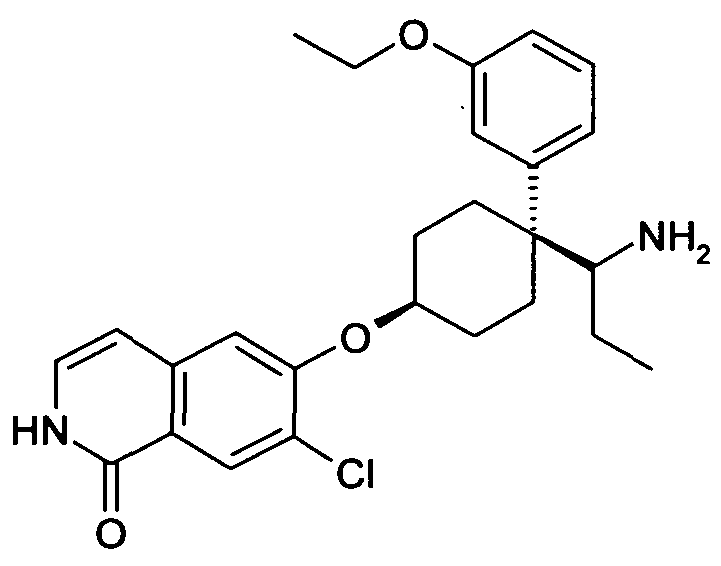
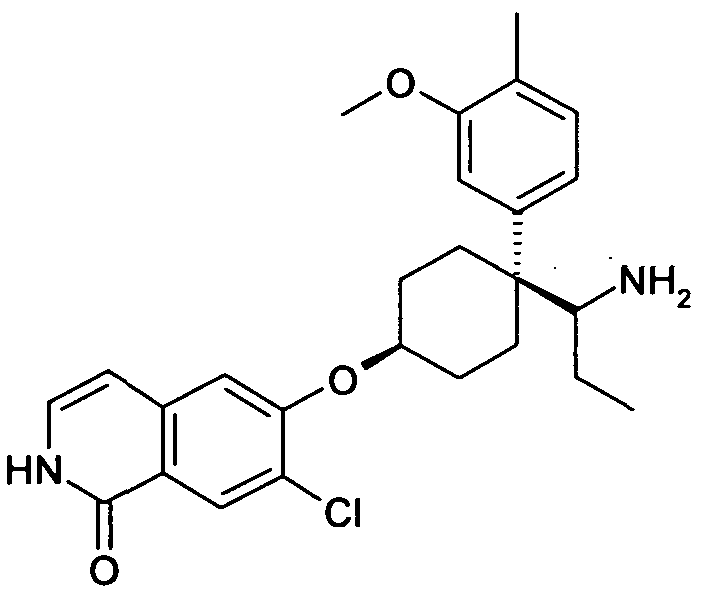
В дополнительном варианте осуществления, соединение формулы (I) выбирают из группы, состоящей из
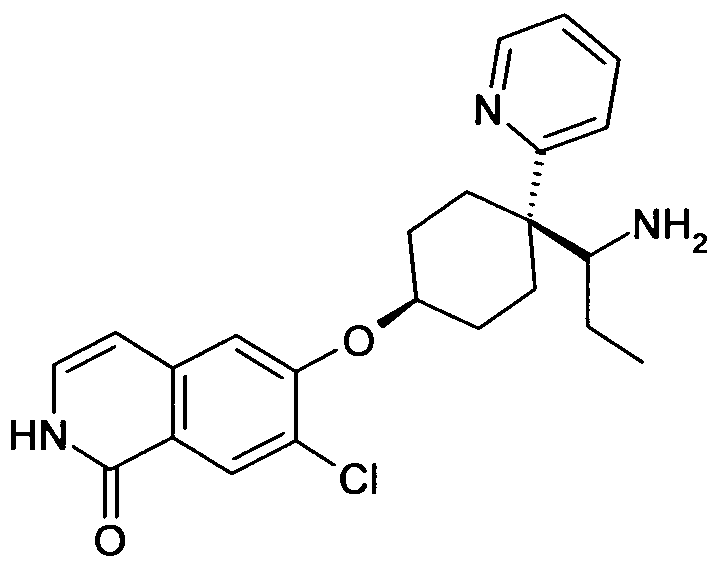
цис-6-[4-(1-Аминопропил)-4-пиридин-2-илциклогексилокси]-7-хлор-2H-изохинолин-1-он,
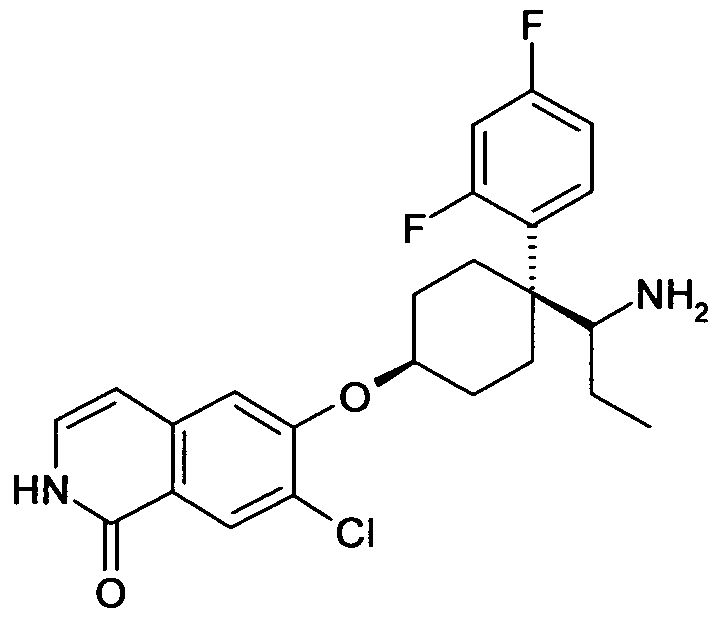
цис-6-[4-(1-Аминопропил)-4-(2,4-дифторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(4-фтор-2-метилфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
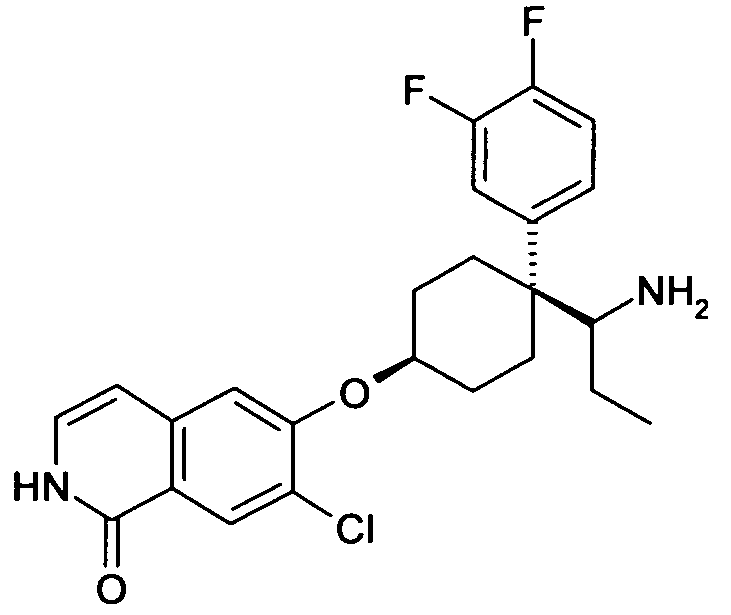
цис-6-[4-(1-Аминопропил)-4-(3,4-дифторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
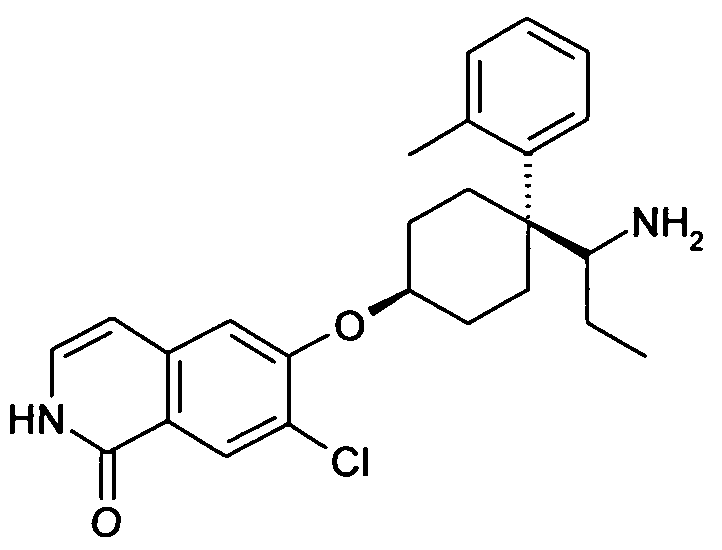
цис-6-[4-(1-Аминопропил)-4-o-толилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(2-трифторметоксифенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(4-фтор-3-метоксифенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-этоксифенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-метокси-4-метилфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,4-дифторфенил)циклогексил-окси]-7-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-7-фтор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,4-дифторфенил)циклогексил-окси]-7-фтор-5-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-7-метокси-2H-изохинолин-1-он,
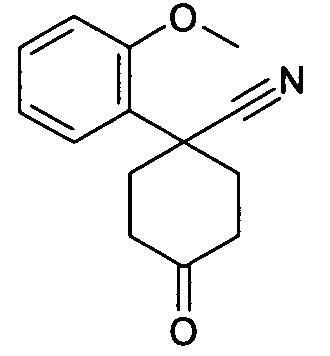
цис-6-[4-(1-Аминопропил)-4-(2-метоксифенил)циклогексил-окси]-7-хлор-2H изохинолин-1-он
цис-6-[4-(1-Аминопропил)-4-(4-трифторметоксифенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Амино-1-метилэтил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-4-бензил-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-5-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3,5-дифторфенил)циклогексил-окси]-5,7-диметил-2H-изохинолин-1-он,
цис-6-[4-(Аминоциклопропилметил)-4-(4-фторфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-трифторметилфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-трифторметоксифенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-трифторметоксифенил)цикло-гексилокси]-7-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-(3-трифторметилфенил)цикло-гексилокси]-7-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-7-фтор-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-7-фтор-5-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-4-бензил-7-хлор-2H-изохинолин-1-он,
цис-4-[1-(1-Аминопропил)-4-(7-хлор-1-оксо-1,2-дигидро-изохинолин-6-илокси)циклогексил]бензонитрил,
цис-3-[1-(1-Аминопропил)-4-(7-хлор-1-оксо-1,2-дигидро-изохинолин-6-илокси)циклогексил]бензонитрил,
6-[цис-4-(1-Аминопропил)-4-(3-метансульфонилфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
6-[(1S,4S,5S)-5-(1-Аминопропил)-5-фенилбицикло[2.2.1]гепт-2-илокси]-7-хлор-2H-изохинолин-1-он,
6-[(1R,4R,5R)-5-(1-Аминопропил)-5-фенилбицикло[2.2.1]гепт-2-илокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Бензиламинопропил)-4-фенилциклогексилокси]-7-метил-2H-изохинолин-1-он,
цис-6-[4-(1-Диэтиламинопропил)-4-фенилциклогексилокси]-7-метил-2H-изохинолин-1-он,
цис-7-Метил-6-[4-(1-пропиламинопропил)-4-(3-трифторметил-фенил)циклогексилокси]-2H-изохинолин-1-он,
цис-6-[4-(1-Бензиламинопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-7-Хлор-6-[4-(1-изобутиламинопропил)-4-фенилцикло-гексилокси]-2H-изохинолин-1-он,
цис-6-[4-(1-Бутиламинопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-7-Хлор-6-{4-[1-(циклопропилметиламино)пропил]-4-фенил-циклогексилокси}-2H-изохинолин-1-он,
цис-6-[4-(2-Аминопропил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(2-Аминобутил)-4-(4-фторфенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Амино-2-фторэтил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-(1-Амино-3-метоксипропил)-4-(4-фторфенил)цикло-гексилокси]-7-хлор-2H-изохинолин-1-он,
6-[3-(1-Аминопропил)-3-(4-фторфенил)циклобутилокси]-7-хлор-2H-изохинолин-1-он, и
6-[3-(1-Аминопропил)-3-(4-фторфенил)циклопентилокси]-7-хлор-2H-изохинолин-1-он,
и их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В дополнительном варианте осуществления, соединение формулы (I) выбирают из группы, состоящей из
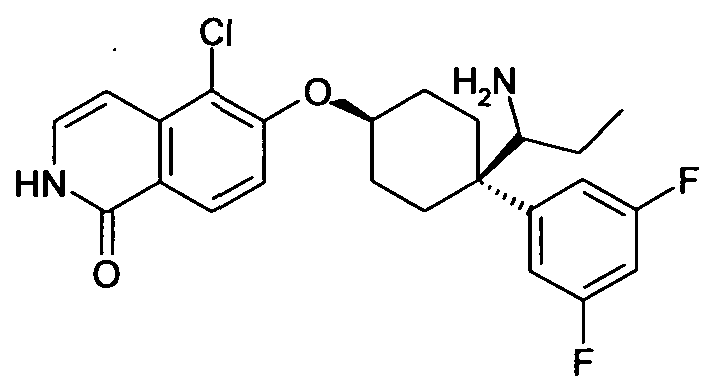
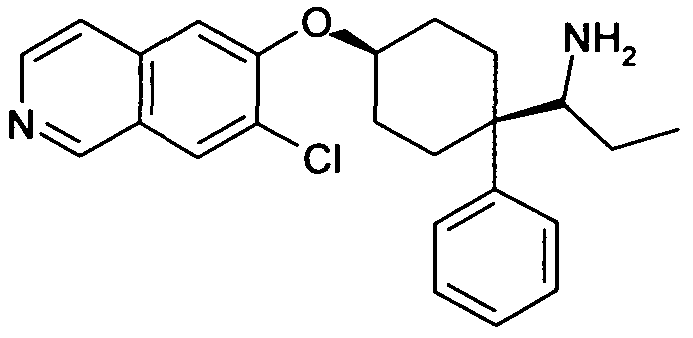
цис-1-[4-(7-Хлоризохинолин-6-илокси)-1-(3,4-дифторфенил)-циклогексил]пропиламин,
цис-1-[4-(7-Бромизохинолин-6-илокси)-1-(3,4-дифторфенил)-циклогексил]пропиламин,
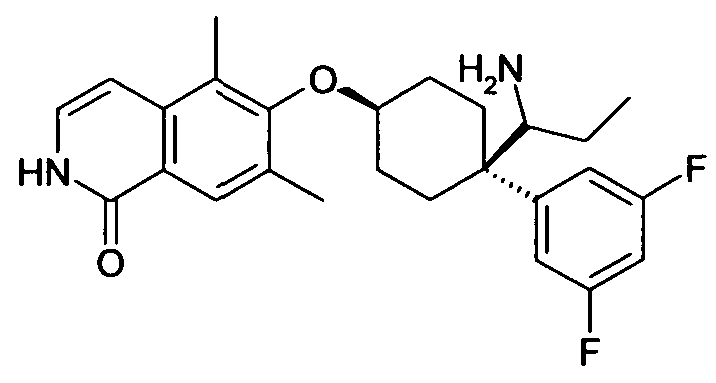
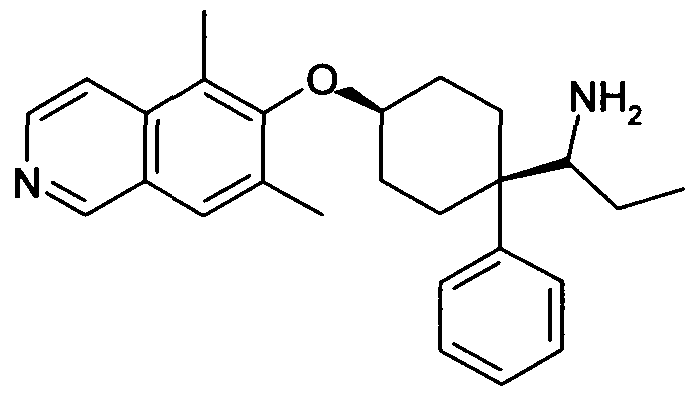
цис-1-[1-(3,5-Дифторфенил)-4-(5,7-диметилизохинолин-6-ил-окси)циклогексил]пропиламин,
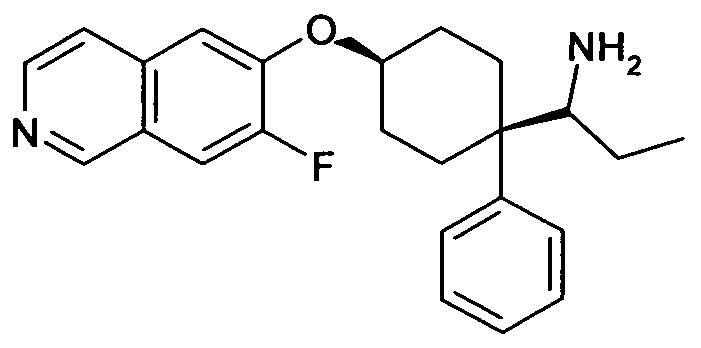
цис-1-[1-(3,5-Дифторфенил)-4-(7-фтор-5-метилизохинолин-6-ил-окси)циклогексил]пропиламин,
цис-1-[1-(3,4-Дифторфенил)-4-(7-фторизохинолин-6-илокси)-циклогексил]пропиламин,
цис-1-[4-(7-Хлоризохинолин-6-илокси)-1-(3,5-дифторфенил)-циклогексил]пропиламин,
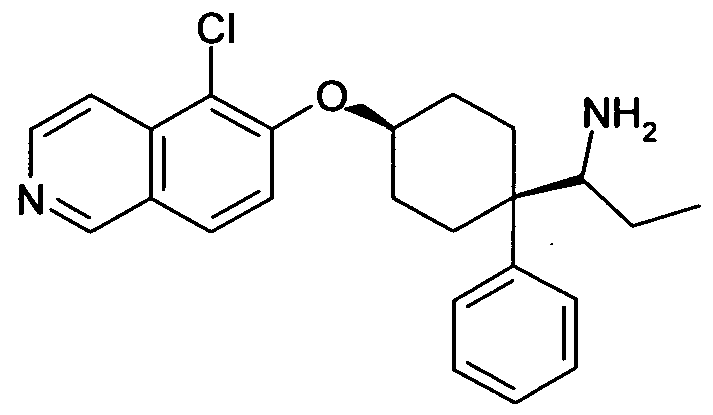
цис-1-[4-(5-Хлоризохинолин-6-илокси)-1-(3,5-дифторфенил)-циклогексил]пропиламин,
цис-1-[4-(7-Хлоризохинолин-6-илокси)-1-фенилциклогексил]-пропиламин,
цис-1-[4-(5,7-Диметилизохинолин-6-илокси)-1-фенилцикло-гексил]пропиламин,
цис-1-[4-(7-Фторизохинолин-6-илокси)-1-фенилциклогексил]-пропиламин,
цис-1-[4-(5-Хлоризохинолин-6-илокси)-1-фенилциклогексил]-пропиламин,
цис-1-[4-(7-Фтор-5-метилизохинолин-6-илокси)-1-фенил-циклогексил]пропиламин,
цис-1-[4-(7-Бромизохинолин-6-илокси)-1-фенилциклогексил]-пропиламин,
цис-1-[4-(7-Метилизохинолин-6-илокси)-1-фенилциклогексил]-пропиламин,
цис-6-[4-(1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-изохинолин-1-иламин,
[4-(1-Аминопропил)-4-(4-метоксифенил)циклогексил]-изохинолин-6-иламин и
1-Амино-[4-(1-аминопропил)-4-(4-метоксифенил)циклогексил]-изохинолин-6-иламин,
и их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В дополнительном варианте осуществления, настоящее изобретение относится к соединению формулы (I), выбранному из группы, состоящей из
6-[4-(1-Амино-1-фенилэтил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-{4-[Амино(4-метоксифенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[Амино(4-фторфенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-[4-(Амино-п-толилметил)циклогексилокси]-7-хлор-2H-изохинолин-1-он, или
6-[4-(Аминофенилметил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В дополнительном варианте осуществления, соединение формулы (I) выбирают из группы, состоящей из
6-{4-[1-Амино-1-(4-фторфенил)этил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[1-Амино-1-(4-метоксифенил)этил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[1-Амино-1-циклопентилэтил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[1-Амино-1-этилпропил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[1-Амино-1-циклопропилэтил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[1-Амино-1-н-пропилэтил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-[4-(1-Аминопропил)циклогексилокси]-7-хлор-2H-изохинолин-1-он и
6-[4-(Аминоциклопропилметил)циклогексилокси]-7-хлор-2H-изохинолин-1-он,
их стереоизомерные и/или таутомерные формы и/или их фармацевтически приемлемые соли.
В любых вариантах осуществления настоящего изобретения одна или более или все группы, содержащиеся в соединениях формулы (I), могут независимо друг от друга иметь любое из указанных выше предпочтительных, более предпочтительных или наиболее предпочтительных определений групп, или любое одно или несколько из указанных обозначений, которые содержатся в определениях групп и указаны выше, при этом все комбинации предпочтительных определений, более предпочтительных или наиболее предпочтительных и/или конкретных обозначений являются предметом настоящего изобретения. Кроме того, что касается всех предпочтительных вариантов осуществления, то изобретение включает соединения формулы (I) во всех стереоизомерных формах и смеси стереоизомерных форм во всех соотношениях, и их фармацевтически приемлемые соли.
Положения замещения в структуре изохинолина пронумерованы в соответствии с правилами IUPAC:
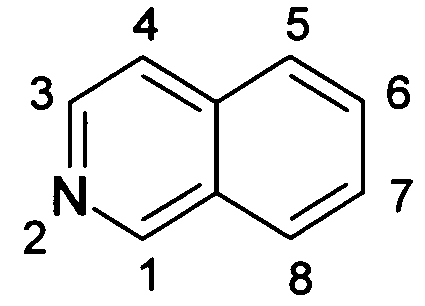
Термины изохинолон и изохинолинон являются тождественными.
Все приводимые здесь ссылки на "соединение (соединения) формулы (I)" относятся к описанному выше соединению (соединениям) формулы (I), (II) (IIIa), (IIIb) и (IV), и их фармацевтически приемлемым солям, и/или к их стереоизомерным формам, полиморфам и сольватам. Кроме того, это относится также к описанным здесь физиологически функциональным производным.
Фармацевтически приемлемые соли соединений формулы (I) относятся как к их органическим, так и неорганическим солям, описываемым в монографии Remington's Pharmaceutical Sciences (17th edition, page 1418 (1985)). Исходя из физической и химической стабильности и растворимости, предпочтение отдается кислотным группам, в числе прочего, солям натрия, калия, кальция и аммония; предпочтение отдается основным группам, в числе прочего, солям малеиновой кислоты, фумаровой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, метилсульфоновой кислоты, хлористоводородной кислоты, серной кислоты, фосфорной кислоты или карбоновых кислот или сульфоновых кислот, например, в виде гидрохлоридов, гидробромидов, фосфатов, сульфатов, метансульфонатов, ацетатов, лактатов, малеатов, фумаратов, малатов, глюконатов, и солям аминокислот, природных оснований или карбоновых кислот. Получение фармацевтически приемлемых солей из соединений формулы (I), которые способны образовывать соли, включая их стереоизомерные формы, осуществляют, по существу, известными способами. Соединения формулы (I) образуют стабильные соли щелочных металлов, щелочноземельных металлов или необязательно замещенного аммония с основными реагентами, такими как гидроксиды, карбонаты, бикарбонаты, алкоголяты и аммиак, или с органическими основаниями, например, триметил- или триэтиламином, этаноламином, диэтаноламином или триэтаноламином, трометамолом или же с основными аминокислотами, например, лизином, орнитином или аргинином. Когда соединения формулы (I) имеют основные группы, могут быть также получены стабильные соли присоединения кислоты с сильными кислотами. Подходящими фармацевтически приемлемыми солями присоединения кислоты соединений изобретения являются соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислота, и органических кислот, таких как, например, уксусная кислота, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изетионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, п-толуолсульфоновая и винная кислота. Гидрохлоридная соль является предпочтительной солью.
Соли с фармацевтически неприемлемым анионом, таким как, например, трифторацетат, также входят в объем изобретения в качестве промежуточных соединений, используемых для получения или очистки фармацевтически приемлемых солей и/или для применения в нетерапевтических целях, например, применений in vitro.
Настоящее изобретение также включает физиологически функциональные производные соединения формулы (I). Используемая здесь физиологически функциональная производная относится к любой физиологически допустимой производной соединения формулы (I) изобретения, например, N-оксиду, которая при введении млекопитающему, такому как, например, человек, способно образовывать (непосредственно или косвенно) соединение формулы (I) или его активный метаболит.
Физиологически функциональные производные включают пролекарства соединений изобретения, описанные, например, в публикации H. Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61. Такие пролекарства могут быть метаболизированы in vivo в соединение изобретения. Эти пролекарства могут сами по себе быть активными или неактивными.
Изобретение относится к соединениям формулы (I) в виде их стереоизомерных форм, которые включают рацематы, энантиомерно обогащенные смеси, чистые энантиомеры и диастереомеры и их смеси в любом соотношении.
Соединения изобретения могут также сосуществовать в различных полиморфных формах, например, в виде аморфных и кристаллических полиморфных форм. Все полиморфные формы соединений изобретения входят в объем изобретения и являются дополнительным аспектом изобретения.
Если в соединениях формулы (I) могут встречаться несколько раз радикалы или заместители, они могут все, независимо друг от друга, иметь заявленное значение и быть одинаковыми или различными.
Настоящее изобретение также относится к соединениям формулы (I) и/или их фармацевтически приемлемым солям и/или их пролекарствам для применения в качестве лекарственных препаратов (или лекарственных средств), к применению соединений формулы (I) и/или их фармацевтически приемлемых солей и/или их пролекарств для получения лекарственных препаратов для лечения и/или предотвращения заболеваний, связанных с Rho-киназой и/или фосфорилированием фосфатазы легких цепей миозина, опосредованным Rho-киназей, то есть, для лечения и/или предотвращения гипертензии, легочной гипертензии, глазной гипертензии, ретинопатии, и глаукомы, расстройства периферического кровообращения, окклюзионного поражения периферических артерий (PAOD), ишемической болезни сердца, стенокардии, гипертрофии сердца, сердечной недостаточности, заболеваний, связанных с ишемией, недостаточности органа, связанной с ишемией (повреждением окончания чувствительного нерва), пневмофиброза, фиброза печени, печеночной недостаточности, нефропатии, включая индуцированную гипертензией, неиндуцированную гипертензией, и диабетические нефропатии, почечной недостаточности, фиброза почек, гломерулосклероза почки, гипертрофии органа, астмы, хронического обструктивного заболевания легких (COPD), синдрома расстройства дыхания у взрослых, тромботических заболеваний, инсульта, спазма мозговых сосудов, ишемии головного мозга, боли, например, невропатической боли, неврональной дегенерации, повреждения спинного мозга, болезни Альцгеймера, преждевременных родов, эректильной дисфункции, нарушений функции желез внутренней секреции, артериосклероза, гипертрофии предстательной железы, диабета и осложнений диабета, метаболического синдрома, рестеноза кровеносного сосуда, атеросклероза, воспаления, аутоиммунных заболеваний, СПИД, остеопатии, такой как остеопороз, бактериального заражения желудочно-кишечного тракта, сепсиса, развития и прогрессирования рака, например, рака молочной железы, толстой кишки, предстательной железы, яичников, мозга и легких и их метастазирования.
В дополнительном варианте осуществления, изобретение также относится к применению соединения формулы (I) и/или его фармацевтически приемлемой соли для лечения и/или предотвращения гипертензии, легочной гипертензии, фиброза печени, печеночной недостаточности, нефропатии, почечной недостаточности, хронического обструктивного заболевания легких (COPD), спазма мозговых сосудов, боли, повреждения спинного мозга, эректильной дисфункции, рестеноза кровеносного сосуда, или развития и прогрессирования рака.
В дополнительном варианте осуществления, изобретение также относится к применению соединения формулы (I) и/или его фармацевтически приемлемой соли при клинических подходах, связанных с лечением с помощью стволовых клеток или индуцированных полипотентных стволовых клеток, с улучшением распознавания, или для лечения или предотвращения депрессии, эпилепсии, миокардиофиброза, медуллярного некроза почки, тубулоинтерстициальной дисфункции, рассеянного склероза, стеноза сосуда, например, стеноза сонной артерии, или липидных расстройств.
Кроме того, настоящее изобретение относится к фармацевтическим препаратам (или фармацевтическим композициям), которые содержат эффективное количество, по меньшей мере, одного соединения формулы (I) и/или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, то есть, одно или более фармацевтически приемлемых веществ носителей (или сред) и/или добавки (или вспомогательные вещества). Фармацевтические препараты могут быть введены перорально, например, в форме пилюль, таблеток, глазурованных таблеток, таблеток, покрытых оболочкой, гранул, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Кроме того, введение может быть также осуществлено ректально, например, в форме суппозиториев, или парентерально, например, внутривенно, внутримышечно или подкожно, в форме инъекционных растворов или инфузионных растворов, микрокапсул, имплантатов или стержней, или чрескожно или местно, например, в форме мазей, растворов или настоек, или другими способами, например, в форме аэрозолей или назальных спреев.
Фармацевтические препараты согласно изобретению получают, по существу, широко распространенными способами, которые известны специалисту в этой области, при этом в дополнении к соединению (соединениям) формулы (I) и/или его (их) фармацевтически приемлемым солям и/или его (их) пролекарствам используют фармацевтически приемлемые инертные неорганические и/или органические вещества в качестве носителей и/или добавок. Для получения пилюль, таблеток, таблеток, покрытых оболочкой, и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли, и так далее. Веществами в качестве носителей для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие полиолы, природные или гидрогенизированные масла, и так далее. Подходящими веществами для носителей для получения растворов, например, инъецируемых растворов, или эмульсий или сиропов, являются, например, вода, физиологический раствор, спирты, глицерин, полиолы, сахароза, инвертный сахар, глюкоза, растительные масла, и так далее. Подходящими веществами для носителей для микрокапсул, имплантатов или стержней, являются например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические препараты обычно содержат приблизительно от 0,5 до 90% по массе соединений формулы (I) и/или их фармацевтически приемлемых солей и/или их пролекарств. Количество активного ингредиента формулы (I) и/или его фармацевтически приемлемых солей и/или его пролекарств в фармацевтических препаратах обычно составляет приблизительно от 0,5 до 1000 мг, предпочтительно, приблизительно от 1 до 500 мг.
Помимо активных ингредиентов формулы (I) и/или их фармацевтически приемлемых солей и веществ для носителя, фармацевтические препараты могут содержать одну или более добавок, таких как, например, наполнители, разрыхлители, связующие, скользящие вещества, смачивающие вещества, стабилизаторы, эмульгаторы, консерванты, подсластители, окрашивающие вещества, вещества, корригирующие вкус и запах лекарственного средства, ароматизаторы, загустители, разбавители, буферирующие вещества, растворители, солюбилизаторы, средства достижения депо-эффекта, соли для изменения осмотического давления, вещества для нанесения покрытий или антиоксиданты. Они могут также содержать два или более соединений формулы (I) и/или их фармацевтически приемлемые соли. В случае, когда фармацевтический препарат содержит два или более соединений формулы (I), выбор индивидуальных соединений может ставить своей целью достижение конкретного общего фармакологического профиля фармацевтического препарата. Например, высокоэффективное соединение с более коротким периодом действия может быть объединено с соединением пролонгированного действия с более низкой эффективностью. Гибкость, допускаемая в отношении выбора заместителей в соединениях формулы (I), позволяет в широких пределах контролировать биологические и физико-химические свойства соединений, и таким образом, делает возможным выбор таких требуемых соединений. Кроме того, в дополнении, по меньшей мере, к одному соединению формулы (I) и/или его фармацевтически приемлемым солям, фармацевтические препараты могут также содержать один или более других терапевтически или профилактически активных ингредиентов.
При применении соединений формулы (I) доза может изменяться в широких пределах и, по обыкновению, и, как это известно врачу, ее следует подбирать в соответствие с конкретными условиями в каждом конкретном случае. Она зависит, например, от конкретного используемого соединения, от природы и тяжести заболевания, подвергаемого лечению, от способа и схемы введения, или от того, подвергается ли лечению острое или хроническое состояние, или проводят профилактику. Соответствующая доза может быть установлена с помощью клинических методов, хорошо известных в медицине. Обычно дневная доза для достижения требуемых результатов в случае взрослого пациента с массой тела около 75 кг составляет приблизительно от 0,01 до 100 мг/кг, предпочтительно, приблизительно от 0,1 до 50 мг/кг, в частности, приблизительно от 0,1 до 10 мг/кг, (в каждом случае в мг на кг массы тела). Дневная доза может быть разделена, в частности, в случае введения относительно больших количеств, на несколько, например, 2, 3 или 4, части для введения. Обычно, в зависимости от конкретной ситуации, она может, при необходимости, отклоняться в сторону увеличения или в сторону уменьшения от указанной дневной дозы.
Кроме того, соединения формулы (I) могут быть использованы в качестве промежуточных продуктов синтеза для получения других соединений, в частности, других фармацевтических активных ингредиентов, которые можно получить из соединений формулы I, например, путем введения заместителей или путем модификации функциональных групп.
Соединения формулы (I) могут быть получены следующим образом.
Соединения общей формулы (I) могут быть синтезированы из фрагмента соответствующе замещенного изохинолина и фрагмента соответствующе замещенного циклоалкиламина.
Изохинолины и изохинолоны, такие как соединение (i) или соединение (ii), имеющие подходящий фрагмент для реакции сочетания в 6-положении, могут быть получены с помощью большого количества различных методов, рассмотренных, например, в публикации Alvarez et al. Science of Synthesis 2005, 15, 661-838 и 839-906 и в материалах, использованных при экспертизе заявки. Изохинолины могут также быть превращены в изохинолоны с помощью способов, описанных, например, в патентных документах WO 2007/012421 или WO 2007/012422, таких как превращение подходящего изохинолина в соответствующий N-оксид с помощью окислителя, такого как пероксид водорода или метахлорпербензойная кислота, и последующее превращение в соответствующую 1-хлорпроизводную с помощью хлорирующего реагента, такого как оксихлорид фосфора, с последующим замещением хлора спиртом в щелочных условиях, таких как метоксид натрия в метаноле, или превращение в соответствующий 2H-изохинолон путем, например, обработки с помощью ацетата аммония в уксусной кислоте при повышенной температуре. Кроме того, N-оксид может быть непосредственно превращен в соответствующее 1-алкоксипроизводное путем взаимодействия его с подходящим хлорформиатом в спиртовом растворителе, таком как метанол, в присутствии основания, такого как триэтиламин. Очевидно, что с гидроксильной группы в 6-положении соединения (ii) может быть снята защита на соответствующей стадии синтеза, например, путем обработки соответствующей 6-метоксипроизводной с помощью кислот Льюиса, таких как хлорид алюминия или трехбромид бора. Кроме того, очевидно, что, 2H-изохинолоны могут быть превращены в соответствующим образом защищенные 1-алкоксиизо-хинолоны с помощью различных методов, например, обработкой соответствующих 2H-изохинолонов алкилирующими реагентами, такими как бензилбромид или метилйодид, в присутствии подходящего основания, такого как карбонат серебра или триэтиламин, в подходящем растворителе, таком как толуол или THF, или превращением указанных 2H-изохинолонов в их 1-хлорпроизводные путем обработки хлорирующим реагентом, таким как оксихлорид фосфора, с последующим замещением хлора спиртом, например, в щелочных условиях, таких как метоксид натрия в метаноле. Очевидно, что остатки R3, R4, R5, R7, и/или R8 могут либо быть введены в исходные реагенты для синтеза реакционно-способного изохинолина или изохинолона, либо могут быть введены на подходящей последующей стадии, например, путем галогенирования, такого как бромирование или хлорирование, и последующего замещения указанного галогена с помощью методов, подробно описанных в литературе, таких как, например, реакция сочетания Сузуки или реакция сочетания Бухвальда-Хартвига, с использованием соответствующих катализаторов и реагентов для сочетания, таких как бороновые кислоты, амины или анилины.
Один возможный синтез изохинолинона, замещенного циклоалкиламином, (v) с L=O описан в качестве примера ниже, но он не ограничивает настоящее изобретение.
Изохинолиноны, замещенные циклоалкиламином (например, соединение v), могут быть синтезированы различными методами. Следующая общая схема 1 иллюстрирует ряд возможных путей синтеза изохинолинонов, которые не ограничивают настоящее изобретение.
Схема 1
6-Фторизохинолоны (i), например, замещенные с помощью R3, R4, R5, R7, и/или R8, которые, например, являются независимыми друг от друга заместителями, такими как водород, алкил, алкокси или галогенид, могут быть подвергнуты взаимодействию с подходящими R13/R14 замещенными аминоспиртами, где R13/R14 являются независимо друг от друга, например, водородом, алкилом или защитной группой, такой как, например, Boc или Cbz, в присутствии основания, такого как DBU, карбонат цезия, или гидрид натрия, при температурах от комнатной температуры до 100°C с получением соответствующих производных (iv). Необязательно, но это превращение может быть уже осуществлено на более ранних стадиях синтеза (например, путем взаимодействия подходящего промежуточного соединения). Очевидно, что в случае незащищенных изохинолонов, при этом может потребоваться установить защиту на азоте или кислороде фрагмента изохинолона с помощью подходящих методов, таких как реакция с соответствующим образом замещенным алкилом или бензилгалогенидами в присутствии основания.
В качестве варианта, аминоспирты могут быть подвергнуты реакции сочетания с 6-гидроксиизохинолонами, такими как соединение (ii), при инверсии несущего гидроксил углеродного центра соединений, таких как соединение (iii), либо защищенных с помощью подходящей защитной группы Q, либо незащищенных, в результате реакции Мицунобу с использованием трифенилфосфина и диалкилазодикарбоксилатов, таких как диэтилазодикарбоксилат или диизопропилазодикарбоксилат, в подходящем растворителе, таком как тетрагидрофуран, или толуол.
Продукты, такие как соединение (iv), получаемые с помощью этих методов, могут затем быть подвергнуты реакции снятия защиты с получением соединений типа (v), либо, если присутствует подходящая аминофункциональность, подвергнуты взаимодействию с подходящими альдегидами или кетонами в присутствии восстановителя, такого как триацетоксиборгидрид натрия, боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе и в присутствии водоотнимающего реагента, такого как молекулярные сита или подходящий ортоэфир. С этой аминогруппы защита может быть снята на исходной стадии, такой как, например, кислотное удаление Boc-групп. Кроме того, аминогруппа может быть ацилирована в результате ее реакции с подходящим хлорангидридом в присутствии основания, такого как триэтиламин или основание Хюнига, или путем ее реакции с подходящей карбоновой кислотой в присутствии основания, такого как триэтиламин или основание Хюнига, и реагента для сочетания, такого как EDC, PyBOP или TOTU.
В случае использования защищенных изохинолонов, требуется разрушение используемых защитных групп для высвобождения требуемого изохинолона (v). Это высвобождение, однако, может быть осуществлено перед стадией восстановительного аминирования или после стадии восстановительного аминирования, в зависимости от природы используемого альдегида/кетона и используемой защитной группы.
Производные изохинолона, такие как соединение (v), могут быть получены в виде свободных оснований или различных солей, таких как, например, гидрохлориды, гидробромиды, фосфаты, трифторацетаты, сульфаты или фумараты. Получаемые соли могут быть превращены в соответствующее свободное основание либо путем применения ионообменной хроматографии, либо, например, в результате воднощелочной обработки и последующей экстракции с помощью подходящих органических растворителей, таких как, например, метил-трет-бутиловый эфир, хлороформ, этилацетат или смеси изопропанол/дихлорметан и последующего испарения досуха.
Циклоалкиламинные фрагменты, такие как, например, (iii), могут быть синтезированы с помощью различных методов. Следующие общие схемы иллюстрируют несколько возможных путей получения аминов, но они не ограничивают настоящее изобретение. Для любого специалиста в этой области не составит труда заменить примеры соединений, приведенных в схемах, и пример реагента, приведенного в тексте, соответствующими альтернативными соединениями или реагентами, или, когда это целесообразно, не применять или добавить стадии синтеза.
Пример синтеза циклоалкиламиноспирта (iii) описан на схемах 2 и 3, но он не ограничивает объем заместителей в настоящем изобретении.
Циклоалкиламинный фрагмент (iii) с подгруппой вторичного или третичного амина, например, может быть получен исходя из соответствующим образом замещенного циклоалкилнитрила (vi), который может быть замещен с помощью таких функциональностей, как алкил, алкокси, или ацетали. Для введения остатка R10, если это необходимо, нитрил может быть функционализирован в альфа-положении путем реакции с подходящими электрофилами, описанными в литературе (Organic Process Research & Development, 5(6), 587-592; 2001), с использованием, например, подходящего соединения фторированного арила и подходящего основания, такого как KHMDS, LiHMDS или гидрид натрия, в инертном растворителе, таком как толуол. В качестве варианта, подходящий нуклеофил, такой как ариллитиевые реагенты, может быть подвергнут взаимодействию с подходящим кетоном (xvi) с получением соответствующего спирта, который может быть превращен в соответствующий нитрил (vii) путем обработки с помощью таких реагентов, как TMSCN.
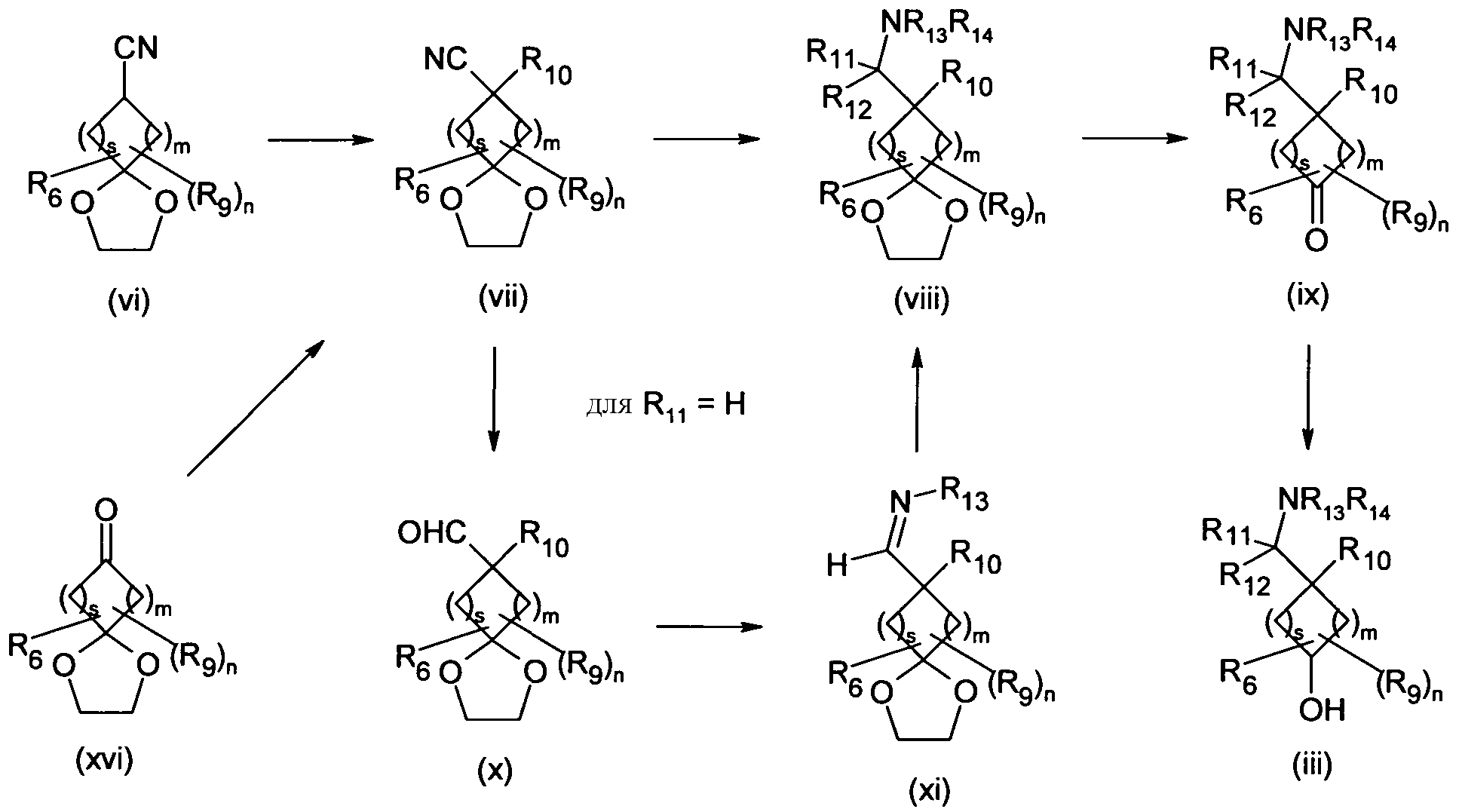
Схема 2
Другим выбором является синтез циклоалкильного фрагмента, например, путем конденсаций Дикмана, описанных в литературе (Lednicer et al., J. Med. Chem. 1980, 23(4), 424-30; DeGraffenreid et al., J. Org. Chem. 2007, 72(19), 7455-7458), с получением кетонов, таких как соединение (xii), которые могут быть превращены в их ацетали (vii) путем обработки с помощью диолов, таких как этилендиол, или могут быть непосредственно превращены в соответствующие спирты с использованием подходящих восстановителей, таких как боргидрид натрия, в подходящем растворителе, таком как метанол, этанол или THF. Получаемый нитрил может затем быть, например, далее превращен, как показано на схемах 2 и 4.
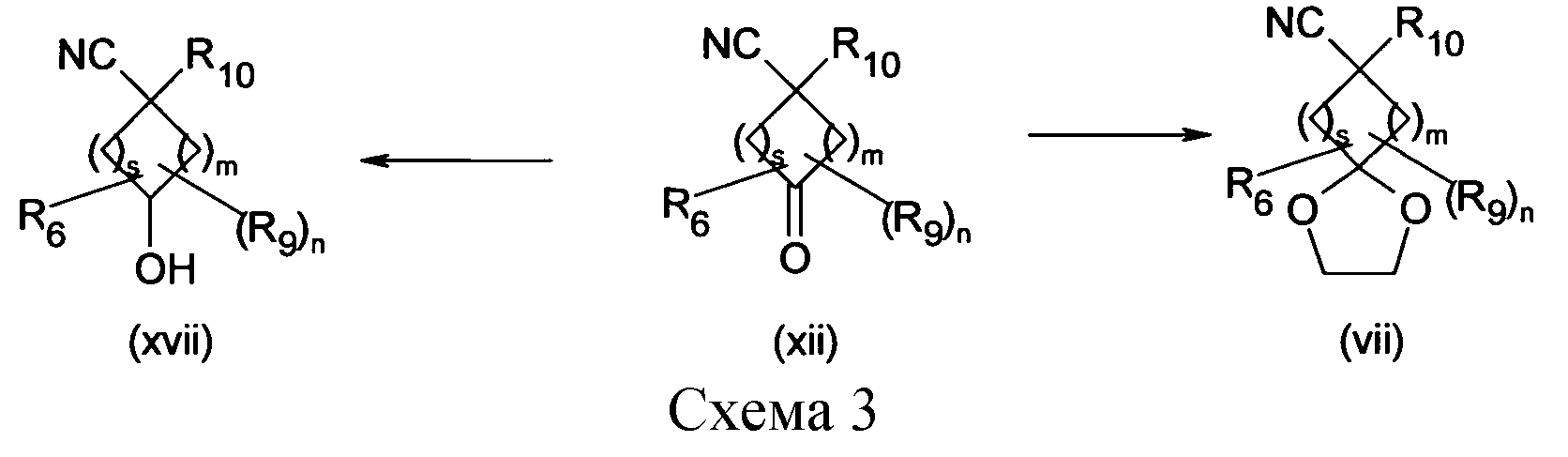
Функционализированный нитрил (vii или xvii) может затем, например, быть непосредственно подвергнут взаимодействию с подходящими нуклеофилами для введения функциональных групп R11 и R12, например, органилами лития или реактивами Гриньяра, с получением соединений, таких как (viii или iii). Подходящая N-защитная группа, такая как т-бутилоксикарбонил или бензилоксикарбонил, может быть присоединена или не присоединена после этой стадии в зависимости от природы исходного нитрила и сложности осуществления реакций. В случае, когда R11=R12, в качестве нуклеофилов могут быть использованы органилы лития, активированные путем добавления кислот Льюиса, таких как изопропоксилат титана и хлорид церия.
В случае, когда R11 является H, промежуточный имин, образующийся при добавлении нуклеофилов, может быть выделен и восстановлен с помощью подходящих восстановителей, таких как цианоборгидриды или боргидриды, в растворителях, таких как тетрагидрофуран или спирты. В качестве варианта, нитрил (vii) может быть восстановлен до альдегида (x) с помощью подходящих реагентов, являющихся донорами водорода, такими как диизобутилалюминийгидрид, в холодных органических растворителях, таких как диэтиловый эфир или толуол, и превращен в соответствующие имины (xi), такие как бензилимины или N-трет-бутансульфинилимины, с помощью реакции с соответствующим образом функционализированными аминами, катализируемой кислотой Льюиса. Эти имины (xi) могут затем быть подвергнуты взаимодействию с подходящими нуклеофильными реагентами, такими как органилы лития, реактивы Гриньяра или триметилсиланы в комбинации с тетраалкилфторидами, для введения различных заместителей, таких как алкильные, циклоалкильные или гетероциклильные группы. С кето-функциональности может затем быть снята защита с помощью методов, известных специалисту в этой области, например, путем обработки с помощью водных растворов кислот, таких как уксусная кислота или хлористоводородная кислота в смесях с ацетоном, и последующего восстановления до соответствующих спиртов (iii), обычно в виде цис/транс смесей, с помощью подходящих восстановителей, таких как боргидриды, в спиртах, тетрагидрофуране или толуоле при низких температурах.
Однако это снятие защиты может быть также осуществлено после стадии функционализации нитрила (схема 4), в зависимости от природы используемого нитрила и характера замещения. Если кетон восстанавливают, перед тем как функционализируют нитрил, то обычно получают с высокой селективностью только один изомер (цис или транс). Для превращения нитрилов из типа (xiii) в амины (iii), может оказаться целесообразной использование подходящей защитной группы на спиртовой функциональности. Подходящие защитные группы известны специалисту в этой области, и они могут являться эфирами, такими как тетрагидропиран, метоксиметильный или силильный эфиры.
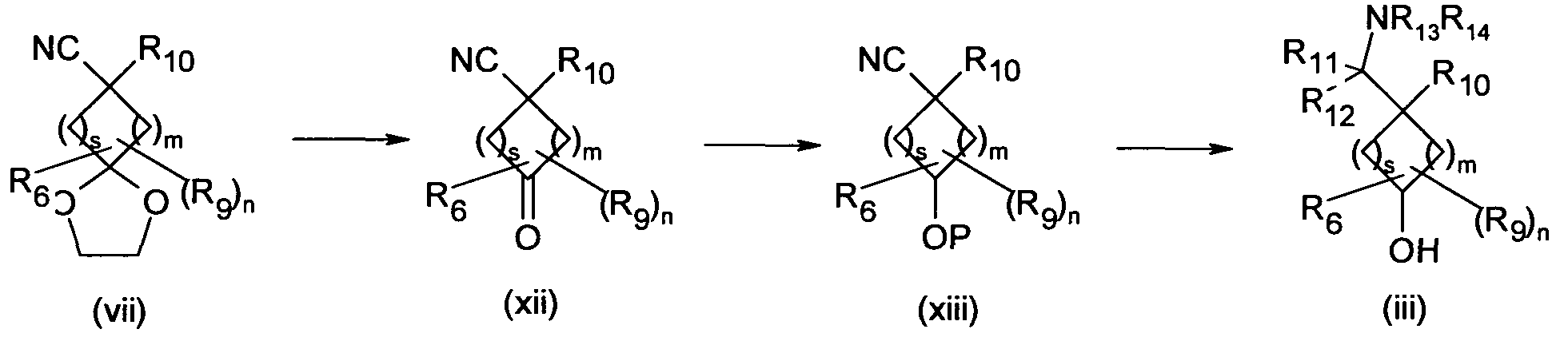
Схема 4
Для получения циклоалкиламинных фрагментов, отличных от циклоалкиламиноспиртов, могут быть применены различные методы. Следующая общая схема (схема 4) иллюстрирует несколько возможных путей синтеза этих аминов, но они не ограничивают настоящее изобретение.
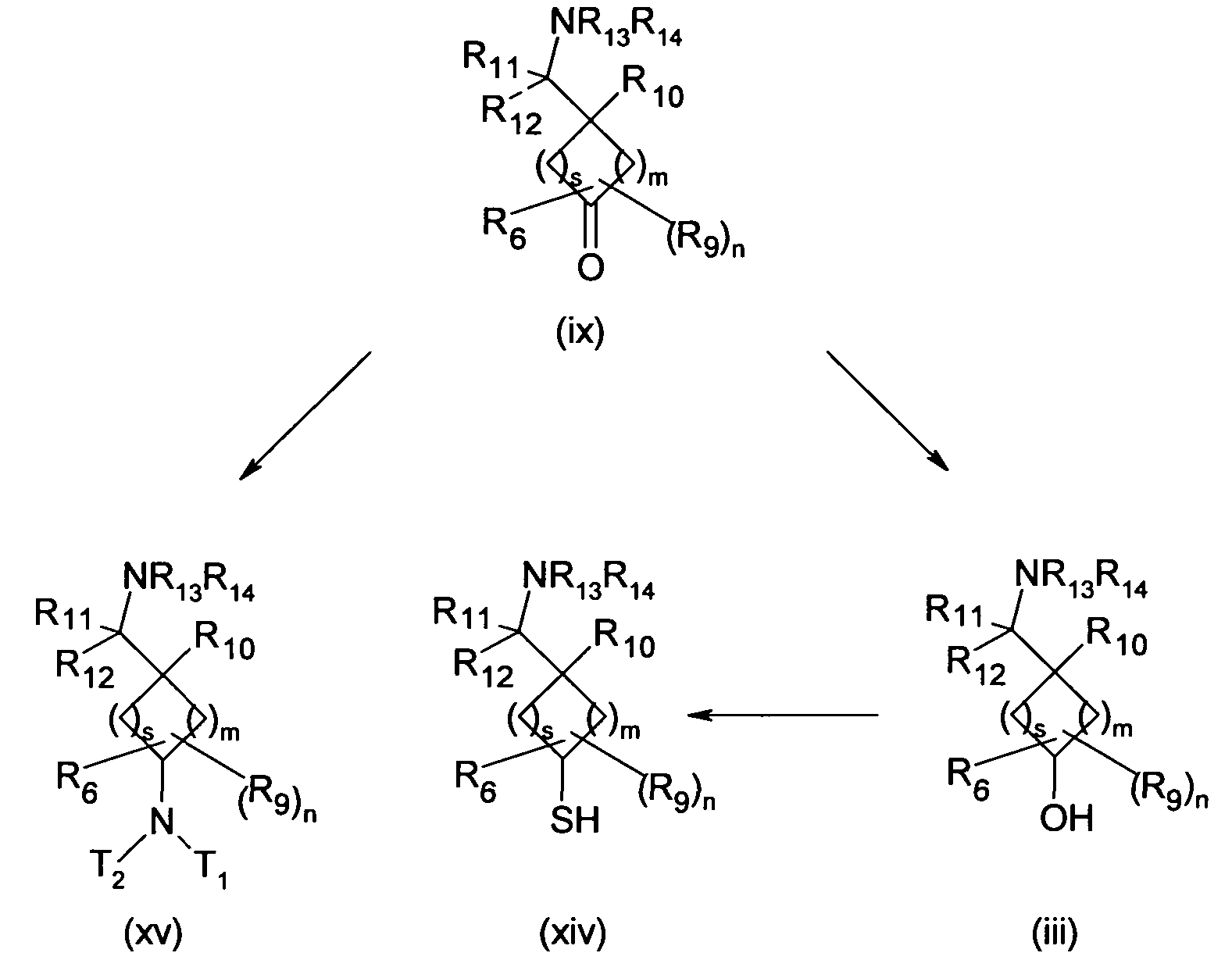
Схема 5
Например, гидроксильная функциональность соединения (iii) может быть превращена в тиол в результате реакции Мицунобу с использованием тиоацетата и последующего щелочного разложения с помощью подходящего основания, с получением аминных фрагментов типа (xiv). Эти тиолы после сочетания с подходящими изохинолинонами при соответствующих условиях реакции, таких как, например, полностью аналогичных тем, которые описаны выше в схеме 1 для реакции сочетания соединения (iii), могут затем быть использованы для получения соединений формулы (I) с линкерным фрагментом L=S, или необязательно окислены с помощью методов, известных специалисту в этой области, до соответствующих сульфоксидов и сульфонов (для получения соединений формулы (I) с линкерным фрагментом L=SO и SO2). Соответствующие амины могут быть синтезированы с помощью стадии восстановительного аминирования исходя из кетонов, таких как соединение (ix или xii) с использованием подходящих аминов в присутствии восстановителя, такого как триацетоксиборгидрид натрия, боргидрид натрия или цианоборгидрид натрия, в присутствии водоотнимающего реагента, такого как молекулярные сита или подходящий ортоэфир.
Обычно, защитные группы, которые могут все еще присутствовать в продуктах, получаемых в реакции сочетания, затем удаляют с помощью стандартных методик. Например, трет-бутильные защитные группы, в частности, трет-бутоксикарбонильная группа, которая является защитной группой для аминогруппы, могут быть сняты, то есть, превращены в аминогруппу, путем обработки с помощью трифторуксусной кислоты. Как уже объяснялось выше, после реакции сочетания функциональные группы могут также быть образованы из подходящих групп предшественника. Кроме того, путем известных методов затем может быть осуществлено превращение в фармацевтически приемлемую соль или пролекарство соединения формулы (I).
Обычно, выделяют реакционную смесь, содержащую конечное соединение формулы (I) или промежуточное соединение, и, если желательно, продукт затем очищают с помощью традиционных методов, известных специалистам в этой области. Например, синтезируемое соединение может быть очищено с помощью хорошо известных методов, таких как кристаллизация, хроматография или высокоэффективная жидкостная хроматография с обращенной фазой (RP-HPLC) или другие методы разделения, основанные, например, на размере, заряде или гидрофобности соединения. Аналогично, для характеристики соединения изобретения могут быть использованы хорошо известные методы, такие как ЯМР, ИК и масс-спектрометрия (MS).
ПРИМЕРЫ
Следующие примеры иллюстрируют различные варианты осуществления настоящего изобретения и являются частью настоящего изобретения.
Цис и транс номенклатура в названии соответствующих соединений относится к относительной конфигурации -[CR11R12]rNR13R14 остатка и L-остатка в циклоалкильном кольце. Это обозначение сохраняется для соответствующих предшественников.
цис-4-Гидрокси-1-фенилциклогексанкарбонитрил (1)
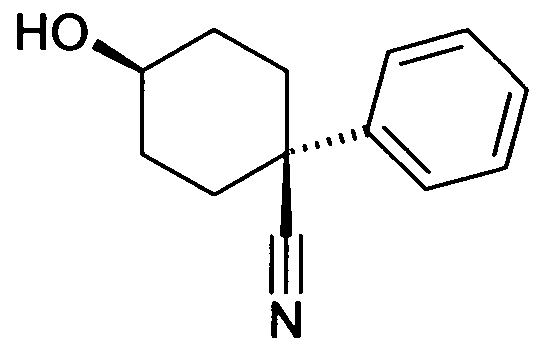
К суспензии 4-циано-4-фенилциклогексанона (25 г, 125 ммоль) в абсолютном этаноле (1 л) добавляли порциями боргидрид натрия (9,5 г, 251 ммоль) в течение 30 минут. Полученную смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли лед, и неочищенную смесь перемешивали в течение еще одного часа. Этанол испаряли при пониженном давлении, и полученный водный слой экстрагировали с помощью дихлорметана. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт цис-4-гидрокси-1-фенилциклогексанкарбонитрил (25 г, содержащий приблизительно 10% транс-изомера) использовали на следующей стадии без какой-либо дополнительной очистки. Rt=3,99 минут (метод 8). Обнаруженная масса: 202 (M+H+).
цис-4-Циано-4-фенилциклогексилацетат (2)
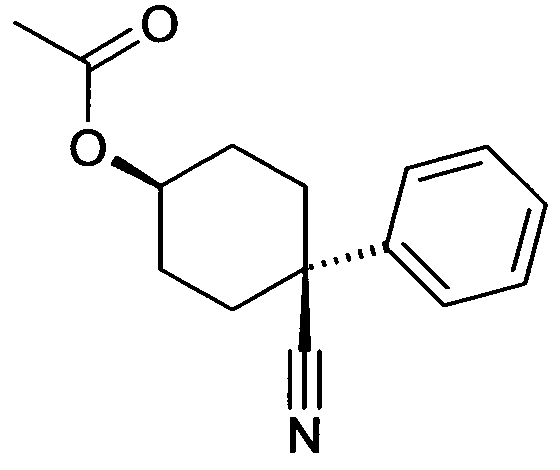
К раствору цис-4-гидрокси-1-фенилциклогексанкарбонитрила (1, 0,2 г, 1 ммоль) в безводном пиридине (10 мл) добавляли уксусный ангидрид (0,1 мл, 1,2 ммоль) и 4-диметиламинопиридин (0,024 г, 0,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, и затем испаряли досуха. К неочищенному продукту добавляли насыщенный водный раствор бикарбоната натрия, и смесь экстрагировали с помощью дихлорметана. Органический слой сушили над сульфатом натрия, фильтровали и испаряли досуха. Неочищенный продукт очищали с помощью хроматографии на силикагеле (элюируя с помощью от 0 до 40% этилацетата в циклогексане) с получением 3,39 г цис-4-циано-4-фенилциклогексилацетата (содержащего приблизительно 10% транс-изомера). Rt=7,34 минуты (метод 9). Обнаруженная масса: 266 (M+Na+).
цис-4-(1-Аминоциклопропил)-4-фенилциклогексилацетат (3)
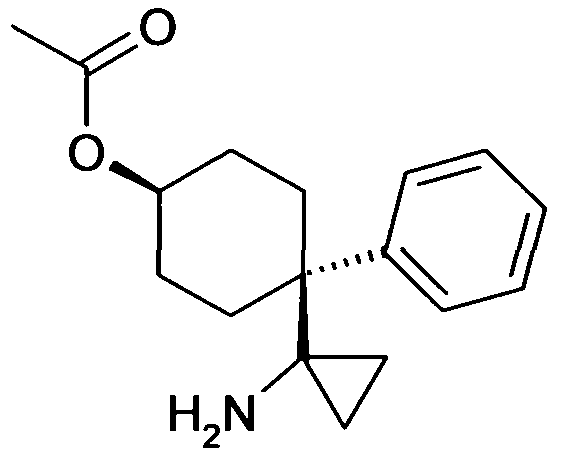
В трехгорлую круглодонную колбу объемом 250 мл, снабженную датчиком температуры и линией с аргоном, загружали цис-4-циано-4-фенилциклогексилацетат (2, 3,39 г, 13,9 ммоль) и безводный тетрагидрофуран (140 мл). Полученный раствор охлаждали до -75°C и добавляли по каплям изопропоксид титана(IV) (4,5 мл, 15,3 ммоль), при этом температура реакции оставалась ниже -70°C. Как только добавление заканчивали, добавляли по каплям этилмагнийбромид (3M в диэтиловом эфире) (10,2 мл, 30,6 ммоль). Смесь перемешивали при -70°C в течение 10 минут и затем медленно подогревали до комнатной температуры, при этом продолжая перемешивание в течение еще 30 минут. На этой стадии, добавляли эфират трифторида бора (3,5 мл, 28 ммоль), и перемешивание продолжали в течение 1 часа. Добавляли воду (14 мл), затем 10% водной HCl (140 мл) и диэтиловый эфир (100 мл). К полученной прозрачной смеси добавляли 10% водный раствор NaOH до тех пор, пока значение pH не становилось щелочным. Продукт экстрагировали с помощью диэтилового эфира. Объединенные органические экстракты сушили над безводным сульфатом натрия. После испарения растворителя, продукт очищали с помощью флэш-хроматографии на силикагеле (элюируя с помощью смеси от 0 до 100% этилацетата в циклогексане) с получением 0,65 г цис-4-(1-аминоциклопропил)-4-фенилциклогексилацетата. Rt=2,72 минуты (метод 7). Обнаруженная масса: 274 (M+H+).
цис-4-(1-Аминоциклопропил)-4-фенилциклогексанол (4)
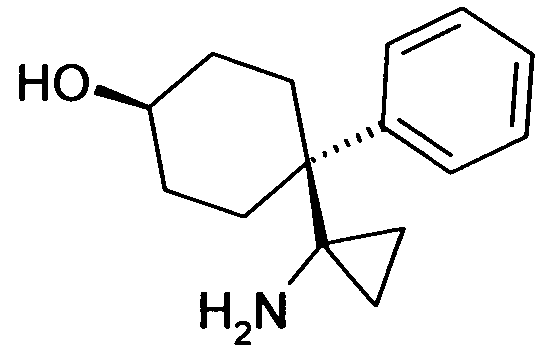
К раствору цис-4-(1-аминоциклопропил)-4-фенилциклогексил- ацетата (3, 0,54 г, 2 ммоль) в безводном метаноле (20 мл) добавляли метоксид натрия (0,5 N в метаноле) (8,7 мл, 4,3 ммоль). После перемешивания в течение 72 часов при комнатной температуре, реакционную смесь охлаждали до 0°C, добавляли 1M раствор хлористоводородной кислоты в диэтиловом эфире (10 мл), и полученный белый осадок отфильтровывали. Фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт растирали со смесью метанол/диэтиловый эфир. Бежевое твердое вещество выделяли с помощью фильтрации с получением 400 мг цис-4-(1-аминоциклопропил)-4-фенил-циклогексанола в виде гидрохлорида.
Rt=2,33 минуты (метод 8). Обнаруженная масса: 232 (M+H+).
цис-4-(1-Аминоциклопропил)-4-(2-фторфенил)циклогексанол (5)
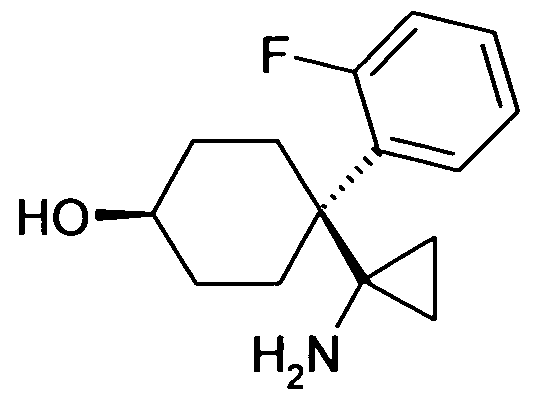
Используя методики, описанные для синтеза 4, исходя из 4-циано-4-(2-фторфенил)циклогексанона получали 0,219 г цис-4-(1-аминоциклопропил)-4-(2-фторфенил)циклогексанола (5) в виде гидрохлорида (загрязненного 4% транс-изомера). Rt=0,66 минуты (метод 7). Обнаруженная масса: 250 (M+H+).
цис-4-(1-Аминопропил)-4-фенилциклогексанол (6)
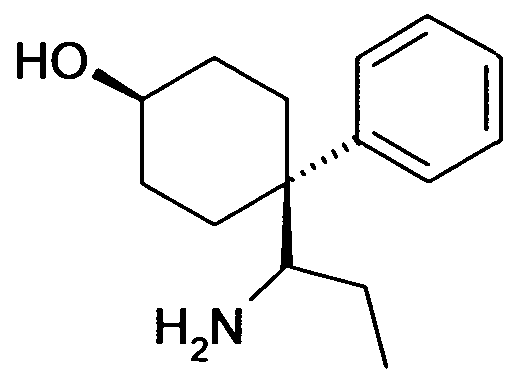
К раствору цис-4-гидрокси-1-фенилциклогексанкарбонитрила (1, 1,0 г, 4,97 ммоль) в безводном толуоле (100 мл) добавляли по каплям раствор этилмагнийбромида (3M в диэтиловом эфире, 10 мл, 30 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи, затем выливали на лед. Полученную смесь экстрагировали с помощью диэтилового эфира, органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. К раствору этого неочищенного продукта в абсолютном этаноле (100 мл) добавляли боргидрид натрия (0,257 г, 7,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли водную 1N HCl до pH=1,3. Этанол испаряли при пониженном давлении, полученную водную фазу промывали с помощью диэтилового эфира, затем нейтрализовывали с помощью насыщенного водного раствора бикарбоната натрия и, наконец, последовательно экстрагировали с помощью диэтилового эфира и хлороформа. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и испаряли досуха. Неочищенный продукт растворяли в 15 мл метанола и добавляли по каплям HCl (4N в диоксане) (0,9 мл). Суспензию перемешивали в течение 30 минут, затем испаряли досуха с получением 0,858 г цис-4-(1-аминопропил)-4-фенилциклогексанола (6) в виде гидрохлорида (загрязненного 10% транс-изомера). Rt=2,59 минуты (метод 8). Обнаруженная масса : 234 (M+H+).
цис-4-(Метоксиметокси)-1-фенилциклогексанкарбонитрил (7)
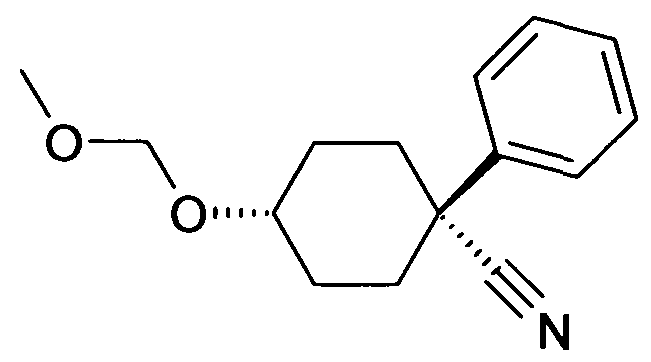
Перемешиваемый раствор трет-бутоксида калия (1,6 M в трет-бутаноле, 37,3 мл, 37,3 ммоль) охлаждали до 0°C и добавляли безводный DMF (6 мл), до того как смесь начинала превращаться в лед. К реакционной смеси добавляли раствор цис-4-гидрокси-1-фенилциклогексанкарбонитрила (1, 3 г, 14,9 ммоль) в безводном DMF (30 мл). Затем добавляли по каплям раствор хлорметилметилового эфира (2,83 мл, 37,3 ммоль) при 2-4°C, и смесь постепенно подогревали до комнатной температуры, при этом продолжая перемешивание в течение ночи. Смесь выливали в холодный водный раствор бикарбоната натрия, затем экстрагировали с помощью диэтилового эфира. Органический слой сушили над сульфатом натрия и испаряли. Неочищенный продукт очищали с помощью хроматографии на силикагеле с получением 2,2 г названного соединения. Rt=7,01 минуты (метод 9). Обнаруженная масса: 246 (M+H+)
цис-4-(1-Амино-1-метилэтил)-4-фенилциклогексанол (8)
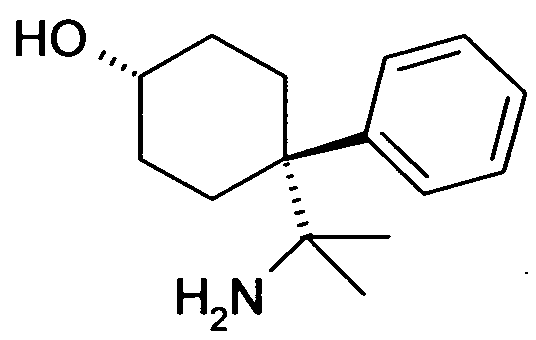
Суспензию выпускаемого промышленностью безводного хлорида церия (Alfa Aesar, 2 г, 8,15 ммоль) в безводном THF (12 мл) нагревали до 45°C в течение 3 часов при интенсивном перемешивании. Суспензию охлаждали до комнатной температуры и обрабатывали с помощью цис-4-(метоксиметокси)-1-фенилцикло-гексанкарбонитрила (7, 1 г, 4,08 ммоль). После охлаждения до -10°C, добавляли по каплям 1,5 M раствор MeLi·LiBr (6,79 мл, 10,2 ммоль) в диэтиловом эфире в течение 20 минут, затем полученную коричневую суспензию перемешивали в течение еще 20 минут. Реакцию останавливали путем добавления концентрированного раствора NH4OH (2,6 мл) в течение 10 минут. Полученную желтую суспензию подогревали до комнатной температуры, перемешивали в течение 30 минут, разбавляли с помощью THF и затем фильтровали. Влажный осадок споласкивали несколько раз с помощью THF. Объединенные фильтраты затем концентрировали почти досуха, разбавляли с помощью дихлорметана и промывали с помощью 0,1 N раствора NaOH. Органический слой сушили над сульфатом натрия и испаряли.
Неочищенную смесь суспендировали в смеси метанола (20 мл) и водной 2N HCl (20 мл), затем перемешивали в течение ночи при комнатной температуре. После испарения метанола и фильтрации, фильтрат концентрировали досуха с получением 0,38 г неочищенной смеси названного соединения (8). Rt=2,43 минуты (метод 9). Обнаруженная масса: 234 (M+H+).
6,7-дифтор-5-метилизохинолин (43)
a) [1-(3,4-Дифтор-2-метилфенил)метилиден]-2,2-диметоксиамин (40)
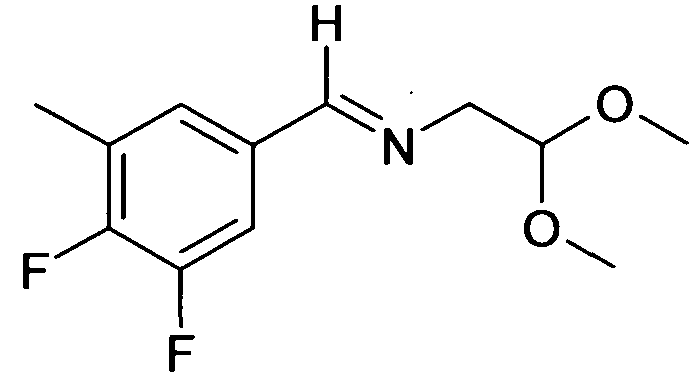
3,4-дифтор-2-метилбензальдегид (26 г, 166 ммоль) растворяли в толуоле (182 мл) и подвергали взаимодействию с диметилацеталем 2-аминоацетальдегида (19,3 г, 183 ммоль) и толуолсульфоновой кислотой (3,2 г) в течение 2 часов в аппарате Дина-Старка. Раствор охлаждали, экстрагировали с помощью насыщенного раствора бикарбоната натрия, воды и рассола, сушили над сульфатом натрия и испаряли досуха с получением 40,4 г темно-желтого масла, которое использовали без дополнительной очистки.
b) 3,4-Дифтор-2-метилбензил-2,2-диметоксиэтиламин (41)
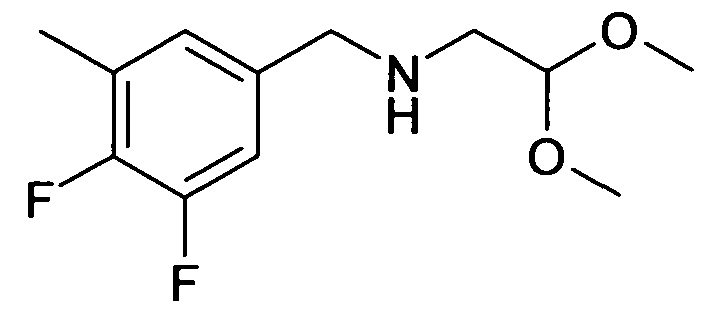
[1-(3,4-Дифтор-2-метилфенил)метилиден]-2,2-диметоксиамин (40, 40,4 г) растворяли в этаноле (225 мл). Добавляли порциями боргидрид натрия (4,8 г, 124 ммоль). Перемешивание продолжали в течение ночи. Для выделения продукта реакции добавляли уксусную кислоту до тех пор, пока не прекращалось выделение газа. Затем раствор испаряли досуха, растворяли в дихлорметане и промывали с помощью насыщенного раствора бикарбоната натрия и дважды с помощью воды. Органический слой промывали с помощью рассола, сушили над сульфатом магния и испаряли досуха. Полученный неочищенный продукт (37,8 г) использовали без очистки.
c) N-(3,4-Дифтор-2-метилбензил)-N-(2,2-диметоксиэтил)-4-метилфенилсульфониламин (42)
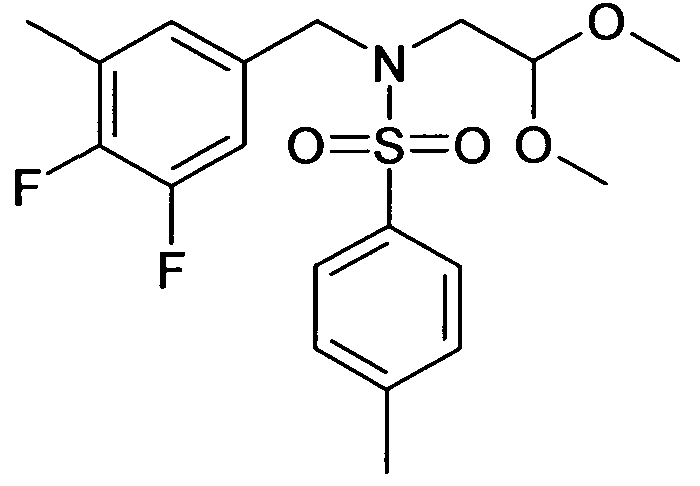
3,4-Дифтор-2-метилбензил-2,2-диметоксиэтиламин (41, 37,8 г) растворяли в дихлорметане (100 мл). Добавляли пиридин (42 мл). Добавляли по каплям при 0°C раствор п-толуолсульфонилхлорида (36,8 г, 193 ммоль) в дихлорметане. Реакционную смесь подогревали до комнатной температуры и постоянно перемешивали до тех пор, пока полностью не прошла реакция. Для выделения продукта реакции, реакционную смесь разбавляли с помощью дихлорметана (100 мл) и дважды экстрагировали с помощью 1,5M хлористоводородной кислоты, дважды с помощью раствора бикарбоната натрия и один раз с помощью рассола. Органический слой сушили над сульфатом магния, испаряли досуха с получением неочищенного продукта в виде оранжевого масла (68,3 г). Его использовали без дополнительной очистки.
d) 6,7-дифтор-5-метилизохинолин (43)
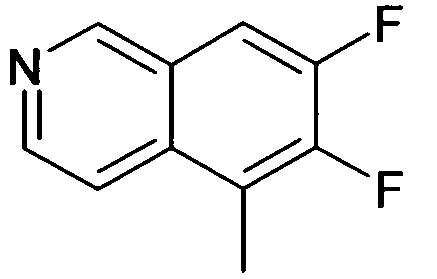
Трихлорид алюминия (112 г, 838 ммоль) суспендировали в дихлорметане (250 мл) при 0°C. Добавляли раствор N-(3,4-дифтор-2-метилбензил)-N-(2,2-диметоксиэтил)-4-метилфенилсульфониламина (42, 68,3 г) в дихлорметане (250 мл). Реакционную смесь нагревали при 50°C в течение 2 часов, после чего охлаждали до 0°C и выливали на лед. Органический слой отделяли, и водный слой еще дважды экстрагировали с помощью смеси дихлорметан/изопропанол (3:1). Объединенную органическую фазу экстрагировали дважды с помощью насыщенного раствора бикарбоната натрия и сушили над сульфатом магния, затем фильтровали и испаряли с получением 63,5 г неочищенного темно-коричневого полутвердого продукта. Его очищали с помощью хроматографии на силикагеле. Элюирование с помощью смеси этилацетат/гептан (от 5%:95% до 35%:65%) давало 11,3 г названного соединения 43 в виде твердого вещества бежевого цвета. Rt=0,86 минуты (метод 10). Обнаруженная масса: 180,1 (M+H+).
Изохинолины, приведенные в следующей таблице, были получены с помощью такой же последовательности реакций, которую использовали для синтеза соединения 43.
|
7-Хлор-6-фторизохинолин 2-оксид (9)
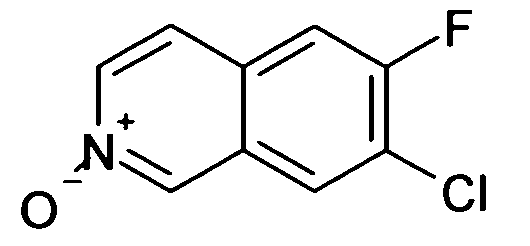
50 г 7-хлор-6-фторизохинолина (полученного согласно патентному документу WO 2007/012422) растворяли в дихлорметане и охлаждали до 5°C. Добавляли порциями 69,6 г м-хлор-пербензойной кислоты (70%). Смесь перемешивали при комнатной температуре. После завершения реакции смесь разбавляли с помощью 1,5 л дихлорметана и промывали три раза с помощью насыщенного раствора бикарбоната натрия. Органический слой сушили над сульфатом натрия и испаряли досуха с получением 47,6 г требуемого продукта 9. Rt=0,98 минуты (Метод 5). Обнаруженная масса: 198,1 (M+H+).
7-Хлор-6-фтор-1-метоксиизохинолин (10)
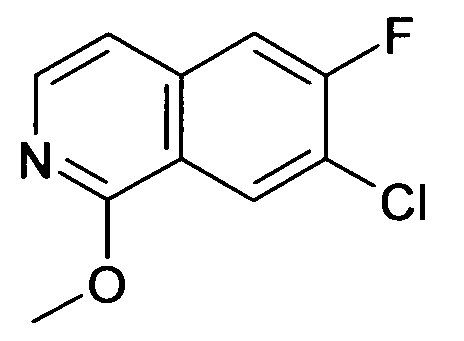
10 г 7-Хлор-6-фторизохинолин 2-оксида (9) растворяли в 100 мл сухого метанола. Добавляли по каплям 12 мл этилхлороформиата при -10°C. Смесь перемешивали в течение 15 минут и затем добавляли по каплям 28 мл триэтиламина, растворенного в 55 мл метанола, при -20°C в течение 1 часа.
Добавляли 100 мл 2N водный раствор гидроксида натрия и образовавшийся осадок отфильтровали. В результате добавления 2N раствора гидроксида натрия и воды к маточному раствору осаждалось дополнительное количество продукта. Объединенное твердое вещество сушили с получением 7,8 г требуемого продукта (10). Rt=3,75 минуты (Метод 1). Обнаруженная масса: 212,0 (M+H+).
Следующие соединения были получены таким же образом, как описано в синтезе 10, исходя из соответствующих изохинолинов.
|
1-Бензилокси-7-хлор-6-фторизохинолин (38)
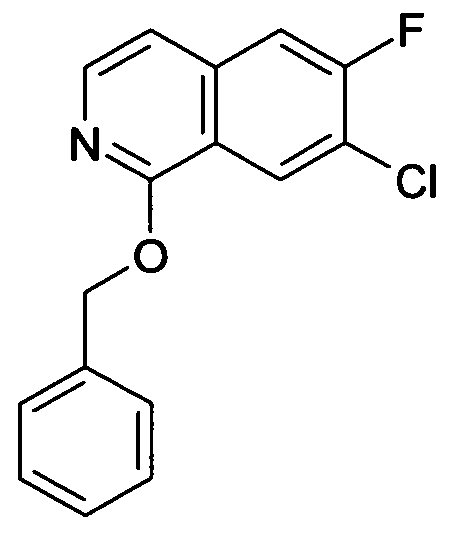
7-Хлор-6-фтор-2H-изохинолин-1-он (полученный согласно патентному документу WO 2007/012422; 52,2 г) растворяли в THF (1 л). После добавления карбоната серебра (145,5 г) и бензилбромида (40,6 мл), смесь перемешивали при комнатной температуре в течение ночи. Добавляли еще 6,2 мл бензилбромида, и смесь перемешивали при 70°C в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь разбавляли путем добавления 1 л этилацетата и фильтровали через целит. Осадок на фильтре тщательно промывали, органический слой испаряли и подвергали хроматографии на силикагеле (н-гептаны: метилтретбутиловый эфир) с получением 27,8 г названного соединения (38). Rt=3,73 минуты (Метод 1). Обнаруженная масса: 288,1 (M+H+).
1-Бензилокси-4-бензил-7-хлор-6-фторизохинолин (55)

В качестве побочного продукта при получении 1-бензилокси-7-хлор-6-фторизохинолина (38), может быть выделено с помощью хроматографии на силикагеле 8,45 г 1-бензилокси-4-бензил-7-хлор-6-фторизохинолина (55). Rt=4,04 минуты (Метод 1). Обнаруженная масса: 378,1 (M+H+).
1-Бензилокси-7-метил-6-фторизохинолин (39)
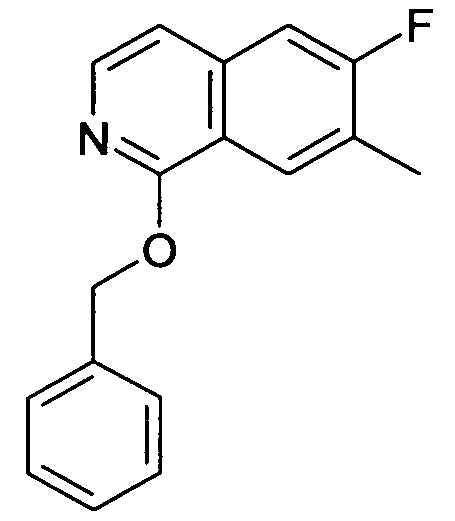
1-Бензилокси-7-метил-6-фторизохинолин (39) был получен согласно методике, описанной для синтеза соединения (38), исходя из 7-метил-6-фтор-2H-изохинолин-1-она (полученного согласно методике, описанной в патентном документе WO 2007/012421 или WO 2007/012422). Rt=4,00 минуты (Метод 1). Обнаруженная масса: 268,1 (M+H+).
1-(4-Фторфенил)-4-оксоциклогексанкарбонитрил (12)
a) 5-Циано-5-(4-фторфенил)-2-оксоциклогексанкарбоновой кислоты метиловый эфир (11)
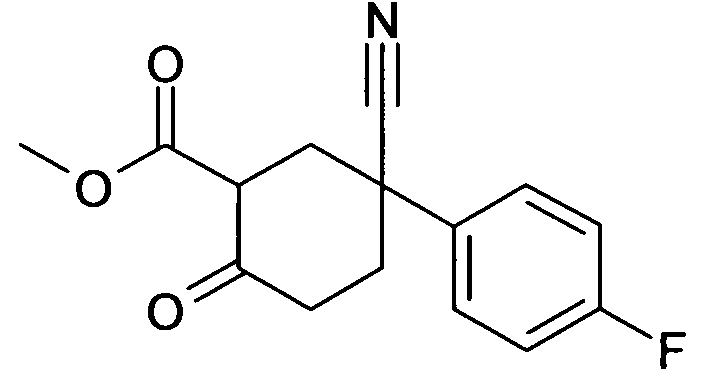
70 мл метилакрилата и 50 г 4-фторфенилацетонитрила растворяли в смеси 200 мл THF и 50 мл сухого метанола. Добавляли по каплям 150 мл метилата натрия (30% в метаноле), поддерживая при этом температуру ниже 40°C. Смесь перемешивали при комнатной температуре в течение 15 часов и нагревали в течение еще 4 часов при 50°C. После окончания реакции, смесь охлаждали до комнатной температуры и выливали в холодный 2N водный раствор хлористоводородной кислоты. Водный слой экстрагировали три раза с помощью этилацетата, и объединенный органический слой промывали с помощью воды и рассола, сушили над сульфатом магния и испаряли с получением 101,5 г требуемого продукта. Rt=1,59 минуты (Метод 5). Обнаруженная масса: 276,2 (M+H+).
b) 1-(4-Фторфенил)-4-оксоциклогексанкарбонитрил (12)
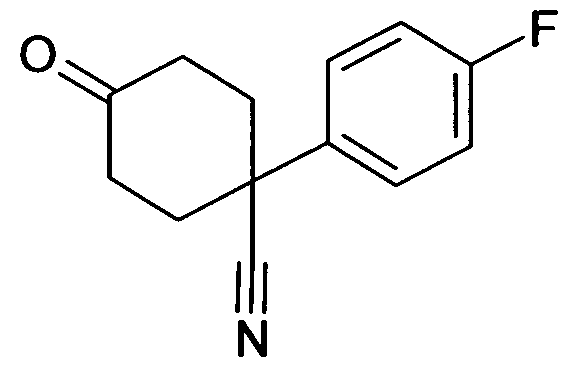
101,5 г 5-Циано-5-(4-фторфенил)-2-оксоциклогексан-карбоновой кислоты метилового эфира (11) растворяли в 680 мл этанола, и добавляли 171 мл концентрированной водной хлористоводородной кислоты. Смесь кипятили с обратным холодильником в течение 40 часов, затем испаряли. Остаток помещали в воду и экстрагировали с помощью дихлорметана. Органический слой промывали с помощью рассола, сушили над сульфатом магния и испаряли с получением 95,2 г неочищенного продукта, который очищали путем фильтрации через силикагель (гептаны:этилацетат) с получением 50,4 г требуемого продукта 12. Rt=1,26 минуты (Метод 1). Обнаруженная масса: 218,2 (M+H+).
1-(4-Метоксифенил)-4-оксоциклогексанкарбонитрил (56)
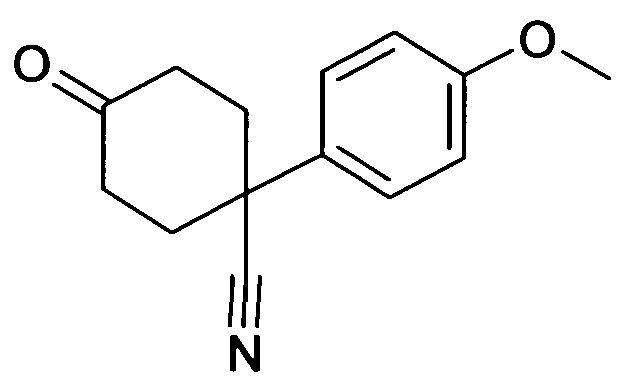
Соединение 56 получали из метилакрилата и 4-метоксифенил-ацетонитрила таким же образом, как описано для синтеза (12). Rt=4,24 минуты (Метод 3). Обнаруженная масса: 230,1 (M+H+).
1-Циано-1-(3-фторфенил)циклогексан-4-он (58)
a) 1-Циано-1-(3-фторфенил)-3-метоксикарбонилциклогексан-4-он (57)
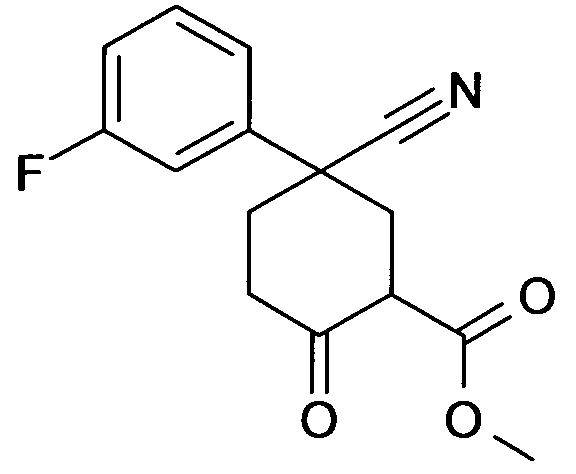
трет-Бутоксид калия (62,3 г, 555 ммоль) добавляли по каплям к раствору 3-фторфенилацетонитрила (56, 25 г, 185 ммоль) в THF (500 мл). Реакционную смесь перемешивали в течение ночи. Реакционную смесь подкисляли с помощью хлористоводородной кислоты (3M) и экстрагировали с помощью дихлорметана. Органические экстракты испаряли с получением 57,2 г оранжевого масла. Rt=3,39 минуты (Метод 3). Обнаруженная масса: 275,1 (M+H+).
b) 1-Циано-1-(3-фторфенил)циклогексан-4-он (58)
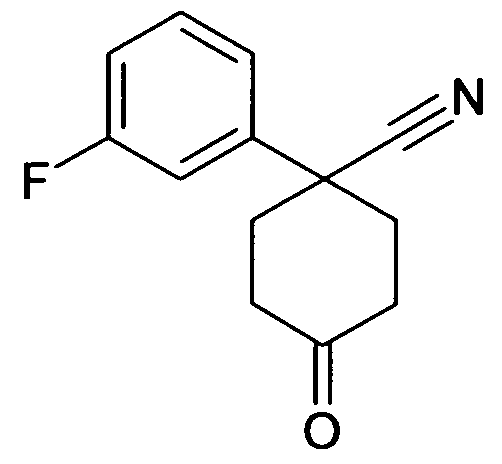
Смесь 1-циано-1-(3-фторфенил)-3-метоксикарбонилциклогексан-4-она (57, 51 г, 185 ммоль), воды (54,8 мл) и DMSO (840 мл) нагревали и перемешивали при 150°C в течение 3 часов, затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь испаряли и очищали с помощью хроматографии на силикагеле. Элюирование с помощью смеси этилацетат/гептан (от 5%:95% до 30%:70%) давало 28 г требуемого материала в виде твердого продукта. Rt=3,89 минуты (Метод 3). Обнаруженная масса: 218,2 (M+H+).
Следующие циклогексаноны получали с использованием такой же методики, как описанная для соединения 58, исходя из соответствующих фенилацетонитрилов.
|
1-Циано-1-(2,4-дифторфенил)циклогексанон (65)
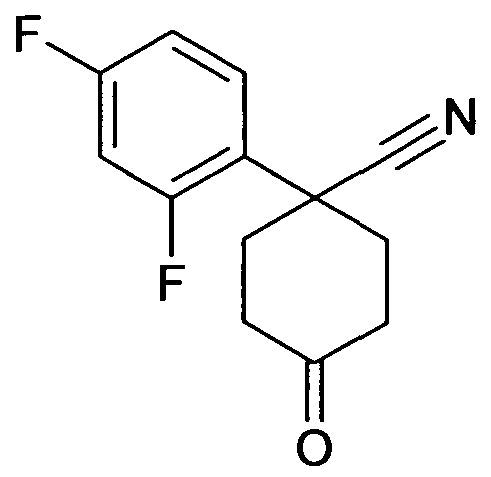
трет-Бутоксид калия (55 г, 489 ммоль) добавляли к перемешиваемому раствору 2,4-дифторфенилацетонитрила (25 г, 163 ммоль) и метилакрилата (28,1 г, 29,4 мл, 326 ммоль) в THF (475 мл) при комнатной температуре. После одного часа перемешивания, добавляли воду (2,4 л), и смесь перемешивали в течение 2 часов при 68°C. После охлаждения смесь экстрагировали с помощью метил-трет-бутилового эфира. После сушки над сульфатом натрия, органическую фазу испаряли с получением 34,7 г оранжевого масла, которое очищали с помощью хроматографии на силикагеле. Элюирование смесью этилацетат/гептан (от 5%:95% до 35%:65%) после испарения давало требуемый продукт в виде 19 г бесцветного кристаллического твердого вещества. Rt=3,84 минуты (Метод 3). Обнаруженная масса: 236,3 (M+H+).
Следующие циклогексаноны получали с использованием такой же методики, как описанная для соединения 65, исходя из соответствующих фенилацетонитрилов:
|
цис-4-Гидрокси-1-(4-фторфенил)циклогексанкарбонитрил (13)
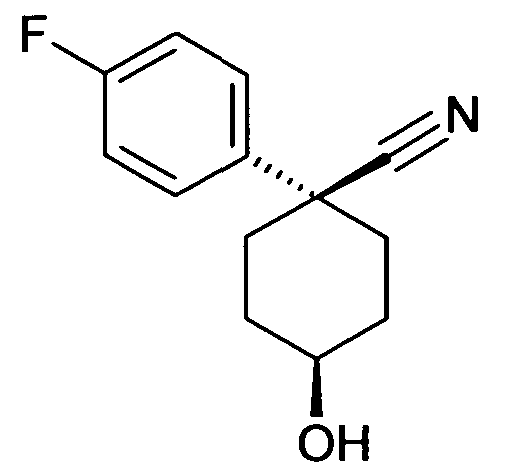
20 г 1-(4-Фторфенил)-4-оксоциклогексанкарбонитрила (12) растворяли в 300 мл сухого этанола и охлаждали до -20°°C. Добавляли 3,83 г боргидрида натрия, и смесь медленно подогревали до комнатной температуры. После завершения реакции, добавляли 150 мл воды, и корректировали pH до значения 2 путем добавления 2N хлористоводородной кислоты. Смесь экстрагировали три раза с помощью этилацетата, и объединенный органический слой экстрагировали с помощью рассола, сушили над сульфатом магния и испаряли досуха. Полученный осадок кристаллизовали из смеси н-гептаны:этилацетат с получением 11,9 г требуемого продукта. Rt=2,78 минуты (Метод 1). Обнаруженная масса: 220,1 (M+H+).
цис-4-(трет-Бутилдиметилсиланилокси)-1-(4-фторфенил)-циклогексанкарбонитрил (78)
30 г цис-4-Гидрокси-1-(4-фторфенил)циклогексанкарбонитрила (13) растворяли в 350 мл сухого дихлорметана. Добавляли 39,8 мл 2,6-лутидина, и смесь охлаждали до 0°C. Добавляли 37,7 мл трет-бутилдиметилсилилтрифторметансульфоната, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном, экстрагировали дважды с помощью воды, 0,1N хлористоводородной кислоты и один раз с помощью насыщенного раствора бикарбоната натрия и рассола, сушили над сульфатом магния, испаряли досуха и очищали с помощью хроматографии на силикагеле с получением 43,8 г требуемого продукта. Rt=3,21 минуты (Метод 12). Обнаруженная масса: 334,2 (M+H+).
цис-4-(1-аминопропил)-4-(4-фторфенил)циклогексанол (14)
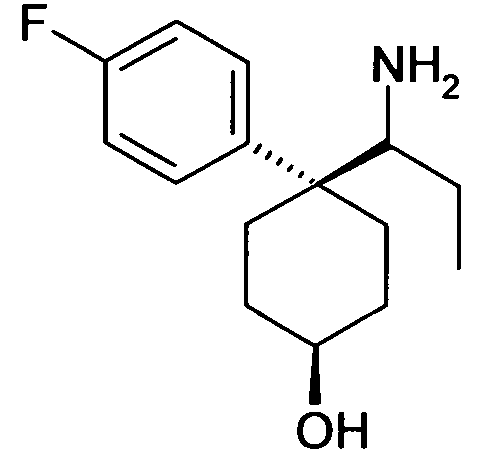
Растворяли при охлаждении в атмосфере аргона 2 г цис-4-гидрокси-1-(4-фторфенил)-циклогексанкарбонитрила (13) в 1M растворе этилмагнийбромида в THF (или диэтиловом эфире, в качестве варианта). Реакционную смесь кипятили с обратным холодильником в течение 14 часов, охлаждали до комнатной температуры и разбавляли с помощью 600 мл THF. Реакцию прерывали путем добавления минимального количества метанола, фильтровали через целит и испаряли досуха. Полученную пену растворяли в 300 мл этанола и добавляли порциями 690 мг боргидрида натрия при охлаждении. Смесь перемешивали до тех пор, пока не заканчивалась реакция, испаряли досуха и полученный остаток распределяли между 1N водной HCl и этилацетатом. Органический слой экстрагировали один раз с помощью 1N HCl, и объединенные водные слои промывали этилацетатом и затем доводили до pH 12 путем добавления 5N раствора гидроксида натрия. Водный слой экстрагировали дважды дихлорметаном, объединенные дихлорметановые слои промывали с помощью рассола, сушили над сульфатом натрия и испаряли с получением 1,72 г требуемого продукта. Rt=2,25 минуты (Метод 1). Обнаруженная масса: 252,2 (M+H+).
В качестве варианта, соединение 14 может быть получено путем использования в аналогичной реакции соединения 78:
18,3 г соединения 78 растворяли в 183 мл сухого толуола и добавляли 36,6 мл раствора этилмагнийбромида (3M в диэтиловым эфире). Смесь перемешивали при 80°C в течение 16 часов, разбавляли с помощью THF, охлаждали до 5°C и останавливали реакцию путем добавления нескольких миллилитров этанола. Смесь фильтровали через целит, раствор испаряли досуха, и остаток помещали в 100 мл этанола. Добавляли порциями 4,15 г боргидрида натрия, и перемешивание продолжали в течение ночи. Смесь испаряли досуха, смесь помещали в дихлорметан и экстрагировали с помощью 2N HCl и рассола. Органический слой испаряли, остаток помещали в метилтретбутиловый эфир и экстрагировали несколько раз с помощью 2N HCl. Объединенные HCl слои доводили до pH 12 путем добавления 5N гидроксида натрия и экстрагировали с помощью дихлорметана. Дихлорметановый слой сушили над MgSO4 и испаряли с получением 13,0 г требуемого продукта.
цис-4-(1-Амино-1-метилэтил)-4-(4-фторфенил)циклогексанол (79)
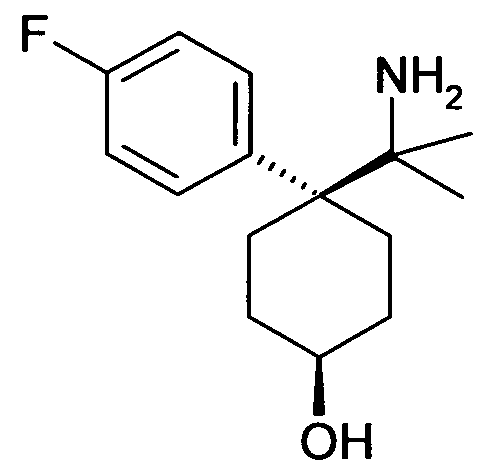
300 мг соединения 78 растворяли в 10 мл сухого диэтилового эфира. Затем добавляли 0,3 мл метилмагнийбромида (3M в диэтиловом эфире). Смесь охлаждали до 0°C, и добавляли 0,85 мл раствора метиллития (1,6 M). Через 1 час добавляли 255 мг изопропоксида титана(IV). Еще через 10 минут добавляли 1,4 мл раствора метиллития (1,6 M) в диэтиловом эфире. Смесь перемешивали в течение ночи. Затем медленно добавляли 5 мл 2N гидроксида натрия при 0°C, добавляли 30 мл метил-трет-бутилового эфира и слой NaOH экстрагировали несколько раз с помощью метил-трет-бутилового эфира. Объединенный органический слой сушили и испаряли. Полученный остаток растворяли в 5 мл метил-трет-бутилового эфира, охлаждали до 0°C и добавляли 5 мл 2N хлористоводородной кислоты. Перемешивание продолжали в течение ночи, эфирный слой снова экстрагировали с помощью 2N хлористоводородной кислоты, и объединенный водный слой охлаждали до 0°C и добавляли 4 мл 5N раствора гидроксида натрия. Водный слой экстрагировали несколько раз с помощью дихлорметана, объединенные дихлорметановые слои сушили и испаряли с получением 80 мг требуемого продукта. Rt=2,33 минуты (Метод 3). Обнаруженная масса: 217,2 (M+H+).
8-(4-Фторфенил)-1,4-диоксаспиро[4,5]декан-8-карбонитрил (15)
15 г 1-(4-Фторфенил)-4-оксоциклогексанкарбонитрила (12) растворяли в 500 мл толуола, затем добавляли 900 мг п-толуол- сульфоновой кислоты, и реакционную смесь нагревали в аппарате Дина-Старка в течение 6 часов. Смесь охлаждали до комнатной температуры и промывали дважды с помощью насыщенного водного раствора бикарбоната натрия и рассола, сушили над сульфатом магния и испаряли досуха с получением 17,9 г требуемого продукта. Rt=1,47 минуты (Метод 5). Обнаруженная масса: 262,2 (M+H+).
трет-Бутиловый эфир {1-[8-(4-Фторфенил)-1,4-диоксаспиро[4,5]дец-8-ил]бутил}карбаминовой кислоты (16)
1,5 г 8-(4-Фторфенил)-1,4-диоксаспиро[4,5]декан-8-карбонитрила (15) растворяли в 2,9 мл 2M раствора пропилмагний- хлорида в диэтиловом эфире. Смесь кипятили с обратным холодильником в течение ночи. Добавляли еще один эквивалент раствора пропилмагнийхлорида и продолжали нагревание в течение еще одного дня. Смесь разбавляли с помощью диэтилового эфира (в качестве варианта может быть использован THF) и добавляли минимальное количество насыщенного раствора сульфата натрия. Смесь фильтровали через целит, и осадок промывали с помощью диэтилового эфира. К объединенному органическому слою добавляли 490 мг боргидрида натрия и смесь перемешивали до тех пор, пока не завершалась реакция. Добавляли смесь 2N HCl, рассола и воды (1:3:6). Фазы разделяли, органический слой экстрагировали дважды с помощью смеси 2N HCl, рассола и воды (1:3:6). Объединенный водный слой доводили до щелочного значения pH путем добавления 2M раствор гидроксида натрия и экстрагировали дважды с помощью дихлорметана. Объединенный дихлорметановый слой промывали с помощью рассола и сушили над сульфатом натрия.
К дихлорметановому слою добавляли 5 мл триэтиламина и 5,86 г дитретбутилдикарбоната, и смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали с помощью 1N гидроксида натрия, смеси 2N хлористоводородной кислоты, рассола и воды (1:3:6) и рассола, сушили над сульфатом натрия и испаряли досуха. Неочищенный продукт очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 1,22 г требуемого продукта. Rt=5,18 минуты (Метод 3). Обнаруженная масса: 815,4 (2M+H+).
трет-Бутиловый эфир {1-[1-(4-Фторфенил)-4-оксоциклогексил]бутил}карбаминовой кислоты (17)
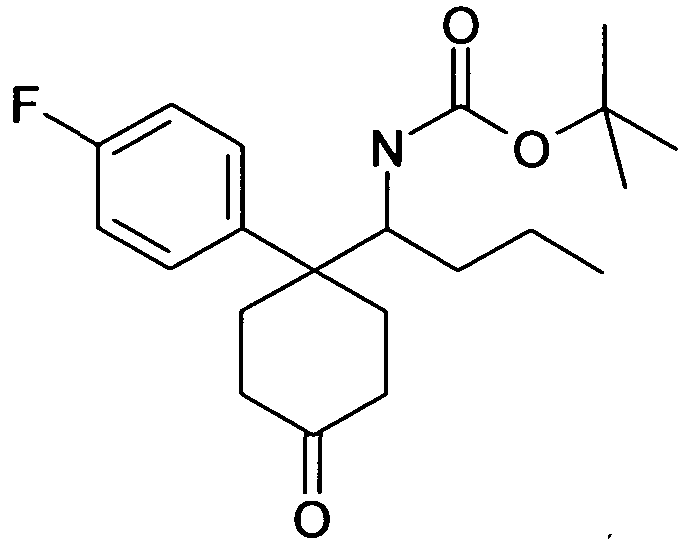
1,22 г {1-[8-(4-фторфенил)-1,4-диоксаспиро[4,5]дец-8-ил]-бутил}карбаминовой кислоты трет-бутиловый эфир (16) растворяли в 42 мл ацетона, и добавляли 3 мл 1N хлористоводородной кислоты. Смесь перемешивали при комнатной температуре до тех пор, пока не заканчивалась реакция. Добавляли 40 мл насыщенного водного раствора бикарбоната натрия, и реакционную смесь три раза экстрагировали с помощью этилацетата. Объединенный органический слой экстрагировали с помощью рассола, сушили над сульфатом натрия и испаряли досуха с получением 966 мг неочищенного соединения (17), которое очищали в достаточной степени для дальнейшего превращения. Rt=1,72 минуты (Метод 5). Обнаруженная масса: 308,2 (м-Изобутен+H+).
трет-Бутиловый эфир транс-{1-[1-(4-Фторфенил)-4-гидроксициклогексил]бутил}карбаминовой кислоты (18)
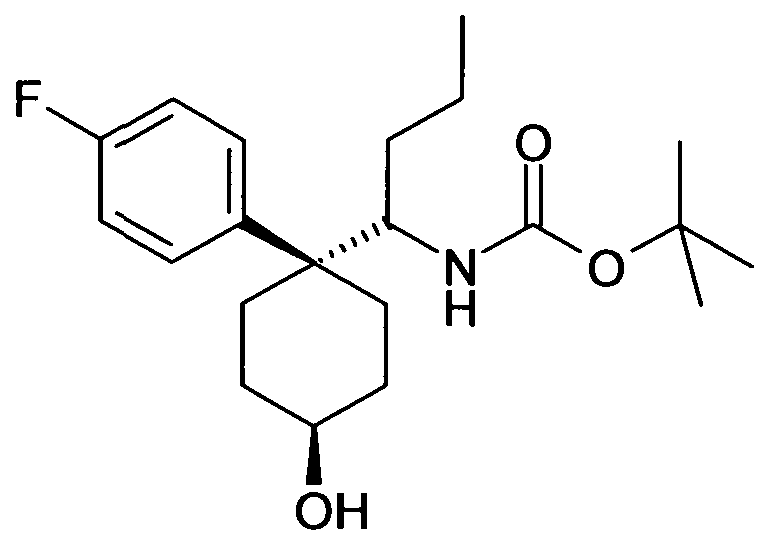
0,97 г трет-Бутилового эфира {1-[1-(4-Фторфенил)-4-оксоциклогексил]бутил}карбаминовой кислоты (17) растворяли в 14 мл этанола, и добавляли 119 мг боргидрида натрия при -20°C. Смесь подогревали до комнатной температуры и перемешивали в течение ночи. Смесь испаряли, остаток растворяли в этилацетате и промывали дважды с помощью 2N хлористоводородной кислоты и один раз с помощью рассола. Органический слой сушили над сульфатом натрия и испаряли досуха с получением неочищенного продукта, который очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 619 мг соединения (18). Rt=3,46 минуты (Метод 1). Обнаруженная масса: 366,3 (M+H+).
транс-4-(1-Аминобутил)-4-(4-фторфенил)циклогексанол (19)
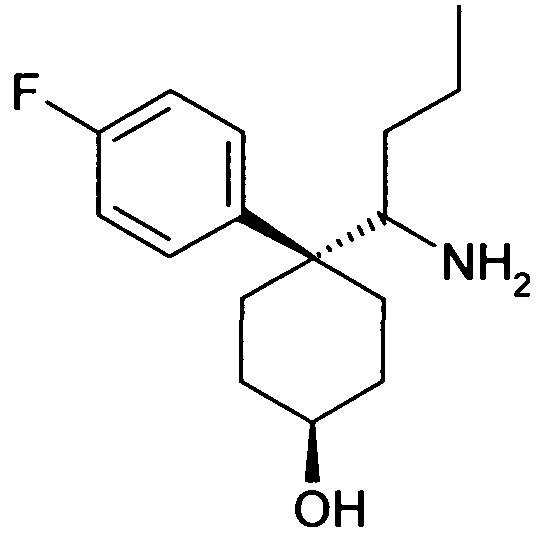
619 мг трет-бутилового эфира транс-{1-[1-(4-Фторфенил)-4-гидроксициклогексил]бутил}карбаминовой кислоты (18) растворяли в 2 мл изопропанола, и добавляли 2 мл 2N водной хлористоводородной кислоты. Смесь перемешивали в течение ночи. Добавляли воду, и удаляли под вакуумом изопропанол. Остаток помещали в воду и лиофилизировали два раза с получением 1,64 г соединения (19) в виде гидрохлорида.
Rt=2,27 минуты (Метод 1). Обнаруженная масса: 266,2 (M+H+).
трет-Бутиловый эфир [1-метил-1-(4-оксоциклогексил)этил]карбаминовой кислоты (20)
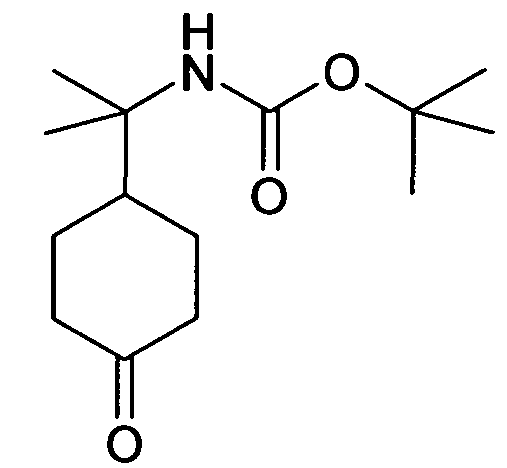
Суспензию производимого в промышленности безводного хлорида церия (ABCR, 8,8 г) в безводном THF (62 мл) нагревали в течение 4 часов при 60°C при интенсивном перемешивании. Суспензию охлаждали до комнатной температуры и обрабатывали с помощью 3 г циклического этиленацеталя 4-цианоциклогексанона. После охлаждения до -20°C, добавляли по каплям 35 мл 1,5 M раствора MeLi.LiBr в диэтиловом эфире. Смесь перемешивали в течение 1 часа при -10°C, затем добавляли 20 мл THF, и реакцию прерывали путем добавления концентрированного NH4OH (10 мл) в течение 10 минут. Смесь подогревали до комнатной температуры, перемешивали в течение 30 минут, разбавляли с помощью метил-трет-бутилового эфира и затем фильтровали. Осадок на фильтре споласкивали несколько раз с помощью метил-трет-бутилового эфира. Затем объединенные фильтраты концентрировали в вакууме.
Неочищенный продукт растворяли в дихлорметане и экстрагировали дважды с помощью 0,1N HCl. Объединенные HCl слои промывали с помощью дихлорметана, охлаждали и доводили значение pH до 12 путем добавления 5N раствора гидроксида натрия. Водный слой дважды экстрагировали с помощью дихлорметана. Дихлорметановые слои объединяли, промывали с помощью рассола, и сушили над сульфатом натрия.
Добавляли 1,82 г триэтиламина и 2,74 г дитретбутилдикарбоната. Смесь перемешивали в течение двух дней при комнатной температуре, промывали с помощью 1N раствора гидроксида натрия, дважды с помощью 0,1 N хлористоводородной кислоты и воды, и один раз с помощью рассола, сушили над сульфатом натрия и испаряли досуха с получением 3,0 г неочищенного продукта.
Неочищенный продукт растворяли в 100 мл ацетона и добавляли 10 мл 1N HCl и перемешивали при комнатной температуре. Добавляли дополнительное количество HCl, и перемешивание продолжали до тех пор, пока не заканчивалась реакция. Добавляли раствор гидроксида натрия и метил-трет-бутиловый эфир, водный слой отделяли и экстрагировали с помощью метил-трет-бутилового эфира. Объединенные эфирные слои сушили над сульфатом натрия и испаряли досуха с получением 2,4 г соединения (20). Rt=3,08 минуты (Метод 1). Обнаруженная масса: 256,2 (M+H+).
трет-Бутиловый эфир [1-метил-1-(4-гидроксициклогексил)этил]карбаминовой кислоты (21)
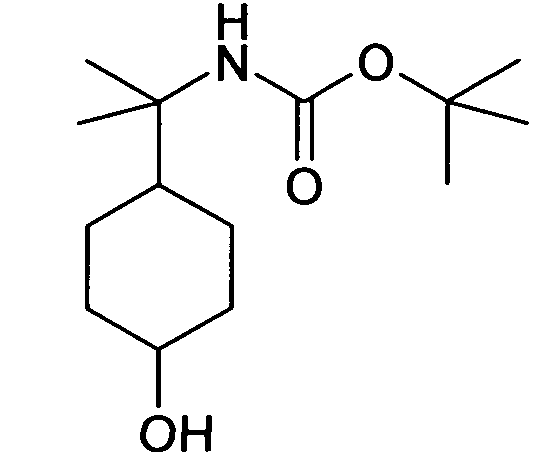
2,91 г трет-бутилового эфира [1-метил-1-(4-оксоциклогексил)этил]карбаминовой кислоты (20) растворяли в 60 мл этанола, и добавляли 473 мг боргидрида натрия при -20°C. Смесь подогревали до комнатной температуры и перемешивали в течение 3,5 часов. Смесь испаряли, остаток растворяли в этилацетате и промывали дважды с помощью 2N хлористоводородной кислоты и один раз с помощью рассола. Органический слой сушили над сульфатом натрия и испаряли досуха с получением 2,74 г соединения (21). Rt=1,27 минуты (Метод 5). Обнаруженная масса: 194 (M-изобутен-H2O+H+).
4-(1-Амино-1-метилэтил)циклогексанол (22)
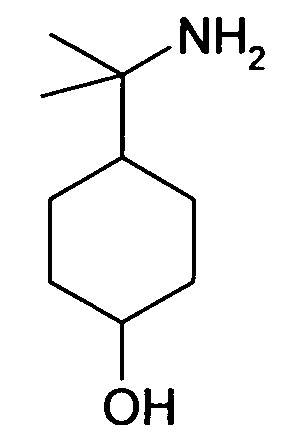
580 мг трет-бутилового эфира [1-метил-1-(4-гидроксициклогексил)этил]карбаминовой кислоты (21) растворяли в 10 мл изопропанола, и добавляли 10 мл 2N хлористоводородной кислоты. Смесь перемешивали в течение ночи. Добавляли воду, и удаляли изопропанол под вакуумом. Остаток помещали в воду и лиофилизировали еще два раза из воды с получением 515 мг соединения (22) в виде гидрохлорида.
Rt=0,18 минуты (Метод 5). Обнаруженная масса: 158,2 (M+H+).
Пример 1: цис-6-[4-(1-Аминопропил)-4-(4-фторфенил)-циклогексилокси]-7-хлор-2H-изохинолин-1-он
a) цис-1-[4-(7-Хлор-1-метоксиизохинолин-6-илокси)-1-(4-фторфенил)циклогексил]пропиламин (23)
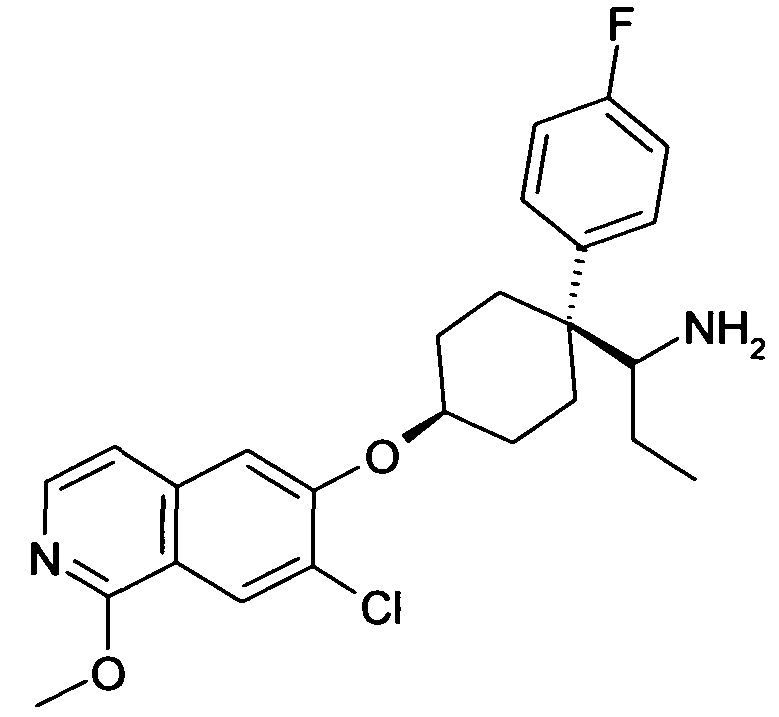
В атмосфере аргона 1,7 г цис-4-(1-аминопропил)-4-(4-фторфенил)циклогексанола (14) растворяли в 50 мл сухого диметилацетамида. Добавляли порциями при охлаждении 513 мг гидрида натрия (95%), и смесь перемешивали в течение 10 минут. Добавляли 1,57 г 7-хлор-6-фтор-1-метоксиизохинолин (10), и смесь нагревали при 50°C в течение 3 часов. Перемешивание продолжали в течение ночи при комнатной температуре. Реакционную смесь охлаждали на ледяной бане, и осторожно добавляли 50 мл воды. Смесь экстрагировали четыре раза с помощью смеси дихлорметан:изопропанол (3:1), и объединенный органический слой промывали три раза с помощью воды и один раз с помощью рассола, сушили над сульфатом натрия и испаряли досуха. Добавляли воду, и смесь лиофилизировали. Неочищенный продукт подвергали хроматографии на силикагеле (дихлорметан:метанол) с получением 1,66 г требуемого продукта. Rt=3,45 минуты (Метод 1). Обнаруженная масса: 443,2 (M+H+).
b) цис-6-[4-(1-Аминопропил)-4-(4-фторфенил)циклогексил-окси]-7-хлор-2H-изохинолин-1-он (пример 1)
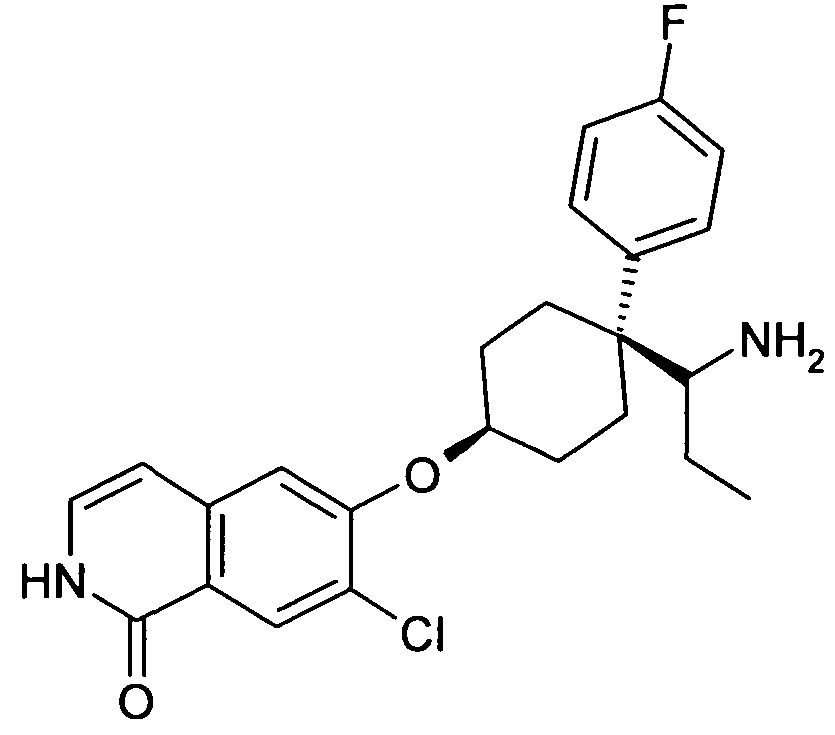
1,66 г цис-1-[4-(7-Хлор-1-метоксиизохинолин-6-илокси)-1-(4-фторфенил)циклогексил]пропиламина (23) растворяли в 16 мл смеси изопропанола и 1N хлористоводородной кислоты (1:1) и нагревали в микроволновой печи в течение 20 минут при 120°C. Добавляли воду, удаляли под вакуумом изопропанол, и оставшийся раствор лиофилизировали. Остаток помещали в воду и лиофилизировали еще два раза из воды с получением 1,64 г требуемого продукта примера 1 в виде гидрохлорида. Rt=2,67 минуты (Метод 1). Обнаруженная масса: 429,2 (M+H+).
Пример 2: цис-6-[4-(1-Аминоциклопропил)-4-фенилцикло-гексилокси]-7-хлор-2H-изохинолин-1-он
a) цис-1-[4-(1-Бензилокси-7-хлоризохинолин-6-илокси)-1-фенилциклогексил]циклопропиламин (24)
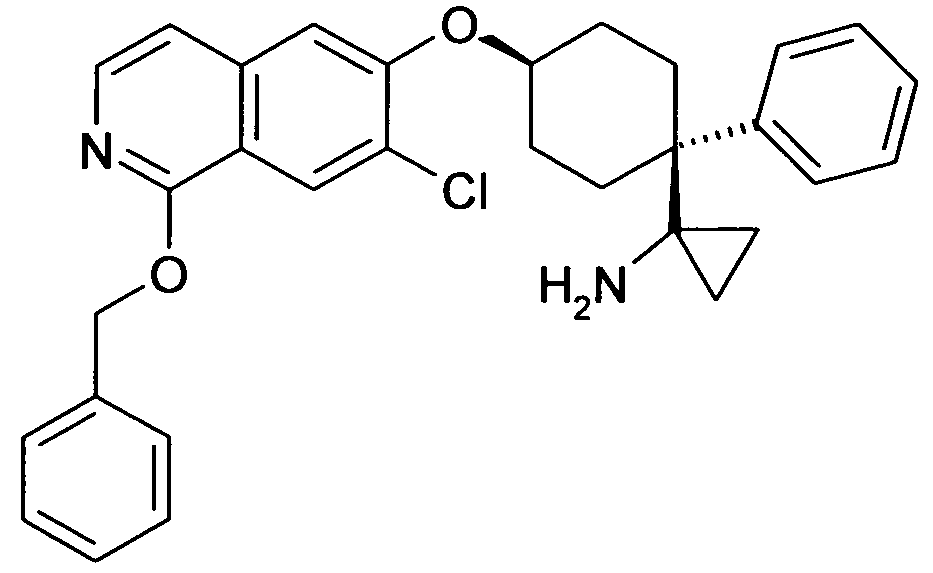
К раствору сухого цис-4-(1-аминоциклопропил)-4-фенилциклогексанола (4, 0,2 г, 0,75 ммоль) в безводном N,N-диметилацетамиде (5 мл) при 0°C добавляли порциями гидрид натрия (60% в минеральном масле, 0,12 г, 3 ммоль). Реакционную смесь перемешивали в течение 10 минут при комнатной температуре, затем добавляли 1-(бензилокси)-7-хлор-6-фторизохинолин (38, 0,28 г, 0,97 ммоль) и перемешивание продолжали в течение ночи. Суспензию выливали на лед, полученный осадок отфильтровали и сушили. Неочищенный продукт очищали с помощью хроматографии на силикагеле (элюируя с помощью смеси от 0 до 5% метанола в дихлорметане, содержащем 1% аммиака) с получением 0,252 г требуемого продукта. Rt=6,21 минуты (Метод 9). Обнаруженная масса: 499 (M+H+).
b) цис-6-[4-(1-Аминоциклопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он (пример 2)
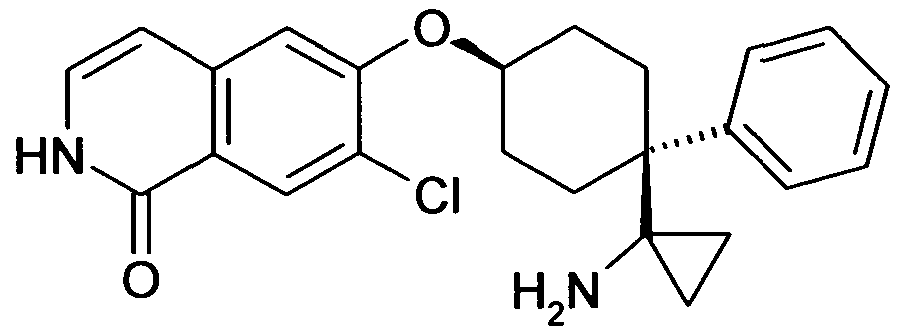
К раствору цис-1-[4-[[7-хлор-1-(фенилметокси)-6-изохинолин-ил]окси]-1-фенилциклогексил]циклопропанамина (24, 0,24 г, 0,48 ммоль) в изопропаноле (2,5 мл) добавляли водный раствор 4N хлористоводородной кислоты (2,5 мл, 10 ммоль), затем 2,5 мл изопропанола, 2,5 мл 4N водной хлористоводородной кислоты (10 ммоль) и, наконец, 2,5 мл метанола. Полученную суспензию перемешивали в течение ночи, испаряли при пониженном давлении и совместно испаряли со смесью метанол/толуол. Неочищенный продукт растирали со смесью метанол/диэтиловый эфир с получением 0,18 г названного соединения в виде его гидрохлорида. Rt=4,83 минуты (Метод 9). Обнаруженная масса: 409 (M+H+).
Пример 3: цис-6-{[4-(1-аминопропил)-4-фенилциклогексил]-окси}-7-хлор-2H-изохинолин-1-он
a) цис-1-(4-{[1-(бензилокси)-7-хлоризохинолин-6-ил]окси}-фенилциклогексил)пропанамин (25)
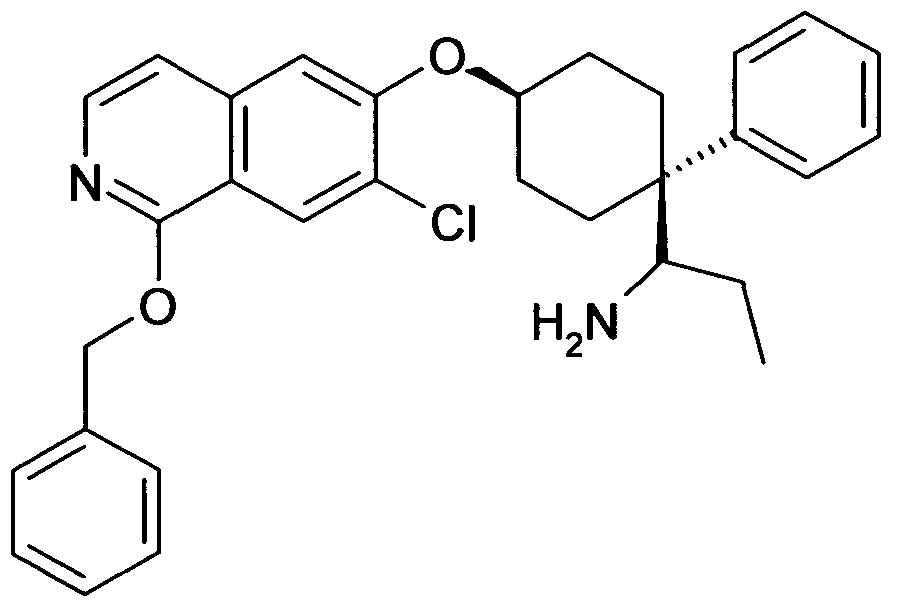
К раствору цис-4-(1-аминопропил)-4-фенилциклогексанола (6, 0,39 г, 1,48 ммоль) в безводном N,N-диметилацетамиде (10 мл) добавляли порциями гидрид натрия (60% в минеральном масле, 0,24 г, 5,92 ммоль). Реакционную смесь перемешивали в течение 10 минут при комнатной температуре, затем добавляли 1-(бензилокси)-7-хлор-6-фторизохинолин (38, 0,42 г, 1,48 ммоль), и продолжали перемешивание в течение 72 часов. Суспензию выливали на лед, полученный водный слой экстрагировали с помощью хлороформа. Органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на силикагеле (элюируя с помощью смеси от 0 до 10% метанола в дихлорметане) с получением 0,604 г цис-1-(4-{[1-(бензилокси)-7-хлоризохинолин-6-ил]окси}-1-фенил-циклогексил)пропанамина (25). Rt=4,18 минуты (Метод 8). Обнаруженная масса: 501 (M+H+).
b) цис-6-{[4-(1-аминопропил)-4-фенилциклогексил]окси}-7-хлор-2H-изохинолин-1-он (пример 3)
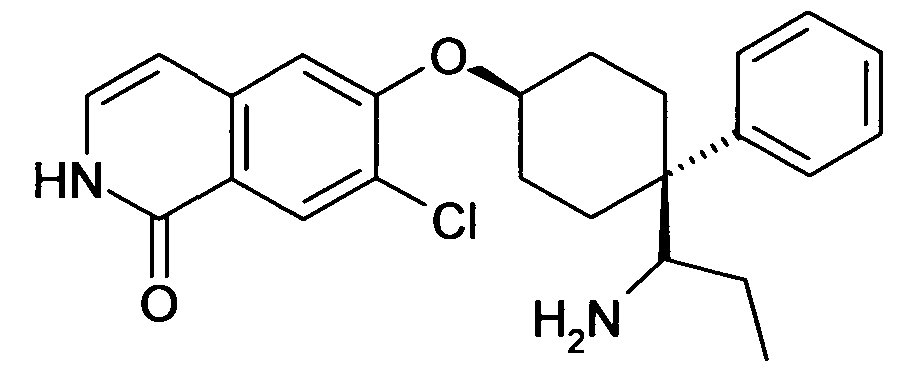
К раствору цис-1-(4-{[1-(бензилокси)-7-хлоризохинолин-6-ил]окси}-1-фенилциклогексил)пропанамина (25, 0,604 г, 1,21 ммоль) в изопропаноле (6,3 мл) добавляли водный раствор 1N хлористоводородной кислоты (7 мл, 7 ммоль). Полученную суспензию перемешивали в течение ночи и испаряли при пониженном давлении. Неочищенный продукт очищали с помощью колонной хроматографии с обращенной фазой (элюируя с помощью смеси от 0 до 30% CH3CN в воде) с получением названного соединения (0,32 г). Rt=5,00 минуты (Метод 9). Обнаруженная масса: 411 (M+H+).
Следующие примеры осуществляли таким же образом, как описанный пример 1, исходя из соответствующим образом защищенных изохинолинонов и соответствующего аминоспирта. Аминоспирты синтезировали из соответствующих бензонитрилов и реактивов Гриньяра: транс-аминоспирты получали таким же образом, как это описано для последовательности реакций получения соединения (19), цис-аминоспирты получали таким же образом, как это описано для последовательности реакций получения соединения (14). Диметилированные аминоспирты получали таким образом, как это описано для соединения (22). Все описанные продукты получали в виде гидрохлоридных солей.
|
Пример 33: цис-6-[4-(1-Аминопропил)-4-фенилциклогексил-окси]-4-бром-7-хлор-2H-изохинолин-1-он
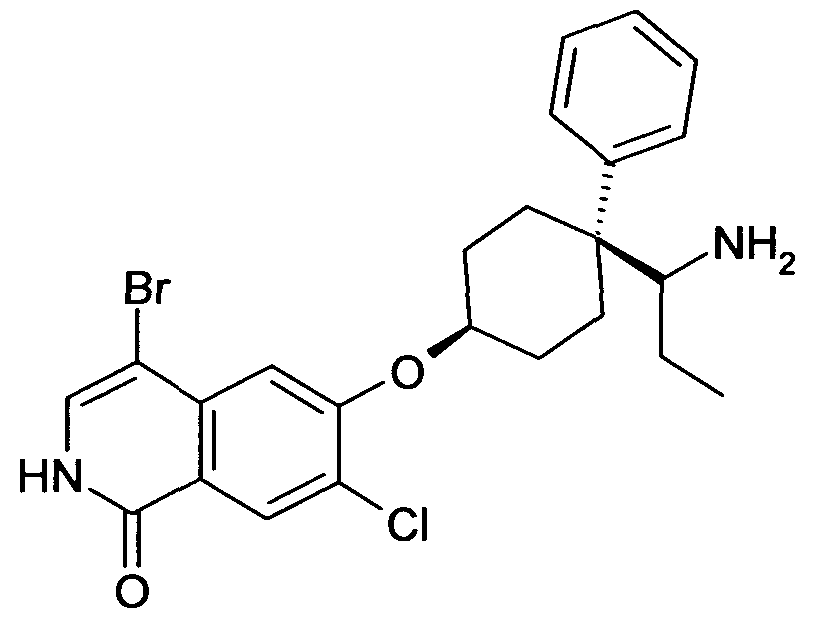
100 мг соединения примера 3 растворяли в 3 мл хлороформа. Добавляли 100 мкл триэтиламина и 268 мкл 1M раствора брома в хлороформе. Реакционную смесь перемешивали при комнатной температуре до тех пор, пока не заканчивалась реакция. Реакцию останавливали путем добавления 11 мл насыщенного раствора тиосульфата натрия. Добавляли 5 мл 2N раствора гидроксида натрия, и водный слой экстрагировали три раза с помощью смеси дихлорметан:изопропанол (3:1). Объединенный органический слой промывали с помощью 2N NaOH и рассола, сушили над сульфатом натрия и испаряли. Смесь очищали с помощью ВЭЖХ, и полученный продукт растворяли в 1 мл смеси изопропанол:1N HCl и нагревали в микроволновой печи в течение 20 минут при 100°C. Смесь испаряли досуха, помещали в воду и лиофилизировали с получением 29 мг требуемого продукта в виде гидрохлорида. Rt=2,77 минуты (Метод 1). Обнаруженная масса: 491,1 (M+H+).
трет-Бутиловый эфир цис-{1-[1-(4-бромфенил)-4-(7-хлор-1-оксо-1,2-дигидро-изохинолин-6-илокси)циклогексил]пропил}-карбаминовой кислоты (81)
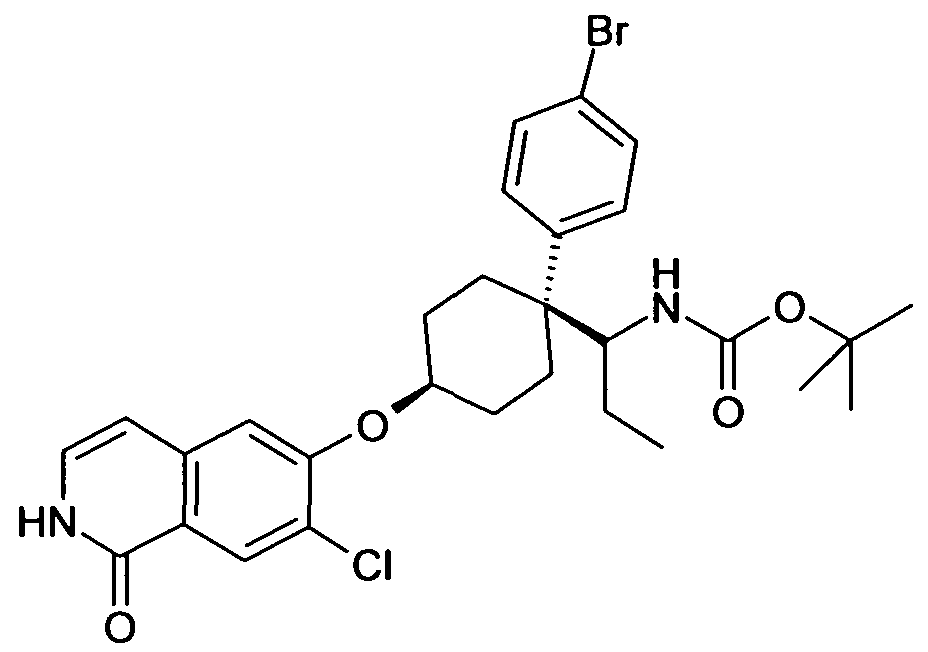
1,11 г соединения примера 6 растворяли в 100 мл сухого дихлорметана. Добавляли 1,2 мл триэтиламина и 1,44 г ди-трет-бутилдикарбоната. После завершения реакции, смесь экстрагировали с помощью 1N раствора гидроксида натрия, 0,2 N хлористоводородной кислоты, воды и рассола, сушили и испаряли. Неочищенный продукт очищали с помощью фильтрации на силикагеле с получением 886 мг требуемого продукта. Rt=4,00 минуты (Метод 1). Обнаруженная масса : 533,0 (M+H-изобутен+).
Пример 97: цис-4-[1-(1-Аминопропил)-4-(7-хлор-1-оксо-1,2-дигидроизохинолин-6-илокси)циклогексил]бензонитрил
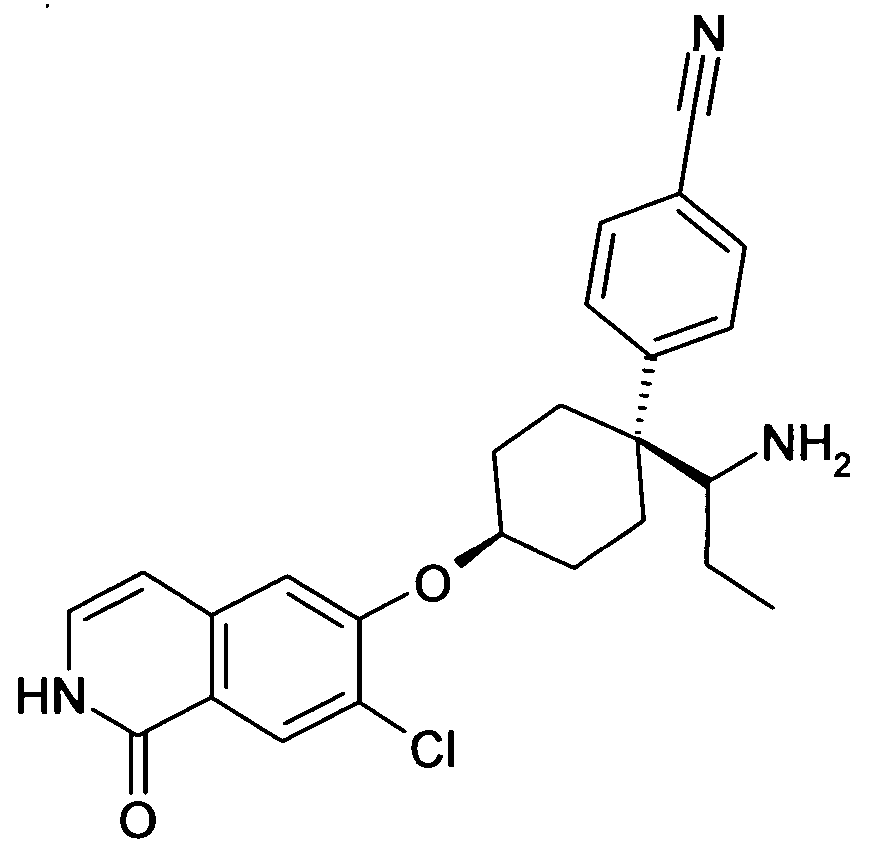
200 мг соединения 81 растворяли в 10 мл дегазированного диметилформамида и добавляли в атмосфере аргона 50 мг цианида цинка и 18 мг тетракис(трифенилфосфин)палладия(0). Смесь нагревали в микроволновой печи в течение 30 минут при 150°C. Смесь разбавляли с помощью метил-трет-бутилового эфира и фильтровали через целит. Органический слой промывали дважды с помощью воды и один раз с помощью рассола, сушили над сульфатом натрия и испаряли досуха. Неочищенный продукт очищали с помощью хроматографии на силикагеле и затем помещали в 2 мл изопропанола и 2 мл 1N хлористоводородной кислоты и нагревали в микроволновой печи при 100°C в течение 1 часа. Добавляли воду, и смесь лиофилизировали. Остаток помещали в воду и опять лиофилизировали с получением 65 мг требуемого продукта в виде гидрохлорида.
Rt=2,55 минуты (Метод 2). Обнаруженная масса: 436,2 (M+H+).
Пример 98: цис-3-[1-(1-Аминопропил)-4-(7-хлор-1-оксо-1,2-дигидроизохинолин-6-илокси)циклогексил]бензонитрил
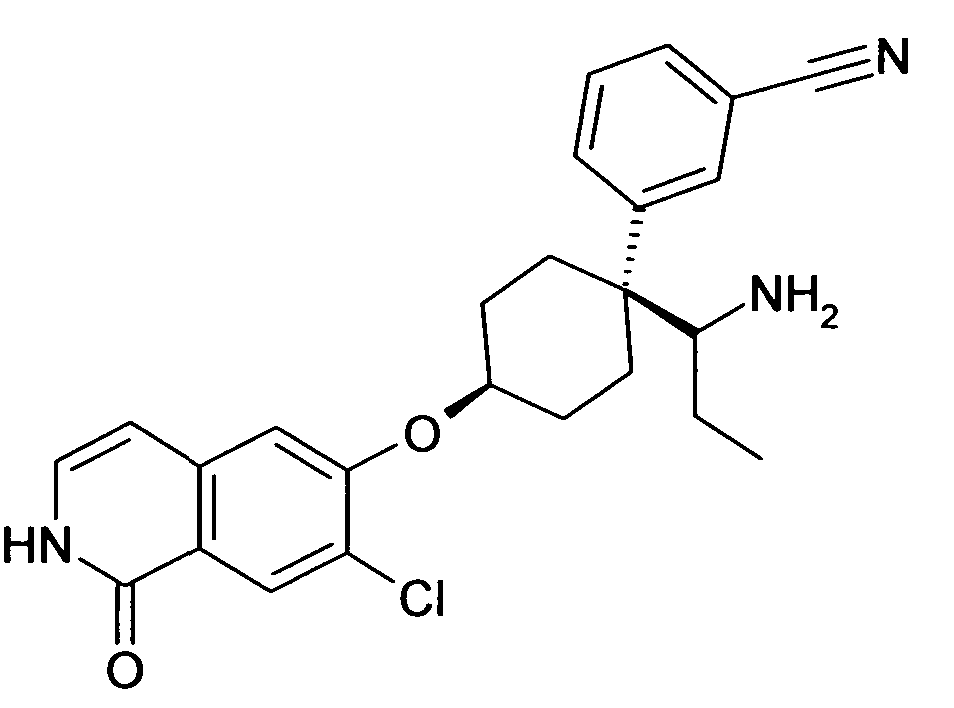
Соединение примера 98 может быть получено, следуя такой же последовательности реакций, которую использовали для синтеза соединения примера 97, исходя из соединения примера 16. Rt=2,98 минуты (Метод 3). Обнаруженная масса: 436,2 (M+H+).
Пример 99: 6-[цис-4-(1-Аминопропил)-4-(3-метансульфонил-фенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он
a) трет-бутиловый эфир цис-{1-[4-(7-Хлор-1-оксо-1,2-дигидроизохинолин-6-ил-окси)-1-(3-метансульфонилфенил)циклогексил]пропилкарбаминовой кислоты (82)
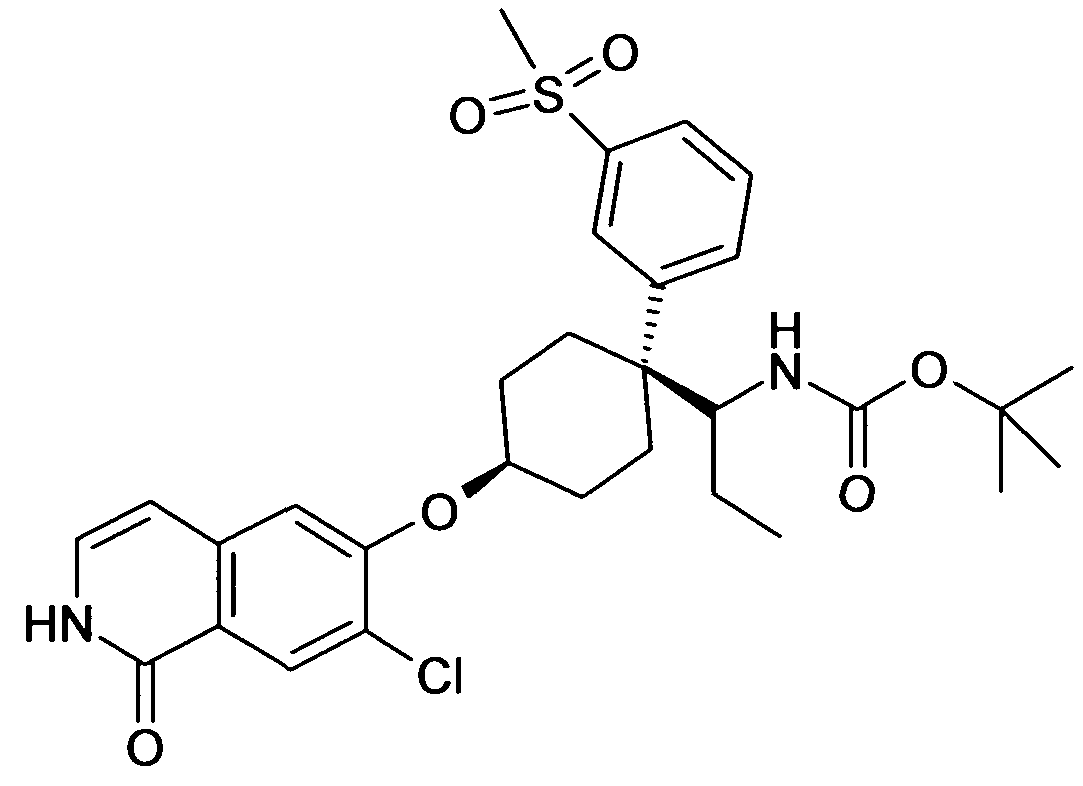
330 мг (559 мкмоль) трет-бутилового эфира цис-{1-[1-(3-Бромфенил)-4-(7-хлор-1-оксо-1,2-дигидроизохинолин-6-илокси)циклогексил]пропил}карбаминовой кислоты (полученного в примере 29, описанного для синтеза соединения 81), 213 мг (1,1 ммоль) CuI и 114 мг (1,1 ммоль) натриевой соли метансульфиновой кислоты растворяли в 10 мл безводного NMP. Смесь перемешивали при 150°C в течение 1 часа при микроволновом облучении, затем выливали в 100 мл насыщенного водного раствора NaHCO3 и экстрагировали три раза, используя каждый раз по 30 мл этилацетата. Затем органический слой промывали пять раз, используя каждый раз по 20 мл воды, сушили над MgSO4, фильтровали, и удаляли растворитель при пониженном давлении. Флэш-хроматография с использованием этилацетата давала 143 мг соединения 82 в виде вязкого масла. Rf (этилацетат): 0,33
b) Пример 99: цис-6-[4-(1-Аминопропил)-4-(3-метансульфонил-фенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он
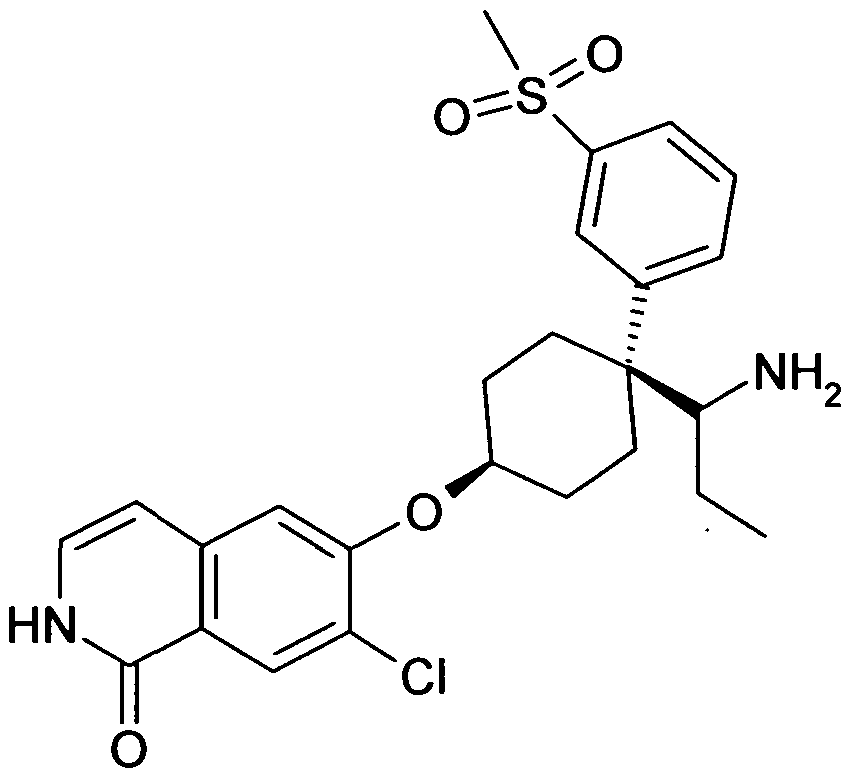
140 мг (238 мкмоль) цис-{1-[4-(7-Хлор-1-оксо-1,2-дигидро-изохинолин-6-илокси)-1-(3-метансульфонилфенил)циклогексил]-пропилкарбаминовой кислоты трет-бутилового эфира (82) растворяли в 3 мл изопропанола и добавляли 3 мл 2N водного раствора HCl. Смесь перемешивали в течение 20 часов при температуре окружающей среды, разбавляли с помощью 30 мл воды и лиофилизировали с получением 120 мг соединения 99 в виде его гидрохлорида в виде аморфного твердого вещества. Rt=0,66 минуты (Метод 18). Обнаруженная масса: 489,2 (M+H+).
Пример 100: 6-[(1S,4S,5S)-5-(1-Аминопропил)-5-фенил-бицикло[2.2.1]гепт-2-илокси]-7-хлор-2H-изохинолин-1-он
a) 5-оксобицикло[2.2.1]гептан-2-карбонитрила этиленкеталь (83)
9,0 г (71 ммоль) 2-циклопен-1-она этиленкеталя, 11,4 г (214 ммоль) акрилонитрила и 150 мг (1,4 ммоль) гидрохинона смешивали и нагревали до 150°C в течение 1 часа при микроволновом облучении. Избыток акрилонитрила удаляли при пониженном давлении, и остаток растворяли в 150 мл диэтилового эфира. Этот раствор промывали три раза, используя каждый раз по 50 мл насыщенного водного раствора Na2CO3, сушили над MgSO4 и испаряли. Полученное масло растворяли в 200 мл циклогексана и 100 мл диэтилового эфира, промывали три раза, используя по 50 мл 0,1 N водного раствора NaOH, и дважды, используя по 100 мл насыщенного водного раствора NaCl. Органический слой сушили над MgSO-4, фильтровали и растворитель испаряли с получением 7,3 г соединения 83 в виде бесцветного масла.
b) (1S,2S,4S)-5-оксо-2-фенилбицикло[2.2.1]гептан-2-карбонитрила этиленкеталь и (1R,2R,4R)-5-оксо-2-фенил-бицикло[2.2.1]гептан-2-карбонитрила этиленкеталь(84 и 85)
 и
и 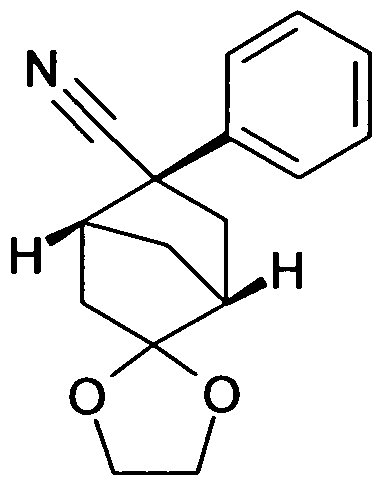
7,5 г (42 ммоль) 5-оксобицикло[2.2.1]гептан-2-карбонитрила этиленкеталя (83) и 4,4 г (46 ммоль) фторбензола растворяли в 10 мл безводного толуола. Смесь перемешивали при 65°C в течение 20 часов, затем выливали в 300 мл насыщенного водного раствора NaHCO3, и дважды экстрагировали, используя каждый раз по 100 мл этилацетата. Органический слой сушили над MgSO4 и испаряли. Хроматография с обращенной фазой (ацетонитрил/вода) давала 3,4 г рацемической смеси в виде единственного диастереомера в виде бесцветного масла.
Хроматография с хиральной фазой (Chiralpak AD-H, 250×4,6 мм) с использованием смеси н-гептан:2-пропанол:метанол 5:1:1 давала 1,4 г соединения 84 (Rt=7,4 минуты) и 1,4 г соединения 85 (Rt=9,3 минуты). Rt=1,44 минуты (Метод 5). Обнаруженная масса: 256,3 (M+H+).
Абсолютную стереохимию указывали произвольно.
c) (1S,2S,4S)-5-оксо-2-фенилбицикло[2.2.1]гептан-2-карбонитрил (86)
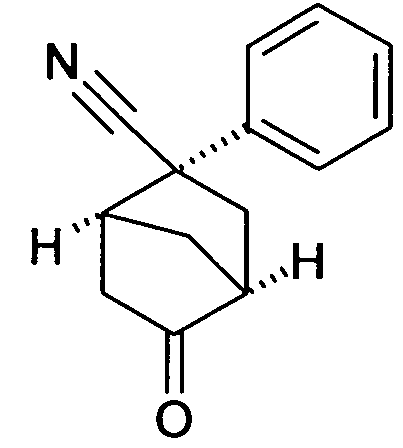
1,3 г (1S,2S,4S)-5-оксо-2-фенилбицикло[2.2.1]гептан-2-карбонитрила этиленкеталя (84) растворяли в смеси 30 мл THF и 30 мл 5% водного раствора HCl и выдерживали при температуре окружающей среды в течение 30 часов. Смесь разбавляли с помощью 100 мл насыщенного водного раствора NaCl и 100 мл этилацетата. После разделения, водный слой экстрагировали дважды, используя каждый раз по 50 мл этилацетат. Органический слой сушили над MgSO4 и испаряли с получением 1,2 г соединения (86) в виде бесцветного масла.
[α]D=+5,6° (c=0,013 в метаноле), Rt=1,27 минуты (Метод 5).
d) (1S,2S,4S)-5-Гидрокси-2-фенилбицикло[2.2.1]гептан-2-карбонитрил (87)
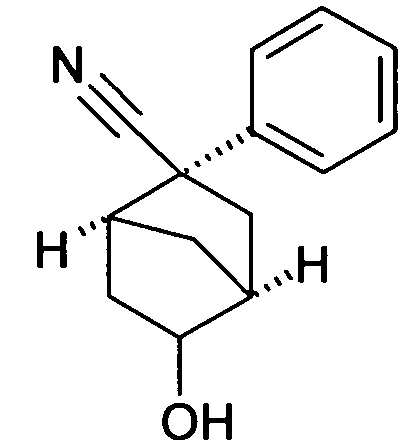
0,9 г (4,3 ммоль) (1S,2S,4S)-5-оксо-2-фенилбицикло-[2.2.1]гептан-2-карбонитрила (86) растворяли в 20 мл этанола, и добавляли 161 мг (4,3 ммоль) NaBH4 при -70°C. Смесь перемешивали при температуре окружающей среды в течение 1 часа, добавляли 100 мл насыщенного водного раствора NaCl и доводили pH до значения 2-3 с помощью водного раствора HCl. Смесь экстрагировали три раза, используя каждый раз по 50 мл этилацетата. Органический слой сушили над MgSO4 и испаряли с получением 0,9 г соединения (87) в форме единственного диастереомера в виде бесцветного масла. Rt=0,76 минуты (Метод 18). Обнаруженная масса: 214,1 (M+H+).
e) (1S,2S,4S)-5-(трет-Бутилдиметилсиланилокси)-2-фенил-бицикло[2.2.1]гептан-2-карбонитрил (88)
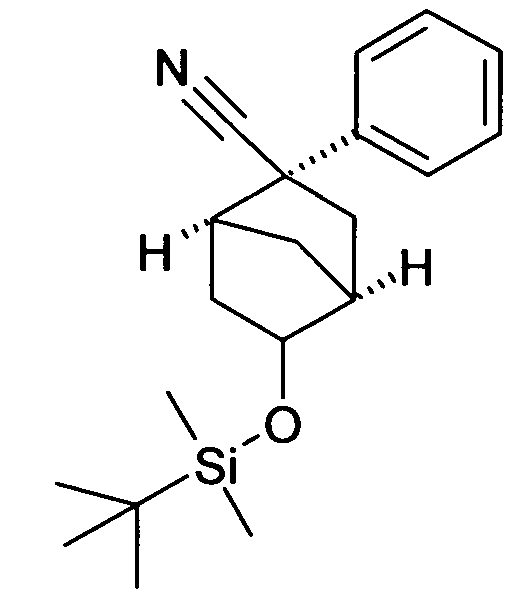
0,9 г (4,2 ммоль) (1S,2S,4S)-5-Гидрокси-2-фенил-бицикло[2.2.1]гептан-2-карбонитрила (87) и 1,1 г (10,6 ммоль) 2,6-лутидина растворяли в 40 мл дихлорметана. Добавляли при -10°C 1,3 г (5,1 ммоль) трет-бутилдиметилсилилтрифторметан-сульфоната. Смесь перемешивали при температуре окружающей среды в течение 17 часов. Затем добавляли при -10°C еще 500 мг 2,6-лутидина и 600 мг трет-бутилдиметилсилилтрифторметан- сульфоната, и смесь перемешивали при температуре окружающей среды в течение 48 часов. Затем добавляли при -10°C еще 1,1 г 2,6-лутидина и 1,3 г трет-бутилдиметилсилилтрифторметан-сульфоната, и смесь перемешивали при температуре окружающей среды в течение 24 часов. Смесь испаряли, остаток растворяли в 100 мл этилацетата и промывали три раза, используя каждый раз по 50 мл насыщенного водного раствора Na2CO3, три раза, используя каждый раз по 50 мл 0,5 N водного раствора HCl, и, наконец, один раз 50 мл насыщенного водного раствора Na2CO3. Органический слой сушили с помощью смеси MgSO4 и K2CO3, фильтровали и испаряли. Флэш-хроматография на силикагели с использованием смеси этилацетат/н-гептан 1:2 давала 970 мг соединения (88) в виде бесцветного масла. Rf (этилацетат/n-гептан 1:2)=0,8. Rt=1,32 минуты (Метод 18).
f) (1S,4S,5S)-5-(1-Аминопропил)-5-фенилбицикло[2.2.1]-гептан-2-ол (89)
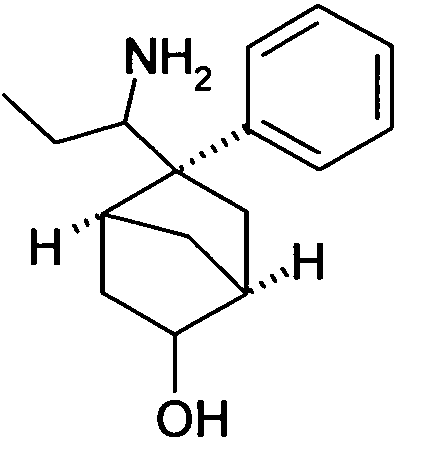
930 мг (2,8 ммоль) (1S,2S,4S)-5-(трет-Бутилдиметил-силанилокси)-2-фенилбицикло[2.2.1]гептан-2-карбонитрила (88) растворяли в 10 мл безводного толуола. Затем добавляли 5,7 мл 1M раствора этилмагнийбромида в THF, и смесь кипятили с обратным холодильником в течение 12 часов. Смесь затем обрабатывали с помощью 3 мл этанола и испаряли. Остаток растворяли в 20 мл этанола, и добавляли 215 мг (5,7 ммоль) NaBH4. Смесь перемешивали при температуре окружающей среды в течение 3 часов и затем испаряли. Остаток растворяли в 100 мл воды, доводили pH до значения 3 с помощью водного раствора HCl для удаления избытка NaBH4 и затем корректировали до pH=12 с помощью насыщенного водного раствора Na2CO3. Смесь экстрагировали три раза, используя каждый раз по 30 мл третбутилметилового эфира. Затем органический слой дважды экстрагировали, используя каждый раз по 20 мл 1N водного раствора HCl, водный слой доводили до pH>11 с помощью насыщенного водного раствора Na2CO3 и экстрагировали три раза, используя каждый раз по 30 мл трет-бутилметилового эфира. Органический слой сушили над MgSO4 и испаряли, получая 200 мг требуемого продукта 89, используемого без дополнительной очистки. Rt=0,58 минуты (Метод 18).
g) 1-[(1S,2S,4S)-5-(7-Хлор-1-метоксиизохинолин-6-илокси)-2-фенилбицикло[2.2.1]гепт-2-ил]пропиламин (90)
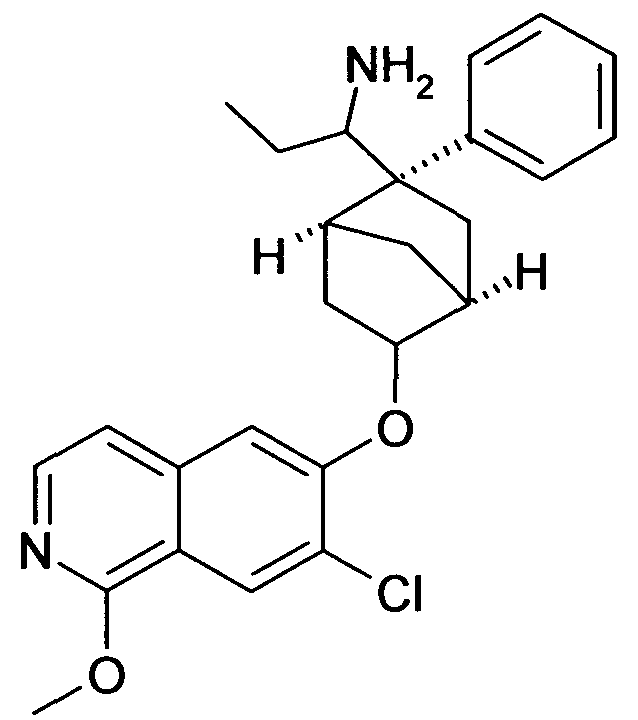
200 мг (0,82 ммоль) (1S,4S,5S)-5-(1-Аминопропил)-5-фенил-бицикло[2.2.1]гептан-2-ол (89) растворяли в 5 мл безводного диметилацетамида. Затем добавляли 39 мг (1,63 ммоль) NaH, затем добавляли 173 мг (0,82 ммоль) 7-хлор-6-фтор-1-метоксиизохинолина (10). Смесь перемешивали при температуре окружающей среды в течение 20 часов. Затем добавляли 50 мл насыщенного водного раствора NaHCO3, и смесь экстрагировали три раза, используя каждый раз по 30 мл этилацетата. Органический слой сушили над MgSO4 и испаряли. Остаток очищали с помощью хроматографии с обращенной фазой (ацетонитрил/вода). Содержащие продукт фракции испаряли до половины исходного объема, добавляли 10 мл насыщенного водного раствора Na2CO3, и смесь экстрагировали три раза, используя каждый раз по 20 мл этилацетата. Органический слой сушили над MgSO4, фильтровали и испаряли, получая 34 мг требуемого продукта 90. Rt=0,86 минуты (Метод 18). Обнаруженная масса: 437,3 (M+H+).
h) 6-[(1S,4S,5S)-5-(1-Аминопропил)-5-фенилбицикло[2.2.1]-гепт-2-илокси]-7-хлор-2H-изохинолин-1-он (пример 100)
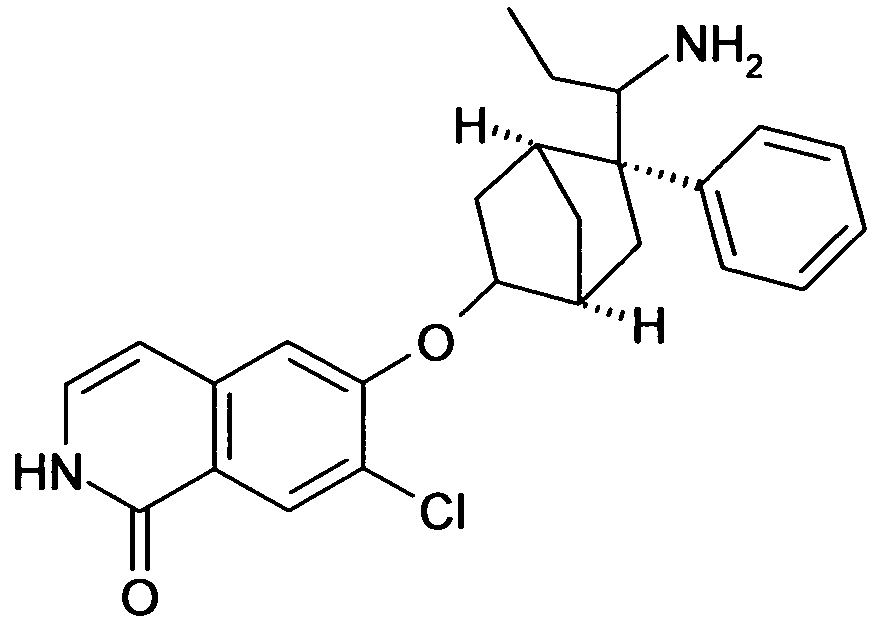
35 мг 1-[(1S,2S,4S)-5-(7-Хлор-1-метоксиизохинолин-6-илокси)-2-фенилбицикло[2.2.1]гепт-2-ил]пропиламина (90) растворяли в 1 мл 2-пропанола и 1 мл 1N водного раствора HCl. Смесь нагревали до 100°C в течение 1 часа при микроволновом облучении. Затем добавляли 20 мл воды, и смесь лиофилизировали. Остаток опять один раз обрабатывали с помощью 20 мл воды и лиофилизировали с получением 34 мг требуемого продукта в форме его гидорохлорида. Rt=0,75 минуты (Метод 18). Обнаруженная масса: 423,2 (M+H+).
Пример 101: 6-[(1R,4R,5R)-5-(1-Аминопропил)-5-фенил-бицикло[2.2.1]гепт-2-илокси]-7-хлор-2H-изохинолин-1-он
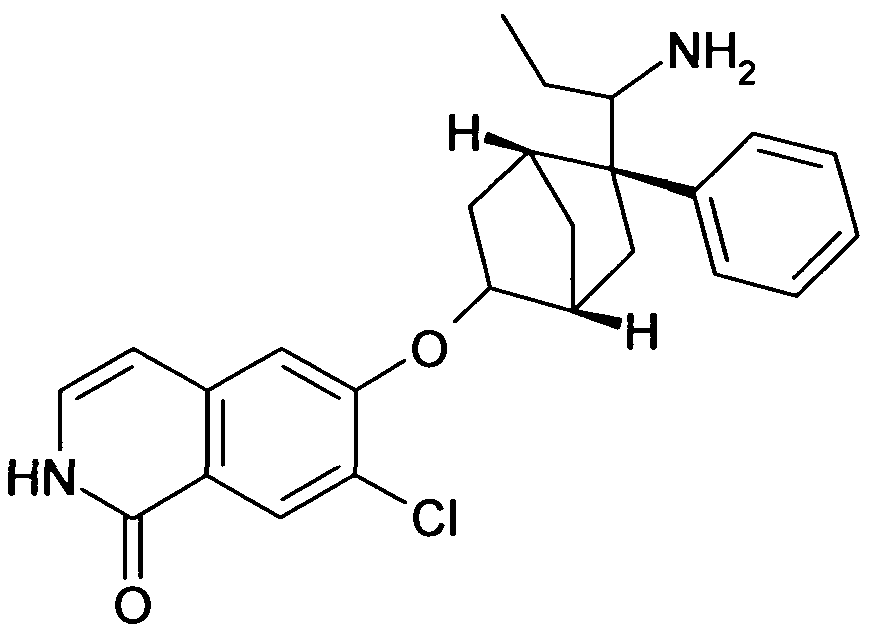
Соединение примера 101 было синтезировано в форме его гидрохлорида по аналогии с синтезом соединения примера 100, исходя из 7-хлор-6-фтор-1-метоксиизохинолина (10) и (1R,2R,4R)-5-оксо-2-фенилбицикло[2.2.1]гептан-2-карбонитрила этиленкеталя (85). Rt=0,75 минуты (Метод 18). Обнаруженная масса: 423,2 (M+H+).
Пример 102: цис-6-[4-(1-Бензиламинопропил)-4-фенил-циклогексилокси]-7-метил-2H-изохинолин-1-он
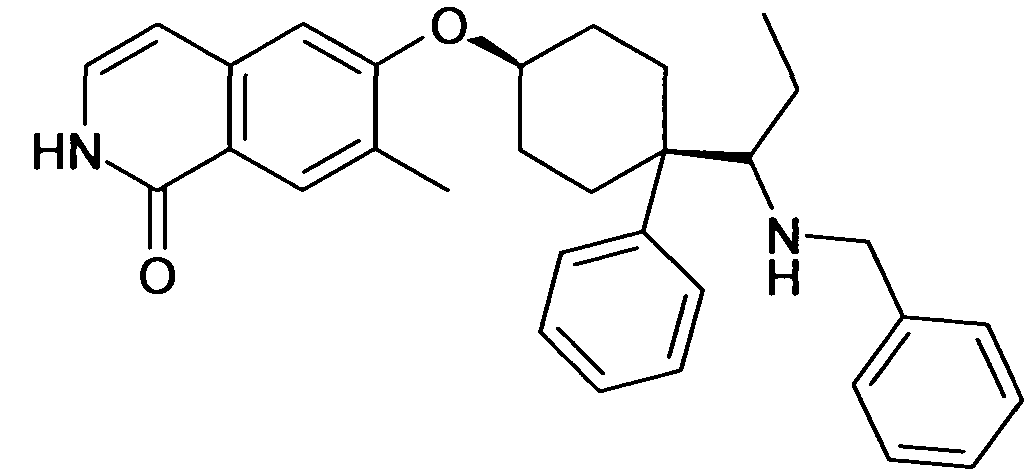
60 мг соединения примера 11 растворяли в 850 мкл метанола, затем добавляли 39 мкл триэтиламина, 80 мкл уксусной кислоты, 50 мг порошкообразных молекулярных сит и 43 мкл бензальдегида, и смесь перемешивали в течение 1 часа. Добавляли раствор 26 мг цианборгидрида натрия в 200 мкл метанола, и смесь перемешивали при 40°C в течение 5 минут. Реакционную смесь фильтровали, и фильтрат испаряли досуха. Остаток растворяли в 50 мл дихлорметана и промывали с помощью насыщенного раствора бикарбоната натрия. Водную фазу дважды реэкстрагировали с помощью дихлорметана. Объединенный органический слой сушили над сульфатом магния, фильтровали, испаряли, и неочищенный материал очищали с помощью ВЭЖХ с обращенной фазой (ацетонитрил/вода) с получением 27 мг требуемого продукта в виде соли трифторуксусной кислоты. Rt=2,94 минуты (Метод 2). Обнаруженная масса: 481,4 (M+H+).
В следующих примерах соединения получали таким же образом, как описано в примере 102, используя соответствующие изохинолины и альдегиды в качестве исходных материалов:
|
цис-4-(трет-Бутилдиметилсиланилокси)-1-(4-фторфенил)-циклогексанкарбальдегид (91)
К раствору 9,74 г (29,2 ммоль) цис-4-(трет-бутилдиметил-силанилокси)-1-(4-фторфенил)циклогексанкарбонитрила (78) в 290 мл дихлорметана при -70°C добавляли в течение 20 минут 73 мл (73 ммоль) раствора диизобутилалюминийгидрида в дихлорметане (1M). Реакционную смесь перемешивали в течение 1 часа при -70°C, затем добавляли 250 мл 10% водного раствора тартрата калия-натрия, и полученную двухфазную систему интенсивно перемешивали в течение 2 часов при комнатной температуре. Добавляли 200 мл этилацетата, и фазы разделяли. Водную фазу экстрагировали с помощью 150 мл этилацетата, и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Получаемое масло очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 8,38 г требуемого продукта. Rt=1,09 минуты (Метод 17). Обнаруженная масса: 337,2 (M+H+).
цис-[4-(трет-Бутилдиметилсиланилокси)-1-(4-фторфенил)-циклогексил]ацетонитрил (92)
К очень холодному раствору 6,60 г (19,6 ммоль) цис-4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)циклогексанкарбальдегида (91) в 50 мл сухого метанола добавляли порциями 1,48 г (39,2 ммоль) боргидрида натрия. Реакционную смесь перемешивали в течение 1 часа при 0°C, затем в течение 16 часов при комнатной температуре, затем реакцию останавливали путем добавления 70 мл воды. Раствор экстрагировали три раза с помощью этилацетата (каждый раз по 100 мл). Органические фазы объединяли, промывали с помощью рассола, сушили над сульфатом магния, фильтровали и испаряли досуха.
Полученный спирт (6,17 г неочищенный) растворяли в 50 мл сухого дихлорметана и охлаждали до 0°C. Добавляли 2,56 мл (1,84 г, 18,2 ммоль) триэтиламина, и смесь перемешивали в течение 5 минут. Затем добавляли по каплям 3,53 мл (5,22 г, 45,6 ммоль) метансульфонилхлорида, и раствор перемешивали в течение 2,5 часов при 0°C. Реакционную смесь обрабатывали с помощью 50 мл воды и перемешивали в течение 30 минут при комнатной температуре. Фазы разделяли, и водную фазу экстрагировали дважды с помощью 100 мл дихлорметана. Органические фазы объединяли, промывали с помощью рассола, сушили над сульфатом магния, фильтровали и испаряли досуха. Неочищенный продукт очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 5,20 г требуемого мезилата, который растворяли в 200 мл сухого диметилформамида и обрабатывали с помощью 4,06 г (62,4 ммоль) цианида калия и 6,60 г (25,0 ммоль) 18-краун-6. Оранжевый раствор нагревали до 155°C в течение 36 часов и перемешивали 16 часов при комнатной температуре, затем выливали в 200 мл смеси воды и льда. Смесь экстрагировали дважды с помощью этилацетата. Органические фазы объединяли, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 1,22 г требуемого продукта 92. Rt=1,04 минуты (Метод 17). Обнаруженная масса: 348,2 (M+H+).
цис-4-(2-Аминопропил)-4-(4-фторфенил)циклогексанол (93)
В атмосфере аргона растворяли 260 мг (0,75 ммоль) цис-[4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)циклогексил]-ацетонитрила (92) в 5 мл абсолютного толуола. Затем добавляли по каплям 500 мкл метилмагнийбромида (3M в диэтиловом эфире), и реакционную смесь нагревали до 80°C в течение 2 часов. После охлаждения до комнатной температуры, добавляли 3 мл сухого метанола. Через 10 минут добавляли 28,3 мг (1,45 ммоль) боргидрида натрия, и смесь перемешивали в течение 3 часов при комнатной температуре. Реакцию прерывали путем добавления 1M водного раствора гидроксида натрия и экстрагировали три раза с помощью диэтилового эфира (каждый раз по 100 мл).
Объединенные органические фазы концентрировали приблизительно до объема 80 мл, и добавляли 50 мл 2N водной хлористоводородной кислоты. Двухфазную систему интенсивно перемешивали при комнатной температуре в течение 3 часов. Фазы разделяли, доводили pH водного слоя до 12 путем добавления 5N раствора гидроксида натрия и экстрагировали три раза с помощью смеси 3:1 дихлорметана и 2-пропанола (каждый раз по 80 мл). Объединенные органические слои испаряли с получением 92 мг требуемого продукта, который непосредственно использовали на следующей стадии. Rt=0,64 минуты (Метод 18). Обнаруженная масса: 252,2 (M+H+).
цис-4-(2-Аминобутил)-4-(4-фторфенил)циклогексанол (94)
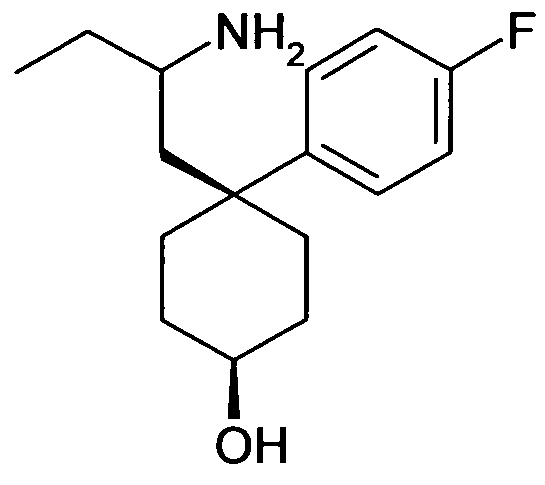
Аналогично получали 355 мг цис-4-(2-Аминобутил)-4-(4-фторфенил)циклогексанола (94) для синтеза цис-4-(2-амино-пропил)-4-(4-фторфенил)циклогексанола (93), исходя из 500 мг (1,44 ммоль) цис-[4-(трет-бутилдиметилсиланилокси)-1-(4-фтор-фенил)циклогексил]ацетонитрила (92), 960 мкл (2,88 ммоль) этилмагнийбромида (3M в диэтиловом эфире) и 54,4 мг (2,88 ммоль) боргидрида натрия. Rt=0,66 минуты (Метод 18). Обнаруженная масса: 266,2 (M+H+).
Пример 109: цис-6-[4-(2-Аминопропил)-4-(4-фторфенил)-циклогексилокси]-7-хлор-2H-изохинолин-1-он
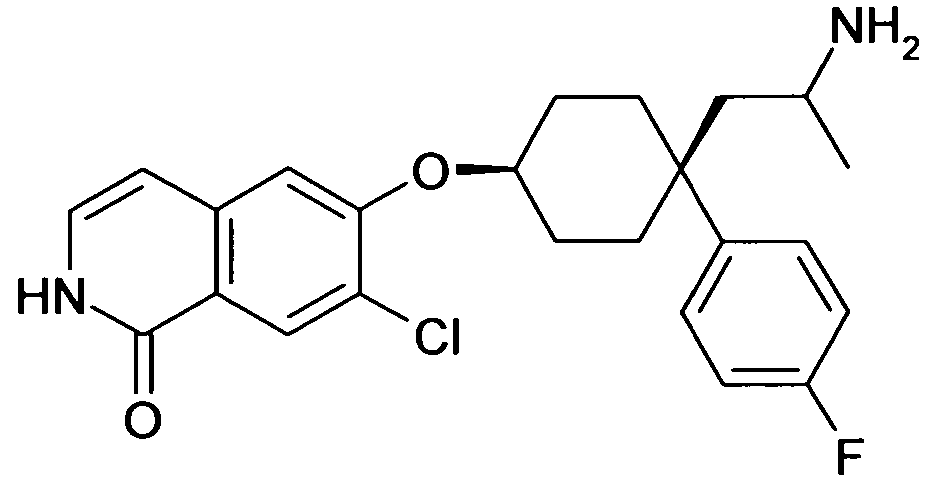
Соединение примера 109 получали при помощи последовательности реакций, описанных для синтеза соединения примера 1. Использовали 90 мг цис-4-(2-аминопропил)-4-(4-фтор-фенил)циклогексанола (93) и 79,6 мг 7-хлор-6-фтор-1-метокси-изохинолина (10) с получением 35 мг соединения примера 109 в виде гидрохлорида. Rt=1,31 минуты (Метод 16). Обнаруженная масса: 429,2 (M+H+).
Пример 110: цис-6-[4-(2-Аминобутил)-4-(4-фторфенил)-циклогексилокси]-7-хлор-2H-изохинолин-1-он
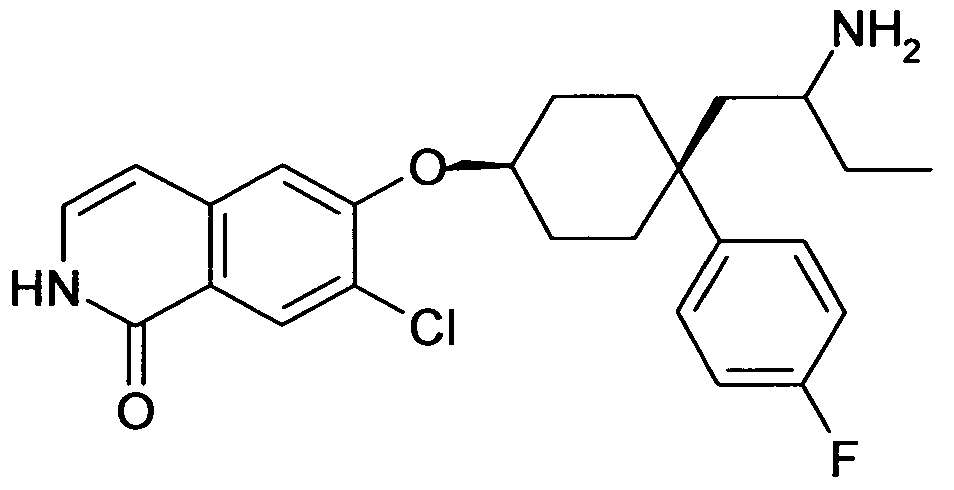
Соединение примера 110 получали в виде гидрохлорида путем последовательности реакций, используемых для синтеза соединения примера 109, исходя из цис-4-(2-аминобутил)-4-(4-фторфенил)-циклогексанола (94) и 7-хлор-6-фтор-1-метоксиизохинолина (10). Rt=1,45 минуты (Метод 16). Обнаруженная масса: 443,2 (M+H+).
трет-Бутил-(7-хлор-6-фторизохинолин-1-ил)амин (95)
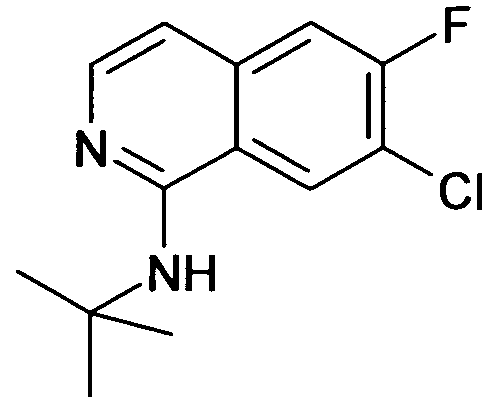
Раствор 5,0 г (25,3 ммоль) 7-хлор-6-фторизохинолин-2-оксида (9) в 120 мл бензотрифторида обрабатывали с помощью 15,9 мл (11,1 г, 152 ммоль) трет-бутиламина и охлаждали до 0°C. Затем добавляли порциями 17,3 г (53,1 ммоль) п-толуолсульфонового ангидрида при контролируемой температуре (<10°C). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, затем охлаждали до 0°C, и добавляли еще 8,0 мл (76,1 ммоль) третбутиламина и 8,26 г (25,3 ммоль) п-толуолсульфонового ангидрида. Реакционную смесь перемешивали в течение 24 часов при комнатной температуре, затем концентрировали и распределяли между 120 мл воды и 150 мл дихлорметана. Фазы разделяли, и органическую фазу промывали восемь раз с помощью 3N водного гидроксида натрия для извлечения избытка п-толуолсульфоновой кислоты, сушили над сульфатом магния, фильтровали и испаряли досуха. Неочищенный продукт очищали дважды с помощью хроматографии на силикагеле (дихлорметан:метанол) с получением 277 мг чистого требуемого продукта (95) и 714 мг продукта, слегка загрязненного п-толуолсульфоновой кислотой. Rt=2,35 минуты (Метод 2). Обнаруженная масса: 253,1 (M+H+).
Пример 111: цис-6-[4-(1-Аминопропил)-4-фенил-циклогексилокси]-7-хлоризохинолин-1-иламин
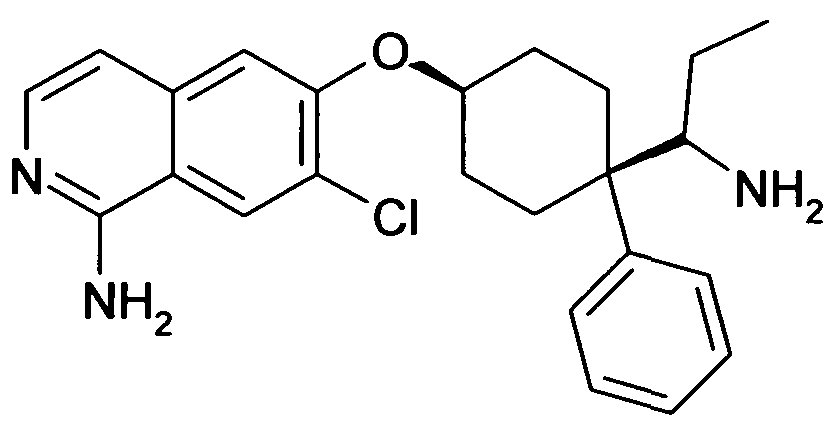
Получали 58 мг соединения примера 111 путем последовательности реакций с помощью реакции сочетания в присутствии NaH и кислотного снятия защиты при микроволновом облучении, также как в случае синтеза соединения примера 1, исходя из 102 мг (0,44 ммоль) цис-4-(1-аминопропил)-4-фенилциклогексанола (6) и 100 мг (0,40 ммоль) трет-бутил-(7-хлор-6-фторизохинолин-1-ил)амина (95). Rt=0,84 минуты (Метод 11). Обнаруженная масса: 410,3 (M+H+).
Бензиловый эфир {1-[8-(4-метоксифенил)-1,4-диоксаспиро[4.5]дец-8-ил]пропил}карбаминовой кислоты (96)
5,0 г (18,3 ммоль) 8-(4-метоксифенил)-1,4-диокса-спиро[4.5]декан-8-карбонитрила (синтезированного из 1-(4-метоксифенил)-4-оксоциклогексанкарбонитрила таким же образом, как описано для соединения 15) растворяли в 20 мл абсолютного толуола. Затем добавляли по каплям 12,2 мл (36,6 ммоль) этилмагнийхлорида (3M в THF), и реакционную смесь нагревали до 90°C в течение 5 часов. После охлаждения до -15°C добавляли 10 мл сухого метанола. Через 10 минут добавляли порциями 1,37 г (36,3 ммоль) боргидрида натрия при 0°C, и смесь перемешивали в течение 16 часов при комнатной температуре. Реакцию прерывали путем добавления 1M водного раствора гидроксида натрия (100 мл) и экстрагировали три раза с помощью диэтилового эфира (каждый раз по 150 мл). Объединенные органические фазы сушили над сульфатом магния, фильтровали и растворитель испаряли.
Неочищенный амин (4,90 г) растворяли в 55 мл сухого дихлорметана, охлаждали до -78°C и добавляли 2,46 мл (1,79 г, 17,6 ммоль) триэтиламина и 2,71 мл (2,74 г, 16,0 ммоль) бензилхлорформиата. Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 2 часов. Затем добавляли 100 мл воды, и смесь экстрагировали три раза с помощью этилацетата. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали с получением неочищенного продукта (96), который непосредственно использовали на следующей стадии. Rt=1,09 минуты (Метод 18). Обнаруженная масса: 440,4 (M+H+).
Бензиловый эфир {1-[1-(4-метоксифенил)-4-оксоциклогексил]пропил}карбаминовой кислоты (97)
534 мг бензилового эфира {1-[8-(4-метоксифенил)-1,4-диоксаспиро[4.5]дец-8-ил]пропил}карбаминовой кислоты (96) растворяли в 1 мл 2:1 смеси ацетона и 6N водной хлористоводородной кислоты. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре, затем добавляли по каплям в 150 мл насыщенного водного раствора бикарбоната натрия. Фазы разделяли, и водную фазу экстрагировали три раза с помощью дихлорметана (каждый раз по 100 мл). Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали с получением кетона 97. Rt=1,58 минуты (Метод 19). Обнаруженная масса: 396,3 (M+H+).
Бензиловый эфир {1-[4-амино-1-(4-метоксифенил)циклогексил]пропил}карбаминовой кислоты (98)
200 мг (0,51 ммоль) кетона (97) растворяли в 1,5 мл абсолютного метанола, затем добавляли 390 мг (5,06 ммоль) ацетата аммония и 31,8 мг (0,51 ммоль) цианборгидрида натрия, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь испаряли, остаток растворяли в 50 мл 1N водного гидроксида натрия и экстрагировали дважды с помощью 100 мл дихлорметана. Объединенный органический слой сушили над сульфатом магния, фильтровали, и испаряли с получением 150 мг названного соединения 98 с чистотой, достаточной для непосредственного использования на следующей стадии. Rt=1,18 минуты (Метод 19). Обнаруженная масса: 397,3 (M+H+).
Бензиловый эфир {1-[4-(изохинолин-6-иламино)-1-(4-метоксифенил)циклогексил]пропил}карбаминовой кислоты (99)
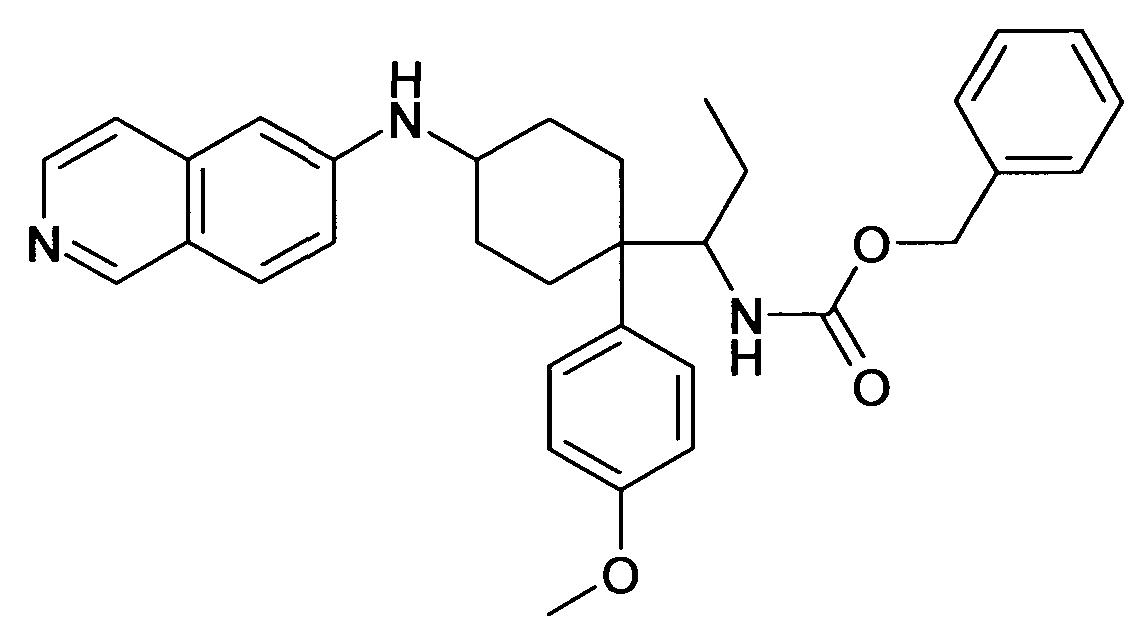
В 1 мл абсолютного толуола растворяли 66,0 мг (0,32 ммоль) 6-бромизохинолина, 151 мг (380 мкмоль) бензилового эфира {1-[4-амино-1-(4-метоксифенил)циклогексил]пропил}карбаминовой кислоты (98), и 155 мг (476 мкмоль) карбоната цезия. Раствор дважды дегазировали, затем добавляли 2,14 мг (9,5 мкмоль) ацетата палладия и 8,89 мг (14,3 мкмоль) 2,2'-бис(дифенилфосфино)-1,1'-бинафтила, и реакционную смесь нагревали до 100°C до тех пор, пока реакция не происходила до конца. Смесь испаряли, затем повторно растворяли в 50 мл дихлорметана и промывали дважды с помощью 50 мл насыщенного водного раствора бикарбоната натрия. Органическую фазу сушили над сульфатом магния, фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле (дихлорметан:метанол) с получением 48 мг чистого требуемого продукта. Rt=1,38 минуты (Метод 19). Обнаруженная масса: 524,4 (M+H+).
Пример 112: [4-(1-Аминопропил)-4-(4-метоксифенил)-циклогексил]изохинолин-6-ил-амин
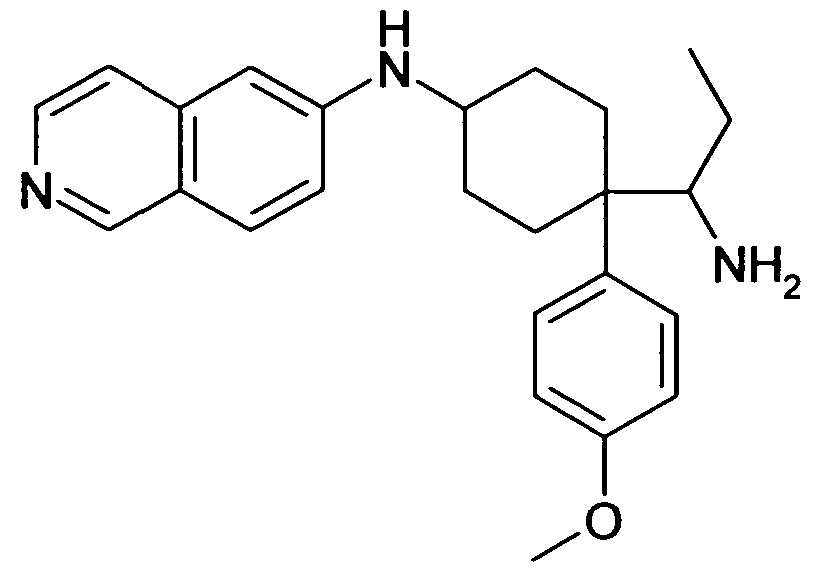
48 мг (91,7 мкмоль) бензилового эфира {1-[4-(изохинолин-6-иламино)-1-(4-метоксифенил)циклогексил]пропил}карбаминовой кислоты (99) растворяли в 300 мкл сухого метанола, и добавляли 9,7 мкг палладия на активированном угле (10%). Смесь перемешивали в атмосфере водорода до тех пор, пока не завершалась реакция. Катализатор отфильтровывали, и реакционную смесь испаряли досуха с получением названного соединения. Rt=0,89 минуты (Метод 19). Обнаруженная масса: 390,3 (M+H+).
1-(Ди-трет-бутилоксикарбонил)амино-[4-(1-аминопропил)-4-(4-метоксифенил)циклогексил]изохинолин-6-иламин (100)
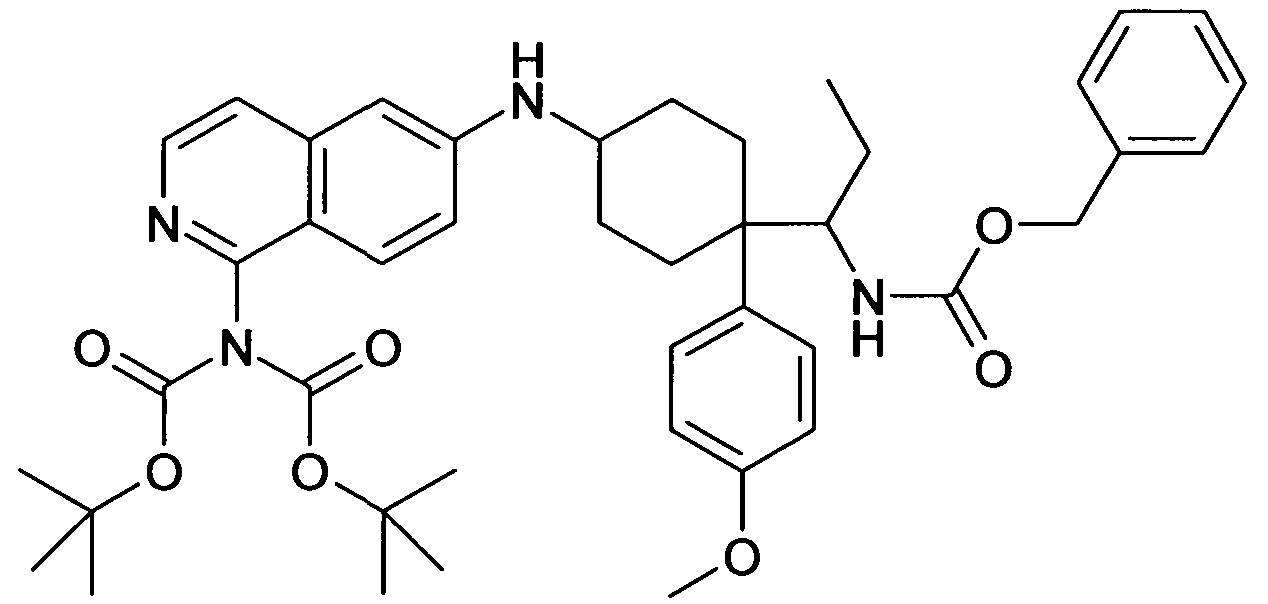
30 мг (83,5 мкмоль) 1-(ди-трет-бутилоксикарбонил)амино-изохинолин-6-амина растворяли в 135 мкл абсолютного метанола, затем добавляли 23 мкл (16,9 мг, 167 мкмоль) триэтиламина, 47,7 мкл (50,1 мг, 835 мкмоль) уксусной кислоты, 20 мг порошкообразных молекулярных сит и 99 мг (250 мкмоль) соединения (97), и смесь перемешивали в течение 1 часа. Добавляли раствор 15,7 мг (250 мкмоль) цианборгидрида натрия в 50 мкл метанола, и смесь перемешивали при 70°C в течение 10 часов. Затем добавляли еще 50 мг (125 мкмоль) соединения (97), затем порциями 15,7 мг (250 мкмоль) цианборгидрида натрия в 50 мкл метанола, и смесь перемешивали в течение 1 часа при 70°C. Реакционную смесь фильтровали, и фильтрат испаряли досуха. Остаток растворяли в 50 мл дихлорметана и промывали с помощью насыщенного раствора бикарбоната натрия. Водную фазу повторно экстрагировали три раза с помощью дихлорметана. Объединенный органический слой сушили над сульфатом магния, фильтровали, испаряли, и неочищенный материал очищали с помощью ВЭЖХ с обращенной фазой (ацетонитрил/вода) с получением 5 мг требуемого продукта в виде соли трифторуксусной кислоты. Rt=1,65 минуты (Метод 19). Обнаруженная масса: 739,3 (M+H+).
Пример 113: 1-Амино-[4-(1-аминопропил)-4-(4-метоксифенил)-циклогексил]изохинолин-6-иламин
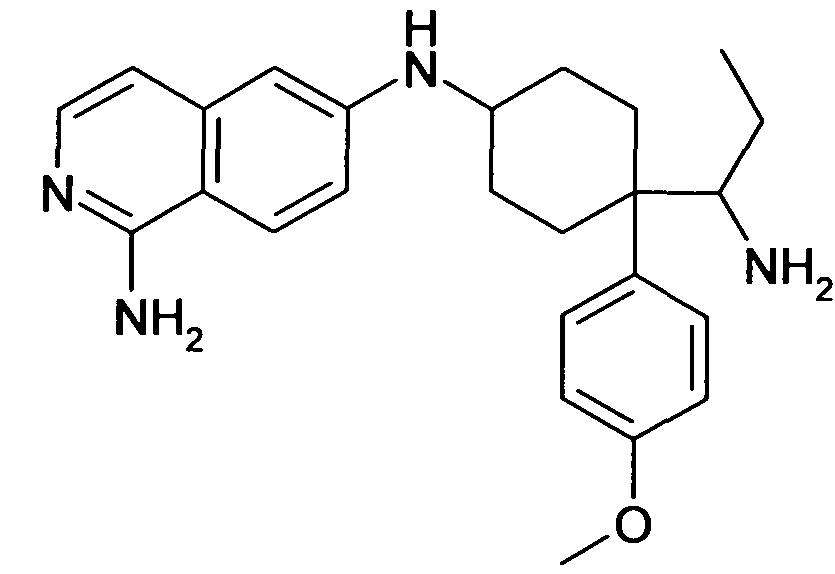
5 мг (6,77 мкмоль) 1-(Ди-трет-бутилоксикарбонил)амино-[4-(1-аминопропил)-4-(4-метоксифенил)циклогексил]изохинолин-6-иламина (100) растворяли в 500 мкл сухого метанола, и добавляли 5,0 мг палладия на активированном угле (10%). Смесь перемешивали в атмосфере водорода до тех пор, пока не завершалась реакция. Катализатор отфильтровывали, и реакционную смесь испаряли досуха. Твердый остаток обрабатывали с помощью 500 мкл 4N хлористоводородной кислоты в диоксане и перемешивали при комнатной температуре до полного снятия защиты. Реакционную смесь испаряли, добавляли воду, и смесь лиофилизировали. Остаток помещали в воду и опять лиофилизировали с получением 1,2 мг требуемого продукта в виде гидрохлорида. Rt=0,98 минуты (Метод 19). Обнаруженная масса: 405,3 (M+H+).
1-[4-(трет-Бутилдиметилсиланилокси)-1-(4-фторфенил)-циклогексил]метилиденамид цис-2-метил-пропан-2-сульфиновой кислоты (101)
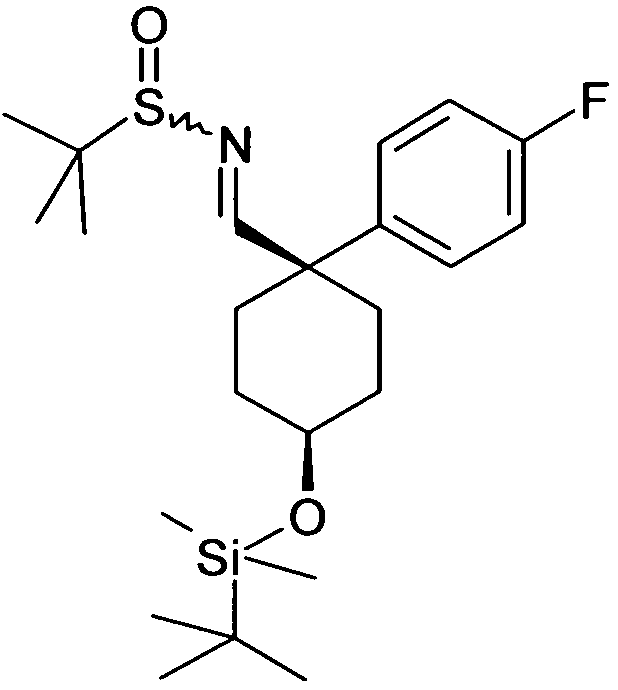
К раствору 3,0 г (8,92 ммоль) цис-4-(трет-бутилдиметил-силанилокси)-1-(4-фторфенил)циклогексанкарбальдегида (91) в 26 мл тетрагидрофурана добавляли 1,19 г (9,81 ммоль) 2-метил-2-пропансульфинамида и 4,31 мл (4,69 г, 13,4 ммоль) этоксида титана(IV). Полученную смесь перемешивали в течение 16 часов при кипячении с обратным холодильником, затем обрабатывали с помощью 30 мл воды. Полученную суспензию фильтровали через целит. Осадок на фильтре споласкивали с помощью 200 мл этилацетата и 60 мл воды. Фазы разделяли, и водный слой экстрагировали с помощью этилацетата. Объединенные органические слои сушили над сульфатом магния, фильтровали, и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2, 0% → 100% этилацетат в гептане) с получением 1,64 г названного соединения (101). Rt=1,15 минуты (Метод 17). Обнаруженная масса: 440,2 (M+H+).
{2-Бензолсульфонил-1-[4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)цикло-гексил]-2-фторэтил}амид цис-2-метилпропан-2-сульфиновой кислоты (102)
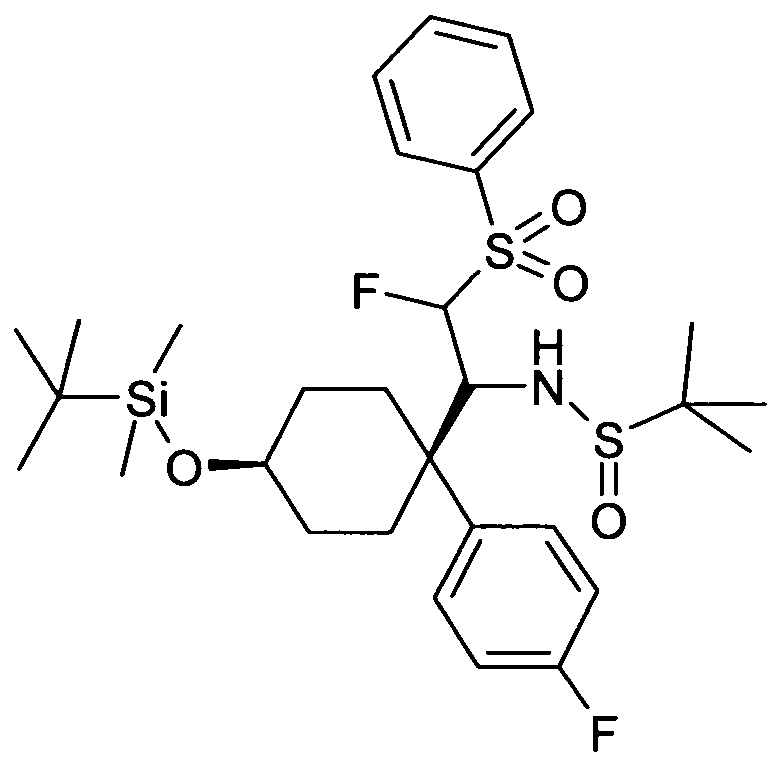
Раствор 1,75 г (3,98 ммоль) 1-[4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)циклогексил]-метилиденамида цис-2-метилпропан-2-сульфиновой кислоты (101) и 693 мг (3,98 ммоль) фторметилфенилсульфона в 40 мл сухого тетрагидрофурана охлаждали до -78°C, и добавляли 4,17 мл (4,17 ммоль) 1M раствор бис(триметилсилил)амида лития в тетрагидрофуране. Смесь перемешивали в течение 1 часа при -78°C, затем реакцию прерывали путем добавления насыщенного водного раствора хлорида аммония и экстрагировали дважды с помощью этилацетата. Объединенные органические слои сушили над сульфатом магния, фильтровали, и концентрировали в вакууме с получением 2,45 г неочищенного названного соединения (102) в виде диастереоизомерной смеси. Rt=3,31 минуты (Метод 12). Обнаруженная масса: 614,3 (M+H+).
{1-[4-(трет-Бутил-диметилсиланилокси)-1-(4-фторфенил)циклогексил]-2-фторэтил}амид цис-2-метилпропан-2-сульфиновой кислоты (103)
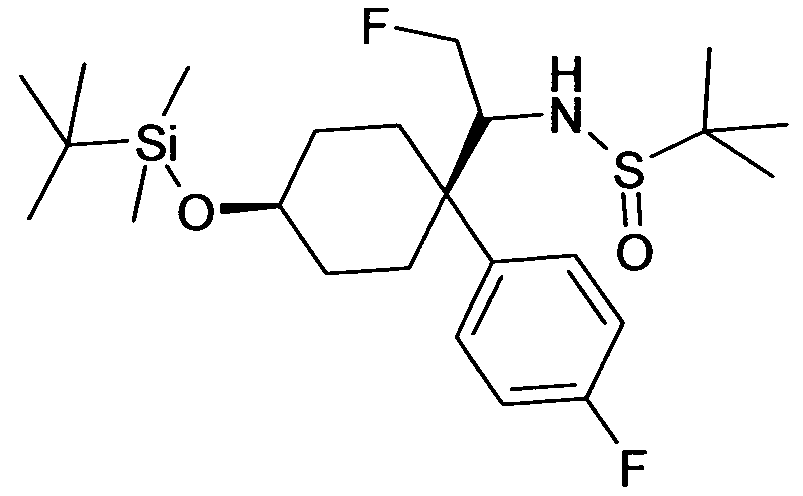
1,70 г (2,77 ммоль) {2-бензолсульфонил-1-[4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)циклогексил]-2-фторэтил}амида цис-2-метилпропан-2-сульфиновой кислоты (102) растворяли в 30 мл сухого метанола, и добавляли 1,57 г (11,1 ммоль) двухосновного фосфата натрия. Суспензию охлаждали до -20°C и обрабатывали с помощью 2,48 г амальгамы натрия (5% ртути). Реакционную смесь перемешивали при 0°C в течение 16 часов, и добавляли еще 620 мг амальгамы натрия. После перемешивания в течение 24 часов при комнатной температуре, раствор отделяли от твердого вещества путем декантирования, испаряли досуха, и остаток распределяли между 50 мл рассола и 100 мл диэтилового эфира. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка с помощью флэш-хроматографии (SiO2, 0% → 100% этилацетат в гептане) давала 300 мг названного соединения (103). Rt=1,07 минуты (Метод 17). Обнаруженная масса: 474,4 (M+H+).
цис-4-(1-Амино-2-фторэтил)-4-(4-фторфенил)циклогексанол (104)
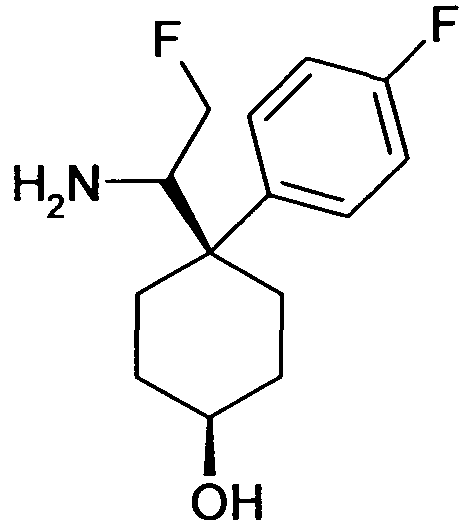
Раствор 300 мг (0,63 ммоль) {1-[4-(трет-бутилдиметилсиланилокси)-1-(4-фторфенил)циклогексил]-2-фторэтил}амида цис-2-метилпропан-2-сульфиновой кислоты (103) в 3 мл 2-пропанола обрабатывали с помощью 3 мл 6N водной хлористоводородной кислоты и перемешивали в течение 18 часов при комнатной температуре. Смесь промывали с помощью 50 мл диэтилового эфира и лиофилизировали, затем помещали в воду и опять лиофилизировали с получением названного соединения (104) в виде его гидрохлорида. Rt=0,49 минуты (Метод 18). Обнаруженная масса: 256,3 (M+H+).
Пример 114: цис-6-[4-(1-Амино-2-фторэтил)-4-(4-фторфенил)-циклогексилокси]-7-хлор-2H-изохинолин-1-он
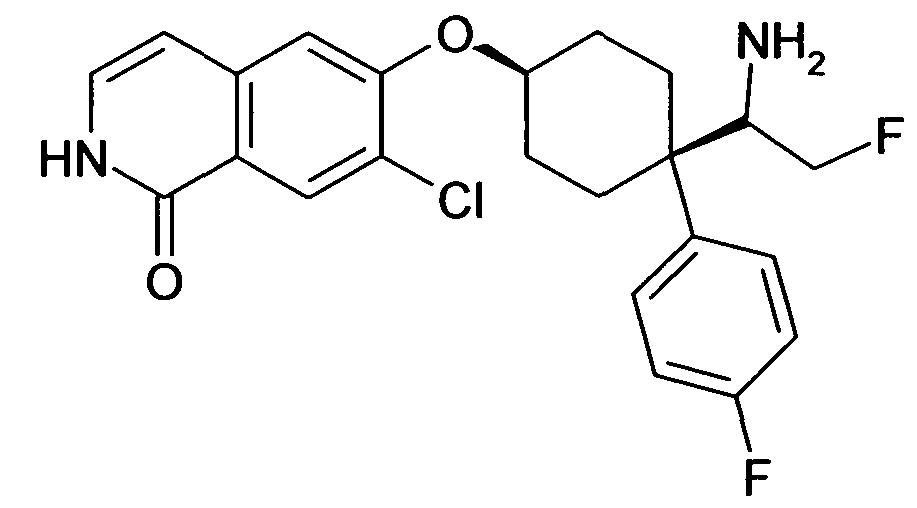
Соединение примера 114 синтезировали с использованием последовательности реакций, описанных для синтеза соединения примера 1. Использовали 209 мг цис-4-(1-амино-2-фторэтил)-4-(4-фторфенил)циклогексанола (104) и 158 мг 7-хлор-6-фтор-1-метоксиизохинолина (10) с получением 132 мг соединения примера 114 в виде его гидрохлорида. Rt=1,79 минуты (Метод 12). Обнаруженная масса: 433,2 (M+H+).
2-Метилпропан-2-сульфиновой кислоты 8-(4-фторфенил)-1,4-диоксаспиро[4.5]дец-8-илметиленамид (105)
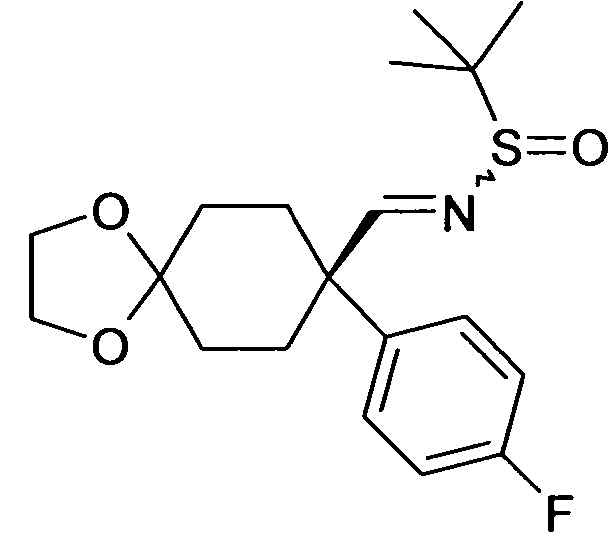
К раствору 10,0 г (38,3 ммоль) 8-(4-фторфенил)-1,4-диокса-спиро[4.5]декан-8-карбонитрила (15) в 44 мл тетрагидрофурана при -78°C медленно добавляли 76,5 мл (76,5 ммоль) 1M раствора диизобутилалюминий гидрида в толуоле, и реакционную смесь подогревали до 0°C в течение 3 часов. Смесь повторно охлаждали до -78°C, нейтрализовали путем добавления по каплям 10% водного раствора лимонной кислоты и подогревали до комнатной температуры в течение 15 часов. Смесь экстрагировали три раза с помощью метил-трет-бутилового эфира (каждый раз по 50 мл), объединенные органические фазы сушили над сульфатом магния, фильтровали и испаряли с получением 8-(4-фторфенил)-1,4-диокса-спиро[4.5]декан-8-карбальдегида.
Неочищенный альдегид растворяли в 113 мл тетрагидрофурана, и добавляли 5,09 г (42,0 ммоль) 2-метил-2-пропансульфинамида и 12,0 мл (13,1 г, 57,3 ммоль) этоксида титана(IV). Полученную смесь перемешивали в течение 3 часов при кипячении с обратным холодильником и 16 часов при комнатной температуре, затем обрабатывали с помощью 30 мл воды и фильтровали через целит. Осадок на фильтре промывали с помощью 200 мл этилацетата и 60 мл воды, фазы разделяли, и водный слой экстрагировали дважды с помощью этилацетата. Объединенные органические слои сушили над сульфатом магния, фильтровали, и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2, 0%→100% этилацетат в гептане) с получением 3,20 г названного соединения (105). Rt=1,01 минуты (Метод 18). Обнаруженная масса: 368,3 (M+H+).
{1-[8-(4-Фторфенил)-1,4-диоксаспиро[4,5]дец-8-ил]аллил}амид 2-метилпропан-2-сульфиновой кислоты (106)
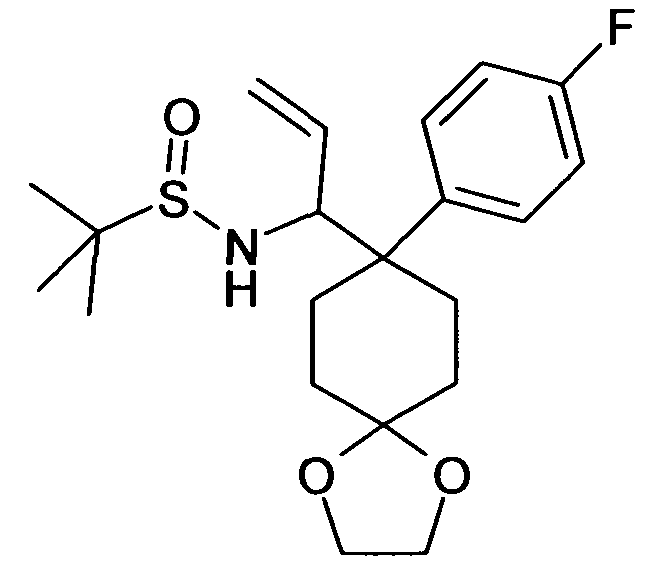
В атмосфере аргона растворяли 2,00 г (5,44 ммоль 8-(4-фторфенил)-1,4-диокса-спиро[4,5]дец-8-илметиленамида) 2-метил-пропан-2-сульфиновой кислоты (105) в 27 мл абсолютного тетрагидрофурана. Затем добавляли по каплям 5,99 мл (5,99 ммоль) винилмагнийбромида (1M в тетрагидрофуране) при 0°C, и реакционную смесь перемешивали в течение 17 часов при комнатной температуре. Добавляли еще 3 мл (3,00 ммоль) винилмагнийбромида (1M в тетрагидрофуране), и смесь перемешивали в течение 20 часов при комнатной температуре. Реакционную смесь охлаждали до 0°C, и добавляли 15 мл насыщенного водного раствора сульфата натрия. Суспензию фильтровали через целит, органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2, 0%→100% этилацетат в гептане) с получением 1,09 г соединения (106). Rt=0,96 минуты (Метод 18). Обнаруженная масса: 396,4 (M+H+).
{1-[8-(4-Фторфенил)-1,4-диоксаспиро[4,5]дец-8-ил]-3-метоксипропил}амид 2-метилпропан-2-сульфиновой кислоты (107)
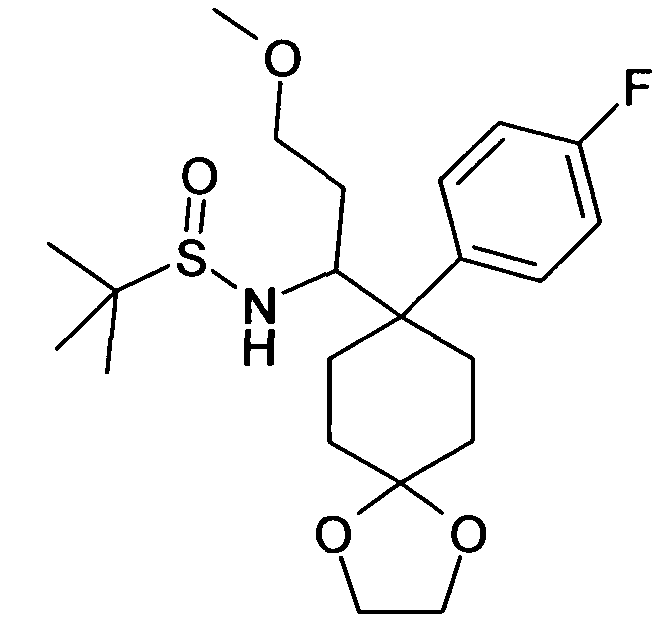
16,5 мл (8,23 ммоль) 0,5M раствора 9-BBN в тетрагидрофуране добавляли к раствору 1,09 г (2,74 ммоль) {1-[8-(4-фторфенил)-1,4-диокса-спиро[4,5]дец-8-ил]аллил}амида 2-метилпропан-2-сульфиновой кислоты (106) в 5 мл THF при 0°C. Реакционную смесь подогревали до комнатной температуры в течение ночи, затем охлаждали до 0°C. Затем медленно добавляли 20 мл 3M водного гидроксида натрия и 7,5 мл 30% водного пероксида водорода, и смесь перемешивали в течение 16 часов при комнатной температуре. Смесь экстрагировали дважды с помощью 50 мл этилацетата, промывали с помощью воды и насыщенного раствора хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Неочищенный спирт растворяли в 5 мл тетрагидрофурана и медленно добавляли к суспензии 131 мг (4,46 ммоль) гидрида натрия (60%) в 5 мл тетрагидрофурана при 0°C. Добавляли 515 мкл (8,20 ммоль) йодметана, и после перемешивания в течение 16 часов при комнатной температуре добавляли еще 50 мг гидрида натрия (60%). Реакционную смесь перемешивали в течение 1 часов при комнатной температуре, затем добавляли 30 мл метанола и 15 мл водного раствора гидроксида аммония (33%). Реакционную смесь испаряли досуха и лиофилизировали из воды с получением 1,17 г названного соединения (107) с чистотой, достаточной для проведения дальнейшего превращения. Rt=0,93 минуты (Метод 18). Обнаруженная масса: 428,2 (M+H+).
цис-4-(1-Амино-3-метоксипропил)-4-(4-фторфенил)-циклогексанол (108)
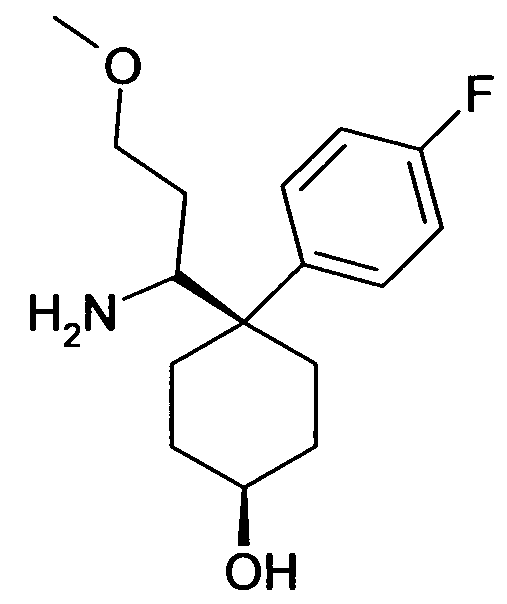
Раствор 1,16 г (2,71 ммоль) {1-[8-(4-фторфенил)-1,4-диоксаспиро[4.5]дец-8-ил]-3-метоксипропил}амида 2-метилпропан-2-сульфиновой кислоты (107) в смеси 5 мл уксусной кислоты и 1,25 мл воды нагревали в микроволновой печи при 100°C в течение 5 минут. Смесь охлаждали до комнатной температуры и медленно выливали в 100 мл холодного насыщенного водного раствора бикарбоната натрия. Смесь экстрагировали три раза с помощью 3:1 смеси дихлорметана и этанола (каждый раз по 50 мл). Органическую фазу концентрировали в вакууме для удаления дихлорметана, и добавляли 203 мг (5,37 ммоль) боргидрида натрия. После добавления еще 203 мг (5,37 ммоль) боргидрида натрия, реакционную смесь перемешивали при комнатной температуре в течение ночи. После того как проводили реакцию в течение 18 часов при комнатной температуре, реакцию прерывали с помощью воды, реакционную смесь концентрировали в вакууме и лиофилизировали дважды из воды с получением названного соединения (108), которое использовали неочищенным на следующей стадии. Rt=1,95 минуты (Метод 2). Обнаруженная масса: 282,2 (M+H+).
Пример 115: цис-6-[4-(1-Амино-3-метоксипропил)-4-(4-фтор-фенил)циклогексилокси]-7-хлор-2H-изохинолин-1-он
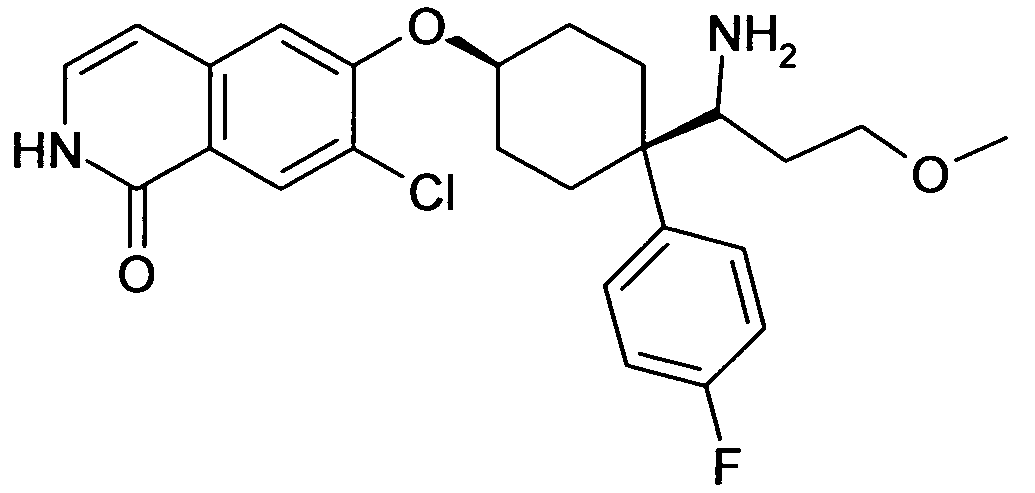
Соединение примера 115 синтезировали с использованием последовательности реакций, описанных для синтеза соединения примера 1. Использовали 414 мг цис-4-(1-амино-3-метоксипропил)-4-(4-фторфенил)циклогексанола (108) и 283 мг 7-хлор-6-фтор-1-метоксиизохинолина (10) с получением 66,6 мг соединения примера 115 в виде его гидрохлорида. Rt=1,88 минуты (Метод 12). Обнаруженная масса: 459,3 (M+H+).
1-(1,4-Диоксаспиро[4.5]дец-8-ил)-1-фенилэтиламин (26)
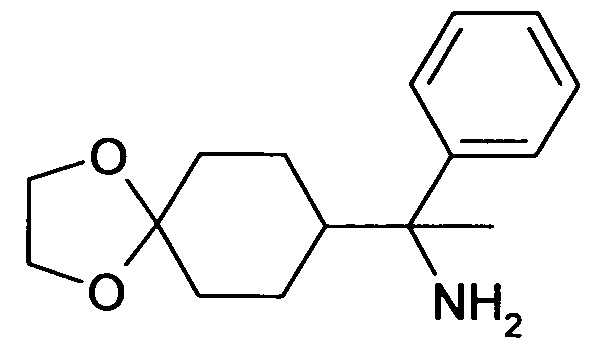
В атмосфере аргона добавляли фенилмагнийбромид (3M) в диэтиловом эфире (6,7 мл, 20 ммоль) к раствору 1,4-диокса-спиро[4.5]декан-8-карбонитрила (3,34 г, 20 ммоль) в диэтиловом эфире (60 мл). Смесь перемешивали в течение 30 минут. Затем добавляли изопропоксид титана(IV) (5,7 г, 20 ммоль). После перемешивания в течение 5 минуты, добавляли метиллитий (1,6 M в диэтиловом эфире, 31,2 мл, 50 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 10 часов. После охлаждения в смеси лед/вода, коричневую смесь осторожно по каплям обрабатывали с помощью 2M раствора NaOH (30 мл) (экзотермическая реакция). Смесь экстрагировали с помощью трет-бутилметилового эфира и сушили над сульфатом натрия. После фильтрации органическую фазу испаряли с получением 5 г бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки. Rt=2,10 минуты (Метод 2). Обнаруженная масса: 261,2 (M+H+).
4-(1-Амино-1-фенилэтил)циклогексанон (27)
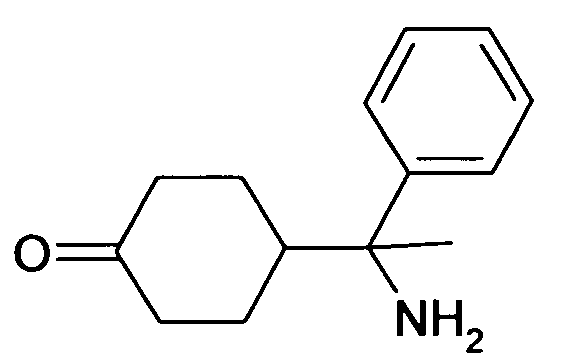
Неочищенный 1-(1,4-диоксаспиро[4.5]дец-8-ил)-1-фенил-этиламин (26, 2,5 г) растворяли в ацетоне (40 мл) и обрабатывали с помощью 6M водной хлористоводородной кислоты (21,1 мл). После 5 часов перемешивания, смесь испаряли при температуре ниже, чем 20°C с получением остатка, который обрабатывали с помощью дихлорметана, промывали с помощью насыщенного раствора бикарбоната натрия, сушили и фильтровали с получением раствора неочищенного продукта, который сразу же использовали. Rt=0,7 минуты (Метод 5). Обнаруженная масса: 218,3 (M+H+).
Третбутиловый эфир [1-(4-оксоциклогексил)-1-фенилэтил]карбаминовой кислоты (28)
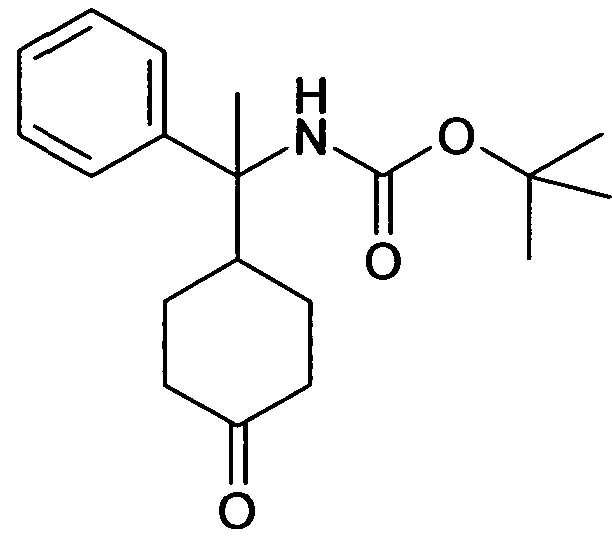
При охлаждении добавляли ди-трет-бутилдикарбонат (3,46 г, 10,6 ммоль) и триэтиламин (1,47 мл, 10,6 ммоль) к неочищенному раствору 4-(1-амино-1-фенилэтил)циклогексанона (27) с предыдущей стадии. После перемешивания в течение ночи, реакционную смесь подвергали экстракции с помощью дихлорметана, промывали с помощью 1M раствора NaOH и затем с помощью 0,05M водной хлористоводородной кислоты (три раза до тех пор, пока величина pH промывок не составляла 4). После промывки органической фазы с помощью рассола, ее сушили над сульфатом натрия, фильтровали и испаряли с получением неочищенного продукта (28) в виде бесцветного масла, которое использовали без дополнительной очистки. Rt=0,14 минуты (Метод 5). Обнаруженная масса: 318,4 (M+H+).
трет-Бутиловый эфир [1-(4-гидроксициклогексил)-1-фенилэтил]карбаминовой кислоты (29)
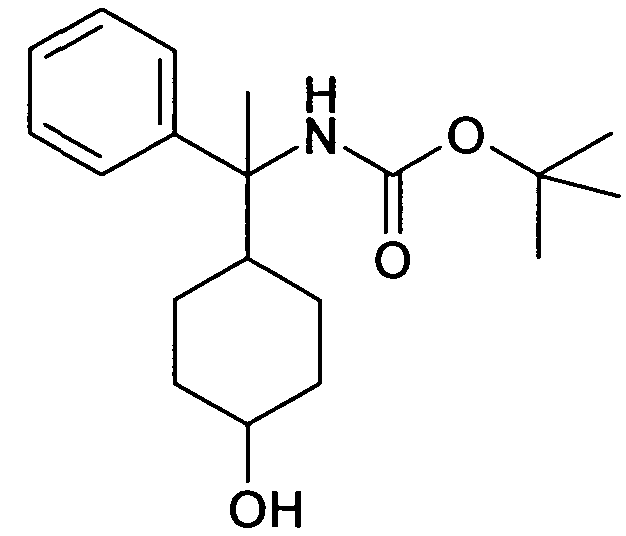
трет-Бутиловый эфир [1-(4-оксоциклогексил)-1-фенилэтил]карбаминовой кислоты (28) с предыдущей стадии (2,7 г) растворяли в THF (60 мл) и охлаждали до -70°C. Добавляли боргидрид натрия (356 мг), и реакционную смесь перемешивали в течение ночи с постепенным повышением температуры до комнатной температуры. Добавляли воду, и раствор экстрагировали с помощью трет-бутилметилового эфира. Органическую фазу промывали с помощью рассола и сушили над сульфатом натрия. Испарение давало 1,24 г белой пены в виде неочищенного продукта. Rt=1,41 минуты (Метод 5). Обнаруженная масса: 246,3 (M-C4H8-H2O+H+).
4-(1-Амино-1-фенилэтил)циклогексанол (30)
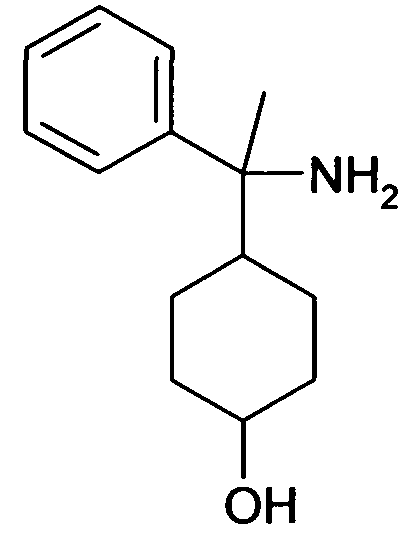
Трифторуксусную кислоту (8 мл) добавляли к раствору [1-(4-гидроксициклогексил)-1-фенилэтил]карбаминовой кислоты трет-бутилового эфира (29) в дихлорметане (75 мл) с предыдущей стадии. После перемешивания в течение 4 часов реакционную смесь подвергали обработки с помощью 2M водной хлористоводородной кислоты (39 мл), затем испаряли. Лиофилизация в течение ночи давала бледно-коричневый полутвердый остаток. Его обрабатывали с помощью смеси воды и ацетонитрила. После еще одной лиофилизации получали 1,24 г неочищенного продукта в виде гидрохлорида, который использовали на следующей стадии без дополнительной очистки. Rt=0,58 минуты (Метод 5). Обнаруженная масса: 185,15 (M-NH3-H2O+H+).
1-[4-(1-Бензилокси-7-хлоризохинолин-6-илокси)циклогексил]-1-фенилэтиламин (31)
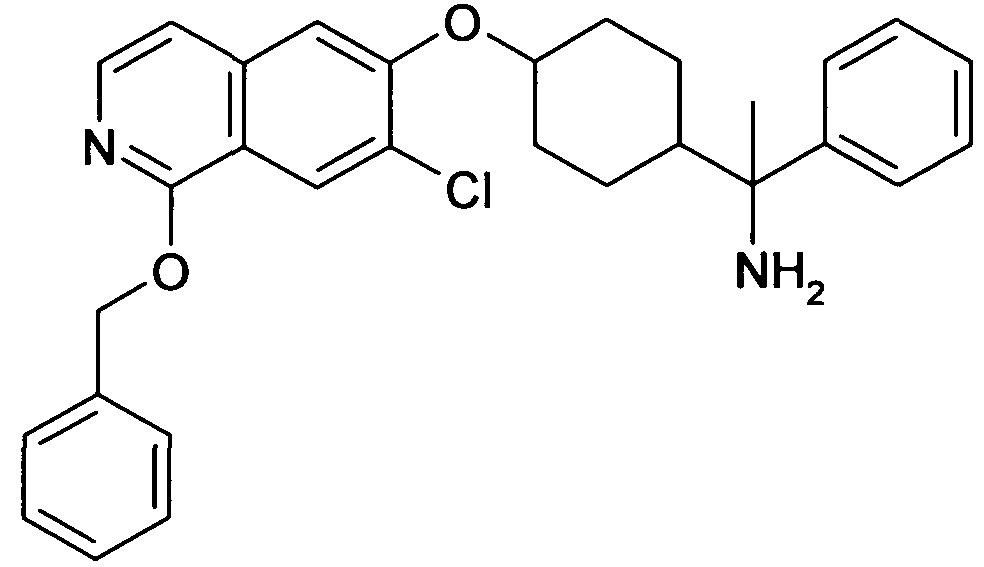
4-(1-Амино-1-фенилэтил)циклогексанол (30, 404 мг, 1,6 ммоль) испаряли дважды из толуола досуха. Остаток растворяли в диметилацетамиде (3 мл), и раствор добавляли по каплям в атмосфере аргона к суспензии гидрида натрия (114 мг, 4,1 ммоль, 60% в минеральном масле) в диметилацетамиде (8 мл). После перемешивания в течение 1 часа, добавляли по каплям раствор 1-бензилокси-7-хлор-6-фторхинолина (38, 0,31 г, 1,09 ммоль) в диметилацетамиде (6 мл), и смесь перемешивали в течение ночи. Затем смесь нагревали и перемешивали при 60°C в течение 1 часа, затем охлаждали и добавляли воду (30 мл) для прерывания реакции. Продукт выделяли путем экстракции с помощью смеси дихлорметан/изопропанол (3:1) и испаряли органическую фазу при пониженном давлении. Очистка с помощью колонной хроматографии (силикагель, 2% метанола в дихлорметане) давала требуемый продукт (67 мг) в виде бесцветного твердого вещества. Rt=4,3 минуты (Метод 3). Обнаруженная масса: 487,3 (M+H+).
Пример 34: 6-[4-(1-Амино-1-фенилэтил)циклогексилокси]-7-хлор-2H-изохинолин-1-он
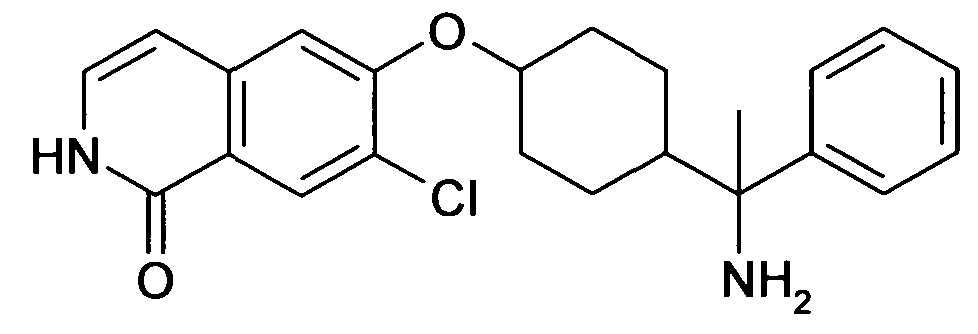
Хлористоводородную кислоту (6,6 мл 2M водного раствора) добавляли к раствору 1-[4-(1-бензилокси-7-хлоризохинолин-6-илокси)циклогексил]-1-фенилэтиламина (31, 67 мг, 0,14 ммоль) в изопропаноле (7 мл). Реакционную смесь перемешивали в течение ночи. Изопропанол удаляли при пониженном давлении, и оставшийся водный раствор лиофилизировали с получением неочищенного продукта в виде аморфного порошка.
Его дважды обрабатывали с помощью смеси ацетонитрил/вода и лиофилизировали с получением 57 мг требуемого продукта в виде бесцветной гидрохлоридной соли. Rt=2,83 минуты (Метод 3). Обнаруженная масса: 380,3 (M-NH3+H+).
Пример 116: 6-{4-[1-Амино-1-(4-фторфенил)этил]цикло-гексилокси}-7-хлор-2H-изохинолин-1-он (изомер 1)
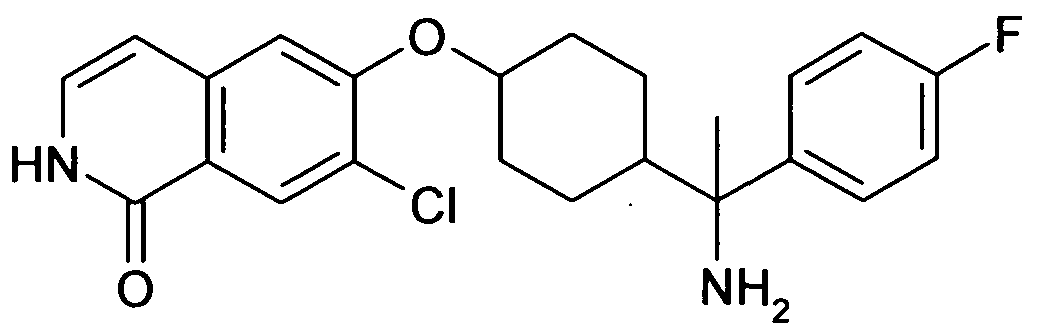
6-{4-[1-Амино-1-(4-фторфенил)этил]циклогексилокси}-7-хлор-2H-изохинолин-1-он (пример 116) получали по такой же методике, которая описана для синтеза соединения примера 34, используя 1-бензилокси-7-хлор-6-фторхинолин (38) и 4-[амино-4-фторфенил-метил]циклогексанол (полученный из 1,4-диоксаспиро[4.5]декан-8-карбонитрила, 4-фторфенилмагнийбромида и метиллития таким же образом, как для соединения 30). Rt=1,74 минуты (Метод 20). Обнаруженная масса: 398,2 (M-NH3+H+).
Пример 117: 6-{4-[1-Амино-1-(4-метоксифенил)этил]-циклогексилокси}-7-хлор-2H-изохинолин-1-он
a) 1-[4-(7-хлор-1-метоксиизохинолин-6-илокси)циклогексил]-1-(4-метоксифенил)этиламин (109)
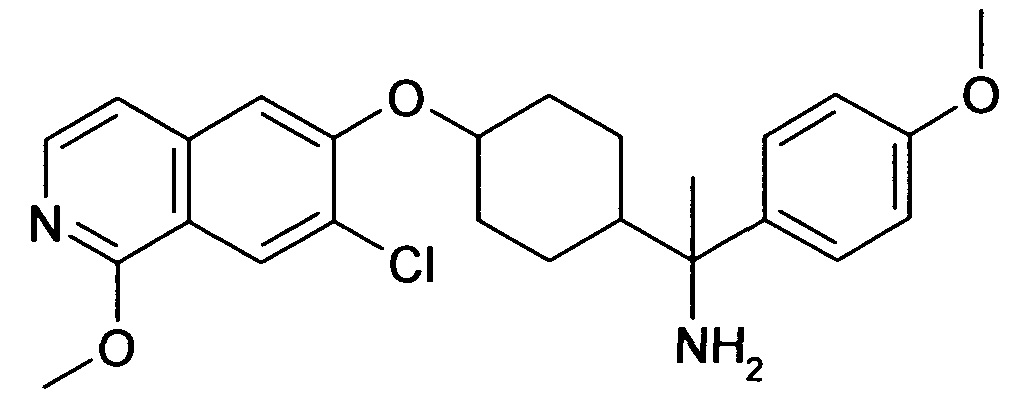
4-[1-Амино-1-(4-метоксифенил)этил)циклогексанол (полученный так же, как описано для синтеза соединения 30, 400 мг, 1,4 ммоль) дважды испаряли из толуола досуха. Остаток растворяли в диметилацетамиде (3 мл), и раствор добавляли по каплям в атмосфере аргона к суспензии гидрида натрия (147 мг, 3,7 ммоль, 60% в минеральном масле) в диметилацетамиде (6 мл). После перемешивания в течение 1 часа, добавляли по каплям раствор 7-хлор-6-фтор-1-метоксиизохинолина (0,3 г, 1,4 ммоль) в диметилацетамиде (6 мл), и смесь перемешивали в течение ночи. Затем смесь нагревали и перемешивали при 60°C в течение 1 часа, затем охлаждали и добавляли воду (30 мл) для прерывания реакции. Продукт выделяли путем экстракции с помощью смеси дихлорметан/изопропанол (3:1) и испарения органической фазы при пониженном давлении. Очистка путем колонной хроматографии (силикагель, от дихлорметана к дихлорметан:метанол=98:2 к MeOH) давала требуемый продукт (30 мг) в виде бесцветного твердого вещества. Rt=3,84 минуты (Метод 3). Обнаруженная масса: 441,4 (M+H+).
b) 6-{4-[1-Амино-1-(4-метоксифенил)этил]циклогексилокси}-7-хлор-2H-изохинолин-1-он (пример 117)
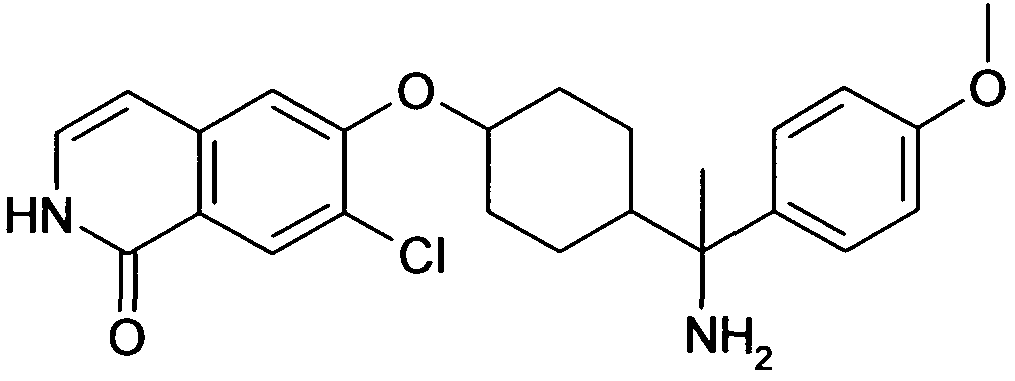
Хлористоводородную кислоту (0,4 мл 1M водного раствора) добавляли к раствору 1-[4-(7-хлор-1-метоксиизохинолин-6-илокси)-циклогексил]-1-(4-метоксифенил)этиламина (109, 30 мг, 0,07 ммоль) в изопропаноле (0,4 мл). Реакционную смесь нагревали в микроволновой печи при 100°C в течение 30 минут. Изопропанол удаляли при пониженном давлении, и оставшийся водный раствор лиофилизировали с получением неочищенного продукта в виде аморфного порошка. Его дважды обрабатывали с помощью смеси ацетонитрил/вода и лиофилизировали с получением 29 мг требуемого продукта примера 117 в виде бесцветной гидрохлоридной соли. Rt=2,60 минуты (Метод 2). Обнаруженная масса: 410,1 (M-NH3+H+).
Следующие рацемические продукты получали по такой же методике, как описанная для синтеза соединения примера 117, используя 7-хлор-6-фтор-1-метоксиизохинолин (10) и соответствующие аминоспирты (получаемые из соответствующих карбонитрилов, реактивов Гриньяра и метил- или этиллития таким же образом, как в случае соединения 30). Можно было выделить один стереоизомер (называемый изомером 1); относительную стереохимию не указывали.
|
Пример 122: 6-{4-[1-Амино-1-этилпропил]циклогексилокси}-7-хлор-2H-изохинолин-1-он (изомер 2)
а) 7-хлор-6-гидрокси-1-метоксиизохинолин (110)
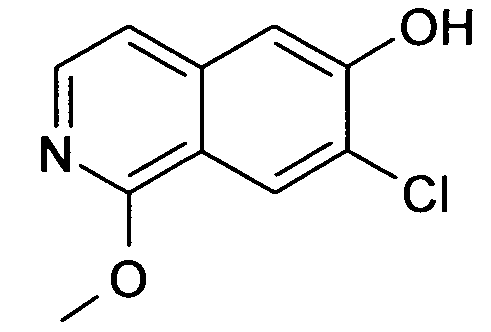
Раствор триметилсиланоата натрия (149,2 мл, 1M в THF) добавляли в атмосфере аргона к раствору 7-хлор-6-фтор-1-метоксиизохинолина (10, 10 г, 47,2 ммоль) в DMA (200 мл). После перемешивания при 60°C в течение 24 часов, раствор испаряли при пониженном давлении и затем лиофилизировали с получением неочищенного продукта (20,4 г). Его растворяли в воде, и корректировали pH до pH=6,5. Отфильтровывали светло-коричневый осадок и очищали его путем хроматографии с обращенной фазой (от 0 до 4 минут, 15% ацетонитрил/вода, от 4 до 24 минут от 15 до 90% ацетонитрил/вода и затем 100% ацетонитрила) с получением 7 г требуемого продукта. Rt=2,60 минуты (Метод 2). Обнаруженная масса: 210,0 (M+H+).
b) трет-Бутиловый эфир 1-(4-[7-хлор-1-метоксиизохинолин-6-илоксициклогексил)-1-этилпропил]карбаминовой кислоты (111)
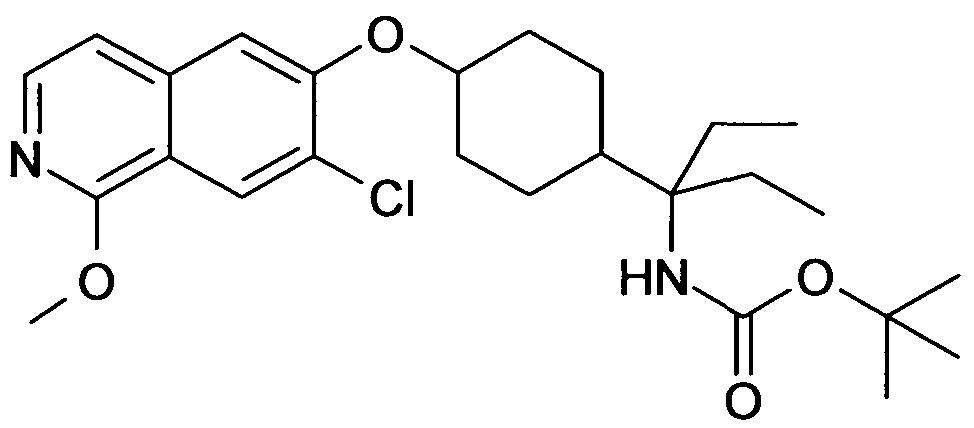
трет-Бутиловый эфир [1-(4-гидроксициклогексил)-1-этилпропил]карбаминовой кислоты (из синтеза соединения 119) дважды сушили путем испарения из толуола. Осушенный материал растворяли в сухом THF (2,5 мл), и добавляли трифенилфосфин (0,63 г, 2,42 ммоль), и 7-хлор-6-гидрокси-1-метоксиизохинолин (110, 0,39 г, 1,86 ммоль). Затем добавляли основание Хюнига (0,24 г, 0,32 мл, 1,86 ммоль). Реакционную смесь охлаждали до 0°C и добавляли по каплям DEAD (0,49 г, 434 мкл, 2,79 ммоль) в течение 1 часа. Реакционную смесь подогревали до 25°C и перемешивали в течение ночи.
Реакционную смесь помещали в дихлорметан, промывали дважды с помощью 2M водного раствора NaOH и один раз с помощью рассола. Сушка над сульфатом натрия с последующей фильтрацией и испарением давала 1,7 г неочищенного продукта, который очищали путем перемешивания три раза со смесью 5% этилацетата/95% гептана. Объединенные органические экстракты испаряли с получением коричневого остатка, который очищали с помощью хроматографии на силикагеле. Элюирование смесью гептан/этилацетат (95:5) давало 113 мг требуемого соединения. Rt=1,54 минуты (Метод 11). Обнаруженная масса: 476,2 (M+H+).
c) 6-{4-[1-Амино-1-этилпропил]циклогексилокси}-7-хлор-2H-изохинолин-1-он, изомер 2 (пример 122)
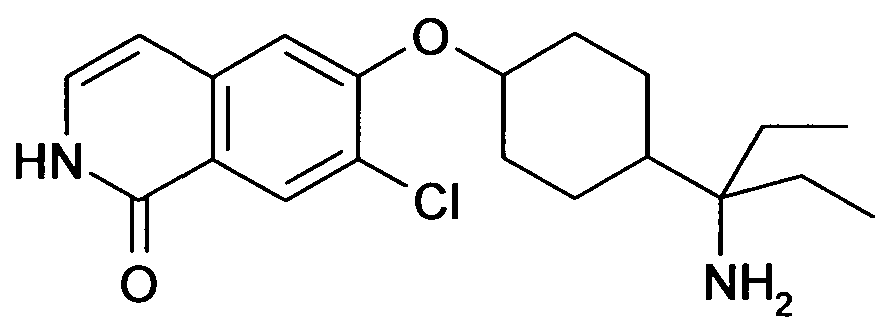
трет-Бутиловый эфир 1-(4-[7-хлор-1-метоксиизохинолин-6-илоксициклогексил)-1-этилпропил]карбаминовой кислоты (111, 113 мг, 0,24 ммоль) растворяли в изопропаноле (1,5 мл) и обрабатывали с помощью хлористоводородной кислоты (1M, 1,5 мл). Реакционную смесь нагревали в микроволновой печи при 100°C в течение 30 минут. Испарение давало неочищенный продукт, который дважды обрабатывали с помощью смеси ацетонитрил/вода и лиофилизировали с получением 63 мг требуемого продукта в виде бесцветной гидрохлоридной соли. Rt=2,45 минуты (Метод 2). Обнаруженная масса: 363,3 (M+H+).
Следующих два рацемических продукта получали по такой же методике, как описанная для синтеза соединения примера 122, используя 7-хлор-6-гидрокси-1-метоксиизохинолин (110) и соответствующий трет-бутиловый эфир 1-(4-гидроксициклогексил)-1-этил]карбаминовой кислоты (полученный так же, как соединение 30). Выделенные продукты являлись стереоизомерами, которые отличались от изомера примера 34 и примера 121, поэтому их называли "изомер 2", однако их относительную стереохимию не указывали.
|
Примеры 125 и 126: 6-[3-(1-Аминопропил)-3-(4-фторфенил)-циклобутилокси]-7-хлор-2H-изохинолин-1-он
a) 3-Циано-3-(4-фторфенил)циклобутан-1-ол (112)
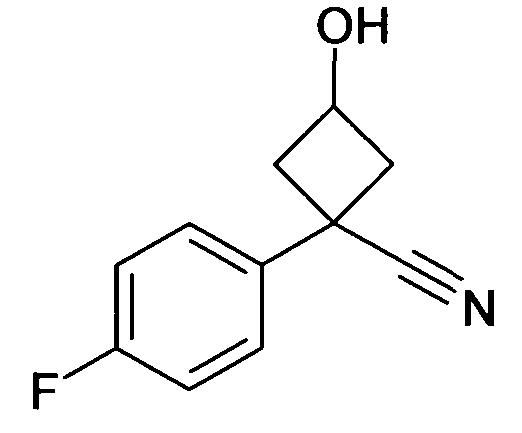
Комплекс метиллитий-бромид лития (123 мл, 185 ммоль) добавляли по каплям к раствору 4-фторацетонитрила (22 мл, 25 г, 185 ммоль) в THF (550 мл) при -70°C. После перемешивания в течение 1 часа при -70°C, добавляли по каплям раствор эпибромгидрина (15,8 мл, 25,3 г, 185 ммоль) в THF (125 мл). Реакционную смесь перемешивали в течение еще одного часа. Затем добавляли по каплям при -70°C метилмагниййодид в эфире (3M, 61,7 мл, 185 ммоль), и реакционную смесь осторожно нагревали до комнатной температуры при перемешивании в течение ночи. Затем реакционную смесь охлаждали на ледяной бане и по каплям добавляли воду (30 мл) и затем хлористоводородную кислоту (5M). Кислотный раствор насыщали хлоридом натрия и экстрагировали с помощью метил-трет-бутилового эфира. Затем органическую фазу промывали с помощью раствор тиосульфата натрия и рассола. После осушки над сульфатом натрия осуществляли фильтрацию, растворитель удаляли при пониженном давлении с получением неочищенного продукта (33,5 г) в виде оранжевого масла. Соединение очищали с помощью хроматографии на силикагеле, элюирование с помощью смеси гептан/этилацетат давало 19,8 г требуемого соединения. Rt=3,33 минуты (Метод 3). Обнаруженная масса: 192,1 (M+H+).
b) 3-Циано-3-(4-фторфенил)циклобутан-1-ила трет-бутил-диметилсилиловый эфир (113)
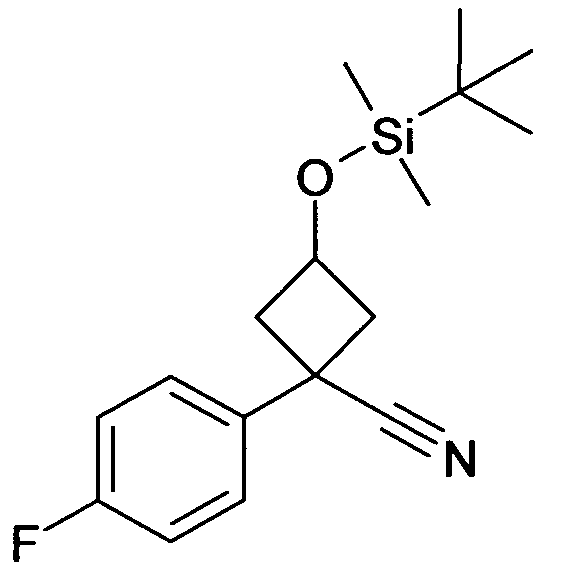
3-циано-3-(4-фторфенил)циклобутан-1-ол (112, 19,8 г, 103,6 ммоль) растворяли в дихлорметане (200 мл) в атмосфере аргона, затем добавляли 2,6-лутидин (27,78 г, 30,1 мл, 259 ммоль), и раствор охлаждали до 0°C. Добавляли по каплям трет-бутилдиметилсилилтрифторметансульфонат (32,9 г, 28,6 мл, 124,3 ммоль) и перемешиваемую реакционную смесь подогревали до комнатной температуры в течение ночи. Реакционную смесь последовательно промывали с помощью воды, хлористоводородной кислоты (0,1M), насыщенного раствора бикарбоната натрия и рассола, затем сушили над сульфатом натрия. Фильтрование и испарение давало 32,9 г желтого масла, которое использовали на следующей стадии без дополнительной очистки. Rt=1,30 минуты (Метод 18). Обнаруженная масса: 306,3 (M+H+).
c) 1-(1-Аминопропил)-1-(4-фторфенил)циклобутан-3-ол (114)
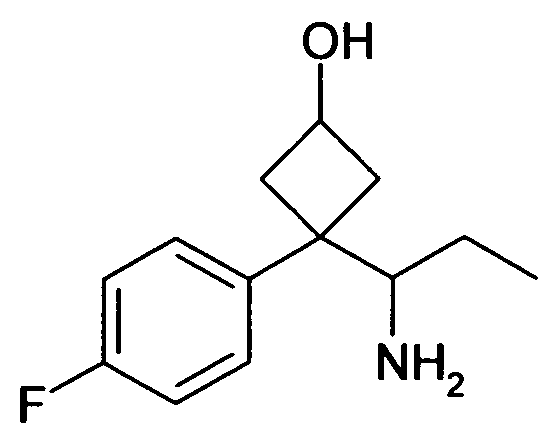
3-циано-3-(4-фторфенил)циклобутан-1-ил-третбутилдиметил-силиловый эфир (113, 1,55 г, 5,1 ммоль) растворяли в толуоле (4 мл) и добавляли по каплям этилмагнийбромид (3,4 мл, 10,2 ммоль, 3M в эфире). Реакционную смесь затем перемешивали в течение 30 минут при 90°C. После охлаждения до 0°C, реакцию прерывали путем добавления метанола (20 мл), затем добавляли боргидрид натрия (384 мг, 10,2 ммоль). После перемешивания в течение ночи добавляли разбавленный раствор гидроксида натрия (50 мл, 1M водный раствор), и смесь экстрагировали с помощью метил-трет-бутилового эфира. Органическую фазу перемешивали с хлористоводородной кислотой (2N, 100 мл) в течение 4 часов. Затем водный слой промывали с помощью метил-трет-бутилового эфира, после чего подщелачивали с помощью раствора гидроксида натрия (5M) и экстрагировали с помощью смеси дихлорметан/изопропанол (3/1). Испарение органического слоя давало 900 мг соединения (114) в виде желтого масла. Rt=1,04 минуты (Метод 10). Обнаруженная масса: 224,2 (M+H+).
d) 1-[3-(7-Хлор-1-метоксиизохинолин-6-илокси)циклобутил]-1-(4-фторфенил)пропиламин (115 и 116)
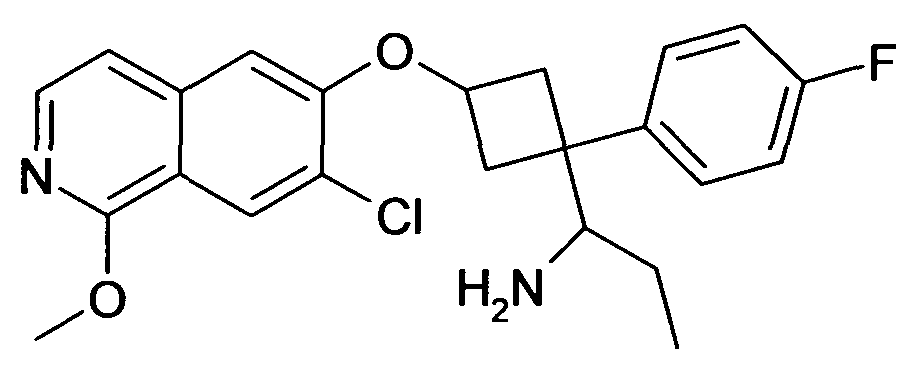
1-[3-(7-хлор-1-метоксиизохинолин-6-илокси)циклобутил]-1-(4-фторфенил)пропиламин (2 изомерные смеси) получали из 1-(1-аминопропил)-1-(4-фторфенил)циклобутан-3-ола (114) и 7-хлор-6-фтор-1-метоксиизохинолина (10) как описано для соединения (109). Два стериоизомера могут быть разделены с помощью хроматографии на силикагеле, относительную стереохимию не указывали.
115: Rt=1,50 минуты (Метод 10). Обнаруженная масса: 415,2 (M+H+).
116: Rt=1,55 минуты (Метод 10). Обнаруженная масса: 415,2 (M+H+).
e) 6-[3-(1-Аминопропил)-3-(4-фторфенил)циклобутилокси]-7-хлор-2H-изохинолин-1-он (пример 125 и 126)
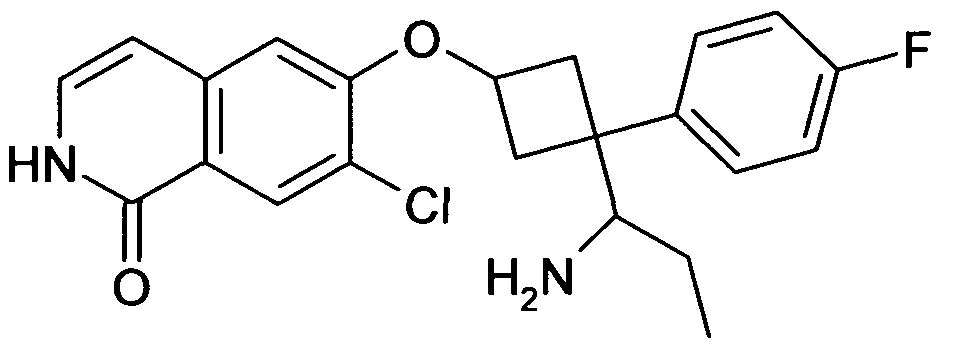
6-[3-(1-Аминопропил)-3-(4-фторфенил)циклобутилокси]-7-хлор-2H-изохинолин-1-он (пример 125 и 126) получали из 1-[3-(7-хлор-1-метоксиизохинолин-6-илокси)циклобутил]-1-(4-фторфенил)пропил-аминов 115 и 116, как описано в примере 117.
Пример 125: Rt=0,94 минуты (Метод 11). Обнаруженная масса: 401,1 (M+H+).
Пример 126: Rt=1,34 минуты (Метод 10). Обнаруженная масса: 401,1 (M+H+).
Пример 127: 6-[3-(1-Аминопропил)-3-(4-фторфенил)-циклопентилокси]-7-хлор-2H-изохинолин-1-он
a) 1-циано-1-(4-фторфенил)циклопент-3-ен (117)
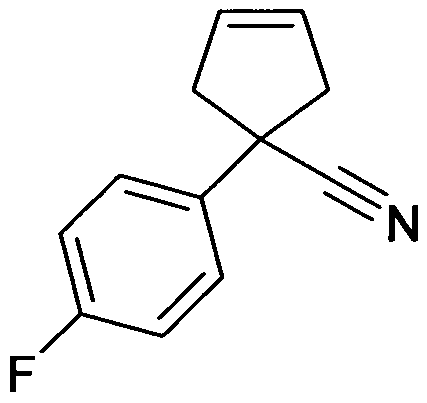
Гидрид натрия (14,4 г, 0,36 моль, 60% в масле) добавляли к охлаждаемому льдом DMSO (500 мл) в атмосфере аргона и перемешивали в течение 10 минут. 4-Фторацетонитрил (22,4 г, 0,16 моль) растворяли в DMSO (200 мл), и затем добавляли в течение 15 минут к перемешиваемой, охлаждаемой смеси гидрида натрия. После добавления по каплям цис-1,4-дихлорбутена (17,7 г, 14,9 мл) смесь подогревали до комнатной температуры и затем перемешивали в течение ночи. Реакцию прерывали путем осторожного добавления реакционной смеси в 1000 мл очень холодной воды, и затем экстрагировали с помощью дихлорметана. Испарение давало неочищенный продукт, который помещали в смесь гептан/этилацетат (1/1) и промывали с помощью воды три раза. Органическую фазу сушили над сульфатом натрия, фильтровали и испаряли с получением 33,7 г красного масла. Его очищали с помощью хроматографии на силикагеле, элюирование смесью гептан/этилацетат (1/2) давало 10,1 г требуемого соединения 117.
b) 1-(1-аминопропил)-1-(4-фторфенил)циклопент-3-ен (118)
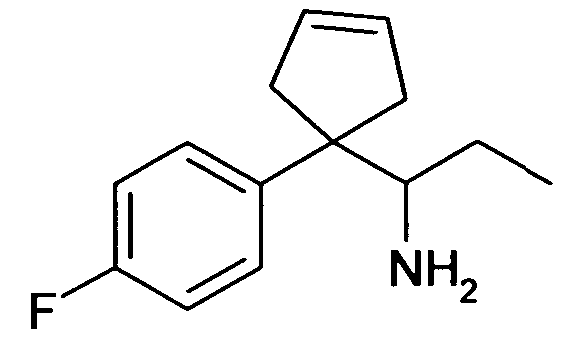
1-циано-1-(4-фторфенил)циклопент-3-ен (117, 1,4 г, 7,48 ммоль) растворяли в толуоле (3,5 мл) и добавляли этилмагнийбромид (5 мл, 15 ммоль, 3M в эфире). После перемешивания в течение 2,5 часов, реакционную смесь добавляли по каплям в охлаждаемый льдом метанол (50 мл), затем боргидрид натрия (560 мг, 15 ммоль). Смесь подогревали до комнатной температуры и перемешивали в течение ночи. Белую суспензию обрабатывали с помощью раствора гидроксида натрия (водный, 1M, 125 мл) и затем экстрагировали с помощью смеси дихлорметан/изопропанол (3/1). Органическую фазу промывали с помощью рассола, сушили над сульфатом натрия и испаряли с получением 1,2 г желтого масла. Его помещали в дихлорметан и экстрагировали дважды с помощью разбавленной хлористоводородной кислоты (2M). Объединенные водные слои подщелачивали с помощью водного раствора гидроксида натрия (5M) и повторно экстрагировали с помощью смеси дихлорметан/изопропанол (3/1). Сушка над сульфатом натрия и испарение давало 348 мг требуемого продукта Rt=2,37 минуты (Метод 2). Обнаруженная масса: 220,1 (M+H+).
c) 1-(1-аминопропил)-1-(4-фторфенил)циклопентан-3-ол (119)
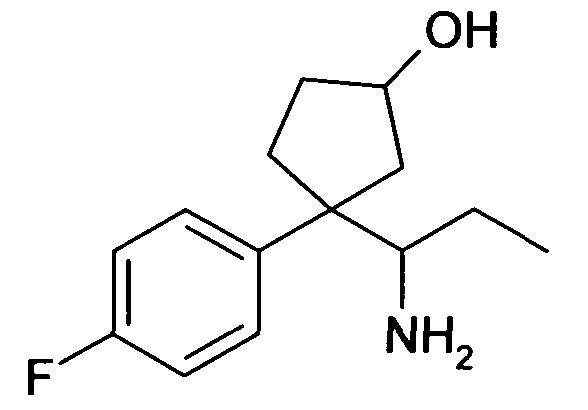
1-(1-аминопропил)-1-(4-фторфенил)циклопент-3-ен (118, 348 мг, 1,6 ммоль) растворяли в THF при 0°C в атмосфере аргона. Добавляли по каплям боран (1,75 мл, 1,75 ммоль, 1M в THF) в течение 10 минут. Реакционную смесь подогревали до комнатной температуры перед перемешиванием в течение ночи. После охлаждения до 0°C, добавляли воду (4 мл), затем пероксид водорода (0,61 мл, 30% раствор в воде) и раствор гидроксида натрия (1,75 мл, 1M водный раствор). После перемешивания в течение 5 минут смесь экстрагировали с помощью этилацетата, сушили над сульфатом натрия и испаряли с получением 458 мг требуемого продукта, который перемешивали в течение 15 минут с разбавленной хлористоводородной кислотой (10 мл, 2M водный раствор). Испарение и затем лиофилизирование давало 514 мг требуемого продукта в форме смеси четырех стереоизомеров в виде бесцветной гидрохлоридной соли. Rt=1,83, 1,99, 2,36, 2,86 минуты (Метод 2). Обнаруженная масса: 203,1 (M-NH3-H2O+H+).
d) 1-[3-(7-хлор-1-метоксиизохинолин-6-илокси)циклопентил]-1-(4-фторфенил)пропиламин (120)
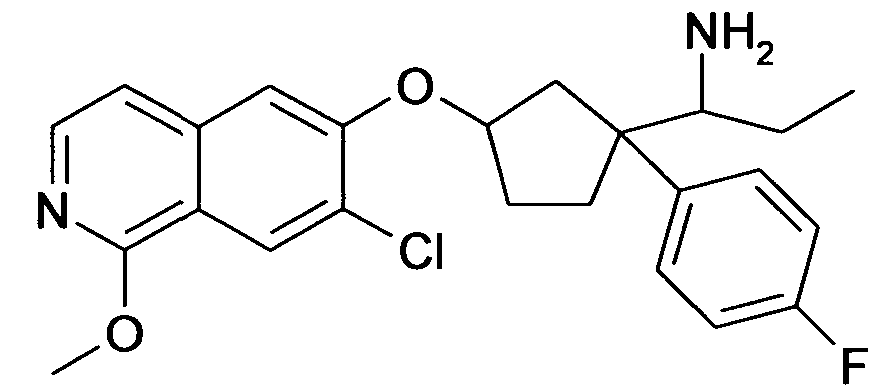
1-[3-(7-хлор-1-метоксиизохинолин-6-илокси)циклопентил]-1-(4-фторфенил)пропиламин (120) получали из 1-(1-аминопропил)-1-(4-фторфенил)циклопентан-3-ола (119) и 7-хлор-6-фтор-1-метоксиизохинолина (10), как описано для соединения 109. Rt=1,11 минуты (Метод 11). Обнаруженная масса: 429,3 (M+H+). Продукт получали в виде смеси изомеров, их относительная стереохимия не указывалась.
e) 6-[3-(1-Аминопропил)-3-(4-фторфенил)циклопентилокси]-7-хлор-2H-изохинолин-1-он (пример 127)
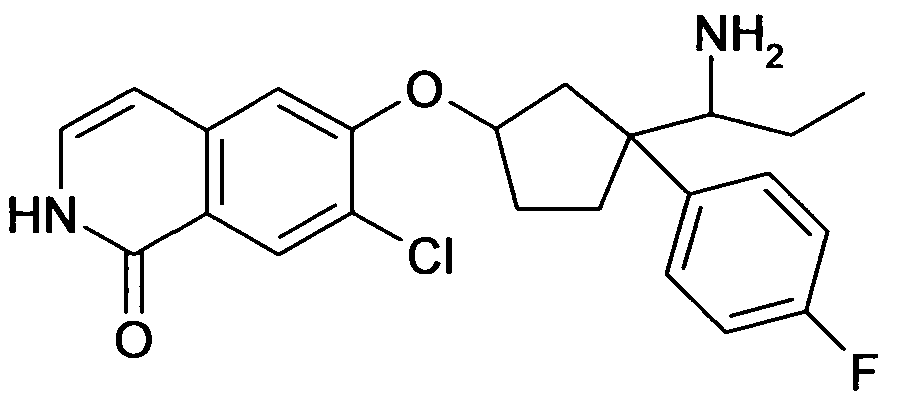
6-[3-(1-Аминопропил)-3-(4-фторфенил)циклопентилокси]-7-хлор-2H-изохинолин-1-он (пример 127) получали из 1-[3-(7-хлор-1-метоксиизохинолин-6-илокси)циклопентил]-1-(4-фторфенил)пропил-амина (120), как описано в примере 117. Материал получали в виде смеси стереоизомеров, их относительную стереохимию не указывали. Rt=1,34, 1,37 минуты (Метод 10). Обнаруженная масса: 415,1 (M+H+).
C-(1,4-Диоксаспиро[4.5]дец-8-ил)-C-(4-метоксифенил)-метиламин (32)
В атмосфере аргона добавляли 4-метоксифенилмагнийбромид (0,5M в THF, 24 мл, 12 ммоль) к раствору 1,4-диокса-спиро[4.5]декан-8-карбонитрила (1,0 г, 6 ммоль) в THF (100 мл). Смесь перемешивали при кипячении с обратным холодильником в течение 16 часов. Затем реакционную смесь охлаждали до 0°C. Добавляли по каплям насыщенный раствор сульфата натрия до тех пор, пока не заканчивалось образование осадка. Осадок удаляли с путем фильтрации и промывали с помощью THF. Объединенные органические фазы перемешивали с боргидридом натрия (452 мг, 12 ммоль) в течение ночи при 25°C. Затем реакционную смесь разбавляли с помощью трет-бутилметилового эфира (100 мл) и обрабатывали с помощью 0,05M водной хлористоводородной кислоты (три раза по 100 мл). Объединенные водные фазы доводили до щелочного pH с помощью 6M водного раствора гидроксида натрия при охлаждении, затем экстрагировали с помощью дихлорметана с получением раствора требуемого продукта, который непосредственно использовали на следующей стадии. Rt=0,74 минуты (Метод 5). Обнаруженная масса: 278,2 (M+H+).
трет-Бутиловый эфир [(4-метоксифенил)-(4-оксоциклогексил)метил]карбаминовой кислоты (33)
При охлаждении добавляли ди-трет-бутилдикарбонат (1,31 г, 6 ммоль) и триэтиламин (0,83 мл, 6 ммоль) к неочищенному раствору C-(1,4-диоксаспиро[4.5]дец-8-ил)-C-(4-метоксифенил)метиламина (32) с предыдущей стадии. После перемешивания в течение ночи, реакционную смесь экстрагировали с помощью дихлорметана и промывали с помощью 1M HCl. The водный слой обрабатывали с помощью 1M раствора NaOH до щелочного pH и затем экстрагировали с помощью дихлорметана. После промывки объединенной органической фазы с помощью рассола и сушки над сульфатом натрия, органическую фазу испаряли с получением неочищенного продукта, который подвергали хроматографии на силикагеле. Элюирование с помощью смеси этилацетат/гексан (30/70) давало 110 мг требуемого продукта. Rt=4,42 минуты (Метод 6). Обнаруженная масса: 278,1 (M-изобутен+H+).
трет-Бутиловый эфир [(4-гидроксициклогексил)-(4-метоксифенил)метил]карбаминовой кислоты (34)
Боргидрид натрия (12 мг, 0,34 ммоль) и 2 капли метанола добавляли к раствору трет-бутилового эфира [(4-метоксифенил)-(4-оксоциклогексил)метил]карбаминовой кислоты (33, 110 мг) в THF (5 мл). После перемешивания в течение 7 часов реакционную смесь выделяли путем промывки раствора с помощью насыщенного раствора бикарбоната натрия и рассола. После сушки органической фазы над сульфатом натрия, ее фильтровали, испаряли с получением 101 мг смеси требуемых цис/транс изомеров (34) в виде бесцветного твердого вещества, которое непосредственно использовали на следующей стадии. Rt=1,36, 1,39 минуты (Метод 5). Обнаруженная масса: 219,2 (M-C4H8-CO2-H2O+).
4-[Амино(4-метоксифенил)метил]циклогексанол (35)
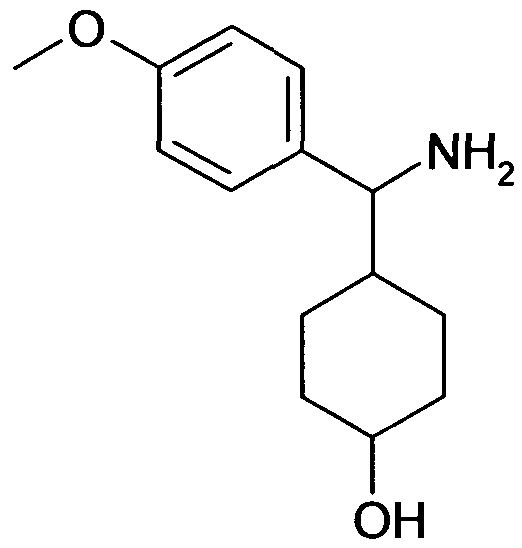
Трифторуксусную кислоту (0,31 мл) добавляли к раствору трет-бутилового эфира [(4-гидроксициклогексил)-(4-метоксифенил)метил]карбаминовой кислоты (34, 101 мг) в дихлорметане (6 мл). После перемешивания в течение 2 часов, добавляли 2M хлористоводородную кислоту (3 мл). Испарение давало неочищенный продукт в виде бесцветного твердого вещества. Добавляли воду и ацетонитрил, и смесь концентрировали и затем лиофилизировали с получением 83 мг 4-[амино(4-метоксифенил)метил]циклогексанола (35) в виде гидрохлоридной соли. Rt=0,71 минуты (Метод 5). Обнаруженная масса: 219,2 (M-NH2 +).
C-[4-(1-Бензилокси-7-хлоризохинолин-6-илокси)циклогексил]-C-(4-метоксифенил)метиламин (36 и 37).
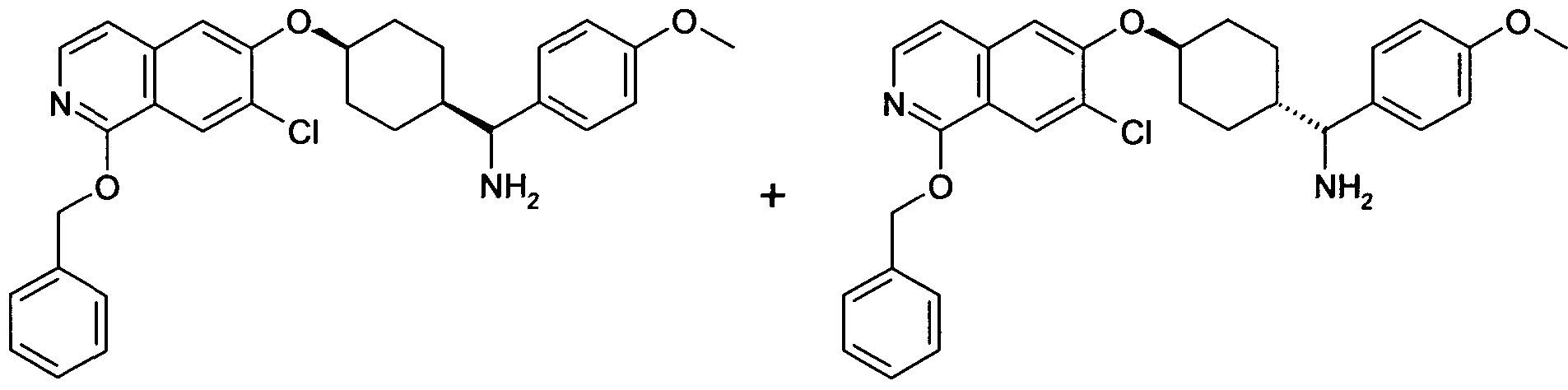
4-[Амино(4-метоксифенил)метил]циклогексанол (35, 83 мг, 0,3 ммоль) дважды испаряли из толуола досуха. Остаток растворяли в диметилацетамиде (1 мл), и раствор добавляли по каплям в атмосфере аргона к суспензии гидрида натрия (37 мг, 0,92 ммоль, 60% в минеральном масле) в диметилацетамиде (2 мл). После перемешивания в течение 1 часа добавляли по каплям раствор 1-бензилокси-7-хлор-6-фторхинолина (38, 62 мг, 0,21 ммоль) в диметилацетамиде (2 мл) и смесь перемешивали в течение ночи. Затем смесь обрабатывали с помощью воды (6 мл) для прерывания реакции. Продукт выделяли путем экстракции с помощью смеси дихлорметан/изопропанол (3:1), и затем получали неочищенный продукт путем испарения органической фазы при пониженном давлении. Очистка с помощью колонной хроматографии (силикагель, 5% метанола в дихлорметане) давала 40 мг ранее элюируемого изомера 1 (36) и 40 мг позже элюируемого изомера 2 (37), оба в виде бесцветных твердых веществ. Относительную стереохимию не указывали.
36: Rt=1,46 минуты (Метод 5). Обнаруженная масса: 503,2 (M+H+).
37: Rt=1,51 минуты (Метод 5). Обнаруженная масса: 503,2 (M+H+).
Пример 35 и Пример 36: 6-{4-[Амино-(4-метоксифенил)метил]-циклогексилокси}-7-хлор-2H-изохинолин-1-он
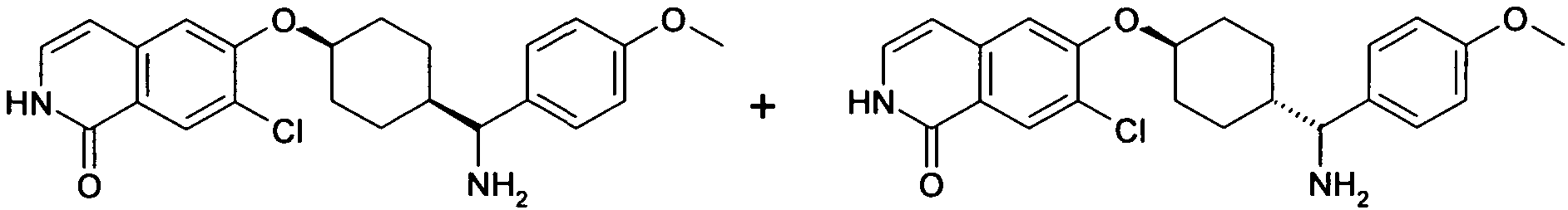
2M водный раствор хлористоводородной кислоты (3,8 мл) добавляли к раствору C-[4-(1-бензилокси-7-хлоризохинолин-6-илокси)циклогексил]-C-(4-метоксифенил)метиламина (36, 40 мг, 0,08 ммоль) в изопропаноле (4 мл). Реакционную смесь перемешивали в течение ночи. Изопропанол удаляли при пониженном давлении, и остававшийся водный раствор лиофилизировали с получением неочищенного продукта в виде аморфного порошка. Его дважды обрабатывали с помощью смеси ацетонитрил/вода и лиофилизировали с получением требуемого продукта в виде бесцветной гидрохлоридной соли. Относительную стереохимию не указывали.
Пример 35: Rt=2,56 минуты (Метод 1). Обнаруженная масса: 396,2 (M-NH2 +).
Соединение примера 36 синтезировали таким же образом, исходя из соединения 37: Rt=2,86 минуты (Метод 1). Обнаруженная масса: 396,2 (M-NH3+H+)
Следующие четыре продукта были получены с помощью такой же методики, что и описанная для синтеза соединения примера 35 и соединения примера 36, используя 1-бензилокси-7-хлор-6-фторизохинолин и соответствующие 4-[аминофенилметил]-циклогексанолы, используя соответствующие фенильные реактивы Гриньяра и 1,4-диоксаспиро[4.5]декан-8-карбонитрилы.
|
Альтернативный синтез соединения примера 40: 6-[4-(Амино-фенилметил)циклогексилокси]-7-хлор-2H-изохинолин-1-он
a) 4-Гидроксициклогексанкарбонитрил (121)
Раствор 10,0 г (59,8 ммоль) 4-цианоциклогексанон циклического этиленацеталя в смеси 80 мл уксусной кислоты и 20 мл воды нагревали в микроволновой печи при 130°C в течение 20 минут. Смесь охлаждали до комнатной температуры и медленно выливали в 2,2 л холодного насыщенного водного раствора бикарбоната натрия. Смесь экстрагировали дважды с помощью дихлорметана, органическую фазу сушили над сульфатом магния, фильтровали, добавляли 100 мл этанола, и дихлорметан удаляли в вакууме. Затем к раствору добавляли 2,0 г (52,9 ммоль) боргидрида натрия, и смесь перемешивали при комнатной температуре в течение ночи. Реакцию прерывали с помощью воды, и реакционную смесь дважды экстрагировали с помощью дихлорметана. Объединенный органический слой концентрировали в вакууме с получением 6,4 г 4-гидроксициклогексанкарбонитрила в виде смеси цис/транс изомеров с чистотой, достаточной для дальнейшего превращения. Rt=0,14 минуты (Метод 18). Обнаруженная масса: 126,1 (M+H+).
b) 4-(трет-Бутилдиметилсиланилокси)циклогексанкарбонитрил (122)
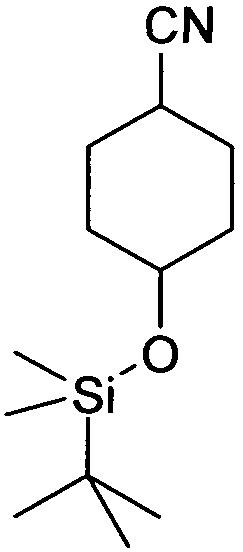
6,4 г (51,1 ммоль) 4-гидроксициклогексанкарбонитрила (121) растворяли в 120 мл дихлорметана, охлаждали до 0°C и добавляли 14,9 мл (13,7 г, 128 ммоль) 2,6-лутидина и 15,4 мл (14,9 г, 56,2 ммоль) трет-бутилдиметилсилилтрифторметансульфоната. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре, затем добавляли еще 5,0 мл трет-бутилдиметилсилилтрифторметан-сульфоната, и перемешивание продолжали в течение 1 часа. Реакционную смесь разбавляли с помощью 100 мл дихлорметана и промывали с помощью 100 мл воды, 80 мл насыщенного водного раствора бикарбоната натрия и 50 мл рассола. Органическую фазу сушили над сульфатом магния, фильтровали, концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (гептаны:этилацетат) с получением 9,76 г требуемого продукта. Rt=0,95 минуты (Метод 18). Обнаруженная масса: 240,1 (M+H+).
c) 4-(Аминофенилметил)циклогексанол (123)
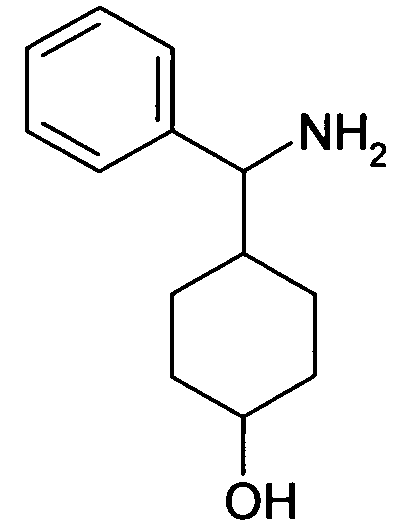
Синтезировали 417 мг 4-(Аминофенилметил)циклогексанола (123) в виде смеси диастереоизомеров, используя последовательность реакций, описанных для синтеза соединения 93, исходя из 700 мг 4-(трет-бутилдиметилсиланилокси)-циклогексанкарбонитрила (122) и 2,09 мл (5,85 ммоль) фенилмагнийбромида. Rt=0,43 минуты (Метод 18). Обнаруженная масса: 206,1 (M+H+).
d) 6-[4-(аминофенилметил)циклогексилокси]-7-хлор-2H-изохинолин-1-он (пример 40)
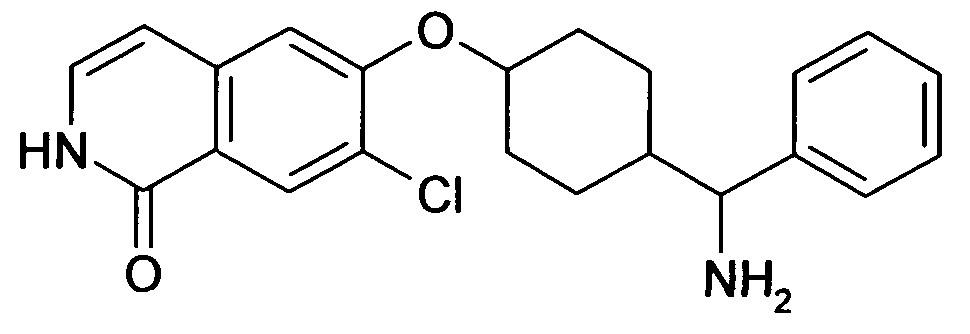
Соединение примера 40 синтезировали с использованием последовательности реакций, описанных для синтеза соединения примера 1. Использовали 240 мг 4-(аминофенилметил)циклогексанола (123) и 272 мг 7-хлор-6-фтор-1-метоксиизохинолина (10) с получением 51 мг соединения примера 40 в виде его гидрохлорида. Rt=1,34 минуты (Метод 10). Обнаруженная масса: 383,1 (M+H+). Кроме того, также выделяли 28 мг другого изомера 4-(аминофенил-метил)циклогексанола (пример 128) в виде его гидрохлорида. Rt=1,31 минуты (Метод 10). Обнаруженная масса: 383,1 (M+H+). Разделение двух изомеров проводили с помощью хроматографии на силикагеле после реакции сочетания аминоспирта 123 и соединения 10. Относительную стереохимию не указывали.
Следующие примеры получали таким же образом, как это описано для альтернативного получения соединения примера 40, используя в качестве исходных материалов соответствующие изохинолины и 4-(аминометил)циклогексанолы (полученные следующей последовательностью реакций, описанных для синтеза 123):
|
Следующие рацематы разделяли с помощью ВЭЖХ, используя хиральную колонку. Абсолютную стереохимию не определяли, ранее элюируемый энантиомер обозначали энантиомером один. В случае примера 41 и примера 42, разделение энантиомеров проводили на стадии получения рацемического защищенного O-бензилом предшественника (1-[транс-4-(1-бензилокси-7-хлор-изохинолин-6-илокси)-1-фенилциклогексил]-1-фенилметиламина) и конечные продукты выделяли после разделения, используя описанную выше стандартную методику. В случае примера 41 и примера 42, данные по временам удерживания приводятся для указанных защищенных соединений.
|
Энантиомерами, полученными в этих примерах путем разделения рацемата, являются
транс-6-[4-((S)-Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
транс-6-[4-((R)-Аминофенилметил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-Аминоциклопропилметил)-4-фенилциклогексил-окси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((S)-1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминоэтил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он,
6-{4-[(S)-Амино-(4-фторфенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
6-{4-[(R)-Амино(4-фторфенил)метил]циклогексилокси}-7-хлор-2H-изохинолин-1-он,
цис-6-[4-((R)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он и
цис-6-[4-((S)-1-Аминопропил)-4-фенилциклогексилокси]-7-хлор-2H-изохинолин-1-он.
(энантиомеры не были указаны как "энантиомер 1" или "энантиомер 2", соответственно)
Методы жидкостной хроматографии и масс-спектрометрии:
|
Определение ингибирования Rho киназы
Для измерения ингибирования Rho-киназы определяли значения IC50 согласно следующему протоколу:
Активный человеческий рекомбинантный ROCK II (остатки 11-552 His6-меченого терминального N рекомбинантного человеческого ROCK-II) был поставлен фирмой Millipore GmbH, Schwalbach, Germany. Пептидный субстрат, флюоресцеин-AKRRRLSSLRA-COOH, получали от фирмы JPT Peptide Technologies, Berlin, Germany. Аденозин-5'-трифосфат (ATP), бычий сывороточный альбумин (BSA), диметилсульфоксид (DMSO), 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (Hepes), Brij-35 (эфиры полиоксиэтилена), дитиотрейтол (DTT) и Pluronic F-68 (поверхностно активное вещество) были поставлены фирмой Sigma-Aldrich, Munich, Germany. Трис(гидроксиметил)аминометан (Tris), хлорид магний, NaOH, 1M HCl и EDTA получали от фирмы Merck Biosciences, Darmstadt, Germany. "Полный" ингибитор протеазы был поставлен фирмой Roche Diagnostics, Mannheim, Germany.
Испытуемые соединения разбавляли до соответствующих концентраций в буфере 1 (25 мM Tris-HCl, pH 7,4, 5 мM MgCl2, 2 мM DTT, 0,02% (мас./об.) BSA, 0,01% Pluronic F-68 и 3% DMSO). ROCK II фермент разбавляли до концентрации 100 нг/мл в буфере 2 (25 мM Tris-HCl, pH 7,4, 5 мM MgCl2, 2 мM DTT и 0,02% (мас./об.) BSA). Пептидный субстрат и АТФ разбавляли до концентраций 3 мкM и 120 мкмM, соответственно, в буфере 2. Два микролитра раствора соединения смешивали с 2 мкл разбавленного фермента в 384-луночном титрационном микропланшете небольшого объема (фирмы Greiner, Bio-One, Frickenhausen, Germany), и инициировали реакцию киназы путем добавления 2 мкл раствора, содержащего пептидный субстрат и АТФ. После 60 минут инкубирования при 32°C реакцию останавливали путем добавления 20 мкл раствора, содержащего 100 мM Hepes-NaOH, pH 7,4, 0,015% (по объему) Brij-35, 45 мM EDTA и 0,227% реагента 1 для нанесения на чип (фирмы Caliper Lifescience Inc, Hopkinton, MA). Затем определяли фосфорилирование пептидного субстрата на приборе Caliper 3000 по существу так же, как описано в публикации Pommereau et al., J. Biomol. Screening 9(5), 409-416, 2004. Условия разделения были следующими: давление - 1,3 фунт/дюйм кв., напряжение на входе - 1562 в, напряжение на выходе - 500 V, время забора образца 200 мсек. Положительный контроль (буфер 1 вместо соединения) и отрицательный контроль (буфер 1 вместо соединения и буфер 2 вместо ROCK II) осуществляли параллельно на каждом планшете.
Следующие продукты/соединения были испытаны в указанном исследовании путем использования соответствующей формы (соли или свободного основания), получаемой в описанных выше примерах, и были определены следующие значения активностей.
|
Приведенная в таблице активность обозначается как отрицательный десятичный логарифм значения IC50 (pIC50) следующим образом:
+: pIC50≤3,0
++: 3,0≤pIC50<4,0
+++: 4,0≤pIC50<5,0
++++: 5,0≤pIC50<6,0
+++++: 6,0≤pIC50<7,0
++++++: 7,0≤pIC50<8,0
+++++++: 8,0≤pIC50
Определение ингибирования протеинкиназы A и протеинкиназы G
Для измерения ингибирования PKA и PKG1-бета определяли значения IC50 согласно следующему протоколу:
активный рекомбинантный человеческий PKG1-бета (полноразмерный, с His-меченым терминальным N) был поставлен фирмой Millipore GmbH, Schwalbach, Germany. Активный рекомбинантный человеческий PKA (остатки 1-351, His-меченый терминальный N) получали от фирмы Invitrogen, Karlsruhe, Germany. Пептидный субстрат, флюоресцеин-AKRRRLSSLRA-COOH, получали от фирмы JPT Peptide Technologies, Berlin, Germany. Аденозин-5'-трифосфат (ATP), бычий сывороточный альбумин (BSA), диметилсульфоксид (DMSO), 4-(2-гидроксиэтил)-пиперазин-1-этансульфоновая кислота (Hepes), Brij-35 (эфиры полиоксиэтилена), дитиотреитол (DTT) и Pluronic F-68 (поверхностно активное вещество) были поставлены фирмой Sigma-Aldrich, Munich, Germany. Трис(гидроксиметил)аминометан (Tris), хлорид магний, NaOH, 1M HCl и EDTA получали от фирмы Merck Biosciences, Darmstadt, Germany. "Полный" ингибитор протеазы был поставлен фирмой Roche Diagnostics, Mannheim, Germany.
Испытуемые соединения разбавляли до соответствующих концентраций в буфере 1 (25 мM Tris-HCl, pH 7,4, 5 мM MgCl2, 2 мM DTT, 0,02% (мас./об.) BSA, 0,01% Pluronic F-68 и 3% DMSO). PKG1-бета и PKA разбавляли до концентрации 150 нг/мл и 30 нг/мл, соответственно, в буфере 2. Пептидный субстрат и АТФ разбавляли до концентраций 3 мкM и 120 мкM, соответственно, в буфере 2. Два микролитра раствора соединения смешивали с 2 мкл разбавленного фермента в 384-луночном титрационном микропланшете небольшого объема (фирмы Greiner, Bio-One, Frickenhausen, Germany), и инициировали реакцию киназы путем добавления 2 мкл раствора, содержащего пептидный субстрат и АТФ. После 60 минут инкубирования при 32°C реакцию останавливали путем добавления 20 мкл раствора, содержащего 100 мM Hepes-NaOH, pH 7,4, 0,015% (по объему) Brij-35, 45 мM EDTA и 0,227% реагента 1 для нанесения на чип (фирмы Caliper Lifescience Inc, Hopkinton, MA). Затем определяли фосфорилирование пептидного субстрата на приборе Caliper 3000 по существу так же, как описано в публикации Pommereau et al, J. Biomol. Screening 9(5), 409-416, 2004. Условия разделения были следующими: давление - 1,3 фунт/дюйм кв., напряжение на входе - 1562 в, напряжение на выходе - 500 V, время забора образца 200 мсек. Положительный контроль (буфер 1 вместо соединения) и отрицательный контроль (буфер 1 вместо соединения и буфер 2 вместо раствора киназы) осуществляли параллельно на каждом планшете.
Следующие продукты/соединения были испытаны в указанном исследовании путем использования соответствующей формы (соли или свободного основания), получаемой в описанных выше примерах, и были определены следующие значения активностей.
|