Результат интеллектуальной деятельности: ЛЕЧЕНИЕ ДЕРМАТОЛОГИЧЕСКИХ АЛЛЕРГИЧЕСКИХ СОСТОЯНИЙ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение направлено на способ терапии для пациентов-людей и не являющихся людьми пациентов, страдающих от или подверженных дерматологическим аллергическим состояниям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Опосредованные тучными клетками воспалительные состояния являются растущим опасением общественного здравоохранения. Триптаза накапливается в секреторных гранулах тучных клеток и является главной протеазой тучных клеток человека. Триптаза задействована в разнообразии биологических процессов, включая деградацию сосудорасширяющих и бронхорасширяющих нейропептидов (Caughey, et al., J. Pharmacol. Exp. Ther., 1988, 244, pages 133-137; Franconi, et al., J. Pharmacol. Exp. Ther., 1988, 248, pages 947-951; и Tam, et al., Am. J. Respir. Cell Mol. Biol., 1990, 3, pages 27-32).
Вследствие этого ингибиторы триптазы могут быть пригодными как противовоспалительные средства (K. Rice, P.A. Sprengler, Current Opinion in Drug Discovery and Development, 1999, 2(5), pages 463-474) и могут быть пригодными для лечения или предотвращения дерматологических аллергических состояний, таких как атопический дерматит (A. Jarvikallio et al., Br. J. Dermatol., 1997, 136, pages 871-877).
Такое соединение наверняка является полезным в лечении пациента, страдающего от состояний, которые можно облегчить путем введения ингибитора триптазы, например, опосредованные тучными клетками воспалительные состояния, воспаление и заболевания или расстройства, связанные с деградацией сосудорасширяющих нейропептидов, и имеет сниженную склонность к метаболизированию семикарбазид-чувствительной аминоксидазы (SSAO).
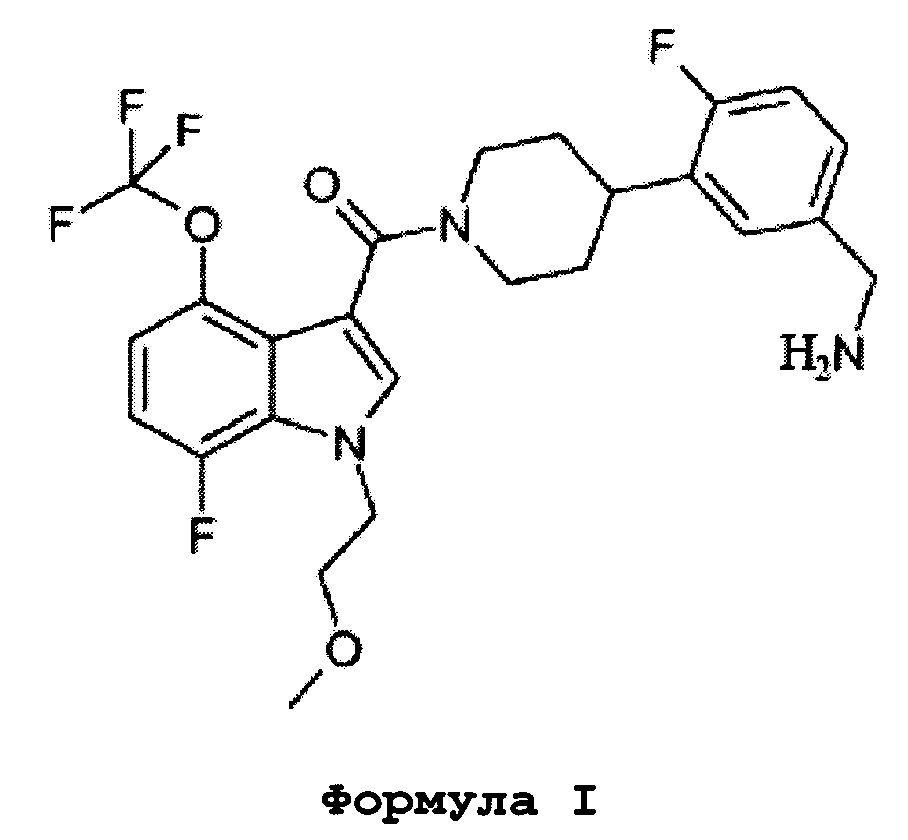
Соединение формулы I (Соединение A) является селективным и обратимо действующим ингибитором человеческой бета-триптазы и мышиной MCPT-6 (мышиного ортолога человеческой бета-триптазы) с Ki рекомбинантных ферментов 38 и 920 нМ, соответственно.
Формула I
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящее время авторами выявлено, что соединение Формулы I или его фармацевтически приемлемые соли, являются пригодными для лечения воспалительного заболевания пищеварительного тракта.
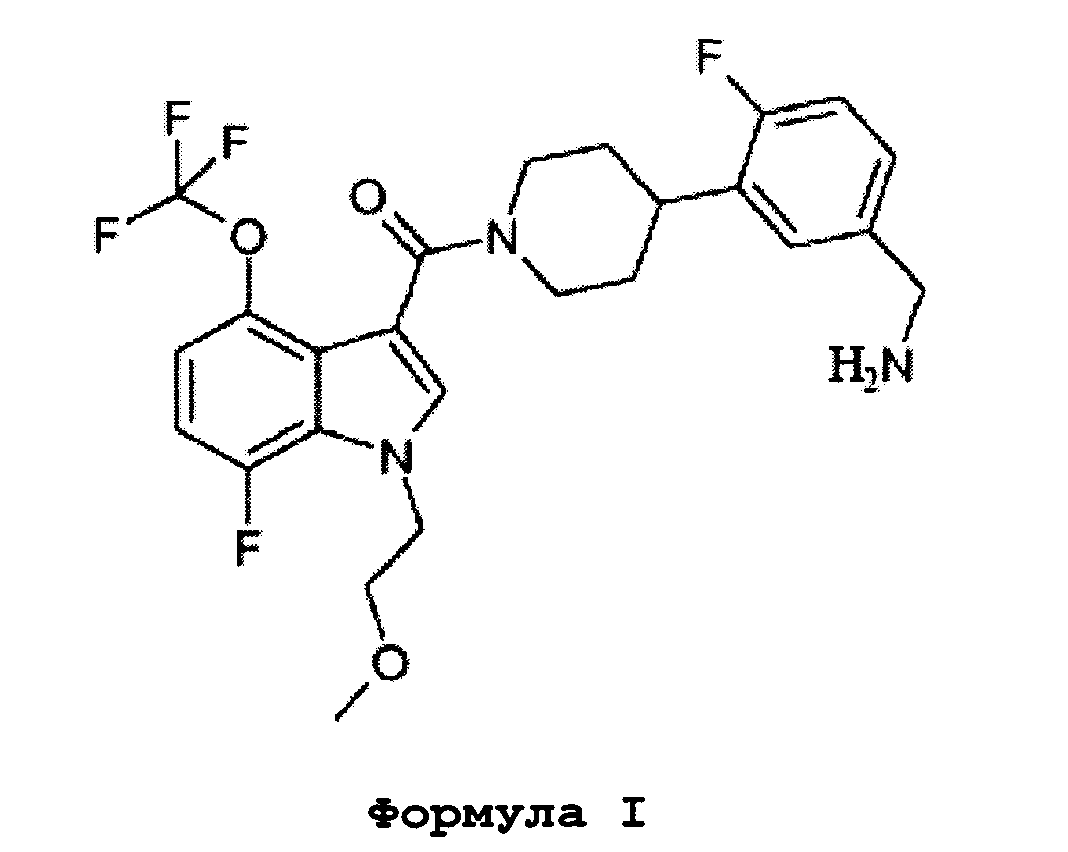
А именно, это изобретение относится к профилактическому или терапевтическому лекарственному средству при дерматологических аллергических состояниях, в частности атопическом дерматите, содержащем в качестве активной составляющей соединение или его соль, представленные Формулой I.
Также раскрыт способ лечения дерматологических аллергических состояний, в частности атопического дерматита, у млекопитающего, включающий стадию введения фармацевтически эффективного количества соединения, представленного Формулой I ниже, или в виде его фармацевтически приемлемой соли.
Формула I
Это соединение также известно как [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон.
Это изобретение направлено на соединение Формулы I, которое, как обнаружено в настоящее время, является активным в животной модели дерматологических аллергических состояний, в частности атопического дерматита.
Другим аспектом настоящего изобретения является фармацевтическая композиция для лечения дерматологических аллергических состояний.
Другим аспектом настоящего изобретения является лечение атопического дерматита.
Еще одним аспектом настоящего изобретения является лечение атопического дерматита путем лечения пациента в большинстве случаев ингибитором бета-триптазы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, в одном аспекте настоящее изобретение направлено на фармацевтические композиции, содержащие соединение основной Формулы I, которое также может быть известно как [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон или Соединение A.
В настоящем описании выражение «соединение настоящего изобретения» и эквивалентные выражения, как подразумевается, охватывают соединение основной формулы (I), как описано выше в данном документе, выражение которой включает сложные эфиры пролекарств, фармацевтически приемлемые соли и сольваты, например, гидраты, там, где это позволяет контекст. Подобным образом ссылка на промежуточные продукты, независимо от того, являются ли они заявленными или нет, как подразумевается, охватывает их соли и сольваты там, где это позволяет контекст. Для ясности частные случаи там, где это позволяет контекст, иногда указывают в тексте, но эти случаи являются исключительно иллюстративными и не предполагается, что другие случаи исключаются там, где это позволяет контекст.
Подробное описание приготовления
Соединение формулы I можно получить путем применения или приспособления известных способов, под которыми подразумеваются способы, применяемые здесь или описанные в литературе, например таковые, описанные R.C. Larock в Comprehensive Organic Transformations, VCH publishers, 1989, или как описано в данном документе.
В реакциях, описанных ниже в данном документе, может быть необходимо защищать реактивные функциональные группы, например, аминогруппы, во избежание их нежелательного участия в реакциях. Можно применять общепринятые защитные группы в соответствии со стандартной практикой, для примера см. T.W. Greene and P.G.M. Wuts в “Protective Groups in Organic Chemistry” John Wiley and Sons, 1991.
В частности, соединение формулы I можно получить так, как показано на Схемах 1-2.
Например, соединение настоящего изобретения является ахиральным соединением, приготовление которого включает конвергентный синтез. Соединение настоящего изобретения в виде его бензоатной соли получают, как показано в схемах ниже.
Схема 1
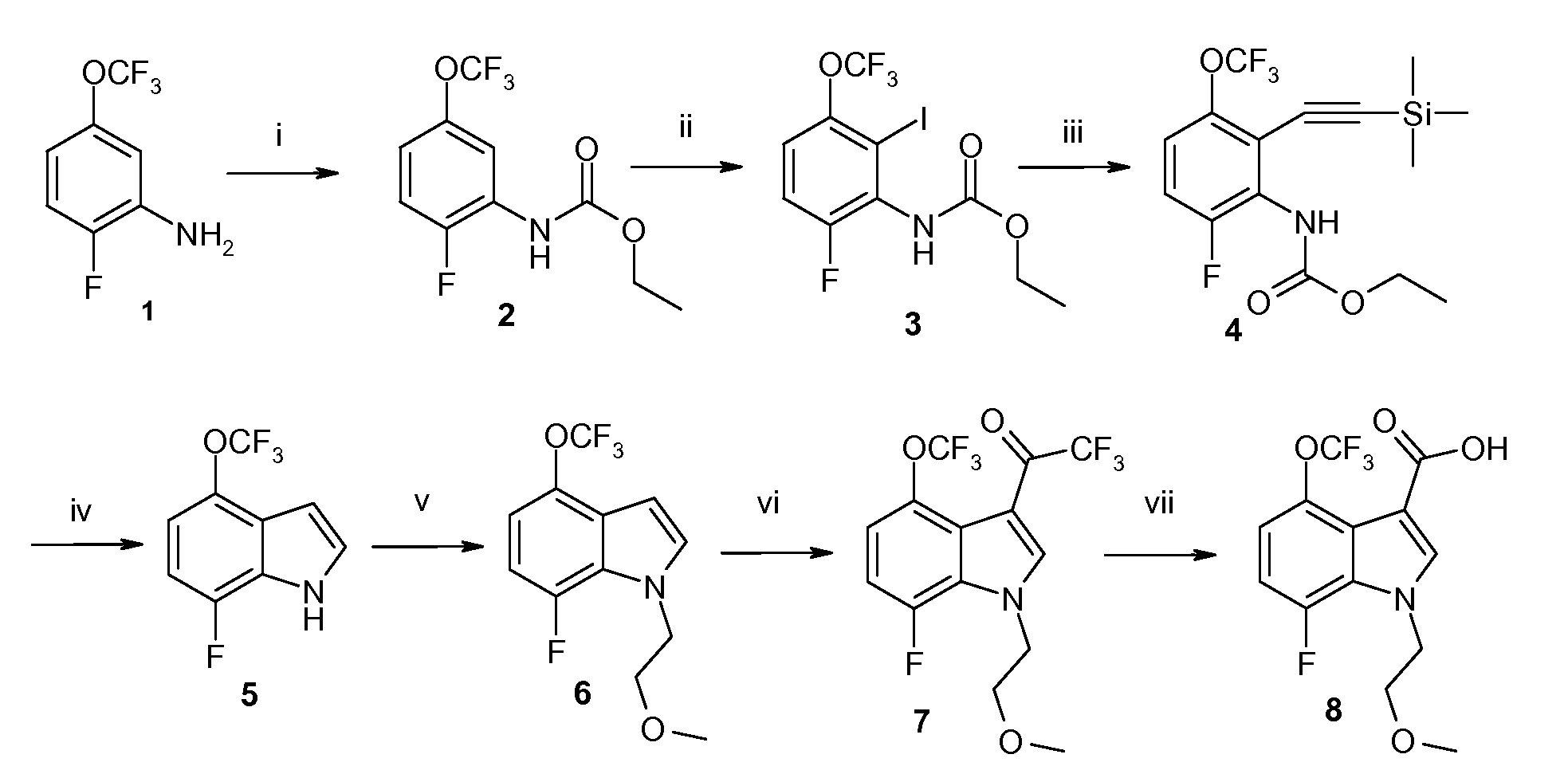
(i) Этилхлорформиат, пиридин, THF, 0°C, 100%; (ii) a: втор-BuLi, THF, -78°C, b: I2, THF, -78°C, 52-68%; (iii) TMS-ацетилен, TEA, CuI, Pd(PPh3)2Cl2, дегазированный THF, 60°C, 93%; (iv) KOH, трет-BuOH, 70°C, 91%; (v) порошкообразный KOH, 2-метоксиэтилбромид, DMSO, комн. темп., 95%; (vi) TFAA, DMF, 40°C, 89%; (vii) 5M NaOH, MeOH, 85°C, 96%; (viii) 2,2,2-трифтор-N-(фтор-3-пиперидин-4-илбензил)ацетамида гидрохлорид, EDCI, TEA, CH2Cl2 (DCM), комн. темп., 99%; (ix) a: K2CO3, MeOH/H2O, b: 1M HCl в Et2O, 90%.
Соединение 1 преобразуют в соединение 2 путем защиты аминогруппы аминозащитным средством, таким как этилхлорформиат в присутствии подходящего основания, такого как пиридин, для выхода защищенного соединения 2.
Соединение 2 преобразуют в соединение 5 способом из трех стадий. Соединение 2 йодируют по положению, следующему за карбаминовым сложным эфиром путем реакции 2 с сильным основанием, таким как вторичный бутиллитий с формированием аниона, который реагирует с источником йодида, таким как молекулярный йод с получением соединения 3. Соединение 3 затем преобразуют в ацетиленовое соединение 4 с использованием каталитических условий, таких как йодид меди (I) и дихлорид бис-(трифенилфосфин)палладия (II) в присутствии триметилсилилацетилена и основания, такого как триэтиламин. Соединение 4 циклизуют с использованием сильного основания, такого как гидроксид калия, и нагревают с получением индольного соединения 5.
Соединение 5 преобразуют в соединение 6 путем алкилирования его индольного азота алкилгалогенидом в присутствии сильного основания, такого как гидроксид калия, в дипольном апротонном растворителе, таком как диметилсульфоксид, при комнатной температуре с выходом соединения 6.
Соединение 6 преобразуют в соединение 8 двухстадийным способом. Вначале соединение 6 преобразуют в соединение 7 путем обработки соединения 6 трифторуксусным ангидридом в присутствии растворителя, такого как N,N-диметилформамид и нагревают. Соединение 7 обрабатывают сильным основанием, таким как гидроксид натрия с получением соединения 8, которое имеет кислотную функцию в его положении 3.
Соединение 8 преобразуют в амид 9 путем реакции кислоты 8 с гидрохлоридом 2,2,2-трифтор-N-(фтор-3-пиперидин-4-илбензил)ацетамида (соединение 14) в присутствии связывающего кислоту реагента, такого как EDCI, и органического основания, такого как триэтиламин, в инертном растворителе, таком как дихлорметан.
Соединение 9 преобразуют в соединение 10 путем снятия защитных групп с N-бензилтрифторацетамида при обработке мягким основанием, таким как карбонат калия, в смеси растворителей, такой как метанол/вода. Гидрохлоридная соль может формироваться в присутствии полярного органического растворителя, такого как эфир, с выходом соединения 10, которое является гидрохлоридной солью ([4-(5-аминометил-2-фторфенил)пиперидин-1-ил]-[7-фтор-1-(2-метоксиэтил)-4-метил-1H-индол-3-ил]метанона) в формуле I.
Реакции данной схемы являются следующими.
Стадия A: Приготовление сложного этилового эфира (2-фтор-5-трифторметоксифенил)карбаминовой кислоты (2)
К раствору 1 (50,72 г, 0,26 моль) и пиридину (27,3 мл, 0,34 моль) в THF (500 мл) при 0°C добавляют этилхлорформиат (32,2 мл, 0,39 моль) по каплям в течение 30-минутного периода. После 1 ч как LC/MS, так и TLC указывают на то, что реакция завершена. Реакционную смесь распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают 1 M HCl, H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (95/5-70/30) в качестве элюента с получением 69,23 г (99%) продукта 2 в виде чистой бесцветной жидкости. 1H ЯМР (CDCl3) δ 8,11 (шир. с, 1H), 7,07 (дд, J=9,1, 9,3 Гц, 1H), 7,00-6,80 (м, 2H), 4,27 (кв., J=7,1 Гц, 2H), 1,33 (т, J=7,1 Гц, 3H); 19F ЯМР (CDCl3) δ -57,84 (с, 3F), -134,01 (шир. с, 1F); MS 309 (M+CH3CN+1, 100%), 268 (M+1).
Стадия B: Приготовление сложного этилового эфира (6-фтор-2-йод-3-трифторметоксифенил)карбаминовой кислоты (3)

К раствору 2 (31,34 г, 117,2 ммоль) в THF (180 мл) при -78°C добавляют втор-BuLi (1,4 M в циклогексане, 200 мл, 280 ммоль) по каплям в течение 1-часового периода. После 20 мин раствор I2 (44,6 г, 175,8 ммоль) в THF (150 мл) добавляют по каплям в течение 30-минутного периода. Эту смесь затем взбалтывают при -78°C в течение 30 мин. Добавляют насыщенный NH4Cl и удаляют охлаждающую ванну. Реакционную смесь распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают 10% Na2SO3, H2O, и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Остаток суспендируют в DCM (50 мл) и добавляют (300 мл) гептана. Белый порошок 3 (18,1 г, 39%) от полученной в результате суспензии собирают путем фильтрования с отсасыванием и высушивают на воздухе. Фильтрат концентрируют in vacuo, и остаток суспендируют в гептане (200 мл). Другую партию 3 (3,8 г, 8%) собирают путем фильтрования с отсасыванием и высушивают на воздухе. Дополнительный продукт можно получить путем очищения фильтрата посредством хроматографии на силикагеле. 1H ЯМР (CDCl3) δ 7,30-17,10 (м, 2H), 6,16 (шир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,32 (т, J=7,1 Гц, 3H); 19F ЯМР (CDCl3) δ -56,90 (с, 3F), -114,35 (д, J=8,5 Гц, 1F); MS 394 (M+1, 100%), 374, 364, 321, 267.
Стадия C: Приготовление сложного этилового эфира (6-фтор-3-трифторметокси-2-триметилсиланилэтинилфенил)карбаминовой кислоты (4)
Смесь 3 (18,1 г, 45,9 ммоль), Et3N (12,8 мл, 91,9 ммоль), Pd(PPh)2Cl2 (1,6 г, 5% моль), CuI (0,7 г, 8% моль) и TMS-ацетилен (19,6 мл, 137,8 ммоль) в дегазированном THF (180 мл) нагревают при 60°C в течение ночи. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и EtOAc. Эту смесь фильтруют через Celite для удаления нерастворимого материала. Два слоя фильтрата разделяют, и органический слой промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc в качестве элюента с получением 15,6 г (93%) продукта 4 в виде бежевого твердого вещества. 1H ЯМР (CDCl3) δ 7,15-7,00 (м, 2H), 6,41 (шир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H), 0,27 (с, 9H); 19F ЯМР (CDCl3) δ -57,59 (с, 3F), -118,15 (с, 1F); MS 364 (M+1, 100%).
Стадия D: Приготовление 7-фтор-4-трифторметокси-1H-индола (5)
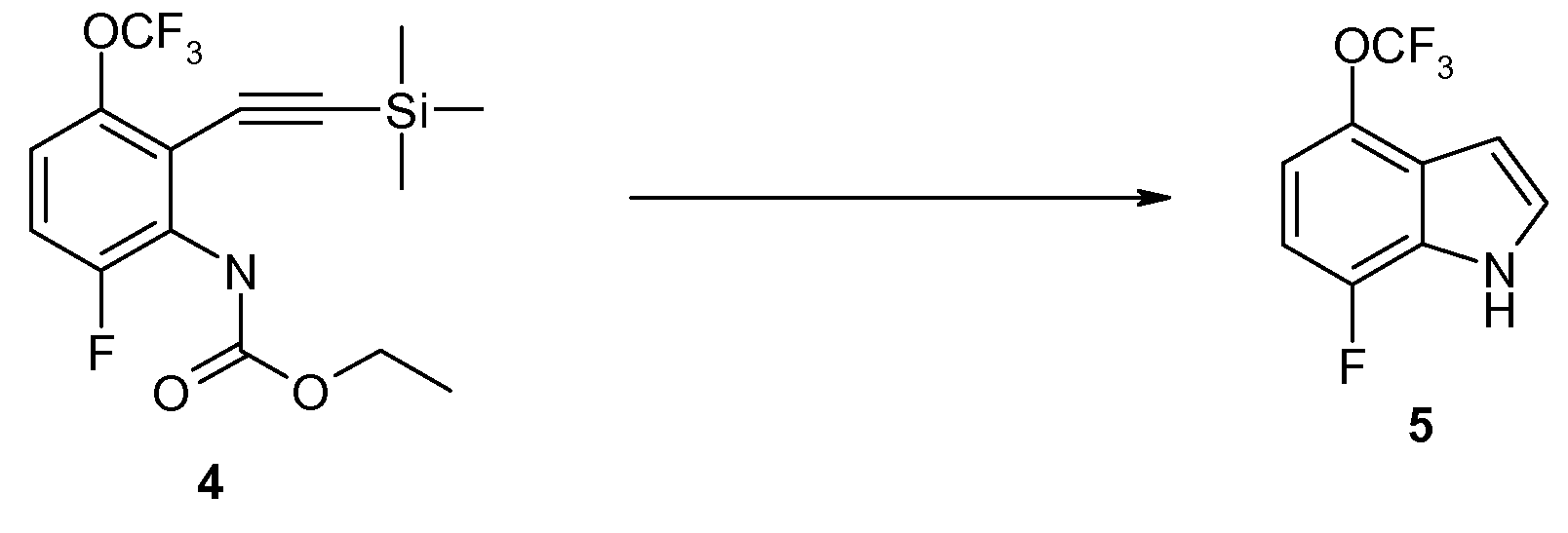
Смесь 4 (28,9 г, 79,6 ммоль) и KOH (35,7 г, 636,7 ммоль) в дегазированном трет-BuOH (300 мл) нагревают при 70°C в течение ночи. LC/MS указывает на то, что реакция завершена. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и Et2O. Два слоя разделяют, и водный слой экстрагируют Et2O (2×). Объединенные органические слои промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (100/0 по 60/40) в качестве элюента с получением 16 г (91%) продукта 5 в виде желтой жидкости. 1H ЯМР (CDCl3) δ 8,47 (шир. с, 1H), 7,35-7,20 (м, 1H), 6,95-6,80 (м, 2H), 6,68 (д, J=2,5 Гц, 1H); 19F ЯМР (CDCl3) δ -57,63 (с, 3F), -136,10 (д, J=8,5 Гц, 1F); MS 220 (M+1, 100%), 200.
Стадия E: Приготовление 7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индола (6)
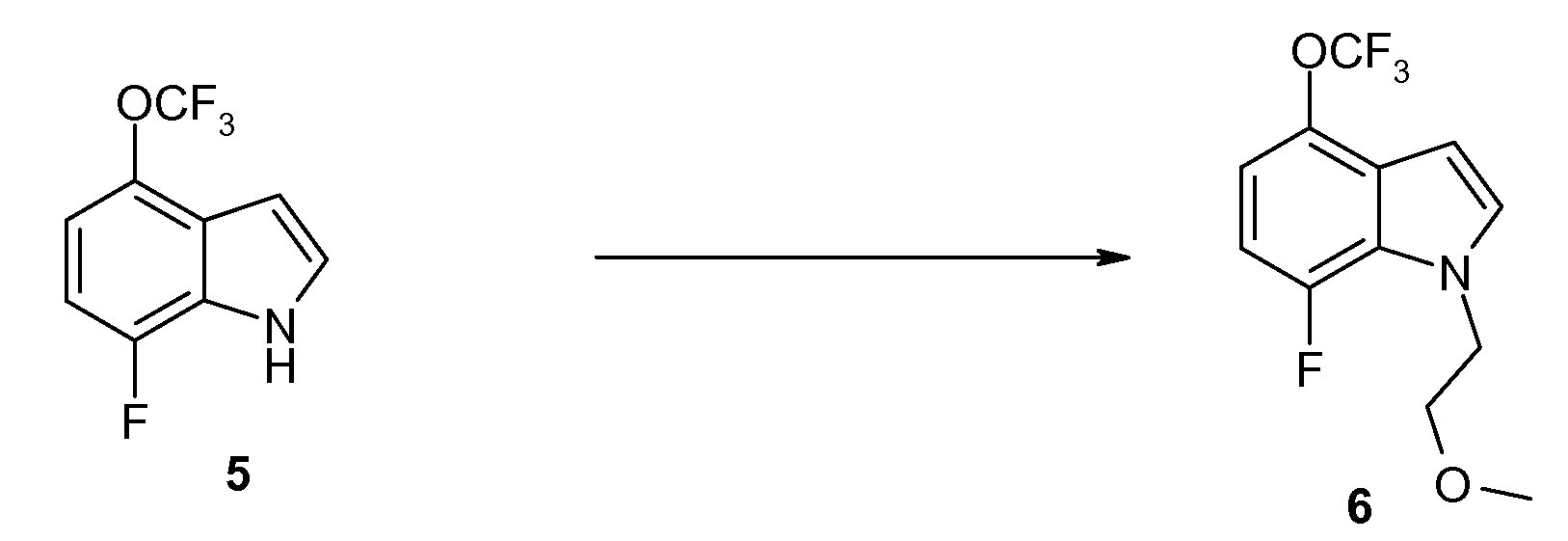
Смесь 5 (16 г, 72,8 ммоль) и порошок KOH (20,4 г, 364,2 ммоль) в DMSO (150 мл) взбалтывают при комнатной температуре в течение 10 мин. Добавляют 2-метоксиэтилбромид (10,3 мл, 109,2 ммоль). Эту смесь взбалтывают при комнатной температуре в течение ночи. LC/MS указывает на то, что реакция завершена. Смесь распределяют между H2O и Et2O. Два слоя разделяют и водный слой экстрагируют Et2O (2×). Объединенные органические слои промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (от 100/0 до 50/50) в качестве элюента с получением 19,3 г (95%) продукта 6 в виде желтой жидкости. 1H ЯМР (CDCl3) δ 7,15 (д, J=2,1 Гц, 1H), 6,90-6,75 (м, 2H), 6,56 (т, J=2,5 Гц, 1H), 3,72 (т, J=5,2 Гц, 2H), 3,72 (т, J=5,2 Гц, 2H), 3,31 (с, 3H); 19F ЯМР (CDCl3) δ -57,54 (с, 3F), -137,00 (д, J=11,3 Гц, 1F); MS 278 (M+1, 100%).
Стадия F: Приготовление 2,2,2-трифтор-1-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]этанона (7)
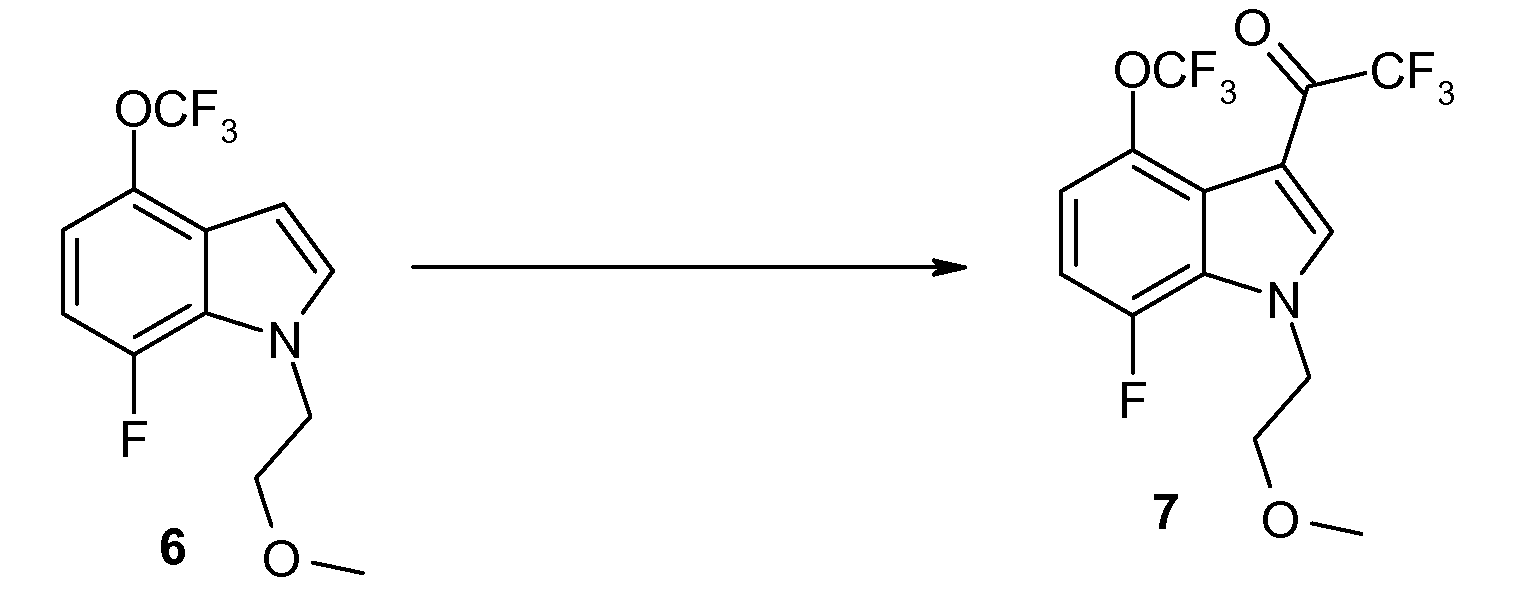
К смеси 6 (19,3 г, 69,7 ммоль) в DMF (135 мл) добавляют TFAA (26,2 мл, 188,2 ммоль). Эту смесь нагревают при 40°C в течение ночи. TLC указывает на то, что реакция завершена. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и Et2O. Два слоя разделяют и органический слой промывают насыщенным NaHCO3 (2×), H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (от 100/0 до 50/50) в качестве элюента с получением 23,4 г (89%) продукта 7 в виде слабо зеленого твердого вещества. 1H ЯМР (CDCl3) δ 8,03 (д, J=1,4 Гц, 1H), 7,20-6,95 (м, 2H), 4,54 (т, J=4,9 Гц, 2H), 3,76 (т, J=4,8 Гц, 2H), 3,33 (с, 3H); 19F ЯМР (CDCl3) δ -57,74 (с, 3F), -71,10 (с, 3F), -134,95 (д, J=11,5 Гц, 1F); MS 374 (M+1, 100%).
Стадия G: Приготовление 7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-карбоксильной кислоты (8)
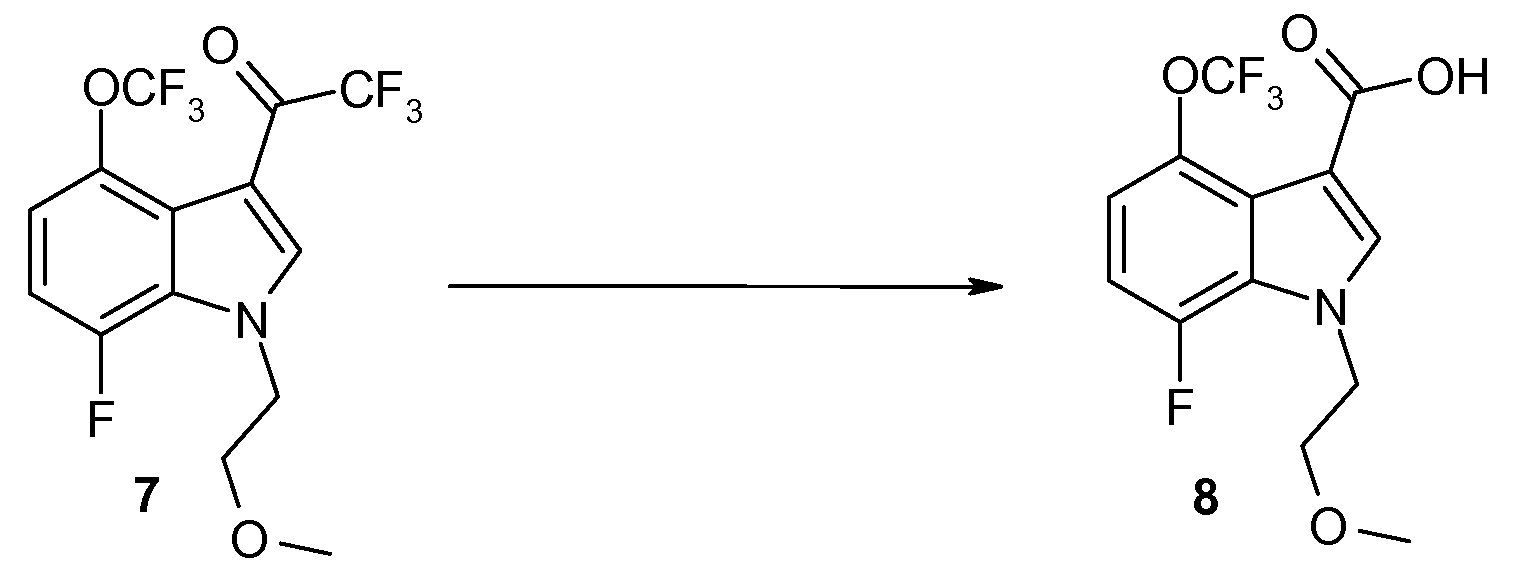
Смесь 7 (23,4 г, 62,6 ммоль) в MeOH (100 мл) и 5 M NaOH (100 мл) нагревают при 80°C в течение ночи. LC/MS указывает на то, что реакция завершена. Реакционную смесь охлаждают до комнатной температуры, и затем концентрируют in vacuo для удаления большей части MeOH. Остаток растворяют в H2O и затем однократно промывают Et2O. Водный слой медленно подкисляют до pH ~2 с помощью конц. HCl. Подкисленную суспензию экстрагируют Et2O, и органический экстракт промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Остаток суспендируют в DCM/гептане (10/90). Белый порошок 8 (19,4 г, 96%) в суспензии собирают путем фильтрования с отсасыванием и высушивают воздухом. 1H ЯМР (CDCl3) δ 8,02 (с, 1H), 7,15-7,05 (м, 1H), 7,00-6,90 (м, 1H), 4,49 (т, J=5,0 Гц, 2H), 3,75 (т, J=4,9 Гц, 2H), 3,33 (с, 3H); 19F ЯМР (CDCl3) δ -57,74 (с, 3F), -135,65 (д, J=11,3 Гц, 1F); MS 363 (M+CH3CN+1), 322 (M+1, 100%).
Стадия H: Приготовление 2,2,2-трифтор-N-(4-фтор-3-{1-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-карбонил]пиперидин-4-ил}бензил)ацетамида (9)
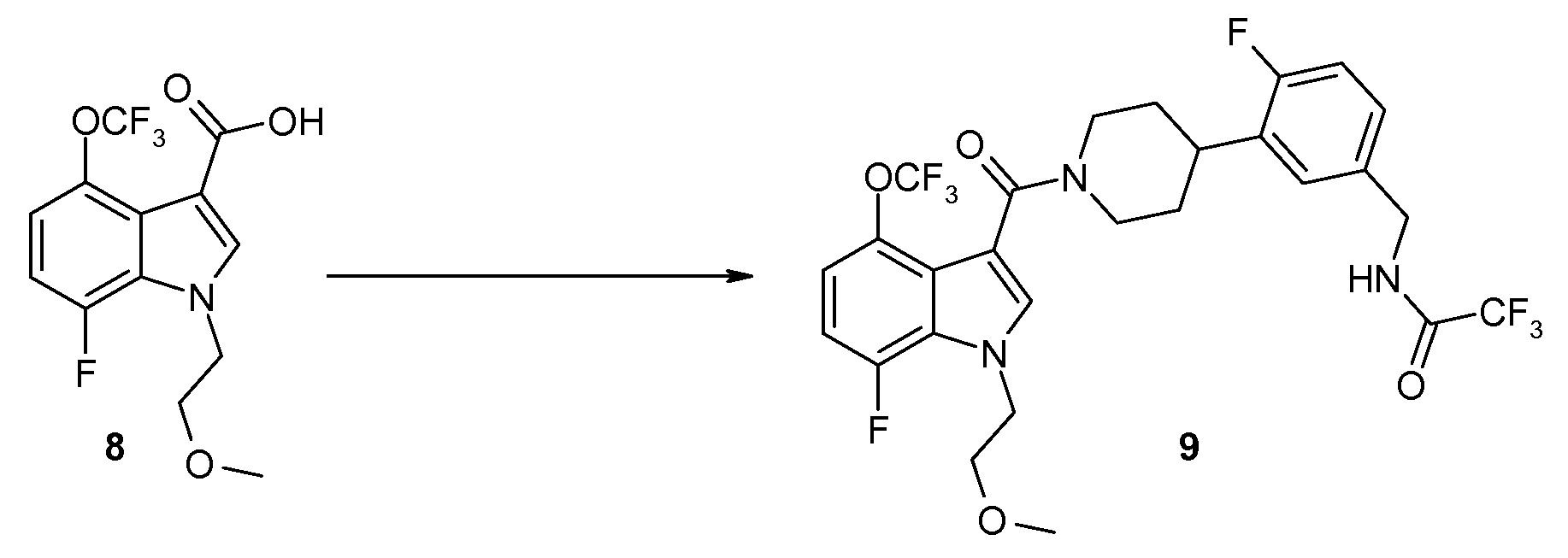
Смесь продукта 8 (19,1 г, 59,6 ммоль), Et3N (24,8 мл, 177,9 ммоль), 2,2,2-трифтор-N-(4-фтор-3-пиперидин-4-илбензил)ацетамида гидрохлорида (11, 26,4 г, 77,5 ммоль) (14), и EDCI (17,1 г, 89,3 ммоль) в CH2Cl2 взбалтывают при комнатной температуре в течение ночи. Как TLC, так и LC/MS указывают на то, что реакция завершена. Смесь распределяют между H2O и CH2Cl2. Два слоя разделяют и органический слой промывают солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (40/60 по 0/100) в качестве элюента с получением продукта 9 (36 г, 99%) в виде белой пены. 1H ЯМР (CDCl3) δ 7,37 (с, 1H), 7,20-7,10 (м, 2H), 7,10-6,85 (м, 4H), 4,95 (шир. с, 1H), 4,60-4,35 (м, 4H), 3,90 (шир. с, 1H), 3,73 (т, J=5,0 Гц, 2H), 3,32 (с, 3H), 3,25-2,70 (м, 3H), 2,05-1,50 (м, 4H); 19F ЯМР (CDCl3) δ -57,54 (с, 3F), -75,39 (с, 3F), -119,31 (с, 1F), -134,96 (д, J=11,3 Гц, 1F); MS 608 (M+1, 100%).
Стадия I: Приготовление [4-(5-аминометил-2-фторфенил)пиперидин-1-ил]-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона хлористоводородной соли (10)
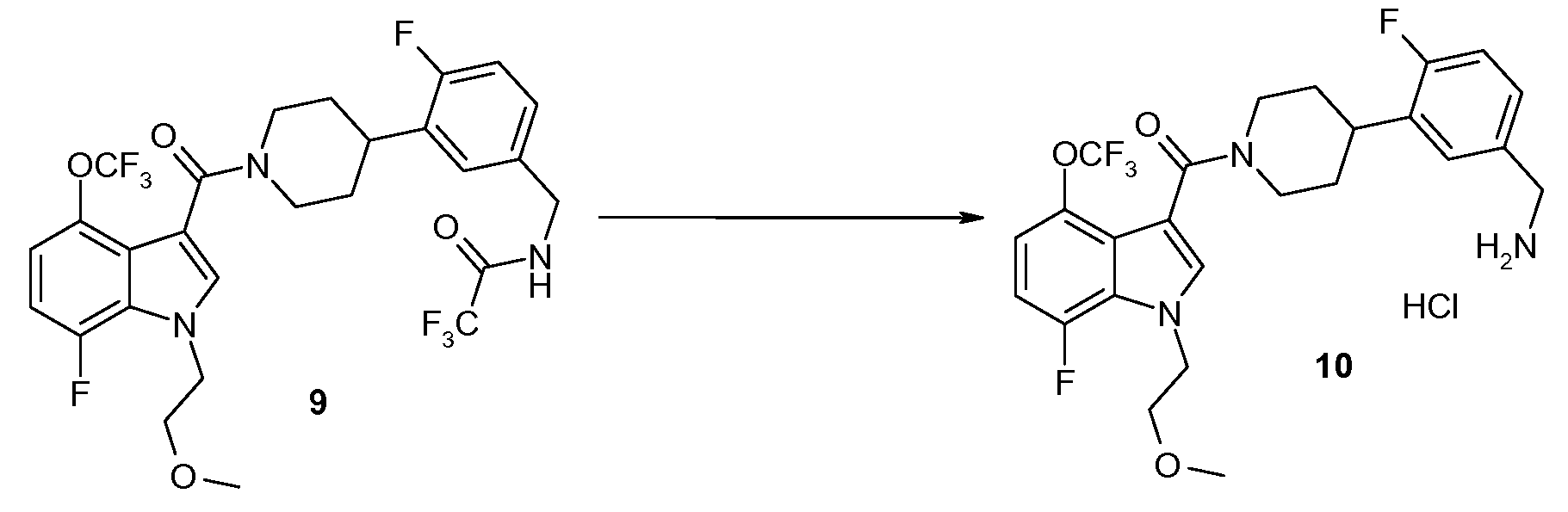
К смеси продукта 9 (36 г, 59,3 ммоль) в MeOH (400 мл) добавляют водный K2CO3 (65,5 г, 474 ммоль, растворенный в 120 мл H2O). Эту смесь взбалтывают при комнатной температуре в течение ночи. LC/MS указывает на то, что реакция завершена. Реакционную смесь концентрируют in vacuo для удаления большей части метанола. Остаток распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo для выхода 27,5 г (90%) продукта 10 в виде чистой бесцветной тягучей смолы.
1H ЯМР (CDCl3) δ 7,42 (с, 1H), 7,25-7,10 (м, 2H), 7,05-6,85 (м, 3H), 4,92 (шир. с, 1H), 4,46 (т, J=5,2 Гц, 2H), 3,86 (шир. с, 3H), 3,74 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,30-2,75 (м, 3H), 2,24 (шир. с, 2H), 2,05-1,55 (м, 4H); 19F ЯМР (CDCl3) δ -57,52 (с, 3F), -121,64 (с, 1F), -136,03 (д, J=11,3 Гц, 1F); MS 512 (M+1, 100%).
К раствору вышеуказанного материала (2,856 г, 5,59 ммоль) в Et2O (30 мл) добавляют 2 N HCl/Et2O (3 мл, 6 ммоль) по каплям. Твердые осадочные формы и эфирный раствор декантируют. Твердое вещество промывают дополнительным Et2O, затем декантируют. Оставшееся бледно-желтое твердое вещество растворяют в теплом MeOH (10 мл), затем добавляют Et2O (50 мл) до тех пор, пока раствор не станет слегка мутным. Приблизительно через 2 часа возникает твердый осадок. Добавляют дополнительный Et2O (5-10 мл), и затем суспензию помещают в холодильник на ночь. Белый кристаллический продукт (2,475 г, 4,52 ммоль) собирают и высушивают под высоким вакуумом в течение 4 часов.
1H ЯМР (ДМСО (DMSO)-d6) δ 8,32 (шир. с, 2H), 7,71 (с, 1H), 7,43 (д, 1H, J=7,2 Гц), 7,36 (м, 1H), 7,26-7,20 (м, 1H), 7,12-7,08 (м, 2H), 4,49 (т, J=5,1 Гц, 2H), 4,00 (с, 2H), 3,71 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,21-3,07 (м, 3H), 2,99 (шир. с, 2H), 1,80-1,62 (м, 4H); 19F ЯМР (DMSO-d6) δ -56,79 (с, 3F), -119,34 (с, 1F), -134,53 (д, J=9,6 Гц, 1F); MS 512 (M+1, 100%). CHN: Теоретический: C 53,06%, H 5,16%, N 7,42% (рассчитано как 1,0 H2O). Установлено: C 53,03%, H 4,82%, N 7,22, Cl 6,64%.
[4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат (10 бензоатная соль)
20-литровый реактор со стеклянной оболочкой, уже содержащий раствор толуола, который, как предполагается, содержит [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон (1320 г, 2,58 моль), взбалтывают и нагревают до 61°C. Добавляют бензойную кислоту (316 г, 2,58 моль) и, после того, как бензойная кислота растворилась, добавляют циклогексан (6,04 л). Реакцию нагревают до 77°C там, где в нее вносят затравку в виде [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат (0,100 г) от предыдущей партии. Кристаллизация протекает при 77°C и, после 15 мин реакцию охлаждают при скорости снижения -10°C/ч. Когда реакция достигает 61°C, как взбалтывание, так и охлаждение останавливают и реакции позволяют остыть до комнатной температуры. После выстаивания в течение ночи взбалтывание возобновляют и продукт собирают путем фильтрации. Осадок на фильтре промывают смесью растворителей, приготовленной из толуола (3 л) и циклогексана (1,5 л). После частичного высушивания путем отсасывания, продукт переносят в сушильный шкаф, где его высушивают при 40°C, предоставляя [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат в виде бесцветного твердого вещества. 1408,8 г (86%), т.пл.=156-159°C. Элементный анализ: рассчитано для C25H26F5N3O3.C7H6O2: C, 60,66; H, 5,09; N, 6,63. Найдено: C, 60,44; H, 5,01; N, 6,87. Инфракрасные спектральные особенности (см-1): 1612, 1526, 1511, 1501, 1394, 1362, 1256, 1232, 1211, 1158, 1117, 999, 826.
Схема 2
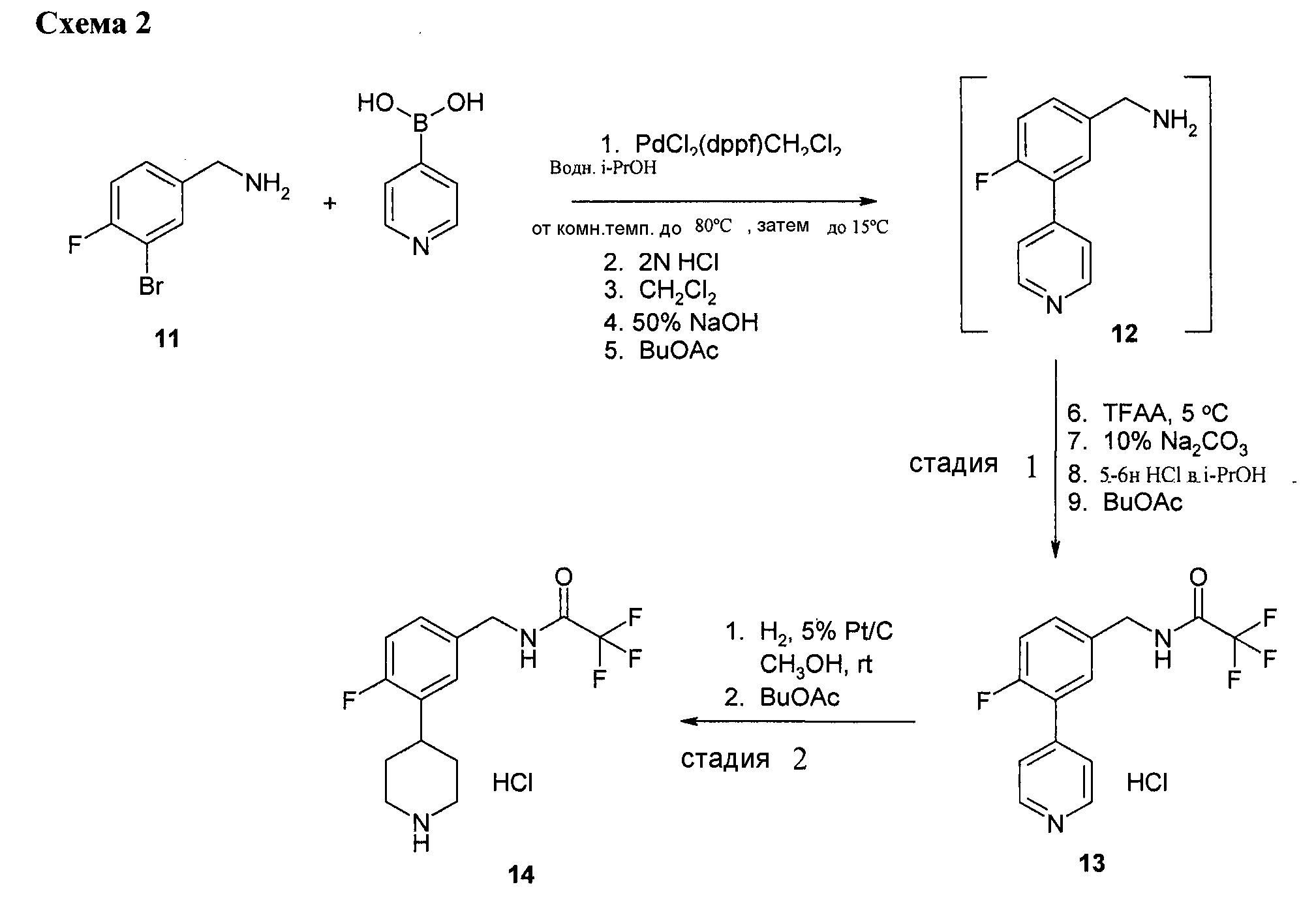
3-бром-4-фторбензиламина гидрохлорид (Wychem) реагирует с пиридин-4-бороновой кислотой (Clariant или Boron Molecular) в спиртовом растворителе с точкой кипения по меньшей мере равной изопропиловому спирту, такому, как н-пропиловый спирт, н-бутиловый спирт и т.п.; полярном апротонном растворителе, таком как диметилформамид, 1-метил-2-пирролидон, диметилсульфоксид и т.п.; эфирном растворителе, таком, как 2-метилтетрагидрофуран, диметоксиэтан, и т.п. Из соединения 12 и соединения 13 в смеси с любым из указанных выше растворителей и воды в присутствии подходящего катализатора, такого как комплекс 1,1'-бис(дифенилфосфин)ферроцен-палладий(II) дихлорида и дихлорметана (PdCl2dppf-CH2Cl2), Pd(PPh3)4, PdCl2(PPh3)2, Pd(dtbpf)Cl2, и т.п. c достаточным нагреванием от приблизительно 70°C до температуры точки кипения смеси реакции соединения Сузуки получают пиридин.
Этот пиридин преобразуют в соединение трифторацетамида 2,2,2-трифтор-N-(4-фтор-3-пиридин-4-илбензил)ацетамида гидрохлорид в трифторацетилирующих условиях с использованием подходящего трифторацетилирующего средства, такого как трифторуксусный ангидрид, трифторацетилфторид, пентафторфенилтрифторацетат и т.п., в трифторацетилирующем растворителе, таком как сложный эфирный растворитель, такой как этилацетат, изопропилацетат, и т.п.; ароматический углеводородный растворитель, такой как толуол, и т.п.; хлорированный углеводородный растворитель, такой как хлорид метилена, 1,2-дихлорэтан, и т.п., при температуре реакции трифторацетилирования приблизительно от -20 до 30°C, с последующей обработкой соляной кислотой.
2,2,2-трифтор-N-(4-фтор-3-пиридин-4-илбензил)ацетамида гидрохлорид восстанавливают в условиях гидрогенизации до соединения 14 путем обработки водородом в присутствии средства катализатора гидрогенизации PtO2, Pd/C, Pd(OH)2, Rh/C и т.п., с или без добавленной неорганической кислоты, такой как HCl и т.п., или органической кислоты, такой как уксусная кислота и т.п., в растворителе реакции гидрогенизации, таком как спиртовой растворитель, такой как этанол, изопропиловый спирт и т.п.; или уксусная кислота; или смесь спиртового растворителя или уксусной кислоты и воды, при температуре реакции гидрогенизации от приблизительно 10 до приблительно 60°C и давлении гидрогенизации от около 20 до около 1000 фунтов на кв. дюйм.
Соединение настоящего изобретения является основным, и данное соединение является применимым в форме свободного основания или в форме фармацевтически приемлемой его кислотно-аддитивной соли.
Кислотно-аддитивные соли могут быть более удобной формой для применения; и на практике применение формы соли по существу сводится к применению формы свободного основания. Кислоты, которые можно использовать для получения кислотно-аддитивных солей, включают предпочтительно таковые, которые дают, при сочетании со свободным основанием, фармацевтически приемлемые соли, а именно соли, чьи анионы являются нетоксичными для пациента в фармацевтических дозах солей так, что благотворные ингибиторные эффекты, присущие свободному основанию, не ослабляются побочными эффектами за счет анионов. Хотя фармацевтически приемлемые соли указанного соединения являются предпочтительными, все кислотно-аддитивные соли являются применимыми в качестве источников формы свободного основания, даже если конкретная соль, сама по себе, требуется только в качестве промежуточного продукта, как, например, когда соль сформирована только для целей очистки и определения, или когда ее используют как промежуточное соединение в приготовлении фармацевтически приемлемой соли путем ионообменных процедур. Фармацевтически приемлемые соли в объеме настоящего изобретения включают следующие, производные от минеральных кислот и органических кислот, и включают гидрогалогениды, например гидрохлорид и гидробромид, сульфаты, фосфаты, нитраты, сульфаматы, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-b-гидроксинафтоаты, бензоаты, тозилаты, гентизаты, изетионаты, ди-п-толуолтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинаты. Более конкретная соль является солью соединения формулы I и является гидрохлоридной солью. Другая конкретная соль настоящего изобретения является фумаратом соединения формулы I. Предпочтительной фармацевтически приемлемой солью настоящего изобретения является бензоат соединения формулы I.
Помимо применения самих по себе в качестве активного соединения, соли соединения настоящего изобретения являются применимыми для целей очистки соединения, например путем использования различий в растворимости между солями и родительским соединением, побочными продуктами и/или исходными материалами посредством техник, хорошо известных специалистам настоящей области техники.
Согласно дальнейшей особенности настоящего изобретения, кислотно-аддитивную соль соединения этого изобретения можно получить путем реакции свободного основания с соответствующей кислотой, путем применения или приспособления известных способов. Например, кислотно-аддитивные соли соединения этого изобретения можно получить растворением свободного основания в воде или водном спиртовом растворе или другом подходящем растворителе, содержащем соответствующую кислоту, и выделением соли выпариванием раствора, или путем реакции свободного основания и кислоты в органическом растворителе, где соль отделяют прямо или можно получить путем концентрации раствора.
Кислотно-аддитивные соли соединения этого изобретения могут быть восстановлены из солей путем применения или приспособления известных способов. Например, исходное соединение настоящего изобретения можно восстанавливать из их кислотно-аддитивных солей путем обработки щелочами, например водным раствором бикарбоната натрия или водным раствором аммиака.
В частности, монобензоат Соединения A является предпочтительным.
Исходные материалы и промежуточные соединения можно приготовить путем применения или приспособления известных способов, например способов, как описано в ссылочных примерах или их очевидных химических эквивалентах.
Настоящее изобретение также направлено на некоторые промежуточные соединения в вышеприведенной схеме 1, и, по существу, способы, описанные в настоящем документе для их приготовления, составляют дальнейшие особенности настоящего изобретения.
Список сокращений
Как используется выше и во всем описании настоящего изобретения, следующие сокращения, если не указано иное, как следует понимать, имеют следующие значения:
ACN ацетонитрил
AIBN 2,2′-азобисизобутиронитрил
bid два раза в день
BOC или Boc трет-бутилкарбамат
BOP бензотриазол-1-ил-окситрис(диметиламино)фосфоний
n-Bu3SnH гидрид три-н-бутилолова
t-Bu трет-бутил
Cbz бензилкарбамат
PTC катализатор межфазного переноса
DAST (диэтиламино) серы трифторид (Et2NSF3)
DCC дициклогексилкарбодиимид
DCM дихлорметан (CH2CI2)
DIC 1,3-диизопропилкарбодиимид
DIPEA диизопропилэтиламин
DMAP 4-(N,N-диметиламино)пиридин
DMP реактив реактив Периодинан Десса-Мартина
DMF диметилформамид
DMSO диметилсульфоксид
EA элементный анализ
EDCI 1-этил-3-(3-диметиламинопропил) карбодиимид HCl
eq эквивалент(ы)
Et этил
Et2O диэтиловый эфир
EtOH этанол
EtOAc этилацетат
FMOC 9-флуоренилметоксикарбонил
HOAt 1-гидрокси-7-азабензотриазол
HOBT 1-гидроксибензтриазол
HOSu N-гидроксисукцинамид
HPLC высокоэффективная жидкостная хроматография
LAH алюмоангидрид лития
Me метил
MeI метилйодид
MeOH метанол
MeOC(O) метилхлорформиат
MOMCl метоксиметилхлорид
MOM метоксиметил
MS масс-спектроскопия
NaBH4 боргидрид натрия
Na2C4H4O6 татрат натрия
ЯМР ядерный магнитный резонанс
P полимерная связь
PO пероральное введение
PyBOP бензотриазол-1-ил-окситрис-пирролидин-фосфония гексафторфосфат
TBD 1,5,7-триазабицикло[4.4.0]-дец-5-ен
RP-HPLC обратнофазная жидкостная хроматография под высоким давлением
TBSCl трет-бутилдиметилсилилхлорид
TCA трихлоруксусная кислота
TFA трифторуксусная кислота
Tf2O трифлата ангидрид
THF тетрагидрофуран
THP тетрагидропиран
TLC тонкослойная хроматография
Определения
Как используется выше и во всем описании настоящего изобретения, следующие выражения, если не указано иное, следует понимать как имеющие следующие значения:
«Биоизостер кислоты» означает группу, которая имеет химические и физические сходства, обеспечивающие биологические свойства, приблизительно подобные карбоксигруппе (см. Lipinski, Annual Reports in Medicinal Chemistry, “Bioisosterism In Drug Design” 21, 283 (1986); Yun, Hwahak Sekye, “Application of Bioisosterism To New Drug Design” 33, 576-579, (1933); Zhao, Huaxue Tongbao, “Bioisosteric Replacement And Development Of Lead Compounds In Drug Design” 34-38, (1995); Graham, Theochem, “Theoretical Studies Applied To Drug Design ab initio Electronic Distributions In Bioisosteres” 343, 105-109, (1995)). Типовые биоизостеры кислот включают -C(O)-NHOH, -C(O)-CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, 3,5-диоксо-1,2,4-оксадиазолидинил или гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3-гидрокси-1-метилпиразолил и т.п.
«Эффективное количество» означает количество соединения/композиции по настоящему изобретению, эффективное для получения требуемого терапевтического эффекта.
«Гидрат» означает сольват, где молекулой(ами) растворителя является/являются H2O.
«Пациент» означает человека и других млекопитающих.
«Фармацевтически приемлемый сложный эфир» относится к сложным эфирам, которые гидролизуются in vivo и включают таковые, которые с легкостью разрушаются в теле человека, оставляя родительское соединение или его соль, Подходящие сложные эфирные группы включают, например, таковые производные от фармацевтически приемлемых карбоксильных кислот, в частности, алкановые, алкеновые, циклоалкановые и алкандиовые кислоты, в которых каждая половина алкила или алкенила преимущественно имеет не более, чем 6 атомов углерода. Типовые сложные эфиры включают формиаты, ацетаты, пропионаты, бутираты, акрилаты, этилсукцинаты и т.п.
«Фармацевтически приемлемые пролекарства», как используется в настоящем документе, относятся к таковым пролекарствам соединений настоящего изобретения, которые являются, в рамках тщательного медицинского заключения, подходящими для применения в контакте с тканями пациентов с повышенной токсичностью, раздражением, аллергическим ответом и т.п., соответственным обоснованному соотношению выгода/риск, и эффективными для преднамеренного применения соединений настоящего изобретения. Термин «пролекарство» относится к соединениям, которые быстро трансформируются in vivo для выхода родительского соединения вышеприведенной формулы, например путем гидролиза в крови. Функциональные группы, которые могут быстро трансформироваться путем метаболического расщепления, in vivo формируют класс групп, реактивный на карбоксильную группу соединений этого изобретения. Они включают, но не ограничиваясь, такие группы, как алканоил (такой как ацетил, пропаноил, бутаноил, и т.п.), незамещенный и замещенный ароил (такой как бензоил и замещенный бензоил), алкоксикарбонил (такой как этоксикарбонил), триалкилсилил (такой как триметил- и триэтилсилил), моносложные эфиры, сформированные дикарбоновыми кислотами (такими как сукцинил) и т.п. Из-за легкости, с которой метаболически расщепляемые группы соединений этого изобретения расщепляются in vivo, соединения, несущие таковые группы, действуют как пролекарства. Соединения, несущие метаболически расщепляемые группы, имеют преимущество в том, что они могут демонстрировать улучшенную биодоступность в результате повышенной растворимости и/или скорости абсорбции, придаваемой родительскому соединению наличием метаболически расщепляемой группы. Подробное обсуждение содержится в Design of Prodrugs, H. Bundgaard, ed., Elsevier (1985); Methods in Enzymology; K. Widder et al., Ed., Academic Press, 42, 309-396 (1985); A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bandaged, ed., Chapter 5; “Design and Applications of Prodrugs” 113-191 (1991); Advanced Drug Delivery Reviews, H. Bundgard, 8, 1-38, (1992); J. Pharm. Sci., 77.,285 (1988); Chem. Pharm. Bull., N. Nakeya et al., 32, 692 (1984); Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, 14 A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, E.B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987, которые включены в данный документ посредством ссылки.
«Фармацевтически приемлемые соли» относятся к относительно нетоксичным неорганическим и органическим кислотно-аддитивным солям и основно-аддитивным солям соединений настоящего изобретения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений. В частности, кислотно-аддитивные соли могут быть получены путем отдельной реакции очищенного соединения в форме его свободного основания с подходящей органической или неорганический кислотой и выделения сформированной таким образом соли. Типовые кислотно-аддитивные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуолтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и лаурилсульфонатные соли и т.п. См., например, S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm. Sci., 66, 1-19 (1977), который включен в данный документ посредством ссылки. Основно-аддитивные соли также можно получить путем отдельной реакции очищенного соединения в форме его кислоты с подходящим органическим или неорганическим основанием и выделения сформированной таким образом соли. Основно-аддитивные соли включают фармацевтически приемлемые соли металлов и аминов. Подходящие соли металлов включают соли натрия, калия, кальция, бария, цинка, магния и алюминия. Соли натрия и калия являются предпочтительными. Подходящие неорганические основно-аддитивные соли получают из оснований металлов, которые включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния, гидроксид цинка и т.п. Подходящие основно-аддитивные соли аминов получают из аминов, которые обладают основностью, достаточной для формирования подходящей соли, и предпочтительно включают те амины, которые являются часто применимыми в медицинской химии из-за их низкой токсичности и приемлемости для медицинского использования, такие как, например, аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N′-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенэтиламин, диэтиламин, пиперазин, трис (гидроксиметил)аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дегидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например, лизин и аргинин, и дициклогексиламин и т.п.
«Сольват» означает физическую ассоциацию соединения этого изобретения с одной или несколькими молекулами растворителя. Эта физическая ассоциация включает связывание водорода. В определенных случаях сольват будет способным к отделению, например, когда одна или несколько молекул растворителя являются встроенными в кристаллическую решетку кристаллического твердого вещества. «Сольват» охватывает как фазу раствора, так и поддающиеся выделению сольваты. Типовые сольваты включают гидраты, этанолаты, метанолаты и т.п.
«Лечение» и «терапия» означает введение соединения для облегчения состояния заболевания или расстройства, или предотвращения состояния заболевания или расстройства. Или замедления прогрессирования состояния заболевания или расстройства, и это также относится к уменьшению восприимчивости к состоянию заболевания или расстройства. Настоящие выражения также включают, но без ограничения, паллиативную терапию, которая является нелечебной.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Со ссылкой на изобретения, описанные в настоящем документе, ниже приведены конкретные варианты осуществления, относящиеся к нему.
Конкретный вариант осуществления данного изобретения представляет собой способ лечения дерматологического аллергического состояния, такого как атопический дерматит, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I или его соответствующего N-оксида, пролекарства, фармацевтически приемлемой соли или сольвата.
Другой конкретный вариант осуществления данного изобретения представляет собой фармацевтическую композицию для лечения дерматологического аллергического состояния, такого как атопический дерматит, содержащая соединение формулы I или его соответствующий N-оксид, пролекарство, фармацевтически приемлемую соль или соль, в сочетании с фармацевтически приемлемым средством.
Еще один вариант осуществления данного изобретения представляет собой способ лечения дерматологического аллергического состояния, такого как атопический дерматит, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения, являющегося ингибитором бета-триптазы.
Соединения данного изобретения, необязательно, поставляются в виде солей. Те соли, которые являются фармацевтически приемлемыми, представляют особый интерес, так как они применимы во введении вышеприведенных соединений для медицинских целей. Соли, которые не являются приемлемыми фармацевтически, используются в процессе производства в целях выделения и очистки, и в некоторых случаях для использования для отделения стереоизомерных форм соединения данного изобретения. Последнее в особенности относится к аминным солям, приготовленным из оптически активных аминов.
Там, где соединение настоящего изобретения содержит карбоксильную группу или достаточно кислый биоизостер, могут быть сформированы основно-аддитивные соли, являющиеся просто более удобной формой для использования; на практике применение формы соли по существу сводится к применению формы свободной кислоты.
Также, когда соединение настоящего изобретения содержит основную группу, или достаточно основной биоизостер, могут формироваться кислотно-аддитивные соли, которые будут просто более удобной формой использования; и на практике применение формы соли по существу сводится к применению формы свободного основания.
Другой задачей настоящего изобретения является предоставление фармацевтической композиции, включающей фармацевтически эффективное количество соединения формулы 1 и фармацевтически приемлемый носитель или разбавитель.
Другой задачей настоящего изобретения является предоставление фармацевтической композиции, которая является эффективной уже сама по себе, для использования в благоприятной комбинированной терапии, потому что она включает множество активных ингредиентов, которые могут быть использованы в соответствии с настоящим изобретением.
Настоящее изобретение также предоставляет наборы или единичные упаковки, объединяющие два или более активных ингредиентов, применимых в лечении или предотвращении макулодистрофии пациента. Набор может предоставлять (одиночный или в сочетании с фармацевтически приемлемым носителем или разбавителем) соединение формулы 1 и дополнительный активный ингредиент (одиночный или в сочетании с растворителем или носителем).
Соединения формулы I могут быть приготовлены путем применения или приспособления известных способов, как известных до сих пор, так и описанных в литературе, или посредством способов, раскрытых в данном документе.
Количество соединения формулы 1 в любом из упомянутых выше применений может быть фармацевтически эффективным количеством, субоптимальным эффективным количеством или комбинациями таковых при условии, что конечная комбинация ингредиентов представляет фармацевтически эффективное количество соединений, которые эффективны в лечении или предотвращении макулодистрофии у пациента.
ФАРМАКОЛОГИЯ
Соединения согласно настоящему изобретению, которые, как описано в данном документе, являются применимыми из-за способности ингибировать бета-триптазу и также применимыми для лечения воспалительных заболеваний кишечника.
Конкретный аспект настоящего изобретения обеспечивает соединения, имеющие отношение к настоящему изобретению, для введения в форме фармацевтической композиции, хотя соединение можно применять отдельно. «Фармацевтическая композиция» означает композицию, включающую соединение формулы 1 и по меньшей мере одного соединения, выбранного из группы, включающей фармацевтически приемлемые носители, растворители, покрытия, вспомогательные средства, воспринимающие средства или наполнители, такие как консервирующие агенты, заполнители, разлагающие агенты, увлажняющие агенты, эмульгирующие агенты, стабилизирующие эмульсию агенты, суспендирующие агенты, изотонические агенты, подслащивающие агенты, ароматизирующие агенты, отдушки, красящие агенты, антибактериальные агенты, противогрибковые агенты, другие терапевтические агенты, смазочные агенты, замедляющие или ускоряющие адсорбцию агенты и дозирующие агенты, в зависимости от характера режима введения и дозирования, форм. Настоящие композиции могут быть представлены в форме таблеток, пилюль, гранул, порошков, водных растворов или суспензий, растворов для инъекций, эликсиров или сиропов. Типовые суспендирующие агенты включают этоксилированные изостеариловые спирты, полиоксиэтиленовый сорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, или смеси этих веществ. Образцовые антибактериальные и антигрибковые агенты для предотвращения действия микроорганизмов включают парааминобензойные кислоты, хлоробутанол, фенол, сорбиновую кислоту и им подобные. Образцовые изотонические агенты включают сахара, хлористый натрий и им подобные. Образцовые задерживающие адсорбцию агенты, служащие для пролонгирования абсорбции, включают моностерат алюминия и желатин. Образцовые поддерживающие адсорбцию агенты, служащие для усиления адсорбции, включают диметилсульфоксид и соответствующие аналоги. Образцовые носители, растворители, сольвенты, вспомогательные средства, повышающие растворимость средства, вещества, способствующие эмульгированию и стабилизирующие эмульсию, включают воду, хлороформ, сахарозу, этанол, изопропиловый спирт, этиловый карбонат, этиловый ацетат, бензиловый спирт, тетрагидрофурфуриловый спирт, бензил бензоат, высокомолекулярные спирты, пропиленгликоль, 1,3-бутиленгликоль, глицерол, полиэтиленгликоли, диметилформамид, Tween® 60, Span® 60, цетостеариловцый спирт, миристиловый спирт, глицерил-моно-стеарат и лаурилсульфат натрия, сложные эфиры жирных кислот или сорбитан, растительные масла (такие как хлопковое масло, арахисовое масло, масло семян огурца, оливковое масло, касторовое масло и кунжутное масло) и инъецируемые органические сложноэфирные, такие как этилолеат и им подобные, или пригодные смеси этих веществ. Типовые носители включают лактозу, молочный сахар, лимоннокислый натрий, карбонат кальция, дикальцийфосфат. Типовые разлагающие агенты включают крахмал, альгиновые кислоты и некоторые сложные силикаты. Типовые смазывающие вещества включают стеарат магния, лаурилсульфат натрия, тальк, так же, как полиэтиленгликоли, имеющие высокую молекулярную массу.
Другие терапевтические средства также могут быть использованы в комбинации с соединениями настоящего изобретения. Терапевтические агенты, используемые в сочетании с соединениями настоящего изобретения, можно применять отдельно, одновременно или последовательно. Выбор иного материала в фармацевтической композиции, нежели соединение формулы 1, обычно определяется в соответствии с химическими свойствами активного соединения, таким, как растворимость, конкретный способ применения и положения, которые должны соблюдаться в фармацевтической практике. К примеру, носители, такие как лактоза, лимоннокислый натрий, карбонат кальция, дикальцийфосфат и разлагающие агенты, такие как крахмал, альгиновые кислоты, определенные сложные силикаты в комбинации со смазывающими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк, можно использовать для приготовления таблеток.
Фармацевтические композиции могут быть представлены в смешанных формах, таких как таблетки, пилюли, гранулы, порошки, водные растворы или суспензии, растворы для инъекций, эликсиры или сиропы.
Термин «жидкие лекарственные формы» означает, что дозу активного соединения должны вводить пациенту в жидкой форме, к примеру, фармацевтически применимые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные растворители, обычно используемые в данной области техники, такие как сольвенты, агенты, повышающие растворимость, и эмульгаторы.
Твердые составы можно также употреблять как заполнители в мягко- и твердозаполненных желатиновых капсулах с использованием таких носителей, как лактоза или молочный сахар, так же, как полиэтиленгликоли с высоким молекулярным весом, и им подобные.
Когда используются водные суспензии, они могут содержать эмульгирующие агенты или агенты, которые облегчают суспензию.
Масляная фаза эмульсионной фармацевтической композиции может быть образована из известных ингредиентов известным способом. Хотя фаза может включать только вещество, способствующее эмульгированию (известное также как эмульгатор), она желательно должна включать смесь по меньшей мере одного эмульгатора с жиром или маслом или и жиром, и маслом. В данном варианте осуществления гидрофильный эмульгатор включают вместе с липофильным эмульгатором, который действует как стабилизатор. Эмульгатор(ы) с или без стабилизатора(ов) вместе образуют эмульгирующую пасту и вместе с маслом и жиром образуют основу эмульгирующей мази, которая формирует масляную диспергированную фазу составов кремов.
При желании, водная фаза кремовой основы может включать, к примеру, не менее 30% массовой части (в/в) многоатомного спирта, т.е. спирта, имеющего две или более гидроксильных группы, такого, как пропиленгликоль, бутан 1,3-диол, маннитол, сорбитол, глицерол и полиэтиленгликоль (включая PEG 400) и их смеси. Составы для наружного применения могут при желании включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента сквозь кожу или другие обработанные области.
Выбор пригодных масел или жиров для лекарственных составов основан на достижении желаемых свойств. Так, крем должен предпочтительно быть нежирным, не красящим и смываемым продуктом с подходящей консистенцией для предотвращения утечки из тюбиков или других контейнеров. Можно использовать прямую или ветвящуюся цепь, моно- или сложные двухосновные эфиры алкилов, такие как диизопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смешанная или ветвящаяся цепь сложных эфиров, известная как Crodamol CAP. Их можно использовать самостоятельно или в комбинации в зависимости от требуемых свойств. Альтернативно, тугоплавкие жиры, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла можно использовать.
На практике соединения/фармацевтические композиции настоящего изобретения можно применять в пригодном составе людям и животным для местного или системного введения, включая оральное, ингаляционное, ректальное, назальное, буккальное, сублингвальное, вагинальное, толстокишечное, парентеральное (включая субкутанное, внутримышечное, внутривенное, подкожное, интратекальное и эпидуральное), интрацистернальное и интраперитонеальное. Следует иметь в виду, что предпочтительный путь может меняться в зависимости от, например, состояния реципиента.
«Фармацевтически приемлемые формы дозировки» относятся к формам дозировки соединений данного изобретения и включают, к примеру, таблетки, драже, порошки, эликсиры, сиропы, жидкие препараты, включая суспензии, спреи, ингаляционные таблетки, ромбовидные пластинки, эмульсии, растворы, гранулы, капсулы и суппозитории так же, как жидкие препараты для инъекций, включая липосомные препараты. Техники и технологии приготовления лекарственных форм могут быть найдены в Remington′s Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, последнее издание.
«Составы, пригодные для перорального введения» могут быть представлены как дискретные единицы, как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее установленное количество активного ингредиента; как порошок или гранулы; как раствор или суспензию в водной жидкости или неводной жидкости; или в виде жидкой эмульсии типа масло-в-воде или жидкой эмульсии типа вода-в-масле. Активный ингредиент может также быть представлен как шарик, электуарий или кашица.
Таблетку могут изготовлять путем сжатия или лепки, необязательно с одним или более добавочными ингредиентами. Сжатые таблетки могут быть приготовлены путем сжатия в соответствующей машине активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, смазывающим веществом, инертным растворителем, консервантом, поверхностно-активным или диспергирующим средством. Сформированные таблетки могут быть изготовлены путем лепки в соответствующей машине, смесь порошкообразных соединений увлажняют инертным жидким растворителем. Таблетки могут необязательно быть покрытыми или рифлеными и могут быть сформированы так, чтобы обеспечить медленное или контролируемое расщепление активного в них ингредиента.
Твердые композиции для ректального применения включают суппозитории, составленные в соответствии с известными методами и содержащие по меньшей мере одно соединение настоящего изобретения.
Если желательно, и для более эффективного распространения, соединения могут микроинкапсулировать в, или прикреплять к системам медленного высвобождения или целевым системам доставки, таким как биологически совместимые, биоразлагаемые полимерные матрицы (например, сополимер d,l-лактида и гликозида), липосомы и микросферы и подкожно или внутримышечно вводить при помощи техники, называемой подкожное или внутримышечное депо, для обеспечения постоянного медленного высвобождения соединения(ий) на период до 2-х недель или дольше. Эти соединения могут быть стерилизованы, к примеру, путем фильтрации через бактериальный фильтр, или включения стерилизующих агентов в форме стерильных твердых составов, которые могут быть растворены в стерильной воде, или некоторых других стерильных инъецируемых средах непосредственно перед использованием.
«Составы, пригодные для назального или ингаляторного применения» означает составы в форме, пригодной для назального применения или ингаляции пациентом. Эти лекарственные формы могут содержать носитель в форме порошка, имея размеры частиц, к примеру, в диапазоне от 1 до 500 микрон (включая размеры частиц в диапазоне между 20 и 500 микронами в приращениях 5 микрон, таких как 30 микрон, 35 микрон и т.д.). Пригодные лекарственные формы, когда носитель представляет собой жидкость, для применения, к примеру, назального спрея или назальных капель, включают водные или масляные растворы активного ингредиента. Лекарственные формы, пригодные для аэрозольного применения, могут быть приготовлены в соответствии с общепринятыми методами и могут быть доставлены другими терапевтическими агентами. Ингаляционная терапия легко применяется с использованием дозирующих ингаляторов.
«Составы, подходящие для перорального введения» означает составы, которые находятся в форме, подходящей для введения перорально пациенту. Составы могут быть представлены в виде дискретных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит заранее установленное количество активного ингредиента; такого как порошок или гранулы; как раствор или суспензия в водной жидкости или неводной жидкости; или в виде жидкой эмульсии типа масло-в-воде или жидкой эмульсии типа вода-в-масле. Активный ингредиент также может быть представлен в виде шарика, электуария или пасты.
«Составы, подходящие для парентерального введения» означает составы, которые находятся в форме, подходящей для введения пациенту парентерально. Составы являются стерильными и включают эмульсии, суспензии, водные и неводные растворы для инъекций, которые могут содержать суспендирующие средства и загустители и антиоксиданты, буферы, бактериостатические факторы и растворы, которые превращают состав в изотонический и имеют надлежащим образом скорректированный рН с кровью планируемого реципиента.
«Составы, подходящие для ректального или вагинального введений» означает составы, которые находятся в форме, подходящей для ректального или вагинального введения пациенту. Суппозитории являются конкретной формой таких составов, которые могут быть приготовлены путем смешивания соединений этого изобретения с подходящими нераздражающими наполнителями либо носителями, такими как масло какао, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при обычных температурах, но жидкими при температуре тела, и следовательно, тают в прямой кишке или полости влагалища и высвобождают активное соединение.
«Составы, подходящие для системного введения» означает составы, которые находятся в форме 20 подходящей для введения пациенту системно. Состав предпочтительно вводят путем инъекции, включая внутримышечную, внутривенную, интраперитонеальную и субкутанную. Для инъекции соединения настоящего изобретения составлены в жидкие растворы, в частности в физиологически совместимые буферы, такой как раствор Хэнка или раствор Рингера. К тому же, соединения можно составлять в твердой форме и повторно растворять или суспендировать непосредственно перед применением. Лиофилизированные формы также включены. Системное введение также может быть получено путем трансмукозального или трансдермального средств, или соединения можно вводить перорально. Для трансмукозального или трансдермального введения пенетранты, соответствующие барьеру, который будет преодолеваться, используются в составе. Такие пенетранты, как правило, известны в данной области техники, и включают, например, производные желчных солей и фузидиевой кислоты для трансмукозального введения. Кроме того, для облегчения проникновения можно использовать детергенты. Трансмукозальное введение можно осуществлять за счет использования назальных спреев, например, или суппозиториев. Для перорального введения соединения разрабатываются в обычных для перорального введения формах, таких как капсулы, таблетки и тоники.
«Составы, пригодные для местного введения» означает составы, которые находятся в форме, пригодной для местного введения пациенту. Состав может быть представлен в виде мази для местного применения, бальзамов, порошков, аэрозолей и ингаляторов, гелей (на водной или спиртовой основе), кремов, известных в настоящем уровне техники, или включен в матричную основу для применения в пластыре, который позволит контролируемое высвобождение соединения через трансдермальный барьер. Составленные в виде мази активные ингредиенты могут быть использованы с парафиновой или водорастворимой основой мази. Кроме того, активные ингредиенты могут быть составлены в виде крема на водно-масляной кремовой основе. Составы, пригодные для местного введения в глаз, включают глазные капли, в которых активный ингредиент растворяют или суспендируют в подходящем носителе, особенно в водном растворителе активного ингредиента. Составы, пригодные для местного введения в полости рта, включают таблетки для рассасывания, содержащие активный ингредиент во вкусовой основе, как правило, сахарозе и камеди или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
«Твердая лекарственная форма» означает лекарственную форму соединения настоящего изобретения в твердой форме, например, в капсулах, таблетках, пилюлях, порошках, драже или гранулах. В таких твердых лекарственных формах соединения настоящего изобретения примешивают к по меньшей мере одному обычному инертному наполнителю (или носителю), такому как цитрат натрия или дикальцийфосфат или (а) наполнителям или разбавителям, как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (b) связующим веществам, как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и камедь, (с) увлажнителям, например, глицерин, (d) разрыхлителям, как, например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые сложные силикаты и карбонат натрия, (е) замедлители высыхания раствора, как, например, парафин, (f) ускорители абсорбции, как, например, соединения четвертичного аммония, (g) смачиватели, как, например, цетиловый спирт и моностеарат глицерина, (h) адсорбенты, как, например, каолин, бентонит, (i), смазочные материалы, как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, (j) замутняющие средства, (k) буферные средства, и средства, которые высвобождают соединение(я) настоящего изобретения в определенной части желудочно-кишечного тракта с задержкой.
Фактические уровни дозы активного ингредиента(ов) в композициях настоящего изобретения можно изменять для получения количества активного ингредиента(ов), которое является(являются) эффективным для получения желаемого терапевтического ответа на конкретную композицию и способ применения для пациента. Выбранный уровень дозировки для каждого конкретного пациента, следовательно, зависит от ряда факторов, в том числе желаемого терапевтического эффекта, пути введения, нужного срока лечения, этиологии и тяжести заболевания, состояния пациента, веса, пола, диеты и возраста, типа и эффективности каждого активного ингредиента, темпов поглощения, обмена веществ и/или выделения и других факторов.
Общая суточная доза соединений данного изобретения, которую вводят пациенту в один или несколько приемов, может составлять, например, от приблизительно 0,001 до приблизительно 100 мг/кг веса тела в день и предпочтительно от 0,01 до 10 мг/кг/сут. Например, у взрослых, дозы, как правило, предпочтительно от 0,01 до 100, приблизительно от 0,01 до 10 мг/кг массы тела в сутки при вдыхании, примерно от 0,01 до 100, предпочтительно от 0,1 до 70, особенно, от 0,5 до 10 мг/кг массы тела в день при приеме внутрь, и от 0,01 до 50, предпочтительно от 0,01 до 10 мг/кг массы тела в сутки при внутривенном введении. Долю активного ингредиента в композиции можно изменять, но она должна составлять такую часть, чтобы была получена подходящая дозировка. Единица дозирования композиции может содержать такое количество дольных единиц, которое можно использовать, для компенсации суточной дозы. Безусловно, несколько стандартных форм дозировки можно вводить примерно одновременно. Дозу можно вводить с частотой, необходимой для получения желаемого терапевтического эффекта. Некоторые пациенты могут быстро реагировать на большую или меньшую дозу, и поддержание гораздо более слабой дозы может оказаться достаточным. Для других пациентов может быть необходимо долгосрочное лечение, от 1 до 4 доз в день, в соответствии с физиологическими потребностями каждого конкретного пациента. Само собой разумеется, что другим пациентам надо будет назначать не более одной или двух доз в день.
Составы могут быть приготовлены в стандартной лекарственной форме любым из способов, хорошо известных в области фармацевтики. Такие способы включают стадию соединения активного ингредиента с носителем, который состоит из одного или нескольких вспомогательных ингредиентов. В основном составы готовят путем однородного и тесного соединения активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями или носителями обоих типов, а затем, при необходимости, формирования продукта.
Составы могут быть представлены в виде контейнеров, содержащих единичную дозу или несколько доз, например запаянных ампул и флаконов с эластомерными пробками, и могут храниться в крио-высушенном (лиофилизированном) состоянии, требуя лишь добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Экстемпоральные растворы для инъекций и суспензий можно получить из стерильных порошков, гранул и таблеток описанных ранее типов.
Соединения в рамках настоящего изобретения проявляют значительную фармакологическую активность в испытаниях, описанных в литературе и ниже, тестовые результаты которых, как полагают, коррелируют по фармакологической активности в организме человека и других млекопитающих.
Химические реакции, описанные в цитируемых выше источниках, в общем раскрывают с точки зрения их широкого применения для получения соединений данного изобретения. Иногда реакции не могут быть применены, как описано для каждого соединения, включенного в объем соединений, описанных в данном документе. Соединения, с которыми это происходит, могут определять специалисты в данной области. Во всех таких случаях или реакцию можно успешно осуществлять с помощью обычных модификаций, известных специалистам в данной области, например путем обеспечения надлежащей защиты интерферирующих групп, за счет перехода на альтернативные обычные реагенты, обычных изменений условий реакции, и т.п., или другие реакции, описанные в данном документе, или в противном случае обычные, будут применимыми к приготовлению соответствующих соединений данного изобретения. Во всех методах приготовления все исходные материалы известны или легко приготовляемы из известных исходных материалов.
Режим для лечения пациентов, страдающих от аллергических дерматологических условий, таких как атопический дерматит, соединением и/или композицией настоящего изобретения, выбирается в соответствии с целым рядом факторов, включая возраст, вес, пол, диету и состояние здоровья больного, тяжесть состояния, пути введения, фармакологические соображения, такие как активность, эффективность, фармакокинетические и токсикологические профили конкретных используемых соединений, и использование системы доставки лекарственного средства. Прием комбинаций препаратов, описанных в данном документе, как правило, должен быть продолжен в течение периода до достижения приемлемого, купированного состояния. Пациенты, проходящие лечение комбинацией препаратов, описанных в данном документе, могут быть объектом постоянного мониторинга с помощью традиционных методов измерения функции почек для определения эффективности терапии. Непрерывный анализ данных, полученных с помощью этих методов, позволяет изменять схему лечения во время терапии, и таким образом вводят оптимальное количество каждого компонента в комбинации, и таким образом, чтобы также определялась продолжительность лечения. Таким образом, схему лечения/дозировки можно рационально изменять в течение терапии, так, чтобы вводили самые малые объемы каждого из соединений, используемых в комбинации, которые вместе обладают удовлетворительной эффективностью, и так, что применение таких соединений в комбинации продолжается только до тех пор, пока это необходимо для успешного лечения дерматологических аллергических состояний, таких как атопический дерматит.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР
Информация о животных
Для данного исследования использовали самцов приматов вида Macaca fascicularis в возрасте от 5 до 10 лет. Каждое животное идентифицировали по уникальной номерной татуировке, расположенной на груди. Размер группы был 12. Животные были поставлены Charles River и размещены в условиях, изложенных в руководстве NIH по уходу и использованию лабораторных животных в соответствии с USDA Laboratory Animal Welfare Act (закон о лабораторных животных МСХ США) в полностью аккредитованном по AAALAC объекте. Кормом для приматов Purina (продукт 5038) кормили два раза в день, с дополнением фруктами, овощами и препаратами. Вода была доступна без ограничений.
Протокол использования животных, по которому проводили это исследование, был одобрен Комитетом по уходу за животными и их использованию (Institutional Animal Care and Use Committee).
Информация о соединении
Соединение А, первоначально упомянутое в солевой форме (гидрохлорид), синтезировали по схеме, описанной выше. Соль/активное вещество соотношение (в/в): 1,07.
Дифенгидрамина гидрохлорид (Bioniche Pharma, номер по каталогу 1084899, номер партии 070709) был использован в качестве положительного контроля.
Составы
Соединение А, составленное в растворе, содержащем 0,22 мг/мл, A sum (Ascaris sum) в фосфатном буферном растворе, дозировали по 0,004, 0,0004, 0,00004 и 0,000004 мг в инъекции в объеме 40 мкл.
Дифенгидрамина гидрохлорид был составлен в растворе, содержащем 0,22 мг/мл A suum в фосфатном буферном растворе. Дифенгидрамина гидрохлорид вводили в дозе 0,4 мг в инъекции в объеме 40 мкл.
Составление антигена
Экстракт Ascaris suum (номер партии XPB33X1A5, лот 30575) был поставлен Greer Laboratories. Экстракт растворяли в дистиллированной воде до конечной концентрации маточного раствора 10 мг/мл.
Процедура
Животных наркотизировали с помощью внутримышечного (IM) раствора для инъекций от 5 до 10 мг/кг кетамина, смешанного с от 0,5 до 0,75 мг/кг медетомидина. Грудь и живот животного брили и протирали спиртом. Следующие инъекции (40 мкл) вводили интрадермально:
PBS (фосфатный буферный раствор)
Ascaris 8,8×10-3 мг/мл
Ascaris 8,8×10-3 мг/мл + 0,4 мг Дифенгидрамина гидрохлорида
Ascaris 8,8×10-3 мг/мл + 0,004 мг SAR160719
Ascaris 8,8×10-3 мг/мл + 0,0004 мг SAR160719
Ascaris 8,8×10-3 мг/мл + 0,00004 мг SAR160719
Ascaris 8,8×10-3 мг/мл + 0,000004 мг SAR160719
Реакция в виде волдырей измерялась через 15 минут после инъекции с использованием верньерного штангенциркуля. Волдырь измеряли по двум диаметрам (D1 и D2) перпендикулярно друг к другу. Площадь волдыря рассчитывали по формуле:
Площадь (мм2)=((D1+D2)/4)2×3,142
После измерения гидрокортизоновый крем наносили на все места инъекций. Дифенгидрамина гидрохлорид 2 мг/кг вводили (IM), а также атропин 0,1 мг/кг подкожно. Животных возвращали с помощью атипамезола гидрохлорида (IM), отправляли обратно в их домашние клетки и наблюдали за любыми дальнейшими аллергическими реакциями или зудом в месте инъекции.
Статистический анализ
Использовали смешанную модель с повторными измерениями для анализа данных с размерами волдырей для различных групп лечения, повторными измерениями, лечением в качестве основных эффектов, а также животными как случайными эффектами. Корреляционную структуру выбрали для составной симметрии. Для получения результатов использовали надежную оценку ковариаций.
Результаты
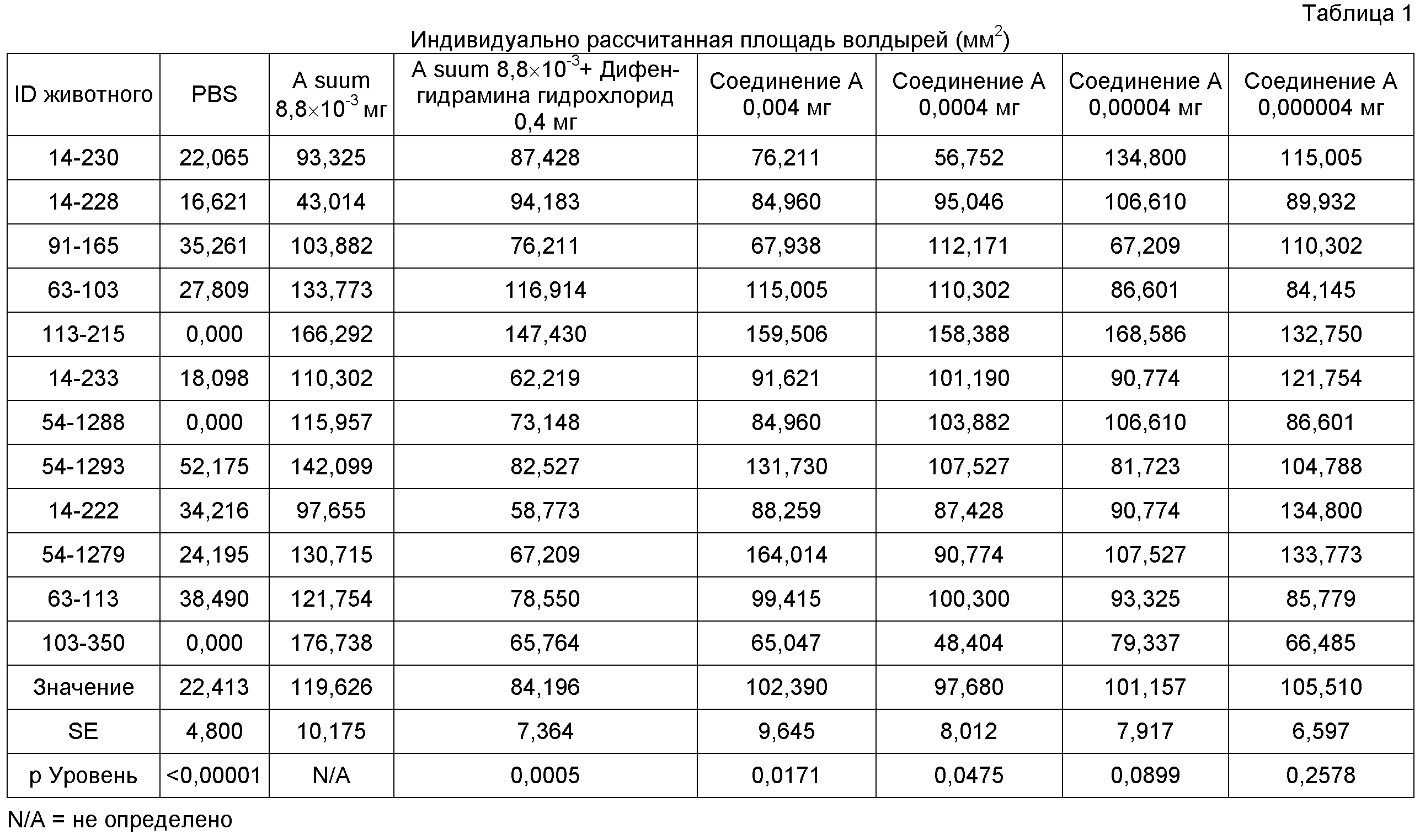
Соединение А, введенное интрадермально совместно с A suum, уменьшало антиген-индуцированное образование волдырей при измерении через 15 минут после инъекции. Средняя площадь волдырей (±SE) в месте инъекции A suum составляла 119,626±10,175 мм2. Соединение А достоверно снижало среднюю площадь волдырей при 0,0004 мг (97,680±8,012 мм2, р=0,0475) и 0,004 мг (102,390±9,645 мм2, р=0,0171) дозах. Дифенгидрамин гидрохлорид, введенный совместно с A suum, достоверно снижал среднюю площадь волдырей при 0,4 мг (84,196±7,364 мм2, р=0,0005).
Результаты отображены в Таблице I ниже.
Настоящее изобретение может быть осуществлено в других конкретных формах без отхода от сущности или его существенных признаков.