Результат интеллектуальной деятельности: ИМИНОПРОИЗВОДНЫЕ КАМФОРЫ - ЭФФЕКТИВНЫЕ ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСА ГРИППА (штамм A/California/07/09 (H1N1)pdm09)
Вид РИД
Изобретение
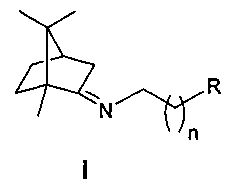
Изобретение относится к медицине и фармацевтике, конкретно к биологически активным веществам, представляющим собой иминопроизводные камфоры общей формулы I:
где n=2-4, R - гидрокси, метокси, диметиламиногруппа или морфолинил,
которые могут использоваться в качестве ингибиторов репродукции вируса гриппа (штамм A/California/07/09 (H1N1)pdm09) и могут быть использованы в медицине, вирусологии и фармакологии.
На сегодняшний день медицина имеет в своем распоряжении относительно небольшой перечень высокоспецифических противовирусных средств (химиопрепаратов), которые получили международное признание. Вирусы гриппа представляют серьезную угрозу для здоровья человека в связи с легкостью передачи через верхние дыхательные пути. Разработка новых лекарственных средств лечения и профилактики вирусных инфекций - одна из актуальных задач современной фармакологии и медицинской химии, поскольку глобализация, мобильность населения и характер передачи вирусных инфекций способствуют их активному распространению по всему миру. Вирус гриппа А вызывает инфекционные заболевания верхних дыхательных путей. Ежегодно эпидемии гриппа в мире приводят к 3,5 миллионам случаев тяжелых заболеваний и к 300-500 тыс. случаев со смертельным исходом. Эпидемия «птичьего» гриппа H5N1 (1997-2006) и затем пандемия гриппа 2009 г., вызванная вирусом свиного происхождения A(H1N1)pdm09, сделали настоятельно необходимой ревизию состояния проблемы с разработкой противовирусных препаратов [Киселев О.И. Химиопрепараты и химиотерапия гриппа. Санкт-Петербург, Росток, 2012].
Противовирусные средства для лечения гриппа представляют собой крайне ограниченную группу лекарственных препаратов, причем для большинства из них известна лекарственная резистентность. Новые эпидемичные штаммы вируса гриппа А возникают каждые 1-2 года в результате точечных мутаций в двух поверхностных гликопротеинах - гемагглютинине (HA) и нейраминидазе (NA) [Еропкин М.Ю., Зарубаев В.В. Современное состояние разработок новых антивирусных препаратов против гриппа и ОРВИ // Фармацевтический бюллетень - 2012. №1. - С 68]. Благодаря особенностям организации генома (отсутствие механизма коррекции ошибок репликации) и короткому жизненному циклу вирус гриппа обладает высокой скоростью мутаций. Как результат антигенная структура вируса в высокой степени подвержена изменениям в результате селективного давления иммунной системы организма-хозяина. Кроме того, применение химиопрепаратов воспринимается вирусом как фактор селекции, в результате чего также происходит формирование устойчивых штаммов. Эти два процесса приводят к появлению вариантов вирусов, способных избегать как активности нейтрализующих антител и тем самым ускользать от иммунного ответа организма, так и преодолевать действие химиопрепаратов, исходно направленных на определенный этап репродукции вируса. При этом каждый тип вируса имеет свой механизм приспособления к химическому препарату [Ison M.G. Antivirals and resistance: influenza virus // Current Opinion in Virology -2011, - V 1. P. 563-573].
Ингибировать репродукцию вируса гриппа можно на разных стадиях его жизненного цикла, на этом основана классификация противовирусных средств по механизму действия.
Известны ингибиторы нейраминидазы, зарегистрированные в России: Озельтамивир (Тамифлю) и Занамивир (Реленза), а также используемые в США: Перамивир (Рапиакта) и Ланинамивир (Инавир), которые действуют на этапе почкования вновь синтезированных вирионов гриппа из оболочки клетки, блокируя отщепление частиц вирусного потомства от поверхности клеток [Ison MG. Clinical use of approved influenza antivirals: therapy and prophylaxis. // Influenza Other Respi Viruses. 2013;7 Suppl 1:7-13]. Практика применения ингибиторов нейраминидазы в лечении гриппа показала, что высокая эффективность этой группы препаратов ограничена ранней стадией инфекции.
Известны противовирусные препараты прямого действия на репликацию вирусов гриппа, например препарат Ремантадин (α-метил-1-адамантилметиламина гидрохлорид) и Амантадин (1-аминоадамантан) [Davies, W.L.; Grunert, R.R.; Haff, R.F.; McGahen, J.W.; Neumayer, E.M; Paulshock, M; Watts, J.C; Wood, T.R.; Hermann, E.C; Hoffmann, С.E. Antiviral Activity of 1-Adamantanamine (Amantadine) // Science. - 1964. - V. 144. P. 862]. Данные соединения блокируют белок М2 вируса гриппа, препятствуя тем самым процессу расщепления гемагглютинина и слияния мембран вируса и лизосомальной вакуоли [Scholtissek С, Quack G., Klenk H.D., Webster R.G. // Antiviral Res. 1998, V. 37, P. 83-95]. Механизм действия этих препаратов изучен достаточно полно [Cady S.D., Schmidt-Rohr К., Wang J., Soto C.S., DeGrado W.F., Hong M.H. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers // Nature. 2010. Vol.463. P. 689-692]. Белок M2 в виде тетрамера является ионным каналом, функционирующим в качестве протонного насоса. Известно, что данные препараты необратимо ингибируют М2-белок и тем самым останавливают поток протонов через мембраны вирионов, что необходимо для снижения рН, расщепления гемагглютинина и реализации его функции как фактора слияния вирусной и клеточной мембран. Ремантадин блокирует активность ионных каналов и нарушает тем самым процесс «раздевания» вируса.
Адамантановые препараты значительно дешевле и проще в производстве, чем коммерчески доступные ингибиторы нейраминидазы, что делает их более доступными для лечения и профилактики гриппа среди населения. Однако в настоящее время в результате широкого использования адамантановых препаратов (ремантадин и амантадин) значительно утрачены их противовирусные свойства в отношении вирусов гриппа А. Потерю активности в основном связывают с мутацией в трансмембранном домене белка М2 вируса гриппа. Кроме хорошо известного ремантадина, сравнимой с ним противовирусной активностью обладает достаточно обширный класс соединений. Так, известно средство на основе дейтифорина (2-(1′-аминоэтил)бицикло[2.2.1]гептана, являющееся одним из наиболее интересных препаратов на основе природных бициклических каркасных соединений - борнанов [Патент RU 2448692 С2, оп. 27.04.2012] и введенных в медицинскую практику. Симметричные диимины на основе камфоры, разделенные алифатической цепочкой, обладают сравнительно высокой активностью (индекс селективности от 40 до 89) [Патент РФ 2520967].
Наиболее близким к заявляемому соединению (прототипом) является дейтифорин, представляющий собой фармацевтические соли (2-(1′-аминоэтил)бицикло[2.2.1]гептана общей формулы II
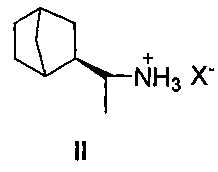
Недостатком известного соединения является невысокая противовирусная активность.
Задачей изобретения является расширение нового класса эффективных ингибиторов репродукции вируса гриппа, которые могут быть синтезированы из доступных природных реагентов в одну стадию и с высоким выходом.
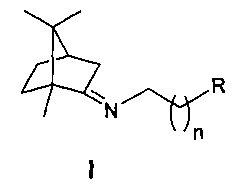
Технический результат: повышение эффективности подавления репродукции вируса гриппа и расширение ассортимента ингибиторов репродукции вируса гриппа для преодоления лекарственной устойчивости современных вирусных штаммов. Поставленная задача решается новыми соединениями общей формулы I, обладающими выраженными свойствами ингибиторов репродукции вируса гриппа.
где n=2-4, R - гидрокси, метокси, диметиламиногруппа или морфолинил.
Соединения общей формулы 1 после проведения углубленных фармакологических исследований могут использоваться как в чистом виде, так и в качестве компонента новых низкотоксичных высокоэффективных противовирусных лекарственных форм.
Исследования биологической активности соединений 1, проведенные в отношении вируса гриппа (штамм A/California/07/09 (H1N1)pdm09), показали их высокую эффективность как ингибиторов репродукции этого вируса. Камфора будучи бициклическим терпеноидом с жестким типом остова, доступным как в правовращающих, так и в левовращающих энантиомерах, не проявила противовирусной активности в проведенных исследованиях. Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации вируса гриппа в культуре клеток MDCK соединениями 1, превышающую тот же показатель у эталонов сравнения - амантадина и римантадина в 15 и более раз. Использование в качестве препаратов сравнения адамантановых производных обусловлено наличием жестких структурных фрагментов как в полученных нами соединениях, так и в указанных препаратах. Синтез соединений Ia,b (примеры 1, 2) проводили с использованием аппарата Сокслета; при этом в патрон аппарата Сокслета помещали прокаленные молекулярные сита в качестве осушителя, в качестве катализатора использовали безводный ZnCl2; азеотропной отгонкой растворителя удаляли из реакционной смеси образовывающуюся воду. Синтез соединений Ic,d,e (примеры 3,4,5) проводили без растворителя, в качестве катализатора также использовали ZnCl2; очистку реакционных смесей проводили вакуумной перегонкой и, при необходимости, дополнительно колоночной хроматографией. Ход реакций отслеживали отбором проб и анализом хромато-масс-спектров.
Величины удельного вращения [α]589 определяли на спектрометре PolAAr 3005. Спектры ЯМР 1Н и 13С регистрировали на спектрометрах Bruker AV-400 (1Н: 400.13 МГц, 13С: 100.61 МГц) и AV-600 (1Н: 600.30 МГц, 13С: 150.95 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (δн 7.24, δс 76.90 м.д.). Отнесение сигналов в спектрах ЯМР проводилось с привлечением стандартных одномерных и двумерных экспериментов (COSY, HETCOR, COLOC, НМВС, HSQC). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS ThermoScientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 µ, Masherey-Nagel). Хромато-масс-спектры записывали на газовом хроматографе Agilent 7890 А с квадрупольным масс-спектрометром Agilent 5975С в качестве детектора, кварцевая колонка HP-5MS 30000×0.25 мм, газ-носитель - гелий. Удельное вращение выражено в (град·мл)·(г·дм)-1, концентрация раствора (г)·(100 мл)-1. Растворители перед использованием сушились и перегонялись.
Изобретение иллюстрируется следующими примерами.
Пример 1
Получение 1,7,7-триметилбицикло[2.2.1]гептан-2-илиденаминопропан-1-ола Ia
Суспензию 5 г (33 ммоль) камфоры и 8 мл (100 ммоль) 3-аминопропан-1-ола в толуоле поместили в аппарат Сокслета. Проводили азеотропную перегонку реакционной смеси, при этом в патрон аппарата Сокслета поместили прокаленные молекулярные сита в качестве осушителя, в качестве катализатора использовали ZnCl2. Далее добавили насыщенный раствор NaCl, экстрагировали серным эфиром, сушили над Na2SO4. Масса полученной смеси 6.5 г, очищали вакуумной перегонкой. Получили 4.8 г соединения Ia. Ткип=109°С (10 мм). Выход 74%.
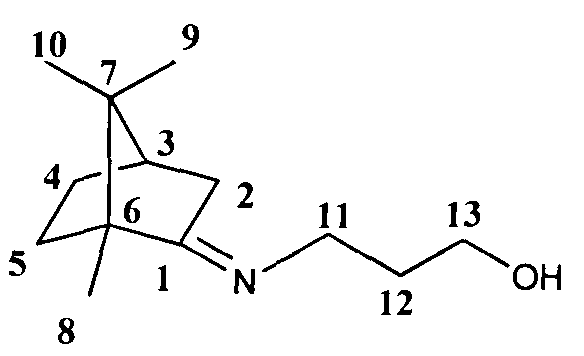
3-(((1R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)амино)пропан-1-ол.
Спектр ЯМР 1H (600МГц, CDCl3, δ, м. д, J/Гц): 0.69 (3H, с, Ме-9), 0.87 (3Н, с, Me-10), 0.87 (3Н, с, Ме-8), 1.15 (1Н, ддц, 2J=12.3, J4н,5н=9.3, J4н,5н=4.2, Н-4н), 1.28 (1Н, ддд, 2J=12.3, J5н, 4н=9.3, J5н,4к=4.5, Н-5н), 1.61 (1Н, ддд, 2J=J5к,4к=12.3, J5k,4н=4.2, Η-5к), 1.71-1.79 (2Η, м, Н-12), 1.75 (1H, д, 2J=16.9, Н-2н), 1.81 (1Н, ддддд, 2J=J4к,5к=12.3, J4к,5н=J4к,3=4.5, J4к,2к=3.2, H-4k), 1.91 (1H, дд, J3,2к=J3,4к=4.5, H-3), 2.28 (1H, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, Н-2к), 3.28-3.39 (2H, m, H-11), 3.78-3.85 (2H, м, H-13). ЯМР 13C (150 МГц, CDCl3, δ, м.д.): 182.80 с (C-1), 63.98 т (C-13), 53.56 с (C-6), 51.97 т (C-11), 46.99 с (C-7), 43.65 д (C-3), 35.08 т (C-2), 31.74 т (C-12), 31.71 т (C-5), 27.20 т (C-4), 19.36 к (Me-9), 18.75 к (Me-10), 11.01 к (Me-8). 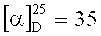 (CHCl3, c=0.92). Найдено: m/z 209.1776 [M]+ C13H23ON. Вычислено: M=209.1774
(CHCl3, c=0.92). Найдено: m/z 209.1776 [M]+ C13H23ON. Вычислено: M=209.1774
Пример 2
Получение 1,7,7-триметилбицикло[2.2.1]гептан-2-илиденаминопрентан-1-ола Ib
Суспензию 3 г (19,7 ммоль) камфоры и 4 г (40 ммоль) 5-амино-1-пентанола в толуоле поместили в аппарат Сокслета. Далее реакцию проводили, как описано в примере 1. Масса полученной смеси 2.9 г, очищали колоночной хроматографией, на 40 г SiO2, элюент гексан/этилацетат (100:0→0:100)+метанол(1%). Получили 2.2 г соединения Ib. Выход 48%
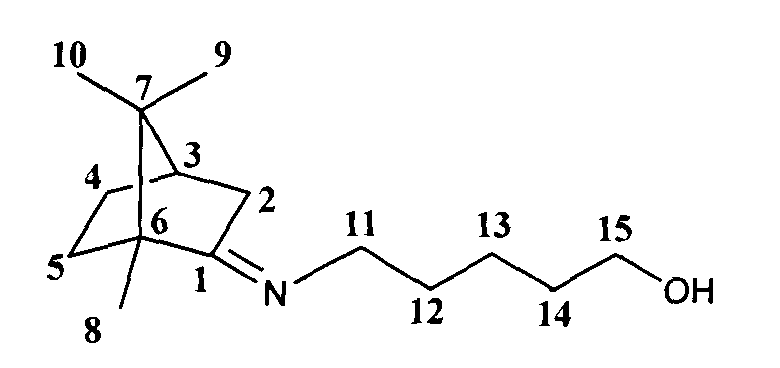
5-(((1R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)амино)пентан-1-ол.
Спектр ЯМР 1H (400 МГц, CDCl3, м.д., J/Гц): 0.70 (3Н, с, Ме-9), 0.87 (3Н, с, Ме-10), 0.92 (3H, с, Ме-8), 1.15 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.28 (3Н, м, Н-5н, 2Н-12), 1.51-1.65 (5Н, м, 2Н-13, 2Н-14, Н-5к), 1.77 (1Н, д, 2J=16.9, Н-2н), 1.76-1.84 (1Н, м, Н-4к), 1.88 (1Н, дд, J3,2к=J3,4к=4.5, Н-3), 2.28 (1Н, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, Η-2к), 3.09-3.23 (2Η, м, H-11), 3.57-3.62 (2Н, м, Н-15). Спектр ЯМР 13С (150 МГц, CDCl3, δ, м.д.): 182.10 с (С-1), 61.81 т (С-15), 53.34 с (С-6), 51.89 т (С-11), 46.70 с (С-7), 43.53 д (С-3), 35.28 т (С-2), 32.12 т (С-14), 31.91 т (С-5), 29.59 т (С-12), 27.20 т (С-4), 23.50 т (С-13), 19.30 к (Ме-9), 18.69 к (Ме-10), 11.15 к (Ме-8). 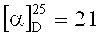 (CHCl3, с=0.82). Найдено: m/z 237.2090 [М]+ С15 Н27 ON. Вычислено: М=237.2087.
(CHCl3, с=0.82). Найдено: m/z 237.2090 [М]+ С15 Н27 ON. Вычислено: М=237.2087.
Пример 3
Получение 3-метокси-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)пропан-1-амина I с
Реакционную смесь, содержащую 2 г (0.013 моль) камфоры, 1.2 мл (0.013 моль) 3-метоксипропиламина и каталитическое количество ZnCl2 кипятили с обратным холодильником 12 часов. Смесь обрабатывали насыщенным раствором NaCl, экстрагировали диэтиловым эфиром, масса полученной смеси 2.3 г. Очищали вакуумной перегонкой Ткип=105°С (10 мм рт.ст), дополнительно очищали колоночной хроматографией, на 20 г SiO2, элюент гексан/этилацетат (100:0→0:100)+метанол (1%). Получили 1 г соединения 1 с, выход 36%.
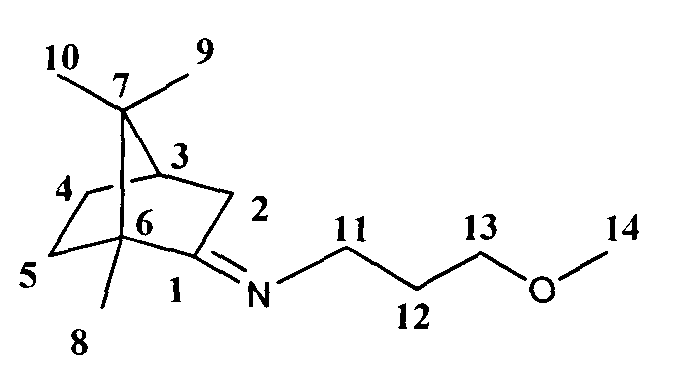
3-метокси-N-((1R,4R)-1,7,7-триметилбицикло [2.2.1] гептан-2-ил иден)пропан-1-амин. ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц): 0.70 (3Н, с, Ме-9), 0.87 (3Н, с, Ме-10), 0.91 (3Н, с, Ме-8), 1.14 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.28 (1Н, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.60 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4к=4.2, Η-5к), 1.74-1.89 (5Η, м, Н-4к, Н-2н, Н-12, Н-3), 2.30 (1H, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, Н-2к), 3.26 (3Н, с, ОМе-14), 3.16-3.28 (2Н, м, Н-11), 3.34 (2Н, м, Н-13). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 181.78 с (С-1), 70.41 т (С-13), 58.23 к (ОМе-14), 53.28 с (С-6), 48.54 т (С-11), 46.63 с (С-7), 43.65 д (С-3), 35.21 т (С-2), 32.04 т (С-5), 30.29 т (С-12), 27.30 т (С-4), 19.29 к (Ме-9), 18.75 к (Ме-10), 11.21 к (Ме-8). 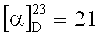 (CHCl3, с=0.84). Найдено: m/z 223.1934 [М]+ C14H25ON. Вычислено: М=223.1931.
(CHCl3, с=0.84). Найдено: m/z 223.1934 [М]+ C14H25ON. Вычислено: М=223.1931.
Пример 4
Получение 3-морфолин-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)пропан-1-амина Id
Реакционную смесь, содержащую 2.5 г (0.016 моль) камфоры, 1.3 г (0.016 моль) N-3-аминопропилморфолина и каталитическое количество ZnCl2, кипятили с обратным холодильником 10 часов. Смесь обрабатывали насыщенным раствором NaCl, экстрагировали диэтиловым эфиром, масса полученной смеси 3.47 г. Очищали вакуумной перегонкой Ткип=145°С (6 мм рт.ст), дополнительно очищали колоночной хроматографией, на 20 г SiO2, элюент гексан/этилацетат (100:0→0:100)+метанол(1%).
Получили 2.2 г соединения Id, выход 49%.
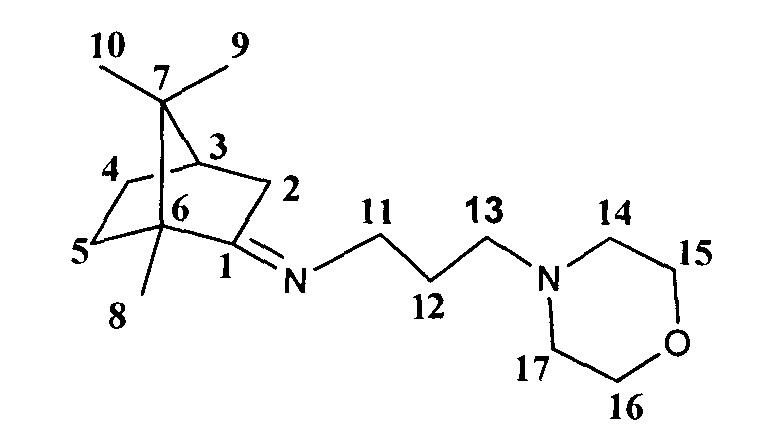
3-морфолин-N-((1R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)пропан-1-амин. ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц): 0.70 (3Н, с, Ме-9), 0.88 (3Н, с, Ме-10), 0.91 (3Н, с, Ме-8), 1.14 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.29 (1Н, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.62 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4н=4.2, Н-5к), 1.70-1.85 (3Н, м, 1Н-4к, 2Н-12), 1.80 (1H, д, 2J=16.9, Н-2н), 1.88 (1H, дд, J3,2к=J3,4к=4.5, Н-3), 2.25 (3Н, м, Н-2к, 2Н-13), 2.35-2.42 (4Н, м, 2Н-14, 2Н-17), 3.13-3.27 (2Н, м, Н-11), 3.61-3.71 (4Н, м, 2Н-15, 2Н-16). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 181.63 с (С-1), 66.84 т (С-15, С-16), 56.64 т (С-14, С-17), 53.91 т (С-11), 52.87 с (С-6), 49.92 т (С-13), 46.66 с (С-7), 43.68 д (С-3), 35.23 т (С-2), 32.05 т (С-5), 27.32 т (С-12), 27.21 т (С-4), 19.35 к (С-9), 18.77 к (С-10), 11.24 к (С-8). 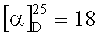 (CHCl3, с=0.9). Найдено: m/z 278.2350 [М]+ C17H30ON2. Вычислено: М-278.2353.
(CHCl3, с=0.9). Найдено: m/z 278.2350 [М]+ C17H30ON2. Вычислено: М-278.2353.
Пример 5
Получение Ν1,Ν1-диметил-N3-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)пропан-1,3-диамина Ie
Реакционную смесь, содержащую 3 г (0.019 моль) камфоры, 2.4 г (0.023 моль) Ν,Ν-диметилпропан-1,3-диамина и каталитическое количество ZnCl2, кипятили с обратным холодильником 8 часов. Смесь обрабатывали насыщенным раствором NaCl, экстрагировали диэтиловым эфиром, масса полученной смеси 3.8 г. Очищали вакуумной перегонкой Ткип=120-126°С (6 мм рт.ст), получили 3.1 г соединения Ie, выход 68%.
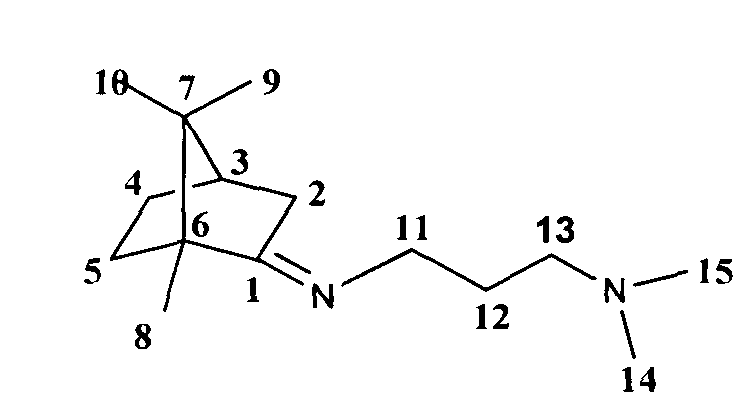
N1,N1-диметил-N3-((1S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)пропан-1,3-диамина.
ЯМР 1H (600 МГц, CDCl3, δ, м.д., J/Гц): 0.69 (3Н, с, Ме-9), 0.86 (3Н, с, Ме-10), 0.90 (3Н, с, Ме-8), 1.12 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.28 (1Н, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.59 (1H, ддд, 2J=J5к,4к=12.3, J5к,4к=4.2, Η-5к), 1.66-1.74 (2Н, м, Н-12), 1.78 (1Н, д, 2J=16.9, Н-2н), 1.78 (1Н, ддддд, 2J=J4к,5к=12.3, J4к,5н=J4к,3=4.5, J4к,2к=3.2, Н-4к), 1.86 (1Н, дд, J3,2к=J3,4к=4.5, Н-3), 2.15 (6Н, с, Ме-14 и Ме-15), 2.20-2.24 (2Н, м, Н-13), 2.28 (1Н, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, Н-2к), 3.15 и 3.20 (оба 1H, дт, 2J=12.2, J11,12=7.2, Н-11). ЯМР 13С (150 МГц, CDCl3, δ, м.д.): 181.54 с (С-1), 57.67 т (С-13), 53.27 с (С-6), 50.18 т (С-11), 46.68 с (С-7), 45.37 к (Ме-14 и Ме-15), 43.66 д (С-3), 35.24 т (С-2), 32.03 т (С-5), 28.53 т (С-12), 27.33 т (С-4), 19.36 к (Ме-9), 18.81 к (Ме-10), 11.28 к (Ме-8).
Пример 6
Изучение токсичности соединений 1а-е
Токсичность продуктов была изучена в отношении клеток MDCK. Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 37°С в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемых соединений 1а-е готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде, после чего готовили серию двукратных разведений препаратов в среде MEM от 1000 до 3,75 мкг/мл.
Растворенный препарат вносили в лунки планшетов и инкубировали 2 суток при 37°С. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°С в атмосфере 5% СО2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию соединения, вызывающую гибель 50% клеток в культуре. Результаты приведены в таблице.
Пример 7
Изучение противовирусной активности препаратов
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°С в атмосфере 5% СО2.
Из вируссодержащей жидкости (штамм A/California/07/09 (H1N1)pdm09) готовили серию десятикратных разведений от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°С в течение 48 часов в атмосфере 5% СО2. По окончании срока инкубации 100 мкл культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 минут инкубации при 20°С. За титр вируса принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке и выражали в количестве 50% инфекционных доз (ID50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ED50, то есть концентрацию препарата, снижающую уровень вирусной репликации вдвое (на 0,3 lg ID50), и химиотерапевтический индекс или индекс селективности (SI), представляющий собой отношение CTD50 к ED50.
В процессе исследования ингибирования репродукции вируса гриппа соединениями общей формулы I и эталонами сравнения (амантадином, ремантадином и дейтифорином) были получены результаты, приведенные в таблице 1.
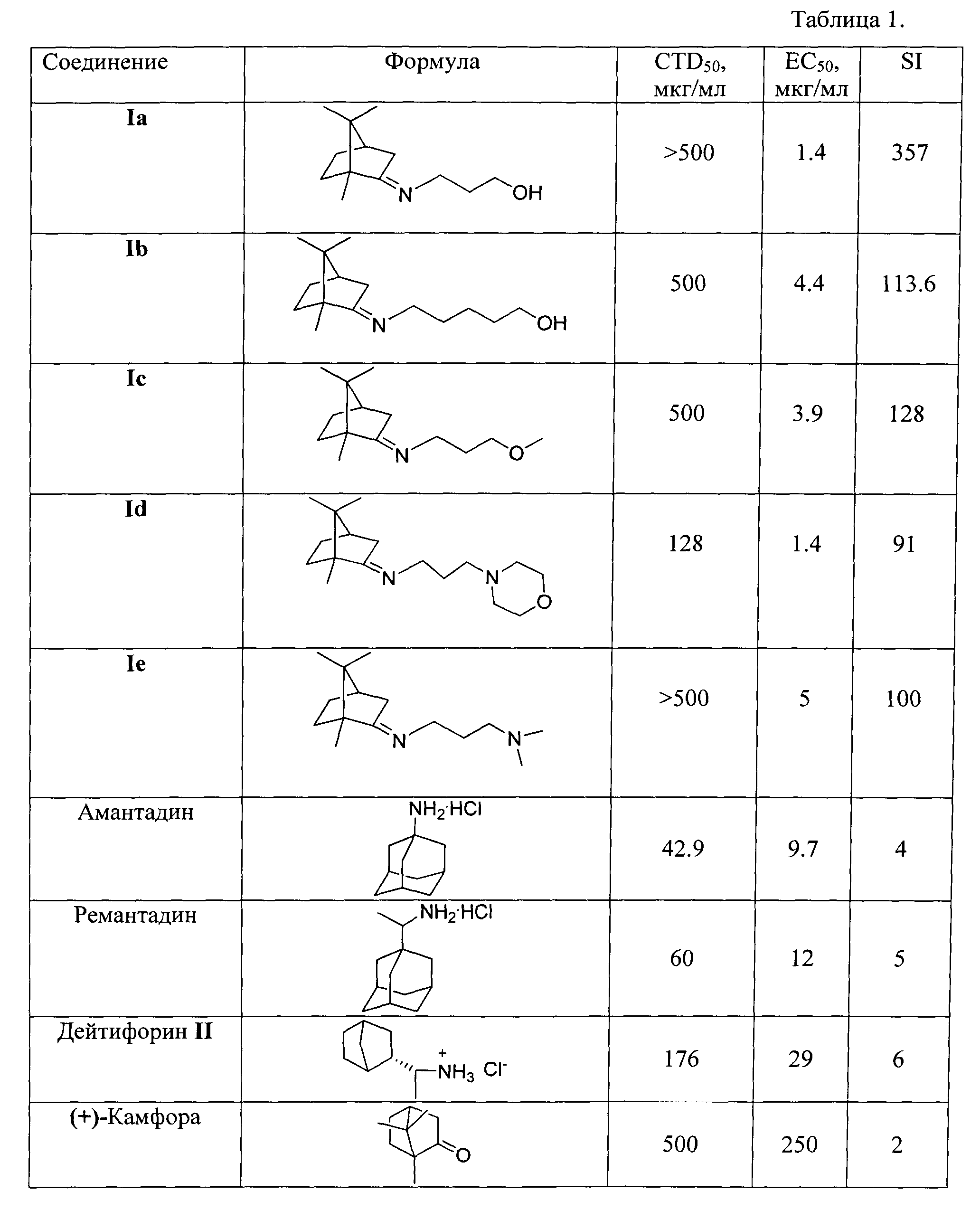
Из таблицы 1 видно, что соединения 1а-е проявляют выраженную противовирусную активность наряду с низкой токсичностью. Химиотерапевтический индекс соединений превышает таковой у препаратов сравнения в 15 и более раз. Преимуществом данных веществ является их активность в отношении ремантадин-устойчивого штамма вируса гриппа A/California/07/09 (H1N1)pdm09, что свидетельствует о перспективности применения их для терапии современных эпидемически актуальных вирусов, подавляющее большинство которых устойчивы к ремантадину.
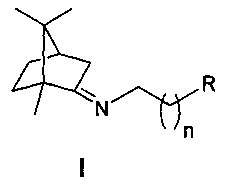
Иминопроизводные камфоры общей формулы I: ,где n=2-4, R - гидрокси, метокси, диметиламиногруппа или морфолинил, проявляющие свойства ингибиторов репродукции вируса гриппа (штамм A/California/07/09 (H1N1)pdm09).