Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ФУЛЛЕРЕНОЛОВ С60(OH)18-24 И С60(OH)30-38 В КАЧЕСТВЕ ПРОТИВОВИРУСНЫХ ПРЕПАРАТОВ
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к фармацевтическим препаратам, используемым при лечении вирусных инфекций различной этиологии - гриппа, аденовирусной, PC-вирусной и герпетической инфекций. Изобретение касается применения при данных видах инфекций соединения класса полигидроксифуллеренов (фуллеренолов) с определенным оптимальным количеством гидроксильных групп, подобранным экспериментальным путем.
Широко применяемые этиотропные противовирусные препараты (например, в случае вируса гриппа - ремантадин, озельтамивир, арбидол; в случае герпеса - ацикловир) направлены против конкретной молекулярной мишени во взаимодействии вирус-клетка, поэтому имеют достаточно узкий спектр противовирусной активности. Так, ремантадин действует только на вирусы гриппа типа А, но неэффективен против гриппа В, озельтамивир действует только на вирусы гриппа, но не действует на другие вирусы, вызывающие острые респираторные инфекции [Киселев О.И., Деева Э.Г., Слита А.В., Платонов В.Г. Антивирусные препараты для лечения гриппа и ОРЗ. Дизайн препаратов на основе полимерных носителей. «Время», СПб., 2000]. Кроме того, при интенсивном применении этиотропные препараты неизбежно вызывают появление и быстрое распространение устойчивых к ним штаммов вирусов. Так, к ремантадину в последние годы устойчивы большая часть вирусов гриппа A(H3N2), значительная часть вирусов «птичьего гриппа» A(H5N1) и вирусы пандемического гриппа 2009 г. A(H1N1)v, а к озельтамивиру (тамифлю) постоянно росло в последние годы число устойчивых сезонных эпидемических штаммов А(Н1N1) [Еропкин М.Ю., Грудинин М.П., Коновалова Н.И и др. // Инфекц. болезни - 2009 - Т.7, Прилож. 1. - С.67].
Также в последнее время получили широкое распространение штаммы вируса герпеса человека, устойчивые к ацикловиру [Брязжикова Т.С. Этиологические особенности и клинико-иммунологические проявления современной герпетической инфекции. Дисс. канд. мед. наук. СПб., 1995; Шульженко А.Е // Цитокины и воспаление. - 2005. - Т.4, №3. - С.76-81].
Все это диктует постоянный поиск новых противовирусных препаратов, причем желательно, чтобы такие препараты обладали широким спектром противовирусной активности, были бы нетоксичными, обладали бы хорошей биодоступностью и в силу неспецифического механизма своего действия не вызывали бы быстрого появления устойчивых штаммов вирусов.
Фуллерены были первой исследованной наноформой углерода (диаметр молекулы С60 - около 0,7 нм).
Их свойства, представляющие наибольший интерес для возможного биомедицинского применения, это: 1) способность генерировать синглетный кислород при облучении УФ- или видимым светом; 2) высокая аффинность фуллеренового кора к донорам электронов, определяющая его способность быть скэвенджером электронов; 3) высокая липофильность фуллеренов [Piotrovsky L., Eropkin M., Eropkina E., Dumpis M., Kiselev О. // In: "Medicinal Chemistry and Pharmacological Potential of Fullerenes and Carbon Nanotubes", Eds. F.Cataldo and T. da Ros, Springer, 2008. - P.139-155]. В то же время немодифицированные или «простые» фуллерены нерастворимы в воде, а следовательно, имеют низкую биодоступность, имеют тенденцию к образованию агрегатов и почти не выводятся из организма. «Функционализация» фуллеренов, т.е. их химическая модификация группами и молекулами различной степени сложности, является распространенным способом преодоления этих недостатков «простых» фуллеренов [Partha R., Conyers J.L. // Int. J. Nanomed.- 2009. - Vol.4. P.261-275].
Одними из наиболее простых производных фуллеренов являются гидроксифуллерены или фуллеренолы С60(ОН)х, где х может колебаться от 4-6 до 40-44 [Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: Росток, 2006. - 335 с.]. Фуллеренолы являются мощными антиоксидантами прямого действия (ловушками свободных радикалов) как in vitro, так и in vivo, обладают защитным действием от ионизирующей радиации, антимутагенным, противоопухолевым и антиметастатическим эффектами [Mrdanovic J., Solajic S., Bogdanovic V. et al. // Mutation Res. - 2009. - Vol.680 (1-2). - P.25-30.; Jun-Jie Yin, Fang Lao, Fu P.P. et al. // Biomaterials. - 2009. - Vol.30. - P.611-621; Mirkov S.M., Djordjevic A.N., Andric N.L. et al. // Nitric Oxide. - 2004. - Vol.11 (2). - P.201-207; Trajkovic S., Dobric S., Jacevic V. et al. // Colloids and Surfaces B: Biointerfaces. - 2007. - Vol.58 (1). - P.39-43; Fang Jiao, Ying Qu, Wei Li et al. // Carbon. - 2010. - Vol.48 (8). - P.2231-2243; Saitoh Y., Miyanishi A., Mizuno H. et al. // J. Photochem. Photobiol. B: Biology. - 2010. - doi:10.1016/j.photobiol.2010.09.006.; Lai H.-S., Chen Y., Chang W.-J., Chiang L.-Y. // Transpl. Proc. - 2000. - Vol.32. - P.1272-1274].
Ранее изучалось противовирусное действие фуллерена С60 в виде комплекса с поливинилпирролидоном, а также микронизированной с помощью ультразвука суспензии С60 на вирусы гриппа [Пиотровский Л.Б., Козелецкая К.Н., Медведева и др. // Вопр. вирусол. - 2001. - №3. - С.38-42; Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: Росток, 2006. - 335 с.; Zarubaev V.V., Belousova I., Rylkov V. et al. // In: "Medicinal Chemistry and Pharmacological Potential of Fullerenes and Carbon Nanotubes", Eds. F.Cataldo and T. da Ros, Springer, 2008. P.107-122]. Комплекс С60/ПВП обладал противовирусной активностью в темноте, причем сам полимер-носитель ПВП противовирусной активности не проявлял, а микронизированная суспензия С60, наоборот, была эффективна только при интенсивном освещении видимым светом и в присутствии избытка кислорода.
Среди функционализированных производных С60 противовирусная активность обнаружена у трикарбоксифуллеренов в отношении вируса Денге-2 и вируса японского энцефалита, Na-соли 1-гидро-фуллеренаминокапроновой кислоты в отношении ВИЧ и вируса герпеса [Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: Росток, 2006. - 335 с.; Носик Д.А., Лялина Н.К., Калнине Л.Б. и др. // Вопр. вирусол. - 2009. - №5 - С.41-43; Носик Н.И., Кондрашина Н.Г., Григорьева А.Ю. и др. // Вопр. вирусол. - 2009. - №1. - С.15-18].
Что касается фуллеренолов, то об их противовирусном действии ранее не сообщалось.
Сущностью данного изобретения является то, что установлено неизвестное ранее свойство фуллеренолов: противовирусная активность в отношении ряда актуальных вирусов гриппа, включая пандемичесикй вирус 2009 г. A(H1N1)v и вирус гриппа птиц A(H5N1), герпеса, адено- и PC-вирусов. Одновременно с этим продемонстрирована нетоксичность этих соединений для клеток различного тканевого происхождения, причем оптимальным для проявления противовирусной активности является наличие 18-24 гидроксильных групп в молекуле фуллеренола.
Экспериментальная часть работы
1. Синтез фуллеренолов с различным содержанием гидроксильных групп
Для получения гидроксифуллерена с содержанием гидроксильных групп 18-24 С60(ОН) 18-24 использовали следующую методику, по данным публикаций [В.М.Mikawa, H.Kato, M.Okumura et al. // Bioconjug. Chem. - 2001. - V.12. - P.510-514; C.Y.Chen, G.M.Xing, J.X.Wang et al. // Nano Letters, - 2005. - V.5(10). - P.2050-2057].
В стакан, снабженный мешалкой, помещали 100 мл раствора фуллерена С60 (150 мг С60) в о-ксилоле или толуоле. При интенсивном перемешивании (на магнитной мешалке) добавляли 100 мл NaOH (50% раствор), затем по каплям прибавили 2 мл межфазного катализатора тетрабутиламмоний гидроксида (ТБАГ).
Реакционную смесь перемешивали в течение 15 часов в присутствии кислорода воздуха. Через 2 суток образовалось три слоя: верхний - слабо окрашенный (светло-желтый) органический слой; нижний - водный слой концентрированного раствора щелочи и промежуточный темно-коричневый эмульсионный слой, содержащий гидроксилированные продукты. Основную часть органического слоя декантировали. Для улучшения растворимости образующихся продуктов порциями добавляли дистиллированную воду (50 мл в сутки) и продолжали перемешивание еще в течение двух суток, что приводило к переходу водорастворимых продуктов в водно-щелочной слой и окрашиванию его в темно-коричневый цвет. Затем реакционную смесь переносили в круглодонную колбу (объемом 1 л) и добавляли 200 мл воды. Водно-органический раствор отгоняли на ротационном испарителе (до остаточного объема - 40-50 мл). Процедуру повторяли до полного удаления органического растворителя.
Для проведения диализа полученный продукт нейтрализовали соляной кислотой до рН ~7,2-7,5 (по индикаторной бумаге).
Диализ через полупроницаемую мембрану проводили в течение 3-х суток со сменой диализной воды каждые 3-5 часов. В результате диализа образовался водорастворимый продукт (окрашен в коричневый цвет) и малорастворимый осадок темно-коричневого цвета. Основной продукт смывали с мембраны в колбу, декантировали от осадка и (после отбора пробы для анализа) высушивали лиофильно.
Синтез гидроксифуллерена с числом гидроксильных групп более 30 С60(ОН)30-38 проводили с использованием 30% перекиси водорода в аналогичных условиях. К раствору фуллерена С60 в ксилоле (200 мг в 100 мл) добавляли 10 мл 50% раствора щелочи, 5 мл воды, 3 мл межфазного инициатора и 10 капель 30% перекиси водорода. Реакционную смесь обработали ультразвуком в УЗ-ванне в течение часа. Полученный раствор переносили в стакан, снабженный мешалкой. После перемешивания в течение нескольких часов органический слой обесцвечивался. Добавяли еще 50 мл воды и отбирали органический слой. Остаточный растворитель удаляли на роторном испарителе, как описано выше. Осадок несколько раз промывали метанолом. Конечный продукт получали лиофильной сушкой из водного раствора.
Для синтеза гидроксифуллерена с числом гидроксильных групп 12-14 C60(OH)12-14 применяли аналогичную методику [R.Singh, Т.Н.Goswami // J. Organometal. Chem. - 2008 - V.693. - P.2021-2032], но в этом случае использовали 1% раствор щелочи и реакцию проводили в течение двух часов. Удаляли органический слой, содержащий непрореагировавший фуллерен. Осаждали нужную фракцию метанолом. Центрифугировали осадок и промывали несколько раз метанолом для удаления щелочи. Из осадка гидроксифуллерены с большим числом гидроксильных групп отмывали водой, а непрореагировавший фуллерен - толуолом. Конечный продукт получали выпариванием досуха водного раствора.
Все фуллеренолы были охарактеризованы методом элементарного анализа, спектральными методами и термогравиметрически. Элементарный анализ (С, и Н, и О по разности) может иметь завышенные значения содержания Н и О из-за высокого содержания влаги в этих соединениях. Это было подтверждено методом протонного ЯМР в твердом теле, где гидроксифуллерены характеризовались сигналом при 4,77 м.д., соответствующим молекулам воды во внешних сферах гидратации.
ИК спектры гидроксифуллеренов характеризовались интенсивной полосой поглощения в области 3360 см-1 (ν, O-H), а также полосами при 1593 см-1 (ν, C=C), 1381 см-1 (δ С-ОН) и 1068 см-1 (ν, C-O) соответственно.
Оценку содержания гидроксильных групп в гидроксифуллерене проводили на основании данных термогравиметрии. Сопоставление потери массы образца фуллеренола с потерей массы исходного фуллерена рассчитывали по формуле:
n={ММС60/Δm C60}×{Δm (ОН)x/ММ(ОН)},
где ММ - молекулярная масса, а Δm - потеря массы.
При расчете по указанной формуле были получены значения приблизительно 23 и 36 групп на молекулу фуллерена соответственно.
2. Оценка токсичности соединений на культурах клеток
В работе использованы перевиваемые клеточные линии из банка клеточных культур НИИ гриппа - МА-104 (клетки почки зеленой мартышки), А-549 (линия карциномы легкого человека), L-41 (моноцитарная лейкемическая линия) и MDCK (клетки почки собаки). Клетки культивировали в среде Игла-МЕМ с добавлением 10% эмбриональной сыворотки теленка в 96-луночных планшетах (Nunc) в CO2-инкубаторе в присутствии 5% СО2. Перед добавлением исследуемых соединений производили замену среды инкубации на бессывороточную среду Игла-МЕМ. На этой же среде готовили серийные разведения фуллеренолов. В случае фуллеренола C60(OH)12-14, практически нерастворимого в водных растворах, вносили его суспензию в среде Игла-МЕМ, и концентрация фуллеренола в данном случае учитывалась только условно.
Методами оценки токсичности in vitro служило восстановление клетками в культуре тетразолиевых красителей резазурина (Sigma) - флуориметрический метод или МТТ (ICN) - фотометрический метод [R.Clothier, G.Starzec, L.Pradel et al. // ATLA. - 2002. - Vol.30. - P.493-504; Mosmann T. // J. Immunol. Meth. - 1983. - Vol.65 (1). - P.55-63]. Соответствующие показатели измеряли на планшетном анализаторе Varioscan (ThermoFischer).
3. Определение противовирусной активности in vitro
Антивирусное действие фуллеренолов определяли в отношении ряда актуальных штаммов гриппа человека: штамма пандемического гриппа 2009 г. А/ С.-Петребург /56/09 (H1N1)v, эталонного штамма, входящего в состав гриппозной вакцины на 2010-2011 гг. А/Перт/16/09 (H3N2), а также штамма гриппа птиц, выделенного в Казахстане и охарактеризованного в НИИ гриппа - А/Мартын/Костанай/7/07 (H5N1). Действие вирусов гриппа человека изучали на культуре клеток MDCK, а гриппа птиц - на развивающихся 10-дневных куриных эмбрионах.
Присутствие вируса в среде инкубации определяли микрометодом реакции гемагглютинации (РГА). Титр вируса выражали в десятичных логарифмах в 100 мкл (lgТИД50), где ТИД50 - 50%-ная тканевая инфекционная доза. Противовирусную активность образцов оценивали по снижению титра вируса в опытных лунках планшетов по сравнению с контрольными (ΔlgТИД50). Кроме того, оценивали степень цитопатогенного действия вируса при микроскопическом исследовании зараженной культуры и по указанному выше критерию восстановления клетками в культуре МТТ. Степень угнетения жизнеспособности клеток в культуре коррелирует с развитием вирусной инфекции in vitro. Среднюю вирусингибирующую концентрацию образца (ВИК50) вычисляли по каждому из 3-х указанных критериев исходя из уравнений линейной регрессии доза-эффект.
Противовирусную активность оценивали также в отношении вируса простого герпеса I типа HSV1/С.-Петербург/248/88, аденовируса III типа Ad/3/эталон/4120 и респираторно-синцитиального вируса К8/эталон/Лондон/3541 на культурах клеток L-41 и А-549, чувствительных к данным вирусам.
Образцы вносили по нескольким схемам: лечебно-профилактической - за 30 мин до внесения в культуру суспензии вируса, одновременно с внесением вируса или вначале смешивали суспензию вируса с исследуемыми соединениями, инкубировали 30 мин и заражали культуры клеток.
Отдельно проверяли влияние УФ-облучения на противовирусный эффект фуллеренолов, облучая смесь вирус-фуллеренол с помощью облучателя мощностью 400 W со спектром излучения 220-400 нм на расстоянии 30 см.
Цитопатическую реакцию учитывали через 48 и 72 час по степени деградации монослоя (микроскопическое исследование культуры), а также методом МТТ. Для вычисления ВИК50 применяли вышеуказанный регрессионный метод. В качестве препаратов сравнения использовали ацикловир (GlaxoSmithKlein) для вируса герпеса и арбидол (ФармСтандарт) в случае аденовируса.
Результаты исследований
Нетоксичность фуллеренолов in vitro
Все водорастворимые фуллеренолы были нетоксичны для клеток в культуре независимо от использованной клеточной линии во всем диапазоне исследованных концентраций - до 1 мг/мл (для C60(OH)18-24 это порядка 943 мкМ).
Более того, выявлено, что в темноте C60(OH)18-24 усиливал дыхательный метаболизм и количество жизнеспособных клеток по сравнению с контролем в резазуриновом или МТТ-тесте, например в культуре А-549 повышение достигало 12% (р=0,025) по сравнению с контрольными клетками,
C60(OH)12-14, нерастворимый в воде и водных растворах, будучи внесен в качестве суспензии (концентрация дана условно), выпадал в осадок, покрывая клеточный монослой, что, вероятно, определило его небольшой подавляющий эффект на исследованные метаболические показатели клеток. В дальнейшем было показано отсутствие какой-либо противовирусной активности у данного соединения (табл.1 и 2).
Противовирусное действие фуллеренолов
Водорастворимые фуллеренолы обладали выраженным противовирусным действием в отношении всех исследованных штаммов вируса гриппа, адено-, PC- и герпес-вирусов (табл.1, 2; рис.1).
Наиболее детально был изучен эффект в отношении вируса герпеса (табл.1, 2).
|
Противовирусное действие было наиболее выражено у C60(OH)18-24, причем ВИК50 данного фуллеренола в молярном выражении была очень близка среднеингибиторной концентрации такого широко используемого при герпетической инфекции препарата, как ацикловир (табл.1).
Очень близкие значения ВИК50 получены в отношении отечественного штамма пандемического вируса гриппа H1N1 2009 г. Для актуального вируса гриппа человека H3N2 и вируса гриппа птиц H5N1 значения ВИК50 были несколько выше.
C60(OH)18-24 был несколько менее эффективен в отношении аденовируса, тем не менее, обладая достоверным противовирусным действием (табл.1, 2).
|
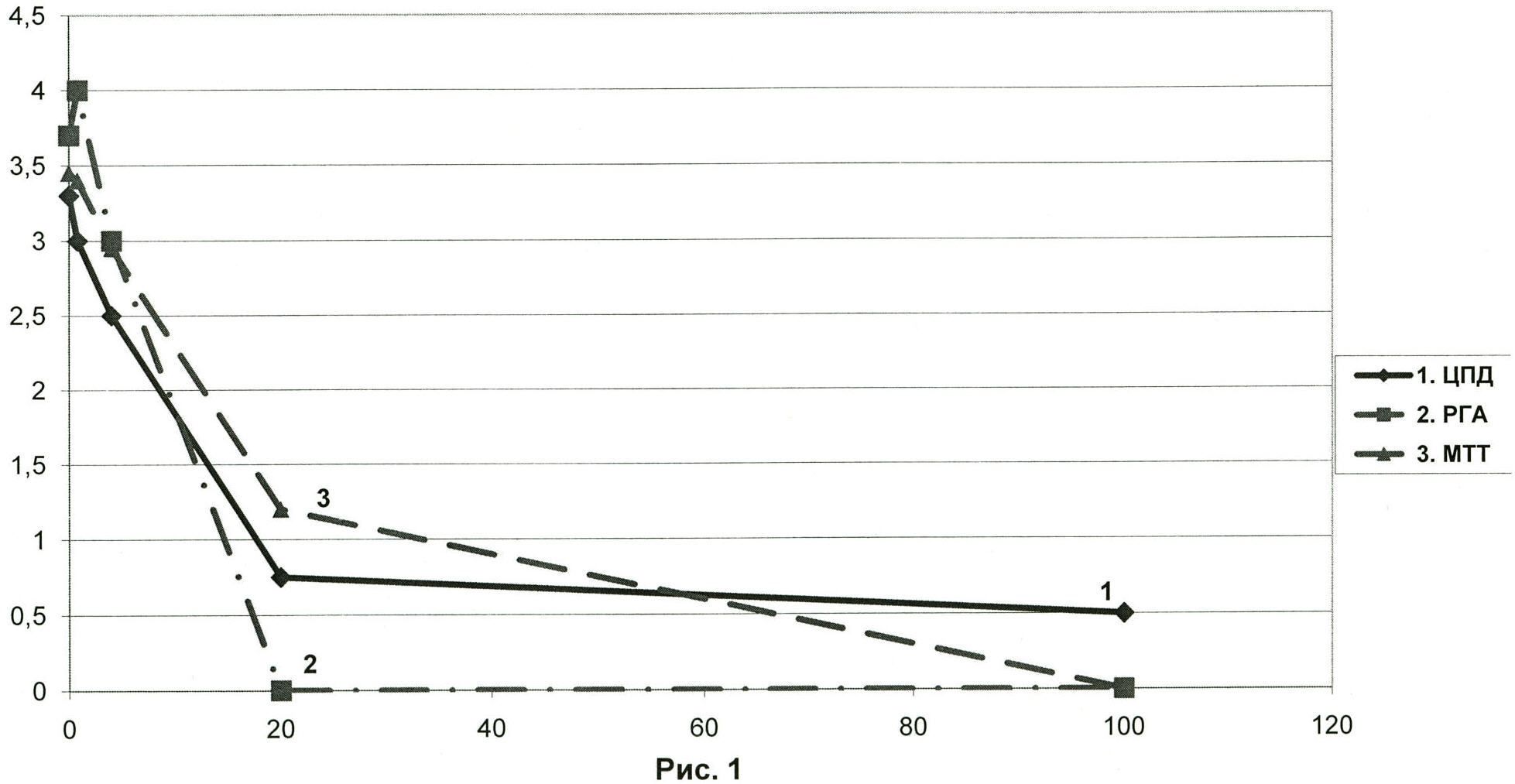
При этом вне зависимости от использованного критерия оценки противовирусного эффекта - по РГА, микроскопическому определению цитопатического действия или МТТ, получены очень близкие результаты - рис.1 [Рис.1. Противовирусное действие фуллеренола C60(OH)18-24 на пандемический вирус гриппа А /С.-Петербург/56/09 (H1N1)v по данным трех методов определения. По оси абсцисс - концентрация фуллеренола, мкг/мл; по оси ординат - титр вируса (-log). Оценка противовирусной активности по методам: 1 - ЦПД, 2 - РГА, 3 - МТТ. Средняя по трем методам вирусингибирующая концентрация ВИК50ср.=33,9±6,65 мкг/мл (31,9±6,27 мкМ)].
Наиболее сильный противовирусный эффект отмечен в отношении респираторно-синцитиального вируса (табл.1, 2). Однако к этим данным нужно подходить с осторожностью по следующей причине: ввиду медленного размножения вируса в культуре опыт длился 5 суток. За это время жизнеспособность клеток в культуре может спонтанно уменьшаться, а поскольку нами обнаружено стимулирующее влияние фуллеренола на клетки без всякого внешнего воздействия, оценка степени его защитного действия на цитопатический эффект PC-вируса в этих условиях может быть завышена.
Предварительная инкубация вируса герпеса с фуллеренолом C60(OH)18-24 в течение 30 мин не влияла на эффективность его противовирусного действия: результаты практически не отличались от тех, когда вирус и фуллеренол вносили одновременно в среду инкубации клеток. Это свидетельствует в пользу того, что действие фуллеренола не является прямым вирулицидным, а связано со взаимодействием вирус-клетка. Не оказало влияния на противовирусный эффект C60(OH)18-24 также предварительное УФ-облучение смеси фуллеренол-вирус в течение 5 мин. Аналогичный эффект получен с аденовирусом. Следовательно, в отличие от наносуспензии С60, солюбилизированного ультразвуком, противовирусная активность фуллеренолов не связана с фотодинамическим эффектом.
Молекула фуллерена обладает высокой электроотрицательностью, которая, естественно, уменьшается при введении в фуллереновый кор электронодонорных заместителей, поэтому полигидроксилирование фуллеренов приводит к уменьшению их способности к взаимодействию со свободными радикалами [Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: Росток, 2006. - 335 с.].
В то же время, по мере увеличения количества гидроксильных групп возрастает растворимость, а следовательно, биодоступность фуллеренолов. Вероятно, в силу этих двух противоположных тенденций существует некоторое оптимальное количество гидроксильных групп, когда фуллеренол уже хорошо растворим, но еще обладает высокой антирадикальной активностью. Наши данные как раз иллюстрируют такую ситуацию: фуллеренол C60(OH)12-14 нерастворим и не обладает в наших тест-системах значимой биологической активностью, С60(ОН)18-24 обладает максимальной противовирусной активностью, а у фуллеренола С60(ОН)30-38 эти эффекты выражены уже меньше.
По данным литературы, несмотря на пониженное сродство к электрону молекулы фуллеренола по сравнению с С60, наличие у фуллеренола аллильных гидроксильных групп делает его весьма перспективным кандидатом на роль ловушки свободных радикалов или растворимого антиоксиданта [Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: Росток, 2006. - 335 с.].
Заключение
Изучение фуллеренолов с различным содержанием гидроксильных групп - C60(OH)12-14, С60(ОН)18-24 и С60(ОН)30-38 на предмет проявления ими противовирусной активности в отношении различных таксономических групп вирусов показало, что соединения C60(OH)18-24 и С60(ОН)30-38 обладают широким спектром противовирусной активности in vitro, причем их эффективные концентрации для противовирусного действия составляют: С60(ОН)18-24 - 25-100 мкг/мл; С60(ОН)30-38 - 50-100 мкг/мл, а соединение С60(ОН)12-14 не растворимо в воде и не обладает биологической активностью при внесении его в клеточные культуры в виде суспензии.