Результат интеллектуальной деятельности: 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИЕ 1,3-ДИКЕТОНЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ ИХ ХЕЛАТНЫХ КОМПЛЕКСОВ С ИОНАМИ МЕДИ (II) И СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИХ 1,3-ДИКЕТОНОВ
Вид РИД
Изобретение
Изобретение относится к химии производных дифенилоксида, а именно к способу получения 3-феноксифенилсодержащих 1,3-дикетонов, промежуточных соединений в синтезах широкого спектра веществ, обладающих биологической активностью общей формулы
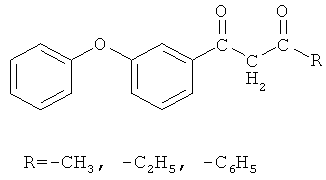
которые могут быть использованы в качестве исходных соединений для получения их хелатных комплексов с ионами меди (II) общей формулы
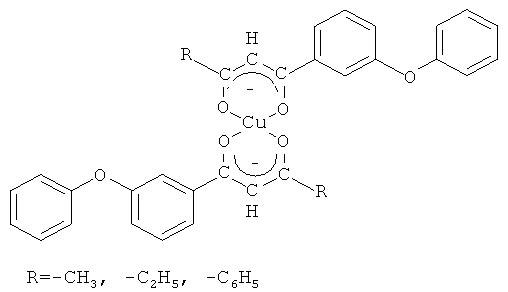
которые представляют интерес в качестве экстрагентов, аналитических реагентов РЗЭ, важнейших полупродуктов в синтезе вероятных биологически активных веществ. В частности, 1,3-дикетоны являются синтонами для получения 3-гидроксикетонов, пиразолов [R.J. Light, C.R. Hauser. J. Am. Chem. Soc., Vol.26, 1961, p.1716-1724], N-замещенных аминопиридонов [G.H. Elgemeie, A.M. Elzanate. Synthetic communications. Vol.33, №12, 2003, p.2087-2094], флавонов [Гетероциклические соединения: В 8 т.: Т.2 / Под ред. Эльдерфильда Р. - М.: Издательство иностранной литературы, 1954. - С.177], изоксазолов [Гетероциклические соединения: В 8 т.: Т.5 / Под ред. Эльдерфильда Р. - М.: Издательство иностранной литературы, 1961. - С.369], диазепинов, бензофуран-4-онов [Ellis, G.P. Ed.; J. Chem. Soc., Chem. Commun. Interscience: New York; Vol.33, 1984, p.495], 1-ацил-1Н-пирролов [Michael P. Sammes. J. Chem. Soc., Chem. Commun. Vol.33, 1984, p.354-355]. Установлено, что бензилсодержащие 1,3-дикетоны обладают выраженной противовирусной активностью в отношении ДНК- и РНК-вирусов. Как полифункциональные лиганды, 1,3-дикетоны применяются для решения практических задач в аналитической химии при определении, разделении и концентрировании редкоземельных элементов [β-дикетоны / Пешкова В.М., Мельчакова Н.В. - М.: Наука, 1986. - С.35]. Хелатные комплексы, образуемые 1,3-дикетонами с металлами, имеют практическое значение в связи с их применением в методе химического осаждения из газовой фазы для получения тонких металлических пленок и композиционных материалов [Dudek М., Clegg J.K., С.R.K. Glasson. Crys. Growth Des. 11, 2011, p.1697-1704]. В литературе сведения о методах получения соединений заявляемой структурной формулы отсутствуют.
Известен способ получения 1-фенил-3-(2-пиридил)-1,3-пропандиона и его хелатного комплекса с ионами меди (II), в котором исходным соединением является ацетофенон, который вводят в реакцию с метилпиколинатом в присутствии каталитических количеств амида натрия. Взаимодействие проводится в среде абсолютного тетрагидрофурана при комнатной температуре в течение 6 часов. Синтез хелатного комплекса осуществляется обработкой полученного 1-фенил-3-(2-пиридил)-1,3-пропандиона сначала карбонатом натрия в течение 1 часа, затем нитратом меди (II) в течение 2 часов при температуре 35°С. Оба реагента используются в виде суспензий в среде абсолютного тетрагидрофурана [Dudek M., Clegg J.K., С.R.K. Glasson. Crys. Growth Des. 11, 2011, p.1697-1704].
Недостатком данного способа является большая продолжительность синтеза. А также в результате получают соединения иной структуры, чем в предлагаемом изобретении.
Известен способ получения 1,1,1,2,2,3,3,7,7,7-декафторо-4,6-гептандиона конденсацией этилгептафторобутирата с трифторацетоном в присутствии каталитических количеств метилата натрия в гексане при комнатной температуре. Хелатный комплекс образовавшегося дикетона с ионами меди (II) синтезирован обработкой продукта водным раствором пентагидрата сульфата меди (II). Выход целевого 1,1,1,2,2,3,3,7,7,7-декафторо-4,6-гептандиона составил 40% [В.Н. Smith, R. W. Moisher, R.E. Sievers. J. Org. Chem. Vol.35, № 5, 1970, p.1696-1698].
Данный метод не приводит к получению веществ заявляемой структурной формулы.
В литературе описан способ получения замещенных 1,4-дифенилбутан-1,3-дионов, заключающийся в сигматропной перегруппировке ароматических α-бромкетонов в присутствии реагента «Фуракава» (этилцинкметилиодид) в условиях реакции Реформацкого [L.Li, P.Cai, D.Xu. J. Org. Chem. Vol.72, 2007, p.8131-8134].
Данный метод не приводит к получению веществ заявляемой структурной формулы. Кроме этого среди недостатков метода можно отметить использование легковоспламеняемого диэтилцинка и сравнительно низкие выходы целевых продуктов.
Существует способ получения 1-фенил-2-метил-1,3-пентандиона путем ацилирования натрий пентан-3-она хлорангидридом бензойной кислоты на холоду. Исходный натрий пентан-3-он получают взаимодействием соответствующего кетона с амидом натрия в среде аммиака [В.О.Linn, C.R.Hauser. J. Org. Chem. Vol.V. 78, 1956, p.6066-6070].
Вышеописанным методом получают соединения совершенно иной структуры по сравнению с предлагаемым изобретением. К недостаткам данного метода следует отнести многостадийность, низкую селективность процесса, обусловленную образованием трикарбонильных соединений, а также O-ацилироизводных 1,3-дикетонов.
Задачей предлагаемого изобретения является разработка метода синтеза 3-феноксифенилсодержащих 1,3-дикетонов и их хелатных комплексов с ионами меди (II).
Техническим результатом является расширение ассортимента производных дифенилоксида, а также получение 3-феноксифенилсодержащих 1,3-дикетонов и их хелатных комплексов с ионами меди (II) с высоким выходом.
Поставленный технический результат достигается тем, что предлагаются 3-феноксифенилсодержащие 1,3-дикетоны общей формулы

в качестве исходных соединений для получения их хелатных комплексов с ионами меди (II) общей формулы

и способ получения 3-феноксифенилсодержащих 1,3-дикетонов общей формулы

заключающийся во взаимодействии 3-феноксибензонитрила с низшими спиртами: метанолом, этанолом при мольном соотношении 1:4,245 соответственно, в присутствии концентрированной серной кислоты в течение 7-8 часов с образованием алкил-3-феноксибензоата, его последующем взаимодействии с кетонами из ряда: ацетон, 2-бутанон, ацетофенон при мольном соотношении 2,0:1 соответственно, в среде абсолютного циклогексана при его температуре кипения в присутствии каталитических количеств гидрида натрия в течение 2,5-3 часов и последующем выделении конечного продукта.
Для получения 3-феноксифенилсодержащих 1,3-дикетонов осуществляют химическое взаимодействие 3-феноксибензонитрила с низшими спиртами: метанолом, этанолом при мольном соотношении 1:4,245 соответственно, в присутствии концентрированной серной кислоты в течение 7-8 часов с образованием алкил-3-феноксибензоата по схеме
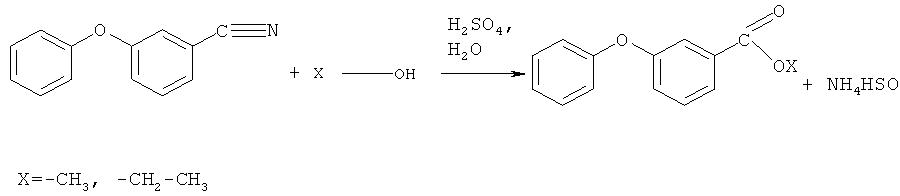
его последующее взаимодействие с кетонами из ряда: ацетон, 2-бутанон, ацетофенон по схеме
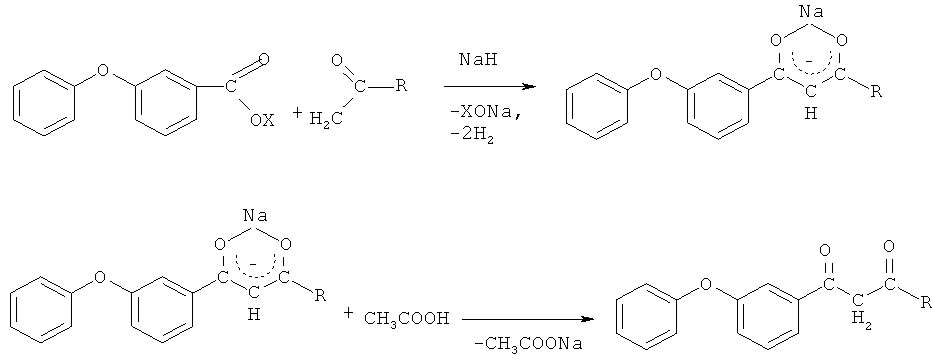
при мольном соотношении 2,0:1 соответственно, в среде абсолютного циклогексана при его температуре кипения в присутствии каталитических количеств гидрида натрия в течение 2,5-3 часов с последующим выделением конечного продукта. Выходы 3-феноксифенилсодержащих 1,3-дикетонов составили 50-74%.
При выборе растворителя для проведения реакции конденсации алкил-3-феноксибензоата с кетонами из ряда: ацетон, 2-бутанон, ацетофенон авторами были учтены следующие требования к растворителю: низкая токсичность, поддержание необходимого температурного режима и инертность по отношению к реагентам. Использование полярных апротонных растворителей (диэтилового эфира и др.) возможно, но проведение процесса в среде этих растворителей приводит к повышению количества побочных продуктов, то есть снижает выход 3-феноксифенилсодержащих 1,3-дикетонов. Установленным требованиям отвечает циклогексан: он обладает низкой токсичностью, абсолютно инертен по отношению к реагентам, создает возможность повышения температуры до 80°С.
В начальный момент взаимодействия нет необходимости в дополнительном нагреве, так как реакция начинается самопроизвольно даже при комнатной температуре, сопровождается выделением водорода и незначительным разогревом реакционной массы. Затем для повышения степени превращения исходных реагентов и ускорения реакции требуется дополнительное нагревание реакционной массы до температуры кипения используемого растворителя в течение 2,5-3 часов, так как за это время достигается наибольшая конверсия исходных реагентов.
Использование в данном процессе 50-100%-ного избытка алкил-3-феноксибензоатов по сравнению со стехиометрическим количеством необходимо для исключения возможности конденсации исходных кетонов из ряда: ацетон, 2-бутанон, ацетофенон, обладающих высокой карбонильной активностью. Самоконденсация исходных кетонов сводится к минимуму при следующем порядке ввода реагентов: к суспензии катализатора в растворителе сначала при сильном охлаждении медленно вводят алкил-3-феноксибензоат, а затем приливают кетон. Предложенный способ получения 3-феноксифенилсодержащих 1,3-дикетонов характеризуется простотой эксперимента, осуществляется в достаточно мягких условиях и обеспечивает высокий (более 50%) выход 3-феноксифенилсодержащих 1,3-дикетонов.
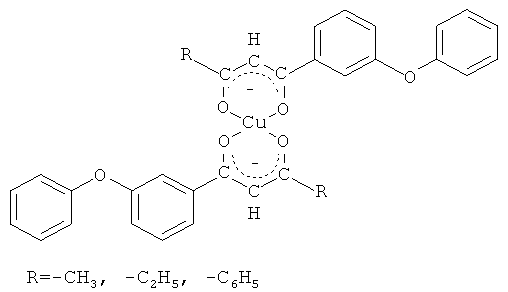
Возможность использования 3-феноксифенилсодержащих 1,3-дикетонов в качестве исходных реагентов в синтезах соединений показана на примере реакции комплексообразования 3-феноксифенилсодержащих 1,3-дикетонов с ионами меди (II) по схеме
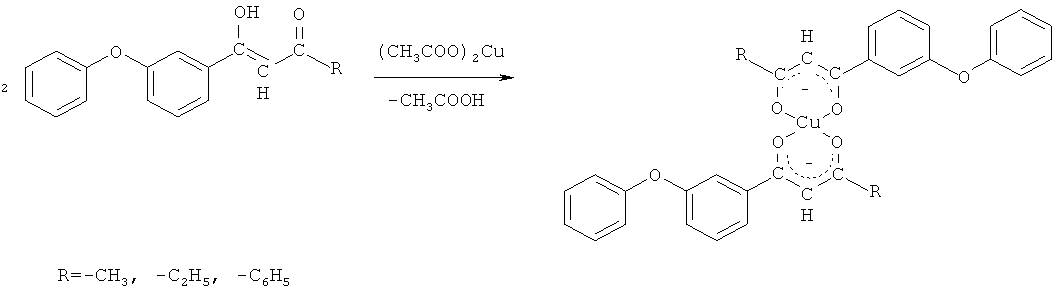
Комплексообразование происходит в мягких условиях: в водно-спиртовой среде при комнатной температуре в течение 3-4 часов. Благодаря способности к кето-еноловой перегруппировке 3-феноксифенилсодержащие 1,3-дикетоны под действием ацетата меди (II) образуют координационно ненасыщенные хелатные комплексы с ионами меди (II), содержащие межмолекулярные связи. Выходы хелатных комплексов составили 67-89%.
Способ осуществляется следующим образом. Для получения алкил-3-феноксибензоата осуществляют химическое взаимодействие 3-феноксибензонитрила с низшими спиртами: метанолом, этанолом при мольном соотношении 1:4,245 соответственно, в присутствии концентрированной серной кислоты в течение 7-8 часов. Для синтеза 3-феноксифенилсодержащих 1,3-дикетонов в реактор, продутый азотом, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром и капельной воронкой, помещают безводный циклогексан и расчетное количество катализатора - гидрида натрия. При энергичном перемешивании (450-500 об/мин) готовят суспензию катализатора в растворителе. К полученной суспензии при перемешивании и интенсивном охлаждении медленно приливают алкил-3-феноксибензоат в безводном циклогексане. Затем по каплям вводят кетон из ряда: ацетон, 2-бутанон, ацетофенон при мольном соотношении 2,0:1 соответственно. В начальный момент взаимодействия процесс протекает с незначительным разогревом реакционной массы и сопровождается выделением водорода. Если при комнатной температуре не наблюдается выделения газа, включают нагрев так, чтобы при интенсивном выделении водорода смесь слабо кипела. Реакционную массу кипятят с обратным холодильником до прекращения выделения газа (2,5-3 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем добавляют порциями раствор 10%-ной уксусной кислоты до слабокислой реакции. Осадок отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Из фильтрата отделяют органический слой. Водный слой экстрагируют эфиром (2×50 мл). Объединенный эфирный слой промывают дистиллированной водой до нейтральной реакции, сушат безводным сульфатом натрия. Растворитель отгоняют при атмосферном давлении. Полученные 3-феноксифенилсодержащие 1,3-дикетоны очищают перекристаллизацией из метанола. Выходы полученных соединений составляют 50-74% от теоретического.
Синтез хелатных комплексов 3-феноксифенилсодержащих 1,3-дикетонов с ионами меди (II) осуществляется по известной методике [Natin S. Nandurkar, Mayur J. Bhanushali. Synt. Comm. Vol.37: 23, 2007, p.4111-4115] в водно-спиртовой среде при комнатной температуре в течение 3-4 часов при соотношении 1,3-дикетон: ацетат меди (II), равном 2:1 соответственно. Полученные хелатные комплексы с ионами меди (II) очищают перекристаллизацией из гексана. Выходы полученных соединений составляют 67-89%.
Идентификация синтезированных соединений проводилась методом ИК -ЯМР 1Н - спектроскопии.
Для лучшего понимания сущности предложенного технического решения приводятся конкретные примеры синтезов.
Пример 1. 1-(3-феноксифенил)-бутан-1,3-дион
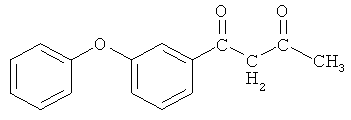
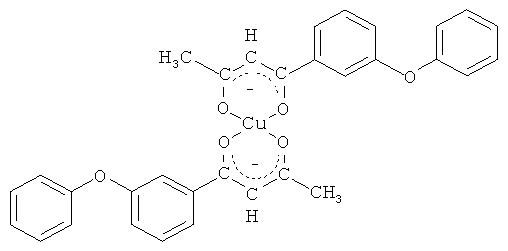
и его хелатный комплекс с ионами меди (II)
Синтез метил-3-феноксибензоата.
В круглодонную колбу, снабженную обратным холодильником с хлоркальциевой трубкой, помещают 10 г (0,05 моль) 3-феноксибензонитрила, 6,784 г (0,212 моль) абсолютного метилового спирта, 11,711 г (0,1195 моль) концентрированной серной кислоты. Смесь кипятят с обратным холодильником в течение 7 часов. Затем реакционную массу охлаждают и выливают в емкость, содержащую 50 мл дистиллированной воды. Верхний органический слой отделяют, разбавляют 25 мл диэтилового эфира для облегчения разделения слоев в последующем процессе отмывки. Эфирный экстракт аккуратно промывают концентрированным водным раствором гидрокарбоната натрия до прекращения выделения углекислого газа, затем - водой до нейтральной реакции. Сушат 10 г безводного сульфата натрия не менее 30-40 минут. Упаривают растворитель при атмосферном давлении. Конечный продукт очищают вакуумной перегонкой (Рост=4 мм рт.ст.). Выход - 6,16 г (54,1%). Т.кип. 185-186°С (4 мм рт.ст.), показатель преломления n=1.5718. ИК-спектр, υ, см-1: 1750 (С=О), 2930-3295 (С-Н), 1780, 1250 (С-O), 1298 (С-С, СН2). Спектр ЯМР 1Н, δ, м.д.: 0,8-1,32 м (6Н, СН3), 1,8-2,25 м (6Н, СН3), 4,2 м (2Н, СН2), 6,0 с (Н, =СН), 6,94-7,76 м (9Н, С6Н5OС6Н4).
Синтез 1-(3-феноксифенил)-бутан-1,3-диона.
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,169 г (7,07 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят в течение 30 минут при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3 г (12,3 ммоль) метил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,3567 г (6,15 ммоль) осушенного ацетона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре, сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (2,5 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший желтый осадок (0,739 г) отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной водой до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,39 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Общий выход 1,137 г (72,8%). Т.пл. 125-130°С. ИК-спектр, υ, см-1: 2740-2890 (ОН), 2900-3300 (С-Н), 1780, 1696 (С=O), 1546 (С=С), 1294 (СН3). Спектр ЯМР 1Н, δ, м.д.: 0,8-2,25 м (3Н, СН3), 16,0 с (Н, ОН), 4,2 м (2Н,СН2), 6.03 с (Н, =СН), 6,94-7,76 м (9Н, С6Н5ОС6Н4).
Синтез бис[1-(3-феноксифенил)-бутан-1,3-дионато]меди (II).
К раствору 1 г (3,93 ммоль) полученного 1-(3-феноксифенил)-бутан-1,3-диона в 40 мл метанола добавляют раствор 0,4 г (1,965 ммоль) ацетата меди (II) в 50 мл воды. Перемешивают в течение 3 часов. Выпавший осадок зеленого цвета отфильтровывают, промывают ледяной водой, сушат. Полученный продукт очищают перекристаллизацией из гексана. Выход 0,784 г (70%), т.пл. 180°С. Спектр ЯМР 1Н, δ, м.д.: 0,792-2,268 м (3Н, СН3), 5,059-5,98 с (Н, =СН), 6,94-7,76 м (9Н, С6H5ОС6H4).
Пример 2.
1-(3-феноксифенил)-пентан-1,3-дион
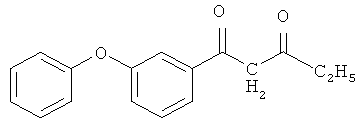
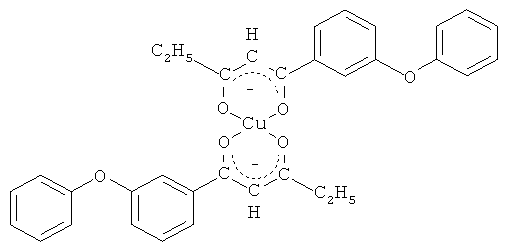
и его хелатный комплекс с ионами меди (II).
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,199 г (8,3145 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят в течение 30 минут при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3,5 г (14,5 ммоль) метил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,52 г (7,23 ммоль) осушенного 2-бутанона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре и сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (2,5 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший желтый осадок (0,85 г) отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной воды до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,45 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Общий выход 1,3 г (67,5%). Тпл=142-145°С. ИК-спектр, υ, см-1: 2758-2890 (ОН), 2920-3300 (С-Н), 1786, 1654 (С=О), 1546 (С=С). Спектр ЯМР 1Н, δ, м.д.: 1,047-1,3 м (3Н, СН3), 8,780 с (Н, ОН), 2,98 м (Н, =СН), 4,2 с (2Н,СН2), 6,94-7,76 м (9Н, С6Н5OС6Н4).
Синтез бис[1-(3-феноксифенил)-пентан-1,3-дионато]меди (II).
К раствору 1,1 г (4,1 ммоль) полученного 1-(3-феноксифенил)-пентан-1,3-диона в 40 мл метанола добавляют раствор 0,416 г (2,05 ммоль) ацетата меди (II) в 50 мл воды. Перемешивают в течение 3 часов. Выпавший осадок зеленого цвета отфильтровывают, промывают ледяной водой, сушат. Полученный продукт очищают перекристаллизацией из гексана. Выход 1,09 г (89%), т.пл. 183°С. Спектр ЯМР 1Н, δ, м.д.: 0.9 т (6Н, СН3), 1,52 м (4Н, СН2), 3,9 м (2Н, СН), 6.31 д (4Н, =СН2), 6.94-7,76 м (9Н, С6Н5OС6Н4).
Пример 3. 1-(3-феноксифенил)-3-фенилпропан-1,3-дион
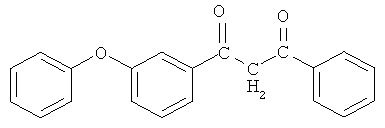
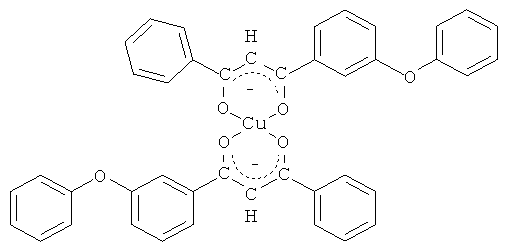
и его хелатный комплекс с ионами меди (II).
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,194 г (8,073 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят в течение 30 минут при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3,4 г (14,05 ммоль) метил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,8424 г (7,02 ммоль) осушенного ацетофенона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре и сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (3 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший осадок (0,68 г) отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной воды до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,42 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Общий выход 1,1 г (50%). Тпл=152-157°С. Спектр ИК, см-1: 2740-2896 (ОН), 2900-3300 (С-Н), 1786, 1654 (C=O), 1546 (С=С). Спектр ЯМР 1Н, δ, м.д.: 7,978 с (Н, ОН), 3,81 с (2Н,СН2), 6.07 с (Н, =СН), 6,92-7,73 м (14Н, С6Н5ОС6Н4, С6Н5).
Синтез бис[1-(3-феноксифенил)-3-фенилпропан-1,3-дионато]меди (II).
К раствору 1 г (3,16 ммоль) полученного 1-(3-феноксифенил)-3-фенилпропан-1,3-дион в 40 мл метанола добавляют раствор 0,32 г (1,58 ммоль) ацетата меди (II) в 50 мл воды. Перемешивают в течение 4 часов. Выпавший осадок зеленого цвета отфильтровывают, промывают ледяной водой, сушат. Полученный продукт очищают перекристаллизацией из гексана. Выход 0,734 г (67%), т.пл. 197°С. Спектр ЯМР 1Н, δ, м.д.: 5,059-5,98 с (Н, =СН), 7,02-7,66 м (28Н, С6Н5OС6Н4, C6H5).
Пример 4. 1-(3-феноксифенил)-бутан-1,3-дион.
Синтез этил-3-феноксибензоата.
В круглодонную колбу, снабженную обратным холодильником с хлоркальциевой трубкой, помещают 10 г (0,05 моль) 3-феноксибензонитрила, 9,752 г (0,212 моль) абсолютного этилового спирта, 11,711 г (0,1195 моль) концентрированной серной кислоты. Смесь кипятят с обратным холодильником в течение 8 часов. Затем реакционную массу охлаждают и выливают в емкость, содержащую в 50 мл дистиллированной воды. Верхний органический слой отделяют, разбавляют 20-30 мл диэтилового эфира для облегчения разделения слоев в последующем процессе отмывки. Эфирный экстракт аккуратно промывают концентрированным водным раствором гидрокарбоната натрия до прекращения выделения углекислого газа, затем - водой до нейтральной реакции. Сушат 10 г безводного сульфата натрия не менее 30-40 минут. Упаривают растворитель при атмосферном давлении. Конечный продукт очищают вакуумной перегонкой (Рост=4 мм рт.ст.). Выход - 6,63 г (54,8%). Т.кип. 195-197°С (4 мм рт.ст.), показатель преломления n=1.5578. ИК-спектр, υ, см-1: 1745, 1696 (С=О), 2975-3545 (С-Н), 1294 (С-С, СН2). Спектр ЯМР 1Н, δ, м.д.: 0,8-1,32 м (6Н, СН3), 1,8-2,25 м (6Н, СН3), 4,2 м (2Н, СН3), 6,0 с (Н, =СН), 6,94-7,76 м (9Н, С6Н5OС6Н4).
Синтез 1-(3-феноксифенил)-бутан-1,3-диона.
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,169 г (7,07 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3 г (12,3 ммоль) этил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,3567 г (6,15 ммоль) осушенного ацетона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре и сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (2,5 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший осадок отфильтровывают (0,733 г) на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной воды до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,42 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Общий выход 1,16 г (74%). Т.пл. 125-130°С. ИК-спектр, υ, см-1: 2740-2890 (ОН), 2900-3300 (С-Н), 1780, 1696 (С=О), 1546 (С=C), 1294 (СН3). Спектр ЯМР 1Н, δ, м.д.: 0,8-2,25 м (3Н, СН3), 16,0 с (Н, ОН), 4,2 м (2Н,СН2), 6.03 с (Н, =СН), 6,94-7,76 м (9Н, С6Н5OС6Н4).
Пример 5. 1-(3-феноксифенил)-пентан-1,3-дион.
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,199 г (8,3145 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3,5 г (14,5 ммоль) этил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,52 г (7,23 ммоль) осушенного 2-бутанона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре и сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (2,5 часа), охлаждают до комнатной температуры, подкисляют оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший желтый осадок (0,88 г) отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной воды до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,46 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Выход 1,34 г (69%). Тпл=142-145°С. ИК-спектр, υ, см-1: 2758-2890 (ОН), 2920-3300 (С-Н), 1786, 1654 (С=O), 1546 (С=С). Спектр ЯМР 1Н, δ, м.д.: 1,047-1,3 м (3Н, СН3), 8,780 с (Н, ОН), 2,98 м (Н, =СН), 4,2 с (2Н,СН2), 6,94-7,76 м (9Н, С6Н5ОС6Н4).
Пример 6. 1-(3-феноксифенил)-3-фенилпропан-1,3-дион.
В четырехгорлой колбе, продутой азотом, оборудованной механической мешалкой, обратным холодильником с хлоркальциевой трубкой, термометром, капельной воронкой, готовят суспензию 0,194 г (8,073 ммоль) гидрида натрия в 50 мл безводного циклогексана и вводят в течение 30 минут при перемешивании (450-500 об/мин) и интенсивном охлаждении раствор 3,4 г (14,05 ммоль) этил-3-феноксибензоата в 10 мл циклогексана. Затем медленно приливают раствор 0,8424 г (7,02 ммоль) осушенного ацетофенона в 10 мл безводного циклогексана. Реакция начинается самопроизвольно даже при комнатной температуре и сопровождается выделением водорода и незначительным разогревом реакционной массы. Для завершения процесса смесь кипятят при перемешивании с обратным холодильником до прекращения выделения газа (3 часа), охлаждают до комнатной температуры, оставляют на ночь. Затем реакционную массу подкисляют 10%-ной уксусной кислотой при перемешивании до слабокислой реакции, добавляют 50 мл ледяной воды. Выпавший желтый осадок (0,74 г) отфильтровывают на воронке Шотта, промывают небольшим количеством циклогексана, сушат. Органический слой отделяют от водно-кислотного, водный экстрагируют эфиром (2×50 мл). Объединенные органические экстракты промывают 200 мл дистиллированной воды до нейтральной реакции, сушат над безводным сульфатом натрия и отгоняют эфир при атмосферном давлении, циклогексан - в вакууме водоструйного насоса. Маточный раствор охлаждают, образовавшиеся кристаллы (0,41 г) фильтруют на воронке Шотта, промывают циклогексаном, сушат. Конечный продукт очищают перекристаллизацией из метанола. Общий выход 1,15 г (52%). Тпл=152-157°С. Спектр ИК, см-1: 2740-2896 (ОН), 2900-3300 (С-Н), 1786, 1654 (C=O), 1546 (С=С). Спектр ЯМР 1Н, δ, м.д.: 7,978 с (Н, ОН), 3,81 с (2Н,СН2), 6.07 с (Н, =СН), 6,92-7,73 м (14Н, C6H5OC6H4, C6H5).
Выводы
Разработан метод синтеза 3-феноксифенилсодержащих 1,3-дикетонов и их хелатных комплексов с ионами меди (II). Структура синтезированных соединений подтверждена ИК-, ЯМР 1Н-спектроскопией.