Результат интеллектуальной деятельности: ПРОМЫШЛЕННЫЙ СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ФЕРМЕНТА ПЕНИЦИЛЛИН G АЦИЛАЗЫ ESCHERICHIA COLI
Вид РИД
Изобретение
Изобретение относится к области микробиологии и биотехнологии и касается оптимизации процессов культивирования штамма E.coli-продуцента пенициллин G ацилазы Escherichia coli (ECOPGA), а точнее способа промышленного культивирования штамма E.coli BL21(DE3)/pMD704 - продуцента пенициллин G ацилазы E.coli. Изобретение предназначено для использования в промышленности в составе биокатализаторов для ферментативного синтеза бета-лактамных антибиотиков класса цефалоспоринов-кислот.
Фермент пенициллин G ацилазу (PGA) широко используют в промышленности в качестве основы биокатализатора для гидролиза пенициллина G, с целью получения «ядер» для синтеза β-лактамных антибиотиков [Parmar A. et al. Advances in enzymatic transformation of penicillins to 6-aminopenicillanic acid (6-APA) // Biotechnol. Adv. Elsevier Science Ltd, 2000. Vol. 18, №4. P. 289-301] а также для ферментативного синтеза цефалоспориновых антибиотиков 1 и 2 поколений, в частности, цефазолина и цефамандола [Volpato G., Rodrigues R.C., Fernandez-Lafuente R. Use of enzymes in the production of semi-synthetic penicillins and cephalosporins: drawbacks and perspectives. // Curr. Med. Chem. 2010. Vol. 17, №32. P. 3855-3873]. Несомненный практический интерес представляет усовершенствование способов получения ферментов, необходимых для синтеза этих антибиотиков, в частности, с помощью технологий рекомбинантных ДНК.
Известны многочисленные примеры попыток достижения суперпрдукции PGA из различных микроорганизмов в клетках бактерий E.coli, B.subtilis, дрожжей P.pastoris в том числе с применением рЕТ системы, основанной на использовании штаммов E.coli, экспрессирующих полимеразу фага Т7 и экспрессионных векторов с геном PGA под контролем промотора гена 10 этого фага [Srirangan K. et al. Biotechnological advances on penicillin G acylase: pharmaceutical implications, unique expression mechanism and production strategies. // Biotechnol. Adv. 2013. Vol. 31, №8. P. 1319-1332]. Общими недостатками таких методов являются невысокий уровень синтеза целевого белка [Narayanan N., Xu Y., Chou C.P. High-level gene expression for recombinant penicillin acylase production using the araB promoter system in Escherichia coli. // Biotechnol. Prog. 2006. Vol. 22, №6. P. 1518-1523], сложности процессов масштабирования ферментации штаммов [ A.M. et al. High-throughput strategies for penicillin G acylase production in rE.coli fed-batch cultivations. // BMC Biotechnol. 2014. Vol. 14. P. 6], накопление телец включения и непроцессированного предшественника, что в свою очередь приводит к замедлению роста штаммов, их лизису, высвобождению синтезированной PGA в среду культивирования [Pan K.L. et al. Roles of DegP in prevention of protein misfolding in the periplasm upon overexpression of penicillin acylase in Escherichia coli // J. Bacteriol. 2003. Vol. 185, №10. P. 3020-3030].
A.M. et al. High-throughput strategies for penicillin G acylase production in rE.coli fed-batch cultivations. // BMC Biotechnol. 2014. Vol. 14. P. 6], накопление телец включения и непроцессированного предшественника, что в свою очередь приводит к замедлению роста штаммов, их лизису, высвобождению синтезированной PGA в среду культивирования [Pan K.L. et al. Roles of DegP in prevention of protein misfolding in the periplasm upon overexpression of penicillin acylase in Escherichia coli // J. Bacteriol. 2003. Vol. 185, №10. P. 3020-3030].
Устранение указанных недостатков может быть достигнуто как путем разработки новых систем экспрессии пенициллин G-ацилазы, так и путем оптимизации условий культивирования известных штаммов [Rosano G.L., Ceccarelli Е.А. Recombinant protein expression in Escherichia coli: Advances and challenges // Frontiers in Microbiology. Frontiers Research Foundation, 2014. Vol. 5, №APR].
За единицу ферментативной (синтетазной или пенцциллинамидазной) активности образца в реакции синтеза цефазолина или гидролиза бензилпенициллина (1 ME) принимают такое количество препарата, которое катализирует образование 1 мкмоля продукта в минуту в стандартных условиях.
В источниках информации приведены в основном сведения о гидролазной активности биомассы клеток штамма-продуцента. Соотношение синтетазной и гидролазной аткинвостей определяется как свойствами самого фермента, особенностями его первичной и пространственной структуры [Tishkov V.I., Savin S.S., Yasnaya A.S. Protein Engineering of Penicillin Acylase // Acta Naturae. Acta Naturae Ltd, 2010. Vol. 2, №3. P. 47-61], так и различными примесями, которые зависят от особенностей штамма и процедур его культивирования. Примеси различных бета-лактамаз и эстераз могут снижать синтетазную активность [Wang Y. et al. Double knockout of β-lactamase and cephalosporin acetyl esterase genes from Escherichia coli reduces cephalosporin С decomposition // J. Biosci. Bioeng. 2012. Vol. 113, №6. P. 737-741] и делать препарат непригодным для прямого использования в составе биокатализатора.
Известен способ получения рекомбинантной ECOPGA с использованием штамма E.coli W3110, модифицированного плазмидой рРА102, содержащей структурный ген PGA под контролем модифицированного lac промотора, в ферментере объемом 1 л в минимальной питательной среде, содержащей 0.5 г NaCl, 6 г Na2HPO4, 3 г KH2PO4, 0.1 г CaCl2, 1 г MgSO4, 1 г NH4Cl, 40 мг тиамина, 35 мг канамицин-сульфата и лактозы в качестве источника углерода и индуктора [De  A. et al. Production of penicillin acylase by a recombinant Escherichia coli using cheese whey as substrate and inducer // Biomol. Eng. 2006].
A. et al. Production of penicillin acylase by a recombinant Escherichia coli using cheese whey as substrate and inducer // Biomol. Eng. 2006].
Выход сухой биомассы - 1,5 г с литра.
Удельная активность - 781 МЕ/г сухих в реакции гидролиза бензилпенициллина.
Синтетазная активность - не указана.
Недостатками данного способа являются: - низкий выход биомассы - низкая продуктивность -непригодность для масштабирования процесса, - неохарактеризованность по синтетазной активности.
Известен способ получения рекомбинантной ECOGA с использованием рекомбинатного штамма E.coli BL21(DE3) модифицированного плазмидой pOAF1, содержащей структурный ген PGA под контролем промотора Т7 [ A.M. et al. High-throughput strategies for penicillin G acylase production in rE.coli fed-batch cultivations. // BMC Biotechnol. 2014. Vol. 14. Р.6]. Способ осуществляют путем культивирования клеток штамма-продуцента в 5 л ферментере в условиях «автоиндукции» при температуре 37°С и рН 7,0 контролируя содержание растворимого кислорода на уровне 30% от максимального путем автоматической корректировки скорости перемешивания (в пределах (200-600 об/мин). По достижении плотности культуры 20 г сухого веса/л снижают температуру культивирования до 20°С. и продолжают культивирование еще в течение 24 часов с однократной подпиткой лактозой и глицерином.
A.M. et al. High-throughput strategies for penicillin G acylase production in rE.coli fed-batch cultivations. // BMC Biotechnol. 2014. Vol. 14. Р.6]. Способ осуществляют путем культивирования клеток штамма-продуцента в 5 л ферментере в условиях «автоиндукции» при температуре 37°С и рН 7,0 контролируя содержание растворимого кислорода на уровне 30% от максимального путем автоматической корректировки скорости перемешивания (в пределах (200-600 об/мин). По достижении плотности культуры 20 г сухого веса/л снижают температуру культивирования до 20°С. и продолжают культивирование еще в течение 24 часов с однократной подпиткой лактозой и глицерином.
Метод позволяет получать биомассу клеток со следующими характеристиками
Удельная активность (в реакции гидролиза бензилпенициллина с образованием 6-АПК) - 2600 МЕ/г сухого,
Выход биомассы - 36 г сухого/л, общий выход ферентативной акивности - около 100000 ME с литра.
Недостатки способа:
- повышенная бета-лактамазная активность клеток из-за использования вектора pET101/D-TOPO с маркерным геном бета-лактамазы, что требует введения этапов дополнительной очистки клеточного гомогената для дальнешего использования его в синтезе бета-лактамных антибиотиков;
- отсутствие данных о синтетазной активности клеток;
- сложность процесса культивирования.
В качестве ближайшего аналога заявляемого способа рассмотрим способ микробиологического синтеза ECOPGA в клетках штамма E.coli BL21(DE3)/pMD704 путем экспрессии рекомбинантной ДНК, кодирующей вариант предшественника ECOPGA с сигнальной последовательностью секреции L-аспарагиназы Erwinia carotovora [патент RU 2624022].
Культивирование этого штамма в условиях «автоиндукции» в колбах позволяет повысить выход целевого фермента (в пересчете на удельную пенициллинамидазную активность с 1 литра культуры) более чем в 5 раз по сравнению с исходным штаммом.
Возможность использования штамма E.coli BL21(DE3)/pMD704 для наработки препарата ECOPGA в промышленно-значимых количествах не показана, но известно, что масштабирование процесса культивирования является нетривиальной задачей и требует тщательного и не всегда очевидного подхода к подбору условий культивирования штамма-продуцента в ферментере [Schmidt F.R. Optimization and scale up of industrial fermentation processes // Appl. Microbiol. Biotechnol. Springer Verlag, 2005. Vol. 68, №4. P. 425-435; Sivashanmugam A. et al. Practical protocols for production of very high yields of recombinant proteins using Escherichia coli. // Protein Sci. 2009. Vol. 18, №5. P. 936-948].
Задача настоящего изобретения состоит в разработке промышленного способа микробиологического синтеза ECOPGA в клетках Escherichia coli.
Задача решена путем разработки промышленного способа микробиологического синтеза фермента пенициллин G ацилазы Escherichia coli путем культивирования штамма-продуцента Escherichia coli BL21(DE3)/pMD 704 с предварительным выращиванием посевного материала на среде YPS в течение 3-5 часов при температуре 38°С и перемешивании 200 об/мин, который затем в количестве 10% по объему вносят в среду культивирования следующего состава (мас%): дрожжевой экстракт - 1, пептон - 1, сульфат аммония - 0,17, глюкоза - 1, глицерин - 5, лактоза - 1, 100 мМ K-Na2 фосфатный буфер, 2 мМ сульфат магния, 100 мкг/мл канамицина-сульфат, вода - остальное, а процесс культивирования осуществляют при концентрации растворенного кислорода 80-90%, скорости перемешивания 700-1200 об/мин и максимальном уровне аэрации 1 объем воздуха/мин: 1 объем культуральной жидкости.
Среда культивирования обозначена как среда ВМ. Она является модификацией среды TRB [патент RU 2545722].
Заявляемый способ представляет собой способ микробиологического синтеза фермента пенициллин G ацилазы Escherichia coli путем культивирования штамма-продуцента E.coli BL21(DE3)/pMD704 в следующих условиях.
Посевной материал штамма-продуцента Escherichia coli BL21(DE3)/pMD 704 выращивают на среде YPS в течение 3-5 часов при температуре 38°С и перемешивании 200 об/мин, который затем в количестве 10% по объему вносят в среду культивирования ВМ следующего состава (мас%): дрожжевой экстракт - 1, пептон - 1, сульфат аммония -0,17, глюкоза - 1, глицерин - 5, лактоза - 1, 100 мМ K-Na2 фосфатный буфер, 2 мМ сульфат магния, 100 мкг/мл канамицина-сульфат, вода - остальное, а процесс культивирования осуществляют при концентрации растворенного кислорода 80-90%, скорости перемешивания 700-1200 об/мин и максимальном уровне аэрации 1 объем воздуха/мин: 1 объем культуральной жидкости при рН 7, температуре 21-23°С. Через 46-48 часов биомассу отделяют центрифугированием, промывают фосфатным буфером и повторно осаждают, a ECOPGA извлекают в виде ферментной пасты путем осаждения с помощью полиэтиленгликоля.
Уровень синтетазной активности в биомассе клеток составляет не менее чем 2000 МЕ/г влажн., общий выход активности - не менее 140000 МЕ/литр культуры.
Заявляемый способ проиллюстрирован следующими фигурами
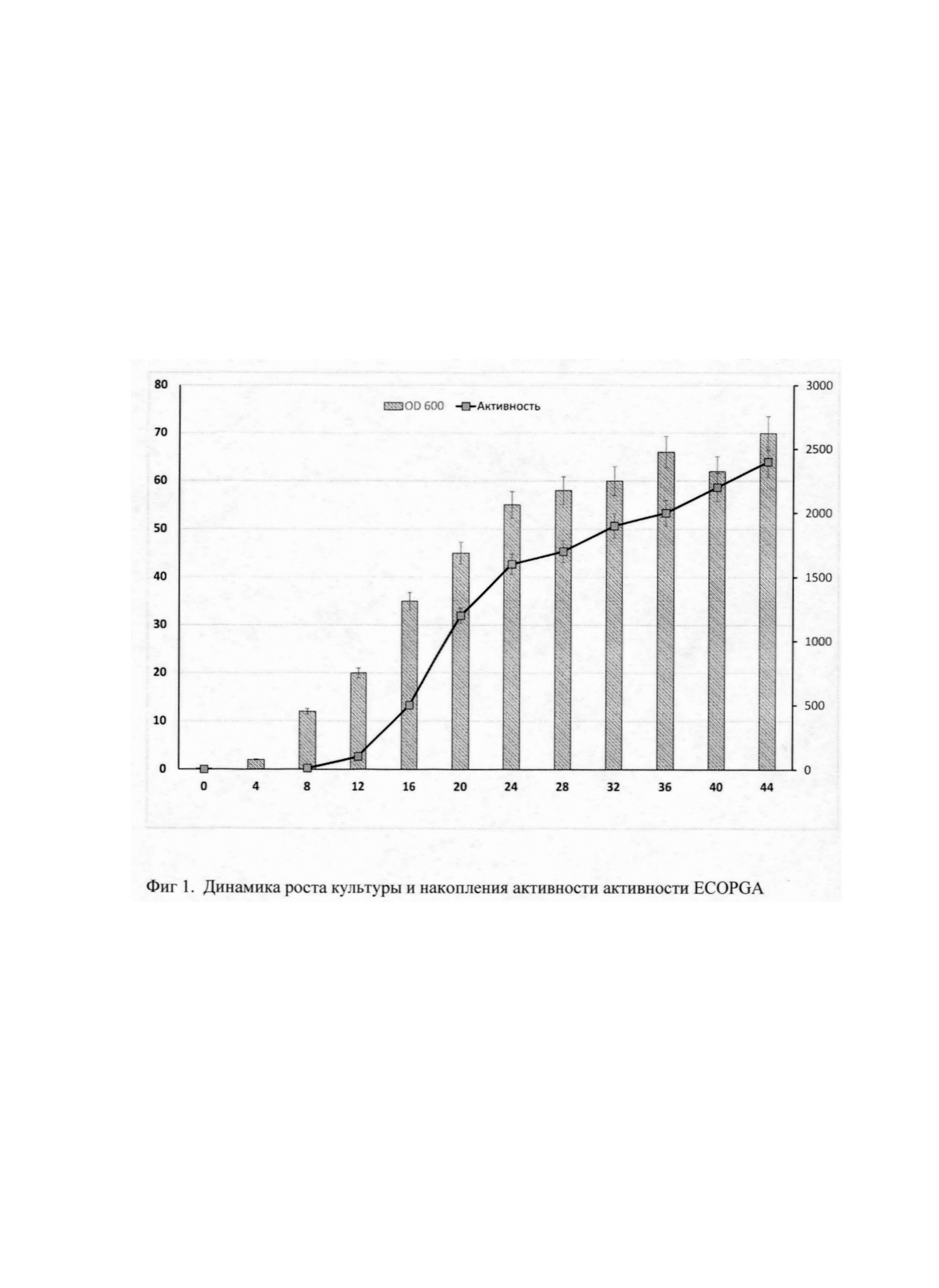
Фиг 1. Динамика роста культуры и накопления активности активности ECOPGA (в реакции гидролиза бензилпенилллина) при культивировании штамма E.coli BL21(DE3)/pMD704 в ферментере объемом 1 л, с объемом среды 460 мл.
Ось X - время культивирования (часы), Ось Y1 - плотность культуры (ОП600), Ось Y2 - пенициллинамидазная активность (МЕ/мл).
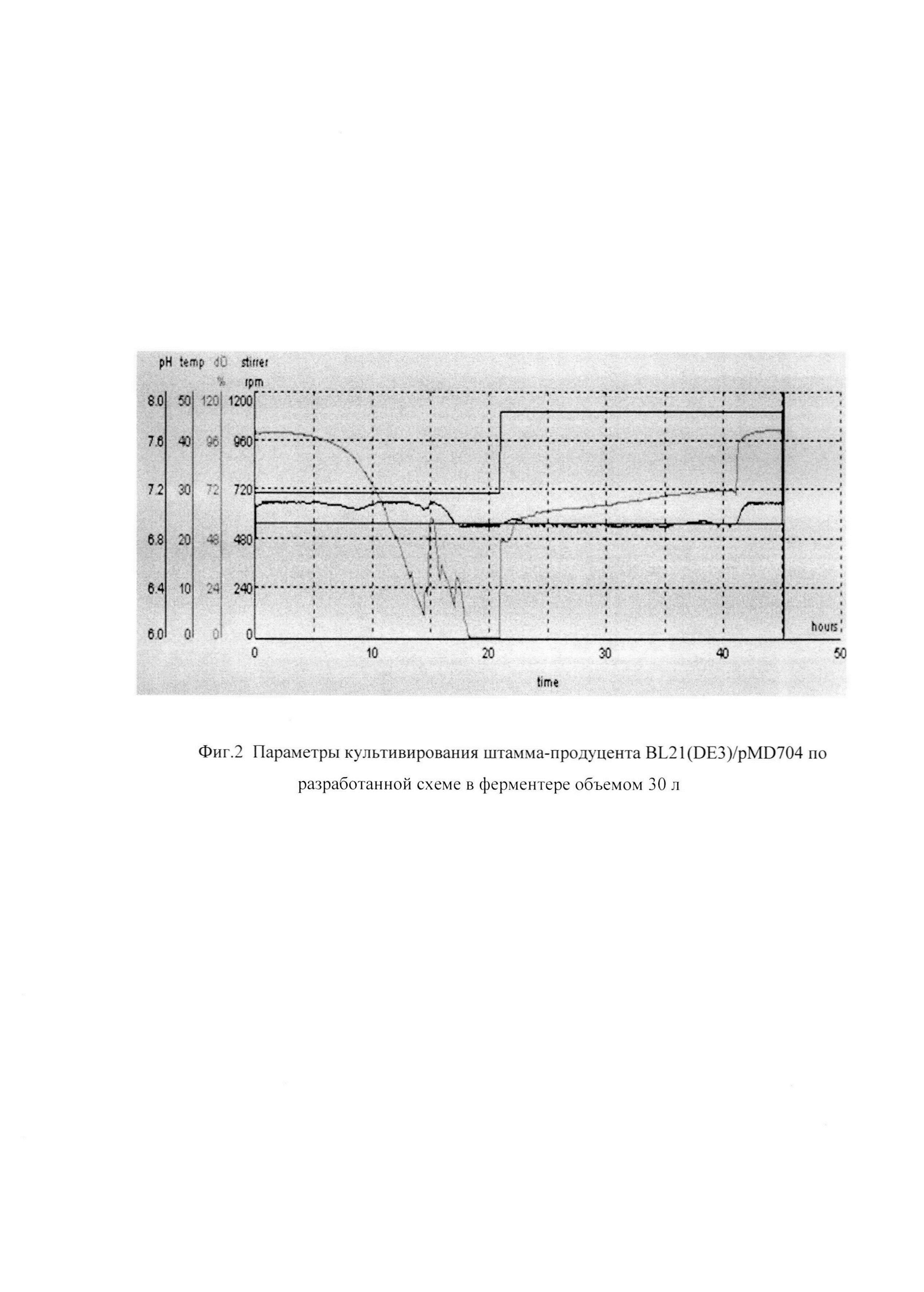
Фиг. 2 Параметры культивирования штамма-продуцента BL21(DE3)/pMD704 по разработанной схеме в ферментере объемом 30 л.
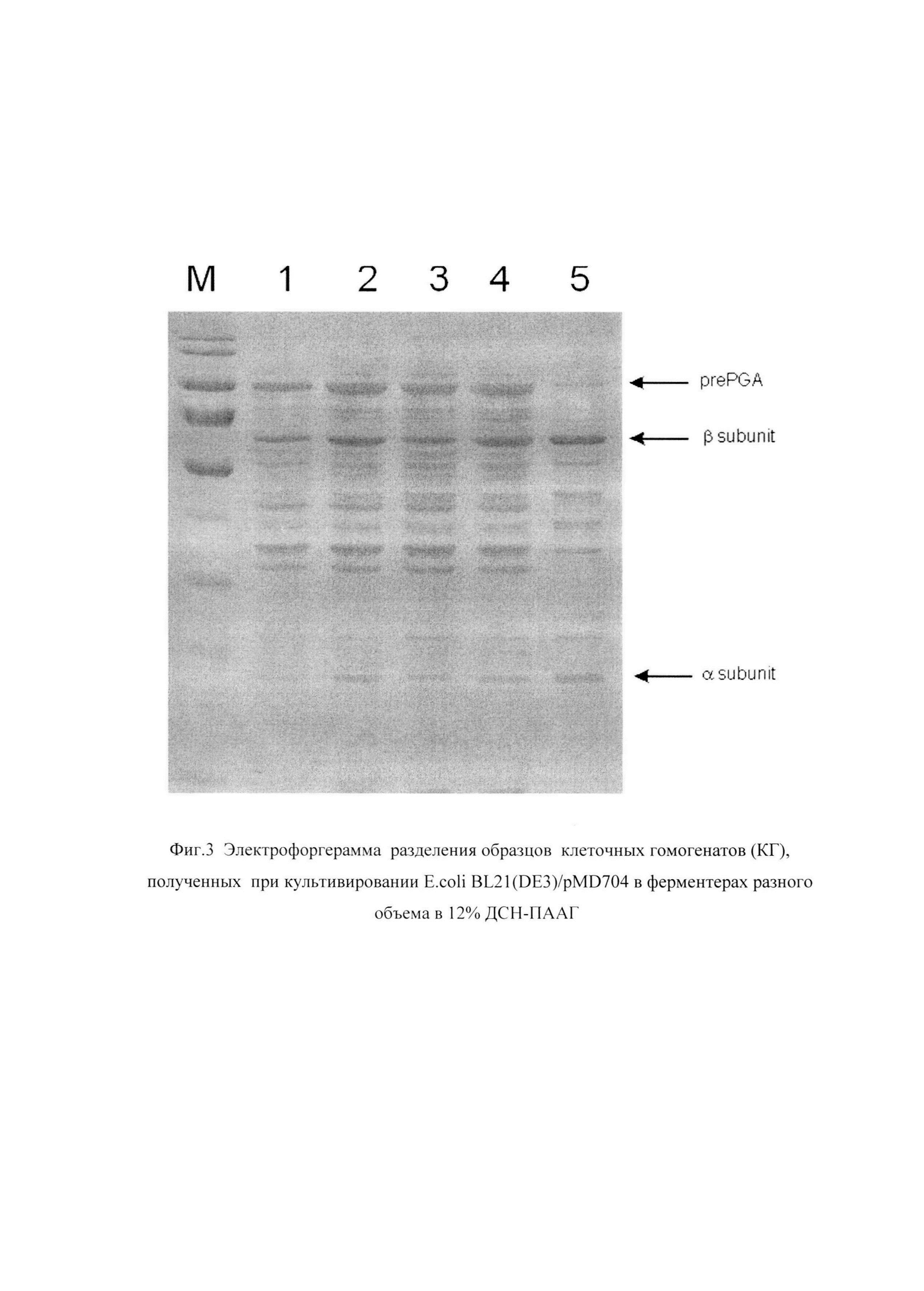
Фиг. 3 Электрофореграмма разделения образцов клеточных гомогенатов (КГ), полученных при культивировании E.coli BL21(DE3)/pMD704 в ферментерах разного объема в 12% ДСН-ПААГ. Дорожки М - маркер молекулярного веса, 1, 2 - суммарные КГ, полученные из образцов, отобранных после 24 часов и 48 часов культивирования в ферментере объемом 1 л (как в примере 2), 3, 4 - суммарные КГ, полученные из образцов, отобранных после 24 часов и 46 часов культивирования в ферментере объемом 30 л (как в примере 3), 5 - растворимая фракция КГ, полученная из образца, отобранного после 46 часов культивирования (пример 3).
Обозначены полосы, соответствующие предшественнику ECOPGA (prePGA), процессированным α- и β-субъединицам (α-subunit, β-subunit).
При осуществлении изобретения, помимо приемов, подробно раскрытых в нижеследующих примерах, используют хорошо известные специалистам методики, описанные в руководствах по микробиологии и промышленной биотехнологии [Manual of Industrial Microbiology and Biotechnology // Manual of Industrial Microbiology and Biotechnology, Third Edition. 3rd ed. / ed. Baltz R.H. (CognoGen!Biotechnology!Consulting), Davies J.E. (!University!of!British!Columbia), Demain, A.L. (Charles!A.Dana!ResearchInstitute(R.I.S.E.) !Drew!University). American Society of Microbiology, 2010. 784 p.; Бирюков В.. Основы промышленной биотехнологии. Москва: КолосС, Химия, 2004. 296 С.].
Пример 1. Микробиологический синтез ECOPGA в колбах с использованием способа-ближайшего аналога (контроль)
Культивирование штамма BL21(DE3)/pMD704 ведут как описано [Studier F.W. Protein production by auto-induction in high density shaking cultures. // Protein Expr. Purif. 2005. Vol. 41, №1. P. 207-234] на среде ZY5052 содержащей мас. %: энзиматический гидролизат казеина - 1, дрожжевой экстракт - 0,5, (NH4)2SO4 - 0,33, КН2РО4 - 0,68, Na2HPO4 - 0,71, глицерин - 0,5, глюкоза - 0,05, лактоза - 0,2, MgSO4 - 0,012, вода - остальное. Дополнительно в среду добавляют 50 мг/л канамицина и 30 мг/л хлорамфеникола. Культивирование проводят в объеме 25 мл среды ZY5052 в колбах объемом 250 мл на качалке при 210 об/мин в течение 40 часов при температуре 21°С. В процессе культивирования контролируют параметры роста культуры и активности фермента в бактериальных клетках.
Активность ферментных препаратов по синтезу цефазолина определяют по начальной скорости образования целевого продукта из 3-(метилмеркапто-5-метил-1,3,4-тиадиазол-2-ил)-7-аминоцефалоспорановой кислоты и метилового эфира 1(H)-тетразолилуксусной кислоты в следующих условиях: при (30±1)°С, начальном рН 7,5±0,1 в среде 0,3 М фосфатно-натриевого буфера при начальных концентрациях субстратов: ММТД-7-АЦК - (0,059±0,001) М; МЭТЗУК - (0,236±0,004) М. Содержание цефазолина в реакционной смеси определяют методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Содержание сухих веществ весовым методом после высушивания препарата при (105±1)°С до постоянной массы. Содержание белка в биомассе клеток определяют методом Лоури [Lowry О.Н. et al. Protein measurement with the Folin phenol reagent. // J. Biol. Chem. 1951. Vol. 193, №1. P. 265-275], не проводя предварительной обработки нативных клеток ультразвуком, так как для штамм содержание белка не зависит от степени разрушения клеток ультразвуком.
Полученная биомасса клеток характеризуется следующими показателями:
- синтетазная активность: 1500 МЕ/г влажн.; - обший выход биомассы - 21 г/литра
- общая продукция ECOPGA с единицы объема - 30000 Ед/л
Пример 2. Микробиологический синтез ECOPGA в ферментере объемом 1 литр с использованием заявляемого способа
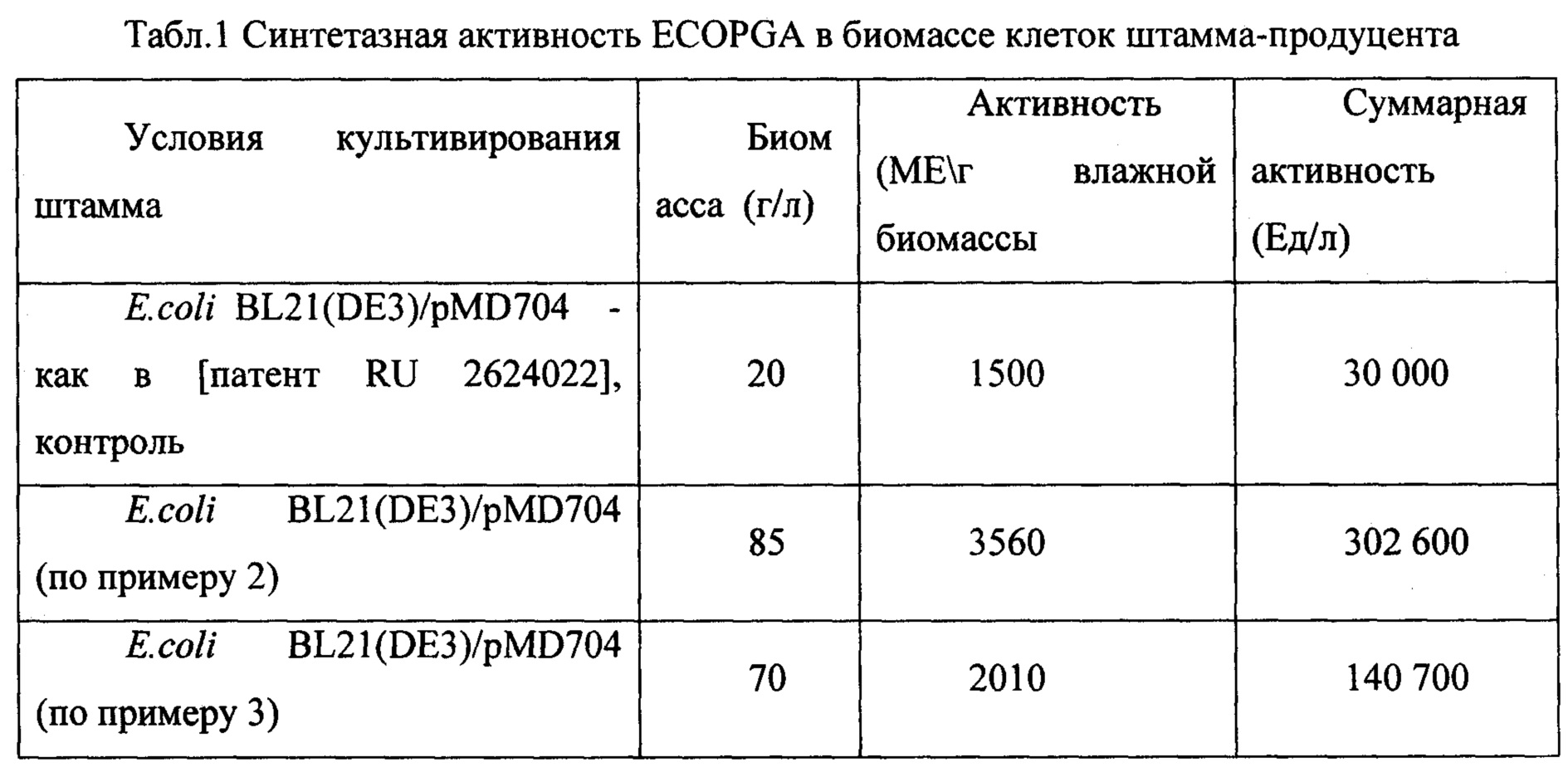
Культивирование штамма BL21(DE3)/pMD704 в ферментере объемом 1 литр на среде ВМ в объеме 460 мл при температуре 23°С, концентрации растворенного кислорода 90% (концентрация растворенного кислорода в процессе культивирования изменяется) при максимальной скорости перемешивания 1000 об/мин, максимальном уровне аэрации 0,5 л л/мин, что соответствует отношению - 1 объем воздуха/1 объем культуральной жидкости. рН 7,0. Инокулят в объеме 50 мл выращен на среде YPS (1% дрожевой экстракт, 2% пептон, 1% NaCl), содержащей также 0,5% глюкозу, 30 мг/л канамицина при температуре 38°С, перемешивании 200 об/мин, времени культивирования 3 ч. Инокулят в посевной дозе 10% внесен в ферментер со стерильной питательной средой ВМ. В процессе культиврования контролируют параметры роста культуры и активности фермента в бактериальных клетках. Удельную пенициллинамидазную активность выражают в единицах фермента (мкмолей субстрата в мин при 37°С) на мл культуры штамма-продуцента при помощи метода [Balasingham К. et al. The isolation and kinetics of penicillin amidase from Escherichia coli // BBA - Enzymol. Elsevier, 1972. Vol. 276, №1. P. 250-256]. Динамика роста культуры и накопления активности активности PGA представлена на фиг 1. Окончание ферментации проводят на 48 ч культивирования. Конечная оптическая плотность - 74 о.е., выход биомассы - 37 г. Активность ECOPGA в реакции синтеза цефазолина в полученной биомассе по окончании культивирования (синтетазная активность) 3560 ЕД/г сырого веса или 12660 Ед/г сухого веса.
Удельная активность PGA в биомассе штамма E.coli BL21(DE3)/pMD704 полученной согласно заявляемому способу превосходит таковую у ближайшего аналога в 2,4 раза, а общий съем активности с 1 литра культуры - в 10 раз (Табл. 1).
Пример 3. Микробиологический синтез ECOPGA в ферментере объемом 30 литров с использованием заявляемого способа
Культивирование штамма BL21(DE3)/pMD704 в ферментере объемом 30 литров проводят при температуре 23°С, концентрации растворенного кислорода 80% (концентрация растворенного кислорода в процессе культивирования изменяется в пределах от 80 до 10%) при максимальной скорости перемешивания 1200 об/мин, максимальном уровне аэрации 30 л/мин, что соответствует отношению - 1 объем воздуха/мин: 1 объем культуральной жидкости. рН 7,0. Инокулят в объеме 3 л выращенный до середины логарифмической фазы роста на среде YPS (1% дрожевой экстракт, 2% пептон, 1% NaCl), содержащей также 0,5% глюкозу, 30 мг/л канамицина при температуре 38°С, перемешивании 200 об/мин, времени культивирования 3 ч. внесен в ферментер со стерильной питательной средой ВМ, в посевной дозе 10%.
Окончание ферментации проводят на 46 ч культивирования. Конечная оптическая плотность - 53 о.е., выход биомассы - 70 г/л. Активность ECOPGA в реакции синтеза цефазолина в полученной биомассе по окончании культивирования (синтетазная активность) 2010 ЕД/г сырого веса.
Общий выход активности с 30 л ферментера - 16 млн Ед.
На фиг.2 представлены параметры культивирования штамма-продуцента BL21(DE3)/pMD704 по разработанной схеме.
На фиг.3 приведена электрофореграмма образцов клеточных гомогенатов, полученных согласно примеру 2 и примеру 3.
В Таблице 1 обобщены характеристики образцов биомассы штамма BL21(DE3)/pMD704 - продуцента ECOPGA полученные согласно заявляемому способу путем культивирования в ферментерах объемом 1 л и 30 л и этого же штамма, полученные при культивировании в колбах.
Представленные результаты демонстрируют, что согласно заявляемому способу удается получить биомассу с более высокой удельной синтетазной активностью (в 1,4-2.4 раза) и более высоким общим выходом фермента по съему активности с единицы объема среды культивирования (в 4,5-10 раз) по сравнению ближайшим аналогом.
Полученная биомасса предназначена для создания гетерогенных биокатализаторов кинетически-контролируемого синтеза бета-лактамных антибиотиков (пример 4) [Эльдаров М.А. и соавт. Рекомбинантная синтетаза цефалоспоринов-кислот: оптимизация экспрессии в клетках E.coli, иммобилизация и использование для биокаталитического синтеза цефазолина // Биомедицинская химия, 2015. Т. 61, №5. С. 646-651.].
Пример 4. Получение гетерогенного биокатализатора на основе препарата ECOPGA из биомассы штамма BL21(DE3)/pMD704 и его использование в синтезе цефазолина.
Полученную в результате культивирования штамма-продуцента биомассу осаждают, разрушают, а ECOPGA извлекают в виде ферментной пасты путем осаждения с помощью полиэтиленгликоля. Используют 10 г биомассы, полученной как описано в примере 3. Аликвоту биомассы суспендируют в 100 мл 0,1 М натрий фосфатного буфера, рН 7,5, охлаждают до 4°С и гомогенизируют с использованием дезинтегратора высокого давления FrenchPress при рабочем давлении 207 Мпа. Ячейку промывают буфером, рН клеточного гомогената доводят до 6,5 титрованием фосфорной кислотой. Для получения бесклеточного экстракта к полученному гомогенату добавляют Флокатон ППС-400 и обрабатывают при слабом перемешивании при +4°С в течение 30 мин с последующей инкубацией при той же температуре в течение 12-24 часов. Разрушенные клетки отделяют центрифугированием при 10000-12000 об/мин, осадок дважды промывают 0,1 М фосфатно-натриевым буфером, рН 7,0. В полученном экстракте устанавливают рН7,0±0,1. Получают 100 мл бесклеточного экстракта с удельной активностью 265±20 МЕ/мл.
Для получения ферментной пасты к 100 мл бесклеточного экстракта добавляют порционно на холоду при постоянном перемешивании в течение 30-45 мин ПЭГ-6000 из расчета 0,28 г на 1 мл экстракта с последующей инкубацией при 4-8°С в течение 12-36 часов. Грубоочищенный ферментный препарат в виде ферментной пасты отделяют центрифугрованием при 10000-12000 об/мин. Препарат хранят при температуре -12°С.
Процедура позволяет получить из биомассы с синтетазной активностью 7270 МЕ/г сух. (1930 МЕ/г сырого) и удельной активностью 20 МЕ/мг белка препарат ECOPGA в виде ферментной пасты с синтетазной активностью ~22000 МЕ/г при удельной активности 56-67 МЕ/мг белка.
Общий выход разработанной процедуры получения ферментного препарата из биомассы клеток рекомбинантного штамма Е. coli BL21(DE3)/pMD704 составляет не менее 90% при степени очистки целевого фермента 4-6 раз.
Для получения гетерогенного биокатализатора на основе полученной ECOPGA проводят иммобилизацию частично очищенного препарата на эпоксиактивированном носителе Relizyme ЕР113/S.
Для приготовления раствора фермента 0,1 г ферментной пасты растворяют на холоду в 20 мл 1,25 М фосфатно-калиевый буфера, рН 8,0 с получением препарата с удельной активностью >100 МЕ/мл.
Процедуру иммобилизации осуществляют путем инкубации при постоянном перемешивании и заданной температуре (15°С) 5 г влажного промытого носителя (нагрузка по активности 2400 МЕ/г сухого носителя) с перемешиванием в колбе при 15°С и 170 об/мин в течение 60-72 часов. Носитель со связанным ферментом отделяют фильтрацией на пористом стеклянном фильтре, промывают дистиллированной водой. Промытый образец иммобилизованного фермента подвергают пост-иммобилизационной обработке для блокирования свободных эпокси-групп носителя с целью предотвращения неконтролируемых процессов при хранении и эксплуатации иммобилизованного фермента. Для этого полученный образец инкубируют в растворе 1,4 М L-аспартата натрия в течение 24 часов из расчета 0,1 г влажного биокатализатора на 1 мл раствора.
В итоге получают биокатализатор с активностью более 500 МЕ/г влажного при выходе активности на стадии иммобилизации более 60%.
Полученный биокатализатор используют для кинетически контролируемого синтеза цефазолина [Эльдаров М.А. и соавт. Рекомбинантная синтетаза цефалоспоринов-кислот: оптимизация экспрессии в клетках E.coli, иммобилизация и использование для биокаталитического синтеза цефазолина // Биомедицинская химия, 2015. Т. 61, №5. С. 646-651]. При использованием 0,4 г биокатализатора (200 ME) за 20 мин синтеза в объеме 20 мл получают 0,4 г цефазолина, что соответствует трети стандартной терапевтической дозы.
Заявляемый способ, осуществляемый в 30 литровом ферментере, позволяет получить ферментный препарат и изготовить из него биокатализатор в количестве, достаточном для однократного получения 13000 доз цефазолина, то есть позволяет синтезировать ECOPGA в промышленно значимых количествах для получения биокатализаторов, применяемых в процессе синтеза цефалоспоринов - кислот.
Промышленный способ микробиологического синтеза фермента пенициллин G ацилазы Escherichia coli путем культивирования штамма-продуцента Escherichia coli BL21(DE3)/pMD 704 с предварительным выращиванием посевного материала, отличающийся тем, что посевной материал выращивают на среде YPS в течение 3-5 часов при температуре 38°С и перемешивании 200 об/мин, затем в количестве 10% по объему вносят в среду культивирования следующего состава, мас.%: дрожжевой экстракт 1, пептон 1, сульфат аммония 0,17, глюкоза 1, глицерин 5, лактоза 1, 100 мМ K-Na2 фосфатный буфер, 2 мМ сульфат магния, 100 мкг/мл канамицина-сульфат, вода остальное, а процесс культивирования осуществляют при концентрации растворенного кислорода 80-90%, скорости перемешивания 700-1200 об/мин и максимальном уровне аэрации 1 объем воздуха/мин : 1 объем культуральной жидкости.