Результат интеллектуальной деятельности: Фосфолипаза А2 для экспрессии в дрожжах (варианты)
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и касается вариантов рекомбинантной фосфолипазы А2, способных к экспрессии в дрожжах, составной частью которых является последовательность фосфолипазы А2 штамма А-2688 бактерий Streptomyces violaceoruber.
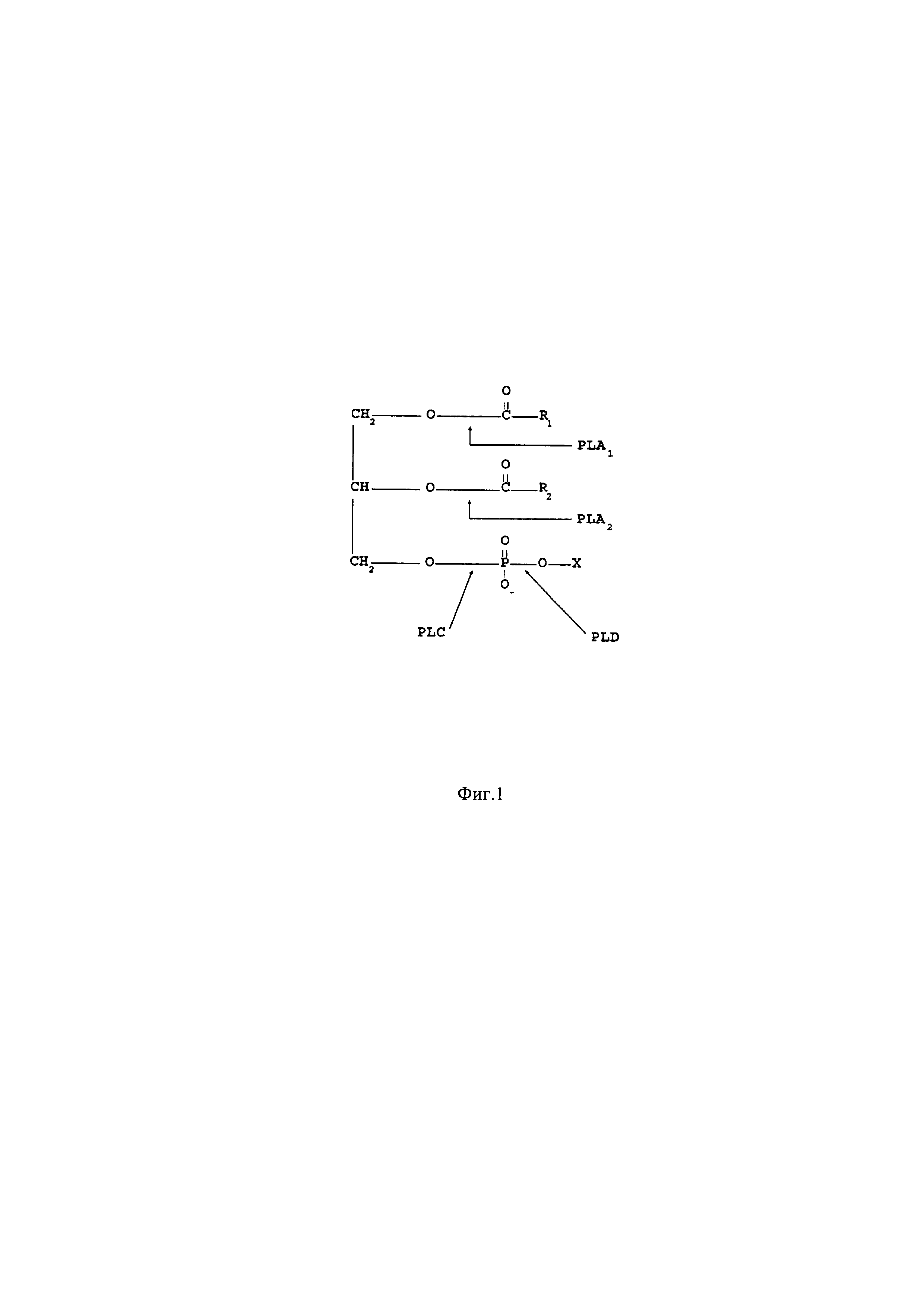
Фосфолипаза А2 (ФЛА2) катализирует гидролиз сложноэфирной связи во втором положении глицерофосфолипидов (фиг. 1) - соединений, являющихся основными компонентами мембран всех живых клеток и по этой причине содержащихся во многих продуктах животного и растительного происхождения. Многообразие молекулярных форм фосфолипидов определяется типом фосфатной группы (холин, этаноламин, инозит или серии) и строением остатков жирных кислот.
ФЛА2 является одним из востребованных ферментов на рынке ферментных препаратов (ФП). В пищевой промышленности ее применяют для улучшения качества майонеза, дегуммирования растительных масел, изготовления хлебобулочных изделий, молочных продуктов, а также при производстве сыра [Бакланов 2008;  & Dennis, 1982]. Другими областями применения ФЛА2 являются текстильная промышленность, кормопроизводство, а также синтез искусственных фосфолипидов (ФЛ), востребованных, в частности, в фармакологии и парфюмерии [De Maria et al., 2007; Hoogevest & Wendel, 2014; Liu et al., 2015]. Интенсивное использование ФЛА2 ожидают в топливно-энергетической промышленности для получения биодизеля [Cesarini et al., 2015]. Из числа ФП, содержащих ФЛА2 наиболее известны следующие:
& Dennis, 1982]. Другими областями применения ФЛА2 являются текстильная промышленность, кормопроизводство, а также синтез искусственных фосфолипидов (ФЛ), востребованных, в частности, в фармакологии и парфюмерии [De Maria et al., 2007; Hoogevest & Wendel, 2014; Liu et al., 2015]. Интенсивное использование ФЛА2 ожидают в топливно-энергетической промышленности для получения биодизеля [Cesarini et al., 2015]. Из числа ФП, содержащих ФЛА2 наиболее известны следующие:
• ФП Maxapal® А2 (DSM), получаемый микробиологическим синтезом с использованием рекомбинантного штамма грибов Aspergillus niger;
• ФП «DENAZYME PLA2» или «PLA2 Nagase» (Nagase Corporation), основу которого составляет ФЛА2 Streptomyces violaceoruber, получаемый микробиологическим синтезом с использованием продуцентов рода Streptomyces;
• ФП «Lecitase L10» (Novozymes A/S), получаемый очисткой из пожелудочной железы свиней.
В подавляющем большинстве промышленно ценные варианты ФЛА2 принадлежат к классу секретируемых кальций-зависимых ферментов, способных проявлять высокую активность только в присутствии ионов кальция Са+2. Это обстоятельство не служит препятствием, существенно ограничивающим использование ФЛА2, поскольку промышленные технологии, как правило, допускают применение кальция в количествах, достаточных для активации фермента.
ФП ФЛА2 получают с использованием природных или рекомбинантных штаммов-продуцентов. Однако, независимо от происхождения, производимые ФП характеризуются высокой себестоимостью, связанной с низким уровнем продукции или низкой активностью ФЛА2, которые обусловлены высокой токсичностью ФЛА2, проистекающей из способности фермента гидролизовать фосфолипиды клеточных мембран и тем самым вызывать их разрушение, приводящее к гибели продуцирующих клеток.
К преимуществам природных продуцентов ФЛА2 относят их высокую адаптированность к биосинтезу токсичного фермента [Sugiyama et al., 2002; WO 2004/097012]. Например, грибные ФЛА2 в большинстве случаев продуцируются в виде удлиненных про-белков, которые подвергаются созреванию и активации лишь на поздних стадиях секреции [WO 2004/097012], чем обеспечивается обратимая инактивация грибных ФЛА2 на период их пребывания внутри клеток. Эта стратегия широко распространена в природе, а также находит применение в биотехнологии для биосинтеза особо токсичных белков, способных в случае преждевременной активации нанести повреждения клеткам-продуцентам.
Другим природным адаптивным механизмом является изменение состава клеточных мембран с целью исключения фосфолипидов, к которым продуцируемый фермент проявляет наибольшее сродство. Результатом адаптации является снижение токсического действия ФЛА2 на клетку-хозяина [Sugiyama et al., 2002].
Несмотря на повышенную устойчивость, использование природных штаммов для производства ФЛА2 сопряжено с рядом экономических ограничений. Как правило, для достижения высокого выхода фермента штамм-продуцент необходимо культивировать в условиях, требующих сложного оборудования, на сложной, комплексной среде, содержащей, в том числе, жировой компонент [Valero, 2012]. При этом организм-хозяин, как правило, синтезирует различные изоформы не только целевой ФЛА2, но и других липаз, которые изменяют специфичность и селективность ФП и способны ухудшать его свойства. В то же время глубокая очистка целевой ФЛА2 представляет собой экономически необоснованный этап.
В этой связи оптимальным способом увеличения продуктивности и получения качественных ФП является использование рекомбинантных технологий для экспрессии целевой ФЛА2 в клетках специально подобранного реципиентного микроорганизма.
В частности, для производства рекомбинантных белков применяют дрожжи Saccharomyces cerevisiae, Komagataella pastoris (бывш. Pichia pastoris). К их преимуществам относят то, что они не продуцируют собственных, но способны продуцировать чужеродные ФЛА2, такие как ФЛА2 индийской кобры Naja naja naja [Lefkowitz et al., 1999] и ФЛА2 штамма бактерий 2917 S. violaceoruber [Liu et al., 2015]. При этом значительных уровней продукции (30 и 200 мг/л) достигают ФЛА2, специфическая активность которых низка и составляет всего 50-80 ед/мг; [Lefkowitz et al., 1999] и 170 ед/мг [Liu et al., 2015], соответственно, что существенно ниже активности известных высокоактивных ФЛА2 штамма А-2688 S. violaceoruber - 1000 ед/мг [Sugiyama et al., 2002; GRAS, 2006] или грибов - 648 ед/мг и выше [WO 2004/097012]. В соответствии с этим продуцированные в дрожжах рекомбинантные ФЛА2 следует отнести к низкоактивным ферментам. Примеров разработки на основе дрожжей продуцентов других, более высокоактивных вариантов ФЛА2 в источниках литературы не обнаружено. Это позволяет заключить, что эффективный биосинтез высокоактивных ФЛА2 в дрожжах, вероятно, затруднен и требует разработки нестандартных подходов.
Природная фосфолипаза ФЛА2 бактерий S. violaceoruber является уникальным ферментом, к числу достоинств которой относят отсутствие у нее «загрязняющей» липазной активности, что позволяет снизить потери при дегуммировании масел [Liu et al., 2015]. Из источников информации известны лишь два природных варианта ФЛА2 S. violaceoruber: высокоактивный из штамма А-2688 [Sugiyama et al., 2002] и низкоактивный из штамма 2917 [Liu et al., 2015]. Информация об экспрессии в дрожжах раскрыта лишь для низкоактивной ФЛА2 [Liu et al., 2015], которую будем рассматривать в качестве ближайшего аналога заявляемой фосфолипазы А2.
Задача заявляемого изобретения заключалась в расширении арсенала фосфолипаз А2, способных к экспрессии в дрожжах.
Задача решена путем конструирования:
- фосфолипазы А2 для экспрессии в дрожжах, структурный ген которой кодирует белок, включающий аминокислотную последовательность фосфолипазы А2 штамма А-2688 Streptomyces violaceoruber, содержащую замену С-концевого дипептида FG, состоящего из аминокислотных остатков фенилаланина и глицина, на дипептид YG, состоящий из аминокислотных остатков тирозина и глицина, и содержащую на N-конце дополнительный дипептид SG, состоящий из аминокислотных остатков серина и глицина.
- фосфолипазы А2 для экспрессии в дрожжах, структурный ген которой кодирует белок, включающий аминокислотную последовательность фосфолипазы А2 штамма А-2688 Streptomyces violaceoruber или ее вариант, не содержащий сайтов N-гликозилирования, имеющую на N-конце дополнительный дипептид SG, состоящий из аминокислотных остатков серина и глицина, включающую С-концевой дипептид FG, состоящий из аминокислотных остатков фенилаланина и глицина, и дополнительно С-концевой полипептид, имеющий последовательность SEQ ID N3.
Решение задачи включает следующие этапы:
- получение синтетического гена Pla2 (SEQ ID N1), кодирующего низкоактивный вариант фермента ФЛА2, аминокислотная последовательность которой идентична последовательности фосфолипазы А2 штамма 2917 S. violaceoruber [Liu et al., 2015], получение на его основе гена, названного нами Pla22, кодирующего высокоактивный вариант фермента, названного нами ФЛА22, аминокислотная последовательность которого идентична последовательности фосфолипазы А2 штамма А-2688 S. violaceoruber [Sugiyama et al., 2002], анализ их экспрессии и активности в дрожжах и выбора варианта ФЛА22 для последующих модификаций;
- конструирование вариантов ФЛА22, содержащих С-концевые замены и/или С-концевые удлинения;
- сконструированные варианты ФЛА22 экспрессируют в дрожжах S. cerevisiae или K. kurtzmanii, используя реципиентные штаммы, векторы, промоторы, лидерные области и условия культивирования, которые идентичны или аналогичны описанным ранее [RU 2460795 и RU 2522479] и не являются существенными признаками изобретения; получают образцы культуральной жидкости дрожжей, содержащие варианты ФЛА22; с использованием техники гель-электрофореза анализируют продукцию вариантов ФЛА22 в дрожжах; анализируют активности вариантов ФЛА22 в различных условиях in vitro, в том числе в присутствии повышенных концентраций ионов кальция.
Ближайшим аналогом заявляемых вариантов изобретения является низкоактивная ФЛА2 штамма 2917 S. violaceoruber, продуцируемая в дрожжах Pichia pastoris. Основным достоинством аналога является высокий уровень экспрессии - 200 мг/л. При этом удельная активность продуцированной ФЛА2 является низкой и составляет всего 170 ед/мг [Liu et al., 2015].
Изобретение проиллюстрировано следующими фигурами.
Фиг. 1. Специфичность фосфолипаз разных типов [De Maria, 2007]
Фиг. 2. Выравнивание известных последовательностей фосфолипаз ФЛА2 S. violaceoruber (в скобках указаны номера штаммов). Аминокислотные замены отмечены маркером и подчеркнуты.
Пример 1. Получение синтетического гена Pla2 фосфолипазы ФЛА2, содержащей сайты N-гликозилирования
Ген Pla2, кодирующий аминокислотную последовательность низкоактивной фосфолипазы А2 штамма 2917 Streptomyces violaceoruber (GenBank AY359866), получают путем химического синтеза в виде BamHI/XhoI фрагмента ДНК (SEQ ID NO 1), Этот вариант фосфолипазы называют ФЛА2.
Синтезированный BamHI/XhoI фрагмент ДНК, кодирующий фосфолипазу ФЛА2, клонируют в лабораторном векторе pUC18x, производном стандартного вектора pUC18, содержащем сайт узнавания рестриктазы XhoI вместо сайта EcoRI, расщепленном по сайтам BamHI и XhoI. В результате клонирования получают плазмиду pUC18x-Pla2, которую используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего фосфолипазу ФЛА2.
Пример 2. Конструирование гена Pla2ng фосфолипазы ФЛА2нг, не содержащей сайтов N-гликозилирования
Фрагмент ДНК, заключающий ген Pla2ng, кодирующий мутантный вариант фосфолипазы, из аминокислотной последовательности которой исключены три потенциальных сайта N-гликозилирования, получают с помощью ПЦР. В результате ПЦР в аминокислотную последовательность фосфолипазы ФЛА2 вносят 3 замены: S31A, S82A и N108Q. Мутантный вариант фосфолипазы называют ФЛА2нг.
Матрицей для ПЦР служит ДНК плазмиды pUC18x-Pla2. ПЦР-амплификацию осуществляют в 2 этапа.
На первом этапе последовательность мутантного гена получают в виде 4 фрагментов ДНК, полученных с помощью ПЦР и имеющих попарно перекрывающиеся концы:
- фрагмент 1 получают, используя праймер N1346 (5'-ggaggatccggagctcctgccgacaag) и N1257 (5'-agcccaggcagcctggttacggtt);
- фрагмент 2 получают, используя праймер N1256 (5'-aaccgtaaccaggctgcctgggct) и N1261 (5'-actgtcgatacgagccttgttggc);
- фрагмент 3 получают, используя праймер N1260 (5'-gccaacaaggctcgtatcgacagt) и N1265 (5'-aggcggtactctgacaggcggtgttcttct);
- фрагмент 4 получают, используя праймер N1264 (5'-agaagaacaccgcctgtcagagtaccgcct) и N169 (5'-gagcggataacaatttcacacagg).
Амплифицированные фрагменты ДНК очищают из геля, используя с этой целью набор Qiagen (Qiagen, cat. №28706).
На следующем этапе проводят ПЦР-опосредованное лигирование 4 очищенных фрагментов ДНК. С этой целью проводят ПЦР с использованием смеси фрагментов 1, 2, 3 и 4 в качестве матрицы. Праймерами для амплификации служат N1346 и N169. Амплифицированный фрагмент ДНК элюируют из агарозного геля и после открывания концов с использованием рестриктаз BamHI и XhoI клонируют в плазмиде pUC18x (Пример 1), расщепленной по тем же сайтам. В результате клонирования получают плазмиду pUC18x-Pla2ng, в составе которой нуклеотидную последовательность клонированного гена подтверждают секвенированием.
Полученная плазмида pUC18x-Pla2ng содержит BamHI/XhoI фрагмент ДНК, кодирующий мутантную фосфолипазу ФЛА2нг, аминокислотная последовательность которой заключает остатки аланина в позициях 31 (замена S31A) и 82 (замена S82A) а также остаток глутамина в позиции 108 (замена N108Q), вводимые с целью инактивации всех потенциальных сайтов N-гликозилирования.
Плазмиду pUC18x-Pla2ng используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего вариант фосфолипазы ФЛА2нг.
Пример 3. Конструирование гена Pla22 фосфолипазы ФЛА22, содержащей сайты N-гликозилирования
Фрагмент ДНК, заключающий структурный ген фосфолипазы А2, называемый Pla22, кодирующий аминокислотную последовательность высокоактивной фосфолипазы А2 штамма А-2688 Streptomyces violaceoruber (GenBank АЕМ88445), получают с использованием ПЦР. Матрицей для ПЦР служит ДНК плазмиды pUC18x-Pla2.
Искомый фрагмент ДНК получают в 2 этапа. На первом этапе с помощью ПЦР получают 2 перекрывающихся фрагмента ДНК:
- фрагмент 1 получают, используя праймер N168 (5'-gccagggttttcccagtcacga) и N1271 (5'-tcaggggcctgtgtacacaagtcggta);
- фрагмент 2 получают, используя праймер N1270 (5'-taccgacttgtgtacacaggcccctga) и N1272 (5'-gatctcgagttaaccgaagatcttgacggcctggta);
Амплифицированные фрагменты ДНК очищают из геля и на следующем этапе проводят ПЦР-опосредованное лигирование очищенных фрагментов ДНК. С этой целью проводят ПЦР с использованием смеси фрагментов 1 и 2 в качестве матрицы. Праймерами для амплификации служат N168 и N1272. Амплифицированный фрагмент ДНК элюируют из агарозного геля и после открывания концов с использованием рестриктаз BamHI и XhoI клонируют в плазмиде pUC18x (Пример 1), расщепленной по тем же сайтам. В результате клонирования получают плазмиду pUC18x-Pla22, в составе которой нуклеотидную последовательность клонированного гена подтверждают секвенированием.
Полученная плазмида pUC18x-Pla22 содержит BamHI/XhoI фрагмент ДНК, кодирующий вариант фосфолипазы, называемый ФЛА22, аминокислотная последовательность которой заключает остаток треонина в позиции 46 (замена S46T) и остатки фенилаланина и глицина на С-конце в позициях 121 и 122, соответственно (замена L121(FG)). Плазмиду pUC18x-Pla22 используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего вариант фосфолипазы ФЛА22.
Пример 4. Конструирование гена Pla22ng фосфолипазы ФЛА22нг, не содержащей сайтов N-гликозилирования
Фрагмент ДНК, заключающий структурный ген Pla22ng, кодирующий мутантный вариант фосфолипазы, из аминокислотной последовательности которой исключают три сайта N-гликозилирования, получают с помощью ПЦР. ПЦР осуществляют, как описано в Примере 2 за исключением того, что в качестве матрицы для ПЦР используют ДНК плазмиды pUC18x-Pla22.
В результате получают плазмиду pUC18x-Pla22ng, которая содержит BamHI/XhoI фрагмент ДНК, кодирующий вариант фосфолипазы, называемый ФЛА22нг, аминокислотная последовательность которой заключает остатки аланина в позициях 31 (замена S31A) и 82 (замена S82A) и остаток глутамина в позиции 108 (замена N108Q), введенные с целью инактивации потенциальных сайтов N-гликозилирования. Кроме этого вариант фосфолипазы ФЛА22нг содержит остаток треонина в позиции 46 (замена S46T) и остатки фенилаланина и глицина на С-конце в позициях 121 и 122, соответственно (замена L121(FG)).
Плазмиду pUC18x-Pla22ng используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего вариант фосфолипазы ФЛА22нг.
Пример 5. Конструирование базовой части гена Pla22(с4), кодирующего фрагмент фосфолипазы ФЛА22(С4), содержащей сайты N-гликозилирования
Фрагмент ДНК, заключающий базовую часть варианта структурного гена Pla22(с4) с инактивированным стоп-кодоном, получают с использованием ПЦР-опосредуемого мутагенеза. Матрицей для ПЦР служит ДНК плазмиды pUC 18х-Pla22, амплификацию осуществляют с использованием праймеров N1346 (Пример 2) и N1272delTA (5'-gatctcgagtaccgaagatcttgacggcctggta).
Амплифицированный фрагмент ДНК размером около 380 п.о. элюируют из агарозного геля и после открывания концов с использованием рестриктаз BamHI и XhoI клонируют в плазмиде pUC18x (Пример 1), расщепленной по тем же сайтам. В результате клонирования получают плазмиду pUC18x-Pla22(c4), в составе которой нуклеотидную последовательность клонированного гена подтверждают секвенированием.
Полученная плазмида pUC 18х-Pla22(с4) содержит BamHI/XhoI фрагмент ДНК, не содержащий стоп-кодона и кодирующий полипептид, заключающий в своем составе полную аминокислотную последовательность фосфолипазы ФЛА22. Позднее этот фрагмент ДНК используют для клонирования в дрожжевом экспрессионном векторе (Пример 10), в ходе которого осуществляют окончательное формирование структурного гена Pla22(с4), кодирующего удлиненный вариант фосфолипазы ФЛА22(С4).
Пример 6. Конструирование базовой части гена Pla22ng(c4) кодирующего фрагмент фосфолипазы ФЛА22нг(С4), не содержащей сайты N-гликозилирования
Фрагмент ДНК, заключающий базовую часть варианта структурного гена Pla22ng(c4) с инактивированным стоп-кодоном, получают, как описано в Примере 5 за исключением того, что в качестве матрицы для ПЦР используют ДНК плазмиды pUC 18х-Pla22ng.
В результате получают плазмиду pUCT 8x-Pla22ng(c4), которая включает BamHI/XhoI фрагмент ДНК, не содержащий стоп-кодона и кодирующий полипептид, заключающий в своем составе полную аминокислотную последовательность зрелой фосфолипазы ФЛА22нг. Позднее этот фрагмент ДНК используют для клонирования в дрожжевом экспрессионном векторе (Пример 10), в ходе которого осуществляют окончательное формирование структурного гена Pla22ng(c4), кодирующего удлиненный вариант фосфолипазы ФЛА22нг(С4).
Пример 7. Конструирование гена Pla2(S46T) фосфолипазы ФЛА2, содержащей сайты N-гликозилирования и замену природного остатка серина в положении 46 на остаток треонина
Фрагмент ДНК, заключающий вариант структурного гена Pla2(S46T), получают с использованием рекомбинантных технологий. С этой целью BamHI/BshTI фрагмент ДНК в плазмиде pUC18x-Pla2 (Пример 1), кодирующий 5'-концевую часть структурного гена фосфолипазы ФЛА2, замещают на аналогичный BamHI/BshTI фрагмент ДНК плазмиды pUC18x-Pla22 (Пример 3).
В результате получают искомую плазмиду pUC18x-Pla2(S46T), которая содержит BamHI/XhoI фрагмент ДНК, кодирующий вариант фосфолипазы, называемый ФЛА2(846Т), аминокислотная последовательность которой заключает остаток треонина в позиции 46 (замена S46T). Плазмиду pUC18x-Pla2(S46T) используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего вариант фосфолипазы ФЛА2(S46T).
Пример 8. Конструирование гена Pla22(YG) фосфолипазы ФЛА22(YG), содержащей сайты N-гликозилирования, природный остаток треонина в позиции 46, а также замену остатка фенилаланина в положении 121 на остаток тирозина
Фрагмент ДНК, заключающий вариант структурного гена Pla22(YG), получают с использованием ПЦР. Матрицей для ПЦР служит ДНК плазмиды pUC18x-Pla22. Амплификацию указанного фрагмента ДНК осуществляют с использованием праймеров N1346 (Пример 2) и N1276 (5'-tttctcgagttaaccataaatcttgacggcctggta).
Амплифицированный фрагмент ДНК размером около 380 п.о. элюируют из агарозного геля и после открывания концов с использованием рестриктаз BamHI и XhoI клонируют в плазмиде pUC18x (Пример 1), расщепленной по тем же сайтам. В результате клонирования получают плазмиду pUC18x-Pla22(YG), в составе которой нуклеотидную последовательность клонированного гена подтверждают секвенированием.
Полученная плазмида pUC18x-Pla22(YG) содержит BamHI/XhoI фрагмент ДНК, кодирующий вариант фосфолипазы, называемой ФЛА22(YG), содержащей на С-конце в позиции 121 остаток тирозина вместо остатка фенилаланина (замена F121Y). Плазмиду pUC18x-Pla22(YG) используют в качестве источника BamHI/XhoI фрагмента ДНК, кодирующего вариант фосфолипазы ФЛА22(YG).
Пример 9. Конструирование базовой части гена Pla22ng(T46S,c4). кодирующей фрагмент фосфолипазы ФЛА22нг(Т46S,С4), не содержащей сайтов N-гликозилирования и содержащей замену природного остатка треонина в позиции 46 на остаток серина
Фрагмент ДНК, заключающий базовую часть варианта структурного гена Pla22ng(T46S,c4), получают с использованием рекомбинантных технологий. С этой целью BamHI/BshTI фрагмент ДНК в плазмиде pUC18x-Pla22ng(c4) (Пример 6), кодирующий 5'-концевую часть структурного гена фосфолипазы ФЛА22нг(С4), замещают на аналогичный BamHI/BshTI фрагмент ДНК плазмиды pUC18x-Pla2ng (Пример 2).
В результате получают плазмиду pUC18x-Pla22ng(T46S,c4), которая включает BamHI/XhoI фрагмент ДНК, не содержащий стоп-кодона и кодирующий полипептид, заключающий в своем составе полную аминокислотную последовательность зрелой фосфолипазы ФЛА22нг(T46S), в 46 позиции которой содержится остаток серина (замена T46S). Позднее этот фрагмент ДНК используют для клонирования в дрожжевом экспрессионном векторе (Пример 10), в ходе которого осуществляют окончательное формирование структурного гена Pla22ng(T46S,c4), кодирующего удлиненный вариант фосфолипазы ФЛА22нг(Т46S,С4).
Пример 10. Конструирование плазмид серии pPDX3 для экспрессии генов различных вариантов фосфолипазы А2 в дрожжах S. cerevisiae
Плазмиды, используемые для биосинтеза вариантов фосфолипазы А2 в дрожжах S. cerevisiae, конструируют путем лигирования трех фрагментов ДНК.
Фрагментом 1 служит XhoI/HindIII фрагмент ДНК лабораторного бирепликонного вектора pPDX3 [RU 2460795]. Данный фрагмент содержит, начиная от сайта XhoI: область терминации транскрипции гена CYC1 дрожжей S. cerevisiae; фрагмент ДНК, обеспечивающий репликацию и селекцию плазмид pPDX3 в клетках E. coli; фрагмент ДНК эндогенной 2-мкм плазмиды дрожжей, обеспечивающий способность плазмид pPDX3 поддерживаться в клетках дрожжей S. cerevisiae в эписомном многокопийном состоянии; структурные гены URA3 и PGK1 дрожжей S. cerevisiae, обеспечивающие селективное поддержание плазмид pPDX3 в штаммах, имеющих соответствующие хромосомные мутации [RU 2460795, RU 2515913 и др.].
Фрагментом 2 является «регуляторный» HindIII/BglII фрагмент ДНК, кодирующий промотор GAL1, используемый для экспрессии, и лидерную область matHH, направляющую секрецию вариантов фосфолипазы А2 в дрожжах S. cerevisiae.
Для конструирования «регуляторного» фрагмента ДНК используют плазмиду pUC18x-GAL1matHH-GH, содержащую ген зрелого соматропина, слитый с фрагментом ДНК, кодирующим лидерный полипептид, включающий последовательности сигнального пептида mat и удвоенной про-области белка HSP150 дрожжей S. cerevisiae [RU 2460795].
Конструирование проводят путем замещения NcoI/XhoI фрагмента ДНК плазмиды pUC18x-GAL1matHH-GH, кодирующего соматропин, на синтетический двуцепочечный фрагмент ДНК, заключающий сайт узнавания рестриктазы BglII и полученный в результате отжига двух олигонуклеотидов:

В результате клонирования получают плазмиду pUC18x-GAL1matHH-(BglII), в составе которой в последовательности ДНК, кодирующей лидерный полипептид matHH, сконструирован сайт рестриктазы BglII, формируемый кодоном аргинина, входящим в сайт узнавания протеиназы Кех2, и кодоном серина, следующим непосредственно за кодоном аргинина.
Плазмида pUC18x-GAL1matHH-(BglII) служит источником «регуляторного» HindIII/BglII фрагмента ДНК (Фрагмента 2).
Фрагментом 3 служат BamHI/XhoI фрагменты ДНК сконструированных плазмид (Примеры 1-9) или ПЦР-фрагментов, заключающие полные структурные гены или базовые части структурных генов, кодирующих различные варианты фосфолипазы А2.
В частности,
- плазмиду pPDX3-Pla2 получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla2 (Пример 1);
- плазмиду pPDX3-Pla2ng получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla2ng (Пример 2);
- плазмиду pPDX3-Pla22 получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla22 (Пример 3);
- плазмиду pPDX3-Pla22ng получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla22ng (Пример 4);
- плазмиду pPDX3-Pla22(C4) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUCT 8х-Pla22(с4) (Пример 5). В результате клонирования базовой части гена Pla22(с4) в векторе pPDX3 осуществляют слияние последовательности ДНК, кодирующей фосфолипазу А2, и последовательности векторной ДНК SEQ ID N2, кодирующей дополнительный полипептид, имеющий последовательность SEQ ID N3. Тем самым осуществляют окончательное формирование структурного гена Pla22(С4), кодирующего удлиненный вариант фосфолипазы ФЛА22(С4), содержащей дополнительный С-концевой полипептид, имеющий последовательность SEQ ID N3;
- плазмиду pPDX3-Pla22ng(C4) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla22ng(c4) (Пример 6). В результате клонирования базовой части гена Pla22ng(c4) в векторе pPDX3 осуществляют слияние последовательности ДНК, кодирующей фосфолипазу А2, и последовательности векторной ДНК SEQ ID N2, кодирующей дополнительный полипептид, имеющий последовательность SEQ ID N3. Тем самым осуществляют окончательное формирование структурного гена Pla22ng(C4), кодирующего удлиненный вариант фосфолипазы ФЛА22нг(С4), содержащей дополнительный С-концевой полипептид, имеющий последовательность SEQ ID N3;
- плазмиду pPDX3-Pla2(S46T) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla2(S46T) (Пример 7);
- плазмиду pPDX3-Pla22(YG) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla22(YG) (Пример 8);
- плазмиду pPDX3-Pla22ng(T46S,C4) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3 из плазмиды pUC18x-Pla22ng(T46S,c4) (Пример 9). В результате клонирования базовой части гена Pla22ng(T46S,c4) в векторе pPDX3 осуществляют слияние последовательности ДНК, кодирующей фосфолипазу А2, и последовательности векторной ДНК SEQ ID N2, кодирующей дополнительный полипептид, имеющий последовательность SEQ ID N3. Тем самым осуществляют окончательное формирование структурного гена Pla22ng(T46S,C4), кодирующего удлиненный вариант фосфолипазы ФЛА22нг(Т46S,С4), содержащей дополнительный С-концевой полипептид, имеющий последовательность SEQ ID N3;
- плазмиду pPDX3-Pla22ng(C42) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3, получаемого с помощью ПЦР, осуществляемой с использованием праймеров N1346 и N1384 (5'-ttacctcgagtcacaggcttttttcaagta) на смеси двух перекрывающихся фрагментов ДНК, называемых фрагментами 3а и 3б и получаемых в результате амплификации последовательностей ДНК плазмиды pPDX3-Pla22ng(C4) (Пример 10), выполняемой с использованием пары праймеров N1346 и N1383 (5'-accgaagattttgacggcctggta) (фрагмент 3а) и пары праймеров N1385 (5'-tcaaaatcttcggttctaaggcgatccaagat) и N1384 (фрагмент 3б), соответственно. Получаемый результирующий фрагмент 3 кодирует белок, заключающий последовательность фосфолипазы А2 штамма А-2688 S. violaceoruber, содержащей на С-конце дипептид FG, состоящий из аминокислотных остатков фенилаланина и глицина, продолжением которой является дополнительный полипептид, имеющий последовательность SEQ ID N3, в которой N-концевые аминокислотные остатки треонина и аргинина заменены на остатки серина и лизина, соответственно;
- плазмиду pPDX3-Pla22ng(C43) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3, получаемого с помощью ПЦР, осуществляемой с использованием праймеров N1346 и N1384 на смеси двух перекрывающихся фрагментов ДНК, называемых фрагментами 3а и 3б и получаемых в результате амплификации последовательностей ДНК плазмиды pPDX3-Pla22ng(C4) (Пример 10), выполняемой с использованием пары праймеров N1346 и N1383 (фрагмент 3а) и пары праймеров N1388 (5'-tcaaaatcttcggtggatccgcgatccaagat) и N1384 (фрагмент 3б), соответственно. Получаемый результирующий фрагмент 3 кодирует белок, заключающий последовательность фосфолипазы А2 штамма А-2688 S. violaceoruber, содержащей на С-конце дипептид FG, состоящий из аминокислотных остатков фенилаланина и глицина, продолжением которой является дополнительный полипептид, имеющий последовательность SEQ ID N3, в которой N-концевые аминокислотные остатки треонина и аргинина заменены на остатки глицина и серина, соответственно;
- плазмиду pPDX3-Pla22ng(C44) получают путем лигирования фрагментов 1 и 2, а также фрагмента 3, получаемого с помощью ПЦР, осуществляемой с использованием праймеров N1346 и N1384 на смеси двух перекрывающихся фрагментов ДНК, называемых фрагментами 3а и 3б и получаемых в результате амплификации последовательностей ДНК плазмиды pPDX3-Pla22ng(C4) (Пример 10), выполняемой с использованием пары праймеров N1346 и N1383 (фрагмент 3а) и пары праймеров N1389 (5'-tcaaaatcttcggtttgcgtgcgatccaagat) и N1384 (фрагмент 3б), соответственно. Получаемый результирующий фрагмент 3 кодирует белок, заключающий последовательность фосфолипазы А2 штамма А-2688 S. violaceoruber, содержащей на С-конце дипептид FG, состоящий из аминокислотных остатков фенилаланина и глицина, продолжением которой является дополнительный полипептид, имеющий последовательность SEQ ID N3, в которой N-концевые аминокислотные остатки треонина и аргинина заменены на остатки лейцина и аргинина, соответственно;
Контрольную плазмиду pPDX3, не содержащую гена фосфолипазы А2, получают путем затупления липких XhoI и HindIII концов во фрагменте 1 лабораторного бирепликонного вектора pPDX3, осуществляемого с использованием фрагмента Klenow ДНК полимеразы 1 E. coli, и их последующего лигирования. Контрольную плазмиду pPDX3 используют для получения трансформированного штамма дрожжей S. cerevisiae, не продуцирующего фосфолипазу А2 (отрицательный контроль).
Полученные бирепликонные экспрессионные плазмиды серии pPDX3 содержат в своем составе различные варианты генов фосфолипазы А2 S. violaceoruber, слитых с последовательностями ДНК, кодирующими промотор GAL1 дрожжей S. cerevisiae и лидерный полипептид matHH, заключающий в своем составе удвоенную (НН) про-области белка HSP150 дрожжей S. cerevisiae. Эти плазмиды, кроме варианта pPDX3-Pla2(S46T), используют для трансформации клеток реципиентного штамма дрожжей S. cerevisiae и последующей наработки соответствующих вариантов фосфолипазы А2. Плазмиду pPDX3-Pla2(S46T) используют для конструирования соответствующей плазмиды серии рРН727.
Пример 11. Конструирование плазмид серии рРН727 для экспрессии генов различных вариантов фосфолипазы А2 в дрожжах K. kurtzmanii (P. pastoris)
Плазмиды, используемые для биосинтеза вариантов фосфолипазы А 2 в дрожжах K. kurtzmanii (P. pastoris), конструируют на базе вектора pPH93-AOX1Y727-HSA [RU 2522479]. Данный вектор содержит в своем составе селективный маркерный ген HIS4, а также фрагмент ДНК, кодирующий промотор AOX1Y727, клонированный из клеток штамма K. kurtzmanii_(бывший K. pastoris) ВКПМ Y-727 [Naumov et al., 2013], слитый с последовательностью ДНК, кодирующей сигнальный пептид art (в составе гена HSA), идентичный сигнальному пептиду PreA [Kazachenko et al., 2014].
С целью удобства восприятия и во избежание путаницы вектор рРН93-AOX1Y727-HSA переименовывают в pPH727-artHSA. Целевые плазмиды, предназначенные для биосинтеза фосфолипазы А2, конструируют путем лигирования двух фрагментов ДНК. Первым фрагментом ДНК является уникальный XhoI/PstI фрагмент вектора рРН727-artHSA, называемый XhoI/PstI фрагментом ДНК плазмиды рРН727, заключающий в своем составе все векторные элементы (кроме структурного гена). Вторым фрагментом ДНК служит PstI/XhoI фрагмент ДНК соответствующих плазмид серии pPDX3 (Пример 10), заключающий в своем составе нуклеотидную последовательность, кодирующую лидерный полипептид, слитый с вариантом зрелой фосфолипазы А2.
В частности,
- плазмиду рРН727-Pla2 получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla2;
- плазмиду pPH727-Pla2ng получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla2ng;
- плазмиду рРН727-Pla22 получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla22;
- плазмиду pPH727-Pla22ng получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla22ng;
- плазмиду рРН727-Pla22(С4) получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/SalI фрагмента ДНК, амплифицируемого с помощью ПЦР с использованием ДНК плазмиды pPDX3-Pla22(C4) в качестве матрицы и праймеров N369 (5'-ttaatatacctctatactttaacgt), комплиментарного 3'-области промотора GAL1, и N1347 (5'-atagtcgacltacaggcttttttcaagtaggtaa), комплиментарного 3'концевой области гена Pla22(С4), кодирующего удлиненный вариант фосфолипазы ФЛА22(С4);
- плазмиду pPH727-Pla22ng(C4) получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/SalI фрагмента ДНК, амплифицируемого с помощью ПЦР с использованием ДНК плазмиды pPDX3-Pla22ng(C4) в качестве матрицы и праймеров N369 и N1347, кодирующего удлиненный вариант фосфолипазы ФЛА22нг(С4);
- плазмид у pPH727-Pla2(S46T) получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla2(S46T);
- плазмиду pPH727-Pla22(YG) получают путем лигирования XhoI/PstI фрагмента ДНК плазмиды рРН727 и PstI/XhoI фрагмента ДНК плазмиды pPDX3-Pla22(YG).
Контрольную плазмиду рРН727, не содержащую гена фосфолипазы А2, получают путем затупления липких концов в XhoI/PstI фрагменте ДНК плазмиды рРН727, осуществляемого с использованием фрагмента Klenow ДНК полимеразы 1 E. coli, и их последующего лигирования. Контрольную плазмиду рРН727 используют для получения трансформированного штамма дрожжей K. kurtzmanii, не продуцирующего фосфолипазу А2 (отрицательный контроль).
Полученные интегративные экспрессионные плазмиды серии рРН727 содержат в своем составе различные варианты генов фосфолипазы А2 S. violaceoruber, слитые с последовательностями ДНК, кодирующими промотор АОХ1 дрожжей K. kurtzmanii и лидерный полипептид artHH, заключающий в своем составе удвоенную (НН) про-области белка HSP150 дрожжей S. cerevisiae. Эти плазмиды используют для трансформации клеток реципиентного штамма дрожжей K. kurtzmanii или P. pastoris и последующей наработки соответствующих вариантов фосфолипазы А2.

Пример 12. Получение трансформированных штаммов дрожжей Saccharomyces cerevisiae
Сконструированные плазмиды серии pPDX3 (пример 10) вводят в клетки лабораторного реципиентного штамма D721W [RU 2460795], для чего применяют процедуру трансформации, которую осуществляют, как описано ранее [RU 2460795]. В результате трансформации получают следующие трансформированные штаммы:
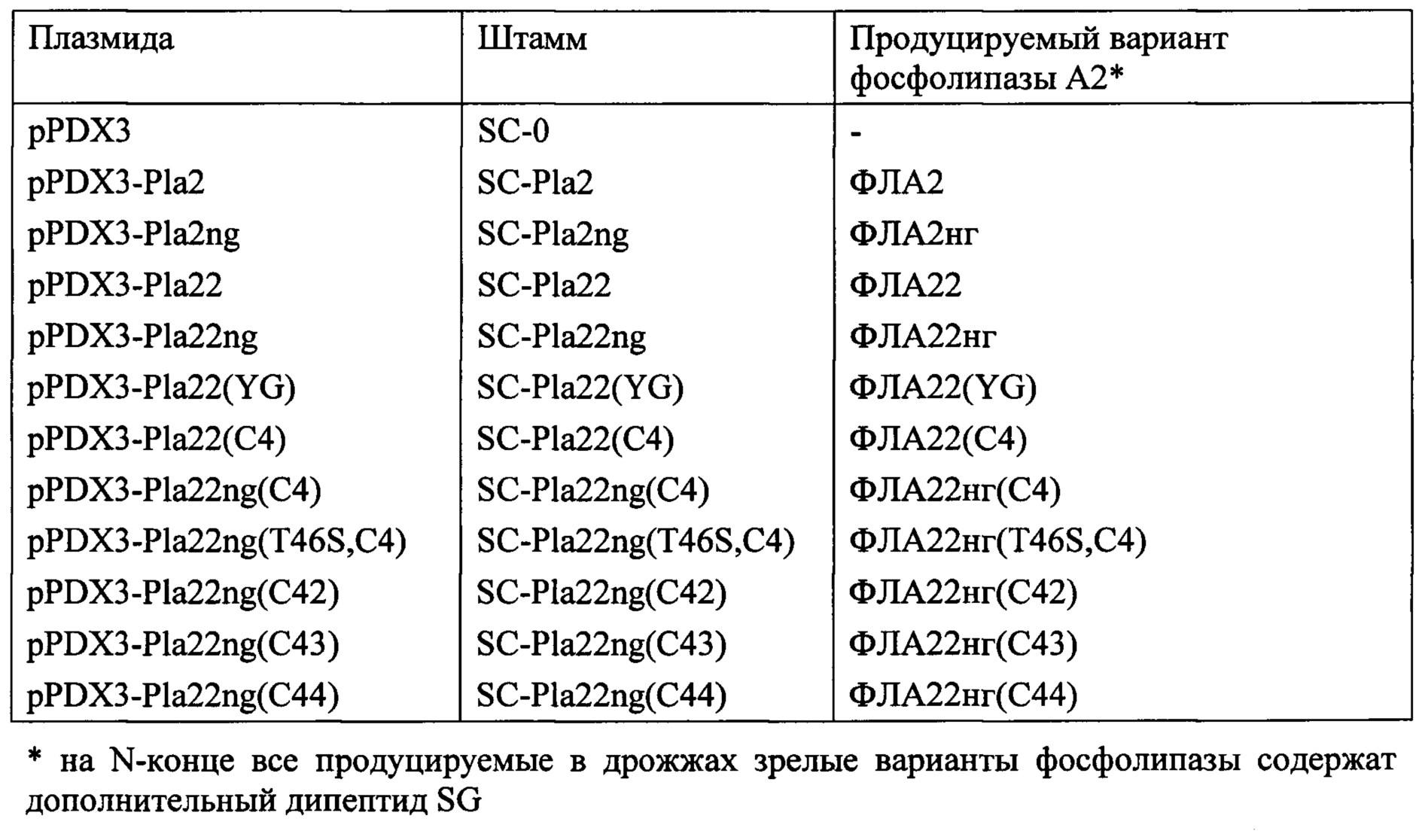
Полученные штаммы используют для биосинтеза соответствующих вариантов фосфолипазы А2 и их анализа.
Пример 13. Получение трансформированных штаммов дрожжей Komagataella kurtzmanii
Сконструированные плазмиды серии рРН727 (пример 11) используют для трансформации клеток лабораторного реципиентного штамма Y-727his4Δ [RU 2522479]. Процедуру трансформации осуществляют, как описано ранее [RU 2522479].
Перед трансформацией из состава сконструированных плазмид удаляют бактериальную (неинтегрируемую) часть. С этой целью ДНК плазмид обрабатывают эндонуклеазой рестрикции MluI. Одновременно с выщеплением бактериальной части осуществляют открывание концов плазмидных ДНК, гомологичных промоторным областям АОХ1, и тем самым направляют интеграцию линеаризованных плазмид в промоторную область АОХ1 генома дрожжей.
В результате трансформации получают следующие трансформированные штаммы:


Полученные штаммы используют для биосинтеза соответствующих вариантов фосфолипазы А2 и их анализа.
Пример 14. Культивирование трансформированных штаммов и получение образцов КЖ, содержащих различные варианты фосфолипазы А2
Трансформированные штаммы S. cerevisiae культивируют в колбах при температуре 20°С на ротационной качалке со скоростью 250 об/мин. Культивирование проводят в жидкой среде YPD следующего состава, в мас. %: бактопептон 2, дрожжевой экстракт 1, глюкоза 2, вода - остальное. Каждый штамм засевают в начальном титре 5×105-5×106 мл-1. Образцы для анализа отбирают через 69 часов роста культур. Конечная оптическая плотность культур составляет ОД600=40-45. Клетки дрожжей
Трансформированные штаммы K. kurtzmanii культивируют в колбах при температуре 20°С на ротационной качалке со скоростью 250 об/мин. Культивирование проводят в жидкой среде YPgM следующего состава (мас. %): пептон 2, дрожжевой экстракт 1, глицерин 0,5, метанол 0,5, вода - остальное. Каждый штамм засевают в начальном титре 5×105-5×106 мл-1. Культуры выращивают в течение 69 часов, через 24 и 48 часов после начала культивирования в колбы вносят раствор 50% метанола в количестве 1/100 от объема среды.
По истечении 69 часов роста клеточную биомассу штаммов S. cerevisiae и K. kurtzmanii отделяют от среды культивирования центрифугированием при 16000 g в течение 2 мин, используя пробирки на 1,5 мл, после чего осветленную культуральную жидкость переливают в чистые пробирки и хранят в холодильнике при температуре +4°С до начала анализа. В результате получают образцы культуральной жидкости трансформированных штаммов дрожжей S. cerevisiae и K. kurtzmanii, содержащие различные варианты фосфолипазы А2.
Пример 15. Анализ образцов КЖ, содержащих различные варианты фосфолипазы А2
а) электрофоретический анализ
Образцы для электрофоретического анализа уровня продукции ФЛА2 получают путем концентрирования белков культуральной жидкости дрожжей с использованием методики, описанной ранее [Козлов, Ягудин 2008].
Электрофоретический анализ белков культуральной жидкости дрожжей проводят в 15% полиакриламидном геле в денатурирующих восстанавливающих условиях по стандартной процедуре, например, с использованием системы Mini-PROTEAN Tetra Cell (#165-8000). Буферы, подготовка образцов, нанесение и проведение электрофореза делают согласно инструкции "BIO-RAD", прилагаемой к системе. В качестве маркеров используют смесь предокрашенных белков с известной молекулярной массой в диапазоне от 10 до 250 кДа ("Thermo Scientific™", PageRuler™ Plus Prestained Protein Ladder, #26620). Окрашивание геля раствором кумасси проводят при помощи набора фирмы "Thermo Scientific™" (Pierce™ Mini Gel Power Staining Kit, #22840) согласно прилагаемой инструкции.
б) оценка содержания целевого белка в образцах культуральной жидкости
Оценку проводят на основании данных денситометрического анализа полос, содержащих различные изоформы целевого белка, который выполняют с использованием электронных фотографий гелей и программного обеспечения (TotalLab Phoretix ID) согласно рекомендациям производителя. Содержание фосфолипазы в анализируемых образцах оценивают по сумме плотностей всех полос, относящихся к целевому белку. Для расчета удельной активности используют показатели содержания целевого белка в образце, выраженные в относительных условных единицах.
в) инструментальное измерение активности фосфолипаз в стандартных условиях (с использованием рН-титратора)
Активность вариантов фосфолипазы А2 в образцах культуральной жидкости дрожжей измеряют с использованием рН-титратора, например, модели Mettler Toledo DL50 Graphix. Субстратом служит соевый лецитин.
Готовят реакционную смесь следующего состава (мас. %): лецитин соевый 1; раствора 1М хлорид кальция 1; тритон Х-100 1; вода - остальное. Для приготовления этой смеси соевый лецитин смешивают с расчетным количеством воды, раствора кальция и тритона и полученную суспензию обрабатывают диспергатором (например, IKA Т18 digital Ultra Turrax) на максимальных оборотах в течение 2 минут. Полученную мелкодисперсную смесь отстаивают, дожидаясь выхода пузырьков воздуха, и используют в течение 8 часов.
Измерения активности проводят при температуре +37°С, рН-статирование осуществляют, фиксируя величину рН7,0, для титрования используют раствор 0,05М NaOH. Для получения калибровочной кривой используют калибровочные растворы «PLA2 Nagase» с известной активностью.
г) инструментальное измерение активности фосфолипаз в специальных условиях (с использованием яичного желтка)
Активность вариантов фосфолипазы А2 измеряют с использованием рН-метра, например, модели Mettler Toledo MP 220 рН Meter. Субстратом для измерения активности служит яичный желток, разбавленной в два раза деионизованной водой.
Реакционная смесь содержит 400 мкл субстрата и 20 мкл тестируемого образца, содержащего фосфолипазу А2. Инкубацию реакционной смеси проводят в микропробирках при постоянной температуре +37°С в термостате, например, TERMO 24 БИОКОМ. Используя рН-метр, фиксируют начальное значение кислотности реакционной смеси сразу после добавления образца культуральной жидкости дрожжей, содержащей фосфолипазу А2, и спустя 5, 10, 15 и 20 минут после начала реакции. Полученные значения ΔрН используют для вычисления средней величины скорости реакции ΔрН/мин. Активность фосфолипазы в образце культуральной жидкости вычисляют, сравнивая скорости реакции ΔрН /мин для опытного образца и для калибровочного раствора «PLA2 Nagase» с активностью 50 ед/мл.
Пример 16. Обобщение результатов анализа
Результаты сравнительного электрофоретического анализа секреции вариантов фосфолипазы А2 в клетках дрожжей S. cerevisiae и K. kurtzmanii и результаты анализа их удельной активности (Табл. 1) свидетельствуют о том, что:
• Инактивация сайтов N-гликозилирования и/или замена аминокислотного остатка серина на треонин (или обратно) в позиции 46 зрелого белка не являются существенными для изменения активности вариантов ФЛА2;
• Варианты ФЛА22 и ФЛА22нг имеют пренебрежимо низкий (неразличимый в условиях проведенного анализа) уровень экспрессии, в связи с чем дрожжевые продуценты этих вариантов не представляют практического интереса;
• Заявляемые варианты фосфолипазы А2 обладают высокой удельной активностью, примерно в 20 раз превышающей показатели активности вариантов ФЛА2 и ФЛА2нг (Табл. 1). При этом заявляемые варианты сохраняют такой же высокий уровень экспрессии, который характерен для ФЛА2 и ФЛА2нг (Табл. 1);
• Заявляемые удлиненные варианты фосфолипазы А2 проявляют высокую, сравнимую с контрольным препаратом «PLA2 Nagase» (Nagase Corporation), активность в обоих условиях, стандартных и специальных. Вариант ФЛА22(YG) проявляет высокую активность в стандартных условиях и обладает низкой активностью на яичном желтке. В это же время варианты ФЛА2 и ФЛА2нг обладают низкой активностью в стандартных условиях и не проявляют активности на яичном желтке.
• Аминокислотные замены аминокислотных остатков треонина и аргинина на N-конце дополнительного полипептида в составе удлиненных вариантов фосфолипазы А2 не приводят к снижению экспрессии или уменьшению удельной активности заявляемых вариантов фосфолипазы А2.

В число заявляемых вариантов фосфолипазы А2 входят N-гликозилируемые и негликозилируемые производные. Негликозилируемые производные содержат аминокислотные замены S31A, S82A и N108Q, инактивирующие все потенциальные сайты N-гликозилирования [Liu et al., 2015]. Все заявляемые варианты фосфолипазы А2 экспрессируются дрожжами, не проявляя in vivo в отношении клеток-хозяев неприемлемой токсической активности (не вызывая лизиса клеток). Это свидетельствует о том, что заявляемые варианты фосфолипазы А2 не проявляют неприемлемой активности в отношении фосфолипидов, находящихся в естественном биологическом окружении. В то же время заявляемые варианты фосфолипазы А2 проявляют активность в условиях in vitro при внесении в реакционную смесь ионов кальция. То есть, активация заявляемых вариантов фосфолипазы А2 достигается в результате изменения внутриклеточных условий на искусственные условия, пригодные для промышленности.
Список научно-технической информации
1. WO 2004/097012 (11-NOV-2004). Stringer М.А., Fatum Т.М., Patkar S.A. Phospholipase and method of producing it.
2. RU 2460795 (10.09.2012). Способ микробиологического синтеза секретируемого соматотропина человека и штамм дрожжей Saccharomyces cerevisiae - продуцент секретируемого соматотропина человека.
3. RU 2522479 (20.05.2014). Применение штамма дрожжей Komagataella pastoris в качестве реципиента для конструирования продуцентов целевого белка.
4. Бакланов К.В. Совершенствование технологии высококалорийных майонезов - М.: 2008, с. 23
5. Cesarini S. Moving towards a Competitive Fully Enzymatic Biodiesel Process / S. Cesarini, F.I.J. Pastor, P.M. Nielsen, P. Diaz. // Sustainability. - 2015. - V. 7 (6). - P. 7884-7903. doi: 10.3390/su7067884
6. De Maria L., Vind J.,  K. M., Svendsen A., Patkar S. (2007). Phospholipases and their industrial applications. Appl Microbiol Biotechnol, 74: 290-300. DOI 10.1007/s00253-006-0775-x
K. M., Svendsen A., Patkar S. (2007). Phospholipases and their industrial applications. Appl Microbiol Biotechnol, 74: 290-300. DOI 10.1007/s00253-006-0775-x
7. GRAS (2006) http://wayback.archive-it.Org/7993/20171031055659/https://www.fda.gov/ downloads/Food/IngredientsPackagingLabeling/GRAS/Noticelnventory/UCM263914.pdf
8. Hoogevest P., Wendel A. (2014). The use of natural and synthetic phospholipids as pharmaceutical excipients. Eur J Lipid Sci Technol., 116(9): 1088-1107. doi: 10.1002/ejlt.201400219.
9. Kazachenko K.Yu., Efremov B.D., Kozlov D.G. (2014). Activities of elements of the yeast α-factor precursor leader at different stages of somatropin secretion by Saccharomyces cerevisiae. Applied Biochemistry and Microbiology, 50(9): 829-834.
10. Lefkowitz L.J., Deems R.A., Dennis E.A. (1999). Expression of Group IA Phospholipase A2 in Pichia pastoris: Identification of a Phosphatidylcholine Activator Site Using Site-Directed Mutagenesis. Biochemistry, 38, 14174-14184.
11. Li J., Wang X., Zhang Т., Wang C., Huang Z., Luo X., Deng Y. (2015). A review on phospholipids and their main applications in drug delivery systems. Asian journal of pharmaceutical sciences, 10: 81-98.
12. Liu A., Yu X.-W., Sha C., Xu Y. (2015). Streptomyces violaceoruber phospholipase A2: expression in Pichia pastoris, properties, and application in oil degumming. Appl Biochem Biotechnol, 175(6): 3195-3206. DOI 10.1007/s12010-015-1492-7
13. Naumov G.I., Naumova E.S., Tyurin O.V., Kozlov D.G. (2013) Komagataella kurtzmanii sp. nov., a new sibling species of Komagataella (Pichia) pastoris b ased on multigene sequence analysis. Antonie van Leemvenhoek, 104: 339-347.
14.  , A. and Dennis, E.A. (1982) Acyl and phosphoryl migration in lysophospholipids: importance in phospholipids synthesis and phospholipase activity, Biochemistry, 21: 1743-1750.
, A. and Dennis, E.A. (1982) Acyl and phosphoryl migration in lysophospholipids: importance in phospholipids synthesis and phospholipase activity, Biochemistry, 21: 1743-1750.
15. Sugiyama M., Ohtan K., Izuhara M., Koike Т., Suzuki K., Imamura S., Misaki H. (2002). A Novel Prokaryotic Phospholipase A2. Characterization, gene cloning, and solution structure. The Journal of Biological Chemistry, 277(22): 20051-20058.
16. USD A. National Nutrient Database for Standard Reference Legacy Release https://ndb.nal.usda.gov/ndb/foods/show/01125?n1=%7BQv%3D1%7D&fgcd=&man=&lfacet=&count=&max=25&sort=default&qlookup=Egg+yolk&offset=&format=Stets&new=&measureby=&ds=&qt=&qp=&qa=&qn=&q=&ing=
17. Valero F. (2012). Heterologous expression systems for lipases: A review. In Lipases and Phospholipases: Methods and Protocols, Methods in Molecular Biology; Sandoval, G., Ed.; Springer Science Business Media: New York, NY, USA, 2012; Volume 861, pp. 161-178.