Результат интеллектуальной деятельности: МОДИФИЦИРОВАННЫЙ ГЕН tsA, КОДИРУЮЩИЙ ТЕРМОСТАБИЛЬНУЮ L-АСПАРАГИНАЗУ ИЗ АРХЕИ THERMOCOCCUS SIBIRICUS, РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ L-АСПАРАГИНАЗЫ И СПОСОБ ОЧИСТКИ ЭТОГО ФЕРМЕНТА
Вид РИД
Изобретение
Область техники
Изобретение относится к биотехнологии, в частности к генетической инженерии, и касается получения рекомбинантного штамма Escherichia coli - продуцента L- аспарагиназы Thermococcus sibiricus путем введения в штамм-реципиент модифицированного гена tsA_mod в составе рекомбинантной плазмидной ДНК. Предлагается новая термостабильная L-аспарагиназа и способ ее очистки.
L-аспарагиназа (L-АСП) является одним из важнейших для биотехнологии ферментов [1]. L-АСП (L-аспарагин-амидогидролаза, КФ 3.5.1.1) катализирует гидролиз амидной группы боковой цепи L-аспарагина с образованием L-аспарагиновой кислоты и аммиака [2]. Это первый для клинической онкогематологии бактериальный фермент со специфическим действием на опухолевые клетки. Он является одним из основных препаратов комбинированной химиотерапии острого лимфобластного лейкоза на протяжении более 40 лет [3,4]. Также имеются данные об эффективности фермента при лимфосаркоме, лимфогранулематозе, остром миелоидном лейкозе, ретикулосаркоме, солидных и ряде других видов опухолей [5-15].
Помимо биомедицинского применения в настоящее время проводятся исследования по введению L-АСП в технологии пищевых производств для снижения уровня акриламида, потенциально канцерогенного и нейротоксического вещества [16,17]. Акриламид образуется в пищевых продуктах в процессе взаимодействия L аспарагина с редуцирующими сахарами в реакции Майяра [18]. Поскольку образование акриламида протекает преимущественно в условиях высокой температуры (как правило, выше 120°C) и низкой влажности из сырья с высоким содержанием углеводов, то он содержится в пищевых продуктах, полученных в результате жарки, выпечки, запекания, обжаривания или приготовления на гриле [18]. Обработка L-АСП выступает одним из способов снижения уровня L-аспарагина, следовательно, акриламида в пищевых продуктах при сохранении их органолептических характеристик [16,19-22].
Еще одним направлением применения L-АСП является создание на ее основе биосенсоров для диагностических целей и мониторинга содержания уровня L-аспарагина в пищевых продуктах [23-28].
Особенностью перечисленных областей биотехнологического использования L-АСП являются повышенные требования к стабильности и активности фермента.
Предшествующий уровень техники
Известные и применяемые на данный момент L-АСП выделены из мезофильных микроорганизмов и имеют ряд недостатков. Биомедицинское использование представленных на рынке препаратов L-АСП не лишено проблем, связанных с побочными эффектами. К ним относятся аллергические реакции, гепатотоксичность, нефротоксичность, диабет, тромбозы, осложнения со стороны ЦНС и др. [15,29-33]. Применение доступных L-АСП в качестве добавки на пищевых производствах ограничено их невысокой активностью, недостаточной стабильностью при высоких температурах и низких значениях рН [34].
Известно, что L-АСП широко распространены в природе и характеризуются варьированием структурно-функциональных и биохимических свойств, что определяет непрерывный поиск новых источников перспективных L-АСП. Среди различных микроорганизмов особый интерес представляют экстремофилы, выступающие естественным источником многих высокостабильных ферментов с широкими перспективами применения в биотехнологии [35,36]. Поскольку проблема стабильности, активности мезофильных L-АСП является одной из ключевых, развивается направление исследования L-АСП экстремофильного происхождения.
Исследования рекомбинантных L-АСП гипертермофилов рода Pyrococcus и Thermococcus показали, что данные ферменты при температурном оптимуме выше 85°С обладают уникальными свойствами - высокой энзиматической активностью, стабильностью в широком диапазоне температур, рН, в присутствии солей и денатурирующих условиях, что расширяет возможности их применения в пищевой промышленности и диагностике, а также биотерапии [37-39]. Они имеют неоспоримые преимущества перед известными на данный момент препаратами при применении в пищевых высокотемпературных технологиях. Повышенная стабильность этих L-АСП позволяет компенсировать потерю активности в неоптимальных, физиологических условиях и конкурировать с L-АСП мезофильных микроорганизмов в биомедицине [39,40]. Важным для биотерапии является также то, что повышение стабильности фермента способствует улучшению его фармакокинетических свойств - увеличению продолжительности циркуляции в крови, снижению кратности дозирования и вероятности развития аллергических проявлений.
К настоящему времени биохимически охарактеризовано несколько L-АСП, гипертермофильных архей Pyrococcus и Thermococcus sp.: Pyrococcus furiosus [41], Pyrococcus yayanosii CH1 [37], Thermococcus kodakaraensis [39,42,43], Thermococcus zilligii [44], Thermococcus gammatolerans [45]. Данные нативные L-АСП гипертермофильных архей превосходят по характеристикам улучшенные варианты мезофильных L-АСП с повышенной термостабильностью, разработанные для пищевых производств и описанные в патентах:
- мутантные формы L-АСП Aspergillus oryzae - их остаточная активность при инкубации в течение 20 минут при 66°С не превышает 72% [46];
- мутантные формы L-АСП Aspergillus oryzae и Aspergillus niger - термостабильные мутантные варианты характеризуются снижением активности в 2 и более раз при повышенной температуре 70°С в сравнении с активностью при температурном оптимуме 50°С [47];
- в качестве источника термостабильной L-АСП для биотехнологии в патенте KR101777904B1 описан штамм Bacillus methylotrophicus MKSY2013, однако выводы о термостабильности данной L-АСП в диапазоне температур 60-95°С в течение 30 минут сделаны на основании оценки свойств не очищенного белка, а супернатанта [48].
В то же время нативные L-АСП гипертермофильных архей при оптимуме 85-95°С способны сохранять активность в интервале температур 70-90°С до 32 часов [43]. Их термостабильность сочетается также с повышенной устойчивостью в широком диапазоне рН, в денатурирующих условиях, в присутствии в средах ионов металлов [49].
Поскольку L-АСП Pyrococcus sp.проявляют более низкую энзиматическую активность в сравнении с L-АСП Thermococcus sp.: L-АСП Pyrococcus sp.- 550÷1483.8 МЕ/мг [37,41]; L-АСП Thermococcus sp.- 2164÷7622 МЕ/мг [39,44,45] (активность для L-АСП мезофильных микроорганизмов - 50-450 МЕ/мг), - L-АСП Thermococcus sp. являются наиболее перспективными с биотехнологической точки зрения.
Настоящее изобретение касается создания эффективной системы гетерологической экспрессии новой L-АСП из гипертермофильной археи Thermococcus sibiricus, выделенной из пластовых вод высокотемпературного нефтяного месторождения в Западной Сибири при температуре 84°C [50], разработки способа очистки, а также характеристики фермента для биотехнологического применения.
Раскрытие изобретения
Задача заявляемой группы изобретений - получение очищенных препаратов новой термостабильной L-АСП из T. sibiricus (TsA) для биотехнологического применения путем создания эффективной системы гетерологической экспрессии в клетках мезофильной бактерии Escherichia coli.
Задача решена путем:
- конструирования модифицированного гена tsA_mod, кодирующего L-АСП из T. sibiricus, имеющего нуклеотидную последовательность SEQ ID NO 1, с учетом соответствия требованиям эффективной экспрессии в клетках E.coli,
- конструирования рекомбинантного штамма E.coli BL21(DE3)/pMЕ2020 - продуцента термостабильной L-АСП из T. sibiricus, полученного путем введения заявляемого модифицированного гена tsA_mod в составе вектора pMЕ2020 в штамм-реципиент E.coli BL21(DE3);
- разработки способа очистки TsA, полученной при экспрессии в рекомбинантном штамме E.coli BL21(DE3)/pMЕ2020 нуклеотидной последовательности SEQ ID NO 1;
- характеристики новой термостабильной L-АСП из T. sibiricus для биотехнологического применения.
Для этого:
а) в источнике новой перспективной для биотехнологии L-АСП - гипертермофильной археи T. sibiricus с ранее аннотированной геномной последовательностью GenBank NC_012883 [51,52] - идентифицирован предполагаемый ген TSIB_RS08165 (tsA_wt), кодирующий L-АСП T. sibiricus (TsA) с номером доступа последовательности в GenBank WP_015849943.1. Нуклеотидная последовательность указанного гена представлена в SEQ ID NO: 3. tsA_wt кодирует белок, состоящий из 331 аминокислоты - SEQ ID NO2;
б) проведен анализ природной кодирующей последовательности tsA_wt с учетом соответствия требованиям эффективной экспрессии в клетках E.coli (индекс кодоновой адаптации, GC-состав);
в) осуществлено проектирование оптимизированного гена tsA_mod SEQ ID NO 1 с помощью оригинальных алгоритмов «TWIST Bioscience» (США). В результате оптимизации индекс адаптации кодонов достиг значения 0.72, близкого к желательному >0.8. После модификации кодонов для финальной оптимизированной нуклеотидной последовательности фиксировали изменение GC содержания с 38.5 до 50.18%;
г) получена синтетическая последовательность tsA_mod;
д) сконструирована рекомбинантная плазмида pMЕ2020, полученная путем введения модифицированного гена tsA_mod в вектор экспрессии pET-28a(+);
е) в результате трансформации плазмидой pMЕ2020 клеток реципиентного штамма Е. соli BL21(DE3) получен рекомбинантный штамм E.coli BL21(DE3)/pMЕ2020, который при культивировании обеспечивает высокий выход активного целевого белка;
ж) разработана схема очистки рекомбинантной L-АСП из T. sibiricus. В ходе выделения и очистки TsA из клеток штамма-продуцента методом ионообменной хроматографии получен белок со степенью очистки 4.1;
з) проведена функциональная характеристика очищенного заявленным способом фермента. Результаты изучения биохимических, кинетических характеристик показали, что L-АСП T. sibiricus сочетает высокую специфическую активность, низкую нежелательную глутаминазную активность, высокую термостабильность, устойчивость к химической денатурации, присутствию в среде ионов металлов, что позволяет сделать вывод о перспективности фермента для применения в биомедицине и пищевой промышленности.
Промышленная применимость
Стабильная L-аспарагиназа из гипертермофильной археи Thermococcus sibiricus с высоким значением температурного оптимума 90°С может быть использована в биомедицине как противоопухолевый агент, в высокотемпературных процессах в пищевой промышленности для снижения уровня акриламида.
Краткое описание чертежей, иллюстрирующих заявляемую группу изобретений
Заявляемая группа изобретений проиллюстрирована следующими фигурами.
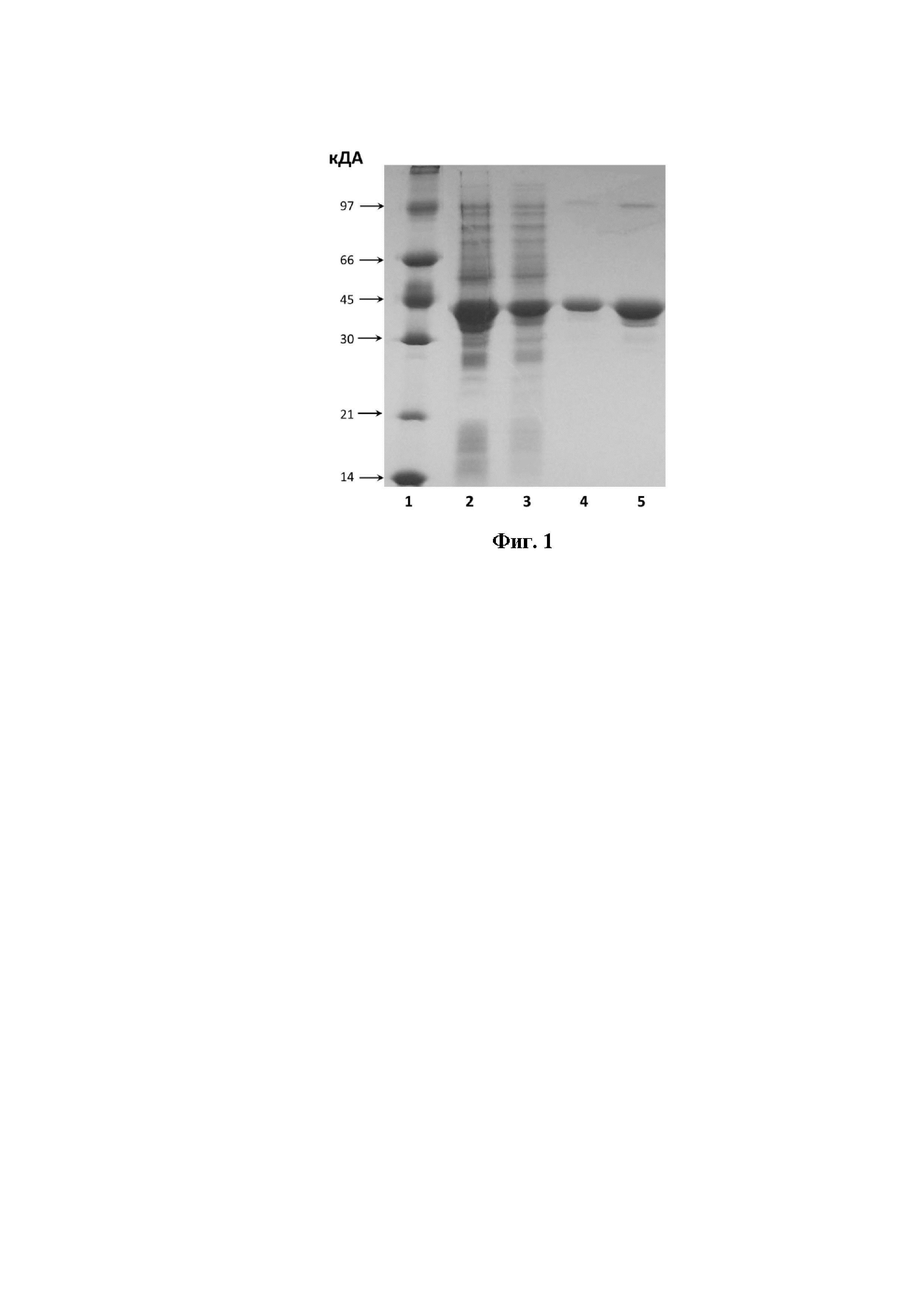
Фиг. 1. Экспрессия TsA в клетках E.coli и очистка белка.
Приведены результаты электрофоретического анализа белковых препаратов:
1 - маркер молекулярного веса белков,
2, 3 - TsA в бесклеточном гомогенате в концентрации 100 и 20 мкг соответственно,
4, 5 - образцы очищенного TsA в концентрациях 2 и 10 мкг соответственно.
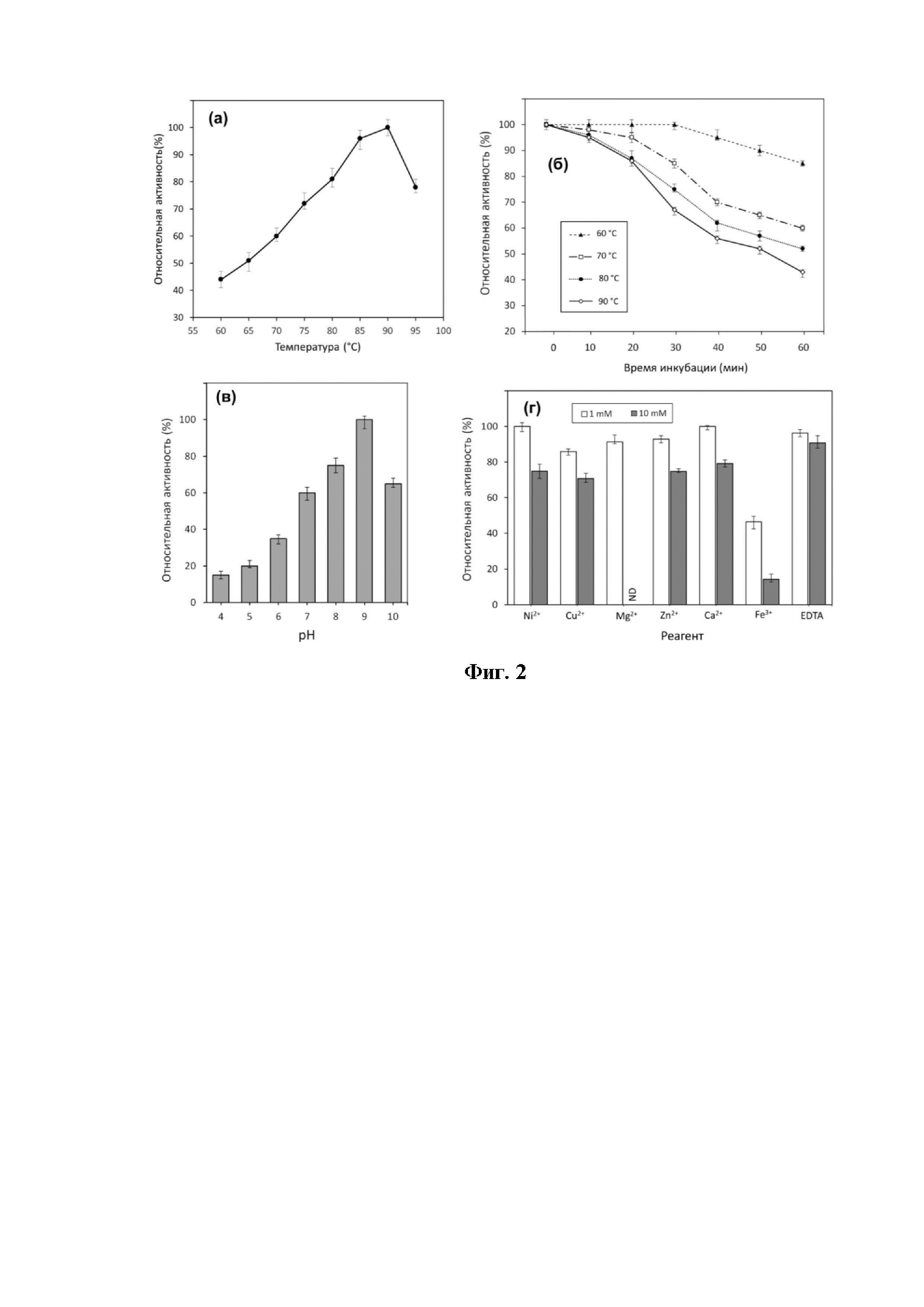
Фиг. 2. Исследование влияния на активность рекомбинантной L-аспарагиназы TsА температуры, рН, ионов металлов:
(а) - влияние температуры на активность и (б) стабильность TsА. Стабильность выражена как остаточная активность (%) при инкубации длительностью 0-60 мин,
(в) влияние рН и (г) ионов металлов на каталитическую активность TsА, где ND - неопределенное значение.
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовались хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [53].
Пример 1. Идентификация гена L-аспарагиназы в геноме термофильной археи Т. sibiricus
В качестве источника новой перспективной для биотехнологии L-АСП была выбрана гипертермофильная архея T. sibiricus с ранее аннотированной геномной последовательностью GenBank NC_012883 [51,52]. На основании геномных данных был идентифицирован предполагаемый ген TSIB_RS08165 (tsA_wt), кодирующий L-АСП T. sibiricus (TsA) с номером доступа последовательности в GenBank WP_015849943.1. Нуклеотидная последовательность указанного гена представлена в SEQ ID NO: 3.
Анализ аминокислотной последовательности TsA (331 а.о.), приведенной в SEQ ID NO: 2, выявил гомологию с L-АСП архей Thermococcus sp.и Pyrococcus sp.: Thermococcus litoralis (GenBank WP_004066133) - 77%, Thermococcus zilligii (GenBank WP_010478656) - 62%, Thermococcus gammatolerans (GenBank WP_015859055) - 61%, Thermococcus kodakarensis (WP_011250607) - 63% [39,42], Pyrococcus yayanosii (GenBank WP_013906452) - 62%, Pyrococcus furiosus (GenBank WP_011013191), Pyrococcus horikoshii (GenBank WP_010884185) - 56%.
Сравнение аминокислотных последовательностей L-АСП архей Thermococcus sp.и Pyrococcus sp.показало, что все они, включая TsA, содержат высококонсервативные аминокислотные остатки, ключевые для их каталитической активности [42,54,55]. В кристаллографических исследованиях L-АСП P. horikoshii было выявлено 8 аминокислотных остатков Thr11, Tyr21, Ser52, Thr53, Thr83, Asp84, Lys154 и Lys274, играющих определяющую роль в обеспечении каталитической активности термофильного фермента. Для TsA идентифицированы все указанные выше высококонсервативные аминокислотные остатки за исключением Lys274, который заменен на глутаминовую кислоту. Аналогичная точечная мутация выявляется в последовательностях L-АСП других термококков. Анализ последовательности новой L-АСП из T. sibiricus подтверждает, что замена Lys274Glu является характерной для всех L-АСП I типа у архей Thermococcus sp.
Пример 2. Создание модифицированного варианта гена, кодирующего TsA, и конструирование плазмиды для высокоэффективной гетерологичной экспрессии белка в клетках мезофильной бактерии E.coli
Для преодоления проблем низкой экспрессии архебактериальных генов в клетках мезофильной бактерии E.coli на основании анализа природной кодирующей последовательности tsA_wt (SEQ ID NO: 3) с учетом соответствия требованиям эффективной экспрессии в клетках E.coli (индекс кодоновой адаптации, GC-состав и пр.) было осуществлено проектирование оптимизированного синтетического гена tsA_mod (SEQ ID NO: 1) с помощью оригинальных алгоритмов компании «TWIST Bioscience» (США). В результате оптимизации индекс адаптации кодонов достиг значения 0.72, близкого к желательному >0.8. После модификации кодонов для финальной оптимизированной нуклеотидной последовательности фиксировали изменение GC содержания с 38.5 до 50.18%.
Экспрессионный вектор конструировали на базе коммерческой плазмиды pET-28а(+) («Novagen», США). Модифицированная последовательность гена tsA_mod (SEQ ID NO: 1) с оптимизированным для экспрессии в E.coli кодоновым составом (номер доступа в GenBank MW981255) для клонирования в вектор pET-28а(+) под контроль промотора гена 10 фага Т7 была предварительно синтезирована компанией «TWIST Bioscience» (США). Кодирующую последовательность tsA_mod, фланкированную сайтами рестрикции NheI/SalI, гидролизовали и встраивали в гидролизованный по сайтам NheI/SalI вектор pET-28а(+). Результирующий вектор был обозначен pMЕ2020.
Пример 3. Получение заявляемого штамма-продуцента термостабильной L-АСП TsA
Гетерологическую экспрессию экстремофильной L-АСП из T. sibiricus проводили в клетках мезофильной бактерии E.coli BL21(DE3) под контролем промотора гена 10 фага T7 в составе вектора pMЕ2020.
Для этого полученной рекомбинантной плазмидной ДНК pMЕ2020 с использованием стандартных методов проводили трансформацию реципиентного штамма E.coli BL21(DE3) [F-, ompT, hsdSB (rB-, mB-), dcm, gal, ((DE3). Выбор этого штамма в качестве реципиента для продукции TsA обусловлен тем, что он синтезирует РНК-полимеразу фага Т7, а также обладает сниженной протеазной активностью, что способствует повышению выхода целевых белков.
В результате трансформации был получен рекомбинантный штамм E.coli BL21(DE3)/pMЕ2020.
Пример 4. Экспрессия, выделение и очистка фермента
Рекомбинантный штамм E.coli BL21(DE3)/pMЕ2020 культивировали в LB среде с добавлением канамицина 0.05 мг/мл при 37°C. Индуктор (лактозу) добавляли в среду при OD600=1.9 до конечной концентрации 0.2%. Клеточную биомассу собирали через 17-20 ч после индукции центрифугированием при 4000g, 15 мин.
Все стадии выделения и очистки TsA проводили при 4С.3 г биомассы ресуспендировали в буфере А (20 мМ Na-фосфатный буфер рН 7.2, 1 мМ глицин, 1 мМ ЭДTA), далее проводили ультразвуковую обработку суспензии клеток [56] и удаление дебриса центрифугированием (35000g, 30 мин). Очистка фермента из клеток штамма-продуцента включала стадию ионообменной хроматографии на колонках с SP-Sepharose. Фермент элюировали линейным градиентом концентрации NaCl (0-1.0 М). Фракции, содержавшие L-АСП (зона элюции - 0.46-0.70 М NaCl), концентрировали в ячейке Amicon («Millipore», США). Препараты хранили при -20°C.
Концентрацию белка определяли методом Sedmak [57], используя в качестве стандарта бычий сывороточный альбумин. Чистоту белка и его молекулярную массу определяли при помощи ДСН-ПААГ-электрофореза (Фиг.1).
Показано, что экспрессия tsA_mod в составе вектора pMЕ2020 в клетках рекомбинантного штамма E.coli BL21(DE3)/pMЕ2020) обеспечивает высокий выход активного целевого белка. В ходе выделения и очистки TsA из клеток штамма-продуцента методом ионообменной хроматографии был получен белок со степенью очистки 4.1 (таблица 1, Фиг. 1).
|
По результатам ДСН-ПААГ-электрофореза молекулярная масса белка составила 37.5 кДа, что близко к теоретически рассчитанному значению 36.6 кДа (Фиг.1).
Пример 5. Исследование энзиматической активности, субстратной специфичности и кинетических характеристик TsA
При определении ферментативной активности L-АСП T. sibiricus за 1 единицу активности принимали количество фермента, катализирующее высвобождение 1 мкМ аммиака в минуту при экспериментальных условиях.
Реакции проводили при 90°C в 0.05 М трис-HCl буфере, рН 9.0. Количество образовавшегося аммиака определяли методом прямой несслеризации [58,59].
L-глутаминазную активность определяли аналогичным образом, используя в качестве субстрата L-глутамин.
Удельную активность выражали в ME/мг белка.
Определение кинетических параметров фермента проводили в 0.05 М трис-HCl буфере рН 9.0, содержащем 20-250 мкМ L-аспарагина, при 90°C. Обработку полученных данных и расчет KМ и Vmax проводили с использованием метода Лайнуивера-Берка [56].
Анализ субстратной специфичности рекомбинантной L-АСП выявил высокую активность TsA при гидролизе L-аспарагина - 2164.0 МЕ/мг.При этом фермент также проявлял незначительную способность к гидролизу L-глутамина, не превышающую 7% от таковой для L-аспарагина.
Кинетические константы при использовании в качестве субстрата L-аспарагина для TsA составили: Vmax 1200 мкМ/мин, Kм 2.8 мМ.
Пример 6. Исследование влияния температуры и рН на ферментативную активность TsA
Специфическую активность очищенной L-АСП определяли при различной температуре и рН.
Температурный оптимум активности TsA определяли в инкубационной смеси в 0.05 М трис-HCl буфере (рН 9.0) в диапазоне температур 60-95°С с шагом 5°С.
Термическую стабильность L-АСП T. sibiricus оценивали по остаточной ферментативной активности при инкубации при температурах 60-90°С с шагом 10°С в 0.05 М трис-HCl буфере (рН 9.0).
Влияние рН на активность фермента изучали при температуре 90°С в различных буферных системах: 0.05 М Na-ацетатной (pH 4.0-6.0), 0.05 М Na-фосфатной (рН 6.0-7.0), 0.05 М трис-HCl (рН 7.0-9.0), 0.05 М глицин-NaOH (рН 9.0-10.0).
В исследовании влияния температуры на активность TsA установлено, что L-АСП T. sibiricus при оптимуме 90°C сохраняет высокую активность в широком диапазоне температур (Фиг. 2а).
При исследования термостабильности фермента (Фиг. 2б) показано, что TsA стабильна при температуре 90°C, сохраняя 86% от первоначальной активности при длительности инкубации 20 минут. При 60-минутной инкубации фермента при 60°C его активность превышала 80%.
При изучении зависимости активности L-АСП T. sibiricus от рН среды в различных буферных системах в диапазоне значений рН 4.0÷10.0 (Фиг. 2в) установлено, что оптимум активности фермента наблюдается при рН 9.0, при этом высокая активность L-АСП сохраняется также в интервале рН 7.0÷10.0 независимо от буферной системы (Фиг. 2в).
Пример 7. Изучение химической стабильности TsА и устойчивости в присутствии ионов металлов
Химическую денатурацию изучали при инкубации фермента в течение 1 ч при концентрации мочевины 0-8 М в 0.05 М трис-HCl буфере (рН 9.0). За 100% принимали активность фермента при 90°С в отсутствии мочевины. Измеренную активность фермента сопоставляли с таковой без добавления мочевины в данных экспериментальных условиях.
Активность TsA определяли при добавлении ионов металлов (Ni2+, Cu2+, Mg2+, Zn2+, Ca2+, Fe3+), а также ЭДТА. Все вещества (NiCl2, CuSO4, MgCl2, ZnCl2, CaCl2, FeCl3 и ЭДТА) добавляли в концентрации 1.0 либо 10.0 мМ. Ферментативную активность определяли при температуре 90°С и рН 9.0 при добавлении L-аспарагина и соответствующих ионов металлов либо ЭДТА в трех повторностях. Полученные значения выражали в % от активности фермента без добавления катионов металлов, которую принимали за 100%.
Установлено, что рекомбинантная L-АСП T. sibiricus проявляет высокую устойчивость к химической денатурации. Мочевина до концентрации 6 М не приводит к значимому снижению активности фермента.
Исследование влияния ионов металлов и ЭДTA показало значимое снижение активности TsA только при добавлении ионов Fe3+в концентрации 1 мМ/л и 10 мМ/л, при этом большинство ионов металлов - Ni2+, Cu2+, Mg2+, Zn2+, Ca2+, ЭДТА (1 мМ/л и 10 мМ/л) - не оказывают значимого ингибирующего эффекта на активность фермента (Фиг. 2г).
Таким образом, получен модифицированный ген tsA_mod, кодирующий новую термостабильную L-АСП из археи T. sibiricus, для эффективной гетерологической экспрессии фермента в клетках мезофильной бактерии Escherichia coli. Сконструированный штамм-продуцент Escherichia coli BL21(DE3)/pMЕ2020 обеспечивает высокий выход активного целевого белка посредством экспрессии разработанного варианта гена в составе плазмиды pMЕ2020. Разработанный способ очистки рекомбинантной L-АСП позволяет получить белок со степенью очистки 4.1 с высокой удельной активностью 2164 МЕ/мг.
Результаты изучения биохимических, кинетических характеристик показали, что L-АСП T. sibiricus, обладая высокой специфической активностью 2164 МЕ/мг, низкой нежелательной глутаминазной активностью (не более 7%), высокой термостабильностью, устойчивостью к химической денатурации, присутствию в среде ионов металлов, является перспективной для применения в биомедицине и пищевой промышленности.
Список использованной информации
1. Dumina, M.V.; Eldarov, M.A.; Zdanov, D.D.; Sokolov, N.N. L-Asparaginases of Extremophilic Microorganisms in Biomedicine. Biochem. Suppl. Ser. B Biomed. Chem. 2020, 14, doi:10.1134/S1990750820040046.
2. Oettgen HF; Old LJ; Boyse EA Inhibition of leukemias in man by L-asparaginase. Cancer Res. 1967, 27, 2619-2631.
3. Solomon, B.; Parihar, N.; Ayodele, L.; Hughes, M. Global incidence and prevalence of acute lymphoblastic leukemia: A 10-year forecast. J Blood Disord Transfus 2017, 8, 24, doi:10.4172/2155-9864-C1-028.
4. Brumano, L.P.; da Silva, F.V.S.; Costa-Silva, T.A.; Apolinario, A.C.; Santos, J.H.P.M.; Kleingesinds, E.K.; Monteiro, G.; Rangel-Yagui, C. de O.; Benyahia, B.; Junior, A.P. Development of L-Asparaginase Biobetters: Current Research Status and Review of the Desirable Quality Profiles. Front. Bioeng. Biotechnol. 2018, 6, 1-22, doi:10.3389/fbioe.2018.00212.
5. Avramis, V.I.; Tiwari, P.N. Asparaginase (native ASNase or pegylated ASNase) in the treatment of acute lymphoblastic leukemia. Int. J. Nanomedicine 2006, 1, 241-254.
6. Verma, N.; Kumar, K.; Kaur, G.; Anand, S. L-asparaginase: A promising chemotherapeutic agent. Crit. Rev. Biotechnol. 2007, 27, 45-62, doi:10.1080/07388550601173926.
7. Abakumova, O.Y.; Podobed, O. V.; Karalkin, P.A.; Kondakova, L.I.; Sokolov, N.N. Antitumor activity of L-asparaginase from Erwinia carotovora against different human and animal leukemic and solid tumor cell lines. Biochem. Suppl. Ser. B Biomed. Chem. 2012, doi:10.1134/s1990750812040026.
8. Kumar, K.; Kaur, J.; Walia, S.; Pathak, T.; Aggarwal, D. L-asparaginase: An effective agent in the treatment of acute lymphoblastic leukemia. Leuk. Lymphoma 2014, 55, 256-262, doi:10.3109/10428194.2013.803224.
9. Абакумова О. Ю.; Подобед О. В.; Каралкин П.А.; Кондакова Л.И.; Соколов Н.Н. Противоопухолевая активность L-аспарагиназы Erwinia carotovora для клеток различных лейкемий человека и солидных опухолей человека и животных. Биомедицинская химия 2013, 59, 498-513.
10. Соколов Н.Н.; Эльдаров М.А.; Покровская М.В.; Александрова С.С.; Абакумова О.Ю.; Подобед О.В.; Мелик-Нубаров Н.С.; Кудряшова Е.В.; Гришин Д.В.; Арчаков А.И. Бактериальные рекомбинантные l-аспарагиназы: свойства, строение и антипролиферативная активность. Биомедицинская химия 2015, 61, 312-324.
11. Avramis, V.I. Is glutamine depletion needed in ALL disease? Blood 2014, 123, 3532-3533, doi:10.1182/blood-2014-04-565523.
12. Matsumoto, Y.; Nomura, K.; Kanda-Akano, Y.; Fujita, Y.; Nakao, M.; Ueda, K.; Horiike, S.; Yokota, S.; Kusuzaki, K.; Kitoh, T.; et al. Successful treatment with Erwinia L-asparaginase for recurrent natural killer/T cell lymphoma. Leuk. Lymphoma 2003, 44, 879-882, doi:10.1080/1042819031000067873.
13. Müller, H.J.; Boos, J. Use of L-asparaginase in childhood ALL. Crit. Rev. Oncol. Hematol. 1998, 28, 97-113., doi:10.1016/S1040-8428(98)00015-8.
14. Hill, J.M.; Roberts, J.; Loeb, E.; Khan, A.; Maclellan, A.; Hill, R.W. L-Asparaginase Therapy for Leukemia and Other Malignant Neoplasms: Remission in Human Leukemia. JAMA J. Am. Med. Assoc. 1967, 202, doi:10.1001/jama.1967.03130220070012.
15. Duval, M.; Suciu, S.; Ferster, A.; Rialland, X.; Nelken, B.; Lutz, P.; Benoit, Y.; Robert, A.; Manel, A.M.; Vilmer, E.; et al. Comparison of Escherichia coli-asparaginase with Erwinia-asparaginase in the treatment of childhood lymphoid malignancies: Results of a randomized European Organisation for Research and Treatment of Cancer - Children’s Leukemia Group phase 3 trial. Blood 2002, doi:10.1182/blood.V99.8.2734.
16. Baskar G; Subanjalin Joy S; Aiswarya R Optimization of enzymatic pretreatment and frying conditions for acrylamide mitigation in fried tapioca chips. Int. J. Mod. Sci. Technol. 2016, 6, 224-229.
17. Aiswarya, R.; Baskar, G. Enzymatic mitigation of acrylamide in fried potato chips using asparaginase from Aspergillus terreus. Int. J. Food Sci. Technol. 2018, doi:10.1111/ijfs.13608.
18. Baskar, G.; Aiswarya, R. Overview on mitigation of acrylamide in starchy fried and baked foods. J. Sci. Food Agric. 2018.
19. Gurunathan, B.; Sahadevan, R. Production of L-asparaginase from Natural Substrates by<em>Aspergillus terreus</em>MTCC 1782: Optimization of Carbon Source and Operating Conditions. Int. J. Chem. React. Eng. 2011, doi:10.2202/1542-6580.2479.
20. Abboudi, M.; Al-Bachir, M.; Koudsi, Y.; Jouhara, H. Combined Effects of Gamma Irradiation and Blanching Process on Acrylamide Content in Fried Potato Strips. Int. J. Food Prop.2016, doi:10.1080/10942912.2014.968790.
21. Acrylamide Reduction in Potato Crisps using: Asparaginase from Candida utilis, Commercial Asparaginase, Salt Immersion, and pH Treatment. Int. J. Eng. 2016, doi:10.5829/idosi.ije.2016.29.07a.01.
22. Enhancement of L-asparaginase Production by Candida utilis in a 13 L Fermenter and its Purification. Int. J. Eng. 2015, doi:10.5829/idosi.ije.2015.28.08b.04.
23. Verma, N.; Bansal, M.; Kumar, S. Whole cell based miniaturized fiber optic biosensor to monitor L-asparagine. Adv Appl Sci Res 2012.
24. Verma, N.; Kumar, K.; Kaur, G.; Anand, S. E.coli K-12 asparaginase-based asparagine biosensor for leukemia. Artif. Cells, Blood Substitutes, Biotechnol. 2007, doi:10.1080/10731190701460358.
25. Hurst, P.L.; Boulton, G.; Lill, R.E. Towards a freshness test for asparagus: Spear tip asparagine content is strongly related to post harvest accumulated heat units. Food Chem. 1998, doi:10.1016/S0308-8146(97)00031-9.
26. Izco, J.M.; Torre, P.; Barcina, Y. Ripening of Ossau-Iraty cheese: Determination of free amino acids by RP-HPLC and of total free amino acids by the TNBS method. Food Control 2000, doi:10.1016/S0956-7135(99)00031-6.
27. Sharma, S.K.; Sehgal, N.; Kumar, A. Biomolecules for development of biosensors and their applications. Curr. Appl. Phys. 2003.
28. Kumar, K.; Kataria, M.; Verma, N. Plant asparaginase-based asparagine biosensor for leukemia. Artif. Cells, Nanomedicine Biotechnol. 2013, doi:10.3109/10731199.2012.716062.
29. El-Naggar, N.E.A.; El-Ewasy, S.M.; El-Shweihy, N.M. Microbial L-asparaginase as a potential therapeutic agent for the treatment of acute lymphoblastic leukemia: The pros and cons. Int. J. Pharmacol. 2014, doi:10.3923/ijp.2014.182.199.
30. Wang, B.; Relling, M. V.; Storm, M.C.; Woo, M.H.; Ribeiro, R.; Pui, C.H.; Hak, L.J. Evaluation of immunologic crossreaction of antiasparaginase antibodies in acute lymphoblastic leukemia (ALL) and lymphoma patients. Leukemia 2003, doi:10.1038/sj.leu.2403011.
31. Plourde, P. V.; Jeha, S.; Hijiya, N.; Keller, F.G.; Silverman, L.B.; Rheingold, S.R.; Dreyer, Z.E.; Dahl, G. V.; Mercedes, T.; Lai, C.; et al. Safety profile of asparaginase Erwinia chrysanthemi in a large compassionate-use trial. Pediatr. Blood Cancer 2014, doi:10.1002/pbc.24938.
32. Hijiya, N.; Van Der Sluis, I.M. Asparaginase-Associated toxicity in children with acute lymphoblastic leukemia. Leuk. Lymphoma 2016.
33. Grace, R.F.; Dahlberg, S.E.; Neuberg, D.; Sallan, S.E.; Connors, J.M.; Neufeld, E.J.; DeAngelo, D.J.; Silverman, L.B. The frequency and management of asparaginase-related thrombosis in paediatric and adult patients with acute lymphoblastic leukaemia treated on Dana-Farber Cancer Institute consortium protocols. Br. J. Haematol. 2011, doi:10.1111/j.1365-2141.2010.08524.x.
34. Krishnapura, P.R.; Belur, P.D.; Subramanya, S. A critical review on properties and applications of microbial l-asparaginases. Crit. Rev. Microbiol. 2016.
35. Sarmiento, F.; Peralta, R.; Blamey, J.M. Cold and hot extremozymes: Industrial relevance and current trends. Front. Bioeng. Biotechnol. 2015.
36. Van den Burg, B. Extremophiles as a source for novel enzymes. Curr. Opin. Microbiol. 2003, 6.
37. Li, X.; Zhang, X.; Xu, S.; Zhang, H.; Xu, M.; Yang, T.; Wang, L.; Qian, H.; Zhang, H.; Fang, H.; et al. Simultaneous cell disruption and semi-quantitative activity assays for high-throughput screening of thermostable L-asparaginases. Sci. Rep.2018, doi:10.1038/s41598-018-26241-7.
38. Bansal, S.; Srivastava, A.; Mukherjee, G.; Pandey, R.; Verma, A.K.; Mishra, P.; Kundu, B. Hyperthermophilic asparaginase mutants with enhanced substrate affinity and antineoplastic activity: structural insights on their mechanism of action. FASEB J. 2012, doi:10.1096/fj.11-191254.
39. Chohan, S.M.; Rashid, N. TK1656, a thermostable l-asparaginase from thermococcus kodakaraensis, exhibiting highest ever reported enzyme activity. J. Biosci. Bioeng. 2013, doi:10.1016/j.jbiosc.2013.04.005.
40. Hatanaka, T.; Usuki, H.; Arima, J.; Uesugi, Y.; Yamamoto, Y.; Kumagai, Y.; Yamasato, A.; Mukaihara, T. Extracellular production and characterization of two Streptomyces L-asparaginases. Appl. Biochem. Biotechnol. 2011, doi:10.1007/s12010-010-9087-9.
41. Bansal, S.; Gnaneswari, D.; Mishra, P.; Kundu, B. Structural stability and functional analysis of L-asparaginase from Pyrococcus furiosus. Biochem. 2010, doi:10.1134/s0006297910030144.
42. Guo; Coker; Wood; Cooper; Chohan; Rashidc; Akhtar Structure and function of the thermostable L-asparaginase from Thermococcus kodakarensis. Acta Cryst. (2017, 889-895.
43. Hong, S.J.; Lee, Y.H.; Khan, A.R.; Ullah, I.; Lee, C.; Park, C.K.; Shin, J.H. Cloning, expression, and characterization of thermophilic L-asparaginase from Thermococcus kodakarensis KOD1. J. Basic Microbiol. 2014, doi:10.1002/jobm.201300741.
44. Zuo, S.; Zhang, T.; Jiang, B.; Mu, W. Reduction of acrylamide level through blanching with treatment by an extremely thermostable l-asparaginase during French fries processing. Extremophiles 2015, doi:10.1007/s00792-015-0763-0.
45. Zuo, S.; Xue, D.; Zhang, T.; Jiang, B.; Mu, W. Biochemical characterization of an extremely thermostable l-asparaginase from Thermococcus gammatolerans EJ3. J. Mol. Catal. B Enzym. 2014, doi:10.1016/j.molcatb.2014.08.021.
46. Tomoko Matsui; Esben Peter Friis; Akihiko Yamagishi Thermostable asparaginases 2008.
47. Tomoko Matsui; Aki Tomiki; Allan Svendsen; Hanne Vang Hendriksen; Mary Ann Stringer; Keiichi Ayabe Thermostable asparaginase variants and polynucleotides encoding same.
48.  Novel Bacillus methylotrophicus MKSY2013 producing enhanced thermostable asparaginase and its producing method 2014.
Novel Bacillus methylotrophicus MKSY2013 producing enhanced thermostable asparaginase and its producing method 2014.
49. Dumina, M. V.; Eldarov, M.A.; Zdanov, D.D.; Sokolov, N.N. L-Asparaginases of Extremophilic Microorganisms in Biomedicine. Biochem. Suppl. Ser. B Biomed. Chem. 2020, 14, doi:10.1134/S1990750820040046.
50. Miroshnichenko, M.L.; Hippe, H.; Stackebrandt, E.; Kostrikina, N.A.; Chernyh, N.A.; Jeanthon, C.; Nazina, T.N.; Belyaev, S.S.; Bonch-Osmolovskaya, E.A. Isolation and characterization of Thermococcus sibiricus sp.nov. from a Western Siberia high-temperature oil reservoir. Extremophiles 2001, 5, doi:10.1007/s007920100175.
51. Mardanov, A. V.; Ravin, N. V.; Svetlitchnyi, V.A.; Beletsky, A. V.; Miroshnichenko, M.L.; Bonch-Osmolovskaya, E.A.; Skryabin, K.G. Metabolic versatility and indigenous origin of the archaeon Thermococcus sibiricus, isolated from a siberian oil reservoir, as revealed by genome analysis. Appl. Environ. Microbiol. 2009, 75, doi:10.1128/AEM.00718-09.
52. Mardanov,A.V., Ravin,N.V., Svetlitchnyi,V.A., Beletsky,A.V., Miroshnichenko,M.L., Bonch-Osmolovskaya,E.A. and Skryabin, K.G. Thermococcus sibiricus MM 739, complete genome Available online: https://www.ncbi.nlm.nih.gov/nuccore/NC_012883.1.
53. Vennison. J Laboratory Manual for Genetic Engineering.; 2010;
54. Swain, A.L.; Jaskolski, M.; Housset, D.; Rao, J.K.; Wlodawer, A. Crystal structure of Escherichia coli L-asparaginase, an enzyme used in cancer therapy. Proc. Natl. Acad. Sci. 2006, doi:10.1073/pnas.90.4.1474.
55. Yao, M.; Yasutake, Y.; Morita, H.; Tanaka, I. Structure of the type I L-asparaginase from the hyperthermophilic archaeon Pyrococcus horikoshii at 2.16 Å resolution. Acta Crystallogr. Sect. D Biol. Crystallogr. 2005, doi:10.1107/S0907444904032950.
56. Pokrovskaya, M. V.; Aleksandrova, S.S.; Pokrovsky, V.S.; Veselovsky, A. V.; Grishin, D. V.; Abakumova, O.Y.; Podobed, O. V.; Mishin, A.A.; Zhdanov, D.D.; Sokolov, N.N. Identification of Functional Regions in the Rhodospirillum rubrum l-Asparaginase by Site-Directed Mutagenesis. Mol. Biotechnol. 2015, 57, doi:10.1007/s12033-014-9819-0.
57. Sedmak, J.J.; Grossberg, S.E. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250. Anal. Biochem. 1977, 79, doi:10.1016/0003-2697(77)90428-6.
58. Wriston, J.C.; Yellin, T.O. L-asparaginase: A review. In Advances in Enzymology and Related Areas of Molecular Biology, Volume 39; 2006.
59. Wade, H.E.; Robinson, H.K.; Phillips, B.W. Asparaginase and glutaminase activities of bacteria. J. Gen. Microbiol. 1971, 69, doi:10.1099/00221287-69-3-299.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1
Модифицированный ген tsA_mod, кодирующий термостабильную
L-аспарагиназу из археи Thermococcus sibiricus.
1 atgaagaagt tactgattat tggcactggc ggcacaatcg cttcggcaaa gacggagcag
61 ggttataaga gcgtgctgaa gatcgacgag attctcaagc ttgcaaagat caagcttgag
121 aacggctaca agattgactc cacgaacatc atgaatattg attcgacctt gattcatcca
181 gaggattggg agatcatcgc gaaggaagtc tttaaagcac tcgacgacta cgacggtatc
241 attattactc acgggaccga taccttagcg tatactgcat ctatgttgtc ttttatgatt
301 aagaatccga ataagcctat cgtgttgacc gggagcatgc tcccgattac cgagaacggc
361 tcagacgctc cgcgtaatat tcgtaccgct atcaagttcg ccatggaaga cgttgccggc
421 gtgttcgtgg cgtttatgga caagattatg ttgggctgcc gtacgagcaa agtgcgcact
481 ttggggctta acgccttcat gtctatcaac tatccggacg tcgcctacgt gaagggcgag
541 aaaattctgt ataacattcc aaaggagaag tttcagccga acggctctcc agaactggac
601 accaaatacg agccgcgcgt ggtagtactg cgtgtaactc cgggactggg tggggaaatt
661 attgacgctg tgctggacgc gggttacaag ggtattgttt tggaaggtta cggcgccggc
721 gggctgccgt accgtaaaag caacctgctc tctaagatca aagagatcac tccgaagatt
781 cccgttatca tgacgaccca ggcgctgtac gacggagtgg atatgcgtaa gtacgaggtg
841 ggccgcaaag ctcttgagac cggtatcatt ccggcgaagg atatgaccaa agaggctacc
901 attacgaaac tgatgtgggc gctggggcat accaaggatg tggagaaaat tcgtgagatt
961 atgcacacca attatgtgaa cgagattaag agttga
SEQ ID NO: 2
Аминокислотная последовательность L-аспарагиназы
TsA термофильной археи Thermococcus sibiricus
MKKLLIIGTGGTIASAKTEQGYKSVLKIDEILKLAKIKLENGYK
IDSTNIMNIDSTLIHPEDWEIIAKEVFKALDDYDGIIITHGTDTLAYTASMLSFMIKN
PNKPIVLTGSMLPITENGSDAPRNIRTAIKFAMEDVAGVFVAFMDKIMLGCRTSKVRT
LGLNAFMSINYPDVAYVKGEKILYNIPKEKFQPNGSPELDTKYEPRVVVLRVTPGLGG
EIIDAVLDAGYKGIVLEGYGAGGLPYRKSNLLSKIKEITPKIPVIMTTQALYDGVDMR
KYEVGRKALETGIIPAKDMTKEATITKLMWALGHTKDVEKIREIMHTNYVNEIKS
SEQ ID NO: 3
Предполагаемый ген TSIB_RS08165 (tsA_wt), кодирующий
L-аспарагиназу термофильной археи Thermococcus sibiricus
1 atgaaaaaac tcttaatcat cggtaccggt ggaacgattg caagcgctaa aacagaacaa
61 ggatacaaaa gtgtcctcaa aatagatgaa atacttaaac tagccaaaat aaaactagaa
121 aatggatata aaatcgatag caccaatatt atgaacatag acagcactct gatacaccct
181 gaagactggg aaattatagc taaagaggtt ttcaaggctc ttgatgatta tgatggcatt
241 ataataaccc atggaacaga cactttggcc tacaccgctt caatgttaag tttcatgata
301 aaaaacccca acaaaccaat tgtactcact ggctctatgt tgccaataac agaaaatgga
361 agtgatgccc ccagaaacat cagaactgca ataaaatttg caatggaaga tgtcgcaggt
421 gtttttgtag ctttcatgga taaaataatg ctgggttgta ggacatctaa ggttagaacc
481 ctcggcctaa atgcatttat gagcataaat taccctgatg tggcttatgt aaaaggagaa
541 aagatcttat acaatatccc caaagaaaaa ttccaaccaa atggtagccc tgagctagat
601 acaaagtatg aaccaagggt tgttgtttta agagttaccc ctggcttagg gggagagatc
661 atagatgcag tcctagatgc tggatataaa ggcatagtgc tagaaggcta tggtgcgggt
721 ggtctcccat atagaaagag taatcttcta agcaaaatta aggaaattac accaaaaatc
781 ccggtaatta tgacaactca agcactctat gatggggttg acatgagaaa atatgaagta
841 ggacgaaagg cattagaaac aggaattatc cccgcaaaag acatgacaaa ggaagcaacg
901 atcacaaagt taatgtgggc ccttggacac acaaaagacg ttgaaaagat aagagaaata
961 atgcatacga actacgtaaa tgaaataaaa agctaa
<---