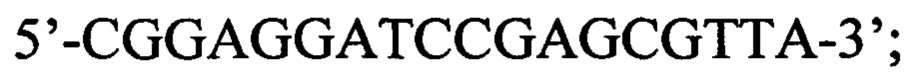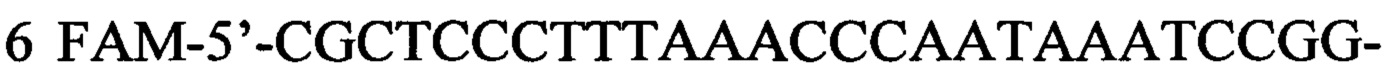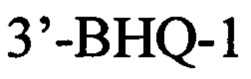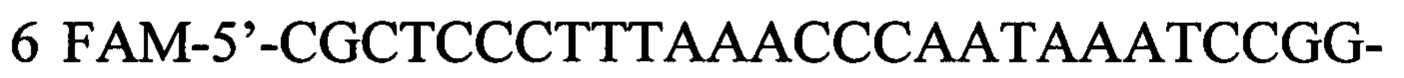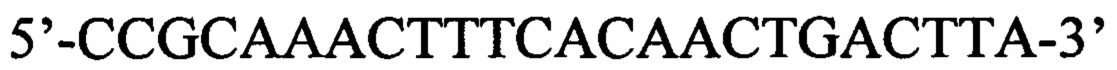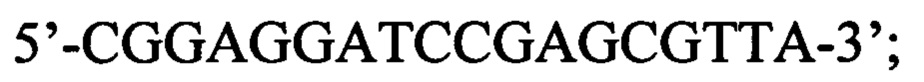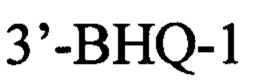Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТРАНСПЛАНТАЦИИ ФЕКАЛЬНОЙ МИКРОБИОТЫ У ПАЦИЕНТОВ С ИММУННОЙ РЕАКЦИЕЙ ПОСЛЕ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к микробиологии и трансплантологии, и может использоваться для оценки эффективности трансплантации фекальной микробиоты (ТФМ) у пациентов с иммунной реакцией после трансплантации гемопоэтических стволовых клеток.
Клинико-лабораторные исследования состава кишечной микробиоты и ее изменений при ТФМ, включая культивируемые и некультивируемые классы микробов, возможны только с помощью молекулярно-биологических методов, сочетающих ПЦР ДНК и секвенирование участков целевых генов. Таким стандартным сегментом является хорошо изученный фрагмент гена 16S рРНК. Его секвенирование позволяет различать и классифицировать сотни видов микробов в данном образце.
Известны клинические исследования с использованием метода NGS-секвенирования, позволившие выявить достоверные корреляции между исчезновением части микрофлоры кишечника, снижением ее биологического разнообразия и частотой тяжелых иммунных реакций «трансплантат против хозяина» (РТПХ) у больных после трансплантации костного мозга. На основании результатов NGS-секвенирования стали известны основные семейства микроорганизмов, связанные с клиническим эффектом [Weber D, Jenq RR, Peled JU. Microbiota disruption induced by early use of broad spectrum antibiotics is an independent risk factor of outcome after allogeneic stem cell transplantation. Biol Blood Marrow Transplant. 2017; 23(5):845-852.]. Этот способ является ближайшим аналогом.
Недостатком методики NGS - секвенирования является очень высокая стоимость и сложность выполнения. Методика состоит в амплификации гена 16SpPHK по всему массиву микробиоты. На следующем этапе составляют «библиотеку» генных фрагментов, которые затем подвергают мультиплексному секвенированию. Затем с помощью специализированных компьютерных программ из множества полученных последовательностей генов составляют базу данных о составе микробиоты в данном образце. Биоинформатический анализ этих данных также требует значительных затрат времени и труда. Такой анализ в целом занимает около 3 суток. В конечном результате наиболее точные данные получают на уровне классов, семейств, родов. Отдельные виды микроорганизмов, особенно малые фракции, определяются с меньшей точностью. С достаточной точностью определяется лишь род Bacteroides, куда относится и Bacteroides fragilis group.Кроме того, результат исследования с помощью NGS не имеет абсолютного количественного значения, а выражается в виде соотношения конкретного типа (рода, семейства) микроорганизмов к общему количеству микробных генов в образце [Weber D, Jenq RR, Peled JU. Microbiota disruption induced by early use of broad spectrum antibiotics is an independent risk factor of outcome after allogeneic stem cell transplantation. Biol Blood Marrow Transplant. 2017; 23(5):845-852].
Техническим результатом изобретения является количественная оценка Bacteroides fragilis group в образце фекальной микробиоты, соответствующая клинической эффективности ТФМ, значительное упрощение способа, повышение точности и экономичность.
Указанный технический результат достигается в способе оценки эффективности ТФМ у пациентов с иммунной реакцией после трансплантации гемопоэтических стволовых клеток, включающем молекулярно-биологическое исследование образца фекальной микробиоты массой 0,1 г, в котором исследование выполняют на 30-45 день после ТФМ путем идентификации Bacteroides fragilis group методом количественной полимеразной цепной реакции ДНК, выделенной из образца фекальной микробиоты, с применением следующей последовательности праймеров:
прямой: 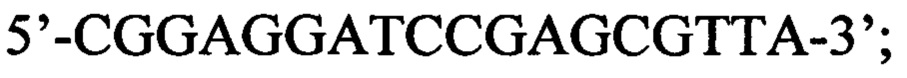
обратный: 
флуоресцентный зонд: 
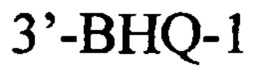
и при идентификации Bacteroides fragilis group в количестве 1010 и более копий гена в образце фекальной микробиоты ТФМ считают эффективной.
В заявляемом способе проводят определение Bacteroides fragilis group - конкретного представителя рода Bacteroides с применением количественной ПЦР, которая позволяет подсчитать число генокопий данных бактерий в стандартном образце (ОД г) и выдать ответ через 4-5 часов после начала выделения ДНК из образца. Высокая корреляция между результатами по методу NGS и количественной ПЦР отмечается только на уровне Phylum: (Bacteroidetes); класса (Bacteroidia); порядка (Bacteroidales); семейства (Bacteroidaceae), рода (Bacteroides). При оценке доли микробов вида Bacteroides fragilis group коэффициент корреляции NGS и количественной ПЦР был значительно ниже (табл. 1). Более высокая точность количественной ПЦР обусловлена наличием референтного генного маркера общей бактериальной массы.
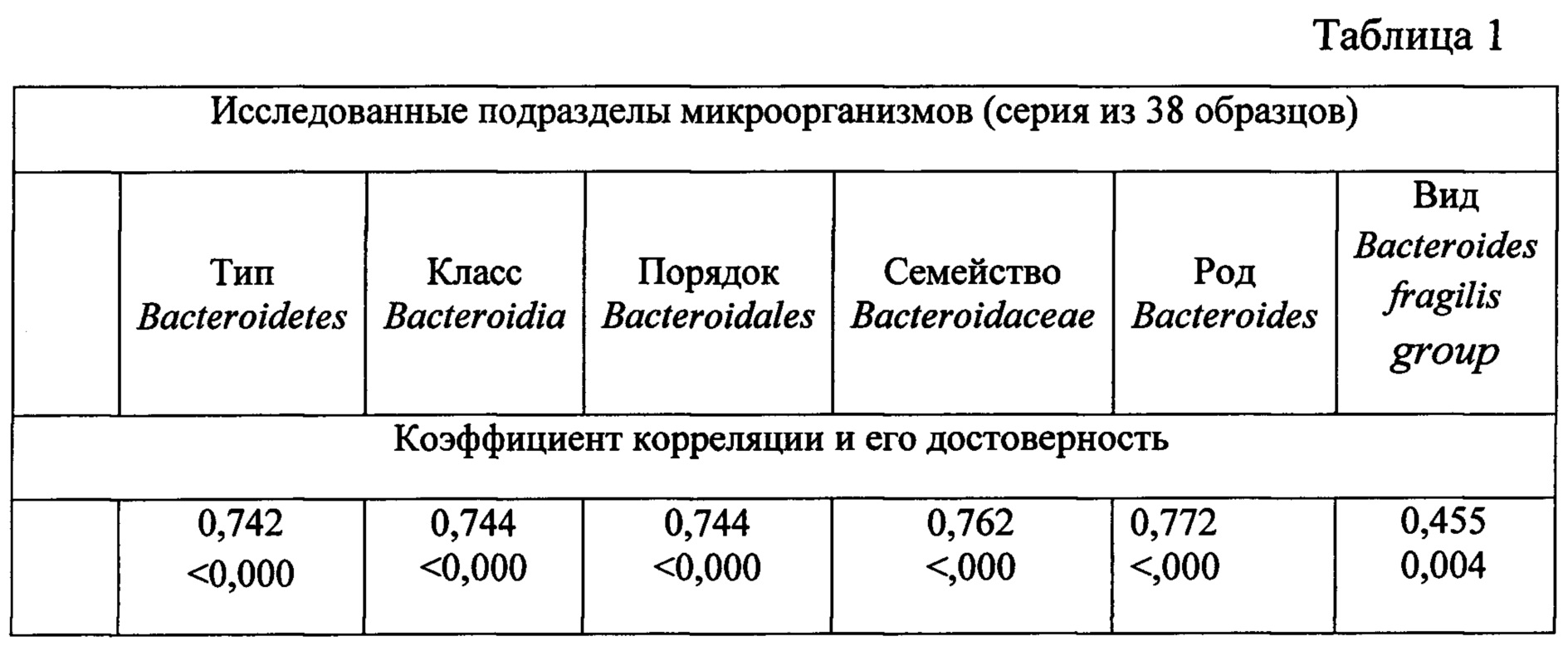
В табл. 1. представлены коэффициенты корреляции между содержанием генокопий Bacteroides Fragilis group, определенной методом количественной ПЦР и относительным содержанием бактериальных генов Phylum Bacteroidetes, различных филогенетических уровней, определенных с помощью методики NGS.
Как видно из табл. 1 коэффициент корреляции снижается, когда анализ результатов NGS доходит до вида Bacteroides Fragilis group, что говорит о недостаточной точности NGS при оценке видовой принадлежности.
Таким образом, заявляемый способ является не только более простым, но и существенно более точным по сравнению с методикой NGS при оценке эффективности ТФМ после трансплантации гемопоэтических стволовых клеток.
Способ иллюстрируется фиг. 1-5, где:
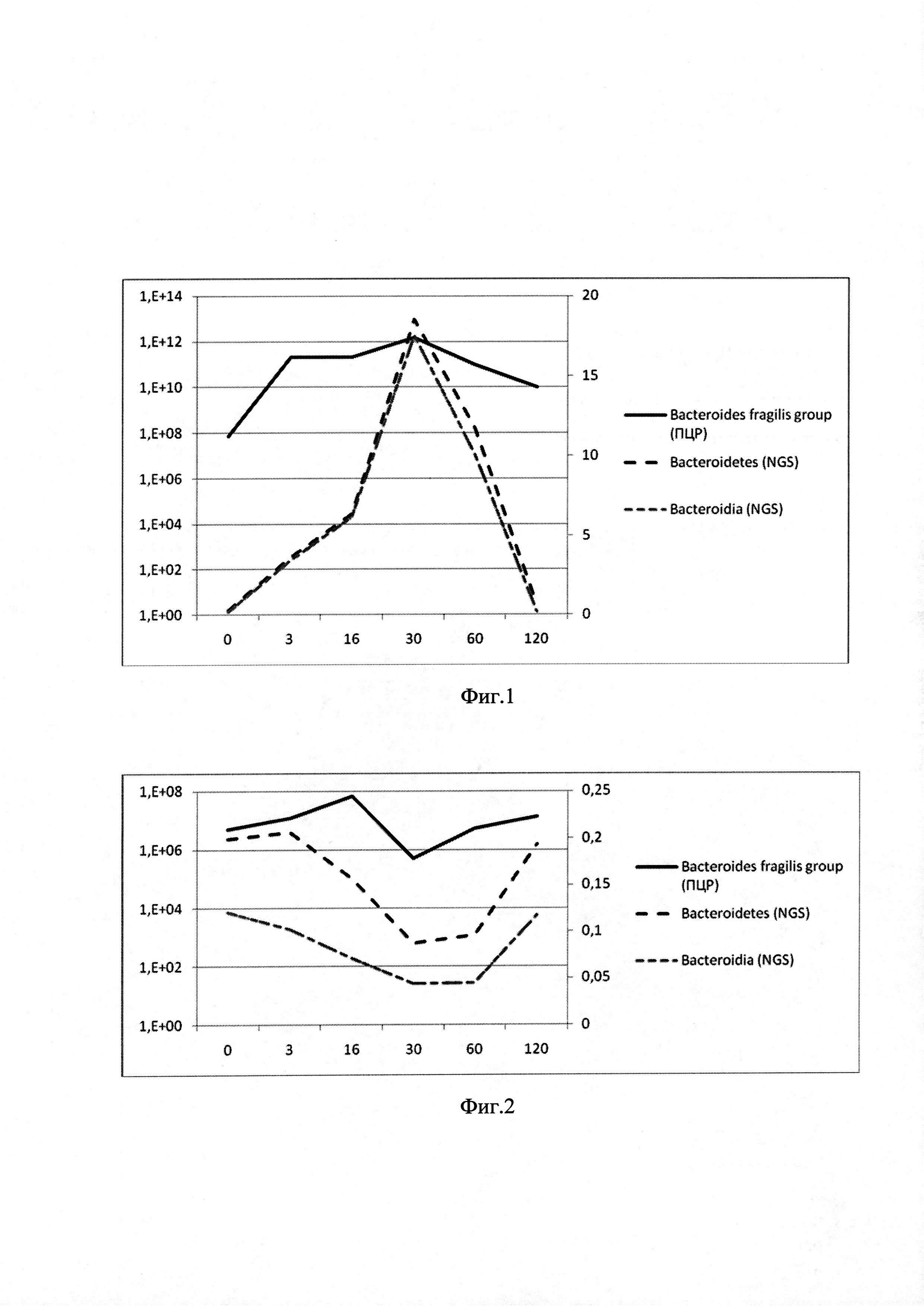
на фиг. 1 представлен график сравнительной временной динамики роста Bacteroides fragilis group, Bacteroidetes (тип), Bacteroidia (класс) в образцах стула у пациентов в группе, получавшей лечение ТФМ. По оси абсцисс - время после ТФМ, сутки; по оси ординат: слева - число копий целевых генов Bacteroides fragilis group в образце фекальной микробиоты по шкале log10, при этом 1,Е+00 соответствует 10; 1.Е+02 - 100 и так далее, справа - доля Bacteroides fragilis group в общей популяции микробиома, %;
на фиг. 2 - график сравнительной временной динамики роста Bacteroides fragilis group, Bacteroidetes (тип), Bacteroidia (класс) в образцах стула у пациентов в контрольной группе (плацебо). По оси абсцисс - время после ТФМ/плацебо, сутки; по оси ординат: слева - число копий Bacteroides fragilis group по шкале log10 в стандартном образце биоматериала; справа -доля Bacteroides в общей популяции микробиома, %;
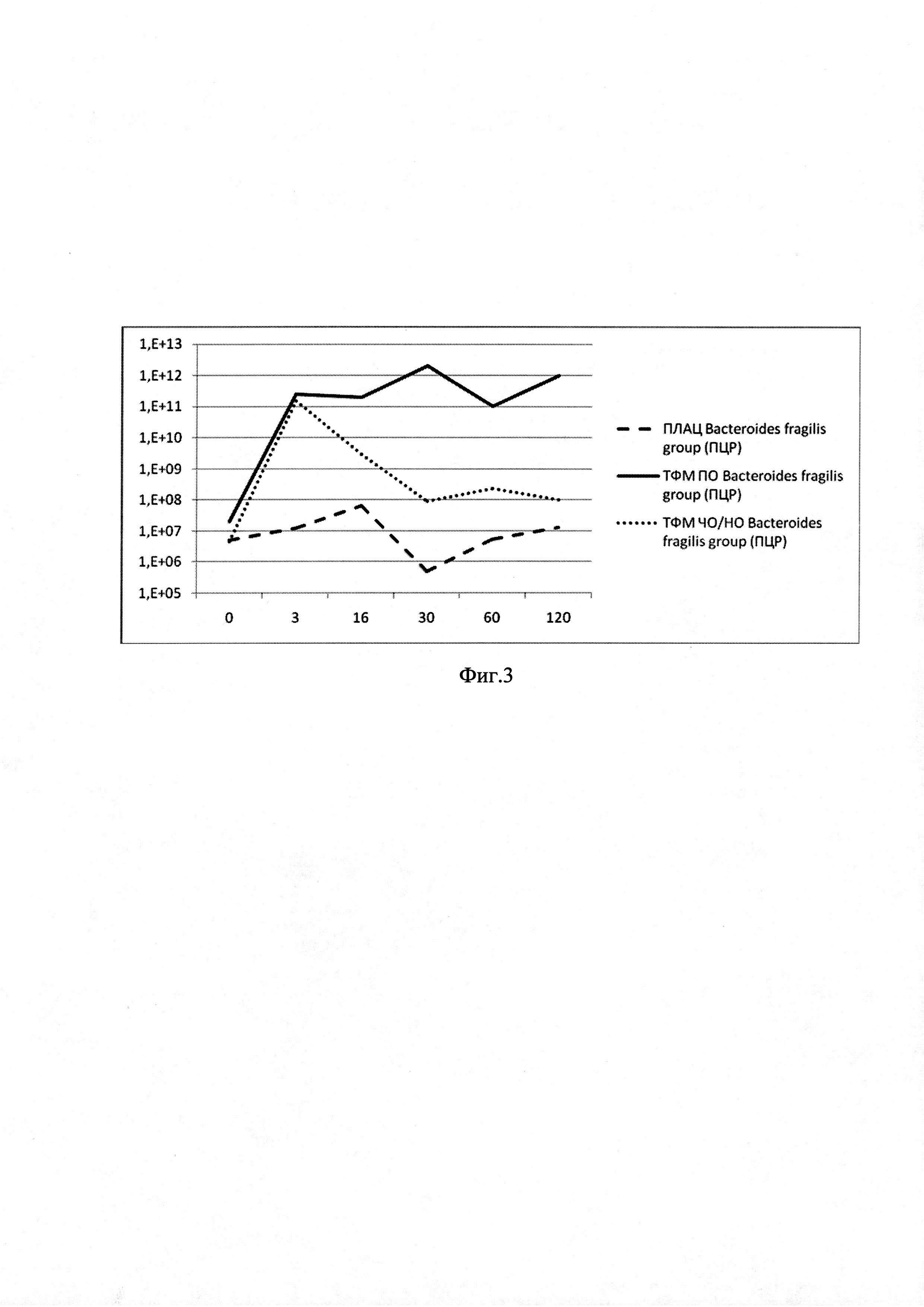
на фиг. 3 - график временной динамики медианных значений Bacteroides Fragilis group, определенной методом количественной ПЦР в составе фекальной микробиоты пациентов группы, получавшей лечение ТФМ и контрольной группы (плацебо). По оси абсцисс - сроки после ТФМ, сутки; по оси ординат: слева - число копий Bacteroides fragilis group по шкале log10 в стандартном образце биоматериала. Сплошной линией обозначена динамика уровней Bacteroides Fragilis group при полном клиническом ответе на ТФМ, точками - при неполном (частичном) / отсутствии ответа; пунктиром - после плацебо.
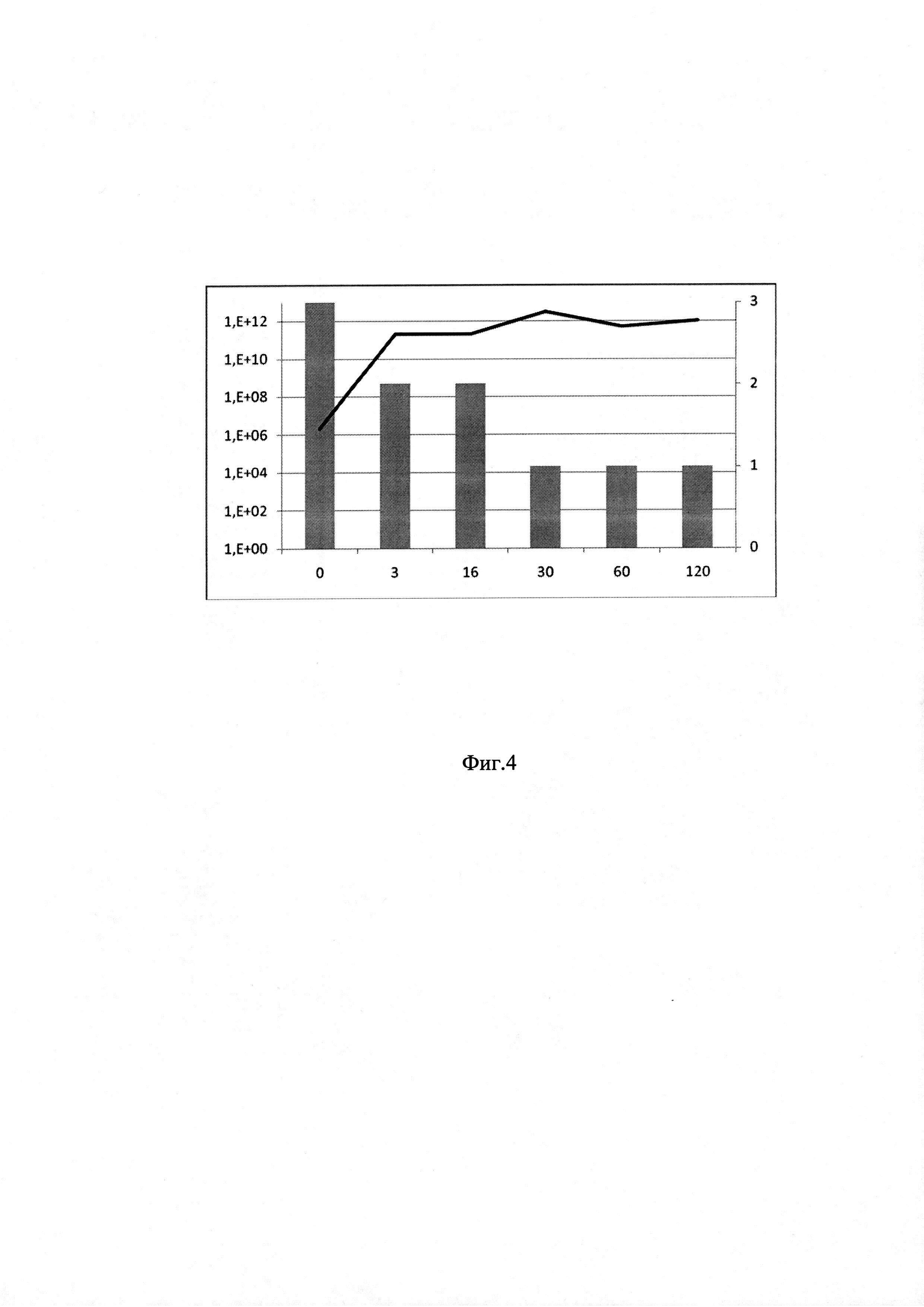
на фиг. 4 - график оценки эффективности ТФМ (пример 1);
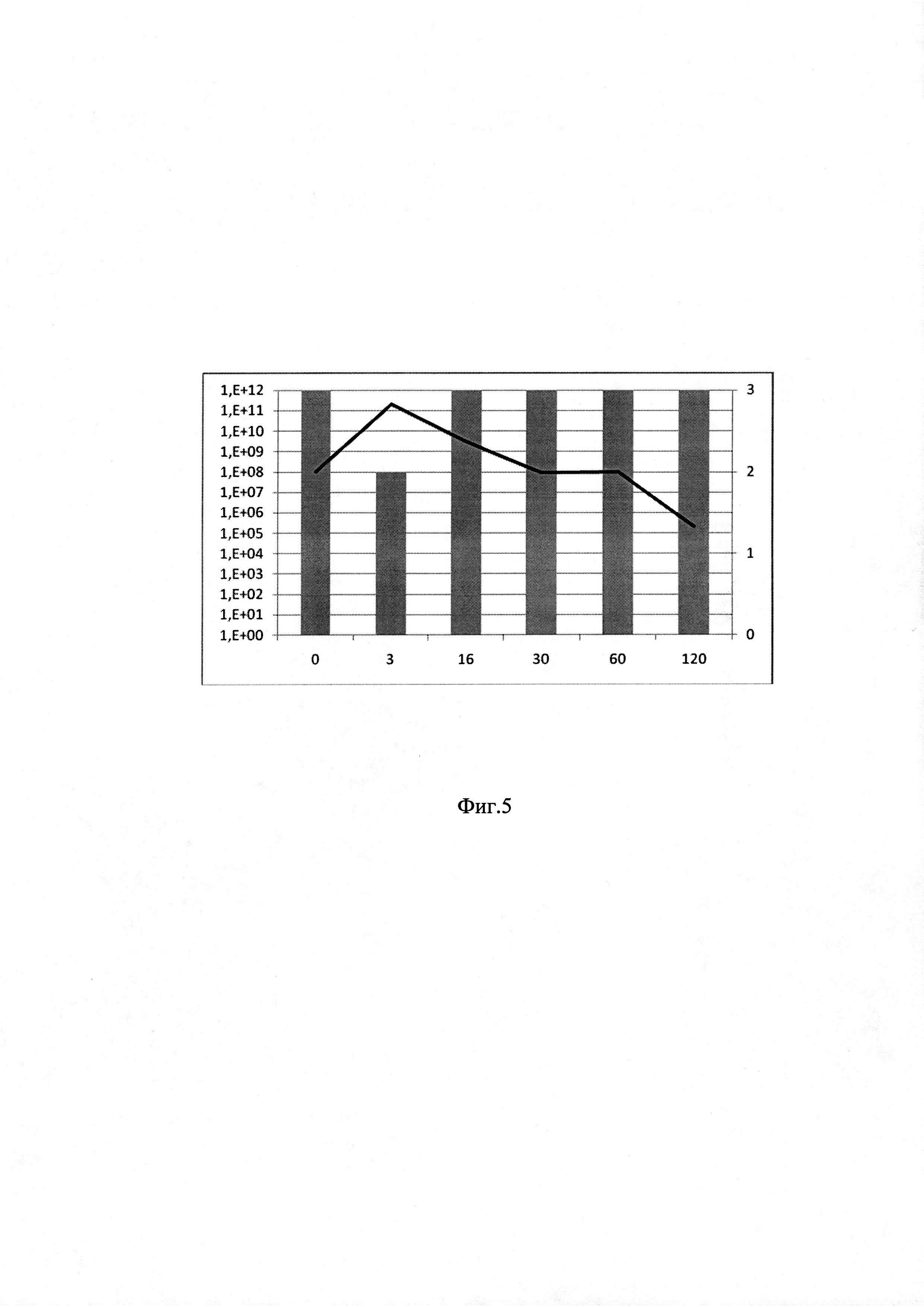
на фиг. 5 - график оценки эффективности ТФМ (пример 2).
В исследование были включены 27 пациентов, главным образом, с лейкозами, лимфомами в возрасте от 1 года до 49 лет (в среднем - 24,2 года), которым проводилась аллогенная трансплантация гемопоэтических стволовых клеток, и они находились в ремиссии по основному заболеванию. У всех указанных пациентов развилась тяжелая резистентная к терапии реакция «трансплантат против хозяина» (РТПХ) с поражением кишечника, что было показанием к трансплантации фекальной микробиоты (ТФМ). Пациентам основной группы (20 человек) проведена ТФМ от здоровых доноров, в контрольной группе (7 человек) больным назначали плацебо.
Методика выполнения ТФМ проводилась по стандартному протоколу [R. Shouval, М Geva A. Nagler, I. Youngster. Fecal Microbiota Transplantation for Treatment of Acute Graft-versus-Host Disease. Clinical Hematology International, Vol. 1(1), 2019, pp. 28-35] В объеме по 15 капсул ежедневно, всего 22 г, в течение двух дней.
Оценку клинического статуса проводили ежедневно. Исследование фекальной микробиоты методом количественной ПЦР общей бактериальной массы и Bacteroides fragilis group проводили перед ТФМ (день 0), а также в сроки 3, 16, 30, 60 и 120 дней после ТФМ. Из этих же образцов фекалий у 10 пациентов основной группы и 4 пациентов из группы плацебо выполняли 168-секвенирование на аппарате ILLUMINA.
Клиническую оценку пациентов проводили по известным шкалам оценки тяжести РТПХ [Glucksberg Н, Storb R, Fefer A, Buckner CD, Neiman РЕ, Clift RA, Lerner KG, Thomas ED. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HL-A-matched sibling donors. Transplantation. 1974; 18(4):295-304].
Тяжесть кишечного синдрома оценивали по Бристольской шкале [S.J. Lewis, K.W. Heaton. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol., 1997, v. 32, №9, c. 920-924,], на основании которой выставляли оценки от 1 до 7 баллов.
Клинический ответ после ТФМ/плацебо определяли как полный, частичный и пациенты без ответа (соответственно, 1, 2 и 3 балла). Для более объективной оценки клинического ответа пациенты основной группы были разделены на две подгруппы: пациенты, которые показали полный клинический ответ и больные с частичным ответом или без клинического ответа. Все пациенты ежедневно заполняли дневник, где отмечали динамику состояния. Все показатели переносили в базу данных: частота и объем стула за сутки (проводился пересчет объема стула на килограмм веса пациента), форму стула оценивали по двум классификациям: Бристольской шкале стула (Lewis S.J., Heaton K.W. Stool form scale as a useful guide to intestinal transit time. Scandinavian Journal of Gastroenterology, v. 32, №9, pp. 920-924, 1997) и по упрощенной шкале (1 балл - оформленный, 2 - кашицеобразный, 3 - жидкий, 4 - водянистый). Для оценки крови, слизи в стуле, аппетита и для анализа побочных эффектов после ТФМ и плацебо использовали шкалу токсичности (Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0 Published: November 27, 2017 - https://ctep.cancer.gov/protocol Development/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.5x11.pdf) - числовая оценка интенсивности симптома по 4-х бальной шкале (0 - отсутствие, 1 - легкое проявление (периодически), 2 - среднее (часто), 3 - тяжелое (постоянно) проявление симптома, требующее терапии). Для оценки болевого синдрома в животе использовали 10-и бальную визуально-аналоговую шкалу (ВАШ). При диагностике полного ответа (1 балл) - должны были отсутствовать жалобы по шкале токсичности, регистрировали оформленный стул (Бристольская шкала 3-4 балла), по шкале ВАШ - 0. Частичный ответ (2 балла) устанавливали при оценке 1 балл по шкале токсичности, кашицеобразному стулу (Бристольская шкала 5 баллов) и до 2 баллов включительно по ВАШ. При отсутствии ответа (3 балла) - оценка по шкале токсичности 2 балла и более, по ВАШ - 3 балла и более, и жидкий стул (Бристольская шкала: 6-7 баллов).
В дни до ТФМ или введения плацебо и после ТФМ/плацебо на 3, 16, 30, 60, 120 дни проводили подсчет среднего значения баллов за предшествующий период, начиная со следующего дня после последней контрольной точки и до искомой точки исследования включительно.
В основной группе (группа ТФМ) полный клинический ответ был достигнут у 11 пациентов (55%), частичный ответ регистрировали у 8 больных (40%), 1 (5%) пациент не ответил на терапию, суммарно - частичный или не было ответа у 9 (45%), умерли 2 (10%). В контрольной группе частичный ответ был получен у 4 (57%), 1 пациент (14%) достиг полного клинического ответа, без ответа - 2 (29%), умерли 2 (29%).
Результаты сравнения динамики Bacteroides fragilis group - Bacteroidetes (тип), Bacteroidia (класс) в образцах стула у пациентов в основной и контрольной группах представлены, соответственно, на фиг. 1, 2.
Как видно из графиков на фиг. 1 и 2, в группах пациентов после ТФМ или введения плацебо отмечается четкая взаимосвязь между содержанием Bacteroides fragilis group, определяемых методом количественной ПЦР ДНК (кривая, отмеченная сплошной линией) и долей бактерий этого типа (Bacteroidetes и Bacteroidia), определяемых методикой NGS (кривые, отмеченные пунктирными линиями). Эта взаимосвязь наиболее достоверна через 30-45 суток наблюдения.
Исследования по заявляемому способу проводили известным методом количественной ПЦР ДНК [С.Ф. Багненко, А.А. Захаренко, А.Н. Суворов, И.В. Шлык, О.А. Тен, Ш.Р. Джамилов, М.А. Беляев, А.А. Трушин, А.С. Натха, Д.А. Зайцев, К.Н. Бовин, В.А. Рыбальченко. Периоперационные изменения кишечного микробиоценоза у больных раком толстой кишки // Вестник хирургии, 2016, с. 33-37] и сравнивали с результатами по методу анализа последовательностей 16S RNA методом секвенирования нового поколения (NGS).
Из табл. 2 видно, что содержание Bacteroides fragilis group у здоровых доноров достоверно выше, чем у пациентов с РТПХ перед ТФМ, что обосновывает необходимость повышения содержания этих микроорганизмов у пациентов. Медианные уровни Bacteroides Fragilis group существенно возрастают у пациентов с полным клиническим ответом, но остаются на пониженных значениях у больных с отсутствием выраженного клинического ответа.
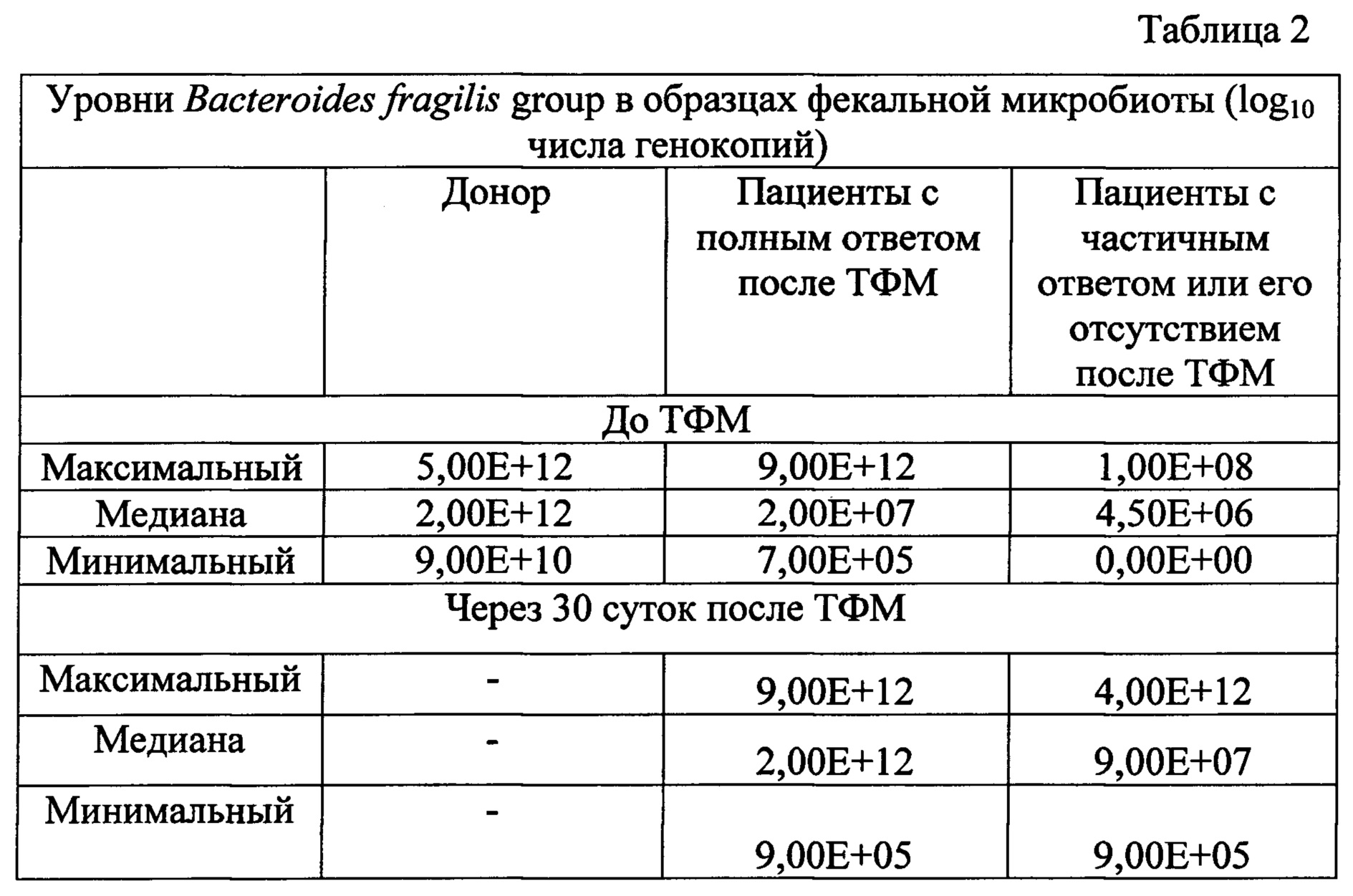
Таким образом, количественная оценка содержания Bacteroides Fragilis group методом ПЦР ДНК соответствует результатам определения более широкого типа бактерий (Bacteroidetes), полученным с помощью более сложной методики NGS (16S-секвенирования).
По результатам этого исследования сделан вывод, что наиболее значимой при оценке клинической эффективности ТФМ у пациентов после трансплантации гемопоэтических стволовых клеток с иммунной реакцией «трансплантат против хозяина», является Bacteroides fragilis group.
Для оценки клинической эффективности Bacteroides fragilis group использовали количественный критерий содержания числа генокопий Bacteroides fragilis group в фекальном образце. С этой целью оценивали динамику изменения числа генокопий этой группы микробов в трех группах пациентов с РТПХ: 1) группа, получившая лечение ТФМ с полным клиническим ответом (ПО); 2) группа, получившая лечение ТФМ с неполным (частичным) или отсутствием клинического ответа (ЧО/НО), и 3) контрольная группа, которую не лечили ТФМ (группа плацебо).
Поскольку медианные значения содержания Bacteroides fragilis group существенно различались в подгруппах с полным клиническим ответом и его отсутствием, то было установлено пороговое значение Bacteroides fragilis group для установления клинической эффективности ТФМ. Выраженный клинический ответ отмечался при увеличении количества Bacteroides fragilis group более 1010 генокопий в образце через 30-45 дней после ТФМ (фиг. 1).
Способ осуществляют, например, следующим образом.
Исследование образца фекальной микробиоты для оценки эффективности ТФМ выполняют на 30-45 день после ТФМ. Образец фекальной микробиоты массой (объемом) 1-3 г (1-3 мл) забирают в стерильный пластиковый контейнер. Контейнер с материалом доставляют в лабораторию и хранят до начала исследования при температуре 2-8°С выше нуля. Время от взятия материала до начала исследования не должно превышать 48 часов.
Для выделения ДНК берут строго определенное количество биоматериала - 0,1 г, то есть перед процедурой экстракции необходимо взвешивание биоматериала. Для приготовления фекальной суспензии в соответствующее пробам количество микроцентрифужных пробирок объемом 1,5 мл вносят в каждую по 0,8 мл стерильного изотонического раствора натрия хлорида. Далее в каждую пробирку отдельным наконечником с аэрозольным барьером или одноразовыми лопатками вносят 0,1 г фекалий и тщательно ресуспендируют на вортексе до образования гомогенной суспензии. Непосредственно перед процедурой выделения ДНК готовят бактериальную фракцию фекалий. Для этого пробирки с фекальной суспензией центрифугируют при 10000-13000 об/мин в течение 30 секунд. Для выделения ДНК используют верхнюю фракцию (супернатант). Выделение ДНК производят с помощью комплектов реагентов, предназначенных для применения в клинической лабораторной диагностике при анализе фекальных образцов.
В штатив помещают необходимое количество микропробирок с ПЦР-смесью - буферным раствором, содержащим геноспецифические праймеры и флуоресцентные пробы для амплификации ДНК целевых микроорганизмов из расчета n+2, где n - количество анализируемых образцов, а также дополнительные пробирки для анализа положительного и отрицательного контрольного образцов.
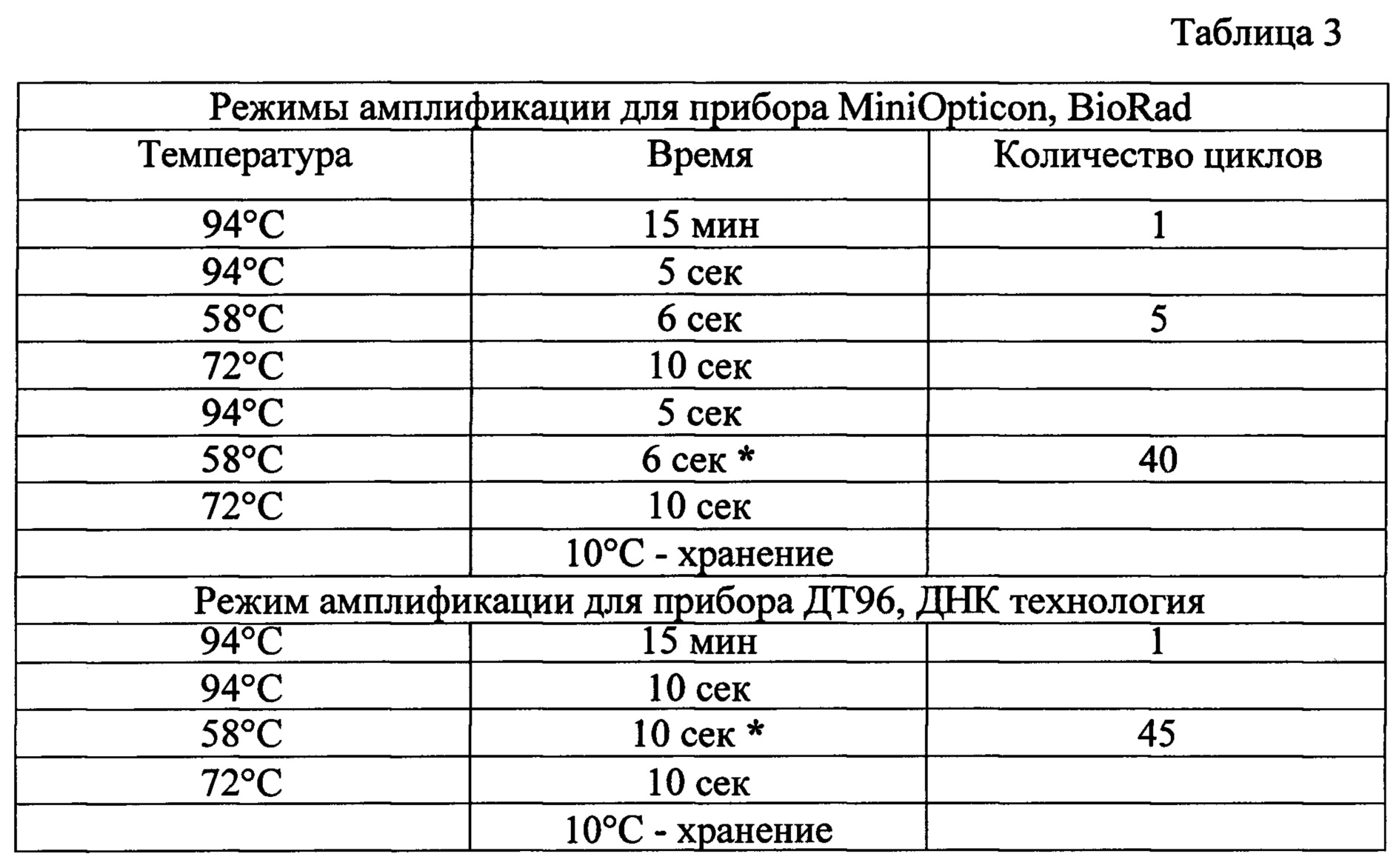
В каждую пробирку, не повреждая слой воска, вносят по 10 мкл тщательно перемешанного раствора Taq-полимеразы и 50 мкл минерального масла, закрывают крышки пробирок. Затем вносят в отдельные пробирки по 5 мкл отрицательного контрольного образца (ОКО). Затем вносят по 5 мкл соответствующих анализируемых образцов ДНК, выделенной из образца фекальной микробиоты. Затем в дополнительные пробирки вносят по 5 мкл положительных контрольных образцов (ПКО). Запускают программу амплификации согласно инструкциям к приборам Mini Opticon, Bio Rad и прибору ДТ-96 с параметрами, указанными в табл. 3.
В табл. 4 представлены последовательности праймеров и флуоресцентных проб для проведения количественной ПЦР ДНК Bacteroides fragilis group. Указанный в табл. 4 набор праймеров ПЦР предназначен для использования на амплификаторах MiniOpticon, BioRad, ДТ-96, детектирующих для постановки ПЦР ДНК в режиме реального времени с регистрацией флуоресцентного сигнала по каналам FAM и HEX (ДТ-лайт, ДТ-прайм - производитель «ДНК-Технология»); CFX-96, MiniOpticon (производитель «BioRad») или других амплификаторах с аналогичными техническими характеристиками.

Флуоресцентная детекция продуктов амплификации осуществляется в режиме реального времени с использованием детектирующего амплификатора.
После окончания реакции детектирующий амплификатор автоматически формирует отчет об исследовании, включающий данные о величине индикаторного цикла для каждой ячейки амплификатора, в которой прибором зарегистрировано нарастание флюоресценции.
Данные об уровнях флуоресценции в каждой пробирке, содержащиеся в отчете об исследовании, подвергают статистической обработке. Для количественной оценки результатов теста используют специальную программу для ЭВМ «Колонофлор 2017», номер регистрации 2017663954. После окончания амплификации цифровые показатели порогового (индикаторного) цикла Ct посредством данной программы преобразуют в количество выявленных микроорганизмов, аналогичным образом рассчитывают общее бактериальное число.
При идентификации Bacteroides fragilis group в количестве 1010 и более копий гена в образце фекальной микробиоты, взятой на 30-45 день после выполнения ТФМ, ТФМ считают эффективной.
Способ подтверждается следующими клиническими примерами.
Пример 1 (фиг. 4). Пациент Ш.А., 36 лет. Острый миелоидный лейкоз (М4), 46XY от 08.02.2017 г. Первично-резистентное течение. Гиперэкспрессия WT1 (WT1/ABLx10000): 459, без дополнительных мутаций, влияющих на риск исхода. Аллогенная неродственная трансплантация периферических стволовых клеток от 15.08.2017. Клинико-гематологическая ремиссия от 31.08.2017. Гипофункция трансплантата средней степени тяжести, анемия средней степения тяжести, тромбоцитопени 2 ст, лейкопения 2 ст. Острая РТПХ кишечника 3 ст, кожи 2 степени. Общая степень РТПХ - 3 на Д+20 (04.09.17). Полный ответ от 11.09.17. Рецидив ОРТПХ кишечника 4 ст. от 14.11.17. Острый тотальный вирусный геморрагический язвенный колит смешанной этиологии (вирус HHV6, Klebsiella pneumoniae, клостридиальный колит) -04.09.2017, 14.11.17. Хроническая РТПХ (слизистые, кишечник, кожа). Общая оценка по клиническим критериям до ТФМ: 3 балла.
ТФМ по 15 капсул ежедневно, всего 22 г, проводилась 27.12.2017, 28.12.2017.
Состояние пациента после коррекции микробиоты кишечника: снижение клинической симптоматики на протяжении 30 суток после ТФМ: сокращение объема стула (с 500 мл до 160 мл/сутки) и кратности (с 11 до 2 раз в сутки), улучшение аппетита. Характер стула - оформленный. К 30 суткам перестал отмечать тошноту, рвоту. Увеличение массы тела с 53,78 кг до 55,88 кг. К Д+30 зарегистрирована полная ремиссия острой РТПХ с поражением кишечника. Общая оценка по клиническим критериям через 30 суток после ТФМ - 1 балл. Содержание Bacteroides fragilis group: до ТФМ -2×106 в образце; в последующие сроки этот показатель повысился до 1011 и к 30 суткам - до 3×1012 копий в образце, что подтверждает эффективность ТФМ.
Пример 2 (фиг. 5). Пациентка Л.А., 24 года. Острый лимфобластный лейкоз, Т-III (cort) EGIL, гиперлейкоцитоз от 09.2017 г. Терапия по протоколу Hyper CVAD. Первичная химиорезистентность. Клинико-гематологическая ремиссия от 12.2017. Аллогенная родственная (гаплоидентичная) трансплантация костного мозга (17.04.2018). Клинико-гематологическая ремиссия. Острая РТПХ III ст (кожи 2 ст от 17.05.18, кишечника 3 ст от 06.07.18). Хроническая РТПХ, распространенная продолжающаяся форма тяжелой степени с поражением ротовой полости 2 ст., кишечника 3 ст. Осложнения: гипофункция трансплантата средней степени (анемия средней степени тяжести, нейтропения 3 степени., тромбоцитопения 3 степени). Геморрагический гастрит (ВПГ 6 типа, ЭБВ), рецидивирующее течение. Вирусно-бактериальный эрозивный колит (Kl. pneumoniae, Pseudomonas spp. ВПГ 6 типа, ЦМВ), рецидивирующее течение. Повторное кишечное кровотечение. Общая оценка по клиническим критериям до ТФМ: 3 балла.
ТФМ по 15 капсул ежедневно, всего 22 г, проводилась 10.07.2018, 11.07.2018. Состояние пациента после коррекции микробиоты кишечника: без существенной динамики на протяжении 30 суток после ТФМ: сокращение объема стула (с 996 мл до 625 мл/сут.) и увеличение его кратности (с 7 до 8 раз в сутки), улучшения аппетита нет. Характер стула - жидкий. Сохраняются примеси крови и слизь в стуле. К 30 суткам сохраняется тошнота и рвота. Снижение массы тела с 53,8 кг до 53 кг. Ремиссия острой РТПХ с поражением кишечника не зарегистрирована. Общая оценка по клиническим критериям через 30 суток после ТФМ - 3 балла.
Содержание Bacteroides fragilis group: до ТФМ - 1×108 в образце; в последующие сроки этот показатель снизился до 9×107 к 30 суткам и к 120 суткам - до 2×105 копий в образце, что свидетельствует об отсутствии эффективности проведенной ТФМ.
Среди 27 пациентов, больных лейкозами или лимфомами, которым проводилась ТФМ после аллогенной трансплантации гемопоэтических стволовых клеток, положительный эффект ТФМ при оценке заявляемым способом подтвердился в 11 случаях, параллельно с клиническим эффектом.
Заявляемый способ позволяет получить пороговую количественную оценку Bacteroides fragilis group в образце фекальной микробиоты для оценки эффективности ТФМ, значительно упростить выполнение способа, повысить его точность и экономичность.