Результат интеллектуальной деятельности: Биокатализатор, способ его приготовления и способ получения сложных эфиров с использованием этого биокатализатора
Вид РИД
Изобретение
Изобретение относится к биокатализаторам для проведения реакций органического синтеза, в том числе реакций этерификации, в результате которых синтезируются ценные продукты - сложные эфиры разнообразных кислот и спиртов, молекулы которых различаются количеством атомов углерода, изомерией углеродного скелета, наличием функциональных групп в молекулах (карбокси-, гидрокси-). Сложные эфиры являются востребованными продуктами пищевой, косметической и парфюмерной промышленностей и применяются в качестве душистых веществ, отдушек, увлажняющих и смягчающих компонентов, поверхностно-активных веществ, антиоксидантов. Получение данных продуктов с участием биокатализаторов, приготовленных на основе ферментов - липаз, протекает с высокой скоростью и селективностью, без образования побочных продуктов, при низких температурах (20-40°С) и атмосферном давлении, при этом конверсия органических кислот достигает ~90 %. Этот процесс называется также ферментативной этерификацией.
В качестве носителей для приготовления биокатализаторов для ферментативной этерификации используют современные наноструктурированные углеродные материалы с высокой удельной поверхностью и выраженной гидрофобностью, такие как углеродные нанотрубки (УНТ). Благодаря этим физико-химическим свойствам, УНТ эффективно адсорбируют белковые молекулы различных ферментов, в том числе, липаз. Биокатализаторы, приготовленные путем адсорбции липаз на углеродных нанотрубках, отличаются высокой ферментативной активностью, а также обладают высокой операционной стабильностью, что позволяет проводить процесс ферментативной этерификации в мягких условиях с высокой выходом конечного продукта в течение продолжительного времени.
Известен способ физической адсорбции липазы B из Candida antarctica на функционализированных многослойных углеродных нанотрубках (МУНТ), содержащих поверхностные карбоксильные группы (МУНТ-СООН), а также остатки, содержащие аминогруппу (МУНТ-СОNH-(CH2)6-NH2) и гидрофобные остатки, состоящие из 8 атомов углерода (МУНТ-СОО-(СН2)7СН3) [I. V. Pavlidis, T. Tsoufis, A. Enotiadis, D. Gournis, H. Stamatis, Functionalized Multi-Wall Carbon Nanotubes for Lipase Immobilization // Adv.Eng.Materials, 2010, 12 (5), 179-193. DOI: 10.1002/adem.200980021]. Адсорбированная на функционализированных нанотрубках липаза катализирует реакцию этерификации каприновой кислоты (С10:0) н-бутанолом в гексане при 30°С и перемешивании 200 об/мин. Максимальная величина адсорбции липазы, до 250 мг/г, наблюдается на карбоксилированных нанотрубках (МУНТ-СООН), тогда как максимальная скорость реакции этерификации наблюдается для липазы, адсорбированной на гидрофобизированных углеродных нанотрубках (МУНТ-СОО-(СН2)7СН3). Недостатком данного способа является сложная процедура функционализации углеродных нанотрубок путем синтеза поверхностных функциональных групп в результате проведения многостадийных химических реакций с использованием токсичных химических реагентов. Например, сначала исходные МУНТ окисляют в концентрированных серной и азотной кислотах при ультразвуковой обработке в течение 3 ч, затем используют реакции органического синтеза, используя различные реактивы: тионилхлорид и N,N-диметил формамид, гексаэтилен диамин, тетра-n-октиламмоний бромид и гексадецилбромид, растворенные в токсичных органических растворителях (толуол, хлороформ, тетрагидрофуран).
Известен способ физической адсорбции липазы из Candida rugosa на немодифицированных многослойных углеродных нанотрубках (МУНТ) в присутствии бычьего сывороточного альбумина [S. Shah, K. Solanki, M.N. Gupta. Enhancement of lipase activity in non-aqueous media upon immobilization on multi-walled carbon nanotubes // Chemistry Central Journal 2007, 1:30. doi:10.1186/1752-153X-1-30]. Удельная поверхность используемых МУНТ составляет ≥200 м2/г, внешний диаметр - 10-30 нм, длина нанотрубок - 1÷10 мкм. Адсорбированная липаза осуществляет реакцию переэтерификации между этилбутиратом и n-бутанолом в гексане при перемешивании 200 об/мин и 35°С; продуктами реакции являются эфир - бутилбутират, и этанол. Конверсия этил бутирата составляет 64-71% за 24 ч. Недостатком данного метода является использование дополнительных дорогостоящих компонентов, таких как бычий сывороточный альбумин и ионная жидкость, для повышения скорости переэтерификации субстратов.
Наиболее близким к предлагаемому изобретению является биокатализатор для получения сложных эфиров в процессе ферментативной этерификации органических кислот, приготовленный путем адсорбции рекомбинантной липазы из Thermomyces lanuginosus, продуцируемой клетками штамма, сконструированного на основе метилотрофных дрожжей Pichia pastoris (обознач. как липаза rPichia/lip), на мезопористом силикагеле и его наноуглеродсодержащих композитах [Пат. РФ 2668405, С12N 11/14, С12P 19/02, 08.06.2018]. С участием данного биокатализатора осуществляют ферментативную этерификацию жирных кислот алифатическими спиртами, в молекулах которых содержится от 2 до 18 атомов углерода. Процесс проводят в периодическом режиме в среде органических растворителей - смеси гексана и диэтилового эфира, при комнатной температуре и атмосферном давлении. Величина адсорбции липазы на силикагеле и его наноуглеродсодержащих композитах составляет 4-33 мг/г. Активность биокатализатора, измеренная в среде, содержащей 0.25 М декановой (каприновой) кислоты (С10:0) и 0.5 М изопентанола (С5), составляет 13-18 ЕА/г, при этом содержание биокатализатора в реакционной среде составляет 20-21 мас.%. Конверсия жирных кислот в каждом реакционном цикле, равная 80-90%, достигается за 6 ч. Биокатализаторы обладают высокой операционной стабильностью и работают в течение 12 реакционных циклов (не менее 500 ч) без потери первоначальной активности.
Недостатком известной группы изобретений является низкая ферментативная активность биокатализаторов, наблюдаемая в реакции этерификации. Для носителей силикатной природы данная активность биокатализаторов обусловлена неэффективной адсорбцией липазы на носителях.
Изобретение решает задачу приготовления биокатализаторов, обладающих высокой ферментативной активностью в реакции этерификации.
Приготовление биокатализаторов осуществляют путем адсорбции рекомбинантной липазы rPichia/lip на гранулированном макропористом углеродном аэрогеле (ГМУА). Процесс ферментативной этерификации проводят с участием приготовленного биокатализатора в периодическом режиме, в среде органических растворителей, при комнатной температуре и атмосферном давлении. Для получения продуктов - сложных эфиров, в качестве субстратов липазы используют органические кислоты и спирты, которые различаются строением молекул, а именно, количеством атомов углерода, наличием двойных/тройных связей, а также количеством функциональных групп (карбокси-, гидрокси-), например, дикарбоновые кислоты и полиолы.
Технический результат - высокая ферментативная активность и стабильность биокатализатора в процессах ферментативной этерификации широкого набора кислот и спиртов.
Задача решается составом биокатализатора - гранулированный макропористый углеродный аэрогель (ГМУА) и адсорбированная на нем рекомбинантная липаза rPichia/lip. Макропористый углеродный аэрогель получают в виде гранул разного диаметра (∅ 1-10 мм) путем высокотемпературного пиролиза этилена на нанесенном Fe,Co/MgO-катализаторе [Пат. РФ 2577273, 10.03.2016]. Гранулы состоят из хаотично переплетенных многослойных углеродных нанотрубок длиной 20-30 мкм и внешним диаметром 7-38 нм, при этом углеродный материал занимает не более 2% пористого пространства гранулы. Гранулированный макропористый углеродный аэрогель обладает следующими текстурными характеристиками: величина удельной поверхности составляет 80-100 м2/г, средний диаметр макропор пор 0.5-1 мкм (мезопоры и микропоры отсутствуют), насыпной вес 0.06-0.08 г/см3. В качестве липазы используют рекомбинантный фермент, продуцируемый специально сконструированным штаммом метилотрофных дрожжей Pichia pastoris [Пат. РФ 2668405, 08.06.2018], в патенте обозначена как липаза ТП]. Количество адсорбированной липазы в катализаторе составляет 30-100 мг/г.
Задача решается способом приготовления биокатализатора, который готовят путем адсорбции рекомбинантной липазы rPichia/lip на гранулированном макропористом углеродном аэрогеле с величиной удельной поверхности 80-100 м2/г, средним диаметром пор 0.5-1 мкм, насыпным весом 0.06-0.08 г/см3, в течение не более 24 ч, с последующей сушкой биокатализатора при комнатной температуре, количество адсорбированной липазы составляет 30-100 мг/г.
В процессе ферментативной этерификации в качестве первого субстрата (S1) используют насыщенные и ненасыщенные жирные кислоты с количеством атомов в молекуле 7 и 18, например, гептановую (энантовую, С7:0) и октадеценовую (олеиновую, С18:1) кислоты. В качестве второго субстрата (S2) используют различные спирты в двух-шести-кратном мольном избытке по отношению к кислоте S1, концентрация которой в реакционной среде составляет 0.1-0.3 М. Реакцию этерификации проводят при комнатной температуре (20-22°С) в органических растворителях - либо в диэтиловом эфире, либо в смеси гексана и диэтилового эфира в соотношении 1:1 (об./об.), либо в ацетоне. Для проведения ферментативной этерификации используют реактор смешения периодического действия. Содержание биокатализатора в реакционной среде составляет 0.8-2 мас.% (в прототипе 20-21 мас.%). Для идентификации продуктов реакций используют газовую, газо-жидкостную (двумерную и с масс-спектрометрической индикацией) и тонкослойную хроматографии.
Скорость реакции этерификации (W) количественно определяют титриметрически по убыли кислоты, для этого используют спиртовый раствор едкого натра с известной концентрацией. Конверсию кислоты (x) рассчитывают по формуле: x, % = 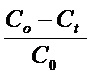 , где С0 и Сt - начальная и текущая концентрация кислоты, t - время реакции, час.
, где С0 и Сt - начальная и текущая концентрация кислоты, t - время реакции, час.
Активность приготовленных биокатализаторов (мкмоль/мин) рассчитывают по формуле: А = 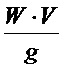 , где: W - скорость реакции, мкмоль мин-1 мл-1, V - объем реакционной среды, мл, g - масса биокатализатора, г. Активность выражают количеством международных единиц активности (ЕА) в расчете на 1 г биокатализатора. После завершения каждого реакционного цикла биокатализатор промывают органическим растворителем - либо диэтиловым эфиром, либо смесью гексана с диэтиловым эфиром состава 1:1 (об./об.), либо ацетоном, в течение 18-20 ч, затем проводят очередной реакционный цикл, заливая биокатализатор свежеприготовленной реакционной смесью.
, где: W - скорость реакции, мкмоль мин-1 мл-1, V - объем реакционной среды, мл, g - масса биокатализатора, г. Активность выражают количеством международных единиц активности (ЕА) в расчете на 1 г биокатализатора. После завершения каждого реакционного цикла биокатализатор промывают органическим растворителем - либо диэтиловым эфиром, либо смесью гексана с диэтиловым эфиром состава 1:1 (об./об.), либо ацетоном, в течение 18-20 ч, затем проводят очередной реакционный цикл, заливая биокатализатор свежеприготовленной реакционной смесью.
Сущность изобретения иллюстрируется следующими примерами и таблицами.
Пример 1.
Биокатализатор для получения сложных эфиров готовят следующим образом. Гранулы макропористого углеродного аэрогеля, обладающие удельной поверхностью 80 м2/г, диаметром макропор 0.5 мкм и насыпным весом 0.06 г/см3, массой 0.1 г заливают 7.5 мл раствора липазы в буфере (0.02 М фосфатный буфер рН 7.0) с концентрацией белка 4.9 мг/мл. Адсорбцию липазы проводят течение 4 ч при комнатной температуре (20-22°С). Затем биокатализатор промывают этим же буфером и высушивают при 20-22°С в течение 1 сут. Биокатализатор содержит 8 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 8 мг/г.
Реакцию этерификации проводят следующим образом. Раствор субстратов - гептановой кислоты и бутанола, готовят в органическом растворителе, представляющем смесь гексана и диэтилового эфира в пропорции 1:1 (об./об.). Навеску биокатализатора (0.02 г) заливают 3.0 мл 0.25 М раствором гептановой кислоты и добавляют 0.17 мл бутанола (С4), при этом начальная концентрация спирта составляет 0.5 М. Содержание биокатализатора в реакционной смеси составляет 0.8 мас.%.
В описанных условиях конверсия гептановой кислоты, равная 84%, достигается за 2 ч. Активность биокатализатора составляет 504 ЕА/г, что в 34 раз выше, чем в прототипе в аналогичных условиях.
Операционная стабильность биокатализатора в периодическом процессе ферментативной этерификации сравнима с прототипом, так, биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 2.
Биокатализатор аналогичен пр.1, только продолжительность адсорбции составляет 8 ч. Биокатализатор содержит 17 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 17 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 82 %, достигается за 2 ч. Активность биокатализатора составляет 498 ЕА/г, что в 33 раза выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают, затем проводят очередной реакционный цикл.
Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 3.
Биокатализатор аналогичен пр.1, только продолжительность адсорбции составляет 24 ч. Биокатализатор содержит 31 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 31 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 85%, достигается за 2 ч. Активность биокатализатора составляет 602 ЕА/г, что в 40 раз выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают, затем проводят очередной реакционный цикл.
Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 4.
Биокатализатор аналогичен пр.1, только продолжительность адсорбции составляет 48 ч. Биокатализатор содержит 43 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 43 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 85%, достигается за 2 ч. Активность биокатализатора составляет 544 ЕА/г, что в 36 раза выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают, затем проводят очередной реакционный цикл.
Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 5.
Биокатализатор аналогичен пр.1, только продолжительность адсорбции составляет 72 ч. Биокатализатор содержит 49 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 49 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 85%, достигается за 2 ч. Активность биокатализатора составляет 506 ЕА/г, что в 34 раза выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают, затем проводят очередной реакционный цикл. Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 6.
Биокатализатор аналогичен пр.1, только продолжительность адсорбции составляет 96 ч. Биокатализатор содержит 51мг липазы, адсорбированной на 1г углеродного аэрогеля, то есть величина адсорбции составляет 51 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 80%, достигается за 2 ч. Активность биокатализатора составляет 464 ЕА/г, что в 31 раз выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают смесью органических растворителей по пр.1, затем проводят очередной реакционный цикл. Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Пример 7.
Биокатализатор аналогичен пр.3, только в качестве носителя используют гранулированный макропористый аэрогель с удельной поверхностью 100 м2/г, диаметром макропор 1 мкм и насыпным весом 0.08 г/см3. Гранулы макропористого углеродного аэрогеля массой 0.1 г заливают 10.0 мл раствора липазы в буфере (0.02 М фосфатный буфер рН 7.0) с концентрацией белка 10.9 мг/мл. Адсорбцию липазы проводят течение 24 ч при комнатной температуре (20-22°С). Затем биокатализатор промывают этим же буфером и высушивают при 20-22°С в течение 1 суток. Биокатализатор содержит 96 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 96 мг/г.
Реакцию этерификации проводят аналогично пр.1, только содержание биокатализатора в реакционной смеси составляет 2.0 мас.%. Конверсия гептановой кислоты, равная 85%, достигается за 2 ч. Активность биокатализатора составляет 543 ЕА/г, что в 36 раз выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают органическим растворителем по пр.1, затем проводят очередной реакционный цикл. Биокатализатор полностью сохраняет начальную активность в течение 30 реакционных циклов (720 ч).
Пример 8.
Биокатализатор аналогичен пр.7, только продолжительность адсорбции составляет 72 ч. Биокатализатор содержит 152 мг липазы, адсорбированной на 1 г углеродного аэрогеля, то есть величина адсорбции составляет 152 мг/г.
Реакцию этерификации проводят аналогично пр.1. Конверсия гептановой кислоты, равная 80%, достигается за 2 ч. Активность биокатализатора составляет 306 ЕА/г, что в 20 раз выше, чем в прототипе. После завершения реакционного цикла биокатализатор промывают органическим растворителем, затем проводят очередной реакционный цикл. Биокатализатор полностью сохраняет начальную активность в течение 11 реакционных циклов (264 ч).
Результаты примеров 1-8 представлены в таблице 1.
Таблица 1
|
* Концентрация гептановой кислоты и бутанола 0.25 М и 0.50 М, соответственно.
Из таблицы 1 видно, что для приготовления биокатализатора с максимальной ферментативной активностью продолжительность адсорбции липазы rPichia/lip составляет не более 24 ч. Оптимальная величина адсорбции составляет 30-100 мг/г, что во много раз выше, чем в прототипе.
Пример 9. Этерификация
Биокатализатор по пр.8 используют в реакции этерификации с участием бутанола, только используют ненасыщенную октадеценовую (олеиновую, С18:1) кислоту, содержащую одну двойную связь. Концентрации кислоты и спирта составляют 0.15 М и 0.6 М, соответственно. Реакцию проводят в смеси гексана и диэтилового эфира в отношении 1:1. Конверсия олеиновой кислоты составляет 75% за 2 ч. Активность биокатализатора в описанных условиях составляет 310 ЕА/г. Данная реакция в прототипе не описана.
Пример 10. Этерификация
Биокатализатор по пр.8 используют в реакции этерификации с участием бутанола, только используют двухосновную 1,4-бутан-дикарбоновую (адипиновую) кислоту, СООН-(СН2)4-НСООС, реакцию проводят в диэтиловом эфире. Концентрации кислоты и спирта составляют 0.1 М и 0.3 М, соответственно. Конверсия адипиновой кислоты составляет 45% и 79% за 2 ч и 24 ч, соответственно. Активность приготовленного биокатализатора в описанных условиях данной реакции составляет 38 ЕА/г. Данная реакция в прототипе не описана.
Пример 11. Этерификация
Биокатализатор по пр.3 используют в реакции этерификации гептановой кислоты, только в реакции используют 2-пропен-1-ол (аллиловый) спирт СН2=СН-СН2ОН. Концентрация кислоты и спирта составляют 0.15 М и 0.3 М, соответственно. Реакцию проводят в смеси гексана и диэтилового эфира состава 1:1 (об./об.). Конверсия гептановой кислоты составляет 29% за 5ч. Активность приготовленного биокатализатора в описанных условиях составляет 43 ЕА/г. Данная реакция в прототипе не описана.
Пример 12. Этерификация
Биокатализатор по пр.8 используют в реакции этерификации гептановой кислоты, только в реакции этерификации используют 2-пропин-1-ол (пропаргиловый) спирт СН=С-СН2ОН, с тройной связью в молекуле. Концентрация кислоты и спирта составляют 0.25 М и 0.6 М, соответственно. Реакцию проводят в смеси гексана и диэтилового эфира состава 1:1 (об./об.). Конверсия гептановой кислоты составляет 40% за 2 ч. Активность приготовленного биокатализатора составляет 260 ЕА/г. Данная реакция в прототипе не описана.
Пример 13. Этерификация.
Биокатализатор по пр.8 используют для этерификации гептановой кислоты, только в реакции используют двухатомный спирт - этандиол-1,2 (этиленгликоль), и реакцию проводят в ацетоне. Концентрация кислоты и спирта составляют 0.25 М и 0.6 Н, соответственно. Конверсия гептановой кислоты составляет 17% и 70% за 2 ч и 24 ч, соответственно. Активность биокатализатора в описанных условиях составляет 24 ЕА/г. Данная реакция в прототипе не описана.
Пример 14. Этерификация
Биокатализатор по пр.8 используют в реакции этерификации олеиновой кислоты в условиях по пр.9, только в реакции используют пропаргиловый спирт, СН=С-СН2ОН. Концентрация кислоты и спирта составляют 0.15 М и 0.3 М, соответственно. Конверсия олеиновой кислоты составляет 22% за 24 ч. Активность приготовленного биокатализатора составляет 3 ЕА/г. Данная реакция в прототипе не описана.
Результаты примеров 3, 9-14 по получению сложных эфиров представлены в таблице 2.
Таблица 2
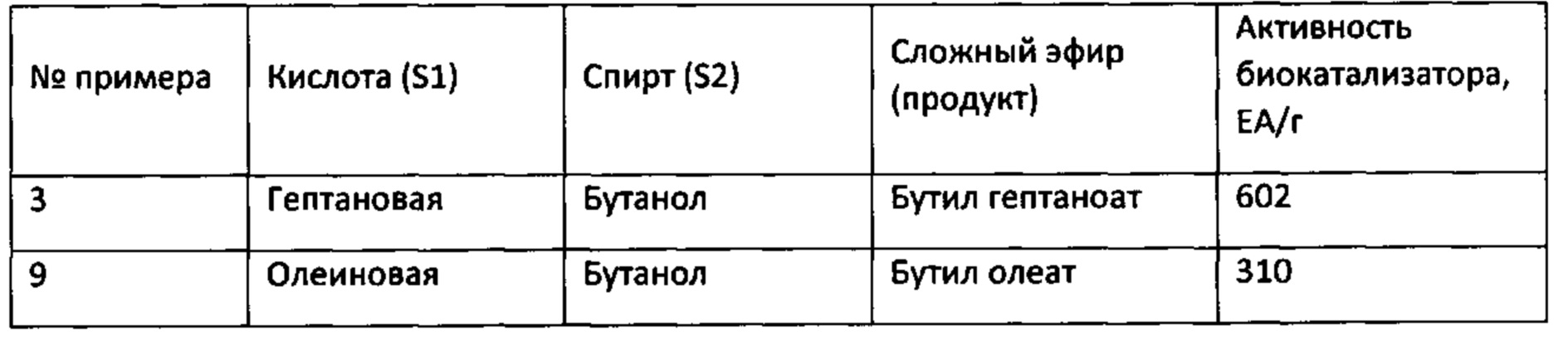
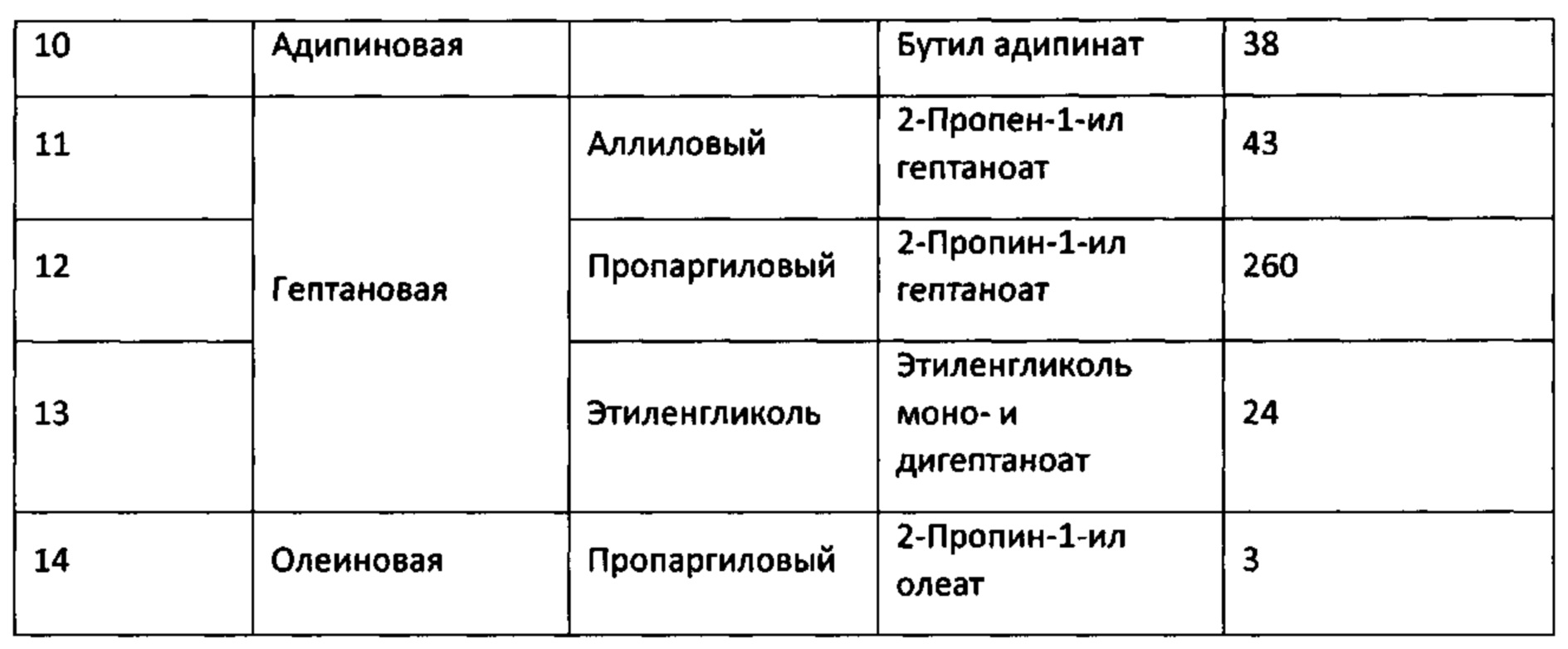
Из приведенных выше примеров видно, что биокатализаторы, приготовленные путем адсорбции рекомбинантной липазы rPichia/lip на гранулированном макропористом углеродном аэрогеле, обладают высокими значениями ферментативной активности, превышающими активность прототипа более чем в 30 раз.
Биокатализаторы также обладают высокой операционной стабильностью в реакциях зтерификации, сопровождающихся синтезом ценных продуктов - различных сложных эфиров. Биокатализаторы сохраняют первоначальную активность при проведении периодических процессов зтерификации в течение не менее 260 ч, протекающих в органических растворителях (гексане, диэтиловом эфире, ацетоне) при комнатной температуре и атмосферном давлении.

