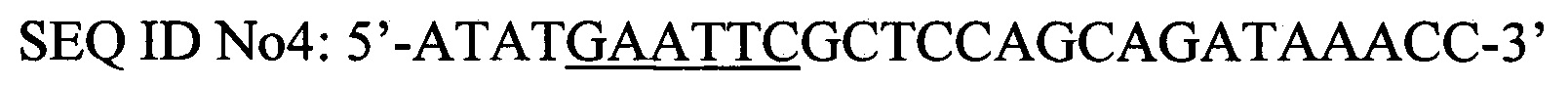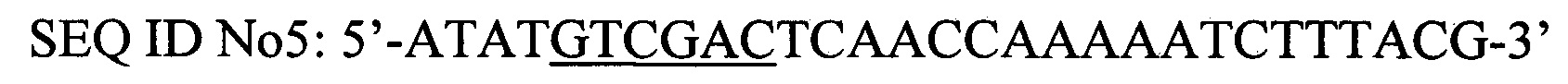Результат интеллектуальной деятельности: Способ получения ферментного препарата фосфолипазы А2 с применением рекомбинантного штамма-продуцента Pichia pastoris X-33/ pPICZαA-PhoA2-StV
Вид РИД
Изобретение
Изобретение относится к области промышленной биотехнологии и может быть использовано в пищевой промышленности при получении лизофосфолипидов и поверхностно-активных веществ с эмульгирующими свойствами.
Фосфолипаза А2 - фермент, катализирующий гидролиз сложноэфирной связи во втором положении глицерофосфолипидов [Головач О.А., Таганович А.Д. Роль фосфолипаз А2 в патологии легких // Медицинский журнал. - 2005. - №1. - с. 1-6]. При действии фосфолипазы А2 на фосфолипид образуется 2-лизофосфолипид и жирная кислота. Стерическая и позиционная специфичность фосфолипазы А2 обусловливает ее высокую ценность в биохимии липидов и химии. Фермент используют для установления позиционного распределения жирных кислот при анализе фосфоглицеридов, для разделения рацемических смесей липидов, а также в синтезе липидов для получения фосфоглицеридов со смешанным составом жирных кислот. Таким образом, ферментный препарат фосфолипаза А2 может использоваться в пищевой промышленности в качестве вспомогательного средства для образования лизофосфолипидов и поверхностно-активных веществ с эмульгирующими свойствами [Довжикова И.В. Гистохимическое исследование фосфолипидов в плаценте беременных при герпесе // Бюллетень физиологии и патологии дыхания: Дальневосточный научный центр физиологии и патологии дыхания (Благовещенск). - 2003. - №15. - с. 19-23; Брагина Н.А., Чупин В.В., Булгаков В.Г., Шальнев А.Н. Липидные ингибиторы фосфолипазы А2 // Биоорганическая химия. - 1999. - том 25. - №2. - с. 83-96; Murakami М, Kudo I. Phospholipase А2 // J Biochem. - 2002. - Mar. - 131(3):285. - c. 92].
Известен способ получения ферментного препарата фосфолипазы А2 с помощью генномодифицированного плесневого гриба Aspergillus niger PLA-54 (США) с геном, кодирующим фосфолипазу свиной поджелудочной железы из Aspergillus niger GAM-53, и кДНК поджелудочной железы свиньи Aspergillus niger PLA-54 с геном, продуцирующим фосфолипазу А2 из Aspergillus niger GAM-53 (NRRL3122 Aspergillus niger) [GRAS notification of phospholipase A2 from a genetically modified strain of Aspergillus niger // DSM. - 28.10.2005].
Известно также, что ферментный препарат фосфолипазы А2 можно получать с помощью штамма Trichoderma reesei RF8793 (Германия), являющегося носителем гена, кодирующего фосфолипазу А2 плесневого грибка Aspergillus nishimurae [A Lipase Enzyme Preparation Derived from Streptomyces viotaceoruber // Genencor International Inc. - 09.02.2004].
Также в США выпускают ферментный препарат фосфолипазы А2, полученный с помощью Streptomyces violaceoruber JAS-591 [A phospholipase А2 preparation produced by Streptomyces violaceoruber expressing the gene encoding phospholipase A2 from Streptomyces violaceoruber // Nagase ChemteX Corporation. - 17.08.2006].
В Японии выпускают ферментный препарат фосфолипазы А2 Streptomyces violaceoruber, полученный с применением рекомбинантного штамма-продуцента Streptomyces violaceoruber AS-10 [GRAS notification for phospholipase A2 from a genetically modified strain of Tricho-derma reesei // AB ENZYMES GmbH. - 12.10.2013].
Основным недостатком данных способов является продолжительное время культивирования штамма (более 7 суток) и использование трудоемких способов очистки ферментного препарата, таких как хроматография и высаливание, требующих внесения дополнительных дорогостоящих реагентов и дополнительной аппаратуры.
Все вышеизложенное свидетельствует о перспективности создания штаммов-продуцентов фосфолипазы А2 на основе других микроорганизмов, в частности дрожжей. Среди всех, отличных от Saccharomyces, дрожжей наиболее применяемой гетерологичной системой для производства коммерчески релевантных рекомбинантных белков являются Pichia pastoris. В сравнении с S. cerevisiae, они достигают более высоких уровней экспрессии, а гипергликозилирование у них не столь высоко. Тем не менее, наиважнейшей особенностью Pichia pastoris является то, что они могут использовать метанол в качестве единственного источника углерода и энергии. Таким образом, переключение с глюкозной среды на метанольную индуцирует высокий уровень экспрессии рекомбинантного белка в этом хосте. В Pichia pastoris рекомбинантные белки могут экспрессироваться внутриклеточно, секретируясь в среду или прикрепляясь к клеточной поверхности. Поскольку метилотрофные дрожжи слабо секретируют собственные белки, секреция рекомбинантных белков в межклеточную среду предпочитается внутриклеточной продукции, поскольку представляет собой первый этап очистки рекомбинантного белка.
Известен патент RU 2409671 (МПК C12N 15/00, опубл. 20.01.2011), относящийся к рекомбинантной плазмиде pP10PLC-Bc для экспрессии гена фосфолипазы С PLC-Bc в дрожжах Pichia pastoris и штамму дрожжей Pichia pastoris PLC-Bc-1 ВКПМ Y-3359 - продуценту фосфолипазы С PLC-Bc. Отечественных аналогов на рынке ферментных препаратов фосфолипазы А2 не представлено.
Изобретение по патенту CN 104328095 (МПК A21D 8/04; С11В 3/00; C12N 1/19; C12N 15/55; C12N 15/81; C12N 9/16, опубл. 2015-02-04) относится к созданию ферментного препарата фосфолипазы А2 с наиболее приемлемым рН. Согласно ему, оптимизированную последовательность гена фосфолипазы А2, полученной из S.violaceoruber, клонируют в плазмиду pPIC9K, а затем рекомбинантная плазмида встраивается в хромосому Pichia pastoris.
Дрожжи Pichia pastoris имеют статус безопасных для человека согласно реестру Федерального управления по контролю за пищевыми продуктами и лекарственными средствами США (GRAS), что позволяет их использовать в качестве продуцентов рекомбинантных ферментов, пригодных для применения в пищевой промышленности.
Задача изобретения - конструирование рекомбинантного штамма Pichia pastoris и плазмиды, кодирующей синтез рекомбинантного белка PhoA2-StV, для получения ферментного препарата фосфолипазы А2 в лабораторных условиях.
Технический результат заключается в расширении арсенала способов получения ферментных препаратов фосфолипазы А2, разработке способа получения ферментного препарата фосфолипазы А2 с содержанием целевого белка не менее 2 мг/мл.
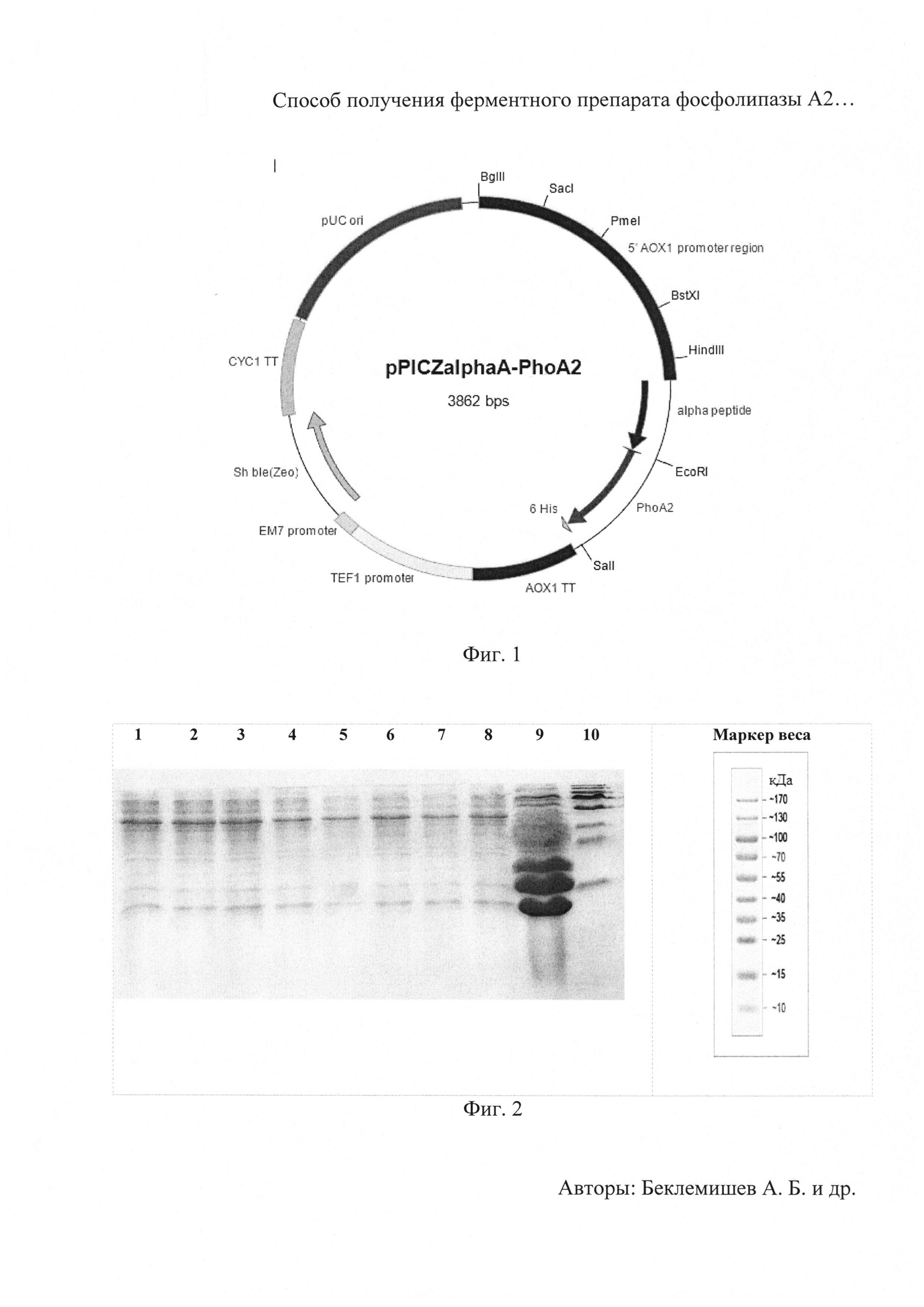
Технический результат достигается созданием генетической конструкции в виде рекомбинантного вектора pPICZαA-PhoA2-StV и штамма Pichia pastoris Х-33/ pPICZαA-PhoA2-StV, обеспечивающих индуцируемый синтез с высоким и стабильным выходом рекомбинантной фосфолипазы А2 в культуральную среду. Способ получения рекомбинантной фосфолипазы А2 PhoA2-StV, заключается в культивировании указанного штамма-продуцента в жидкой питательной среде, выделении культуральной жидкости путем осаждения дрожжевых клеток центрифугированием, очистке и концентрировании ферментного препарата.
Ген фосфолипазы А2 SEQ ID No1 получен путем химико-ферментативного синтеза нуклеотидной последовательности, кодирующей фосфолипазу А2 в Streptomyces violaceoruber из GenBank (Sequence ID AY359866.1). Для увеличения экспрессии гена фосфолипазы А2 за счет увеличения эффективности считывания информации с данной мРНК на рибосомах последовательность была оптимизирована по ко донам для Pichia pastoris в онлайн-программе IDT (Integrated DNA Technologies).
Для решения задачи предлагается способ конструирования плазмиды pPICZαA-PhoA2-StV, обеспечивающей синтез фосфолипазы А2 в клетках дрожжей Pichia pastoris. Согласно предложенному способу осуществляют расщепление вектора pPICZαA («Invitrogen») ферментами рестрикции EcoRI SEQ ID No2 и SalI SEQ ID No3, расщепленный вектор лигируют с геном фосфолипазы А2 PhoA2-StV, затем полученной лигазной смесью трансформируют клетки Escherichia coli и отбирают клоны, содержащие рекомбинантную плазмиду pPICZαA-PhoA2-StV. Проводят амплификацию плазмиды pPICZαA-PhoA2-StV в клетках Escherichia coli путем их культивирования в стерильной питательной среде LB с добавлением антибиотиков и выделение плазмиды pPICZαA-PhoA2-StV из клеток Escherichia coli с помощью набора «Plasmid Midiprep».
Экспрессия гена фосфолипазы А2 в составе плазмиды pPICZαA-PhoA2-StV находится под контролем промотора гена АОХ1, содержащего области, обеспечивающие активацию транскрипции в присутствии метанола в культуральной среде, а также область инициации транскрипции. Промотор гена АОХ1 относится к числу наиболее сильных дрожжевых промоторов. Уровень экспрессии генов, находящихся под контролем АОХ1 промотора, эффективно регулируется источниками углерода. Транскрипция гена АОХ1 полностью блокирована при выращивании дрожжей на среде с глюкозой, на среде с глицерином наблюдается только базальный уровень экспрессии гена. Использование метанола в качестве единственного источника углерода значительно усиливает экспрессию гена АОХ1 и, следовательно, генов, находящихся под контролем АОХ1 промотора. Это позволяет регулировать синтез фосфолипазы А2 в клетках дрожжей. Регулируемая экспрессия клонированного гена позволяет существенно снизить метаболическую нагрузку на клетку дрожжей.
В качестве продуцента фосфолипазы А2 предложен штамм Pichia pastoris Х-33/ pPICZαA-PhoA2-StV. Штамм Pichia pastoris Pichia pastoris Х-33/ pPICZαA-PhoA2-StV получен при трансформации штамма дрожжей Pichia pastoris Х-33 (Wild Type, «Invitrogen») плазмидой pPICZαA-PhoA2-StV согласно изобретению. Штамм Pichia pastoris Pichia pastoris Х-33/ pPICZαA-PhoA2-StV зарегистрирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ Y-4333.
Рекомбинантный штамм Pichia pastoris Х-33/ pPICZαA-PhoA2-StV характеризуется следующими признаками.
Морфологические признаки. Клетки округлой, слегка овальной формы, размером 3-7 мкм, часть клеток имеет на поверхности почки или соединена с дочерними клетками.
Культуральные признаки. Клетки хорошо растут на полной органической среде YPD - дрожжевой экстракт - 1%, пептон - 1%, глюкоза - 2%. Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base («Difco», США), а также на других синтетических средах для дрожжей, содержащих в качестве источника углерода глюкозу (2%) или глицерин (1%). При росте на твердых средах клетки образуют гладкие, круглые колонии с матовой поверхностью, светло-кремового цвета, край неровный. При росте в жидких средах образуют интенсивную ровную суспензию. Культура имеет характерный запах метилотрофных дрожжей.
Физиолого-биохимические признаки. Клетки растут в пределах от 4 до 37°С. Оптимальной температурой выращивания является 30°С. При росте в аэробных условиях клетки незначительно закисляют среду. Оптимум рН для роста составляет 4,5-6,5. В качестве источника углерода клетки могут использовать многие простые соединения, такие как глюкоза, глицерин, метанол. В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину. Клетки способны к аэробному и анаэробному росту.
Устойчивость к антибиотикам. Клетки штамма характеризуются устойчивостью к зеоцину (25 мкг/мл).
Штамм хранится обычным способом в суспензии с глицерином (15%) при -80°С.
В результате трансформации линеаризованной плазмидой и последующей гомологичной рекомбинации происходит встраивание экспрессионной кассеты в хромосому дрожжей Pichia pastoris, что обеспечивает стабильное поддержание клонированного гена фосфолипазы А2.
Заявляемый способ получения рекомбинантной фосфолипазы А2 PhoA2-StV заключается в культивировании клеток штамма Pichia pastoris Х-33/ pPICZαA-PhoA2-StV в минеральной питательной среде BSM, выделении культуральной жидкости путем отделения биомассы центрифугированием, очистке и концентрировании ферментного препарата. Очистку ферментного препарата осуществляют с помощью ультрафильтрационных мембран с размером пор не менее 100 кДа, концентрирование ферментного препарата проводят также с помощью ультрафильтрационных мембран, но с размером пор не более 10 кДа. Выход рекомбинантной PhoA2 в результате применения описанного способа составляет не менее 0,1 г рекомбинантного белка с 1 л культуральной жидкости.
Рекомбинантный белок PhoA2 имеет молекулярную массу 14 кДа, оптимальную температуру реакции 45-50°С, оптимальный рН=8,5, повышенную активность в присутствии 1 мМ Са2+ в инкубационной среде.
Данные по физико-химической характеристике и определению ферментативной активности рекомбинантной фосфолипазы А2 свидетельствуют о наличии у исследуемого полипептида фосфолипазной активности, присущей его природному аналогу. Рекомбинантная фосфолипаза А2 может быть успешно использована в биотехнологических процессах, проводимых при температурах от 30 до 55°С и рН от 2 до 11, а также как модель для изучения молекулярных механизмов рН-устойчивости.
Существенными преимуществом заявляемого способа являются:
- использование гена, оптимизированного для экспрессии в Pichia pastoris;
- использование рекомбинантного штамма, что позволяет получать при биосинтезе большое количество высокоактивной рекомбинантной PhoA2;
- использование упрощенной схемы очистки и концентрирования рекомбинантного белка PhoA2-StV, что позволяет обеспечить невысокую себестоимость готового ферментного препарата.
Фиг. 1 Карта плазмиды pPICZαA-PhoA2-StV.
Фиг. 2 Электрофореграмма белков культуральной жидкости штамма-продуцента Pichia pastoris Х-33/ pPICZαA-PhoA2-StV. М - белковый маркер, 1-10 - культуральная жидкость трансформантов Pichia pastoris Х-33 (9 - культуральная жидкость штамма-продуцента Pichia pastoris Х-33/ pPICZαA-PhoA2-StV).
Способ получения функционально активного белка на основе использования гена, кодирующего фосфолипазу бактерии Streptomyces violaceoruber иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pPICZαA-PhoA2-StV.
Ген фосфолипазы А2 был получен путем химико-ферментативного синтеза нуклеотидной последовательности, кодирующей фосфолипазу А2 в Streptomyces violaceoruber, полученной из открытых баз данных.
Наработку фрагмента ДНК, содержащего полноразмерный ген PhoA2-StV, получают при помощи полимеразной цепной реакции с использованием в качестве матрицы плазмиды, содержащей синтезированный ген PhoA2-StV SEC ID No 1, и праймеры PhoA2 EcoRI for SEC ID No4 и PhoA2 Sail rev mut SEC ID No5.
Реакцию амплификации гена PhoA2 проводят с набором реагентов Accu-Prime Pfx polymerase, используя в качестве матрицы плазмиду с геном PhoA2 (50 нг) с помощью праймеров PhoA2 EcoRI for и PhoA2 Sail rev mut. Процесс амплификации состоит из 15 циклов со следующими параметрами: денатурация 95°С - 20 сек, отжиг 60°С - 20 сек, элонгация 68°С - 30 сек.
После амплификации очищеный фрагмент ДНК обрабатывают рестриктазами EcoRI и Sail, чистят на стекловолоконных фильтрах и клонируют в вектор pPICZαA, обработанный теми же рестриктазами.
Полученной лигазной смесью трансформируют компетентные клетки Е. coli XL 10 Gold. Выделенные из клонов плазмиды анализируются на присутствие вставки картированием; отсутствие мутаций подтверждается секвенированием.
Пример 2. Получение штамма Pichia pastoris Х-33/ pPICZαA-PhoA2-StV, трансформированного плазмидой pPICZαA-PhoA2-StV, несущей ген фосфолипазы А2.
Штамм-продуцент получают путем трансформации химически компетентных клеток штамма Pichia pastoris Х-33 с помощью электропорации рекомбинантной плазмидой pPICZαA-PhoA2-StV.
Суспензию компетентных клеток Pichia pastoris Х-33 в количестве 40 мкл помещают в охлажденные эппендорфы. Добавляют к компетентным клеткам 5-20 мкг линеаризованной плазмиды pPICZαA-PhoA2-StV и осторожно перемешивают. Помещают эппендорфы в ледяную баню на 5 мин. Переносят смесь в охлажденную стерильную кювету для электропоратора с шириной зазора 2 мм. Электропорацию клеток проводят в режиме Fungi -> Pic. После проведения трансформации в кюветы вносят 1 мл 1 М ледяного сорбита. Переносят смесь в стерильную пробирку с 1 мл среды YPD и инкубируют при 30°С в течение 1-3 часов.
Аликвоты трансформированных клеток Pichia pastoris Х-33 100 и/или 200 мкл пересевают на твердую питательную среду YPD с антибиотиком зеоцином в концентрации 100 мкг/мл и инкубируют в термостате на +30°С в течение 48-72 ч.
Проросшие колонии трансформированных клеток Pichia pastoris Х-33 пересевают в культуральные планшеты, содержащие по 2 мл среды YPG: дрожжевой экстракт-1%, пептон - 1%, глицерин - 0,5%. В засеянные культуральные планшеты в стерильных условиях необходимо вносить по 1% метанола от объема питательной среды в каждую засеянную лунку каждые 24 часа с момента засева. Планшеты размещают в шейкере-инкубаторе и устанавливают следующие условия: скорость перемешивания - 250 об/мин, температурный режим - 30°С, продолжительность культивирования - 72 ч.
Для определения продуктивности штамма культуральную жидкость из планшетов, отделенную от биомассы, анализируют электрофорезом в 15% полиакриламидном геле. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в культуральной жидкости составляет не менее 50% от всех белков (Фиг. 2).
Как следует из приведенных примеров, заявляемое изобретение позволяет получать с помощью штамма-продуцента Pichia pastoris Х-33/ pPICZαA-PhoA2-StV активную рекомбинантную фосфолипазу А2, секретируемую в питательную среду.
Пример 3. Культивирование штамма Pichia pastoris Х-33/ pPICZαA-PhoA2-StV в 5 - литровом ферментере, отделение биомассы, очистка и концентрирование ферментного препарата.
Штамм-продуцент рекомбинантной фосфолипазы А2 культивируют в 5 л ферментере марки Inforce. Объем среды в ферментере - 2 л, температура во время культивирования 30°С, рН=6,0, концентрация растворенного кислорода - не менее 20%, скорость перемешивания - 900-1100 об/мин.
Инокулят в объеме 200 мл выращивают в конических колбах на 500 мл, заполненных на 100 мл питательной средой YPG с дрожжевым экстрактом -1%, пептоном - 1%, глицерином - 2%, в течение 24 ч при 30°С на орбитальной качалке с числом оборотом 250 в минуту. Инокулят вносят в ферментер, его объем составляет 10% от объема питательной среды в ферментере. Питательная среда в ферментере имеет следующий состав на 1 литр: 178 г NaH2PO4*12H2O, 0,9 г CaSO4, 18,2 г K2SO4, 14,9 г MgSO4*7H2O (стерилизуют отдельно), 4,1 г KOH, 40 г глицерина, 6 г мочевины, 41,3 г лимонной кислоты. Раствор микроэлементов (РТМ) готовят растворением в 100 мл 0,38 г CuSO4, 0,008 г NaI, 0,46 г MnSO4*7H2O, 0,023 г Na2MoO4*2H2O, 0,002 г борной кислоты, 0,092 г CoCl2*7H2O, 4,72 г ZnSO4*7H2O, 6,5 г FeSO4*7H2O, 0,5 г серной кислоты, 0,02 биотина.
Для наращивания биомассы до высоких плотностей используют подпиточный раствор, содержащий 88 мл глицерина и 2,7 мл раствора РТМ. Каждые 2 часа вносится по 37 мл подпиточного раствора. Всего внесение осуществляется 6 раз.
Через 20 часов с момента начала ферментации вносится каждый час по 8 мл заранее подготовленного индукционного раствора, состоящего из 6,7 мл стерильного раствора РТМ и 553,3 мл метанола. Через 24 часа с момента начала ферментации температуру проведения процесса снижают до 20°С. Через 95 часов с момента начала ферментации прекращают подачу индуктора и прекращают ферментацию.
После 95 часов от начала индукции клеточную массу отделяют центрифугированием. Белковый состав образцов культуральной жидкости после внесения индуктора в среду анализировался с помощью электрофореза в 10% полиакриламидном геле (Фиг. 2). Электрофорез Проводят в следующих условиях: 200 V, 50 mA, 25 W.
Отделенную от биомассы культуральную жидкость для отделения раствора целевого белка фосфолипазы А2 от высокомолекулярных примесей отправляют на ультрафильтрацию на мембранном фильтре с размером пор 100 кДа. Полученный фильтрат, содержащий целевой белок фосфолипазы А2 для отделения низкомолекулярных примесей и концентрирования отправляют на ультрафильтрацию на мембранном фильтре с размером пор 5 кДа. Содержание целевого белка в готовом ферментном препарате - не менее 10000 ед/мл.
Как следует из приведенных примеров, заявляемое изобретение позволяет получать активную рекомбинантную фосфолипазу при использовании относительно простых и надежных технологий культивирования клеток штамма- продуцента и выделения, а также ферментный препарат на ее основе в течение 20 часов, включая этап очистки и концентрирования ферментного препарата.
Перечень последовательностей
Оптимизированная нуклеотидная последовательность гена фосфолипазы А2 из Streptomyces violaceoruber
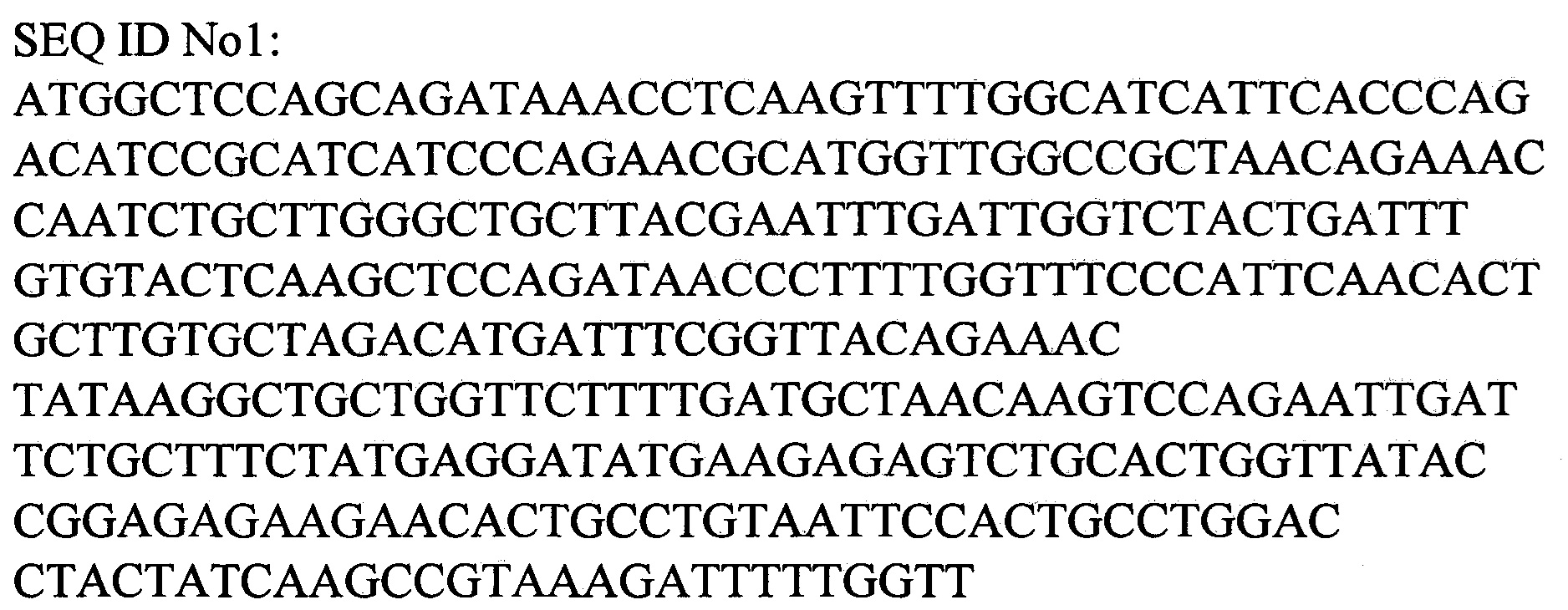
Ферменты рестрикции
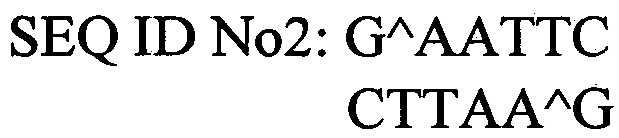
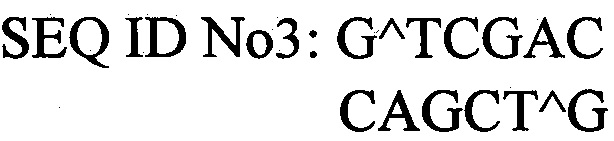
Праймеры