Результат интеллектуальной деятельности: Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов
Вид РИД
Изобретение
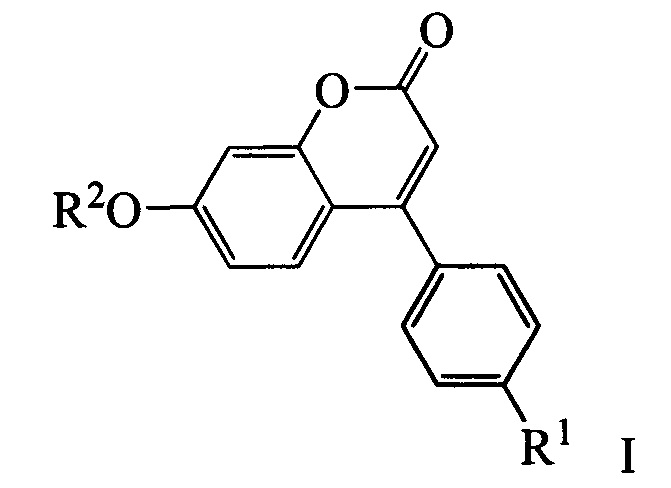
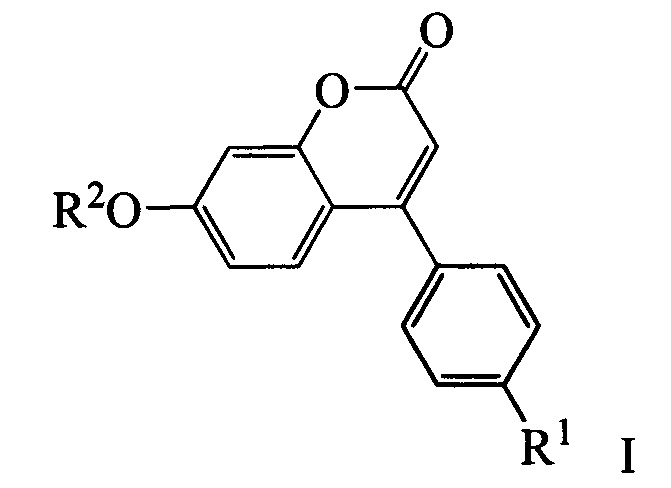
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к соединениям, представляющим собой производные фенилкумаринов общей формулы I:
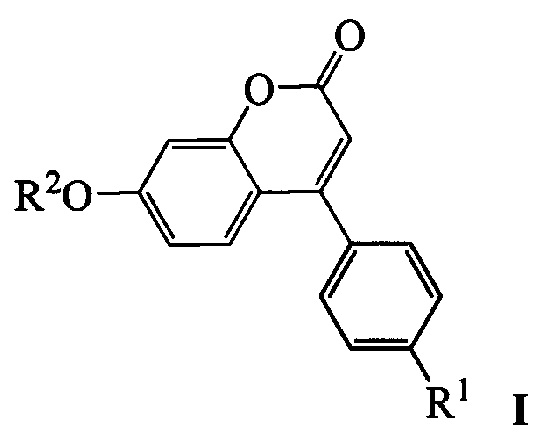
где R1 может быть атомом водорода, галогеном или алкокси группой, a R2 может быть бензилом, 3,7-диметилокта-2,6-диен-1-илом, (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метилом или (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этилом, у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека  и сенсибилизировать опухоли к действию противоопухолевых агентов.
и сенсибилизировать опухоли к действию противоопухолевых агентов.
Традиционная химиотерапия онкологических заболеваний направлена на повреждение ДНК злокачественных клеток, и одним из факторов, влияющих на ее результат, является эффективность систем репарации ДНК. Во многих раковых клетках отдельные ферменты репарации ДНК гиперэкспрессированы, что в сочетании с ускоренной клеточной пролиферацией приводит к резистентности таких опухолей к лекарственным препаратам. Развитие молекулярной биологии привело к принципиальному изменению подходов к созданию новых противоопухолевых препаратов. Важным стратегическим направлением лечения онкологических заболеваний является избирательное подавление активности ряда ферментов, вовлеченных в регуляцию жизнедеятельности клеток. В последнее время соединения - ингибиторы репарации ДНК рассматриваются как потенциальные лекарства [Hosoya N., Miyagawa K., Targeting DNA damage response in cancer therapy. // Cancer Sci. 2014, 105, 370-388]. При лишении раковой клетки способности к восстановлению поврежденной ДНК, существенно возрастает эффективность традиционных методов лечения. Поиск ингибиторов ключевых ферментов репарации ДНК относится к перспективным направлениям медицинской химии и является одним из путей создания эффективной терапии сердечно-сосудистых, нейродегенеративных и онкологических заболеваний [Laev S.S., Salakhutdinov N.F., Lavrik O.I., Tyrosyl-DNA phosphodiesterase inhibitors: Progress and potential // Bioorg. Med. Chem. 2016, 24, 5017-5027].
К числу перспективных мишеней относится фермент тирозил-ДНК-фосфодиэстераза1 (Tdp1). Этот фермент является важной мишенью в случае противоопухолевой терапии, основанной на применении ингибиторов топоизомеразы 1 (Top1) [Negrini S., Gorgoulis V.G., Halazonetis T.D., Genomic instability-an evolving hallmark of cancer. // Nat. Rev. Mol. Cell. Biol. 2010, 11, 220-228]. Tdp1 играет ключевую роль в удалении аддуктов Top1-ДНК, стабилизированных ингибиторами Top1, такими как камптотецин и его клинические производные. Мутация в гене Tdp1 делает клетки гиперчувствительными к камптотецину - каноническому ингибитору Top1 [El-Khamisy S.F., Masutani М., Suzuki Н., Caldecott K.W., A requirement for PARP-1 for the assembly or stability of XRCC1 nuclear foci at sites of oxidative DNA damage. // Nucleic Acids Res., 2003, 31, 5526-5533]. Мыши, нокаутные по Tdp1, гиперчувствительны к камптотецину и его производным. Также при подавлении экспрессии Tdp1 с помощью миноциклина усиливается антиметастатический эффект иринотекана и увеличивается продолжительность жизни экспериментальных животных [Huang Н.-С., Liu J., Baglo Y., Rizvi I., Anbil S., Pigula M., Hasan Т., Mechanism-informed Repurposing of Minocycline Overcomes Resistance to Topoisomerase Inhibition for Peritoneal Carcinomatosis. // Mol. Cancer Ther., 2018, 17, 508-520]. И, наоборот, гиперэкспрессия Tdp1 приводит к защите клеток от повреждений ДНК, вызванных камптотецином [Nivens М.С., Pouliot J.J., Felder Т., Pena М.М.О., Spencer Н.Т., Galloway, А.Н., Engineered resistance to camptothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-I and thymidylate synthase. // Cancer Chemother. Pharmacol., 2004, 53, 107-115; Alagoz M., Gilbert D.C., El-Khamisy S., Chalmers A.J., DNA Repair and Resistance to Topoisomerase I Inhibitors: Mechanisms, Biomarkers and Therapeutic Targets. // Curr. Med. Chem., 2012, 19, 3874-3885]. Более того, в опухолях кишечника с гиперэкспрессией Tdp1 снижен ответ на терапию иринотеканом [Meisenberg С., Gilbert D.C., Chalmers A., Haley V., Gollins S., Ward S.E., El-Khamisy, S.F., Clinical and Cellular Roles for TDP1 and TOP1 in Modulating Colorectal Cancer Response to Irinotecan. // Mol. Cancer Ther. 2015, 14, 575-585]. Следовательно, подавление активности Tdp1 может значительно усилить терапевтический эффект ингибиторов Top1.
В литературе имеются данные о некоторых ингибиторах Tdp1, эффективных при различных концентрациях в диапазоне значений IC50 0.15-100 мкМ. Известны ингибиторы производные гликозидов: неомицина, нетилмицина, спектиномицина [Liao Z., Thibaut L., Jobson A., Pommier Y., Inhibition of Human Tyrosyl-DNA Phosphodiesterase by Aminoglycoside Antibiotics and Ribosome Inhibitors // Mol. Pharmacol. 2006, 70, 366-372]. Однако для ингибирования необходимы достаточно высокие концентрации, кроме того, селективность ингибирования данного фермента очень низкая. В том же диапазоне концентраций ингибируют тирозил-ДНК-фосфодиэстеразу 1 диамидины [Huang S.N., Pommier Y., Marchand С., Tyrosyl-DNA Phosphodiesterase 1 (Tdp1) inhibitors // Expert Opin. Ther. Pat. 2011, 9, 1285-1292]. Активно изучается способность ингибировать Tdp1 производных инденоизохинолина [Elsayed M.S.A., Su Y., Wang P., Sethi Т., Agama K., Ravji A., Redon C.E., Kiselev E., Horzmann K.A., Freeman J.L., Yves Pommier Y., Cushman M., Design and Synthesis of Chlorinated and Fluorinated 7 Azaindenoisoquinolines as Potent Cytotoxic Anticancer Agents That Inhibit Topoisomerase, I // J. Med. Chem. 2017, 60, 5364-5376]. Исследована ингибирующая активность в отношении Tdp1 производных 2-циано-3-фенилпроп-2-ентиоамида. Соединения ингибируют фермент со значениями IC50=0.9-100 мкМ [Sirivolu V.R., Vernekar S.K., Marchand С., Naumova A., Chergui A., Renaud А., Stephen A.G., Chen F., Sham Y.Y., Pommier Y., Wang Z., 5-Arylidenethioxothiazolidinones as inhibitors of tyrosyl-DNA phosphodiesterase I // J. Med. Chem. 2012, 55, 8671-8684]. Были обнаружены такие новые классы ингибиторов как аналоги бензопентатиепина [Zakharenko A., Khomenko Т., Zhukova S., Koval О., Zakharova О., Anarbaev R., Lebedeva N., Korchagina D., Komarova N., Vasiliev V., Reynisson J., Volcho K., Salakhutdinov N., Lavrik O. // Bioorg. Med. Chem. 2015, 23, 2044-2052], производные кумаринов [Khomenko Т., Zakharenko A., Odarchenko Т., Arabshahi H.J., Sannikova V., Zakharova O., Korchagina D., Reynisson J., Volcho K., Salakhutdinov N., Lavrik O. // Bioorg. Med. Chem. 2016, 24, 5573-5581] и производные усниновой кислоты [Zakharenko A., Luzina О., Koval О., Nilov D., Gushchina I., Dyrkheeva N.,  V., Salakhutdinov N., Lavrik O. // J. Nat. Prod. 2016, 79, 2961-2967].
V., Salakhutdinov N., Lavrik O. // J. Nat. Prod. 2016, 79, 2961-2967].
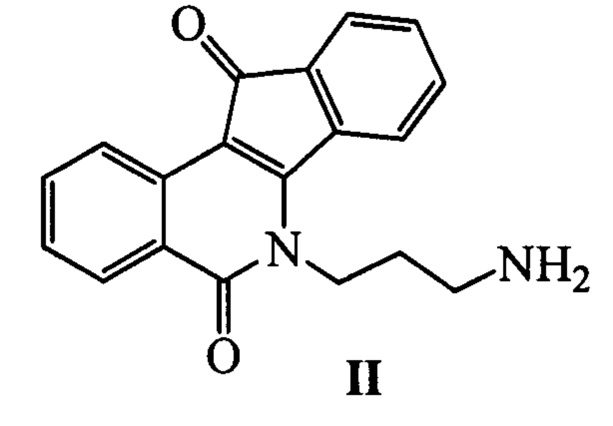
Наиболее близким по свойствам к заявляемым соединениям - прототипом, является инденоизохинолин, представляющий собой полициклическую структуру формулы II [Nguyen ТХ, Morrell A, Conda-Sheridan М, Marchand С, Agama K, Bermingham A, Stephen AG, Chergui A, Naumova A, Fisher R, O'Keefe BR, Pommier Y, Cushman M. // J Med Chem. 2012, 23, 55, 7297]. Недостатками известного соединения являются невысокая активность в отношении очищенного фермента Tdp1 (IC50 29.5 мкМ) и значительная цитотоксичность.
Задачей изобретения является выявление нового эффективного ингибитора фермента Tdp1, обладающего высокой активностью и низкой токсичностью и проявляющего синергетический эффект с противоопухолевыми препаратами, например, топотеканом в отношении опухолевых клеток.
Технический результат: повышение эффективности ингибирования фермента Tdp1, расширение ассортимента ингибиторов фермента Tdp1 и усиление цитотоксического действия химиопрепарата топотекана на опухолевые клетки.
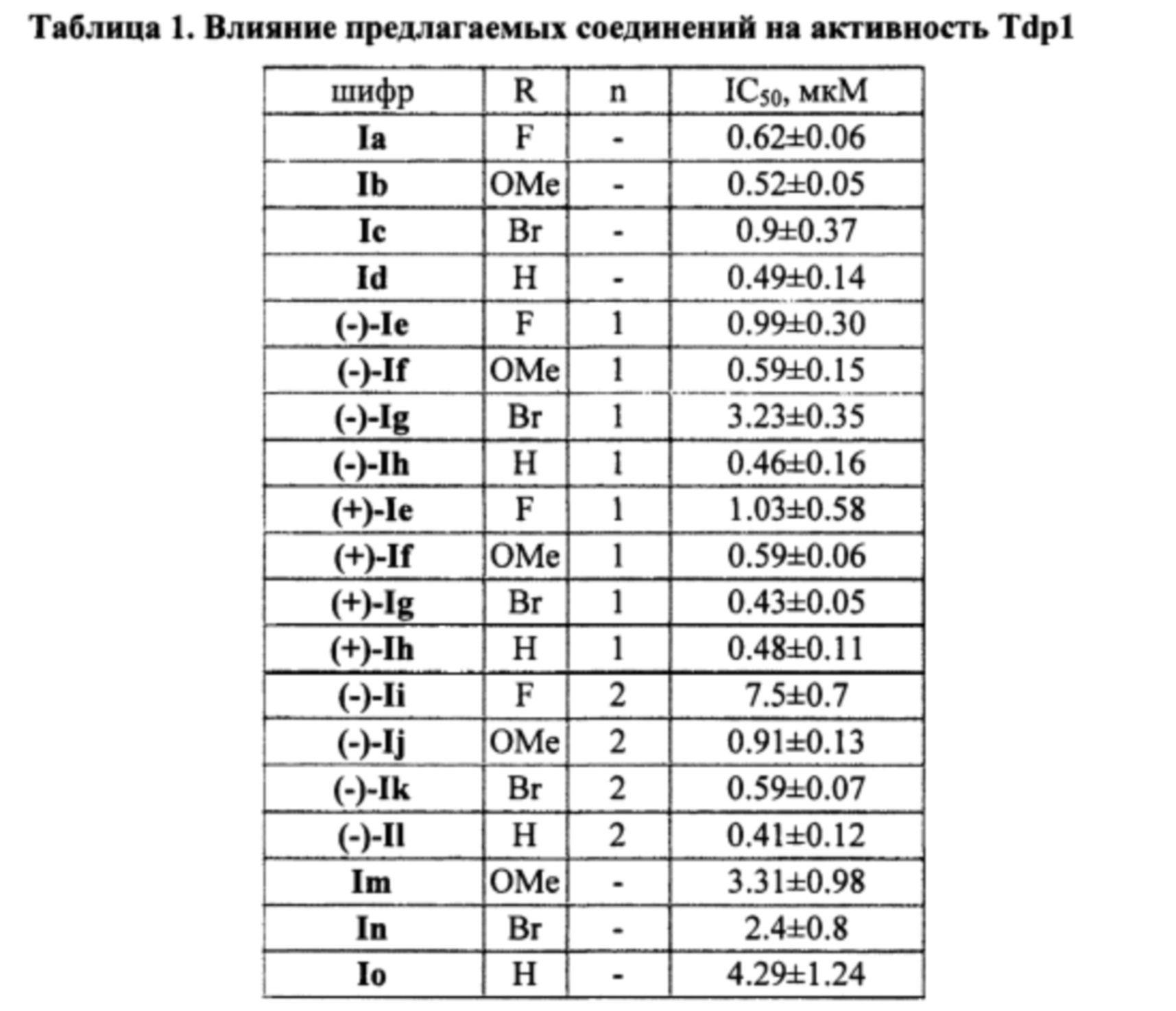
Поставленная задача решается применением производных 7-гидрокси-4-фенил-2H-хромен-2-она общей формулы I, у которых выявлена высокая ингибирующая активность в отношении фермента репарации Tdp1 (IC50 0.4-4.3 мкМ), низкая токсичность в отношении ряда опухолевых клеток и усиление эффективности действия топотекана в отношении карциномы Кребс-2 мышей.
Соединения общей формулы I могут быть синтезированы взаимодействием фенилзамещенных кумаринов III с соответствующими алкилирующими агентами, например, бромидами IV-VI в соответствии со следующей схемой:
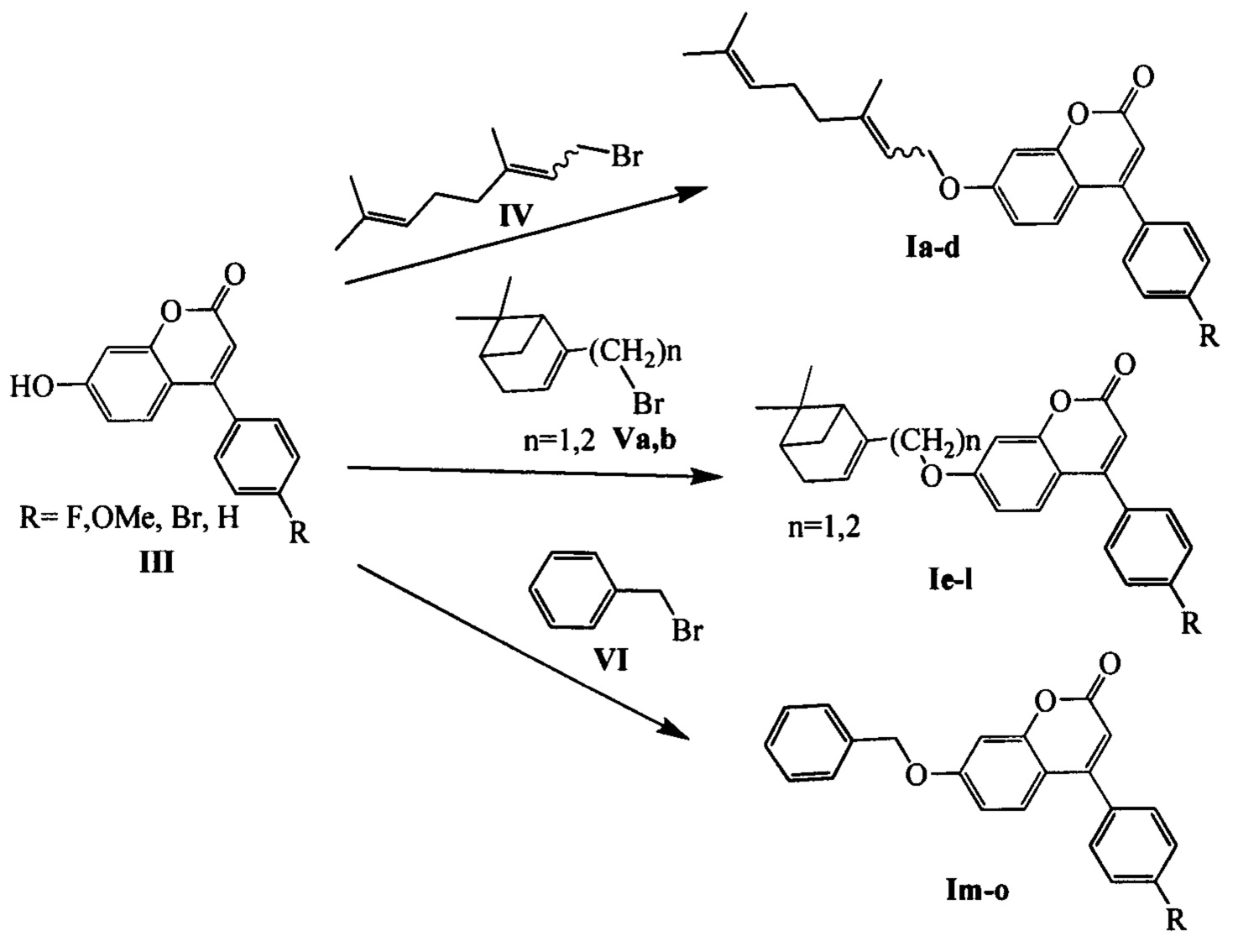
Соединения III могут быть синтезированы, например, взаимодействием резорцина VII с эфирами соответствующих β-кетокислот VIII по следующей схеме:
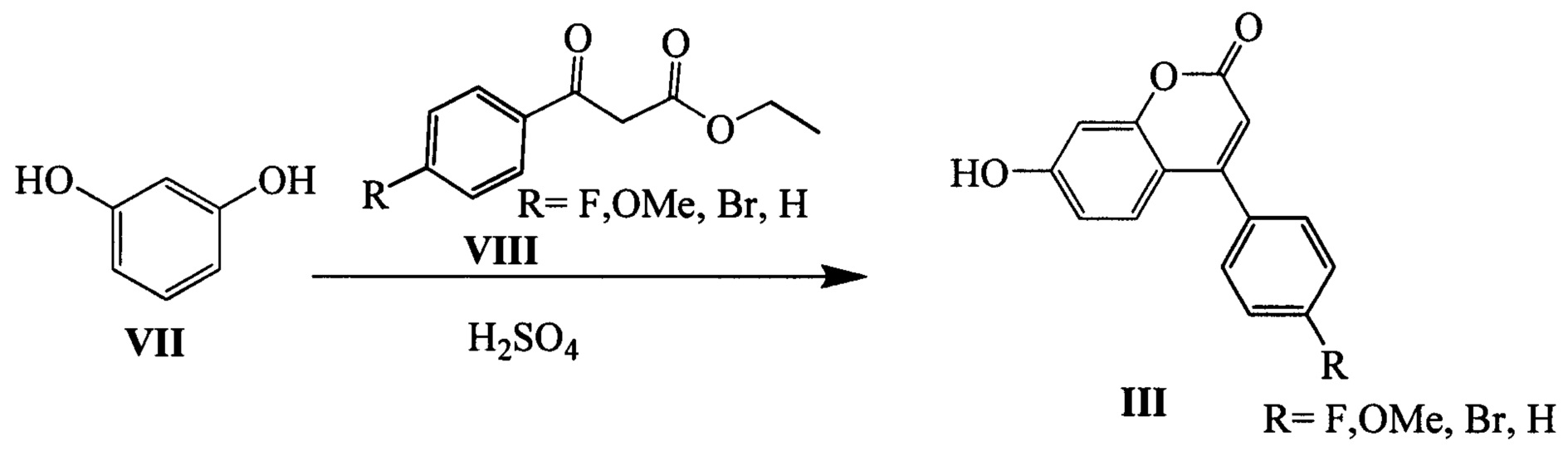
Эфиры β-кетокислот VIII (R=F, OMe, Br) могут быть синтезированы из 4-метокси(или 4-фтор)ацетофенонов IX и диэтилкарбоната в присутствии гидрида натрия по следующей схеме:
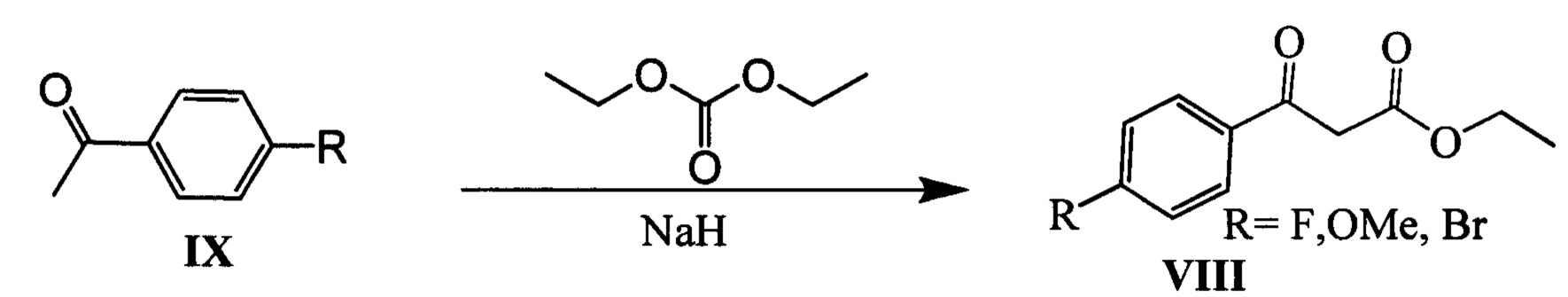
Соединения IV и Vb (n=2) могут быть синтезированы, например, из монотерпеноидов гераниола X и нопола XI в соответствии со следующей схемой:
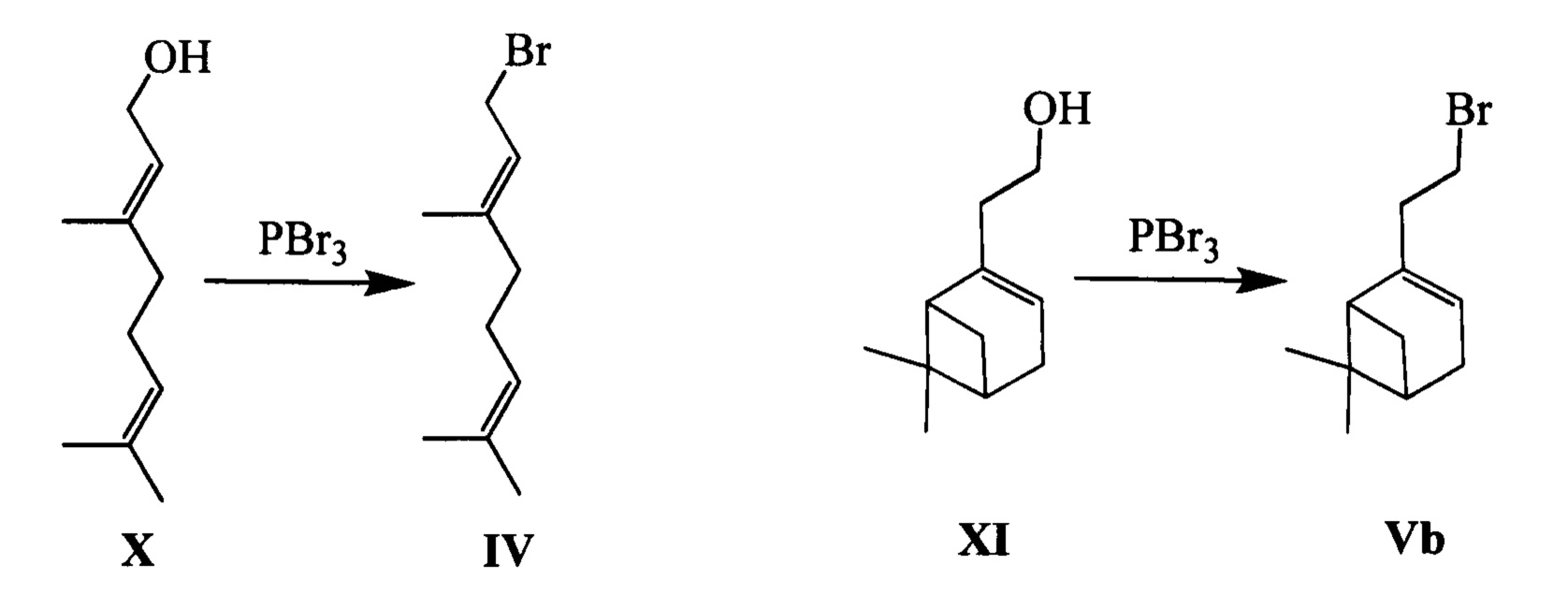
Соединение Va (n=1) может быть синтезировано, например, из монотерпеноида миртеналя XII в соответствии со следующей схемой:
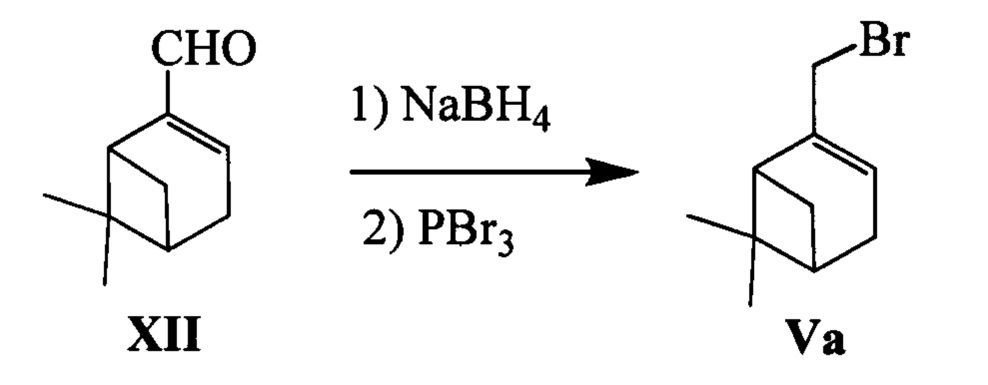
Для получения обоих энантиомеров соединения Va в качестве исходных соединений использовались (+)- и (-)-миртенали (+)- и (-)-XII.
Структура полученных соединений I подтверждена данными ЯМР-спектроскопии и масс-спектрометрии.
Результаты тестирования соединений общей структуры I на способность ингибировать фермент Tdp1 приведены в таблице. Все представленные соединения проявили высокую ингибирующую активность в отношении фермента Tdp1, с IC50 в субмикромолярном или нижнем микромолярном диапазонах.
Анализ цитотоксичности предлагаемых соединений проводили на линиях клеток аденокарциномы молочной железы человека MCF-7 и рака шейки матки человека HeLa. Показано, что для всех испытанных соединений цитотоксичность отсутствовала или была незначительна во всем диапазоне изученных концентраций (до 100 мкМ), что делает принципиально возможным использование их как сенсибилизаторов опухолей к применяющимся в настоящее время противоопухолевым препаратам без привнесения дополнительной токсичности.
Изучение влияния соединения Ia на противоопухолевый эффект ингибитора Top1 топотекана проводили с использованием модельной опухоли карцинома Кребс-2 мышей. Совместное применение Ia с топотеканом приводило к достоверному снижению веса асцитической опухоли по сравнению с применением только топотекана. Использование Ia в отсутствие топотекана влияния на рост опухоли не оказывало.
Технический результат: получен класс эффективных ингибиторов Tdp1 с хорошими ингибирующими характеристиками (IC50 от 0.4 до 4.3 мкМ), обладающих незначительной цитотоксичностью и способных усиливать противоопухолевый эффект ингибиторов Top1.
Соединения общей формулы I, после проведения углубленных фармакологических исследований, могут использоваться для дальнейшей разработки новых высокоэффективных противораковых средств.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез (Е)-7-(3,7-диметилокта-2,6-диенилокси)-4-(4-фторофенил)-2Н-хромен-2-она Ia
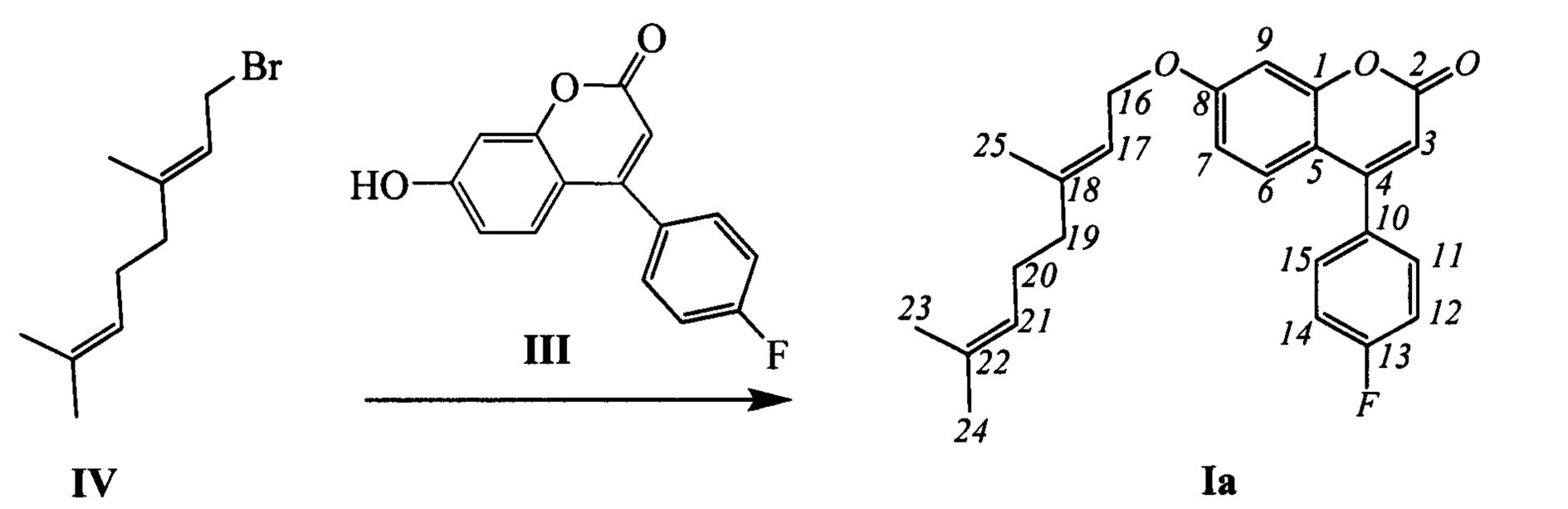
К 0.228 г (1.05 ммоль) бромида IV в 5 мл диметилформамида прибавили 0.182 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°C и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°C в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт Ia выделили кристаллизацией из этанола, выход составил 0.086 г (31%).
Тпл=72°С. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 1.58 (с, 3Н, С24Н3); 1.64 (с, 3Н, С23Н3); 1.74 (с, 3Н, С25Н3); 2.02-2.16 (м, 4Н, 2Н19, 2Н20); 4.60 (д, 2Н, J16,17=6.5, 2Н16); 5.06 (тм, 1Н, J21,20=6.8, другие J<2, Н21); 5.45 (тм, J17,16=6.5, другие J<2, 1Н, Н17); 6.16 (с, 1Н, Н3); 6.78 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.87 (д, 1H, J9,7=2.5, Н9); 7.19 (дд, 2Н, J12,11=J14,15=8.7, J12(14),F=8.7, Н12, Н14); 7.30 (д, 1H, J6,7=8.9, Н6); 7.41 (дд, 2Н, J11,12=J15,14=8.7, J11(15),F=5.3, Н11, Н15). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.86 (с, С1); 160.98 (с, С2); 111.77 (д, С3); 154.66 (с, С4); 112.17 (с, С5); 127.51 (д, С6); 112.95 (д, С7); 162.12 (с, С8); 101.84 (д, С9); 131.52 (с, 4J=3.4, С10); 130.18 (д, 3J=8.3, С11, С15); 115.89 (д, 2J=21.4, С12, С14); 163.35 (с, 1J=250.0, С13); 65.43 (т, С16); 118.29 (д, С17); 142.30 (с, С18); 39.39 (т, С19); 26.13 (т, С20); 123.49 (д, С21); 131.82 (с, С22); 25.51 (к, С23); 17.57 (к, С24); 16.64 (к, С25). Найдено: m/z=392.1778 [М]+ (C25H25O3F)+ Вычислено: m/z=392.1782.
Пример 2. Синтез (Е)-7-(3,7-диметилокта-2,6-диенилокси)-4-(4-метоксифенил)-2Н-хромен-2-она Ib
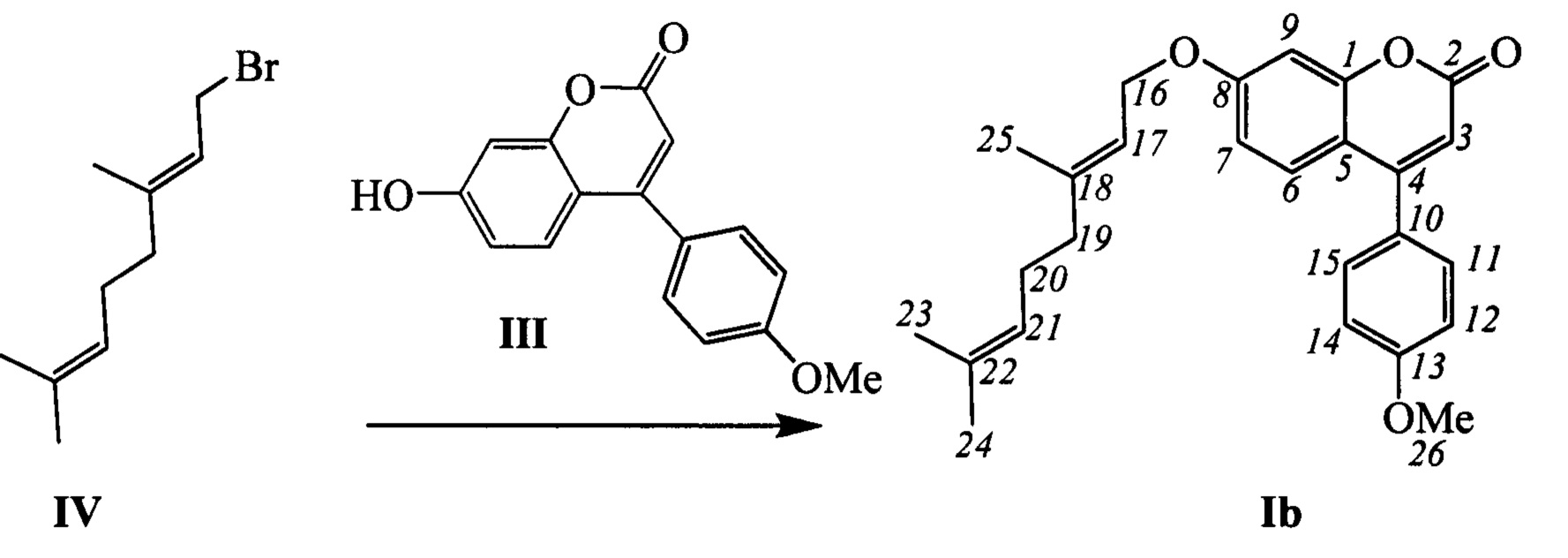
К 0.240 г (1.05 ммоль) бромида IV в 5 мл диметилформамида прибавили 0.190 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.082 г продукта Ib (29%).
Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 1.58 (с, 3Н, С24Н3); 1.64 (м, 3Н, все J<2.0, С23Н3); 1.74 (м, 3Н, все J<1.5, С25Н3); 2.03-2.15 (м, 4Н, 2Н19, 2Н20); 3.86 (с, 3Н, С26Н3); 4.59 (д, 2Н, J16,17=6.6, 2Н16); 5.06 (тм, 1Н, J21,20=6.8, другие J<1.5, Н21); 5.45 (тм, 1H, J17,16=6.6, другие J<1.5, Н17); 6.16 (с, 1Н, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.86 (д, 1Н, J9,7=2.5, Н9); 7.00 (ш.д, 2Н, J12,11=J14,15=8.7, Н12, Н14); 7.37 (ш.д, 2Н, J11,12=J15,14=8.7, Н11, Н15); 7.41 (д, 1H, J6,7=8.9, Н6). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.85 (с, С1); 161.34 (с, С2); 111.08 (д, С3); 155.40 (с, С4); 112.39 (с, С5); 127.78 (д, С6); 112.74 (д, С7); 161.87 (с, С8); 101.70 (д, С9); 127.74 (с, С10); 129.73 (д, С11, С15); 114.12 (д, С12, С14); 160.60 (с, С13); 65.34 (т, С16); 118.31 (д, С17); 142.21 (с, С18); 39.38 (т, С19); 26.10 (т, С20); 123.48 (д, С21); 131.80 (с, С22); 25.52 (к, С23); 17.57 (к, С24); 16.63 (к, С25); 55.28 (к, С26). Найдено: m/z=404.1980 [М]+ (C26H28O4)+ Вычислено: m/z=404.1982.
Пример 3. Синтез 4-(4-бромофенил)-(E)-7-(3,7-диметилокта-2,6-диенилокси)-2Н-хромен-2-она (-)-Ic
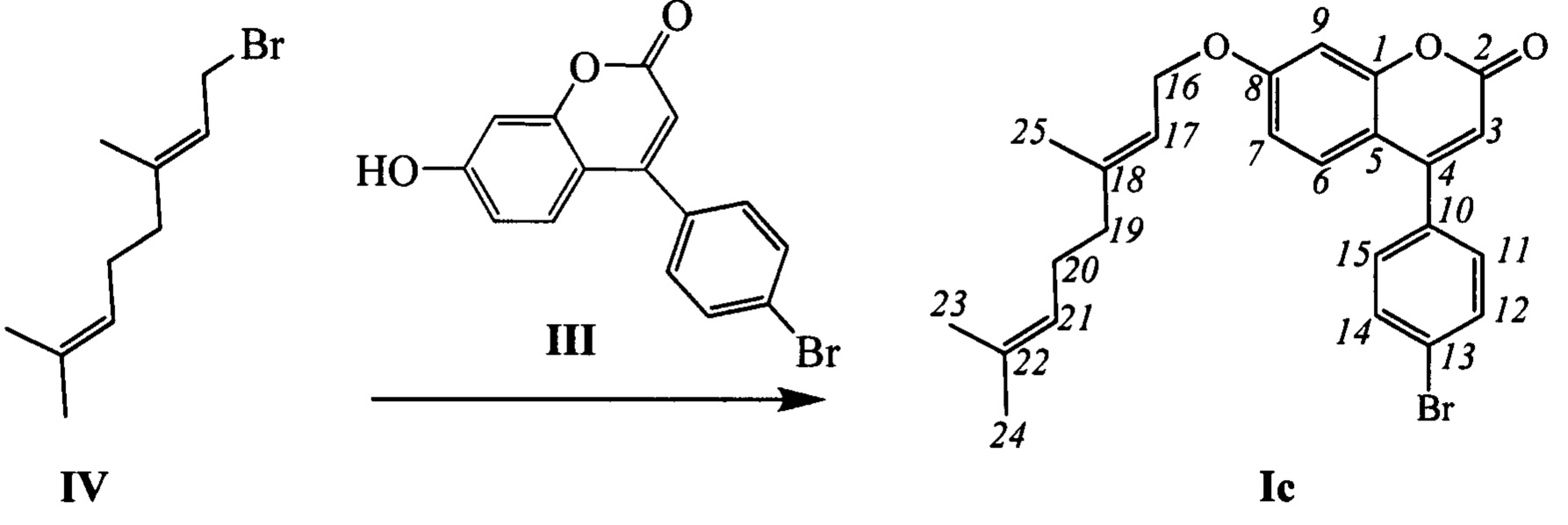
К 0.228 г (1.05 ммоль) бромида IV в 5 мл диметилформамида прибавили 0.226 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт Ic выделили кристаллизацией из этанола, выход составил 0.127 г (40%).
Тпл=80°C. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 1.58 (ш.с, 3Н, С24Н3); 1.64 (м, 3Н, все J<1.5, С23Н3); 1.74 (ш.с, 3Н, С25Н3); 2.03-2.14 (м, 4Н, 2Н19, 2Н20); 4.59 (д, 2Н, J16,17=6.6, 2Н16); 5.06 (тм, 1Н, J21,20=6.7, другие J<1.5, Н21); 5.44 (тм, J17,16=6.6, другие J<1.5, 1Н, Н17); 6.16 (с, 1Н, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.87 (д, 1Н, J9,7=2.5, Н9); 7.28 (д, 1Н, J6,7=8.9, Н6); 7.29 (ш.д, 2Н, J11,12=J15,14=8.5, Н11, Н15); 7.63 (ш.д, 2Н, J12,11=J14,15=8.5, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.82 (с, С1); 160.92 (с, С2); 111.65 (д, С3); 154.52 (с, С4); 111.83 (с, С5); 127.43 (д, С6); 112.99 (д, С7); 162.13 (с, С8); 101.78 (д, С9); 134.31 (с, С10); 129.84 (д, С11, С15); 131.98 (д, С12, С14); 123.87 (с, С13); 65.39 (т, С16); 118.16 (д, С17); 142.38 (с, С18); 39.37 (т, С19); 26.08 (т, С20); 123.45 (д, С21); 131.84 (с, С22); 25.54 (к, С23); 17.59 (к, С24); 16.65 (к, С25). Найдено: m/z=452.0979 [М]+ (C25H25O3Br)+ Вычислено: m/z=452.0982.
Пример 4. Синтез (Е)-7-(3,7-диметилокта-2,6-диенилокси)-4-фенил-2Н-хромен-2-она Id
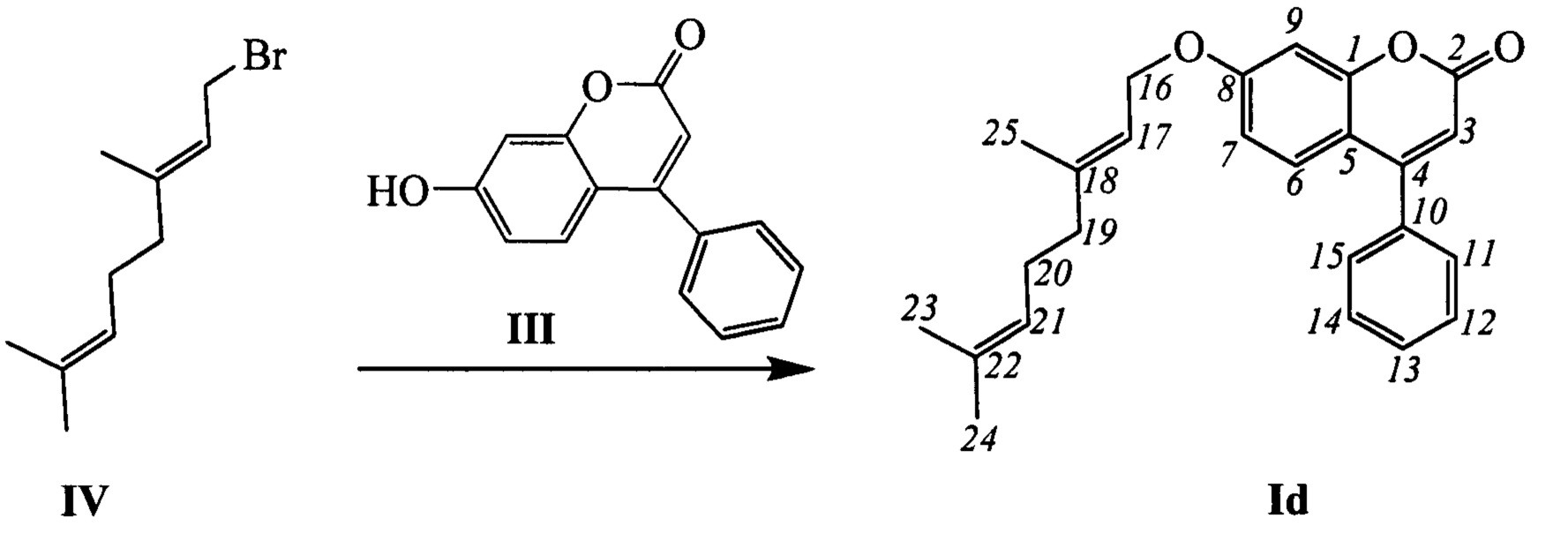
К 0.119 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.163 г (0.75 ммоль) бромида IV при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Продукт Id выделили кристаллизацией из этанола, выход составил 0.105 г (56%).
Тпл=54°С. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 1.58 (ш.с, 3Н, С24Н3); 1.64 (м, 3Н, все J<1.5, С23Н3); 1.74 (м, 3Н, все J<1.5, С25Н3); 2.03-2.15 (м, 4Н, 2Н19, 2Н20); 4.60 (д, 2Н, J16,17=6.6, 2Н16); 5.06 (тм, 1Н, J21,20=6.8, другие J<1.5, Н17); 5.45 (тм, J17,18=6.6, другие J<1.5, 1Н, Н17); 6.18 (с, 1H, Н3); 6.77 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.87 (д, 1Н, J9,7=2.5, Н9); 7.34 (д, 1H, J6,7=8.9, Н6); 7.39-7.43 (м, 2Н, Н11, Н15); 7.46-7.51 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.85 (с, С1); 161.12 (с, С2); 111.61 (д, С3); 155.70 (с, С4); 112.28 (с, С5); 127.75 (д, С6); 112.81 (д, С7); 161.99 (с, С8); 101.75 (д, С9); 135.52 (с, С10); 128.23 (д, С11, С15); 128.66 (д, С12, С14); 129.40 (д, С13); 65.38 (т, С16); 118.34 (д, С17); 142.19 (с, С18); 39.37 (т, С19); 26.11 (т, С20); 123.49 (д, С21); 131.78 (с, С22); 25.50 (к, С23); 17.56 (к, С24); 16.63 (к, С25). Найдено: m/z=374.1879 [М]+ (C25H26O3)+ Вычислено: m/z=374.1877.
Пример 5. Синтез 7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-(4-фторофенил)-2Н-хромен-2-она (-)-Ie
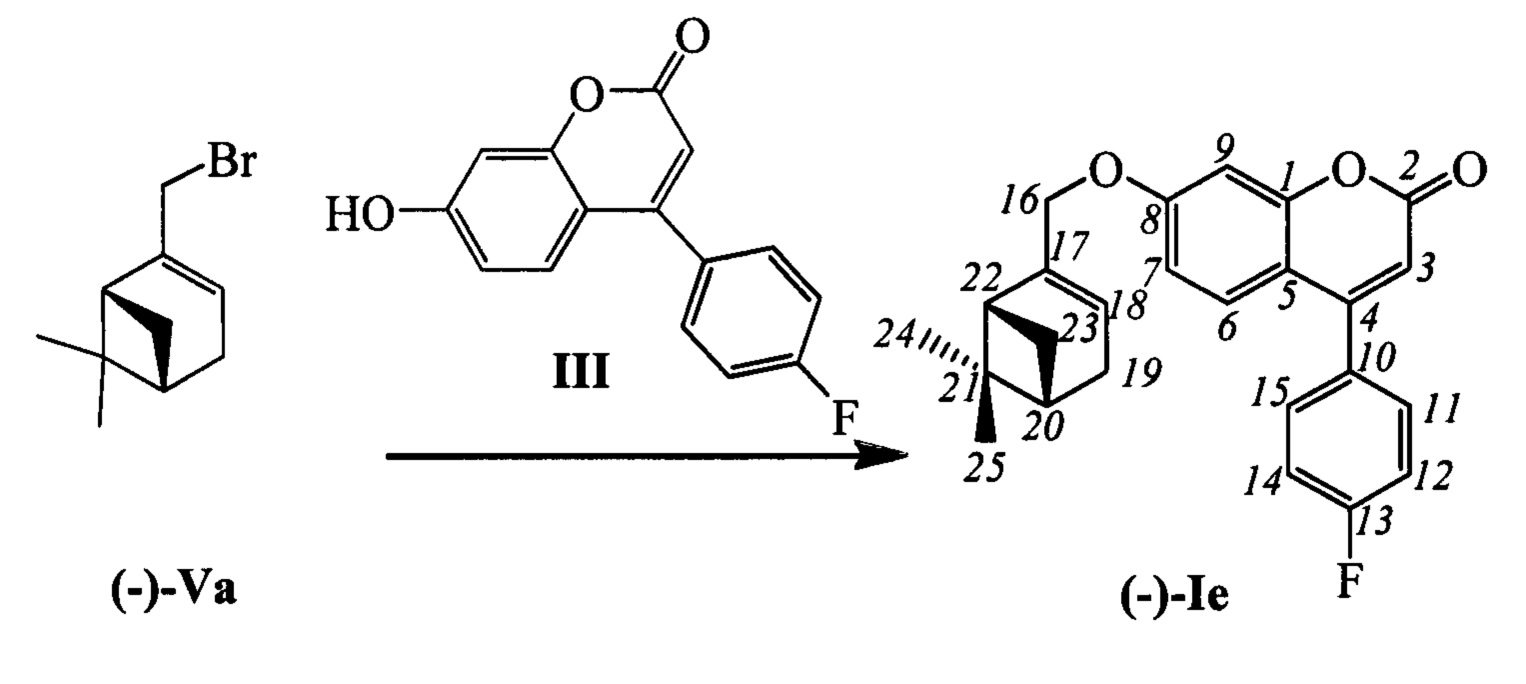
К 0.128 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.161 г (0.75 ммоль) бромида (-)-Va при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Выделили хроматографией на SiO2 0.084 г исходного кумарина (конверсия 34%) и 0.035 г продукта (-)-Ie, выход с учетом конверсии (53%).
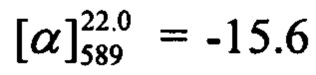 (с=0.68, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С25Н3); 1.17 (д, 1Н, J23a,23c=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.11 (ддтд, 1Н, J20,22=J20,23s=5.6, J20,19=2.9, J20,18=1.3, H20); 2.20 (ддд, 1H, J22,20=J22,23s=5.6, J22,18=1.4, H22); 2.26 (д. м, 1H, J19,19'=18.0, другие J<3.5, H19); 2.33 (д.м, 1H, 2J19',19=18.0, другие J<3.5, H19'); 2.40 (ддд, 1H, J23s,23a=8.7, J23s,20=J23s,22=5.6, H23s); 4.41-4.49 (м, 2H, 2H16); 5.61-5.64 (м, 1H, H18); 6.16 (с, 1H, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.88 (д, 1Н, J9,7=2.5, Н9); 7.16-7.21 (м, 2Н, J12,11=J14,15=8.8, J12(14),F=8.6, Н12, Н14); 7.29 (д, 1Н, J6,7=8.9, Н6); 7.38-7.43, (м, 2Н, J11,12=J15,14=8.8, J11(15),F=5.3, Н11, Н15). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.80 (с, С1); 161.02 (с, С2); 111.78 (д, С3); 154.66 (с, С4); 112.18 (с, С5); 127.42 (д, С6); 113.03 (д, С7); 162.23 (с, С8); 102.07 (д, С9); 131.52 (с, 4J=3.5, С10); 130.19 (д, 3J=8.3, С11, С15); 115.88 (д, 2J=21.8, С12, С14); 71.14 (т, С16); 142.86 (с, С17); 121.39 (д, С18); 31.18 (т, С19); 40.69 (д, С20); 38.00 (с, С21); 43.09 (д, С22); 31.39 (т, С23); 26.00 (к, С24); 20.97 (к, С25). Найдено: m/z=390.1624 [М]+ (C25H23O3F)+ Вычислено: m/z=390.1626.
(с=0.68, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С25Н3); 1.17 (д, 1Н, J23a,23c=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.11 (ддтд, 1Н, J20,22=J20,23s=5.6, J20,19=2.9, J20,18=1.3, H20); 2.20 (ддд, 1H, J22,20=J22,23s=5.6, J22,18=1.4, H22); 2.26 (д. м, 1H, J19,19'=18.0, другие J<3.5, H19); 2.33 (д.м, 1H, 2J19',19=18.0, другие J<3.5, H19'); 2.40 (ддд, 1H, J23s,23a=8.7, J23s,20=J23s,22=5.6, H23s); 4.41-4.49 (м, 2H, 2H16); 5.61-5.64 (м, 1H, H18); 6.16 (с, 1H, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.88 (д, 1Н, J9,7=2.5, Н9); 7.16-7.21 (м, 2Н, J12,11=J14,15=8.8, J12(14),F=8.6, Н12, Н14); 7.29 (д, 1Н, J6,7=8.9, Н6); 7.38-7.43, (м, 2Н, J11,12=J15,14=8.8, J11(15),F=5.3, Н11, Н15). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.80 (с, С1); 161.02 (с, С2); 111.78 (д, С3); 154.66 (с, С4); 112.18 (с, С5); 127.42 (д, С6); 113.03 (д, С7); 162.23 (с, С8); 102.07 (д, С9); 131.52 (с, 4J=3.5, С10); 130.19 (д, 3J=8.3, С11, С15); 115.88 (д, 2J=21.8, С12, С14); 71.14 (т, С16); 142.86 (с, С17); 121.39 (д, С18); 31.18 (т, С19); 40.69 (д, С20); 38.00 (с, С21); 43.09 (д, С22); 31.39 (т, С23); 26.00 (к, С24); 20.97 (к, С25). Найдено: m/z=390.1624 [М]+ (C25H23O3F)+ Вычислено: m/z=390.1626.
Пример 6. Синтез 7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-(4-метоксифенил)-2Н-хромен-2-она (-)-If
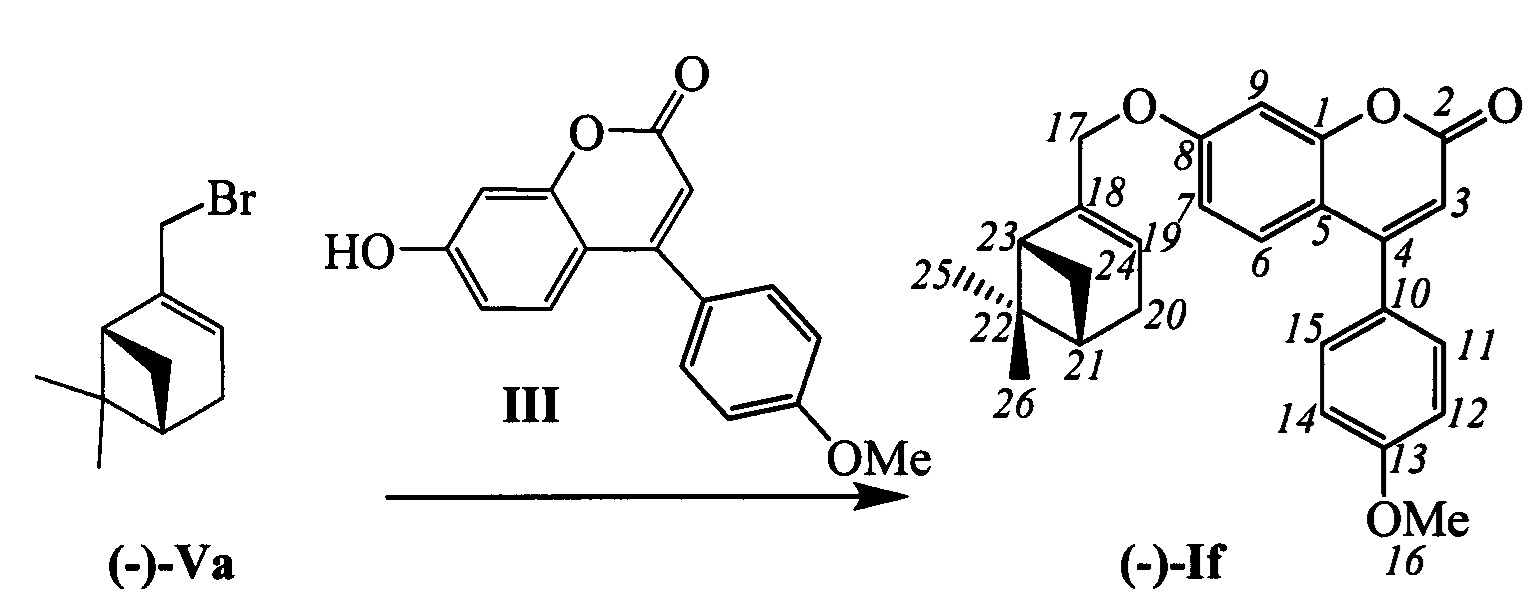
К 0.134 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.161 г (0.75 ммоль) бромида (-)-Va при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Выделили хроматографией на SiO2 0.060 г исходного кумарина (конверсия 55%) и 0.065 г продукта (-)-If, выход с учетом конверсии (59%).
Тпл=124°С. 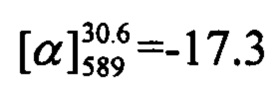 (с=0.82, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.17 (д, 1Н, 2J24a,24s=8.7, Н24а); 1.28 (с, 3Н, С25Н3); 2.10 (ддтд, 1H, J21,24s=J21,23=5.6, J21,20=2.8, J21,19=1.3, H21); 2.20 (ддд, 1Н, J23,21=J23,24s=5.6, J23,19=1.4, H23); 2.25 (дм, 1H, J20,21'=18.0, другие J<3.0, H20); 2.33 (дм, 1H, J20',20=18.0, другие J<3.5, H20'); 2.40 (ддд, 1H, J24s,24a=8.7, J24s,21=J24s,23=5.6, H24s); 3.85 (с, 3H, C16H3); 4.40-4.48 (м, 2H, 2H17); 5.60-5.63 (м, 1H, H19); 6.14 (с, 1H, H3); 6.77 (дд, 1H, J7,6=8.9, J7,9=2.5, H7); 6.86 (д, 1H, J9,7=2.5, H9); 7.00 (ш.д, 2Н, J12,11=J14,15=8.8, H12, H14); 7.36 (ш.д, 2H, J11,12=J15,14=8.8, H11, H15); 7.39 (д, 1H, J6,7=8.9, H6). Спектр ЯМР 13C (CDCl3, δ, м. д.): 155.80 (с, С1); 161.30 (с, С2); 111.11 (д, С3); 155.36 (с, С4); 112.41 (с, С5); 127.67 (д, С6); 112.79 (д, С7); 161.99 (с, С8); 101.96 (д, С9); 127.77 (с, С10); 129.72 (д, С11, С15); 114.13 (д, С12, С14); 160.62 (с, С13); 55.27 (к, С16); 71.06 (т, С17); 142.91 (с, С18); 121.26 (д, С19); 31.15 (т, С20); 40.67 (д, С21); 37.97 (с, С22); 43.07 (д, С23); 31.37 (т, С24); 25.99 (к, С25); 20.94 (к, С26). Найдено: m/z=402.1820 [М]+ (C26H26O4)+ Вычислено: m/z=402.1827.
(с=0.82, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.17 (д, 1Н, 2J24a,24s=8.7, Н24а); 1.28 (с, 3Н, С25Н3); 2.10 (ддтд, 1H, J21,24s=J21,23=5.6, J21,20=2.8, J21,19=1.3, H21); 2.20 (ддд, 1Н, J23,21=J23,24s=5.6, J23,19=1.4, H23); 2.25 (дм, 1H, J20,21'=18.0, другие J<3.0, H20); 2.33 (дм, 1H, J20',20=18.0, другие J<3.5, H20'); 2.40 (ддд, 1H, J24s,24a=8.7, J24s,21=J24s,23=5.6, H24s); 3.85 (с, 3H, C16H3); 4.40-4.48 (м, 2H, 2H17); 5.60-5.63 (м, 1H, H19); 6.14 (с, 1H, H3); 6.77 (дд, 1H, J7,6=8.9, J7,9=2.5, H7); 6.86 (д, 1H, J9,7=2.5, H9); 7.00 (ш.д, 2Н, J12,11=J14,15=8.8, H12, H14); 7.36 (ш.д, 2H, J11,12=J15,14=8.8, H11, H15); 7.39 (д, 1H, J6,7=8.9, H6). Спектр ЯМР 13C (CDCl3, δ, м. д.): 155.80 (с, С1); 161.30 (с, С2); 111.11 (д, С3); 155.36 (с, С4); 112.41 (с, С5); 127.67 (д, С6); 112.79 (д, С7); 161.99 (с, С8); 101.96 (д, С9); 127.77 (с, С10); 129.72 (д, С11, С15); 114.13 (д, С12, С14); 160.62 (с, С13); 55.27 (к, С16); 71.06 (т, С17); 142.91 (с, С18); 121.26 (д, С19); 31.15 (т, С20); 40.67 (д, С21); 37.97 (с, С22); 43.07 (д, С23); 31.37 (т, С24); 25.99 (к, С25); 20.94 (к, С26). Найдено: m/z=402.1820 [М]+ (C26H26O4)+ Вычислено: m/z=402.1827.
Пример 7. Синтез 4-(4-бромофенил)-7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-2Н-хромен-2-она (-)-IIg
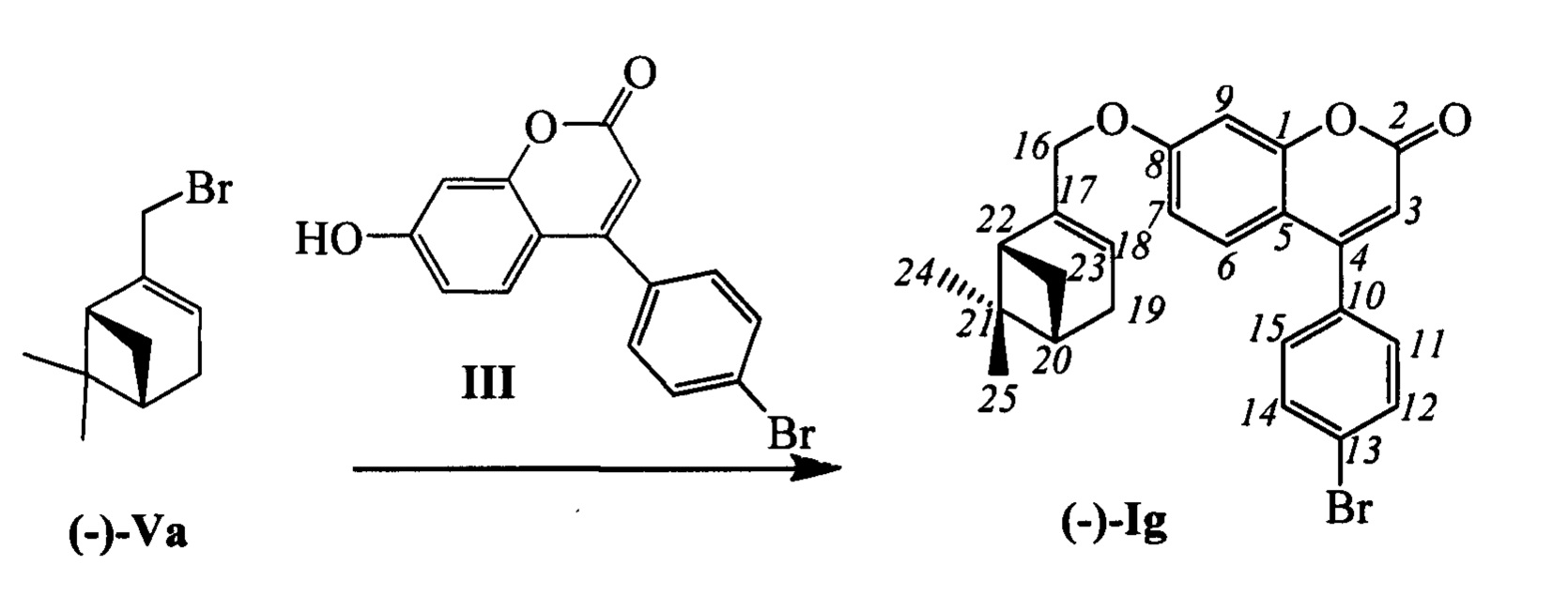
К 0.228 г (1.05 ммоль) бромида (-)-Va в 5 мл диметилформамида прибавили 0.226 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт (-)-Ig выделили кристаллизацией из этанола, выход составил 0.116 г (36%).
Тпл=130°C. 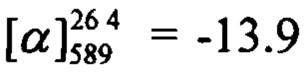 (c=0.52, CHCl3). Спектр ЯМР 1H (CDCl3, δ, м. д, J, Hz): 0.80 (с, 3Н, С25Н3); 1.16 (д, 1Н, 2J23a,23s=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.11 (ддтд, 1H, J20,22=J20,23s=5.6, J20,19=2.9, J20,18=1.3, H20); 2.08-2.12 (м, 1Н, Н-20), 2.19 (ддд, 1Н, J22,20=J22,23s=5.6, J22,18=1.3, Н22); 2.25 (дм, 1Н, J19,19'=18.0, другие J<3.5, Н19); 2.33 (дм, 1H, 2J19',19=18.0, другие J<3.5, Н19'); 2.40 (ддд, 1Н, J23s,23a=8.7, J23s,20=J23s,22=5.6, H23s); 4.43-4.48 (м, 2Н, 2Н16); 5.60-5.63 (м, 1Н, Н18); 6.16 (с, 1Н, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.88 (д, 1Н, J9,7=2.5, Н9); 7.27 (д, 1Н, J6,7=8.9, Н6); 7.30 (д, 2Н, J11,12=J15,14=8.5, Н11, Н15); 7.63 (д, 2Н, J12,11=J14,15=8.5, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.76 (с, С1); 160.97 (с, С2); 111.67 (д, С3); 154.53 (с, С4); 111.85 (с, С5); 127.33 (д, С6); 113.10 (д, С7); 162.25 (с, С8); 102.02 (д, С9); 134.32 (с, С10); 129.85 (д, С11, С15); 131.98 (д, С12, С14); 123.87 (с, С13); 71.12 (т, С16); 142.77 (с, С17); 121.43 (д, С18); 31.15 (т, С19); 40.60 (д, С20); 37.99 (с, С21); 43.00 (д, С22); 31.37 (т, С23); 25.98 (к, С24); 20.96 (к, С25). Найдено: m/z=450.0826 [М]+ (C25H23O3Br)+ Вычислено: m/z=450.0825.
(c=0.52, CHCl3). Спектр ЯМР 1H (CDCl3, δ, м. д, J, Hz): 0.80 (с, 3Н, С25Н3); 1.16 (д, 1Н, 2J23a,23s=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.11 (ддтд, 1H, J20,22=J20,23s=5.6, J20,19=2.9, J20,18=1.3, H20); 2.08-2.12 (м, 1Н, Н-20), 2.19 (ддд, 1Н, J22,20=J22,23s=5.6, J22,18=1.3, Н22); 2.25 (дм, 1Н, J19,19'=18.0, другие J<3.5, Н19); 2.33 (дм, 1H, 2J19',19=18.0, другие J<3.5, Н19'); 2.40 (ддд, 1Н, J23s,23a=8.7, J23s,20=J23s,22=5.6, H23s); 4.43-4.48 (м, 2Н, 2Н16); 5.60-5.63 (м, 1Н, Н18); 6.16 (с, 1Н, Н3); 6.78 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.88 (д, 1Н, J9,7=2.5, Н9); 7.27 (д, 1Н, J6,7=8.9, Н6); 7.30 (д, 2Н, J11,12=J15,14=8.5, Н11, Н15); 7.63 (д, 2Н, J12,11=J14,15=8.5, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.76 (с, С1); 160.97 (с, С2); 111.67 (д, С3); 154.53 (с, С4); 111.85 (с, С5); 127.33 (д, С6); 113.10 (д, С7); 162.25 (с, С8); 102.02 (д, С9); 134.32 (с, С10); 129.85 (д, С11, С15); 131.98 (д, С12, С14); 123.87 (с, С13); 71.12 (т, С16); 142.77 (с, С17); 121.43 (д, С18); 31.15 (т, С19); 40.60 (д, С20); 37.99 (с, С21); 43.00 (д, С22); 31.37 (т, С23); 25.98 (к, С24); 20.96 (к, С25). Найдено: m/z=450.0826 [М]+ (C25H23O3Br)+ Вычислено: m/z=450.0825.
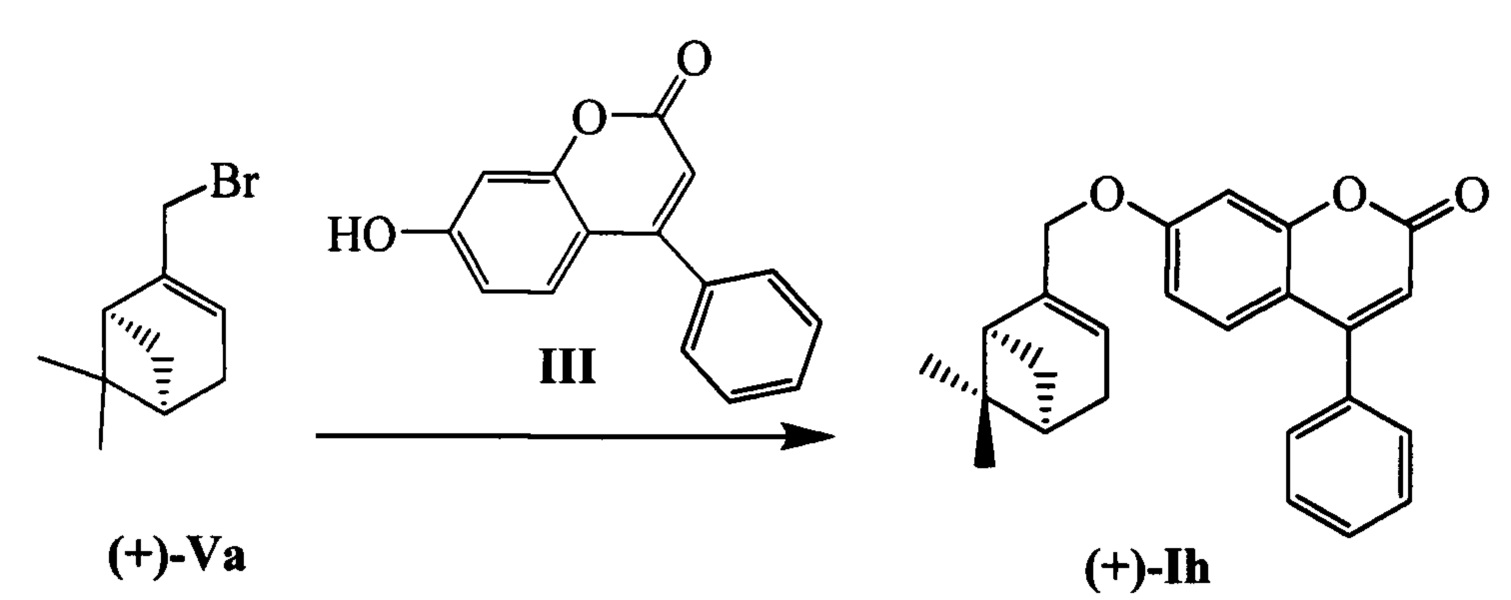
Пример 8. Синтез 7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-фенил-2Н-хромен-2-она (-)-Ih
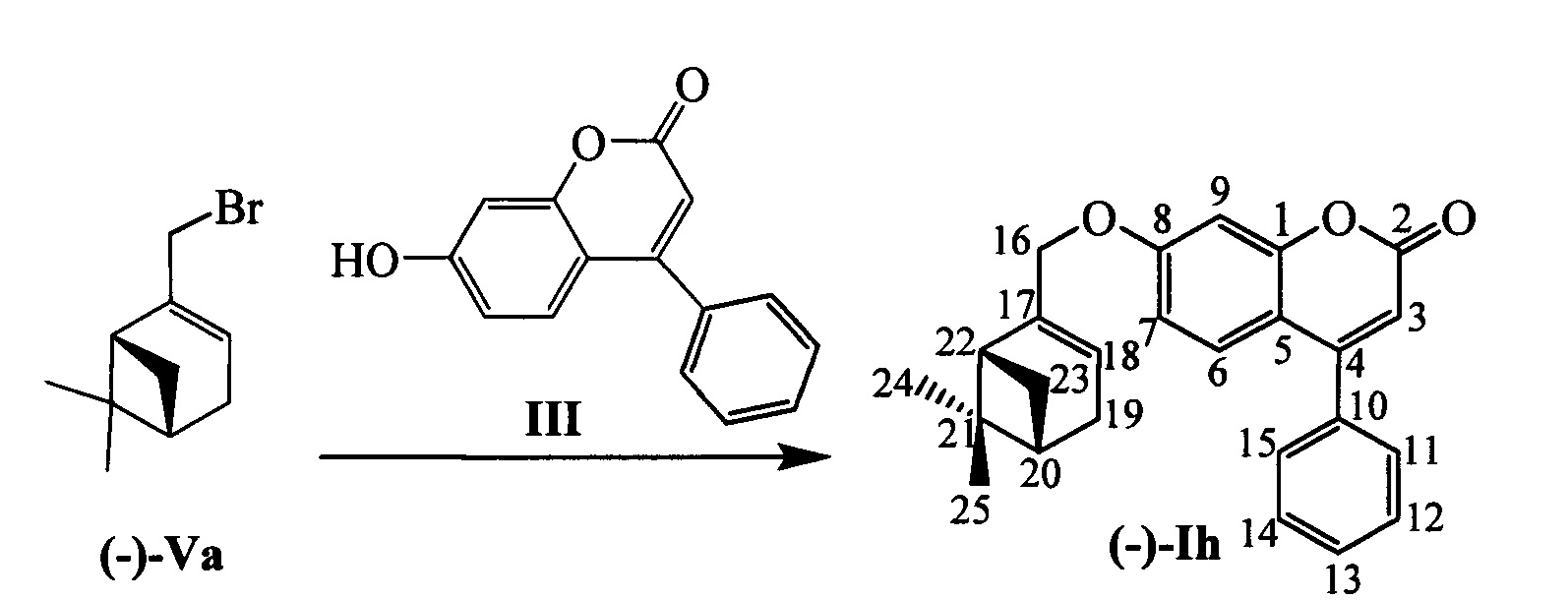
К 0.119 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.161 г (0.75 ммоль) бромида (-)-Va при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Продукт (-)-Ih выделили хроматографией на SiO2, выход составил 0.074 г (40%). Тпл=106°С. 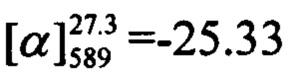 (с=1.02, EtOH). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.82 (с, 3Н, С25Н3); 1.18 (д, 1Н, 2J=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.08-2.14 (м, 1H, Н20); 2.20 (ддд, 1Н, J22,20=J22,23s=5.6, J22,18=1.4, Н22); 2.26 (д. м, 1H, 2J=18.1, H19s); 2.33 (д. м, 1Н, 2J=18.1, Н19а); 2.41 (ддд, 1H, 2J=8.7, J23s,20=J23s,22=5.6, H23s); 4.44 (д. м, 1Н, 2J=12.4, другие J≤2.0, Н16); 4.47 (д. м, 1Н, 2J=12.4, другие J≤2.0, Н16'); 5.61-5.64 (м, 1H, Н18); 6.19 (с, 1Н, Н3); 6.77 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.89 (д, 1Н, J9,7=2.5, Н9); 7.33 (д, 1H, J6,7=8.9, Н6); 7.40-7.43 (м, 2Н, H11, Н15); 7.47-7.51 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.81 (с, С1); 161.24 (с, С2); 111.65 (д, С3); 155.76 (с, С4); 112.32 (с, С5); 127.68 (д, С6); 112.94 (д, С7); 162.14 (с, С8); 102.00 (д, С9); 135.55 (с, С10); 128.27 (д, С11, С15); 128.68 (д, С12, С14); 129.42 (д, С13); 71.12 (т, С16); 142.92 (с, С17); 121.34 (д, С18); 31.18 (т, С19); 40.71 (д, С20); 38.00 (с, С21); 43.11 (д, С22); 31.40 (т, С23); 26.02 (к, С24); 20.97 (к, С25). Найдено: m/z=372.1717 [М]+ (C25H24O3)+ Вычислено: 372.1720.
(с=1.02, EtOH). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.82 (с, 3Н, С25Н3); 1.18 (д, 1Н, 2J=8.7, Н23а); 1.28 (с, 3Н, С24Н3); 2.08-2.14 (м, 1H, Н20); 2.20 (ддд, 1Н, J22,20=J22,23s=5.6, J22,18=1.4, Н22); 2.26 (д. м, 1H, 2J=18.1, H19s); 2.33 (д. м, 1Н, 2J=18.1, Н19а); 2.41 (ддд, 1H, 2J=8.7, J23s,20=J23s,22=5.6, H23s); 4.44 (д. м, 1Н, 2J=12.4, другие J≤2.0, Н16); 4.47 (д. м, 1Н, 2J=12.4, другие J≤2.0, Н16'); 5.61-5.64 (м, 1H, Н18); 6.19 (с, 1Н, Н3); 6.77 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.89 (д, 1Н, J9,7=2.5, Н9); 7.33 (д, 1H, J6,7=8.9, Н6); 7.40-7.43 (м, 2Н, H11, Н15); 7.47-7.51 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.81 (с, С1); 161.24 (с, С2); 111.65 (д, С3); 155.76 (с, С4); 112.32 (с, С5); 127.68 (д, С6); 112.94 (д, С7); 162.14 (с, С8); 102.00 (д, С9); 135.55 (с, С10); 128.27 (д, С11, С15); 128.68 (д, С12, С14); 129.42 (д, С13); 71.12 (т, С16); 142.92 (с, С17); 121.34 (д, С18); 31.18 (т, С19); 40.71 (д, С20); 38.00 (с, С21); 43.11 (д, С22); 31.40 (т, С23); 26.02 (к, С24); 20.97 (к, С25). Найдено: m/z=372.1717 [М]+ (C25H24O3)+ Вычислено: 372.1720.
Пример 9. Синтез 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-(4-фторофенил)-2Н-хромен-2-она (+)-Ie
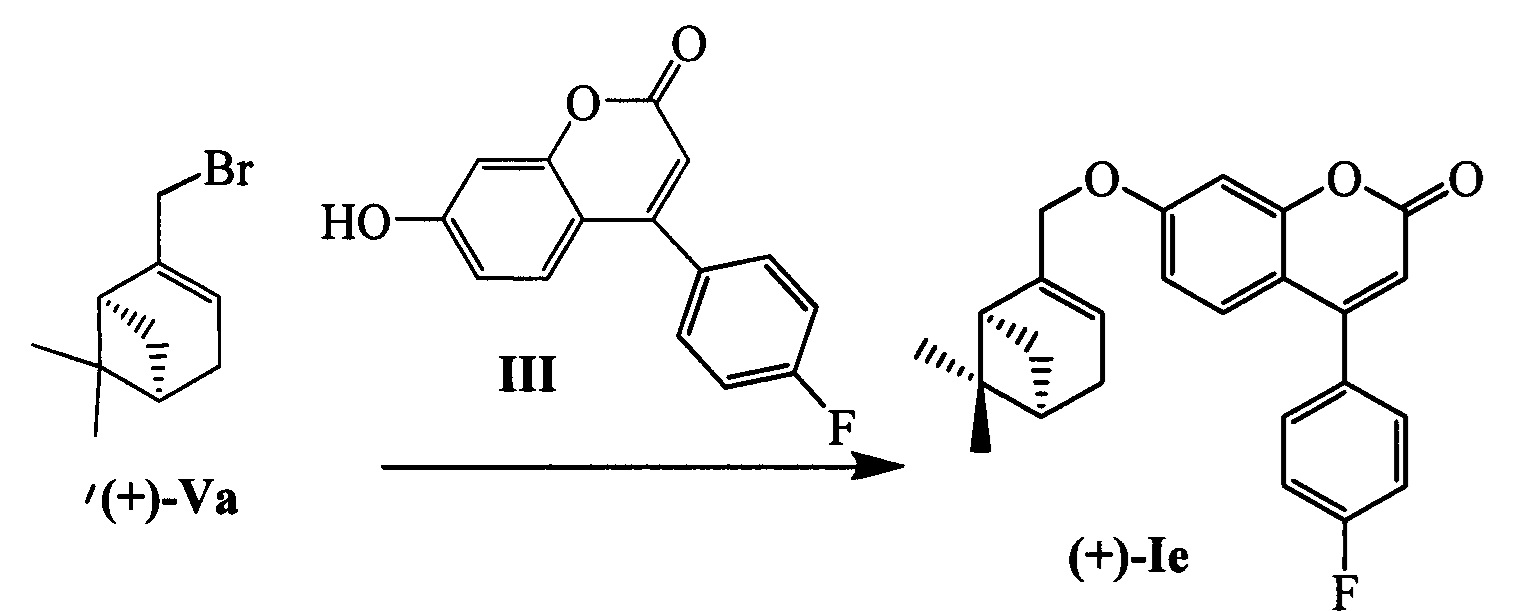
К 0.128 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.161 г (0.75 ммоль) бромида (+)-Va при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Продукт (+)-Ie выделили кристаллизацией из этанола, выход составил 0.065 г (33%).
Тпл=129°С. 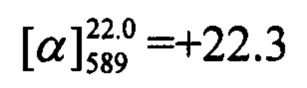 (CHCl3, с=0.53). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ie. Найдено: m/z=390.1628 [М]+ (C25H23O3F)+ Вычислено: m/z=390.1626.
(CHCl3, с=0.53). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ie. Найдено: m/z=390.1628 [М]+ (C25H23O3F)+ Вычислено: m/z=390.1626.
Пример 10. Синтез 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-(4-метоксифенил)-2Н-хромен-2-она (+)-If
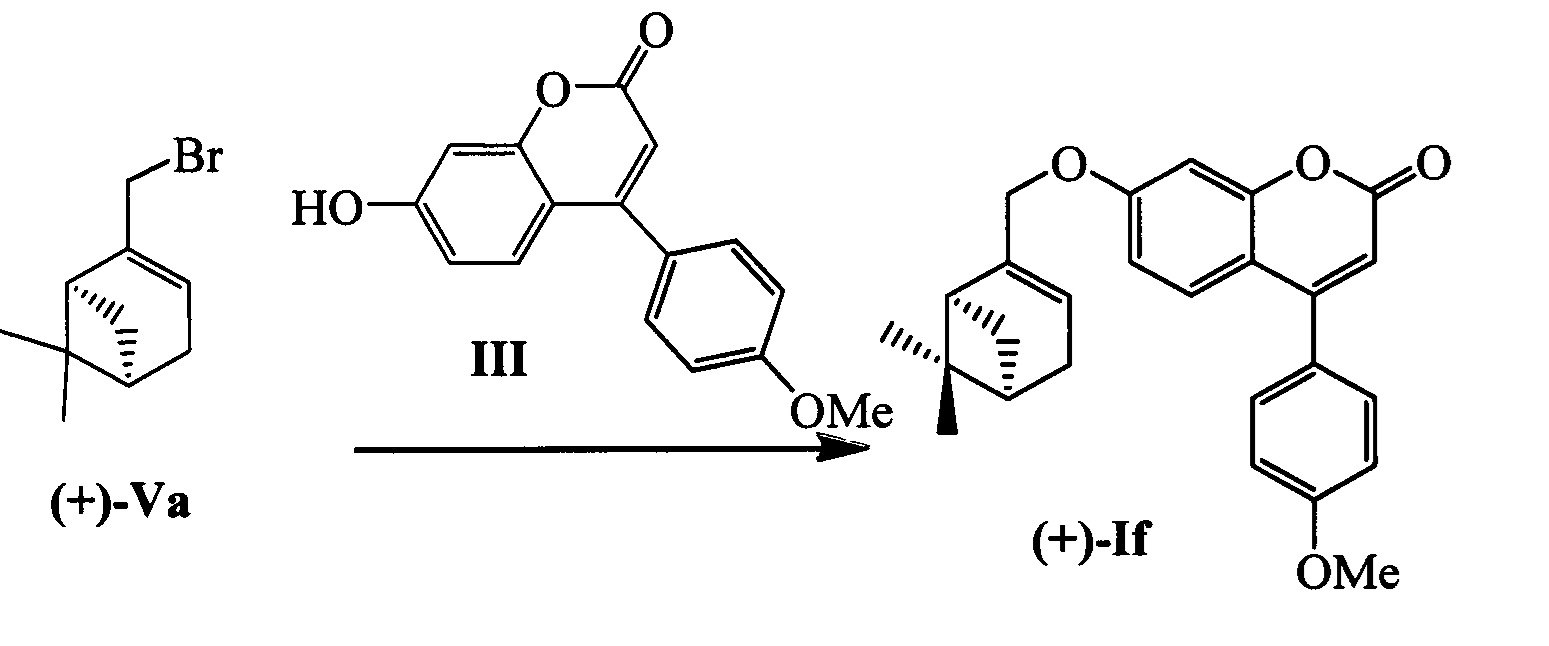
К 0.225 г (1.05 ммоль) бромида (+)-Va в 5 мл диметилформамида прибавили 0.190 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт (+)-If выделили кристаллизацией из этанола, выход составил 0.070 г (25%).
Тпл=112°C.  (с=0.72, CHCl3). Спектры ЯМР 1H и 13С соответствуют спектрам энантиомера (-)-If. Найдено: m/z=402.1823 [М]+ (C26H26O4)+ Вычислено: m/z=402.1827.
(с=0.72, CHCl3). Спектры ЯМР 1H и 13С соответствуют спектрам энантиомера (-)-If. Найдено: m/z=402.1823 [М]+ (C26H26O4)+ Вычислено: m/z=402.1827.
Пример 11. Синтез 4-(4-бромофенил)-7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-2Н-хромен-2-она (+)-Ig
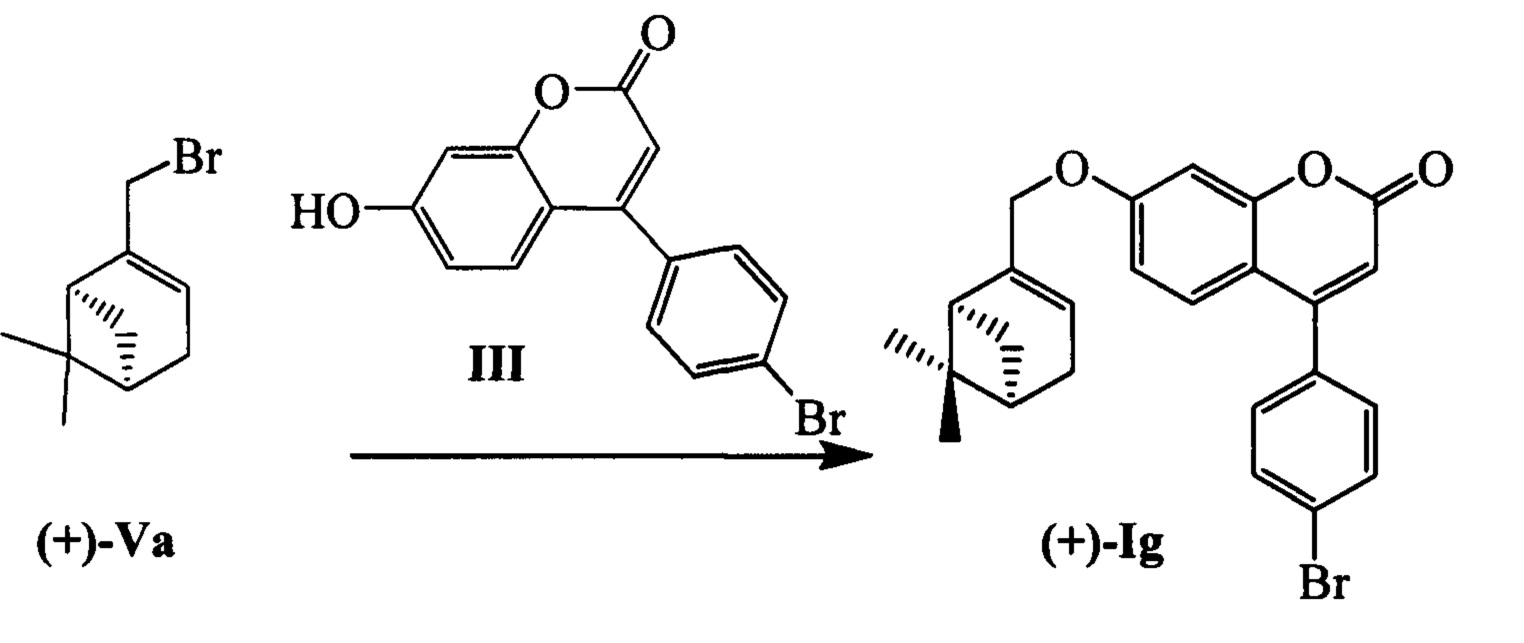
К 0.228 г (1.05 ммоль) бромида (+)-Va в 5 мл диметилформамида прибавили 0.226 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт (+)-Ig выделили кристаллизацией из этанола, выход составил 0.125 г (39%).
 (с=0.58, CHCl3). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ig. Найдено: m/z=450.0825 [М]+ (C25H23O3Br)+ Вычислено: m/z=450.0820.
(с=0.58, CHCl3). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ig. Найдено: m/z=450.0825 [М]+ (C25H23O3Br)+ Вычислено: m/z=450.0820.
Пример 12. Синтез 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-фенил-2Н-хромен-2-она (+)-Ih
К 0.119 г (0.5 ммоль) соединения III в 5 мл этанола прибавили 0.104 г (0.75 ммоль) K2CO3 и 0.161 г (0.75 ммоль) бромида (+)-Va при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Горячий раствор отфильтровали, фильтрат выдерживали при -10°С в течение 48 часов. Продукт (+)-Ih выделили хроматографией на SiO2, выход составил 0.079 г (42%).
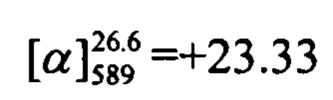 (с=1.02, EtOH). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ih. Найдено: m/z=372.1718 [М]+ (C25H24O3)+ Вычислено: 372.1720.
(с=1.02, EtOH). Спектры ЯМР 1Н и 13С соответствуют спектрам энантиомера (-)-Ih. Найдено: m/z=372.1718 [М]+ (C25H24O3)+ Вычислено: 372.1720.
Пример 13. Синтез 7-(2-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этокси)-4-(4-фторофенил)-2Н-хромен-2-она (-)-Ii
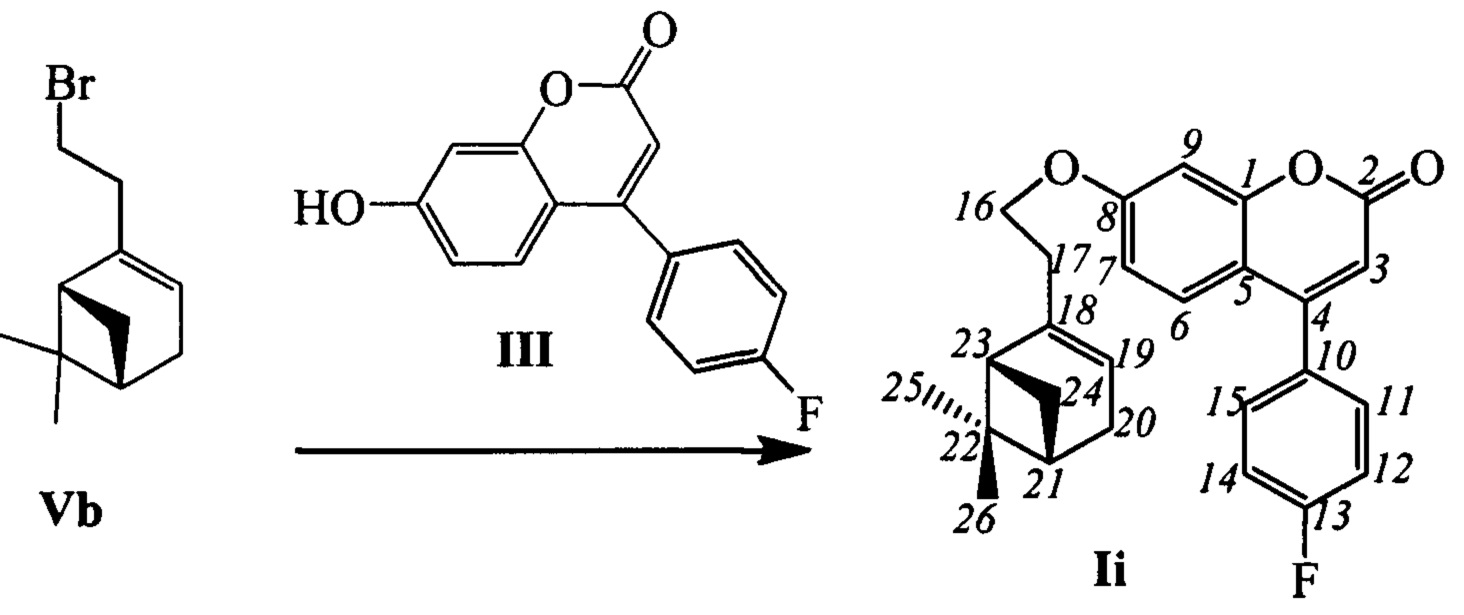
К 0.240 г (1.05 ммоль) бромида Vb в 5 мл диметилформамида прибавили 0.179 г (0.70 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.100 г исходного кумарина III и 0.046 г продукта (-)-Ii (с учетом конверсии 37%).
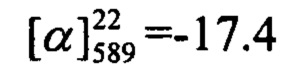 (с=0.78, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.16 (д, 1Н, 2J24a,24c=8.6, Н24а); 1.26 (с, 3Н, С25Н3); 2.06-2.10 (м, 2Н, Н21, Н23); 2.20 (дм, 1Н, J20,20'=17.7, Н20); 2.27 (дм, 1Н, J20',20=17.7, Н20'); 2.36 (ддд, 1H, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.51 (м, 2Н, 2Н17); 4.02 (т, 2Н, J16,17=7.0, 2Н16); 5.32-5.36 (м, 1H, Н19); 6.16 (с, 1Н, Н3); 6.75 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.84 (д, 1Н, J9,7=2.5, Н9); 7.16-7.21 (м, 2Н, J12,11=J14,15=8.7, J12(14),F=8.7, Н12, Н14); 7.30 (д, 1Н, J6,7=8.9, Н6); 7.38-7.43 (м, 2Н, J11,12=J15,14=8.7, J11(15),F=5.3, H11, Н15). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.90 (с, С1); 160.94 (с, С2); 111.76 (д, С3); 154.64 (с, С4); 112.16 (с, С5); 127.54 (д, С6); 112.74 (д, С7); 162.18 (с, С8); 101.57 (д, С9); 131.51 (с, 4J=3.5, С10); 130.18 (д, 3J=8.3, С11, С15); 115.88 (д, 2J=21.8, С12, С14); 66.93 (т, С16); 36.05 (т, С17); 143.86 (с, С18); 119.02 (д, С19); 31.27 (т, С20); 40.64 (д, С21); 37.97 (с, С22); 45.79 (д, С23); 31.54 (т, С24); 26.17 (к, С25); 21.08 (к, С26). Найдено: m/z=404.1774 [М]+ (C26H25O3F)+ Вычислено: m/z=404.1782.
(с=0.78, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.16 (д, 1Н, 2J24a,24c=8.6, Н24а); 1.26 (с, 3Н, С25Н3); 2.06-2.10 (м, 2Н, Н21, Н23); 2.20 (дм, 1Н, J20,20'=17.7, Н20); 2.27 (дм, 1Н, J20',20=17.7, Н20'); 2.36 (ддд, 1H, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.51 (м, 2Н, 2Н17); 4.02 (т, 2Н, J16,17=7.0, 2Н16); 5.32-5.36 (м, 1H, Н19); 6.16 (с, 1Н, Н3); 6.75 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.84 (д, 1Н, J9,7=2.5, Н9); 7.16-7.21 (м, 2Н, J12,11=J14,15=8.7, J12(14),F=8.7, Н12, Н14); 7.30 (д, 1Н, J6,7=8.9, Н6); 7.38-7.43 (м, 2Н, J11,12=J15,14=8.7, J11(15),F=5.3, H11, Н15). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.90 (с, С1); 160.94 (с, С2); 111.76 (д, С3); 154.64 (с, С4); 112.16 (с, С5); 127.54 (д, С6); 112.74 (д, С7); 162.18 (с, С8); 101.57 (д, С9); 131.51 (с, 4J=3.5, С10); 130.18 (д, 3J=8.3, С11, С15); 115.88 (д, 2J=21.8, С12, С14); 66.93 (т, С16); 36.05 (т, С17); 143.86 (с, С18); 119.02 (д, С19); 31.27 (т, С20); 40.64 (д, С21); 37.97 (с, С22); 45.79 (д, С23); 31.54 (т, С24); 26.17 (к, С25); 21.08 (к, С26). Найдено: m/z=404.1774 [М]+ (C26H25O3F)+ Вычислено: m/z=404.1782.
Пример 14. Синтез 7-(2-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этокси)-4-(4-метоксифенил)-2Н-хромен-2-она (-)-Ij
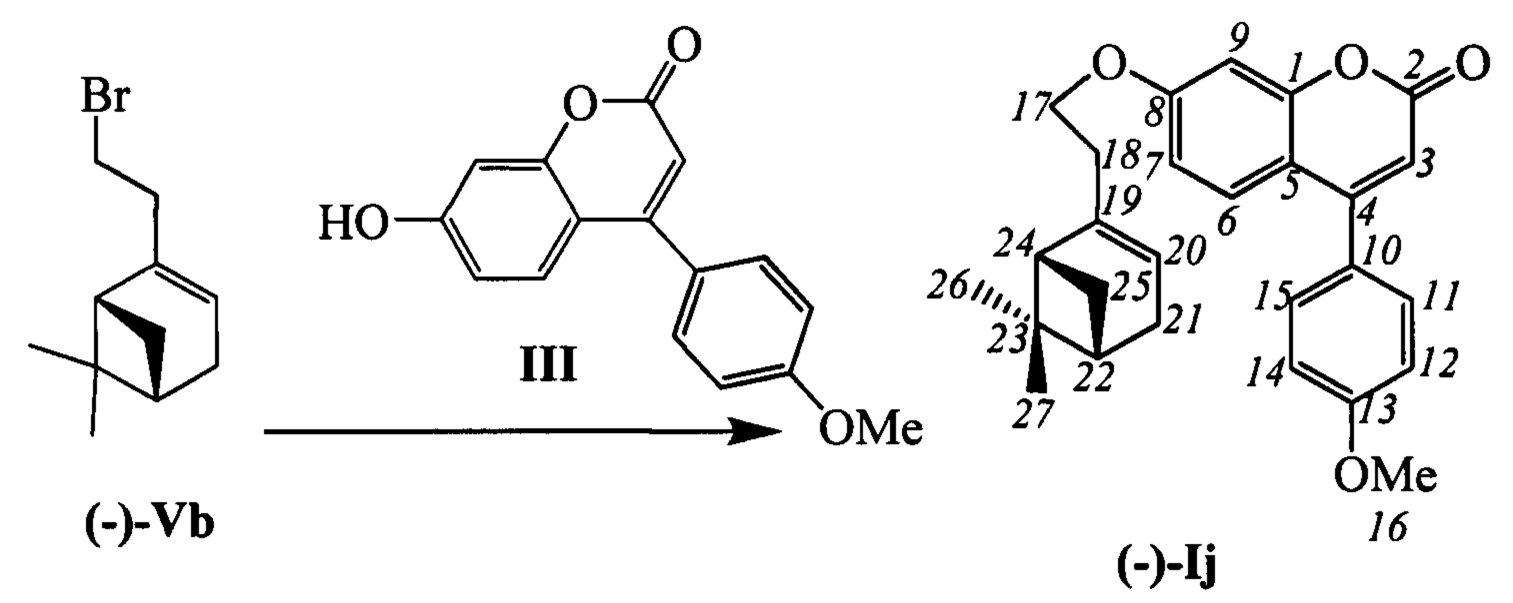
К 0.240 г (1.05 ммоль) бромида Vb в 5 мл диметилформамида прибавили 0.188 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.159 г исходного кумарина III (конверсия 16%) и 0.037 г продукта (-)-Ij (выход с учетом конверсии 65%).
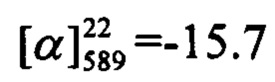 (с=0.75, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С27Н3); 1.16 (д, 1Н, 2J25a,25s=8.6, Н25а); 1.26 (с, 3Н, С26Н3); 2.05-2.11 (м, 2Н, Н21, Н24); 2.19 (дм, 1Н, 2J=17.6, Н21); 2.26 (дм, 1Н, 2J=17.6, Н21'); 2.36 (ддд, 1H, J25s,25a=8.6, J25s,22=J25s,24=5.6, H25s); 2.40-2.51 (м, 2Н, 2Н18); 3.86 (с, 3Н, С16Н3); 4.02 (т, 2Н, J17,18=7.0, 2Н17); 5.32-5.36 (м, 1Н, Н20); 6.15 (с, 1H, Н3); 6.75 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.83 (д, 1H, J9,7=2.5, H9); 7.01 (ш.д, 2Н, J12,11=J14,15=8.7, Н12, Н14); 7.37 (ш.д, 2Н, J11,12=J15,14=8.7, Н11, Н15); 7.40 (д, 1Н, J6,7=8.9, Н6). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.93 (с, С1); 161.28 (с, С2); 111.12 (д, С3); 155.38 (с, С4); 112.43 (с, С5); 127.81 (д, С6); 112.54 (д, С7); 161.97 (с, С8); 101.49 (д, С9); 127.79 (с, С10); 129.74 (д, С11, С15); 114.16 (д, С12, С14); 160.62 (с, С13); 55.30 (к, С16); 66.88 (т, С17); 36.07 (т, С18); 143.90 (с, С19); 118.97 (д, С20); 31.27 (т, С21); 40.64 (д, С22); 37.97 (с, С23); 45.79 (д, С24); 31.54 (т, С25); 26.17 (к, С26); 21.08 (к, С27). Найдено: m/z=415.1906 [М-Н]+ (C27H27O4)+ Вычислено: m/z=415.1904.
(с=0.75, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С27Н3); 1.16 (д, 1Н, 2J25a,25s=8.6, Н25а); 1.26 (с, 3Н, С26Н3); 2.05-2.11 (м, 2Н, Н21, Н24); 2.19 (дм, 1Н, 2J=17.6, Н21); 2.26 (дм, 1Н, 2J=17.6, Н21'); 2.36 (ддд, 1H, J25s,25a=8.6, J25s,22=J25s,24=5.6, H25s); 2.40-2.51 (м, 2Н, 2Н18); 3.86 (с, 3Н, С16Н3); 4.02 (т, 2Н, J17,18=7.0, 2Н17); 5.32-5.36 (м, 1Н, Н20); 6.15 (с, 1H, Н3); 6.75 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.83 (д, 1H, J9,7=2.5, H9); 7.01 (ш.д, 2Н, J12,11=J14,15=8.7, Н12, Н14); 7.37 (ш.д, 2Н, J11,12=J15,14=8.7, Н11, Н15); 7.40 (д, 1Н, J6,7=8.9, Н6). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.93 (с, С1); 161.28 (с, С2); 111.12 (д, С3); 155.38 (с, С4); 112.43 (с, С5); 127.81 (д, С6); 112.54 (д, С7); 161.97 (с, С8); 101.49 (д, С9); 127.79 (с, С10); 129.74 (д, С11, С15); 114.16 (д, С12, С14); 160.62 (с, С13); 55.30 (к, С16); 66.88 (т, С17); 36.07 (т, С18); 143.90 (с, С19); 118.97 (д, С20); 31.27 (т, С21); 40.64 (д, С22); 37.97 (с, С23); 45.79 (д, С24); 31.54 (т, С25); 26.17 (к, С26); 21.08 (к, С27). Найдено: m/z=415.1906 [М-Н]+ (C27H27O4)+ Вычислено: m/z=415.1904.
Пример 15. Синтез 4-(4-бромофенил)-7-(2-((1R,5S))-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этокси)-2Н-хромен-2-она (-)-Ik
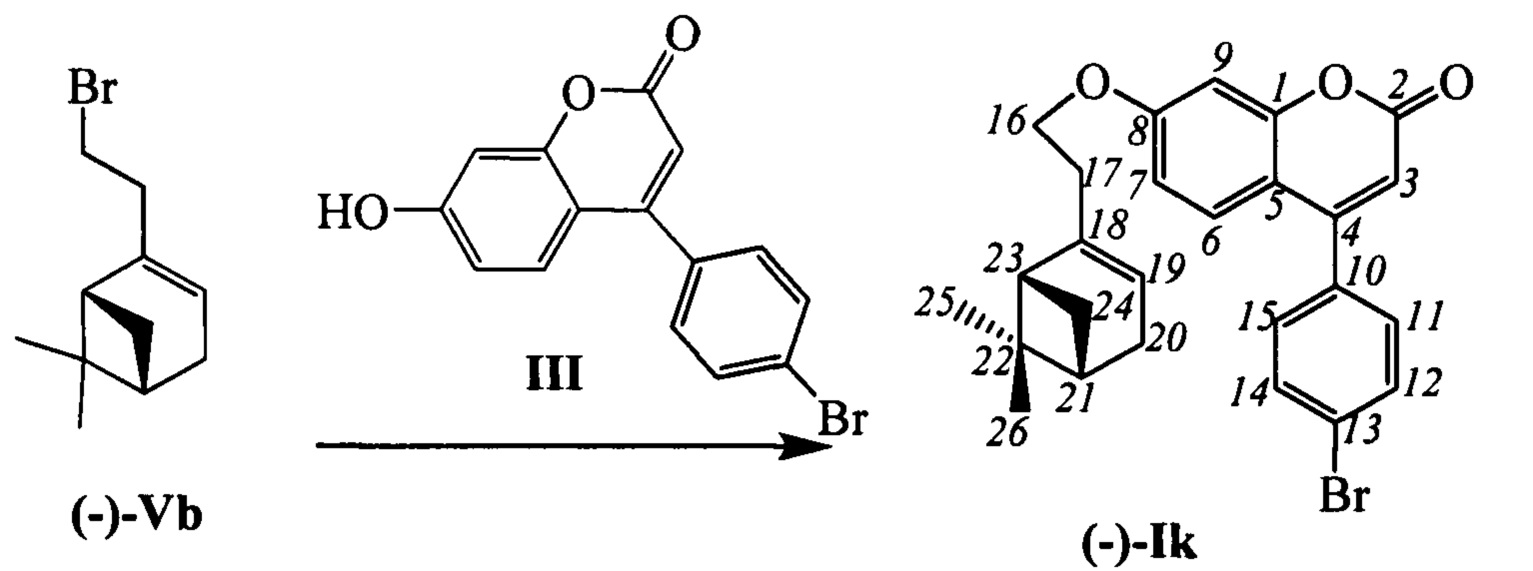
К 0.240 г (1.05 ммоль) бромида (-)-Vb в 5 мл диметилформамида прибавили 0.226 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.031 г исходного кумарина III (конверсия 86%) и 0.042 г продукта (-)-Ik (выход с учетом конверсии 15%).
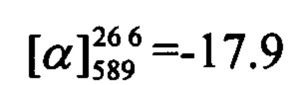 (с=0.58, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.80 (с, 3Н, С26Н3); 1.15 (д, 1Н, 2J24a,24s=8.6, Н24а); 1.25 (с, 3Н, С25Н3); 2.06-2.09 (м, 2Н, Н21, Н23); 2.19 (дм, 1Н, J20,20'=17.6, Н20); 2.26 (дм, 1Н, J20',20=17.6, Н20'); 2.36 (ддд, 1Н, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.51 (м, 2Н, 2Н17); 3.98-4.04 (м, 2Н, 2Н16); 5.33-5.36 (м, 1Н, Н19); 6.16 (с, 1Н, Н3); 6.75 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.84 (д, 1H, J9,7=2.5, Н9); 7.28 (д, 1Н, J6,7=8.9, H6); 7.28-7.31 (м, 2Н, J11,12=J15,14=8.4, Н11, Н15); 7.61-7.64 (м, 2Н, J12,11=J14,15=8.4, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.86 (с, С1); 160.87 (с, С2); 111.65 (д, С3); 154.49 (с, С4); 112.81 (с, С5); 127.44 (д, С6); 112.79 (д, С7); 162.19 (с, С8); 101.50 (д, С9); 134.30 (с, С10); 129.84 (д, С11, С15); 131.97 (д, С12, С14); 123.86 (с, С13); 66.87 (т, С16); 36.01 (т, С17); 143.78 (с, С18); 119.03 (д, С19); 31.23 (т, С20); 40.54 (д, С21); 37.95 (с, С22); 45.65 (д, С23); 31.51 (т, С24); 26.14 (к, С25); 21.08 (к, С26). Найдено: m/z=464.0988 [М]+ (C26H25O3Br)+ Вычислено: m/z=464.0982.
(с=0.58, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.80 (с, 3Н, С26Н3); 1.15 (д, 1Н, 2J24a,24s=8.6, Н24а); 1.25 (с, 3Н, С25Н3); 2.06-2.09 (м, 2Н, Н21, Н23); 2.19 (дм, 1Н, J20,20'=17.6, Н20); 2.26 (дм, 1Н, J20',20=17.6, Н20'); 2.36 (ддд, 1Н, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.51 (м, 2Н, 2Н17); 3.98-4.04 (м, 2Н, 2Н16); 5.33-5.36 (м, 1Н, Н19); 6.16 (с, 1Н, Н3); 6.75 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.84 (д, 1H, J9,7=2.5, Н9); 7.28 (д, 1Н, J6,7=8.9, H6); 7.28-7.31 (м, 2Н, J11,12=J15,14=8.4, Н11, Н15); 7.61-7.64 (м, 2Н, J12,11=J14,15=8.4, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.86 (с, С1); 160.87 (с, С2); 111.65 (д, С3); 154.49 (с, С4); 112.81 (с, С5); 127.44 (д, С6); 112.79 (д, С7); 162.19 (с, С8); 101.50 (д, С9); 134.30 (с, С10); 129.84 (д, С11, С15); 131.97 (д, С12, С14); 123.86 (с, С13); 66.87 (т, С16); 36.01 (т, С17); 143.78 (с, С18); 119.03 (д, С19); 31.23 (т, С20); 40.54 (д, С21); 37.95 (с, С22); 45.65 (д, С23); 31.51 (т, С24); 26.14 (к, С25); 21.08 (к, С26). Найдено: m/z=464.0988 [М]+ (C26H25O3Br)+ Вычислено: m/z=464.0982.
Пример 16. Синтез 7-(2-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этокси)-4-фенил-2Н-хромен-2-она I1
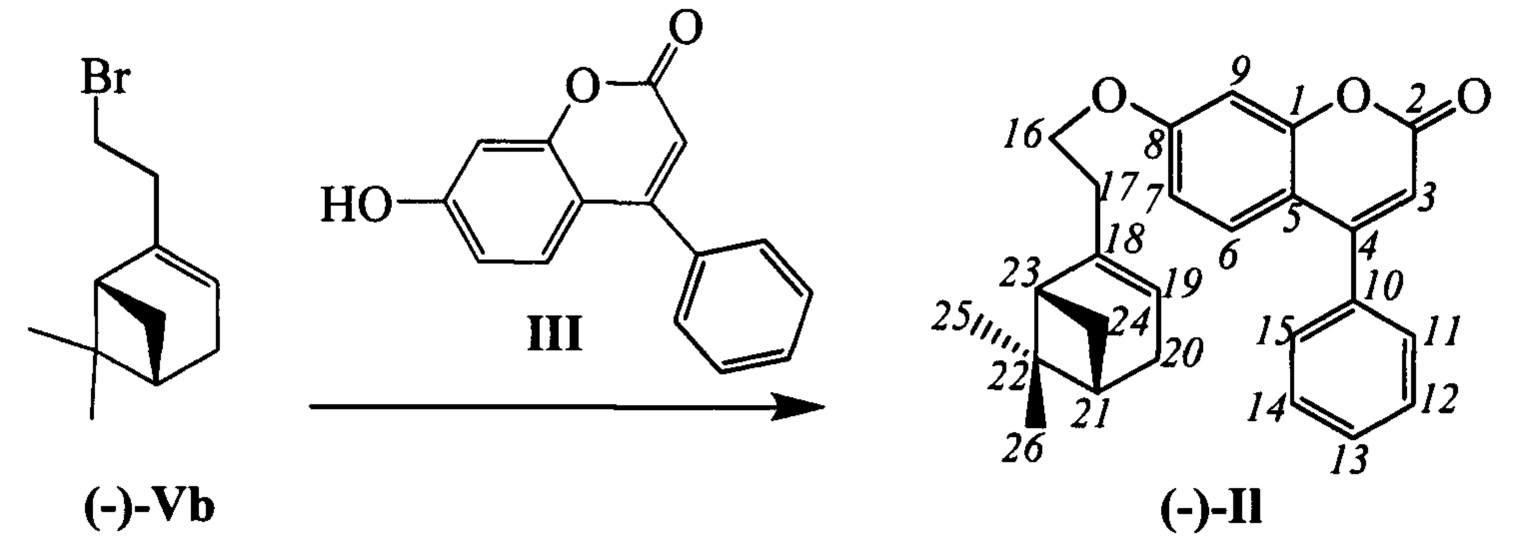
К 0.240 г (1.05 ммоль) бромида (-)-Vb в 5 мл диметилформамида прибавили 0.169 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили двукратным хроматографированием на SiO2 0.032 г продукта (-)-I1 (12%).
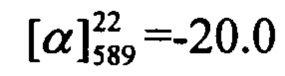 (с=0.53, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.16 (д, 1Н, 2J24a,24s=8.6, Н24а); 1.26 (с, 3Н, С25Н3); 2.05-2.11 (м, 2Н, Н21, Н23); 2.20 (д.м, 1Н, J20,20'=17.6, другие J<3.5, Н20); 2.26 (д. м, 1Н, J20',20=17.6, другие J<3.5, Н20'); 2.37 (ддд, 1Н, 2J=8.7, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.52 (м, 2H, 2Н17); 3.98-4.06 (м, 2Н, 2Н16); 5.32-5.36 (м, 1H, Н19); 6.18 (с, 1Н, Н3); 6.74 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.85 (д, 1Н, J9,7=2.5, Н9); 7.34 (д, 1Н, J6,7=8.9, Н6); 7.39-7.44 (м, 2Н, Н11, Н15); 7.46-7.51 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.91 (с, С1); 161.11 (с, С2); 111.63 (д, С3); 155.71 (с, С4); 112.30 (с, С5); 127.80 (д, С6); 112.63 (д, С7); 162.07 (с, С8); 101.50 (д, С9); 135.54 (с, С10); 128.25 (д, С11, С15); 128.68 (д, С12, С14); 129.42 (д, С13); 66.90 (т, С16); 36.07 (т, С17); 143.89 (с, С18); 118.99 (д, С19); 31.27 (т, С20); 40.64 (д, С21); 37.97 (с, С22); 45.79 (д, С23); 31.54 (т, С24); 26.18 (к, С25); 21.08 (к, С26). Найдено: m/z=386.1872 [М]+ (C26H26O3)+ Вычислено: m/z=386.1877.
(с=0.53, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 0.81 (с, 3Н, С26Н3); 1.16 (д, 1Н, 2J24a,24s=8.6, Н24а); 1.26 (с, 3Н, С25Н3); 2.05-2.11 (м, 2Н, Н21, Н23); 2.20 (д.м, 1Н, J20,20'=17.6, другие J<3.5, Н20); 2.26 (д. м, 1Н, J20',20=17.6, другие J<3.5, Н20'); 2.37 (ддд, 1Н, 2J=8.7, J24s,24a=8.6, J24s,21=J24s,23=5.6, H24s); 2.40-2.52 (м, 2H, 2Н17); 3.98-4.06 (м, 2Н, 2Н16); 5.32-5.36 (м, 1H, Н19); 6.18 (с, 1Н, Н3); 6.74 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.85 (д, 1Н, J9,7=2.5, Н9); 7.34 (д, 1Н, J6,7=8.9, Н6); 7.39-7.44 (м, 2Н, Н11, Н15); 7.46-7.51 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.91 (с, С1); 161.11 (с, С2); 111.63 (д, С3); 155.71 (с, С4); 112.30 (с, С5); 127.80 (д, С6); 112.63 (д, С7); 162.07 (с, С8); 101.50 (д, С9); 135.54 (с, С10); 128.25 (д, С11, С15); 128.68 (д, С12, С14); 129.42 (д, С13); 66.90 (т, С16); 36.07 (т, С17); 143.89 (с, С18); 118.99 (д, С19); 31.27 (т, С20); 40.64 (д, С21); 37.97 (с, С22); 45.79 (д, С23); 31.54 (т, С24); 26.18 (к, С25); 21.08 (к, С26). Найдено: m/z=386.1872 [М]+ (C26H26O3)+ Вычислено: m/z=386.1877.
Пример 17. Синтез 7-(бензилокси)-4-(4-метоксифенил)-2Н-хромен-2-она Im
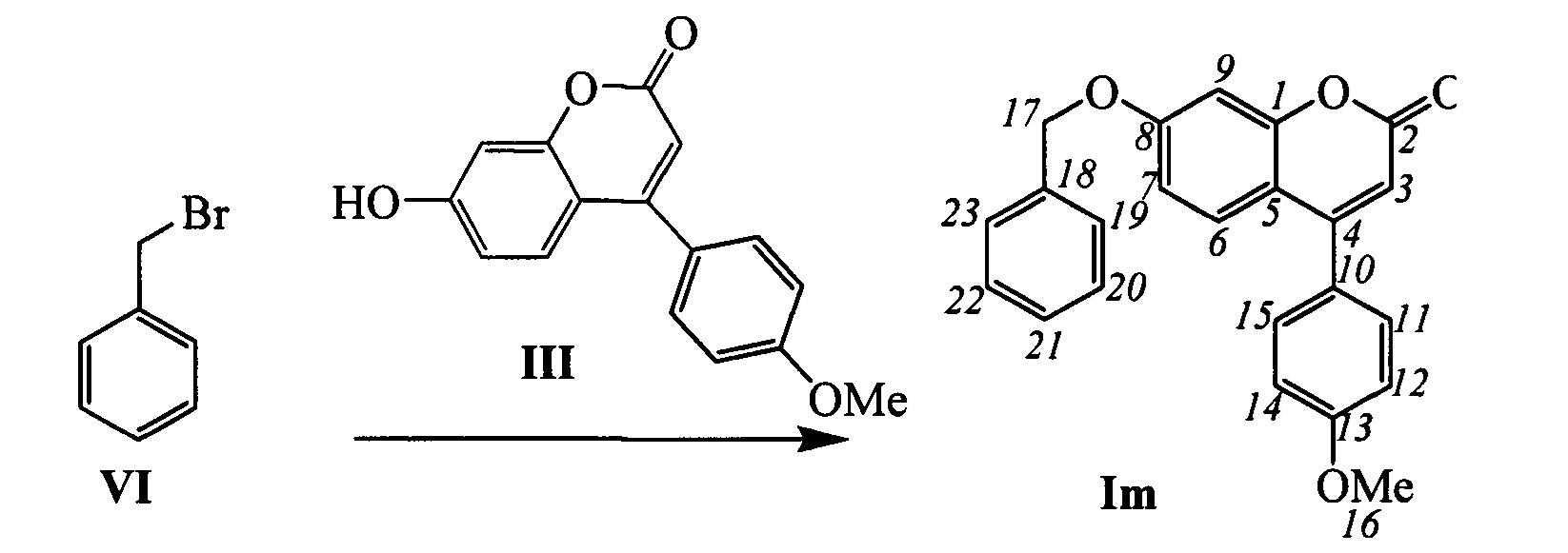
К 0.180 г (1.05 ммоль) бромида VI в 5 мл диметилформамида прибавили 0.182 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.084 г продукта Im (33%).
Тпл=143°С. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 3.86 (с, 3Н, С16Н3); 5.12 (с, 2Н, 2Н17); 6.16 (с, 1Н, Н3); 6.85 (дд, 1H, J7,6=8.9, J7,9=2.5, Н7); 6.93 (д, 1Н, J9,7=2.5, Н9); 7.01 (дм, 2Н, J12,11=J14,15=8.7, Н12, Н14); 7.30-7.35 (м, 1H, Н21); 7.35-7.45 (м, 7Н, Н6, Н11, Н15, Н19,Н20, Н22, Н23). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.82 (с, С1); 161.18 (с, С2); 111.34 (д, С3); 155.30 (с, С4); 112.75 (с, С5); 127.90 (д, С6); 112.72 (д, С7); 161.61 (с, С8); 102.07 (д, С9); 127.68 (с, С10); 129.72 (д, С11, С15); 114.16 (д, С12, С14); 160.65 (с, С13); 55.29 (к, С16); 70.37 (т, С17); 135.70 (с, С18); 127.36 (д, С19, С23); 128.61 (д, С20, С22); 128.22 (д, С21). Найдено: m/z=358.1198 [М]+ (C23H18O4)+ Вычислено: m/z=358.1200.
Пример 18. Синтез 7-(бензилокси)-4-(4-бромофенил)-2Н-хромен-2-она In
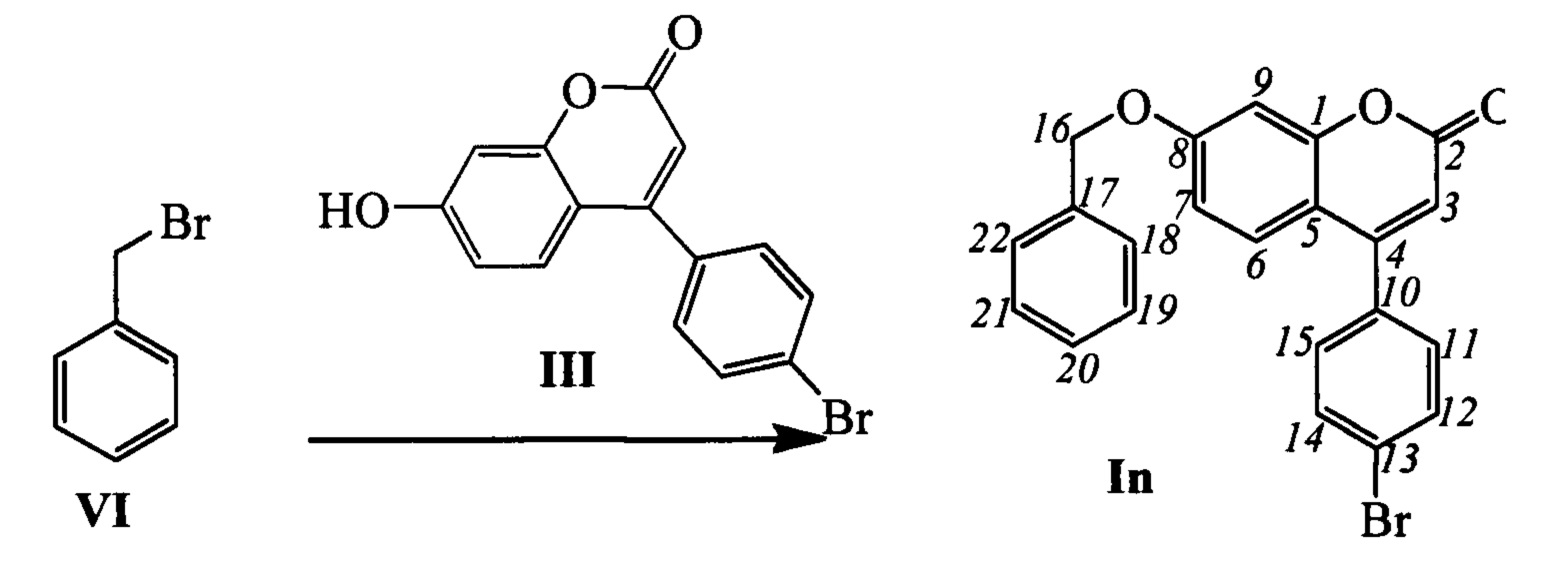
К 0.180 г (1.05 ммоль) бромида VI в 5 мл диметилформамида прибавили 0.225 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) и при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Продукт In выделили кристаллизацией из этанола, выход составил 0.060 г (21%).
Тпл=128°C. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 5.13 (с, 2Н, 2Н16); 6.17 (с, 1H, Н3); 6.86 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.94 (д, 1Н, J9,7=2.5, Н9); 7.29 (дм, 2Н, J11,12=J15,14=8.5, Н11, Н15); 7.31 (д, 1Н, J6,7=8.9, Н6); 7.32-7.35 (м, 1Н, Н20); 7.37-7.43 (м, 4Н, Н18, Н19, Н21, Н22); 7.63 (дм, 2Н, J12,11=J14,15=8.5, Н12, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.79 (с, С1); 160.81 (с, С2); 111.92 (д, С3); 154.46 (с, С4); 112.18 (с, С5); 127.56 (д, С6); 113.02 (д, С7); 161.86 (с, С8); 102.14 (д, С9); 134.24 (с, С10); 129.83 (д, С11, С15); 132.01 (д, С12, С14); 123.92 (с, С13); 70.42 (т, С16); 135.54 (с, С17); 127.38 (д, С18, С22); 128.66 (д, С19, С21); 128.30 (д, С20). Найдено: m/z=406.0204 [М]+ (C22H15O3Br)+ Вычислено: m/z=406.0199.
Пример 19. Синтез 7-(бензилокси)-4-фенил-2Н-хромен-2-она Io
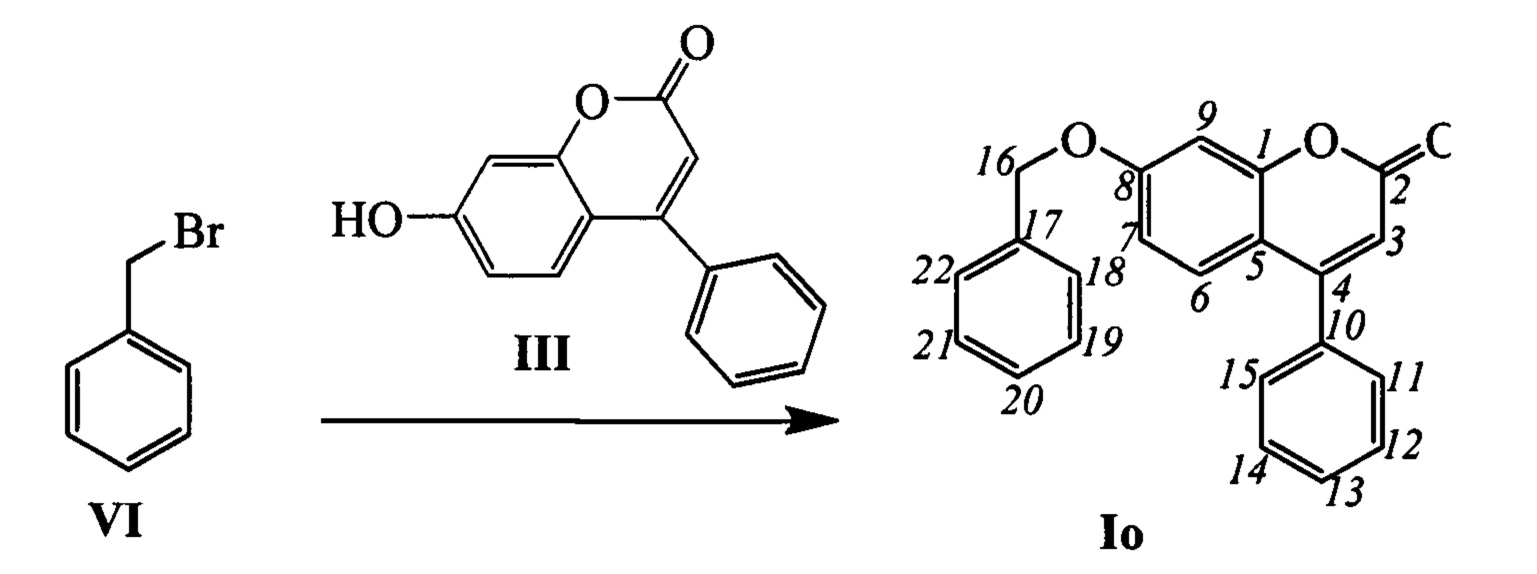
К 0.180 г (1.05 ммоль) бромида VI в 5 мл диметилформамида прибавили 0.169 г (0.71 ммоль) соединения III и 0.320 г (2.10 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) при 25°С и перемешивании. Перемешивали при комнатной температуре 15 минут, затем нагревали при 60°С в течение 5 часов. Добавили 5 мл воды и 5 мл этилацетата. Этилацетатный слой отделили, водный - экстрагировали этилацетатом (2×5 мл), объединенный экстракт промыли водой и высушили Na2SO4, упарили. Выделили хроматографией на SiO2 0.107 г продукта Io (46%).
Тпл=92°С. Спектр ЯМР 1Н (CDCl3, δ, м. д, J, Hz): 5.13 (с, 2Н, 2Н16); 6.19 (с, 1Н, Н3); 6.85 (дд, 1Н, J7,6=8.9, J7,9=2.5, Н7); 6.94 (д, 1Н, J9,7=2.5, Н9); 7.31-7.35 (м, 1H, Н20); 7.35-7.44 (м, 7Н, Н6, Н11, Н15, Н18, Н22, Н19, Н21); 7.46-7.52 (м, 3Н, Н12, Н13, Н14). Спектр ЯМР 13С (CDCl3, δ, м. д.): 155.80 (с, С1); 161.00 (с, С2); 111.86 (д, С3); 155.62 (с, С4); 112.62 (с, С5); 127.88 (д, С6); 112.80 (д, С7); 161.71 (с, С8); 102.09 (д, С9); 135.44 (с, С10); 128.23 (д, С11, С15); 128.68 (д, С12, С14); 129.44 (д, С13); 70.39 (т, С16); 135.67 (с, С17); 127.35 (д, С18, С22); 128.62 (д, С19, С21); 128.23 (д, С20). Найдено: m/z=328.1093 [М]+ (C22H16O3)+ Вычислено: m/z=328.1094 404.1982.
Пример 20. Влияние производных фенилкумаринов на активность фермента Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.-) была экспрессирована в системе Escherichia coli (плазмида рЕТ  любезно предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена как описано [Interthal Н, Pouliot JJ, Champoux JJ. // Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014].
любезно предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена как описано [Interthal Н, Pouliot JJ, Champoux JJ. // Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014].
В качестве тест-системы для определения ингибирующих свойств предлагаемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3'-конца олигонуклеотида, катализируемая  . На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
. На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-HCl, рН 8.0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением  до конечной концентрации 1.3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводился с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
до конечной концентрации 1.3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводился с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
Величины IC50 для изученных соединений приведены в таблице 1.
Пример 21. Цитотоксичность предлагаемых соединений.
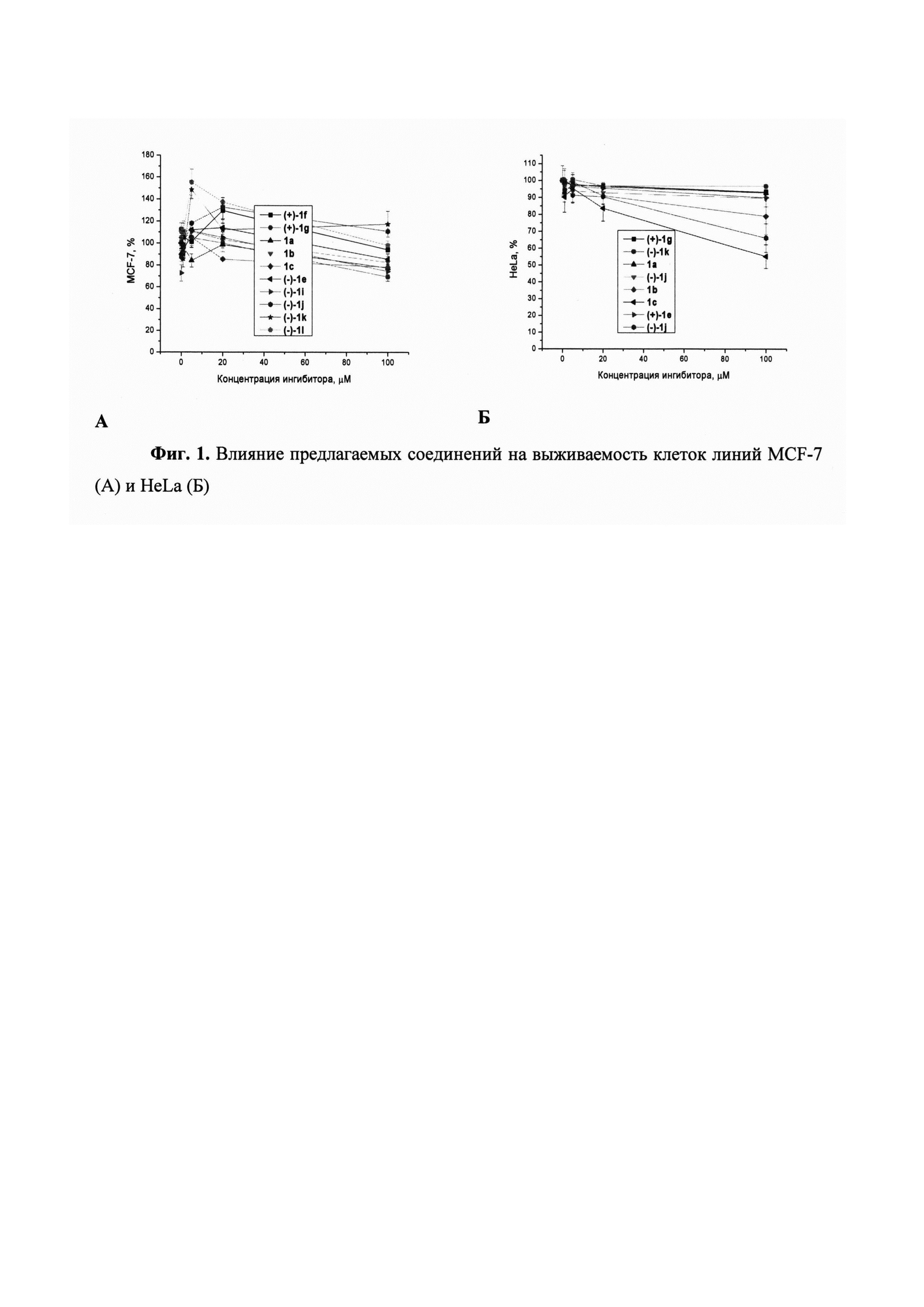
Анализ цитотоксичности предлагаемых соединений проводили на линиях клеток аденокарциномы молочной железы человека MCF-7 и рака шейки матки человека HeLa. Индуцированную соединениями клеточную гибель оценивали с помощью стандартного МТТ-теста [Mosmann Т // J Immunol Methods. 1983, 65, 55-63] путем колориметрического измерения количества формазана, конвертированного из 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия бромида (МТТ) клетками, подвергшимися воздействию соединений. Клетки выращивали в среде IMDM, с 40 мкг/мл гентамицина, 100 ед/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% CO2.
После формирования 50% монослоя в культуральную среду добавляли исследуемые препараты (объем добавляемых реагентов составляет 1/100 общего объема культуральной среды, объем DMSO 1% от конечного объема) и следили за ростом клеточной культуры в течение 3 сут. В качестве контроля использовали клетки, которые выращивали в присутствии 1% DMSO.
Токсичность соединений отсутствовала или была незначительна во всем диапазоне изученных концентраций (до 100 мкМ), Фиг. 1.
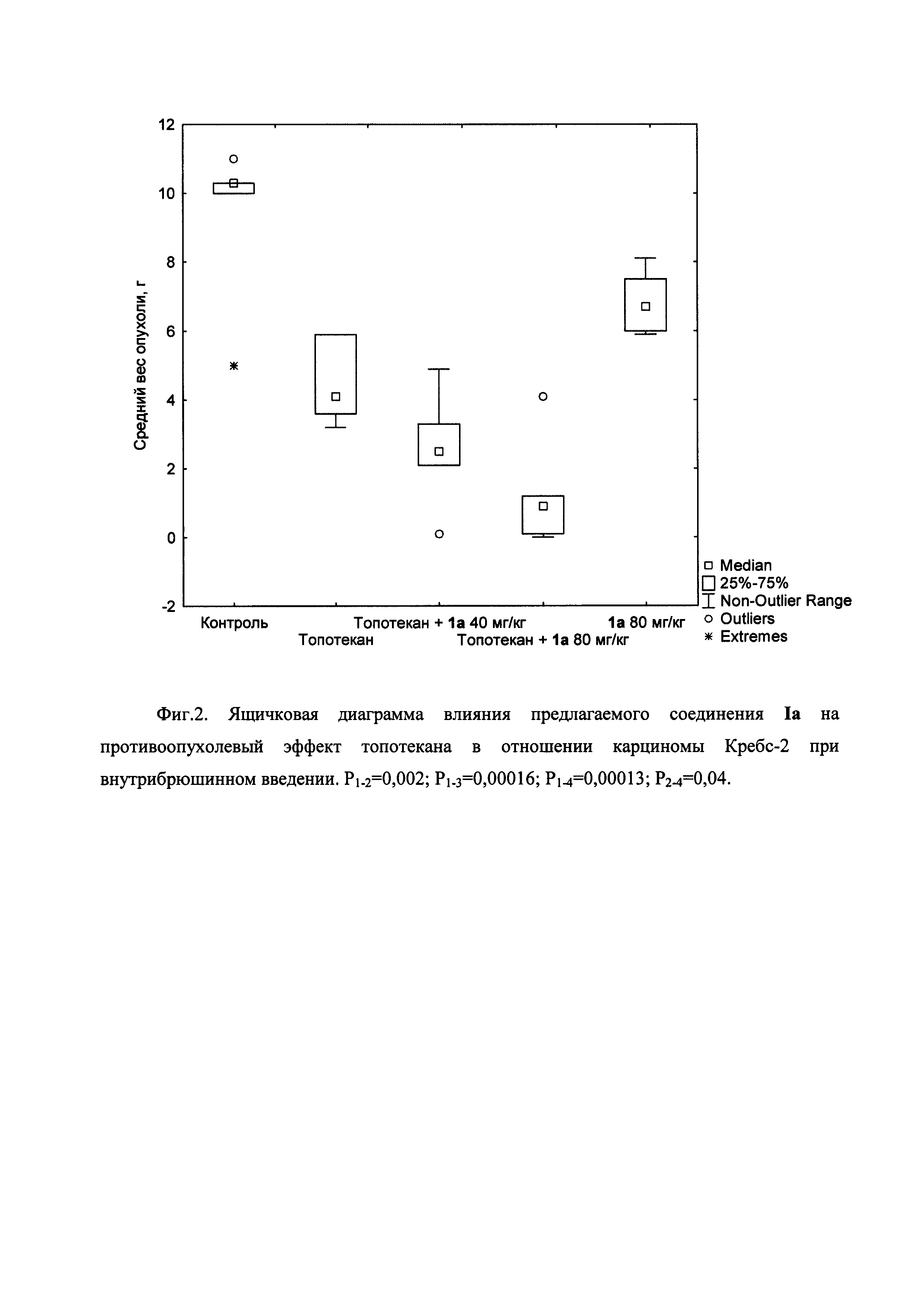
Пример 22. Влияние соединения Ia на развитие асцитной карциномы Кребс-2 у мышей
Использованы мыши самцы линии BALB/C в возрасте 3-4 недели. Мышам внутрибрюшинно привили карциному Кребс-2 (по 0,2 мл в разведении 1/20). Через сутки мышей разделили на группы и оставили без лечения (группа 1, контроль); ввели топотекан 0,5 мг/кг внутрибрюшинно (группа 2); ввели топотекан как выше и соединение Ia 40 мг/кг внутрибрюшинно (группа 3); ввели топотекан как выше и соединение Ia 80 мг/кг внутрибрюшинно (группа 4); ввели только соединение Ia 80 мг/кг внутрибрюшинно (группа 5).
Применение топотекана в виде монопрепарата снизило вес асцитной опухоли приблизительно вдвое с 9,3 г до 4,5 г (Фиг. 2). Использование комбинации топотекана с предлагаемым соединением привело к еще большему снижению веса опухоли, более выраженному при дозе соединения 80 мг/кг до 1,3 г. Разница между весом опухоли в группах, получавших только топотекан или топотекан + 80 мг/кг соединение Ia, достоверна (р=0,044). Вес опухоли в группе, получавшей только предлагаемое соединение, достоверно не отличался от контроля.
Таким образом, применение предлагаемого соединения Ia в разовой дозе 80 мг/кг внутрибрюшинно в сочетании с топотеканом приводит к достоверному снижению веса асцитной опухоли Кребс-2.