Результат интеллектуальной деятельности: Способ получения моногидрата гидроксида лития из рассолов
Вид РИД
Изобретение
Область техники
Изобретение относится к области гидрометаллургии лития и может быть использовано для получения моногидрата гидроксида лития из природных рассолов.
Уровень техники
Известен способ получения гидроксида лития из рассолов, содержащих галогениды лития, щелочных и щелочноземельных металлов, после их концентрирования в естественных условиях с отделением большей части хлоридов натрия и калия и осаждением кальция и магния при рН=10.5-11.5. Концентрированный раствор, содержащий до 2-7 % лития, после очистки от кальция и магния поступает на электролиз, который осуществляется в электролизере с катионообменной мембраной Nafion, отделяющей анолит от католита, где происходит переход ионов лития в катодную камеру с образованием LiOH. Процесс сопровождается выделением хлора и водорода. Для получения моногидрата гидроксида лития высокой чистоты производят кристаллизацию его из раствора католита, в котором содержание примесных катионов не превышает 0.5 %. Маточный раствор, полученный после упаривания католита и отделения LiOH⋅Н2О, подвергают карбонизации диоксидом углерода для осаждения карбоната лития высокой чистоты, примесь хлора в котором составляет не более 0.005%. Выделяющиеся хлор и водород, вступая во взаимодействие, образуют соляную кислоту, которая в результате обменной реакции с высокочистым моногидратом гидроксида лития образует хлорид лития для получения высокочистого металлического лития (патент ФРГ №2700748.08.09.77) [1]. Близким по технической сущности является способ получения LiOH⋅H2O в основе которого лежит мембранный электролиз раствора хлорида, произведенного в свою очередь из литиеносных рассолов, включая природные (патент RU2470861.09.04.2009. Опубл. 27.05.2014. Бюл. № 14) [2].
Общим недостатком данных способов является многоступенчатость получения раствора хлорида лития, поступающего на электролиз, что возможно только в условиях аридного климата по галургической технологии с постадийным отделением хлоридов натрия и калия и химическим примесей кальция, магния и бора. Полученные растворы хлорида лития требуют дальнейшего концентрирования уже с помощью погружного газового горения, повторного осаждения примесей Са и Mg с помощью LiOH и Li2CO3. Таким образом, необходимо дважды использовать химическую очистку и многократно фильтровать концентрируемый рассол. Кроме того для получения требуемого количества продуктивного раствора LiCl требуется очищать очень большие объемы исходных рассолов, что приводит к большим расходам реагентов и образованию больших объемов твердых отходов и глубоко концентрировать по хлориду лития исходные литиеносные рассолы с, как правило, солесодержанием выше 200 кг/м3, что сопровождается высокими капитальными вложениями, высокой энергоемкостью производства и неизбежным высаливанием огромной массы солей в виде NaCl и NaCl в смеси с KCl не востребованных на рынке. Для литиеносных рассолов с высоким содержанием кальция и магния, до 50-70 % от суммы солей, какими являются глубинные рассолы Сибирской платформы и озерные рассолы провинции Цинхай в Китае, использование галургической технологии для получения продуктивного раствора LiCl невозможно принципиально.
Для литиеносных рассолов, с высоким содержанием кальция и магния, разработана технология сорбционного обогащения рассолов по литию включающая способ получения первичного литиевого концентрата в виде раствора хлорида лития и установки для его получения (патент RU2516538, 17.02.2012. Опубл 20.05.2014. Бюл. № 14) [3]. В технологии предусматривается сорбционное получение литиевого концентрата, его дообогащение и концентрирование, но в установке отсутствует конвертер для получения раствора LiOH из раствора хлорида лития. Технология сорбционного выделения хлорида лития из литиеносных рассолов оказалась эффективной не только применительно к литиеносным рассолам с высоким содержанием кальция и магния, но и к традиционным поликомпоненнтным литиеносным высокоминерализованным рассолам хлоридного натриевого типа с невысоким исходным содержанием кальция и магния. Для селективной сорбции LiCl из рассолов используют гранулированный сорбент ДГАЛ-Cl (патент RU 2455063, 13.10.10. Опубл. 10.07.2014. Бюл. №19) [4], основу которого составляет двойное соединение алюминия, лития - LiCl⋅2Al(OH)3⋅mH2O с дефицитом лития в структуре, способное селективно сорбировать LiCl из насыщенного сорбента в пресную воду. На основе использования селективного гранулированного сорбента разработан способ получения гидроокиси лития из рассолов и установка для его осуществления (патент RU2193008, 25.03.1998. Опубл. 20.11.2002. Бюл. № 32) [5]. По данному способу получение раствора хлорида лития, осуществляют в U- образной колонне путем селективной сорбции хлорида лития из рассолов и десорбции LiCl водой с последующим концентрированием раствора LiCl в той же колонне путем многократной обработки насыщенного литием сорбента на стадии сорбции оборотными растворами LiCl от предыдущей десорбции. Десорбцию LiCl с насыщенного сорбента осуществляют при соотношении объема циркулирующего раствора к объему сорбента, равного 1.5:1.0. Десорбция LiCl оборотными растворами хлорида лития позволяет повысить концентрацию LiCl с 0.5-3.0 кг/м3 до 11.0-17.0 кг/м3. Концентрированный раствор LiCl подвергают ионообменной очистке от примесей Са и Mg на катионите КУ-2 в Li -форме с последующей его регенерацией раствором хлорида лития. Полученный очищенный раствор LiCl поступает на стадию электрохимической конверсии для получения раствора LiOH. Выделяющийся на аноде хлор абсорбируют в присутствии мочевины маточным раствором LiOH образующимся после кристаллизации LiOH⋅Н2О.
Анолит после электролиза хлорида лития направляют на стадию обессоливания до концентрации LiCl, равной 0.5-3.0 кг/м3, который используют на стадии десорбции лития с сорбента. Все перечисленные операции осуществляют в одной U-образной колонне, заполненной гранулированным сорбентом на основе LiCl⋅2Al(OH)3⋅mH2O селективным к литию. Колонна снабжена устройством для реверсивной циркуляции промывочной жидкости и обводной системой для возврата десорбирующей жидкости в зону десорбции. Все процессы осуществляются в ступенчато-противоточном режиме. Установка включает так же колонну, заполненную катионитом КУ-2 в Li-форме для очистки раствора хлорида лития, от примесей Ca и Mg. Раствор хлорида лития после очистки и концентрирования до 70-100 г/м3 используют на стадии регенерации катионита.
Установка для конверсии хлорида лития в гидроксид состоит из мембранного электролизера и электродиализатора - обессоливателя фильтр-прессного типа для получения обессоленного раствора, абсорбера для улавливания хлора, а также кристаллизатора для получения LiOH⋅Н2О и центрифуги для отделения кристаллов от маточного рассола, используемого для поглощения хлора. Процесс конверсии LiCl в LiOH осуществляют в электролизере, работающим в гальваностатическом режиме при плотности тока 0.25-0.95 кА/м2, куда подают раствор хлорида лития 18 кг/м3. Полученный раствор гидроокиси лития концентрируют до 60-80 кг/м3. Анолит с содержанием LiCl 6.5-6.7 кг/м3 подвергают обессоливанию до 0.5-3.0 кг/м3 LiCl.
Электролизер для конверсии хлорида лития имеет анод из коррозионностойкого материала, в качестве которого использовали платину или титан с покрытием из иридия или платины, а в качестве катода применяли нержавеющую сталь. Электролизер снабжен промежуточными электродами, выполненными из иридированной титановой фольги, и мемранамиМК-40 или МК-41. Хлор, выделяющийся на аноде в процессе электролиза, направляют в газоотделитель, а затем в абсорбер для его поглощения маточным раствором после кристаллизации LiOH⋅H2O. Избыток хлора улавливают исходным бромсодержащим рассолом, где осуществляется окисление бромид-иона до элементного брома, газообразный бром отдувают и конденсируют до жидкого состояния.
Недостатками способа являются:
1) концентрирование раствора хлорида лития непосредственно в сорбционно-десорбционной колонне, что приводит к получению раствора хлорида лития с концентрацией не выше 16-18 кг/м3;
2) получение разбавленных растворов LiOH в связи с большим переносом воды при электролизе низко концентрированных растворов LiCl;
3) низкая плотность тока вследствие использования в процессе электрохимической конверсии разбавленных растворов хлорида лития и как следствие низкая производительность процесса;
4) производимый продукт характеризуется повышенным содержанием примесей натрия и калия;
5) большой износ сорбента в процессе перемещения по колонне.
Указанные недостатки устранены в способе получения LiOH⋅H2O из рассолов (патент RU 2656452, 04.02.2016. Опубл. 05.06.2018. Бюл. № 16) реализацией следующих технических решений, заложенных в основу заявляемого способа:
- получение первичного литиевого концентрата осуществляют в колоннах с неподвижным слоем гранулированного сорбента, что позволяет на порядок сократить потери сорбента;
- глубокое концентрирование первичного литиевого концентрата перед электрохимической конверсией, что достигается комбинированным методом: обратноосмотическим до общего солесодержания 60 кг/м3 в сочетании с электродиализным до 190-205 кг/м3 по LiCl и термическим до 450 кг/м3 по LiCl;
- очистка обратноосмотического литиевого концентрата от примесей Ca и Mg реагентным методом;
- глубокая ионообменная очистка электродиализного литиевого концентрата от кальция и магния;
- удаление примесей в виде NaCl и KCl при глубоком термическом концентрировании;
- реагентная очистка анолита от сульфат-ионов;
- ведение процесса электролиза при плотности тока 0.9-1.2 кА/м2 за счет поддержания в циркулирующем анолите концентрации LiCl на уровне 115-125 кг/м3.
Реализация предлагаемых технических решений позволила: повысить производительность процесса получения моногидрата гидрокида лития с одновременным повышением его чистоты и, как следствие, повысить экономические показатели способа.
Однако и данный способ, принятый в качестве прототипа, имеет ряд существенных недостатков, а именно:
- в процессе промышленной эксплуатации разработанной технологии получения LiOH⋅H2O из природных рассолов, основанной на сорбционно-десорбционном выделении хлоридного литиевого концентрата из литиеносного гидроминерального сырья, был установлен факт постепенного зарастания активной поверхности дренажных устройств сорбционных колонн частицами твердофазных примесей, присутствующих в составах исходных природных рассолов, что приводит к необходимости остановки процесса, выгрузки сорбента, промывки дренажных устройств и выгруженного сорбента от инородных примесей и снижению удельной производительности оборудования;
- повышенное остаточное содержание макрокомпонентов рассола в выделенном из рассола первичном литиевом концентрате и большие потери лития с промывной жидкостью ввиду несовершенства операции удаления рассола из слоя сорбента перед десорбцией хлорида лития;
- исключительно реагентное удаление примесей из первичного литиевого концентрата, приводящее к повышенному расходу химических реагентов;
- повышенный расход производимых продуктов LiOH.H2O и HCl на собственные нужды производства;
- низкая концентрация производимого раствора соляной кислоты;
- усложнение технологического процесса проведением операции реагентной очистки литиевого концентрата в два этапа: очистка от кальция и магния хлоридного литиевого концентрата после операции обратноосмотического концентрирования и очистка анолита от сульфат-ионов непосредственно в процессе электролиза;
- присутствие мелкой фракции алюмосодержащего сорбента в потоке отработанного по литию маточного рассола затрудняющее утилизацию рассола.
Предлагаемый способ получения моногидрата гидроксида лития высокой степени чистоты из поликомпонентных литиеносных рассолов сохраняет все преимущества и устраняет выше описанные недостатки прототипа.
Сущность изобретения
Технический результат, позволяющий устранить указанные недостатки, достигается тем, что в предлагаемом способе: исходный поликомпонентный литиеносный рассол перед селективным извлечением из него LiCl с использованием гранулированного сорбента ДГАЛ-Cl очищают от твердофазных примесей фильтрацией, получая продуктивный литиеносный рассол, основной поток которого направляют на операцию селективного извлечения LiCl, а заданную часть потока используют для регенерации отработанных фильтров, подавая образующийся отработанный регенерат фильтров на осветление, осветленный регенерат смешивают с исходным поликомпонентным литиеносным рассолом, направляемым на операцию фильтрации, сгущенный регенерат подвергают осадительному центрифугированию, смешивая образующийся фугат с осветленным потоком регенерата, в свою очередь подаваемым на смешение с исходным поликомпонентным природным литиеносным рассолом, выгружаемый осадок твердофазных примесей захоранивают;
- продуктивный литиеносный рассол пропускают в режиме фильтрации через слой гранулированного сорбента в колонне до появления проскоковой концентрации LiCl в потоке на выходе из колонны, фильтрацию рассола через насыщенный LiCl слой гранулированного сорбента прекращают, оставшийся в колонне продуктивный рассол вытесняют из колонны первой порцией оборотной литийсодержащей промывной жидкости, фильтруемой через слой сорбента порционно, и смешивают с продуктивным литиеносным рассолом, количество порции определяют задаваемым уровнем остаточного содержания макрокомпонентов рассола в сорбенте, находящемся в колонне, при этом в качестве последней порции промывной жидкости используют пресную воду, первую порцию находящейся в колонне отработанной литийсодержащей промывной жидкости вытесняют второй порцией литиеносной промывной жидкости и также смешивают с продуктивным литиеносным рассолом, вторую и последующие порции промывной литийсодержащей жидкости используют в следующем цикле вытеснения рассола из насыщенного LiCl слоя гранулированного сорбента, при этом первичный литиевый концентрат - водный раствор хлорида лития, содержащего макрокомпоненты рассола в виде примесей, получают фильтрацией заданного объема пресной воды через слой сорбента в колонне после завершения стадии удаления продуктивного рассола;
- полученный поток первичного литиевого концентрата декарбонизируют подкислением и направляют на операцию нанофильтрации для безреагентной очистки от основного количества примесей в виде магния, кальция и сульфат ионов, основной поток очищенного нанофильтрацией от магния, кальция и сульфат ионов первичного литиевого концентрата и обогащенного литием направляют на операцию обратноосмотического концентрирования, а сбросной поток, обогащенный магнием и кальцием, смешивают с продуктивным литиеносным рассолом;
- поток электродиализного хлоридного литиевого концентрата, образующийся после электродиализного концентрирования обратноосмотического литиевого концентрата, подвергают реагентной очистке от кальция и магния и сульфат-ионов, смешивая его с раствором бикарбоната лития, полученного обработкой углекислым газом заданного объема отработанного упаренного католита, отработанным упаренным католитом, отработанным щелочным регенератом и хлоридом бария, реагентно очищенный электродиализный хлоридный литиевый концентрат отделяют от образовавшегося осадка примесей фильтрацией. Осадок промывают деминерализованной водой, образующийся отработанный промывной раствор смешивают с основным потоком очищенного нанофильтрацией первичного литиевого концентрата. После подкисления соляной кислотой до рН=6…8 реагентно очищенный электродиализный хлоридный концентрат направляют на глубокую ионообменную очистку от остаточного количества примесей, используя при этом образующийся в результате кислотной регенерации отработанного ионита отработанный кислотный регенерат в качестве вспомогательного подкисляющего агента на операции декарбонизации первичного литиевого концентрата перед его нанофильтрацией и переводя отрегенерированный раствором соляной кислоты ионит Lewatit - 208-TP в Li-форму заданным объемом отработанного упаренного католита, а образующийся отработанный щелочной регенерат направляя в качестве реагента на операцию реагентной очистки электродиализного хлоридного литиевого концентрата;
- поток, выводимого на операции электролиза, отработанного содержащего сульфат-ионы анолита направляют в качестве основного подкисляющего агента на операцию декарбонизации первичного литиевого концентрата;
- отделение высоленных из прошедшего глубокую ионообменную очистку и упаренного электродиализного хлоридного литиевого концентрата кристаллов NaCl, KCl и Na2B4O7⋅10H2O осуществляют центрифугированием с последующей их отмывкой заданным объемом деминерализованной воды от остатков литийсодержащего маточного раствора операции упаривания очищенного электродиализного хлоридного литиевого концентрата и смешением образующегося отработанного литийсодержащего промывного хлоридного раствора с очищенным электродиализным хлоридным литиевым концентратом перед его упариванием;
- получают концентрированную соляную кислоту водной абсорбцией при охлаждении хлористого водорода, производимого сжиганием потока, очищенного от остатков католита катодного водорода в потоке очищенного от анолита анодного хлора;
- с целью снижения расхода производимой соляной кислоты на собственные нужды путем переработки отработанного упаренного католита в высокочистый товарный карбонат лития, отработанный упаренный католит после использования его заданных объемов для перевода ионита Lewatit-208-TP в литий-форму, подщелачивания электродиализного литиевого концентрата до заданного показателя рН на операции его реагентной очистки, направляют на смешение c содержащим NaHCO3, KHCO3 и LiHCO3 бикарбонатным оборотным раствором, образующуюся при смешении пульпу Li2CO3 в карбонатном растворе концентрируют удалением заданного количества воды из пульпы в виде паров путем барботажа через пульпу нагретого выше 100°С заданного объема атмосферного воздуха, твердую фазу образовавшегося карбоната лития отделяют от упаренного карбонатного раствора, содержащего Na2CO3, K2CO3 и Li2CO3, центрифугированием, карбонатный раствор обрабатывают углекислым газом до полного перевода карбонатов в бикарбонаты, выпавшие при этом в осадок бикарбонаты натрия и калия отфильтровывают, а оборотный бикарбонатный раствор направляют на смешение с отработанным упаренным католитом, выпавшие в осадок бикарбонаты натрия и калия отфильтровывают, промывают деминерализованной водой, образующейся отработанный литийсодержащий промывной бикарбонатный раствор направляют на смешение с отработанным упаренным католитом, получаемый при этом карбонат лития промывают деминерализованной водой, получая после сушки и фасовки товарный карбонат лития высокой степени чистоты, образующийся в результате промывки Li2CO3 отработанный промывной литийсодержащий карбонатный раствор направляют либо на операцию смешения с отработанным упаренным католитом, оборотным бикарбонатным раствором и отработанным литийсодержащим промывным бикарбонатным раствором и концентрирования упариванием либо на операцию реагентной очистки электродиализного литиевого концентрата, полученные кристаллы NaHCO3 и KHCO3 декарбонизируют раствором соляной кислоты с переводом в хлоридный раствор и смешивают с отработанным по литию маточным рассолом, образующийся на операции селективной сорбции LiCl или сушат и используют на хозяйственные нужды производства;
- мелкую фракцию сорбента ДГАЛ-Cl, содержащуюся в потоках отработанного по литию маточного рассола, вытесненного из слоя сорбента продуктивного литиевого рассола и отработанной промывной литийсодержащей жидкости выводят путем фильтрации потоков на фильтрах тонкой очистки, уловленные на фильтрах мелкие частицы селективного сорбента ДГАЛ-Cl и возвращают на производство гранулированного сорбента.
Преимущества предлагаемых решений по сравнению со способом прототипа состоит:
1. В исключении риска снижения производительности операции сорбционного выделения на селективном к хлориду лития гранулированном сорбенте первичного литиевого концентрата из литиеносных поликомпонентных рассолов, содержащих в своем составе твердофазные примеси и расширении диапазона литиеносных гидроминеральных сырьевых источников, пригодных для производства моногидрата лития гидроксида высокой степени чистоты;
2. В снижении уровня содержания примесей в выделяемом из литиеносных рассолов первичном литиевом концентрате.
3. В снижении эксплуатационных расходов производства LiOH⋅H2O высокой степени чистоты из литиеносных поликомпонентных рассолов;
4. В обеспечении возможности производства из литиеносных поликомпонентных рассолов наряду с моногидратом лития гидроксида батарейного качества товарного продукта в виде карбоната лития батарейного качества чистотой выше 99,99%;
5. В возможности получения в качестве побочного продукта производства концентрированной соляной кислоты взамен ее 20% раствора;
6. В снижении расходов производимых продуктов LiOH⋅H2O и концентрированной HCl на собственные нужды.
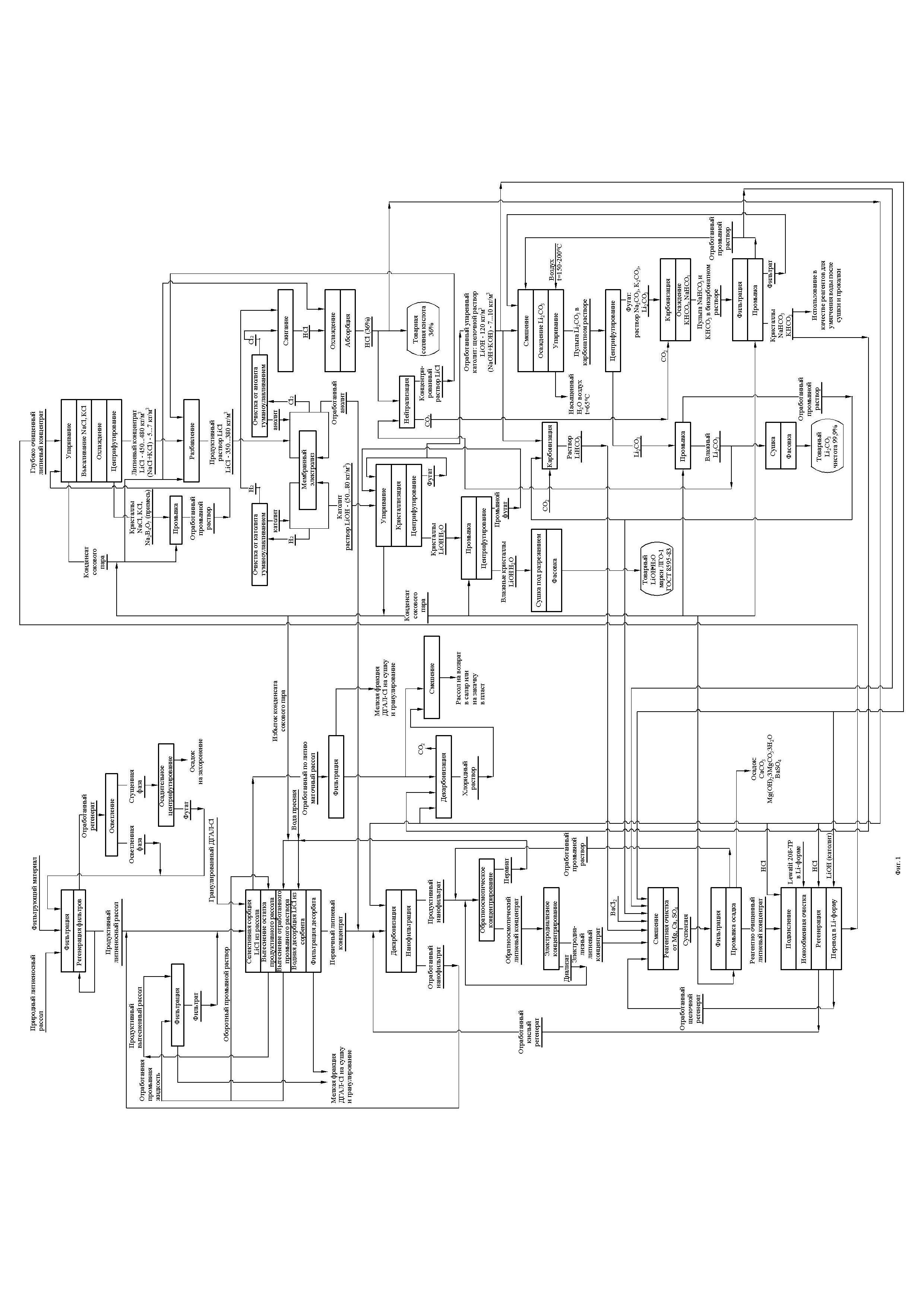
Сведения, подтверждающие возможность реализации предлагаемого изобретения представлены на фиг. 1 и в примерах.
Перечень чертежей
Фиг. 1. Технологическая схема производства моногидрата гидроксида лития из литиеносных поликомпонентных рассолов.
Ниже приводится описание реализации предлагаемого способа.
Реализация предлагаемого изобретения осуществляется в соответствии с последовательностью и взаимосвязью технологических операций представленных в рамках общей технологической схемы (фиг. 1) производства LiOH⋅H2O.
В соответствии с предлагаемой схемой исходный природный литиеносный рассол, содержащий взвешенные частицы твердофазных примесей, фильтруют на фильтровальной установке состоящей из регенерируемых фильтров тонкой очистки, производя продуктивный литиеносный рассол практически не содержащий твердофазных примесей. По мере накопления в фильтрах фильтрующей установки уловленных частиц до показателя предельной грязеемкости для используемых фильтров, фильтры последовательно регенерируют импульсной противоточной подачей продуктивного литиеносного рассола. Отработанный регенерат фильтров представляет собой пульпу с содержанием твердой фазы не ниже 5-7% мас. направляют на операцию сгущения. Осветленную часть регенерата возвращают на операцию фильтрации, смешивая с исходным природным литиеносным рассолом, сгущенную часть регенерата подвергают осадительному центрифугированию, например, в турбодекантерах. Отделенный от жидкой фазы рассола осадок захоранивают, фугат смешивают с осветленной частью регенерата, возвращаемого на фильтрацию. Далее продуктивный литиеносный рассол поступает на операцию селективного выделения хлорида лития в сорбционно десорбционный комплекс, состоящий из аппаратов колонного типа, заполненных гранулированным сорбентом ДГАЛ-Cl, селективным к содержащемуся в рассоле хлориду лития. Сорбционно-десорбционный комплекс работает в режиме: часть колонн на сорбции, часть колонн на регенерации. На стадии селективной сорбции литиеносный продуктивный рассол пропускают через сорбент в колоннах в режиме фильтрации в объеме, обеспечивающем заданную степень насыщения сорбента LiCl при заданной его степени извлечения из рассола. Обедненный по литию маточный рассол в обязательном порядке фильтруют, освобождая его от мелких частиц сорбента, выносимых рассолом из колонны в процессе сорбции. Колонны с насыщенным сорбентом переводят в режим регенерации. Регенерация сорбента состоит из стадии удаления из колонны и возврата на сорбцию рассола по составу близкому к продуктивному и стадии десорбции LiCl из сорбента, освобожденного от рассола.
Удаляют рассол ступенчато, порциями промывной литийсодержащей жидкости, состоящей из макрокомпонентов рассола и лития, содержание которых в промывных порциях изменяется ступенчато. При этом содержание макрокомпонентов от промывки к промывке существенно уменьшается, содержание лития изменяется незначительно и находится на уровне его содержания в продуктивном литиеносном рассоле. Количество ступеней определяют, исходя из заданной глубины удаления макрокомпонентов рассола и допустимой степени потерь хлорида лития из сорбента на стадии удаления рассола. Вытесненный из колонны первой порцией промывной жидкости литиеносный рассол перед смешиванием с продуктивным рассолом фильтруют, удаляя мелкие частицы сорбента. Первую порцию промывной жидкости, наиболее близкую по составу к продуктивному рассолу вытесняют второй порцией вытесняющей жидкости и также направляют после фильтрации на смешение с продуктивным рассолом. Вторую порцию промывной жидкости вытесняют третьей и оставляют в обороте на следующий цикл. Все последующие порции промывной жидкости также оборотные. Последняя порция вытесняющей жидкости - пресная вода. Ее вытесняют из колонны на стадии десорбции, и она становится оборотной предпоследней порцией промывной жидкости. Предложенная система удаления рассола из колонн с сорбентом позволяет снизить уровень содержания примесей в первичном литиевом концентрате на 8-12% в сравнении с прототипом.
После завершения стадии удаления рассола колонны переходят в стадию десорбции LiCl из сорбента с получением полупродукта - первичного литиевого концентрата в виде водного раствора, содержащего 4-6 кг/м3 хлорида лития и остаточные макрокомпоненты продуктивного литиеносного рассола в количествах, зависящих от глубины удаления рассола на предыдущей стадии. Десорбцию ведут также порционно пресной водой. Объем пресной воды определяют заданной степенью десорбции лития при заданном среднем содержании LiCl в первичном литиевом концентрате.
Полученный первичный литиевый концентрат смешивают с отработанным кислым сульфатсодержащим анолитом выводимым из процесса на операции мембранного электролиза, отработанным кислым регенератом, образующимся на операции ионообменной очистки электродиализного литиевого концентрата. В результате подкисления первичного литиевого концентрата происходит разрушение карбонатов и бикарбонатов, вносимых пресной водой при производстве первичного литиевого концентрата. Процесс декарбонизации описывается следующими химическими реакциями


Далее смешенный декарбонизированный и подкисленный поток первичного литиевого концентрата, содержащего магний, кальция и сульфат-ионы в качестве примесей подают на узел нанофильтрации пропуская его через фильтрующие элементы под давлением более 50 ат. В результате нанофильтрации образуется два потока. Отработанный малый литийсодержащий поток, обогащенный магнием, кальцием и сульфат-ионами направляют на смешение с продуктивным литиеносным рассолом.
Нанофильтрационная очистка первичного литиевого концентрата позволяет удалить основное количество примесей без затрат на реагенты. Как правило степень удаления магния составляет 90-93%, кальция - 63-65%, сульфат-ионов - более 90%. Основной литийсодержащий поток, обогащенный хлоридом лития поступает на установку обратноосмотического концентрирования - опреснения, где разделяется на основной по объему жидкой фазы поток - пермиат, представляющий собой деминерализованную воду с остаточным солесодержанием менее 50 г/м3, который направляют на операцию десорбции LiCl из сорбента пресной водой и меньший по объему, но концентрированный по LiCl поток - обратноосмотический литиевый концентрат с общим солесодержанием 50-60 кг/м3 направляют на электродиализное концентрирование, в результате которого также образуется два потока. Больший из них по объему поток - диализат с остаточным солесодержанием 8-12 кг/м3 направляют на смешение с продуктивным нанофильтратом декарбонизированного первичного литиевого концентрата, поступающего на обратноосмотическое концентрирование - опреснение, меньший по объему, но концентрированный по LiCl поток - электродиализный литиевый концентрат подвергают реагентной очистке от кальция, магния и сульфат-ионов. В качестве реагентов используют отработанный упаренный католит, раствор бикарбоната лития заданной концентрации, отработанные щелочно-карбонатные промывные растворы. В результате смешивания происходит нейтрализация кислоты и создание щелочной среды рН=10,5-11,0, образование карбонат-ионов из бикарбонат ионов и осаждение кальция и магния в виде нерастворимых соединений. Процесс реагентной очистки описывается следующими уравнениями химических реакций:



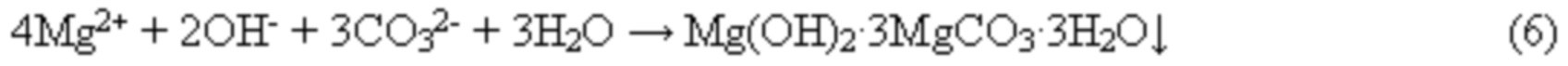
Остаточный сульфат (в случае необходимости) удаляют переводом в осадок путем использования в качестве реагента хлорида бария по реакции:

Раствор LiHCO3 используют для быстрого создания в реакционной среде требуемого уровня концентрации карбонат-ионов чего невозможно достичь вводом плохо растворимого карбоната лития.
Раствор бикарбоната лития производят обработкой заданного объема, отработанного упаренного католита, содержащего в виде примесей NaOH и KOH, выводимого из католитного (щелочного) контура операции мембранного электролиза по реакции:




Образующиеся осадки примесей удаляют из потока реагентного очищенного электродиализного хлоридного литиевого концентрата фильтрацией, промывают деминерализованной водой, отработанный промывной раствор смешивают с продуктивным нанофильтратом перед его обратноосмотическим концентрированием. Раствор реагентно очищенного электродиализного литиевого концентрата далее направляют на глубокую ионообменную очистку от остатка катионов Ca2+ и Mg2+ на ионите Lewatit-208-TP в литий форме. Процесс ионообменной очистки описывается следующими уравнениями:


Отработанный ионит регенерируют раствором HCl по реакции:
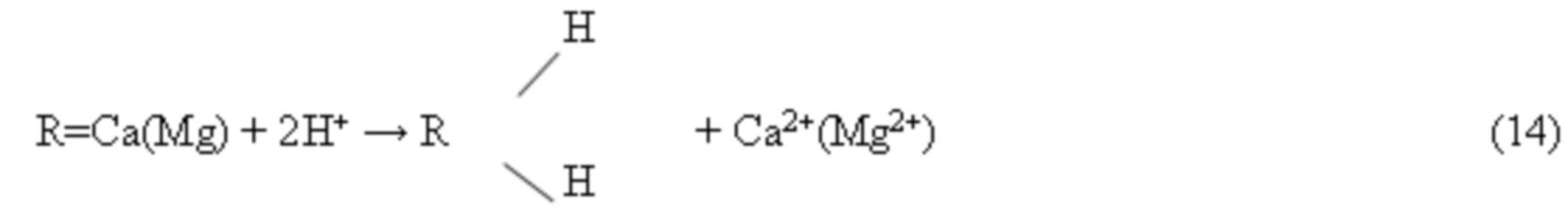
Отработанный кислый регенерат направляют на декарбонизацию первичного литиевого концентрата. Далее ионит из Н-формы переводят в Li-форму обработкой щелочным раствором LiOH, в качестве которого используют заданный объем отработанного упаренного католита по реакции:

Отработанный щелочной регенерат используют на операции реагентной очистки электродиализного хлоридного литиевого концентрата.
Использование упаренного отработанного католита на вышеописанных операциях позволяет сократить потребление LiOH⋅H2O на собственные нужды на 7-10% в сравнении с прототипом.
Далее прошедший глубокую ионообменную очистку электродиализный хлоридный литиевый концентрат упаривают, повышая уровень концентрации LiCl до 450-480 кг/м3 и глубоко высаливая при этом кристаллы NaCl, KCl и Na2B4O7⋅10H2O ввиду их более низкой растворимости. Упаренный хлоридный литиевый концентрат разбавляют деминерализованной водой до получения продуктивного раствора хлорида лития концентрацией 350-380 кг/м3, используемого для подпитки анолита на операции получения раствора LiOH мембранным электролизом продуктивного раствора хлорида лития (при плотности тока 1-4кА/м2), которая описывается суммарным уравнением химических реакций:

В качестве мембран используют мембраны марок CTIEM-3, NAFION-424 или их аналоги.
При этом LiOH образуется в катодном контуре мембранного электролизера в результате протекания следующих химических реакций:



В анодном контуре мембранного электролизера образуется элементарный хлор по реакции:

После очистки от капель и тумана электролитов поток анодного водорода сжигают в потоке анодного хлора при температуре 1000-1100°С получая хлористый водород по реакции:
t

Хлористый водород при охлаждении абсорбируют ступенчато противоточным потоком деминерализованной воды, с выводом с первой ступени абсорбции товарную соляную кислоту концентрацией 33-36% мас.
Процесс электромембранной конверсии LiCl в LiOH проводят в режиме непрерывной циркуляции анолита (раствор LiCl 150-170 кг/м3) с постоянным отбором заданного объема католита и постоянной подпиткой заданного объема анолита продуктивным раствором LiCl, обеспечивающей баланс материальных потоков на операции мембранного электролиза. По мере накопления в циркулирующем анолите примесей в виде сульфат-ионов и бора до критических концентраций объемный поток анолита, обеспечивающий прекращение дальнейшего роста концентрации этих примесей в циркулирующем анолите, выводят из процесса электролиза и направляют на операцию декарбонизации первичного литиевого концентрата. Включение в технологический процесс получения LiOH⋅H2O из литиеносных рассолов операции нанофильтрации, на которой из первичного литиевого концентрата выводят более 90% сульфат-ионов позволяет сократить поток отработанного анолита в сравнении с прототипом на 90%.
Поток поступающего с операции электролиза католита упаривают в режиме циркуляции, поддерживая концентрацию LiOH в упариваемом растворе на уровне 125-130 кг/м3 при температуре кипения. Стабильный режим упаривания обеспечивают постоянным выводом заданного объема упаренного раствора LiOH и постоянной подпиткой католита. Выводимый упаренный раствор LiOH охлаждают в кристаллизаторе до температуры 60-65°С, образующуюся пульпу центрифугируют, отделяя кристаллы LiOH⋅H2O от раствора. Фугат упаренного католита возвращают на упаривание, кристаллы LiOH⋅H2O промывают деминерализованной водой и сушат под разрежением при температуре 60-70°С, получая товарный продукт LiOH⋅H2O высокой степени чистоты. Образующийся отработанный промывной раствор также возвращают на операцию упаривания, смешивая с исходным католитом. По мере накапливания в циркулирующем потоке упариваемого католита примесей в виде натрия и калия до критических значений, часть католита постоянно выводят из процесса объемным потоком, обеспечивающим прекращение дальнейшего роста примесей в католите. Поток отработанного упаренного католита, содержащего не более 5-10 кг/м3 NaOH используют в качестве реагента для получения раствора LiHCO3, переводя иониты в Li-форму и реагентной очистки от примесей электродиализного литиевого концентрата. Содержащиеся в отработанном упаренном католите примеси в виде NaOH и KOH выводятся из процесса на операции упаривания, глубоко очищенного хлоридного литиевого концентрата перед его подачей на разбавление и электролиз. В качестве деминерализованной воды в технологическом процессе используют конденсат сокового пара операций упаривания.
Предложенная технология предусматривает в случае необходимости производство наряду с LiOH⋅H2O батарейного качества карбоната лития батарейного качества. В этом случае отработанный упаренный католит используют только для перевода ионита в Li-форму и обеспечения требуемого значения показателя рН на операции реагентной очистки электродиализного литиевого концентрата. Основной поток отработанного упаренного католита смешивают с оборотным, содержащим NaHCO3, KHCO3 и LiHCO3 бикарбонатным раствором, образуя смешанный карбонатный раствор по реакции:

Хорошо растворимые карбонаты натрия и калия при этом остаются в растворе, а плохо растворимый карбонат лития переходит в осадок по реакции:

Для повышения выхода Li2CO3 и исключения разбавления оборотного бикарбонатного раствора, осаждение карбоната лития ведут в сочетании с удалением из реакционной смеси воды в виде водяных паров в процессе контакта, нагретого до температуры выше 100°С атмосферного воздуха с реакционной смесью. Объемный расход нагретого воздуха задают, исходя из требуемого количества удаляемой воды. Образующуюся пульпу Li2CO3 в карбонатном растворе центрифугируют, отделяя карбонат лития от раствора. Карбонат лития промывают деминерализованной водой, образующийся литийсодержащий карбонатный раствор направляют на реагентную очистку электродиализного литиевого концентрата напрямую либо через операцию получения раствора бикарбоната лития, используемого при реагентной очистке. Полученный влажный продукт сушат, получая товарный карбонат лития батарейного качества чистотой не ниже 99,9%. Маточный карбонатный раствор, образовавшийся на операции осаждения Li2CO3 и упаривания карбонатной пульпы, переводят в смешанный бикарбонатный раствор обработкой углекислым газом по реакциям:



Ввиду значительно более низкой растворимости NaHCO3 и KHCO3 в сравнении с растворимостью Na2CO3 и K2CO3 (более 300 кг/м3), в установившемся режиме протекания операции получения Li2CO3 из отработанного упаренного католита, содержание NaHCO3 и KHCO3 в бикарбонатном растворе, образующемся после карбонизации карбонатного раствора превысит пределы растворимости этих солей и часть образующихся бикарбонатов NaHCO3 и KHCO3 переходит в твердую фазу. При этом содержание LiHCO3 в бикарбонатном растворе никогда не превысит предел растворимости данного соединения (63 кг/м3), так как концентрация Li2CO3 в бикарбонатном растворе, поступающем на обработку углекислым газом не превышает 10 кг/м3. Осадок, состоящий из кристаллов NaHCO3 и KHCO3 отделяют от смешанного оборотного бикарбонатного раствора, оборотный бикарбонатный раствор направляют на смешение с отработанным упаренным католитом, а кристаллы NaHCO3 и KHCO3 промывают деминерализованной водой, образующийся отработанный промывной раствор направляют на операцию осаждения Li2CO3 и упаривания образующейся пульпы. Полученные кристаллы NaHCO3 и KHCO3 используют на производстве в качестве моющих реагентов, реагентов для умягчения воды. В случае отсутствия необходимости их использования на производстве они могут быть переведены раствором соляной кислоты в хлоридный раствор, который смешивают с отработанным по литию маточным раствором.
Предлагаемое изобретение в варианте получения наряду с LiOH⋅H2O товарного продукта в виде Li2CO3 батарейного качества позволяет более чем на 10% сократить расход соляной кислоты на собственные нужды, и на 60-90% сократить расход реагентов на очистку растворов и на 2-3% снизить расход электроэнергии за счет сокращения литийсодержащих оборотных потоков, поступающих на операцию мембранного электролиза в виде добавок в католит и анолит.
В случае возникновения отсутствия в потребности производства Li2CO3 как товарного продукта, очищенный от примесей карбонат лития может быть переведен в состав анолита соляной кислотой по реакции:
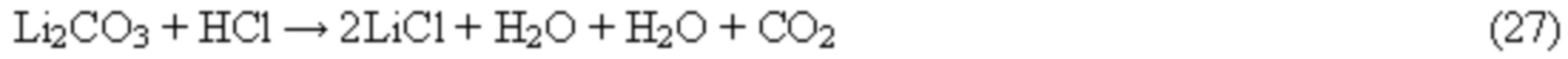
В дальнейшем предлагаемое изобретение поясняется конкретными примерами.
Пример 1. На опытно-промышленной установке сорбционного выделения из природного литиеносного поликомпонентного рассола общей минерализацией 486 кг/м3 и содержанием LiCl 1,18 кг/м3 первичного литиевого концентрата, используемого далее для производства моногидрата лития гидроксида, проводили сравнительные испытания сорбционно-десорбционных модулей (СДМ) состоящих из двух заполненных гранулированным сорбентом ДГАЛ-Cl колонн на каждый модуль, при массовом содержании сорбента 8,15 тонн в каждой колонне. В процессе испытаний СДМ № 1 (прототип) работал на исходном нефильтрованном озерном рассоле. СДК № 2 работал на аналогичном озерном рассоле, предварительно прошедшем стадию фильтрации по предлагаемому способу. В процессе испытаний контролировали гидравлическое сопротивление колонн модулей и удельную производительность 1 тонны загруженного сорбента в пересчете на получаемый продукт LiOH⋅H2O. В процессе испытаний гидравлическое сопротивление колонн СДК № 1 возросло с исходного, равного 0,6 ат, до критического 2,8 ат за 97 суток непрерывной работы. Работу останавливали, сорбент выгружали, промывали сорбент и дренажные системы, сорбент вновь загружали, продолжая испытания. Следующее повышение гидравлического сопротивления колонн СДК №и 1 до критического уровня наступило через 79 суток непрерывной работы. За весь период испытаний сопротивление колонн СДМ № 2 возросло на 5-7% в течение первых пяти суток испытаний и далее оставалось стабильным до окончания испытаний. При этом удельная годовая производительность 1 тонны сорбента в пересчете на LiOH⋅H2O в составе СДМ № 2 составила 3018 кг, а в 1 тонне сорбента в составе СДМ № 1 3562 кг. Таким образом удаление твердой фазы примесей из литиеносного природного рассола позволяет повысить удельную годовую производительность каждой тонны загрузки сорбента на 18%.
Пример 2. На пилотной установке проводили сравнительные испытания получения моногидрата лития гидроксида из продуктивного (фильтрованного) литиеносного рассола хлоридного магниевого типа с содержанием хлорида лития 1,24 кг/м3 способом прототипа и предлагаемым способом. В составе пилотной установки два сорбционно-десорбционных модуля (СДМ) с общей загрузкой гранулированного селективного сорбента ДГАЛ-Cl по 66,2 кг каждый. Операция получения первичного литиевого концентрата из рассола на одном из модулей была организована по прототипу, на другом модуле по предлагаемому способу. Общая продолжительность сравнительных испытаний составила 1440 часов. В процессе испытаний контролировали содержание алюминия в потоках маточного рассола. При этом на каждом из модулей за этот период времени было переработано по 436111,6 дм3 продуктивного (очищенного от взвешенных частиц) природного рассола. Получаемый по предлагаемому способу первичный литиевый концентрат подвергали нанофильтрации. Полученные результаты представлены в таблице 1.
Из полученных результатов однозначно следует, что при одном и том же потоке перерабатываемого литиеносного рассола выход LiCl в первичный литиевый концентрат по прототипу составляет 44,31 кг, а по предлагаемому способу 48,62 кг, то есть удельный объемный расход литиеносного продуктивного рассола на 1 кг выделенного из рассола LiCl по прототипу (984,24 дм3/кг) на 9,7% выше, чем по предлагаемому способу (896,98 дм3/кг). При этом уровень содержания примесей макрокомпонентов рассола по предлагаемому способу на 10% и более ниже, чем в аналогичном полупродукте, произведенному по способу прототипа.
Таблица 1
Результаты предварительных испытаний операции получения первичного литиевого концентрата
|
Полученные результаты также подтверждают факт очистки нанофильтрацией первичного литиевого концентрата от магния на 90,8%, от кальция на 56,4%, от сульфат-ионов на 91,6% в соответствии с предлагаемым способом.
Потери лития в отработанный раствор нанофильтрации составляют не более 5%, сокращая выход LiCl с 48,62 кг в первичный литиевый концентрат до 46,21 кг, который все равно остается на 4,3% выше, чем аналогичный показатель по способу прототипу. Учитывая существенное снижение расхода реагентов на очистку от магния, кальция и сульфат ионов, получение первичного литиевого концентрата по предлагаемому способу имеет существенное преимущество. Периодический контроль содержания алюминия в потоках маточного рассола на выходе из СДМ показал отсутствие содержания алюминия в потоке маточного раствора СДМ, работающего по предлагаемому способу и содержание алюминия на уровне 0,6-0,8 мг/дм3 в потоке маточного рассола СДМ работающего по прототипу.
Пример 3. На пилотной установке, включающей электролизный агрегат на основе биполярного мембранного электролизера с мембранами CTIEM-3, анодами из титана с окисло-рутеневым покрытием и катодами из нержавеющей стали, из потока первичного литиевого концентрата, прошедшего нанофильтрационную очистку (пример 2) в соответствии с предлагаемым способом производили моногидрат лития гидроксида. При этом на операции мембранного электролиза проводимом при плотности тока 3,9 А/дм2 было получено 432,38 дм3 католита, содержащего 60,34 г/дм3 LiOH. После упаривания, кристаллизации LiOH⋅H2O, промывки кристаллов и сушки выход товарного продукта в виде LiOH⋅H2O составил 39,158 г. На собственные нужды (реагентная очистка от примесей, регенерация ионита) было использовано 3,714 кг LiOH в виде упаренного раствора концентрацией LiOH 120 г/дм3. Таким образом на собственные нужды расходуется 14,2% от производимого количества литиевой щелочи.
В сравнении с предлагаемым способом при получении высокочистого LiOH⋅H2O по способу прототипу на собственные нужды требуется в 14 раз больше литиевой щелочи на собственные нужды. В связи с этим удельный расход электроэнергии на 1 кг производимого продукта по способу прототипу в 2,2 раза выше чем по предлагаемому способу.
Расход хлорида бария на реагентную очистку литиевого концентрата от сульфат-ионов по предлагаемому способу составил 0,751 кг (19,2 г на 1 кг товарного LiOH⋅H2O), что в 13,5 раз меньше, чем аналогичный показатель у способа прототипа. Снижение расхода реагентов обеспечивает пропорциональное снижение массового количества твердых отходов.
Химический состав полученного из природного литиеносного рассола (по предлагаемому способу) LiOH⋅H2O представлен в таблице 2.
Таблица 2
Состав LiOH⋅H2O полученного из природного литиеносного рассола по предлагаемому способу
|
Как следует из содержимого таблицы 2 получаемый по предлагаемому способу продукт - моногидрат лития гидроксида (LiOH⋅H2O) соответствует марке ЛГО-1 ГОСТ 8595-83.
Пример 4. На пилотной установке, описанной в примерах 2 и 3 из 33586,4 дм3 природного рассола хлоридно-магниевого типа произвели по предлагаемому способу 24,498 кг LiOH в виде раствора объемом 401,34 дм3 содержанием LiOH 61,04 г/дм3. При этом 52,239 дм3 было затрачено на собственные нужды. Остальной объем направлен на получение моногидрата лития гидроксида. В процессе упаривания, кристаллизации было получено 31,202 кг товарного LiOH⋅H2O и 28,967 дм3 упаренного отработанного (загрязненного K и Na) католита состава, г/дм3: LiOH - 120,1; KOH - 5,4; NaOH - 3,9. Упаренный отработанный католит использовали для получения карбоната лития батарейного качества по предлагаемому способу (п. 2 формулы изобретения). В результате переработки упаренного отработанного католита было получено 5,363 кг Li2CO3, 0,278 кг KHCO3 и 0,237 кг NaHCO3. Химический состав полученного карбоната лития представлен в таблице 3.
Таблица 3
Химический состав карбоната лития, полученного из упаренного отработанного католита операции упаривания католита и кристаллизации LiOH⋅H2O
|
Из содержимого таблицы 3 однозначно следует, что по остаточному содержанию примесей полученный карбонат лития соответствует квалификации 99,99%.
В полученных побочных продуктах в виде смеси бикарбонатов калия и натрия присутствует в виде примеси литий, содержание которого менее 0,0004% мас.
Пример 5. На пилотной установке (примеры 2,3) в процессе получения LiOH⋅H2O из литиеносного природного рассола по предлагаемому способу потоки катодного водорода (0,755 г/ч) и анодного хлора (26,81 г/ч), образующиеся в качестве побочных продуктов на операции мембранного электролиза сжигали в специальной углеграфитовой печи (температура 1100°С), получая поток газообразного хлористого водорода. Поток хлористого водорода форсировано охлаждали до точки росы (78°С) путем прямого контакта с концентрированным раствором HCl. Охлажденный поток хлористого водорода проходил трехступенчатую противоточную абсорбцию деминерализованной водой. Вывод товарной соляной кислоты осуществляли с первой ступени, подпитку абсорбента деминерализованной водой осуществляли на третьей (санитарной) ступени абсорбции. Производительность установки по соляной кислоте концентрацией 35,7% составила 77,1 кг/ч.
Источники информации
1. Патент ФРГ №2700748, 08.09.77.
2. Патент RU №2470861, 09.04.2009. Опубл. 27.05.12. Бюл. №15.
3. Патент RU №2516538, 17.02.2012. Опубл. 20.05.14. Бюл. №14.
4. Патент RU №2455063, 13.10.2010. Опубл. 10.07.12. Бюл. №19.
5. Патент RU №2193008, 25.03.1998. Опубл. 20.11.02. Бюл. №32.
6. Патент RU №2656452, 04.02.2016. Опубл. 05.06.18. Бюл. №16.