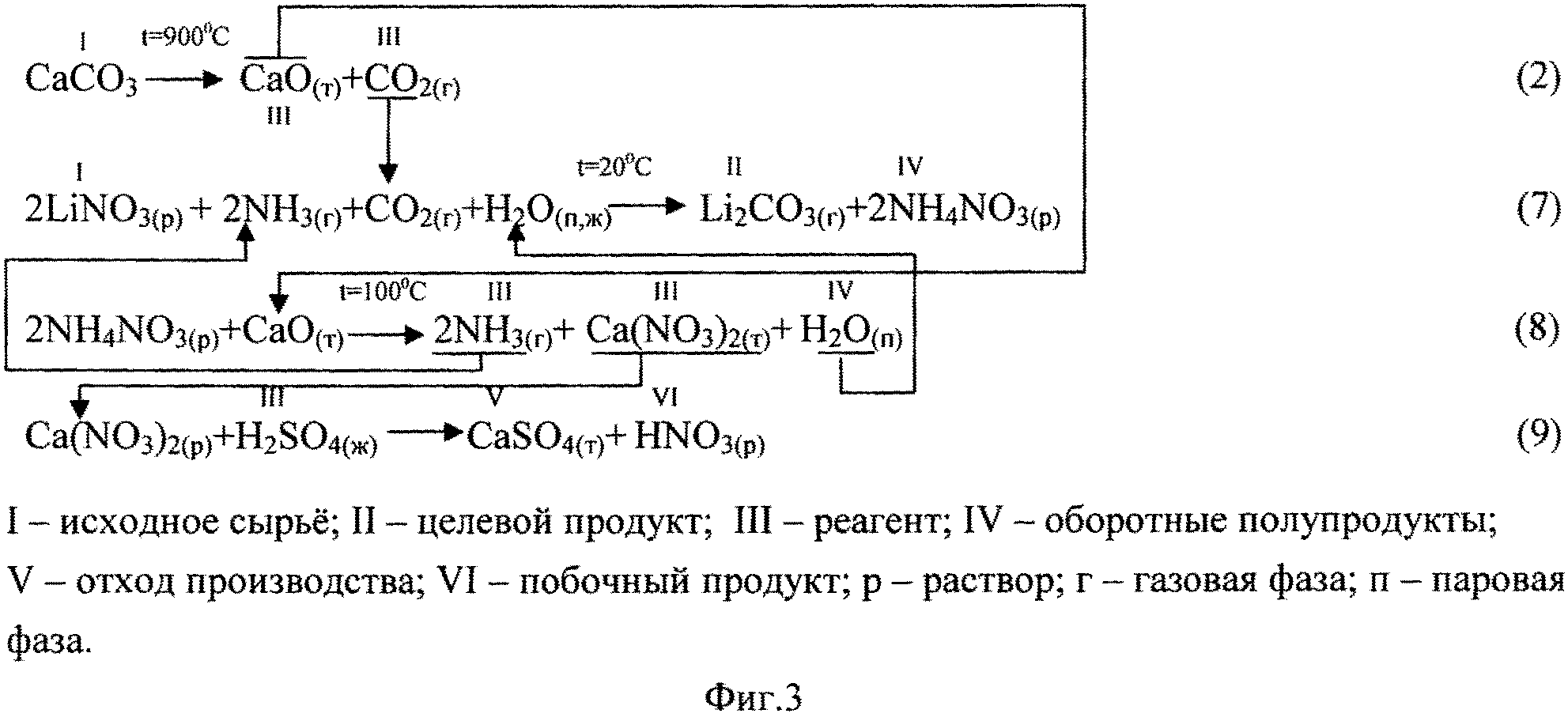Результат интеллектуальной деятельности: КАЛЬЦИНАТНЫЙ СПОСОБ ПОЛУЧЕНИЯ КАРБОНАТА ЛИТИЯ ИЗ ЛИТИЕНОСНОГО СЫРЬЯ
Вид РИД
Изобретение
Изобретение относится к химической технологии получения неорганических веществ и может быть использовано в производстве литиевых соединений из различных литиеносных сырьевых источников.
Известен способ осаждения карбоната лития из продуктивных сернокислых литийсодержащих растворов, образующихся при вскрытии литиеносного рудного сырья серной кислотой (Pat. CN №1059702) [1]. Для осаждения используют карбонат аммония, который получают путем термической диссоциации бикарбоната аммония в процессе нагрева его водного раствора или путем взаимодействия раствора бикарбоната аммония с аммиачной водой. Степень осаждения карбоната лития по данному способу составляет 80%. Недостатками способа являются: а) необходимость стадии перевода бикарбоната аммония в карбонат аммония, на которой происходят неизбежные потери бикарбоната аммония, вследствие чего расход NH4HCO3 возрастает на 30-40% от стехиометрического количества, требуемого для осаждения Li2CO3; б) использование аммиачной воды, относящейся к разряду ядовитых веществ.
Известен способ получения карбоната лития из литийсодержащего рассола хлоридного натриевого типа, согласно которому карбонат лития осаждают раствором соды (Pat. US №5219550) [2], как это принято в мировой практике производства карбоната лития из гидроминерального сырья по галургической технологии. Для этого рассол концентрируют до содержания лития 4.0-6.5% мас., одновременно высаливая NaCl, KCl, KCl·MgCl2·6H2O, MgCl2·6H2O, полученный литиевый концентрат подвергают очистке от примесей бора, магния и щелочноземельных металлов, используя известные химические методы, и затем в очищенный подогретый концентрированный раствор LiCl (продуктивный раствор LiCl) вводят насыщенный раствор Na2CO3 при повышенной температуре (около 90°C). Недостатком способа является использование раствора соды, который в результате взаимодействия с хлоридом лития конвертируется в раствор хлорида натрия, на удаление которого из осажденного целевого продукта требуется большой расход воды, сопровождаемый потерями лития, связанные с растворимостью карбоната лития в промывной воде на уровне 10 г/л.
Полученный продукт, тем не менее, всегда содержит остаточное количество натрия и вследствие этого качество выпускаемого продукта ограничивается сортом технический. Еще одним недостатком этого способа является необходимость для минимизации потерь лития с маточным раствором осаждения нагревать продуктивный литийсодержащий раствор и раствор соды до 90°C.
Известен способ получения карбоната лития высокой степени чистоты из литиеносных хлоридных растворов (Pat. RU №2283283) [3], включающий получение хлоридного литиевого концентрата, очистку его от основного количества примесей кальция, магния, сульфат-ионов; реагентное осаждение карбоната лития из очищенного хлоридного литиевого концентрата (продуктивного раствора LiCl) пульпой бикарбоната аммония при 20-40°C; промывку карбоната лития, отделение осадка от остаточных примесей маточного раствора и его сушку. Маточный раствор после операции осаждения Li2CO3 упаривают, выделяя NH4Cl для реализации в качестве побочного товарного продукта. Способ позволяет получить карбонат лития высокого качества, практически не содержащий натрия. Содержание хлорида аммония в получаемом карбонате лития сводится к минимуму путем его прокаливания при температуре выше 200°C, сопровождающееся термическим разложением хлорида аммония до летучих ингредиентов NH3 и HCl по реакции:

Этот способ является наиболее близким к предлагаемому решению и выбран авторами в качестве прототипа. Основным недостатком указанного способа является использование в качестве расходуемого реагента-осадителя относительно дорогостоящего бикарбоната аммония. Согласно отчету по маркетинговым исследованиям организации "MOST marketing" за 2010 г. затраты на реагент-осадитель в структуре себестоимости производства карбоната лития из литиевого концентрата составляют не менее 33%.
Отличительным признаком заявляемого способа получения карбоната лития является использование в качестве исходного реагента-осадителя карбоната лития в процессе его получения из хорошо растворимых солей лития или их продуктивных растворов более дешевого и доступного природного карбоната кальция в виде известняка (доломитизированного известняка) вместо традиционно применяемых осадителей в виде солей Na2CO3, (NH4)2CO3 и NH4HCO3.
Сущность изобретения
Технический результат достигается тем, что осаждение карбоната лития из очищенного продуктивного литийсодержащего хлоридного, или сульфатного, или нитратного, или смешанного хлоридно-сульфатного раствора ведут путем его обработки газовой смесью аммиака и углекислого газа, взятых в соотношении 2:1, при охлаждении в ступенчато-противоточном режиме контакта жидкой и газовой фаз.
Технический результат достигается тем, что получение углекислого газа и извести осуществляют путем термического разложения известняка (доломатизированного известняка).
Технический результат достигается тем, что из маточного раствора операции осаждения Li2CO3 высаливают аммонийную соль хлорида или нитрата аммония введением в маточный раствор хлорида или нитрата лития в виде безводной соли или в виде водного насыщенного раствора LiCl или LiNO3; выделенные кристаллы аммонийной соли NH4Cl или NH4NO3 отделяют от маточного раствора, промывают водой, из промытых кристаллов готовят насыщенный раствор хлорида или нитрата аммония, полученные растворы подогревают в рекуператоре тепла и подвергают кальцинации для воспроизводства аммиака путем контакта с негашеной известью.
Технический результат достигается тем, что горячий маточный раствор операции кальцинации (CaCl2 или Ca(NO3)2) аэрируют воздухом, удаляя остаточный аммиак; далее аммиак из воздушного потока абсорбируют разбавленным и подкисленным раствором операции высаливания аммонийной соли (абсорбентом); очищенный от аммиака воздух возвращают на аэрацию раствора после операции кальцинации, поглотивший аммиак абсорбент, представляющий собой продуктивный литийсодержащий раствор, направляют на операцию осаждения Li2CO3; очищенный от аммиака воздух возвращают на аэрацию маточных растворов после кальцинации.
Технический результат достигается тем, что промывной раствор, образовавшийся в результате промывки выделенных кристаллов аммонийной соли, смешивают с маточным раствором операции осаждения Li2CO3 перед операцией высаливания аммонийной соли, а промывной раствор, образующийся в результате промывки осажденных кристаллов
Li2CO3, используют для разбавления маточного раствора (раствор LiCl или LiNO3 с остаточным содержанием NH4Cl или NH4NO3) операции высаливания аммонийной соли.
Технический результат достигается тем, что маточный раствор хлорида кальция, образовавшийся при кальцинации раствора хлорида аммония, используют сначала для подогрева NH4Cl в рекуператоре тепла, затем используют в качестве твердого отхода для получения противогололедного материала.
Технический результат достигается тем, что маточный раствор операции осаждения карбоната лития, содержащий (NH4)2SO4 и Li2SO4, нагревают и подают на кальцинацию, образовавшийся осадок CaSO4 отделяют, а маточный раствор, содержащий Li2SO4, LiOH, NH4OH, смешивают с промывными водами осадков Li2CO3, CaSO4 и после очистки в него добавляют сульфат лития или его насыщенный раствор для получения продуктивного сульфатного раствора.
Технический результат достигается тем, что при кальцинации продуктивного литийсодержащего смешанного хлорид-сульфатного раствора часть раствора хлорида кальция, после воздушной отгонки аммиака, используют для десульфатизации исходной смешанной хлоридно-сульфатной литиевой соли или исходного смешанного хлоридно-сульфатного литийсодержащего раствора.
Технический результат также достигается тем, что при кальцинации литийсодержащего нитратного раствора и воздушной отгонки аммиака раствор нитрата кальция используют для получения раствора азотной кислоты путем его обработки серной кислотой и отделения образующегося осадка CaSO4.
Предлагаемый кальцинатный способ получения карбоната лития позволяет снизить себестоимость производимого продукта на 15-20% за счет замены традиционных дорогостоящих реагентов соды или углеаммонийных солей на более дешевый реагент - природный известняк. При этом возможно использование доломитизированного известняка, содержащего, наряду с СаСО3, примеси MgCO3, SiO2 и Fe2CO3, которые не влияют на качество получаемого карбоната лития, т.к. в процессе кальцинации аммонийных растворов оксиды магния, железа и кремния (MgO, Fe2O3 и SiO2) остаются в фазе осадка CaSO4. Сведения, подтверждающие возможность реализации кальцинатного способа получения карбоната лития из литиеносных сырьевых источников, представлены на фигурах 1-6 и примерах.
Перечень чертежей и таблиц
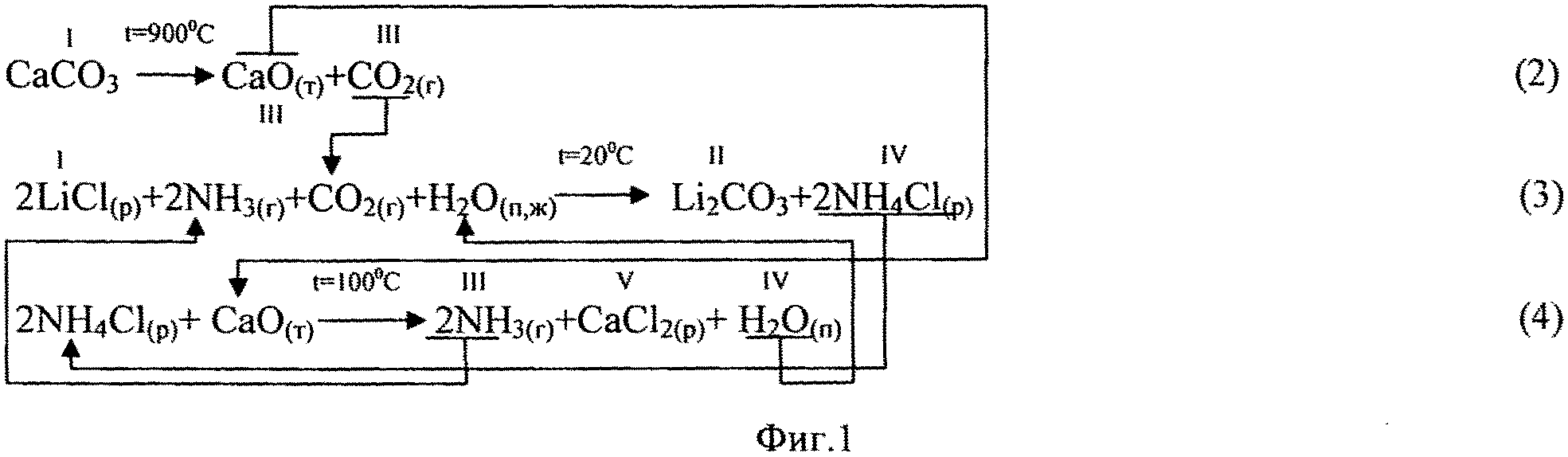
Фиг. 1. Химическая схема процесса получения Li2CO3 кальцинатным способом из хлорида лития.
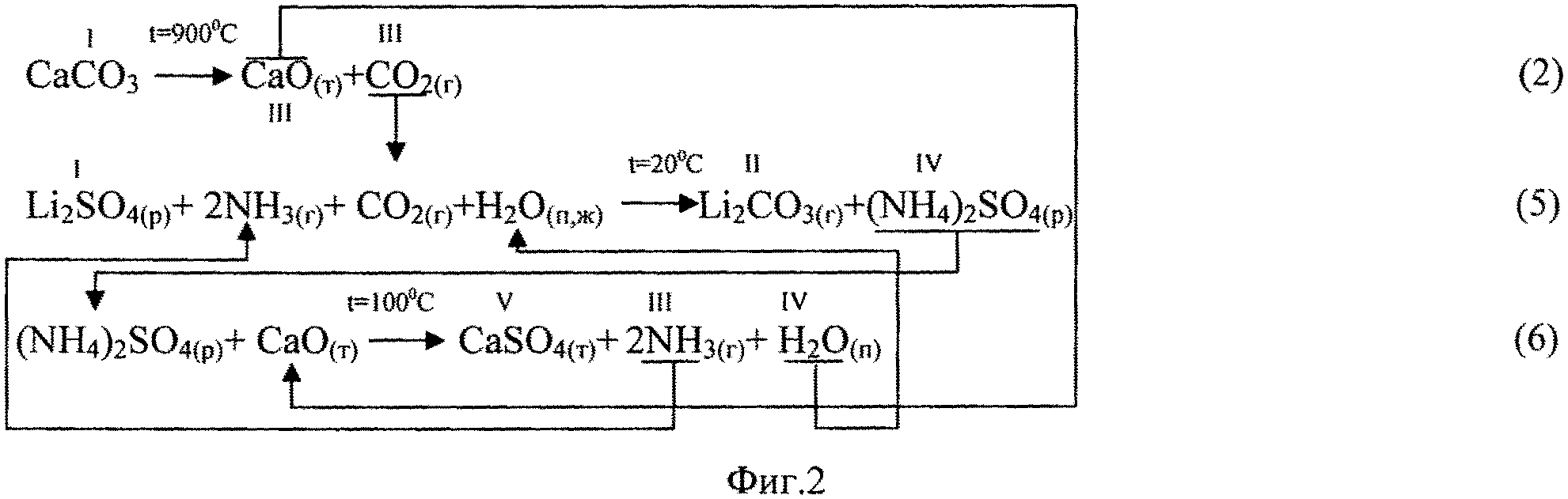
Фиг.2. Химическая схема процесса получения Li2CO3 кальцинатным способом из сульфата лития.
Фиг.3. Химическая схема процесса получения Li2CO3 кальцинатным способом из нитрата лития.
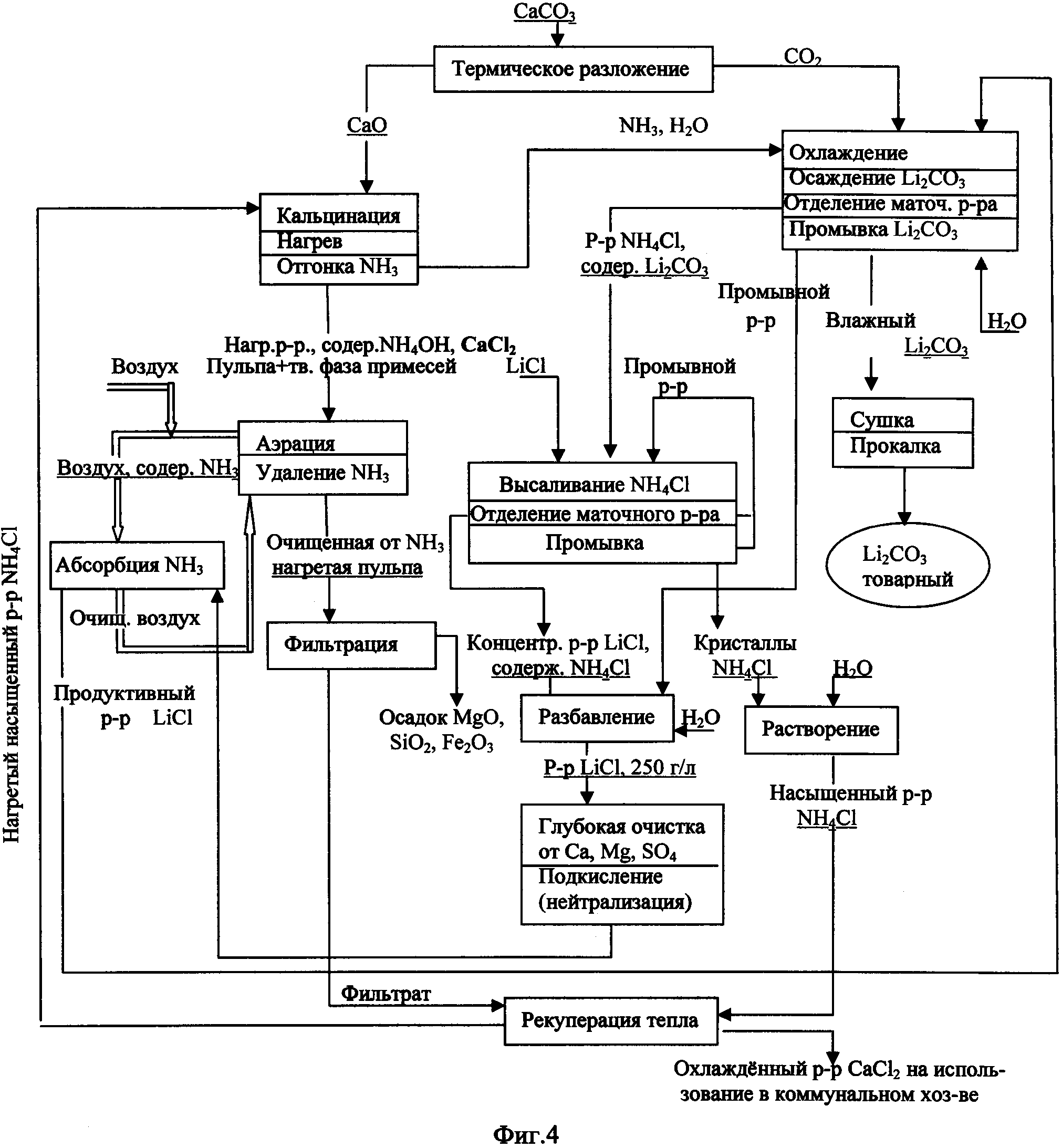
Фиг.4. Технологическая схема производства Li2CO3 кальцинатным способом из хлорида лития.
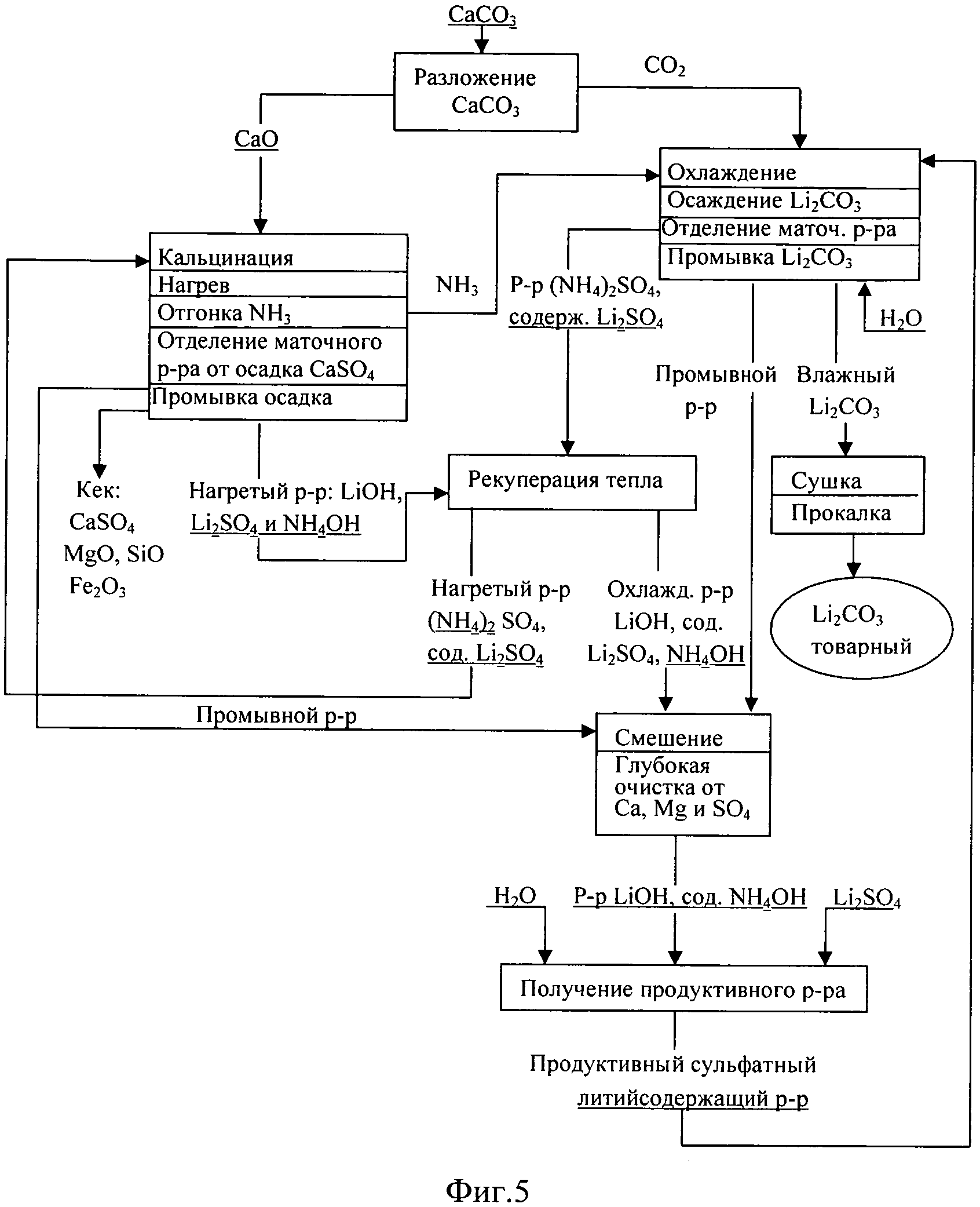
Фиг.5. Технологическая схема производства Li2CO3 кальцинатным способом из сульфата лития.
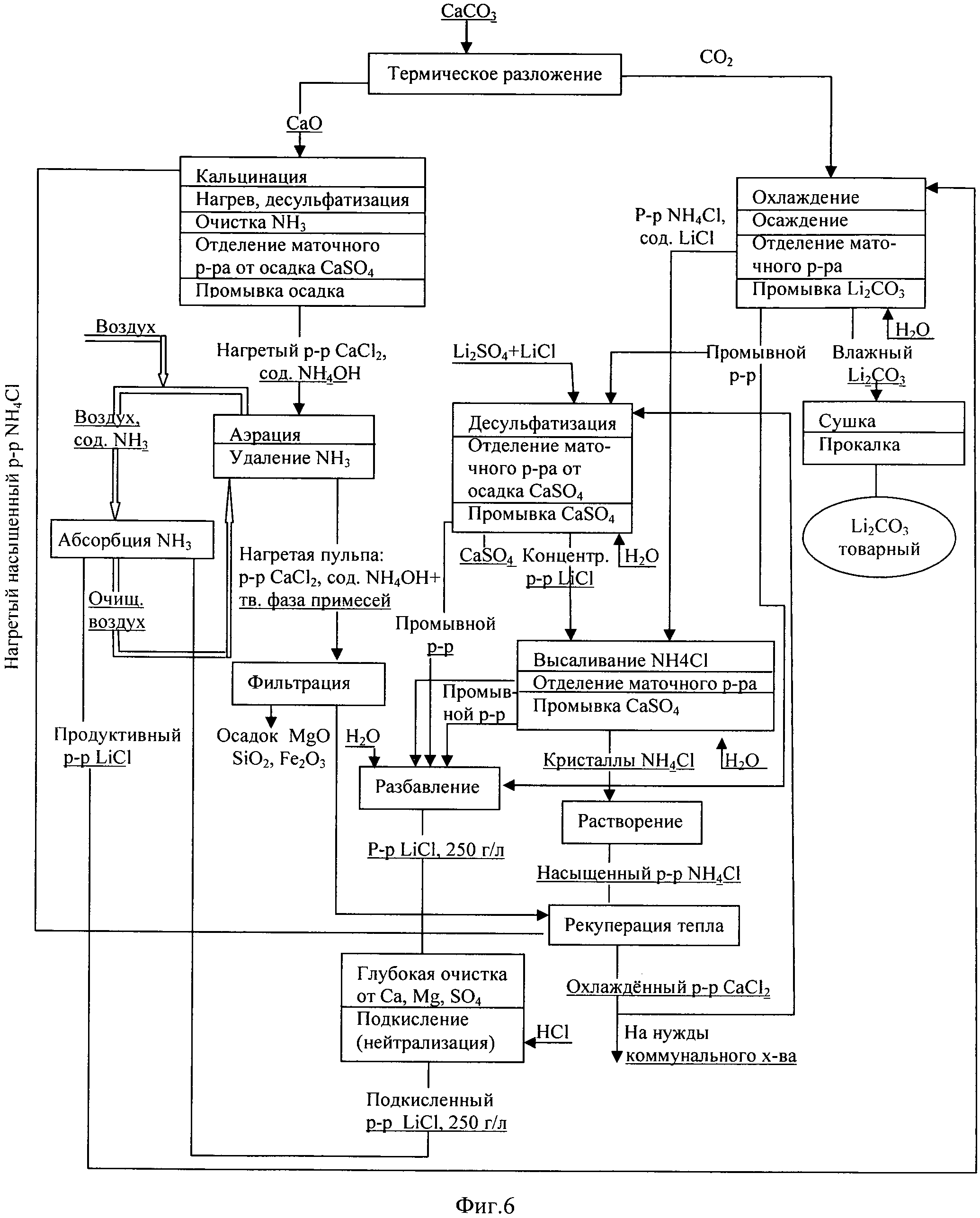
Фиг.6. Технологическая схема производства Li2CO3 кальцинатным способом из смеси хлорида и сульфата лития.
Химические схемы реализации заявляемого способа приведены на фиг.1-3.
При получении Li2CO3 кальцинатным способом из литиеносного хлоридного сырьевого источника (хлорида лития) процесс состоит из 3-х стадий (фиг.1). На первой стадии проводят термическое разложение известняка (реакция 2) с получением негашеной извести, основным компонентом которой является CaO, и углекислого газа. На второй стадии процесса продуктивный раствор LiCl карбонизируют газовой смесью NH3 и CO2, взятой в мольном отношении 2:1 (реакция 3), с получением твердой фазы целевого продукта Li2CO3 и маточного раствора, содержащего преимущественно NH4Cl. На третьей стадии производят кальцинацию маточного раствора NH4Cl, осуществляя воспроизводство аммиака и водяных паров (реакция 4), которые возвращают на операцию карбонизации. Отходом производства в этом случае является раствор CaCl2, используемый в холодный период года в качестве эффективного антигололедного средства, а в теплый период года - для укрепления грунтовых дорог с целью снижения пыления.
При получении Li2CO3 кальцинатным способом из литиеносного сульфатного сырьевого источника (сульфат лития) процесс также состоит из 3-х стадий (фиг.2). Его отличие заключается в том, что на 3-й стадии процесса воспроизводство аммиака (реакция 6) осуществляется кальцинацией маточного раствора (NH4)2SO4, образующегося на стадии карбонизации (реакция 5). Отходом производства является твердый CaSO4 (гипс), используемый в стройиндустрии.
Получение Li2CO3 кальцинатным способом из литиеносного нитратного сырья (нитрата лития) также осуществляют в 3 стадии (фиг.3). Однако с целью превращения отхода производства - раствора Ca(NO3)2, в товарный побочный продукт - раствор азотной кислоты, раствор Ca(NO3)2 приводят в контакт с серной кислотой (реакция 9), осаждая кальций в виде сульфата (гипса).
Таким образом, последовательность протекающих при реализации способа взаимодействий имеет реальное химическое описание, соответствующее основополагающим положениям неорганической химии, что теоретически подтверждает возможность реализации кальцинатного способа получения лития из различных литиеносных сырьевых источников.
Возможность промышленной реализации данного способа на практике приводится в разработанных технологических схемах (фиг.4-6). В соответствии с технологической схемой производства Li2CO3 из хлоридного литиеносного сырьевого источника (фиг.4) насыщенный раствор NH4Cl после подогрева в рекуператоре тепла направляют на кальцинатное разложение путем контакта с негашеной известью (реакция 4). В результате экзотермической реакции и дополнительного подогрева процесс разложения протекает при температуре 100°C и выше под небольшим разрежением, что способствует более полному удалению аммиака из реакционной массы. Поток отгоняемого с парами воды аммиака смешивают с потоком углекислого газа, поступающего после очистки от пыли с операции разложения известняка (реакция 2), на которой наряду с углекислым газом образуется негашеная известь, содержащая, как правило, в качестве примесей MgO, Fe2O3 и SiO2. Парогазовую смесь, содержащую NH3 и СО2 в мольном отношении 2:1, подают на карбонизацию продуктивного раствора LiCl. Операцию карбонизации ведут при охлаждении, поддерживая температуру на уровне 20°C, при этом осаждается слаборастворимый карбонат лития (реакция 3). Далее карбонат лития отделяют от маточного раствора центрифугированием или фильтрацией, промывают деминерализованной водой от остаточного количества маточного раствора, сушат в микроволновой печи при температуре 105°C и затем прокаливают при температуре >205°C, удаляя остатки NH4Cl разложением (реакция 1). Содержание основного вещества в получаемом продукте находится на уровне 99.6% и выше. Отделенный от Li2CO3 маточный раствор, представляющий собой раствор NH4Cl с содержанием LiCl, направляют на высаливание NH4Cl путем добавления в него хлорида лития в виде соли или насыщенного раствора, доводя общее содержание LiCl до уровня 350-450 г/л. Остаточная концентрация хлорида аммония в растворе LiCl при этом составляет 54-17 г/л. Кристаллы NH4Cl отделяют от маточного раствора операции высаливания, удаляют остаток маточного раствора промывкой осадка водой, возвращая отработанный промывной раствор в голову операции высаливания хлорида аммония. Отмытые кристаллы NH4Cl растворяют в воде, получая насыщенный раствор NH4Cl, который, пройдя рекуперационный подогрев, направляют на операцию кальцинации. Операцию кальцинации (известкование) проводят при повышенной температуре (~90-95°C) и небольшом разрежении, достигаемым за счет тепла экзотермической реакции (4) и в случае необходимости дополнительным внешним подогревом. Образующийся в результате химической реакции аммиак отгонят из зоны реакции совместно с парами воды, создавая разрежение в зоне реакции на уровне 100-500 Па, и отправляют на операцию осаждения Li2CO3, а отработанную маточную жидкость операции кальцинации, представляющую собой суспензию MgO, SiO2, Fe2O3 и Ca(OH)2 в растворе CaCl2, содержащую остаточное количество NH4OH (на уровне 15-20 г/л), аэрируют потоком воздуха, удаляя аммиак из суспензии до остаточной концентрации 0.5-1.0 г/л. Из воздушного потока аммиак поглощают потоком подкисленного раствора LiCl, получаемым разбавлением маточного раствора операции высаливания хлорида аммония отработанным промывным раствором операции осаждения Li2CO3 с последующей глубокой очисткой от примесей Ca, Mg и SO4. Прошедший стадию поглощения аммиака раствор LiCl с примесью NH4Cl (продуктивный раствор LiCl) направляют на операцию осаждения Li2CO3, а очищенный воздушный поток возвращают на десорбцию аммиака. В свою очередь, освобожденную от аммиака аэрацией горячую суспензию на основе раствора CaCl2 фильтруют, отделяя твердую фазу (смесь MgO, SiO2 и Fe2O3), полученным раствором CaCl2 в рекуператоре тепла нагревают насыщенный раствор NH4Cl, направляемый на кальцинацию. Раствор CaCl2 используют в коммунальном хозяйстве. При реализации данной схемы производства Li2CO3 общие потери лития в пересчете на LiCl составляют менее 0.5%, а общие потери аммиака менее 1%.
Производственный процесс получения Li2CO3 из сульфатного литиеносного источника (фиг.5) организован аналогично. Отличие заключается в том, что ввиду перевода кальция на стадии кальцинации в нерастворимый сульфат кальция (твердофазный отход) отсутствует необходимость аэрировать маточный раствор операции кальцинации воздухом, который возвращают в производство. После отделения осадка CaSO4 маточный раствор смешивают с промывными водами и добавляют Li2SO4, получая продуктивный сульфатный раствор.
Процесс получения Li2CO3 из смешанного хлоридно-сульфатного литиеносного сырьевого источника (фиг.6) отличается от процесса получения карбоната лития из хлоридного литиеносного сырьевого источника (фиг.4) включением в технологический процесс дополнительно операции десульфатизации исходного смешанного литиеносного сырьевого концентрата раствором CaCl2 (отход производства процесса, фиг.4) и превращением его в хлоридный литиеносный продуктивный раствор.
Процесс получения Li2CO3 из нитратного литиеносного сырьевого источника полностью повторяет процесс, представленный на фиг.4. Только отходом производства в этом случае является не раствор CaCl2, а раствор Ca(NO3)2, который предлагается перерабатывать в раствор азотной кислоты путем перевода кальция в осадок действием на раствор серной кислотой по реакции:
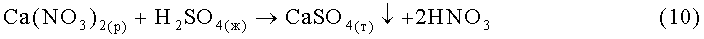 .
.
По другому варианту раствор нитрата кальция перерабатывают в раствор NH4NO3 (удобрение) и нерастворимый СаСО3 путем обработки раствора Са(NO3)2 карбонатом аммония по реакции:
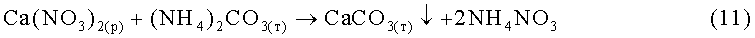 .
.
Возможность реализации заявляемых процессов подтверждается нижеследующими примерами.
Пример 1. Доломитизированный известняк состава (% мас.): СаСО3 - 47.6; MgCO3 - 42.8; SiO2; минералы примеси, содержащие оксиды SiO2, Al2O3, Fe2O3 и др. - 9.6, загружали в контейнер, снабженный крышкой и встроенным патрубком для отвода газовой фазы который соединяли посредством стальной трубки с цилиндрическим фильтром, заполненным стекловолокном (насадка). В свою очередь выходной патрубок фильтра соединяли с газгольдером для сбора углекислого газа. Контейнер с доломитизированным известняком помещали в печь с электрическим нагревом. Содержимое контейнера прокаливали в течение 4-х часов при температуре 850°C. Прокаленный остаток состава (% мас.): CaO - 47.1; MgO - 36.0; ∑SiO2 + оксидов - 16.9, выгружали и использовали на операции кальцинации аммонийного раствора, образующегося на операции осаждения карбоната лития.
Пример 2. В 1000 мл водного раствора, содержащего (г/л): Li - 9.4; NH4 + - 85.1; СО3 2- - 69.1; Cl- - 160.5, и имеющего показатель pH=8.9, добавляли кристаллы LiCl до высаливания NH4Cl, кристаллы отделяли, промывали и готовили насыщенный раствор NH4Cl (пример 4), который заливали в герметичный реактор с мешалкой и засыпали 334 г прокаленного доломитизированного известняка, содержащего 157 г CaO (пример 1). Содержимое перемешивали, поддерживая кипение в реакторе (температура, близкая к 100°C,) и откачивали выделяющийся аммиак перистальтическим насосом в аммиачный газгольдер. После завершения операции кальцинации, критерием которого служит прекращение выделения аммиака из раствора, образовавшуюся суспензию, остаточное содержание NH4OH в которой составляло 5.1 г/л, выгружали из реактора и аэрировали потоком воздуха в пластинчатой подогреваемой десорбционной колонне. Температуру в зоне десорбции поддерживали на уровне 90-93°C при соотношении объемов жидкой фазы к газовой, равном 1:750, при линейной скорости газового потока в колонне 0.3 м/с. Воздушный поток, прошедший стадию десорбции и содержащий аммиак, направляли на стадию абсорбции в абсорбционную пленочную охлаждаемую колонну. В качестве абсорбента аммиака из воздушного потока использовали литийсодержащий хлоридный раствор, после отделения кристаллов NH4Cl, подкисленный соляной кислотой состава (г/л): LiCl - 252; NH4Cl - 8.8; HCl - 6.1, объемом в 1 литр.
Обработанную воздушным потоком суспензию фильтровали на вакуумном нутч-фильтре, твердую фазу промывали деминерализованной водой, твердый остаток выводили из процесса. В составе высушенного осадка (258.2 г) содержались компоненты - примеси MgO, SiO2 и др. и неразложившийся карбонат кальция. Фильтрат представлял собой раствор CaCl2 концентрацией 204.2 г/л с остаточным содержанием аммиака 52 мг/л. Наличие магния, кремния, железа и алюминия в растворе хлорида кальция выше значения 1 мг/л не обнаружено.
В свою очередь прошедший стадию абсорбции аммиака хлоридный литийсодержащий раствор (продуктивный раствор для получения LiCO3) имел состав (г/л): LiCl - 252; NH4Cl - 17.2; pH=6.3. Таким образом, предлагаемая схема (фиг.6) кальцинации аммонийного раствора с последующей абсорбцией аммиака позволяет добиться степени воспроизводства аммиака выше значения 99.5%.
Пример 3. Литийсодержащий продуктивный раствор (пример 2) объемом 0.5 литра делили на 4-е равные по объему части, заливали в 4-е охлаждаемых реактора с мешалкой. Каждый реактор имел патрубок для входа газового потока, соединенный с диспергатором, расположенным под перемешивающим устройством, и патрубки для вывода газовой фазы. Реакторы по газовому тракту были объединены в каскад. Из потока аммиака и углекислого газа, отбираемых из газгольдеров, готовили смешанный поток (VNH3:VCO2=2), смешанный поток пропускали через каскад реакторов в течение 2 часов 20 минут с расходом 14 литров в час, периодически контролируя содержание NH3 на выходе из 4-го реактора. На протяжении всего эксперимента проскока аммиака не наблюдали. Образование осадков наблюдали только в 2-х первых по ходу газового потока реакторах. По окончании эксперимента содержимое первого реактора выгружали, образовавшийся карбонат лития фильтровали, промывали деминерализованной водой, сушили и прокаливали при t=300°C. Полученный образец карбоната лития имел следующий состав (% мас.): основное вещество Li2CO3 - 99.7; K+Na<0.002; NH4<0.005; Mg<0.02; Ca<0.02; Fe<0.001; Al<0.005; Si<0.005; SO4<0.01; Cl<0.01. Маточный раствор имел следующий состав (г/л): Li - 9.4; NH4 - 85.1; CO3 2- - 69.1; Cl- - 160.5; pH - 8.9.
Пример 4. В маточный раствор операции осаждения LiCO3 состава (г/л): Li - 9.4; NH4 + - 85.1; СО3 2- - 69.1; Cl- - 160.5; pH=8.9 добавляли насыщенный раствор LiCl, полученный растворением соли LiCl·H2O, порциями при перемешивании, повысив, таким образом, содержание лития до 74.6 г/л (453 г/л в пересчете на LiCl). В результате повышения содержания лития происходило высаливание кристаллов NH4Cl из раствора с образованием густой суспензии в конце эксперимента. Кристаллы NH4Cl отделяли от маточного раствора фильтрацией, отмывали от маточного раствора деминерализованной водой, промывной раствор направляли на операцию высаливания NH4Cl, кристаллы NH4Cl растворяли в воде и направляли на операцию кальцинации для воспроизводства NH3 (пример 2). Фильтрат, представляющий собой хлоридный раствор, содержащий 453 г/л LiCl и 9.7 г/л NH4Cl, разбавляли до содержания LiCl 240 г/л, производили глубокую очистку от примесей магния, кальция и сульфат-ионов реагентными методами до остаточных концентраций (мг/л): магний ≤5; кальций ≤8; SO4 ≤50. Очищенный раствор подкисляли соляной кислотой до содержания HCl 6.1 г/л и использовали в качестве абсорбента аммиака из десорбирующего воздушного потока (пример 2).
Пример 5. Продуктивный литийсодержащий сульфатный раствор состава (г/л): Li+ - 37.9; SO4 2- - 202; NH4 + - 0.5; ОН- - 20.7, и объемом 500 мл делили на 4-е равные части и по методике, прописанной в примере 3, в каскаде из 4-х реакторов обрабатывали смесью NH3 и СО2. Отличие заключалось в том, что ввиду присутствия в растворе, наряду с Li2SO4, гидроксида лития объемное соотношение потоков NH3 к CO2 поддерживали 2:1.3. По окончании операции обработки содержимое первого реактора выгружали, образовавшийся карбонат лития отделяли фильтрацией, промывали деминерализованной водой, сушили, прокаливали при 300°C. Полученный образец карбоната лития имел следующий состав (% мас.): основное вещество Li2CO3 - 99.6; K+Na<0.002; NH4<0.005; Mg<0.02; Ca<0.02; Fe<0.001; Al<0.005; Si<0.005; SO4<0.05; Cl<0.005. Маточный раствор операции осаждения Li2CO3 имел следующий состав (г/л): Li - 8.5; NH4+ - 117.2; SO4 2- - 312.6; СО3 2- - 32.1; pH - 8.7.
Пример 6. Маточный раствор операции осаждения Li2CO3 из продуктивного литийсодержащего сульфатного раствора состава (г/л): Li+ - 8.5; SO4 2- - 312.6; NH4 + - 117.2; СО3 - 32.8, pH=8.7 и объемом 1000 мл подвергали кальцинации обожженным доломитизированным известняком по методике, описанной в примере 2. В раствор добавляли 483 г обожженного доломита. После удаления из реакционной массы аммиака образовавшуюся суспензию фильтровали, отфильтрованный осадок промывали деминерализованной водой, сушили. Высушенный осадок имел следующий состав (% мас.): CaSO4 - 40.2; СаСО3 - 10.5; MgO - 28.0; SiO2 + оксиды металлов + остаточная влага - 21.3. Фильтрат, имеющий состав (г/л): Li+ - 9.2; SO4 2- - 1.5; NH4 + - 0.6; ОН- - 22.3, доукрепляли путем растворения в нем соли Li2SO4, доводя общее содержание лития до значения 37.9 г/л. Полученный раствор очищали глубоко от кальция и использовали в качестве продуктивного литийсодержащего сульфатного раствора для получения Li2CO3.
Пример 7. В соответствии с методикой, описанной в примере 3, был проведен эксперимент с использованием в качестве сырьевого источника продуктивного литийсодержащего нитратного раствора состава (г/л): LiNO3 - 277; NH4 - 19.1; pH=6, из которого получали карбонат лития, по составу близкий к Li2CO3, полученному в пример 3. Дополнительно контролировали содержание СО3 в продукте, которое не превышало значение 0.01% мас. Маточный раствор операции осаждения Li2CO3 после операции кальцинации, отгонки аммиака и удаления осадка представляет собой слабощелочной раствор Са(NO3)2 концентрацией 368 г/л с примесью NH4 (67 мг/л). Данный раствор приводили в контакт с концентрированной серной кислотой, взятой в избытке 5% от стехиометрии, выпавший осадок CaSO4 удаляли фильтрацией, остаток сульфат-ионов переводили в осадок добавлением нитрата бария. После фильтрации получали раствор HNO3 концентрацией 283 г/л с остаточным содержанием примесей (мг/л): Ca - 125; SO4 - 250; Ва<20.
Промышленная применимость
В мировой промышленной практике карбонат лития получают путем его осаждения содой из продуктивных литийсодержащих растворов, полученных из различных видов сырья как рудного, так и гидроминерального. Известны способы получения Li2CO3 путем осаждения углеаммонийными солями. При сульфатном способе переработки сподумена получают сульфатные литийсодержащие растворы. При галургическом способе переработки природного гидроминерального сырья получают хлоридные или хлоридно-сульфатные литийсодержащие продуктивные растворы. По заявляемому кальцинатному способу получения карбоната лития его осаждают смесью аммиака с углекислым газом, причем углекислый газ получают из природного известняка, содержащего примеси магния, кремния, железа и др., а аммиак воспроизводят из маточных растворов операции осаждения Li2CO3 после высаливания аммонийных солей и дальнейшей их обработки известью, получаемой, как и СО3, из известняка.
Применение дешевого известняка в качестве карбонатсодержащего реагента позволяет снизить себестоимость Li2CO3 на 15-20%. Рыночная цена природного известняка (400-450 руб./т) в 40 раз ниже рыночной цены на соду и в 55 раз ниже, чем на углеаммонийную соль (NaCO3 - 16000-18800 руб./т, аммонийная соль - 22000-26000 руб./т). В связи с бурным развитием производства электромобилей необходимость в литиевых солях ежегодно возрастает. Производство более дешевого карбоната лития позволит получать и более дешевый катодный материал для Li-ионных батарей, используемых не только для электромобилей, но и в других областях техники.
Источники информации
1. Pat. CN №1059702, заявл. 10.09.90, опубл. 25.03.92 / Wang Guiying, Shi Ving
2. Pat. US №5219550, заявл. 06.12.90, опубл. 15.06.93 / Brown P.M., Boruta D.A.
3. Pat. RU №2283283, заявл. 30.12.2004, опубл. 10.09.2005 / Рябцев А.Д., Титаренко В.И., Коцупало Н.П., Менжерес Л.Т., Кураков А.А., Гущина Е.П. (прототип).