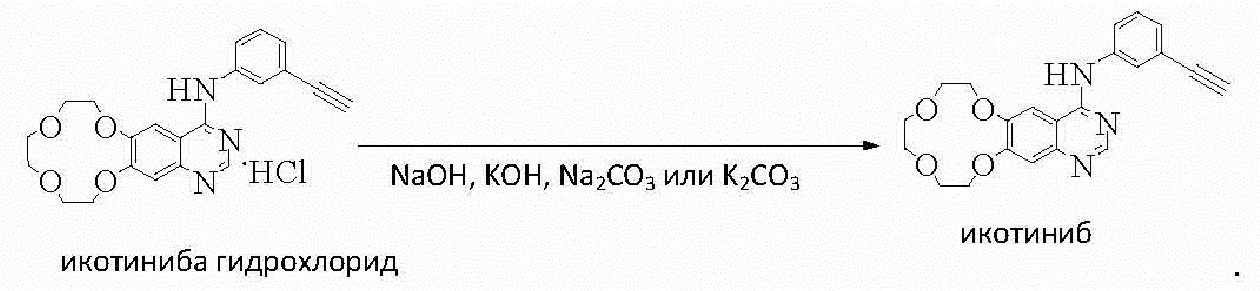Результат интеллектуальной деятельности: ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА МАЛЕАТА И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым полиморфным формам икотиниба малеата, способам получения этих новых полиморфных форм, фармацевтическим композициям с ними и к применению новых полиморфных форм и фармацевтических композиций для лечения рака и заболеваний, связанных с возникновением рака.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Тирозинкиназные рецепторы представляют собой трансмембранные белки, которые в ответ на внеклеточный стимул распространяют cигнальный каскад для контроля клеточной пролиферации, ангиогенеза, апоптоза и других важных характеристик клеточного роста. Один класс таких рецепторов, тирозинкиназы рецептора эпидермального фактора роста (EGFR), чрезмерно экспрессируются при многих формах рака у человека, в том числе при раке головного мозга, легкого, печени, мочевого пузыря, молочной железы, головы и шеи, пищевода, желудочно-кишечного тракта, молочной железы, яичника, шейки матки или щитовидной железы.
EGFR экспрессируется во многих типах опухолевых клеток. Связывание когнатных лигандов (в том числе EGF, TGFα (т.е. трансформирующего фактора роста α) и нейрегулинов) с внеклеточным доменом вызывает образование гомо- или гетеродимеров между представителями семейства. Непосредственное соседство цитоплазматических доменов тирозинкиназ приводит в результате к трансфосфорилированию специфических тирозиновых, сериновых и треониновых остатков в каждом цитоплазматическом домене. Образованные фосфотирозины действуют как участки стыковки для различных адаптерных молекул и последующей активации каскадов сигнальной трансдукции (Ras/митоген-активируемый, PI3K/Akt и Jak/STAT), которые запускают связанные с пролиферацией клеточные ответы.
Различные исследования по молекулярной и клеточной биологии и клинические исследования продемонстрировали, что ингибиторы тирозинкиназы EGFR могут блокировать пролиферацию и метастазирование раковых клеток, а также другие ответы, основанные на связанной с EGFR сигнальной трансдукции, для достижения клинических противоопухолевых терапевтических эффектов. Гефитиниб (Иресса, AstraZeneca), одобренный Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для распространенного немелкоклеточного рака легкого в 2003 году (и позднее отозванный), и эрлотиниба гидрохлорид (Тарцева, Roche и OSI), одобренный FDA США для лечения распространенного немелкоклеточного рака легкого и рака поджелудочной железы в 2004 году, являются двумя пероральными ингибиторами киназы EGFR с подобными химическими структурами.
Многие фармацевтически активные органические соединения могут образовывать кристаллы с трехмерной кристаллической структурой более чем одного типа. То есть соединения могут кристаллизоваться в различные кристаллические формы. Это явление (идентичная химическая структура, но различная кристаллическая структура) называется полиморфизмом, а разновидности, характеризующиеся различными молекулярными структурами, называются полиморфами.
Полиморфы конкретного органического фармацевтического соединения могут характеризоваться различными физическими свойствами, такими как растворимость и гигроскопичность, вследствие своих отличных трехмерных кристаллических структур. Тем не менее, обычно невозможно предсказать, будет ли конкретное органическое соединение образовывать различные кристаллические формы, не говоря уже о том, чтобы предсказать структуру и свойства самих кристаллических форм. Открытие новой кристаллической или полиморфной формы полезного с точки зрения фармацевтики соединения может обеспечить новую возможность для улучшения общих характеристик фармацевтического продукта. Это расширяет спектр материалов, которые доступны для разработки ученому, специализирующемуся на получении составов. Это может обеспечить преимущество в случае, когда этот спектр расширяется при открытии новых полиморфов полезного соединения.
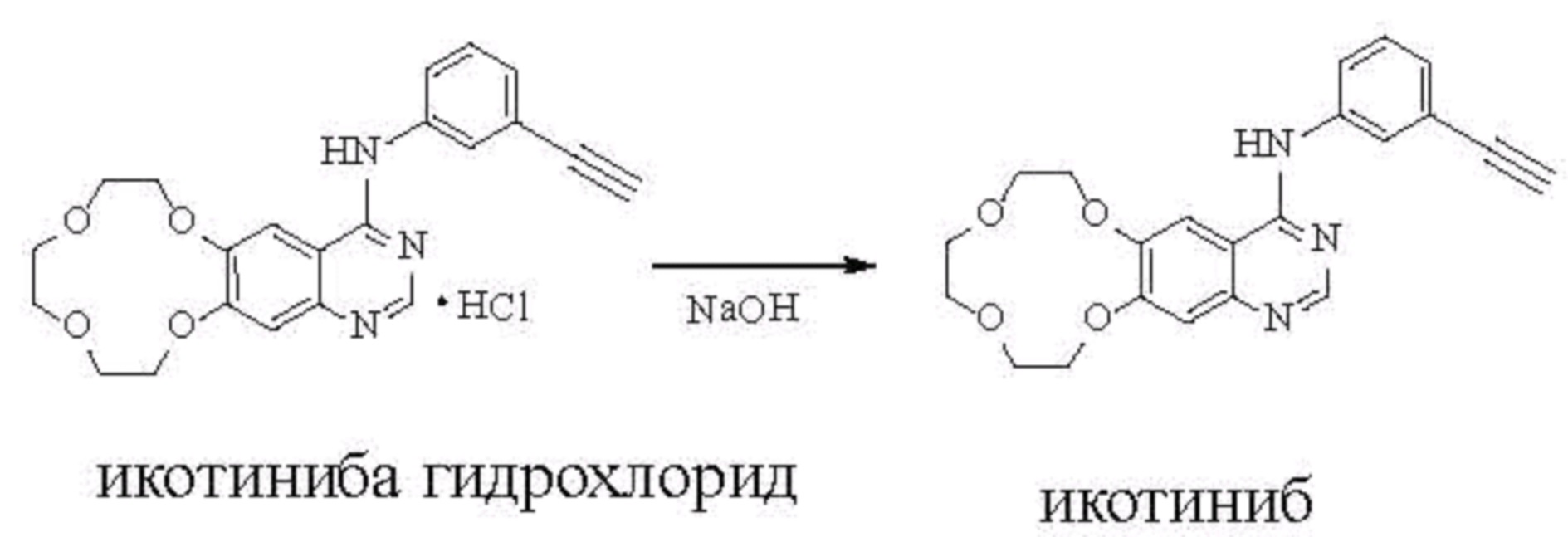
В публикации патентного документа Китая № CN1305860C раскрыта структура икотиниба (свободное основание), на странице 29, пример 15, соединение 23, а в документе WO 2010/003313 раскрыт икотиниба гидрохлорид и его новые кристаллические полиморфы.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает достижение технического результата, который заключается в улучшении биодоступности заявленного икотиниба малеата по сравнению с гидрохлоридом икотиниба.
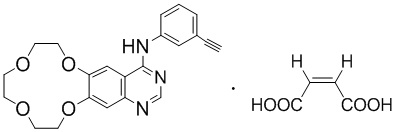
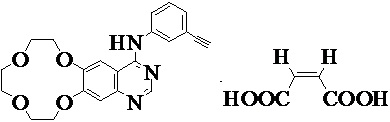
В целом, настоящее изобретение относится к икотиниба малеату (т.е. соединению формулы I), его практически чистым полиморфным формам и его фармацевтически приемлемым солям,
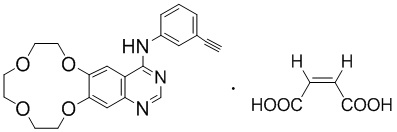 ,
,
формула I.
Полиморфная форма согласно настоящему изобретению относится к полиморфной форме II, и ее рентгеновская порошковая дифрактограмма имеет характеристические пики при углах дифракции 2θ, составляющих приблизительно 7,5°, 19,0° и 31,2° ± 0,2°.
В некоторых вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма имеет характеристические пики при углах дифракции 2θ, составляющих приблизительно 7,5°, 15,0°, 19,0°, 23,8° и 31,2° ± 0,2°.
В некоторых других вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма имеет характеристические пики при углах дифракции 2θ, составляющих приблизительно 7,5°, 13,8°, 15,0°, 15,5°, 19,0°, 22,5°, 23,8° и 31,2° ± 0,2°.
Помимо этого, в некоторых других вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма имеет характеристические пики, выраженные в пересчете на межплоскостное расстояние, составляющее 11,8 Å, 4,7 Å и 2,9 Å.
Помимо этого, в некоторых других вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма имеет характеристические пики, выраженные в пересчете на межплоскостное расстояние, составляющее 11,8 Å, 5,9 Å, 4,7 Å, 3,7 Å и 2,9 Å.
Помимо этого, в некоторых других вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма имеет характеристические пики, выраженные в пересчете на межплоскостное расстояние, составляющее 11,8 Å, 6,4 Å, 5,9 Å, 5,7 Å, 4,7 Å, 4,0 Å, 3,7 Å и 2,9 Å.
Помимо этого, в некоторых других вариантах осуществления полиморфной формы II ее рентгеновская порошковая дифрактограмма представлена в том же виде, как и на фигуре 2.
Помимо этого, в некоторых других вариантах осуществления полиморфной формы II она имеет температуру плавления, составляющую 182-184°С.
Полиморфная форма II согласно настоящему изобретению может иметь чистоту ≥85%, ≥95% или даже ≥99%.
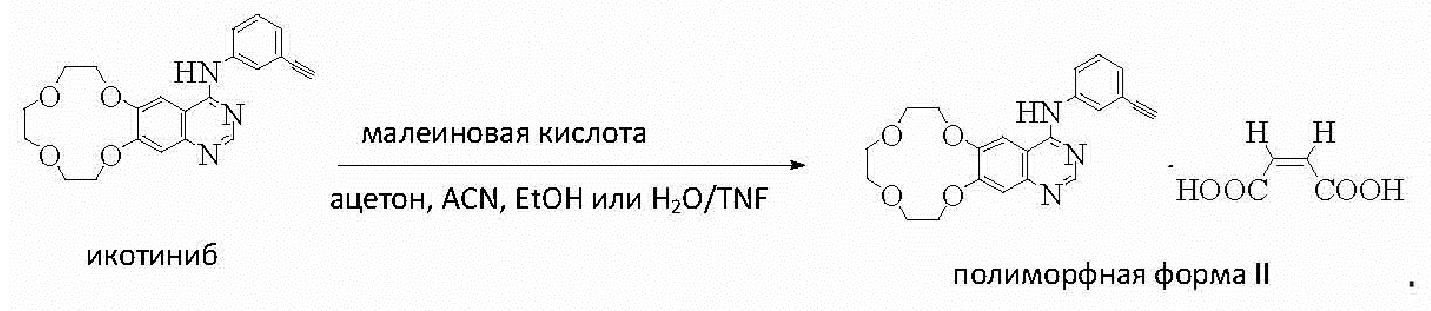
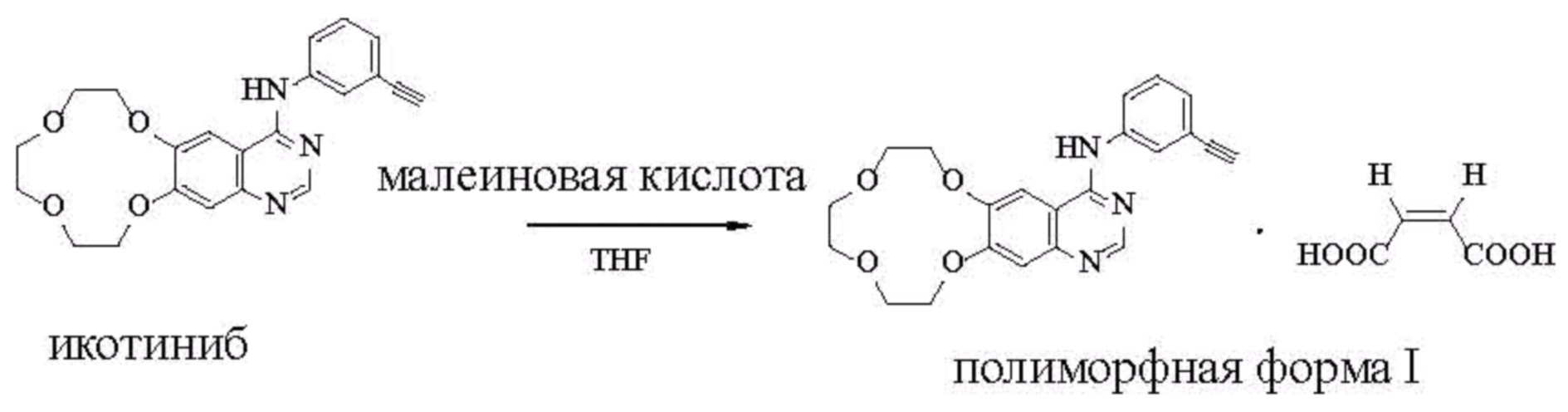
В еще одном аспекте настоящее изобретение предлагает способы получения полиморфной формы икотиниба малеата, причем каждый из них предусматривает стадию осуществления реакции икотиниба с малеиновой кислотой в реакционной среде с получением икотиниба малеата в полиморфной форме. Реакцию между икотинибом и малеиновой кислотой можно проводить, например, при комнатной температуре.
Согласно заявленному способу реакционная среда содержит ацетон, ацетонитрил, этанол или смесь воды и THF, и полученный в результате полиморф представляет собой полиморфную форму II.
При этом, молярное соотношение малеиновой кислоты и икотиниба находится в диапазоне от 1:1 до 2:1 (например, 1:1, 1,5:1 или 2:1).
Некоторые варианты осуществления способов дополнительно включают стадию осуществления реакции икотиниба гидрохлорида с основанием в реакционной среде с получением икотиниба перед стадией осуществления реакции икотиниба с малеиновой кислотой. Эту реакцию можно проводить, например, при температуре 40-80°С.
Примеры подходящего основания включают гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия.
Реакционная среда может включать, например, воду и этанол, воду и IPA, воду и метанол или воду и THF.
Полиморфная форма согласно настоящему изобретению, в частности, полиморфная форма II, неожиданно проявляли значительно лучшую биодоступность и химическую стабильность, чем икотиниба гидрохлорид, активный ингредиент лекарственного средства, присутствующего в настоящее время на рынке. Соответственно, настоящее изобретение также предлагает фармацевтические композиции, содержащие терапевтически эффективное количество полиморфной формы согласно настоящему изобретению и фармацевтически приемлемое вспомогательное средство, дополнительное средство или носитель.
Фармацевтическая композиция может дополнительно включать второй терапевтически активный ингредиент и может присутствовать в форме, подходящей для перорального введения (например, таблетки или капсулы).
Также в пределах объема настоящего изобретения находится применение полиморфной формы или фармацевтической композиции согласно настоящему изобретению в производстве лекарственного препарата для предупреждения или лечения у млекопитающих интенсивного незлокачественного заболевания, панкреатита, заболевания почек, рака, ангиогенеза или заболевания сосудов или для трансплантации клеток эмбриона млекопитающего.
Также в пределах объема настоящего изобретения находится способ лечения интенсивного незлокачественного заболевания, панкреатита, заболевания почек, рака, ангиогенеза или заболевания сосудов или трансплантации клеток эмбриона млекопитающего путем введения пациенту-млекопитающему, нуждающемуся в этом, полиморфной формы или фармацевтической композиции согласно настоящему изобретению.
Интенсивное незлокачественное заболевание может представлять собой, например, доброкачественную гиперплазию кожи или доброкачественную гиперплазию предстательной железы. Или интенсивное незлокачественное заболевание, панкреатит, заболевание почек, рак, болезнь, связанная с ангиогенезом или возникновением сосудов, выбрана из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, кожных заболеваний, таких как псориаз и склеродерма, вызванных диабетом кожных заболеваний, диабетической ретинопатии, ретинопатии недоношенных, возрастной дегенерации желтого пятна, гемангиомы, глиомы, внутренней опухоли Капоши, рака яичника, рака молочной железы, рака легкого, рака поджелудочной железы, лимфомы, опухолей предстательной железы, толстой кишки и кожи, а также их осложнений.
Все полиморфы согласно настоящему изобретению являются практически чистыми.
Используемое в данном документе выражение “практически чистый” относится к тому, что по меньшей мере 85 вес. %, предпочтительно по меньшей мере 95 вес. %, более предпочтительно по меньшей мере 99 вес. % соединения формулы I существует в полиморфной форме согласно настоящему изобретению, в частности, в полиморфных формах, относящихся к форме II.
Главные пики, описанные для вышеприведенных полиморфных форм, являются воспроизводимыми и находятся в пределах погрешности (определенное значение ± 0,2).
Согласно настоящему изобретению фраза “рентгеновская порошковая дифрактограмма представлена в том же виде, как и на фигуре 1”, относится к рентгеновской порошковой дифрактограмме, на которой основные пики представлены, как на фигуре 1, где основные пики относятся к пикам с относительной интенсивностью, большей чем 10%, предпочтительно большей чем 30% в сравнении с наивысшим пиком (причем его относительная интенсивность определяется как 100%) на фигуре 1. Аналогично, согласно настоящему изобретению рентгеновская порошковая дифрактограмма, представленная в том же виде, как и на фигуре 2, относится к рентгеновской порошковой дифрактограмме, на которой основные пики представлены, как на фигуре 2, где основные пики относятся к пикам с относительной интенсивностью, большей чем 10%, предпочтительно большей чем 30% в сравнении с наивысшим пиком (причем его относительная интенсивность определяется как 100%) на фигуре 2.
Кристаллизация согласно настоящему изобретению относится к динамике и равновесию между различными полиморфными формами в определенных условиях. Таким образом, специалист в данной области техники поймет, что получаемая в результате полиморфная форма зависит от кинетики и термодинамики процесса кристаллизации. В определенных условиях (система растворителей, температура, давление и концентрация соединения согласно настоящему изобретению) одна полиморфная форма может быть более стабильной, нежели другая (или, фактически, может быть более стабильной, чем все прочие полиморфные формы). Тем не менее, полиморфы, которые характеризуются меньшей термодинамической стабильностью, могут быть выгодны с точки зрения кинетики. На полиморфную форму также могут оказывать воздействие факторы, отличные от кинетики, такие как время, распределение примесей, встряхивание, наличие или отсутствие затравки полиморфа. В контексте настоящего изобретения различные гидратные и сольватные формы включены в объем выражения “полиморф”.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество одного или несколько полиморфов формы II соединения формулы I и фармацевтически приемлемое вспомогательное средство, дополнительное средство или носитель. При этом фармацевтическая композиция содержит 1-99 вес. %, предпочтительно 1-70 вес. %, более предпочтительно 10-30 вес. % формы II соединения формулы I.
Используемое в данном документе выражение “терапевтически эффективное количество” относится к количеству соединения, которое при введении субъекту для лечения заболевания или по меньшей мере одного из клинических симптомов заболевания или нарушения является достаточным для влияния такого лечения на заболевание, нарушение или симптом. “Терапевтически эффективное количество” может изменяться в зависимости от соединения, заболевания, нарушения и/или симптомов заболевания или нарушения, тяжести заболевания, нарушения и/или симптомов заболевания или нарушения, возраста субъекта, подлежащего лечению, и/или веса субъекта, подлежащего лечению. Надлежащее количество в каждом конкретном случае будет очевидно специалисту в данной области или может быть определено путем стандартных экспериментов. В случае комбинированной терапии выражение “терапевтически эффективное количество” относится к общему количеству объектов в комбинации для эффективного лечения заболевания, нарушения или состояния.
Фармацевтическую композицию, содержащую соединение согласно настоящему изобретению, можно вводить посредством перорального, ингаляционного, ректального, парентерального или местного введения субъекту, который нуждается в лечении. Для перорального введения фармацевтическая композиция может представлять собой стандартный состав в виде твердого вещества, такой как таблетки, порошок, гранула, капсулы и т.п., жидкий состав, такой как водная или масляная суспензия, или другой жидкий состав, такой как сироп, раствор, суспензия или подобное; для парентерального введения фармацевтическая композиция может представлять собой раствор, водный раствор, концентрат масляной суспензии, лиофилизированный порошок или подобное. Предпочтительно состав фармацевтической композиции выбран из таблетки, покрытой таблетки, капсулы, суппозитория, назального спрея или инъекционной формы, более предпочтительно из таблетки или капсулы. Фармацевтическая композиция может представлять собой одну единицу для введения с точной дозировкой. Кроме того, фармацевтическая композиция может также содержать дополнительные активные ингредиенты.
Все составы фармацевтической композиции согласно настоящему изобретению можно получить с помощью общепринятых способов в области фармацевтики. Например, активный ингредиент можно смешать с одним или несколькими вспомогательными средствами, чтобы затем получить необходимый состав. Выражение “фармацевтически приемлемый носитель” относится к общепринятым фармацевтическим носителям, подходящим для необходимого фармацевтического состава, например: разбавитель, среда, такая как вода, различные органические растворители и т.д., наполнитель, такой как крахмал, сахароза и т.д.; связующее, такое как производные целлюлозы, альгинаты, желатин и поливинилпирролидон (PVP); смачивающее средство, такое как глицерин; разрыхлитель, такой как агар, карбонат кальция и бикарбонат натрия; усилитель абсорбции, такой как соединение четвертичного аммония; поверхностно-активное вещество, такое как гексадеканол; абсорбционный носитель, такой как каолин и мыльная глина; смазывающее средство, такое как тальк, стеарат кальция, стеарат магния, полиэтиленгликоль и т.д. Кроме того, фармацевтическая композиция дополнительно содержит другие фармацевтически приемлемые вспомогательные средства, такие как разукрупняющее средство, стабилизатор, загуститель, комплексообразующее средство, буферное средство, усилитель проницаемости, полимер, душистые вещества, подсластитель и краситель. Предпочтительно вспомогательное средство является подходящим для необходимого типа состава и введения.
Выражение “заболевание”, или “нарушение”, или “состояние” относится к любому заболеванию, недомоганию, болезни, симптомам или признакам.
В другом аспекте настоящее изобретение предлагает применение соединений (икотиниба малеата и его полиморфных форм) и/или фармацевтических композиций в производстве лекарственного препарата для лечения или предупреждения у млекопитающих незлокачественного заболевания, связанного с чрезмерной гиперплазией, панкреатита, заболевания почек, рака, болезни, связанной с ангиогенезом или возникновением сосудов, или для трансплантации клеток эмбриона млекопитающего. Незлокачественное заболевание, связанное с чрезмерной гиперплазией, может представлять собой доброкачественную гиперплазию кожи или доброкачественную гиперплазию предстательной железы.
Предпочтительно полиморфные формы или фармацевтическую композицию согласно настоящему изобретению можно применять в производстве лекарственного препарата для лечения или предупреждения у млекопитающих незлокачественного заболевания, связанного с чрезмерной гиперплазией, панкреатита, заболевания почек, рака, болезни, связанной с ангиогенезом или возникновением сосудов, выбранной из опухолевого ангиогенеза, хронических воспалительных заболеваний, таких как ревматоидный артрит, атеросклероза, кожных заболеваний, таких как псориаз и склеродерма, связанных с диабетом кожных заболеваний, диабетической ретинопатии, ретинопатии недоношенных, возрастной дегенерации желтого пятна, гемангиомы, глиомы, внутренней опухоли Капоши, рака яичника, рака молочной железы, рака легкого, рака поджелудочной железы, лимфомы, опухолей предстательной железы, толстой кишки и кожи, а также их осложнений.
Среди млекопитающих, упомянутых в данном документе, люди являются предпочтительными.
Настоящее изобретение предлагает способ лечения гиперплазии злокачественной ткани у млекопитающих. Этот способ лечения включает применение эффективного количества икотиниба малеата, и/или его полиморфных форм, и/или фармацевтических композиций к пациентам-млекопитающим с заболеванием, связанным с гиперплазией. В некоторых вариантах осуществления способ лечения также включает применение ингибитора MMP (матриксной металлопротеиназы), ингибиторов киназы VEGFR (рецептора фактора роста эндотелия сосудов), ингибитора HER2, лекарственных средств на основе антител к VEGFR и/или лекарственных средств на основе эндостатина. В некоторых вариантах осуществления способ лечения также включает применение одного или нескольких противоопухолевых средств, таких как ингибиторы митоза, алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, ингибиторы факторов роста, ингибиторы клеточного цикла, ферменты, ингибиторы ферментов, модификаторы биологического ответа, антигормональные лекарственные средства и так далее. Противоопухолевые средства можно выбрать из карбоплатина, паклитаксела, гемцитабина, метотрексата, 5-FU, кампотецина, циклофосфамида, BCNU и других средств для лечения.
Другой целью настоящего изобретения является обеспечения применения соединений (икотиниба малеата и его полиморфов) и/или фармацевтических композиций в производстве лекарственного препарата для лечения заболевания, связанного с дисфункцией тирозинкиназы.
Предпочтительно настоящее изобретение предлагает способ лечения заболевания, вызванного дисфункцией тирозинкиназы. Данный способ лечения включает введение пациенту с заболеванием, вызванным дисфункцией тирозинкиназы, эффективного количества соединений (икотиниба малеата и его полиморфов) и/или фармацевтических композиций. Заболевания, связанные с дисфункцией тирозинкиназы, включают без ограничения заболевания, связанные с опухолями головного мозга, легкого, печени, мочевого пузыря, молочной железы, головы и шеи, пищевода, желудочно-кишечного тракта, яичника, шейки матки или щитовидной железы, а также их осложнения.
Заболевание-мишень для вышеописанного способа лечения предпочтительно выбрано из рака головного мозга, рака легкого (такого как немелкоклеточный рак легкого (NSCLC)), рака почки, рака кости, рака печени, рака мочевого пузыря, рака молочной железы, лимфомы или опухолей щитовидной железы, а также их осложнений.
Вышеописанные способы можно применять в комбинации с любой химиотерапией, биологической терапией или лучевой терапией.
Вышеописанные способы лечения могут дополнительно включать применение антител к EGFR, антител к EGF или и тех, и других в одном и том же лечении.
Доза активного ингредиента или соединения в случае введения будет определяться индивидуальными потребностями пациента, получающего лечение, путем введения, тяжестью заболевания или болезни, схемой дозирования, а также оценкой и решением уполномоченного врача. Тем не менее, с учетом активного соединения предпочтительный диапазон эффективной дозы может составлять приблизительно 0,01-120 мг в сутки на килограмм массы тела; или более предпочтительно 1-50 мг в сутки на килограмм массы тела в виде одной дозы или отдельных доз. В некоторых случаях более подходящим является применение нижнего предела вышеописанного диапазона дозы, тогда как в других случаях можно применять более высокую дозу, не вызывая вредных побочных эффектов.
Другим аспектом настоящего изобретение является обеспечение икотиниба малеата для клинических применений. В частности, настоящее изобретение относится к клиническому лечению икотиниба малеатом со следующими вариантами лечения для пациентов с раком: доза икотиниба малеата и/или полиморфной формы II может составлять 25-2100 мг/сутки, причем частота введения составляет 1-3 раза в сутки; предпочтительная доза составляет 75-1200 мг/сутки, причем частота введения составляет 2-3 раза в сутки; еще более предпочтительная доза составляет 100-1200 мг/сутки, причем частота введения составляет 2-3 раза в сути. Также в пределах объема настоящего изобретения находится применение полиморфной формы или фармацевтической композиции согласно настоящему изобретению в производстве лекарственного препарата для предупреждения или лечения у млекопитающих интенсивного незлокачественного заболевания, панкреатита, заболевания почек, рака, ангиогенеза или заболевания сосудов или для трансплантации клеток эмбриона млекопитающего.
Интенсивное незлокачественное заболевание может представлять собой, например, доброкачественную гиперплазию кожи или доброкачественную гиперплазию предстательной железы. Или интенсивное незлокачественное заболевание, панкреатит, заболевание почек, рак, болезнь, связанная с ангиогенезом или возникновением сосудов, выбраны из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, кожных заболеваний, таких как псориаз и склеродерма, вызванных диабетом кожных заболеваний, диабетической ретинопатии, ретинопатии недоношенных, возрастной дегенерации желтого пятна, гемангиомы, глиомы, внутренней опухоли Капоши, рака яичника, рака молочной железы, рака легкого, рака поджелудочной железы, лимфомы, опухолей предстательной железы, толстой кишки и кожи, а также их осложнений.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
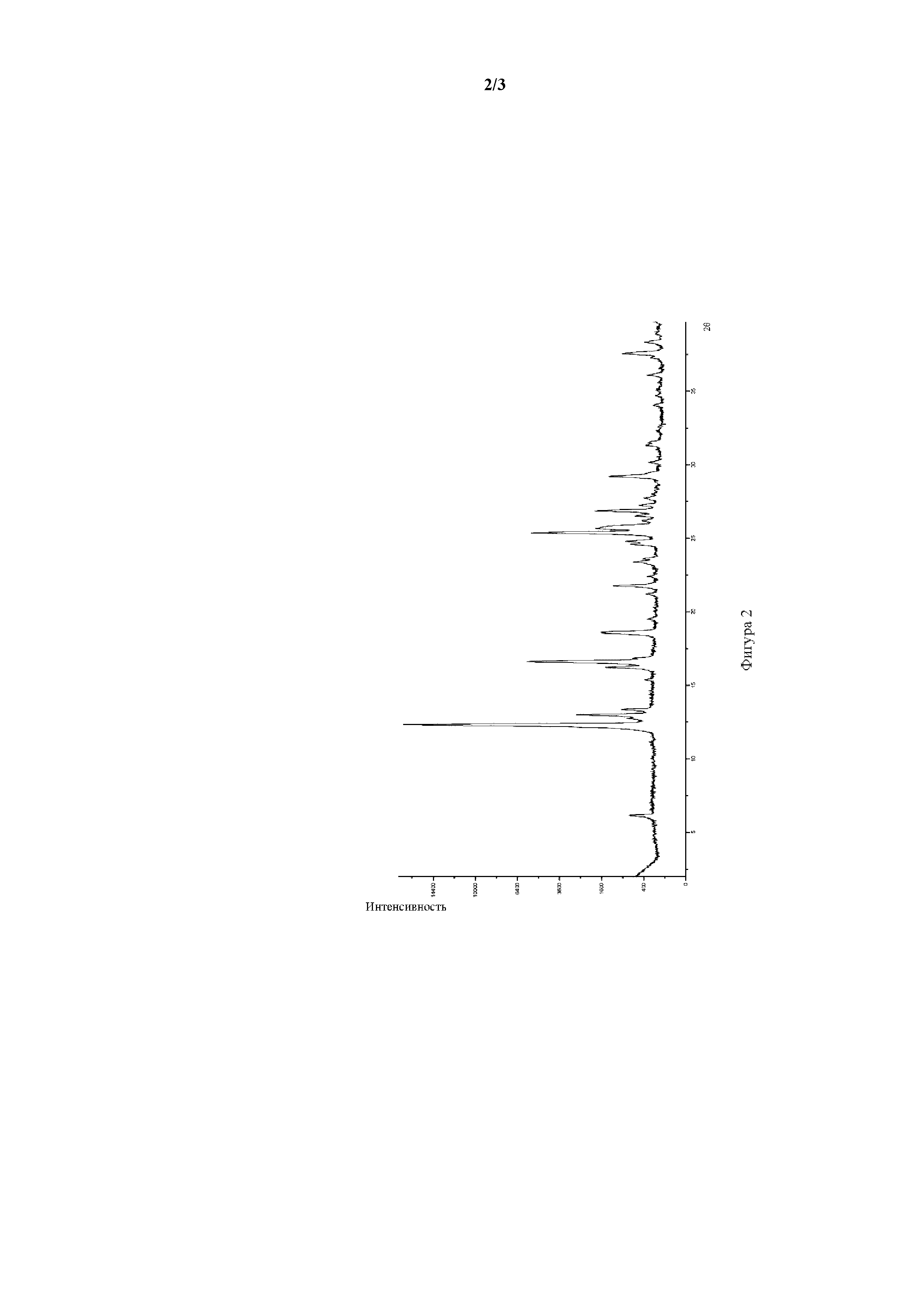
Фигура 1. Рентгеновская порошковая дифрактограмма полиморфной формы I соединения формулы I.
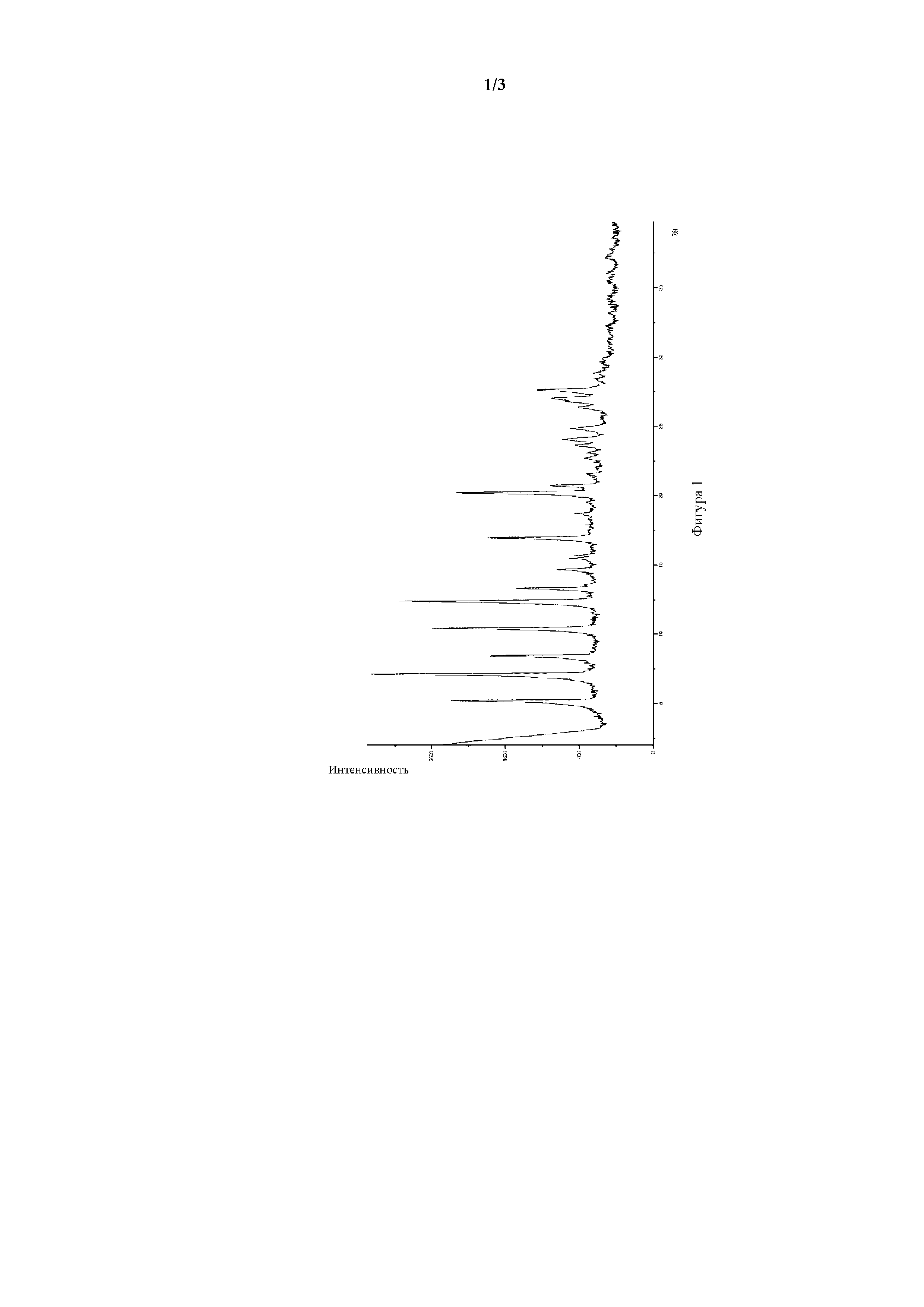
Фигура 2. Рентгеновская порошковая дифрактограмма полиморфной формы II соединения формулы I.
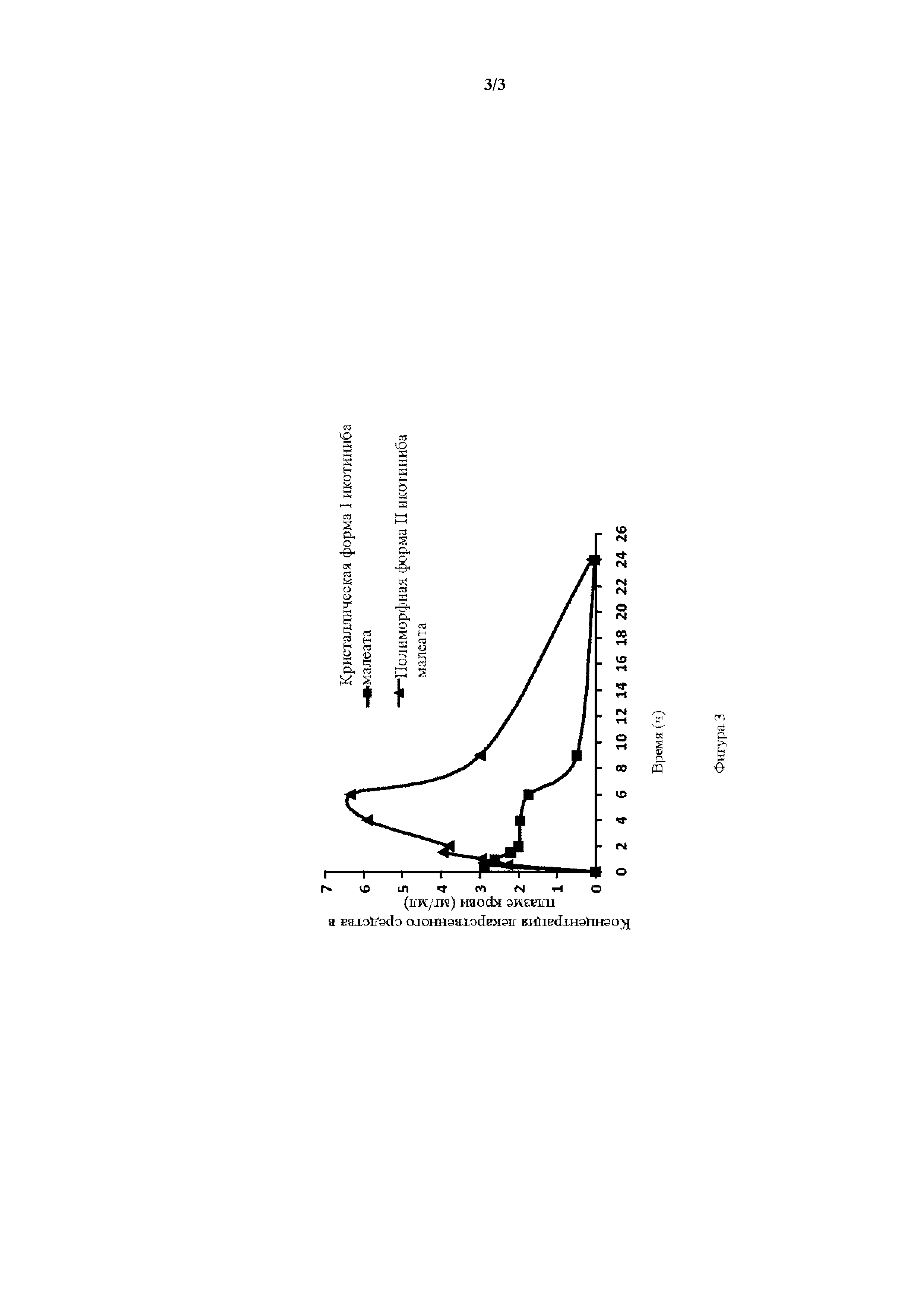
Фигура 3. Кривые зависимости концентрации в плазме от времени для полиморфной формы II соединения формулы I и кристаллической формы I икотиниба гидрохлорида.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение дополнительно поясняется следующими примерами, которые иллюстрируют настоящее изобретение, но не ограничивается ими. Методики или способы, применяемые в этих примерах, если явно не указывается иное, представляли собой общепринятые методики или способы, хорошо известные из уровня техники.
Рентгеновские порошковые дифрактограммы (XRPD) для полиморфных форм икотиниба малеата получали на рентгенодифракционной системе PANalytical с консолью Empyrean. Положения дифракционных пиков калибровали с использованием кремниевого порошка, который имел величину 2θ, составляющую 28,443 градуса. В качестве источника использовали K-альфа излучение рентгеновской трубки Empyrean Cu LEF.
Пример 1. Получение полиморфной формы I
100 г икотиниба гидрохлорида растворяли в смеси 300 мл этанола и 200 мл воды. Раствор 11,2 г гидроксида натрия в 100 мл воды добавляли по каплям при 60°С к раствору икотиниба гидрохлорида до тех пор, пока значение pH реакционного раствора не достигало 13. Реакционный раствор перемешивали в течение 1 часа, а затем охлаждали до комнатной температуры. Осадок фильтровали и промывали очищенной водой и сушили в течение 8 часов в вакууме при температуре ниже 60°С с получением 90 г икотиниба.
Полиморфную форму I икотиниба малеата получали путем осуществления реакции раствора икотиниба с раствором малеиновой кислоты (молярное соотношение 1:1) в тетрагидрофуране (THF) при комнатной температуре. Подробности процедуры были следующими: 10 мг икотиниба растворяли в 1 мл THF. 34,82 мг малеиновой кислоты также растворяли в 3 мл THF с получением раствора малеиновой кислоты в концентрации 0,1 моль/л. 0,26 мл раствора малеиновой кислоты добавляли к раствору икотиниба и реакционную смесь перемешивали в течение 24 часов, а затем выделяли полиморфную форму I. Температура плавления полиморфной формы составляла 173-176°С.
Пример 2. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 1.
Пример 3. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 1.
Пример 4. Получение полиморфной формы I
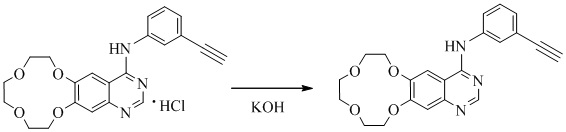
10 г икотиниба гидрохлорида растворяли в смеси 30 мл изопропанола (IPA) и 20 мл воды, раствор 1,6 г гидроксида калия в 10 мл воды добавляли к раствору икотиниба гидрохлорида до тех пор, пока значение pH реакционной смеси не достигало 13. Реакционную смесь затем перемешивали в течение 1-2 часов перед охлаждением до комнатной температуры. Осадок фильтровали и промывали очищенной водой и сушили в вакууме в течение 8-10 часов при температуре ниже 50°С с получением 7,9 г икотиниба.
Полиморфную форму I получали путем осуществления реакции раствора икотиниба с раствором малеиновой кислоты при молярном соотношении 1:1 в IPA при комнатной температуре. Подробности процедуры были следующими: 10 мг икотиниба растворяли в 1 мл IPA. 34,82 мг малеиновой кислоты растворяли в 3 мл IPA с получением раствора малеиновой кислоты в концентрации 0,1 моль/л. Затем 0,26 мл раствора малеиновой кислоты в концентрации 0,1 моль/л добавляли к раствору икотиниба с получением раствора, который перемешивали в течение 24 часов, а затем выделяли полиморфную форму I.
Пример 5. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 4.
Пример 6. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 4.
Пример 7. Получение полиморфной формы I
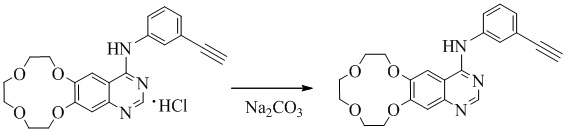
5 г икотиниба гидрохлорида растворяли в смеси 20 мл метанола и 15 мл воды. К этому раствору икотиниба гидрохлорида добавляли по каплям раствор 1,5 г карбоната натрия в 10 мл воды при 40°С до тех пор, пока значение pH смеси не достигало 13. Реакционную смесь перемешивали в течение 1-2 часов перед охлаждением до комнатной температуры. Осадок фильтровали и промывали очищенной водой и сушили в вакууме в течение 8-10 часов при температуре ниже 60°С с получением 4,0 г икотиниба.
Полиморфную форму I получали путем осуществления реакции раствора икотиниба с раствором малеиновой кислоты (молярное соотношение 1:1) в диоксане при комнатной температуре. Подробности процедуры были следующими: 10 мг икотиниба растворяли в 1 мл диоксана. 34,82 мг малеиновой кислоты растворяли в 3 мл диоксана с получением раствора малеиновой кислоты в концентрации 0,1 моль/л. 026 мл раствора малеиновой кислоты в концентрации 0,1 моль/л добавляли к раствору икотиниба и реакционную смесь перемешивали в течение 24 часов, а затем выделяли полиморфную форму I.
Пример 8. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 7.
Пример 9. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 7.
Пример 10. Получение полиморфной формы I
5 г икотиниба гидрохлорида растворяли в смеси 20 мл THF и 15 мл воды и к этому раствору икотиниба гидрохлорида по каплям добавляли раствор 1,9 г карбоната калия в 10 мл воды при 50°С до тех пор, пока значение pH реакционной смеси не достигало 13. Реакционную смесь затем перемешивали в течение 1-2 часов перед охлаждением до комнатной температуры. Осадок фильтровали и промывали очищенной водой, а затем сушили в течение 8-10 часов в вакууме при температуре ниже 60°С с получением 4 г икотиниба.
Полиморфную форму I получали путем осуществления реакции раствора икотиниба с раствором малеиновой кислоты (молярное соотношение 1:1) в 2-бутаноне при комнатной температуре. Подробности процедуры были следующими: 10 мг икотиниба растворяли в 1 мл 2-бутанона с получением раствора икотиниба. 34,82 мг малеиновой кислоты растворяли в 3 мл 2-бутанона с получением раствора малеиновой кислоты в концентрации 0,1 моль/л. 0,26 мл раствора малеиновой кислоты в концентрации 0,1 моль/л добавляли к раствору икотиниба. Реакционную смесь перемешивали в течение 24 часов, а затем выделяли полиморфную форму I.
Пример 11. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 10.
Пример 12. Получение полиморфной формы I
Полиморфную форму I получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 10.
Пример 13. Получение полиморфной формы II
Полиморфную форму II получали путем осуществления реакции раствора икотиниба (из примера 1) с раствором малеиновой кислоты (молярное соотношение 1:1) в ацетоне при комнатной температуре в соответствии со следующими стадиями.
10 мг икотиниба растворяли в 1 мл ацетона. 34,82 мг малеиновой кислоты растворяли в 3 мл ацетона с получением раствора малеиновой кислоты в концентрации 0,1 моль/л. 0,26 мл раствора малеиновой кислоты в концентрации 0,1 моль/л добавляли к раствору икотиниба и реакционную смесь перемешивали в течение 24 часов с получением полиморфной формы II, а затем выделяли полиморфную форму II. Температура плавления полиморфной формы составляла 182-184°С.
Пример 14. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 13.
Пример 15. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 13.
Пример 16. Получение полиморфной формы II
Полиморф II получали таким же образом (молярное соотношение 1:1) и в соответствии с такой же процедурой, которая представлена в примере 13, за исключением того, что ацетон заменяли ацетонитрилом, а затем выделяли полиморфную форму II.
Пример 17. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 16.
Пример 18. Получение полиморфной формы II
Полиморфную форму II получали посредством изменения молярного соотношения малеиновой кислоты и икотиниба на 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 16.
Пример 19. Получение полиморфной формы II
Полиморф II получали получали таким же образом (молярное соотношение 1:1) и в соответствии с такой же процедурой, которая представлена в примере 13, за исключением того, что ацетон заменяли этанолом, а затем выделяли полиморфную форму II.
Пример 20. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 19.
Пример 21. Получение полиморфной формы II
Полиморфную форму II получали посредством изменения молярного соотношения малеиновой кислоты и икотиниба на 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 19.
Пример 22. Получение полиморфной формы II
Полиморф II получали таким же образом (молярное соотношение 1:1) и в соответствии с такой же процедурой, которая представлена в примере 13, за исключением того, что ацетон заменяли смесью H2O и THF (соотношение 1:19, об./об.), а затем выделяли полиморфную форму II.
Пример 23. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 2:1 вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 22.
Пример 24. Получение полиморфной формы II
Полиморфную форму II получали с использованием молярного соотношения малеиновой кислоты и икотиниба 1,5:1 (3:2) вместо 1:1, как в примере 1, следуя тем же условиям реакции, которые описаны в примере 22.
Пример 25. Фармакокинетическое исследование икотиниба гидрохлорида и полиморфной формы II икотиниба малеата
Лекарственные средства и реактивы: икотиниба гидрохлорид, используемый в данном исследовании, относился к кристаллической форме I, раскрытой в документе WO2010/003313. Полиморфную форму II икотиниба малеата и икотиниба гидрохлорид размалывали до мелких частиц. Содержание материала (чистота) составляло не менее чем 99,0%. Карбоксиметилцеллюлоза натрия имела степень чистоты, пригодную для медицинского применения.
Экспериментальные животные: крыс SD делили на группу икотиниба гидрохлорида и группу полиморфной формы II, причем обе группы состояли из самцов.
Приготовление фармацевтического средства: отвешивали количество каждого соединения, а затем добавляли карбоксиметилцеллюлозу натрия с получением в результате концентрации тестируемого соединения 0,5%. Затем добавляли смесь в твердом состоянии для приготовления из нее суспензии в конечной концентрации 10 мг/мл в воде.
Введение и сбор образцов: каждую суспензию вводили перорально крысам SD натощак в дозе, эквивалентной 35 мг/кг икотиниба при объеме дозы 5 мл/кг. 0,4 мл крови собирали в предварительно заполненные антикоагулянтом EDTA-K пробирки с временными интервалами 0,5, 1, 1,5, 2, 4, 6, 8 и 24 часов после введения тестируемого соединения, центрифугировали при 3000 об/мин в течение 10 минут и 120 мкл плазмы собирали и хранили в холодильнике.
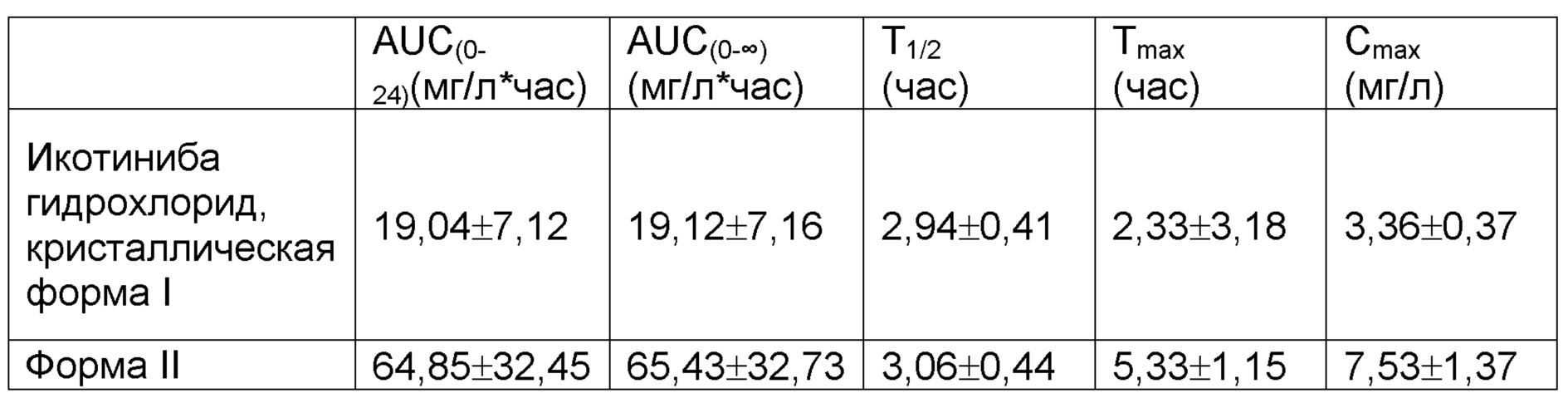
Образцы анализировали с помощью высокоэффективной жидкостной хроматографии. В хроматографии использовали C18-силан-связанный диоксид кремния в качестве неподвижной фазы, 0,02 моль/л дигидрофосфата натрия в ацетонитриле (40:60, с использованием раствора гидроксида натрия для доведения pH до 5,0) в качестве подвижной фазы и выявление при длине волны 334 нм. Сравнение PK профиля для полиморфной формы II икотиниба малеата и кристаллической формы I икотиниба гидрохлорида кратко изложено в таблице 1 и на фигуре 3. Полиморфная форма II икотиниба малеата показывала более высокую биодоступность, нежели кристаллическая форма I икотиниба гидрохлорида.
Таблица 1
Пример 26. Состав для твердой гелевой капсулы
В конкретном варианте осуществления пероральной композиции примерно 100 мг полиморфной формы из примеров 1-24 составляют с достаточно тонкодисперсной лактозой с получением общего количества от приблизительно 580 мг до приблизительно 590 мг для заполнения твердой гелевой капсулы размера 0.
Хотя настоящее изобретение было полно описано применительно к вариантам его осуществления со ссылкой на прилагаемые графические материалы, следует заметить, что различные изменения и модификации будут очевидны для специалистов в данной области. Такие изменения и модификации следует считать включенными в объем настоящего изобретения, который определяется прилагаемой формулой изобретения.