Результат интеллектуальной деятельности: СТАБИЛИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ АНАЛОГОВ ИНСУЛИНА И/ИЛИ ПРОИЗВОДНЫЕ ИНСУЛИНА
Вид РИД
Изобретение
ВВЕДЕНИЕ
Настоящее изобретение относится к фармацевтическому составу по меньшей мере одного аналога инсулина и/или производного инсулина, к способу получения фармацевтического состава по меньшей мере одного аналога инсулина и/или производного инсулина, и к соответствующему набору. Оно также относится к фармацевтическому составу по меньшей мере одного аналога инсулина и/или производного инсулина и к соответствующему набору для использования в лечении сахарного диабета, гипергликемии, и/или для использования в снижении уровней глюкозы в крови. Настоящее изобретение также относится к применению медицинского устройства для введения фармацевтического состава по меньшей мере одного аналога инсулина и/или производного инсулина животному и/или человеку.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
Сахарный диабет представляет собой нарушение метаболизма, при котором способность утилизировать глюкозу более или менее полностью утрачена.
В течение десятилетий инсулин использовали для лечения сахарного диабета. Разработано несколько составов инсулина, например, суспензия инсулина с цинком (Zn (II)), составы, содержащие протамин и т.д. Кроме того, собственно активный фармацевтический ингредиент инсулин модифицировали посредством разработки быстро действующих аналогов инсулина (например, инсулина аспарт, инсулина лизпро, инсулина глулизин) и длительно действующих аналогов и производных инсулина (например, инсулина детемир, инсулина деглюдек, инсулина гларгин). Быстро действующие препараты инсулина, как правило, представляют собой растворы инсулина, в то время как длительно действующие препараты инсулина могут представлять собой суспензии, содержащие инсулин в кристаллической и/или аморфной форме, преципитированный посредством добавления солей цинка (Zn(II)) (например, хлорида цинка) отдельно или посредством добавления протамина или посредством комбинации обоих.
Химическая и физическая стабильность составов инсулина является очень важной. Составы инсулина часто вводят с использованием устройств-ручек для инъекции или инсулиновых насосов, в которых состав инсулина сохраняют в картриджах, пока целый картридж не опустеет. Составы инсулина можно также сохранять во флаконах, что требует стабильного состава по отношению к химической и физической стабильности на протяжении срока хранения состава.
Химическая и/или физическая стабильность инсулина, аналогов инсулина и/или производных инсулина сильно зависит от фармацевтического состава, например, растворителя, значения pH и наполнителей. В Brange et al. (Acta Pharm. Nord. 4(3), pp. 149-158, 1992) описаны некоторые аспекты в связи с химической стабильностью инсулина. В WO 2004/080480 описаны фармацевтические препараты, содержащие стабилизированный кислотой инсулин. В GB 835638 описаны суспензии кристаллического инсулина, обладающие длительным эффектом. В WO 98/56406 описаны стабильные составы инсулина. В US 6489292 описаны стабильные водные препараты инсулина без фенола и крезола. В US 6211144 описаны стабильные концентрированные препараты инсулина для доставки в легкие. В Bhatt et al. (Pharmaceutical Research, Vol. 7, No. 6, pp. 593-599, 1990) описаны химические пути деградации пептидов. В Patel et al. (Pharmaceutical Research, Vol. 7, No. 7, pp. 703-711, 1990) описаны химические пути деградации пептидов. В Tyler-Cross et al. (Journal of Biological Chemistry, Vol. 266, No. 33, Issue of November 25, pp. 22549-22556, 1991) описаны эффекты аминокислотной последовательности, буферов и ионной силы на скорость и механизм дезамидирования остатков аспарагина в небольших пептидах. В GB 840870 описаны улучшения в препаратах инсулина или относящиеся к препаратам инсулина. В US 6852694 описаны стабилизированные составы инсулина. В Galloway et al. (Diabetes - The Journal of the American Diabetes Association, Vol. 21, No. Suppl.2, pp. 637-648, 1972) описаны новые формы инсулина. В Jackson et al. описаны некоторые аспекты по отношению к нейтральному обычному инсулину (Diabetes - The Journal of the American Diabetes Association, Vol. 21, No. 4, pp. 235-245, 1972). В Lill (Pharmazie in unserer Zeit, No. 1, pp. 56-61, 2001) описаны некоторые аспекты в связи с составами инсулина. В Германской спецификации препарата лекарственного средства Berlinsulin® H Normal 3 mL Pen описан состав, содержащий инсулин человека, метакрезол, глицерин, воду и необязательно, соляную кислоту и гидроксид натрия. В Германской спецификации препарата лекарственного средства Actrapid® описан состав, содержащий инсулин человека, хлорид цинка, глицерин, метакрезол, гидроксид натрия, соляную кислоту и воду.
Растворимость инсулина, аналогов инсулина и/или производных инсулина в водной среде зависит от значения pH. Например, наиболее низкая растворимость показана близко к изоэлектрической точке, которая для инсулина человека составляет приблизительно pH 5,3 и 5,4. Очень хорошую растворимость можно наблюдать при значениях pH ниже 4 и выше 7. Однако инсулин страдает от деградации в сильно кислых условиях и сильно щелочных условиях. Таким образом, большинство из лекарственных средств, содержащих инсулин, аналоги инсулина и/или производные инсулина, обладают значением pH в диапазоне 7,2-7,4, и большинство забуферивающих средств используют для достижения и поддержания pH в пределах этого диапазона.
В настоящее время неожиданно обнаружено, что для альтернативного водного фармацевтического состава, содержащего по меньшей мере один аналог инсулина и/или производное инсулина, содержащие хлорид натрия, без какого-либо дополнительного забуферивающего средства, показана отличная химическая и физическая стабильность, что квалифицирует этот водный фармацевтический состав как лекарственное средство, обладающее определенным сроком хранения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из вариантов осуществления настоящего изобретения относится к фармацевтическому составу, содержащему
(a). по меньшей мере один аналог и/или производное инсулина; и
(b). Zn(II); и
(c). хлорид натрия; и
(d). необязательно, протамин;
где фармацевтический состав обладает значением pH в диапазоне от 6,0 до 9,0 и является свободным от какого-либо дополнительного забуферивающего средства.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением представляет собой водную фармацевтическую композицию.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением не содержит никакого дополнительного забуферивающего средства.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением не содержит никакого дополнительного забуферивающего средства, отличного от по меньшей мере одного аналога и/или производного инсулина и необязательно присутствующего протамина.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением является свободным от какого-либо дополнительного забуферивающего средства, выбранного из группы, состоящей из 2-амино-2-гидроксиметил-пропан-1,3-диола (TRIS), фосфата, лимонной кислоты или солей цитратов, уксусной кислоты и ее солей, глицилглицина и метионина.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением не содержит какого-либо дополнительного забуферивающего средства, выбранного из группы, состоящей из 2-амино-2-гидроксиметил-пропан-1,3-диола (TRIS), фосфата, лимонной кислоты или солей цитратов, уксусной кислоты и ее солей, глицилглицина и метионина.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит по меньшей мере один аналог и/или производное инсулина и необязательно, протамин, где единственным компонентом, вносящим вклад в какую-либо забуферивающую активность, является по меньшей мере один аналог и/или производное инсулина и необязательно, протамин.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит по меньшей мере один аналог и/или производное инсулина и необязательно, протамин, где общая концентрация любого забуферивающего средства по настоящему изобретению лежит в диапазоне от 3,496 мг/мл (округленно: 3,5 мг/мл) до 3,996 мг/мл (округленно: 4,0 мг/мл), от 3,496 мг/мл (округленно: 3,5 мг/мл) до 3,816 мг/мл (округленно: 3,8 мг/мл) или общая концентрация любого забуферивающего средства по настоящему изобретению составляет 3,496 мг/мл (округленно: 3,5 мг/мл).
В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением состоит из (a). по меньшей мере одного аналога и/или производного инсулина; и (b). Zn(II); и (c). хлорида натрия; и (d). необязательно, протамина; и (e). метакрезола; (f). фенола; и (g). полисорбата 20; и (h). гидроксида натрия и/или соляной кислоты для доведения pH до значения pH в диапазоне от 6,0 до 9,0; и (i). воды.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением представляет собой водный фармацевтический состав.
В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением содержит по меньшей мере один аналог и/или производное инсулина, обладающий или обладающие изоэлектрической точкой (IEP) в диапазоне от 4,0 до 6,0, от 4,5 до 6,0, от 4,5 до 5,5, от 5,0 до 5,5, от 5,0 до 5,2 или 5,1.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением обладает значением pH в диапазоне от 6,5 до 8,5, в диапазоне от 7,0 до 8,0, от 7,0 до 7,8, от 7,1 до 7,6, 7,2, 7,3, 7,4 или 7,5, или 7,4.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит по меньшей мере один аналог инсулина, выбранный из группы, состоящей из инсулина аспарт, инсулина лизпро и/или инсулина глулизин. В одном варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит аналог инсулина, представляющий собой инсулин лизпро. В одном варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит аналог инсулина, представляющий собой инсулин аспарт. В одном варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит аналог инсулина, представляющий собой инсулин глулизин.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит производное инсулина, выбранное из группы, состоящей из инсулина детемир и/или инсулина деглюдек. В одном варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит производное инсулина, представляющее собой инсулин детемир. В одном варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит производное инсулина, представляющее собой инсулин деглюдек.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит по меньшей мере один аналог и/или производное инсулина, присутствующие в концентрации от 10 ед./мл до 1000 ед./мл, от 10 ед./мл до 600 ед./мл, от 10 ед./мл до 300 ед./мл, от 50 ед./мл до 300 ед./мл или 100 ед./мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит аналог и/или производное инсулина, присутствующие в концентрации от 60 до 6000 нмоль/мл, от 60 нмоль/мл до 3600 нмоль/мл, от 60 нмоль/мл до 1800 нмоль/мл, от 300 нмоль/мл до 1800 нмоль/мл или 600 нмоль/мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит Zn(II), присутствующий в концентрации от 0,0100 мг/мл до 0,0600 мг/мл, от 0,0150 мг/мл до 0,0500 мг/мл, от 0,0150 мг/мл до 0,0300 мг/мл, от 0,0150 мг/мл до 0,0200 мг/мл, от 0,0190 мг/мл до 0,0200 мг/мл или 0,0196 мг/мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит Zn(II), присутствующий в концентрации от 0,0100 мг/100 ед. до 0,0600 мг/100 ед., от 0,0150 мг/100 ед. до 0,0500 мг/100 ед., от 0,0150 мг/100 ед. до 0,0300 мг/100 ед., от 0,0150 мг/100 ед. до 0,0200 мг/100 ед., от 0,0190 мг/100 ед. до 0,0200 мг/100 ед. или 0,0196 мг/100 ед.
В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением содержит хлорид натрия, присутствующий в концентрации от 0,01 мг/мл до 15 мг/мл, от 0,1 мг/мл до 15 мг/мл, от 0,1 мг/мл до 10 мг/мл, от 1 мг/мл до 10 мг/мл, от 2,0 мг/мл до 10 мг/мл, от 3,0 мг/мл до 9,0 мг/мл, от 4,0 мг/мл до 9,0 мг/мл, от 5,0 мг/мл до 9,0 мг/мл, от 6,0 мг/мл до 9,0 мг/мл, от 6,8 мг/мл до 8,3 мг/мл, 6,9 мг/мл, 7,0 мг/мл, 7,1 мг/мл, 7,2 мг/мл, 7,3 мг/мл, 7,4 мг/мл, 7,5 мг/мл, 7,6 мг/мл, 7,7 мг/мл, 7,8 мг/мл, 7,9 мг/мл, 8,0 мг/мл, 8,1 мг/мл, 8,2 мг/мл или 8,3 мг/мл, или 6,8 мг/мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит протамин или сульфат протамина, присутствующие в концентрации от 0,10, 0,15, 0,20, 0,25, 0,30, 0,32, 0,35, 0,40, 0,45 или 0,5 мг/мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит стабилизатор, представляющий собой в одном варианте осуществления поверхностно-активное вещество, полиоксиэтиленовое производное монолаурата сорбитана (например, полисорбат 20), полиэтоксиэтиленовое производное олеиновой кислоты (например, полисорбат 80), полоксамер (представляющий собой сополимер полиоксиэтилен-полиоксипропилен) или полисорбат 20, или полисорбат 80, или их смеси. В другом варианте осуществления стабилизатор, в одном варианте осуществления поверхностно-активное вещество, полиоксиэтиленовое производное монолаурата сорбитана (например, полисорбат 20), полиэтоксиэтиленовое производное олеиновой кислоты (например, полисорбат 80), полоксамер (представляющий собой сополимер полиоксиэтилен-полиоксипропилен) и другой полисорбат 20 или полисорбат 80, или их смеси присутствует/присутствуют в концентрации от 0,01 до 0,05 мг/мл, 0,010 мг/мл, 0,015 мг/мл, 0,020 мг/мл, 0,025 мг/мл, 0,03 мг/мл или 0,02 мг/мл.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит более одного аналога и/или производного инсулина, где одни аналог и/или производное инсулина представляет собой быстро действующий инсулин, и один аналог и/или производное инсулина представляет собой длительно действующий инсулин. В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит быстро действующий инсулин, выбранный из группы, содержащей инсулин аспарт, инсулин лизпро и/или инсулин глулизин, и длительно действующий инсулин, выбранный из группы, содержащей инсулин гларгин, инсулин детемир и/или инсулин деглюдек.
В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением содержит один или несколько дополнительных активных фармацевтических ингредиентов. В одном варианте осуществления дополнительный активный фармацевтический ингредиент представляет собой противодиабетическое средство. В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит одно или несколько противодиабетических средств в качестве дополнительных активных фармацевтических ингредиентов, выбранных из группы, содержащей: агонисты рецептора GLP-1, двойные агонисты рецептора GLP-1/рецептора глюкагона, FGF-21 человека, аналоги FGF-21, производные FGF-21, инсулины, инсулин человека, аналоги инсулина и производные инсулина. В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением содержит один или несколько дополнительных активных фармацевтических ингредиентов, выбранных из группы, содержащей: инсулин и производные инсулина, GLP-1, аналоги GLP-1 и агонисты рецептора GLP-1, связанные с полимером аналоги GLP-1 и GLP-1, двойные агонисты GLP1/GIP, двойные агонисты рецепторов GLP1/глюкагона, PYY3-36 или его аналоги, панкреатический полипептид или его аналоги, агонисты или антагонисты рецептора глюкагона, агонисты или антагонисты рецептора GIP, антагонисты или обратные агонисты грелина, ксенин и его аналоги, ингибиторы DDP-IV, ингибиторы SGLT2, двойные ингибиторы SGLT2/SGLT1, бигуаниды тиазолидиндионы, двойные агонисты PPAR, сульфонилмочевины, меглитиниды, ингибиторы альфа-глюкозидазы, амилин и аналоги амилина, агонисты GPR119, агонисты GPR40, агонисты GPR120, агонисты GPR142, системные или низкоадсорбируемые агонисты TGR5, циклозет, ингибиторы 11-бета-HSD, активаторы глюкокиназы, ингибиторы DGAT, ингибиторы протеинтирозинфосфатазы 1, ингибиторы глюкоза-6-фосфатазы, ингибиторы фруктозо-1,6-бисфосфатазы, ингибиторы гликоген-фосфорилазы, ингибиторы фосфоенолпируваткарбоксикиназы, ингибиторы киназы синтазы гликогена, ингибиторы киназы пируват-дегидрогеназы, альфа2-антагонисты, антагонисты CCR-2, модуляторы транспортера-4 глюкозы, агонисты рецептора 3 соматостатина, ингибиторы HMG-CoA-редуктазы, фибраты, никотиновую кислоту и ее производные, агонисты рецептора 1 никотиновой кислоты, агонисты или модуляторы PPAR-альфа, гамма или альфа/гамма), агонисты PPAR-дельта, ингибиторы ACAT, ингибиторы абсорбции холестерина, связывающие желчную кислоту вещества, ингибиторы IBAT, ингибиторы MTP, модуляторы PCSK9, повышающие регуляторы рецептора LDL посредством избирательных для печени агонистов β-рецепторов гормонов щитовидной железы, повышающие уровень HDL соединения, модуляторы метаболизма липидов, ингибиторы PLA2, энхансеры ApoA-I, ингибиторы синтеза холестерина, модуляторы метаболизма липидов, омега-3 жирные кислоты и их производные, активные вещества для лечения ожирения, такие как сибутамин, тезофензин, орлистат, антагонисты рецептора CB-1, антагонисты MCH-1, агонисты и частичные агонисты рецептора MC4, антагонисты NPY5 или NPY2, агонисты NPY4, бета-3-агонисты, лептин или миметики лептина, агонисты рецептора 5HT2c, или комбинации бупропиона/налтрексона (CONTRAVE), бупропиона/зонизамида (EMPATIC), бупропиона/фентермина или прамлинтида/метрелептина, QNEXA (фентермин+топирамат), ингибиторы липазы, ингибиторы ангиогенеза, антагонисты H3, ингибиторы AgRP, тройные ингибиторы поглощения моноамина (норадреналин и ацетилхолин), ингибиторы MetAP2, назальный состав блокатора кальциевых каналов дилтиазема, антисмысловые олигонуклеотиды против продукции рецептора 4 фактора роста фибробластов, нацеленный на прохибитин пептид-1, лекарственные средства для влияния на высокое кровяное давление, хроническую сердечную недостаточность или атеросклероз, такие как антагонисты рецептора ангиотензина II, ингибиторы ACE, ингибиторы ECE, диуретики, бета-блокаторы, антагонисты кальция, гипертензивные средства центрального действия, антагонисты альфа-2-адренергического рецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением содержит более одного аналога и/или производного инсулина, где один аналог и/или производное инсулина представляет собой быстро действующий инсулин, и один аналог и/или производное инсулина представляет собой длительно действующий инсулин. В другом варианте осуществления быстро действующий инсулин выбран из группы, содержащей инсулин аспарт, инсулин лизпро и/или инсулин глулизин, и длительно действующий инсулин выбран из группы, содержащей инсулин детемир и/или инсулин деглюдек.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением состоит из (a). 3,496 мг/мл инсулина аспарт (округленно: 3,5 мг/мл); и (b). 1,72 мг/мл метакрезола; и (c). 1,50 мг/мл фенола; и (d). 0,04087 мг/мл Zn(II); и (e). 6,8 мг/мл хлорида натрия; и (f). 0,02 мг/мл полисорбата 20; и (g). гидроксида натрия и/или соляной кислоты для доведения pH до 7,4 и (h). воды.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением состоит из (a). 3,496 мг/мл инсулина аспарт (округленно: 3,5 мг/мл); и (b). 1,72 мг/мл метакрезола; и (c). 1,50 мг/мл фенола; и (d). 0,04087 мг/мл Zn(II); и (e). от 6,8 мг/мл до 8,3 мг/мл хлорида натрия; (f). 0,02 мг/мл полисорбата 20; (g) от 0,1 мг/мл до 0,5 мг/мл сульфата протамина; и (h). гидроксида натрия и/или соляной кислоты для доведения pH до pH в диапазоне от 7,1 до 7,6 и (i). воды.
В другом варианте осуществления фармацевтический состав в соответствии с настоящим изобретением состоит из (a). 3,496 мг/мл инсулина аспарт (округленно: 3,5 мг/мл); и (b). 1,72 мг/мл метакрезола; и (c). 1,50 мг/мл фенола; и (d). 0,04087 мг/мл Zn(II); и (e). 6,8 или 6,9, или 7,0, или 7,1, или 7,2, или 7,3, или 7,4, или 7,5, или 7,6, или 7,7, или 7,8, или 7,9, или 8,0, или 8,1, или 8,2, или 8,3 мг/мл хлорида натрия; (f). 0,02 мг/мл полисорбата 20; (g) 0,1 или 0,15, или 0,2, или 0,25, или 0,3, или 0,32, или 0,35, или 0,4, или 0,45, или 0,5 мг/мл сульфата протамина; и (h). гидроксида натрия и/или соляной кислоты для доведения pH до 7,4 и (i). воды.
Настоящее изобретение также относится к фармацевтическому составу для использования в лечении сахарного диабета, гипергликемии и/или для использовании в снижении уровней глюкозы в крови.
Настоящее изобретение также относится к способу получения фармацевтического состава в соответствии с настоящим изобретением, где компоненты смешивают вместе в форме раствора или суспензии, доводят до желательного pH, и смесь доводят до конечного объема с помощью воды.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением и медицинское устройство. В одном варианте осуществления медицинское устройство выбрано из группы, содержащей: шприц, систему для инъекции инсулина, систему для инфузии инсулина, инсулиновый насос, устройство-ручку для инъекции инсулина.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство. В одном варианте осуществления медицинское устройство выбрано из группы, содержащей: шприц, систему для инъекции инсулина, систему для инфузии инсулина, инсулиновый насос, устройство-ручку для инъекции инсулина.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство, где дополнительный активный фармацевтический ингредиент представляет собой противодиабетическое средство.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство, где дополнительный активный фармацевтический ингредиент представляет собой противодиабетическое средство, выбранное из группы, содержащей: агонисты рецептора GLP-1, двойные агонисты рецептора GLP-1/рецептора глюкагона, FGF-21 человека, аналоги FGF-21, производные FGF-21, инсулины, инсулин человека, аналоги инсулина, и производные инсулина. В другом варианте осуществления, фармацевтический состав в соответствии с настоящим изобретением содержит один или несколько дополнительных активных фармацевтических ингредиентов, выбранных из группы, содержащей: инсулин и производные инсулина, GLP-1, аналоги GLP-1 и агонисты рецептора GLP-1, связанные с полимером аналоги GLP-1 и GLP-1, двойные агонисты GLP1/GIP, двойные агонисты рецепторов GLP1/глюкагона, PYY3-36 или его аналоги, панкреатический полипептид или его аналоги, агонисты или антагонисты рецептора глюкагона, агонисты или антагонисты рецептора GIP, антагонисты или обратные агонисты грелина, ксенин и его аналоги, ингибиторы DDP-IV, ингибиторы SGLT2, двойные ингибиторы SGLT2/SGLT1, бигуаниды тиазолидиндионы, двойные агонисты PPAR, сульфонилмочевины, меглитиниды, ингибиторы альфа-глюкозидазы, амилин и аналоги амилина, агонисты GPR119, агонисты GPR40, агонисты GPR120, агонисты GPR142, системные или низкоадсорбируемые агонисты TGR5, циклозет, ингибиторы 11-бета-HSD, активаторы глюкокиназы, ингибиторы DGAT, ингибиторы протеинтирозинфосфатазы 1, ингибиторы глюкоза-6-фосфатазы, ингибиторы фруктозо-1,6-бисфосфатазы, ингибиторы гликоген-фосфорилазы, ингибиторы фосфоенолпируваткарбоксикиназы, ингибиторы киназы синтазы гликогена, ингибиторы киназы пируват-дегидрогеназы, альфа2-антагонисты, антагонисты CCR-2, модуляторы транспортера-4 глюкозы, агонисты рецептора 3 соматостатина, ингибиторы HMG-CoA-редуктазы, фибраты, никотиновую кислоту и ее производные, агонисты рецептора 1 никотиновой кислоты, агонисты или модуляторы PPAR-альфа, гамма или альфа/гамма), агонисты PPAR-дельта, ингибиторы ACAT, ингибиторы абсорбции холестерина, связывающие желчную кислоту вещества, ингибиторы IBAT, ингибиторы MTP, модуляторы PCSK9, повышающие регуляторы рецептора LDL посредством избирательных для печени агонистов β-рецепторов гормонов щитовидной железы, повышающие уровень HDL соединения, модуляторы метаболизма липидов, ингибиторы PLA2, энхансеры ApoA-I, ингибиторы синтеза холестерина, модуляторы метаболизма липидов, омега-3 жирные кислоты и их производные, активные вещества для лечения ожирения, такие как сибутамин, тезофензин, орлистат, антагонисты рецептора CB-1, антагонисты MCH-1, агонисты и частичные агонисты рецептора MC4, антагонисты NPY5 или NPY2, агонисты NPY4, бета-3-агонисты, лептин или миметики лептина, агонисты рецептора 5HT2c, или комбинации бупропиона/налтрексона (CONTRAVE), бупропиона/зонизамида (EMPATIC), бупропиона/фентермина или прамлинтида/метрелептина, QNEXA (фентермин+топирамат), ингибиторы липазы, ингибиторы ангиогенеза, антагонисты H3, ингибиторы AgRP, тройные ингибиторы поглощения моноамина (норадреналин и ацетилхолин), ингибиторы MetAP2, назальный состав блокатора кальциевых каналов дилтиазема, антисмысловые олигонуклеотиды против продукции рецептора 4 фактора роста фибробластов, нацеленный на прохибитин пептид-1, лекарственные средства для влияния на высокое кровяное давление, хроническую сердечную недостаточность или атеросклероз, такие как антагонисты рецептора ангиотензина II, ингибиторы ACE, ингибиторы ECE, диуретики, бета-блокаторы, антагонисты кальция, гипертензивные средства центрального действия, антагонисты альфа-2-адренергического рецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство, где набор содержит более одного аналога и/или производного инсулина, где один аналог и/или производное инсулина представляет собой быстро действующий инсулин, и один аналог и/или производное инсулина представляет собой длительно действующий инсулин. В одном варианте осуществления быстро действующий инсулин выбран из группы, содержащей инсулин аспарт, инсулин лизпро и/или инсулин глулизин, и где длительно действующий инсулин выбран из группы, содержащей инсулин гларгин, инсулин детемир и/или инсулин деглюдек.
Настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство для использования в лечении сахарного диабета, гипергликемии и/или для использования для снижения уровней глюкозы в крови.
В другом варианте осуществления, настоящее изобретение также относится к набору или комбинации, содержащим отдельные упаковки фармацевтического состава в соответствии с настоящим изобретением, по меньшей мере одного дополнительного активного фармацевтического ингредиента и необязательно, медицинское устройство, где фармацевтический состав в соответствии с настоящим изобретением и дополнительный активный фармацевтический ингредиент, в одном варианте осуществления противодиабетическое средство, вводят непрерывно, отдельно, последовательно и/или ступенчато.
Настоящее изобретение также относится к применению медицинского устройства для введения фармацевтического состава животному и/или человеку. В одном варианте осуществления медицинское устройство выбрано из группы, содержащей: шприц, систему для инъекции инсулина, систему для инфузии инсулина, инсулиновый насос, устройство-ручку для инъекции инсулина.
ПОДРОБНОЕ ОПИСАНИЕ
Как применяют в настоящем документе, формы единственного числа «a», «an», и «the» включают в себя ссылки на множественное число, если контекст явно не требует иного. Таким образом, например, ссылка на наполнитель, содержащий «носитель», включает в себя один или несколько носителей, ссылка на «добавку» включает в себя ссылку на одну или несколько таких добавок.
Как применяют в настоящем документе, термин «активный фармацевтический ингредиент» (API) включает в себя любое фармацевтически активное химическое или биологическое соединение и любую его фармацевтически приемлемую соль, и любую их смесь, которое обеспечивает некоторый фармакологический эффект, и которое используют для лечения или предотвращения состояния. Иллюстративные фармацевтически приемлемые соли включают в себя соли соляной, серной, азотной, фосфорной, бромистоводородной, малеиновой, яблочной, аскорбиновой, лимонной, виннокаменной, памовой, лауриновой, стеариновой, пальмитиновой, олеиновой, миристиновой, лаурилсерной, нафталинсульфоновой, линолевой, линоленовой кислоты, и т.п. Как применяют в настоящем документе, термины «активный фармацевтический ингредиент», «лекарственное средство», «активное средство», «активный ингредиент», «активное вещество» и «лекарственное средство» предназначены, чтобы являться синонимами, т.е., обладают идентичным значением.
В одном варианте осуществления активный фармацевтический ингредиент представляет собой противодиабетическое средство. Примеры противодиабетических средств обнаружены в Rote Liste 2012, chapter 12. Примеры противодиабетических средств включают в себя, но без ограничения, (a) инсулин, аналоги инсулина и производные инсулина, (b) глюкагоноподобный пептид 1 (GLP-1) и его аналоги и агонисты рецептора, (c) двойные агонисты GLP-1/GIP, и (d) двойные агонисты рецептора GLP-1/глюкагона, как подробно описано ниже.
(a). Инсулин, аналоги инсулина и производные инсулина
Примеры инсулина, аналогов инсулина и производных инсулина включают в себя, но без ограничения инсулин гларгин (Lantus®), инсулин глулизин (Apidra®), инсулин детемир (Levemir®), инсулин лизпро (Humalog®/Liprolog®), инсулин деглюдек (Tresiba®), инсулин аспарт (NovoLog®/NovoRapid®), базальный инсулин и аналоги (например, LY2605541, LY2963016), пэгилированный инсулин лизпро, Humulin®, Linjeta®, SuliXen®, NN1045, инсулин плюс Symlin®, быстродействующие и коротко действующие инсулины (например, Linjeta®, инсулин PH20, NN1218, HinsBet®), пероральный, пригодный для ингаляций, чрескожный и подъязычный инсулины (например, Exubera®, Nasulin®, Afrezza®, инсулин трегопил, TPM -02/Инсулин, Capsulin®, Oral-lyn®, Cobalamin® пероральный инсулин, ORMD-0801, NN1953, VIAtab®). Кроме того, включены также производные инсулина, связанные с альбумином или другим белком посредством бифункционального линкера.
(b). Глюкагоноподобный пептид 1 (GLP-1), аналоги GLP-1 и агонисты рецептора GLP-1
Примеры GLP-1, аналогов GLP-1 и агонистов рецептора GLP-1 включают в себя, но без ограничения ликсисенатид (AVE0010/ZP10/Lyxumia®), эксенатид/эксендин-4 (Byetta®/Bydureon®/ITCA 650, лираглутид/Victoza®), семаглутид, таспоглутид, альбиглутид, дулаглутид, р-эксендин-4, CJC-1134-PC, PB-1023, TTP-054, HM-11260C, CM-3, GLP-1 элиген, ORMD-0901, NN9924, нодексен, виадор-GLP-1, CVX-096, ZYOG-1, ZYD-1, MAR-701, ZP-2929, ZP-3022, CAM-2036, DA-15864, ARI-2651, ARI-2255, эксенатид-XTEN и глюкагон-XTEN, AMX-8089+VRS-859 и связанные с полимером аналоги GLP-1 и GLP-1.
(c). Двойные агонисты GLP-1/зависимых от глюкозы инсулинотропных пептидов (GIP)
Примеры двойных агонистов GLP-1/GIP включают в себя, но без ограничения, MAR701, MAR-709, BHM081/BHM089/BHM098).
(d). Двойные агонисты рецепторов GLP-1/глюкагона
Примеры двойных агонистов рецепторов GLP-1/глюкагона включают в себя, но без ограничения, OAP-189 (PF-05212389, TKS-1225), TT-401/402, ZP2929, LAPS-HMOXM25, MOD-6030).
Другие пригодные активные фармацевтические ингредиенты, которые можно включать в фармацевтические составы по изобретению, включают в себя, но без ограничения, следующие:
Дополнительные желудочно-кишечные пептиды, такие как пептид YY 3-36 (PYY3-36) или его аналоги, и панкреатический полипептид (PP) или его аналоги.
Агонисты или антагонисты рецептора глюкагона, агонисты или антагонисты рецептора GIP, антагонисты или обратные агонисты грелина, и ксенин и его аналоги.
Ингибиторы дипептидил-пептидазы-IV (DPP-4), например: алоглиптин/Nesina®, линаглиптин/BI-1356/Ondero®/Trajenta®/Tradjenta®/Trayenta®, саксаглиптин/Onglyza®, ситаглиптин/Januvia®/Xelevia®/Tesavel®, ситаглиптин+метформин/Janumet®/Velmetia®, вилдаглиптин, анаглиптин, аемиглиптин, тенеглиптин, мелоглиптин, трелаглиптин, DA-1229, MK-3102, KM-223, KRP-104 и Ari-2243.
Ингибиторы натрий-зависимого транспортера 2 глюкозы (SGLT2), например: канаглифлозин, дапаглифлозин, ремоглифлозин, серглифлозин, эмпаглифлозин, ипраглифлозин, тофоглифлозин (RO-4998452), лусеоглифлозин, LX-4211, эртуглифлозин (PF-04971729), EGT-0001442 и DSP-3235.
Двойные ингибиторы SGLT2/SGLT1.
Бигуаниды (например, метформин, буформин, фенформин), тиазолидиндионы (например, пиоглитазон, ривоглитазон, розиглитазон, троглитазон), двойные агонисты PPAR (например, алеглитазар, мураглитазар, тезаглитазар), сульфонилмочевины (например, толбутамид, глибенкламид, глимепирид/Amaryl®, глипизид), меглитиниды (например, натеглинид, репаглинид, митиглинид), ингибиторы альфа-глюкозидазы (например, акарбоза, миглитол, воглибоза), амилин и аналоги амилина (например, прамлинтид/Symlin®).
Агонисты сопряженного с G-белком рецептора 119 (GPR119) (например, GSK-1292263, PSN-821, MBX-2982, APD-597, ARRY-981).
Агонисты GPR40 (например, TAK-875, TUG-424, P-1736, JTT-851, GW9508).
Агонисты GPR120 и агонисты GPR142.
Системные или низкоадсорбируемые агонисты TGR5 (GPBAR1=сопряженного с G-белком рецептор 1 желчной кислоты) (например, INT-777, XL-475, SB756050).
Бромкриптин/Cycloset®, ингибиторы 11-бета-гидроксистероид-дегидрогеназы (11-бета-HSD) (например, LY2523199, BMS770767, RG-4929, BMS816336, AZD-8329, HSD-016, BI-135585), активаторы глюкокиназы (например, PF-04991532, TTP-399, GK1-399, ARRY-403 (AMG-151), TAK-329, ZYGK1), ингибиторы диацилглицерин-O-ацилтрансферазы (DGAT) (например, прадигастат (LCQ-908), LCQ-908), ингибиторы протеинтирозинфосфатазы 1 (например, тродусквемин), ингибиторы глюкоза-6-фосфатазы, ингибиторы фруктозо-1,6-бисфосфатазы, ингибиторы гликоген-фосфорилазы, ингибиторы фосфоенолпируваткарбоксикиназы, ингибиторы киназы синтазы гликогена, ингибиторы киназы пируват-дегидрогеназы, антагонисты адренергического рецептора альфа2, антагонисты рецептора типа 2 C-C хемокинов (CCR-2), модуляторы транспортера-4 глюкозы и агонисты рецептора 3 соматостатина (например, MK-4256).
Одно или несколько снижающих уровень липидов средств также являются пригодными в качестве активных фармацевтических ингредиентов, например, такие как: ингибиторы 3-гидрокси-3-метилглутарил-кофермент-A-редуктазы (HMG-CoA-редуктазы) (например, симвастатин, аторвастатин, розувастатин), фибраты (например, безафибрат, фенофибрат), никотиновая кислота и ее производные (например, ниацин, включая составы ниацина с замедленным высвобождением), агонисты рецептора 1 никотиновой кислоты (например, GSK-256073), агонисты или модуляторы активируемых пролифератором пероксисом рецепторов (PPAR-)(альфа, гамма или альфа/гамма) (например, алеглитазар), агонисты PPAR-дельта, ингибиторы ацетил-CoA-ацетилтрансферазы (ACAT) (например, авазимиб), ингибиторы абсорбции холестерина (например, эзетимиб), связывающие желчную кислоту вещества (например, холестирамин, колесевилам), ингибиторы транспорта желчной кислоты в повздошной кишке (IBAT) (например, GSK-2330672), ингибиторы микросомального белка-переносчика триглицеридов (MTP) (например, ломитапид (AEGR-733), SLx-4090, гранотапид), модуляторы пробелка конвертазы субтилизин/кексин типа 9 (PCSK9) (например, REGN727/SAR236553, AMG-145, LGT-209, PF-04950615, MPSK3169A, LY3015014, ALD-306, ALN-PCS, BMS-962476, SPC5001, ISIS-394814, 1B20, LGT-210, 1D05, BMS-PCSK9Rx-2, SX-PCK9, RG7652), повышающие регуляторы рецептора LDL, например, избирательные для печени агонисты рецепторов бета гормонов щитовидной железы (например, эпротиром (KB-2115), MB07811, зобетиром (QRX-431), VIA-3196, ZYT1), повышающие уровень HDL соединения, такие как: ингибиторы CETP (например, торцетрапиб, анацетрапиб (MK0859), далцетрапиб, эвацетрапиб, JTT-302, DRL-17822, TA-8995, R-1658, LY-2484595) или регуляторы ABC1, модуляторы метаболизма липидов (например, BMS-823778, TAP-301, DRL-21994, DRL-21995), ингибиторы фосфолипазы A2 (PLA2) (например, дарапладиб/Tyrisa®, вареспладиб, рилапладиб), энхансеры ApoA-I (например, RVX-208, CER-001, MDCO-216, CSL-112, VRX-HDL, VRX-1243, VIRxSYS), ингибиторы синтеза холестерина (например, ETC-1002) и модуляторы метаболизма липидов (например, BMS-823778, TAP-301, DRL-21994, DRL-21995), и омега-3 жирные кислоты и их производные (например, икозапентэтил (AMR101), Epanova®, AKR-063, NKPL-66).
Другие пригодные фармацевтические ингредиенты, которые можно включать в фармацевтические составы, включают в себя одно или несколько активных веществ для лечения ожирения, включая, но без ограничения:
Сибутамин, тезофензин, орлистат, антагонисты рецептора 1 каннабиноида (CB1) (например, TM-38837), антагонисты меланин-концентрирующего гормона (MCH-1) (например, BMS-830216, ALB-127158(a)), агонисты и частичные агонисты рецептора MC4 (например, AZD-2820, RM-493), антагонисты нейропептида Y5 (NPY5) или NPY2 (например, велнеперит, S-234462), агонисты NPY4 (например, PP-1420), агонисты бета-3-адренергического рецептора, лептин или миметики лептина, агонисты рецептора 5-гидрокситриптамина 2c (5HT2c) (например, лоркасерин), или комбинации бупропиона/налтрексона (Contrave®), бупропиона/зонизамида (Empatic®), бупропиона/фентермина или прамлинтида/метрелептина, фентермина/топирамата (Qsymia®), ингибиторы липазы (например, цетилистат/Cametor®), ингибиторы ангиогенеза (например, ALS-L1023), антагонисты гистамина H3 (например, HPP-404), ингибиторы AgRP (родственного агути белка) (например, TTP-435), тройные ингибиторы поглощения моноамина (повторного поглощения дофамина, норадреналина и серотонина) (например, тезофензин), ингибиторы метионин-аминопептидазы 2 (MetAP2) (например, белораниб), назальный состав блокатора кальциевых каналов дилтиазема (например, CP-404) и антисмысловые олигонуклеотиды против продукции рецептора 4 фактора роста фибробластов (FGFR4) (например, ISIS-FGFR4Rx) или нацеленный на прохибитин пептид-1 (например, Adipotide®).
Дополнительные пригодные активные фармацевтические ингредиенты, которые можно включать в фармацевтические составы, включают в себя, но без ограничения:
Антагонисты рецептора ангиотензина II (например, телмисартан, кандесартан, валсартан, лозартан, эпросартан, ирбесартан, олмесартан, тасосартан, азилсартан), ингибиторы ангиотензинпревращающего фермента (ACE), ингибиторы эндотелинпревращающего фермента (ECE), диуретики, бета-блокаторы, антагонисты кальция, гипертензивные средства центрального действия, антагонисты альфа-2-адренергического рецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов и другие или их комбинации являются пригодными.
Как применяют в настоящем документе, термины «аналог инсулина» и «инсулиновый аналог» относятся к полипептиду, обладающему молекулярной структурой, которую формально можно вывести из структуры природного инсулина, например, структуры инсулина человека, посредством делеции и/или замены по меньшей мере одного аминокислотного остатка, встречающегося в природном инсулине, и/или добавления по меньшей мере одного аминокислотного остатка. Добавленный и/или замененный аминокислотный остаток могут представлять собой поддающиеся кодированию аминокислотные остатки или другие природные остатки, или полностью синтетические аминокислотные остатки. Примеры аналогов инсулина включают в себя, но без ограничения, следующие:
(i). «Инсулин аспарт» получен посредством способа рекомбинантной ДНК, так что аминокислота B28 в инсулине человека (т.е. аминокислота no. 28 в цепи B инсулина человека), представляющая собой пролин, заменена на аспарагиновую кислоту;
(ii). «Инсулин лизпро» получен посредством способа рекомбинантной ДНК, так что предпоследние остатки лизина и пролина на C-конце B-цепи инсулина человека обращены (инсулин человека: ProB28LysB29; инсулин лизпро: LysB28ProB29);
(iii). «Инсулин глулизин» отличается от инсулина человека тем, что аминокислота аспарагин в положении B3 заменена на лизин, и лизин в положении B29 заменен на глутаминовую кислоту;
(iv). «Инсулин гларгин» отличается от инсулина человека тем, что аспарагин в положении A21 заменен на глицин, и цепь B удлинена на карбокси-конце посредством двух остатков аргинина.
Как применяют в настоящем документе, термин «водный» относится к раствору, в котором растворитель представляет собой воду, и/или к суспензии, в которой внешняя фаза представляет собой воду, и/или к эмульсии, в которой диспергированная или непрерывная фаза представляет собой воду.
Как применяют в настоящем документе, термин «забуферивающее средство» относится к слабым кислоте или основанию, использованных для поддержания кислотности (pH) раствора, суспензии и/или эмульсии близко к выбранному значению после добавления других кислоты или основания. Функцией забуферивающего средства является предотвращение быстрого изменения значения pH, когда кислоты или основания добавляют в раствор. В водном растворе, суспензии и/или эмульсии забуферивающее средство присутствует в смеси слабой кислоты и сопряженного с ней основания или в смеси слабого основания и сопряженной с ней кислоты. Примеры забуферивающих средств включают в себя, но без ограничения, следующие: бикарбонат натрия; уксусная кислота или соли ацетаты (например, ацетат натрия, ацетат цинка); борная кислота или соли борной кислоты; N-циклогексил-2-аминоэтансульфоновая кислота (CHES) или ее соли; 3-[[1,3-дигидрокси-2-(гидроксиметил)пропан-2-ил]амино]пропан-1-сульфоновая кислота (TAPS) или ее соли; 2-(N-морфолино)этансульфоновая кислота (MES) и ее соли; пиперазин-N,N'-бис(2-этансульфоновая кислота (PIPES) и ее соли; N-(2-ацетамидо)-2-аминоэтансульфоновая кислота (ACES) и ее соли; хлорид холамина; BES; 2-[[1,3-дигидрокси-2-(гидроксиметил)-пропан-2-ил]амино]этансульфоновая кислота (TES) и ее соли; 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновая кислота (HEPES) и ее соли; ацетамидоглицин; N-(2-гидрокси-1,1-бис(гидроксил-метил)этил)глицин (трицин); глицинамид; 2-(бис(2-гидроксиэтил)амино)уксусная кислота (бицин) и ее соли; соли пропионаты; 3-[[1,3-дигидрокси-2-(гидроксиметил)пропан-2-ил]-амино]-2-гидрокси-пропан-1-сульфоновая кислота (TAPSO) и ее соли; 3-морфолинопропан-1-сульфоновая кислота (MOPS) и ее соли; солевой раствор-цитрат натрия (SSC) буфер; 2-амино-2-гидроксиметил-пропан-1,3-диол (синонимы: TRIS, трисамин, THAM, трометамин, трометамол, трометан); лимонная кислота или соли цитраты (например, цитрат натрия); трифосфат натрия, гидрофосфат динатрия, дигидрофосфат натрия, фосфат трикалия, фосфат дикалия, фосфат монокалия и/или любое другое забуферивающее средство, содержащее фосфат.
Аминокислоты (обладающие свободными основными или кислыми функциональными группами, например, метионин, аргинин) или пептиды (обладающие свободными основными или кислыми функциональными группами) можно также использовать в качестве забуферивающего средства. Как применяют в настоящем документе, термин «забуферивающее средство» включает в себя также аминокислоты, пептиды и белки. Поскольку аналоги инсулина и/или производные инсулина, и/или протамин представляют собой пептиды или производные пептидов (т.е. оба содержат аминокислоты, обладающие свободными основными или кислыми функциональными группами), они могут также обладать определенной буферной емкостью, т.е. их также можно рассматривать как забуферивающее средство.
Как применяют в настоящем документе, термин «быстро действующий инсулин» или «кратко действующий инсулин» относится к аналогам инсулина и/или производным инсулина, где опосредованный инсулином начинается в пределах 5-15 минут и продолжает являться активным в течение 3-4 часов. Примеры быстро действующих инсулинов включают в себя, но без ограничения, следующие: (i). инсулин аспарт; (ii). инсулин лизпро и (iii). инсулин глулизин.
Как применяют в настоящем документе, термины «свободный от дополнительного забуферивающего средства» или «свободный от буфера» означают, что не присутствует дополнительного забуферивающего средства наряду с аналогом и/или производным инсулина и необязательно, протамином. Как упомянуто выше, аналоги и/или производные инсулина, так же как протамин, содержат аминокислоты, обладающие кислыми или основными боковыми цепями, и их, таким образом, также можно рассматривать как забуферивающее средство. Независимо от отсутствия каких-либо забуферивающих средств, водный фармацевтический состав в соответствии с настоящим изобретением может, необязательно, содержать протамин.
Как применяют на протяжении описания и формулы изобретения из этого описания, слово «содержать» и варианты слова, такие как «содержащий» и «содержит», не предназначено для исключения других добавок, компонентов, целых чисел или стадий.
Как применяют в настоящем документе, термины «производное инсулина» и «инсулиновое производное» относятся к полипептиду, обладающему молекулярной структурой, которую формально можно вывести из структуры природного инсулина, например, структуры инсулина человека, в которой один или несколько органических заместителей (например, жирная кислота) связаны с одной или несколькими аминокислотами. Необязательно, одна или несколько аминокислот, встречающихся в природном инсулине, могут быть делетированы и/или заменены другими аминокислотами, включая не поддающиеся кодированию аминокислоты, или аминокислоты, включая не поддающиеся кодированию, могут быть добавлены к природному инсулину. Примеры производных инсулина включают в себя, но без ограничения, следующие:
(i). «Инсулин детемир», который отличается от инсулина человека в том, что C-концевой треонин в положении B30 удален, и остаток жирной кислоты (миристиновая кислота) присоединен к функциональной эпсилон-аминогруппе лизина в положении B29.
(ii). «Инсулин деглюдек», который отличается от инсулина человека в том, что последняя аминокислота делетирована из B-цепи, и посредством добавления глутамильной связи от LysB29 к гексадекандикарбоновой кислоте.
Как применяют в настоящем документе, термин «FGF-21» означает «фактор роста фибробластов 21». Соединения FGF-21 могут представлять собой FGF-21 человека, аналог FGF-21 (обозначенный как «FGF-21 аналог») или производное FGF-21 (обозначенное как «FGF-21 производное»).
Как применяют в настоящем документе, термин «состав» относится к продукту, содержащему указанные ингредиенты в предопределенных количествах или пропорциях, так же как к любому продукту, который возникает, напрямую или опосредованно, в результате комбинации указанных ингредиентов в указанных количествах. В отношении фармацевтических составов, этот термин охватывает продукт, содержащий один или несколько активных ингредиентов, и необязательный носитель, содержащий инертные ингредиенты, так же как любой продукт, который возникает, напрямую или опосредованно, в результате комбинации, комплексообразования или агрегации любых двух или более из ингредиентов, или в результате диссоциации одного или нескольких из ингредиентов, или в результате других типов реакций или взаимодействий одного или нескольких из ингредиентов. Как правило, фармацевтические составы получают посредством равномерного приведения активного фармацевтического ингредиента (т.е. аналога и/или производного инсулина) в ассоциацию с жидким носителем или с тонкодисперсным твердым носителем, или с обоими, и затем, при необходимости, формования продукта в желательный состав. Фармацевтический состав включает достаточно активного фармацевтического ингредиента для оказания желательного эффекта при прогрессировании или состоянии заболеваний. Как применяют в настоящем документе, термин «состав» может относится к раствору, так же как к суспензии или к эмульсии. Как применяют в настоящем документе, термины «состав» и «композиция» понимают как являющиеся синонимами, т.е., имеющие идентичное значение. Фармацевтические композиции получают, следуя общепринятым способам фармацевтической технологии, включающим в себя смешивание, заполнение и растворение ингредиентов, соответствующим образом, для получения желательных пероральных, парентеральных, ректальных, чрескожных или местных продуктов.
Как применяют в настоящем документе, термин «агонист рецептора GLP-1» относится к соединениям, обладающим агонистической активностью для рецептора глюкагоноподобного пептида-1. Примеры агонистов рецептора GLP-1 включают в себя, но без ограничения, следующие: эксенатид/эксендин-4, лираглутид, ликсисенатид, дулаглутид, альбиглутид, семаглутид, таспоглутид, р-эксендин-4, CJC-1134-PC, PB-1023, TTP-054, HM-11260C, CM-3, GLP-1 элиген, ORMD-0901, NN9924, нодексен, виадор-GLP-1, CVX-096, ZYOG-1, ZYD-1, MAR-701, ZP-2929, ZP-3022, CAM-2036, DA-15864, ARI-2651, ARI-2255, эксенатид-XTEN и глюкагон-XTEN, AMX-8089+VRS-859 и связанные с полимером аналоги GLP-1 и GLP-1.
Как применяют в настоящем документе, термин «двойной агонист рецептора GLP-1/рецептора глюкагона» относится к соединениям, обладающим агонистической активностью для обоих рецептора GLP-1 и рецептора глюкагона. Примеры двойных агонистов рецептора GLP-1/рецептора глюкагона включают в себя, но без ограничения, следующие: оксинтомодулин, MAR701, MAR-709, и BHM081/BHM089/BHM098.
Как применяют в настоящем документе, термин «инсулин человека» относится к гормону человека, структура и свойства которого хорошо известны. Инсулин человека имеет две полипептидных цепи (цепи A и B), соединенные дисульфидными мостиками между остатками цистеина, а именно, A-цепь и B-цепь. A-цепь представляет собой пептид из 21 аминокислот, и B-цепь представляет собой пептид из 30 аминокислот, где две цепи соединены тремя дисульфидными мостиками: одним между остатками цистеина в положении 6 и 11 A-цепи; вторым между цистеином в положении 7 A-цепи и цистеином в положении 7 B-цепи; и третьим между цистеином в положении 20 A-цепи и цистеином в положении 19 B-цепи.
Как применяют в настоящем документе, термин «включающий в себя» используют для обозначения «включающий, но без ограничения». «Включающий в себя» и «включающий, но без ограничения», используют взаимозаменяемо.
Как применяют в настоящем документе, термин «изоэлектрическая точка» (pI, IEP) относится к значению pH, при котором конкретная молекула не несет суммарного электрического заряда. Изоэлектрическую точку можно определять с использованием изоэлектрического фокусирования, представляющего собой способ разделения различных молекул по различиям в их изоэлектрических точках и хорошо известного в данной области. Ее можно также рассчитать (см., например, Levene and Simms, 'Calculation of isoelectric point' J. Biol. Chem., 1923, pp. 801-813).
Как применяют в настоящем документе, термин «набор» относится к продукту (например, лекарственному средству, набору компонентов), содержащему одну упаковку или одну или несколько отдельных упаковок:
(i). Фармацевтического состава, содержащего активный фармацевтический ингредиент и по меньшей мере один дополнительный активный фармацевтический ингредиент, и необязательно, медицинское устройство. По меньшей мере один дополнительный активный фармацевтический ингредиент может присутствовать в указанном фармацевтическом составе, т.е. набор может содержать одну или несколько упаковок, где каждая упаковка содержит один фармацевтический состав, содержащий два или более активных фармацевтических ингредиентов. Дополнительный активный фармацевтический ингредиент может также присутствовать в дополнительном фармацевтическом составе, т.е. набор может содержать отдельные упаковки двух или более фармацевтических составов, где каждый фармацевтический состав содержит один активный фармацевтический ингредиент.
Или
(ii). Фармацевтического состава, содержащего активный фармацевтический ингредиент, и медицинское устройство.
Набор может содержать только одну упаковку или может содержать одну или несколько отдельных упаковок
Например, набор может представлять собой продукт (например, лекарственное средство), содержащий два или более флаконов, где каждый содержит определенный фармацевтический состав, где каждый фармацевтический состав содержит по меньшей мере один активный фармацевтический ингредиент. Например, набор может содержать (i.) флакон, содержащий определенный фармацевтический состав и (ii). дополнительные таблетку, капсулу, порошок или любую другую пероральную лекарственную форму, содержащую по меньшей мере один дополнительный активный фармацевтический ингредиент. Набор может дополнительно содержать листок-вкладыш с инструкциями, как вводить фармацевтический состав, и по меньшей мере один дополнительный активный фармацевтический ингредиент.
Как применяют в настоящем документе, термин «медицинское устройство» обозначает любой инструмент, аппарат, имплантат, реагент in vitro или сходное или родственное изделие, которое используют для диагностики, предотвращения или лечения заболевания или другого состояния, и которое не достигает своей цели посредством фармакологического действия внутри организма или на теле. Как применяют в настоящем документе, медицинское устройство может представлять собой шприц, систему для инъекции инсулина, систему для инфузии инсулина, инсулиновый насос или устройство-ручку для инъекции инсулина. Как применяют в настоящем документе, медицинское устройство может являться управляемым механически или электромеханически.
Как применяют в настоящем документе, если конкретно не указано иначе, союз «или» используют во включающем смысле «и/или», а не в исключающем смысле «или/или».
Как применяют в настоящем документе, термин «pH» и «значение pH» относятся к десятичному логарифму обратного значения активности ионов водорода в растворе.
Как применяют в настоящем документе, термин «фармацевтический» относится к предназначенному применению для медицинской диагностики, излечения, лечения и/или предотвращения заболеваний.
Как применяют в настоящем документе, термин «фармацевтически приемлемый» относится к физиологически хорошо переносимому млекопитающим или человеком.
Как применяют в настоящем документе, термин «протамин» относится к смеси сильно основных пептидов. Его первоначально выделили из спермы лосося и других видов рыбы, но в настоящее время в основном получают рекомбинантным способом посредством биотехнологии. Он содержит более двух третей L-аргинина. Поскольку протамин содержит аминокислоты, обладающие свободными основными боковыми цепями, он обладает определенной буферной емкостью, и его, таким образом, рассматривают как являющийся забуферивающим средством. Протамин можно использовать в форме сульфата протамина или гидрохлорида протамина.
Концентрации, количества, растворимость, размер частиц, длина волны, значения pH, масса, молекулярная масса, процент и другие числовые данные могут быть выражены или представлены в настоящем документе в формате диапазона. Следует понимать, что такой формат диапазона используют просто для удобства и краткости, и его, таким образом, можно гибко интерпретировать для включения не только числовых значений, явно указанных как пределы диапазона, но также для включения всех индивидуальных числовых значений или поддиапазонов, охваченных внутри этого диапазона, как если бы каждое числовое значение и поддиапазон были явно указаны.
Как применяют в настоящем документе, термин «длительно действующий инсулин» относится к аналогам инсулина и/или производным инсулина, где опосредованный инсулином эффект начинается в пределах 0,5-2 часов и продолжает являться активным в течение приблизительно или более 24 часов. Примеры быстро действующих инсулинов включают в себя, но без ограничения, следующие: (i). инсулин гларгин; (ii). инсулин детемир и (iii). инсулин деглюдек.
Как применяют в настоящем документе, термин «стабильность» относится к химической и/или физической стабильности активных фармацевтических ингредиентов, в частности, аналогов и/или производных инсулина. Целью тестирования стабильности является предоставление свидетельств того, как качество активного фармацевтического ингредиента или лекарственной формы меняется с течением времени под влиянием множества факторов внешней среды, таких как температура, влажность и цвет, и установления срока хранения активного фармацевтического ингредиента или лекарственной формы и рекомендованных условий хранения. Исследования стабильности могут включать в себя тестирование тех особенностей активного фармацевтического ингредиента, которые являются чувствительными к изменению в ходе хранения и которые возможно влияют на качество, безопасность и/или эффективность. Тестирование может покрывать, соответствующим образом, физические, химические, биологические и микробиологические особенности, содержание консерванта (например, антиоксиданта, противомикробного консерванта) и тесты функциональности (например, для системы доставки доз). Аналитические способы могут являться полностью валидированными и указывающими на стабильность. Как правило, значительные изменения активного фармацевтического ингредиента и/или лекарственной формы по отношению к стабильности определяют как:
5% изменение в анализе от его исходного значения; или невозможность удовлетворения критериям приемлемости для активности с использованием биологических или иммунологических способов;
любые продукты деградации, превосходящие их критерий приемлемости;
невозможность удовлетворения критериям приемлемости для внешнего вида, физических особенностей и теста функциональности (например, цвет, фаза, разделение, возможность ресуспендирования, слеживание, твердость, точность вводимой дозы); однако, некоторого изменения физических особенностей (например, размягчения суппозиториев, разжижения кремов) можно ожидать в условиях ускоренной деградации;
и, соответствующим для лекарственной формы образом:
невозможность удовлетворения критериям приемлемости для pH; или
невозможность удовлетворения критериям приемлемости для растворения 12 единичных доз.
Можно также оценивать значительные изменения по сравнению с установленными критериями приемлемости до начала оценки стабильности.
Критерии приемлемости можно получать из монографий (например, монографий Европейской Фармакопеи, Фармакопеи Соединенных Штатов, Британской Фармакопеи или других), и из аналитических партий активного фармацевтического ингредиента и лекарственного средства, используемых в доклинических и клинических исследованиях. Приемлемые пределы следует предлагать и обосновывать, принимая во внимание уровни, наблюдаемые в материале, используемом в доклинических и клинических исследованиях. Характеристики продукта могут представлять собой внешний вид, чистоту, цвет и прозрачность для растворов/суспензий, видимые частицы в растворах и pH. В качестве неограничивающего примера, пригодные критерии приемлемости для инсулина аспарт показаны ниже:
|
Критерии приемлемости, показанные выше, основаны на приведенных в монографиях пределах приемлемости (например, Британская Фармакопея, том III, 2012 или Pharmacopoeial Forum, Volume 36(6), Nov-Dec 2010) и/или выведены из обширного опыта в разработке составов инсулина.
Как применяют в настоящем документе, термин «лечение» относится к любому лечению состояния или заболевания млекопитающего, например, человека, и включает в себя: (1) ингибирование заболевания или состояния, т.е., арест его развития, (2) облегчение заболевание или состояния, т.е., вызов регрессии состояния, или (3) остановку симптомов заболевания.
Как применяют в настоящем документе, единица измерения «ед.» и/или «международные единицы» относится к понижающей уровень глюкозы в крови активности инсулина, и ее определяют (в соответствии с Всемирной организацией здравоохранения, ВОЗ) следующим образом: 1 ед. соответствует количеству высоко очищенного инсулина (как определено ВОЗ), являющемуся достаточным для снижения уровня глюкозы в крови кролика (обладающего массой тела 2-2,5 кг) до 50 мг/100 мл в течение 1 часа и до 40 мг/100 мл в течение 2 часов. Для инсулина человека, 1 ед. соответствует приблизительно 35 мкг (Lill, Pharmazie in unserer Zeit, No. 1, pp. 56-61, 2001). Для инсулина аспарт, 100 ед. соответствует 3,5 мг (информация продукта NovoRapid®). Для инсулина лизпро, 100 ед. соответствует 3,47 мг (информация продукта Humalog®). Для инсулина глулизин, 100 ед. соответствует 3,49 мг (информация продукта картриджей Apidra®). Для инсулина детемир, 100 ед. соответствует 14,2 мг (информация продукта Levemir®). Для инсулина гларгин, 100 ед. соответствует 3,64 мг (информация продукта Lantus®).
Следующие варианты осуществления настоящего изобретения включают в себя следующее:
В одном аспекте изобретение относится к фармацевтическому составу, содержащему (a). по меньшей мере один аналог и/или производное инсулина; и (b). Zn(II); и (c). хлорид натрия; и (d). Необязательно, протамин; где фармацевтический состав обладает значением pH в диапазоне от 6,0 до 9,0 и является свободным от какого-либо дополнительного забуферивающего средства.
В одном аспекте фармацевтический состав по изобретению представляет собой водный фармацевтический состав.
В одном аспекте фармацевтический состав по изобретению обладает значением pH в диапазоне от 7,0 до 7,8.
В одном аспекте фармацевтический состав по изобретению содержит аналог инсулина, выбранный из группы, состоящей из инсулина аспарт, инсулина лизпро и инсулина глулизин.
В одном аспекте фармацевтический состав по изобретению содержит производное инсулина, представляющее собой инсулин детемир и/или инсулин деглюдек.
В одном аспекте фармацевтический состав по изобретению содержит аналог и/или производное инсулина, присутствующие в концентрации от 10 ед./мл до 1000 ед./мл.
В одном аспекте фармацевтический состав по изобретению содержит Zn(II) в концентрации от 0,0100 до 0,0600 мг/100 ед. аналога и/или производного инсулина.
В одном аспекте фармацевтический состав по изобретению содержит хлорид натрия в концентрации от 0,01 до 15 мг/мл.
В одном аспекте фармацевтический состав по изобретению содержит хлорид натрия в концентрации от 6,8 до 8,3 мг/мл.
В одном аспекте фармацевтический состав по изобретению содержит протамин сульфат в концентрации от 0,1 до 0,5 мг/мл.
В одном аспекте фармацевтический состав по изобретению является свободным от какого-либо дополнительного забуферивающего средства, выбранного из группы, состоящей из 2-амино-2-гидроксиметил-пропан-1,3-диола (TRIS), фосфата, лимонной кислоты, цитрата, уксусной кислоты, ацетата, глицилглицина и метионина.
В одном аспекте фармацевтический состав по изобретению содержит один или несколько дополнительных активных фармацевтических ингредиентов.
В одном аспекте фармацевтический состав по изобретению содержит дополнительный активный фармацевтический ингредиент, представляющий собой противодиабетическое средство.
В одном аспекте фармацевтический состав по изобретению содержит дополнительный активный фармацевтический ингредиент, представляющий собой противодиабетическое средство выбранное из группы, состоящей из (a) агониста рецептора GLP-1; (b) двойного агониста рецептор GLP-1/рецептор глюкагона; (c) FGF-21 человека; (d) аналога FGF-21; (e) производного FGF-21; (f) инсулина; (g) инсулина человека; (h) аналога инсулина; и (i) производного инсулина.
В одном аспекте фармацевтический состав по изобретению содержит более одного аналога и/или производного инсулина, где один аналог и/или производное инсулина представляет собой быстро действующий инсулин, и один аналог и/или производное инсулина представляет собой длительно действующий инсулин.
В одном аспекте фармацевтический состав по изобретению содержит быстро действующий инсулин, выбранный из группы, состоящей из инсулина аспарт, инсулина лизпро и инсулина глулизин, и где длительно действующий инсулин представляет собой один или несколько инсулинов, выбранных из группы, состоящей из инсулина детемир и инсулина деглюдек.
В одном аспекте фармацевтический состав по изобретению состоит из:
(a). 3,5 мг/мл инсулина аспарт;
(b). 1,72 мг/мл метакрезола;
(c). 1,50 мг/мл фенола;
(d). 0,04087 мг/мл Zn(II);
(e). 6,8 мг/мл хлорида натрия;
(f). 0,02 мг/мл полисорбата 20;
(g). гидроксида натрия и/или соляной кислоты для доведения pH до 7,4, и
(h). воды.
В одном аспекте фармацевтический состав по изобретению состоит из:
(a). 3,5 мг/мл инсулина аспарт;
(b). 1,72 мг/мл метакрезола;
(c). 1,50 мг/мл фенола;
(d). 0,04087 мг/мл Zn(II);
(e). от 6,8 мг/мл до 8,3 мг/мл хлорида натрия;
(f). 0,02 мг/мл полисорбата 20;
(g). от 0,1 мг/мл до 0,5 мг/мл сульфата протамина;
(h). гидроксида натрия и/или соляной кислоты для доведения pH до pH в диапазоне от 7,1 до 7,6; и
(i). воды.
В одном аспекте изобретение относится к способу получения фармацевтического состава по изобретению, где компоненты смешивают вместе в форме раствора или суспензии, pH доводят до для достижения желательного pH, и воду добавляют для достижения конечного объема.
В одном аспекте изобретение относится к набору, содержащему одну или несколько отдельных упаковок:
(a). фармацевтического состава по изобретению; и
(b). медицинское устройство.
В одном аспекте изобретение относится к набору, содержащему одну или несколько отдельных упаковок:
(a). фармацевтического состава по изобретению; и
(b). по меньшей мере одного дополнительного активного фармацевтического ингредиента;
(c). и необязательно, медицинское устройство.
В одном аспекте набор по изобретению содержит дополнительный активный фармацевтический ингредиент, представляющий собой противодиабетическое средство.
В одном аспекте набор по изобретению содержит дополнительный активный фармацевтический ингредиент, представляющий собой противодиабетическое средство, выбранное из группы, состоящей из:
(a). агониста рецептора GLP-1;
(b). двойного агониста рецептора GLP-1/рецептора глюкагона;
(c). FGF-21 человека;
(d). аналога FGF-21;
(e). производного FGF-21;
(f). инсулина;
(g). инсулина человека;
(h). аналога инсулина; и
(i). производного инсулина.
В одном аспекте набор по изобретению содержит более одного аналога и/или производного инсулина, где один аналог и/или производное инсулина представляет собой быстро действующий инсулин, и один аналог и/или производное инсулина представляет собой длительно действующий инсулин.
В одном аспекте набор по изобретению содержит быстро действующий инсулин, выбранный из группы, состоящей из инсулина аспарт, инсулина лизпро и инсулина глулизин, и длительно действующий инсулин, выбранный из группы, состоящей из инсулина гларгин, инсулина детемир и инсулина деглюдек.
В одном аспекте изобретение относится к фармацевтическому составу или набору для применения в лечении сахарного диабета.
В одном аспекте изобретение относится к фармацевтическому составу или набору для применения в лечении гипергликемии.
В одном аспекте изобретение относится к фармацевтическому составу или набору для применения в снижении уровня глюкозы в крови.
В одном аспекте изобретение относится к способу лечения сахарного диабета у нуждающегося в этом субъекта, включающему в себя введение фармацевтического состава по изобретению.
В одном аспекте изобретение относится к способу лечения гипергликемии у нуждающегося в этом субъекта, включающему в себя введение фармацевтического состава по изобретению.
В одном аспекте изобретение относится к способу снижения уровней глюкозы в крови у нуждающегося в этом субъекта, включающему в себя введение фармацевтического состава по изобретению.
В одном аспекте изобретение относится к медицинскому устройству для введения фармацевтического состава по изобретению животному и/или человеку.
Настоящее изобретение проиллюстрировано следующими примерами. Однако следует понимать, что настоящее изобретение не является ограниченным конкретными деталями этих примеров.
ПРИМЕРЫ
Пример 1
Способ изготовления
(a) Раствор полисорбата
Раствор полисорбата получали посредством растворения 1,00 г полисорбата 20 в воде для инъекций (в соответствии с Европейской Фармакопеей) и посредством дополнения водой для инъекций до конечного объема 1000 мл.
(b) Раствор хлорида цинка
Раствор хлорида цинка (содержащий Zn(II)) получали посредством растворения 2,00 г хлорида цинка в воде для инъекций и посредством дополнения водой для инъекций до конечного объема 1000 мл.
(c) Раствор A
Конечный состав раствора A приведен в таблице 1:
|
Раствор A получали, как описано далее:
1. Начинали с приблизительно 500 мл воды для инъекций.
2. 34,00 г хлорида натрия, 7,5 г фенола и 8,6 г м-крезола растворяли при постоянном перемешивании.
3. Раствор дополняли до приблизительно 900 г с помощью воды для инъекций.
4. Раствор перемешивали в течение приблизительно 15 мин с использованием магнитной мешалки.
5. Проверяли pH (pH должен составлять 8,65, округленно: pH 9,0). Если значение pH не составляло 8,65, pH доводили до указанного диапазона с использованием 1 Н соляной кислоты или раствора 1 Н гидроксида натрия.
6. Раствор дополняли до 1026 г с помощью воды для инъекций.
(d) Конечный Раствор
Конечный состав конечного раствора приведен в таблице 2:
|
В дальнейшем описано получение состава на 2000 мл. Другие объемы (например, состав на 1000 мл) можно получать таким же способом (с использованием соответствующего количества инсулина аспарт и наполнителей).
Конечный раствор получали, как описано далее:
1. Начинали с приблизительно 300 мл воды для инъекций (в соответствии с Европейской Фармакопеей).
2. 6,992 г (округленно 7,0 г) инсулина аспарт добавляли к 300 мл воды для инъекций при постоянном перемешивании (образуется суспензия инсулина аспарт в воде для инъекций).
3. Проверяли значение pH.
4. Значение pH изменяли на приблизительно 3,1-3,2 посредством добавления 0,1 Н соляной кислоты или раствора 0,02 Н гидроксида натрия для растворения инсулина аспарт.
5. Раствор перемешивали в течение приблизительно 15 мин с использованием магнитной мешалки.
6. 40,866 г раствора хлорида цинка добавляли в раствор при постоянном перемешивании.
7. 40 г раствора полисорбата добавляли при постоянном перемешивании.
8. Раствор дополняли до 600 г с помощью воды для инъекций.
9. 410,4 г раствора A добавляли медленно и осторожно при постоянном перемешивании.
10. pH доводили до 7,4 (в диапазоне 7,2-7,6) с использованием 0,1 Н соляной кислоты или раствора 0,02 Н гидроксида натрия.
11. Раствор дополняли до 2010 г (соответствует 100% конечного раствора).
Контроль качества: Конечный раствор представлял собой прозрачный и неокрашенный раствор, обладающий значением pH 7,4 (плюс/минус 0,2; при 20-25°C).
Конечный раствор подвергали стерилизации фильтрацией с использованием фильтра «Sartopore Minisart high flow» (материал фильтра: полиэфирсульфон; размер пор: 0,2 мкм; поставщик: Sartorius).
Конечный раствор после стерилизации фильтрацией представлял собой прозрачный и неокрашенный раствор, и обладал осмоляльностью 260 мосмоль/кг (плюс/минус 30).
Конечным раствором после стерилизации фильтрацией заполняли подходящие флаконы (объем: 5 и 10 мл; 13 мм; прозрачное стекло; стекло типа 1).
Флаконы, содержащие конечный раствор после стерилизации фильтрацией, хранили между +2°C и +8°C и защищали от света.
Пример 2
Контроль состава
(a) Аналитические способы
Тесты проводили с использованием фармакопейных аналитических способов тестирования, при целесообразности. Концепцию контроля качества разрабатывали, принимая во внимания требования cGMP, так же как текущий статус процесса ICH.
Нефармакопейные и хроматографические аналитические способы, используемые для контроля состава, обобщены в следующем:
Описание
Визуально обследовали ряд контейнеров по соответствию критериям приемлемости.
Идентификация (HPLC)
Идентичность активного ингредиента подтверждали посредством сравнения времени удержания образца состава лекарственного средства с временем удержания эталонного стандарта с использованием способа обращеннофазовой HPLC. Способ использовали также для анализа определения активного ингредиента, для определения родственных соединений и примесей, и для количественного определения консервантов м-крезола и фенола.
Анализ (HPLC)
Тест проводили посредством обращеннофазовой жидкостной хроматографии (HPLC). Способ использовали также для идентификации, для анализа определения активного ингредиента, для определения родственных соединений и примесей, и для количественного определения консервантов м-крезола и фенола. Колонка: Lichrosorb RP18, размер частиц 5 мкм, размер пор 100 Ǻ (250 мм × 4,0 мм), термосатирована при +35°C. Автодозатор: Термосатирован при ≤+8°C. Подвижная фаза A: Сульфат натрия, растворенный в воде, 14 г/мл, доведенный с помощью фосфорной кислоты и гидроксида натрия до pH 3,4. Подвижная фаза B: Вода/ацетонитрил (50:50 об./об.). Градиент показан в таблице 3.
|
Скорость потока: 1,0 мл/мин. Объем инъекции: 10 мкл. Детекция: 214 нм (для активного ингредиента) и 260 нм (для м-крезола и фенола). Типичное время прогона: 60 мин.
Анализ активного ингредиента, м-крезола и фенола рассчитывали посредством внешней стандартизации. Примеси рассчитывали с использованием способа процента площади пика.
Тестируемый раствор: Состав использовали без какого-либо разведения или дополнительной обработки.
Родственные соединения и примеси (HPLC)
Такие же хроматографические условия, как для «Анализа (HPLC)», использовали для определения родственных соединений и примесей. Родственные соединения и примеси рассчитывали с использованием способа процента площади пика.
Высокомолекулярные белки (HMWP)
Высокомолекулярные белки определяли с использованием эксклюзионной хроматографии высокого давления (HPSEC). Колонка: Waters Insulin HMWP, размер частиц 5-10 мкм, размер пор 12-12,5 нм (300 мм × 7,8 мм), термостатирована при комнатной температуре. Автодозатор: термостатирован при ≤+8°C. Подвижная фаза: 650 мл раствора аргинина (1 г/л) смешивали с 200 мл ацетонитрила и 150 мл ледяной уксусной кислоты. Изократическая элюция. Скорость потока: 1,0 мл/мин. Объем инъекции: 100 мкл. Детекция: 276 нм. Типичное время прогона: 35 мин.
HMWP рассчитывали с использованием способа процента площади пика. Тестируемый раствор: Состав использовали без какого-либо разведения или дополнительной обработки.
Анализ противомикробного консерванта
Такие же хроматографические условия, как для «Анализа (HPLC)», использовали для анализа определения м-крезола и фенола. М-крезол и фенол рассчитывали посредством внешней стандартизации.
(b) Валидация аналитических способов
Аналитический способ HPLC для состава для определения идентификации, анализа и родственных соединений и примесей валидировали для демонстрации специфичности, линейности, предела детекции и предела количественного определения, корректности, точности и диапазона.
(c) Обоснование критериев приемлемости
Тесты и критерии приемлемости, как представлено ранее, выбирали на основании ICH Q6B и опубликованных монографий, полученных аналитических результатов, точности используемых способов, фармакопейных и/или нормативных рекомендаций, и они были согласованы с стандартными пределами на этой стадии разработки.
Пример 3
Стабильность состава
(a) Стабильность состава
Исследования стабильности для состава начинали в соответствии с обобщением способа анализа стабильности, описанным в следующей таблице. Состав и способ изготовления партий для анализа стабильности являлись репрезентативными для материала. Профиль стабильности оценивали для хранения в условиях долгосрочного, ускоренного и стрессового тестирования в соответствии с руководством ICH. Образцы упаковывали и хранили в стеклянных флаконах с фланцевой крышкой с вставленным диском и съемным колпачком. Данные стабильности, полученные с использованием этого упаковочного материала, являлись репрезентативными для предварительных срока хранения и правил хранения для обеих конфигураций упаковки (10 мл стеклянные флаконы и 3 мл картриджи).
До настоящего времени, доступны данные по стабильности в течение 12 месяцев для партии, заполненной в 10 мл флаконы, и 12 месяцев для партии, заполненной в 3 мл картриджи, из продолжающихся исследований стабильности состава.
|
Следующие тесты проводили в ходе тестирования стабильности: внешний вид, анализ, родственные примеси, высокомолекулярные белки, pH, вещество в форме частиц (видимые и невидимые частицы), анализ противомикробных консервантов (м-крезол и фенол), содержание цинка. Исследования физических и химических свойств после 12 месяцев хранения в условиях долгосрочного хранения при +5°C подтверждают стабильность состава при хранении в рекомендованных условиях хранения. Можно было наблюдать только очень слабые изменения родственных примесей.
При хранении в ускоренных условиях в течение 3 месяцев при +25°C/60%RH содержание родственных примесей и высокомолекулярных белков увеличивалось, однако, оставалось в пределах современного предела приемлемости. При хранении в стрессовых условиях (1 месяц при +40°C/75% RH) содержание одной из родственных примесей увеличивалось выше критерия приемлемости. Содержание активного ингредиента, м-крезола и фенола в основном оставалось неизменным в ускоренных условиях.
Благодаря настоящим результатам исследований стабильности состава, химическая и физическая стабильность состава может быть подтверждена.
В таблицах 5-12 показаны результаты для долгосрочной стабильности, где партия no. «_0105» относится к составу в соответствии с настоящим изобретением, заполненному в 10 мл флаконы, и где партия no. «_318» относится к составу в соответствии с настоящим изобретением, заполненному в 3 мл картриджи.
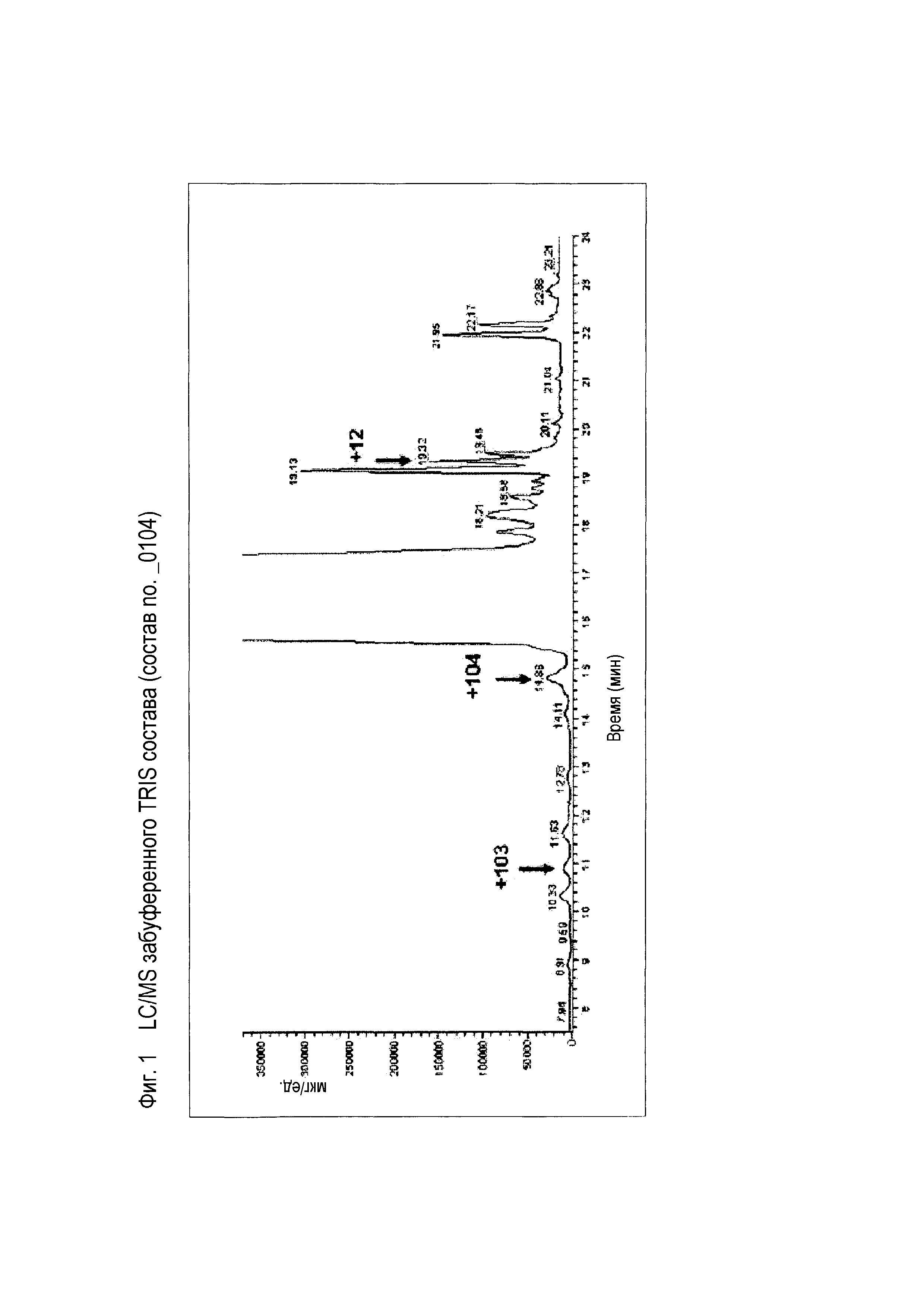
(b) Сравнения стабильности свободного от буфера состава по сравнению с составами с буфером
Для забуференного состава, содержащего фосфатный буфер, показана физическая нестабильность по образованию неорганических частиц (формированию гидрата фосфата натрия-цинка, Na6(ZnPO4)6 ⋅ 8 H2O, кристаллическая структура содалитного типа). Для другого состава с буфером, содержащего цитратный буфер, также показана физическая нестабильность по появлению мутности после воздействия слабого физического стресса. Для забуференного состава, содержащего 2-амино-2-гидроксиметил-пропан-1,3-диол (синоним: TRIS) показано увеличение содержания родственных примесей при хранении в ускоренных условиях. Кроме того, для забуференного состава, содержащего 2-амино-2-гидроксиметил-пропан-1,3-диол (TRIS) показаны три дополнительные примеси (идентифицированные по LC/MS) при хранении в стрессовых условиях (+40°C/75% RH), т.е. TRIS-аддукт +103 Да; соответствующий дезамидо-аддукт +104 Да; и формальдегид-аддукт+12 Да (см. фигуру 1). Для состава по изобретению не показано этих примесей.
Соответствующие тестируемые элементы и аналитические результаты через один месяц анализа стабильности в долгосрочных, ускоренных и стрессовых условиях по отношению к физико-химической стабильности по сравнению с составом по изобретению перечислены в таблице 13.
После хранения составов в условиях долгосрочного хранения (1 месяц при +5°C), составы подвергали механическому стрессу (встряхиванию) и термическому стрессу (+37°C). Измеряли мутность (нефелометрическое исследование).
Для стабильности свободного от буфера состава (т.е., альтернативного водного фармацевтического состава, содержащего по меньшей мере один аналог инсулина и/или производное инсулина, содержащего хлорид натрия и без каких-либо дополнительного забуферивающих средств) показана отличная химическая и физическая стабильность, что квалифицирует указанный водный фармацевтический состав как лекарственное средство, обладающее определенным сроком хранения.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|