Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СОЛИ ПРОИЗВОДНОГО ОЛИВОМИЦИНА, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к медицине, фармации и химико-фармацевтической промышленности, а более конкретно к фармацевтическим композициям на основе соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, обладающим противоопухолевой активностью.
Уровень техники
По данным мировой статистики злокачественные опухоли, заболевания кроветворной и лимфатической систем занимают второе место среди причин смертности населения в экономически развитых странах. Поэтому разработка новых противоопухолевых препаратов и методов борьбы со злокачественными образованиями является одной из приоритетных задач фармацевтической химии.
Основным способом лечения опухолевых заболеваний на сегодняшний день является химиотерапия, подразумевающая введение пациенту различных противоопухолевых препаратов. Примером таких препаратов являются антибиотики группы ауреоловой кислоты, являющиеся высокоэффективными природными противоопухолевыми агентами, ряд из которых разрешен к применению в качестве антинеопластических агентов для лечения опухолевых заболеваний.
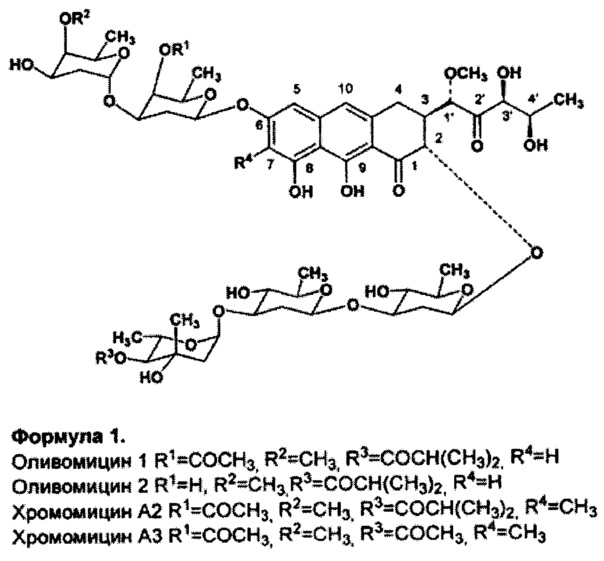
Важнейшими представителями этой группы являются: оливомицин 1 (оливомицин А) (формула 1, R1=COCH3, R2=CH3, R3=COCH(CH3)2, R4=H), оливомицин 2 (формула 1, R1=H, R2=CH3, R3=COCH(CH3)2, R4=H), хромомицин A2 (формула 1, R1=COCH3, R2=CH3, R3=COCH(CH3)2, R4=CH3), хромомицин A3 (формула 1, R1=COCH3, R2=CH3, R3=COCH3, R4=CH3), митрамицин.
Формула 1.
Механизм действия антибиотиков группы ауреоловой кислоты основан на взаимодействии их с GC-парами в малой бороздке ДНК, приводящем к нарушению структуры и функций нуклеиновых кислот, в том числе генной транскрипции [Симонова B.C. и др., Бюллетень экспериментальной биологии и медицины, 2005, том 139, 451].
Основными недостатками этого класса антибиотиков являются высокая токсичность, мутагенность, канцерогенность, миело- и иммунодепрессивное действие.
Ранее был описан способ получения производных антибиотика группы ауреоловой кислоты оливомицина А, заключающийся в селективной модификации 2'-карбонильной группы оливомицина А реакцией с аминооксиуксусной кислотой, с последующим проведением реакции амидирования полученного ключевого интермедиата 2'-(карбоксиметоксим) оливомицина 1 (2'-(карбоксиметоксим)оливомицина А) с соответствующими аминами в присутствии конденсирующего агента [Патент RU 2350621]. Однако проведенная модификация приводила к снижению цитотоксической активности производных минимум на один порядок по сравнению с исходным оливомицином А.
На основании данных по антипролиферативной активности и ингибированию производными оливомицина А работы топоизомеразы I было сделан вывод, что удлинение и увеличение объема боковой цепи агликона в производных оливомицина А затрудняет образование комплекса антибиотик-ДНК вследствие стерических факторов [Деженкова Л.Г. Диссертация на соискание ученой степени кандидата химических наук, «Связь структура-активность в ряду противоопухолевых антибиотиков, их аналогов и производных - новых ингибиторов топоизмеразы I», Москва, 2008 г.].
Позднее были получены полусинтетические производные оливомицина А, содержащие укороченную боковую цепь по сравнению с известными ранее производными, которая не препятствовала взаимодействию антибиотика с мишенью [Патент RU 2453552]. Эти производные обладают цитотоксичностью, близкой к таковой для исходного антибиотика.
Представителем таких производных является N,N-диметиламиноэтиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 2), обладающий высокой противоопухолевой активностью наряду со сниженной токсичностью.
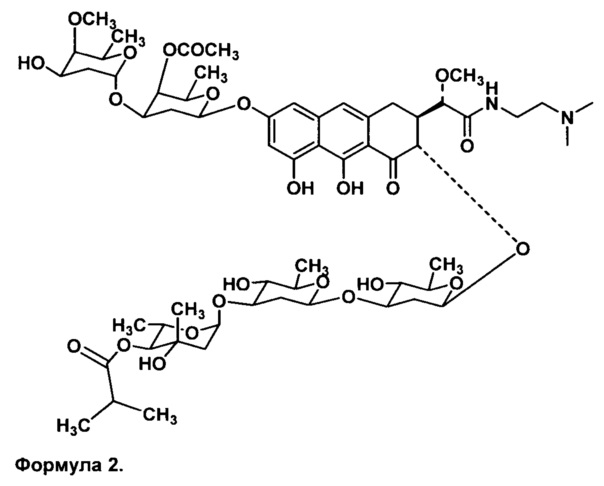
Недостатки фармацевтических композиций, включающих N,N-диметиламиноэтиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, обусловлены его амфотерностью и проявляются в недостаточной растворимости активного агента. Это сказывается на его биологической доступности, приводит к резким колебаниям концентрации при введении и уменьшает время пребывания препарата в организме. Кроме того такие композиции нестабильны при длительном хранении.
Раскрытие сущности изобретения
Настоящее изобретение направлено на решение технических проблем, представленных выше. Они могут быть решены созданием противоопухолевых композиций, включающих солевую форму N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А. Применение в составе композиции солевой формы N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А способствует повышению растворимости терапевтического агента, увеличению биологической доступности, позволяет контролировать профиль его растворения, нивелировать резкие скачки концентраций препарата в системном кровотоке, а также увеличить время пребывания лекарственного вещества в организме. Также необходимо учитывать, что модификация исходного соединения может привести к снижению его терапевтической активности или увеличению побочных эффектов, подтверждением чему служат производные, известные из патента RU 2350621. Соли в составе фармацевтических композиций должны иметь активность, соответствующую или превышающую активность исходного соединения.
Технический результат настоящего изобретения относится к получению фармацевтической композиции соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, обладающей хорошей растворимостью в водных фармацевтически приемлемых средах, характеризующейся более высокой стабильностью, чем свободное основание N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А. Технический результат настоящего изобретения проявляется также в высокой противоопухолевой активности фармацевтической композиции соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А, соответствующей или превышающей активность исходного соединения.
Подходящими солями в контексте решаемой технической проблемы являются метансульфонат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, гидрохлорид N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, цитрат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, фумарат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А. Наиболее подходящими солями в контексте решаемой технической проблемы являются цитрат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А и фумарат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А.
Фармацевтическая композиция согласно изобретению может дополнительно включать фармацевтически приемлемые вещества.
Фармацевтическая композиция согласно изобретению может содержать один или более растворителей, выбранных из воды, буферного раствора, изотонического раствора.
Фармацевтическая композиция согласно изобретению может содержать один или более эксципиентов, выбранных из сорастворителей, диспергаторов, поверхностно-активных веществ, солюбилизаторов, эмульгаторов, стабилизаторов, консервантов, антиоксидантов, буферных соединений, веществ для подержания изотоничности композиции.
Фармацевтические композиции могут быть получены любыми способами, известными в фармацевтической области, например смешиванием активных ингредиентов с фармацевтически приемлемыми веществами в стерильных условиях.
Фармацевтические композиции могут быть выполнены в лиофилизированной форме или в жидкой лекарственной форме в виде инъекционного раствора.
Фармацевтические композиции включают соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А в терапевтически эффективном количестве.
Краткое описание чертежей
Рис. 1 ИК-спектр бензоата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А.
Рис. 2 ИК-спектр цитрата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А.
Рис. 3 ИК-спектр гидрохлорида N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А.
Рис. 4 ИК-спектр фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А.
Рис. 5 ИК-спектр метансульфоната N,N-диметиламино-этиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А.
Рис. 6 ИК-спектр комплекса N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А с двухвалентным железом.
Рис. 7 ИК-спектр комплекса N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А с магнием.
Осуществление изобретения
Пример 1. Синтез солевых форм N,N-диметиламиноэтиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А
Солевые формы получали взаимодействием субстанции N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А и соответствующей неорганической, органической кислоты или соли металла.
1.1. Бензоат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А в МеОН (8 мл) добавляли 414 μl 0,1 н раствора бензойной кислоты в МеОН. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.2. Цитрат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в МеОН (4 мл) добавляли 414 μl 0,1 н раствора лимонной кислоты в МеОН. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.3. Гидрохлорид N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в МеОН (4 мл) добавляли 414 μl 0,1 н раствора HCl в МеОН. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.4. Фумарат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в МеОН (4 мл) добавляли 414 μl 0,1 н раствора фумаровой кислоты в МеОН. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.5. Метансульфонат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в МеОН (8 мл) добавляли 414 μl 0,1 н раствора метансульфокислоты в МеОН. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.6. Комплекс N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с двухвалентным железом
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А в МеОН (4 мл) добавляли 414 μl 0,05 н раствора гептагидрата сульфата железа (II) в воде. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
1.7. Комплекс N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А с магнием
К раствору 50 мг N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в МеОН (4 мл) добавляли 414 μl 0,1 н раствора сульфата магния в воде. Смесь перемешивали в течение 15 мин при комнатной температуре, затем добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме.
Полученные соли охарактеризованы ИК-спектрами, зарегистрированными на приборе ИК-Фурье-спектрометре «Nicolet-iS10» (см. рис. 1-7).
Пример 2. Определение стабильности солевых форм N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
Стабильность при хранении определяли методом ускоренного старения. Для этого тестируемый образец соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в стеклянном флаконе, закрытом резиновой пробкой и закатанной алюминиевой крышкой помещали в термостат при температуре 60±1°C. Выдерживали в течение 1 месяца в термостате при указанной температуре, оценивая физико-химические характеристики (внешний вид, температура плавления, содержание основного компонента методом ВЭЖХ) каждой соли через 1 неделю и через 1 месяц.
Данные о стабильности солей при хранении в условиях ускоренного старения, полученные методом ВЭЖХ, представлены в таблице 1. ВЭЖХ-анализ проводили на хроматографе Shimadzu (Япония) LC-20 AD с УФ детектором на колонке Kromasil (Швеция) С18 размером 4×240 мм, с зернением 5 мкм или аналогичной. Концентрация вводимого раствора - 0,1 мг/мл; объем петли - 20 мкл. Хроматографирование проводили в системе, состоящей из ацетонитрила и 0,01М фосфорной кислоты, рН 2,6 в режиме линейного градиента с увеличением концентрации ацетонитрила от 30 до 70% за 30 мин при скорости потока 1 мл/мин.
На основании результатов экспериментов, представленных в таблице 1, можно сделать вывод о том, что полученные соединения, за исключением комплексов N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с металлами и бензоата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А, демонстрировали стабильность, превышающую стабильность свободного основания.
Пример 3. Антипролиферативная активность композиций солевых форм N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
С целью установления влияния солевой формы субстанции N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А на антипролиферативную активность проведено изучение цитотоксического действия солей, описанных в примере 1 (1.1-1.5), в отношении опухолевых клеток линий К562 и НСТ116 (American Type Culture Collection, США) методом МТТ-анализа [Tevyashova A.N. et al., Biorg. Med. Chem., 2011, 7387]. В виду низкой стабильности антипролиферативная активность комплексов N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с металлами (описанных в примерах 1.6-1.7) не исследовалась.
Полученные результаты сравнительного тестирования антипролиферативной активности солевых форм и свободного основания N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, представлены в таблице 1.
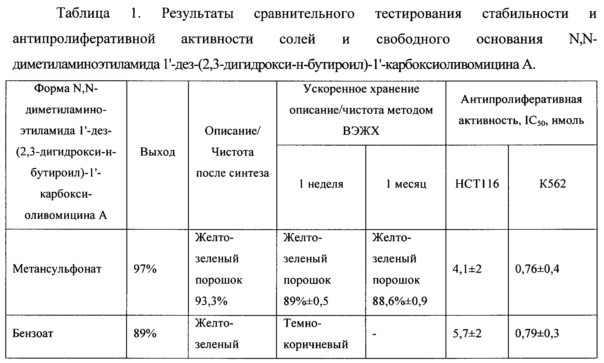
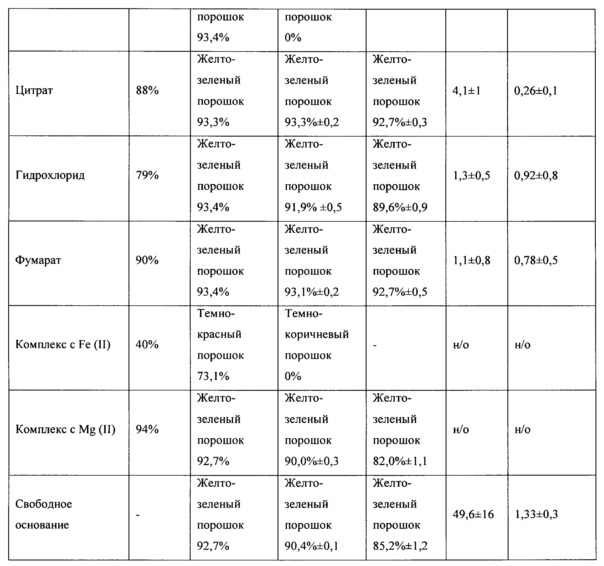
На основании результатов экспериментов согласно примеру 3 можно сделать вывод о том, что антипролиферативная активность полученных соединений, за исключением комплексов N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с металлами, соответствовала или превышала таковую исходного соединения.
Оптимальное сочетание таких характеристик, как устойчивость при хранении в условиях ускоренного старения в течение 1 месяца и высокая антипролиферативная активность в отношении опухолевых клеток, демонстрируют цитрат и фумарат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А. Для них была подтверждена противоопухолевая активность in vivo.
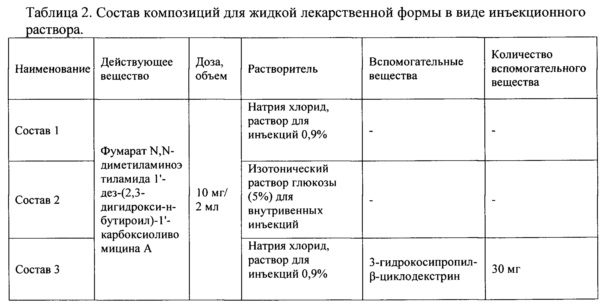
Пример 4. Композиции для жидкой лекарственной формы фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в виде инъекционного раствора
Жидкие фармацевтические композиции на основе фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А приготовлены в изотоническом растворе глюкозы (5%) или натрия хлорида (0,9%) для внутривенных инъекций в стерильной посуде. В мерный сосуд наливают 3/4 от требуемого объема растворителя, растворяют в нем отвешенное количество фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, добавляют при необходимости вспомогательных компоненты и перемешивают смесь. Растворы стерилизуют фильтрованием через микропористый фильтр (размер пор 25 μm) в асептических условиях. Полученный раствор переносят в мерный сосуд и доводят стерильным растворителем до требуемого объема. После проверки содержания фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А методом ВЭЖХ (требуемая концентрация 5±0.1 мг/мл) растворы дозируют по 2 мл в стерильные флаконы из нейтрального стекла. Флаконы с растворами закупоривают стерильными резиновыми пробками, обкатывают алюминиевыми колпачками и маркируют. Таким образом, были приготовлены жидкие лекарственные формы для парентерального применения фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (каждый флакон содержит 2 мл раствора), иллюстративные рецептуры которых приведены в таблице 2 (составы 1-4).

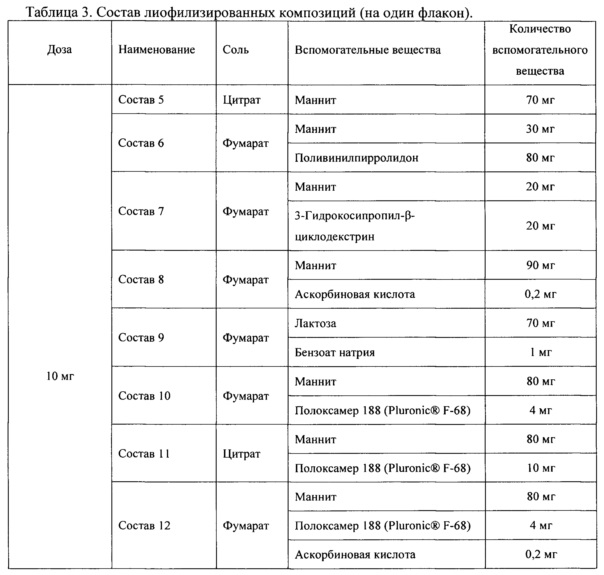
Пример 5. Композиции для лиофилизированной лекарственной формы солей N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А для парентерального применения
Растворы солей N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А для получения лиофилизированных фармацевтических композиций готовят в дистиллированной воде в стерильной посуде. В мерный сосуд наливают 3/4 от требуемого объема воды, растворяют в ней отвешенное количество соли N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А и вспомогательных компонентов и помешивают до полного растворения. Раствор стерилизуют, удаляют бактериальную контаминацию и механические примеси фильтрованием раствора через микропористый фильтр в асептических условиях. Полученный раствор переносят в мерный сосуд и доводят стерильной водой до требуемого объема. После проверки содержания методом ВЭЖХ (требуемая концентрация 5±0.5 мг/мл) растворы дозируют по 2 мл в стерильные флаконы из нейтрального стекла. Флаконы с растворами закрывают стерильными тампонами и после охлаждения до комнатной температуры выдерживают при -70°C 12 ч. Флаконы загружают на полки лиофильной сушки, высушивают 24 ч в режиме Main drying (температура полок -44°C, давление 0.08 мбар). По окончании режима Main drying продолжают лиофилизацию 24 ч в режиме Final drying (температура полок -75°C, давление 0.0012 мбар). Флаконы с лиофилизатом закрывают стерильными резиновыми пробками, затем укупоривают колпачками алюминиевыми для пенициллиновых флаконов. На флаконы с препаратом наклеивают этикетки и готовую лекарственную форму хранят при температуре 2-6°C.
Иллюстративные рецептуры лиофилизированных фармацевтических композиций солей N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А для приготовления инъекционных растворов приведены в таблице 3. Лиофилизированные композиции составов 5-12 легко восстанавливаются в исходный гомогенный раствор при комнатной температуре менее чем через 5 минут при добавлении стерильной воды или «изотонического раствора глюкозы (5%) для внутривенных инъекций».
Пример 6. Противоопухолевая активность in vivo фармацевтических композиций солей N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А
Сравнительное исследование противоопухолевой активности фармацевтических композиций солей и свободного основания N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А проводили на гибридных мышах BDF1 (С57 В1×DBA2). В качестве контрольного вещества использован 5% апирогенный раствор глюкозы для внутривенного введения.
Фармацевтические композиции на основе N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А растворяли в 5% растворе глюкозы и в виде 0,02% раствора вводили животным с помощью одноразового шприца с металлической иглой внутривенно ежедневно в течение 5 дней в одно и то же время суток.
6.1. Противоопухолевая активность фармацевтической композиции фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А на мышах с лимфолейкозом Р-388
Штамм лимфолейкоза Р-388, полученный из банка опухолевых штаммов РОНЦ им. Н.Н. Блохина, трансплантировали по стандартной методике внутрибрюшинно по 1 млн. клеток. Введение фармацевтической композиции на основе фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (состав 12) производили через 24 часа после перевивки опухоли. Противоопухолевый эффект для мышей с асцитным лимфолейкозом Р-388 оценивали по увеличению средней продолжительности жизни леченных животных по сравнению с нелеченым контролем (УПЖ%), которое рассчитывается по формуле:
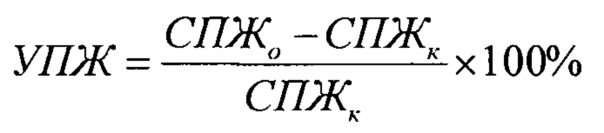
где СПЖо - средняя продолжительность жизни, животных, получавших лечение, СПЖк - средняя продолжительность жизни нелеченых животных.
Полученные данные представлены в таблице 4.
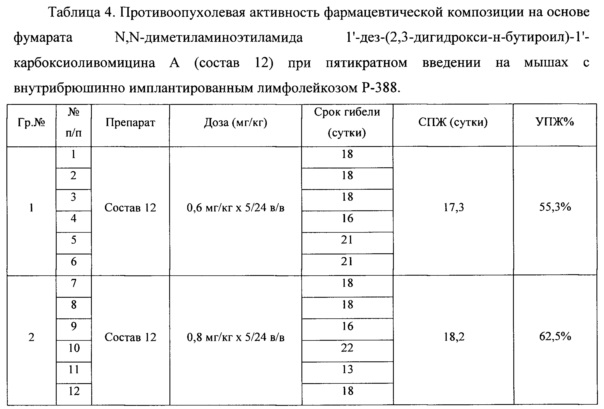
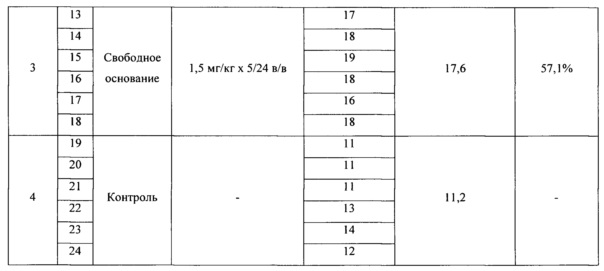
Средняя продолжительность жизни мышей в контроле роста опухоли - 11,2 суток. В группе получавшей фумарат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А в дозе 0,6 мг/кг СПЖ составила 17,3 суток; в группе с разовой дозой 0,8 мг/кг - 18,2 суток. В группе получавшей свободное основание N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А в разовой дозе 1,5 мг/кг СПЖ составила 17,6 суток.
Таким образом, результаты эксперимента показывают, что при ежедневном пятикратном введении фумарата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбокси-оливомицина А в разовой дозе 0,6-0,8 мг/кг препарат проявляет высокую противоопухолевую активность близкую к противоопухолевой активности свободного основания в большей разовой дозе препарата.
6.2. Противоопухолевая активность композиции цитрата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А на мышах с подкожно перевитой меланомой мышей В-16
Исследование проведено на мышах BDF1 (С57 Bl×DBA2) самцах, массой 20-22 грамма в группах по 10 особей. Штамм меланомы мышей В-16, полученный из банка опухолевых штаммов РОНЦ им. Н.Н. Блохина, трансплантирован по стандартной методике подкожно по 1 млн клеток. Введение фармацевтической композиции на основе цитрата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (пример 5, состав 11) производили на 3 сутки после перевивки опухоли ежедневно в течение пяти дней внутривенно в указанных дозах. Ежедневно наблюдали за состоянием и поведением животных, один раз в неделю измеряли условный объем опухолей (как произведение 3-х диаметров опухоли).
Противоопухолевый эффект оценивали по торможению роста опухоли по сравнению с нелеченым контролем (ТРО%), которое рассчитывали по формуле:
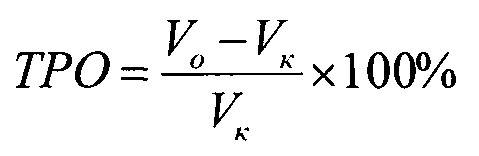
где Vo - средний размер опухоли, животных, получавших лечение, Vк - средний размер опухоли нелеченных животных.
Для определения достоверности межгрупповых различий данные проанализированы t-тестом Стьюдента. Различия определяются как достоверные при р≤0,05.
Противоопухолевая активность соединения представлена в таблицах 5 и 6.
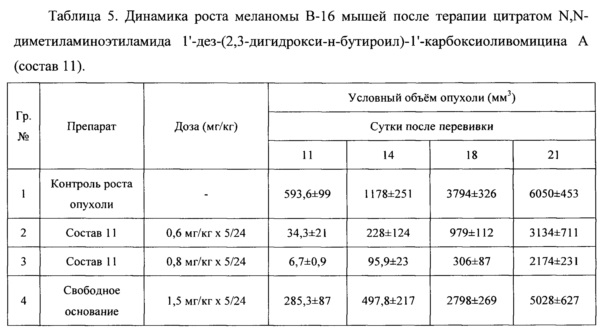
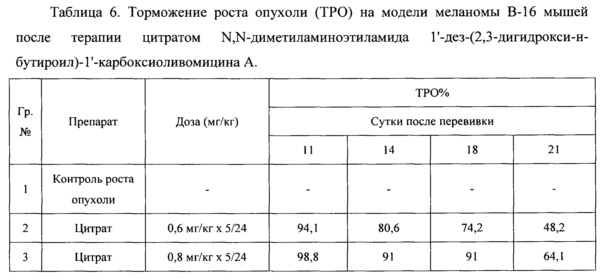
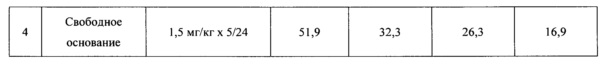
Полученные данные показывают, что цитрат N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А при пятидневном введении проявляет высокую противоопухолевую активность в отношении меланомы мышей В-16, значительно превосходящую противоопухолевую активность свободного основания, примененного в оптимальном режиме.