Результат интеллектуальной деятельности: ХИМЕРНЫЕ АНТИБИОТИКИ НА ОСНОВЕ ГЛИКОПЕПТИДОВ И 11,12-ЦИКЛИЧЕСКОГО КАРБОНАТА АЗИТРОМИЦИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к фармацевтической промышленности и касается новых производных на основе гликопептидных антибиотиков и антибиотика азитромицина и способа их получения.
Антибиотики - вещества природного происхождения, их синтетические и полусинтетические аналоги, подавляющие рост клеток, чаще всего прокариотических или простейших. Антибиотики занимают на мировом рынке лекарственных средств один из крупных сегментов и широко используются для лечения инфекционных заболеваний. Эффективными классами антибактериальных агентов являются антибиотики-макролиды, в том числе, азитромицин и гликопептидные антибиотики.
Азитромицин (1) (Формула 1) - антибиотик-азалид широкого спектра действия, обладающий уникальной по сравнению с другими макролидами способностью накапливаться в органах и тканях. Азитромицин активно поглощается разными клетками, включая лейкоциты, фибробласты, макрофаги и фагоциты, и вместе с ними транспортируется к месту инфекции (воспаления) [Lalak N.J., Morris D.L., Azithromycin Clinical Pharmacokinetics, Clinical Pharmacokinetics, 1993, V. 25, P. 370-374; Gladue R.P, Bright G.M., Isaacson R.E., Newborg M.F. In vitro and in vivo uptake of azithromycin (CP-62,993) by phagocytic cells: possible mechanism of delivery and release at sites of infection. Antimicrobial Agents Chemotherapy, 1990, V. 34, P. 1056-1060].
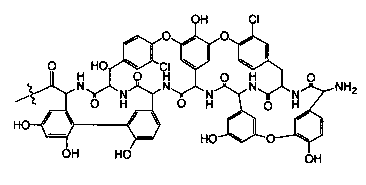
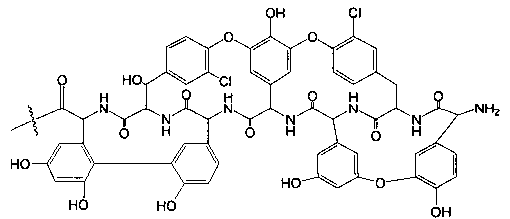
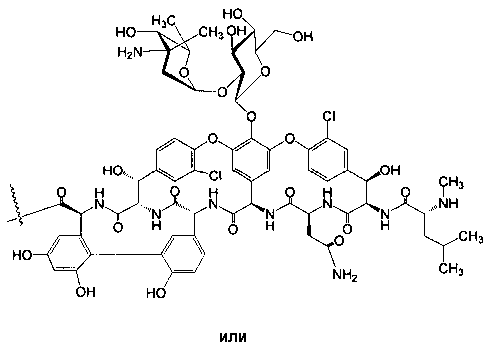
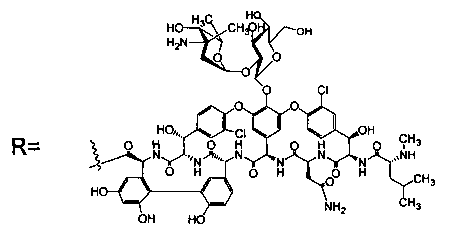
Гликопептидные антибиотики включат такие соединения, как ванкомицин (2), эремомицин (3) и агликон тейкопланина (4) (формула 1), в основе строения которых лежат циклические или полициклические гликозилированные нерибосомные пептиды [Van Bambeke F., Van Laethem Y., Courvalin P., Tulkens P.M. Glycopeptide antibiotics: from conventional molecules to new derivatives. // Drugs. - 2004. - V. 64. - P. 913-936]. Ванкомицин (2) представляет собой трициклический гептапептид, к которому присоединен дисахарид, состоящий из аминодезоксисахара (ванкозамина) и D-глюкозы (формула 1) [Sztaricskai F., Pelyva's-Ferenczik I.. Chemistry of carbohydrate components. In Glycopeptide Antibiotics, 1st edn (Ed. Nagarajan R.), 1994, Marcel Dekker, New York, NY, USA]. Эремомицин (3) - оригинальный отечественный антибиотик, агликон которого отличается от агликона ванкомицина отсутствием атома хлора в боковом ароматическом радикале аминокислоты 6, структурой дисахаридной цепи (2-O-(α-L-эремозаминил)-β-D-глюкопиранозил) и наличием третьего углеводного остатка (L-эремозаминил) в боковом радикале аминокислоты 6 (формула 1) [Gause G.F., Brazhnikova M.G., Lomakina N.N., Berdnikova T.F., Fedorova G.B., Tokareva N.L., Borisova V.N., Batta G. Eremomycin - new glycopeptide antibiotics. Chemical properties and structure. J. Antibiotics, 1989, V. 42, P. 1790-1799]. Агликон тейкопланина (4) представляет собой гептапептид, в котором боковые радикалы аминокислот 1 и 3 являются ароматическими и соединены между собой эфирной связью (формула 1). Гликопептидные антибиотики активны в отношении грамположительных аэробных и анаэробных микроорганизмов и являются препаратами выбора при инфекциях, вызванных метициллин-устойчивых Staphylococcus aureus (MSRA), метициллин-устойчивых Staphylococcus epidermidis (MRSE), а также резистентными к ампицилину и аминогликозидам энтерококками.
Большую проблему представляет собой распространение резистентных грамположительных микроорганизмов, в том числе устойчивых к ванкомицину энтерококков (VRE) и появление ванкомицин-резистентных St. aureus (VRSA) [Mendez-Alvarez S., Perez-Hernandez X., Claverie-Martin F. Glycopeptide resistance in enterococci. // Internat. Microbiol. - 2000. - V. 3. - P. 71-80; Cetinkaya Y., Falk P., Mayhall C.G. Vancomycin-resistant Enterococci. // Clin. Microboil. Rev. - 2000. - V. 13. - P. 686-707]. Штаммы VRE, и, в особенности, VRSA устойчивы к подавляющему большинству применяемых антибиотиков, поэтому поиск новых эффективных антибиотиков является актуальной задачей.
Известно, что в ряде случаев, особенно при лечении тяжелых инфекций, в том числе вызванных MRSA, комбинированная терапия с использованием макролидов (таких как азитромицин) и антибиотиков, механизм действия которых связан с воздействием на клеточную стенку бактерий (таких как пенициллин или ванкомицин), оказывается более эффективной, чем монотерапия макролидами или β-лактамами или гликопептидами [Deresinski S. Vancomycin in combination with other antibiotics for the treatment of serious Methicillin-Resistant Staphylococcus aureus infections, Clinical Infectious Diseases, 2009, V. 49, P. 1072-107; Marti'nez J.A., Horcajada J.P., Almela M., Marco F., Soriano A., Garci'a A., Marco M.A., Torres A., Mensa J. Addition of a macrolide to a β-lactam-based empirical antibiotic regimen is associated with lower in-hospital mortality for patients with bacteremic Pneumococcal pneumonia, Clinical Infectious Diseases, 2003, V. 36, P. 389-395].
Известно однако, что комбинированная терапия обладает рядом серьезных недостатков, поскольку эффект определенной комбинации, наблюдаемый in vitro, не всегда проявляется in vivo из-за различных фармакокинетических характеристик каждого из препаратов, входящих в комбинацию. Кроме того, это стратегия не применима к тем полирезистентным микроорганизмам, которые устойчивы к каждому из антибиотиков, входящих в комбинацию, по отдельности.
В связи с этим целью настоящего изобретения является получение новых «химерных» антибиотиков на основе гликопептидных антибиотиков и макролидного антибиотика азитромицина.
Поставленная задача решается путем получения химерных антибиотиков на основе гликопептидных антибиотиков и макролидного антибиотика азитромицина.
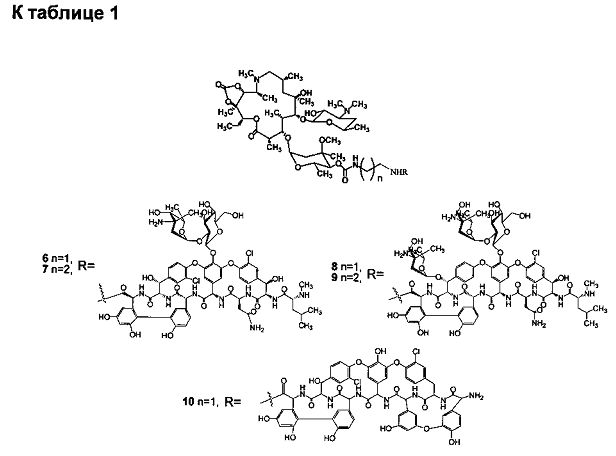
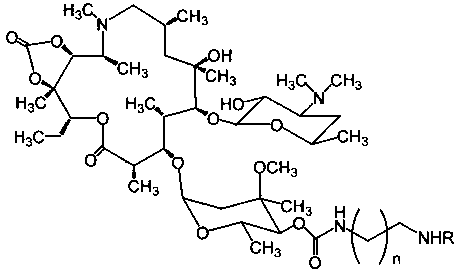
Изобретение включает соединения, соответствующие формуле 2:
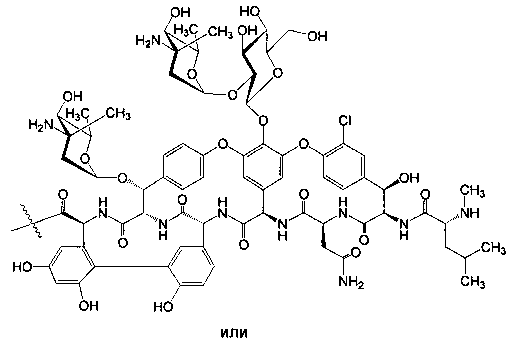
где n=1-10, a R представляет собой гликопептидный антибиотик, такой как ванкомицин, или эремомицин, или агликон тейкопланина.
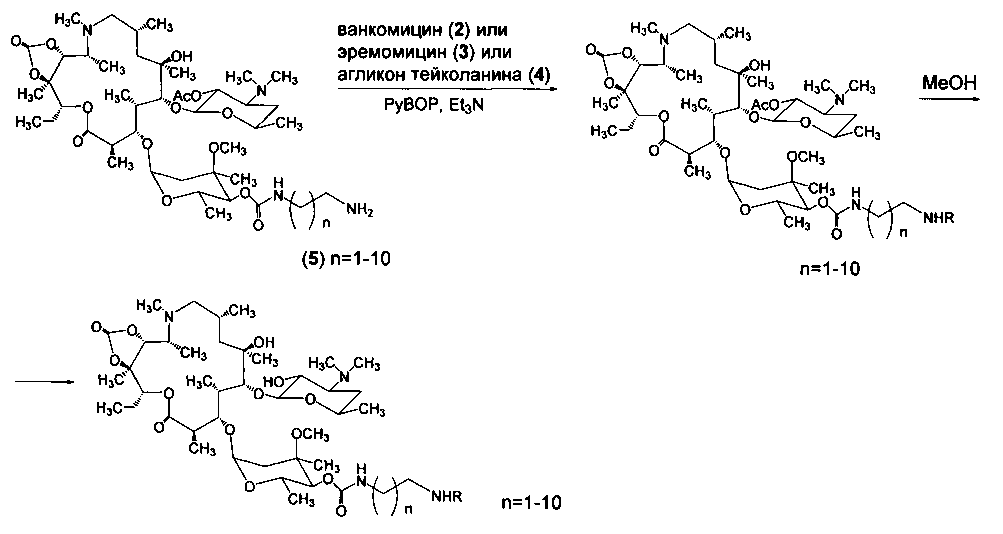
Изобретение также включает в себя способ получения антибиотиков на основе азитромицина и гликопептидных антибиотиков (формула 1), заключающийся в проведении реакции ацилирования 11,12-циклического карбоната 2'-О-ацетил-4''-O-(амино)карбамоилазитромицина (5) гликопептидным антибиотиком (эремомицином (2) или ванкомицином (3) или агликоном тейкопланина (4)) в присутствии конденсирующего агента (Схема 1) и последующем удалении 2'-O-ацетил-защитной группы.
Поиск, проведенный в патентной и научно-технической литературе, показал, что химерные антибиотики на основе азитромцина и гликопептидных антибиотиков не описаны и не исследованы и, следовательно, являются новыми соединениями.
11,12-Циклический карбонат 2'-O-ацетил-4'-O-(ω-аминоалкил)карбамоилазитромицина (5) получен в две стадии из азитромицина (1) методом, описанным в литературе [Ma X., Zhang L., Wang R., Cao J., Liu C., Fang Y., Wang J., Ma S. Novel C-4"-modified azithromycin analogs with remarkably enhanced activity against erythromycin-resistant Streptococcus pneumonia: The synthesis and antimicrobial evaluation. // Europ. J. Med. Chem. - 2011. - V. 46. - P. 5196-5205].
Реакцию ацилирования 11,12-циклического карбоната 2'-O-ацетил-4''-O-(ω-аминоалкил)карбамоилазитромицина (5) (Схема 1) гликопептидным антибиотиком с получением соединения формулы 2 проводят в присутствии конденсирующих агентов, известных из уровня техники и применяемых для образования амидной связи, например, бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфата (РуВОР) или О-(бензотриазол-1-ил)-N,N,N',N'-бис(тетраметилен)) гексафторфосфат мочевины (HBPyU). Реакцию ацилирования 11,12-циклического карбоната 2'-O-ацетил-4''-O-(ω-аминоалкил)карбамоилазитромицина (5) (Схема 1) гликопептидным антибиотиком с получением соединения формулы 2 проводят в растворителе, выбираемом из метанола, этанола, N,N-диметилформамида, диметилсульфоксида, толуола, ксилола и хлороформа.
Соединения формулы 2 обладают выраженной антибактериальной активностью, в том числе в отношении штаммов, устойчивых к ванкомицину (см. Пример 2), и могут быть использованы для лечения инфекционных заболеваний.
Вспомогательные средства
Эремомицин сульфат получен на опытной установке НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе РАМН. Ванкомицин гидрохлорид, агликон тейкопланина были коммерческими продуктами фирмы Aldrich (США). Бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфат (РуВОР), O-(бензотриазол-1-ил)-N,N,N',N'-бис(тетраметилен)) гексафторфосфат мочевины (HBPyU) были коммерческими продуктами фирмы Acros. Все растворы высушивали над сульфатом натрия и упаривали при температуре не выше 40°C.
Тонкослойную хроматографию осуществляли на пластинках с силикагелем G60 (Merck) в смеси растворителей: система (A1) AcOEt-n-PrOH-NH4OH, 1:1:1.25, и система (А2) AcOEt-n-PrOH-NH4OH, 1:1:2. Для препаративной очистки использовали колоночную хроматографию на силанизированном силикагеле Merck с размером частиц 0.040-0.063 µм.
Аналитическую ВЭЖХ осуществляли на хроматографе LC-10 (Shimadzu, Япония) с использованием УФ детектора и колонки Kromasil 100-С18 4×250 мм, размер частиц 6 мкм (АО БиоХимМак СТ, РФ). Подвижной фазой служили системы, состоящие из двух компонентов А и Б:
Система (1): А (0.2% HCOONH4 рН 6.4) и Б (MeCN), изократический режим 8% ацетонитрила от 0 до 5 минут, затем линейный градиент концентрации ацетонитрила 8→70% от 5 до 20 мин, затем изократический режим 70% ацетонитрила от 20 до 40 минут, скорость потока 1.0 мл/мин;
Система (2): А (0.2% HCOONH4 рН 6.4) и Б (MeCN), изократический режим 8% ацетонитрила от 0 до 15 минут, затем линейный градиент концентрации ацетонитрила 8→70% от 15 до 30 мин, затем изократический режим 70% ацетонитрила от 30 до 40 минут, скорость потока 1.0 мл/мин.
ИК-спектры снимали в таблетке КВr на спектрофотометре DTGS. Температуры плавления получены на приборе Buchi SMP-20.
Масс-спектры при ионизации электрораспылением (ESI) получали на приборе Finnigan MAT 900S (Германия).
Примеры получения производных на основе азитромицина и гликопептидных антибиотиков по настоящему изобретению и изучение их антибактериальной активности
Пример 1. Общая методика проведения реакции ацилирования 11,12-циклического карбоната 2'-O-ацетил-4''-O-(ω-аминоалкил)карбамоилазитромицина (5) гликопептидными антибиотиками (ванкомицином, или эремомицином, или агликоном тейкопланина), отщепления ацетильной группы и очистки.
К раствору гликопептидного антибиотика (0.129 ммоль) в ДМСО (7 мл) добавляли 11,12-циклического карбоната 2'-O-ацетил-4''-O-(ω-аминоалкил)карбамоилазитромицина (5) (3 экв., 0.386 ммоль), значение рН реакционной смеси доводили до ~7.5 добавлением Et3N. Порциями в течение 1 ч добавляли РуВОР (1.1 экв., 0.141 ммоль), поддерживая рН реакционной смеси ~7.5 добавлением Et3N. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, затем добавляли пятикратный объем диэтилового эфира. Полученную смесь интенсивно перемешивали, затем эфирный слой удаляли. Процедуру повторяли дважды, до получения вязкого масла, затем добавляли ацетон (2 мл) и избыток диэтилового эфира, выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали. Раствор полученных 2'-O-ацетильных производных в МеОН (5 мл) выдерживали при 37°С в течение 24 ч. Последующее концентрирование раствора в вакууме приводили к целевым производным, которые далее очищали методом колоночной хроматографии на силанизированном силикагеле. Вещество растворяли в 30% водном растворе МеОН, наносили на колонку с силанизированным силикагелем, уравновешенную системой МеОН-Н2О (30:70). Элюцию осуществляли системой МеОН-Н2O (30:70) (100 мл), затем системой МеОН-Н2O (40:60) (100 мл), затем системой МеОН-Н2О-СН3СООН (30:70:0.1) (100 мл). Фракции, содержащее целевое вещество, объединяли, упаривали на роторном испарителе с добавлением n-BuOH, к остатку добавляли диэтиловый эфир. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали в вакууме. Физико-химические данные для производных 6-10 представлены в Таблице 1.

Пример 2. Изучение антибактериальной активности антибиотиков на основе азитромицина и гликопептидных антибиотиков
В работе использовались одноразовые стерильные 96-луночные плоскодонные планшеты, чашки Петри, пипетки, наконечники и пробирки (Пан-Эко, Москва).
Питательные среды: бульон и агар Мюллера-Хинтон для работы готовили из сухих сред (Mueller Hinton broth and Mueller Hinton agar, Acumedia, Baltimore) и стерилизовали автоклавированием при 121°С в течение 15 мин.
Для культивирования Staphylococcus, Escherichia coli, Klebsiella pneumoniae, Salmonella cholerasuis использовали готовую сухую среду - Триптиказо-соевый агар (Trypticase Soy Agar, BBL). Для культивирования Enterococcus, Pseudomonas aeruginosa использовали готовую сухую среду - Колумбийский агар (Columbia Agar Base, BBL).
Сравнительная оценка спектра антибактериального действия на эталонных штаммах грамположительных и грамотрицательных микроорганизмов проводилась с использованием микрометода определения минимальной подавляющей концентрации (МПК) методом серийных разведений в бульоне Мюллера-Хинтон с использованием 96-луночных стерильных планшетов.
Исходные растворы испытуемых соединений готовили в концентрации 1000 мкг/мл.
МПК определяли методом серийных разведений в бульоне с шагом 2, поэтому различия соседних разведений не считаются существенными. В каждом опыте присутствовал контроль бульона и роста бактериальной культуры.
Приготовление инокулюма
Для приготовления инокулюма использовали чистую, суточную культуру грамположительных и грамотрицательных микроорганизмов, выросших на плотной питательной среде, соответствующей для каждого типа микроорганизмов (см. Материалы). В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5×108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 5×105 КОЕ/мл бульоном Мюллера-Хинтон. Инокулюм использовали в течение 15 минут после приготовления; чистота бактериальных штаммов контролировалась перед каждым экспериментом.
Постановка эксперимента
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтон; в первую лунку вносили испытуемое вещество в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.25 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм, разводя тем самым вдвое концентрацию изучаемых соединений. Каждый препарат в эксперименте титровали дважды. В качестве контроля включали лунки, не содержащие тестируемых веществ (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36°С в течение 24 часов.
Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них.
За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов.
Полученные данные представлены в Таблице 2.
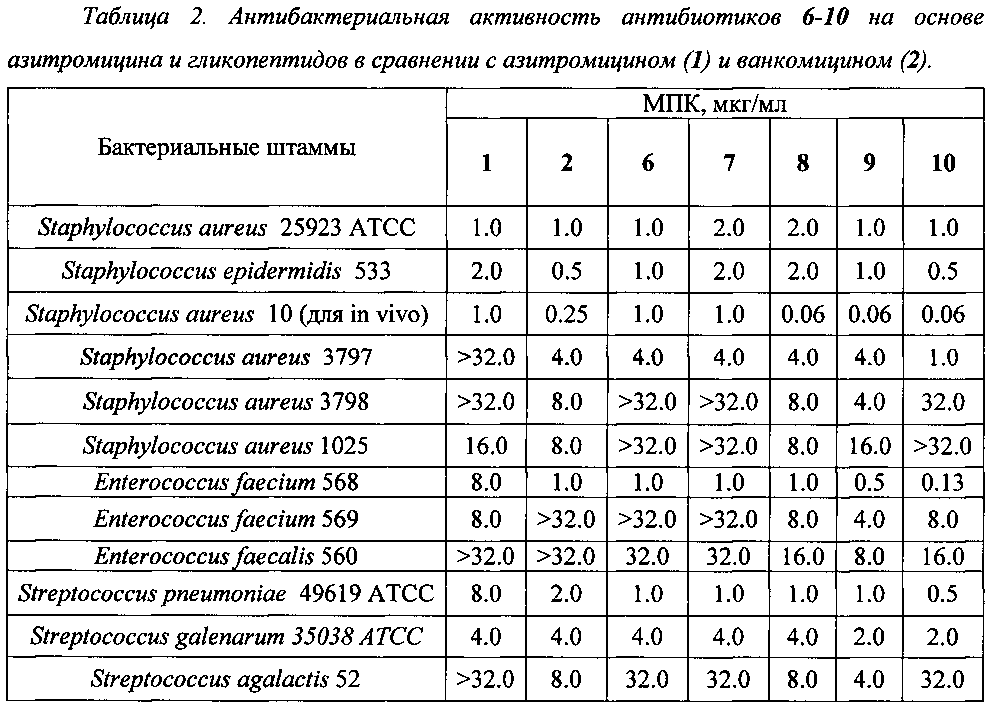
Полученные данные свидетельствуют, что все синтезированные химерные антибиотики на основе азитромицина и гликопептидов 6-10 не уступали или превосходили азитромицин и ванкомицин по антибактериальной активности в отношении всех изученных штаммов грамположительных бактерий.
Особо ценной является высокая активность производных (выше, чем у азитромицина и ванкомицина) в отношении пневмококков (Streptococcus pneumoniae), являющихся причиной большинства случаев менингитов, внебольничных пневмоний и ряда гнойно-септических инфекций.
Производные на основе эремомицина и азитромицина оказались активны в отношении штаммов Enterococcus faecium и Enterococcus faecalis, устойчивых к ванкомицину.
Таким образом, предложены новые антибиотики на основе азитромицина и гликопептидов, обладающие высокой антибактериальной активностью, в том числе, в отношении ряда штаммов Enterococcus, устойчивых к ванкомицину, и способ их получения.
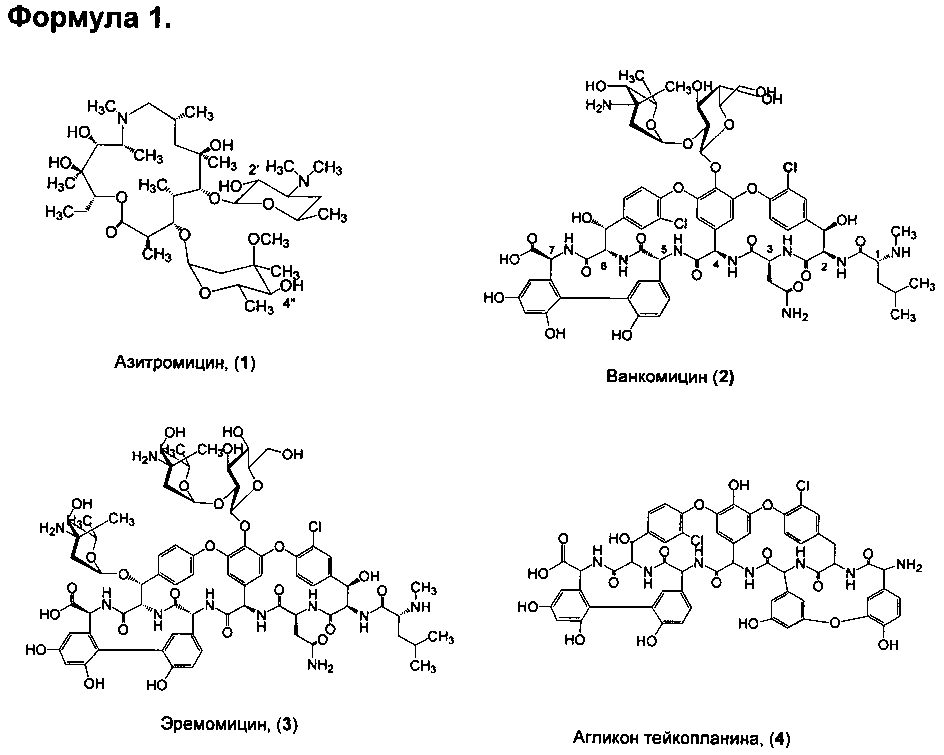
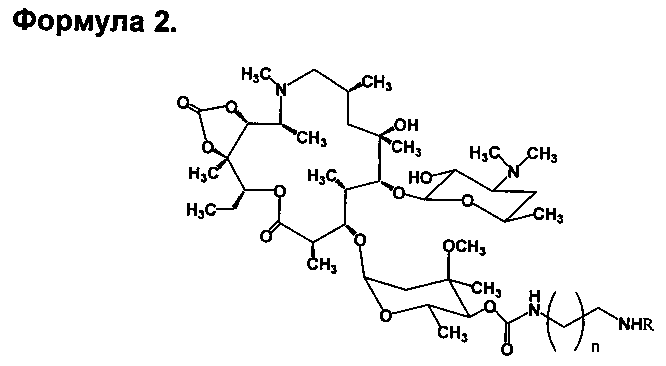
Схема 1.
 или
или 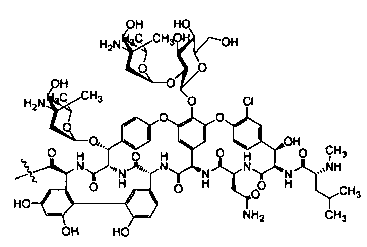
или