Результат интеллектуальной деятельности: Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона
Вид РИД
Изобретение
Изобретение относится к способу получения индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-диона 2 из индолино[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индолин-1,3(2H,10H)-диона 1 (Схема 1). Индололо[1',7':1,2,3]пиролло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-дион 2 является ключевым веществом для получения потенциального противоопухолевого средства [1, 2].

Область техники, к которой относится изобретение
Фармацевтическая промышленность. Для наработки и производства значительных количеств продукта 2 следовало разработать способ его синтеза, дающий больший выход.
Уровень техники
Способ получения соединения 2, описанный ранее [3] был неудобен для наработки значительных количеств, необходимых для проведения предклинических испытаний, субстанции.
Описанный ранее способ дегидрирования соединения с формулой 1 при помощи 2,3-дихлоро-5,6-дицианбензохинона (DDQ) был затруднен образованием димерного побочного продукта 3 (схема 2) и сопутствовавшим этому низким выходом, а также затруднительной очисткой целевого вещества.
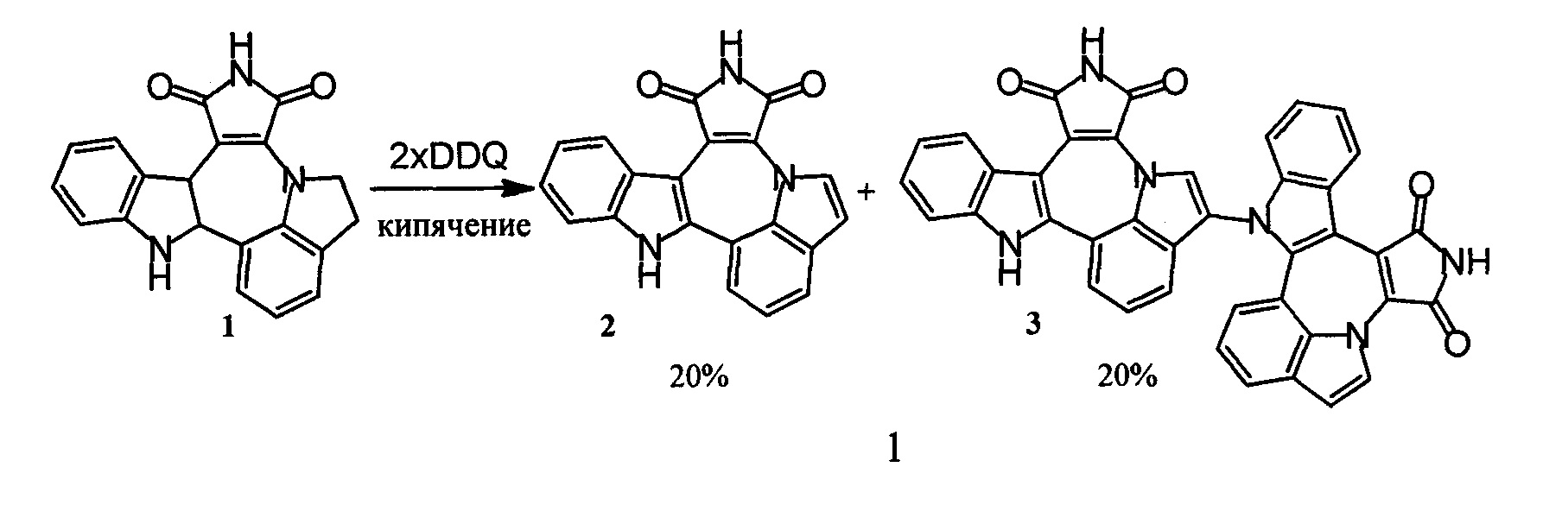
Схема 2. Дегидрирование индолино[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индолин-1,3(2Н,10Н)-диона 1 при помощи DDQ.
Окисление при помощи активной MnО2 давало еще меньший выход и было также осложнено образованием димера 3 [3].

Раскрытие изобретения
Сущность изобретения заключается в новом способе получения соединения с формулой 2, более удобного с синтетической точки зрения и дающего более высокий выход целевого вещества с формулой 3. Поскольку в образовании димера 3 участвовал один из индольных атомов азота молекулы, это было осуществлено путем введения по индольному атому азота какой-либо защитной группы PG (Схема 3). Реализован синтез с двумя видами PG силильной и ацильной.

Схема 3. Синтез индоло[1',7':1,2,3]пирроло[3',4,:6,7]азепино[4,5-b]индол-1,3(2H,10H)-диона, условия проведения реакций приведены ниже.
1. Путь I→III→V; 
Реакция I. Введение защитной группы.
Реакция проводится в полярном апротонном растворителе, в качестве которого могут выступать например ДМФА, диметилацетамид, тетрагидрофуран, метил-т-бутиловый эфир, диметилсульфоксид, ацетон и другие полярные апротонные растворители. Реагентом для введения защитной группы может быть вещество с формулой  , где R1, R2, R3 могут быть независимо друг от друга алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R1, R2, R3 хлор, бром или йод. Реакция проводится в присутствии органического основания.
, где R1, R2, R3 могут быть независимо друг от друга алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R1, R2, R3 хлор, бром или йод. Реакция проводится в присутствии органического основания.
Реакция III. Дегидрирование.
Реакцию проводят в бензоле, толуоле, о-, м-, п-ксилоле, хлорбензоле, дихлорбензоле а также любом апротонном неполярном расворителе, в котором плохо растворяется 2,3-дихлоро-5,6-дициангидрохинон. Дегидрирование осуществляют при помощи более 2-х эквивалентов 2,3-дихлоро-5,6-дицианбензохинона.
Реакция V. Удаление защитной группы.
Вещество с формулой 7 нагревают в смеси минеральная или органическая кислота - вода - полярный растворитель, такой как ТГФ, диоксан, спирт С1-С5, в том числе с разветвленной алкильной цепью до температуры.
2. Путь II→IV→VI; 
Реакция II. Введение защитной группы.
А. Реакция проводится в полярном апротонном растворителе, в качестве которого могут выступать например ДМФА, диметилацетамид, тетрагидрофуран, метил-т-бутиловый эфир, ацетон и другие полярные апротонные растворители. Реагентом для введения защитной группы может быть вещество с формулой  где R4 может быть алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R4 хлор, бром или йод. Реакция проводится в присутствии органического основания, любого третичного амина, такого так триэтиламин или диизопропилэтиламин.
где R4 может быть алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R4 хлор, бром или йод. Реакция проводится в присутствии органического основания, любого третичного амина, такого так триэтиламин или диизопропилэтиламин.
Б. Реакция проводится в полярном апротонном растворителе, в качестве которого могут выступать, например, ДМФА, диметилацетамид, тетрагидрофуран, метил-т-бутиловый эфир, ацетон и другие полярные апротонные растворители. Реагентом для введения защитной группы может быть вещество с формулой  где R4 может быть алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R4 хлор, бром или йод. Реакция проводится в присутствии органического основания, любого третичного амина такого, как, напрмер, триэтиламин или диизопропиэтилламин.
где R4 может быть алкил C1-С7, разветвленный алкил С3-С9, арил, замещенный в ядре арил, Hal может быть независимо от вида R4 хлор, бром или йод. Реакция проводится в присутствии органического основания, любого третичного амина такого, как, напрмер, триэтиламин или диизопропиэтилламин.
В. Реакция проводится без растворителя при нагревании исходного вещества 1 и РЕАГЕНТА3 с формулой  , где R4 может быть алкил C1-C7, разветвленный алкил С3-С9, арил, замещенный в ядре арил.
, где R4 может быть алкил C1-C7, разветвленный алкил С3-С9, арил, замещенный в ядре арил.
Реакция IV. Дегидригование.
Реакцию проводят в бензоле, толуоле, о-, м-, п-ксилоле, хлорбензоле, дихлорбензоле а также любом апротонном неполярном расворителе, в котором плохо растворяется 2,3-дихлоро-5,6-дициангидрохинон. Дегидрирование осуществляют при помощи более 2-х эквивалентов 2,3-дихлоро-5,6-дицианбензохинона.
Реакция VI. Удаление защитной группы.
Реакцию проводят в полярном растворителе под действием кислоты, например HBr, HCl, H2SO4, MeSO3Н, толуолсульфокислоты.
Примеры синтеза
Пример 1. (Реакция I)
10-[трет-бутил(диметил)силил]-5,6,10,14b-тетрагидроиндоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,9bH)-дион (4)
К раствору 5,6,10,14b-тетрагидроиндоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индоло-1,3(2H,9bH)-диона (1) 3.3 г (10 ммоль) в ДМФА (30 мл) добавили диизопропилэтиламин (1.3 г, 1.75 мл, 10 ммоль) и TBDMSC1 (1.7 г, 12 ммоль). Реакционную массу оставили на ночь при перемешивании. Реакционную массу вылили в холодную воду (150 мл) и экстрагировали EtOAc (3×50 мл). Органические экстракты объединили, сушили и упарили. Целевое вещество выделяли хроматографически (Петролейный эфир - этилацетат 7:1). Фракции, содержащие продукт, объединили и упарили. Получили силильное производное 4 (3.7 г, 8.5 ммоль, 85%) в виде твердого вещества оранжевого цвета. Т. пл. 187-189°C, 'Н ЯМР-спектр, δ: -0,02 (с, 6Н, Si(CH3)2), 0.88 (с, 9Н, SiC(CH3)3), 3.09-3.13 (м, 2Н), 4.44-4.50 (м, 3Н), 4.66 (д, 1H, J 6.8), 6.48 (д, 1H, J 8.2), 6.52 (т, 1Н, J 8.2), 6.53 (т, 1H, J 7.5), 6.90 (т, 1Н, J 7.7), 6.99 (д, 1Н, J 7.3), 7.17 (д, 1H, J 7.0), 7.42 (д, 1H, J 7.7), 10.61 (с, 1H, N-H); 13С ЯМР-спектр, δ: -3.2, 17.1, 25.3, 27.5, 42.4, 49.5, 62.5, 103.0, 1083.9, 117.1, 122.8, 124.1, 124.2, 127.4 (2С), 129.5, 131.6, 133.0, 138.0, 142.0, 149.4, 168.2 (C=O), 171.9 (C=O).
Пример 2. (Реакция II, РG = ацетил)
10-ацетил-5,6,10,14b-тетрагидроиндоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индоло-1,3(2H,9bH)-дион (5).
5,6,10,14b-тетрагидроиндоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индоло-1,3(2H,9bH)-дион 1 3.3 г (10 ммоль) суспендировали в уксусном ангидриде (50 мл). Реакционную массу нагревали до кипения в течение 3 ч, осадок за это время растворяется, охладили и упарили. Остаток кристаллизовали из изопропанола. Получили 3.5 г (9.4 ммоль, 94%) продукта 5 в виде твердого вещества оранжевого цвета. Т. пл. 288-290°C, 1Н ЯМР-спектр, δ: 2.35 (с, 3H, N-C(O)CH3), 3.11-3.23 (м, 2Н, С6-Н), 4.31-4.39 (м, 1Н, С5-Н), 4.77-4.84 (м, 1Н), 4.98 (д, 1H, J 5.7), 5.61 (д, 1Н, J 5.5), 6.95-6.99 (м, 3Н), 7.14-7.18 (м, 3Н), 7.66 (д, 1Н, J 9.0), 10.51 (с, 1Н, N-H); 13С ЯМР-спектр, δ: 22.0, 27.0, 43.3, 49.1, 62.6, 94.5, 117.3, 122.6, 123.1, 123.3, 123.8, 124.0, 126.4, 126.8, 133.3, 136.8, 138.0, 140.1, 141.0, 167.3 (C=O), 167.5 (N-Ac), 171.1 (C=O).
Пример 3. (Реакция III)
10-[трет-бутил(диметил)силил]индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-дион (7).
К раствору азепина 4 (1.5 г, 3.4 ммоль) в толуоле (50 мл) добавили DDQ (3.4 г, 7.5 ммоль). Реакционную массу нагревали до кипения в течение 16 часов при перемешивании. Реакционную массу охладили и выпавший осадок отфильтровали. Фильтрат промывали насыщенным раствором NaHCO3 до бесцветных промывных вод. Органический слой сушили и упарили. Остаток очистили хроматографически. Получили азепин 7 (1.1 г,2.6 ммоль, 75%) в виде твердого вещества темно-синего цвета. Т. пл. 195-197°C, 1Н ЯМР-спектр, δ: 0,04 (с, 6Н, Si(CH3)2), 0.85 (с, 9Н, SiC(CH3)3), 6.50 (д, 1Н, J 3.5), 6.91 (т, 1Н, J7.7), 6.99 (т, 1Н, J 7.3), 7.07 (д, 1H, J 8.5), 7.10 (т, 1H, J 7.9), 7.15 (д, 1H, J 7.9), 7.29 (д, 1H, J 8.0), 8.03 (д, 1H, J 8.4), 8.13 (д, 1H, J 3.6), 11.73 (c, 1H, N-H). 13C ЯМР-спектр, δ: 28.5, 46.1, 48.0, 105.8, 110.9, 119.9, 120.0, 121.2, 121.3, 122.2, 122.4, 123.0, 123.1, 123.8, 124.0, 124.9, 131.5, 138.3, 138.6, 139.5, 147.5, 166.1 (C=O), 169.4 (C=O).
Пример 4. (Реакция IV, PG = ацетил)
10-ацетилиндоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-дион (6).
Получали из ацетильного производного 5 по методике, аналогичной применяемой для синтеза производного азепина 7 с выходом 78% в виде твердого вещества темно-синего цвета. Т. пл. 291-292°C, 1Н ЯМР-спектр, δ: 2.20 (с, 3H, NC(O)CH3), 6.60 (д, 1Н, J 3.6), 6.73 (д, 1Н, J 7.3), 7.04 (т, 1Н, J 7.7), 7.24 (т, 1Н, J 8.1), 7.30 (д, 1Н, J 5.5),7.31 (т, 1Н, J 5.7), 7.73 (д, 1H, J 8.0), 8.03 (д, 1Н, J 3.5), 8.04 (д, 1H, J 8.2), 11.29 (с, 1H, N-H). 13С ЯМР-спектр, δ: 28.5, 107.8, 112.3, 116.0, 120.8, 121.7, 122.9, 123.2, 123.31, 1213.35, 123.4, 124.5, 125.2, 125.3, 128.0, 131.7, 137.8, 139.2, 146.4, 165.7 (C=О), 168.9 (C=O), 173.0.
Пример 5. (Реакция V, PG = ацетил)
Индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-дион (2)
Силильное производное 10 (1.5 г, 4.1 ммоль) суспендировали в смеси АсОН - вода (1:1,20 мл) к смеси добавили ТГФ до расворения и кипятили в течение 10 часов. Реакционную смесь охладили, упарили, остаток кристаллизовали из изопропанола. Получили азепин 3, идентичный по физикохимическим характеристикам полученному ранее (1.2 г, 3.7 ммоль, 90%). [3]
Пример 6. (Реакция VI, PG = ацетил)
Индоло [1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-дион (2)
Ацетильное производное 9 (1.5 г, 4.1 ммоль) растворили в 2М растворе HCl в ТГФ (20 мл) и оставили на 16 часов при перемешивании. Реакционную смесь упарили. Остаток кристаллизовали из изопропанола, получили азепин 3, идентичный по физикохимическим характеристикам полученному нами ранее [3] (1.1 г, 3.3 ммоль, 80%) [3].
Таким образом, общий выход азепина Индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2H,10H)-диона 2 из 1 составил 57% по схеме с силильной защитой и 58% - с ацетильной (Схема 3), что более чем в два раза превышает выход при получении этого вещества известными на настоящий момент способами.
Литература
1. RU 2466132.
2. RU 2523387.
3. S.A. Lakatosh, Y.N. Luzikov and М.N. Preobrazhenskaya. Synthesis of 4-substituted 3-(indol-3-yl)maleimides and azepines with annelated indole and maleimide nuclei. Tetrahedron, 2005, v. 34, 8241-8248.
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/5961dbaf785e90f68f8edece3cb7edcf.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/e04f4d65f8e04090a6642bf79a4bdc56.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/83b7cbea0ee917e40a56ccbf6e225d5c.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/867c57c19f925a1804d843e7a851ae94.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/e61a9b0bec32dbc6024169a6c2c67104.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/4a8c1e1a8712bb31da6bf157c72f1ca5.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/ea3b8b0dc8a714880e054c8f3c34ba67.jpg)
![Способ синтеза индоло[1',7':1,2,3]пирроло[3',4':6,7]азепино[4,5-b]индол-1,3(2Н,10Н)-диона](https://fips.edrid.ru/images/rid/52/1c/3a/fd8f6647c8ba3dd36112c7816afd7bec.jpg)

