Результат интеллектуальной деятельности: СЕЛЕКТИВНЫЕ ЛИГАНДЫ G-КВАДРУПЛЕКСНЫХ СТРУКТУР НУКЛЕИНОВЫХ КИСЛОТ
Вид РИД
Изобретение
Область техники
Изобретение относится к фармацевтической промышленности и касается лигандов G-квадруплексных структур нуклеиновых кислот на основе линейных тетрациклических гетероциклических производных антрацендиона (гетероаренантрацендионов), содержащих в положениях 4, 11 аминоалкиламиногруппы и карбоксамидную группу в положении 2, имеющую цепь с терминальной гуанидиногруппой, а также их структуры, методов получения и медицинского использования в качестве агентов, ингибирующих рост опухолевых клеток.
Уровень техники
Фрагменты нуклеиновых кислот, богатые гуанином, способны к формированию четырехцепочечных элементов - G-квадруплексных структур [Ambrus Α., et al. Nucl. Acids Res., 2006, 34, 2723; Luu K.N., et al. J. Am. Chem. Soc., 2006, 128, 9963; Zhang S. et al., ChemMedChem, 2014, 9, 899]. G-квадруплексы, формируемые теломерными участками ДНК, регулируют активность фермента теломеразы, контролирующего длину теломерной ДНК и участвующего в контроле клеточного цикла нормальных и опухолевых клеток [Sedivy J.M. Cancer Cell, 2007, 11, 389]. Этот фермент является перспективной мишенью противоопухолевой терапии [Crees Ζ. et al. Current Pharmaceutical Design, 2014, 20, 6422; Chen Z.F. et al. J. Med Chem. 2015, 58, 2159]. Кроме того, G-квадруплексные структуры обнаружены в промоторных областях многочисленных онкогенов таких, как c-myc, c-kit, bcl-2, k-ras, h-ras, VEGF, HIF-1 [Le T.V.T., et al. Current Pharmaceutical Design, 2012, 18, 1948], в 5′-нетранслируемых участках иРНК (5′-UTR) [Kumari S., et al. Nat. Chem. Biol., 2007, 3, 218], а также в геноме ряда вирусов [Métifiot M. et al., Nucl. Acids Res. 2014, 42, 12352]. Доказано, что G-квадруплексные структуры играют важную роль в функционировании генома эукариотических клеток [Cogoi S., et al. Nucl. Acids Res. 2014, 42, 8379].
Таким образом, G-квадруплексные структуры теломерной ДНК, промоторов онкогенов, 5′-UTR участков РНК и генома вирусов являются перспективными мишенями для противоопухолевой и противовирусной терапии, а лиганды, стабилизирующие G-квадруплексы, рассматриваются как перспективные кандидаты для поиска новых лекарственных средств [Gu L.Q., et. al. ChemMedChem, 2008, 3, 690; Patel D.J., et al. Nucl. Acids Res. 2007, 35, 7429; Artusi S. et al. Antiviral Res. 2015, 108, 123; Harris L.M. et al., PLoS Pathog. 2015, 11, e1004562].
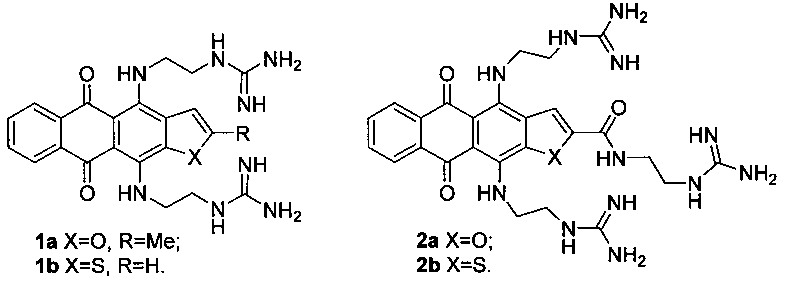
Ранее было показано, что гетероаренантрацендионы, содержащие в положениях 4 и 11 заместители с терминальными гуанидино- или амидиногруппами, обладают сродством к теломерным G-квадруплексным структурам ДНК. Так, производные с двумя боковыми цепями, содержащие терминальные гуанидиногруппы (соединения 1a, b), обладающие высокой аффинностью к G-квадруплексам, способны их стабилизировать и блокировать синтез теломер и транскрипцию ряда онкогенов [Shchekotikhin А.Е. et. al. Bioorg. Med. Chem., 2009, 17, 1861; Cogoi S., et al. J. Med. Chem., 2013, 56, 2764]. Наряду с этим показано, что введение в положение 2 дополнительного заместителя, содержащего терминальную гуанидиногруппу (соединения 2a, b), повышает сродство лигандов к теломерным G-квадруплексным структурам ДНК [Патент РФ №2527459 (2013)]. Однако увеличение числа гуанидиногрупп снижает внутриклеточное проникновение соединений, поэтому для эффективного воздействия на опухолевый рост перспективен поиск лигандов G-квадруплексных структур нуклеиновых кислот, содержащих одну гуанидиногруппу и имеющих лучшее накопление в опухолевых клетках [Ilyinsky N.S., et al. Eur. J. Med. Chem., 2014, 85, 605].
Раскрытие изобретения
Настоящее изобретение призвано получить новые лиганды на основе линейных тетрациклических гетероаренантрацендионов, более селективно стабилизирующие четырехцепочечные G-квадруплексные элементы нуклеиновых кислот и способные ингибировать пролиферацию опухолевых клеток. Настоящее изобретение включает соединения, соответствующие формуле 3, их фармакологически приемлемые соли и сольваты 3 и их использование в медицине для терапии опухолевых заболеваний.

где X означает независимо гетероатом (выбранный из О, S) или NH-группу, входящие в состав пятичленного гетероарена, конденсированного с антрацендионовым ядром по связи 2-3. Примеры гетероциклических ядер, пригодных для формирования базовой структуры гетероаренантрацендиона, включают, прежде всего, фуран и тиофен, а также их биоизостерный аналог, пиррол;
Y означает независимо атом кислорода, серы, CH2-группу или простую углерод-углеродную связь в составе боковых цепей, соединяющих аминогруппы в пери-положениях гетероаренантрацендионов с терминальными аминогруппами;
m означает независимо число 2 или 3, равное количеству атомов углерода алкиленового спейсера, соединяющего атом азота карбоксамидной группы, расположенной в положении 2 гетероциклического ядра гетероаренантрацендиона, с атомом азота терминальной гуанидиногруппы боковой цепи.
Кроме того, настоящее изобретение относится к применению соединений в качестве терапевтически активных для лечения заболеваний человека, связанных с повышенной скоростью роста клеток (т.е. гиперпролиферацией), прежде всего онкологических заболеваний различного генеза, включая без ограничения перечисленным, карциномы, лейкемии, лимфомы, меланомы, саркомы и т.п.
В отличие от описанных ранее лигандов на основе гетероаренантрацендионов, соединения формулы 3, являющиеся предметом настоящего изобретения, обладают большей специфичностью связывания с G-квадруплексными элементами нуклеиновых кислот, по сравнению с дуплексной формой ДНК. Комбинация аминоалкиламиногрупп в положениях 4, 11 гетероаренантрацендинов и боковой цепи в положении 2, содержащей терминальную гуанидиногруппу, способствует значительному увеличению селективности связывания лигандов формулы 3 с G-квадруплексами, по сравнению с ранее известными лигандами формул 1 и 2, содержащими две или три гуанидиногруппы [Cogoi S., et al. J. Med. Chem., 2013, 2013, 56, 2764; Ilyinsky N.S., et al. Eur. J. Med. Chem., 2014, 85, 605; Патент РФ №2527459 (2013)].
Соединения по настоящему изобретению могут быть получены различными способами. Один из них, описанный ниже, лишь иллюстрирует методы их синтеза и модификации функциональных групп. Исходные материалы и реагенты, которые используются при получении соединений формулы 3, являются коммерческими химическими веществами, поставляемыми такими фирмами, как Aldrich Chemical Co., Acros или их можно получить методами, известными специалисту в данной области, по методикам, описанным в литературе, при необходимости используя защитные группы.
Если не указано иное, реакции, приведенные в описании заявки, проводят при атмосферном давлении от приблизительно -78°С до 180°С, предпочтительно от 0°С до 120°С в инертном растворителе или без него, более предпочтительно при комнатной температуре (20-25°С).
Одна из общих схем получения соединений формулы 3 по настоящему изобретению включает стадии активации карбоксильной группы в положении 2 гетероцикла А, последующее ацилирование активированной кислотой В монозащищенного аминоалкиламина и удаление защитной группы. На следующей стадии проводится модификация терминальной аминогруппы в боковой цепи производного С в гуандиногруппу обработкой гуанидирующими агентами. Заключительным этапом служит замещение уходящих групп в положениях 4 и 11 ядра гетероаренантрацендиона D на аминоалкиламины или их аналоги (схема 1).
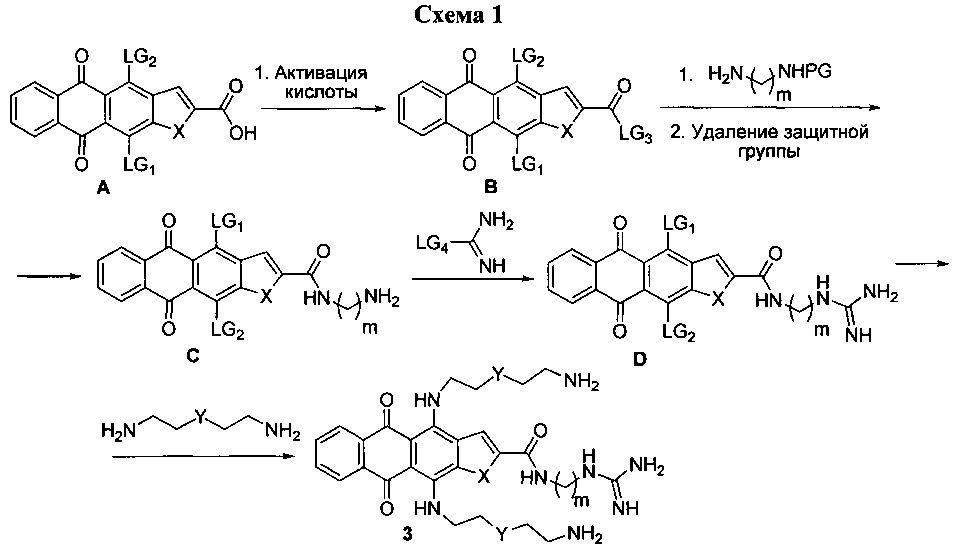
При этом подразумевается, что LG1-LG4 - означают уходящие группы; PG - защитные группы, используемые для повышения выхода и/или селективности реакций, а также для удобства выделения и очистки продуктов.
Если не указано иное, термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже. Следует отметить, что, если не указано иное, используемые в описании и пунктах формулы формы единственного числа включают также формы множественного числа.
"Алкил" означает, если не указано иное, одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью или циклический радикал, включающий только атомы углерода и водорода и содержащий от 1 до включительно 6 атомов углерода. Примеры алкильных радикалов включают, без ограничения перечисленным, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил и т.п.
"Алкилен" означает насыщенный двухвалентный углеводородный радикал с прямой цепью, содержащий от двух до трех атомов углерода, или насыщенный двухвалентный углеводородный радикал с разветвленной цепью, содержащий от трех до пяти атомов углерода. Например, С2-С3 алкилен включает, без ограничения перечисленным этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, 2,2-диметилпропилен и т.п.
"Алкокси" означает радикал -OR, где R - указанный выше алкильный радикал. Примеры алкоксирадикалов включают, без ограничения перечисленным, метокси, этокси, изопропокси, изобутокси и т.п.
"Амино" означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо - алкильные радикалы, указанные выше. Примеры аминогрупп включают, без ограничения перечисленным, метиламино, этиламино, диметиламино, метилэтиламино и т.п.
"Аминоалкил" означает алкильный радикал, указанный выше, замещенный одной или более, предпочтительно одной аминогруппой, указанной выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры аминоалкильных радикалов включают, без ограничения перечисленным, амино, аминометил, метиламинометил, диметиламинометил.
"Аминоалкиламино" означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от двух до пяти атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры аминоалкиламинорадикалов включают, без ограничения перечисленным, 2-аминоэтиламино, 2-аминопропиламино, 3-аминопропиламино, 4-аминобутиламино, 5-аминопентиламино и т.п.
"Антрацендион" означает производное 9,10-антрацендиона (антрахинона).
"Гетероарен" означает, если не указано иное, пятичленный ароматический гетероцикл, содержащий один гетероатом (выбранных из N, О или S), и необязательно замещенный заместителем, выбранным из группы, включающей алкил, алкокси, галоген, Примеры гетероаренов, пригодных для построения гетероаренантрацендионов, включают пиррол, фуран, тиофен.
"Гетероаренантрацендион" означает, если не указано иное, линейную замещенную тетрациклическую систему, состоящую из пятичленного гетероарена, конденсированного с антрацендионом по связи 2-3.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакций, как описано в литературе [Green, T.W.; Wuts, P.G. М. Protective Groups in Organic Synthesis. J. Wiley & Sons, N.-Y., 1991, 351]. Пример таких групп для блокирования амино-, имино- или гуанидино-групп включает, без ограничения перечисленным, трет-бутоксикарбонильную (Boc), адамантилоксикарбонильную (Adoc), флуоренилметоксикарбонильную (Fmoc), карбонилбензилокси (Cbz), метоксикарбонильную, этоксикарбонильную, тозильную группы.
"Изомеры" означает соединения с одинаковой молекулярной формулой, но отличающиеся природой или последовательностью химических связей, или пространственным расположением атомов.
Термин "ингибитор" относится к соединению, которое уменьшает активность фермента или снижает скорость деления опухолевых клеток.
"Инертный органический растворитель" означает растворитель, инертный в условиях описываемой в тексте реакции, включающий, например, бензол, толуол, ацетонитрил, тетрагидрофуран, Ν,Ν-диметилформамид, Ν,Ν-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано иное, растворители, используемные в реакциях по настоящему изобретению, являются инертными растворителями.
"Карбоксамидо" обозначает группу, соответствующую формуле: -CONR1R2, где NR1R2 означает амино, аминоалкиламино. Примеры NR1R2 радикалов включают, без ограничения перечисленным, амино, метиламино, этиламино, диметил амино, метилэтиламино, диэтиламино, 2-аминоэтиламино, 3-аминопропиламино, морфолинил, пиперазинил.
"G-квадруплекс", если не указано иное, означает четырехцепочечный элемент пространственной укладки гуанин-богатых последовательностей нуклеиновых кислот, формируемый стопкой плоских структур - G-квартетов (G-тетрады), в которых четыре остатка гуанина связаны между собой восьмью водородными связями.
"Лиганд", если не указано иное, означает молекулу, способную за счет многоцентрового связывания (которое может включать ионные, водородные, гидрофобные связи и стекинг-взаимодейстия) образовывать комплекс с био-молекулой или ее фрагментом.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет, и, что описание включает случаи, когда это событие или обстоятельство произойдет, и случаи, когда оно не произойдет. Например, термин "необязательно замещенный" при использовании в связи с термином "арил", "фенил", "бензил", "бензоил", "гетероарил" или "гетероциклил" означает арил, фенил, бензил, бензоил, гетероарил или гетероциклил, который необязательно и независимо содержит от одного до пяти заместителей, предпочтительно один или два заместителя, выбранных из группы, включающей алкил, алкокси, циклоалкил, галогеналкил, гидрокси, гидроксиалкил, галоген, нитро, циано, гидрокси, алкокси, амино, ациламино, аминоалил, карбоксиалкил, карбомоил, ацилокси и т.п.
"Сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват. Гидраты образуются в том случае, если в качестве растворителя используется вода, а если растворителем является спирт - образуются алкоголяты.
"Субъект" означает млекопитающих, т.е. любого члена класса млекопитающих, включая, без ограничения перечисленным, человека, приматов, сельскохозяйственных животных, лабораторных животных и т.п., предпочтительно человека. Термин субъект не означает конкретный возраст или пол.
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединения формулы 3 содержат группы, которые могут находиться в таутомерном равновесии, поэтому подразумевается, что настоящее изобретение включает все таутомерные формы соединений 3, а их названия не исключают любые таутомерные формы.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту является достаточным для оказания фармакологического действия при лечении патологического состояния субъекта. Терапевтически эффективное количество варьируется в зависимости от типа соединения, патологического состояния подлежащего лечению, тяжести болезни, возраста и относительного состояния здоровья субъекта, от способа и формы введения, от мнения лечащего врача или практикующего ветеринара и других факторов.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу атомов, которая замещается в условиях реакции. Примеры уходящей группы включают, без ограничения перечисленным, галоген, алкансульфонилокси (такие, как метансульфонилокси, этансульфонилокси), аренсульфонилокси, (такие, как бензолсульфонилокси, тозилокси), алкокси (метокси), алкилтио (тиометил), арилокси (фенокси), амино (диметиламино), гетероциклил (имидазолил) и т.п.
"Фармакологическое действие" означает термин, используемый в описании заявки, включает результаты воздействия на субъект, при которых достигается предполагаемая цель терапии. Например, фармакологическое действие означает такие результаты воздействия, которые приводят к излечению, замедлению развития или предупреждению рецидива заболевания.
"Фармацевтически приемлемый" означает материал, который используют при получении фармацевтической композиции, обычно являющийся безопасным, нетоксичным, безопасным в биологическом или ином отношении и включает материал, приемлемый как в ветеринарии, так и в фармацевтике.
"Фармацевтически приемлемые соли соединения" означают соли, которые являются фармацевтически приемлемыми и обладают необходимой фармакологической активностью исходного соединения. Эти соли включают: (1) кислотно-аддитивные соли неорганических кислот таких, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот таких, как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п., или (2) соли, образующиеся при замене кислотного протона (в О-Н, N-H или S-H-группах), присутствующего в исходном соединении, на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия, или при образовании координационного соединения с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, триэтаноламин и т.п. Приемлемые неорганические основания включают гидроксид калия, карбонат натрия, гидроксид натрия, гидроксид алюминия, гидроксид кальция и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли уксусной кислоты, соляной кислоты, серной кислоты, метансульфоновой кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния.
Краткое описание фигур
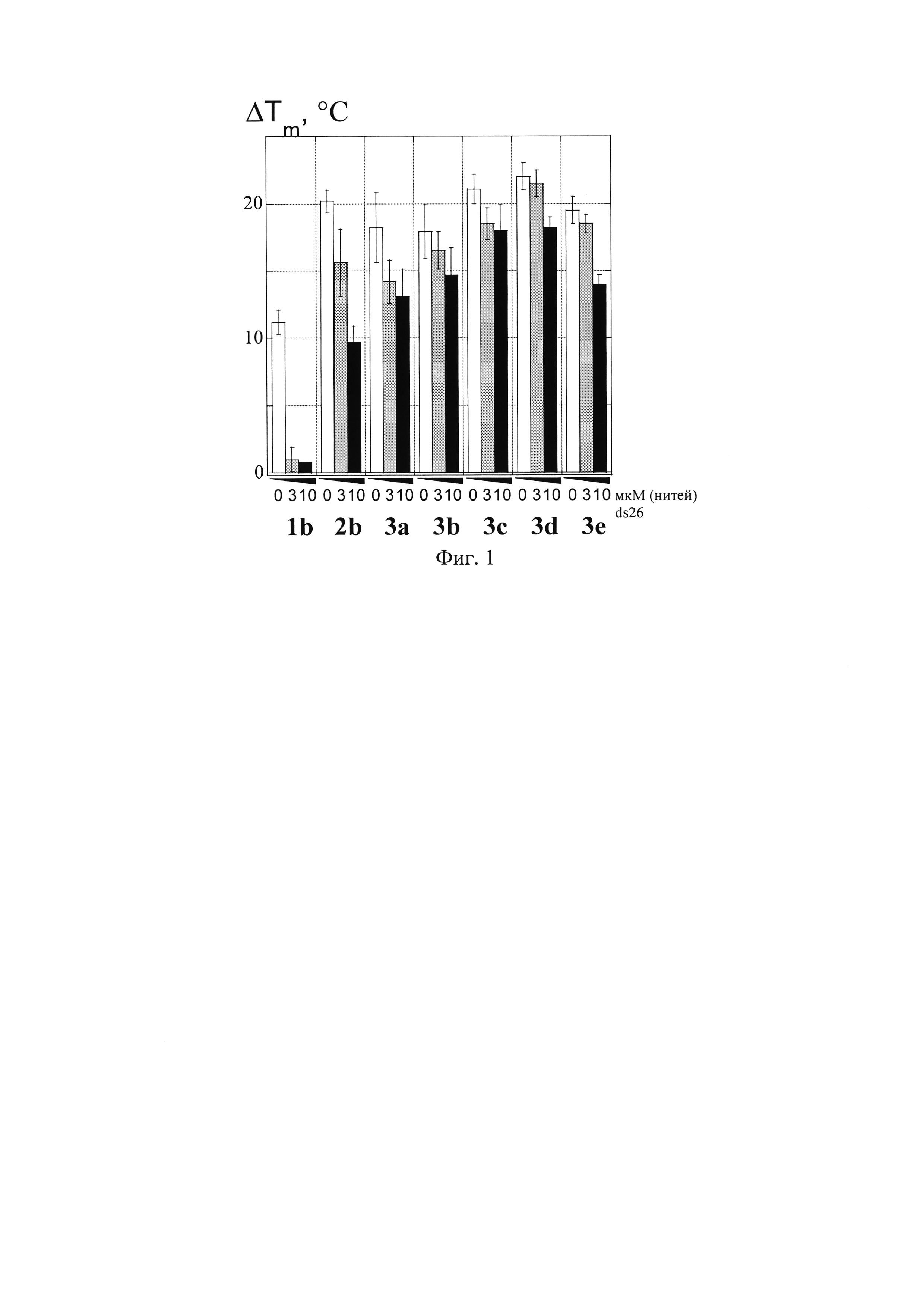
Фиг. 1 представляет собой влияние избытка конкурирующей двутяжевой ДНК ds26 на стабилизацию ΔTm теломерного G-квадруплекса соединениями 1b, 2b, 3а-3e. Концентрация TelQ - 200 нМ (нитей); соединений 1b, 2b, 3a-3e - 1 мкМ. Тестирование проводилось в растворе, содержащем 10 мМ Na-фосфатного буфера (pH 7.6), 10 мМ KCl, 80 мМ LiCl, по методу [Ilyinsky N.S. et al. Eur. J. Med. Chem., 2014, 85, 605].
Один из методов синтеза соединений структурной формулы 3 (схема 2) и типичные представители по изобретению приводятся в ряде примеров, описанных ниже. Исходные производные 2-карбоновых кислот 4,11-диалкоксигетероаренантрацендионов с одним гетероатомом, соответствующие формуле 4, могут быть получены, например, описанными ранее методами [Тихомиров А.С. и др. ХГС, 2011, 10, 1464; Щекотихин А.Е. и др. ХГС, 2007, 4, 538]. Модификацией карбоксильной группы гетероаренантрацендионов формулы 4a, b получены полупродукты 5а-с, гуанидирование терминальных аминогрупп которых дает гетероаренантрацендионы 6a-c. На заключительной стадии замещение метоксигрупп производных 6a-c на остатки аминов приводит к лигандам, соответствующим формуле 3, содержащим две аминоалкиламиногруппы и одну цепь с терминальной гуанидиногруппой.
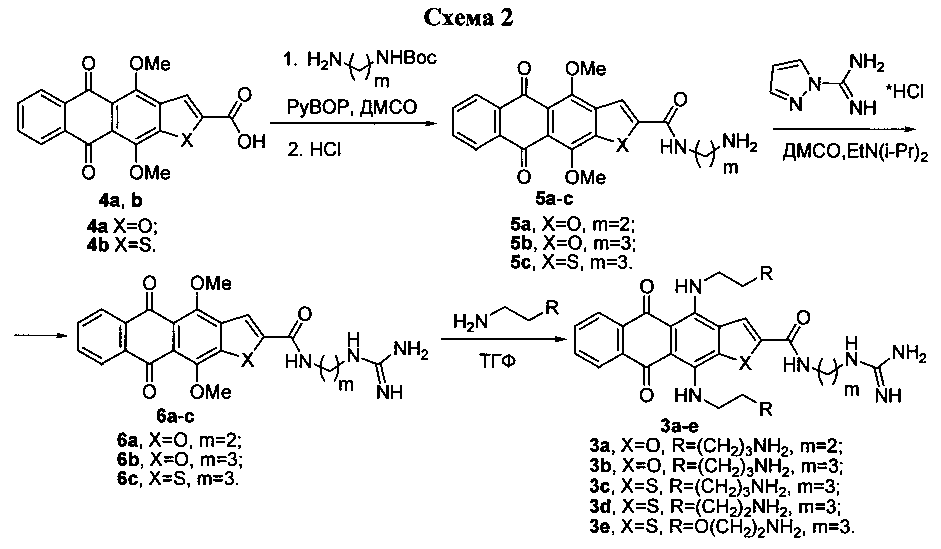
Пример 1
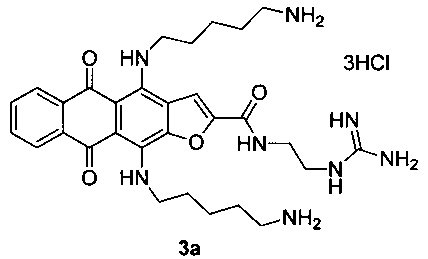
4,11-Бис(5-аминопентиламино)-N-(2-гуанидиноэтил)-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида тригидрохлорид (3а)
Стадия 1. N-(2-Аминоэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорид (5а).
К раствору 100 мг (0.27 ммоль) 4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоновой кислоты (4а, Х=O, схема 2 [Тихомиров А.С. и др. ХГС, 2011, 10, 1464]) в 5 мл ДМСО прибавляют 0.32 г (2.0 ммоль) N-Boc-этилендиамина, 200 мг (0.38 ммоль) бензтриазол-1-ил-окситрипирролидинофосфония гексафторфосфата (PyBOP) и перемешивают 1 ч. Реакционную массу выливают в 5% водный раствор HCl, экстрагируют продукт этилацетатом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают хроматографически (CHCl3-MeOH, 1:0→3:1). Полученный желтый порошок растворяют в 5 мл ТГФ, прибавляют 2 мл 3М раствора HCl в MeOH и перемешивают 2 ч, после чего отгоняют растворитель в вакууме. Продукт переосаждают из теплой воды ацетоном, промывают ацетоном и сушат. Выход N-(2-аминоэтил)-4,11-диметокси-5,10-диоксоантра[2,3-6]фуран-2-карбоксамида гидрохлорида (5а, Х=O, m=2) 105 мг (85%), желтые кристаллы. Т.пл. 225°С (разл.). Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Γц): 9.20 (1Η, т, J=6, ΝΗ), 8.08 (3Н, уш с, ΝΗ3), 8.07-8.05 (2Н, м, Н-6,9), 8.06 (1Н, с, Н-3), 7.85-7.83 (2Н, м, Н-7,8), 4.13 (3Н, с, СН3), 4.09 (3Н, с, СН3), 3.58 (2Н, кв, J=6, СН2), 3.03 (2Н, т, J=6, СН2). HRMS: m/z (ESI), найдено 395.1207 [М+Н]+. Вычислено C21H19N2O6: 395.1238.
Стадия 2. N-(2-Гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорид (6а).
Соединение 5а (Х=O, m=2) 73 мг (0.17 ммоль) растворяют в 5 мл ДМСО и при перемешивании прибавляют 0.5 мл (3 ммоль) этилдиизопропиламина и 150 мг (1.0 ммоль) гидрохлорида пиразол-1-карбоксамидина. Реакционную массу выдерживают 5 ч при 60°С и охлаждают. Продукт осаждают избытком ацетона, отфильтровывают, промывают ацетоном и сушат. Выход N-(2-гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорида (6а, Х=O, m=2) 60 мг (74%), желтые кристаллы. Т.пл. 186-188°С (разл.). Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м.д., J (Гц): 9.15 (1H, т, J=6, ΝΗ), 8.06-8.04 (2Н, м, Н-6,9), 8.05 (1Н, с, Н-3), 7.84-7.81 (2Н, м, Н-7,8), 7.79 (1H, т, J=6, ΝΗ), 7.40 (2Н, уш с, ΝΗ2), 7.17 (2Н, уш с, ΝΗ2), 4.12 (3Н, с, СН3), 4.08 (3Н, с, СН3), 3.44 (2Н, м, СН2), 3.30 (2Н, м, СН2). ЯМР 13С (100 МГц, DMSO-d6), δ, м.д., 182.08, 181.67, 157.48, 157.14, 151.69, 151.20, 150.53, 142.56, 134.02, 133.98, 133.85, 133.68, 127.11, 126.11, 125.99, 123.51, 120.46, 109.07, 61.88, 61.75, 38.87, 38.33. HRMS: m/z (ESI), найдено 437.1421 [M+H]+. Вычислено C22H21N4O6: 437.1456.
Стадия 3. 4,11-Бис(5-аминопентиламино)-N-(2-гуанидиноэтил)-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида тригидрохлорид (3а).
Желтые кристаллы 6а (Х=O, m=2) 50 мг (0.11 ммоль) растворяют в 5 мл ТГФ и прибавляют 1.50 г (15 ммоль) 1,5-диаминопентана и перемешивают 24 ч. Смесь выливают в воду, экстрагируют продукт н-бутанолом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают методом колоночной хроматографии (CHCl3-МеОН-конц. NH4OH, 1:0:0→2:2:1). Темно-синий продукт растворяют в теплом водном растворе (1%) соляной кислоты (1.5 мл) и осаждают ацетоном, промывают ацетоном и сушат. Выход соединения 3а 44 мг (61%), темно-синие кристаллы. Т.пл. 203-205°С. Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 12.20 (1Н, с, ΝΗ), 11.58 (1Н, с, ΝΗ), 9.22 (1Н, с, ΝΗ), 8.24 (1Н, с, Н-3), 8.15-8.08 (5Н, м, Н-6,9, ΝΗ3), 8.07-8.01 (4Н, м, ΝΗ, ΝΗ3), 7.68-7.66 (2Н, м, Н-7,8), 7.45 (2Н, уш с, ΝΗ2), 7.20 (2Н, уш с, ΝΗ2), 3.86-3.81 (2Н, м, СН2), 3.66-3.62 (2Н, м, СН2), 3.48-3.44 (4Н, м, СН2), 2.86-2.79 (4Н, м, СН2), 1.73-1.67 (8Н, м, СН2), 1.59-1.52 (4Н, м, СН2). HRMS: m/z (ESI), найдено 577.3235 [М+Н]+. Вычислено C30H41N8O4: 577.3245.
Пример 2
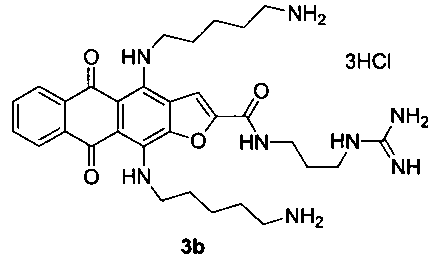
4,11-Бис(5-аминопентиламино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида тригидрохлорид (3b)
Стадия 1. N-(3-Аминопропил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорид (5b).
К раствору 100 мг (0.27 ммоль) 4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоновой кислоты (4а, Х=O, схема 2) в 5 мл ДМСО прибавляют 0.35 г (2.0 ммоль) N-Boc-1,3-диаминопропана, 200 мг (0.38 ммоль) бензтриазол-1-ил-окситрипирролидинофосфония гексафторфосфата (PyBOP) и перемешивают 1 ч. Реакционную массу выливают в 5% водный раствор HCl, экстрагируют этилацетатом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают хроматографически (CHCl3-MeOH, 1:0→3:1). Полученный желтый порошок растворяют в 5 мл CH2Cl2, прибавляют 2 мл 3М раствора HCl в MeOH и перемешивают 2 ч, после чего отгоняют растворитель в вакууме. Продукт переосаждают из теплой воды ацетоном, промывают ацетоном и сушат. Выход N-(3-аминопропил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорида (5b, Х=O, m=3) 103 мг (81%), желтые кристаллы. Т.пл. 251-253°С (разл.). Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 9.17 (1H, т, J=6, NH), 8.07-8.04 (2Н, м, Н-6,9), 8.01 (1Н, с, Н-3), 7.98 (3Н, уш с, NH3), 7.84-7.82 (2Н, м, Н-7,8) 4.12 (3Н, с, СН3), 4.08 (3Н, с, СН3), 3.40 (2Н, м, СН2), 2.86 (2Н, м, СН2), 1.86 (2Н, м, СН2). ЯМР 13С (100 МГц, DMSO-d6), δ, м.д., 182.05, 181.64, 157.32, 151.66, 151.31, 150.51, 142.57, 133.99, 133.96, 133.84, 133.67, 127.15, 126.11, 125.99, 123.38, 120.38, 108.86, 61.85, 61.73, 36.81, 36.18, 27.17. HRMS: m/z (ESI), найдено 409.1368 [М+Н]+. Вычислено C22H21N2O6: 409.1394.
Стадия 2. N-(2-Гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорид (6b).
Соединение 5b (Х=O, m=3) 72 мг (0.16 ммоль) растворяют в 5 мл ДМСО и при перемешивании прибавляют 0.5 мл (3 ммоль) этилдиизопропиламина и 150 мг (1.0 ммоль) гидрохлорида пиразол-1-карбоксамидина. Реакционную массу выдерживают 5 ч при 60°С и охлаждают. Продукт осаждают избытком ацетона, отфильтровывают, промывают ацетоном и сушат. Выход N-(2-гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида гидрохлорида (6b, Х=O, m=3) 53 мг (68%), желтые кристаллы. Т.пл. 151-153°С. Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м.д., J (Гц): 9.07 (1Н, т, J=6, NH), 8.07-8.05 (2Н, м, Н-6,9), 8.02 (1Н, с, Н-3), 7.85-7.83 (2Н, м, Н-7,8), 7.75 (1H, т, J=6, NH), 7.35 (2Н, уш с, NH2), 7.05 (2Н, уш с, NH2), 4.12 (3Н, с, СН3), 4.08 (3Н, с, СН3), 3.34 (2Н, м, СН2), 3.20 (2Н, м, СН2), 1.77 (2Н, м, СН2). HRMS: m/z (ESI), найдено 451.1570 [М+Н]+. Вычислено C23H23N4O6: 451.1612.
Стадия 3. 4,11-Бис(5-аминопентиламино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]фуран-2-карбоксамида тригидрохлорид (3b).
Желтые кристаллы 6b (Х=O, m=3) 40 мг (0.10 ммоль) растворяют в 5 мл ТГФ, прибавляют 1.50 г (15 ммоль) 1,5-диаминопентана и перемешивают 24 ч. Смесь выливают в воду, экстрагируют продукт н-бутанолом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают методом колоночной хроматографии (CHCl3-МеОН-конц. NH4OH, 1:0:0→2:2:1). Темно-синий продукт растворяют в теплом водном растворе (1%) соляной кислоты (1.5 мл) и осаждают ацетоном, промывают ацетоном и сушат. Выход соединения 3b 33 мг (69%), темно-синие кристаллы. Т.пл. 189-191°С. Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м.д., J (Гц): 12.24 (1Н, с, NH), 11.64 (1Н, с, NH), 9.17 (1H, с, NH), 8.29 (1Н, с, Н-3), 8.16-8.12 (2Н, м, Н-6,9), 8.07 (3Н, с, NH3) 8.03-7.99 (4Н, м, NH, NH3), 7.70-7.68 (2Н, м, Н-7,8), 7.51 (2Н, уш с, NH2) 7.13 (2Н, уш с, NH2), 3.86-3.83 (2Н, м, СН2), 3.68-3.63 (2Н, м, СН2), 3.30-3.25 (4Н, м, СН2), 2.84-2.77 (4Н, м, СН2), 1.82-1.79 (2Н, м, СН2), 1.74-1.64 (8Н, м, СН2), 1.58-1.49 (4Н, м, СН2). HRMS: m/z (ESI), найдено 591.3321 [М+Н]+. Вычислено C31H43N8O4: 591.3402.
Пример 3
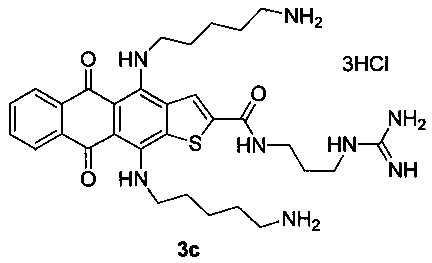
4,11-Бис(5-аминопентиламино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида тригидрохлорид (3c)
Стадия 1. N-(3-Аминопропил)-4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида гидрохлорид (5с).
К раствору 360 мг (1.0 ммоль) 4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен-2-карбоновой кислоты (4b, X=S, схема 2, [Щекотихин А.Е. и др. ХГС, 2007, 4, 538]) в 20 мл ДМСО прибавляют 1.5 г (10.0 ммоль) N-Boc-1,3-диаминопропана, 1.0 мг (1.5 ммоль) бензтриазол-1-ил-окситрипирролидинофосфония гексафторфосфата (PyBOP) и перемешивают 1 ч. Реакционную массу выливают в 5% водный раствор HCl, экстрагируют этилацетатом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают хроматографически (CHCl3-MeOH, 1:0→3:1). Полученный желтый порошок растворяют в 20 мл CH2Cl2, прибавляют 10 мл 3М раствора HCl в МеОН и перемешивают 2 ч, после чего отгоняют растворитель в вакууме. Продукт переосаждают из теплой воды ацетоном, промывают ацетоном и сушат. Выход N-(3-аминопропил)-4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида гидрохлорида (5с, X=S, m=3) 380 мг (83%), желтые кристаллы. Т.пл. 208-210°С (разл.). Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 9.33 (1Н, т, J=6, NH), 8.50 (1Н, с, Н-3), 8.13-8.11 (2Н, м, Н-6,9), 7.93 (3Н, уш с, NH3), 7.89-7.86 (2Н, м, Н-7,8), 4.04 (3Н, с, СН3), 4.01 (3Н, с, СН3), 3.37 (2Н, м, СН2), 2.87 (2Н, м, СН2), 1.86 (2Н, м, СН2). HRMS: m/z (ESI), найдено 425.1154 [М+Н]+. Вычислено C22H21N2O5S: 425.1166.
Стадия 2. N-(3-Гуанидинопропил)-4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен--карбоксамида гидрохлорид (6с).
Соединение 5с (X=S, m=3) 360 мг (1.0 ммоль) растворяют в 15 мл ДМСО и при перемешивании прибавляют 1.0 мл (6 ммоль) этилдиизопропиламина и 750 мг (5.0 ммоль) гидрохлорида пиразол-1-карбоксамидина. Реакционную массу выдерживают 5 ч при 60°С и охлаждают. Продукт осаждают избытком ацетона, отфильтровывают, промывают ацетоном и сушат. Выход N-(2-гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-6]тиофен-2-карбоксамида гидрохлорида (6с) 325 мг (65%), желтые кристаллы. Т.пл. 191-193°С (разл.). Спектр ЯМР 1H (400 МГц, DMSO252-d6), δ, м.д., J (Гц): 9.23 (1Н, т, J=6, NH), 8.50 (1H, с, Н-3), 8.13-8.11 (2Н, м, Н-6,9), 7.88-7.86 (2Н, м, Н-7,8), 7.73 (1H, т, J=6, NH), 7.37 (2Н, уш с, NH2), 7.05 (2Н, уш с, NH2), 4.04 (3Н, с, СН3), 4.01 (3Н, с, СН3), 3.40 (2Н, м, СН2), 3.21 (2Н, м, СН2), 1.78 (2Н, м, СН2). HRMS: m/z (ESI), найдено 467.1343 [М+Н]+. Вычислено C23H23N4O5S: 467.1384.
Стадия 3. 4,11-Бис(5-аминопентиламино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида тригидрохлорид (3с).
Желтые кристаллы 6с (X=S, m=3) 52 мг (0.11 ммоль) растворяют в 5 мл ТГФ и прибавляют 1.32 г (15 ммоль) 1,5-диаминопентана и перемешивают 24 ч. Смесь выливают в воду, экстрагируют продукт н-бутанолом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают методом колоночной хроматографии (CHCl3-МеОН-конц. NH4OH, 1:0:0→2:2:1). Темно-синий продукт растворяют в теплом водном растворе (1%) соляной кислоты (1.5 мл) и осаждают ацетоном, промывают ацетоном и сушат. Выход соединения 3с 56 мг (73%), темно-синие кристаллы. Т.пл. 269-271°С. Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 12.57 (1Н, с, NH), 12.35 (1Н, с, NH), 9.64 (1H, с, NH), 8.75 (1H, с, Н-3), 8.26-8.21 (2Н, м, Н-6,9), 8.03-7.94 (6Н, с, 2NH3), 7.94 (1Н, с, NH), 7.76-7.74 (2Н, м, Н-7,8), 7.52 (2Н, уш с, NH2), 7.13 (2Н, уш с, NH2), 3.90-3.87 (2Н, м, СН2), 3.84-3.80 (2Н, м, СН2), 3.30-3.25 (4Н, м, СН2), 2.85-2.80 (4Н, м, СН2), 1.84-1.81 (2Н, м, СН2), 1.78-1.65 (8Н, м, СН2), 1.61-1.50 (4Н, м, СН2). HRMS: m/z (ESI), найдено 607.3062 [М+Н]+. Вычислено C31H43N8O3S. Вычислено: 607.3173.
Пример 4
4,11-Бис(4-аминобутиламино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида тригидрохлорид (3d)
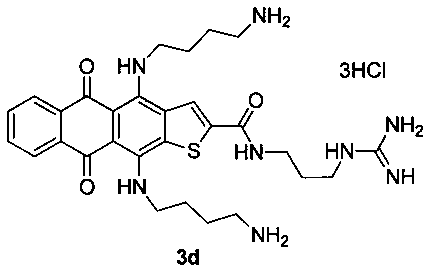
Желтые кристаллы N-(2-гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида гидрохлорида 6 с 52 мг (0.11 ммоль, X=S, m=3, пример 3, стадия 2) растворяют в 5 мл ТГФ и прибавляют 1.32 г (15 ммоль) 1,4-диаминобутана и перемешивают 24 ч. Смесь выливают в воду, экстрагируют продукт н-бутанолом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают методом колоночной хроматографии (CHCl3-МеОН-конц. NH4OH, 1:0:0→2:2:1). Темно-синий продукт растворяют в теплом водном растворе (1%) соляной кислоты (1.5 мл) и осаждают ацетоном, промывают ацетоном и сушат. Выход соединения 3d 54 мг (74%), темно-синие кристаллы. Т.пл. 233-236°С. Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 12.45 (1Н, с, NH), 12.19 (1Н, с, NH), 9.64 (1Н, с, NH), 8.62 (1Н, с, Н-3), 8.15 (6Н, с, 2NH3), 8.11-8.08 (2Н, м, Н-6,9), 8.01 (1Н, т, J=6, NH), 7.77-7.74 (2Н, м, Н-7,8), 7.53 (2Н, уш с, NH2) 7.17 (2Н, уш с, NH2), 3.90-3.85 (2Н, м, СН2), 3.64-3.66 (2Н, м, СН2), 3.38-3.29 (4Н, м, СН2), 2.91-2.83 (4Н, м, СН2), 1.84-1.81 (4Н, м, СН2), 1.76-1.71 (2Н, м, СН2), 1.64-1.62 (2Н, м, СН2). ЯМР 13С (100 МГц, DMSO-d6), δ, м.д., 179.22, 178.51, 160.47, 157.16, 146.57, 144.56, 142.49, 136.72, 134.63, 133.97, 133.63, 131.75, 131.61, 125.97, 125.53 (2С), 106.01, 105.83, 46.95, 45.10, 38.65, 38.55, 38.45, 36.86, 28.64, 27.18, 27.05, 24.58, 24.54. HRMS: m/z (ESI), найдено 579.2832 [М+Н]+. Вычислено C29H39N8O3S. Вычислено: 579.2860.
Пример 5
4,11-Бис((2-(2-аминоэтокси)этил)амино)-N-(3-гуанидинопропил)-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида тригидрохлорид (3е)
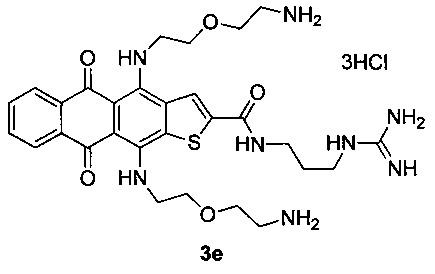
Желтые кристаллы N-(2-гуанидиноэтил)-4,11-диметокси-5,10-диоксоантра[2,3-b]тиофен-2-карбоксамида гидрохлорида 6 с 52 мг (0.11 ммоль, X=S, m=3, пример 3, стадия 2) растворяют в 5 мл ТГФ и прибавляют 1.56 г (15 ммоль) 2,2′-диаминодиэтилового эфира и перемешивают 24 ч. Смесь выливают в воду, экстрагируют продукт н-бутанолом, промывают экстракт водой и отгоняют растворитель в вакууме. Остаток очищают методом колоночной хроматографии (CHCl3-МеОН-конц. NH4OH, 1:0:0→2:2:1). Темно-синий продукт растворяют в теплом водном растворе (1%) соляной кислоты (1.5 мл) и осаждают ацетоном, промывают ацетоном и сушат. Выход соединения 3е 40 мг (51%), темно-синие кристаллы. Т.пл. 200-203°С. Спектр ЯМР 1Н (400 МГц, DMSO-d6), δ, м.д., J (Гц): 12.58 (1Н, с, NH), 12.35 (1H, с, NH), 9.69 (1H, с, NH), 8.81 (1Н, с, Н-3), 8.23-8.16 (8Н, м, Н-6,9, 2NH3), 7.99 (1Н, с, NH), 7.73-7.71 (2Н, м, Н-7,8), 7.52 (2Н, уш с, NH2) 7.17 (2Н, уш с, NH2), 4.10 (2Н, уш с, СН2), 4.04 (2Н, уш с, СН2), 3.80-3.75 (6Н, м, СН2), 3.39-3.35 (4Н, м, СН2), 3.30-3.25 (2Н, м, СН2), 3.12-3.05 (4Н, м, СН2), 1.85-1.79 (2Н, м, СН2). ЯМР 13С (100 МГц, DMSO-d6), δ, м.д., 179.62, 178.87, 160.42, 157.10, 147.00, 144.89, 142.89, 136.97, 134.92, 134.01, 133.71, 131.98, 131.96, 126.07, 125.79 (2С), 106.48, 106.27, 69.25, 69.06, 66.60, 66.56, 47.10, 45.24, 38.62 (2С), 38.50, 36.89, 28.54. HRMS: m/z (ESI), найдено 611.2748 [М+Н]+. Вычислено C29H39N8O5S. Вычислено: 611.2759.
Примеры, подтверждающие наличие биологической активности
Пример 6
Исследование связывания новых лигандов с теломерным G-квадруплексом
Для лигандов формулы 3, содержащих в положениях 4, 11 аминоалкиламиногруппы и в положении 2 цепь с терминальной гуанидиногруппой, являющихся предметом настоящего изобретения, были определены параметры связывания с теломерным G-квадруплексом в сравнении с ранее описанными лигандами 1b и 2b [Cogoi S., et al. J. Med. Chem., 2013, 56, 2764; Патент РФ №2527459 (2013)]. Тестирование аффинности к теломерному G-квадруплексу проведено методом FRET-плавления [Mergny J.L., Lacroix L. Oligonucleotides, 2003, 13 (6), 515] с использованием флуоресцентно меченого олигонуклеотида FAM-5′-d(AGGGTTAGGGTTAGGGTTAGGG)-3′-BHQ1 [Ilyinsky N.S. et al. Eur. J. Med. Chem., 2014, 85, 605], формирующего в присутствии ионов калия ′3+1′ гибридный G-квадруплекс (TelQK+). В экспериментах по определению селективности связывания лигандов образцы с G-квадруплексом (200 нМ (нитей)) и 1 мкМ лиганда дополнительно содержали 3 или 10 мкМ (нитей) конкурентного двутяжевого самокомплементарного олигонуклеотида ds26 (5′-d(CA2TCG2ATCGA2T2CGATC2GAT2G)-3′), что соответствовало 65- и 217-кратному избытку концентрации дуплекса (в парах оснований) над концентрацией квадруплекса (в квартетах оснований).
Величины стабилизации квадруплекса лигандами ΔTm (разность температуры плавления комплекса с лигандом и температуры плавления свободного квадруплекса TelQK+(Tm=64.8±0.3°С), Фиг. 1) для соединений 1b, 2b и 3а-3е определены методом FRET-плавления и представлены в Таблице 1 и Фиг. 1. Данные показывают, что новые лиганды формулы 3 значительно стабилизируют ′3+1′ теломерный G-квадруплекс (ΔTm=18-22°С) и превосходят по стабилизации ранее описанный лиганд 1b с двумя гуанидиногруппами (ΔTm≈11°C для 1b). Введение в образцы 10 мкМ конкурентной дуплексной ДНК ds26 существенно меньше снижает стабилизационный сдвиг для лигандов формулы 3 (ΔTm(+10мкМ ds26)=13-18°С), чем для ранее описанных лигандов с двумя и тремя боковыми цепями формул 1b, 2b (ΔTm(+10мкМ ds26)=1 и 10°С соответственно).
Количественная оценка селективности связывания проведена по отношению констант связывания лигандов с квадруплексом и дуплексом (Kb TelQ/Kb ds26, оценка по формулам из [Ilyinsky N.S. et al. Eur. J. Med. Chem., 2014, 85, 605]), а также по величине SFRET, вычисленной по формуле:
SFRET=ΔTm(+10мкМ ds26)/ΔTm,
где ΔTm - стабилизация плавления G-квадруплекса лигандом в отсутствии конкурентного дуплекса; ΔTm(+10мкМ ds26) - стабилизация в присутствии 10 мкМ (нитей) дуплексной ДНК ds26 [Bertrand Н. et al. Chem. - Eur. J., 2011, 17 (16), 4529].
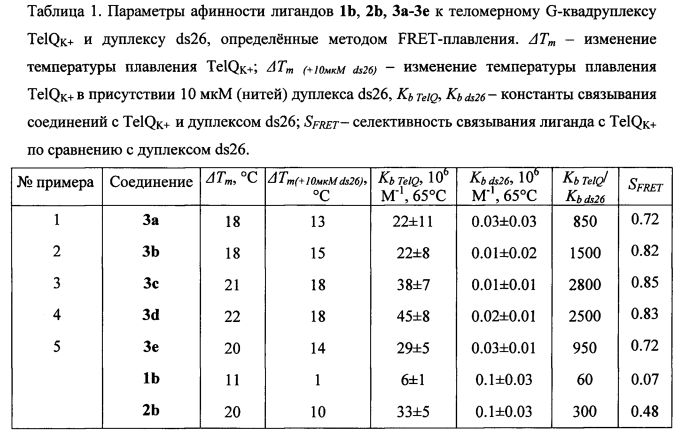
Величины Kb TelQ/Kb ds26 и SFRET (Таблица 1) демонстрируют увеличение селективности связывания лигандов формулы 3 по сравнению с соединением 2b (SFRET≈0.5 для 2b, SFRET≈0.9 для 3с). Наибольшей селективностью к квадруплексу (по сравнению с дуплексом) обладают производные 3b и 3c, содержащие 5-аминопентиламиногруппы в положениях 4,11 и пропильный спейсер в положении 2.
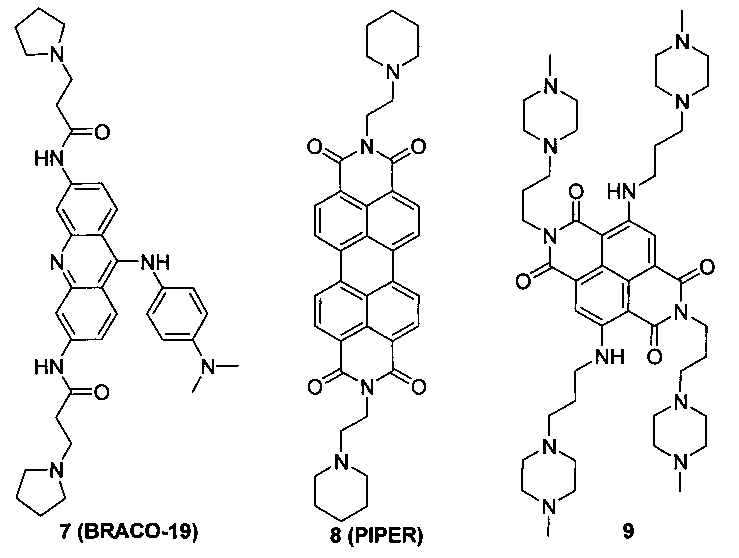
Представленные результаты тестирования аффинности свидетельствуют, что модификация терминальных гуанидиногрупп в боковых цепях, расположенных в положениях 4, 11, лиганда 2b на аминогруппы привела к существенному увеличению селективности связывания новых лигандов формулы 3 с квадруплексом по сравнению с дуплексом ДНК. Новые лиганды формулы 3 значительно стабилизируют теломерный G-квадруплекс (ΔTm≈20°С), имеют высокие константы связывания с TelQK+(Kb TelQ ~ 107 М-1) и селективность по сравнению с дуплексной структурой ДНК (Kb TelQ/Kb ds26 ~ 103). Таким образом, параметры аффинности для соединений формулы 3, являющихся предметом настоящего изобретения, находятся на уровне лучших из описанных ранее G-квадруплексных лигандов формул 7-9:
- 7 (BRACO-19) - ΔTm=27.3°С [Moore M.J. et al. J. Med. Chem., 2006, 49 (2), 582], Kb TelQ ~ 3·107 M-1, Kb TelQ/Kb ds26 ~ 30 [White E.W. et al. Biophys. Chem., 2007, 126 (1), 140];
- 8 (PIPER) - Kb TelQ ~ 105 M-1 [Casagrande V. et al. Journal of mass spectrometry, 2009, 44(4), 530], Kb TelQ/Kb ds26 ~ 10 [Kern J.T. et al. Biochem., 2002, 41 (38), 11379];
- 9 - ΔTm=28°C, Kb TelQ/Kb ds26 ~ 300 [Hampel S.M. et al. Bioorg. Med. Chem. Lett., 2010, 20 (22), 6459].
Пример 7
Антипролиферативная активность соединений
Изучение антипролиферативной активности заявленных соединений проводилось в тестах in vitro на культурах клеток лейкемии мыши L1210, Т-лимфоцитов человека СЕМ и рака шейки матки HeLa. Данные об антипролиферативной активности (IC50 - концентрация, ингибирующая рост клеток на 50%) заявленных по изобретению соединений 3а-3е приводятся в таблице 2, где для каждого соединения указана структура и номер примера (описанных выше), а также приводятся данные об антипролиферативной активности ранее описанных квадруплексных лигандов 1b и 2b. Определение IC50 проводилось с помощью МТТ-теста по стандартной методике, описанной в литературе [Mossman Т.J. Immunol. Methods, 1983, 65, 55]. Как видно из представленных данных, соединения 3а-3е, являющиеся предметом настоящего изобретения и описанные в примерах, ингибируют пролиферацию опухолевых клеток в микромолярных концентрациях.