Результат интеллектуальной деятельности: Способ получения литиевого концентрата из литиеносных природных рассолов и его переработки в хлорид лития или карбонат лития
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к гидрометаллургии лития и может быть использовано для получения литиевых концентратов путем обогащения природных литиевых рассолов и производства из этих концентратов товарных литиевых продуктов.
Уровень техники
В мировой практике литиевые продукты получают как из твердо-минеральных (сподумен, лепидолит, петалит), так и из гидроминеральных литиеносных сырьевых источников (озерные рассолы, рассолы саларов, глубинные подземные рассолы, минерализованные воды).
При этом если в прошлом столетии производители литиевой продукции использовали преимущественно твердо-минеральные сырьевые источники, то в XXI веке предпочтение отдается литиеносному гидроминеральному сырью, поскольку использование сырьевых источников данного вида позволяет не только строить литиевые предприятия с более высокими экономическими и экологическими показателями, но и создавать производственные комплексы глубокой переработки сырья данного типа ввиду его поликомпонентности и доступности выделения других ценных компонентов (Остроушко Ю.И., Дегтярева Т.В. Гидроминеральное сырье - неисчерпаемый источник лития. Аналитический обзор. ЦНИАТОМИНФОРМ, 1999 г, 64 с.) [1].
Все современные технологии получения солей лития из литиеносного гидроминерального сырья основаны на его обогащении по литию. Обогащение по литию традиционного литиеносного гидроминерального сырья (природные рассолы хлоридного натриевого типа с низким содержанием магния и кальция), как правило, осуществляют последовательным высаливаем макрокомпонентов при упаривании (NaCl, KCl, KCl⋅MgCl2⋅6H2O, MgCl2⋅6H2O) и одновременным концентрированием исходного рассола по литию до содержаний, позволяющих производить из полученных литиевых концентратов хлорид и (или) карбонат лития чистотой 98-99% (пат. США 4243392, пат. США 274834) [2, 3]. Очистку от примесей (SO42-, Са2+, Mg2+) производимых таким образом литиевых концентратов производят с переводом примесей в труднорастворимые соли CaSO4, CaCO3, Mg(OH)2 с использованием в качестве реагентов CaCl2, CaO, Na2CO3 (пат. США 4271131) [4]. После реагентной очистки перед получением литиевых продуктов из литиевых концентратов, как правило, извлекают бор в виде борной кислоты экстракцией высокомолекулярными спиртами (патент США 5219550) [5].
Для получения литиевых продуктов более высокой квалификации производимой из литиевых концентратов соли лития LiCl и Li2CO3 перерабатываются в более чистые соли либо с использованием изопропилового спирта, в котором в отличие от нерастворимых NaCl, KCl, CaCl2, MgCl2 хлорид лития хорошо растворим (патент США 4271131) [4], либо карбонизируя карбонат лития до его полного перевода в растворимый и свободный от основных примесей бикарбонат лития с последующей декарбонизацией и осаждением более чистого карбоната лития (патент США 6207126) [6].
Таким образом, при получении из традиционного литиеносного гидроминерального сырья литиевого концентрата его глубокая очистка от примесей не предусматривается, так как она весьма затруднительна. Повышение чистоты производимых из такого концентрата литиевых продуктов осуществляют путем переочистки полученных продуктов.
Из нетрадиционного литиеносного гидроминерального сырья (природные рассолы хлоридного магниевого, хлоридного кальциевого и смешанных типов) получить литиевые концентраты с высокой концентрацией лития традиционными галлургическими методами невозможно, так как при его упаривании неизбежно образование и высаливание двойных солей типа LiCl⋅MgCl2⋅6H2O и LiCl⋅CaCl2⋅5H2O совместно с высаливаемыми кристаллогидратами CaCl2⋅6H2O и MgCl2⋅6H2O. Поэтому получение литиевых концентратов из нетрадиционного литиеносного гидроминерального сырья возможно только путем селективного извлечения лития с последующим концентрированием до содержания лития, позволяющего производить карбонат или хлорид лития. Появление патентов США, описывающих использование для селективного выделения лития из литиеносных рассолов сорбентов представляющих собой микрокристаллические алюминаты лития, синтезированные в порах ионообменной смолы (патенты США 4159311, 4221767, 4347327, 4477367, 5389349) [7-11]. Однако в реальных условиях эксплуатации таких сорбентов выяснилось, что, во-первых, макропоры смолы забиваются содержащимися в рассолах механическими примесями, затрудняя доступ лития к кристаллам селективного сорбента, во-вторых, кристаллы селективного сорбента очень быстро вымываются из носителя.
Позднее был предложен способ извлечения лития из литиеносных рассолов с помощью сорбента на основе крупнокристаллической разновидности соединения LiX/Al(OH)3, где X-ОН-, Cl-, NO3-, SO42- способного внедрять литий без нарушения структуры (патент США 5599516) [12].
Однако основными недостатками данного способа явились большие потери сорбента вследствие разрушения (растрескивания) его кристаллов вследствие неизбежных локальных перенапряжений в синтезируемых кристаллах и необходимости при извлечении лития из насыщенного сорбента нагревать десорбирующую жидкость до 90°С.
Разработан процесс получения литиевого концентрата обогащением природных литиеносных рассолов на гранулированном сорбенте, основой которого является композит-аморфная разновидность соединения состава LiCl⋅2Al(OH)3⋅mH2O1 (1 В дальнейшем ДГАЛ-Cl хлорсодержащая разновидность двойного гидроксида алюминия, лития), где m=3-5, с дефектом в его структуре, что позволяет при соответствующей подготовке сорбента (водной обработке) создавать дефицит лития в его составе и осуществлять обратимый процесс интеркаляции хлорида лития в среде рассола и его деинтеркаляции в среде пресной воды (Химия и технология получения соединений лития из литиеносного гидроминерального сырья) [13].
Способ получения гранулированного сорбента селективного к литию описан в следующих источниках заявка РСТ/ДЕ. 01.04062, Германия [14], патенты РФ 2223142, 2455063 [15, 16]. На основе данного сорбента разработан способ селективного извлечения хлорида лития из литиеносных природных рассолов с выделением первичного литиевого концентрата способного к дальнейшему концентрированию по литию любым из известных способов, включая упаривание. Использование гранулированного сорбента на основе аморфной разновидности соединения LiCl⋅2Al(ОН)3⋅mH2O вместо кристаллических гранул, из гидратированного соединения LiCl/Al(OH)3 позволяет вести все технологические операции процесса обогащения при комнатной температуре, получая при этом первичный литиевый концентрат, содержащий в зависимости от концентрации лития в рассоле 4,0-6,0 г/л хлорида лития с остаточным содержанием макроосновы рассола не более 6,0 г/л. Для минимизации массы единовременной загрузки гранулированного сорбента в данной разработке использовали сорбционно-десорбционный обогатительный модуль с движущимся слоем сорбента. Основанный на использовании гранулированного селективного сорбента способ получения хлорида лития из литиеносных рассолов и установка для его осуществления описаны (заявка РСТ/ДЕ 01/04061, Германия) [17].
Однако наряду с несомненными вышеописанными достоинствами данный способ имеет недостатки, одним из которых является высокая степень истирания сорбента (выше 37% в год) в процессе его движения в оборудовании. Хлорид лития, получаемый по данному способу, имеет чистоту не выше 98%. Получение наиболее востребованного соединения лития карбоната лития данный способ не предусматривает. Кроме того, реализация способа в варианте движущегося слоя сорбента требует разработки сложного нестандартизированного оборудования, что увеличивает затраты при практической реализации данного способа.
С целью устранения недостатков этого технологического процесса предложен способ получения литиевого концентрата из природных рассолов и его переработки в литиевые продукты (патент РФ 2516538) [18].
Устранение вышеуказанных недостатков достигается тем, что в предлагаемом способе получения литиевого концентрата из литиеносных рассолов процесс обогащения рассола по литию осуществляют в сорбционно-десорбционном модуле, состоящем из двух колонн, заполненных гранулированным селективным сорбентом. Одна из колонн постоянно находится в режиме насыщения (интеркаляции) лития, в то время как другая колонна находится в режиме удаления рассола и извлечения (деинтеркаляции) лития из насыщенного гранулированного сорбента. Режим движения рассола через колонну на стадии насыщения может быть либо проточным, либо порционным (порции рассола заданного объема с различным содержанием LiCl возрастающим в порядке использования порций). При порционном режиме движения рассола первая порция рассола, прошедшая операцию контакта с гранулированным сорбентом, считается отработанной по содержанию лития. Удаление рассола из насыщенного гранулированного сорбента осуществляют ступенчатым вытеснением порциями раствора хлорида натрия либо порциями литиевого концентрата. Десорбцию хлорида лития из освобожденного от рассола гранулированного сорбента также осуществляют ступенчато порциями воды с различным содержанием LiCl до полного удаления интеркалированного хлорида лития из гранулированного сорбента. Получаемый первичный литиевый концентрат - водный раствор LiCl концентрацией 5,0-5,5 кг/м3, содержащий CaCl2, MgCl2, NaCl, KCl, сульфат-ионы в виде примесей очищают от кальция и магния методом ионного обмена на катионите КУ-2 в Li-форме либо переводом в нерастворимые соединения CaCO3 и Mg(OH)2⋅3MgCO3⋅3H2O путем контактирования первичного литиевого концентрата с твердой фазой карбоната лития при температуре 60-90°C. Далее первичный литиевый концентрат подвергают концентрированию в испарительных бассейнах до содержания LiCl - 220-350 кг/м3 или обратноосмотическим методом с последующим упариванием до содержания LiCl 350-400 кг/м3, высаливая при этом NaCl и KCl, разбавляют деминерализованной водой до содержания 190-210 кг/м3, подвергают реагентной очистке от кальция и магния и используют в качестве продуктивного литиевого концентрата для получения литиевых соединений: карбоната лития, моногидрата гидроксида лития, хлорида лития и др. Предложенный способ позволяет снизить степень истирания сорбента до 7-10% и довести чистоту производимого данным способом карбоната лития до 99,5%.
По своей технической сущности и достигаемому результату этот способ получения литиевого концентрата из литиеносных природных рассолов и его переработки по технической сущности и достигаемому результату является наиболее близким к заявляемому способу и выбран нами в качестве прототипа. Наряду с вышеописанными достоинствами способу прототипу свойственны следующие недостатки.
Одним из недостатков является невозможность достижения высокой степени извлечения лития из рассолов в условиях достижения высокой степени насыщения гранулированного сорбента. Для доведения динамической емкости по хлориду лития до значения близкого к прогнозируемому значению в условиях, обеспечивающих максимальную движущую силу процесса интеркаляции лития, то есть при фильтрации исходного рассола через слой сорбента «на проток», степень извлечения хлорида лития из рассола составляет 50-55%. При ступенчатом режиме контакта рассола с сорбентом степень извлечения хлорида лития можно повысить до 75-80%, но при этом общий объем фильтруемого через сорбент рассола за один и тот же промежуток времени возрастает в несколько раз. Особенно это негативно сказывается при переработке рассола с низким содержанием LiCl (ниже 1 кг/м3), общий объемный расход фильтруемого через сорбент рассола оказывается за пределами реальной пропускной способности оборудования.
Вторым существенным недостатком данного способа является организация процесса вытеснения рассола из слоя сорбента вытесняющей жидкости в направлении «сверху - вниз» и использование в качестве вытесняющей жидкости раствора хлорида натрия или первичного литиевого концентрата. Движение вытесняющей жидкости в направлении «сверху - вниз» приводит к существенному уплотнению слоя сорбента и повышению гидравлического сопротивления. Ввиду высокого содержания в рассоле CaCl3 и MgCl2 в процессе контакта рассола с раствором хлорида натрия при вытеснении происходит высаливание хлорида натрия из раствора и отложение его твердой фазы в слое сорбента. Использование первичного литиевого концентрата в качестве высаливающей жидкости приводит к снижению выхода товарного первичного литиевого концентрата.
Кроме того, очистка первичного литиевого концентрата в способе прототипе сопряжено либо с высокими капитальными затратами в случае использования варианта ионообменной очистки на катионите КУ-2 в Li-форме либо, с низкой производительностью процесса очистки в случае варианта удаления кальция и магния в виде труднорастворимых соединений при контакте нагретого первичного литиевого концентрата с твердой фазой карбоната лития, что является существенным недостатком данного способа. К недостаткам способа-прототипа также следует отнести: отсутствие технологических решений по очистке природного литиеносного рассола от механических примесей, отсутствие мероприятий по утилизации твердого отхода производства в виде хлорида натрия при упаривании маточного раствора операции содового осаждения карбоната лития; невозможность получения карбоната лития батарейного качества (квалификация 99,9%) ввиду повышенного содержания примесей в виде щелочных металлов, кальция и магния. Кроме всего прочего способ не предусматривает получения из вторичного литиевого концентрата безводного хлорида лития, являющегося наряду с карбонатом лития, востребованным товарным литиевым продуктом.
Предлагаемый способ получения литиевого концентрата из литиеносных природных рассолов и его переработки в хлорид лития и (или) карбонат лития сохраняет все преимущества прототипа и устраняет его основные недостатки.
Сущность изобретения
Технический результат, позволяющий устранить указанные недостатки, достигается тем, что в предлагаемом способе природный рассол предварительно освобождается от взвешенных частиц путем осадительного центрифугирования рассола с выводом образовавшегося осадка и последующей фильтрацией фугата на фильтрах тонкой очистки, регенерируемых обратной промывкой потоком отфильтрованного рассола с последующей подачей потока отработанного регенерирующего рассола на операцию осадительного центрифугирования совместно с исходным литиеносным природным рассолом, если содержание взвешенных частиц в исходном природном литиеносном рассоле составляет 1,0 кг/м3 и выше или путем фильтрации исходного природного литиеносного рассола на фильтрах тонкой очистки, регенерируемых обратной промывкой потоком отфильтрованного рассола с последующим осадительным центрифугированием потока отработанного регенерирующего раствора с выводом осадка и подачей фугата на операцию фильтрации совместно с исходным природным литиеносным рассолом, если содержание взвешенных частиц в исходном природном рассоле ниже 1,0 кг/м3.
Технический результат достигается тем, что получение первичного литиевого концентрата осуществляеся путем его сорбционного обогащения по литию с использованием гранулированного сорбента на основе хлорсодержащей разновидности двойного гидроксида алюминия и лития состава: LiCl⋅2Al(ОН)3⋅mH2O, где m=3-5 с дефицитом хлорида лития.
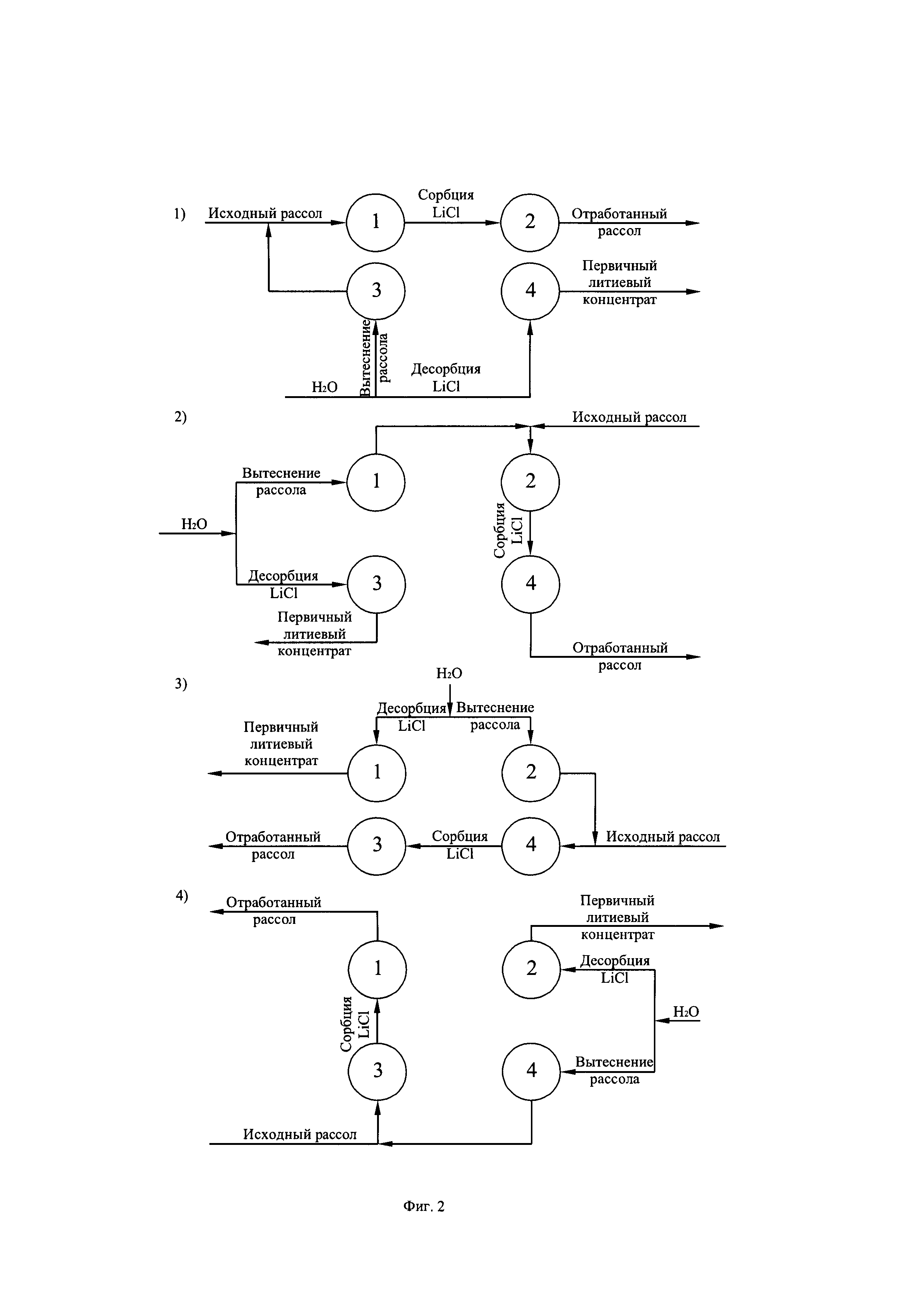
первичный литиевый концентрат производят в сорбционно-десорбционных модулях, состоящих из четырех заполненных гранулированным сорбентом колонн каждая, две из которых пребывают в стадии сорбции хлорида лития из рассола, одна из колонн пребывает в стадии отмывки насыщенного хлоридом лития сорбента от рассола и одна колонна пребывает в стадии десорбции хлорида лития из сорбента, отмытого от рассола, поток очищенного от взвешенных частиц рассола всегда пропускают вначале через колонну с частично насыщенным хлоридом лития сорбентом (первая ступень сорбции), затем через колонну с сорбентом, прошедшую стадию десорбции хлорида лития из сорбента (вторая ступень сорбции) при этом после полного насыщения хлоридом лития сорбента в первой по ходу потока рассола колонне ее переводят в стадию отмывки сорбента от рассола, колонну, находившуюся в стадии отмывки сорбента от рассола переводят в стадию десорбции хлорида лития из насыщенного сорбента, колонну, пребывавшую в стадии десорбции хлорида лития из насыщенного сорбента, переводят в стадию сорбции в качестве колонны второй ступени, используя в качестве первой ступени сорбции колонну с частично насыщенным сорбентом, которую на предыдущей стадии сорбции использовали в качестве колонны второй ступени, далее цикл повторяют по экспериментально обоснованной циклограмме; линейную скорость жидких фаз в колоннах на всех стадиях производства первичного литиевого концентрата поддерживают на уровне 5-7 м/ч, при этом отмывку сорбента от рассола осуществляют предварительным сливом рассола из колонны, затем ступенчатой промывкой сорбента последовательно пятью порциями промывной жидкости в направлении снизу вверх объемом, составляющим 1/3 от объема сорбента в колоне каждая, четыре порции из пяти представляют собой промывные жидкости с различным содержанием компонентов рассола в порядке снижения их содержания по ступеням промывки, а пятая порция представляет собой объем пресной воды, причем первой порцией промывной жидкости заполняют колонну и вытесняют ее из колонны второй порцией промывной жидкости, направляя вытесненный объем на смешение с очищенным от взвешенных частиц природным литиеносным рассолом, вторую порцию промывной жидкости вытесняют из колонны третьей порцией промывной жидкости и используют в следующем цикле отмывки как первую порцию промывной жидкости, третью порцию промывной жидкости вытесняют из колонны четвертой порцией промывной жидкости и используют в следующем цикле как вторую порцию промывной жидкости, четвертую порцию промывной жидкости вытесняют пятой порцией промывной жидкости (пресной водой) и используют в следующем цикле как третью порцию промывной жидкости, пятую порцию промывной жидкости вытесняют из колонны соответствующей порцией десорбирующей жидкости и используют в следующем цикле как четвертую порцию промывной жидкости, в качестве пятой порции промывной жидкости в следующем цикле использую свежую порцию пресной воды, десорбцию хлорида лития из отмытого от рассола сорбента осуществляют последовательной ступенчатой фильтрацией заданных объемов десорбирующих жидкостей, исходя из того, что первый объем десорбирующей жидкости, представляющий собой разбавленный водный раствор хлорида лития с примесью остатка компонентов рассола (десорбирующая жидкость первой ступени) после контакта с сорбентом выводят из процесса в качестве первичного литиевого концентрата, второй объем десорбирующей жидкости, представляющий собой пресную воду (десорбирующая жидкость второй ступени), после контакта с сорбентом используют в качестве десорбирующей жидкости первой ступени стадии десорбции в следующем цикле совместно с объемом десорбирующей жидкости, вытесненной из колонны соответствующим объемом литиеносного рассола на стадии сорбции следующего цикла;
Технический результат достигается тем, что полученный из литиеносного природного рассола первичный литиевый концентрат превращают во вторичный литиевый концентрат одним из вариантов:
по первому варианту первичный литиевый концентрат подвергают гелиоконцентрированию по хлориду лития в испарительном бассейне с одновременной очисткой от кальция и магния путем предварительного деления первичного литиевого концентрата на два потока, в одном из которых распульповывают заданное весовое количество карбоната лития, пульпу карбонизируют углекислым газом или газовой смесью, содержащей CO2, в режиме циркуляции пульпы до полного растворения карбоната лития, далее этот поток смешивают с другим потоком первичного литиевого концентрата, смешанный раствор направляют в испарительный бассейн для концентрирования жидкой фазы по LiCl до 220 кг/м3, декарбонизации постепенного перевода растворимых хлоридов кальция и магния в труднорастворимые соединения CaCO3 и Mg(OH)2⋅3Mg(OH)2⋅3H2O, которые отделяют от содержащего NaCl и KCl в качестве основных примесей концентрированного раствора хлорида лития, доводя полученный вторичный литиевый концентрат до содержания LiCl 190-200 кг/м3, используемого в дальнейшем для получения хлорида лития или карбоната лития;
по второму варианту заданное весовое количество Li2CO3 распульповывают в произведенном обратноосмотическим концентрированием - опреснением первичного литиевого концентрата, пульпу карбонизируют углекислым газом или газовой смесью, содержащей CO2, в режиме циркуляции пульпы до полного растворения карбоната лития, раствор нагревают до температуры 80-85°С при вакууммировании до 0,5 ат, декарбонизируют, направляя выделяющийся углекислый газ на операцию карбонизации пульпы, приготовленной из карбоната лития и обратноосмотического литиевого концентрата и одновременно переводя CaCl2 и MgCl2 в нерастворимые осадки СаСО3 и Mg(OH)2⋅3MgCO3⋅3H2O, которые отделяют от жидкой фазы, жидкую фазу, представляющую собой водный раствор LiCl с примесью NaCl и KCl концентрируют по хлориду лития электродиализным или термическим путем, или их комбинацией после чего раствор LiCl доводят до концентрациии 190-200 кг/м3 (вторичного литиевого концентрата), используемого в дальнейшем для получения хлорида лития или карбонат лития;
Технический результат достигается тем, что получение хлорида лития из вторичного литиевого концентрата осуществляют делением вторичного литиевого концентрата на два потока, один поток вторичного литиевого концентрата подвергают вначале реагентной очистке от магния, кальция, сульфат и борат-ионов с использованием в качестве реагентов гидроксид или оксид бария и углекислый газ, затем глубокой ионообменной очистке на полиамфолите Lewatit 208-ТР в Li-форме или его аналогах, концентрированию упариванием до содержания LiCl 485-490 кг/м3 (хлоридный литиевый рассол), высаливая при этом кристаллы NaCl и KCl, полученный хлоридный литиевый рассол охлаждают до комнатной температуры, выпавшие кристаллы NaCl и KCl с примесью кристаллов LiCl⋅H2O отделяют от жидкой фазы, кристаллы промывают ступенчато в режиме репульпации и отжима тремя порциями промывного хлоридного рассола объемом равным двум объемам порции промываемых кристаллов каждая, две порции из которых представляют собой смешанные хлоридные растворы (NaCl+KCl+LiCl) в порядке снижения содержания в них LiCl, а третья порция представляет собой смешанный раствор хлоридов щелочных металлов, не содержащих LiCl, первую порцию промывного хлоридного раствора (отработанную промывную жидкость) направляют на операцию упаривания, предварительно смешивая с очищенным от примесей вторичным литиевым концентратом, две другие порции промывного хлоридного раствора используют для последовательной ступенчатой промывки следующей порцией кристаллов, свежую (третью) порцию хлоридного промывного раствора готовят растворением в деминерализованной воде хлорида натрия или хлорида натрия с примесью хлорида калия, при этом охлажденный и освобожденный от кристаллов выпавших солей хлоридный литиевый рассол с остаточным содержанием NaCl+KCl не более 2 кг/м3 упаривают до перехода LiCl в твердую фазу хлорида лития моногидрата, остаток маточного раствора операции упаривания хлоридного литиевого рассола и кристаллизации LiCl⋅H2O отделяют от кристаллов хлорида лития моногидрата и смешивают с поступающим на упаривание очищенным вторичным литиевым концентратом, кристаллы хлорида лития моногидрата отмывают от остатка маточного раствора промывной жидкостью состава (% мас.): LiCl - (98,5-99,0), LiOH - (1,0-1,5), отработанную жидкость подкисляют соляной кислотой до рН=6-7 и смешивают с поступающим на упаривание очищенным вторичным литиевым концентратом, промытые кристаллы LiCl⋅H2O освобождают от остаточной щелочности контактом с расчетным количеством соляной кислоты и сушат до получения безводного хлорида лития путем двухступенчатой сушки в потоке воздуха, поддерживая температуру в зоне сушки на первой ступени 85-90°C, на второй ступени 108-110°C при влагосодержании воздушного потока на выходе из зон сушки 75-80%, другой поток вторичного литиевого концентрата используют для осаждения из него карбоната лития при контакте с раствором карбоната натрия или раствором карбоната натрия, содержащим карбонат калия, осажденный карбонат лития отделяют от маточного раствора операции осаждения Li2CO3 центрифугированием и направляют на распульповку с частью потока первичного литиевого концентрата или с потоком обратноосмотического литиевого концентрата, маточный раствор операции осаждения карбоната лития подкисляют соляной кислотой до рН=6,0-6,5, упаривают до достижения концентрации LiCl в жидкой фазе 485-490 кг/м3, жидкую фазу отделяют от высаленных кристаллов NaCl с примесью кристаллов KCl и смешивают с потоком вторичного литиевого концентрата, используемого для получения хлорида лития, кристаллы NaCl с примесью кристаллов KCl отмывают от остатка маточного раствора, смешивают с отмытыми кристаллами NaCl и KCl, высаленными в процессе упаривания потока вторичного литиевого концентрата при производстве LiCl, растворяют в расчетном объеме деминерализованной воды, получая хлоридный раствор щелочных металлов с концентрацией NaCl 250-260 кг/м3, полученный раствор подвергают мембранному электролизу, производя раствор NaOH и водород на катоде и хлор на аноде, производимый водород смешивают с потоком природного газа, смесь газов сжигают, используя тепловую энергию для получения греющего пара, который в свою очередь применяют в качестве теплоносителя при упаривании литиевых концентратов и маточного хлоридного раствора операции осаждения Li2CO3, содержащим CO2 топочным газом карбонизируют раствор Na2CO3, превращая его в раствор Na2CO3 (карбонатный раствор) и используя в качестве осадительного реагента на операции осаждения карбоната лития, анодный хлор эжектируют потоком водного раствора карбамида, производя таким образом раствор соляной кислоты, используемой для подкисления карбонатсодержащих растворов перед их упариванием и для регенерации отработанного полиамфолита Lewatit 280-ТР;
Технический результат достигается тем, что получение технического карбоната лития из вторичного литиевого концентрата прошедшего реагентную очистку от кальция, магния, сульфат и борат-ионов осуществляют осаждением карбоната лития из всего потока вторичного литиевого концентрата путем контакта при перемешивании и температуре 90-95°С с раствором карбоната натрия, содержащем карбонат калия, при этом после отделения от маточного раствора осаждают одну часть карбоната лития используют для получения раствора бикарбоната лития и далее для очистки первичного литиевого концентрата или обратноосмотического литиевого концентрата от кальция и магния, другую (продуктивную) часть карбоната лития промывают ступенчато в режиме распульпации и центрифугирования тремя порциями промывного раствора объемом равным трем объемам порции промываемого карбоната лития при температуре 90-95°С, вначале двумя порциями насыщенного раствора карбоната лития в порядке снижения в них содержания натрия и хлорид-иона и затем порцией деминерализованной воды, при этом первую порцию промывного раствора после контакта с карбонатом лития направляют на операцию получения пульпы Li2CO3, используемой для карбонизации, перевода твердой фазы Li2CO3 в раствор LiHCO3 и использованием для очистки первичного литиевого концентрата или обратноосмотического литиевого концентрата от кальция и магния, две другие порции промывного раствора используют для последовательной ступенчатой промывки следующей порции карбоната лития, отмытые кристаллы карбоната лития подвергают СВЧ сушке до остаточного содержания влаги 0,4% мас.;
Технический результат достигается тем, что получение карбоната лития батарейного качества из вторичного литиевого концентрата прошедшего реагентную очистку от кальция, магния, сульфат и борат-ионов и глубокую ионообменную очистку от кальция и магния на полиамфолите Lewatit 208-ТР в Li-форме осуществляют осаждением насыщенным водным раствором карбоната аммония при комнатной температуре, осадок карбоната лития отделяют от маточного раствора хлорида аммония, одну часть осадка карбоната лития используют для получения раствора бикарбоната лития далее применяемого для очистки первичного литиевого концентрата или обратноосмотического литиевого концентрата от кальция и магния, другую (продуктивную) часть осадка карбоната лития промывают ступенчато в режиме репульпации и центрифугирования тремя порциями промывного раствора объемом равным трем объемам порции промываемого карбоната лития каждая при температуре 90-95°C, причем вначале двумя порциями насыщенного раствора карбоната лития в порядке снижения в них содержания аммония и хлорид-ионов и затем порцией деминерализованной воды, первую порцию промывного раствора после контакта с карбонатом лития направляют на операцию получения пульпы Li2CO3, используемой для карбонизации, перевода твердой фазы Li2CO3 в раствор LiHCO3 и применения для очистки первичного литиевого концентрата или обратноосмотического литиевого концентрата от кальция и магния, две другие порции промывного раствора используют для последовательной промывки следующей порции карбоната лития, отмытые кристаллы карбоната лития подвергают СВЧ сушке до остаточного содержания влаги 0,2% мас, из маточного раствора операции осаждения карбоната лития высаливают хлорид аммония упариванием, после отделения от маточного раствора упаривания отмывают от остатка маточного раствора, отработанный промывной раствор направляют на упаривание, смешивая с маточным раствором операции осаждения карбоната лития, в свою очередь маточный раствор операции упаривания и высаливания кристаллов хлорида аммония, представляющий собой раствор LiCl 480-490 кг/м3 с примесью NH4Cl смешивают с вторичным литиевым концентратом перед его ионообменной очисткой на полиамфолите Lewatit 208-ТР в Li-форме, отмытый от маточного раствора хлорид аммония разлагают, обрабатывая водной пульпой содержащей в виде твердой фазы СаО или СаО с примесью MgO, SiO2 и Fe2O3, удаляя выделяющийся аммиак, смешивая его с углекислым газом в соотношении 2:1 и абсорбируя смесь газов водой при охлаждении в ступенчато противоточном режиме контакта жидкой и газовой фаз с выводом отработанного абсорбента в виде насыщенного раствора карбоната аммония, используемого для осаждения карбоната лития, образующуюся после удаления аммиака пульпу разделяют фильтрацией или центрифугированием, жидкую фазу, представляющую собой раствор хлористого кальция с примесью NaCl и KCl выводят из процесса и используют в коммунальном хозяйстве в качестве реагента для укрепления грунтовых дорог (летний период) и в качестве противогололедного реагента (зимний период), твердую фазу, представляющую собой MgO с примесью SiO2 и Fe2O3, используют для производства магниевых продуктов, оксид кальция и углекислый газ, необходимые для разложения хлорида аммония и производства раствора (NH4)2CO3, получают путем термического разложения осадка солей CaCO3 и Mg(OH)2⋅3MgCO3⋅3H2O, образующихся на операции очистки первичного литиевого концентрата от кальция и магния в смеси с измельченным природным известняком или доломитом.
Преимущества предлагаемых решений по сравнению со способом прототипа состоят:
1. В расширении диапазона литиеносных гидроминеральных сырьевых источников пригодных для производства соединений лития за счет использования литиеносных природных рассолов, содержащих в своем составе взвешенные частицы;
2. В повышении степени селективного извлечения хлорида лития при сорбционном обогащении литиеносных природных рассолов по хлориду лития на гранулированном сорбенте ДГАЛ-Cl с получением первичного литиевого концентрата;
3. В снижении потерь хлорида лития и сокращении энергозатрат при производстве литиевого концентрата за счет разработки рациональной схемы удаления рассола из колонн сорбционно-десорбционных модулей перед операцией десорбции;
4. В более экономичном способе очистки первичного литиевого концентрата или обратноосмотического литиевого концентрата от кальция и магния;
5. В получении безводного хлорида лития квалификацией, соответствующей ТУ 95.1926-89 и пригодного для получения металлического лития батарейного качества;
6. В исключении при производстве технического Li2CO3 использования привозной соды путем замены на содовый раствор, производимый из маточного раствора операции осаждения Li2CO3 и отходящего топочного газа;
7. В возможности производства из первичного литиевого концентрата карбоната лития батарейного качества с заменой привозного дорогостоящего реагента соды на более дешевый местный известняк или доломит.
Сведения, подтверждающие возможность реализации предлагаемого изобретения представлены на фигурах 1-4 и в примерах.
Перечень чертежей
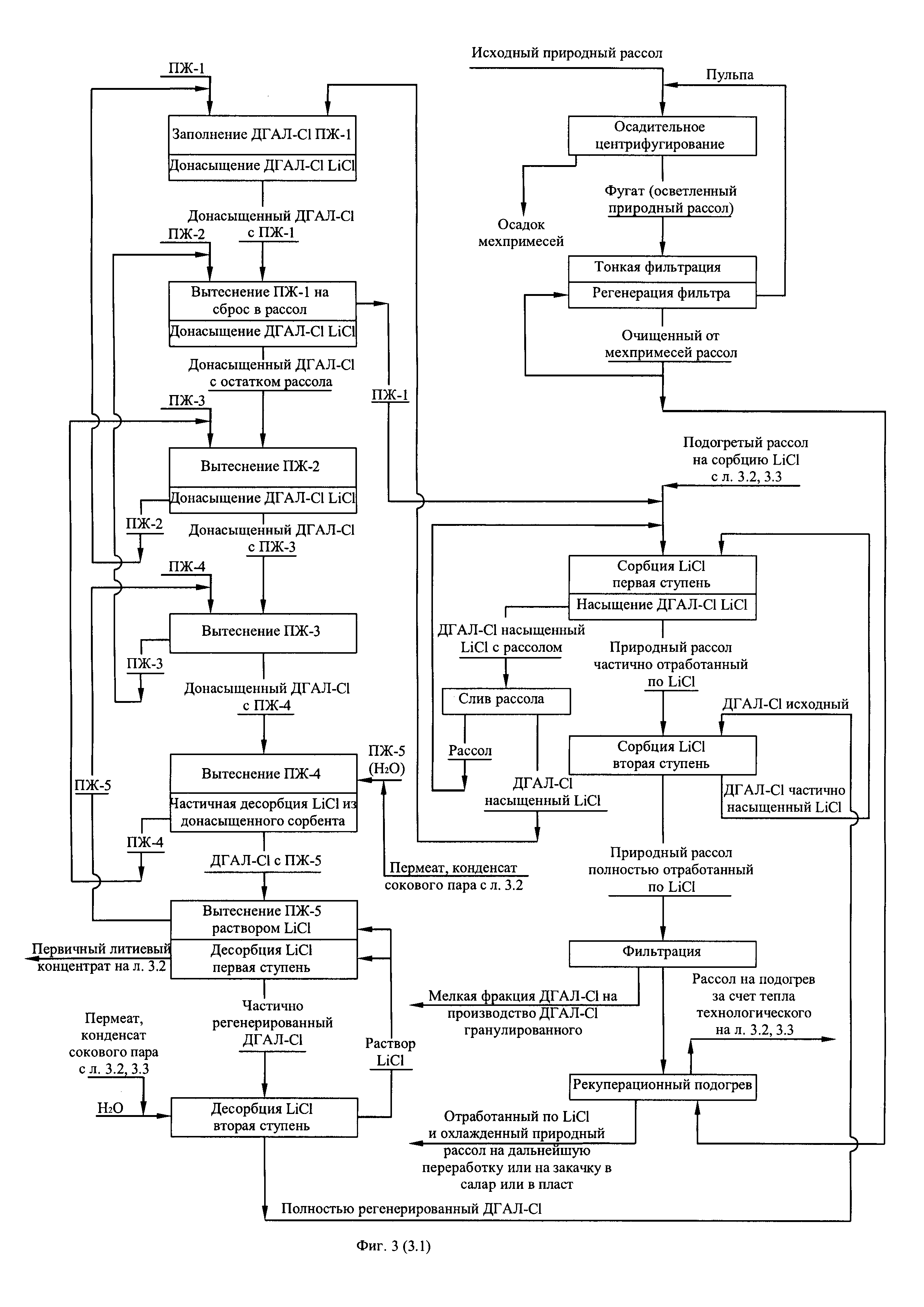
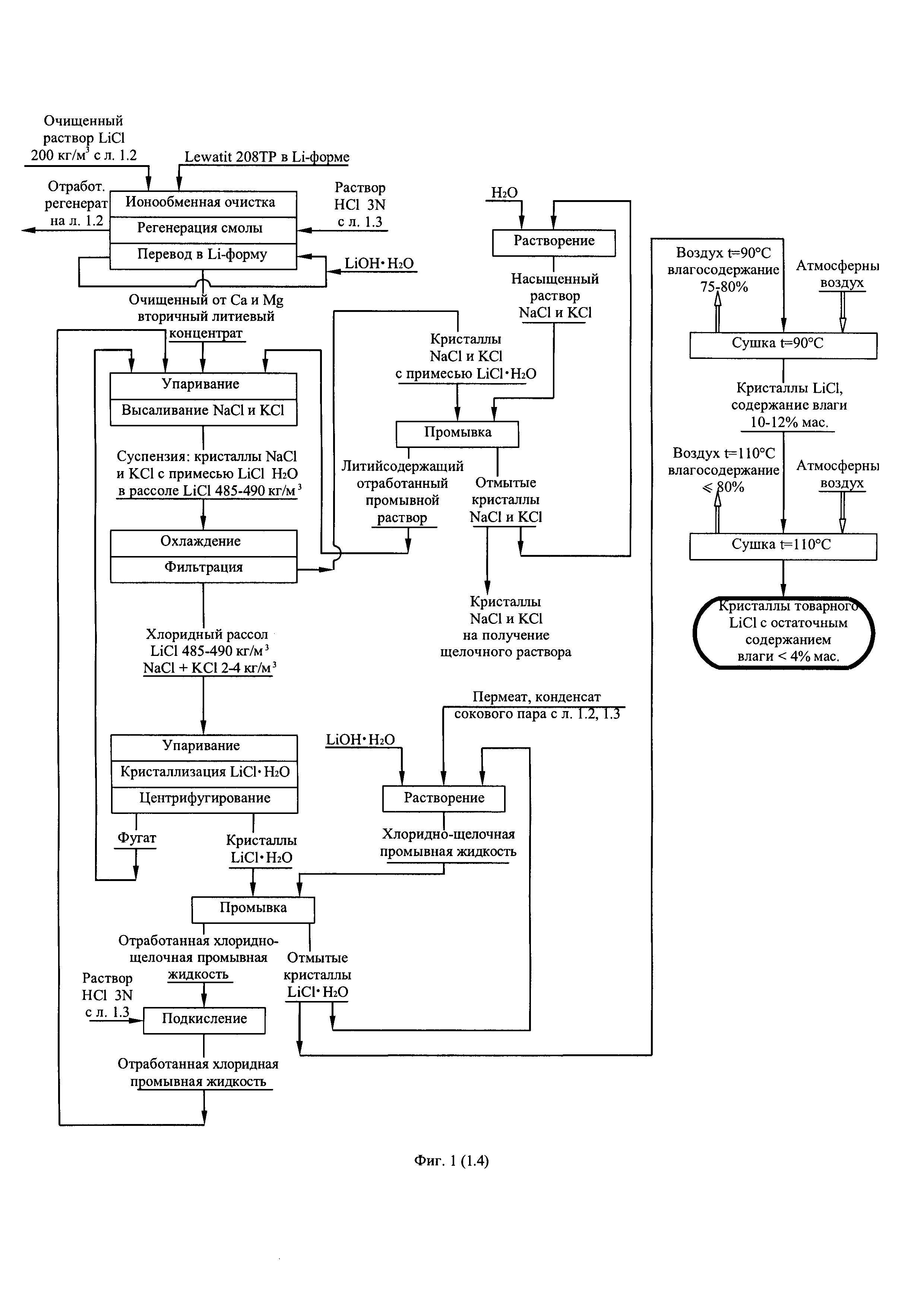
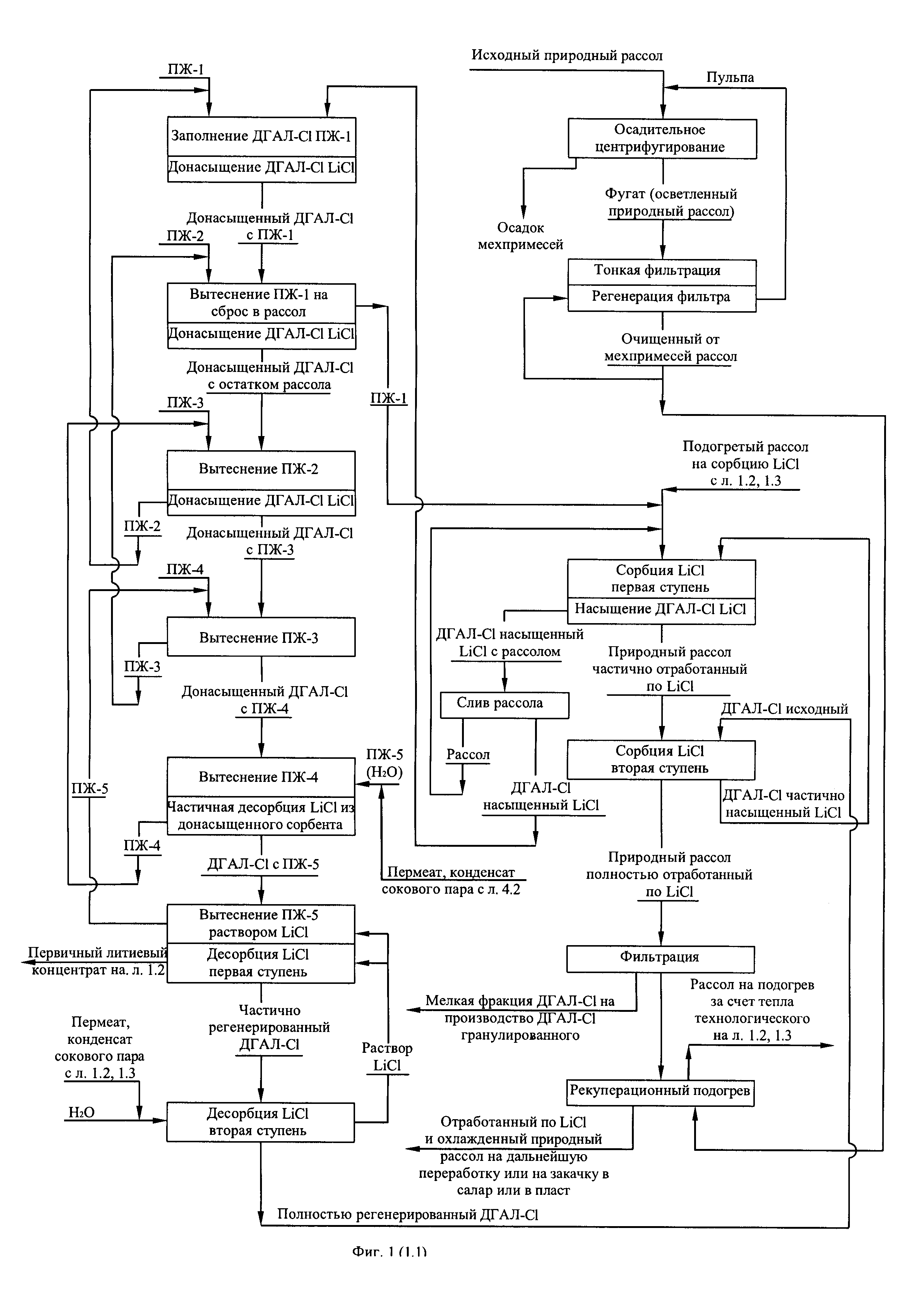
Фиг. 1. (листы 1.1, 1.2, 1.3, 1.4) Технологическая схема получения из литиеносных природных рассолов первичного литиевого концентрата и переработки его в безводный хлорид лития
Фиг. 2. Схема работы сорбционно-десорбционного модуля из четырех колонн с гранулированным селективным сорбентом ДГАЛ-Cl
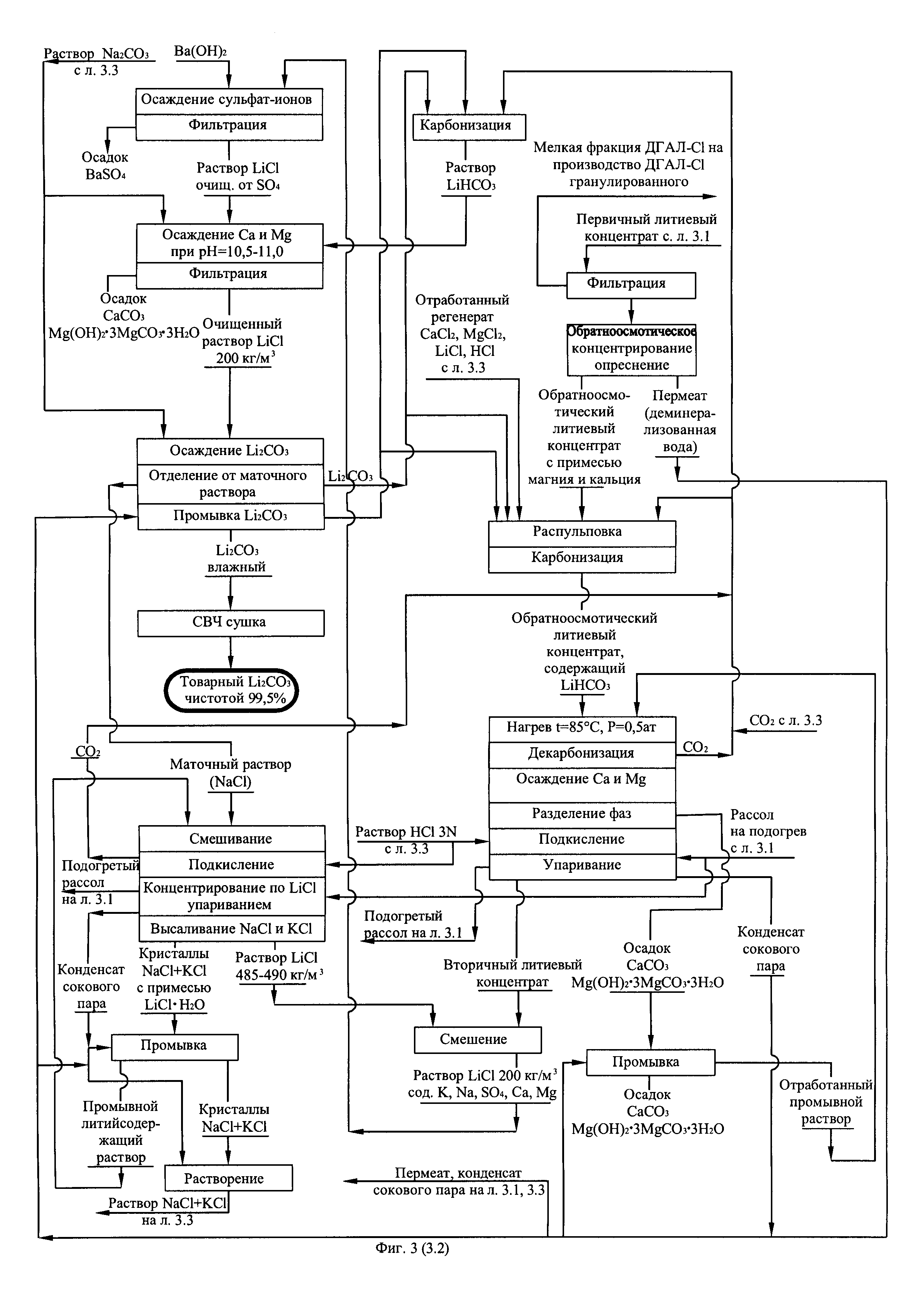
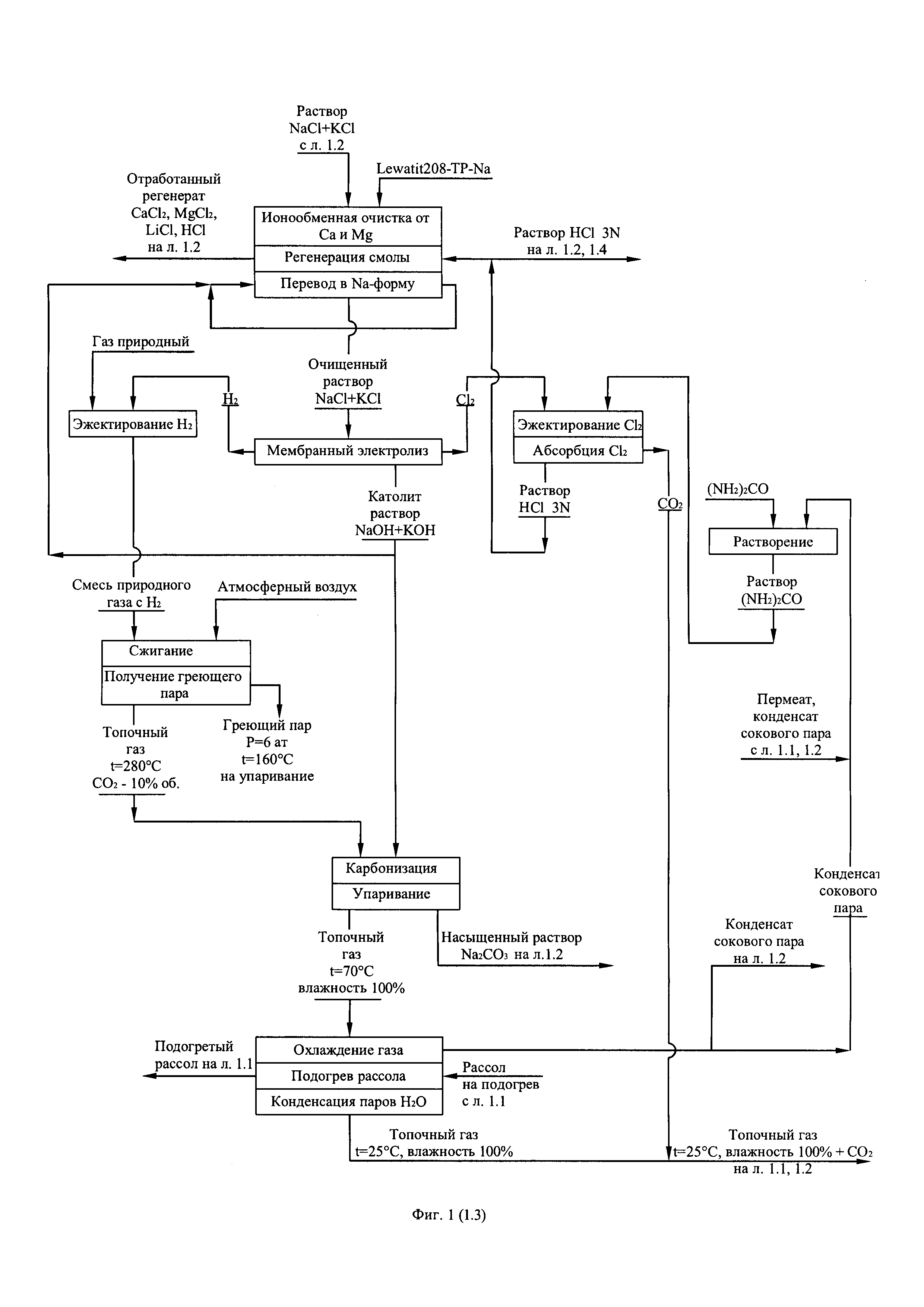
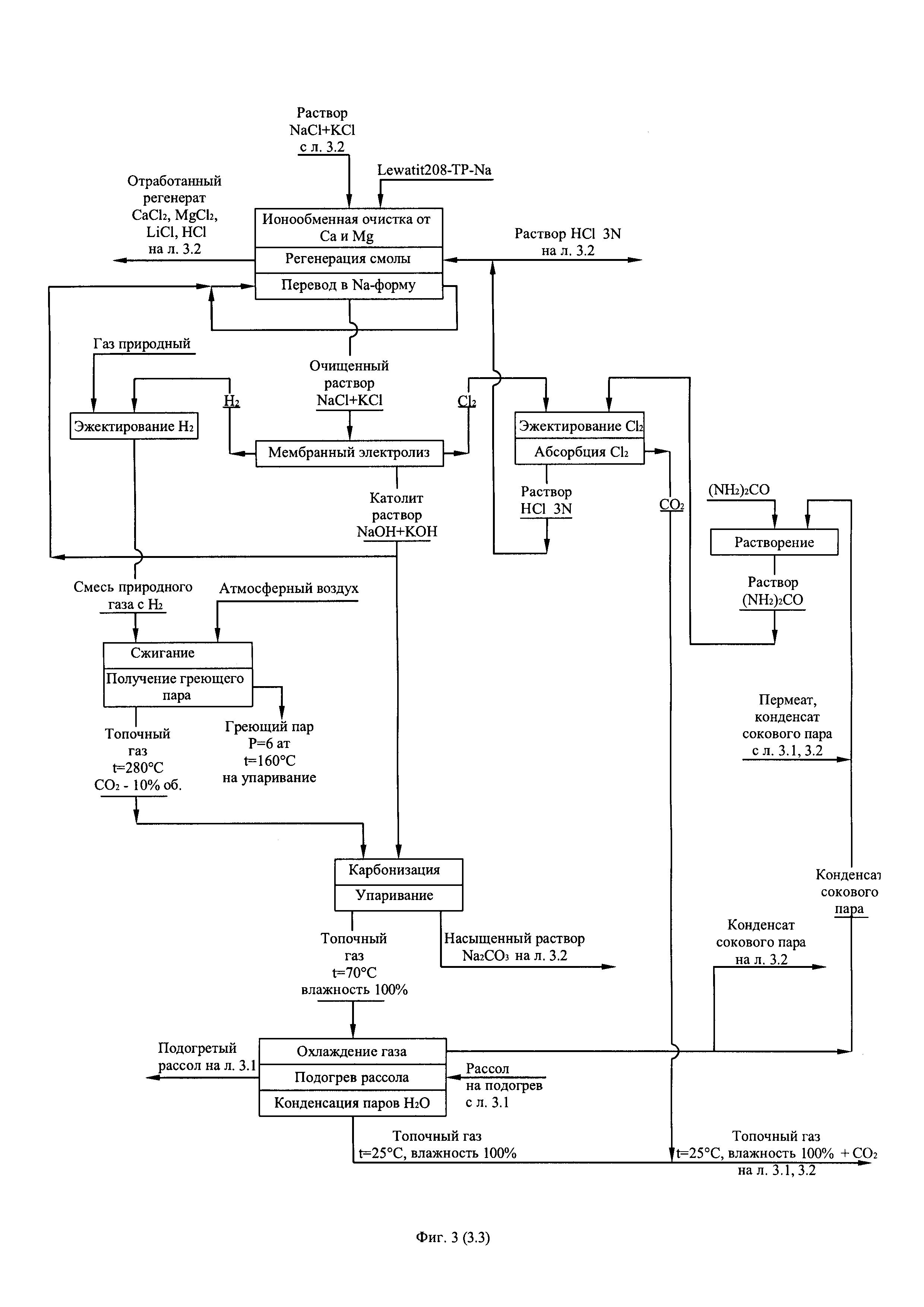
Фиг. 3. (листы 3.1, 3.2, 3.3) Технологическая схема получения первичного литиевого концентрата из литиеносных природных рассолов и переработки его в технический карбонат лития по содовой схеме.
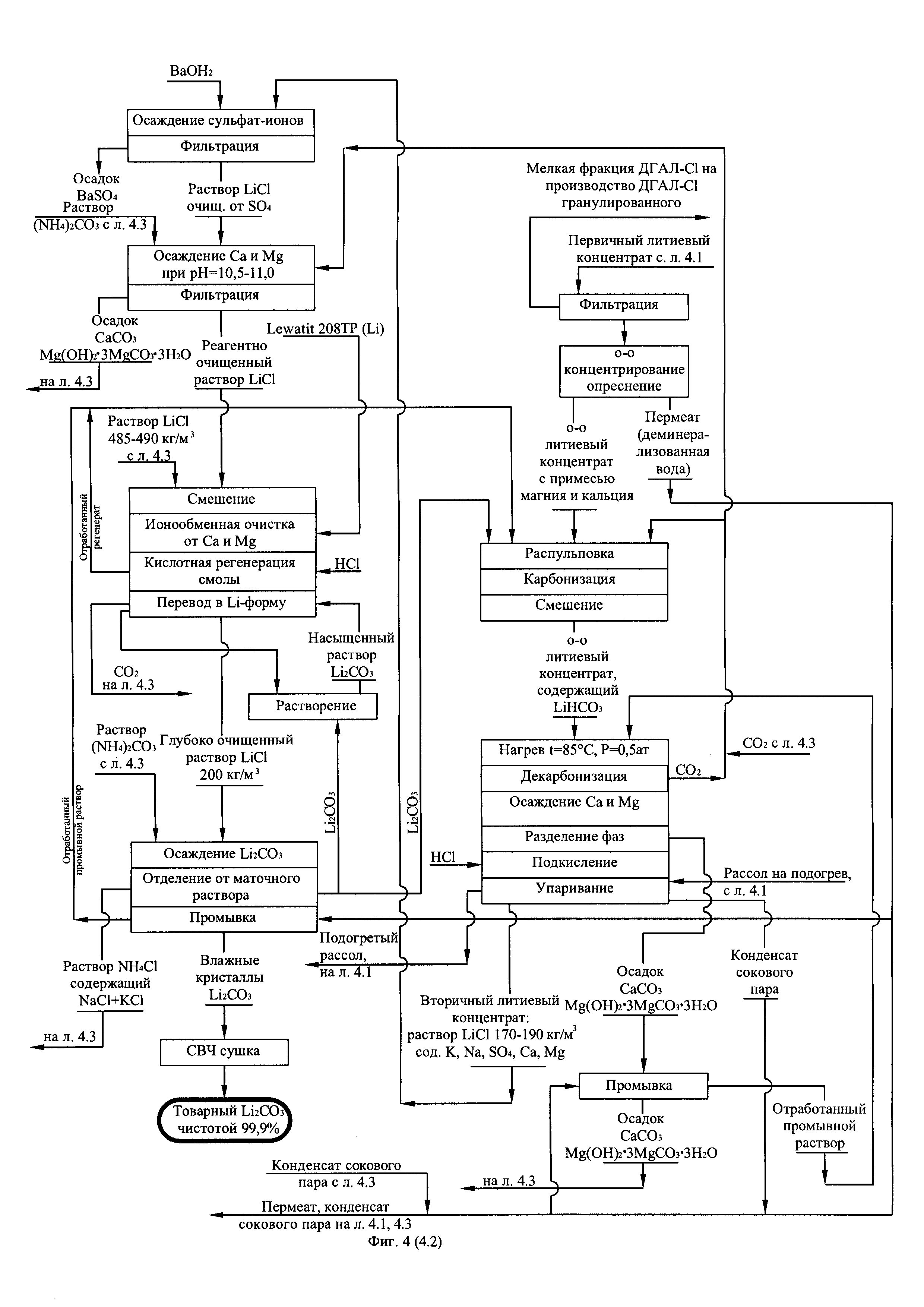
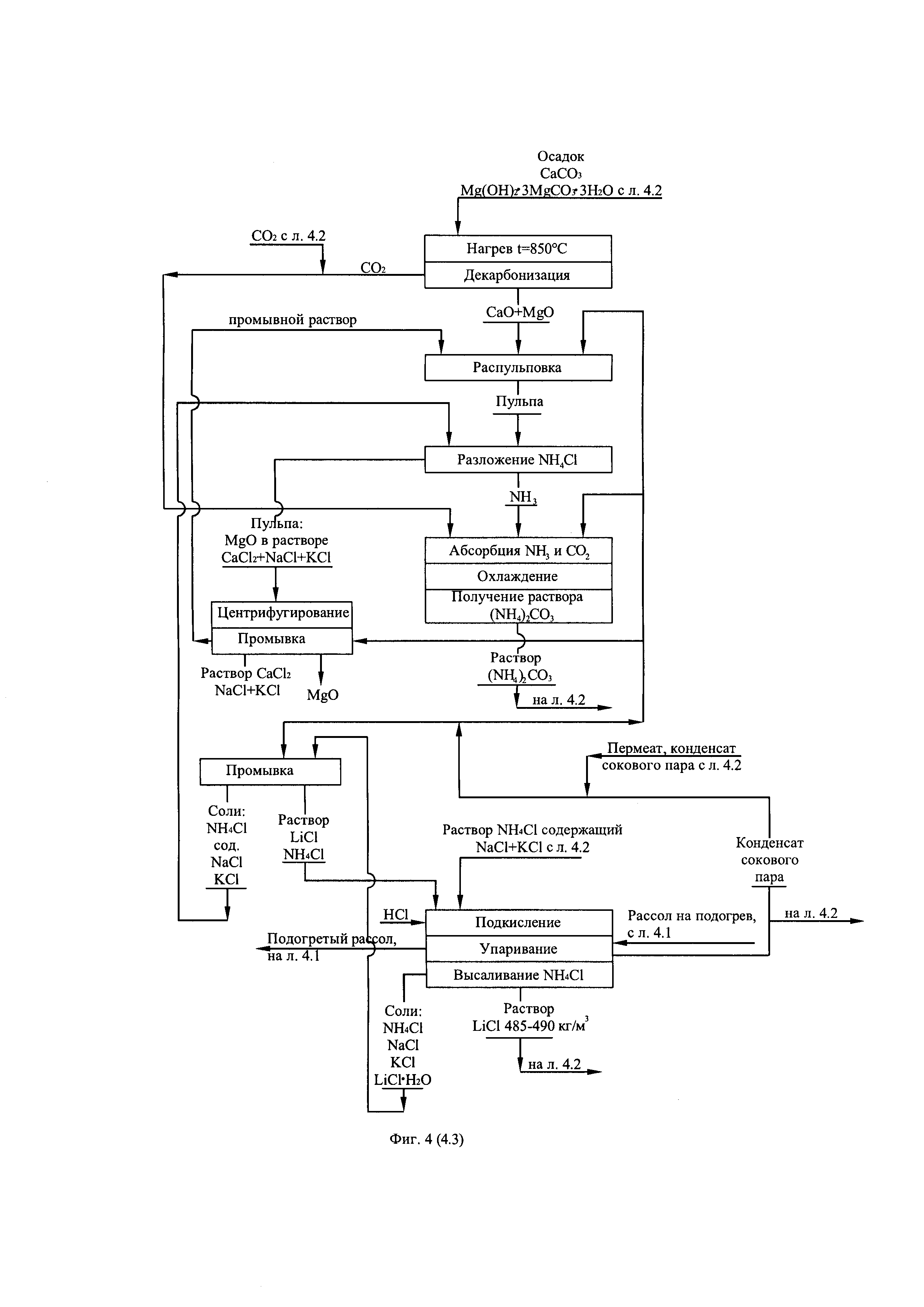
Фиг. 4. (листы 4.1, 4.2, 4.3) Технологическая схема получения первичного литиевого концентрата из литиеносных природных рассолов и переработка его в карбонат лития батарейного качества по известковой схеме.
Примечание: В схемах 1, 3, 4 приняты сокращения: ДГАЛ-Cl-гранулированный сорбент на основе хлорсодержащей разновидности двойного гидроксида алюминия, лития; ПЖ - промывная жидкость.
Ниже приводится описание реализации предлагаемого способа.
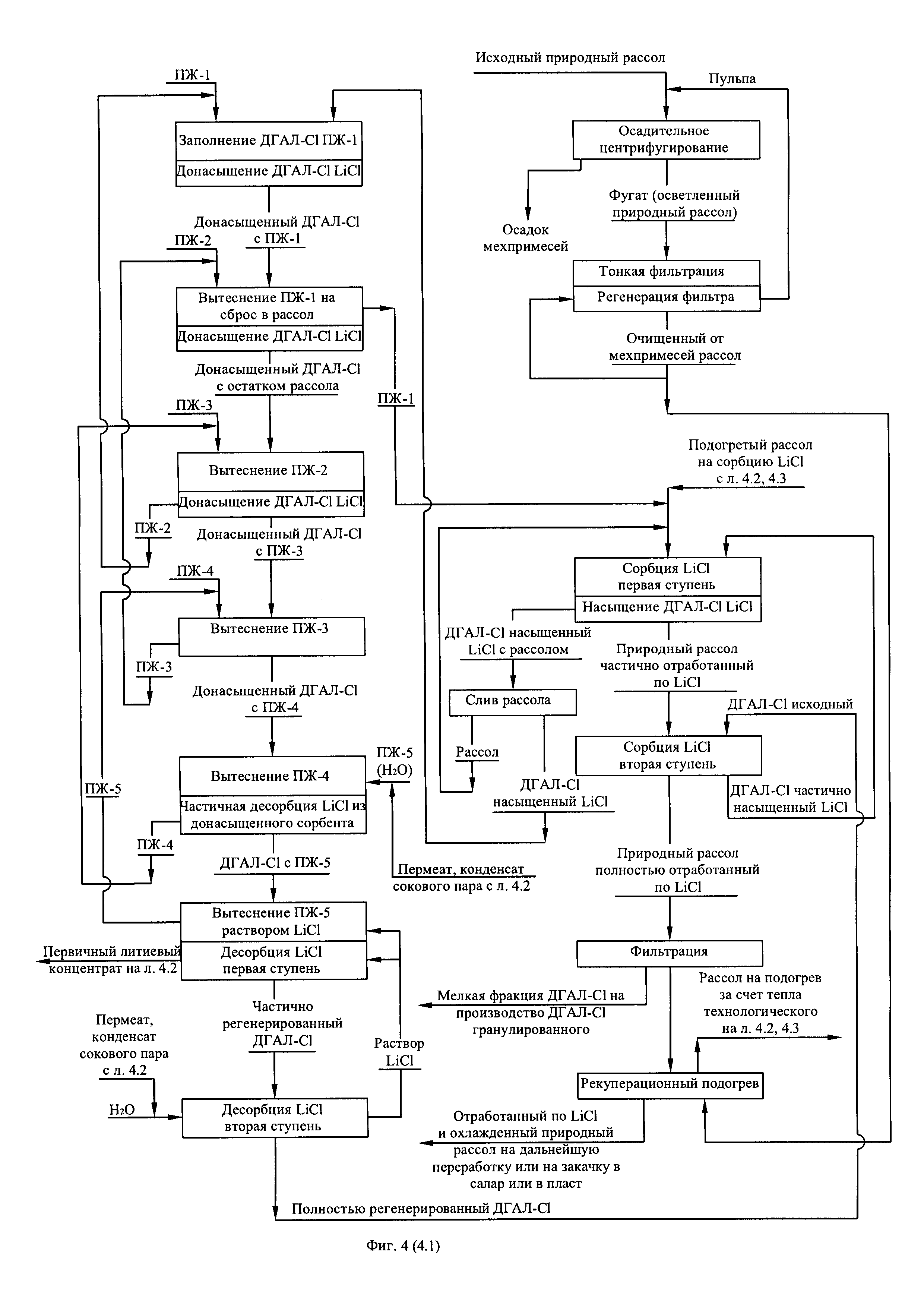
В соответствии с технологической схемой (фиг. 1) получения первичного литиевого концентрата из литиеносного природного рассола и его переработку в безводный хлорид лития осуществляют следующим образом. Исходный природный рассол проходит стадию очистки от механических примесей. При содержании механических примесей 1,0 кг/м3 и выше рассол подвергают вначале осадительному центрифугированию, затем тонкой фильтрации. Регенерацию отработанных фильтрующих элементов осуществляют потоком отфильтрованного рассола, подаваемому противоточно направлению рассола при фильтрационной очистке. Отработанный рассол операции регенерации фильтрующих элементов смешивают с исходным природным рассолом, поступающим на центрифугирование.
Очищенный от механических примесей рассол направляют вначале на рекуперационный подогрев потоком отработанного по литию рассола, прошедшего передел сорбционного обогащения, затем на подогрев за счет утилизации технологического тепла, выделяемого на операциях упаривания и охлаждения, где природный рассол используют в качестве хладагента.
Подогретый рассол поступает в сорбционно-десорбционный комплекс на селективную двухступенчатую сорбцию хлорида лития гранулированным сорбентом ДГАЛ-Cl. На первой ступени сорбции поток рассола контактирует с частично насыщенным сорбентом, обеспечивая тем самым полное насыщение последнего за временной период, отводимый на операцию сорбции. В то же время на второй ступени сорбции поток рассола, освобожденный от хлорида лития на 45-55% контактирует с исходным (свежим) сорбентом, где освобождается от хлорида лития еще на 45-55%, частично насыщая сорбент. Рассол, прошедший стадию сорбции (маточный рассол) подвергают фильтрации с целью улавливания выносимой из колонн мелкой фракции сорбента. Сорбент первой ступени, насыщенный хлоридом лития, освобождают от рассола вначале путем его слива из колонны и возврата слитого объема на сорбцию затем ступенчатой последовательной промывкой пятью объемами промывной жидкости, четыре из которых содержат промывную жидкость с различным содержанием компонентов рассола в порядке снижения содержания с ростом ступеней промывки, а пятая порция представляет собой пресную воду. Первой порцией промывной жидкости (ПЖ-1) заполняют освобожденную от рассола колонну и вытесняют ее из колонны второй порцией промывной жидкости (ПЖ-2). Направляя вытесненный объем на смешение с очищенным от взвешенных частиц и подогретым природным литиеносным рассолом, вторую порцию промывной жидкости вытесняют из колонны третьей порцией промывной жидкости (ПЖ-3) и используют в следующем цикле как ПЖ-1, третью порцию промывной жидкости вытесняют из колонны четвертой промывной жидкостью (ПЖ-4) и используют в следующем цикле как ПЖ-2, четвертую порцию промывной жидкости вытесняют пятой порцией промывной жидкости (пресная вода) и используют в следующем цикле как ПЖ-3, пятую порцию промывной жидкости вытесняют из колонны соответствующей порцией десорбирующей жидкости (водный раствор LiCl) и используют в следующем цикле как ПЖ-4. В качестве пятой порции промывной жидкости в следующем цикле используют свежую порцию пресной воды, такая организация удаления рассола из колонны является оптимальной, поскольку обеспечивает достаточно глубокую степень удаления рассола (выше 98%) при минимальном количестве ступеней отмывки, равном пяти. Из отмытого от рассола, насыщенного хлоридом лития сорбента десорбируют заданное количество хлорида лития фильтрацией через слой сорбента порцией заданных объемов десорбирующих жидкостей, исходя из того, что первая порция десорбирующей жидкости, представляющая собой разбавленный водный раствор хлорида лития с примесью остатка компонентов рассолов после контакта с сорбентом выводят из процесса в качестве первичного литиевого концентрата. Вторая порция десорбирующей жидкости, представляющая собой пресную воду после контакта с сорбентом используют в качестве десорбирующей жидкости первой ступени в следующем цикле совместно с объемом десорбирующей жидкости, вытесненной из сорбента соответствующим объемом литиеносного рассола на стадии сорбции следующего цикла. Более подробно схема цикла работы сорбционно-десорбционного модуля из четырех колонн представлена на фиг. 2. Полученный первичный литиевый концентрат фильтруют с целью улавливания мелкой фракции сорбента выносимого из сорбционно-десорбционных колонн в процессе десорбции.
После фильтрации первичный литиевый концентрат подвергают обратноосмотическому концентрированию-опреснению, производя обратноосмотический литиевый концентра общей минерализацией до 60 кг/м3, с одной стороны, и пермеат (деминерализованную воду с общей минерализацией не более 30 г/м3), используемый в технологии в качестве промывной, вытесняющей и десорбирующей жидкостей, снижая таким образом расход пресной воды. В свою очередь в обратноосмотическом литиевом концентрате, смешиваемый предварительно с отработанным регенератом ионообменной очистки вторичного литиевого концентрата и промывным карбонатным раствором операции осаждения карбоната лития, распульповывают расчетное количество карбоната лития, пульпу карбонизируют углекислым газом до полного растворения карбоната лития и перехода его в раствор бикарбоната лития по реакции:
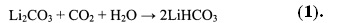
Полученный бикарбонатно-хлоридный литийсодержащий раствор концентрируют до содержания LiCl 190-200 кг/м3 упариванием с одновременной очисткой от кальция и магния, производя вторичный литиевый концентрат. При этом в случае использования для упаривания раствора природного гелио-концентрирования в бассейнах, процесс естественного упаривания сопровождается постепенным разложением бикарбоната лития и переводом ионов кальция и магния в нерастворимые соединения анионами CO32- и ОН-, образующимися при разложении LiHCO3.
Процесс может быть описан следующими химическими реакциями:



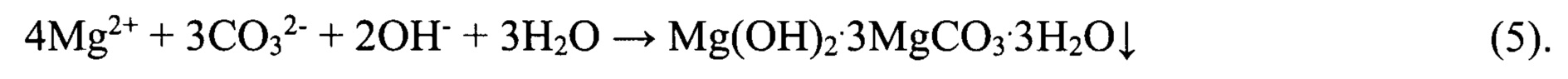
В случае отсутствия возможности использования природного гелиоконцентрирования хлоридно-бикарбонатный литийсодержащий раствор вначале нагревают при интенсивном перемешивании и разрежении 0,5 ат до температуры 85°C, проводя декарбонизацию и осаждая кальций и магний в нерастворимые соединения CaCO3 и Mg(OH)2⋅3MgCO3⋅3Н2О. Процесс полной декарбонизации протекает в течение 45-60 минут. После завершения процесса декарбонизации и осаждения примесей раствор после подкисления упаривают с получением вторичного литиевого концентрата и конденсата сокового пара.
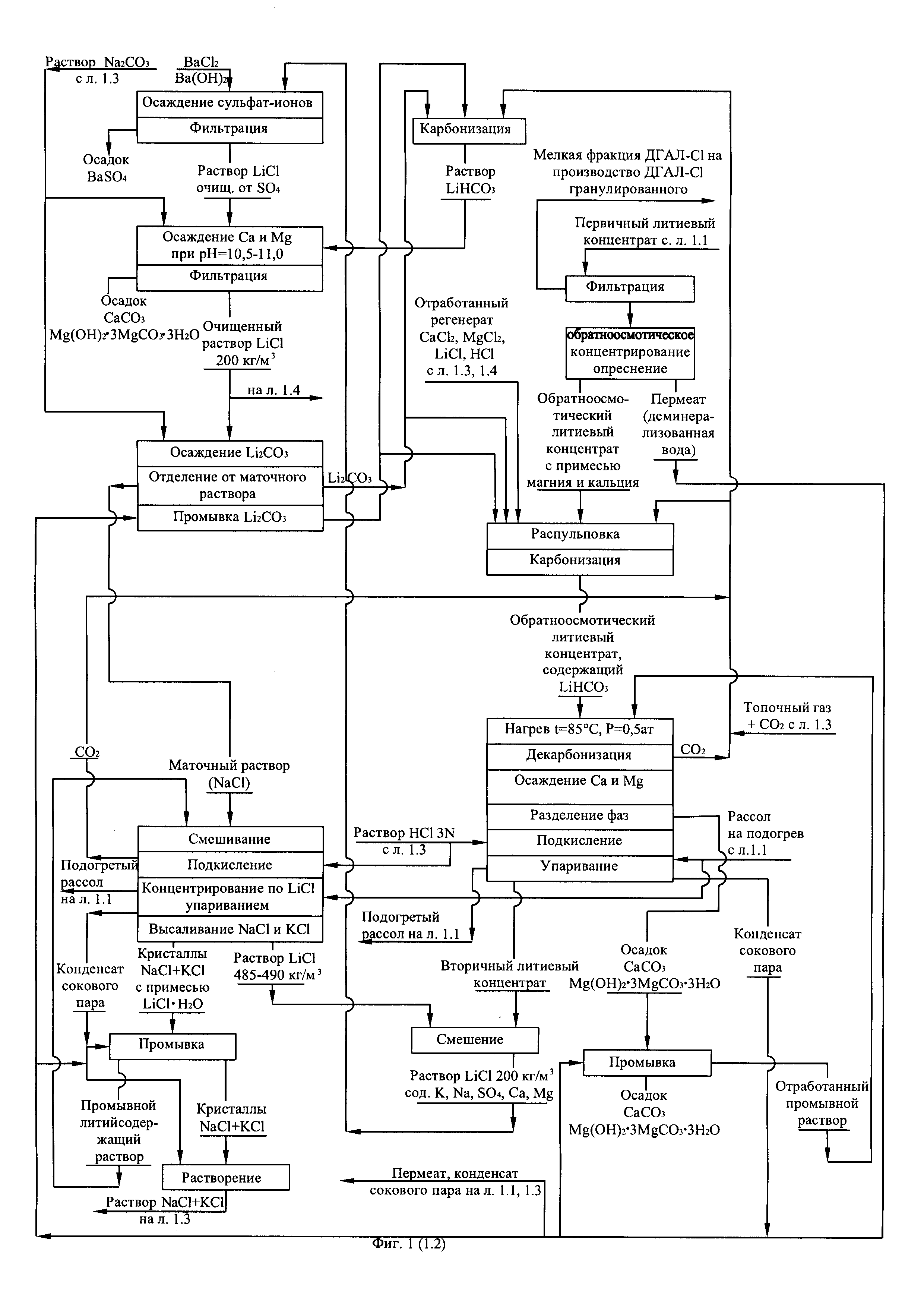
Полученный вторичный литиевый концентрат после смешивания с концентрированным раствором LiCl, полученным при переработке маточного раствора операции осаждения карбоната лития направляют на реагентную очистку от кальция, магния и сульфат-ионов вследствие повышения содержания примесей в результате упаривания вторичного литиевого концентрата. Реагентную очистку проводят, исходя из двух возможных вариантов. По первому варианту в качестве реагента для осаждения бария используют BaCl2, а в качестве реагента для очистки от кальция и магния расчетное количество Na2CO3.
Процесс очистки может быть описан следующими уравнениями химических реакций:



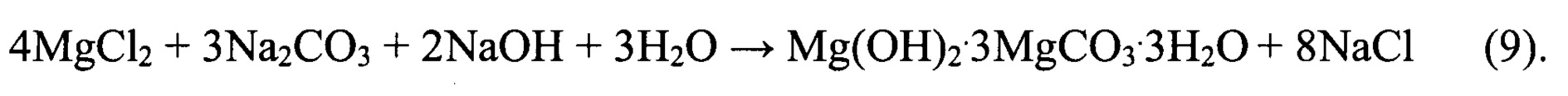
По второму варианту в качестве реагента для очистки вторичного литиевого концентрата от сульфат-ионов используют Ba(OH)2, а в качестве реагента для очистки от кальция и магния раствор LiHCO3, получаемый путем карбонизации углекислым газом пульпы, приготовленной из расчетных количеств карбоната лития и промывного карбонатного раствора. Процесс очистки по этому варианту может быть описан следующими химическими реакциями:

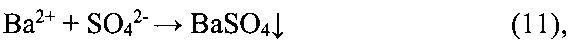
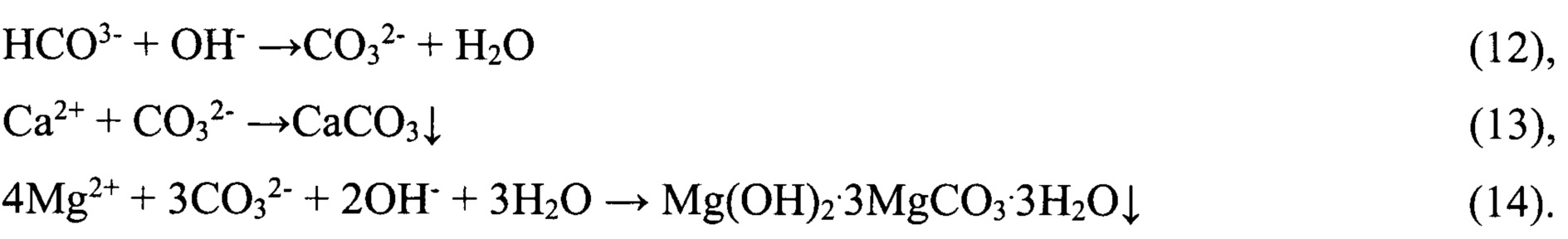
Целесообразность применения того или иного варианта очистки определяют на стадии проектирования производства.
После фильтрации и отделения от твердой фазы осадков реагентно очищенный вторичный литиевый концентрат, представляющий собой раствор хлорида лития, делят на два заданных потока, один из которых направляют на осаждение Li2CO3 путем контакта с насыщенным раствором Na2CO3. Полученный Li2CO3 используют для очистки первичного литиевого концентрата или очистки обратноосмотического литиевого концентрата от кальция и магния. Другой поток раствора хлорида лития направляют на глубокую ионообменную очистку от остаточного количества кальция и магния на амфолите Lewatit 208-ТР в Li-форме или его аналогах.
Процесс ионообменной очистки описывается следующими уравнениями:
1) Сорбция
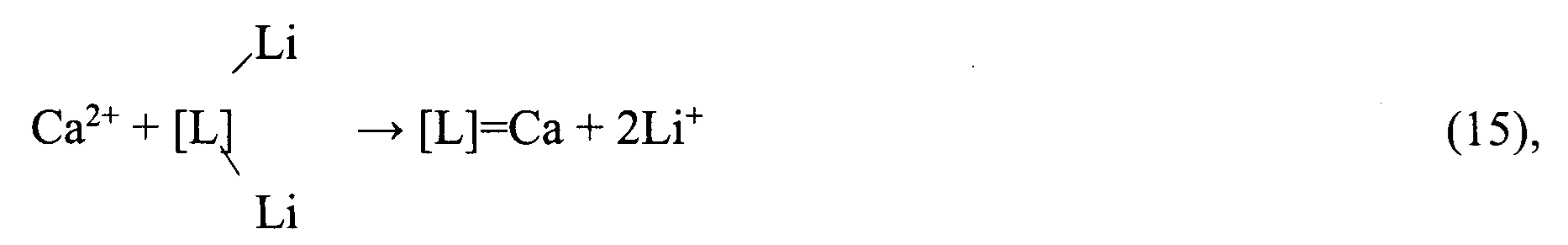
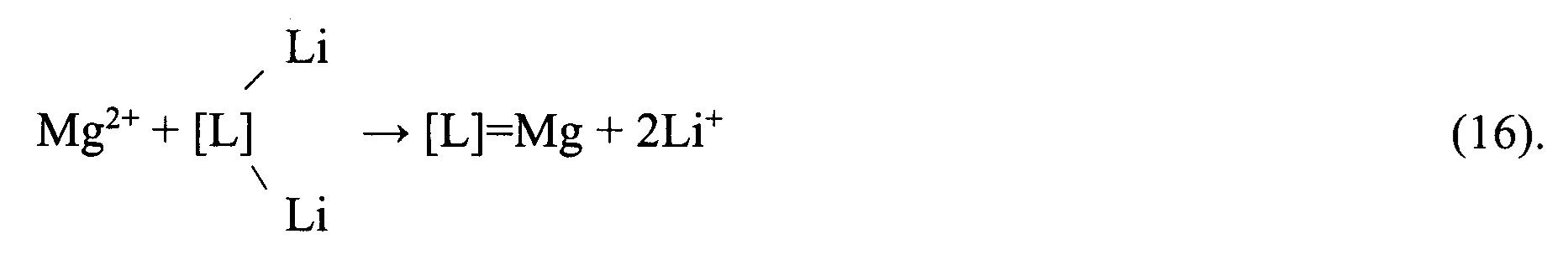
2) Регенерация
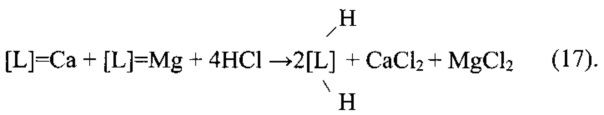
3) Перевод в Li-форму
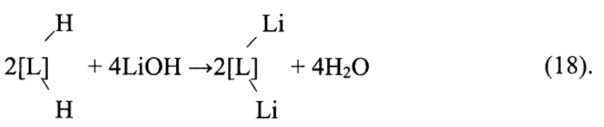
Перевод смолы в Li-форму может быть осуществлен и раствором LiHCO3, используемым вместо раствора LiOH по реакции:
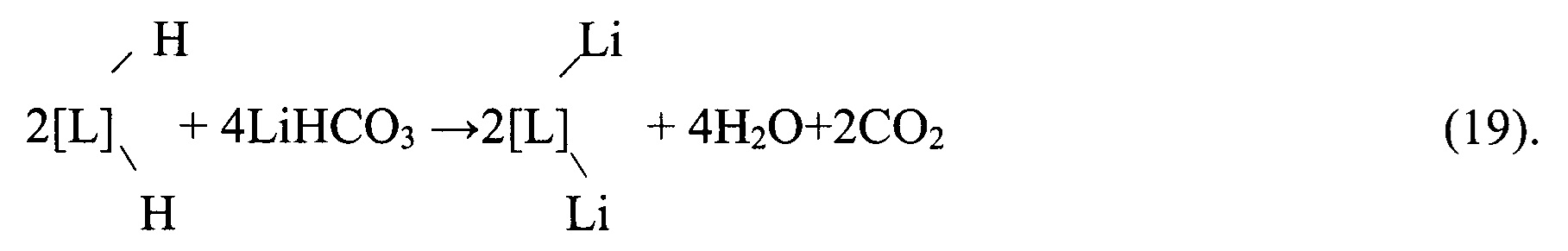
Отработанный регенерационный раствор направляют на смешение с обратноосмотическим литиевым концентратом для приготовления пульпы Li2CO3 карбонизацией и использования для очистки обратноосмотического литиевого концентрата или первичного литиевого концентрата от кальция и магния.
Прошедший глубокую очистку от кальция и магния поток вторичного литиевого концентрата упаривают до содержания LiCl 485-490 кг/м3, охлаждают до комнатной температуры, высаливая при этом NaCl и KCl из раствора до их остаточной суммарной концентрации, не превышающей 4 кг/м3.
После отделения кристаллов NaCl и KCl от раствора LiCl последний упаривают, кристаллизуя моногидрат лития хлорида (LiCl⋅H2O), образовавшиеся кристаллы отделяют от остатка жидкой фазы центрифугированием. Фугат возвращают на упаривание, кристаллы LiCl⋅H2O отмывают от остатка маточного раствора хлоридно-щелочным раствором (1,0-1,5% мас. LiOH в насыщенном растворе LiCl). Добавка LiOH в раствор LIC1 обеспечивает перевод содержащихся в твердой фазе кристаллогидрата LiCl⋅H2O остаточных примесей натрия и калия в промывной раствор. Содержащий натрий и калий отработанный промывной раствор после подкисления направляют на смешивание с глубоко очищенным от кальция и магния вторичным литиевым концентратом и упаривание. Отмытые от маточного раствора кристаллы LiCl⋅Н2О направляют на двухстадийную сушку. Сушку ведут в токе воздуха. На первой стадии кристаллы хлорида лития моногидрата сушат до остаточного содержания влаги 10-12% мас. при температуре в зоне сушки 90°C. На второй стадии температуру в зоне сушки повышают до 110°C, получая безводный LiCl с остаточным влагосодержанием <4% мас., соответствующий требованиям ТУ 95.1926-89. Воизбежание концентрации водяных паров относительную влажность воздуха на выходе из зон сушки на обеих стадиях поддерживают в пределах 75-80°C. Высоленные в процессе упаривания очищенного от примесей вторичного литиевого концентрата кристаллы NaCl и KCl, содержащие кристаллы LiCl⋅Н2О в качестве примеси, промывают насыщенным хлоридным раствором, приготовленным из смеси кристаллов NaCl и KCl. Отмытые кристаллы NaCl и KCl используют в качестве сырья для получения щелочного раствора (NaOH и КОН), который в свою очередь используют для получения карбонатного раствора (Na2CO3 и K2CO3). Литийсодержащий отработанный промывной раствор, образующийся в результате отмывки кристаллов NaCl и KCl, направляют на смешение с очищенным вторичным литиевым концентратом и упаривание. В свою очередь маточный раствор операции осаждения карбоната лития, представляющий собой раствор NaCl концентрацией 220-230 кг/м3 с примесью KCl (содержание 2 кг/м3) и Li2CO3 (содержание 11-12 кг/м3) подкисляют, декарбонизируют и упаривают, высаливая кристаллы NaCl и KCl, до достижения концентрации LiCl в упаренном растворе 485-490 кг/м3.
После отделения литийсодержащей жидкой фазы от кристаллов NaCl и KCl ее направляют на смешение с вторичным литиевым концентратом, поступающем на реагентную очистку от примесей. Кристаллы NaCl и KCl отмывают от маточного раствора конденсатом сокового пара, смешивают с кристаллами NaCl и KCl, выделенными в результате упаривания потока, глубоко очищенного от кальция и магния вторичного литиевого концентрата, направляемого для получения товарного хлорида лития, смесь кристаллов растворяют в конденсате сокового пара, производя водный раствор NaCl с примесью KCl с показателем общего солесодержания 260-270 кг/м3. Раствор глубоко чистят от примеси кальция и магния ионообменным способом на смоле Lewatit 208-ТР в Na-форме и направляют на мембранный электролиз для получения раствора NaOH (католит) и анодного хлор-газа. Католит карбонизируют отходящим топочным газом, производя насыщенный раствор Na2CO3 в соответствии с реакцией:

Содовый раствор используют в качестве осадительного реагента для получения заданного количества Li2CO3. Топочный газ является отходом процесса производства греющего пара в котле-утилизаторе при сжигании газовой смеси, состоящей из природного газа и водорода. Газовую смесь получают путем эжектирования потоком исходного природного газа катодного водорода из газоотделителя католитного контура мембранного электролизного агрегата. Анодный хлор превращают в 3,0N-3,5N раствор соляной кислоты путем эжектирования потоком водного раствора карбамида анодного хлора из газоотделителя анолитного контура мембранного электролизного агрегата с последующей абсорбцией, сопровождаемой следующей химической реакцией:
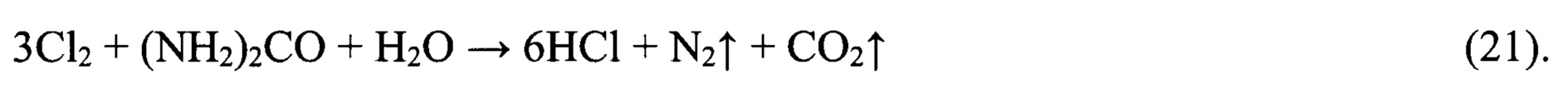
Раствор соляной кислоты используют для регенерации ионообменной смолы, подкисления и декарбонизации растворов перед упариванием и для других целей производства.
Технология получения первичного литиевого концентрата и его переработки в технический карбонат лития (фиг. 3) отличается от технологии получения первичного литиевого концентрата и его переработки в безводный хлорид лития только тем, что весь поток произведенного и очищенного от примесей кальция и магния вторичного литиевого концентрата перерабатывают в Li2CO3 по той же самой схеме.
Технология получения первичного литиевого концентрата и его переработку в карбонат лития батарейного качества представлена на фиг. 4. Главные отличия данной технологии от технологии получения технического карбоната лития (фиг. 3) заключается в том, что поток реагентноочищенного от примесей кальция и магния вторичного литиевого концентрата подвергают глубокой ионообменной очистке на амфолите Lewatit 208-TP в Li-форме или его аналогах, а осаждение карбоната лития из глубоко очищенного от примесей вторичного литиевого концентрата ведут карбонатом аммония по реакции:
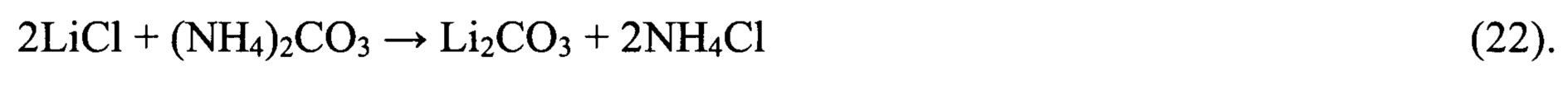
При этом маточный раствор операции осаждения, представляющий собой водный раствор NH4Cl с небольшой примесью NaCl и KCl после подкисления, упаривают, высаливая NH4Cl, до уровня содержания LiCl 485-490 кг/м3. Жидкую фазу после отделения кристаллов направляют на смешение с вторичным литиевым концентратом перед его ионообменной очисткой, а кристаллы NH4Cl с примесями приводят во взаимодействие с пульпой СаО или СаО с примесью MgO, производимых путем разложения осадка CaCO3 с примесью 3MgCO3⋅Mg(OH)2⋅3H2O или известняка и доломита по реакции:

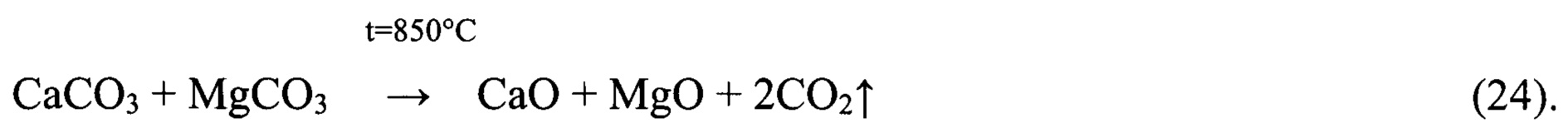
Взаимодействие NH4Cl с СаО в присутствии воды протекает с выделением тепла (Q) и сопровождается интенсивной отгонкой аммиака в соответствии с экзотермической реакцией:
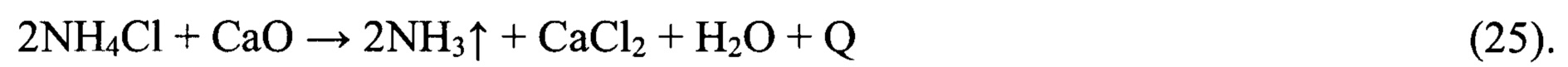
В свою очередь газовую смесь аммиака с углекислым газом, образующимся при получении СаО абсорбируют водой при охлаждении в противоточном режиме, получая концентрированный раствор (NH4)2CO3 по реакции:

Производимый таким образом раствор (NH4)2CO3 используют для осаждения Li2CO3 из глубоко очищенного от примесей вторичного литиевого концентрата (реакция 22).
Маточную суспензию, образующуюся на операции известкового разложения NH4Cl и отгонки NH3, центрифугируют, отделяя твердую фазу MgO с примесью SiO2 и Fe2O3 от жидкой фазы. Жидкая фаза, представляющая собой раствор CaCl2 250-270 кг/м3 с небольшой примесью NaCl и KCl 2-4 кг/м3 используют либо в коммунальном хозяйстве как противопылящее и антигололедное средство, либо в качестве реагента для снижения содержания сульфат-ионов в исходном природном рассоле, в случае если рассол характеризуется повышенным содержанием сульфат-ионов.
Поскольку содержание хлоридов натрия и калия в глубоко очищенном от кальция и магния вторичном литиевом концентрате находится в пределах 2-4 кг/м3, после отмывки осажденного карбоната лития от маточного раствора, суммарная концентрация натрия и калия в готовом продукте составляет менее 0,002% мас. Основной примесью в отмытом Li2CO3 является NH4Cl. Однако в процессе сушки влажного карбоната лития NH4Cl гидролизуется, образуя в конечном итоге летучие продукты NH3 и HCl в соответствии с уравнением химической реакции:


Таким образом, предлагаемый технологический процесс (фиг. 4) позволяет при наличии месторождения известняка или доломита производить из поликомпонентных литиеносных природных рассолов карбонат лития батарейного качества, снизив при этом себестоимость производства за счет замены дорогостоящей соды на более дешевые реагенты известняк или доломит.
В дальнейшем предлагаемое изобретение поясняется конкретными примерами.
Пример 1.
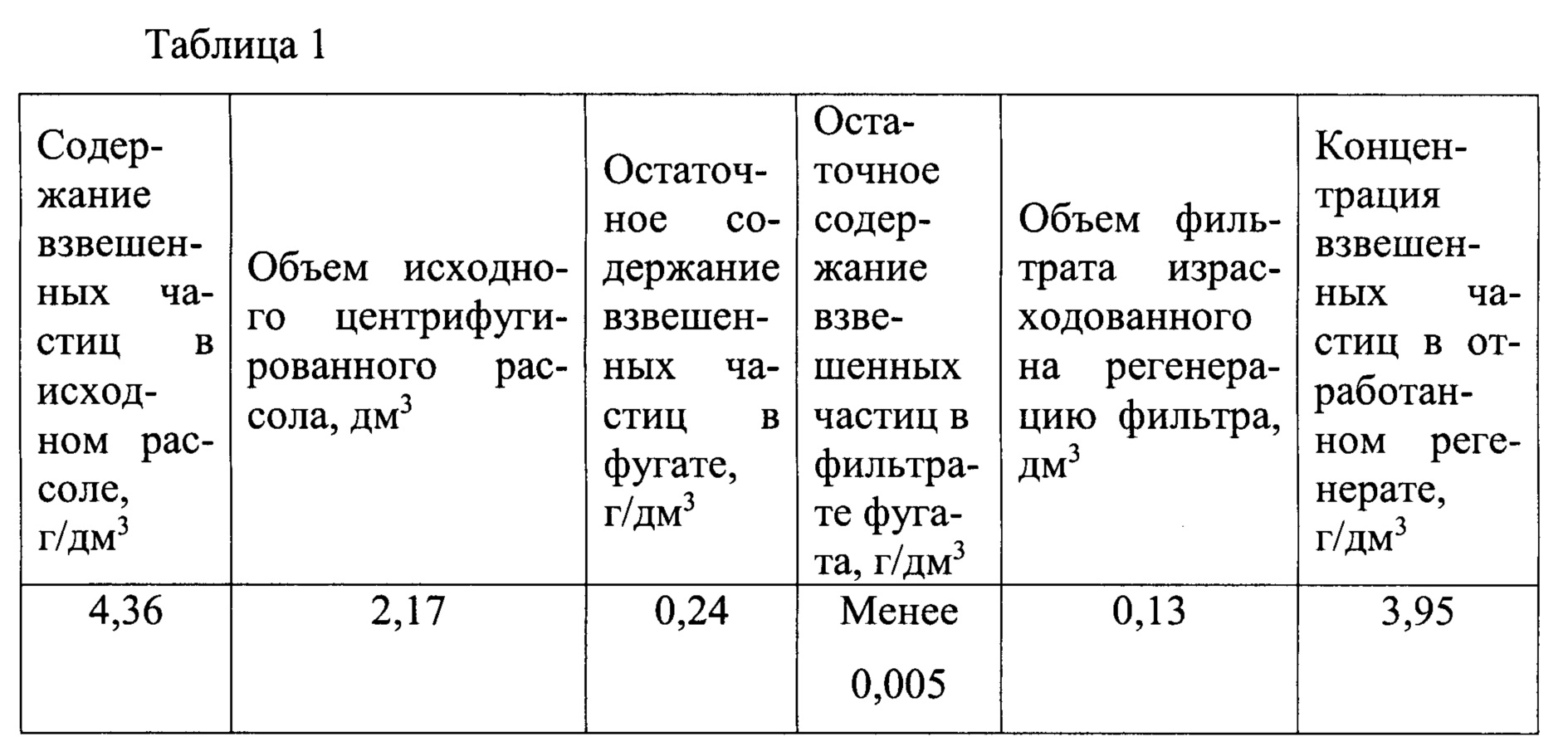
Природный дренажный литиеносный рассол плотностью 1215 г/дм3, рН=6,2, вещественный состав (г/дм3): LiCl - 1,16; NaCl - 53,5; KCl - 21,3; CaCl2 - 182,3; MgCl2 - 47,2; Br- - 4,0; Feобщ - 0,01; взвешенные частицы - 4,3; общее солесодержание 305,4 г/дм3 подвергали центрифугированию на осадительной лабораторной центрифуге, фугат отделяли от осадка твердой фазы. Фугат анализировали на остаточное содержание взвешенных частиц и фильтровали на тканевом фильтре тонкой очистки. Фильтрат анализировали на содержание взвешенных частиц. Уловленные на фильтре взвешенные частицы смывали противоточным потоком смеси фильтрата с воздухом (регенератом). Отработанный регенерат анализировали на содержание взвешенных частиц. Полученные результаты представлены в таблице 1.
Из содержимого таблицы следует, что комбинированная очистка природного рассола от взвешенных частиц (центрифугирование + фильтрация) обеспечивает степень очистки на уровне 99,9%. При этом на регенерацию фильтра требуется не более 5% объема отфильтрованного рассола, обеспечивая концентрацию взвешенных частиц в потоке отработанного регенерата близкую к содержанию взвешенных частиц в исходном рассоле.
Пример 2.
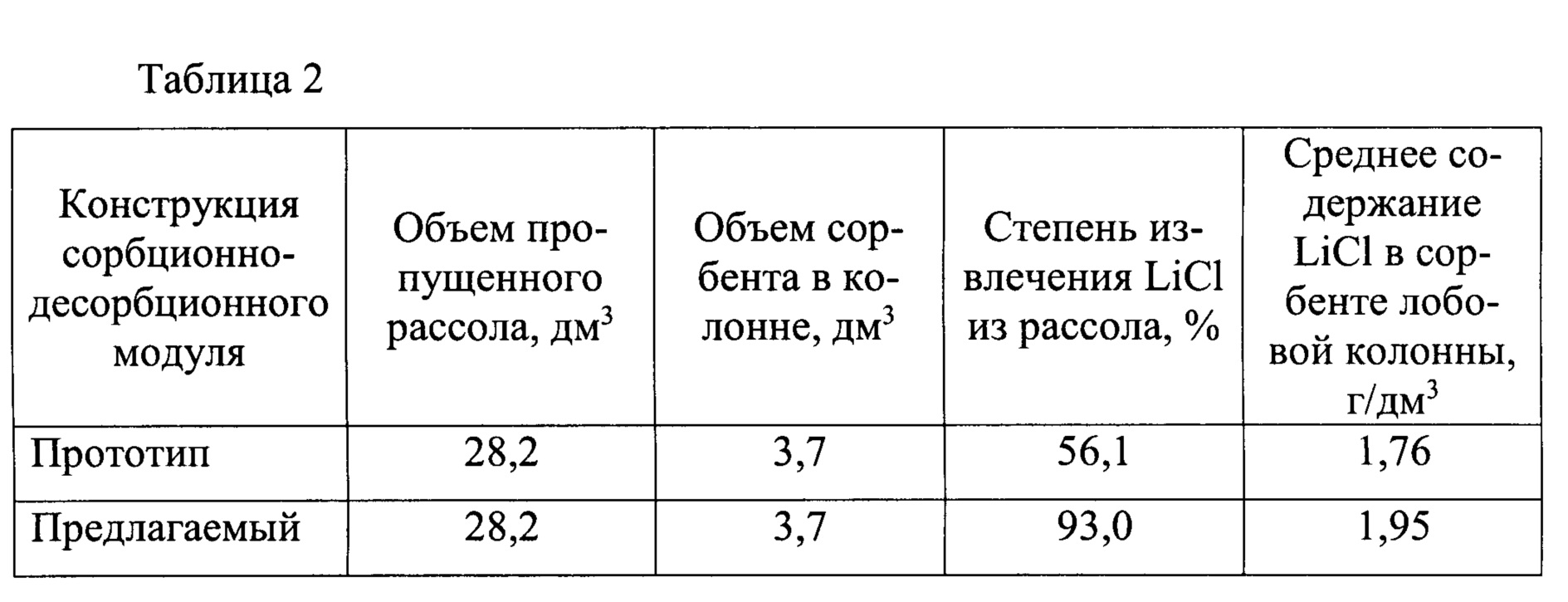
На лабораторном стенде, представляющем сорбционно-десорбционные модули из двух колонн (прототип) и четырех колонн (предлагаемый модуль, фиг. 4) проведены сравнительные испытания с использованием очищенного от взвешенных частиц и железа природного пластового литиеносного рассола Знаменского месторождения Иркутской области. Состав рассола (г/дм3): LiCl - 2,5; NaCl - 6,1; KCl - 8,2; CaCl2 - 330; MgCl2 - 115; Br - 10,1; общее солесодержание 472 г/дм3, показатель рН=4,2. Через каждый из модулей было пропущено по 28,2 дм3 исходного рассола: в прототипе через одну колонну с сорбентом прошедшем стадию регенерации, в предлагаемом модуле через две колонны последовательно (первая колонна по ходу потока рассола с частично насыщенным сорбентом, вторая колонна с сорбентом, прошедшим стадию регенерации). Результаты сравнительных испытаний представлены в таблице 2.
Из содержимого таблицы 2 однозначно следует, что степень извлечения в предлагаемом сорбционно-десорбционном модуле более чем в 1,6 выше, чем в модуле по прототипу. Кроме того, степень насыщения хлоридом лития сорбента в лобовой колонне (колонне переходящей в стадии удаления рассола и регенерации) в предлагаемом модуле на 10% выше, чем в прототипе.
Пример 3.
На пилотной установке, состоящей из двух одинаковых сорбционно-десорбционных колонн, подготовленных к стадии удаления рассола с загрузкой гранулированного сорбента ДГАЛ-Cl объемом 3,7 дм3 каждая проведены сравнительные испытания по следующей методике.
В колонну №1 подавали насосом вытесняющую жидкость (водный раствор LiCl концентрацией 6 г/дм3) объемом 10 дм3 в направлении движения потока вытесняющей жидкости через сечение колонны сверху вниз. В колонну №2 вытесняющую жидкость тем же объемом подавали в колонну аналогичным насосом, в направлении снизу вверх. Начальный расход вытесняющей жидкости через обе колонны устанавливали на уровне 0,2 дм3/мин. К концу эксперимента расход жидкости через колонну №1 снизился до 0,08 дм3/мин, в то время как расход через колонну №2 был неизменным на протяжении всего эксперимента. При этом 10 дм3 вытесняющей жидкости через колонну №1 было пропущено в течение 77 минут в то время как через колонну №2 такой же объем вытесняющей жидкости был пропущен в течение 50 минут. Полученные результаты однозначно показывают, что вытеснение рассола из слоя сорбента в направлении сверху вниз приводит к уплотнению зернистого слоя и существенному росту его сопротивления вытесняющему потоку, что в конечном итоге приводит к повышению давления в колонне при сохранении постоянства расхода промывной жидкости. Далее сравнительные испытания были продолжены в направлении установления влияния направления движения вытесняющей жидкости на глубину отмывки от рассола. С этой целью была проведена десорбция LiCl из сорбента, освобожденного от рассола в колоннах №1 и №2. В результате проведения десорбции были получены следующие первичные литиевые концентраты. Концентрат из колонны №1 (состав, г/дм3): LiCl - 5,3; остаточный рассол - 6,4. Концентрат из колонны №2 (состав, г/дм3): LiCl - 5,1; остаточный рассол - 6,2. Эксперимент показал, что глубина отмывки сорбента от рассола практически не зависит от направления движения вытесняющей жидкости через слой сорбента. Таким образом, по совокупности двух факторов вытеснение рассола в направлении снизу-вверх предпочтительнее.
Пример 4.
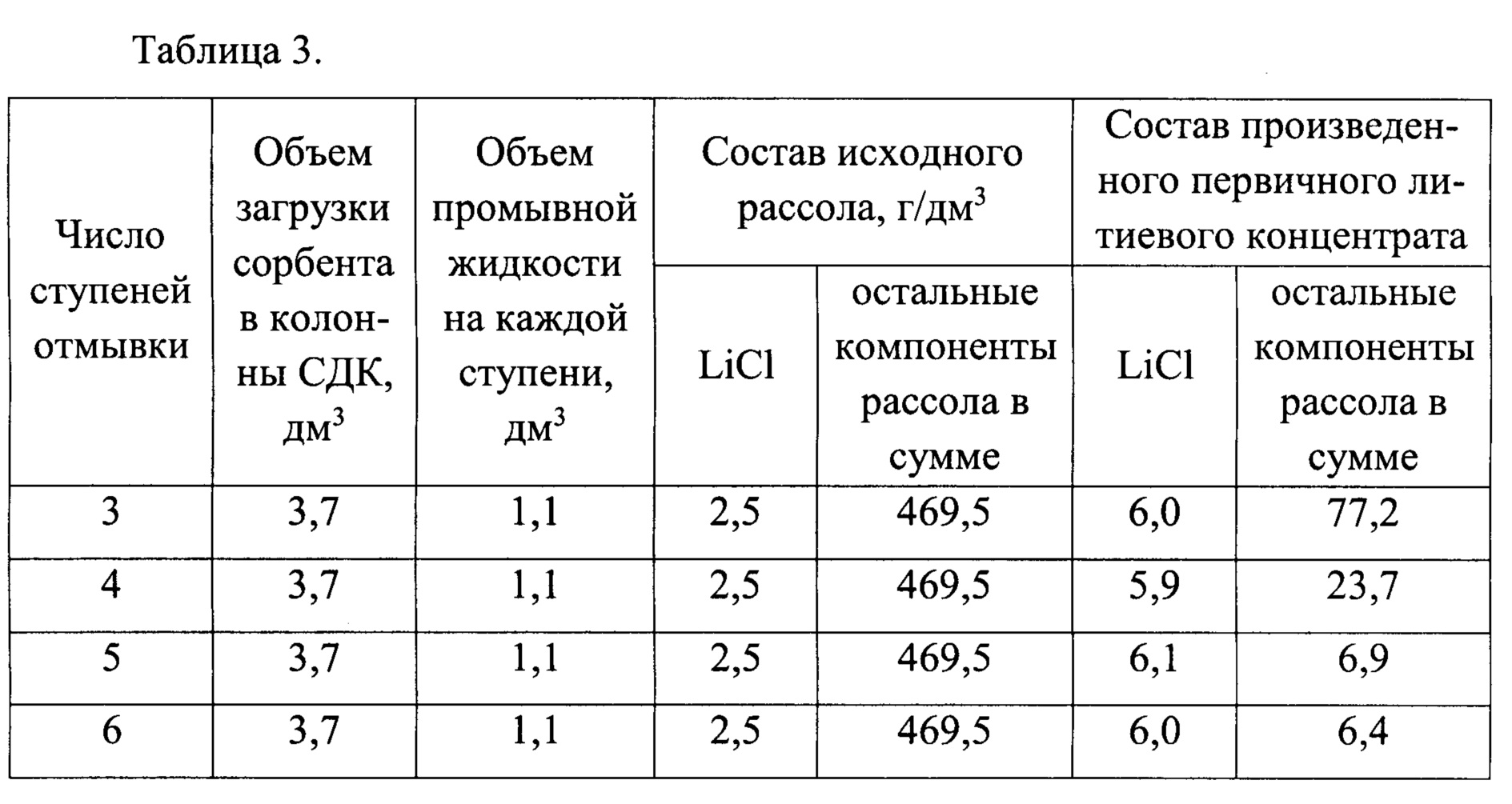
На пилотном стенде, включающем сорбционно-десорбционный модуль из четырех колонн, исследовали влияние числа ступеней отмывки сорбента от рассола в колонне, прошедшей стадию сорбции на остаточное содержание рассола в получаемом первичном литиевом концентрате. Исследование проводили в установившемся режиме, строго соблюдая последовательность технологических операций, представленных на фиг. 1. В качестве литиеносного рассола использовали природный рассол Знаменского месторождения Иркутской области (состав в примере 2). Объем загрузки гранулированного сорбента в колоннах сорбционно-десорбционного модуля составлял 3,7 дм3. Объем промывной жидкости на каждой из ступеней отмывки составлял 1,1 дм3. Полученные результаты представлены в таблице 3.
Исследования показали, что оптимальным количеством ступеней при ступенчато-противоточной отмывке сорбента от рассола является пять ступеней отмывки, так как дальнейшее увеличение числа промывок не приводит к существенному повышению чистоты получаемого первичного литиевого концентрата, в то время как эксплуатационные расходы, связанные с увеличением числа промывок увеличиваются существенно. В то же время сокращение числа ступеней промывок приводит к повышению содержания компонентов рассола в первичном литиевом концентрате более чем в три раза.
Пример 5.
На экспериментальном стенде было переработано 200 дм3 природного литиеносного рассола Знаменского месторождения Иркутской области (состав в примере 2). Переработку вели по технологическим схемам, представленным на фиг. 1 и фиг. 2, производя безводный хлорид лития. При этом использовали вариант обратноосмотического концентрирования первичного литиевого концентрата с очисткой от кальция и магния обратноосмотического литиевого концентрата путем термического разложения бикарбоната лития, производимого в составе обратноосмотического литиевого концентрата карбонизацией углекислым газом твердой фазы карбоната лития, предварительно введенного в состав обратноосмотического литиевого концентрата. Для получения карбоната лития, необходимого для очистки обратноосмотического литиевого концентрата, в данном эксперименте использовали раствор соды, концентрацией 300 г/дм3, полученный растворением в деминерализованной воде товарного Na2CO3. В результате было получено 464,8 г безводного хлорида лития, химический состав которого представлен в таблице 4.
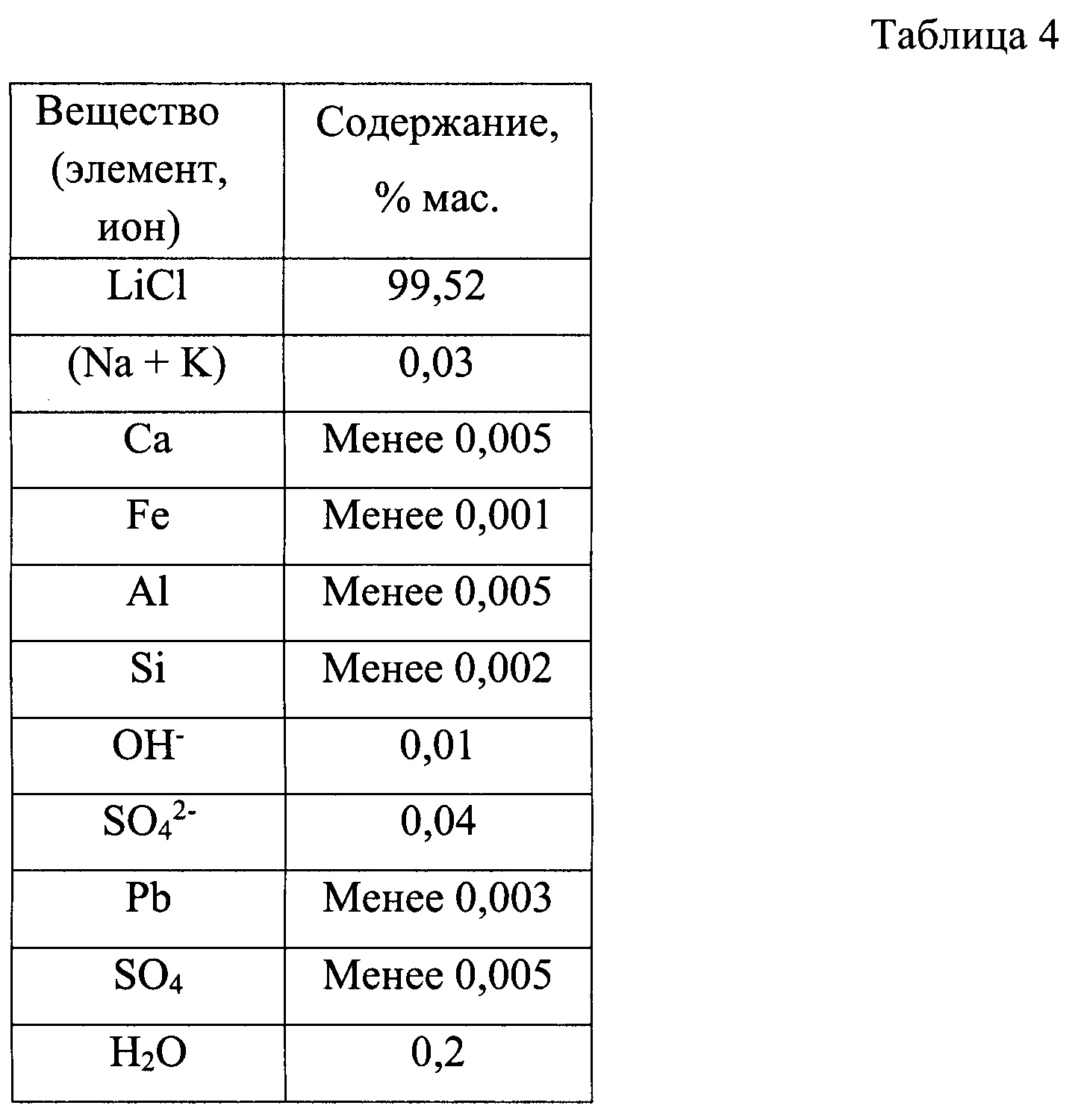
Кроме того, в процессе получения LiCl из первичного литиевого концентрата было произведено в качестве побочных продуктов: NaCl - 644,9 г (641,1 г из маточного раствора операции осаждения карбоната лития, 3,8 г из глубоко очищенного от кальция и магния вторичного литиевого концентрата); KCl - 10,6 г, содержащих LiCl в качестве примеси в количестве 0,02% мас., то есть 0,13 г.
Пример 6.
Кристаллы NaCl+KCl с примесью LiCl растворяли в деминерализованной воде, доводя общее солесодержание в растворе до 262 г/дм3 (объем раствора 11 дм3). Раствор подвергали мембранному электролизу на лабораторной электролизной установке (мембрана CTIEM-1, плотность тока 2 кА/м2) в циркуляционно-отборном режиме движения католита и циркуляционно-подпиточном режиме движения анолита (хлоридный раствор щелочных металлов). В результате переработки было получено 2,73 дм3 щелочного раствора содержащего (г/дм3): NaOH - 160,57; KOH - 2,92; LiOH - 0,03. Раствор приводили в контакт с отходящими топочными газами газовой горелки, в которой сжигалась пропан-бутановая смесь. Карбонизацию прекращали по переходу щелочного показателя карбонизируемого раствора в показатель pH=10. После карбонизации объем раствора уменьшился до 1,98 дм3. Содержание карбонатов щелочных металлов было следующее (г/дм3): Na2CO3 - 293,23; K2CO3 - 4,93; Li2CO3 - 0,05. Полученный раствор, имеющий температуру 75,4°C, приводили в контакт с раствором LiCl концентрацией 196 г/дм3 и объемом 2,41 дм3. Выход Li2CO3 в твердую фазу составил 365,3 г при содержании Li2CO3 в маточном растворе 11,2 г/дм3. Из полученных результатов однозначно следует, что хлоридные кристаллы, выделенные из маточного хлоридного раствора, образующегося после осаждения Li2CO3 из вторичного литиевого концентрата, могут быть переработаны в карбонатный раствор Na2CO3, содержащий K2CO3 и Li2CO3, который также является эффективным осадителем Li2CO3 из раствора LiCl.
Пример 7.
На экспериментальном стенде было переработано 700 дм3 природного литиеносного рассола хлоридного магниевого типа провинции Цинхай (г. Гэрму, Китай) состава, г/дм3: LiCl - 2,75; NaCl - 23,1; KCl - 19,1; MgCl2 - 349,2; B4O7 - 1,2; SO4 - 2,3; Fe - 0,003; плотность - 1280 г/дм3, показатель pH - 6; общее солесодержание 401 г/дм3 строго по технологической схеме, представленной на фиг. 3.
Рассол перерабатывали порциями по 50 дм3 каждая. Средняя степень извлечения лития из рассола составила 90%. Было получено 14 образцов карбоната лития в суммарном количестве 1507, 9 г. Химический анализ образцов показал стабильность состава получаемого продукта. Результаты анализа представлены в таблице 6.
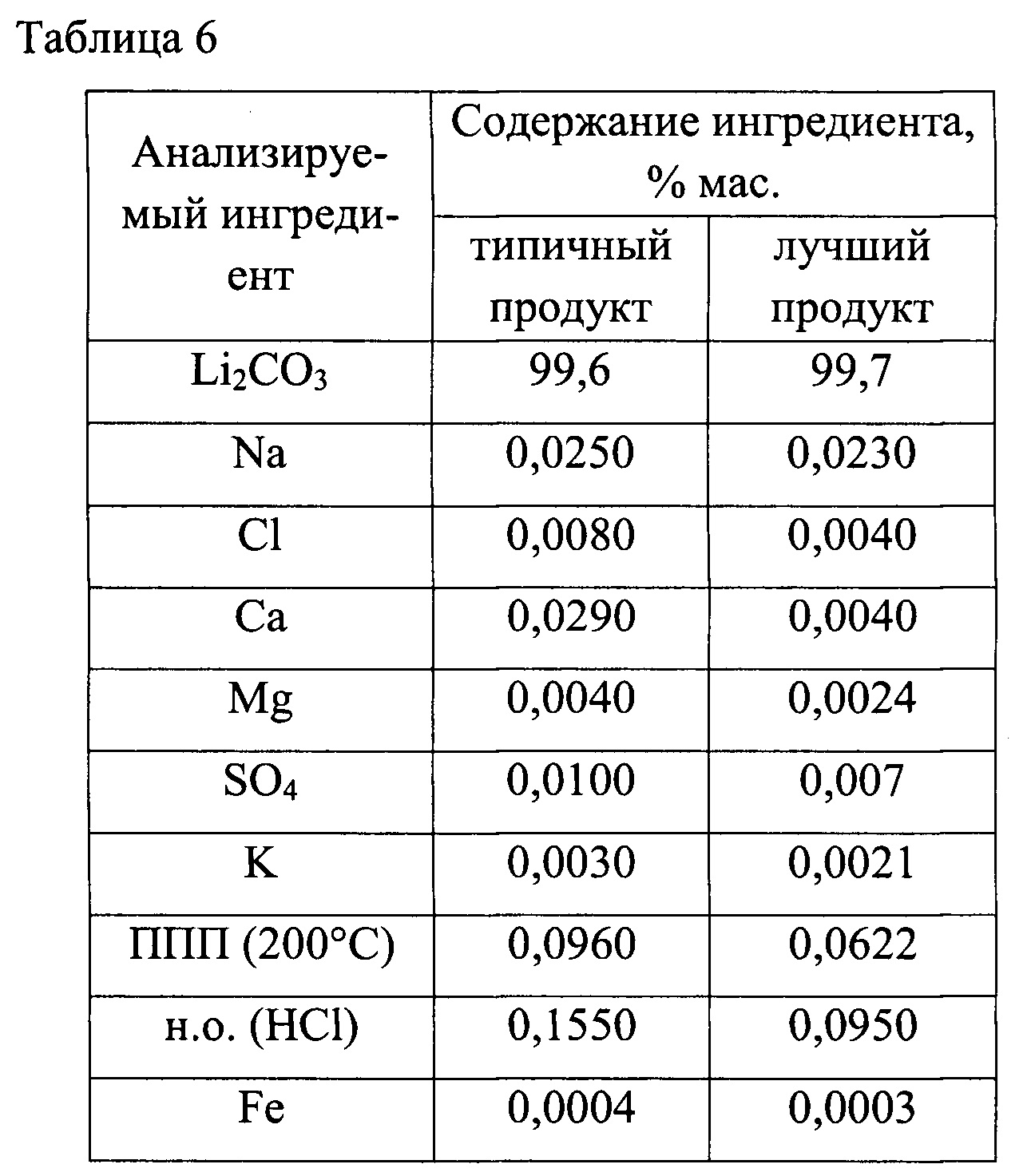
Из полученных результатов следует, что чистота получаемого из природного литиеносного рассола карбоната лития по предлагаемой технологии (схема на фиг. 3) существенно выше 99%, а производимый продукт соответствует требованиям мирового рынка на Li2CO3 квалификации «технический».
Пример 8.
На экспериментальном стенде было переработано 600 дм3 природного литиеносного рассола Знаменского месторождения Иркутской области (состав в примере 2) по технологической схеме, представленной на фиг. 4. Рассол перерабатывали порциями по 50 дм3 каждая. Средний показатель степени извлечения LiCl из рассола составил 93%. Для разложения соли NH4Cl использовали гашеную известь производства ПАО «Красноярский химико-металлургический завод». Для получения абсорбируемой смеси NH3:Cl2=2:1 использовали баллонный углекислый газ. Средний показатель степени возврата аммонийной соли составил 99,2%. Разложение известняка не проводили ввиду того, что практическая реализация данного процесса очевидна. Было получено 12 образцов карбоната лития. Из каждого образца брали четвертую часть массы и тщательно перемешивали. Из полученной смеси отбирали представительные пробы и анализировали на содержание основного вещества и примесей, содержание которых ограничивают требования на карбонат лития батарейного качества. Полученные результаты представлены в таблице 7.
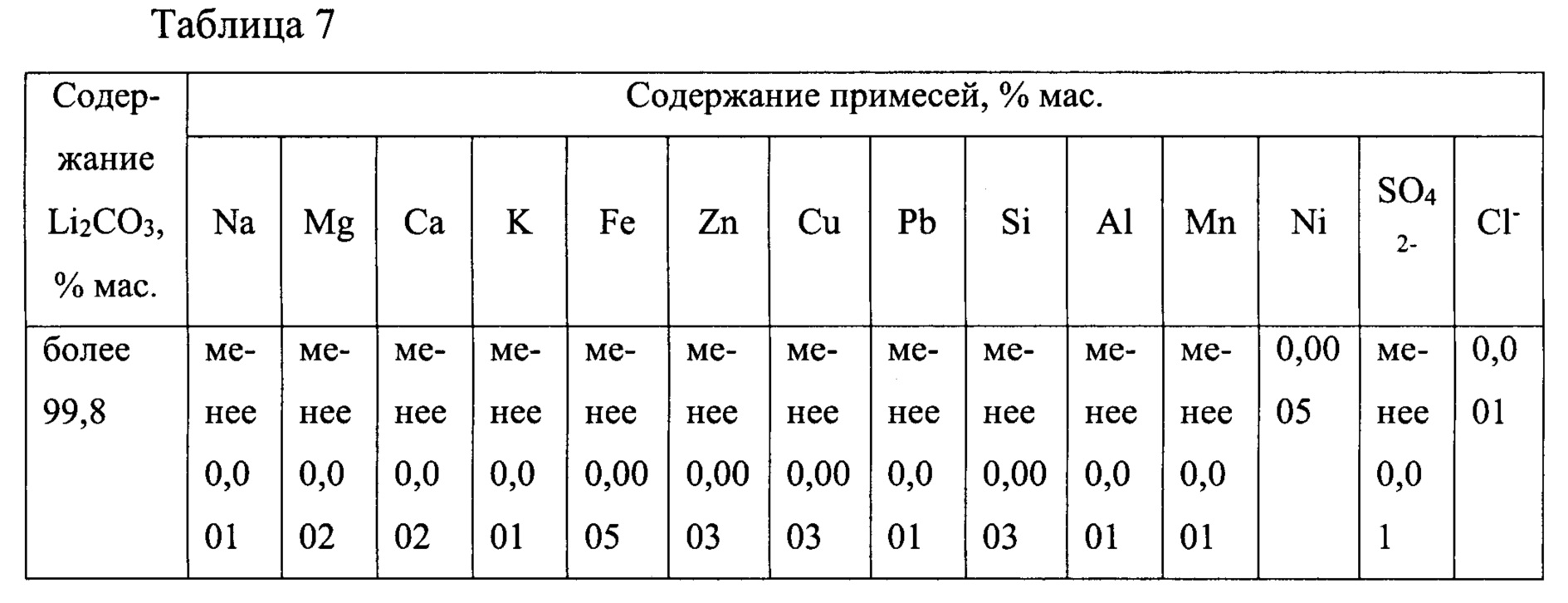
Из содержимого таблицы следует, что чистота получаемого из природного литиеносного рассола карбоната лития по предлагаемой технологии (схема на фиг. 4) выше 99,8%, а производимый продукт соответствует требованиям мирового рынка на Li2CO3 батарейного качества.
Используемые источники информации
1. Ю.И. Остроушко, Т.В. Дегтярева Гидроминеральное сырье - неисчерпаемый источник лития. Аналитический обзор. Москва. Изд. ЦНИИАТОМИНФОРМ, 1999, 64 с.
2. Pat. 4243392 US Process for solar concentration of lithium hloride brines / P.M. Brown, et. al. Заявл. 23.07.81.
3. Pat. 4274834 US Process for purification of lithium chloride / P.M. Brown, et. al. Заявл. 23.07.84.
4. Пат. 4271131 US Получение высокочистого хлорида лития / P.M. Brown et. Al. Заявл. 02.06.81.
5. Pat. 5219550 US Production of low boron lithium carbonate from lithium containing brine / P.M. Brown, D.A. Boryta. Опубл. 1993.
6. Pat. 6207126 US Получение соединений лития из рассола / D.A. Boryta, T.F. Kullberg, A.M. Nhurston. Заявл. 2001.
7. Pat. 4159311 US Recovery of lithium from brines / J.M. Lee, W.C Bauman. Заявл. 26.06.79.
8. Pat. 4221767 US Recovery of lithium from brines / J.M. Lee, W.C. Bauman. Заявл. 09.09.80.
9. Pat. 4347327 US Recovery of lithium from brines / J.M. Lee, W.C. Bauman. Заявл. 19.11.79. Опубл. 31.08.82.
10. Pat. 4477367 US Recovery of lithium from brines / J.L. Burba. Oct. 1984.
11. Pat. 5389349 US Recovery of lithium values from brines / W.C. Bauman, J.L. Burba. Заявл. 24.05.90. Опубл. 14.02.95.
12. Pat. 5599516 US Recovery of lithium values from brines / W.C. Bauman, J.L. Burba. Заявл. 13.02.95. Опубл. 04.02.97.
13. Н.П. Коцупало, А.Д. Рябцев Химия и технология получения соединений лития из литиеносного гидроминерального сырья. Изд. Гео, г. Новосибирск, 2008, 291 с.
14. РСТ/ДЕ 01/04062 Способ получения гранулированного сорбента для извлечения лития из рассолов и установка для его осуществления / А.Д. Рябцев, Н.П. Коцупало, Л.Т. Менжерес и др. Заявл. 25.10.01.
15. Пат. 2223142 РФ Способ получения сорбента для извлечения лития из рассола / Л.Т. Менжерес, А.Д. Рябцев, Е.В. Мамылова и др. Опубл. 10.02.2004. Бюл. №23.
16. Пат. 2455063 РФ Способ получения гранулированного сорбента для извлечения лития из рассола / А.Д. Рябцев, В.И. Титаренко, Н.П. Коцупало и др. Решение о выдаче патента от 27.02.12.
17. РСТ/ДЕ 01/04061 Способ получения хлорида лития из растворов и установка для его осуществления / А.Д. Рябцев, Л.Т. Менжерес, В.И. Титаренко и др. Заявл. 25.10.01.
18. Пат. №2516538 RU Способ получения литиевого концентрата из литиеносных природных рассолов и его переработки (прототип).