Результат интеллектуальной деятельности: Способ получения гетерогенного биокатализатора на основе липазы дрожжей Candida antarctica фракции В
Вид РИД
Изобретение
Изобретение относится к получению гетерогенных биокатализаторов (БК) для процессов биокаталитической трансформации органических соединений, в том числе протекающих в неводных средах, а именно биокатализатора на основе липазы Candida antarctica фракции В (CALB).
Липаза дрожжей Candida antarctica фракции В является ферментом, имеющим большое прикладное значение. Высокая стерео- и позиционная селективность CALB позволяет использовать ее для направленных трансформаций органических соединений, являющихся полупродуктами синтеза лекарственных препаратов, где особо важна чистота получаемых веществ. Способность данного фермента работать в гетерогенных системах (на границе раздела фаз) и в фазе органических растворителей делает его незаменимым при трансформации и получении соединений, обладающих высокой растворимостью в неводных системах.
Обязательным условием практического применения CALB в технологических процессах является иммобилизация фермента с целью создания гетерогенного биокатализатора, пригодного для многократного использования и обладающего высокой эффективностью в целевых процессах и хорошей операционной стабильностью. При этом источником фермента должен служить высокопродуктивный рекомбинантный штамм.
Известно использование для иммобилизации CALB носителей, обладающих высокой гидрофобностью за счет гидрофобной природы матрицы [1-6], либо за счет гидрофобизации поверхности гидрофильного или слабо гидрофобного носителя [7-10]. Гидрофобная адсорбция CALB на таких носителях из водных растворов, содержащих фермент, является широко используемым способом иммобилизации CALB. К достоинствам способа следует отнести его простоту и, как правило, высокую стабильность получаемых биокатализаторов в органических растворителях. Коммерческий биокатализатор Novozym 435®, представляющий собой рекомбинантную CALB, гидрофобно адсорбированную на полиметакрилатном носителе Lewatit® VP ОС 1600, сохраняет 60% активности после инкубации в толуоле при 95°C в течение 24 часов. CALB, иммобилизованная путем адсорбции на полиметакритном носителе, поверхность которого гидрофобизована прививкой октадецильных групп, полностью сохраняет активность после инкубации в 50% водном растворе диоксана при комнатной температуре в течение 200 часов [8].
Синтетазная (по синтезу пропиллаурата) активность биокатализатора Novozym 435® составляет 10000 ПЛЕ/г сух. БК [6]. Более высокая синтетазная активность достигнута путем адсорбционной иммобилизации CALB на носителе Lifetech™ ECR 1030М, представляющем собой сополимер дивинилбензола с метакрилатом - 12000 ПЛЕ/г сух. БК [3]. Другие известные способы иммобилизации CALB путем адсорбции на гидрофобных носителях обеспечивают получение биокатализаторов с худшим уровнем активности: на макропористом полистирольном носителе - 3450 ПЛЕ/г сух. БК [4]; на макропористом полипропиленовом носителе Accurel® ЕР 100 - 4900 ПЛЕ/г сух. БК [1] или 6200 ПЛЕ/г сух. БК [2].
Главным недостатком биокатализаторов, получаемых адсорбционной иммобилизацией CALB является обратимость связывания целевого фермента и других белков, приводящая в определенных условиях к падению активности БК и загрязнению продуктов биокаталитической трансформации, что ограничивает возможности применения адсорбционно-иммобилизованной CALB. Такие БК абсолютно непригодны для использования в присутствии поверхностно-активных веществ и в водных средах с высокой ионной силой. В определенных условиях наблюдается также смывание CALB с носителя и загрязнение реакционной смеси органическими соединениями в ионных жидкостях и органических растворителях, являющихся средой для биокаталитических трансформаций, катализируемых данных ферментом [7, 11, 12]. Проблема достижения необратимой фиксации, адсорбционно-иммобилизованной CALB, может быть решена путем ковалентной сшивки адсорбированного фермента с помощью бифункционального реагента.
Известен способ получения биокатализатора, обладающего активностью в денатурирующих ионных жидкостях, путем адсорбции CALB на макропористом полипропиленовом носителе Accurel ЕР100, дополнительного осаждения фермента в виде агрегатов 2-пропанолом и последующей ковалентной сшивки агрегированной CALB глутаровым альдегидом (ГА) в водно-органической среде с содержанием 2-пропанола 75% (об/об) [13].
Известен также способ получения биокатализатора для процессов кинетического разделения рацематов 1-фенилэтанола или 1-фенилэтаноламина при их энантиоселективном ацилировании трет-бутанолом [7]. Для адсорбции CALB используют гидрофильный мезопористый силикагель, поверхность которого модифицируют путем прививки фенильных и аминоалкильных групп под действием соответствующих производных силана. Исходя их водного раствора CALB, фермент осаждают ацетоном в виде ферментных агрегатов с одновременной адсорбцией на гидрофобизованной поверхности носителя и ковалентной сшивкой белковых молекул друг с другом и с носителем через первичные аминогруппы в водно-органической среде с содержанием ацетона 75% (об/об). Уровень активности получаемого таким образом БК в форме адсорбционно-ковалентно иммобилизованной CALB, измеренный в отношении энантиоселективной этерефикации 1-фенилэтанола трет-бутиловым эфиром, составляет 50-70% от активности CALB, гидрофобно-адсорбированной на соответствующем носителе. При этом адсорбционно-ковалентно иммобилизованная CALB сохраняет 80% своей исходной активности после инкубации в 2% растворе детергента Тритон Х-100, в то время как гидрофобно-адсорбированная CALB практически полностью инактивируется. К недостаткам данного способа получения БК в форме адсорбционно-ковалентно иммобилизованной CALB [7] следует отнести его сложность, а также значительные потери активности при процедуре ковалентной сшивки фермента, возможно, за счет ее осуществления в водно-органической среде и/или из-за диффузионных ограничений для доступа субстратов к крупным ферментным агрегатам, адсорбированным в порах носителя.
Наиболее близким к заявляемому способу получения гетерогенного биокатализатора является способ иммобилизации CALB путем адсорбции на гидрофобном носителе - сополимере дивинилбензола и метакрилата, выпускаемом компанией Purolite® Life Sciences под маркой Lifetech™ ECR 1030М [3]. Согласно ближайшему аналогу процедура иммобилизации состоит в следующем.
Для иммобилизации используют CALB в виде водного раствора (коммерческий препарат Lipozyme® CALB L, компания Novozymes) с удельной гидролазной (липазной) активностью (по гидролизу трибутирина)1 (1 За международную единицу ферментативной (гидролазной, липазной) активности образца CALB в реакции гидролиза трибутирина (1 ЛЕ) принимают такое количество препарата, которое катализирует образование 1 мкмоля масляной кислоты в минуту в стандартных условиях, а именно в 0,1 М водной эмульсии трибутирина при рН 7,0 и температуре (30±1)°C.) 330 ЛЕ/мг белка. Перед использованием в растворе CALB устанавливают рН 7,5 и инкубируют раствор с носителем при перемешивании в течение ночи. Затем внешний раствор отделяют вакуумной фильтрацией, носитель с адсорбированной CALB однократно промывают 0,02 М фосфатно-натриевым буфером, рН 7,5, и высушивают в токе азота.
Получаемые образцы биокатализатора характеризуют по синтетазной активности в отношении синтеза пропиллаурата2 (2 За международную единицу ферментативной (синтетазной) активности образца CALB в реакции синтеза пропиллаурата (1 ПЛЕ) принимают такое количество препарата, которое катализирует образование 1 мкмоля продукта в минуту в стандартных условиях, а именно в расплаве, содержащем 40 ммолей лауриловой кислоты и 40 ммолей н-пропилового спирта, при температуре (60±1)°C.).
Лучший результат по активности получаемого таким образом БК достигнут при использовании нагрузки по белку - Qprot=160 мг белка/г сух. носителя. Полученный в этих условиях биокатализатор в форме гидрофобно-адсорбированной CALB обладает синтетазной активностью АБК=12000 ПЛЕ/г сух. БК.
При снижении нагрузки на носитель вдвое (Qprot=80 мг белка/г сух. носителя) получен БК с синтетазной активностью АБК=10250 ПЛЕ/г сух. БК.
Основными недостатками способа ближайшего аналога являются:
- отсутствие необратимого связывания CALB, которое в определенных условиях может повлечь за собой падение активности БК и загрязнение продуктов биокаталитической трансформации, а также
- недостаточно высокая ферментативная активность.
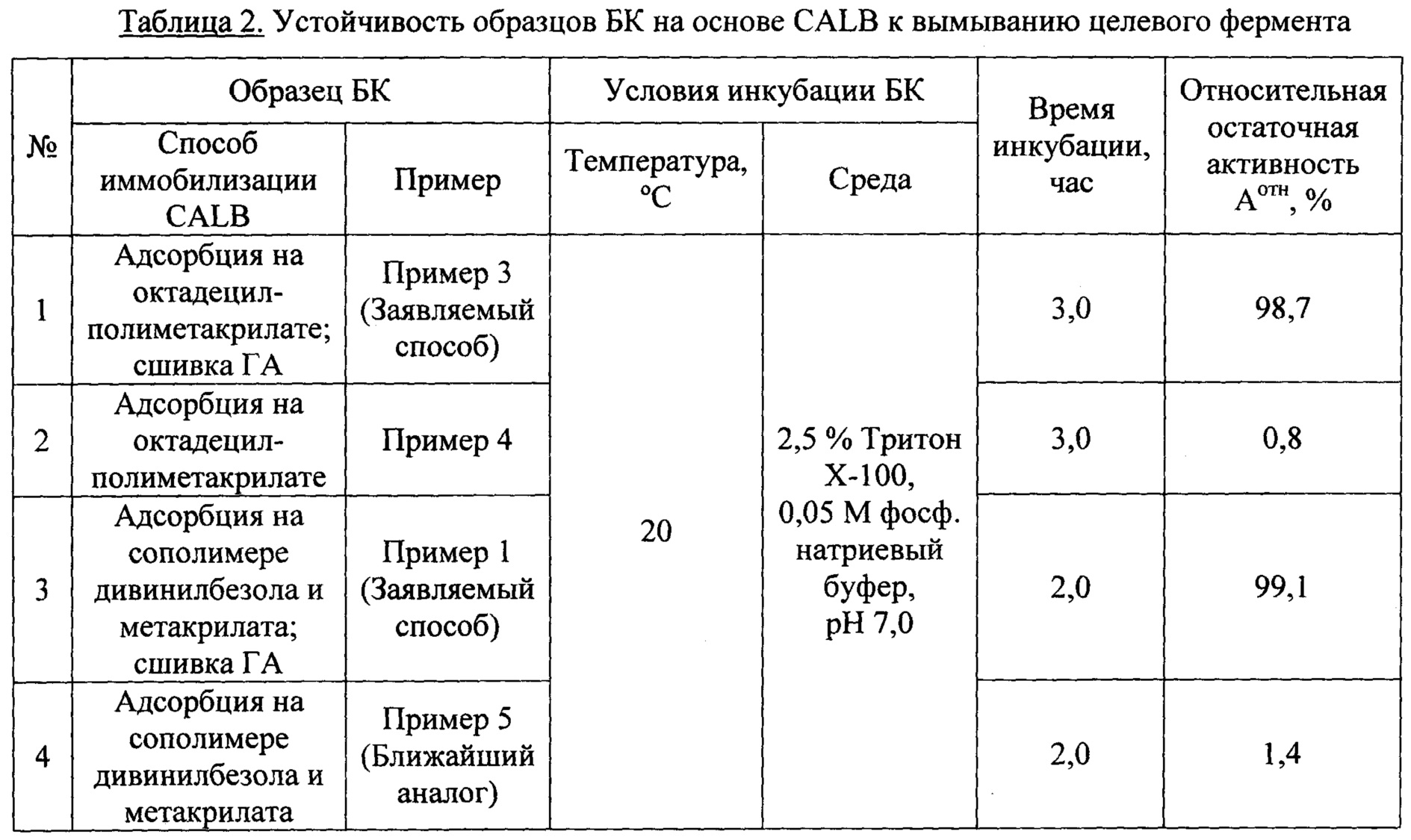
Воспроизведение способа иммобилизации CALB согласно ближайшему аналогу с использованием концентрата культуральной жидкости, продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298, обладающего удельной гидролазной (липазной) активностью 350 ЛЕ/мг белка (Пример 5), позволило получить биокатализатор с активностью по синтезу пропиллаурата АБК=11100 ПЛЕ/г сухого БК. Инкубация этого БК в растворе детергента приводит к практически полной потере синтетазной активности (Пример 7, №4 в Таблице 2), что свидетельствует об обратимости связывания CALB с дивинил-бензол-метакрилатным полимерным носителем Lifetech™ ECR 1030М при использовании способа иммобилизации CALB согласно ближайшему аналогу.
Задача заявляемого изобретения - создание способа получения биокатализатора, обладающего высокой активностью и высокой термической стабильностью в среде органических растворителей, а также характеризующегося необратимым связыванием CALB в биокатализаторе.
Поставленную задачу решают путем совокупного использования в процессе получения биокатализатора приемов адсорбционной и ковалентной иммобилизации CALB, а именно путем избирательной адсорбции CALB на гидрофобном макропористом носителе, осуществляемой при инкубации частиц носителя в водном концентрате культуральной жидкости штамма дрожжей Pichia pastoris ВКПМ Y-4298 с удельной ферментативной активностью не менее 350 ЛЕ/мг белка, и последующей ковалентной сшивке (модификации) адсорбированного фермента глутаровым альдегидом (ГА), добавляемым непосредственно в инкубационную суспензию до конечной концентрации его 1,0-2,5%, осуществляя модификацию в течение 30-120 мин.
Согласно заявляемому способу исходным материалом для процедуры адсорбционно-ковалентной иммобилизации CALB служит водный концентрат культуральной жидкости (КЖ), продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298, несущим ген липазы из Candida antarctica фракции В, который может быть получен, например, методом мембранной фильтрации культуральной жидкости. В качестве носителей для иммобилизации CALB используют полимерные материалы, обладающие развитой (за счет макропористой структуры) гидрофобной поверхностью. При этом гидрофобность поверхности носителя обеспечена или за счет гидрофобной природы полимерной матрицы (например, макропористый полистирол или сополимеры дивинилбензола и метакрилата), или за счет модификации поверхности полимера привитыми гидрофобными остатками (например, октадецил-полиметакрилат).
В качестве сшивающего агента для ковалентной фиксации гидрофобно-адсорбированной CALB используют бифункциональный реагент глутаровый альдегид, способный взаимодействовать с аминогруппами на поверхности белка, в первую очередь с первичными аминогруппами лизина, с образованием внутри- и межмолекулярных сшивок [14]. Модификация аминогрупп лизина не оказывает негативного действия на активность получаемого биокатализатора, так как большая часть доступных остатков лизина локализована в гидрофильных зонах поверхности белковой глобулы CALB вдали от активного центра фермента [15, 16], что позволяет вовлекать их в процессы модификации и ковалентной сшивки без существенных потерь ферментативной активности в том случае, если процесс протекает в мягких условиях.
Применение для иммобилизации CALB гидрофобных носителей обеспечивает избирательность адсорбции целевого белка, обладающего, как все липазы, природным сродством к гидрофобным поверхностям [17]: в растворе после адсорбции фермента, согласно заявляемому способу, отсутствует активность CALB, при этом остаточное содержание в нем белка составляет 15-20% от концентрации в исходном концентрате КЖ. Кроме того, молекула CALB, связанная силами гидрофобного взаимодействия, принимает открытую конформацию, открывающую доступ субстратов к активному центру фермента [18, 19]. Фиксация активной формы белка ковалентными связями за счет сшивки адсорбированной CALB глутаровым альдегидом обеспечивает необратимое связывание фермента в биокатализаторе, высокую активность и стабильность получаемого БК.
Способ в общем виде
Адсорбцию CALB на гидрофобном носителе осуществляют путем инкубации аликвоты носителя в концентрате культуральной жидкости, продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298, несущим ген липазы из Candida antarctica фракции В. Процедуру проводят при рН 6,0÷8,0; температуре (20÷30)°C и умеренной скорости перемешивания, обеспечивающей отсутствие пенообразования. Соотношение между массой носителя и объемом КЖ задают, исходя из нагрузки по белку на носитель Qprot=150÷250 мг белка/г сух. носителя. Время инкубации при адсорбции CALB на носителе τинк=6÷24 часа.
Сшивку (модификацию) адсорбированной CALB глутаровым альдегидом осуществляют в водной среде, а именно непосредственно в реакционной смеси, полученной в результате процедуры адсорбции, без отделения носителя, несущего адсорбированный фермент, от внешнего раствора. В реакционную смесь через 6-24 часа добавляют водный раствор глутарового альдегида в объеме, необходимом для создания концентрации сшивающего агента СГА=1,0÷2,5%, и продолжают инкубацию реакционной смеси в тех же условиях, в которых осуществлялась адсорбция CALB на носителе. Время сшивки (модификации) адсорбированной CALB глутаровым альдегидом τмод=30÷120 мин.
Биокатализатор в форме адсорбционно-ковалентно иммобилизованной CALB отделяют от внешнего раствора вакуумной фильтрацией и отмывают водой от не связанных с носителем веществ. Полученный влажный биокатализатор обезвоживают ацетоном и удаляют летучие вещества под вакуумом.
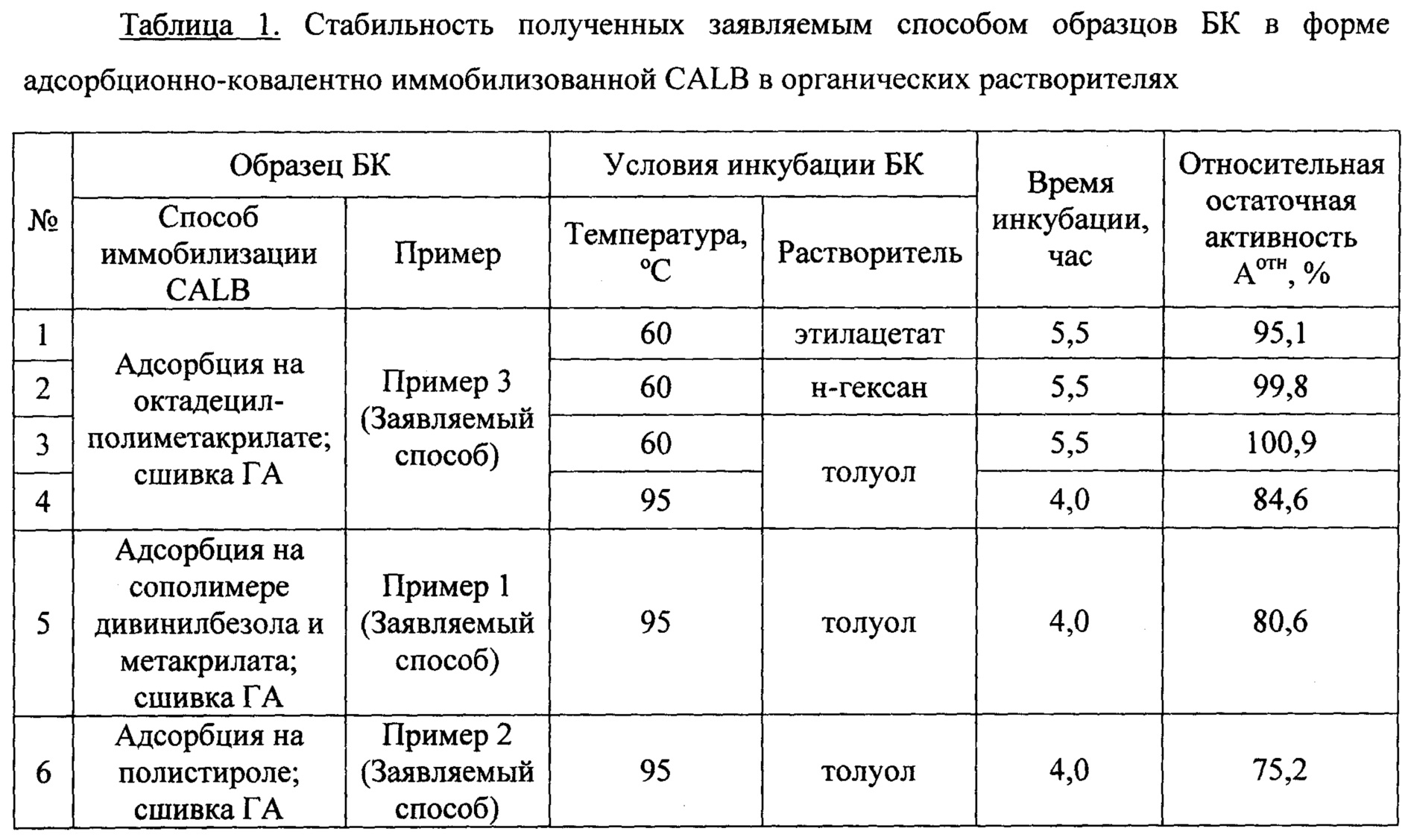
Биокатализатор на основе CALB, полученный согласно заявляемому способу, обладает синтетазной активностью (в отношении синтеза пропиллаурата) 18000÷25000 ПЛЕ/г сух. БК, что превосходит активность БК, полученного согласно ближайшему аналогу, в 1,5-2,5 раза (10250÷12000 ПЛЕ/г сух. БК). При этом он толерантен к воздействию органических растворителей при высоких температурах (см. таблицу 1 в Примере 6).
Кроме того, фермент в биокатализаторе, получаемом согласно заявляемому способу, связан необратимо, что продемонстрировано в Примере 7, где показано, что БК в форме адсорбционно-ковалентно иммобилизованной CALB, полностью сохраняет синтетазную активность после инкубации в растворе детергента, в то время как БК, полученный при воспроизведении способа согласно ближайшему аналогу (Пример 5), практически полностью ее теряет (см. таблицу 2 в Примере 7).
Сопоставление активности биокатализаторов в форме гидрофобно-адсорбированной CALB (Пример 4) и полученного способом адсорбционно-ковалентной иммобилизации (Пример 3) позволяет заключить, что процедура сшивки глутаровым альдегидом согласно заявляемому способу осуществляется без потери активности БК. Сохранение активности является следствием мягких условий проведения процесса (водная среда, комнатная температура), а также того, что предварительно адсорбированный фермент равномерно распределен по развитой поверхности носителя (в отличие от одновременной адсорбции и сшивки ферментных агрегатов CALB в водно-органической среде, согласно способу, описанному в [7], когда возможны диффузионные ограничения для доступа субстратов к крупным ферментным агрегатам, адсорбированным в порах носителя).
Изобретение проиллюстрировано следующими примерами осуществления способа.
Исходные образцы ферментного препарата CALB в форме жидкого концентрата культуральной жидкости характеризуют по гидролазной (липазной активности) в отношении гидролиза трибутирина (1,2,3-масляного эфира глицерина), эмульгированного в водной среде, в стандартных условиях, а именно 0,01 М фосфатно-натриевый буфер, рН 7,0; 0,1 М трибутирина, (30±1)°C. Процесс гидролиза осуществляют в водной эмульсии трибутирина, фиксируя количество образующейся масляной кислоты титриметрическим методом при постоянном рН с использованием в качестве титранта 0,1 М раствора гидроокиси натрия.
Получаемые гетерогенные биокатализаторы характеризуют по синтетазной активности в отношении синтеза пропилового эфира лауриловой кислоты (пропиллаурата, ПЛ) путем этерификации лауриловой кислоты (ЛК) 1-пропанолом (н-пропиловым спиртом, ПС) в стандартных условиях, а именно в расплаве, содержащем 40 ммолей лауриловой кислоты и 40 ммолей н-пропилового спирта, при температуре (60±1)°C. Активность определяют по начальной скорости реакции синтеза при глубине трансформации ЛК в ПС не более 15%. Количество образовавшегося продукта ПЛ и остаточное содержание ЛК в реакционной смеси определяют методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Содержания сухих веществ в образцах носителя и гетерогенного биокатализатора определяли весовым методом после высушивания образцов до постоянной массы при температуре (105±1)°C.
Определение содержания белка в ферментных препаратах проводят спектрофотометрическим методом по реакции с реактивом Бредфорд по стандартной методике (Инструкции фирмы "SIGMA" - производителя реактива Bradford) с использованием калибровочной кривой, построенной по отношению к стандартному белку - бычьему сывороточному альбумину.
Стабильность биокатализатора в органических растворителях при заданной температуре характеризуют по относительной остаточной активности образца БК после его инкубации в соответствующих условиях.
Устойчивость биокатализатора к вымыванию целевого фермента характеризуют по относительной остаточной активности образца БК после его инкубации в растворе детергента Тритон Х-100.
Пример 1. Осуществление заявляемого способа с использованием в качестве носителя макропористого сополимера дивинилбензола и метакрилата
Иммобилизацию осуществляют в четырех колбах Эрленмейера вместимостью 750 мл (реакционные колбы), помещенных на круговую термостатируемую качалку при перемешивании 100 об/мин.
Для иммобилизации используют концентрат культуральной жидкости, продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298, полученный методом мембранной фильтрации, со следующими характеристиками:
- гидролазная активность (по гидролизу трибутирина) - 2220 ЛЕ/мл;
- содержание белка - 4,0 мг белка/мл;
- удельная гидролазная активность - 555 ЛЕ/мг белка.
Перед использованием в концентрате КЖ устанавливают рН 7,0±0,1.
Шарики макропористого сополимера дивинилбензола и метакрилата (Lifetech™ ECR1030M, компания Purolite® Life Sciences) промывают 0,05 М фосфатно-натриевым буфером, рН 7,0, отделяя промывные воды вакуумной фильтрацией.
- Содержание сухих веществ в носителе: 41,9%.
Адсорбцию CALB на носителе осуществляют при рН 7,0±0,1, температуре (20±1)°C в течение времени инкубации τинк=6 часов с использованием нагрузки на носитель по белку Qprot=160 мг белка/г сух. носителя.
В каждую из четырех реакционных колб помещают по 6,6 г влажного промытого носителя и добавляют по 110 мл концентрата КЖ с рН 7,0±0,1. Колбы помещают на качалку и инкубируют при (20±1)°C в течение 6 часов.
Модификацию (сшивку) адсорбированной CALB глутаровым альдегидом осуществляют при концентрации сшивающего агента в реакционной смеси СГА=1,5%, время модификации составляет 30 мин.
В каждую из четырех реакционных колб, где проводят адсорбцию CALB, добавляют по 7,0 мл 25% водного раствора ГА и продолжают инкубацию реакционной смеси на качалке в течение еще 30 минут в тех же условиях, в которых осуществлялась адсорбция CALB на носителе.
Биокатализатор в форме адсорбционно-ковалентно иммобилизованной CALB отделяют от внешнего раствора вакуумной фильтрацией на пористом стеклянном фильтре и прямо на фильтре промывают дистиллированной водой до бесцветных и прозрачных промывных вод. Влажный БК, находящийся на фильтре, обезвоживают путем трехкратной промывки ацетоном с отделением отработанного растворителя вакуумной фильтрацией. Летучие вещества из биокатализатора удаляют под вакуумом при комнатной температуре до содержания сухих веществ в БК βБК=(95±2)%.
Получено 15,4 г обезвоженного биокатализатора со следующими характеристиками:
- содержание сухих веществ: βБК=96,1%;
- синтетазная (по синтезу пропиллаурата) активность: АБК=17840 ПЛЕ/г сух. БК.
Пример 2. Осуществление заявляемого способа получения биокатализатора с использованием в качестве носителя макропористого полистирола
Иммобилизацию CALB осуществляют, как описано в Примере 1, с той разницей, что в качестве носителя используют макропористый полистирол (Lifetech™ ECR1090F, компания Purolite® Life Sciences).
- Содержание сухих веществ в носителе: 28,0%.
Адсорбцию CALB на носителе проводят в условиях Примера 1, но в течение времени инкубации τинк=24 часа внося в каждую реакционную колбу, содержащую 110 мл концентрата КЖ, по 6,3 г влажного носителя, то есть с использованием нагрузки на носитель по белку Qprot=250 мг белка/г сух. носителя.
Сшивку (модификацию) адсорбированной CALB глутаровым альдегидом осуществляют в условиях Примера 1, но с использованием концентрации сшивающего агента в реакционной смеси СГА=2,5% (по 12 мл 25% водного раствора ГА в каждую реакционную колбу) в течение времени модификации τмод=120 мин.
Получено 10,1 г обезвоженного биокатализатора со следующими характеристиками:
- содержание сухих веществ: βБК=96,8%;
- синтетазная (по синтезу пропиллаурата) активность: АБК=19320 ПЛЕ/г сух. БК.
Пример 3. Осуществление заявляемого способа получения биокатализатора с использованием в качестве носителя макропористого октадецил-полиметакрилата
Иммобилизацию CALB осуществляют, как описано в Примере 1, с той разницей, что в качестве носителя используют макропористый октадецил-полиметакрилат (Lifetech™ ECR8806F, компания Purolite® Life Sciences).
- Содержание сухих веществ в носителе: 34,2%.
Адсорбцию CALB на носителе проводят в условиях Примера 1, но в течение времени инкубации τинк=23 часа, внося в каждую реакционную колбу, содержащую 110 мл концентрата КЖ, по 6,5 г влажного носителя, то есть с использованием нагрузки на носитель по белку Qprot=200 мг белка/г сух. носителя.
Модификацию адсорбированной CALB глутаровым альдегидом осуществляют в условиях Примера 1, но с использованием концентрации сшивающего агента в реакционной смеси СГА=1,0% (по 4,7 мл 25% водного раствора ГА в каждую реакционную колбу) в течение времени модификации τмод=60 мин.
Получено 12,4 г обезвоженного биокатализатора со следующими характеристиками:
- содержание сухих веществ: βБК=95,9%;
- синтетазная (по синтезу пропиллаурата) активность: АБК=24840 ПЛЕ/г сух. БК.
Пример 4. Осуществление заявляемого способа получения биокатализатора в форме CALB, гидрофобно-адсорбированной на макропористом октадецил-полиметакрилате
Адсорбцию CALB на носителе Lifetech™ ECR8806F проводят, как это описано в соответствующей части Примера 3. Стадию ковалентной сшивки не осуществляют.
Биокатализатор в форме гидрофобно-адсорбированной CALB отделяют от внешнего раствора вакуумной фильтрацией, однократно промывают дистиллированной водой, а затем обезвоживают ацетоном и высушивают, как это описано в соответствующей части Примера 1.
Получено 11,0 г обезвоженного биокатализатора со следующими характеристиками:
- содержание сухих веществ: βБК=94,8%;
- синтетазная (по синтезу пропиллаурата) активность: АБК=23960 ПЛЕ/г сух. БК.
Пример 5. Контроль. Осуществление способа получения биокатализатора на основе CALB согласно ближайшему аналогу с использованием концентрата культуральной жидкости, продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298.
Для иммобилизации используют концентрат культуральной жидкости, продуцируемой рекомбинантным штаммом Pichia pastoris ВКПМ Y-4298, полученный методом мембранной фильтрации, со следующими характеристиками:
- гидролазная активность (по гидролизу трибутирина) - 1620 ЛЕ/мл;
- содержание белка - 4,6 мг белка/мл;
- удельная гидролазная активность - 350 ЛЕ/мг белка.
Перед использованием в концентрате культуральной жидкости устанавливают рН 7,5±0,1.
В качестве носителя используют макропористый сополимер дивинилбензола и метакрилата (Lifetech™ ECR1030M, компания Purolite® Life Sciences). Носитель промывают 0,02 М фосфатно-натриевым буфером, рН 7,5, отделяя промывные воды вакуумной фильтрацией.
- Содержание сухих веществ в носителе: 40,2%.
Адсорбцию CALB осуществляют в четырех колбах Эрленмейера вместимостью 750 мл (реакционные колбы), помещенных на круговую термостатируемую качалку при перемешивании 100 об/мин в следующих операционных условиях: рН 7,5±0,1; температура (20±1)°C; нагрузка на носитель по белку Qprot=160 мг белка/г сух. носителя; время инкубации τинк=16 часов. В каждую из четырех реакционных колб помещают по 7,9 г влажного промытого носителя и добавляют по 110 мл концентрата КЖ с рН 7,5±0,1 и инкубируют колбы на качалке.
По окончании процедуры адсорбции внешний раствор отделяют вакуумной фильтрацией, а носитель с адсорбированной CALB однократно промывают 0,02 М фосфатно-натриевым буфером, рН 7,5, и высушивают в токе азота.
Способ получения биокатализатора гидрофобно-адсорбированной CALB согласно ближайшему аналогу не предусматривает ковалентную сшивку адсорбированного фермента.
Получено 19,1 г обезвоженного биокатализатора со следующими характеристиками:
- содержание сухих веществ: βБК=94,1%;
- синтетазная (по синтезу пропиллаурата) активность: АБК=11910 ПЛЕ/г сух. БК.
Пример 6. Стабильность полученных заявляемым способом биокатализаторов в органических растворителях
Стабильность образцов биокатализаторов на основе CALB в органических растворителях при заданной температуре характеризуют по относительной остаточной активности образца БК после его инкубации в заданных условиях.
Аликвоту обезвоженного образца БК (300 мг) с известной синтетазной активностью заливают органическим растворителем (5 мл) и инкубируют на качалке при заданной температуре (60°C или 95°C) в течение необходимого времени. Органический растворитель отделяют вакуумной фильтрацией, а образец БК промывают ацетоном и высушивают под вакуумом. В образце БК после инкубации определяют синтетазную активность. Относительную остаточную активность образца БК после его инкубации в заданных условиях (Аотн, %) рассчитывают как отношение синтетазной активности БК после инкубации (в пересчете на сухой вес) к исходной синтетазной активности образца (в пересчете на сухой вес).
Пример 7. Устойчивость полученных биокатализаторов на основе CALB к вымыванию целевого фермента
Устойчивость биокатализатора к вымыванию целевого фермента характеризуют по относительной остаточной активности образца БК после его инкубации в растворе детергента.
Аликвоту обезвоженного образца БК (300 мг) с известной синтетазной активностью заливают 2,5% раствором детергента Тритон Х-100 в 0,05 М фосфатно-натриевом буфере, рН 7,0 (5 мл) и инкубируют на качалке при заданной температуре 20°C в течение 3 часов. Внешний раствор отделяют вакуумной фильтрацией, а образец БК промывают водой, затем ацетоном и высушивают под вакуумом. В образце БК после инкубации определяют синтетазную активность. Относительную остаточную активность образца БК после его инкубации в заданных условиях (Аотн, %) рассчитывают как отношение синтетазной активности БК после инкубации (в пересчете на сухой вес) к исходной синтетазной активности образца (в пересчете на сухой вес).
Таким образом, разработан способ получения биокатализатора путем адсорбционно-ковалентной иммобилизации CALB, состоящий в физической адсорбции фермента из водного раствора на гидрофобном носителе и последующей ковалентной сшивки адсорбированной CALB. Биокатализатор в форме адсорбционно-ковалентно иммобилизованной CALB обезвоживают и высушивают до содержания сухих веществ (95±2)%, что делает его пригодным для использования в биокаталитических процессах, протекающих в среде органических растворителей.
Способ позволяет получать биокатализатор с синтетазной активностью (в отношении синтеза пропиллаурата) 18000÷25000 ПЛЕ/г сух. БК, обладающий высокой термической стабильностью в среде органических растворителей и толерантный к обработке раствором детергента в водной среде, что свидетельствует о необратимости связывания CALB в биокатализаторе.
Преимущества заявляемого способа получения БК:
- ферментативная активность в 1,5-2,5 раза выше, чем у ближайшего аналога;
- высокая термическая стабильность в органических растворителях;
- необратимость связывания целевого фермента (устойчивость к вымыванию) многократно выше, чем у ближайшего аналога (98-99% остаточной активности по сравнению с 0,8-1,4%).
Источники информации
1. US 5773266 (1998) Immobilized lipases on a dry, porous particulate hydrophobic support and containing a non-ionic surfactant.
2. WO 9015868 (1990) IMMOBILIZED LIPASE PREPARATION AND USE THEREOF FOR ESTER SYNTHESIS.
3. Basso A., Froment L., Hesseler M., Serban S. New highly robust divinyl benzene/acrylate polymer for immobilization of lipase CALB // Eur. J. Lipid Sci. Technol. - 2013. - V. 115 - P. 468-472.
4. Ferrario, V. Lipases Immobilization for Effective Synthesis of Biodiesel Starting from Coffee Waste Oils / V. Ferrario, H. Veny, E. De Angelis, L. Navarini, C. Ebert, L. Gardossi // Biomolecules. - 2013. - V. 3. - P. 514-534.
5. Wang W., Zhou W., Li J., Hao D., Su Z., Ma G. Comparison of covalent and physical immobilization of lipase in gigaporous polymeric microspheres // Bioproc. Biosyst. Eng. - 2015. - V. 38 - P. 2107-2115.
6. Poojairi Y., Clarson S.J. Thermal stability of Candida Antarctica lipase В immobilized on macroporous acrylic resin in organic media // Biocatal. Agricul. Biotech. - 2013. - V. 2. - P. 7-113.
7. Boros Z., Weiser D., Markus M., Abahaziova E., Magyar A., Tomin A., Koczka В., Kovacs P., Poppe L. Hydrophobic adsorption and covalent immobilization of Candida antarctica lipase В on mixed-function-grafted silica gel supports for continuous-flow biotransformations // Proc. Biochem. - 2013. - V. 48. - P. 1039-1047.
8. Palomo J.M., Munoz G., Fernández-Lorente G., Mateo C., Fernández-Lafuente R., Guisán J.M. Interfacial adsorption of lipases on very hydrophobic support (octadecyl-Sepabeads): immobilization, hyperactivation and stabilization of the open form of lipases // J. Mol. Catal. B: Enz. - 2002. - V. 19-20. - P. 279-286.
9. Truppo M.D., Hughes G. Development of an improved immobilized CAL-B for the enzymatic resolution of a key intermediate to odanacatib. // Org. Process Res. Dev. - 2011. - V. 15. - P. 1033-1035.
10. Hernandez К., Fernandez-Lafuente R. Lipase В from Candida antarctica immobilized on octadecyl Sepabeads: A very stable biocatalyst in the presence of hydrogen peroxide. // Process Biochem. - 2011. - V. 46. - P. 873-878.
11. Chen В., Hu J., Miller E.M., Xie W., Cai M., Gross R.A. Candida antarctica lipase В chemically immobilized on epoxy-activated micro- and nanobeads: catalysts for polyester synthesis // Biomacromolecules. - 2008. - V. 9. - P. 463-471.
12. Zhao H., Song Z. Migration of reactive trace compounds from Novozym® 435 into organic solvents and ionic liquids // Biochem. Eng. J. - 2010. - V. 49. - P. 113-118.
13. Ruiz Toral A., de los  A.P., Francisco J., Hernandez F.J., Janssen M.H.A., Schoevaart R., van Rantwijk F., Sheldon R.A. Cross-linked Candida Antarctica lipase В is active in denaturing ionic liquids // Enz. Microb. Technol. - 2007. - V. 40 - P. 1095-1099.
A.P., Francisco J., Hernandez F.J., Janssen M.H.A., Schoevaart R., van Rantwijk F., Sheldon R.A. Cross-linked Candida Antarctica lipase В is active in denaturing ionic liquids // Enz. Microb. Technol. - 2007. - V. 40 - P. 1095-1099.
14. Migneault I., Dartiguenave C., Bertrand M. J., Waldron K.C. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking (Review). // BioTechniques - 2004. - V. 37, №5 - P. 790-802.
15. Uppenberg J., Hansen M.T., Patkar S., Jones T.A. The sequence, crystal structure determination and refinement of two crystal forms of lipase В from Candida Antarctica // Structure. - 1994. - V. 2. - P. 293-308.
16. Basso A., Braiuca P., Cantone S., Ebert C., Paolo Linda P., Spizzo P., Caimi P., Hanefeld U., Giuliano Degrassi G., Gardossi L. In Silico Analysis of Enzyme Surface and Glycosylation Effect as a Tool for Efficient Covalent Immobilisation of CalB and PGA on Sepabeads® // Adv. Synth. Catal. - 2007. - V. 349 - P. 877-886.
17. Miled N., Beisson F., de Caro J., de Caro A., Arondel V., Verger R. Interfacial catalysis by lipases // J. Mol. Catal. B. Enzym. - 2001. - V. 11. - P. 65-171.
18. Ericsson D.J., Kasrayan A., Johansson P., Bergfors Т., Sandstrom A.G., Backvall J.E., Mowbray S.L. X-ray structure of Candida Antarctica lipase A shows a novel lid structure and a likely mode of interfacial activation // J. Mol. Biol. - 2008. - V. 376. - P. 109-119.
19. Skjot M., de Maria L., Chatterjee R., Svendsen A., Patkar S.A., Ostergraad P.R., Brask J. Understanding the plasticity of the alpha/beta hydrolase fold: Lid swapping on the Candida antarctica lipase В results in chimeras with interesting biocatalytic properties // ChemBioChem - 2009 - V. 10 - P. 520-527.
Способ получения гетерогенного биокатализатора на основе фермента - липазы дрожжей Candida antarctica фракции В путем адсорбции этого фермента на гидрофобном макропористом носителе в процессе инкубации частиц носителя в водном растворе, содержащем фермент, отличающийся тем, что в качестве водного раствора, содержащего фермент, используют концентрат культуральной жидкости штамма дрожжей Pichia pastoris ВКПМ Y-4298 с удельной ферментативной активностью не менее 350 ЛЕ/мг белка, а адсорбированный на носителе фермент по окончании инкубации модифицируют путем добавления глутарового альдегида непосредственно в инкубационную суспензию до конечной его концентрации 1,0÷2,5% и продолжают процесс инкубации в тех же условиях в течение 30÷120 мин.
