Результат интеллектуальной деятельности: Применение полипептида, полученного на основе глюкагоноподобного пептида 1 человека, в качестве средства для контроля за весом тела
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и касается применения рекомбинантного генетически модифицированного глюкагоноподобного пептида 1 человека (рмГПП-1) в качестве средства для контроля за весом.
Серьезную быстрорастущую угрозу здоровью населения по всему миру представляет ожирение, которому сопутствуют такие болезни как диабет, сердечно-сосудистые и онкологические заболевания [Di Cesare et al, 2016]. Одним из вызовов 21 века является также детское ожирение [Facts, 2014]. Известны средства для снижения веса различной природы [Haslam, 2016]. В частности некоторые пептидные препараты на основе аналогов глюкагоноподобного пептида 1 человека (ГПП-1), действующие как агонисты рецепторов ГПП-1 и применяемые для лечения диабета, проявляют свойства, приводящие к снижению веса тела [Sanchez-Garrido, 2017]. В число таких препаратов входят: эксенатид (exenatide; торговые марки «Баета», Byetta, «Байдьюрон», Bydureon) [Painter et al., 2013], ликсисенатид (lixisenatide; торговая марка «Ликсумия», Lyxumia) [Fonseca et al., 2012; Rosenstock et al., 2013], лираглютид (торговая марка «Виктоза», Victoza) [Ostawal et al., 2016], дулаглютид (dulaglutide, торговая марка «Трулисити»,ТгиНску) [Jendle et al., 2016] и альбиглютид (albiglutide, торговая марка «Танзеум», Tanzeum) [Rosenstock et al., 2009], одобренные Управлением по контролю за продуктами питания и лекарствами США, Food and Drug Administration, USA; FDA) для лечения сахарного диабета типа 2. Более того, в 2014 г лираглютид под торговой маркой «Саксенда» (Saxenda) одобрен FDA в качестве препарата для лечения ожирения и контроля за весом тела.
В качестве ближайшего аналога рассмотрим пептид лираглютид (торговая марка «Саксенда» (Saxenda), применение которого позволяет снизить вес тела взрослых пациентов на 5-10% за 56 недель. Применение препарата не показано пациентам до 18 лет, а также с предрасположенностью к онкологическим заболеваниям. Лираглютид состоит из получаемой путем микробиологического синтеза пептидной части, к которой путем химического синтеза присоединяют остаток пальмитиновой кислоты [http://www.saxenda.com/].
Задача изобретения - расширить арсенал пептидных средств, применяемых для контроля за весом тела на основе аналогов глюкагоноподобного пептида 1 человека (ГПП-1).
Задача решена путем использования в качестве средства для контроля за весом тела рекомбинантного генетически модифицированного глюкагоноподобного пептида 1 человека (рмГПП-1), имеющего последовательность SEQ ID N 1, которая включает, начиная с N-конца, аминокислотную последовательность мутантного глюкагоноподобного пептида 1 человека ГПП-1(7-37), содержащего остаток глицина во втором положении с N-конца вместо аланина, слитую с аминокислотной последовательностью спейсерного пептида (G4S)4, слитого с последовательностью гепарин-связывающего пептида НВ1 (KRKKKGKGLGKKR), слитого с С-концевой последовательностью (G4S), где G - остаток глицина, S - остаток серина, K - остаток лизина, R - остаток аргинина, L - остаток лейцина.
Для получения полипептида рмГПП-1 используют способ биосинтеза целевого полипептида в составе слитого белка-предшественника, ПРЕ-рмГПП-1, содержащего мутантный температуро-чувствительный вариант интеина Int4bPro (RU 2619217). Уникальные свойства Int4bPro обусловлены наличием у него мутаций Cys1Ala, Cys11Tyr и Leu93Pro, первые две из которых инактивируют его способность к сплайсингу, а последняя делает его способность к формированию телец включения и С-концевому автокаталитическому процессингу зависимой от температуры.
В результате в условиях биосинтеза при температуре +37°С предшественник заявляемого полипептида - слитой белок ПРЕ-рмГПП-1, содержащий интеин Int4bPro, синтезируется в нерастворимой фракции в клетках штамма-продуцента E. coli ECR-Glp20, который получают путем трансформации реципиентного штамма Escherichia coli BL21(DE3) [Novagen, ВКПМ В-10189] плазмидой pET28-Glp20, являющейся производной вектора pET28b+ [Novagen] и содержащей структурный ген слитого белка - ПРЕ- рмГПП-1 под контролем сильного промотора, узнаваемого РНК полимеразой фага Т7 E. coli.
Штамм E. coli ECR-Glp20 используют для биосинтеза слитого белка ПРЕ-рмГПП-1.
Выделение целевого полипептида рмГПП-1 из состава слитого белка-предшественника осуществляют путем автокаталитического выщепления.
Изобретение проиллюстрировано следующими фигурами:
Фиг. 1. Оценка эффективности заявляемого полипептида в дозах 0,1 мг/кг и 1,0 мг/кг на самцах крыс.
Фиг. 2. Оценка эффективности заявляемого полипептида в дозах 0,1 мг/кг 1,0 мг\кг на самках крыс.
Пример 1. Конструирование рекомбинантной плазмиды pET28-Glp20
Рекомбинантную плазмиду pET28-Glp20 конструируют путем клонирования комплексного фрагмента ДНК размером 713 пар оснований, заключающего структурный ген pre-Glp20, кодирующий слитый белок ПРЕ-рмГПП-1 - предшественник заявляемого полипептида рмГПП-1, в вектор экспрессии pET-28(b) + (Novagen).
Конструирование комплексного фрагмента ДНК производят путем последовательного линейного лигирования пяти фрагментов ДНК, А, В, С, D и Е, которые конструируют следующим образом:
• фрагмент «А», кодирующий структурный ген мутантного интеина int4bPRO (Cys1Ala, Cys11Tyr, Leu93Pro), получают в результате ПЦР-амплификации фрагмента ДНК плазмиды pET28b_(His)x10_IntMUT, которая представляет собой плазмиду pET-28(b) + (Novagen), содержащую последовательность ДНК, кодирующую ген мутантного интеина (Cys1Ala, Cys11Tyr, Leu93Pro), дополненный на 3'-конец (перед стоп-кодоном) линкерной областью, кодирующей триплет Ser-Gly-Ser и заключающей сайт эндонуклеазы рестрикции BamHI для удобства последующего клонирования. Амплификацию осуществляют с использованием праймеров:
5'-tttccatggaaaagagatctgctctcgccaaggggacccgtctcttgcgatacgatggaaccgagat
5'-tcaccatggttgtgcaggacaaggtagt.
Липкие концы полученного в результате амплификации фрагмента ДНК открывают с помощью рестриктазы NcoI (локализация сайтов узнавания рестриктазы NcoI в составе праймеров амплификации указана).
• фрагмент «В», кодирующий модифицированный глюкагоноподобный пептид 1 человека, синтезируют искусственно в виде двуцепочечной последовательности ДНК с липким концами NcoI и BamHI;
• фрагмент «С», кодирующий линкерный пептид (Gly4Ser)4, синтезируют искусственно в виде двуцепочечной последовательности ДНК с липкими концами BglII и BamHI;
• фрагмент «D», кодирующий гепарин-связывающий пептид KRKKKGKGLGKKR из состава природного белка HB-EGF человека, синтезируют искусственно в виде двуцепочечной последовательности ДНК с липкими концами BglII и BamHI;
• фрагмент «Е», кодирующий С-концевую аминокислотную последовательность Gly4Ser и терминирующий кодон, искусственно синтезируют в виде двуцепочечной последовательности ДНК с липкими концами BglII и XhoI.
Результирующий комплексный фрагмент ДНК размером 713 пар нуклеотидов, имеющий липкие концы NcoI и XhoI, получают в результате последовательного лигирования указанных фрагментов ДНК.
Комплексный фрагмент ДНК заключает структурный ген слитого белка ПРЕ-рмГПП-1, являющегося предшественником заявляемого полипептида, составными частями которого являются последовательность модифицированного интеина Pch PRP8 Penicillium chrysogenum (InBase, http://www.neb.com/neb/inteins.html), содержащего мутации Cys1Ala, Cys11Tyr и Leu93Pro и последовательность рекомбинантного модифицированного глюкагоноподобного пептида 1 человека рмГПП-1.
Клонирование комплексного фрагмента ДНК в вектор экспрессии рЕТ-28(b) + производят по сайтам узнавания рестриктаз NcoI и XhoI.
В результате клонирования получают рекомбинантную плазмиду pET28-Glp20, которая содержит ген слитого белка ПРЕ-рмГПП-1 под контролем сильного промотора, узнаваемого РНК полимеразой фага Т7.
Пример 2. Конструирование штамма - продуцента слитого белка ПРЕ-рмГПП-1, являющегося предшественником заявляемого полипептида
Штамм E. coli ECR-Glp20 - продуцент слитого белка ПРЕ-рмГПП-1 получают в результате трансформации реципиентного штамма E. coli BL21(DE3) [Novagen, ВКПМ В-10189] плазмидой pET28-Glp20.
Трансформацию реципиентного штамма осуществляют с применением СаСl2-реактива [Маниатис и др., 1984]. Колонии трансформированного штамма отбирают на селективной среде, содержащей антибиотик канамицин.
В результате трансформации получают штамм E. coli ECR-Glp20, который используют для биосинтеза слитого белка ПРЕ-рмГПП-1.
Пример 3. Получение рекомбинантного генетически модифицированного глюкагоноподобного пептида 1 человека (рмГПП-1)
Биосинтез слитого белка ПРЕ-рмГПП-1 осуществляют путем культивирования штамма-продуцента E. coli ECR-Glp20 следующим образом. Сначала получают посевную культуру. Для этого одну колонию штамма засевают в пробирку, содержащую 3 мл среды YTS следующего состава (мас. %): дрожжевой экстракт - 1, триптон бакто - 2, NaCl - 1, канамицин - 0,003, вода - остальное. Культуру выращивают на роторной качалке со скоростью 250 об/мин в течение 18 ч при температуре 37°С.
Выросшую культуру переносят в среду с индуктором. С этой целью 0,5 мл посевной культуры переносят в колбу, содержащую 50 мл среды TRB следующего состава (мас. %): дрожжевой экстракт - 2,4; триптон бакто - 1,2; одномолярный фосфатный буфер (рН7) - 10; раствор 1 М сульфата магния - 0,2; лактоза - 0,5; глицерин - 0,5; канамицин - 0,009; вода - остальное. Культивирование продолжают в течение 20 ч в тех же условиях.
Индуктором синтеза слитого белка ПРЕ-рмГПП-1 является лактоза, изначально входящая в состав среды TRB.
Полученную биомассу осаждают центрифугированием в течение 10 мин со скоростью 9000 об/мин с охлаждением (4°С). Клеточный осадок суспендируют в 30 мл буфера PBS следующего состава: 137 мМ NaCl, 2 мМ KCl, 10 мМ фосфатный буфер, рН 7,4, после чего вновь подвергают центрифугированию в тех же условиях. Надосадочную жидкость сливают, и остатки жидкости тщательно удаляют с помощью вакуумного насоса.
В результате получают 12 г биомассы с 1 л культуры. Полученную биомассу замораживают и хранят при температуре минус 20°С.
Пример 4. Выделение и очистка заявляемого полипептида
Для выделения и очистки полипептида рмГПП-1 из фракции нерастворимых белков используют биомассу штамма-продуцента E. coli ECR-Glp20.
4.1. Разрушение биомассы и получение нерастворимой фракции клеточного лизата
Биомассу (70 г) ресуспендируют на ледяной бане в 1 л холодного 10 мМ калий-натрий фосфатного буфера, рН 7,0, содержащего 0,137 М NaCl и 5 мМ динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). К суспензии клеток добавляют 5 мл 0,2 М раствора фенилметилсульфонилфторида (PMSF), тщательно перемешивают на диспергаторе (IKA Т18 basic ULTRA-TURRAX). Разрушение клеток производят на дезинтеграторе APV1000 (APV1000, "SPX Flow Technology") при давлении 970 бар. Проводят 4 цикла, с охлаждением биомассы до 15°С между циклами.
В результате получают 1,07 л общего клеточного лизата.
4.2. Выделение нерастворимой фракции клеточного лизата
1,07 л клеточного лизата центрифугируют на центрифуге KR 25i, ("Jouan") 20 мин при 9000 об/мин и температуре 4°С. Полученный осадок (46 г) (нерастворимая фракция лизата), смешивают с 0,64 л воды марки Milli Q "(Millipore") и тщательно перемешивают до получения однородной суспензии. Суспензию центрифугируют, как сказано выше. К полученному осадку (31 г) прибавляют 0,22 л 0,02 М Трис-HCl буфера, рН 9.0, содержащего 0,005 М ЭДТА (буфер 1), перемешивают и центрифугируют, как описано выше.
4.3. Экстракция слитого белка ПРЕ-рмГПП-1 из нерастворимой фракции клеточного лизата
К осадку, полученному выше (30 г), прибавляют 0.34 л 0,05 М раствора Трис, содержащего 2 М мочевину и 0,005 М Na4ЭДТА, рН 12,5 (буфер 2), и тщательно перемешивают. Суспензию выдерживают 15 мин при 4°С и центрифугируют 20 мин при 9000 об/мин. В результате получают 0,35 л экстракта слитого белка ПРЕ-рмГПП-1. Выход этого белка на стадии составляет 85,2%
4.4. Ренатурация и процессинг слитого белка ПРЕ-рмГПП-1
Экстракт слитого белка ПРЕ-рмГПП-1, полученный выше, помещают в стеклянную бутыль емкостью 20 л, прибавляют 14 л 0,02 М раствора натрия фосфата, содержащего 0,005 М ЭДТА, рН 7,0 (буфер 3) и тщательно перемешивают. Значение рН суспензии доводят до 7,0 с помощью 3N раствора соляной кислоты. Объем суспензии увеличивают до 15 л с помощью буфера 3 и выдерживают при 4°С в течение 3 суток до завершения процессинга, которое устанавливают с помощью ПААГЭ. Смесь центрифугируют на центрифуге MISTRAL 6L с ускорением 5500 об/мин в течение 15 мин. Полученная надосадочная жидкость содержит смесь продуктов процессинга слитого белка ПРЕ-рмГПП-1, в том числе, искомый пептид. Выход рмГПП-1 на стадии составляет 38,9%.
4.5. Очистка рмГПП-1 хроматографией на колонке с SP-Сефарозой (Хроматография I)
Супернатант, полученный выше (15 л), разбавляют в 2 раза равным объемом 0,02 М раствора натрия фосфата, содержащего 0,005 М ЭДТА, рН 7,0 (буфер 4) и центрифугируют на центрифуге MISTRAL 6L при 5500 об/мин в течение 15 мин.
Фильтрат (29,5 л) л наносят на колонку, содержащую 40 мл SP-Сефарозы, уравновешенной буфером 4. Элюцию осуществляют градиентом концентрации хлорида натрия (0-1М).
Средний выход целевого белка на стадии - 68%.
4.6. Ультрафильтрация
Элюат, полученный в ходе хроматографии 1, подвергают ультрафильтрации на ячейке Stirred Cell Model 8050 ("Millipore") емкостью 0,05 л, снабженную мембраной Ultracel 3 KDa ("Millipore"). Выход рмГПП-1 на стадии составляет 91,9%
4.7. Очистка рмГПП-1 хроматографией на колонке, содержащей 20 мл SP-сефарозы (Хроматография II)
Раствор рмГПП-1, полученный на предыдущей стадии очистки, наносят на колонку, содержащую 20 мл SP-сефарозы. Элюцию осуществляют градиентом концентрации хлорида натрия (0-1М). Выход рмГПП-1 на стадии составляет 93,9%.
4.8. Очистка рмГПП-1 методом ультрафильтрации
Раствор рмГПП-1, очищенный в ходе хроматографии II (0,04 л), помещают в ультрафильтрационную ячейку Stirred Cell Model 8050, Millipore  0,05 л, снабженную мембраной Ultracel 3 KDa ("Millipore"). Раствор концентрируют до объема 0,01 л, затем разбавляют водой марки Milli Q до объема 0,05 л и снова концентрируют при тех же условиях до объема 0,01 л. В ходе этой процедуры концентрация целевого пептида в растворе увеличивается в 4 раза, а концентрация соли уменьшается в 5 раз, достигая 0,15 М. Выход рмГПП-1 на стадии составляет 96,7%.
0,05 л, снабженную мембраной Ultracel 3 KDa ("Millipore"). Раствор концентрируют до объема 0,01 л, затем разбавляют водой марки Milli Q до объема 0,05 л и снова концентрируют при тех же условиях до объема 0,01 л. В ходе этой процедуры концентрация целевого пептида в растворе увеличивается в 4 раза, а концентрация соли уменьшается в 5 раз, достигая 0,15 М. Выход рмГПП-1 на стадии составляет 96,7%.
4.9. Стерилизующая фильтрация раствора рмГПП-1
Стерилизующую фильтрацию раствора рмГПП-1, полученного на предыдущей стадии очистки, осуществляют с помощью фильтр-насадки Millex-GV Syringe Driven Filter Unit с удерживающим размером пор 0,22 мкм ("Millipore") в ламинарном шкафу. В результате получается 0,01 л стерильного раствора рмГПП-1 с концентрацией искомого пептида 6 мг/мл. Выход на стадии составляет 99%.
Суммарно из 1 л клеточного лизата получают 60 мг рмГПП-1. Суммарный выход составляет свыше 18%, при чистоте - 97%.
Пример 5. Приготовление препарата рмГПП-1
Стерильный раствор рмГПП-1 используют для приготовления препарата, следующего состава:
Активное вещество: рекомбинантный модифицированный глюкагоноподобный пептид 1 человека (рмГПП-1). В одном флаконе содержится 1,5 мг очищенного белка рмГПП-1.
Вспомогательные вещества: натрия фосфат - 1 мг; натрия хлорид - 2,2 мг; глицин - 15 мг. Перед применением лиофилизованный препарат переводят в форму раствора, используя для этого растворитель - воду для инъекций.
Пример 6. Оценка эффективности полипептида рмГПП-1 в качестве средства для контроля за весом тела и подтверждение отсутствия у него хронической токсичности
Оценку эффективности приготовленного препарата проводили на половозрелых беспородных крысах самцах и самках, весом 150-170 г, полученных из сертифицированного питомника. Все животные имели ветеринарный паспорт.
В кратком виде план исследования препарата представлен в таблице.
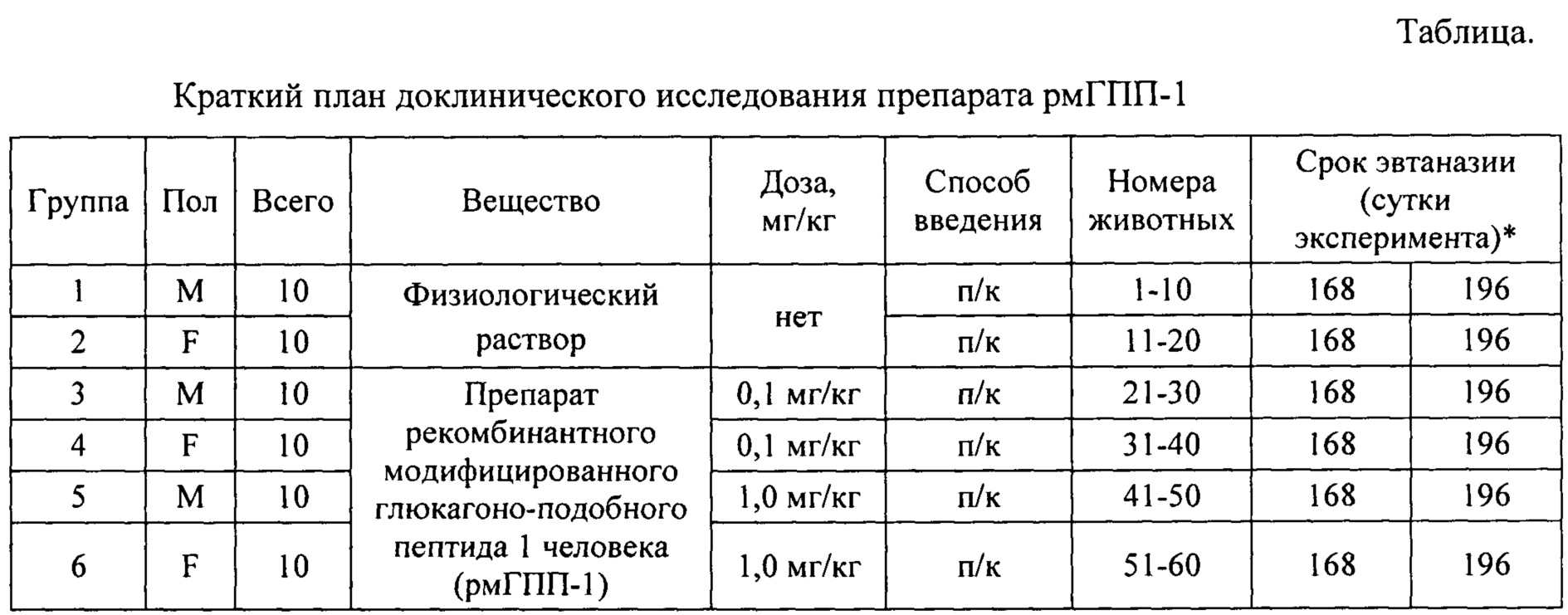
* - По 5 голов из группы
Введение препарата осуществляли один раз в сутки подкожно (п/к) на протяжении 24 недель, в одно и то же время в дозе 0,1 мг/кг, что соответствовало терапевтической дозе (1 ТД) для этого вида животных и 1,0 мг/кг, что соответствовало дозе, в 10 раз превышающей терапевтическую дозу (10 ТД). После окончания курса введений препарата выполняли период отмены введений в течение 4 недель.
Выполняли следующие прижизненные наблюдения:
1. Наблюдение/осмотр - раз в день ежедневно после введения
2. Клинический осмотр - еженедельно
3. Масса тела - еженедельно
4. Потребление корма - еженедельно
5. Гематологическое исследование периферической крови. Клинический анализ крови (лейкоциты, эритроциты, гемоглобин, тромбоциты, лейкоформула и гематокрит) производили на 0, 30, 60, 90, 120, 150 и 168 сутки во время курса, на 3, 5, 7; 10, 20 и 30 сутки после окончания курса введений. Для определения указанных показателей забор крови у крыс осуществляли из хвостовой вены.
6. Биохимическое изучение сыворотки крови осуществляли на 1 и 30 день после окончания курса введений препарата. В сыворотке определяли наличие следующих веществ: аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (ACT), щелочная фосфатаза, креатинин, мочевина, билирубин (прямой и общий), общий белок, альбумин, глюкоза.
7. Для исследования мочи на 1 и 30 день после окончания курса введений у крыс при помощи метаболических клеток определяли суточный диурез (выпито жидкости / выделено мочи). Производили клинический анализ мочи (рН, лейкоциты, эритроциты, кетоновые тельца, белок, уробилиноген, удельный вес).
8. Электрокардиограмму (ЭКГ) во втором стандартном отведении регистрировали на 1 и 30 сутки после окончания курса введений.
9. Наличие новообразований определяли в процессе наблюдения за прижизненными показателями, макроскопического изучения органов животных и гистологического изучения образцов тканей
Результаты показали, что:
- за время введения препарата в течение 6 месяцев в группах животных смертности не было. В течение 30 суток после прекращения введения препарата гибели крыс также не наблюдали ни в одной из групп экспериментальных и контрольных животных.
- на всем протяжении эксперимента отклонений в поведенческих реакциях животных не отмечали. Животные не становились беспокойными, агрессивными или вялыми. У них соответственно возрасту изменялся мышечный тонус, сохранялся гладкий шерстный покров. Ни в одном случае не отмечено явлений мидриаза и экзофтальмии.
- шестимесячное введение препарата в испытанных дозах не оказывало статистически значимого влияния на потребление крысами корма и воды.
- результаты ежедневного наблюдения за экспериментальными животными свидетельствовали о том, что шестимесячное введение исследуемого препарата в изученных дозах не оказывало влияния на состояние кожи, подкожной жировой ткани, волосяного покрова, видимых слизистых оболочек. У подопытных крыс видимые слизистые оболочки оставались бледно-розового цвета, влажность их не изменялась, симптомы бронхита, конъюнктивита и ринита отсутствовали.
- при гематологических исследованиях установлено, что общее количество лейкоцитов и лейкоцитарная формула во всех подопытных группах на всем протяжении опыта не отличалась от контроля. Количество эритроцитов и содержание гемоглобина колебалось в пределах физиологической нормы;
- гематокрит и общее количество тромбоцитов во всех подопытных группах не отличались от контроля;
- при биохимическом исследовании сыворотки крови показано, что биохимические показатели сыворотки крови подопытных животных всех групп не отличались от контроля;
- на оба срока исследования суточного диуреза и состава мочи различий между подопытными и контрольными группами не выявлено;
- при изучении ЭКГ на 1 и 30 сутки после окончания курса введений препарата различий между контрольными и подопытными группами не выявлено;
- при вскрытии животных, забитых на 1 и 30 сутки после окончания курса введений препарата, макроскопических патологических изменений внутренних органов не выявлено;
- при определении массовых коэффициентов внутренних органов во всех подопытных группах отличий от контроля не выявлено на оба срока наблюдения.
- при оценке параметров состояния систем организма: нервной, сердечно-сосудистой и дыхательной нежелательных эффектов действующего препарата выявлено не было.
- ежедневное подкожное введение препарата в дозе 0,1 мг/кг или 1,0 мг/кг не приводило к появлению новообразований, выявляемых при макроскопических и гистологических исследованиях органов и тканей животных и не вызывало признаков гиперплазии или метаплазии тканей, свидетельствующих об их предопухолевом или неопластическом перерождении.
Перечисленные данные свидетельствовали об отсутствии у препарата заметного токсического или канцерогенного действия.
В то же время результаты по оценке эффективности препарата полипептида рмГПП-1 в качестве средства для контроля за весом животных показали следующее.
У самок и самцов крыс, получавших препарат в разовой дозе 0,1 мг/кг, выявлена очевидная тенденция (р>0,05) к замедлению прироста веса тела по сравнению с контролем (фиг. 1).
Данная тенденция приобрела статистически достоверный характер (р<0,05) при оценке замедления прироста веса животных на протяжении 84 суток введения препарата крысам-самцам в дозе 1,0 мг/кг. Наблюдавшееся отставание сохранялось до конца эксперимента (фиг. 2).
В то же время у самок крыс препарат в дозе 1,0 мг/кг не вызывал отклонения в прибавке массы животных по сравнению с контролем (фиг. 2).
Таким образом, у самцов введение препарата в дозе 0,1 мг/кг (1 ТД) вызывало очевидную тенденцию к замедлению прироста веса животных: снижение веса относительно контроля составило в среднем 6,5±2,7%. Эта тенденция при увеличении дозы до 1,0 мг/кг (10 ТД) превращалась в статистически достоверный эффект: снижение веса относительно контроля составило в среднем 13,7±3,8%.
У самок введение препарата в дозе 0,1 мг/кг также вызывало тенденцию к замедлению прироста веса: снижение веса относительно контроля составило в среднем 8,1±2,6%. Однако, увеличение дозы до 1,0 мг/кг привело к практически полному исчезновению эффекта.
В этой связи, очевидно, что величина выявленного эффекта находится в зависимости от пола животных и величины разовой дозы, причем у самок зависимость эффекта от дозы носит более сложный характер, чем у самцов. Возможно, что наблюдаемый эффект связан с набором и уровнем половых гормонов.
Таким образом, применение в течение 24 недель препарата полипептида рмГПП-1 на здоровых животных (крысах), содержавшихся в нормальных условиях без ограничения в доступе к воде и пище, вызывало снижение веса на 6-13%, что сопоставимо с показателями 5-10% у ближайшего аналога, применявшегося таким же способом (подкожно) и в таком же режиме (раз в сутки) на взрослых пациентах в течение 56 недель [http://www.saxenda.com/]. Эффект рмГПП-1 выявлялся при отсутствии признаков токсичности и канцерогенности препарата и без заметного изменения потребления корма.
При этом в отличие от ближайшего аналога рмГПП-1 получают в одну стадию путем микробиологического синтеза с использованием существенно менее трудоемкой и затратной технологии.
Список цитируемых источников научно-технической информации
Маниатис и др., 1984; Маниатис Т., Фрич Э., Сэмбрук Дж. (1984). Молекулярное клонирование. Пер с англ. М. Мир. 480 с.
Di Cesare et al., 2016; Di Cesare M., Bentham J., Stevens G.A., Zhou В., Danaei G., Lu Y., Bixby H., Cowan M.G., Riley L.M., Hajifathalian K., Fortunato L., Taddei C, Bennett J.E., Ikeda N., Khang Y.H., Kyobutungi C, Laximaiah A., Li Y., Lin H.H., Miranda J. & 725 others. (2016). Trends in adult body-mass index in 200 countries from 1975 to 2014: A pooled analysis of 1698 population-based measurement studies with 19.2 million participants. The Lancet, 387 (10026): 1377-1396.
Facts, 2014: Facts and figures on childhood obesity. (2014) http://www.who.int/end-childhood_obesity/facts/en/.
Fonseca et al., 2012; Fonseca V.A., Alvarado-Ruiz R., Raccah D., Boka G., Miossec P., Gerich J.E. (2012). Efficacy and safety of the once-daily GLP-1 receptor agonist lixisenatide in monotherapy. A randomized double-blind, placebo-controlled trial in patients with type 2 diabetes (GetGoal-Mono). Diabetes Care, 35(6): 1225-1231.
Haslam, 2016; Haslam D. (2016) Weight management in obesity - past and present. Int J Clin Pract, 70 (3): 206-217.
Jendle et al., 2016; Jendle J., Grunberger G., Blevins Т., Giorgino F., Hietpas R.T., Botros F.T. (2016). Efficacy and safety of dulaglutide in the treatment of type 2 diabetes: a comprehensive review of the dulaglutide clinical data focusing on the AWARD phase 3 clinical trial program. Diabetes Metab Res Rev, 32(8): 776-790.
Ostawal et al., 2016; Ostawal A., Mocevic E., Kragh N. (2016). Clinical Effectiveness of liraglutide in type 2 diabetes treatment in the real-world setting: A systematic literature review. Diabetes Ther, 7(3): 411-438.
Painter et al., 2013; Painter N.A., Morello СМ., Singh R.F., McBane S.E. (2013). An-evidence-based and practical approach to using Bydureon™ in patients with type 2 diabetes. J Am Board Fam Med, 26(2): 203-210.
Rosenstock et al., 2009; Rosenstock J., Reusch J., Bush M., Yang F., Stewart M. (2009). Potential of albiglutide, a long-acting GLP-1 receptor agonist, in type 2 diabetes. A randomized controlled trial exploring weekly, biweekly, and monthly dosing. Diabetes Care, 32(10): 1880-1886
Rosenstock et al, 2013; Rosenstock J., Raccah D., Koranyi L., Maffei L., Boka G., Miossec P., Gerich J.E. (2013). Efficacy and safety of lixisenatide once-daily versus exenatide twice-daily in type 2 diabetes inadequately controlled on metformin: A 24-week, randomized, open-label, active-controlled study (GetGoal-X). Diabetes Care, 36(10): 2945-2951.
Sanchez-Garrido et al., 2017; Sanchez-Garrido M.A., Brandt S.J., Clemmensen C, Muller T.D., DiMarchi R.D.,  M.H. (2017); GLP-1/glucagon receptor co-agonism for treatment of obesity. Diabetologia, 60(10): 1851-1861.
M.H. (2017); GLP-1/glucagon receptor co-agonism for treatment of obesity. Diabetologia, 60(10): 1851-1861.

