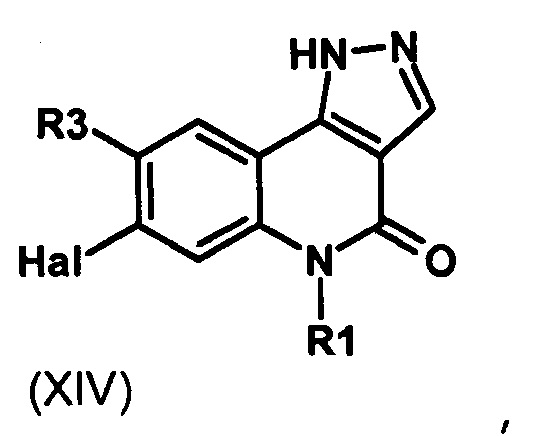
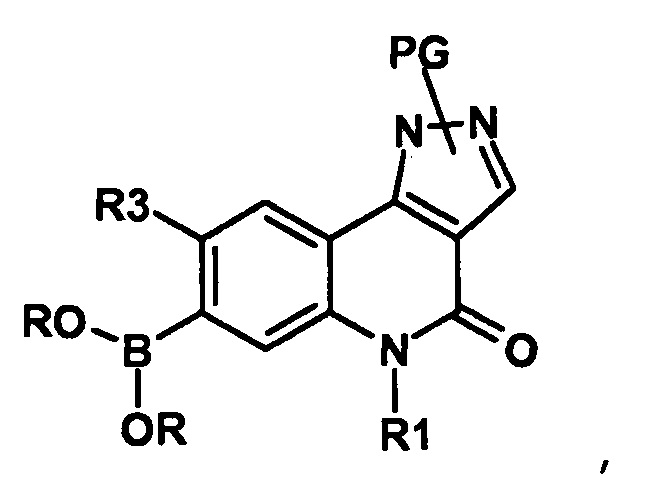
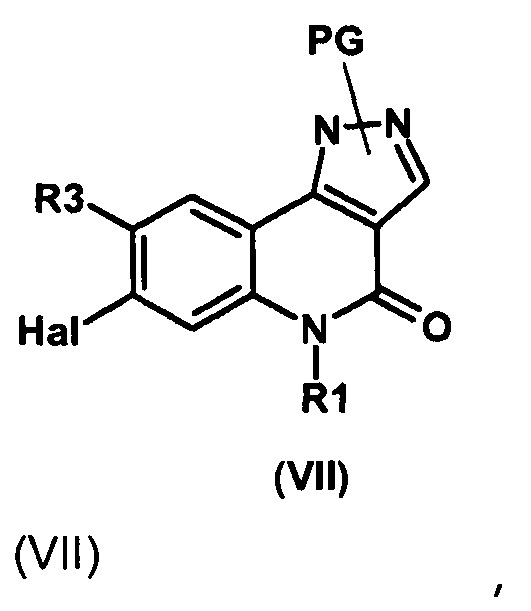
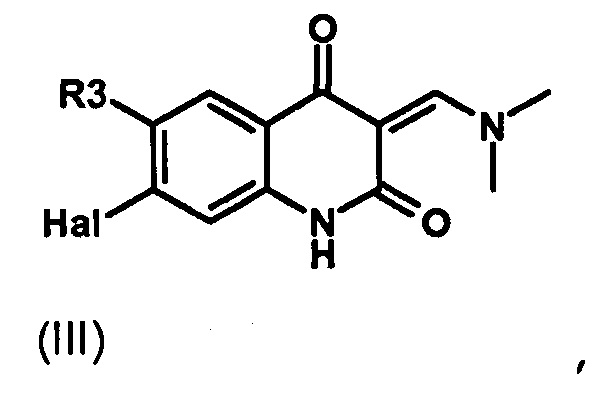
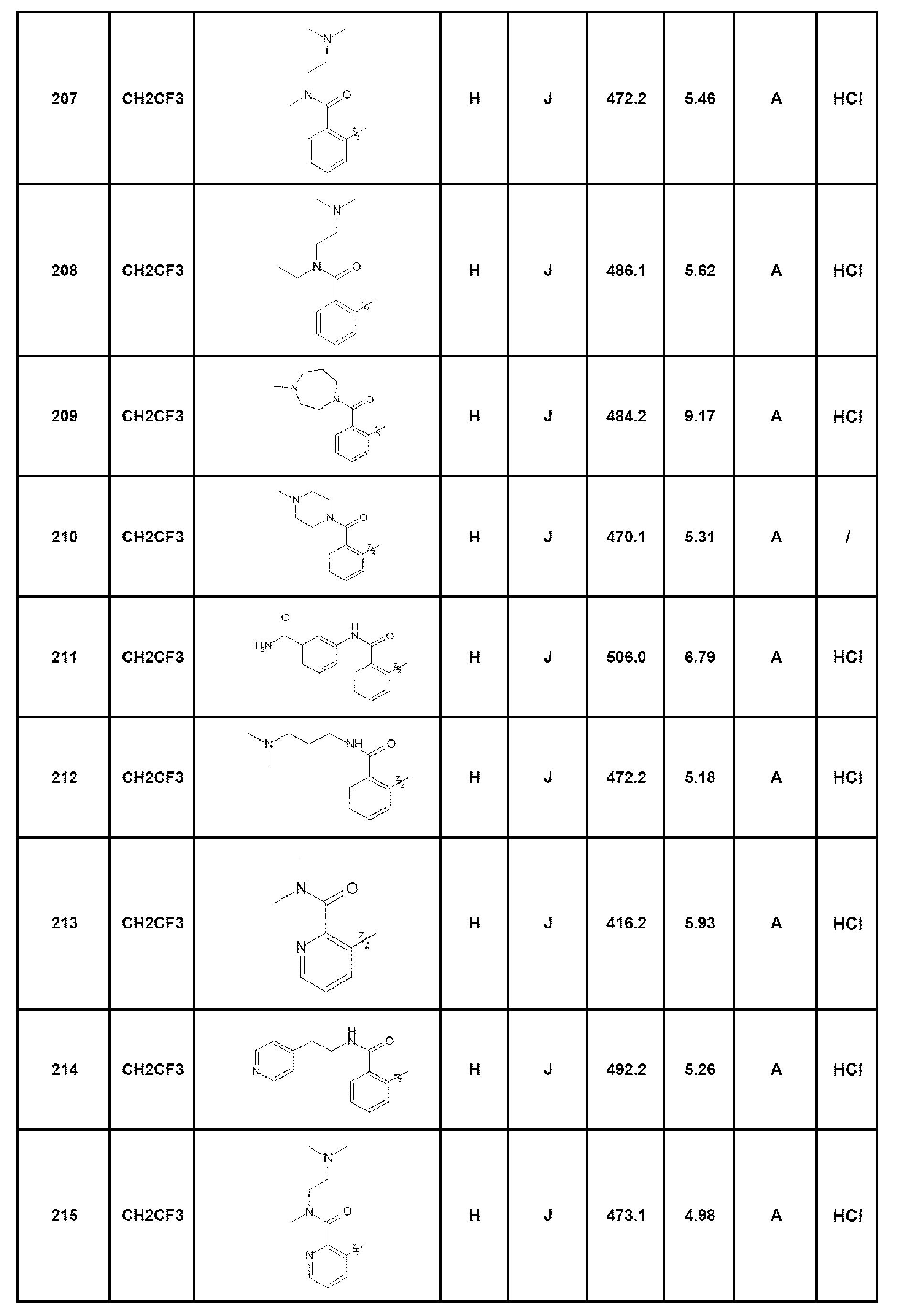
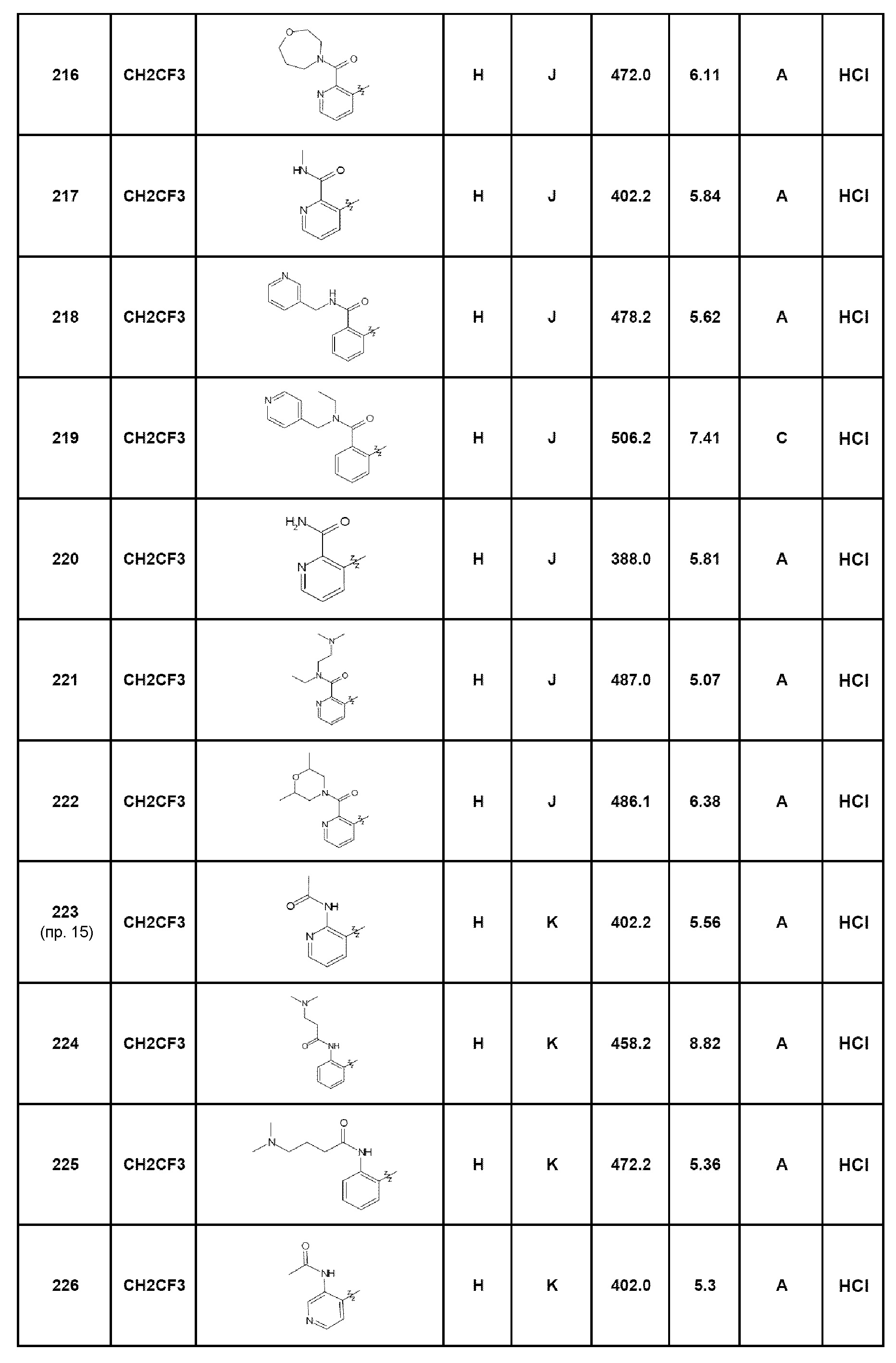
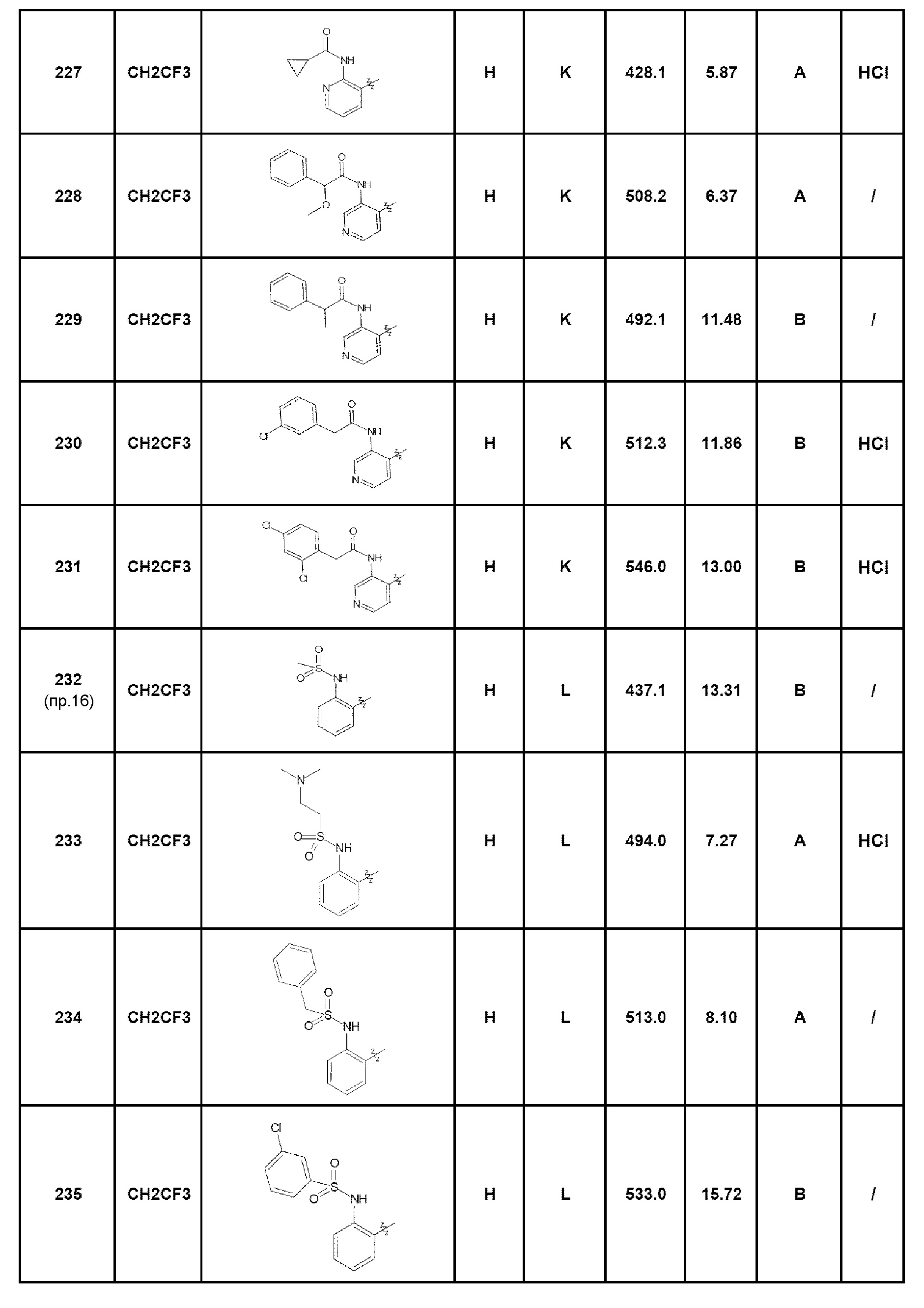
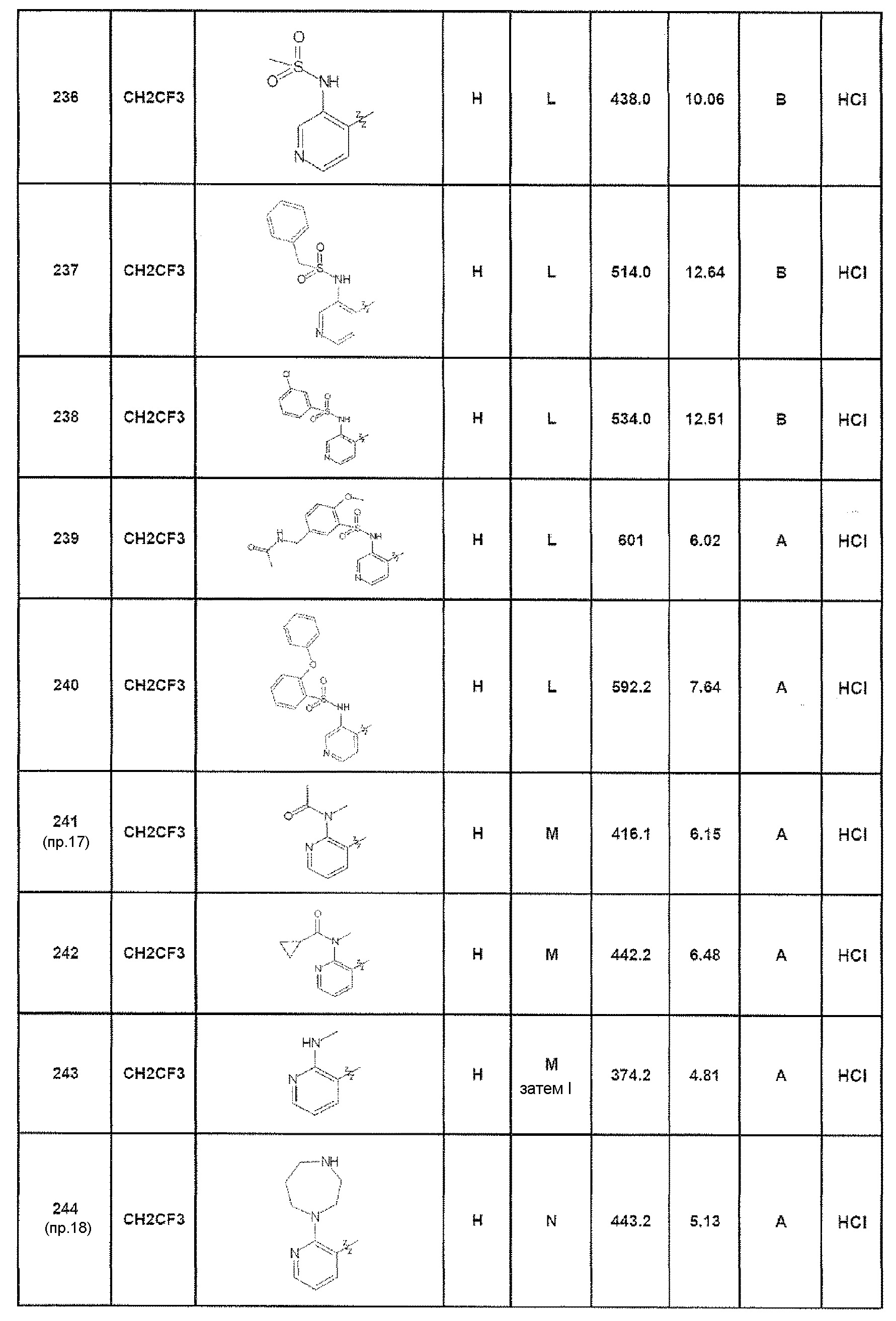
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ПИРАЗОЛОХИНОЛИНОНА, ИХ ПОЛУЧЕНИЕ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к производным пиразолохинолинона, их получению и их терапевтическому применению.
Соединения по настоящему изобретению являются обратимыми и селективными ингибиторами метионинаминопептидазы типа 2 (MetAP2).
MetAP2 представляет собой убиквитарную металлопротеазу на основе цитозоля, вовлеченную в катаболизм полипептидов.
MetAP2 катализирует отщепление метиониновых остатков, расположенных в N-конце белков, заново синтезированных клеткой (Bradshaw R.A. et al., TIBS, 1998, 23, 263-267). Отщепление N-концевых метиониновых остатков является важной стадий в созревании многих белков и полипептидов. Оно позволяет клетке продолжать обычные посттрансляционные модификации (миристоилирование, пальмитоилирование и т.д.) и затем разрушать такие же белки. Однако MetAP2 может отщеплять такой остаток только при условии, что второй остаток является остатком незаряженным и меньшего размера.
MetAP2 активна, когда активный сайт содержит два атома двухвалентного металла, такого как Со(II) или Mn(II) (Li X., Chang Y.H., Biochem. Biophys. Res. Commun., 227, 1996, 152-159). Более того, исследования позволили установить, что человеческая MetAP2 вполне вероятно использует марганец в качестве физиологического иона металла (Wang J. et al., Biochemistry, 2003, 42, 5035-5042).
Другой функцией MetAP2 является объединение с фактором трансляции белков eIF2 (эукариотный фактор инициации 2), причем таким образом предотвращается его фосфорилирование (Datta et al., 1988; Li and Chang, 1996). Показано, что фосфорилирование eIF2 приводит к ингибированию общего синтеза белков в эукариотных клетках. Связывая eIF2, MetAP2 защищает сайт фосфорилирования (Datta, 2000; Kimball, 1999; Pestova et al., 2001). Однако ингибиторы активности MetAP2 не влияют на способность MetAP2 блокировать фосфорилирование eIF2 (Griffin, 1997), что предполагает, что две функции являются независимыми.
Существует изоформа MetAP2 MetAP1. Такие две изоформы отличаются наличием дополнительного спирального домена в примерно 60 остатков в пределах С-концевого домена MetAP2. Мутация двух форм является летальной для эукариотной клетки. Такой результат лежит в основе интереса к идентификации ингибиторов, которые селективны в отношении MetAP2. С другой стороны, когда мутирована только одна изоформа, наблюдают снижение роста (Li X. and Chang Y.H., Proc. Natl. Acad. Sci., 1995, 92, 12357-12361). Такие результаты подтверждают, что функция метионинаминопептидазы (МАР) является существенной для роста клеток, и такая активность не может передаваться независимо от MetAP.
Также существуют два типа ингибиторов MetAP2: обратимые ингибиторы и необратимые ингибиторы. Некоторыми известными необратимыми ингибиторами являются фумагиллин, TNP-470 и овалицин. На молекулярном уровне TNP-470, как и фумагиллин и овалицин, связываются с MetAP2 ковалентно и необратимо (Griffith E.C. et al., Chem. Biol., 1997, 4, 461-471).
MetAP2 идентифицирована как мишень для семейства антиангиогенных средств, образованных от фумагиллина, описанных как сильные необратимые ингибиторы MetAP2. Причинная связь между ингибированием MetAP2 и полученным в результате ингибированием пролиферации эндотелиальных клеток и образования новых сосудов четко установлена (Griffith E.C. et al., Chem. Biol., 1998, 95, 15183-15188).
На клеточном уровне белки-мишени MetAP2 в настоящее время все еще едва известны. Одним из них является глицеральдегид-3-фосфатдегидрогеназа. Нарушение в синтезе такого фермента наблюдают во время обработки эндотелиальных клеток TNP-470. Недавние исследования поддерживают гипотезу, что анти-MetAP2 активность TNP-470 является источником его антиангиогенной активности.
Показано, что необратимые ингибиторы MetAP2 играют некую роль при лечении фиброзов легких и печени. Фиброз представляет собой анормальное образование рубцовых тканей после повреждения ткани и ведет к хроническому и прогрессирующему ухудшению пораженных органов, что может привести к тяжелой дисфункции пораженного органа. Могут существовать различные случаи фиброза, но в большинстве случаев причина недуга остается неизвестной, и повреждения трудно определить. Развиваются скопления активированных фибробластов и миофибробластов, которые являются началом многочисленных фиброзных очагов. Когда образуются повреждения, они являются необратимыми и не могут быть устранены. Таким образом, лечение направлено на замедление развития болезни и улучшение симптомов. В таком контексте необратимые ингибиторы MetAP2 показывают на моделях in vivo ослабление фиброза легких и печени. Однако показана существенная токсичность таких ингибиторов (Kruger E.A., Exp. Opinion Invest. Drugs, 2000; Satchi-Fainaro R. et al., Nature Medicine, 2004).
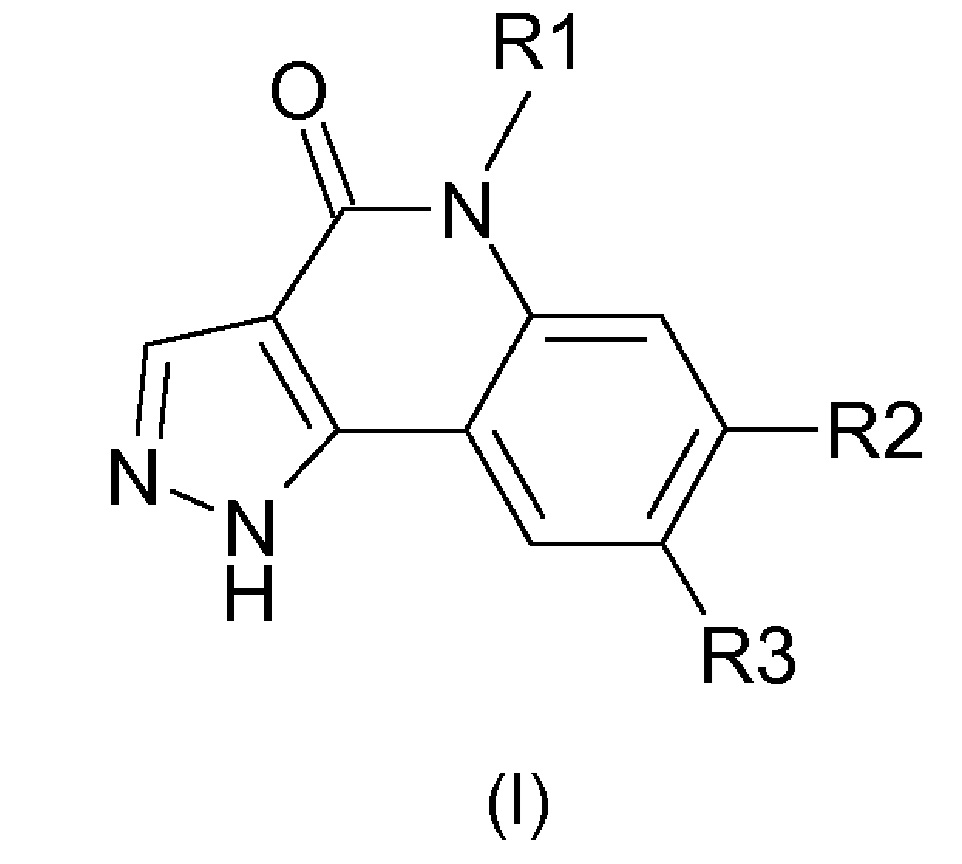
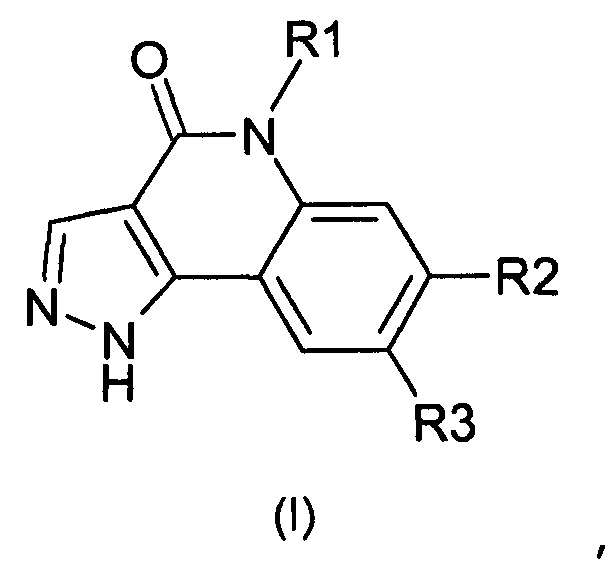
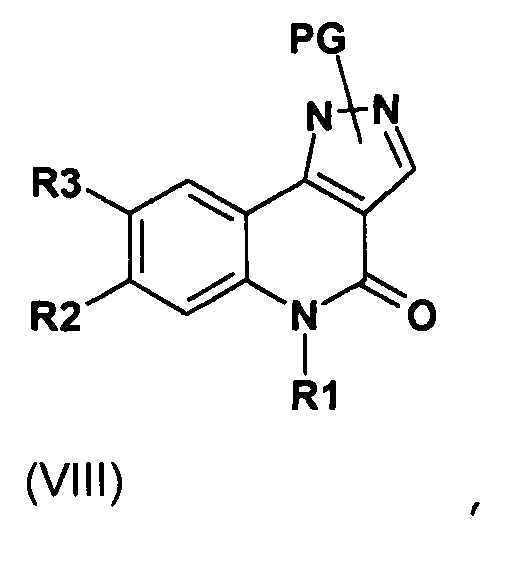
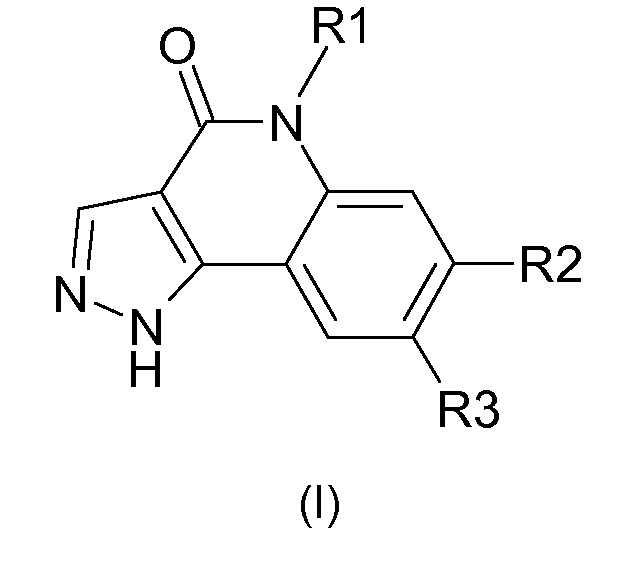
Одним предметом настоящего изобретения являются соединения, соответствующие формуле (I)
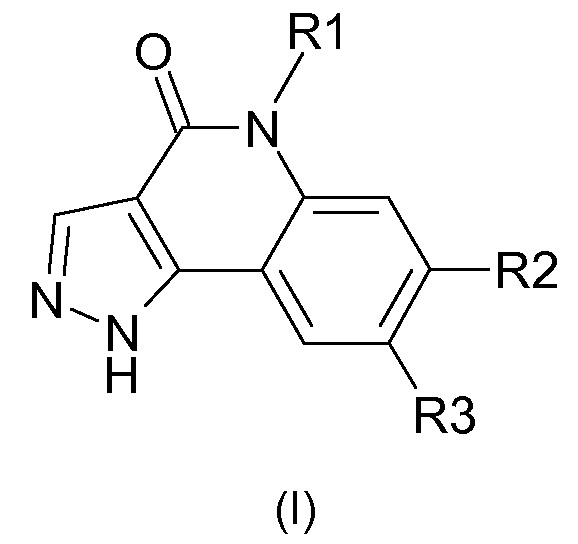 ,
,
в которой
R1 представляет собой
-(С1-С4)алкил,
-(С1-С4)галогеналкил;
R2 представляет собой
группу
 ,
,
группу
 ,
,
группу -А-Х;
R3 представляет собой
-Н,
галоген,
-(С1-С6)алкил,
цианогруппу,
-СО2Н,
-CONH2;
А представляет собой
арильную или гетероарильную группу;
Х отсутствует или представляет собой
галоген,
цианогруппу,
оксогруппу,
-(СН2)nOH,
-(С1-С6)галогеналкил,
-(С1-С6)алкил,
-(С1-С6)алкокси,
-СНОН-арил,
гетероцикл,
гетероарил,
-(С1-С6)алкилгетероцикл,
-(С1-С6)алкилгетероарил,
-(С1-С6)алкил-COORa,
-(С1-С6)алкил-NRaRb,
-гетероарил-(СН2)n-NRaRb,
-(СН2)n-NRa-С(О)-Rb,
-NRaRb,
-NRa-(СН2)n-О-Rb,
-NRa-гетероцикл,
-NRa-арил,
-NRa-С(О)-(СН2)n-NRaRb,
-NRa-С(О)-(С1-С6)алкил,
-NRa-С(О)-(С1-С6)алкиларил,
-NRa-С(О)-(СН2)n-О-Rb,
-NRa-SO2-(СН2)n-арил,
-NRa-SO2-(СН2)n-NRaRb,
-NRa-SO2-Rb,
-NRa-SO2-арил-О-арил,
-NRa-SO2-арил-(СН2)n-NRb-С(О)-Rb,
-COORa,
-CONRaRb,
-С(О)-NRa-(СН2)n-О-Rb,
-С(О)-NRa-арил-С(О)-NRaRb,
-С(О)-NRa-(СН2)n-NRaRb,
-С(О)-NRa-(СН2)n-гетероарил,
-О-(СН2)n-NRaRb,
-О-гетероцикл,
-СО-гетероцикл,
-СО-гетероарил,
-SO2NRaRb,
-SO2-гетероцикл;
Ra и Rb представляют собой независимо
-Н,
-(С1-С6)алкил;
n равен 0, 1, 2 или 3.
Соединения формулы (I) могут включать один или несколько асимметричных атомов углерода. Таким образом, они могут существовать в форме энантиомеров или диастереоизомеров. Такие энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть изобретения.
Соединения формулы (I) могут существовать в форме таутомеров. Такие таутомеры составляют часть изобретения.
Соединения формулы (I) могут существовать в форме оснований или образовывать соли с кислотами или основаниями, в частности, фармацевтически приемлемые соли кислот или оснований. Такие соли присоединения составляют часть изобретения.
Такие соли преимущественно получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, которые применимы, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения.
Соединения формулы (I) могут существовать в форме гидратов, т.е. в форме ассоциаций или сочетаний с одной или несколькими молекулами воды. Такие гидраты также составляют часть изобретения.
В контексте настоящего изобретения, и если в тексте не указано иное, применяют определения, указанные далее.
- Атом галогена: фтор, хлор, бром или йод;
- Алкильная группа: линейная, разветвленная или циклическая насыщенная алифатическая группа. Алкильная группа может быть замещена одной или несколькими алкоксигруппами. Примеры, которые можно назвать, включают метильную, этильную, пропильную, изопропильную, циклопропильную, циклобутильную, циклопентильную, циклогексильную и т.д. группы.
- Алкоксигруппа: радикал -О-алкил, в котором алкильная группа имеет значения, указанные ранее; примером, который можно назвать, является метокси.
- Галогеналкильная группа: алкильная группа, имеющая значения, указанные ранее, замещенная 1-5 атомами галогена, имеющими значения, указанные ранее. Примерами, которые можно назвать, являются трифторметильная, трифторэтильная и т.д. группы.
- Цианогруппа: группа CN.
- Оксогруппа: радикал, содержащий атом кислорода с двойной связью в форме =О; такая группа может замещать арильную, гетероарильную или гетероциклическую группу, как в следующем примере:  .
.
- Арильная группа: циклическая ароматическая группа, включающая от 5 до 10 атомов углерода, причем группа возможно конденсирована с гетероциклом как в морфолине (соединение 56). Примером арильной группы, который можно назвать, является фенильная группа; арильная группа может быть замещена одним или несколькими атомами галогена или (С1-С6)алкильными, (С1-С6)алкокси, NRaRb, OH, С(О)-(С1-С6)алкильными или оксогруппами.
- Гетероарильная группа: циклическая ароматическая группа, включающая от 5 до 10 атомов углерода и включающая от 1 до 5 гетероатомов, таких как азот, кислород или сера. Гетероарильная группа может включать N-оксидную группу. Примеры гетероарильных групп, которые можно назвать, включают группы пиридина, 2-пиридильную, 4-пиридильную, 3-пиридильную, пиразола, тиофена, индола, пиримидина, имидазола, фурана, индазола, тетразола, бензоксазина, оксазола, хинолина, тиазола и оксазадиазола; гетероарильная группа может быть замещена одним или несколькими атомами галогена или (С1-С6)алкильными, (С1-С6)алкокси, NRaRb, ОН, С(О)-(С1-С6)алкильными или оксогруппами.
- Гетероцикл: необязательно мостиковая циклическая алкильная группа, включающая от 4 до 9 атомов, образующих указанный цикл, 1 или 2 из которых являются гетероатомами, такими как кислород, азот или сера. Можно назвать, в частности, группы пирролидина, пиперазина, пиперидина, морфолина, оксазепана, диазепана и азетидина; гетероциклическая группа может быть замещена одним или несколькими атомами галогена или (С1-С6)алкильными, (С1-С6)алкокси, NRaRb, ОН, С(О)-(С1-С6)алкильными или оксогруппами.
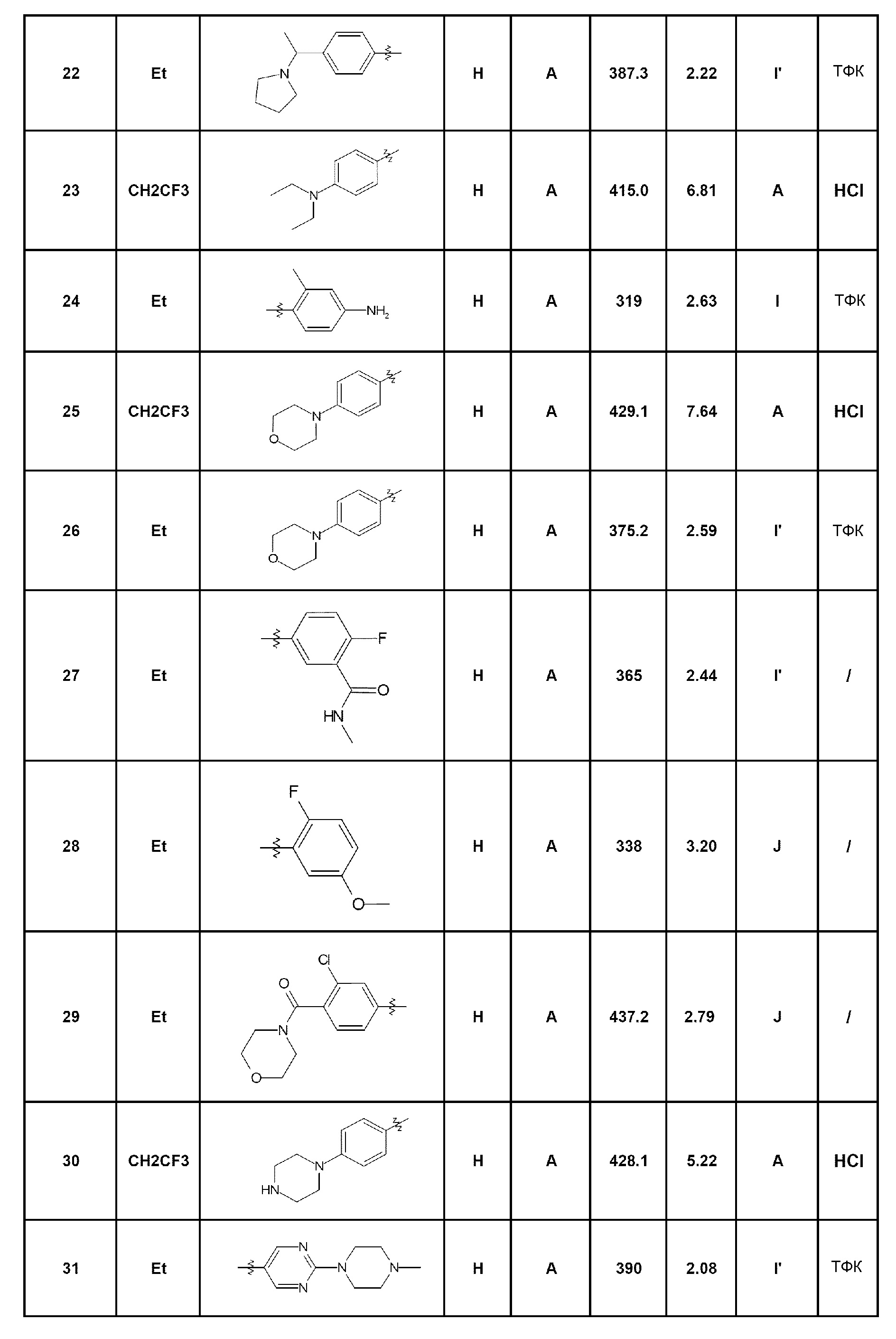
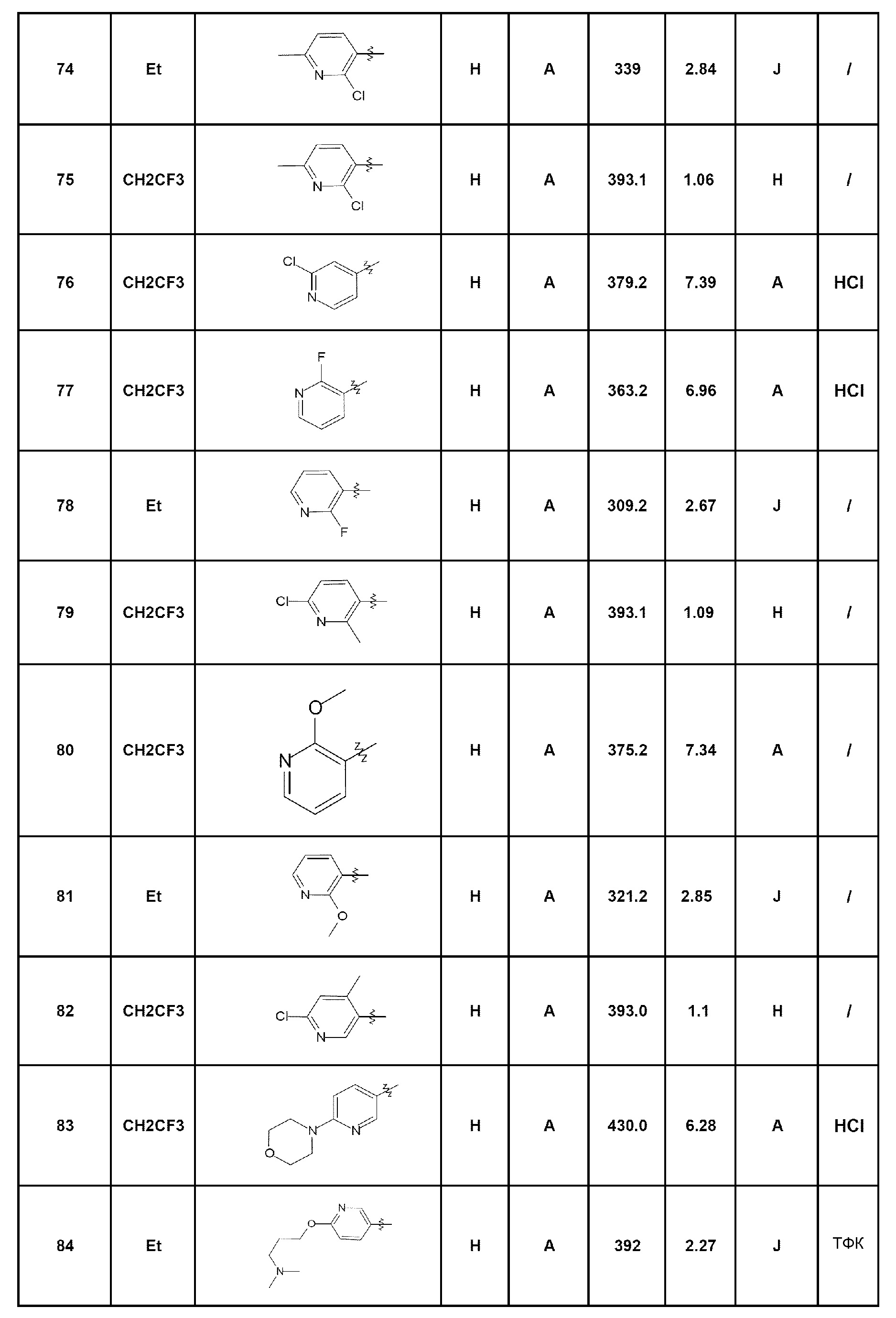
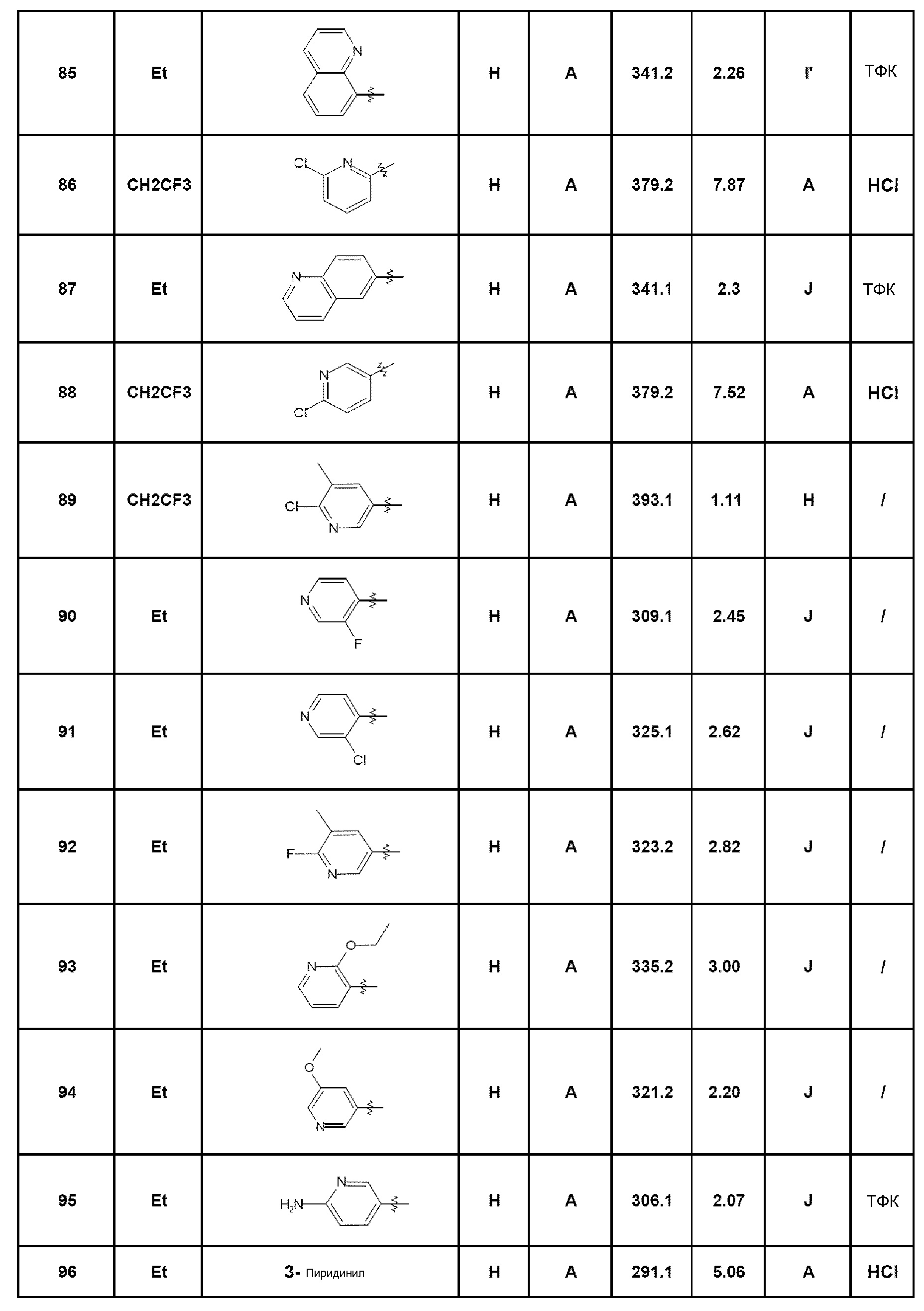
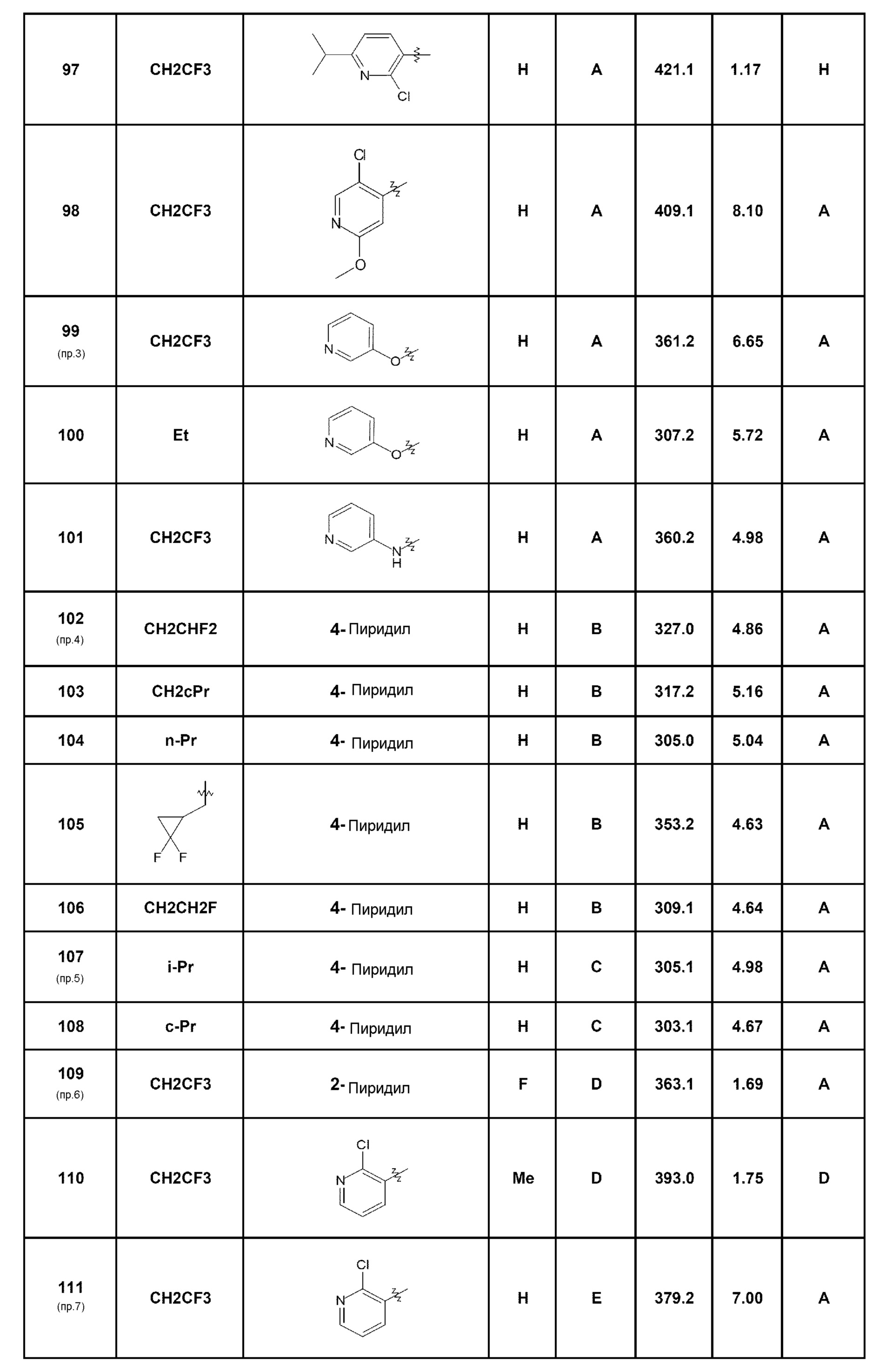
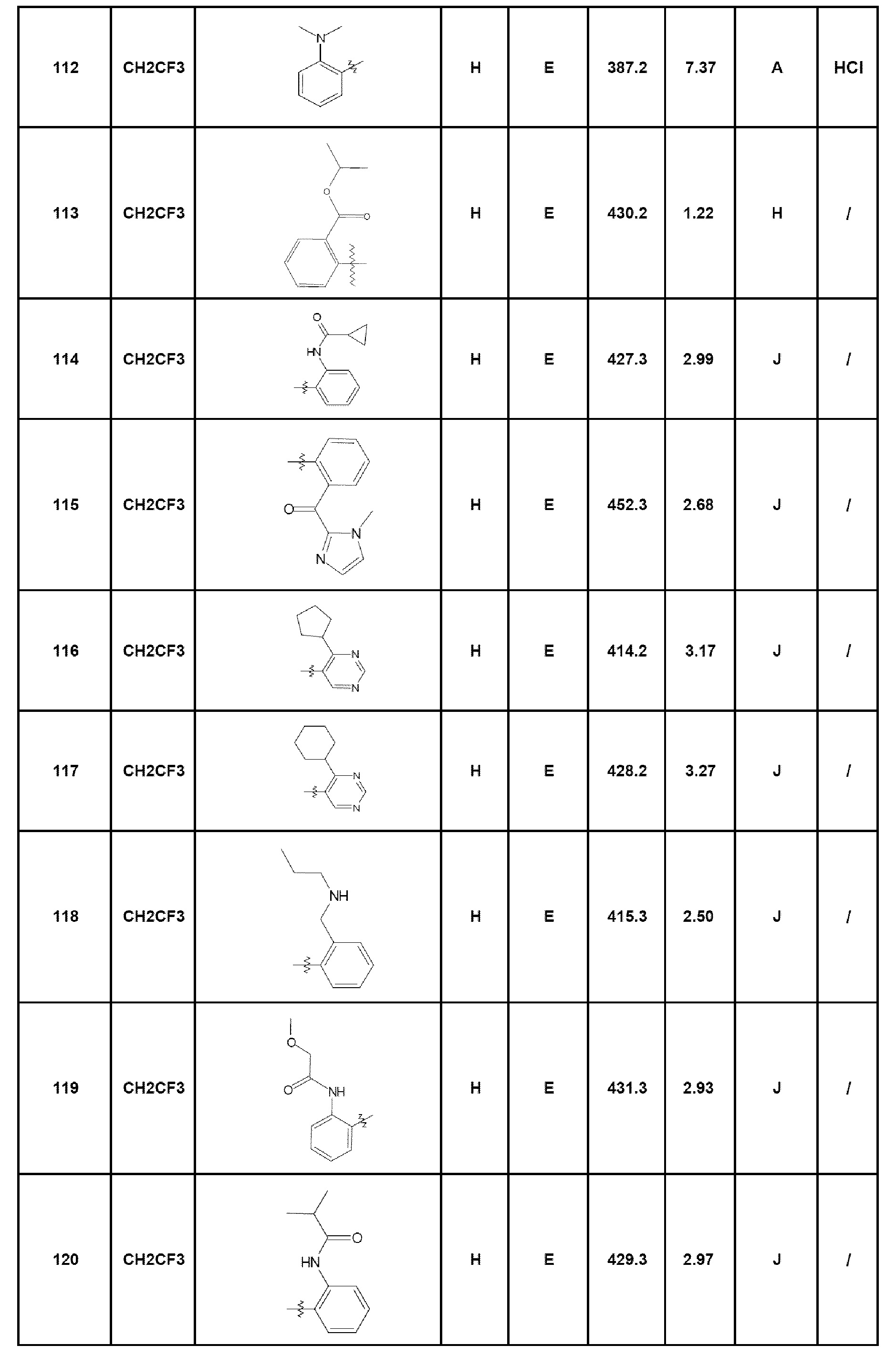
Среди соединений, которые являются предметом изобретения, можно назвать первую группу соединений формулы (I), в которых R3 представляет собой Н или атом галогена, конкретнее, атом хлора, причем определение других заместителей остается без изменений.
Другую группу соединений, которые являются предметом изобретения, образуют соединения формулы (I), в которых R1 представляет собой (С1-С4)алкильную группу, конкретнее, этильную группу, или (С1-С4)галогеналкильную группу, конкретнее, трифторэтильную группу, причем определение других заместителей остается без изменений.
Другую группу соединений, которые являются предметом изобретения, образуют соединения формулы (I), в которых R2 представляет собой группу -А-Х, причем А представляет собой арильную или гетероарильную группу, и Х отсутствует или представляет собой гетероцикл, NRaRb, (С1-С6)алкил, галоген, конкретнее, хлор или фтор, циано, NRa-SO2-Rb или СО-гетероциклическую группу; причем определение других заместителей остается без изменений.
Комбинации вышеуказанных групп соединений по изобретению также составляют часть изобретения как воплощения согласно изобретению.
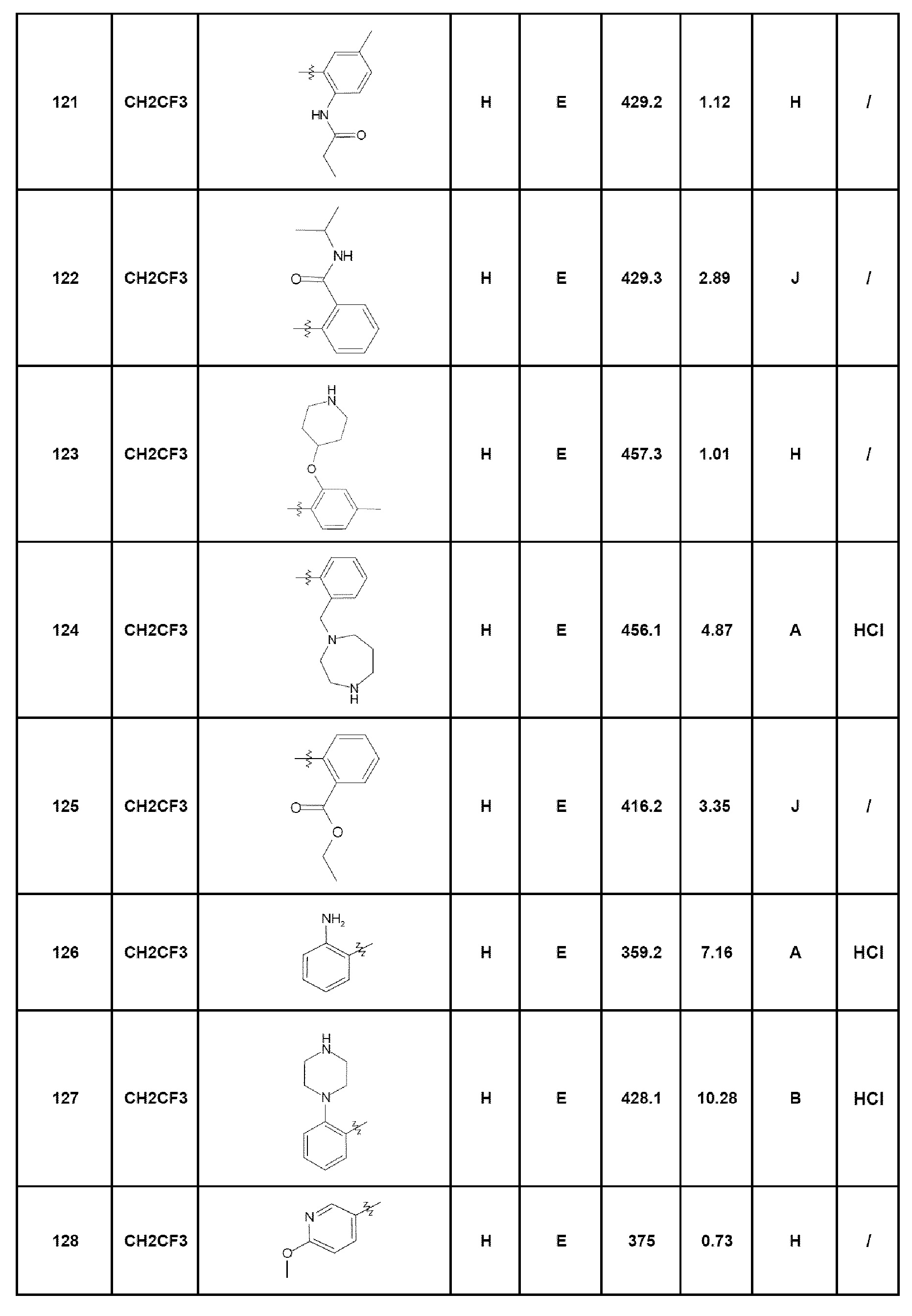
Другую группу соединений, которые являются предметом изобретения, образуют соединения формулы (I), за исключением соединений, перечисленных далее:
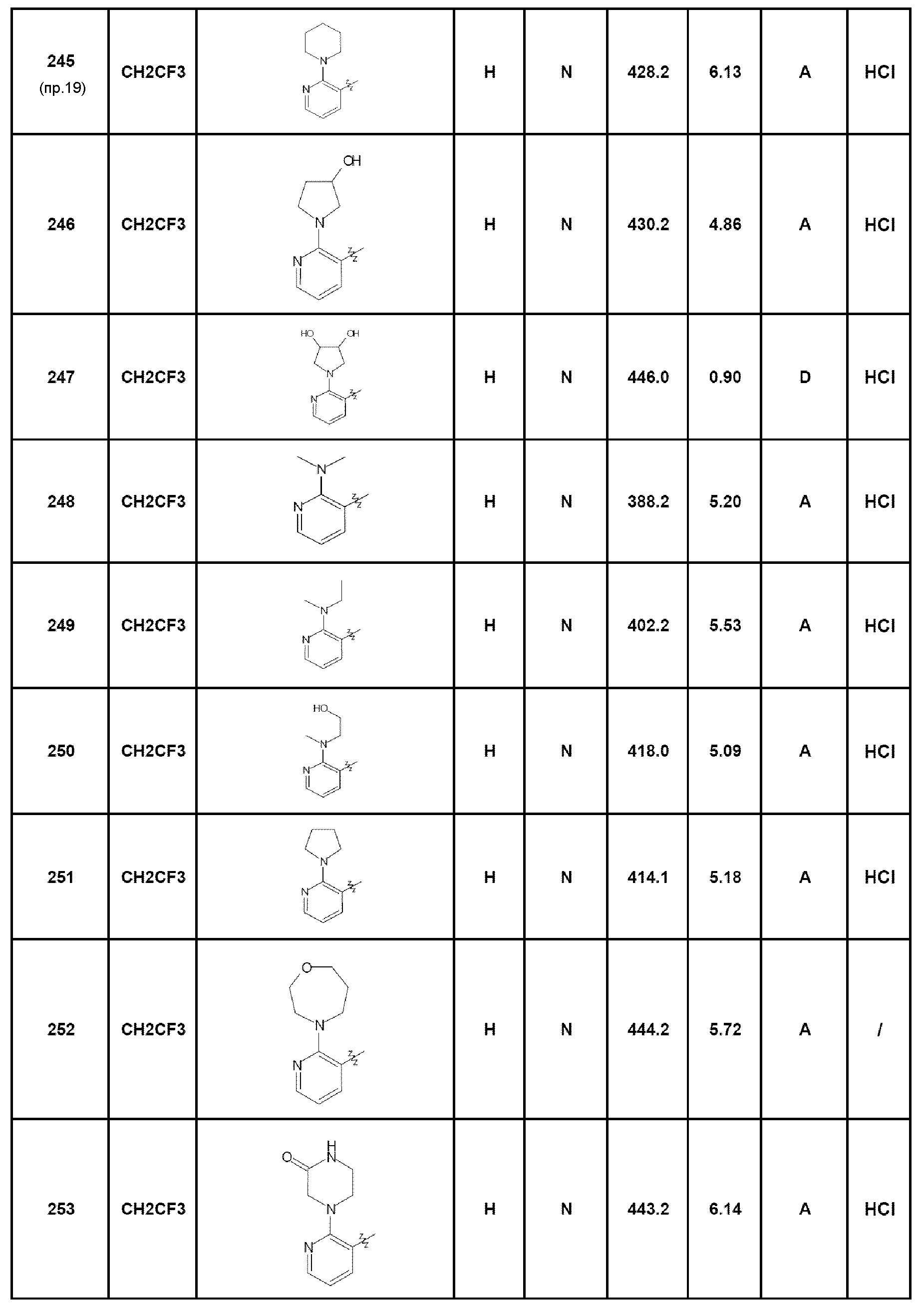
- соединение 2: 7-(2-аминопиридин-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 12: 7-[2-(морфолин-4-илкарбонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 14: 7-(2-морфолин-4-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 16: 7-(2-морфолин-4-илметилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 19: 7-[4-(4-метилпиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 23: 7-(4-диэтиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 30: 7-[4-(пиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 32: 7-(4-диметиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 42: 7-(2-{5-[(пропан-2-иламино)метил]фуран-2-ил}фенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 66: 7-[6-(пиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 68: 7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 70: 7-[2-(пиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 83: 7-[6-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 95: 7-(6-аминопирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 113: изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 114: {2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}амид циклопропанкарбоновой кислоты;
- соединение 115: 7-[2-(1-метил-1Н-имидазол-2-карбонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 116: 7-(4-циклопентилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 117: 7-(4-циклогексилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 118: 7-(2-пропиламинометилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 119: 2-метокси-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}ацетамид;
- соединение 120: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}изобутирамид;
- соединение 121: N-{4-метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}пропионамид;
- соединение 123: 7-[4-метил-2-(пиперидин-4-илокси)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 124: 7-[2-(1,4-диазепан-1-илметил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 125: этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 126: 7-(2-аминофенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 127: 7-(2-пиперазин-1-илфенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
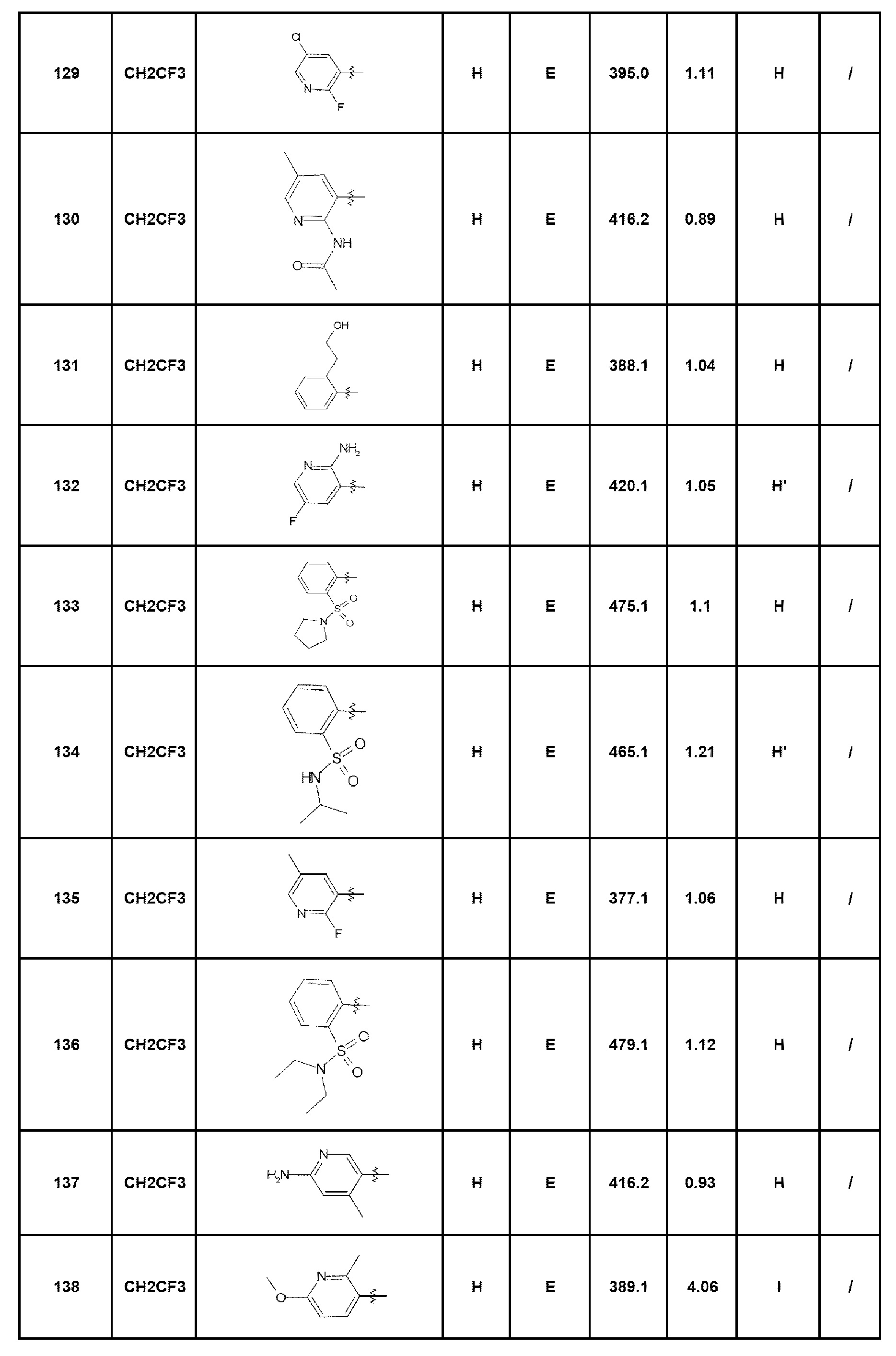
- соединение 172: 7-[2-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 174: 7-(2-циклопропиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 178: метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]никотинат;
- соединение 181: 7-[2-(4-фторфениламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 196: 8-хлор-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 204: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензойная кислота;
- соединение 209: 7-{2-[(4-метил-1,4-диазепан-1-ил)карбонил]фенил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 210: 7-{2-[(4-метилпиперазин-1-ил)карбонил]фенил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 212: N-(3-диметиламинопропил)-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 214: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-[2-(пирид-4-ил)этил]бензамид;
- соединение 218: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-(пирид-3-илметил)бензамид;
- соединение 219: N-этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-(пирид-4-илметил)бензамид;
- соединение 223: N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 224: 3-диметиламино-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-7-ил]фенил}пропионамид;
- соединение 225: 4-(диметиламино)-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}бутанамид;
- соединение 230: 2-(3-хлорфенил)-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 231: 2-(2,4-дихлорфенил)-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 232: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид;
- соединение 233: 2-(диметиламино)-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}этансульфонамид;
- соединение 234: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}-1-фенилметансульфонамид;
- соединение 235: 3-хлор-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}бензолсульфонамид;
- соединение 236: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}метансульфонамид;
- соединение 237: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-1-фенилметансульфонамид;
- соединение 238: 3-хлор-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}бензолсульфонамид;
- соединение 240: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-феноксибензолсульфонамид.
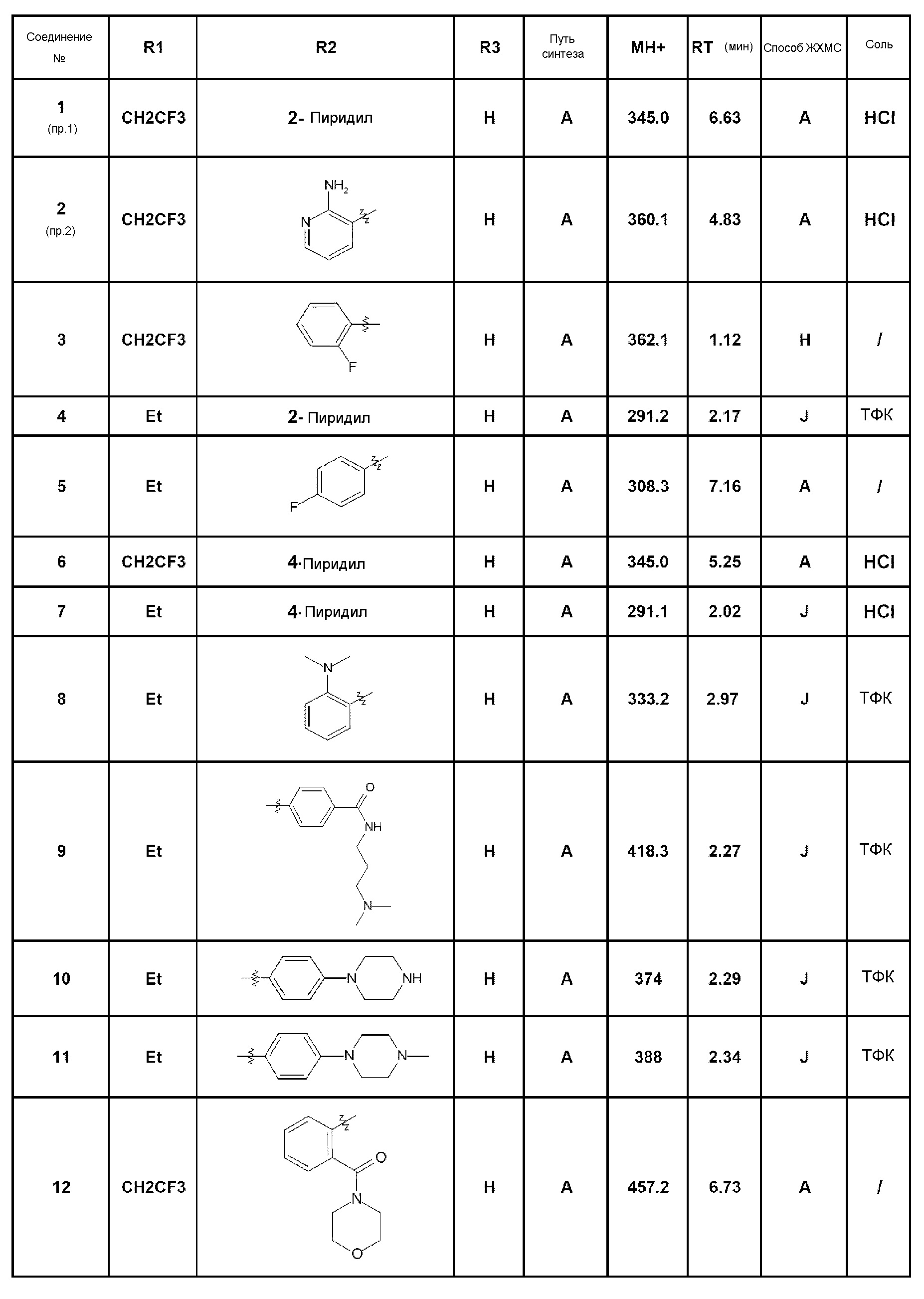
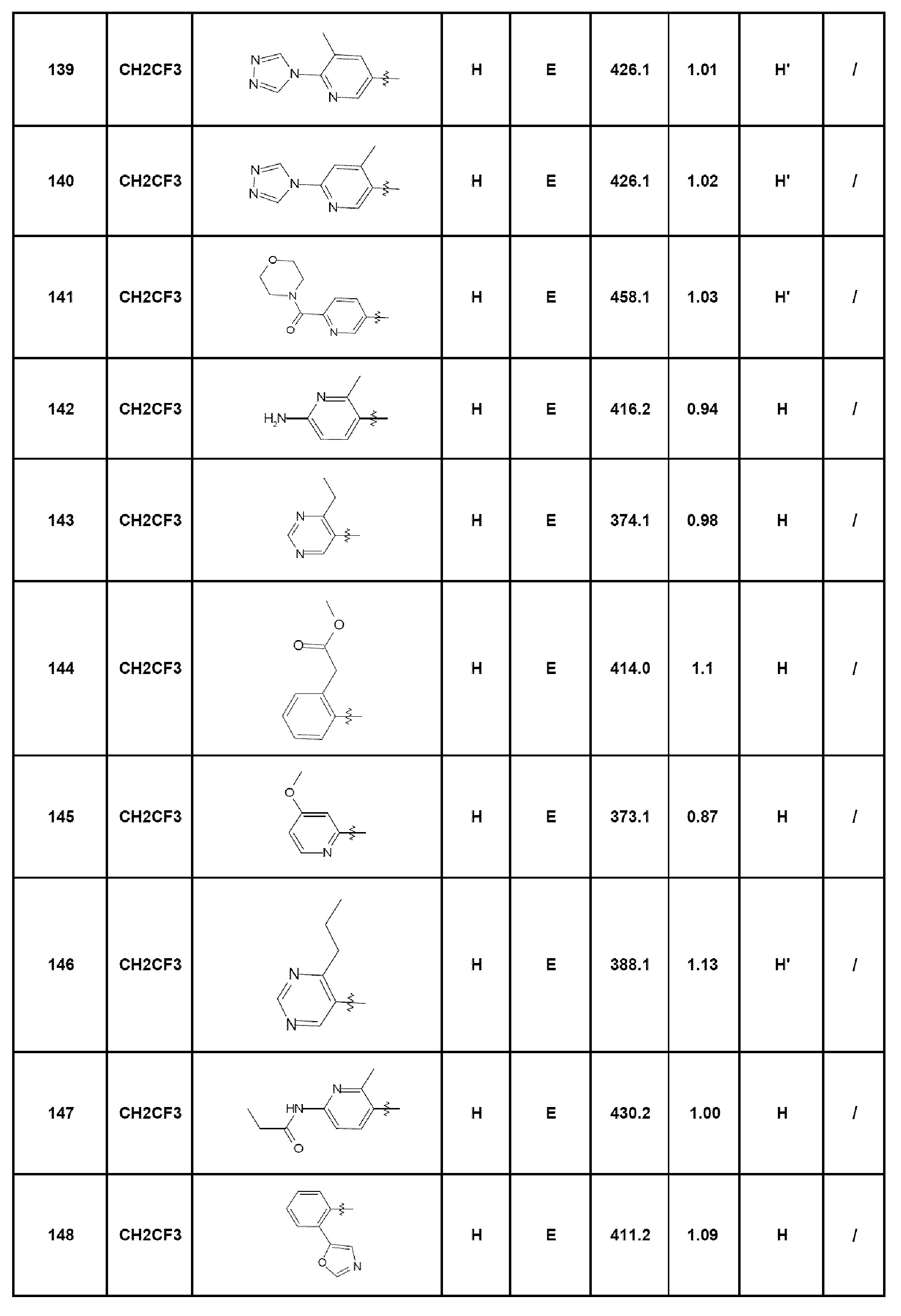
Из соединений формулы (I), которые являются предметом изобретения, можно упомянуть, по существу, следующие соединения:
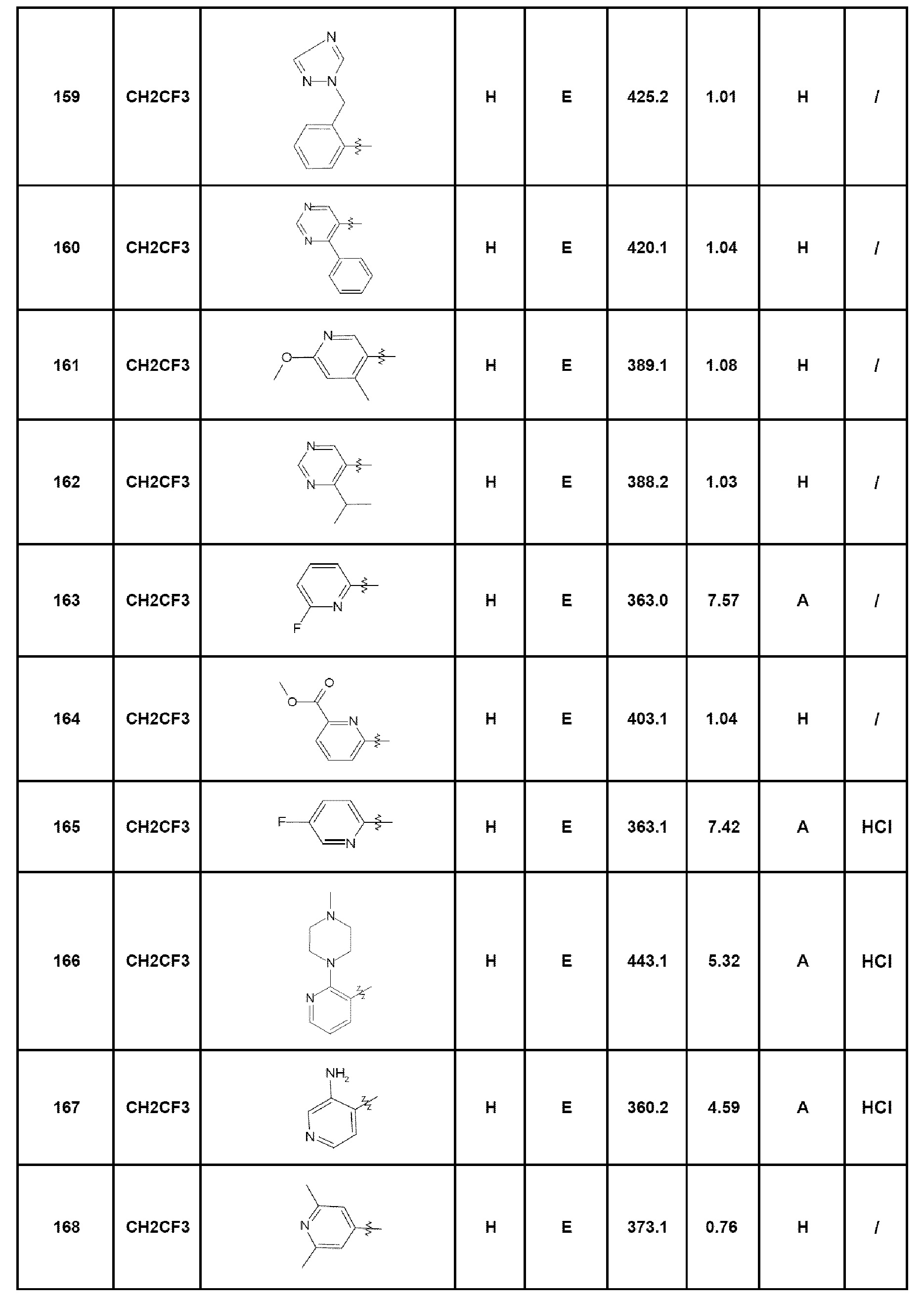
- соединение 1: 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 2: 7-(2-аминопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 3: 7-(2-фторфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 4: 5-этил-7-пирид-2-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 5: 5-этил-7-(4-фторфенил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 6: 7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 7: 5-этил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 8: 7-(2-диметиламинофенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 9: N-(3-диметиламинопропил)-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 10: 5-этил-7-(4-пиперазин-1-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
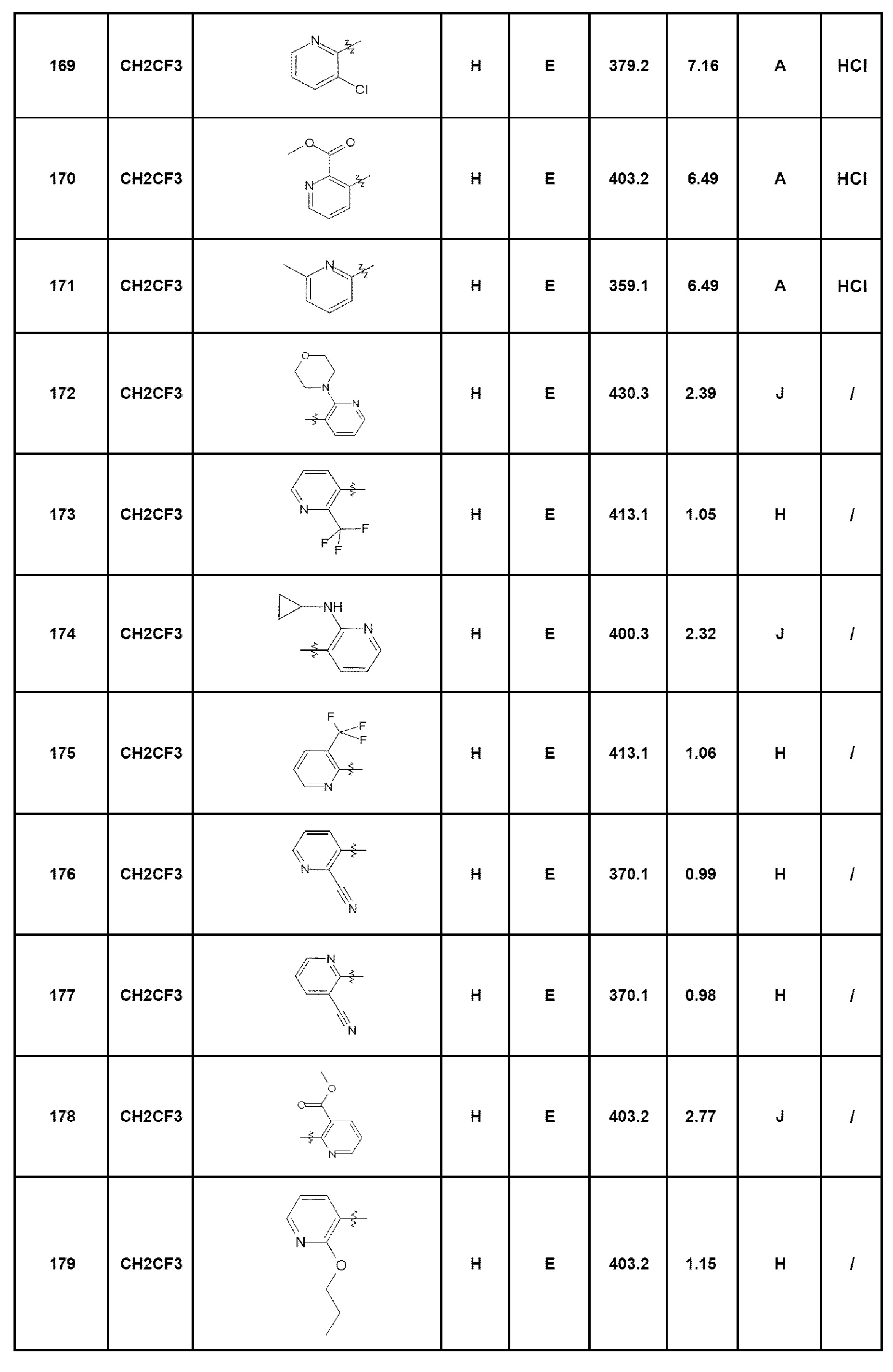
- соединение 11: 5-этил-7-[4-(4-метилпиперазин-1-ил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 12: 7-[2-(морфолин-4-илкарбонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
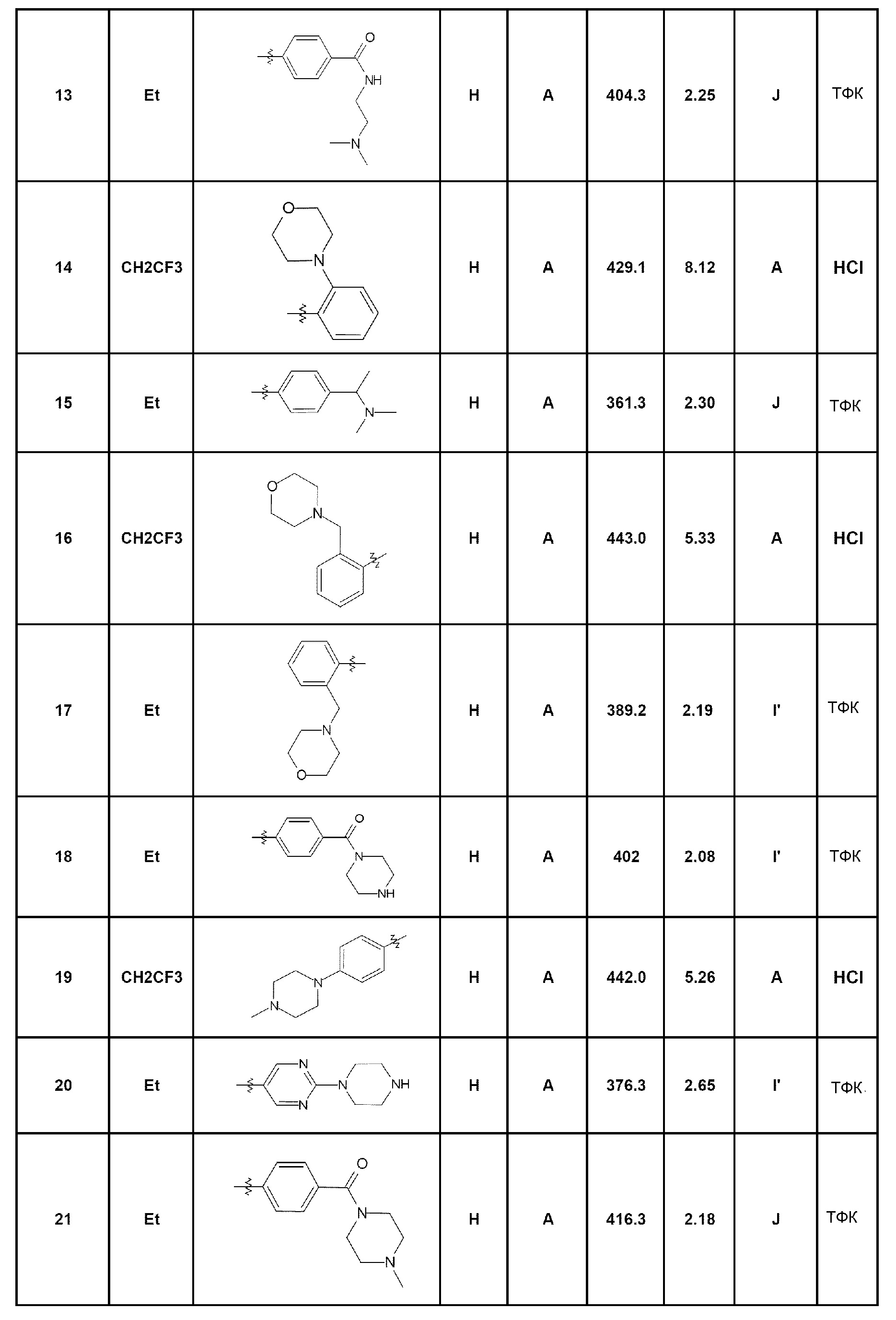
- соединение 13: N-(2-диметиламиноэтил)-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 14: 7-(2-морфолин-4-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 15: 7-[4-(1-диметиламиноэтил)фенил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 16: 7-(2-морфолин-4-илметилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 17: 5-этил-7-(2-морфолин-4-илметилфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 18: 5-этил-7-[4-(пиперазин-1-карбонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 19: 7-[4-(4-метилпиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 20: 5-этил-7-(2-пиперазин-1-илпиримидин-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 21: 5-этил-7-[4-(4-метилпиперазин-1-карбонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
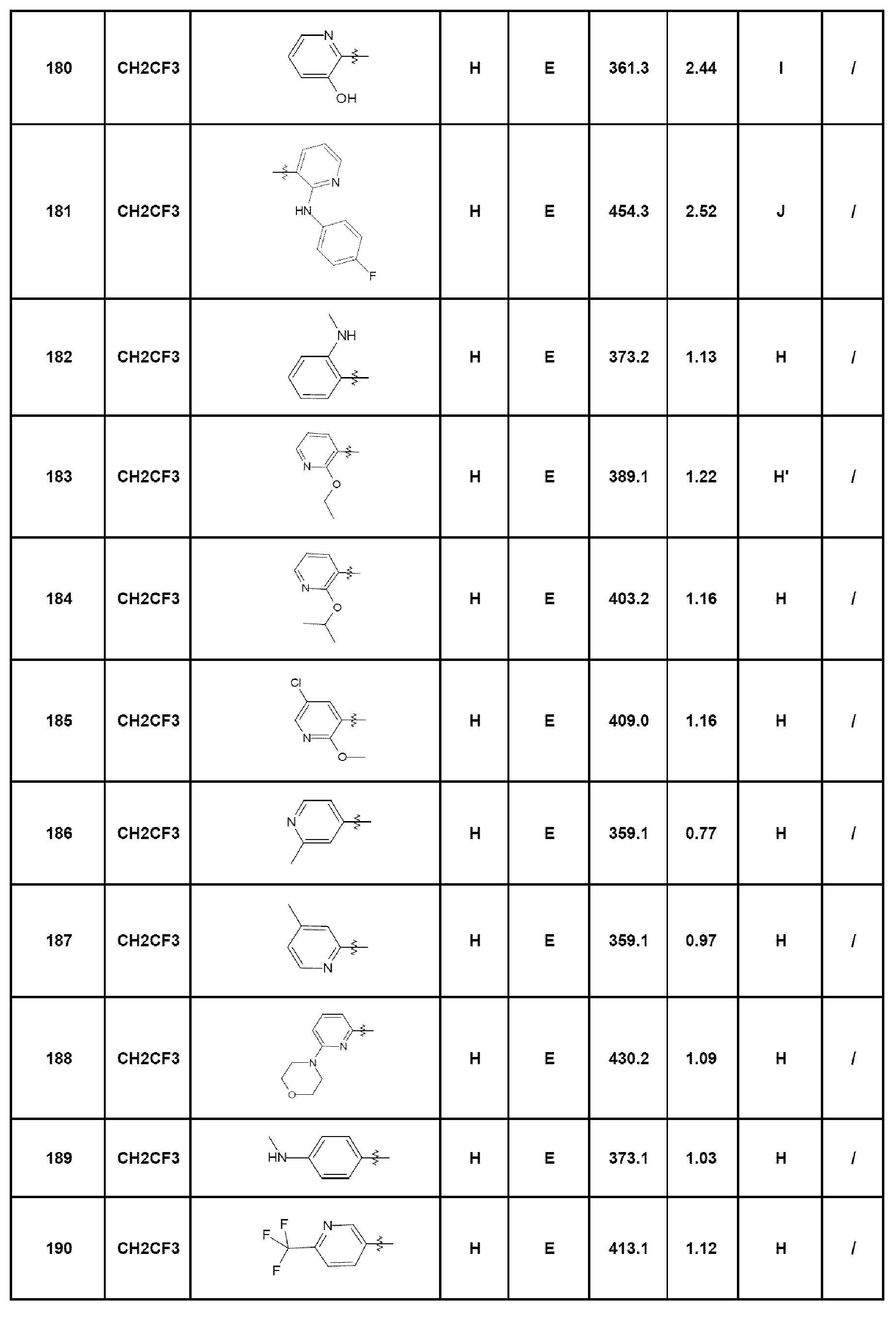
- соединение 22: 5-этил-7-[4-(1-пирролидин-1-илэтил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 23: 7-(4-диэтиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 24: 7-(4-амино-2-метилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 25: 7-(4-морфолин-4-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 26: 5-этил-7-(4-морфолин-4-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 27: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-2-фтор-N-метилбензамид;
- соединение 28: 5-этил-7-(2-фтор-5-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 29: 7-[3-хлор-4-(морфолин-4-карбонил)фенил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 30: 7-[4-(пиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 31: 5-этил-7-[2-(4-метилпиперазин-1-ил)пиримидин-5-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 32: 7-(4-диметиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
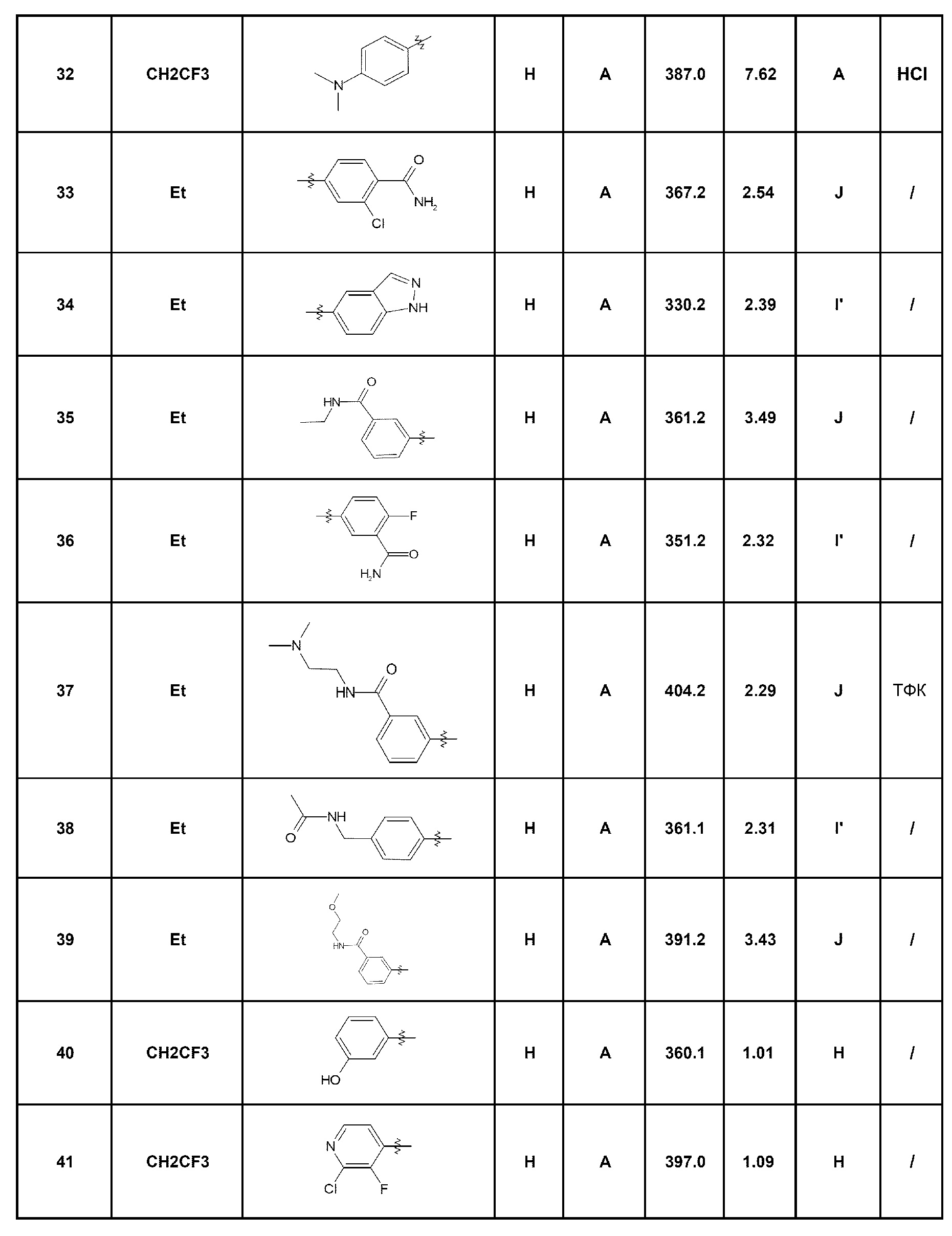
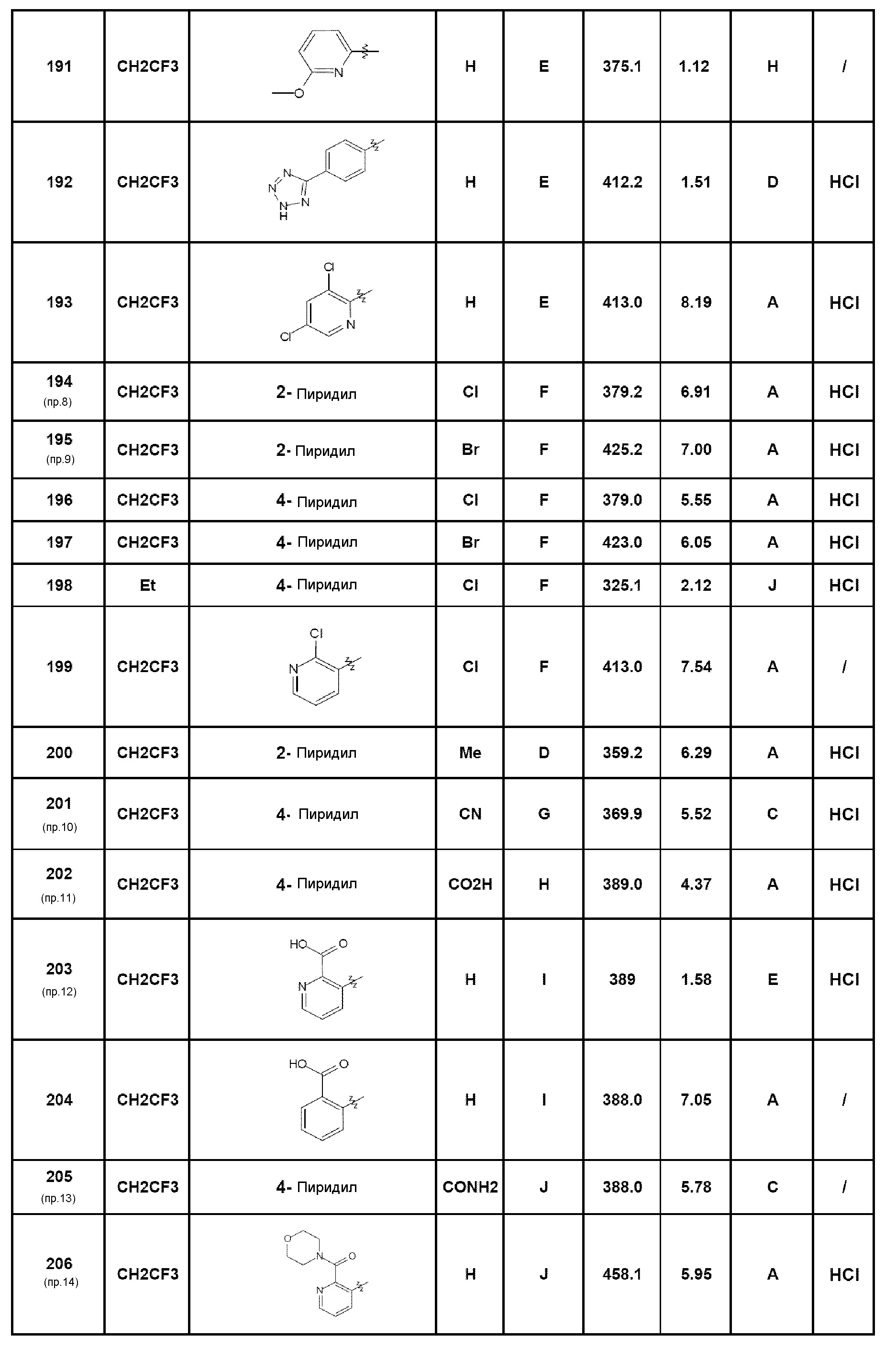
- соединение 33: 2-хлор-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 34: 5-этил-7-(1Н-индазол-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 35: N-этил-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 36: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-2-фторбензамид;
- соединение 37: N-(2-диметиламиноэтил)-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 38: N-[4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензил]ацетамид;
- соединение 39: 3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-N-(2-метоксиэтил)бензамид;
- соединение 40: 7-(3-гидроксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 41: 7-(2-хлор-3-фторпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 42: 7-(2-{5-[(пропан-2-иламино)метил]фуран-2-ил}фенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 43: N-[2-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)фенил]метансульфонамид;
- соединение 44: 7-(2-аминофенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 45: 5-этил-7-(3-морфолин-4-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 46: N-[2-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)фенил]ацетамид;
- соединение 47: 5-этил-7-(2-гидроксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 48: 5-этил-7-[4-(морфолин-4-сульфонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 49: 7-(2-гидроксиметил-4-метоксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 50: 5-этил-7-(3-пиразол-1-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 51: 5-этил-7-(1Н-индол-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 52: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)тиофен-2-карбонитрил;
- соединение 53: 7-(3-хлор-2-гидроксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 54: 5-этил-7-(2-гидрокси-3-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 55: метил-3-амино-4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 56: 5-этил-7-(4-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-7-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 57: 7-(2,5-дихлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 58: 7-(2-хлор-5-метоксифенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 59: N-(3-диметиламинопропил)-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 60: 5-этил-7-(4-фтор-2-гидроксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 61: 5-этил-7-(2-фтор-4-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 62: 7-(4-аминометилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 63: 5-этил-7-(2-фтор-3-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 64: 7-(2-диметиламинометилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 65: 4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензойная кислота;
- соединение 66: 7-[6-(пиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 67: 5-этил-7-[6-(пиперазин-1-ил)пирид-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 68: 7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 69: 5-этил-7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 70: 7-[2-(пиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 71: 5-этил-7-(2-пиперазин-1-илпирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 72: 7-(2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 73: 5-этил-7-(2-метилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 74: 7-(2-хлор-6-метилпирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 75: 7-(2-хлор-6-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 76: 7-(2-хлорпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 77: 7-(2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 78: 5-этил-7-(2-фторпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 79: 7-(6-хлор-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 80: 7-(2-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 81: 5-этил-7-(2-метоксипирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 82: 7-(6-хлор-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 83: 7-[6-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 84: 7-[6-(3-диметиламинопропокси)пирид-3-ил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 85: 5-этил-7-хинолин-8-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 86: 7-(6-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 87: 5-этил-7-хинолин-6-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 88: 7-(6-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 89: 7-(6-хлор-5-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 90: 5-этил-7-(3-фторпирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 91: 7-(3-хлорпирид-4-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 92: 5-этил-7-(6-фтор-5-метилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 93: 7-(2-этоксипирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 94: 5-этил-7-(5-метоксипирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 95: 7-(6-аминопирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 96: 5-этил-7-пирид-3-ил-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 97: 7-(2-хлор-6-изопропилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 98: 7-(5-хлор-2-метоксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 99: 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 100: 5-этил-7-(пирид-3-илокси)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 101: 7-(пирид-3-иламино)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 102: 5-(2,2-дифторэтил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 103: 5-циклопропилметил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 104: 5-пропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 105: 5-(2,2-дифторциклопропилметил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 106: 5-(2-фторэтил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 107: 5-изопропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 108: 5-циклопропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 109: 8-фтор-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 110: 7-(2-хлорпирид-3-ил)-8-метил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 111: 7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 112: 7-[2-(диметиламино)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
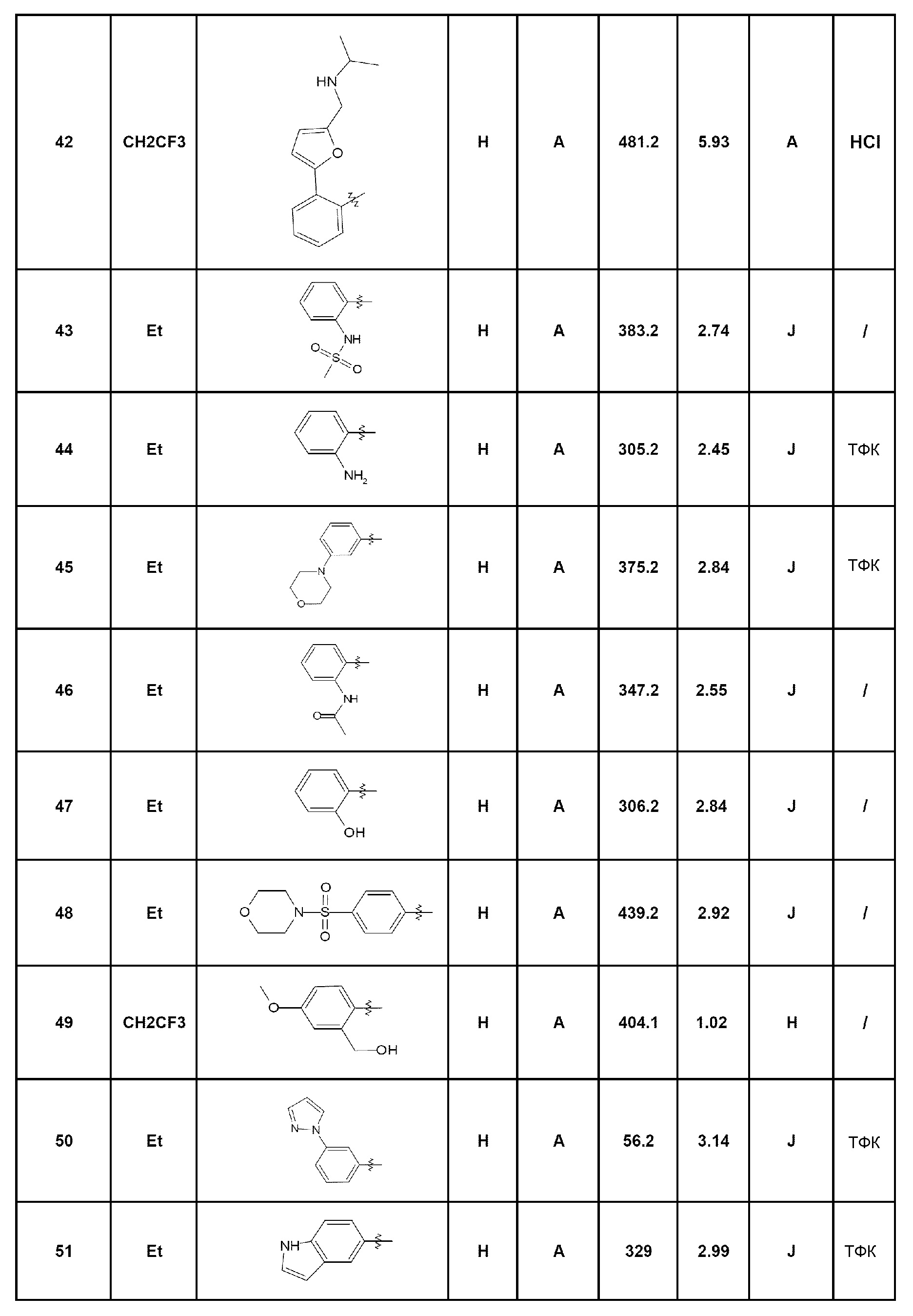
- соединение 113: изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 114: {2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}амид циклопропанкарбоновой кислоты;
- соединение 115: 7-[2-(1-метил-1Н-имидазол-2-карбонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 116: 7-(4-циклопентилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 117: 7-(4-циклогексилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 118: 7-(2-пропиламинометилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 119: 2-метокси-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}ацетамид;
- соединение 120: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}изобутирамид;
- соединение 121: N-{4-метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}пропионамид;
- соединение 122: N-изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 123: 7-[4-метил-2-(пиперидин-4-илокси)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 124: 7-[2-(1,4-диазепан-1-илметил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 125: этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 126: 7-(2-аминофенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 127: 7-(2-пиперазин-1-илфенил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 128: 7-(6-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 129: 7-(5-хлор-2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 130: N-{5-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 131: 7-[2-(2-гидроксиэтил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 132: 7-(2-амино-5-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 133: 7-[2-(пирролидин-1-сульфонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 134: N-изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензолсульфонамид;
- соединение 135: 7-(2-фтор-5-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 136: N,N-диэтил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензолсульфонамид;
- соединение 137: 7-(6-амино-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 138: 7-(6-метокси-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 139: 7-(5-метил-6-[1,2,4]триазол-4-илпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 140: 7-(4-метил-6-[1,2,4]триазол-4-илпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 141: 7-[6-(морфолин-4-карбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 142: 7-(6-амино-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 143: 7-(4-этилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 144: метил-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}ацетат;
- соединение 145: 7-(4-метоксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 146: 7-(4-пропилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 147: N-{6-метил-5-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}пропионамид;
- соединение 148: 7-(2-оксазол-5-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
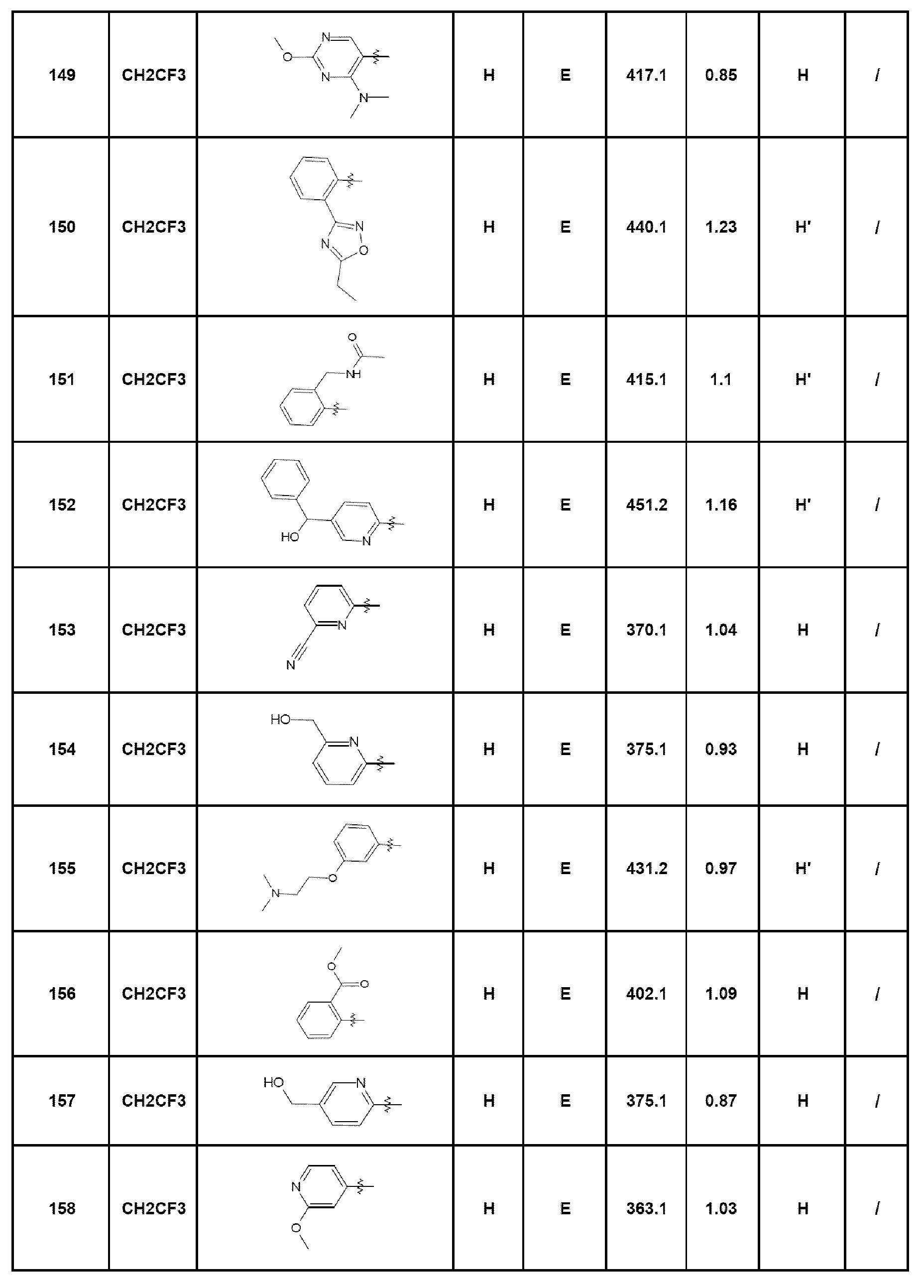
- соединение 149: 7-(4-диметиламино-2-метоксипиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 150: 7-[2-(5-этил[1,2,4]оксадиазол-3-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 151: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензил}ацетамид;
- соединение 152: 7-[5-(гидроксифенилметил)пирид-2-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 153: 6-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 154: 7-(6-гидроксиметилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 155: 7-[3-(2-диметиламиноэтокси)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
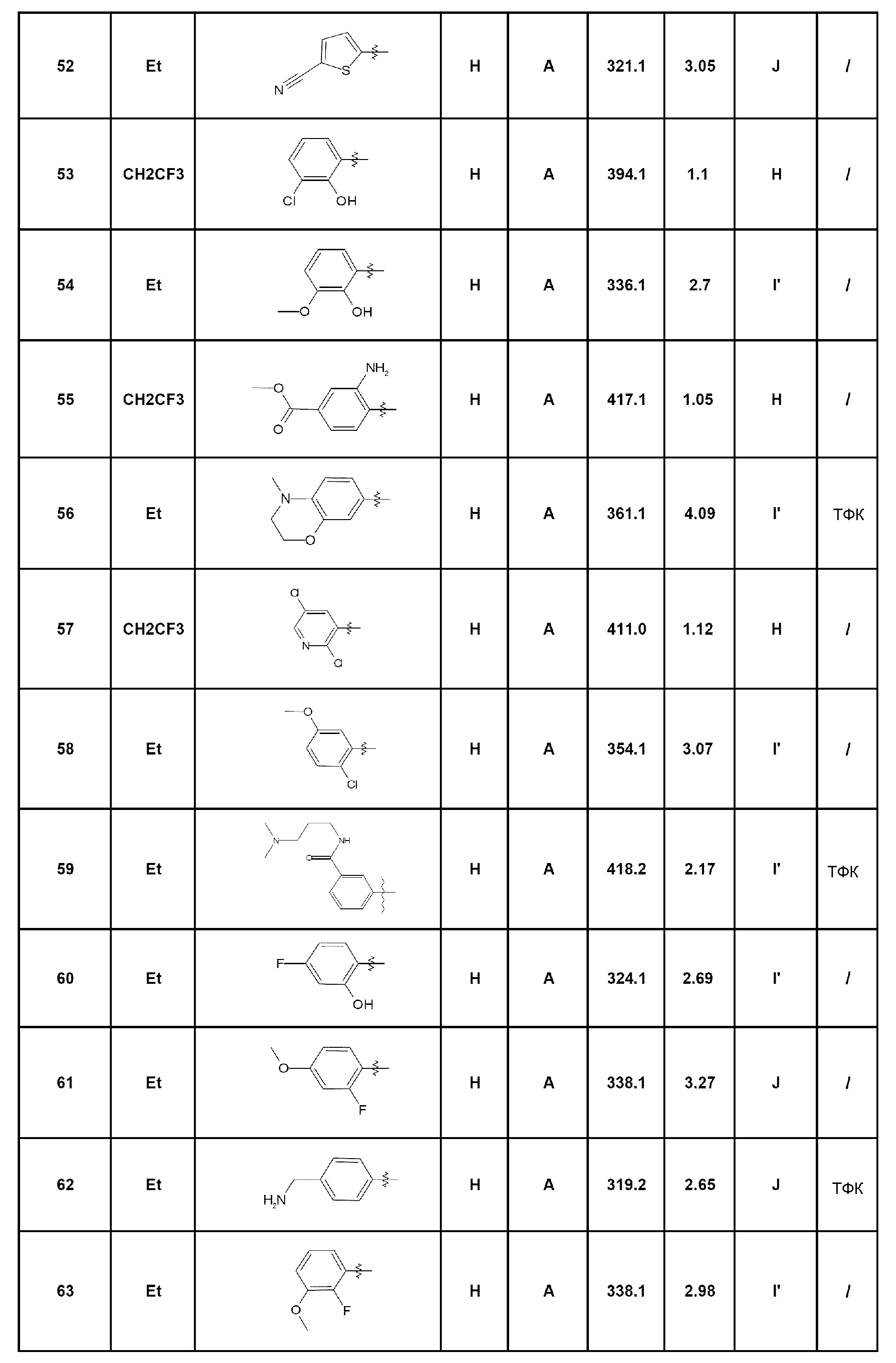
- соединение 156: метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 157: 7-(5-гидроксиметилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 158: 7-(2-метоксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 159: 7-(2-[1,2,4]триазол-1-илметилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 160: 7-(4-фенилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 161: 7-(6-метокси-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 162: 7-(4-изопропилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 163: 7-(6-фторпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 164: метил-6-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксилат;
- соединение 165: 7-(5-фторпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 166: 7-[2-(4-метилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 167: 7-(3-аминопирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 168: 7-(2,6-диметилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 169: 7-(3-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 170: метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксилат;
- соединение 171: 7-(6-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 172: 7-[2-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 173: 5-(2,2,2-трифторэтил)-7-(2-трифторметилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 174: 7-(2-циклопропиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 175: 5-(2,2,2-трифторэтил)-7-(3-трифторметилпирид-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 176: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 177: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-3-карбонитрил;
- соединение 178: метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]никотинат;
- соединение 179: 7-(2-пропоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 180: 7-(3-гидроксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 181: 7-[2-(4-фторфениламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 182: 7-(2-метиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 183: 7-(2-этоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 184: 7-(2-изопропоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 185: 7-(5-хлор-2-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 186: 7-(2-метилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 187: 7-(4-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 188: 7-(6-морфолин-4-илпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 189: 7-(4-метиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 190: 5-(2,2,2-трифторэтил)-7-(6-трифторметилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 191: 7-(6-метоксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 192: 7-[4-(2Н-тетразол-5-ил)фенил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 193: 7-(3,5-дихлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 194: 8-хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 195: 8-бром-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 196: 8-хлор-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 197: 8-бром-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 198: 8-хлор-5-этил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 199: 8-хлор-7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 200: 8-метил-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 201: 4-оксо-7-пирид-4-ил-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-8-карбонитрил;
- соединение 202: 4-оксо-7-пирид-4-ил-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-8-карбоновая кислота;
- соединение 203: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновая кислота;
- соединение 204: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензойная кислота;
- соединение 205: 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбоксамид;
- соединение 206: 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 207: N-[2-(диметиламино)этил]-N-метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 208: N-(2-диметиламиноэтил)-N-этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 209: 7-{2-[(4-метил-1,4-диазепан-1-ил)карбонил]фенил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 210: 7-{2-[(4-метилпиперазин-1-ил)карбонил]фенил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 211: N-(3-карбамоилфенил)-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 212: N-(3-диметиламинопропил)-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 213: N,N-диметил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 214: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-[2-(пирид-4-ил)этил]бензамид;
- соединение 215: N-[2-(диметиламино)этил]-N-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 216: 7-[2-(1,4-оксазепан-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 217: N-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 218: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-(пирид-3-илметил)бензамид;
- соединение 219: N-этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]-N-(пирид-4-илметил)бензамид;
- соединение 220: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 221: N-[2-(диметиламино)этил]-N-этил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 222: 7-[2-((2S,6R)-2,6-диметилморфолин-4-карбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 223: N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 224: 3-диметиламино-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-7-ил]фенил}пропионамид;
- соединение 225: 4-(диметиламино)-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}бутанамид;
- соединение 226: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 227: N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}циклопропанкарбоксамид;
- соединение 228: 2-метокси-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-фенилацетамид;
- соединение 229: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-фенилпропионамид;
- соединение 230: 2-(3-хлорфенил)-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 231: 2-(2,4-дихлорфенил)-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 232: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид;
- соединение 233: 2-(диметиламино)-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}этансульфонамид;
- соединение 234: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}-1-фенилметансульфонамид;
- соединение 235: 3-хлор-N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}бензолсульфонамид;
- соединение 236: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}метансульфонамид;
- соединение 237: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-1-фенилметансульфонамид;
- соединение 238: 3-хлор-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}бензолсульфонамид;
- соединение 239: N-(4-метокси-3-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-илсульфамоил}бензил)ацетамид;
- соединение 240: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-феноксибензолсульфонамид;
- соединение 241: N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 242: N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}циклопропанкарбоксамид;
- соединение 243: 7-[2-(метиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 244: 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 245: 7-(3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-3’-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 246: 7-[2-(3-гидроксипирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 247: 7-[2-(3,4-дигидроксипирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 248: 7-[2-(диметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 249: 7-{2-[этил(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 250: 7-{2-[(2-гидроксиэтил)(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 251: 7-[2-(пирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 252: 7-[2-(1,4-оксазепан-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 253: 7-[2-(3-оксопиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
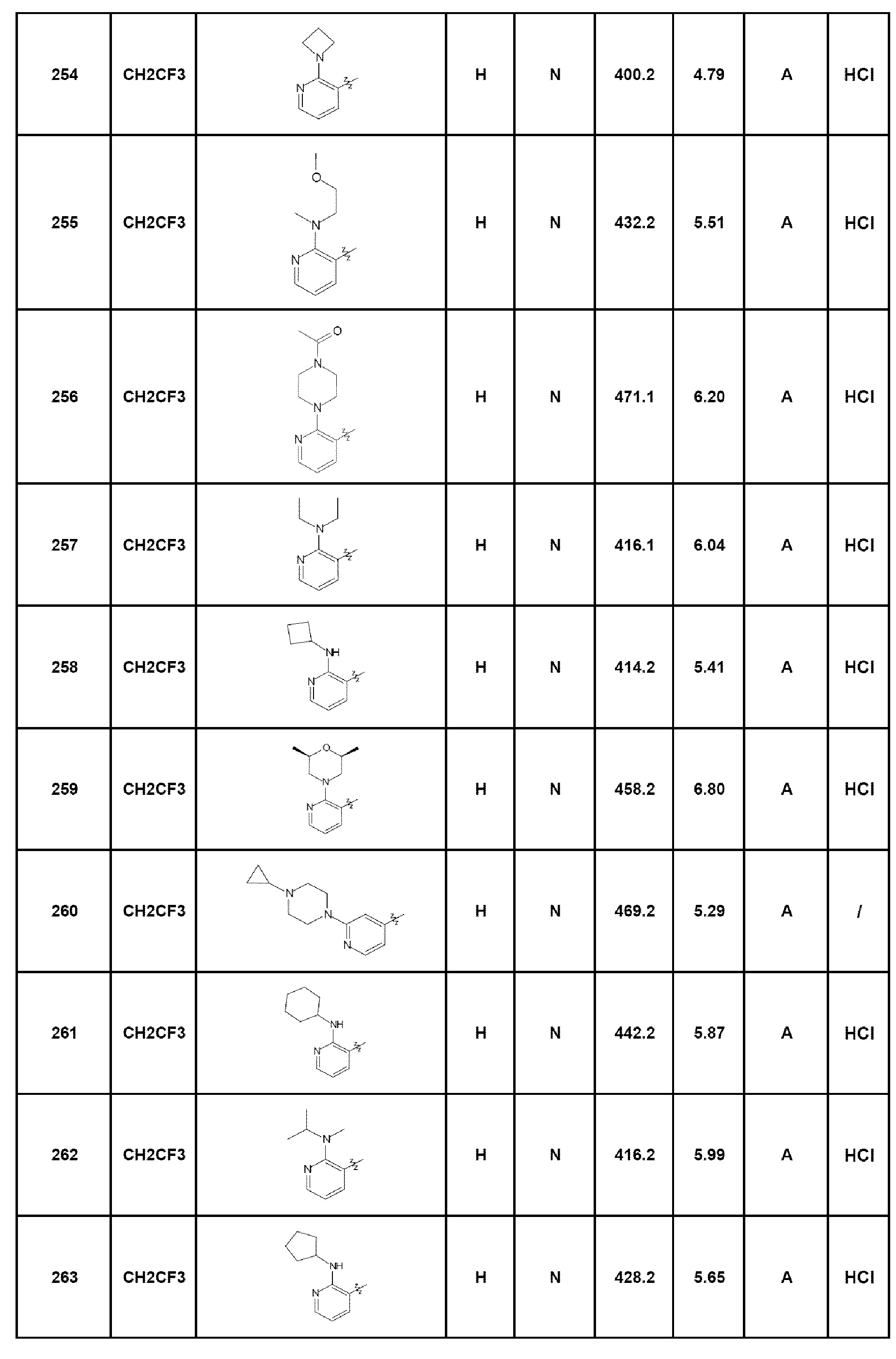
- соединение 254: 7-[2-(азетидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 255: 7-{2-[(2-метоксиэтил)метиламино]пирид-3-ил}-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 256: 7-[2-(4-ацетилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 257: 7-[2-(диэтиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 258: 7-[2-(циклобутиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 259: 7-[2-(2,6-диметилморфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 260: 7-[2-(4-циклопропилпиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 261: 7-(2-циклогексиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 262: 7-[2-(изопропилметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 263: 7-(2-циклопентиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 264: 7-(6-пирролидин-1-илпирид-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
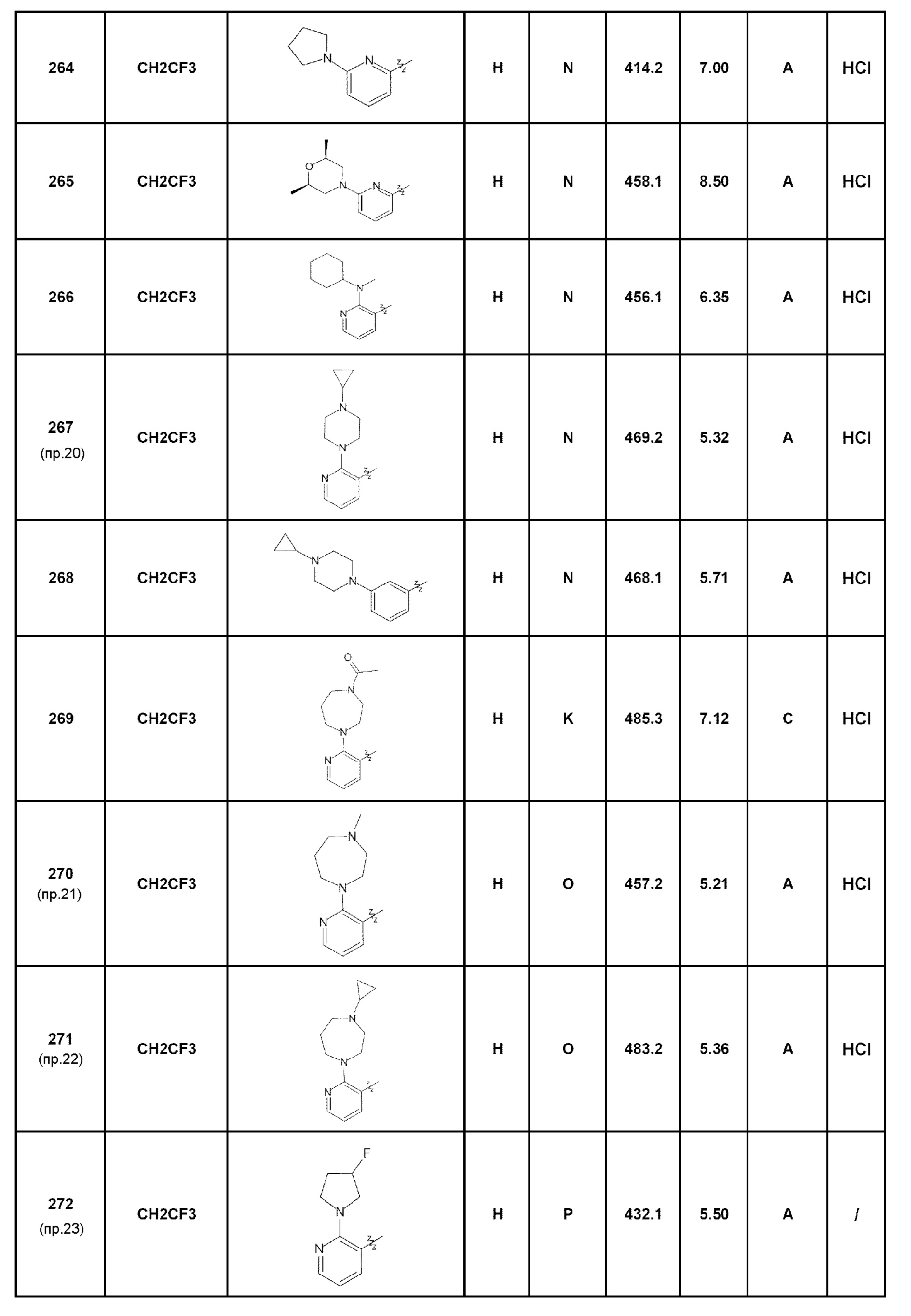
- соединение 265: 7-[6-(2,6-диметилморфолин-4-ил)пирид-2-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 266: 7-{2-[циклогексил(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 267: 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 268: 7-[3-(4-циклопропилпиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 269: 7-[2-(4-ацетил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 270: 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 271: 7-[2-(4-циклопропил[1,4]диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 272: 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 273: 7-[2-(4-фторпиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 274: 7-(2-гидроксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
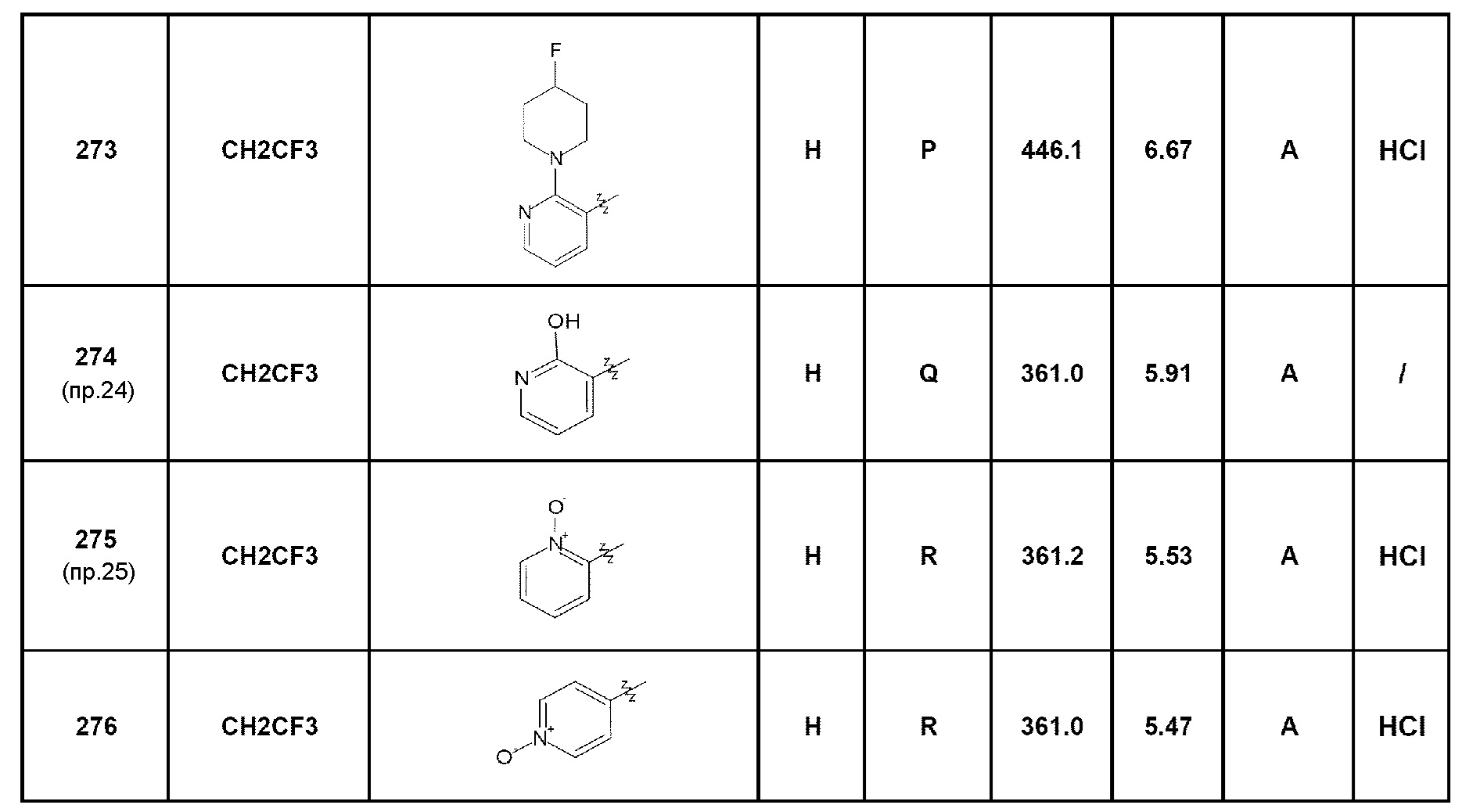
- соединение 275: 7-(1-оксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 276: 7-(1-оксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
в форме основания или соли присоединения кислоты, и также в форме гидрата.
Среди соединений формулы (I), которые являются предметом изобретения, можно назвать, в частности, следующие соединения:
- соединение 1: 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 3: 7-(2-фторфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 4: 5-этил-7-пирид-2-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 5: 5-этил-7-(4-фторфенил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 6: 7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 7: 5-этил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 8: 7-(2-диметиламинофенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 9: N-(3-диметиламинопропил)-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 10: 5-этил-7-(4-пиперазин-1-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 11: 5-этил-7-[4-(4-метилпиперазин-1-ил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 13: N-(2-диметиламиноэтил)-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 15: 7-[4-(1-диметиламиноэтил)фенил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 17: 5-этил-7-(2-морфолин-4-илметилфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 18: 5-этил-7-[4-(пиперазин-1-карбонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 20: 5-этил-7-(2-пиперазин-1-илпиримидин-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 21: 5-этил-7-[4-(4-метилпиперазин-1-карбонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 22: 5-этил-7-[4-(1-пирролидин-1-илэтил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 24: 7-(4-амино-2-метилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 25: 7-(4-морфолин-4-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 26: 5-этил-7-(4-морфолин-4-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 27: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-2-фтор-N-метилбензамид;
- соединение 28: 5-этил-7-(2-фтор-5-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 29: 7-[3-хлор-4-(морфолин-4-карбонил)фенил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 31: 5-этил-7-[2-(4-метилпиперазин-1-ил)пиримидин-5-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 33: 2-хлор-4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 34: 5-этил-7-(1Н-индазол-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 35: N-этил-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 36: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-2-фторбензамид;
- соединение 37: N-(2-диметиламиноэтил)-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 38: N-[4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензил]ацетамид;
- соединение 39: 3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)-N-(2-метоксиэтил)бензамид;
- соединение 40: 7-(3-гидроксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 41: 7-(2-хлор-3-фторпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 43: N-[2-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)фенил]метансульфонамид;
- соединение 44: 7-(2-аминофенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 45: 5-этил-7-(3-мофролин-4-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 46: N-[2-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)фенил]ацетамид;
- соединение 47: 5-этил-7-(2-гидроксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 48: 5-этил-7-[4-(морфолин-4-сульфонил)фенил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 49: 7-(2-гидроксиметил-4-метоксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 50: 5-этил-7-(3-пиразол-1-илфенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 51: 5-этил-7-(1Н-индол-5-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 52: 5-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)тиофен-2-карбонитрил;
- соединение 53: 7-(3-хлор-2-гидроксифенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 54: 5-этил-7-(2-гидрокси-3-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 55: метил-3-амино-4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 56: 5-этил-7-(4-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-7-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 57: 7-(2,5-дихлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 58: 7-(2-хлор-5-метоксифенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 59: N-(3-диметиламинопропил)-3-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензамид;
- соединение 60: 5-этил-7-(4-фтор-2-гидроксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 61: 5-этил-7-(2-фтор-4-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 62: 7-(4-аминометилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 63: 5-этил-7-(2-фтор-3-метоксифенил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 64: 7-(2-диметиламинометилфенил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 65: 4-(5-этил-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил)бензойная кислота;
- соединение 67: 5-этил-7-[6-(пиперазин-1-ил)пирид-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 69: 5-этил-7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 71: 5-этил-7-(2-пиперазин-1-илпирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 72: 7-(2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 73: 5-этил-7-(2-метилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 74: 7-(2-хлор-6-метилпирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 75: 7-(2-хлор-6-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 76: 7-(2-хлорпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 77: 7-(2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 78: 5-этил-7-(2-фторпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 79: 7-(6-хлор-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 80: 7-(2-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 81: 5-этил-7-(2-метоксипирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 82: 7-(6-хлор-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 84: 7-[6-(3-диметиламинопропокси)пирид-3-ил]-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 85: 5-этил-7-хинолин-8-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 86: 7-(6-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 87: 5-этил-7-хинолин-6-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 88: 7-(6-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 89: 7-(6-хлор-5-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 90: 5-этил-7-(3-фторпирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 91: 7-(3-хлорпирид-4-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 92: 5-этил-7-(6-фтор-5-метилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 93: 7-(2-этоксипирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 94: 5-этил-7-(5-метоксипирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 96: 5-этил-7-пирид-3-ил-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 97: 7-(2-хлор-6-изопропилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 98: 7-(5-хлор-2-метоксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 99: 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 100: 5-этил-7-(пирид-3-илокси)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 101: 7-(пирид-3-иламино)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 102: 5-(2,2-дифторэтил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 103: 5-циклопропилметил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 104: 5-пропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 105: 5-(2,2-дифторциклопропилметил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 106: 5-(2-фторэтил)-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 107: 5-изопропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 108: 5-циклопропил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 109: 8-фтор-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 110: 7-(2-хлорпирид-3-ил)-8-метил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 111: 7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 112: 7-[2-(диметиламино)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 122: N-изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 128: 7-(6-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 129: 7-(5-хлор-2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 130: N-{5-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 131: 7-[2-(2-гидроксиэтил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 132: 7-(2-амино-5-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 133: 7-[2-(пирролидин-1-сульфонил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 134: N-изопропил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензолсульфонамид;
- соединение 135: 7-(2-фтор-5-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 136: N,N-диэтил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензолсульфонамид;
- соединение 137: 7-(6-амино-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 138: 7-(6-метокси-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 139: 7-(5-метил-6-[1,2,4]триазол-4-илпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 140: 7-(4-метил-6-[1,2,4]триазол-4-илпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 141: 7-[6-(морфолин-4-карбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 142: 7-(6-амино-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 143: 7-(4-этилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 144: метил-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]фенил}ацетат;
- соединение 145: 7-(4-метоксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 146: 7-(4-пропилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 147: N-{6-метил-5-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}пропионамид;
- соединение 148: 7-(2-оксазол-5-илфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 149: 7-(4-диметиламино-2-метоксипиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 150: 7-[2-(5-этил[1,2,4]оксадиазол-3-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 151: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензил}ацетамид;
- соединение 152: 7-[5-(гидроксифенилметил)пирид-2-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 153: 6-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 154: 7-(6-гидроксиметилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 155: 7-[3-(2-диметиламиноэтокси)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 156: метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензоат;
- соединение 157: 7-(5-гидроксиметилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 158: 7-(2-метоксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 159: 7-(2-[1,2,4]триазол-1-илметилфенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 160: 7-(4-фенилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 161: 7-(6-метокси-4-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 162: 7-(4-изопропилпиримидин-5-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 163: 7-(6-фторпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 164: метил-6-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксилат;
- соединение 165: 7-(5-фторпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 166: 7-[2-(4-метилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 167: 7-(3-аминопирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 168: 7-(2,6-диметилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 169: 7-(3-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 170: метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксилат;
- соединение 171: 7-(6-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 173: 5-(2,2,2-трифторэтил)-7-(2-трифторметилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 175: 5-(2,2,2-трифторэтил)-7-(3-трифторметилпирид-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 176: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 177: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-3-карбонитрил;
- соединение 179: 7-(2-пропоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 180: 7-(3-гидроксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 182: 7-(2-метиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 183: 7-(2-этоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 184: 7-(2-изопропоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 185: 7-(5-хлор-2-метоксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 186: 7-(2-метилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 187: 7-(4-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 188: 7-(6-морфолин-4-илпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 189: 7-(4-метиламинофенил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 190: 5-(2,2,2-трифторэтил)-7-(6-трифторметилпирид-3-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 191: 7-(6-метоксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 192: 7-[4-(2Н-тетразол-5-ил)фенил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 193: 7-(3,5-дихлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 194: 8-хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 195: 8-бром-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 197: 8-бром-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 198: 8-хлор-5-этил-7-пирид-4-ил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 199: 8-хлор-7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 200: 8-метил-7-пирид-2-ил-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 201: 4-оксо-7-пирид-4-ил-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-8-карбонитрил;
- соединение 202: 4-оксо-7-пирид-4-ил-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н,4Н-пиразоло[4,3-c]хинолин-8-карбоновая кислота;
- соединение 203: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновая кислота;
- соединение 204: 2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензойная кислота;
- соединение 205: 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбоксамид;
- соединение 206: 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 207: N-[2-(диметиламино)этил]-N-метил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 208: N-(2-диметиламиноэтил)-N-этил-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 211: N-(3-карбамоилфенил)-2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]бензамид;
- соединение 213: N,N-диметил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 215: N-[2-(диметиламино)этил]-N-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 216: 7-[2-(1,4-оксазепан-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 217: N-метил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 220: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 221: N-[2-(диметиламино)этил]-N-этил-3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксамид;
- соединение 222: 7-[2-((2S,6R)-2,6-диметилморфолин-4-карбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 226: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}ацетамид;
- соединение 227: N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}циклопропанкарбоксамид;
- соединение 228: 2-метокси-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-фенилацетамид;
- соединение 229: N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}-2-фенилпропионамид;
- соединение 238: 3-хлор-N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-ил}бензолсульфонамид;
- соединение 239: N-(4-метокси-3-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-3-илсульфамоил}бензил)ацетамид;
- соединение 241: N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид;
- соединение 242: N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}циклопропанкарбоксамид;
- соединение 243: 7-[2-(метиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 244: 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 245: 7-(3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-3’-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 246: 7-[2-(3-гидроксипирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 247: 7-[2-(3,4-дигидроксипирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 248: 7-[2-(диметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 249: 7-{2-[этил(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 250: 7-{2-[(2-гидроксиэтил)(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 251: 7-[2-(пирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 252: 7-[2-(1,4-оксазепан-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 253: 7-[2-(3-оксопиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 254: 7-[2-(азетидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 255: 7-{2-[(2-метоксиэтил)метиламино]пирид-3-ил}-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 256: 7-[2-(4-ацетилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 257: 7-[2-(диэтиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 258: 7-[2-(циклобутиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 259: 7-[2-(2,6-диметилморфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 260: 7-[2-(4-циклопропилпиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 261: 7-(2-циклогексиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 262: 7-[2-(изопропилметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 263: 7-(2-циклопентиламинопирид-3-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 264: 7-(6-пирролидин-1-илпирид-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 265: 7-[6-(2,6-диметилморфолин-4-ил)пирид-2-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 266: 7-{2-[циклогексил(метил)амино]пирид-3-ил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 267: 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 268: 7-[3-(4-циклопропилпиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 269: 7-[2-(4-ацетил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 270: 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 271: 7-[2-(4-циклопропил[1,4]диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 272: 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 273: 7-[2-(4-фторпиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 274: 7-(2-гидроксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 275: 7-(1-оксипирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 276: 7-(1-оксипирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
в форме основания или соли присоединения кислоты и также в форме гидрата.
Из соединений формулы (I), которые являются предметом изобретения, можно упомянуть, по существу, следующие соединения:
- соединение 1: 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 2: 7-(2-аминопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 6: 7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 19: 7-[4-(4-метилпиперазин-1-ил)фенил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 67: 5-этил-7-[6-(пиперазин-1-ил)пирид-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 68: 7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 69: 5-этил-7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 72: 7-(2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 74: 7-(2-хлор-6-метилпирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 75: 7-(2-хлор-6-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 76: 7-(2-хлорпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 77: 7-(2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 79: 7-(6-хлор-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 83: 7-[6-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 88: 7-(6-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 111: 7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 168: 7-(2,6-диметилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 169: 7-(3-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 171: 7-(6-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 172: 7-[2-(морфолин-4-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 176: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 186: 7-(2-метилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 196: 8-хлор-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 199: 8-хлор-7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 209: 7-{2-[(4-метил-1,4-диазепан-1-ил)карбонил]фенил}-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 232: N-{2-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид;
- соединение 248: 7-[2-(диметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 251: 7-[2-(пирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 257: 7-[2-(диэтиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 273: 7-[2-(4-фторпиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
в форме основания или соли присоединения кислоты и также в форме гидрата.
Из соединений формулы (I), которые являются предметом изобретения, можно упомянуть, по существу, следующие соединения:
- соединение 1: 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 2: 7-(2-аминопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 6: 7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 67: 5-этил-7-[6-(пиперазин-1-ил)пирид-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 69: 5-этил-7-[2-(4-метилпиперазин-1-ил)пирид-4-ил]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 72: 7-(2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 74: 7-(2-хлор-6-метилпирид-3-ил)-5-этил-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 75: 7-(2-хлор-6-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 76: 7-(2-хлорпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 77: 7-(2-фторпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 79: 7-(6-хлор-2-метилпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 88: 7-(6-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 111: 7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 168: 7-(2,6-диметилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 169: 7-(3-хлорпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 171: 7-(6-метилпирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 176: 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбонитрил;
- соединение 186: 7-(2-метилпирид-4-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 199: 8-хлор-7-(2-хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 248: 7-[2-(диметиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 251: 7-[2-(пирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 257: 7-[2-(диэтиламино)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
- соединение 273: 7-[2-(4-фторпиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он;
в форме основания или соли присоединения кислоты и также в форме гидрата.
В тексте данного описания ниже термин «защитная группа PG» обозначает группу, которая может, во-первых, во время синтеза защитить реакционноспособную функциональную группу, такую как выступающий гидроксил или амин, и во-вторых, восстановить исходную реакционноспособную функциональную группу в конце синтеза. Примеры защитных групп и способы введения и удаления защитных групп приводятся в «Protective Groups in Organic Synthesis», Greene et al., 3rd Edition (John Wiley & Sons, Inc., New York).
В тексте данного описания ниже термин «уходящая группа LG» обозначает группу, которую можно легко отщепить от молекулы путем разрушения гетеролитической связи с утратой электронной пары. Такую группу, таким образом, можно легко заменить на другую группу, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогеногруппы или активированная гидроксильная группа, такая как мезильная, тозильная, трифлатная, ацетильная и т.д. Примеры уходящих групп и ссылки для работы с ними приводятся в «Advanced Organic Chemistry», J. March, 3rd Edition, Wiley Interscience, pp. 310-316.
В соответствии с изобретением, соединения формулы (I) можно получить согласно способам, указанным далее.
Если не указано иное, R1, R2 и R3 имеют значения, указанные ранее.
Если не указано иное, группа Hal представляет собой атом брома, йода или хлора, более конкретно, атом брома или йода.
Схема 1: получение промежуточного соединения 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она формулы (VI)
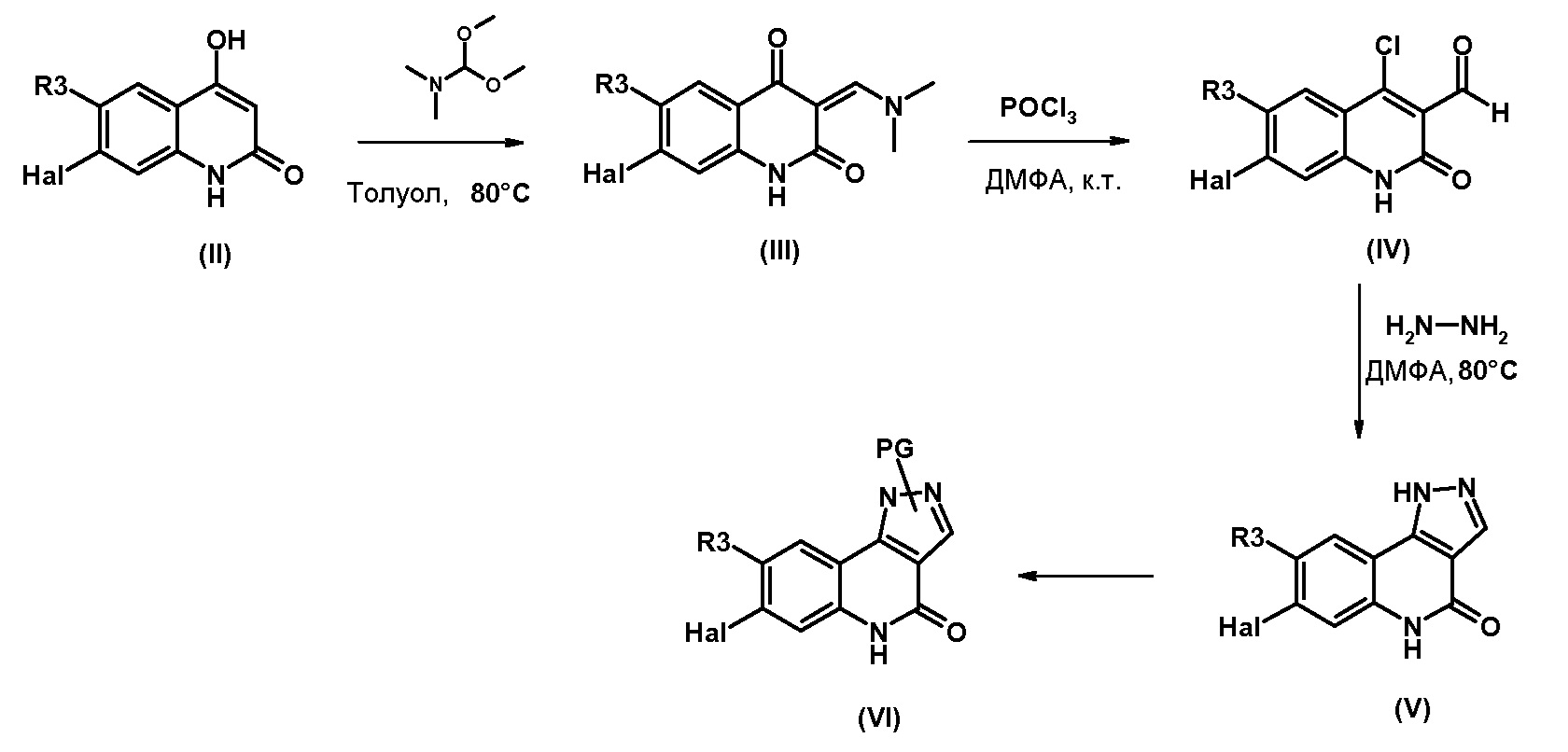
Схема 1 иллюстрирует синтез основного промежуточного соединения формулы (VI). Взаимодействие производного 4-гидроксихинолин-2(1Н)-она формулы (II) [полученного согласно или после адаптации способов, описанных в Bioorganic & Medical Chemistry, 2005, 13(4), 1069-1081] с диметилацеталем N,N-диметилформамида (DMFDMA) дает енамин формулы (III) [согласно адаптации способа, описанного в Tetrahedron, 2004, 60(39), 8633-8644]. Обработка соединения (III) POCl3 при комнатной температуре в инертном растворителе, таком как ДМФА, дает, после водной обработки, производное 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегида формулы (IV). Термин «комнатная температура» обозначает температуру от 5 до 25°С. Конденсация гидразина с хлоральдегидом формулы (IV) в растворителе, таком как ДМФА, ТГФ или этанол, дает 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он формулы (V) при работе при температуре от комнатной температуры до 100°С, и предпочтительно, при нагревании при 80°С. В пиразол можно селективно ввести защитную группу, которая устойчива в щелочной среде, такую как SEM или ТНР, и получить промежуточное соединение формулы (VI).
Схема 2 (пути А и В): получение соединений формулы (I) из промежуточного соединения формулы (VI)
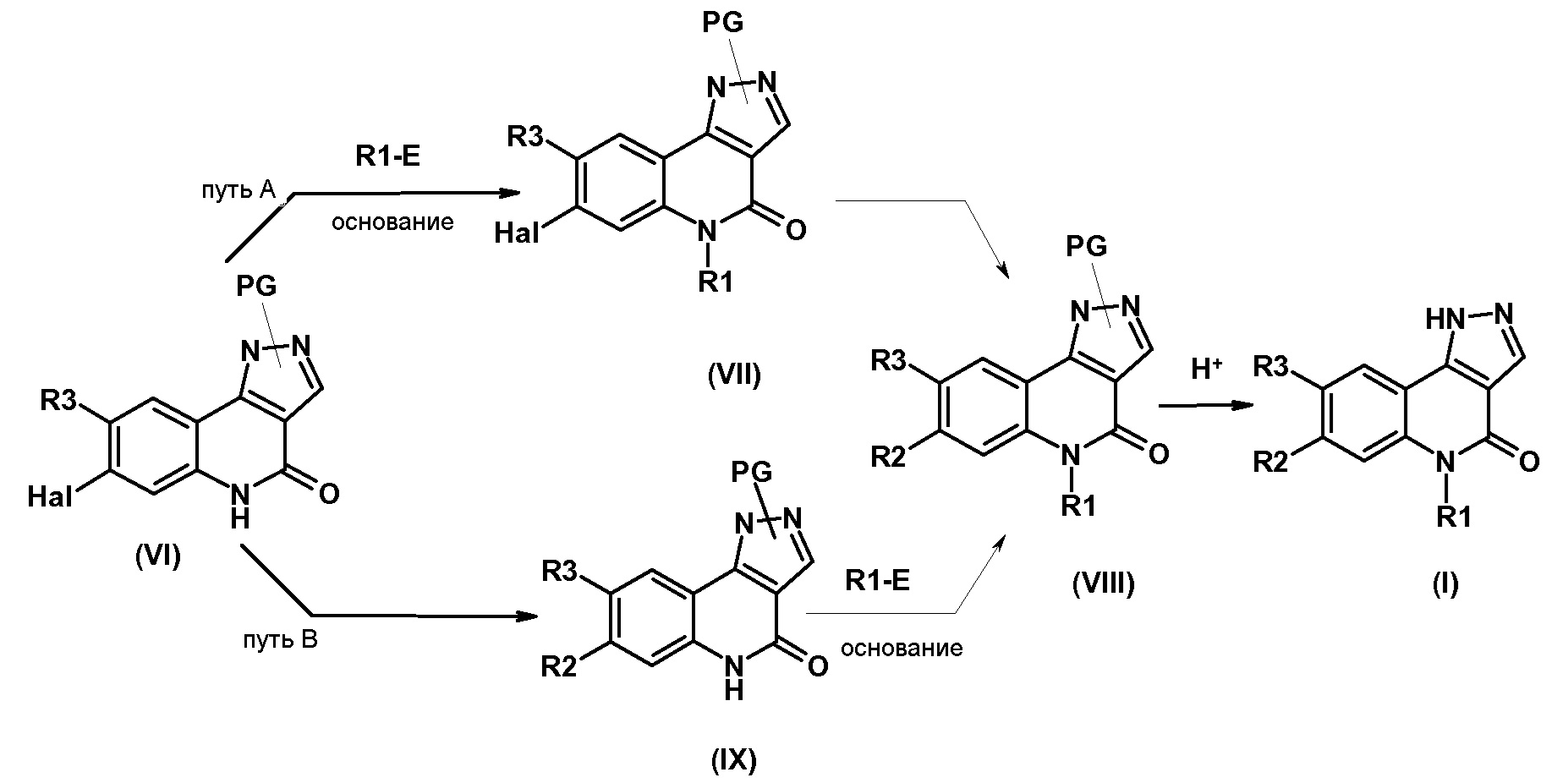
Как показано на схеме 2, соединения формулы (I), в которых группа R2 представляет собой -О-пиридин или -NH-пиридин или -А-Х, как указано ранее, и за исключением случая, когда R3 представляет собой -СО2Н, можно получить согласно путям, описанным далее.
- Путь А. 1,5-Дигидро-4Н-пиразоло[4,3-c]хинолин-4-он формулы (VI) можно алкилировать электрофилом R1-E, где Е представляет собой хорошо уходящую группу, такую как атом галогена или трифлатная группа, в присутствии основания, такого как гидрид натрия, трет-бутоксид калия или карбонат натрия, калия или цезия, в инертном растворителе, таком как ДМФА или ТГФ, при комнатной температуре или при нагревании при 80°С. Преобладающим является N-алкильное соединение формулы (VII), и его О-алкильный изомер получают в количестве до 30%, в зависимости от используемого электрофила и основания.
Галогенированное производное формулы (VII) можно ввести
- или в реакцию металлоорганического синтеза, катализируемую палладием, например, PdCl2(dppf), или с бороновыми кислотами или эфирами или производными олова, в присутствии, или в отсутствие, фосфинового лиганда и/или слабого основания в растворителе, таком как ДМФА, при нагревании при 80-150°С, и получить соединения формулы (VIII), причем R2 представляет собой группу -А-Х-;
- или в реакцию сочетания с производными гидроксипиридина или аминопиридина, катализируемую медью, в присутствии, или в отсутствие, лиганда и/или слабого основания и получить соединения формулы (VIII), причем R2 представляет собой группу -О-пиридин или -NH-пиридин.
Наконец, соединения формулы (I) получают после удаления защитной группы для пиразола в соединениях формулы (VIII) в подходящих условиях, соответствующих защитной группе PG. Например, когда PG в соединениях формулы (VIII) представляет собой SEM или ТНР, обработка в кислой среде, например, ТФК или безводной разбавленной HCl, делает возможным получение соединений формулы (I).
- Путь В. Галогенированное производное формулы (VI) можно ввести в реакцию металлоорганического синтеза или с бороновыми кислотами или эфирами или производными олова, или с производными гидроксипиридина или аминопиридина, причем R2 представляет собой группу -А-Х или -О-пиридин или -NH-пиридин, соответственно, и получить соединение формулы (IX), которое затем можно алкилировать электрофилом R1-E в присутствии основания, как описано выше на пути А.
Схема 3 (путь С): получение промежуточного соединения 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она формулы (XIV) и получение соединений формулы (I)
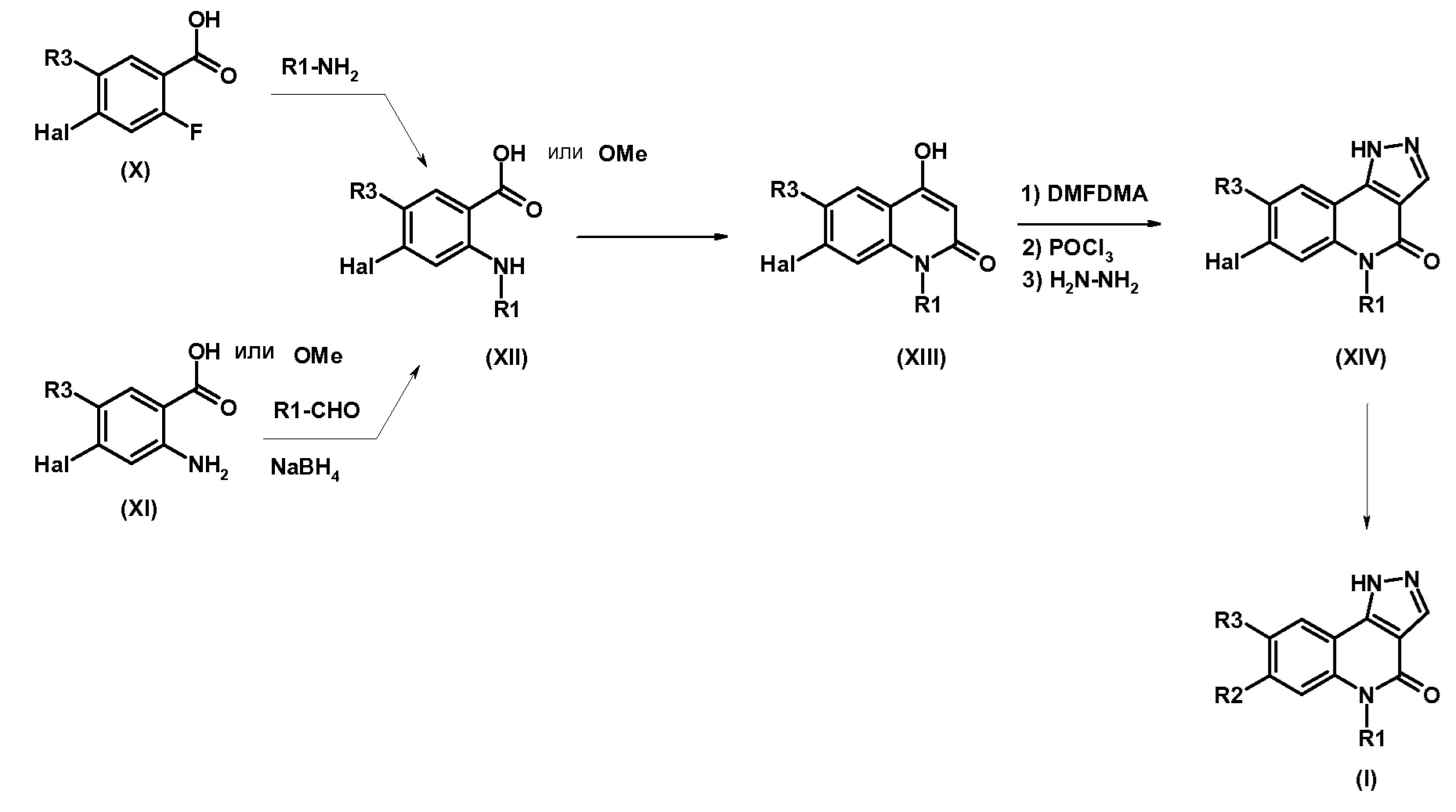
Альтернатива введению заместителя R1 N-алкилированием промежуточных соединений формулы (VI) или (IX) с помощью электрофила R1-E (см. пути А и В, описанные выше) состоит во введении группы R1 через замену атома фтора соединений формулы (X), за исключением случаев, когда R3 представляет собой атом фтора, через амин R1-NH2, как описано в J. Med. Chem., 2008, 51(6), 1925-1944, или путем восстановительного аминирования альдегидом R1-CHO анилинов формулы (XI), как показано на схеме 3. Полученные соединения формулы (XII) превращают в соединения формулы (XIII) согласно способам, описанным для получения соединений формулы (II). Способы превращения соединений формулы (II) в соединения формулы (V) используют для превращения соединений формулы (XIII) в соединения формулы (XIV). Соединения формулы (I) получают непосредственно из соединений формулы (XIV) через
- или металлоорганическую реакцию сочетания, катализируемую палладием, например, PdCl2(dppf), или с бороновыми кислотами или эфирами или производными олова, в присутствии фосфинового лиганда и/или слабого основания в растворителе, таком как ДМФА, при нагревании при 80-150°С; таким образом получают соединения формулы (I), причем R2 представляет собой группу -А-Х-;
- или реакцию сочетания с производными гидроксипиридина или аминопиридина, катализируемую медью, в присутствии лиганда и/или слабого основания, и получают соединения формулы (I), причем R2 представляет собой группу -О-пиридин или -NH-пиридин.
Схема 4 (путь D): получение промежуточного соединения 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она формулы (VII) через внутримолекулярную реакцию Хека
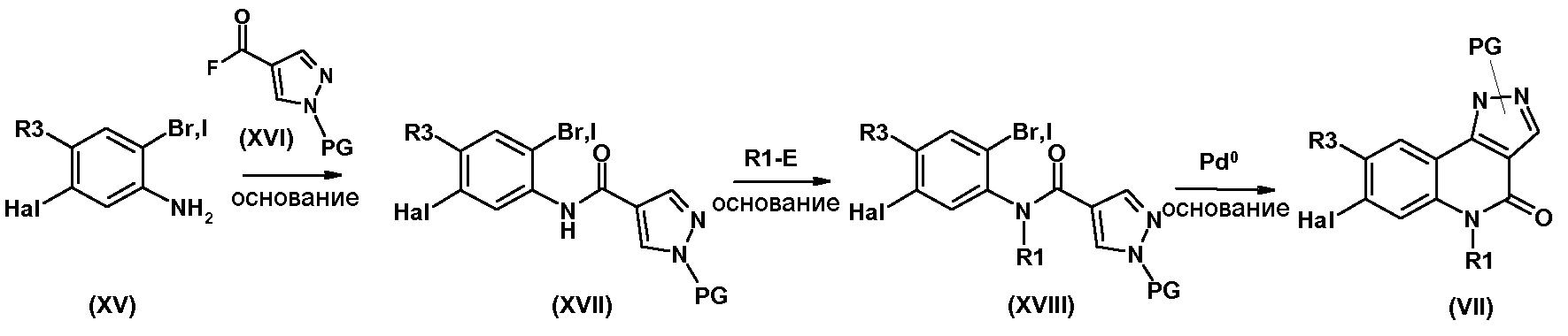
Схема 4 иллюстрирует альтернативный путь синтеза соединения формулы (VII), и такое промежуточное соединение можно использовать для получения соединений формулы (I) так, как описано на схеме 2. Анилины формулы (XV) реагируют с хлорангидридом формулы (XVI), включающим защитную группу, которая устойчива в щелочной среде, такую как SEM или ТНР, в присутствии основания, такого как трет-BuOK или NaH, в растворителе, таком как ТГФ или ДМФА, при комнатной температуре с образованием амида формулы (XVII). Амид формулы (XVII) можно алкилировать электрофильной группой R1-E, в которой Е представляет собой хорошо уходящую группу, такую как атом галогена или трифлатная группа, в присутствии основания, такого как гидрид натрия, трет-бутоксид калия или карбонат натрия, калия или цезия, в инертном растворителе, таком как ДМФА или ТГФ, при комнатной температуре или при нагревании при 80°С. Затем N-алкильное соединение формулы (XVIII), полученное преимущественно относительно его О-алкильного изомера, вводят во внутримолекулярную реакцию Хека, катализируемую палладием, например, Pd(PPh3)4, в присутствии слабого основания, такого как триэтиламин или ацетат калия, в растворителе, таком как ДМФА, при нагревании в то же время при 60-120°С, и получают содержащий защитную группу 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он формулы (VII).
Схема 5 (путь Е): альтернатива получению соединений формулы (I) через промежуточные соединения формул (VII) и (XIV)
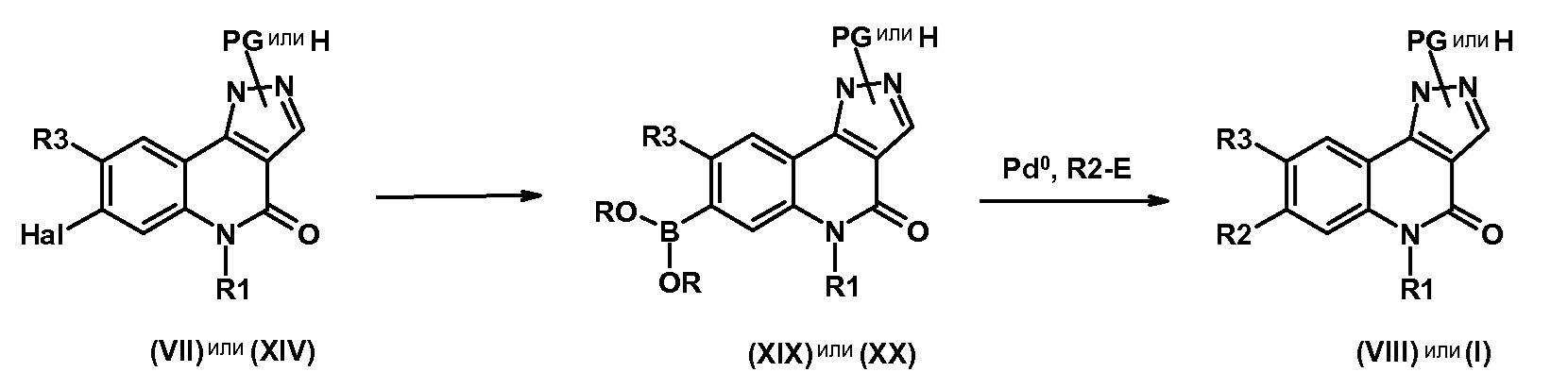
Галогенсодержащие производные формулы (VII) или (XIV), полученные согласно способам, описанным на схемах 2, 3 и 4, можно превратить в бороновую кислоту или эфир формулы (XIX) или (ХХ), соответственно, через катализируемую палладием реакцию сочетания с диборановым производным, например, дибораном пинакона. Бороновую кислоту или эфир формулы (XIX) или (ХХ), в которых R представляет собой атом водорода, или две группы R представляют собой атомы углерода, связанные вместе и необязательно замещенные одной или несколькими (С1-С4)алкильными группами, можно ввести в катализируемую палладием реакцию сочетания по Судзуки с ароматическими соединениями R2-E, содержащими отщепляемую группу Е, такую как атом галогена, например, хлора, брома или йода, или трифлатную группу, и получить, соответственно, соединения формулы (VIII), которые позволяют получить соединения формулы (I), как описано ранее, или непосредственно соединение формулы (I).
Схема 6 (путь F): введение функциональной группы в положение 8 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-онов, причем R3 представляет собой галоген
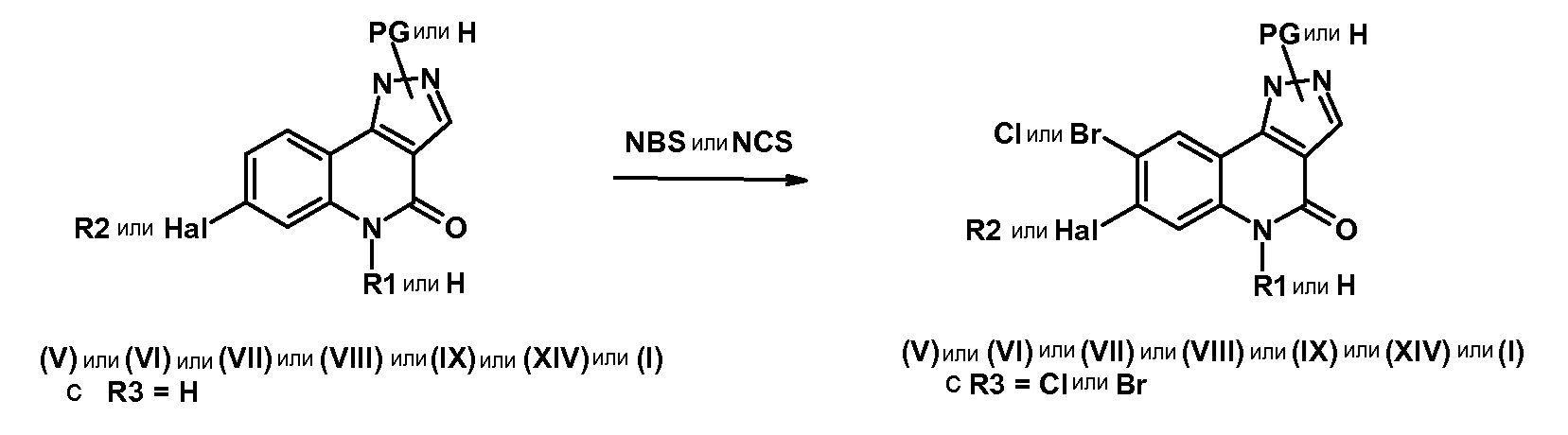
Как показано на схеме 6, региоселективное введение атома галогена в положение 8 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-онов формулы (V) или (VI) или (VII) или (VIII) или (IX) или (XIV) или (I), когда R3 представляет собой водород, можно осуществить через реакцию ароматического электрофильного замещения с такими реагентами, как, например, NBS или NCS, в присутствии катализатора, такого как палладий, например, Pd(OAc)2, или в его отсутствие, в присутствии кислоты, такой как сухая уксусная кислота, или в ее отсутствие, при нагревании при 60-120°С.
Схема 7 (путь G): введение функциональной группы в положение 8 1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-онов, причем R3 представляет собой -Ме или -CN
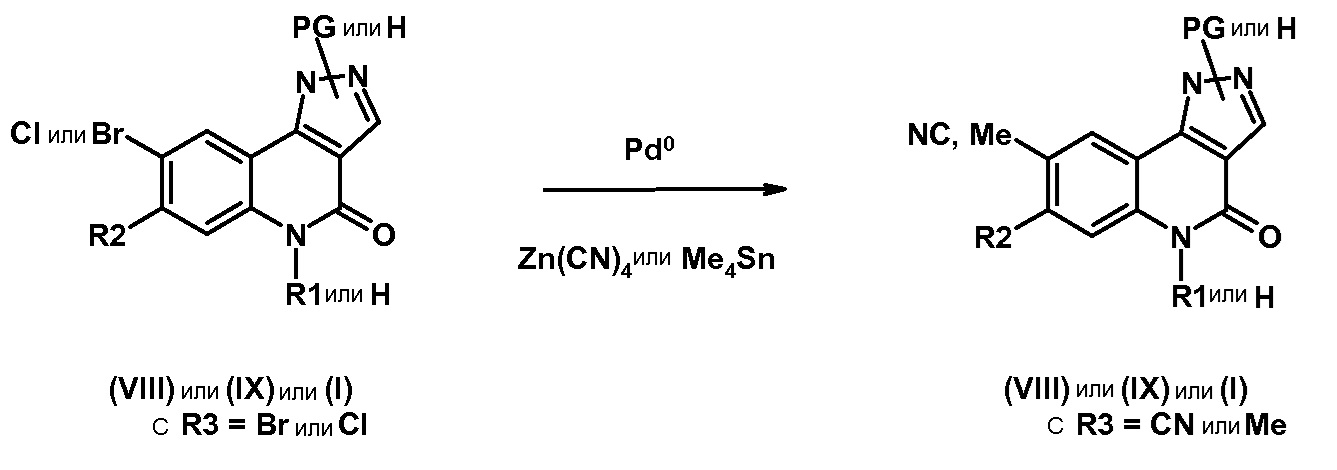
Когда R3 представляет собой атом хлора или брома, галогенсодержащее производное формулы (VIII) или (IX) или (I) можно ввести в катализируемую палладием реакцию сочетания с тетраметилоловом и получить соединение формулы (VIII) или (IX) или (I), причем R3 представляет собой метильную группу или, с другой стороны, цианидом цинка, и получить соединение формулы (VIII) или (IX) или (I), причем R3 представляет собой нитрильную группу.
Когда Х и/или R3 содержит или представляет собой цианогруппу, их можно гидролизовать до группы -COORa, причем Ra представляет собой Н или первичный амид, согласно способам, которые хорошо известны специалистам в данной области техники (путь Н).
Когда Х содержит или представляет собой группу -COORa с Ra иным, чем Н, ее можно превратить омылением в группу -COORa причем Ra представляет собой Н (путь I).
Когда Х и/или R3 содержит или представляет собой группу -COORa, причем Ra представляет собой Н, их после активации можно ввести в сочетание с амином или бикарбонатом аммония или с гетероциклом или гетероарилом, включающим функциональную группу -NH, и получить группу -CONRaRb c Ra=Rb=H для R3 и/или группу -CONRaRb, -C(O)-NRa-(CH2)n-O-Rb, -C(O)-NRa-арил-C(O)-NRaRb, -C(O)-NRa-(CH2)n-NRaRb, -C(O)-NRa-(CH2)n-гетероарил, -СО-гетероцикл или -СО-гетероарил для Х (путь J).
Когда Х содержит или представляет собой группу -NRaRb, причем Rb представляет собой Н, его можно ввести в сочетание с активированным производным карбоновой кислоты в присутствии слабого основания и получить группу -NRaC(О)-(С1-С6)алкил, -NRaC(О)-(CH2)n-NRaRb, -NRaC(О)-арил, -NRa-С(О)-(С1-С6)алкил-арил или -NRaC(О)-(CH2)n-О-Rb (путь К).
Когда Х содержит или представляет собой группу -NRaRb, причем Rb представляет собой Н, его можно ввести во взаимодействие с сульфонилхлоридом в присутствии слабого основания и получить группу -NRa-SO2-(CH2)n-арил, -NRa-SO2-(CH2)n-NRaRb, -NRa-SO2-Rb, -NRa-SO2-арил-О-арил или -NRa-SO2-арил-(CH2)n-NRaC(О)-Rb (путь L).
Когда Х содержит или представляет собой группу -NRaC(О)-(С1-С6)алкил, -NRaC(О)-(CH2)n-NRaRb, -NRaC(О)-арил, -NRa-С(О)-(С1-С6)алкиларил, -NRaC(О)-(CH2)n-О-Rb, -NRa-SO2-(CH2)n-арил, -NRa-SO2-(CH2)n-NRaRb, -NRa-SO2-Rb, -NRa-SO2-арил-О-арил или -NRa-SO2-арил-(CH2)n-NRaC(О)-Rb, причем Rb представляет собой водород, его можно ввести во взаимодействие с электрофилом формулы (С1-С6)алкил-LG (причем LG представляет собой уходящую группу) в присутствии основания и получить группу NRaC(О)-(С1-С6)алкил, -NRaC(О)-(CH2)n-NRaRb, -NRaC(О)-арил, -NRa-С(О)-(С1-С6)алкиларил, -NRaC(О)-(CH2)n-О-Rb, -NRa-SO2-(CH2)n-арил, -NRa-SO2-(CH2)n-NRaRb, -NRa-SO2-Rb, -NRa-SO2-арил-О-арил или -NRa-SO2-арил-(CH2)n-NRaC(О)-Rb, в которой Ra представляет собой -(С1-С6)алкил (путь М).
Когда Х представляет собой галоген, его можно заменить на амин в присутствии палладиевого(0) или медного катализатора или в его отсутствии, в присутствии основания или его отсутствии и получить соединения, в которых Х представляет собой группу -NRaRb, -NRa-(CH2)n-О-Rb, -NRa-гетероцикл или -NRa-арил (путь N).
Когда Х содержит первичную или вторичную функциональную аминогруппу, его можно ввести в реакцию восстановительного аминирования с альдегидом в присутствии восстановителя типа гидрида и получить соответствующий амин (путь О).
Когда Х содержит гидроксильную функциональную группу, его можно ввести в реакцию фторирования (путь Р).
Когда Х представляет собой группу -(С1-С6)алкокси, его можно ввести в реакцию гидролиза и получить группу -O-Ra, причем Ra представляет собой Н (путь Q).
Когда А представляет собой гетероарил, например, пиридин, его можно окислить и получить N-оксидный аналог гетероарила (путь R).
На схемах 1-7 исходные вещества и реагенты, когда способ их получения не описан, являются коммерчески доступными или описаны в литературе, или еще их можно получить согласно способам, которые описаны в данном описании или которые известны специалистам в данной области техники.
Согласно другому аспекту предметом изобретения также являются соединения формул (II)-(ХХ). Такие соединения применимы в качестве промежуточных соединений для синтеза соединений формулы (I), в особенности, промежуточные соединения (III),(IV), (V), (VI), (VII), (VIII), (IX), (XIII), (XIV), (XVII), (XVIII), (XIX) и (ХХ).
В примерах, приведенных далее, описывается получение некоторых соединений согласно изобретению. Примеры не являются ограничительными, но служат только для пояснения настоящего изобретения. Приведенная в данном описании ниже таблица иллюстрирует химические структуры и физические свойства ряда соединений по изобретению.
Используются следующие аббревиатуры и эмпирические формулы:
|
|
|
В тексте, который приводится ниже,
- спектры протонного магнитного резонанса (1Н ЯМР), приведенные ниже, регистрировали при 400 МГц или 500 МГц в ДМСО-d6 с использованием пика ДМСО-d6 в качестве эталона; химические сдвиги δ выражали в миллионных долях (м.д.); наблюдаемые сигналы выражали следующим образом: с = синглет; д = дублет; т = триплет; м = мультиплет или уш.с. = уширенный синглет;
- характеристики ЖХМС, приведенные ниже, последовательно показывают используемый аналитический способ высокоэффективной жидкостной хроматографии, и ниже подробно приводятся (A-J) пик МН+, идентифицированный масс-спектрометрией, и время удерживания соединения, выраженное в минутах.
* Способ А
Прибор линия ВЭЖХ типа 1100 (Agilent) или Alliance (Waters); одноквадрупольный масс-спектрометр типа MSD (Agilent) или ZQ (Waters);
колонка Symmetry С18, 3,5 мкм (2,1×50 мм), Waters;
растворитель А: Н2О+0,005% ТФК; растворитель В: CH3CN+0,005% ТФК;
скорость потока 0,4 мл/мин;
градиент А/В от 100/0 (t 0 мин) до 0/100 (t 10 мин) до 0/100 (t 15 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ В: способ А с изменением градиента А/В
Градиент А/В от 100/0 (t 0 мин) до 0/100 (t 30 мин) до 0/100 (t 35 мин).
* Способ С
Прибор линия ВЭЖХ типа 1100 (Agilent) или Alliance (Waters); одноквадрупольный масс-спектрометр типа MSD (Agilent) или ZQ (Waters);
колонка X Terra С18, 3,5 мкм (2,1×50 мм), Waters;
растворитель А: Н2О+NH4OAc, 10 мМ, рН 7; растворитель В: CH3CN;
скорость потока 0,4 мл/мин;
градиент А/В от 100/0 (t 0 мин) до 10/90 (t 10 мин) до 10/90 (t 15 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ D
Прибор линия UPLC Acquity (Waters); масс-спектрометр SQD (Waters);
колонка ВЕН- С18 (2,1×50 мм), 1,7 мкм (Waters); темп. колонки 55°С;
растворитель А: Н2О+0,02% НСООН; растворитель В: CH3CN+0,02% НСООН;
скорость потока 1 мл/мин;
градиент А/В от 98/2 (t 0 мин) до 2/98 (t 14 мин) до 2/98 (t 14,5 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ Е
Прибор линия ВЭЖХ типа 1100 (Agilent) или Alliance (Waters); одноквадрупольный масс-спектрометр типа MSD (Agilent) или ZQ (Waters);
колонка Luna С18(2)-HST Phenomenex (30×2 мм), 2,5 мкм, темп. колонки 50°С;
растворитель А: Н2О+0,05% ТФК; растворитель В: CH3CN+0,035% ТФК;
скорость потока 1 мл/мин;
градиент А/В от 100/0 (t 0 мин) до 0/100 (t 2,5 мин) до 0/100 (t 3,5 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ F
Прибор линия ВЭЖХ типа 1100 (Agilent) или Alliance (Waters); одноквадрупольный масс-спектрометр типа MSD (Agilent) или ZQ (Waters);
колонка Symmetry С18 (50×2,1 мм), 3,5 мкм, (Waters); темп. колонки 40°С;
растворитель А: Н2О+0,05% ТФК; растворитель В: CH3CN+0,035% ТФК;
скорость потока 0,5 мл/мин;
градиент А/В от 100/0 (t 0 мин) до 0/100 (t 7 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ G
Прибор линия UPLC Acquity (Waters); масс-спектрометр SQD (Waters);
колонка ВЕН С18 (50×2,1 мм), 1,7 мкм (Waters); темп. колонки 55°С;
растворитель А: Н2О+0,05% ТФК; растворитель В: CH3CN+0,035% ТФК;
скорость потока 0,8 мл/мин;
градиент А/В от 98/2 (t 0 мин) до 0/100 (t 2,4 мин) до 0/100 (t 3 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ Н
Прибор Waters UPLC;
колонка ВЕН С18 (2,1×50 мм), 1,7 мкм;
растворитель А: Н2О+0,05% НСО2Н; растворитель В: CH3CN+0,035% НСО2Н;
скорость потока 0,9 мл/мин;
градиент А/В от 95/5 (t 0 мин) до 5/95 (t 1,1 мин) до 95/95 (t 1,7 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ Н’: способ Н с изменением элюентов
Растворитель А: Н2О+0,1% НСО2Н; растворитель В: CH3CN+0,08% НСО2Н;
градиент А/В от 95/5 (t 0 мин) до 5/95 (t 1,1 мин) до 5/95 (t 1,7 мин).
* Способ I
Прибор Waters UPLC;
колонка Waters XBridge С18 (4,6×50 мм), 2,5 мкм;
растворитель А: Н2О+0,1% НСО2Н; растворитель В: CH3CN+0,08% НСО2Н;
градиент А/В от 97/3 (t 0 мин) до 40/60 (t 3,5 мин) до 2/98 (t 4 мин) до 2/98 (t 5 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
* Способ I’: способ Н с изменением элюентов
Растворитель А: Н2О+0,05% ТФК; растворитель В: CH3CN+0,05% ТФК;
градиент А/В от 95/5 (t 0 мин) до 95/5 (t 0,3 мин) до 5/95 (t 3,5 мин) до 5/95 (t 4 мин).
* Способ J
Прибор Waters UPLC;
колонка Jsphere С18 (33×2,1 мм), 4 мкм;
растворитель А: Н2О+0,05% ТФК; растворитель В: CH3CN+0,05% ТФК;
градиент А/В от 98/2 (t 0 мин) до 98/2 (t 1 мин) до 5/95 (t 5 мин) до 5/95 (t 6,25 мин);
детекция УФ 220 нм;
ионизация электронным распылением по положительному типу ESI+.
Пример 1. Гидрохлорид 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 1)
Стадия 1.1. (3E,Z)-7-Бром-3-[(диметиламино)метилиден]хинолин-2,4-(1Н,3Н)-дион
В трехгорлую колбу к суспензии 7-бром-4-гидроксихинолин-2(1Н)-она (12,3 г, 51,2 ммоль) в 250 мл толуола добавляли диметилацеталь N,N-диметилформамида (103 мл, 0,77 моль). Реакционную смесь перемешивали в течение 24 часов при 80°С и затем охлаждали до комнатной температуры и фильтровали. Полученное твердое вещество промывали толуолом и сушили в вакууме, и получали 13,5 г (3E,Z)-7-бром-3-[(диметиламино)метилиден]хинолин-2,4-(1Н,3Н)-диона в форме твердого вещества бежевого цвета (выход 89%).
ЖХМС (способ С): МН+=295,0, RT=5,86 мин.
Стадия 1.2. 7-Бром-4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегид
К суспензии (3E,Z)-7-бром-3-[(диметиламино)метилиден]хинолин-2,4-(1Н,3Н)-диона (5 г, 16,9 ммоль) в 50 мл ДМФА при 0°С добавляли по каплям фосфорилхлорид (1,9 мл, 20,3 ммоль). Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и затем выливали в смесь воды со льдом. Образовавшееся выпавшее в осадок вещество отфильтровывали и сушили в вакууме, и получали 4,6 г 7-бром-4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегида в форме желтого твердого вещества (выход 81%).
ЖХМС (способ А): МН+=288,0, RT=6,38 мин.
Стадия 1.3. 7-Бром-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-бром-4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегида (8,0 г, 27,9 ммоль) в 150 мл ДМФА при 80°С добавляли гидразингидрат (2 мл, 33,5 ммоль) при 80°С. Реакционную смесь перемешивали в течение 24 часов при 80°С и затем охлаждали до комнатной температуры и фильтровали. Полученное твердое вещество промывали диизопропиловым эфиром и сушили, и получали 5,3 г 7-бром-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она в форме бледно-желтого порошка (выход 72%).
ЖХМС (способ А): МН+=264,1, RT=5,27 мин.
Стадия 1.4. 7-Бром-1-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-бром-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (17,95 г, 67,97 ммоль) в 1 л ДМФА при комнатной температуре добавляли 3,4-дигидро-2Н-пиран (18,6 мл, 204 ммоль) и пара-толуолсульфоновую кислоту (1,29 г, 6,80 ммоль). Реакционную среду перемешивали при комнатной температуре в течение 72 часов и затем выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органическую фазу промывали насыщенным раствором NaCl и сушили над Na2SO4, фильтровали и концентрировали досуха, и получали коричневое твердое вещество. Твердое вещество разводят в диизопропиловом эфире, и после фильтрования получали 18,8 г порошка оранжевого цвета (выход 71%).
ЖХМС (способ А): МН+=350,1, RT=5,28 мин.
Стадия 1.5. 7-Бром-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-бром-1-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (17,3 г, 49,7 ммоль) в 170 мл безводного МеТГФ при 70°С добавляли по частям трет-BuOK (11,2 г, 99,4 ммоль). После перемешивания в течение 15 минут при 70°С добавляли по каплям 2,2,2-трифторэтилтрифторметансульфонат (14,4 мл, 99,4 ммоль). Реакционную среду после добавления 180 мл безводного МеТГФ перемешивали в течение 2 часов при 70°С. Через 2 часа при 70°С добавляли дополнительную порцию трет-BuOK (11,14 г, 49,7 ммоль) и 2,2,2-трифторэтилтрифторметансульфоната (7,2 мл, 49,7 ммоль). Реакционную среду перемешивали в течение 2 часов 30 минут при 70°С. Реакционную среду концентрировали, и остаток растворяли в DCM. Раствор промывали водой и затем насыщенным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха, и получали коричневое твердое вещество, которое разводили в смеси диизопропиловый эфир/ацетон (2/1), перемешивали в течение 16 часов, и получали 12,1 г белого порошка (выход 57%).
ЖХМС (способ Е): МН+=347,9, RT=5,27 мин.
Стадия 1.6. 7-(Пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-бром-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (1,0 г, 2,32 ммоль) в 20 мл безводного ДМФА, содержащейся в микроволновом реакторе в атмосфере азота, добавляли 2-пиридилтри-н-бутилстаннана (1,21 мл, 3,02 ммоль) и катализатор Pd(трет-Bu3P)2 (356 мг, 0,7 ммоль). Реактор герметично закрывали, и реакционную среду перемешивали в течение 10 минут при 120°С при облучении микроволнами. Смесь концентрировали досуха и растворяли в EtOAc. Раствор промывали насыщенным раствором NaHCO3, насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха, и получали твердое вещество бежевого цвета. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH, от 95/5 до 85/15) получали 0,38 г белого порошка (выход 38%).
ЖХМС (способ А): МН+=429,2, RT=8,14 мин.
Стадия 1.7. Гидрохлорид 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
К раствору 7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (60 мг, 0,14 ммоль) в 1 мл DCM добавляли 4 М раствор безводного хлороводорода в диоксане (350 мкл, 1,40 ммоль). После перемешивания в течение 1 часа при комнатной температуре суспензию фильтровали, твердое вещество сушили в вакууме, и получали 59 мг 7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она в форме порошка бежевого цвета (гидрохлорид, 0,88 Н2О; выход количественный).
ЖХМС (способ А): МН+=345,0, RT=6,63 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,79 (д, 1H) 8,47 (шир.с, 1H) 8,39 (с, 1H) 8,35 (д, 1H) 8,26 (д, 1H) 8,14 (дд, 1H) 8,10 (т, 1H) 7,51-7,58 (м, 1H) 5,47 (д, 1H) 5,42 (д, 1H).
Пример 2. Гидрохлорид 7-(2-аминопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 2)
Стадия 2.1. 7-(3-Аминопирид-4-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
7-Бром-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он (9,7 г, 19,4 ммоль), карбонат калия (5,3 г, 38,4 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пирид-2-амин (4,82 г, 21,9 ммоль), 14 мл безводного ДМФА, 1,8 мл обезгаженной воды и катализатор PdCl2(dppf) (0,79 г, 0,96 ммоль) последовательно загружали в микроволновый реактор в атмосфере аргона. Реактор герметично закрывали, и смесь перемешивали в течение 10 минут при 130°С при облучении микроволнами. Смесь разбавляли EtOAc, выливали в насыщенный водный раствор NaHCO3 и перемешивали в течение 30 минут. Выпавшее в осадок вещество отфильтровывали, промывали водой и затем разводили в изопропаноле. После фильтрования и сушки получали 7,58 г серого порошка (выход 88%).
ЖХМС (способ D): МН+=444,2, RT=0,87 мин.
Стадия 2.2. Гидрохлорид 7-(2-аминопирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, обрабатывая 7-(3-аминопирид-4-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он раствором безводного HCl в диоксане (4 М), в форме порошка бежевого цвета (гидрохлорид, 2 Н2О; выход 89%).
ЖХМС (способ А): МН+=360,1, RT=4,83 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 14,22 (шир.с, 1H) 8,20-8,60 (м, 2H) 8,11 (дд, 1H) 7,95 (дд, 1H) 7,87 (с, 1H) 7,80 (шир. с, 2H) 7,50 (д, 1H) 7,06 (дд, 1H) 5,35 (д, 1H) 5,31 (д, 1H).
Пример 3. Гидрохлорид 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 99)
Стадия 3.1. 7-Бром-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-бром-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанного на стадии 1.3] (1,49 г, 5,64 ммоль) в 30 мл безводного ДМФА добавляли карбонат цезия (2,0 г, 6,21 ммоль) и по каплям [2-(хлорметокси)этил](триметил)силан (10 мл, 56,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере азота и затем выливали в воду и экстрагировали смесью ТГФ/EtOAc (50/50). Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха. Полученный остаток очищали флэш-хроматографией на диоксиде кремния (DCM/MeOH от 100/0 до 98/2), и получали 1,45 г желтого твердого вещества (выход 61%).
ЖХМС (способ А): МН+=396,1, RT=8,77 мин.
Стадия 3.2. 7-Бром-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-бром-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (10,0 г, 25,4 ммоль) и карбоната цезия (24,8 г, 76,1 ммоль) в 130 мл МеТГФ, нагретой до 60°С, добавляли по каплям 2,2,2-трифторэтилтрифторметансульфонат (5,5 мл, 38,0 ммоль). Смесь перемешивали при 60°С в течение 3 часов. Реакционную среду охлаждали и концентрировали досуха. Полученный остаток разводили в воде, отфильтровывали и сушили. После очистки флэш-хроматографией (циклогексан/EtOAc от 90/10 до 50/50) получали 6,67 г белого порошка (выход 55%).
ЖХМС (способ А): МН+=476,3, RT=10,64 мин.
Стадия 3.3. 7-(Пирид-3-илокси)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
7-Бром-1-[2-(триметилсилил)этокси]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-бром-2-[2-(триметилсилил)этокси]-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он (0,2 г, 0,42 ммоль), 3-гидроксипиридин (0,12 г, 1,26 ммоль), катализатор CuI (80 мг, 0,42 ммоль), лиганд 1,1,1-трис(гидроксиметил)этан (50 мг, 0,42 ммоль), карбонат цезия (0,55 г, 1,68 ммоль), 0,4 мл безводного ДМФА и 1,5 мл диоксана последовательно загружали в реактор в атмосфере аргона. Реактор герметично закрывали, и смесь энергично перемешивали в течение 17 часов при 110°С. После охлаждения смесь фильтровали через целит и промывали EtOAc. Раствор промывали водой и насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха, и получали 195 мг коричневой смолы, которую использовали на следующей стадии.
ЖХМС (способ Е): МН+=491,4, RT=2,36 мин.
Стадия 3.4. Гидрохлорид 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Суспензию 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-3-илокси)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (0,19 г, 0,39 ммоль) в 10 мл раствора безводного хлороводорода в диоксане (4 М) перемешивали при комнатной температуре в течение 18 часов. Суспензию фильтровали, и твердое вещество промывали DCM и затем очищали флэш-хроматографией на С18 с обращенной фазой (H2O/MeCN от 100/0 до 0/100). Полученную смолу растворяли в одномолярном растворе хлороводорода и затем концентрировали досуха, и получали 78 мг белого порошка (1,2 гидрохлорид, 1,15 H2O; выход 58%).
ЖХМС (способ А): МН+=361,2, RT=6,65 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,66 (д, 1H) 8,56 (д, 1H) 8,41 (с, 1H) 8,30 (д, 1H) 7,84 (д, 1H) 7,73 (дд, 1H) 7,62 (с, 1H) 7,19 (дд, 1H) 5,27 (д, 1H) 5,23 (д, 1H).
Пример 4. Гидрохлорид 5-(2,2,2-трифторэтил)-7-(пирид-4-илокси)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 102)
Стадия 4.1. 7-(Пирид-4-ил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(пирид-4-ил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-бром-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 3.1] (18,2 г, 46,2 ммоль) в 150 мл ДМФА, помещенному в микроволновый реактор, в атмосфере азота последовательно добавляли 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (11,4 г, 55,4 ммоль), водный 2 М раствор К3РО4 (47 мл, 92,4 ммоль) и катализатор PdCl2(dppf) (1,88 г, 2,31 ммоль). Реактор герметично закрывали, и реакционную смесь перемешивали в течение 20 минут при 150°С при облучении микроволнами. После концентрирования реакционной смеси очистка флэш-хроматографией на диоксиде кремния (DCM/MeOH от 0/100 до 95/5) дает 12,4 г 7-(пирид-4-ил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-4-ил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она в форме белого твердого вещества (выход 54%).
ЖХМС (способ А): МН+=393,2, RT=6,60 и 6,74 мин (изомеры пиразола с защитной группой SEM).
Стадия 4.2. 5-(2,2-Дифторэтил)-7-(пирид-4-ил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 5-(2,2-дифторэтил)-7-(пирид-4-ил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-(пирид-4-ил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-4-ил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (0,40 г, 1,0 ммоль) в 8 мл ДМФА добавляли карбонат цезия (0,66 г, 2,04 ммоль) и 2,2-дифторэтилтрифторметансульфонат (0,33 мл, 2,55 ммоль). Смесь перемешивали в течение 24 часов при комнатной температуре и затем выливали в воду и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 95/5) получали 108 мг твердого вещества оранжевого цвета (выход 23%).
ЖХМС (способ А): МН+=457,3, RT=6,94 мин.
Стадия 4.3. Гидрохлорид 5-(2,2-дифторэтил)-7-(пирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
К раствору 5-(2,2-дифторэтил)-7-(пирид-4-ил)-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 5-(2,2-дифторэтил)-7-(пирид-4-ил)-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (100 мг, 0,22 ммоль) в 2 мл DCM при комнатной температуре добавляли 4 М раствор безводного хлороводорода в диоксане (1,10 мл, 4,38 ммоль). После перемешивания при комнатной температуре в течение 24 часов смесь фильтровали. Полученное твердое вещество разводили в изопропаноле, отфильтровывали и сушили в вакууме, и получали 74 мг белого порошка (гидрохлорид, выход 94%).
ЖХМС (способ А): МН+=327,0, RT=4,86 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,96-9,03 (м, 2H) 8,37-8,56 (м, 4H) 8,19 (с, 1H) 7,98 (д, 1H) 6,43 (тт, 1H) 5,04 (тд, 2H).
Пример 5. Гидрохлорид 5-(пропан-2-ил)-7-(пирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 107)
Стадия 5.1. 4-Бром-2-(пропан-2-иламино)бензойная кислота
Изопропиламин (134,9 г, 2,28 моль), 10 мл трет-бутанола и 4-бром-2-фторбензойную кислоту (10 г, 45,7 ммоль), добавленную по частям, смешивали вместе в микроволновом реакторе. Реактор герметично закрывали, и реакционную смесь перемешивали в течение 45 минут при 150°С при облучении микроволнами. Бесцветный раствор охлаждали и выливали в смесь воды со льдом, и затем добавляли ледяную уксусную кислоту. Образовавшееся выпавшее в осадок белое вещество отфильтровывали, промывали водой и сушили в вакууме. Получали 7,9 г белого твердого вещества (выход 67%).
ЖХМС (способ А): МН+=257,1, RT=8,11 мин.
Стадия 5.2. 4-Бром-2-[(3-этокси-3-оксопропаноил)(пропан-2-ил)амино]бензойная кислота
К раствору 4-бром-2-(пропан-2-иламино)бензойной кислоты (6,8 г, 26,64 ммоль) в 260 мл DCM добавляли триэтиламин (4 мл, 31,6 ммоль), а затем добавляли по каплям хлорид этилмалоната (4,0 мл, 31 ммоль). Смесь перемешивали в течение 2 часов при комнатной температуре и затем выливали в одномолярный раствор хлороводорода и экстрагировали EtOAc. Органическую фазу промывали водой и насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. Получали 7,15 г бледно-желтого твердого вещества (выход 72%).
ЖХМС (способ А): МН+=372,1, RT=7,42 мин.
Стадия 5.3. Этил-7-бром-2,4-диоксо-1-(пропан-2-ил)-1,2,3,4-тетрагидрохинолин-3-карбоксилат
К раствору 4-бром-2-[(3-этокси-3-оксопропаноил)(пропан-2-ил)амино]бензойной кислоты (6,2 г, 16,7 ммоль) в 170 мл DCE при 0°С добавляли триэтиламин (3,5 мл, 25,1 ммоль) и затем добавляли тионилхлорид (1,45 мл, 20,6 ммоль). После перемешивания при комнатной температуре в течение 3 часов реакционную среду разбавляли DCM и промывали соляной кислотой (1 М). Органическую фазу промывали насыщенным водным раствором NaHCO3 и насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. Полученное масло очищали флэш-хроматографией (толуол/EtOAc от 100/0 до 90/10), и получали 2,23 г белого твердого вещества (выход 52%).
ЖХМС (способ А): МН+=354,2, RT=9,58 мин.
Стадия 5.4. 7-Бром-4-гидрокси-1-(пропан-2-ил)хинолин-2(1Н)-он
Суспензию этил-7-бром-2,4-диоксо-1-(пропан-2-ил)-1,2,3,4-тетрагидрохинолин-3-карбоксилата (1,5 г, 4,23 ммоль) в 2 М растворе гидроксида натрия (32 мл, 64 ммоль) кипятили с обратным холодильником. Реакционная среда становится однородной, и через 3 часа снова наблюдали суспензию. Добавляли для гомогенизации 6 мл NMP, и затем полученную смесь кипятили с обратным холодильником в течение 12 часов. Раствор, охлажденный до комнатной температуры, выливали в 6 М соляную кислоту, и получали выпавшее в осадок белое вещество, которое отфильтровывали. После промывки водой и сушки осадка в вакууме получали 1,1 г белого твердого вещества (выход 91%).
ЖХМС (способ А): МН+=284,1, RT=6,99 мин.
Стадия 5.5. (3E,Z)-7-Бром-3-[(диметиламино)метилиден]-1-(пропан-2-ил)хинолин-2,4(1Н,3Н)-дион
Как описано на стадии 1.1, к раствору 7-бром-4-гидрокси-1-(пропан-2-ил)хинолин-2(1Н)-она (1,2 г, 4,25 ммоль) в 43 мл толуола добавляли диметилацеталь N,N-диметилформамида (8,8 мл, 63,8 ммоль). Раствор нагревали при 80°С в течение 8 часов. Полученную смесь концентрировали досуха, и получали бледно-желтое твердое вещество, которое разводили в диизопропиловом эфире. После фильтрования получали 321 мг белого твердого вещества (выход 92%).
ЖХМС (способ А): МН+=338,1, RT=8,39 мин.
Стадия 5.6. 7-Бром-4-хлор-2-оксо-1-(пропан-2-ил)-1,2-дигидрохинолин-3-карбальдегид
Как описано на стадии 1.2, к раствору (3E,Z)-7-бром-3-[(диметиламино)метилиден]-1-(пропан-2-ил)хинолин-2,4(1Н,3Н)-диона (1,32 г, 3,9 ммоль) в 10 мл ДМФА при 0°С добавляли по каплям POCl3 (0,44 мл, 4,70 ммоль). Раствор перемешивали в течение 3 часов при комнатной температуре и затем выливали в смесь воды со льдом, и получали выпавшее в осадок вещество. После фильтрования и сушки осадка в вакууме получали 1,2 г желтого твердого вещества (выход 93%).
ЖХМС (способ А): МН+=327,1, RT=7,29 мин.
Стадия 5.7. 7-Бром-5-(пропан-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
Как описано на стадии 1.3, к раствору 7-бром-4-хлор-2-оксо-1-(пропан-2-ил)-1,2-дигидрохинолин-3-карбальдегида (1,0 г, 3,08 ммоль) в 30 мл ДМФА при 0°С добавляли гидразингидрат (0,19 мл, 3,70 ммоль). После перемешивания в течение 8 часов при комнатной температуре реакционную смесь выливали в воду. Образовавшееся выпавшее в осадок вещество оранжевого цвета отфильтровывали, промывали водой и затем сушили в вакууме, и получали 859 мг твердого вещества оранжевого цвета (выход 73%).
ЖХМС (способ А): МН+=306,1, RT=6,88 мин.
Стадия 5.8. 5-(Пропан-2-ил)-7-(пирид-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-бром-5-(пропан-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (0,25 г, 0,82 ммоль) в 8 мл ДМФА, помещенному в микроволновый реактор, добавляли карбонат цезия (0,8 г, 2,5 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (0,25 г, 1,22 ммоль) и катализатор PdCl2(dppf) (60 мг, 0,08 ммоль). Реактор герметично закрывали, и смесь перемешивали в течение 20 минут при 150°С при облучении микроволнами. Реакционную среду разбавляли смесью EtOAc/ТГФ (50/50) и промывали водой и затем насыщенным водным раствором NaCl. Органическую фазу сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией (DCM/MeOH от 100/0 до 90/10) получали 45 мг белого твердого вещества (выход 19%).
ЖХМС (способ А): МН+=305,2, RT=4,98 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,92 (д, 2H) 8,23-8,44 (м, 4 H) 8,11 (с, 1H) 7,90 (д, 1H) 5,48 (шир. с, 1H) 1,64 (д, 6 H).
Пример 6. Гидрохлорид 8-фтор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 109)
Стадия 6.1. 1-(Тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоновая кислота
К суспензии 1Н-пиразол-4-карбоновой кислоты (50 г, 446 ммоль) в 500 мл ДМФА добавляли пара-толуолсульфоновую кислоту (8,48 г, 44 ммоль) и DHP (132 мл, 1561 ммоль). При перемешивании при комнатной температуре в течение 20 часов реакционная среда становится желтой и затем черной. Реакционную смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Водную фазу подкисляли до рН 3, добавляя 6 М соляную кислоту. Образовавшееся выпавшее в осадок вещество отфильтровывали и промывали водой и затем сушили в вакууме при 50°С, и получали 61,2 г белого порошка (выход 70%).
ЖХМС (способ D): МН+=197,1, RT=0,60 мин.
Стадия 6.2. Фторангидрид 1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоновой кислоты
К раствору 1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоновой кислоты (31,7 г, 61 ммоль) в 650 мл DCM при 0°С добавляли по каплям пиридин (77 мл, 0,97 моль) и фторциан (41 мл, 0,48 ммоль). Реакционную среду перемешивали в течение 4 часов при комнатной температуре, выливали в насыщенный водный раствор NaHCO3 и экстрагировали DCM. Органическую фазу промывали водой и затем насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха, и получали 29,1 г коричневого масла (выход 91%).
ЖХМС (способ D): [М+NH4]+=216,6, RT=0,95 мин.
Стадия 6.3. N-(5-Хлор-4-фтор-2-йодфенил)-1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоксамид
К раствору 5-хлор-4-фтор-2-йоданилина (5,0 г, 22,3 ммоль) в 250 мл безводного ТГФ в атмосфере азота при комнатной температуре добавляли трет-бутоксид калия (12,52 г, 111,6 ммоль). После перемешивания в течение 15 минут добавляли по каплям раствор фторангидрида 1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоновой кислоты (5,67 г, 24,6 ммоль) в 30 мл безводного ТГФ. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и затем выливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (циклогексан/EtOAc от 95/5 до 80/20) получали красное твердое вещество, которое очищали флэш-хроматографией на аминной фазе (DCM), и получали 2,84 г белого твердого вещества (выход 31%).
ЖХМС (способ Е): МН+=404,0, RT=2,29 мин.
Стадия 6.4. N-(5-Хлор-4-фтор-2-йодфенил)-1-(тетрагидро-2Н-пиран-2-ил)-N-(2,2,2-трифторэтил)-1Н-пиразол-4-карбоксамид
К раствору N-(5-хлор-4-фтор-2-йодфенил)-1-(тетрагидро-2Н-пиран-2-ил)-1Н-пиразол-4-карбоксамида (1,26 г, 3,13 ммоль) в 55 мл безводного МеТГФ, нагретому до 65°С, добавляли трет-бутоксид калия (421 мг, 3,76 ммоль) и 2,2,2-трифторэтилтрифторметансульфонат (0,54 мл, 3,76 ммоль). Реакционную смесь перемешивали в течение 2 часов при 65°С и затем охлаждали, выливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOAc от 100/0 до 95/5) получали 2,32 г твердого вещества оранжевого цвета (выход 73%).
ЖХМС (способ G): МН+=404,0, RT=1,82 мин.
Стадия 6.5. 7-Хлор-8-фтор-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору N-(5-хлор-4-фтор-2-йодфенил)-1-(тетрагидро-2Н-пиран-2-ил)-N-(2,2,2-трифторэтил)-1Н-пиразол-4-карбоксамида (2,2 г, 4,5 ммоль) в 10 мл безводного ДМФА, помещенному в микроволоновый реактор в атмосфере азота, добавляли катализатор Pd(PPh3)4 (630 мг, 0,55 ммоль) и ацетат калия (890 мг, 9,0 ммоль). Реактор герметично закрывали, и реакционную смесь перемешивали в течение 15 минут при 90°С при облучении микроволнами. В реакционную среду добавляли дополнительное количество катализатора Pd(PPh3)4 (630 мг, 0,55 ммоль) и ацетата калия (890 мг, 9,0 ммоль), и смесь перемешивали в течение 15 минут при 110°С при облучении микроволнами. Смесь охлаждали, выливали в воду и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOAc от 100/0 до 95/5 и затем циклогексан/ЕА 90/10 и DCM (100%)) получали 260 мг белого твердого вещества (выход 57%).
ЖХМС (способ G): МН+=403,9, RT=2,59 мин.
Стадия 6.6. 8-Фтор-7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
Согласно способу, описанному на стадии 1.6, к раствору 7-хлор-8-фтор-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (526 мг, 1,30 ммоль) в 10 мл безводного ДМФА в атмосфере азота, помещенному в микроволновый реактор, добавляли 2-пиридилтри-н-бутилстаннан (4,40 мл, 11,5 ммоль) и катализатор Pd(трет-Bu3P)2 (199 мг, 0,39 ммоль). Реактор герметично закрывали, и реакционную смесь перемешивали в течение 20 минут при 130°С при облучении микроволнами. Смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Органическую фазу промывали водой и насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (циклогексан/EtOAc от 90/10 до 70/30 и затем DCM/ацетон от 92/2 до 90/10) получали 72 мг белого порошка (выход 12%).
ЖХМС (способ Е): МН+=447,0, RT=2,44 мин.
Стадия 6.7. Гидрохлорид 8-фтор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, обрабатывая 8-фтор-7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он раствором HCl в диоксане (4 М). Продукт имеет форму белого порошка (гидрохлорид; выход 75%).
ЖХМС (способ D): МН+=363,1, RT=1,69 мин.
1H ЯМР (500 МГц, ДМСО-d6): δ м.д. 8,81-8,83 (м, 1H) 8,52 (шир.с, 1H) 8,21 (д, 1H) 8,13 (д, 1H) 8,03 (тд, 1H) 7,90-7,93 (м, 1H) 7,52 (ддд, 1H) 5,35 (д, 1H) 5,32 (д, 1H).
Пример 7. 7-(2-Хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он (соединение 111)
Стадия 7.1. 1-(Тетрагидро-2Н-пиран-2-ил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 2-(тетрагидро-2Н-пиран-2-ил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-бром-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 1.5] (8,0 г, 18,6 ммоль) в 200 мл ДМФА добавляли диборан пинакона (18,9 г, 74,4 ммоль). Смесь нагревали до 60°С в атмосфере азота, затем добавляли ацетат калия (4,6 г, 46,5 ммоль) и катализатор PdCl2(dppf) (3,04 г, 3,72 ммоль). Раствор нагревали в течение 3 часов при 60°С и затем охлаждали до комнатной температуры и выливали в насыщенный водный раствор NaHCO3. После экстракции EtOAc органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. Получали черное масло, к которому добавляли диизопропиловый эфир, что ведет к образованию черного твердого вещества. После фильтрования и концентрирования фильтрата получали желтое масло, которое разводили в смеси петролейный эфир (40-65°С)/диизопропиловый эфир, что ведет к выпадению в осадок бледно-желтого твердого вещества. После фильтрования и сушки осадка в вакууме получали 5,10 г бледно-желтого твердого вещества (первая порция).
Фильтрат концентрируют. К полученному желтому маслу добавляли насыщенный водный раствор NaHCO3 и 10% ТГФ. Смесь энергично перемешивали при комнатной температуре в течение 12 часов и затем подкисляли одномолярным раствором хлороводорода и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха, и получали желтое твердое вещество, которое разводили в петролейном эфире. После фильтрования и сушки в вакууме получали 1,44 г белого твердого вещества (вторая порция).
Обе порции объединяли и обрабатывали диизопропиловым эфиром. После фильтрования и сушки получали 6,54 г белого порошка (выход 74%).
ЖХМС (способ F): МН+=478,0, RT=2,80 мин.
Стадия 7.2. 7-(2-Хлорпирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(2-хлорпирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 1-(тетрагидро-2Н-пиран-2-ил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 2-(тетрагидро-2Н-пиран-2-ил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (100 мг, 0,1 ммоль) в 3 мл ДМФА в атмосфере азота при 95°С добавляли катализатор PdCl2(dppf) (17 мг, 0,02 ммоль), карбонат цезия (136 мг, 0,42 ммоль), 0,5 мл обезгаженной воды и 3-бром-2-хлорпиридин (40 мг, 0,21 ммоль). Реакционную смесь перемешивали в течение 1,5 часов при 95°С в атмосфере азота, охлаждали до комнатной температуры, концентрировали и растворяли в EtOAc. Раствор промывали водой и затем насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха, и получали черный воск. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 95/5) получали 38 мг желтого твердого вещества (выход = 79%).
ЖХМС (способ G): МН+=463,3, RT=1,66 мин.
Стадия 7.3. 7-(2-Хлорпирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-(2-хлорпирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-хлорпирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (1,6 г, 3,46 ммоль) в 34 мл DCM добавляли 4 М раствор хлороводорода в диоксане (8,5 мл, 34,6 ммоль). Смесь перемешивали в течение 3 часов при комнатной температуре и концентрировали досуха. После очистки флэш-хроматографией на аминной фазе (DCM/EtOH от 100/0 до 90/10) получали 189 мг белого твердого вещества (выход = 15%).
ЖХМС (способ А): МН+=379,2, RT=6,91 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,51 (дд, 1H) 8,47 (шир. с, 1H) 8,29 (д, 1H) 7,95 (дд, 1H) 7,90 (с, 1H) 7,61 (дд, 1H) 7,53 (д, 1H) 5,36 (д, 1H) 5,31 (дд, 1H).
Пример 8. Гидрохлорид 8-хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 194)
Стадия 8.1. 8-Хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 1.5] (1,6 г, 3,73 ммоль) в 32 мл уксусной кислоты добавляли N-хлорсукцинимид (2,49 г, 18,67 ммоль). Реакционную смесь перемешивали в течение 3 часов при 80°С, охлаждали до комнатной температуры и концентрировали досуха, и получали желтое твердое вещество, которое растворяли в DCM. Раствор промывали насыщенным водным раствором NaHCO3 и затем насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали, и получали желтое твердое вещество. Твердое вещество обрабатывали DCM. После фильтрования и сушки получали 542 мг белого твердого вещества (выход 35%).
ЖХМС (способ А): МН+=379,2, RT=6,93 мин.
Стадия 8.2. Гидрохлорид 8-хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
К раствору 8-хлор-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (532 мг, 1,40 ммоль) в смеси DCM/MeOH (50/50) добавляли 4 М раствор хлороводорода в диоксане (3,5 мл, 14,1 ммоль). Суспензию перемешивали при комнатной температуре, затем фильтровали, остаток на фильтре сушили в вакууме, и получали 420 мг белого порошка (гидрохлорид, 0,06 Н2О; выход 72%).
ЖХМС (способ А): МН+=379,2, RT=6,91 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,77-8,83 (м, 1H) 8,52 (шир.с, 1H) 8,40 (с, 1H) 8,06 (тд, 1H) 7,96 (с, 1H) 7,77 (д, 1H) 7,54-7,59 (м, 1H) 5,35 (д, 1H) 5,30 (д, 1H).
Пример 9. Гидрохлорид 8-бром-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 195)
Стадия 9.1. 8-Бром-7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 8-бром-7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 1.5] (100 мг, 0,23 ммоль) в 2 мл ацетонитрила, помещенному в микроволновый реактор в атмосфере азота, добавляли N-бромсукцинимид (50 мг, 0,28 ммоль) и катализатор Pd(OAc)2 (2,6 г, 0,01 ммоль). Реактор герметично закрывали, и реакционную смесь перемешивали в течение 15 минут при 100°С в атмосфере азота при облучении микроволнами. Так как реакция не завершается, к реакционной смеси добавляли еще N-бромсукцинимид (17 мг, 0,1 ммоль) и катализатор Pd(OAc)2 (2,6 г, 0,01 ммоль), и смесь перемешивали еще в течение 10 минут при 100°С при облучении микроволнами. Смесь разбавляли EtOAc, и раствор промывали водой и затем насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 90/10 до 80/20) получали 72 мг желтого твердого вещества (выход 43%).
ЖХМС (способ А): МН+=507,0, RT=8,88 мин.
Стадия 9.2. Гидрохлорид 8-бром-7-(пирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, обрабатывая 8-бром-7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 8-бром-7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он 4 М раствором HCl в диоксане, в форме белого порошка (гидрохлорид, 0,4 Н2О; выход 94%).
ЖХМС (способ А): МН+=425,2, RT=7,00 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,77-8,84 (м, 1H) 8,58 (с, 1H) 8,51 (шир.с, 1H) 8,04-8,17 (м, 1H) 7,93 (с, 1H) 7,75 (дд, 1H) 7,56-7,65 (м, 1H) 5,33 (д, 1H) 5,29 (д, 1H).
Пример 10. Гидрохлорид 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила (соединение 201)
Стадия 10.1. 4-Оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрил и 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрил
8-Бром-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он [полученный согласно протоколам, описанным на стадии 4.2 с 2,2,2-трифторэтилтрифторметансульфонатом и на стадии 9.1] (1,0 г, 1,88 ммоль), цианид цинка (0,66 г, 5,64 ммоль), катализатор Pd(PPh3)4 (390 мг, 0,34 ммоль) и 16 мл безводного ДМФА последовательно загружали в микроволновый реактор в атмосфере азота. Реактор герметично закрывали, и смесь энергично перемешивали в течение 10 минут при 180°С при облучении микроволнами. После охлаждения смесь выливали в насыщенный водный раствор NaHCO3. После экстракции EtOAc органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (диизопропиловый эфир/EtOAc от 90/10 до 20/80 и затем диизопропиловый эфир/EtOAc 50/50) получали 342 мг белого порошка (выход 36%).
ЖХМС (способ А): МН+=500,0, RT=8,59 мин.
Стадия 10.2. Гидрохлорид 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила
Продукт получали согласно процедуре, описанной на стадии 4.3, исходя из 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила и 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила, в форме белого порошка (1,8 гидрохлорид; выход 15%).
ЖХМС (способ С): МН+=369,9, RT=6,82 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,92 (д, 2H) 8,80 (с, 1H) 8,61 (шир.с, 1H) 8,08 (с, 1H) 7,90 (д, 2H) 5,47 (д, 1H) 5,43 (д, 1H).
Пример 11. Гидрохлорид 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбоновой кислоты (соединение 202)
Раствор 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила и 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбонитрила [описанных на стадии 10.1] (0,23 г, 0,46 ммоль) в смеси 5 мл уксусной кислоты и 5 мл концентрированной соляной кислоты перемешивали в течение 80 минут при 160°С. Смесь концентрировали досуха. Полученный коричневый остаток растворяли в МеОН и осаждали этиловым эфиром. После фильтрования и сушки в вакууме получали 182 мг порошка бежевого цвета (гидрохлорид, 2,8 Н2О; выход 93%).
ЖХМС (способ А): МН+=389,0, RT=4,37 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 13,33 (шир. с, 1H) 8,88-8,97 (м, 3 H) 8,55 (шир.с, 1H) 7,96 (д, 2H) 7,81 (с, 1H) 5,40 (д, 1H) 5,36 (д, 1H).
Пример 12. Гидрохлорид 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты (соединение 203)
Стадия 12.1. 3-[4-Оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновая кислота и 3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновая кислота
К раствору метил-3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоксилата [полученного с помощью способа, описанным на стадии 7.2] (1,0 г, 2,06 ммоль) в 15 мл ДМСО при 40°С добавляли раствор гидроксида натрия (1 М, 3,1 мл, 3,1 ммоль). Реакционную смесь перемешивали в течение 15 минут при 40°С и затем выливали в воду и подкисляли 30 мл 0,1 М соляной кислоты для достижения рН=3,4. После экстракции EtOAc органическую фазу промывали насыщенным раствором NaCl, сушили над Na2SO4 и концентрировали досуха, и получали 890 мг белого твердого вещества (выход 92%).
ЖХМС (способ А): МН+=473,1, RT=6,73 мин.
Стадия 12.2. Гидрохлорид 3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты
К раствору 3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты и 3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты (50 мг, 0,11 ммоль) в 1 мл DCM добавляли 4 М раствор хлороводорода в диоксане (0,26 мл, 1,06 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь фильтровали. Твердое вещество промывали DCM и сушили в вакууме, и получали 42 мг белого порошка (гидрохлорид; выход 93%).
ЖХМС (способ А): МН+=389,0, RT=1,58 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,68 (дд, 1H) 8,46 (с, 1H) 8,26 (д, 1H) 7,99 (дд, 1H) 7,81 (с, 1H) 7,70 (дд, 1H) 7,42 (дд, 1H) 5,35 (д, 1H) 5,30 (д, 1H).
Пример 13. 4-Оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбоксамид (соединение 205)
Смесь 4-оксо-7-(пирид-4-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-8-карбоновой кислоты [пример 11] (38 мг, 0,10 ммоль), бикарбоната аммония (46 мг, 0,59 ммоль) и трет-бутилдикарбоната (47 мг, 0,22 ммоль) в 1 мл смеси пиридин/EtOAc (1/1) перемешивали при комнатной температуре в атмосфере азота в течение 16 часов и затем концентрировали досуха. После очистки препаративной ВЭЖХ с обращенной фазой на С10 [элюент А: Н2О/0,1 М CH3COONH4 (90/10); элюент B: CH3CN/0,1 М CH3COONH4 (90/10); градиент А/В от 95/5 до 50/50] получали 3 мг белого порошка (8%).
ЖХМС (способ С): МН+=388,0, RT=5,78 мин.
1H ЯМР (500 МГц, ДМСО-d6): δ м.д. 14,37 (шир. с, 1H) 8,65-8,68 (м, 2H) 8,47 (шир.с, 1H) 8,36 (с, 1H) 7,99 (с, 1H) 7,77 (с, 1H) 7,53 (шир.с, 1H) 7,48-7,50 (м, 2H) 5,43 (д, 1H) 5,39 (д, 1H).
Пример 14. Гидрохлорид 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 206)
Стадия 14.1. 7-[2-(Морфолин-4-илкарбонил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты и 3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пиридин-2-карбоновой кислоты [описанных на стадии 12.1] (100 мг, 0,21 ммоль) в 5 мл безводного ТГФ при комнатной температуре в атмосфере азота последовательно добавляли триэтиламин (60 мкл, 0,53 ммоль), PyBOP® (132 мг, 0,25 ммоль) и, после перемешивания в течение 10 минут, морфолин (22 мкл, 22 мг, 0,25 ммоль). Раствор перемешивали в течение 3 часов, выливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией (DCM/EtOH от 100/0 до 95/5) получали 46 мг белого твердого вещества (выход 36%).
ЖХМС (способ А): МН+=542,1, RT=7,18 мин.
Стадия 14.2. Гидрохлорид 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(морфолин-4-илкарбонил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (гидрохлорид, 0,7 Н2О; выход 78%).
ЖХМС (способ А): МН+=458,1, RT=5,95 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,68 (дд, 1H) 8,49 (шир. с, 1H) 8,28 (д, 1H) 8,03 (дд, 1H) 7,81 (с, 1H) 7,66 (дд, 1H) 7,46 (дд, 1H) 5,33 (д, 1H) 5,29 (д, 1H) 3,45-3,52 (м, 2H) 3,33-3,41 (м, 2H) 3,05-3,11 (м, 2H) 2,98-3,04 (м, 2H).
Пример 15. Гидрохлорид N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида (соединение 223)
Стадия 15.1. N-{3-[4-Оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид и N-{3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид
К раствору 7-(2-аминопирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-аминопирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 2.1] (3,0 г, 6,77 ммоль) в 34 мл пиридина, нагретому до 80°С, добавляли уксусный ангидрид (1,28 мл, 13,5 ммоль). После перемешивания при 80°С в течение 2,5 часов реакционную среду охлаждали и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 70/30) получали 2,1 г белого порошка (выход 63%).
ЖХМС (способ А): МН+=486,2, RT=6,69 мин.
Стадия 15.2. Гидрохлорид N-{4-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида
Продукт получали согласно процедуре, описанной на стадии 3.4, исходя из N-{3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида и N-{3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида, в форме белого порошка (гидрохлорид, 1,5 Н2О; выход 66%).
ЖХМС (способ А): МН+=402,0, RT=5,56 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 10,34 (с, 1H) 8,52 (дд, 1H) 8,44 (с, 1H) 8,28 (д, 1H) 8,05 (дд, 1H) 7,82 (с, 1H) 7,54 (дд, 1H) 7,48 (дд, 1H) 5,33 (д, 1H) 5,29 (д, 1H) 1,91 (с, 3 H).
Пример 16. N-{2-[4-Оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид (соединение 232)
Стадия 16.1. N-{2-[4-Оксо-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид и N-{2-[4-оксо-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид
К раствору 7-(2-аминофенил)-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-аминофенил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [полученных согласно способу, описанному на стадии 7.2, исходя из 2-хлоранилина и 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, полученного согласно способу, описанному на стадии 7.1., исходя из 7-бром-1-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-2-{[2-(триметилсилил)этокси]метил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, описанных на стадии 3.1] (0,20 г, 0,41 ммоль), в 2 мл пиридина при комнатной температуре добавляли метансульфонилхлорид (33 мкл, 0,41 мл). После перемешивания в течение 1 часа реакционную среду выливали в одномолярную соляную кислоту и экстрагировали EtOAc. Органическую фазу промывали водой, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (циклогексан/EtOAc от 100/0 до 50/50) получали 195 мг белого порошка (выход 84%).
ЖХМС (способ А): МН+=567,0, RT=9,70 мин.
Стадия 16.2. N-{2-[4-Оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамид
Продукт получали согласно процедуре, описанной на стадии 4.3, исходя из N-{2-[4-оксо-5-(2,2,2-трифторэтил)-1-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамида и N-{2-[4-оксо-5-(2,2,2-трифторэтил)-2-{[2-(триметилсилил)этокси]метил}-4,5-дигидро-2Н-пиразоло[4,3-c]хинолин-7-ил]фенил}метансульфонамида, в форме белого порошка (выход 74%).
ЖХМС (способ В): МН+=437,1, RT=13,31 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 14,29 (шир. с, 1H) 9,08 (шир.с, 1H) 8,39 (шир.с, 1H) 8,24 (д, 1H) 7,79 (с, 1H) 7,37-7,56 (м, 5H) 5,35 (д, 1H) 5,33 (д, 1H) 2,74 (с, 3H).
Пример 17. Гидрохлорид N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида (соединение 241)
Стадия 17.1. N-Метил-N-{3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид и N-метил-N-{3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид
N-{3-[4-Оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид и N-{3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамид [описанные на стадии 15.1] (0,69 г, 1,43 ммоль) и метилйодид (0,27 мл, 4,33 ммоль) в атмосфере азота при комнатной температуре последовательно добавляли к гидриду натрия (60% суспензия в масле, 0,17 г, 4,33 ммоль) в 16 мл безводного ДМФА. После перемешивания в течение 15 минут реакционную смесь выливали в одномолярный раствор гидросульфата калия и экстрагировали EtOAc. Органическую фазу промывали водой и насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 50/50) получали 0,57 г белого порошка (выход 80%).
ЖХМС (способ А): МН+=500,3, RT=1,16 мин.
Стадия 17.2. Гидрохлорид N-метил-N-{3-[4-оксо-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида
Продукт получали согласно процедуре, описанной на стадии 4.3, исходя из N-метил-N-{3-[4-оксо-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида и N-метил-N-{3-[4-оксо-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразоло[4,3-c]хинолин-7-ил]пирид-2-ил}ацетамида, в форме белого порошка (гидрохлорид, 1 Н2О; выход 58%).
ЖХМС (способ А): МН+=416,1, RT=6,15 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,62 (д, 1H) 8,46 (шир. с, 1H) 8,26 (д, 1H) 8,03 (д, 1H) 7,82 (с, 1H) 7,63 (дд, 1H) 7,38 (д, 1H) 5,27-5,41 (м, 2H) 2,97 (с, 3 H) 1,70 (с, 3 H).
Пример 18. Гидрохлорид 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 244)
Стадия 18.1. 7-[2-(1,4-Диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
Раствор 7-(2-фторпирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-фторпирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (1,0 г, 2,16 ммоль) в 11 мл гомопиперазина нагревали в течение 4 часов при 180°С при облучении микроволнами в герметично закрытом реакторе. Раствор охлаждали до комнатной температуры и выливали в воду. Образовавшееся выпавшее в осадок белое вещество отфильтровывали и очищали флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 70/30), и получали 745 мг белого твердого вещества (выход 66%).
ЖХМС (способ А): МН+=527,4, RT=5,90 мин.
Стадия 18.2. Гидрохлорид 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (гидрохлорид, 1 Н2О; выход 75%).
ЖХМС (способ А): МН+=443,2, RT=5,13 мин.
1H ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,90 (шир.с, 2H) 8,44 (шир.с, 1H) 8,28 (д, 1H) 8,24 (дд, 1H) 7,80 (с, 1H) 7,68 (д, 1H) 7,47 (дд, 1H) 7,05 (дд, 1H) 5,35 (д, 1H) 5,31 (д, 1H) 3,58-3,62 (м, 2H) 3,13-3,24 (м, 4H) 2,98-3,06 (м, 2H) 1,80-1,89 (м, 2H).
Пример 19. Гидрохлорид 7-[2-(пиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 244)
Стадия 19.1. 7-[2-(Пиперидин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(пиперидин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
Раствор 7-(2-фторпирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-фторпирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (0,4 г, 0,896 ммоль) и циклогексиламина (0,76 г, 8,96 ммоль) в 5 мл NMP нагревали в течение 2 часов при 185°С в герметично закрытом реакторе при облучении микроволнами. Реакционную смесь выливали в воду и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 90/10) получали 232 мг продукта реакции в форме твердого вещества (выход 51%).
ЖХМС (способ А): МН+=512,1, RT=2,01 мин.
Стадия 19.2. Гидрохлорид 7-[2-(пиперидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(пиперидин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(пиперидин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (гидрохлорид, 1,3 Н2О; выход 86%).
ЖХМС (способ А): МН+=428,2, RT=6,13 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 8,46 (с, 1H) 8,31 (д, 1H) 8,23 (дд, 1H) 7,83-7,98 (м, 2H) 7,62 (д, 1H) 7,23 (дд, 1H) 5,35 (д, 1H) 5,30 (д, 1H) 3,15 (шир.с, 4H) 1,46 (шир.с, 6H).
Пример 20. Гидрохлорид 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 267)
Стадия 20.1. 7-[2-(4-Циклопропилпиперазин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
7-(2-Хлорпирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(2-хлорпирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он [описанные на стадии 7.2] (0,4 г, 0,86 ммоль), трет-бутоксид натрия (0,83 г, 8,64 ммоль), 1-циклопропилпиперазин (0,69 г, 3,46 ммоль), 9 мл безводного ДМФА и катализатор [Pd(μ-Br)(трет-Bu3P)]2 (0,14 г, 0,18 ммоль) последовательно загружали в микроволновый реактор в атмосфере аргона. Реактор герметично закрывали, и смесь перемешивали в течение 30 минут при 100°С при облучении микроволнами. Смесь охлаждали и адсорбировали на диоксиде кремния. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOAc от 100/0 до 50/50) получали 75 мг желтого порошка (выход 16%).
ЖХМС (способ Е): МН+=553,0, RT=1,92 мин.
Стадия 20.2. Гидрохлорид 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(4-циклопропилпиперазин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (3 гидрохлорид, 3 Н2О; выход 70%).
ЖХМС (способ А): МН+=469,2, RT=5,32 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 10,57 (шир.с, 1H) 8,46 (шир.с, 1H) 8,28-8,33 (м, 2H) 7,88 (с, 1H) 7,71-7,75 (м, 2H) 7,19 (дд, 1H) 5,38 (д, 1H) 5,34 (д, 1H) 3,53 (д, 2H) 3,38 (д, 2H) 3,03-3,24 (м, 4H) 2,85 (шир.с, 1H) 1,04 (шир.с, 2H) 0,70-0,78 (м, 2H).
Пример 21. Гидрохлорид 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 270)
Стадия 21.1. 7-[2-(4-Метил-1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 18.1] (0,2 г, 0,38 ммоль) в 17 мл МеОН добавляли формальдегид (0,356 мл, 3,80 ммоль), и раствор перемешивали при комнатной температуре в течение 1 часа. При 0°С добавляли по частям NaBH4 (72 мг, 1,90 ммоль), и наблюдали выделение газа. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем выливали в воду и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. Полученное белое твердое вещество разводили в диизопропиловом эфире, и после фильтрования получали 142 мг продукта реакции в форме белого порошка (выход 70%).
ЖХМС (способ А): МН+=541,2, RT=7,68 мин.
Стадия 21.2. Гидрохлорид 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(4-метил-1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (2 гидрохлорид, 5,5 Н2О; выход 28%).
ЖХМС (способ А): МН+=457,2, RT=5,21 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 9,61 (шир.с, 1H) 8,40 (шир.с, 1H) 8,18-8,29 (м, 2H) 7,76 (с, 1H) 7,64 (дд, 1H) 7,45 (д, 1H) 7,01 (дд, 1H) 5,26-5,42 (м, 2H) 2,91-4,04 (м, 8H) 2,73-2,80 (м, 3H) 1,90 (шир.с, 2H).
Пример 22. Гидрохлорид 7-[2-(4-циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 271)
Стадия 22.1. 7-[2-(4-Циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(4-циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 18.1] (0,1 г, 0,19 ммоль) в 8 мл МеОН добавляли (1-метоксициклопропокси)триметилсилан (36,5 мг, 0,23 ммоль). Смесь перемешивали в течение 30 минут при комнатной температуре, и затем добавляли NaBH3CN (24 мг, 0,38 ммоль). Наблюдали выделение газа, и смесь перемешивали в течение 72 часов. Полученную смесь выливали в водный раствор, экстрагировали EtOAc, экстракт промывали насыщенным водным раствором NaCl, сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Получали 85 мг белого твердого вещества (выход 78%).
ЖХМС (способ А): МН+=567,1, RT=6,11 мин.
Стадия 22.2. Гидрохлорид 7-[2-(4-циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(4-циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(4-циклопропил-1,4-диазепан-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (гидрохлорид, 3,6 Н2О; выход 57%).
ЖХМС (способ А): МН+=483,2, RT=5,36 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 9,95 (шир.с, 1H) 8,44 (шир.с, 1H) 8,19-8,29 (м, 2H) 7,77 (с, 1H) 7,66 (дд, 1H) 7,46 (д, 1H) 7,02 (дд, 1H) 5,33 (кв, 2H) 3,54 (шир.с, 2H) 3,12-3,47 (м, 4H) 3,06 (шир.с, 2H) 2,88 (шир.с, 1H) 1,96 (шир.с, 2H) 1,00-1,06 (м, 2H) 0,72-0,84 (м, 2H).
Пример 23. 7-[2-(3-Фторпирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он (соединение 272)
Стадия 23.1. 7-[2-(3-Фторпирролидин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору трифторида диметиламиносеры (32 мг, 0,20 ммоль) в 4 мл DCM, охлажденному до -70°С, добавляли 7-[2-(3-гидроксипирролидин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-[2-(3-гидроксипирролидин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он [полученные согласно способу, описанному на стадии 18.1, исходя из пирролидин-3-ола] (85 мг, 0,17 ммоль), растворенные в 3 мл DCM. Смесь перемешивали в течение 2 часов при комнатной температуре, затем добавляли насыщенный водный раствор NaHCO3, и полученную смесь экстрагировали DCM. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 90/10) получали 38 мг белого твердого вещества (выход 43%).
ЖХМС (способ Е): МН+=516,1, RT=1,89 мин.
Стадия 23.2. Гидрохлорид 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, исходя из 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-[2-(3-фторпирролидин-1-ил)пирид-3-ил]-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она, в форме белого порошка (гидрохлорид, Н2О; выход 47%).
ЖХМС (способ А): МН+=432,1, RT=5,50 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 8,45 (шир.с, 1H) 8,26 (д, 1H) 8,17 (дд, 1H) 7,82 (с, 1H) 7,76 (шир.с, 1H) 7,41 (д, 1H) 7,02 (шир.с, 1H) 5,15-5,39 (м, 3H) 3,18-3,48 (м, 4H) 1,83-2,22 (м, 2H).
Пример 24. 7-(2-Гидроксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он (соединение 274)
Стадия 24.1. 7-(2-Метроксипирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(2-метоксипирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-бром-1-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-бром-3-(тетрагидро-2Н-пиран-2-ил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она [описанных на стадии 1.4] (0,40 г, 0,93 ммоль) в 10 мл ДМФА, помещенному в микроволновый реактор, добавляли 2-метокси-3-пиридинбороновую кислоту (0,284 г, 1,86 ммоль), Cs2CO3 (1,2 г, 3,72 ммоль), 1 мл обезгаженной воды и катализатор PdCl2(dppf) (0,159 мг, 0,2 ммоль). Реактор герметично закрывали, и смесь перемешивали при 110°С при облучении микроволнами в течение 10 минут в атмосфере азота. Реакционную смесь охлаждали, выливали в воду и экстрагировали EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, сушили над Na2SO4 и концентрировали досуха. После очистки флэш-хроматографией на диоксиде кремния (DCM/EtOH от 100/0 до 90/10) получали 103 мг желтого твердого вещества (выход 24%).
ЖХМС (способ А): МН+=459,2, RT=9,04 мин.
Стадия 24.2. 7-(2-Гидроксипирид-3-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К раствору 7-(2-метоксипирид-3-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она и 7-(2-метоксипирид-3-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (90 мг, 0,20 ммоль) в смеси DCM/MeOH (50/50) добавляли 4 М раствор хлороводорода в безводном диоксане (2 мл, 2,45 ммоль). Раствор перемешивали при комнатной температуре в течение 10 суток и затем выливали в диизопропиловый эфир. Образовавшееся выпавшее в осадок вещество отфильтровывали и промывали EtOH. Получали 52 мг белого твердого вещества (выход 65%).
ЖХМС (способ А): МН+=361,0, RT=5,91 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 14,30 (шир.с, 1H) 11,92 (шир.с, 1H) 8,20-8,80 (м, 1H) 8,17 (д, 1H) 8,08 (шир.с, 1H) 7,85 (д, 2H) 7,48 (д, 1H) 6,38 (т, 1H) 5,31 (кв, 2H).
Пример 25. Гидрохлорид 7-(1-оксидопирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (соединение 275)
Стадия 25.1. 7-(1-Оксидопирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(1-оксидопирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он
К суспензии 7-(пирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(пирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-2,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она (280 мг, 0,65 мл) в 5 мл DCM при 0°С добавляли мета-хлорпербензойную кислоту (585 мг, 2,62 ммоль). Смесь перемешивали в течение 3 часов при комнатной температуре. После очистки флэш-хроматографией на аминной фазе (DCM/EtOAc от 95/5 до 80/20 и затем DCM/EtOH 95/5) получали 120 мг белого порошка (выход 43%).
ЖХМС (способ А): МН+=445,2, RT=6,69 мин.
Стадия 25.2. Гидрохлорид 7-(1-оксидопирид-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она
Продукт получали согласно процедуре, описанной на стадии 1.7, обрабатывая 7-(1-оксидопирид-2-ил)-1-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он и 7-(1-оксидопирид-2-ил)-2-(тетрагидро-2Н-пиран-2-ил)-5-(2,2,2-трифторэтил)-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он 4 М раствором HCl в диоксане, в форме белого порошка (гидрохлорид, 1 Н2О; выход 99%).
ЖХМС (способ А): МН+=361,2, RT=5,53 мин.
1H ЯМР (250 МГц, ДМСО-d6): δ м.д. 8,48 (шир.с, 1H) 8,39-8,43 (м, 1H) 8,27 (д, 1H) 8,15 (с, 1H) 7,92 (д, 1H) 7,70-7,76 (м, 1H) 7,46-7,52 (м, 2H) 5,36 (д, 1H) 5,31 (д, 1H).
Таблица, которая следует далее, иллюстрирует химические структуры и физические свойства ряда соединений по изобретению. В указанной таблице
- Ме, Et, Pr, c-Pr и изо-Pr представляют собой, соответственно, метильную, этильную, пропильную, циклопропильную и изопропильную группы;
- в колонке «Соль» «/» представляет соединение в форме свободного основания, в то время как «HCl» представляет соединение в форме гидрохлорида, и «ТФК» представляет соединение в форме соли трифторуксусной кислоты.
|
Соединения по изобретению подвергали биохимическим исследованиям для того, чтобы определить их способность ингибировать фермент метионинаминопептидазу 2 (ферментный тест на выделенном ферменте). Затем ингибирующую активность соединений подтверждали клеточным тестом (испытание на пролиферацию in vitro клеток HUVEC, индуцированную FGF-2 (фактор роста фибробластов 2)).
Ферментный скрининг-тест MetAP2
Для ферментного теста человеческий белок MetAP2 получали из культурального супернатанта клеток насекомых (sf9), инфицированных MetAP2-рекомбинантным бакуловирусом.
Перед выполнением эксперимента выполняли диализ супернатанта MetAP2 в течение 24 часов при 4°С в буфере (10 мМ Hepes, 100 мМ KCl, 10% глицерина, рН 7,4) в присутствии ЭДТК (1 мМ) в течение первых 12 часов.
Диализованный супернатант извлекали, и добавляли марганец, используемый как кофактор, в конечной концентрации 300 мкМ.
Ферментный тест представляет собой испытание в две стадии.
На первой стадии оно состоит в приведении в контакт соединения по изобретению, диализованного белка MetAP2 и субстрата (пептида Met-Pro-Arg-pNa, синтезированного Neosystem), N-концевой метионин которого может быть отщеплен MetAP2, и который имеет в С-конце хромофор пара-нитроанилин (pNa), который сам может высвобождаться другой пептидазой только когда N-концевой метионин заблаговременно отщеплен.
Следовательно, вторая стадия состоит во взаимодействии пептидов, расщепленных на предыдущей стадии, со второй пептидазой для того, чтобы высвободить хромофор. Пептидазой, используемой на второй стадии, является катепсин, который берут из набора TagZyme “DAPase” (Quiagen, 34366).
Активность MetAP2 пропорциональна количеству высвобожденного пара-нитроанилина, которое измеряли по поглощению при 405 нм.
Величины IC50 для соединений по изобретению обычно составляют менее 550 нМ, чаще от 1 до 550 нМ, и даже еще чаще от 1 до 100 нм, и/или соединения показывают ингибирование при 100 нМ большее или равное 34%, как показано в таблице ниже.
|
Для того чтобы определить селективность соединений по изобретению в отношении белка MetAP1, выполняли ферментный тест на изолированном ферменте. Рекомбинантный белок MetAP1 получали в Escherichia colli.
Ферментный тест для MetAP1 основан на том же принципе, что и тест для MetAP2.
Активность MetAP1 пропорциональна количеству высвобожденного пара-нитроанилина, которое измеряли по поглощению при 405 нм.
Соединения по изобретению не показывают активность при 10 мкМ.
Испытание на пролиферацию in vitro клеток HUVEC, индуцированную фактором роста фибробластов 2 (FGF-2)
Показано, что ингибитор ангиогенеза фумагиллин способен селективно ингибировать пролиферацию эндотелиальных клеток (Wang J. et al., J. Cell. Biochem., 2000, vol.77, 465-473). Поэтому соединения по изобретению, которые показывают хорошую активность в ферментном тесте с MetAP2, оценивали в испытании на пролиферацию in vitro клеток HUVEC, индуцированную FGF-2.
Эндотелиальные клетки вены человека HUVEC (promocell, C-12200) высевали в количестве 5000 клеток на лунку в 96-луночные планшеты (Biocoat collagen I cellware, Becton Dickinson 354650) в 200 мкл среды ЕВМ (Clonetics C3121) с 2% FCS (фетальная телячья сыворотка) и hEGF (эпидермальный фактор роста человека) при 10 мкг/мл и затем инкубировали в течение 24 часов при 37 оС в присутствии СО2. Затем среду аспирировали и заменяли 200 мкл среды для депривации RPMI1640 (Invitrogen, 31872-025) с добавлением 0,5% FCS, 2 мМ глутамина, 2 мМ пирувата натрия 1х (Invitrogen, 11360-039) и NEAA (заменимые аминокислоты) 1х (Invitrogen, 11140-035). Затем клетки приводили в контакт с соединением по изобретению и FGF-2 в количестве 1 нг/мл (R&D System, 133-FB-025). После инкубации в течение 48 часов среду аспирировали и заменяли средой для депривации RPMI1640, упомянутой ранее. Затем выполняли вторую стимуляцию. Клетки снова инкубировали при 37°С в присутствии СО2. После инкубации в течение 72 часов среду снова аспирировали, и в течение 10 минут добавляли 100 мкл GLO™ для титра клеток в люминесцентном анализе клеток на жизнеспособность (Promega, G7571). Количество АТР, присутствующей в клетках, измеренное с использованием люминометра, пропорционально числу клеток на лунку, соответствующему пролиферации клеток.
Величины IC50 для соединений по изобретению, как правило, меньше 900 нМ, чаще от 150 до 900 нМ и даже чаще от 100 до 350 нМ, как указано, например, для соединений, приведенных ниже.
|
Таким образом, оказывается, что соединения по изобретению имеют ингибирующую активность в отношении MetAP2.
Таким образом, соединения по изобретению можно использовать для получения лекарственных средств, в частности, лекарственных средств для предупреждения или лечения любой патологии, в которую вовлечена MetAP2, конкретнее показанную ниже.
Таким образом, соединения по изобретению можно использовать для предупреждения или лечения любой патологии, в которую вовлечена MetAP2, конкретнее показанную ниже.
Таким образом, согласно другим аспектам предметом изобретения являются лекарственные средства, которые включают соединение формулы (I) или его соль присоединения с фармацевтически приемлемой кислотой или, с другой стороны, гидрат соединения формулы (I).
Таким образом, соединения по изобретению можно использовать для людей или животных при лечении или предупреждении фиброза легких и печени.
Соединения по изобретению также можно использовать при лечении или предупреждении патологий, включающих реактивацию ангиогенеза, таких как диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна (ARMD) и псориаз.
Соединения по изобретению также можно использовать при лечении или предупреждении любой карциномы с существенной степенью васкуляризации, такой как карцинома легких, молочной железы, предстательной железы, пищевода, поджелудочной железы, печени, толстой кишки или почек, или карцином, которые индуцируют метастазы, таких как карцинома толстой кишки, молочной железы, печени и желудка, и меланом. Указанные соединения можно использовать в монотерапии или в комбинации с лучевой терапией или химиотерапией.
Соединения по изобретению также можно использовать при лечении от рака, одни или в комбинации с химиотерапией, или солидных опухолей, таких как опухоли поджелудочной железы, молочной железы, предстательной железы, толстой кишки или почек, при лечении от нейробластом и саркомы Капоши.
Соединения по изобретению также можно использовать при лечении или предупреждении гепатокарцином, холангиокарциномы и также злокачественной мезотелиомы, рака поджелудочной железы, гемангиомы, эндометриоза, артрита, и в частности, ревматоидного артрита, аутоиммунных заболеваний, ожирения и микроспоридиоза.
Согласно другому своему аспекту настоящее изобретение относится к фармацевтическим композициям, включающим в качестве активной основы соединение по изобретению. Такие фармацевтические композиции содержат эффективную дозу, по меньшей мере, одного соединения по изобретению или фармацевтически приемлемой соли указанного соединения и также, по меньшей мере, один фармацевтически приемлемый эксципиент.
Указанные эксципиенты выбирают, соответственно фармацевтической форме и желательному типу введения, из обычных эксципиентов, известных специалистам в данной области техники.
В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, наружного, местного, интратрахеального, интраназального, трансдермального или ректального введения активная основа указанной выше формулы (I) или ее соль может вводиться в стандартной для введения форме в виде смеси со стандартными фармацевтическими эксципиентами людям и животным для предупреждения или лечения указанных выше расстройств или заболеваний.
Соответствующие стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, сублингвальные, трансбуккальные, интратрахеальные, интраокулярные, интраназальные или инагаляционные формы для введения, формы для местного, парентерального введения, такого как трансдермальное, подкожное, внутримышечное или внутривенное введение, формы для ректального введения и импланты. Для местного введения соединения по изобретения могут использоваться в кремах, гелях, мазях или лосьонах.
Как пример, стандартная лекарственная форма соединения по изобретению в форме таблетки может включать следующие компоненты:
соединение по изобретению - 50,0 мг;
маннит - 223,75 г;
кроскармелозанатрий - 6,0 мг;
кукурузный крахмал - 15,0 мг;
гидроксипропилметилцеллюлоза - 2,25 мг;
стеарат магния - 3,0 мг.
Доза активной основы, вводимая в сутки, может колебаться от 0,01 до 100 мг/кг, и преимущественно составляет 0,02-50 мг/кг, за один или несколько приемов. Как правило, суточная доза соединения по изобретению будет составлять наименьшую эффективную дозу соединения, которая способна производить терапевтическое действие.
Могут иметь место отдельные случаи, в которых подходящими являются более высокие или более низкие дозировки; такие дозировки не отклоняются от объема изобретения. Согласно обычной практике, дозировка, которая является подходящей для каждого пациента, определяется врачом согласно способу введения и массе и реакции указанного пациента.
Согласно другому своему аспекту настоящее изобретение также относится к способу лечения патологий, указанных выше, который включает введение пациенту эффективной дозы соединения по изобретению или его фармацевтически приемлемой соли.