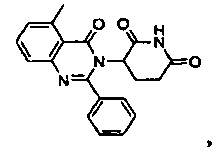
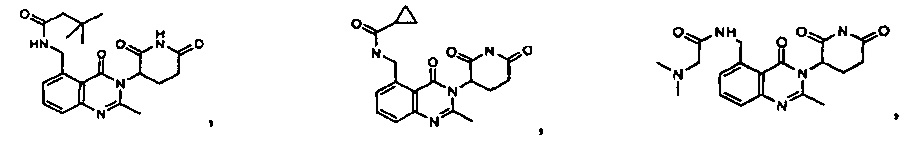
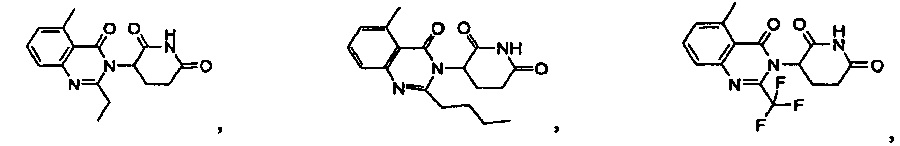
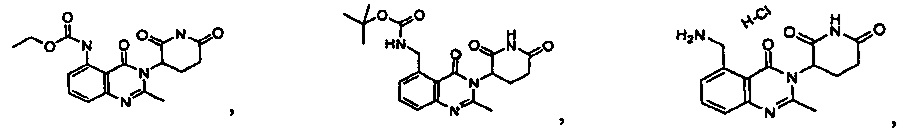
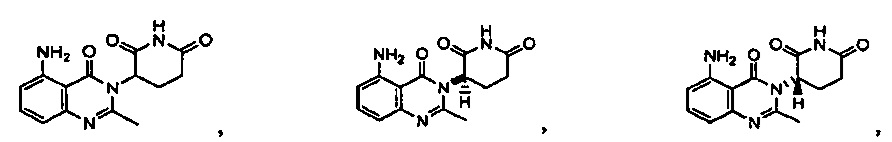
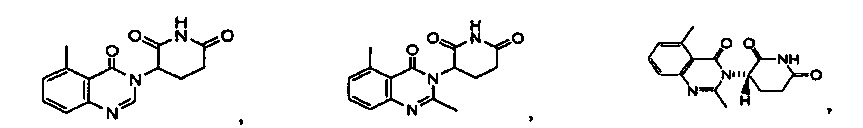
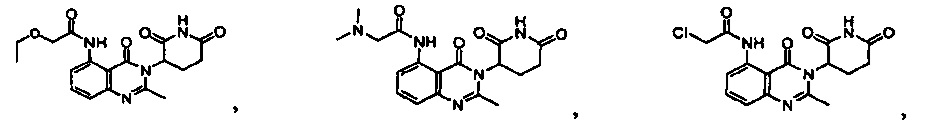
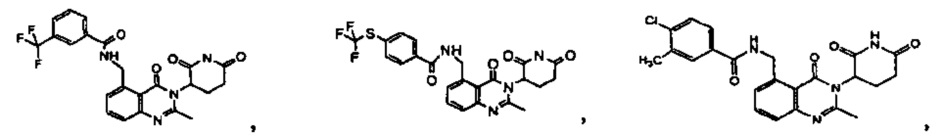
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 5-ЗАМЕЩЕННОГО ХИНАЗОЛИНОНА, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Данная заявка заявляет приоритет предварительной заявки на патент США № 60/847471, направленной на рассмотрение 26 сентября 2006 г., содержание которой включено в описание в качестве ссылки.
1. Область техники
Предложены производные 5-замещенного хиназолинона. Также раскрыты фармацевтические композиции, содержащие эти соединения, и способы лечения, профилактики и контролирования различных нарушений.
2. Уровень техники
2.1 Патология рака и других заболеваний
Рак характеризуется главным образом повышением числа аномальных клеток, образующихся из данной нормальной ткани, инвазией соседних тканей такими аномальными клетками или лимфатическим или переносимым кровью распространением злокачественных клеток к регионарным лимфоузлам и к дистантным сайтам (метастазирование). Клинические данные и молекулярные биологические исследования показывают, что рак представляет собой многоступенчатый процесс, который начинается с незначительных предраковых изменений, которые при определенных условиях развиваются в неоплазию. Неопластическое повреждение может эволюционизировать клонально и развивать повышенную способность для инвазии, роста, метастазирования и неоднородности, особенно в условиях, при которых неопластические клетки избегают иммунного надзора реципиента. (см. Roitt I., Brostoff J., Kale D., Immunology, 17.1-17.12, 3-rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное множество раковых заболеваний, которые подробно описаны в медицинской литературе. Примерами являются рак легких, толстой кишки, прямой кишки, простаты, молочной железы, мозга и кишечника. Распространенность рака продолжает расти по мере старения основной популяции, по мере появления новых видов рака и по мере увеличения восприимчивых популяций (например, людей, инфицированных СПИДом или подвергшихся чрезмерному воздействию солнечного света). Однако варианты лечения рака ограничены. Например, в случае рака крови (например, множественной миеломы) доступно незначительное число вариантов лечения, в особенности, когда обычная химиотерапия не оправдывается, а трансплантация костного мозга невозможна. Таким образом, существует огромная потребность в новых способах и композициях, которые могут быть использованы для лечения больных раком.
Многие типы рака ассоциируются с образованием новых кровеносных сосудов, процессом, известным как ангиогенез. Выяснено несколько механизмов, вовлеченных в ангиогенез, вызывающих образование опухоли. Главным направлением из этих механизмов является секреция опухолевыми клетками цитокинов с ангиогенными свойствами. Примерами таких цитокинов являются кислотный и основный фактор роста фибробластов (a,b-FGF), ангиогенин, сосудистый эндотелиальный фактор роста (VEGF) и TNF-α. С другой стороны, опухолевые клетки могут высвобождать ангиогенные пептиды через продуцирование протеаз и последующий распад внеклеточной матрицы, где накапливаются некоторые цитокины (например, b-FGF). Ангиогенез также может быть вызван опосредованно через рекрутмент воспалительных клеток (в частности, макрофагов) и последующее высвобождение ангиогенных цитокинов (например, TNF-α, b-FGF).
Ряд других заболеваний и нарушений также ассоциируется с или характеризуется нежелательным ангиогенезом. Например, усиленный или неурегулированный ангиогенез вовлечен в ряд заболеваний или медицинских состояний, включая, но без ограничения ими: глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, покраснение (неовакуляризация радужно-роговичного угла), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и автоиммунные заболевания. Примерами таких заболеваний и состояний являются, но не ограничиваются ими: диабетическая ретинопатия; ретинопатия недоношенных; корнеальное отторжение трансплантата; неоваскулярная глаукома; ретролентальная фиброплазия; артрит; и пролиферативная витреоретинопатия.
Таким образом, соединения, которые могут контролировать ангиогенез или ингибировать продуцирование некоторых цитокинов, включая TNFα, могут быть полезны при лечении или профилактике различных заболеваний и состояний.
2.2. Способы лечения рака
Современное лечение рака может включать хирургическое вмешательство, химиотерапию, гормональную терапию и/или лучевую терапию, чтобы уничтожить неопластические клетки у пациента (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). В последнее время лечение рака также включает биологическую терапию или иммунотерапию. Все эти методики обладают значительными недостатками для пациента. Хирургическое вмешательство, например, может противопоказано вследствие состояния здоровья больного и может быть неприемлемо для него. Кроме того, при хирургическом вмешательстве неопластическая ткань может быть удалена не полностью. Лучевая терапия эффективна только тогда, когда неопластическая ткань проявляет более высокую чувствительность к облучению, чем нормальная ткань. Лучевая терапия также часто может вызывать серьезные побочные эффекты. Гормональная терапия редко проводится в виде единственного средства. Хотя гормональная терапия может быть эффективна, ее часто используют для профилактики или задержки рецидива рака после того, как другими видами лечения удалена большая часть раковых клеток. Биологическая терапия и иммунотерапия ограничены количеством и могут давать побочные эффекты, такие как сыпь или опухание, гриппоподобные симптомы, включая лихорадку, озноб и утомление, проблемы пищевого тракта или аллергические реакции.
Что касается химиотерапии, то существует ряд химиотерапевтических средств, доступных для лечения рака. Большая часть противораковых химиотерапевтических средств действует путем ингибирования синтеза ДНК или напрямую или опосредованно за счет ингибирования биосинтеза деоксирибонуклеотид-трифосфатных предшественников, чтобы предупредить репликацию ДНК и сопутствующее деление клеток (Gilman et al., Goodman and Gilman’s: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, New York).
Несмотря на доступность ряда химиотерапевтических средств, химиотерапия имеет много недостатков (см., Stockdale, Medicine, Vol. 3, Rubenstein and Federman, eds., Ch. 12, Sect. 10, 1998). Почти все химиотерапевтические средства являются токсичными, и химиотерапия вызывает значительные и часто опасные побочные эффекты, в том числе тяжелую тошноту, подавление костного мозга и иммуносупрессию. Кроме того, даже при введении комбинаций химиотерапевтических средств многие опухолевые клетки являются устойчивыми или развивают устойчивость к химиотерапевтическим средствам. Действительно, те клетки, которые устойчивы к конкретным химиотерапевтическим средствам, используемым в схеме лечения, часто, как оказывается, устойчивы к другим лекарствам, даже если эти средства действуют по другому механизму, чем механизм действия лекарств, используемых при конкретном лечении. Это явление называют плейотропным лекарством или множественной устойчивостью. Из-за лекарственной устойчивости многие виды рака проявляют невосприимчивость или становятся невосприимчивыми к химиотерапевтическим схемам лечения.
Другие заболевания или состояния, ассоциирующиеся с нежелательным ангиогенезом или характеризующиеся нежелательным ангиогенезом, также трудно поддаются лечению. Однако предложены некоторые соединения, такие как протамин, гепаин и стероиды, которые могут быть использованы при лечении некоторых конкретных заболеваний. (см., Taylor et al., Nature 297:307; Folkmann et al., Science 221:719 (1983); и патенты США №№ 5001116 и 4994443).
Кроме того, существует большая потребность в безопасных и эффективных способах лечения, профилактики и контролирования рака и других заболеваний и состояний, включая заболевания, которые невосприимчивы к стандартным видам лечения, таким как хирургическое вмешательство, химиотерапия и гормональная терапия, при снижении или исключении токсичности и/или побочных эффектов, связанных с обычным лечением.
3. Сущность изобретения
В изобретении предложены 5-замещенные хиназолиноновые соединения и их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства, клатраты или стереоизомеры.
Также предложены способы лечения и регулирования различных заболеваний или нарушений. Способы включают введение пациенту, нуждающемуся в таком лечении или регулировании, терапевтически эффективного количества соединения, предложенного в изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
Также предложены способы профилактики различных заболеваний и нарушений, которые включают введение пациенту, нуждающемуся в такой профилактике, профилактически эффективного количества соединения, предложенного в изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
Кроме того, в изобретении предложены фармацевтические композиции, единичные дозированные лекарственные формы, схемы дозирования и наборы, которые включают соединение, предложенное в изобретении, или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер.
4. Подробное описание изобретения
В одном из вариантов осуществления предложены 5-замещенные хиназолиноновые соединения и их фармацевтически приемлемые соли, сольваты, пролекарства, клатраты и стереоизомеры.
В другом варианте изобретения предложены способы лечения, регулирования и профилактики различных заболеваний и нарушений, которые включают введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически или профилактически эффективного количества соединения, предложенного в изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера. Примеры заболеваний и нарушений описаны в изобретении.
В других вариантах осуществления, соединение, предложенное в изобретении, или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер, вводят в комбинации с другим лекарственным средством («вторым активным агентом») или лечением. Вторые активные агенты включают небольшие молекулы и большие молекулы (например, белки и антитела), примеры которых приведены в описании, а также стволовые клетки. Способы или методы терапии, которые могут быть использованы в комбинации с введением соединений, предложенных изобретением, включают, но не ограничиваются ими, хирургическое вмешательство, переливание крови, иммунотерапию, биологическую терапию, лучевую терапию и другие нелекарственные способы лечения, используемые в настоящее время для лечения, профилактики или регулирования различных нарушений, описанных в изобретении.
Кроме того, предложены фармацевтические композиции (например, единичные дозированные лекарственные формы), которые могут быть использованы в способах, предложенных в изобретении. В одном из вариантов осуществления, фармацевтические композиции содержат соединение, предложенное в изобретении, или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер, и необязательно второй активный агент.
4.1. Соединения
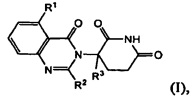
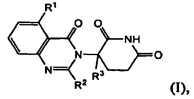
В одном из вариантов осуществления предложены соединения формулы (I):
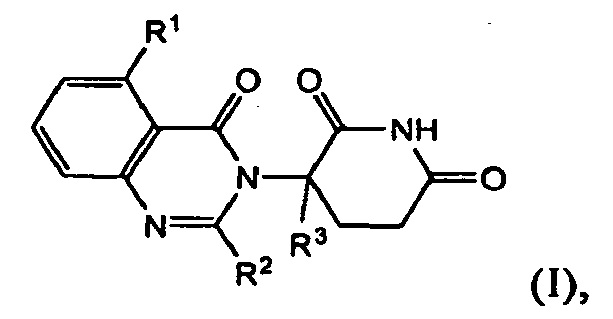
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R1 представляет собой атом водорода; атом галогена; -(CH2)nOH; (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; (С1-С6)алкокси-группу, необязательно замещенную одним или несколькими атомами галогена; или
-(СН2)nNHRa, где Ra представляет собой
атом водорода;
(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
-(СН2)n-(6-10-членный арил);
-С(О)-(СН2)n-(6-10-членный арил) или -С(О)-(СН2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещены одним или несколькими заместителями из атома галогена; -SCF3; (С1-С6)алкила, самого необязательно замещенного одним или несколькими атомами галогена; или (С1-С6)алкокси-группы, самой необязательно замещенной одним или несколькими атомами галогена;
-С(О)-(С1-С8)алкил, где алкил необязательно замещен одним или несколькими атомами галогена;
-С(О)-(СН2)n-(С3-С10-циклоалкил);
-С(О)-(СН2)n-NRbRc, где Rb и Rc каждый независимо друг от друга представляет собой
атом водорода;
(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
(С1-С6)алкокси-группу, необязательно замещенную одним или несколькими атомами галогена; или
6-10-членный арил, необязательно замещенный одним или несколькими заместителями из атома галогена; (С1-С6)алкила, самого необязательно замещенного одним или несколькими атомами галогена; или (С1-С6)алкокси-группы, самой необязательно замещенной одним или несколькими атомами галогена;
-С(О)-(СН2)n-О-(С1-С6)алкил; или
-С(О)-(СН2)n-О-(СН2)n-(6-10-членный арил);
R2 представляет собой атом водорода; -(СН2)nOH; фенил; -О(С1-С6)алкил; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
R3 представляет собой атом водорода; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; и
n принимает значения 0, 1 или 2.
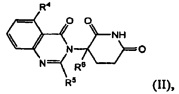
В одном из вариантов осуществления предложены соединения формулы (II):
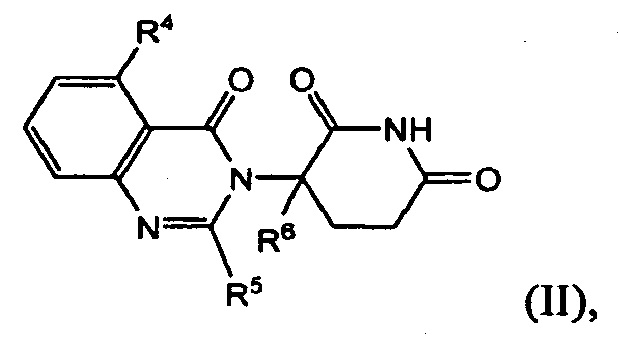
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R4 представляет собой атом водорода; атом галогена; -(CH2)nOH; (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; (С1-С6)алкокси-группу, необязательно замещенную одним или несколькими атомами галогена;
R5 представляет собой атом водорода; -(СН2)nOH; фенил; -О(С1-С6)алкил; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
R6 представляет собой атом водорода; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; и
n принимает значения 0, 1 или 2.
В одном из вариантов осуществления R4 представляет собой атом водорода. В другом варианте осуществления R4 представляет собой атом галогена. В другом варианте осуществления R4 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена. В другом варианте осуществления R4 представляет собой –(СН2)nOH или гидроксил. В другом варианте осуществления R4 представляет собой (С1-С6)-алкокси-группу, необязательно замещенную одним или несколькими атомами галогена.
В одном из вариантов осуществления R5 представляет собой атом водорода. В другом варианте осуществления R5 представляет собой –(СН2)nOH или гидроксил. В другом варианте осуществления R5 представляет собой фенил. В другом варианте осуществления R5 представляет собой –О-(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена. В другом варианте осуществления R5 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления R6 представляет собой атом водорода. В другом варианте осуществления R6 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления n равно 0. В другом варианте осуществления n равно 1. В другом варианте осуществления n равно 2.
Соединения, предложенные в изобретении, охватывают любые комбинации R4, R5, R6 и n, описанных выше.
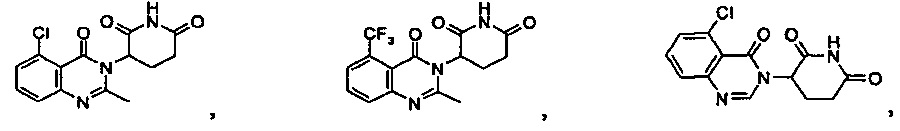
В одном из конкретных вариантов осуществления R4 представляет собой метил. В другом варианте осуществления R4 представляет собой метокси-группу. В другом варианте осуществления R4 представляет собой –CF3. В другом варианте осуществления R4 представляет собой F или Cl.
В другом конкретном варианте осуществления R5 представляет собой метил. В другом варианте осуществления R5 представляет собой –CF3.
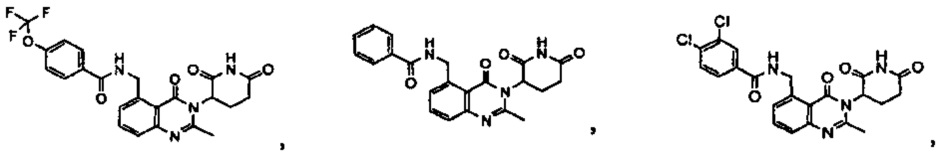
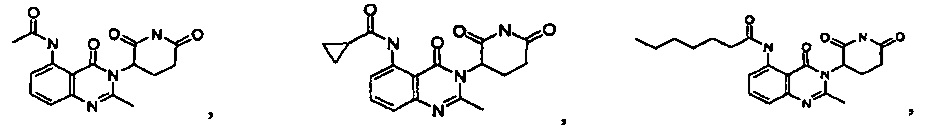
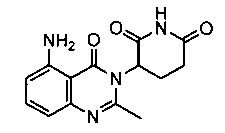
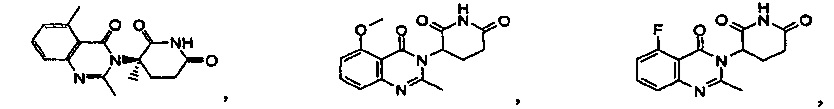
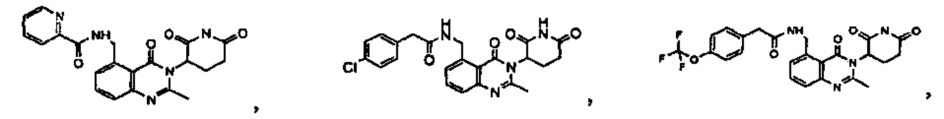
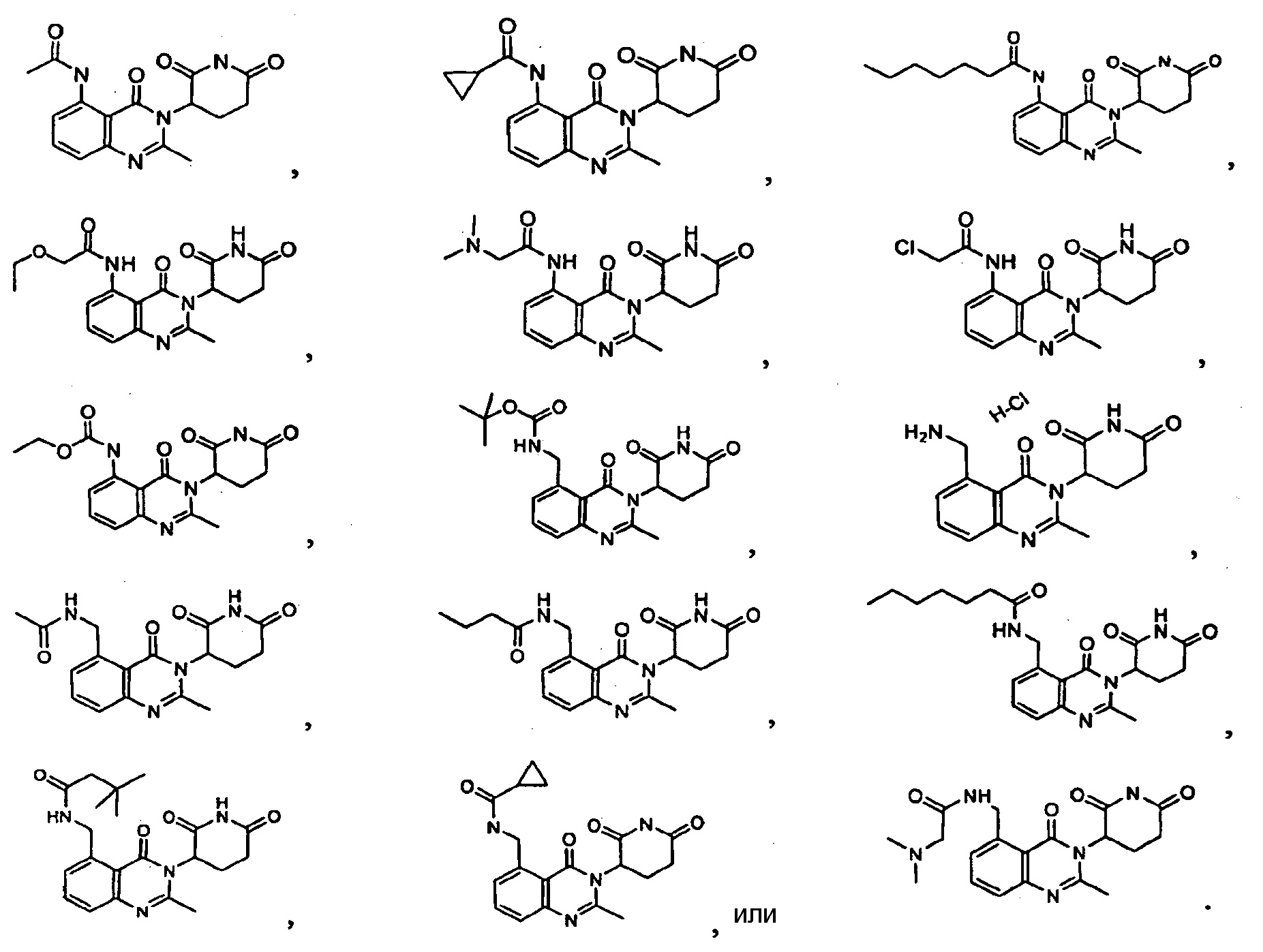
Конкретные примеры включают, но не ограничиваются ими:
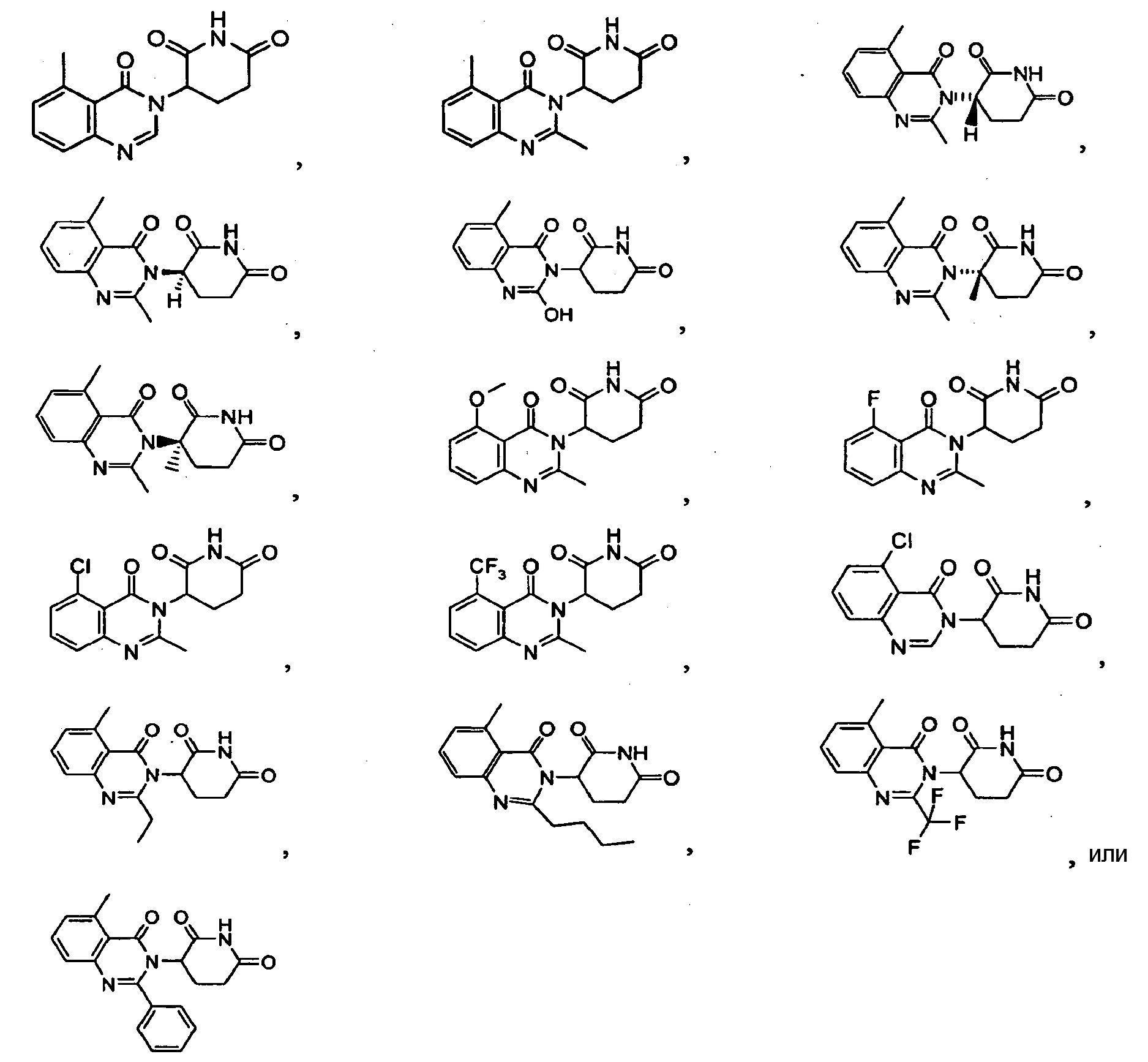
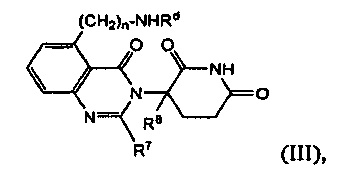
В другом варианте осуществления предложены соединения формулы (III):
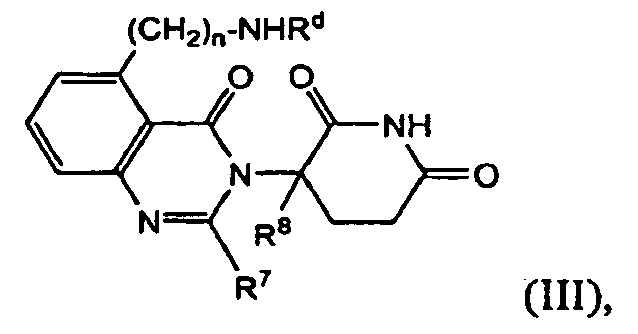
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
Rd представляет собой
атом водорода;
(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
-С(О)-(С1-С8)алкил, где алкил необязательно замещен одним или несколькими атомами галогена;
-С(О)-(СН2)n-(С3-С10-циклоалкил);
-С(О)-(СН2)n-NReRf, где Re и Rf каждый независимо друг от друга представляет собой
атом водорода;
(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; или
(С1-С6)алкокси-группу, необязательно замещенную одним или несколькими атомами галогена; или
-С(О)-(СН2)n-О-(С1-С6)алкил;
R7 представляет собой атом водорода; -(СН2)nOH; фенил; -О-(С1-С6)алкил; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
R8 представляет собой атом водорода; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; и
n принимает значения 0, 1 или 2.
В одном из вариантов осуществления Rd представляет собой атом водорода. В другом варианте осуществления Rd представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена. В другом варианте осуществления Rd представляет собой -С(О)-(С1-С8)алкил. В другом варианте осуществления Rd представляет собой -С(О)-(СН2)n-(С3-С10-циклоалкил). В другом варианте осуществления Rd представляет собой -С(О)-(СН2)n-NReRf, где Re и Rf имеют значения, описанные выше. В другом варианте осуществления Rd представляет собой -С(О)-(СН2)n-О-(СН2)n-(С1-С6)алкил.
В одном из вариантов осуществления R7 представляет собой атом водорода. В другом варианте осуществления R7 представляет собой –(СН2)nOH или гидроксил. В другом варианте осуществления R7 представляет собой фенил. В другом варианте осуществления R7 представляет собой -О-(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена. В другом варианте осуществления R7 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления R8 представляет собой атом водорода. В другом варианте осуществления R8 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления n равно 0. В другом варианте осуществления n равно 1. В другом варианте осуществления n равно 2.
Соединения, предложенные в изобретении, охватывают любые комбинации Rd, R7, R8 и n, описанных выше.
В одном из конкретных вариантов осуществления R7 представляет собой метил. В другом варианте осуществления Rd представляет собой –С(О)(С1-С6)алкил. В другом варианте осуществления Rd представляет собой NH2. В другом варианте осуществления Rd представляет собой –С(О)-СН2-О-(С1-С6)алкил.
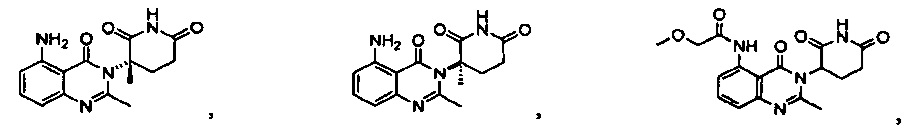
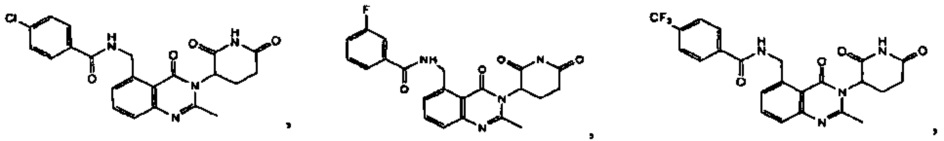
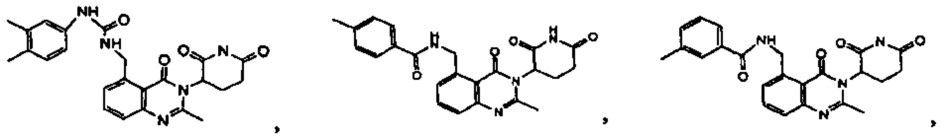
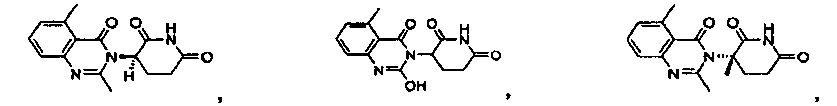
Конкретные примеры включают, но не ограничиваются ими:
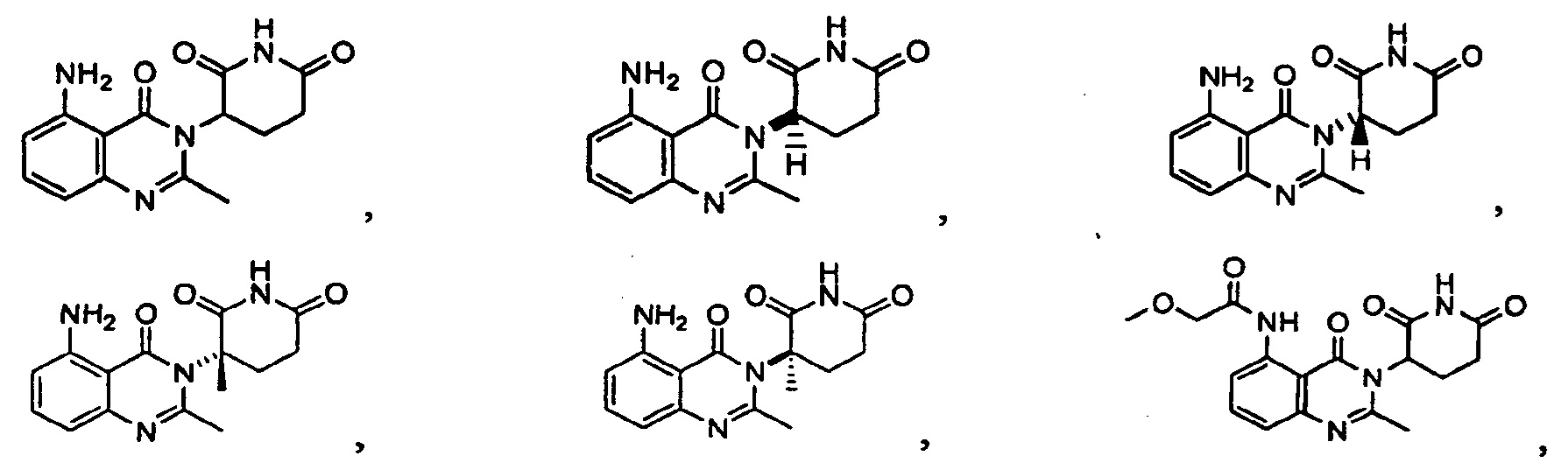
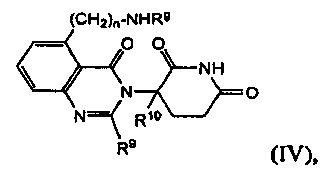
В другом варианте осуществления изобретение предлагает соединения формулы (IV):
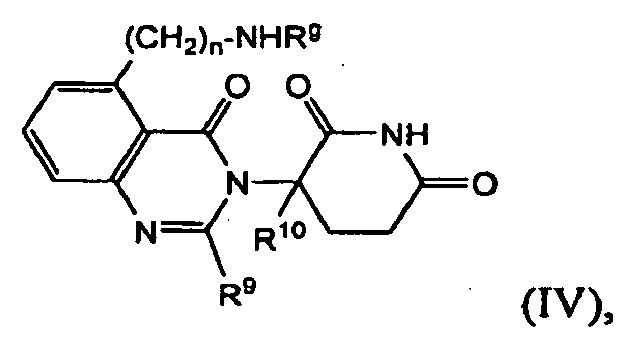
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
Rg представляет собой
-(СН2)n-(6-10-членный арил);
-С(О)-(СН2)n-(6-10-членный арил) или -С(О)-(СН2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещены одним или несколькими заместителями из атома галогена; -SCF3; (С1-С6)алкила, самого необязательно замещенного одним или несколькими атомами галогена; или (С1-С6)алкокси-группы, самой необязательно замещенной одним или несколькими атомами галогена;
-С(О)-(СН2)n-NHRh, где Rh представляет собой
6-10-членный арил, необязательно замещенный одним или несколькими заместителями из атома галогена; (С1-С6)алкила, самого необязательно замещенного одним или несколькими атомами галогена; или (С1-С6)алкокси-группы, самой необязательно замещенной одним или несколькими атомами галогена; или
–С(О)-(СН2)n-O-(CH2)n-(6-10 членный арил);
R9 представляет собой атом водорода; -(СН2)nOH; фенил; -О-(С1-С6)алкил; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
R10 представляет собой атом водорода; или (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена; и
n принимает значения 0, 1 или 2.
В одном из вариантов осуществления Rg представляет собой -(СН2)n-(6-10-членный арил). В другом варианте осуществления Rg представляет собой -С(О)-(СН2)n-(6-10-членный арил) или -С(О)- (СН2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещены, как описано выше. В другом варианте осуществления Rg представляет собой -С(О)-(СН2)n-NHRh, где Rh представляет собой 6-10-членный арил, необязательно замещенный, как описано выше. В другом варианте осуществления Rg представляет собой –С(О)-(СН2)n-O-(CH2)n-(6-10-членный арил).
В одном из вариантов осуществления R9 представляет собой атом водорода. В другом варианте осуществления R9 представляет собой –(СН2)nOH или гидроксил. В другом варианте осуществления R9 представляет собой фенил. В другом варианте осуществления R9 представляет собой -О-(С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена. В другом варианте осуществления R9 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления R10 представляет собой атом водорода. В другом варианте осуществления R10 представляет собой (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена.
В одном из вариантов осуществления n равно 0. В другом варианте осуществления n равно 1. В другом варианте осуществления n равно 2.
Соединения, предложенные в изобретении, охватывают любые комбинации Rg, R9, R10 и n, описанных выше.
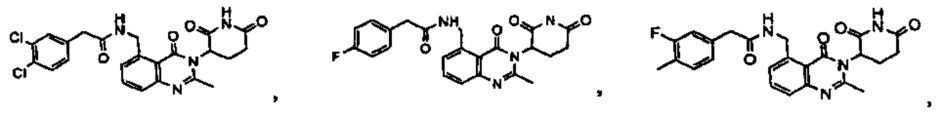
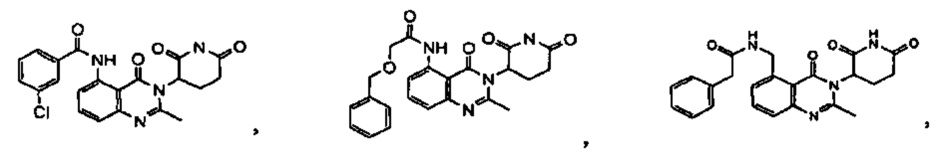
В одном из конкретных вариантов осуществления R9 представляет собой метил. В другом варианте осуществления Rg представляет собой –С(О)-фенил или –С(О)-СН2-фенил, где фенил необязательно замещен метилом, -CF3 и/или атомом галогена. В другом варианте осуществления Rg представляет собой –С(О)-NH-фенил, где фенил необязательно замещен метилом, -CF3 и/или атомом галогена.
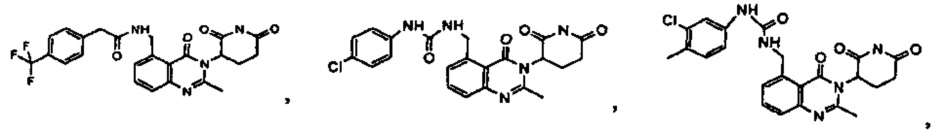
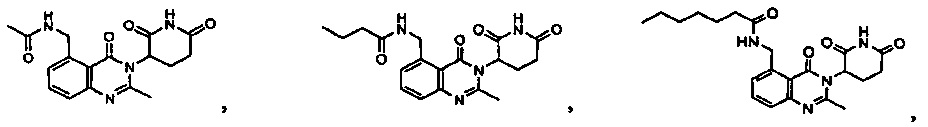
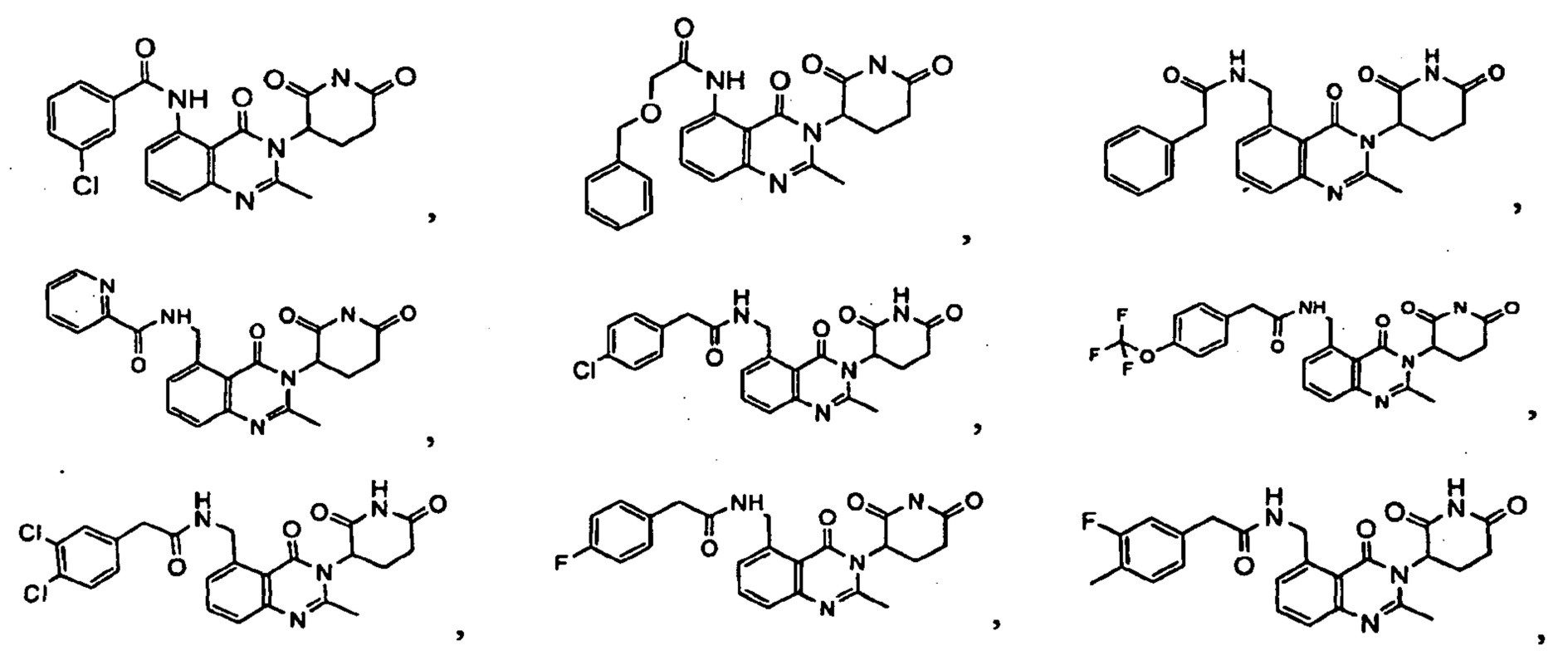
Конкретные примеры включают, но не ограничиваются ими:

Как используется в данном описании и если не оговорено особо, определение «фармацевтически приемлемая соль» относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот, включая неорганические кислоты и органические кислоты. Подходящими нетоксичными кислотами являются неорганические и органические кислоты, такие как, но без ограничения ими, уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этансульфоновая, муравьиная, фумаровая, фуроновая, глюконовая, глутаминовая, глюкуроновая, галактуроновая, глицидная, бромистоводородная, соляная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, памовая, пантотеновая, фенилуксусная, пропионовая, фосфорная, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная, п-толуолсульфоновая кислоты и т.д. В одном из вариантов осуществления подходящими кислотами являются соляная, бромистоводородная, фосфорная и серная кислоты.
Как используется в данном описании и если не оговорено особо, определение «сольват» означает соединение, которое также включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами взаимодействия. Когда растворителем является вода, сольват представляет собой гидрат.
Как используется в данном описании и если не оговорено особо, определение «пролекарство» означает производное соединения, которое может гидролизоваться, окисляться или иным образом реагировать в биологических условиях (in vitro или in vivo), давая соединение. Примерами пролекарств являются, но не ограничиваются ими, соединения, которые содержат способные к биогидролизу остатки, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другими примерами пролекарств являются соединения, которые содержат остатки –NO, –NO2, -ONO или –ONO2. Пролекарства могут быть получены при использовании хорошо известных способов, например, способов, описанных в публикациях: Burger’s Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed. 1985) и Design of Prodrugs (H. Bundgaard ed., Elselvier, New York 1985).
Как используется в данном описании и если не оговорено особо, определения «биогидролизуемый карбамат», «биогидролизуемый карбонат», «биогидролизуемый уреид» и «биогидролизуемый фосфат» означает карбамат, карбонат, уреид и фосфат, соответственно, соединения, который: 1) не вмешивается в биологическую активность соединения, но может придавать соединению полезные свойства in vivo, такие как поглощение, продолжительность действия или наступление действия; или 2) является биологически неактивным, но превращается in vivo в биологически активное соединение. Примерами биогидролизуемых карбаматов являются, но не ограничиваются ими, карбаматы, которые содержат низший алкиламинный, замещенный этилендиаминный, аминокислотный, гидроксиалкиламинный, гетероциклический и гетероароматический аминный и полиэфираминный остатки.
Как используется в данном описании и если не оговорено особо, определение «стереоизомер» охватывает все энантиомерно/стереомерно чистые и энантиомерно/стереомерно обогащенные соединения, представленные в изобретении.
Как используется в данном описании и если не оговорено особо, определение «стереомерно чистый» означает композицию, которая содержит один стереоизомер соединения и по существу не содержит другие стереоизомеры этого соединения. Например, стереомерно чистая композиция соединения, имеющего один хиральный центр, по существу не будет содержать противоположный энантиомер этого соединения. Стереомерно чистая композиция соединения, имеющего два хиральных центра, по существу не будет содержать другие диастереомеры этого соединения. Типичное стереомерно чистое соединение содержит более чем приблизительно 80% масс. одного стереоизомера соединения и менее чем приблизительно 20% масс. других стереизомеров соединения, более чем приблизительно 90% масс. одного стереоизомера соединения и менее чем приблизительно 10% масс. других стереоизомеров соединения, более чем приблизительно 95% масс. одного стереоизомера соединения и менее чем приблизительно 5% масс. других стереоизомеров соединения, или более чем приблизительно 97% масс. одного стереоизомера соединения и менее чем приблизительно 3% масс. других стереоизомеров соединения.
Как используется в данном описании и если не оговорено особо, определение «стереомерно обогащенная» означает композицию, которая содержит более чем приблизительно 55% масс. одного стереоизомера соединения, более чем приблизительно 60% масс. одного стереоизомера соединения, более чем приблизительно 70% масс. или более чем приблизительно 80% масс. одного стереоизомера соединения.
Как используется в данном описании и если не оговорено особо, определение «энантиомерно чистая» означает стереомерно чистую композицию соединения, имеющего один хиральный центр. Аналогично, определение «энантиомерно обогащенный» означает стереомерно обогащенную композицию соединения, имеющего один хиральный центр.
Как используется в данном описании и если не оговорено особо, определение «алкил» означает насыщенный линейный или разветвленный углеводород, имеющий число атомов углерода, которое определено в описании. Типичными насыщенными линейными алкилами являются метил, этил, н-пропил, н-бутил, н-пентил и н-гексил; тогда как насыщенными разветвленными алкилами являются изопропил, вторбутил, изобутил, трет.-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил и т.д. Определение «алкил» также включает циклоалкил.
Как используется в данном описании и если не оговорено особо, определение «циклоалкил» означает разновидность алкила, содержащего от 3 до 15 атомов углерода без чередующихся или взаимодействующих двойных связей между атомами углерода. Циклоалкил может иметь от 1 до 4 колец. Примерами незамещенных циклоалкилов являются, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Циклоалкил может быть замещен одним или несколькими заместителями.
Как используется в данном описании, определение «арил» означает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в цикле. Все атомы в цикле карбоциклической арильной группы представляют собой атомы углерода. Арильные кольцевые структуры включают соединения, содержащие одну или несколько кольцевых структур, такие как моно-, би- или трициклические соединения, а также бензо-конденсированные карбоциклические остатки, такие как 5,6,7,8-тетрагидронафтил и т.д. В частности, арильная группа представляет собой моноциклическое кольцо или бициклическое кольцо. Типичными арильными группами являются фенил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил.
Следует отметить, что если существует расхождение между изображенной структурой и названием такой структуры, изображенная структура должна рассматриваться более значимой. Кроме того, если стереохимия структуры или части структуры не показана, например, с помощью жирных или пунктирных линий, структура или часть структуры должны интерпретироваться как охватывающие все ее стереоизомеры.
4.2. Способы лечения, профилактики и регулирования
В изобретении предложены способы лечения, профилактики и/или регулирования различных заболеваний или нарушений с использованием предложенного соединения или его фармацевтически приемлемой соли, сольвата (например, гидрата), пролекарства, клатрата или стереоизомера. Без ограничения какой-либо теорией, соединения, предложенные в изобретении, могут контролировать ангиогенез или ингибировать продуцирование некоторых цитокинов, в том числе, но без ограничения ими, TNF-α, IL-1β, IL-12, IL-18, GM-CSF и/или IL-6. Без ограничения какой-либо конкретной теорией, соединения, предложенные в изобретении, могут стимулировать продуцирование некоторых других цитокинов, в том числе IL-10; а также могут действовать как вспомогательный сигнал для активации Т-клеток, что приводит к повышенному продуцированию цитокинов, таких как, но без ограничения ими, IL-12 и/или IFN-γ. Кроме того, соединения, предложенные в изобретении, могут усиливать эффекты NK клеток и опосредованной антителами клеточной цитотоксичности (ADCC). Кроме того, соединения, предложенные в изобретении, могут быть иммуномодулирующими и/или цитотоксичными, и, следовательно, могут быть полезны в качестве химиотерапевтических агентов. Следовательно, без ограничения какой-либо конкретной теорией, некоторые или все такие характеристики, которыми обладают соединения, предложенные в изобретении, могут делать эти соединения полезными при лечении, регулировании и/или профилактике различных заболеваний или нарушений.
Примерами заболеваний или нарушений являются, но не ограничиваются ими, рак, заболевания, связанные с ангиогенезом, боли, в том числе, но без ограничения, комплексный региональный болевой синдром (CRPS), дегенерация желтого пятна (MD) и сопутствующие синдромы, кожные заболевания, легочные заболевания, связанные с асбестом нарушения, паразитные заболевания, иммунодефицитные расстройства, нарушения ЦНС (CNS), поражения ЦНС, атеросклероз и сопутствующие нарушения, дисфункциональный сон и сопутствующие нарушения, гемоглобинопатия и сопутствующие нарушения (например, анемия), TNFα-связанные нарушения и другие различные заболевания и нарушения.
Как используется в данном случае и если не оговорено особо, определения «лечить», «лечение» и «терапия» относятся к искоренению или облегчению заболевания или нарушения или одного или нескольких симптомов, сопутствующих заболеванию или нарушению. В некоторых вариантах осуществления эти определения относятся к минимизации распространения или ухудшения заболевания или нарушения, вытекающей из введения одного или нескольких профилактических или терапевтических агентов субъекту, имеющему заболевание или нарушение.
Как используется в данном случае и если не оговорено особо, определения «предупреждать», «предупреждение» и «профилактика» относятся к профилактике наступления, рецидива или распространения заболевания или нарушения или одного или нескольких их симптомов.
Как используется в данном случае и если не оговорено особо, определения «регулировать», «регулирование» и «контролирование» относятся к предупреждению или замедлению развития, распространения или ухудшения заболевания или нарушения или одного или нескольких их симптомов. В некоторых случаях положительные эффекты, которые субъект имеет от профилактического или терапевтического агента, не приводят к излечению заболевания или нарушения.
Как используется в данном случае и если не оговорено особо, определение «терапевтически эффективное количество» соединения представляет собой количество, достаточное, чтобы обеспечить терапевтический положительный эффект при лечении или регулировании заболевания или нарушения, или приостановить или минимизировать один или несколько симптомов, связанных с заболеванием или нарушением. Терапевтически эффективное количество соединения означает количество терапевтического агента, отдельно или в комбинации с другими терапевтическими средствами, которое обеспечивает положительный эффект при лечении или регулировании заболевания или нарушения. Определение «терапевтически эффективное количество» может охватывать количество, которое улучшает всю терапию, снижает или исключает симптомы или причины заболевания или нарушения, или усиливает терапевтическую эффективность другого терапевтического агента.
Как используется в данном случае и если не оговорено особо, определение «профилактически эффективное количество» соединения представляет собой количество, достаточное, чтобы предупредить заболевание или нарушение или предупредить их рецидив. Профилактически эффективное количество соединения означает количество терапевтического агента, отдельно или в комбинации с другими агентами, которое обеспечивает профилактический положительный эффект при профилактике заболевания. Определение «профилактически эффективное количество» может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического агента.
Примеры рака и предраковых состояний включают, но не ограничиваются ими, рак и предраковые состояния, описанные в патентах США №№ 6281230 и 5635517 (Muller at al.), в различных патентных публикациях, принадлежащих Zeldis, включая публикацию № 2004/0220144А1, опубликованную 4 ноября 2004 г. (Лечение миелодиспластического синдрома); 2004/00298332А1, опубликованную 12 февраля 2004 г. (Лечение различных типов рака); и 2004/0087546, опубликованную 6 мая 2004 г. (Лечение миелопролиферативных заболеваний). Примеры также включают рак и предраковые состояния, описанные в публикации WO 2004/103274, опубликованной 2 декабря 2004 г. Все указанные ссылки включены в описание во всей их полноте в качестве ссылки.
Конкретные примеры рака включают, но не ограничиваются ими: рак кожи, такой как меланома; рак лимфатических узлов; молочной железы; шейки матки; желудочно-кишечного тракта; легкого; яичника; простаты; толстой кишки; прямой кишки; ротовой полости; мозга; головы и шеи; горла; семенников; почек; поджелудочной железы; кости; селезенки; печени; мочевого пузыря; гортани; носовых проходов; и рак, сопутствующий СПИД. Соединения также могут быть использованы для лечения рака крови и костного мозга, такого как множественная миелонома и острая и хроническая лейкемия, например, лимфобластическая, миелогенная, лимфоцитарная и миелоцитарная лейкемия. Соединения, предложенные в изобретении, могут быть использованы для лечения, профилактики или регулирования или первичных или метастатических опухолей.
Другие конкретные виды рака включают, но не ограничиваются ими: опухоль на поздней стадии, амилоидоз, нейробластома, менингиома, гемангиоперицитома, множественные метастазы мозга, мультиформная глиобластома, глиобластома, глиома ствола мозга, плохо прогнозируемая злокачественная опухоль мозга, злокачественная глиома, рецидив злокачественной глиомы, анапластическая астроцитома, анапластическая олигодендроглиома, нейроэндокринная опухоль, ректальная аденокарцинома, колоректальный рак в стадиях Dukes C и D, нерезектабельный колоректальный рак, метастатическая гепатоцеллюлярная карцинома, саркома Капоши, кариотипная острая нейробластная лейкемия, хроническая лимфоцитарная лейкемия, ходжкинская лимфома, неходжкинская лимфома, Т-клеточная лимфома кожи, В-клеточная лимфома кожи, диффузная крупно-В-клеточная лимфома, низкодифференцированная фолликулярная лимфома, метастатическая меланома (локализованная меланома, в том числе, но без ограничения, глазная меланома), злокачественная мезотелиома, синдром злокачественной мезотелиомы плеврального выпота, перитонеалная карцинома, папиллярная серозная карцинома, гинекологическая саркома, саркома мягких тканей, склеродерма, васкулит кожи, гистиоцитоз клеток Лангерганса, лейомиосаркома, оссифицирующая прогрессивная фибродисплазия, устойчивый к гормонам рак простаты, саркома высокого риска резецированной мягкой ткани, нерезектабельная печеночно-клеточная карцинома, макроглобулинемия Вальденстрема, тлеющая миелома, безболезненная миелома, рак фаллопиевых труб, андроген-независимый рак простаты, андроген-зависимый неметастазирующий рак простаты IV стадии, устойчивый к гормонам рак простаты, невосприимчивый к химиотерапии рак простаты, папиллярная карцинома щитовидной железы, фолликулярная карцинома щитовидной железы, медуллярная карцинома щитовидной железы и лейомиома. В конкретном варианте осуществления рак является метастатическим. В другом варианте осуществления рак является невосприимчивым или устойчивым к химиотерапии или облучению.
В одном из вариантов осуществления изобретения предложены способы лечения, профилактики или регулирования различных форм лейкемии, таких как хроническая лимфоцитарная лейкемия, хроническая миелоцитарная лейкемия, острая лимфобластическая лейкемия, острая миелогенная лейкемия и острая миелобластическая лейкемия, включая лейкемии, являющиеся рецидивными, трудноизлечимыми или устойчивыми, которые описаны в публикации США № 2006/0030594 (опубликована 9 февраля 2006 г.), которая включена во всей ее полноте в качестве ссылки.
Определение «лейкемия» относится к злокачественным опухолям кровеобразующих тканей. Определение «лейкемия» включает, но не ограничивается ими, хроническую лимфоцитарную лейкемию, хроническую миелоцитарную лейкемию, острую лимфобластическую лейкемию, острую миелогенную лейкемию и острую миелобластическую лейкемию. Лейкемия может быть рецидивной, трудноизлечимой или устойчивой к обычной терапии. Определение «рецидивная» относится к ситуации, когда пациенты, которые имели ремиссию лейкемии после терапии, показывают возвращение лейкемических клеток в костном мозге и уменьшение нормальных клеток крови. Определение «трудноизлечимый или устойчивый» относится к ситуации, когда пациенты, даже после интенсивного лечения, имеют остаточные лейкемические клетки в костном мозге.
В других вариантах осуществления изобретения предложены способы лечения, профилактики или регулирования различных типов лимфом, включая неходжкинскую лимфому (NHL). Определение «лимфома» относится к гетерогенной группе опухолей, возникающих в ретикулоэндотелиальной и лимфатической системах. «NHL» относится к злокачественной моноклональной пролиферации лимфоидных клеток в сайтах иммунной системы, включая лимфоузлы, костный мозг, селезенка, печень и желудочно-кишечный тракт. Примерами NHL являются, но не ограничиваются ими: лимфома сократительных клеток (MCL), лимфоцитарная лимфома промежуточной степени дифференцировки, промежуточная лимфоцитарная лимфома (ILL), диффузная низкодифференцированная лимфоцитарная лимфома (PDL), центроцитарная лимфома, диффузная мелкоклеточная недифференцированная лимфома (DSCCL), фолликулярная лимфома и любой тип лимфом клеток ткани, который можно увидеть под микроскопом (лимфома узловой, диффузной, бластической и тканевой зоны).
Примеры заболеваний и нарушений, ассоциирующихся с нежелательным ангиогенезом или характеризующихся нежелательным ангиогенезом, включают, но не ограничиваются ими: воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания чувствительной оболочки глаза и покраснение (неоваскуляризация радужно-роговичного угла). Конкретные примеры заболеваний и нарушений, ассоциирующихся с нежелательным ангиогенезом или характеризующихся нежелательным ангиогенезом, включают, но не ограничиваются ими, артрит, эндометриоз, болезнь Крона, сердечная недостаточность, запущенная сердечная недостаточность, почечная недостаточность, эндотоксемия, синдром токсического шока, остеоартрит, ретровирусная репликация, зашлакованность, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарные нарушения, связанная со злокачественной опухолью гиперкальциемия, инсульт, циркуляторный шок, периодонтит, гингивит, макроцитарная анемия, устойчивая анемия и синдром 5q-делеции.
Примеры болей включают, но не ограничиваются ими, боли, описанные в патентной публикации США № 2005/0203142, опубликованной 15 сентября 2005 г., которая включена в качестве ссылки. Конкретные типы боли включают, но не ограничиваются ими, ноцицептивную боль, нейропатическую боль, смешанную боль из ноцицептивной боли и нейропатической боли, висцеральную боль, мигрень, головную боль и послеоперационную боль.
Примеры ноцицептивной боли включают, но не ограничиваются ими, боль, сопутствующая химическим или термическим ожогам, порезам кожи, ушибам кожи, остеоартриту, ревматоидному артриту, тендониту и миофасциальной боли.
Примерами нейропатической боли являются, но не ограничиваются ими, CRPS I типа, CRPS II типа, рефлекторная симпатическая дистрофия (RSD), рефлекторная нейроваскулярная дистрофия, рефлекторная дистрофия, удерживаемый симпатической частью нервной системы болевой синдром, каузалгия, костная атрофия Зудека, алгонейродистрофия, плечевой синдром, посттравматическая дистрофия, тригеминальная невралгия, постгерпетическая невралгия, боль, сопутствующая раку, ложное ощущение ампутированной конечности, фибромиалгия, синдром хронической усталости, боль от травмы спинного мозга, центральная послешоковая боль, радикулопатия, диабетическая невропатия, послешоковая боль, люэтическая невропатия и другие причиняющие боль невропатические состояния, например, состояния, вызванные лекарственными средствами, такими как винкристин и велкейд.
Как используется в данном описании, определения «синдром комплексной региональной боли», «CRPS» и «CRPS и сопутствующие синдромы» означают хронические болевые нарушения, характеризующиеся одним или несколькими следующими признаками: боль, или спонтанная или спровоцированная, в том числе, аллодиния (вызывающая боль реакция на стимул, который обычно не является болезненным) и гипералгезия (преувеличенная реакция на стимул, который обычно является только умеренно болезненным); боль, которая является непропорциональной для провоцирования события (например, годы сильной боли после растяжения связок голеностопного сустава); региональная боль, которая не ограничена распространением в одном периферическом нерве; и автономное нарушение ритма (например, отек, альтерация кровяного потока и гипергидроз), сопутствующее трофическим изменениям кожи (ненормальность роста волос и ногтей и кожное изъязвление).
Примерами MD и сопутствующих синдромов являются, но не ограничиваются ими, примеры, описанные в патентной публикации США № 2004/0091455, опубликованной 13 мая 2004 г., которая включена в описание в качестве ссылки. Конкретными примерами являются, но не ограничиваются ими, атрофическая (сухая) MD, экссудативная (влажная) MD, возрастная макулопатия (ARM), хориоидальная неоваскулизация (CNVM), отслоение пигментного эпителия сетчатки (PED) и атрофия пигментного эпителия сетчатки (RPE).
Примеры кожных заболеваний включают, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0214328А1, опубликованной 29 сентября 2005 г., которая включена в описание в качестве ссылки. Конкретными примерами являются, но без ограничения, кератоз и сопутствующие симптомы, кожные заболевания и нарушения, характеризующиеся чрезмерным ростом эпидермиса, угри и морщины.
Как используется в данном описании, определение «кератоз» относится к любому повреждению эпидермиса, отмеченному присутствием очагового чрезмерного роста ороговевшего слоя, в том числе, но без ограничения, актинический кератоз, себорейный кератоз, кератоакантома, фолликулярный кератоз (болезнь Дарье), ретроградный фолликулярный кератоз, ладонно-подошвенный кератоз (PPR, кератоз ладоней и подошв), кератоз волосяной и штукатурный кератоз. Определение «актинический кератоз» также относится к старческому кератозу, сенильному кератозу, старческой кератоме, юношеской кератоме, старческой бородавке, кератодермии или кератоме. Определение «себорейный кератоз» также относиться к себорейной бородавке, старческой бородавке или базальноклеточной папилломе. Кератоз характеризуется одним или несколькими следующими симптомами: неприятный внешний вид, эритематозные папулы, бляшки, спикулы или наросты на открытых поверхностях (например, на лице, руках, ушах, шее, ногах и грудной клетке), патологическое разрастание кератина, называемое кожными рогами, гиперкератоз, телангиэктазия, эластоз, пигментированный лентигиноз, акантоз, паракератоз, дискератоз, папилломатоз, гиперпигментация базальных клеток, клеточная атипия, фигуры митоза, аномальная межклеточная адгезия, плотные воспалительные инфильтраты и небольшое преобладание плоскоклеточного рака.
Примеры кожных заболеваний или нарушений, характеризующихся чрезмерным ростом эпидермиса, включают, но не ограничиваются ими, любые состояния, заболевания или нарушения, отмеченные присутствуем чрезмерно разросшегося эпидермиса, в том числе, но без ограничения, инфекции, связанные с вирусной папилломой, мышьяковистый кератоз, симптом Лезера-Трелата, бородавчатая дискератома (WD), волосы пучкообразные (trichostasis spinulosa (TS), фигурная вариабельная эритрокератодермия (EKV), врожденный ихтиоз («арлекиновый» плод), врожденная узловатость пальцев кисти, кожная меланоакантома, порокератоз, псориаз, плоскоклеточный рак, врожденный и ретикулярный папилломатоз (CRP), акрохордон, кожный рог, болезнь Каудена (синдром множественной гамартомы), дерматическая папулезная сыпь (dermatosis papulosa nigra, DPN), синдром эпидермального невуса (ENS), простой ихтиоз, контагиозный моллюск, узелковая почесуха и акантокератодермия (AN).
Примерами легочных нарушений являются, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0239842А1, опубликованной 27 октября 2005 г., которая включена в описание в качестве ссылки. Конкретными примерами являются легочная гипертензия и сопутствующие нарушения. Примерами легочной гипертензии и сопутствующих нарушений являются, но не ограничиваются ими: первичная легочная гипертензия (РРН); вторичная легочная гипертензия (SPH); семейная РРН; спорадическая РРН; прекапиллярная легочная гипертензия; легочная артериальная гипертензия (РАН); легочная системная гипертензия; идиопатическая легочная гипертензия; тромботическая легочная артериопатия (ТРА); плексогенная легочная артериопатия; легочная гипертензия функциональных классов I-IV; и легочная гипертензия, связанная с, сопутствующая или вторичная по отношению к дисфункции левого желудочка (сердца), митральному пороку сердца, констриктивному перикардиту, стенозу устья аорты, кардиомиопатии, медиастинальному фиброзу, аномальному легочному венозному оттоку, легочной веноокклюзионной болезни, сосудистому коллагенозу, врожденному пороку сердца, инфицированию ВИЧ, лекарствам и токсинам, таким как фенфлурамины, врожденному пороку сердца, легочной венозной гипертензии, хроническому обструктивному легочному заболеванию, нарушающему сон дыханию, альвеолярной гиповентиляции, хроническому воздействию высокого положения над уровнем моря, болезни легких новорожденного, альвеолярно-капиллярной дисплазии, серповидно-клеточной болезни, другим нарушениям свертывания, хронической тромбоэмболии, болезни соединительных тканей, волчанке, включая системную и кожную волчанку, шистосомозу, саркоидозу или легочному капиллярному гемангиоматозу.
Примерами заболеваний, связанных с асбестом, являются, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0100529, опубликованной 12 мая 2005 г., которая включена в качестве ссылки. Типичными примерами являются, но не ограничиваются ими, мезотелиома, асбестоз, злокачественный плевральный выпот, доброкачественный экссудативный выпот, плевральные бляшки, кальциноз плевры, диффузное плевральное наслоение, округлый ателектаз, фиброзные массы и рак легких.
Примерами паразитарных заболеваний являются, но не ограничиваются ими, примеры, описанные в публикации США № 2006/0154880, опубликованной 13 июля 2006 г., которая включена в описание в качестве ссылки. Паразитарные заболевания включают заболевания и нарушения, вызванные внутриклеточными паразитами человека, таким как, но без ограничения ими, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. Cayetanensis, E. histolytica, I. belli, S. Mansonii, S. Haematobium, Trypanosoma ssp., Toxoplasma ssp., и O. Volvulus. Также охватываются другие заболевания и нарушения, вызванные нечеловеческими внутриклеточными паразитами, такими как, но без ограничения ими, Babesia bovis, Babesia canis, Babesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. и Theileria ssp. Конкретными примерами являются, но не ограничиваются ими, малярия, бабезиоз, сонная болезнь, лейшманиоз, токсоплазмоз, менингоэнцефалит, кератит, амебиаз, жиардиаз, криптоспоридоз, изоспоридиоз, циклоспориаз, микроспоридиоз, аскаридоз, трихиуриаз, анкилостомоз, стронгилоидоз, токсокароз, трихинеллез, лимфатический филяриатоз, онхоцеркоз, филяриатоз, шистосомоз и дерматиты, вызванные шистосомным дерматитом животных.
Примеры нарушений иммунодефицита включают, но не ограничиваются ими, примеры, описанные в заявке США № 11/289723, направленной на рассмотрение 30 ноября 2005 г. Конкретными примерами являются, но не ограничиваются ими, дефицит аденозиндезаминазы, дефицит антител с нормальными или повышенными Ig, атаксия-телеангиэктазия, синдром «голых» лимфоцитов, общая вариабельная иммунная недостаточность, дефицит Ig с синдромом гипер-IgM, делеции тяжелых цепочек Ig, дефицит IgA, иммунодефицит с тимомой, ретикулярная дисгенезия, синдром Незелофа, селективный дефицит подкласса IgG, младенческая гипогаммаглобулинемия, синдром Вискотта-Олдрижда, сцепленная с Х-хромосомой агаммаглобулинемия, сцепленная с Х-хромосомой тяжелая комбинированная агаммаглобулинемия.
Примерами нарушений ЦНС являются, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0143344, опубликованной 30 июня 2005 г., которая включена в описание в качестве ссылки. Конкретными примерами являются, но не ограничиваются ими: боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, рассеянный склероз и другие нейроиммунологические расстройства, такие как синдром Туретта, расстройства или нарушения сознания, которые происходят в течение короткого периода времени, и амнестические нарушения, или разрозненное расстройство памяти, которое происходит в отсутствие других нарушений центральной нервной системы.
Примеры поражений ЦНС и сопутствующих симптомов включают, но не ограничиваются ими, примеры, описанные в публикации США № 2006/0122228, опубликованной 8 июня 2006 г., которая включена в описание в качестве описания. Конкретными примерами являются, но не ограничиваются ими: поражение/повреждение ЦНС и сопутствующие симптомы, которые включают, но не ограничиваются ими, первичную травму головного мозга, вторичную травму головного мозга, травматическое повреждение мозга, фокальное повреждение мозга, диффузное аксональное повреждение, травму головы, постконтузионный синдром, сотрясение и разрыв головного мозга, субдуральную гематому, эпидермальную гематому, посттравматическую эпилепсию, хроническое вегетативное состояние, полную травму спинного мозга, неполную травму спинного мозга, острую травму спинного мозга, подострую травму спинного мозга, хроническую травму спинного мозга, центральный спинальный синдром, синдром Броун-Секара, синдром переднего хорда, синдром мозгового конуса, синдром поражения конского хвоста, нейрогенный шок, спинальный шок, измененные уровни сознания, головную боль, тошноту, рвоту, потерю памяти, головокружение, диплопию, размытое зрение, эмоциональную неустойчивость, нарушения сна, раздражительность, неспособность к концентрации, нервозность, поведенческие нарушения, нарушение познавательной способности и припадки.
Другие заболевания и нарушения включают, но не ограничиваются ими, вирусные, генетические, аллергические и аутоиммунные заболевания. Конкретными примерами являются, но не ограничиваются ими, ВИЧ, гепатит, респираторный дистресс-синдром у взрослых, резорбция кости, хронические легочные воспалительные заболевания, дерматиты, кистозный фиброз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, септический синдром, постишемическая реперфузия, менингит, псориаз, фиброзное заболевание, кахексия, реакция трансплантат против хозяина, отторжение трансплантата, аутоиммунное заболевание, «одеревенелость» позвоночника, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, рассеянный склероз, системная красная волчанка, ENL (лепрозная узловая эритема) при проказе, радиационное поражение, рак, астма или альвеолярная гипоксия.
Примеры атеросклероза и сопутствующих состояний включают, но не ограничиваются ими, примеры, описанные в публикации США № 2002/0054899, опубликованной 9 мая 2002 г., которая включена в качестве ссылки. Конкретными примерами являются, но не ограничиваются ими, все формы состояний, включающие атеросклероз, в том числе рестеноз после сосудистого вмешательства, такого как ангиопластика, эндопротезирование, атерэктомия и трансплантация. В данном случае рассматриваются все формы сосудистого вмешательства, включая вмешательства при заболеваниях сердечно-сосудистой и почечной системы, такие как, но без ограничения ими, ангиопластика почечной артерии, подкожная коронарная ангиопластика (PCI), подкожная транслуминальная коронарная ангиопластика (РТА), коронарное шунтирование, ангиопластика с эндопротезированием, периферическая подкожная транслуминальная интервенция подвздошной, бедренной или подколенной артерии и хирургическое вмешательство с использованием импрегнированных трансплантатов. Приведенная ниже таблица дает перечень основных артерий, которые могут нуждаться в лечении и которые все подразумеваются в данном описании.
|
|
Примерами дисфункционального сна и сопутствующих синдромов являются, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0222209А1, опубликованной 6 октября 2005 г., которая включена в описание в качестве ссылки. Конкретные примеры включают, но не ограничиваются ими, храп, апноэ во сне, бессонницу, нарколепсию, синдром усталых ног, ужасы во время сна, лунатизм, синдром ночного аппетита, а также дисфункциональный сон, сопутствующий хроническим неврологическими или воспалительными состояниями. Хронические неврологические или воспалительные состояния включают, но не ограничиваются ими, синдром комплексной региональной боли, хроническую поясничную боль, скелетно-мышечную боль, артрит, радикулопатию, боль, сопутствующую раковому заболеванию, фибромиалгию, синдром хронической усталости, висцеральную боль, боль в мочевом пузыре, хронический панкреатит, невропатию (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные нарушения, такие как болезнь Паркинсона; болезнь Альцгеймера; боковой амиотрофический склероз; рассеянный склероз; болезнь Гентингтона; брадикинезия; мышечная ригидность; паркинсонов тремор; паркинсонова походка; двигательное застывание; депрессия; дефективная долговременная память; синдром Рубинстайна-Туйби (RTS); деменция; постуральная нестабильность; гипокинетические нарушении; синуклеиновые нарушения; множественная системная атрофия; стриатонигральная дегенерация, оливопонтоцеребеллярная атрофия, синдром Шая-Дрейджера; заболевание моторного нерва с признаками паркинсонизма; деменция с тельцами Леви; паталогические расстройства Тау; прогрессирующий супрануклеарный паралич; кортико-базальная дегенерация; лобно-височная деменция; амилоидные патологические расстройства; средние нарушения познавательной способности; болезнь Альцгеймера с паркинсонизмом; болезнь Вилсона; болезнь Галлервордена-Шпатца; болезнь Чедиака-Хигаши; SCA-3 спинально-церебеллярная атаксия; сцепленный с Х-хромосомой синдром дистония-паркинсоснизм; прионная инфекция; гиперкинетические нарушения; хорея; гиперкинетичнеские двигательные расстройства (ballismus); дистонический тремор; боковой амиотрофический склероз (ALS); травма ЦНС и миоклонус.
Примеры гемоглобинопатии и сопутствующих нарушений включают, но не ограничиваются ими, примеры, описанные в публикации США № 2005/0143420А1, опубликованной 30 июня 2005 г., которая включена в описание в качестве ссылки. Конкретными примерами являются, но не ограничиваются ими, гемоглобинопатия, серповидно-клеточная анемия и любые другие нарушения, относящиеся к дифференциации CD34+ клеток.
Примеры TNFα-связанных нарушений включают, но не ограничиваются ими, примеры, описанные в публикациях WO 98/03502 и WO 98/54170, которые обе включены в качестве ссылки. Конкретными примерами являются, но не ограничиваются ими: эндотоксемия или синдром токсического шока; кахексия; респираторный дистресс-синдром у взрослых; резорбция костей, такая как артрит; гиперкальциемия; реакция трансплантат против хозяина; мозговая форма малярии; воспаление; рост опухоли; хронические легочные воспалительные заболевания; реперфузное повреждение; инфаркт миокарда; инсульт; циркуляторный шок; ревматоидный артрит; болезнь Крона; ВИЧ инфекция и СПИД; другие расстройства, такие как ревматоидный артрит, «одеревенелость» позвоночника, остеоартрит, псориатический артрит и другие артритные состояния, септическмй шок, сепсис, эндотоксический шок, реакция трансплантат против хозяина; зашлакованность, болезнь Крона, язвенный колит, рассеянный склероз, системная красная волчанка, ENL (лепрозная узловая эритема) при проказе, ВИЧ, СПИД и оппортунистические инфекции при ВИЧ; нарушения, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, постишемическое реперфузное поражение, мялярия, микобактериальная инфекция, менингит, псориаз, застойная сердечная недостаточность, фиброзные заболевания; кахексия, отторжение трансплантата, онкогенные или канцерогенные состояния, астма, аутоиммунные заболевания, аутоиммунное заболевание, лучевое поражение и альвеолярная гипероксия; вирусные инфекции, такие как инфекции, вызванные вирусом герпеса; вирусные конъюнктивиты; или атопический дерматит.
В других вариантах осуществления предложено применение соединений, представленных в изобретении, при различных иммунологических применениях, в частности, применение в качестве вакцинных адъювантов, в особенности противораковых вакцинных адъювантов, которые описаны в предварительной заявке США № 60/712823, направленной на рассмотрение 1 сентября 2005 г., которая включена в описание в качестве ссылки. Такие варианты осуществления также относятся к вариантам применения соединений, предложенных в изобретении, в комбинации с вакцинами для лечения или профилактики рака или инфекционных заболеваний, и к другим вариантам применения иммуномодулирующих соединений, таким как снижение или десенсибилизация аллергических реакций.
Дозы соединения, предложенного в данном изобретении, или его фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства меняются в зависимости от таких факторов, так конкретные показания для лечения, профилактики или регулирования; возраст и состояние пациента; и количество используемого второго активного агента, если он используется. Как правило, соединение, предложенное изобретением, или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство могут быть использованы в количестве приблизительно от 0,1 до 500 мг/день; и это количество может быть скорректировано по обычной схеме (например, одинаковое количество вводят каждый день лечения, профилактики или регулирования), по циклам (например, одна неделя приема, одна неделя без приема) или в количестве, которое повышается или понижается по ходу курса лечения, профилактики или регулирования. В других вариантах осуществления доза может составлять приблизительно от 1 до 300 мг, приблизительно от 0,1 до 150 мг, приблизительно от 1 до 200 мг, приблизительно от 10 до 100 мг, приблизительно от 0,1 до 50 мг, приблизительно от 1 до 50 мг, приблизительно от 10 до 50 мг, приблизительно от 20 до 30 мг или приблизительно от 1 до 20 мг.
4.3. Вторые активные агенты
Соединение, предложенное в изобретении, или его фармацевтически приемлемая соль, сольват, пролекарство, клатрат или стереоизомер, могут быть смешаны с другими фармакологически активными соединениями («вторые активные агенты») способами и в композициях, предложенных в изобретении. Некоторые комбинации могут работать синергетически при лечении определенных типов заболеваний или нарушений, а также состояний и симптомов, сопутствующих таким заболеваниям или нарушениям. Соединение, предложенное в изобретении, или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство, также могут смягчать отрицательные эффекты, связанные с некоторыми вторыми активными агентами, и наоборот.
Один или несколько вторых активных ингредиентов или агентов могут быть использованы в способах и композициях, предложенных в изобретении. Вторые активные агенты могут представлять собой большие молекулы (например, белки) или небольшие молекулы (например, синтетические неорганические, металлорганические или органические молекулы).
Примерами активных агентов с большими молекулами являются, но не ограничиваются ими, гемопоэтические ростовые факторы, цитокины и моноклональные и поликлональные антитела. Конкретными примерами активных агентов являются моноклональные анти-CD40-антитела (такие как, например, SGN-40); ингибиторы гистондеацетилазы (такие как, например, SAHA и LAQ 824); ингибиторы белка-90 шокового типа (такие как, например, 17-AAG); ингибиторы рецептора киназы инсулиноподобного фактора роста 1; ингибиторы рецептора киназы эндотелиального фактора роста сосудов (такие как, например, РТК787); ингибиторы рецептора инсулинового фактора роста; ингибиторы лизофосфатидная кислота-ацилтрансферазы; ингибиторы IkB-киназы; ингибиторы p38MAPK; ингибиторы EGFR (такие как, например, гефитиниб и эрлотиниб HCl); антитела рецепторов HER-2 (такие как трастузумаб (Herceptin®) и пертузумаб (OmnitargTM)); антитела к VEGFR (такие как, например, бевацизумаб (AvastinTM)); ингибиторы VEGFR (такие как, например, ингибиторы flk-1 специфической киназы, SU5416 и ptk787/zk222584); ингибиторы Р13К (такие как, например, вортманнин); ингибиторы С-Met (такие как, например, РНА-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и анти-TNFα-антитела. Примерами небольших молекул активных агентов являются, но не ограничиваются ими, противораковые агенты и антибиотики (например, кларитромицин).
Конкретные вторые активные соединения, которые могут быть объединены с соединениями, предложенными в изобретении, меняются в зависимости от конкретного симптома, которое подвергается лечению, профилактике или регулированию.
Например, для лечения, профилактики или регулирования рака вторые активные агенты включают, но не ограничиваются ими: семаксаниб; циклоспорин; этанерсепт; доксициклин; бортезомиб; ацивицин; акларубицин; акодазол-гидрохлорид; акронин; адозелецин; альдеслейкин; альтретамин; амбомицин; аметантрон-ацетат; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бизантрен-гидрохлорид; биснафид-димезилат; бизелезин; блеомицин-сульфат; бреквинар-натрий; бропиримин; бисульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин-гидрохлорид; карзелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол-мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин-гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин-мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен-цитрат; дромостанолон-пропионат; дуазомицин; эдатрексат; эфлорнитин-гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин-гидрохлорид; эрбулозол; эзорубицин-гидрохлорид; эстрамустин; эстрамустин-натрийфосфат; этанидазол; этопозид; этопозид-фосфат; этоприн; фадрозол-гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабин-фосфат; флуороурацил; флуроцитабин; фосхидон; фостриецин-натрий; гемцитабин; гемцитабин-гидрохлорид; гидрокимочевина; идарубицин-гидрохлорид; ифосфамид; илмофозин; ипроплатин; иринотекан; иринотекан-гидрохлорид; ланреотид-ацетат; летрозол; леупролид-ацетат; лиарозол-гидрохлорид; лометрексол-натрий; ломустин; лозоксантрон-гидрохлорид; мазопрокол; маитанзин; мехлоретамин-гидрохлорид; мегестрол-ацетат; меленгестрол-ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат-натрий; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомалцин; митомицин; митоспер; митотан; митоксантрон-гидрохлорид; микофенольная кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргаза; пелиомицин; пентамустин; пепломицин-сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон-гидрохлорид; пликамицин; пломестан; порфимер-натрий; порфиромицин; преднимустин; прокарбазин-гидрохлорид; пуромицин; пуромицин-гидрохлорид; пиразофурин; рибоприн; сафингол; сафингол-гидрохлорид; семустин; симтразен; спарфосат-натрий; спарсомицин; спирогерманий-гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; талисомицин; текогалан-натрий; таксотер; тегафур; телоксантрон-гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифен-цитрат; трестолон-ацетат; трицирибин-фосфат; триметрексат; триметрексат-глюкуронат; трипторелин; тубулозол-гидрохлорид; урацил-мустард; уредепа; вапреотид; вертепорфин; винбластин-сульфат; винкристин-сульфат; винепидин-сульфат; виндезин; виндезин-сульфат; винглицинат-сульфат; винлейрозин-сульфат; винорелбин-тартрат; винрозидин-сульфат; винзолидин-сульфат; ворозол; зениплатин; зиностатин и зорубицин-гидрохлорид.
Другие вторые агенты включают, но не ограничиваются ими: 29-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адозелецин; альдезлейкин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; anti-dorsalizing морфогенетический белок-1; антиандроген; карцинома предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин-глицинат; модуляторы гена апоптоза; регуляторы апоптоза; апуриновая кислота; ara-CDP-DL-PTBA; аргининдеаминаза; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бетакламицин В; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелезин; брефлат; бропиримин; будотитан; бутионин-сульфоксимин; кальципотриол; калфостин С; производные камптотецина; капецитабин; карбоксамид-аминотриазол; карбоксиаминотриазол; CaRest M3; CARN 700; ингибитор, полученный из хрящей; карзелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; chlorlns; хлорхиноксалин-сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин А; коллисмицин В; комбретастатин А4; аналоги комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципемицин; цитарабин-ocfosfat; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; 9-дигидротаксол; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эделфозин; эдреколомаб; эфлорнитин; элемене; эмитефур; эпирубицин; эпристерид; аналоги эстрамутина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид-фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; флуородаунорубицин-гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиний-тексафурин; галлий нитрат; галоцитабин; ганиреликс; ингибиторы гелатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; гексаметилен-бисацетамид; гиперицин; ибандроновая кислота; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; иматиниб (Gleevec®), имиквимод; иммуностимулирующие пептиды; ингибиторы рецептора инсулиноподобного фактора роста 1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; ипомеанол; иропласт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кахалалид F; ламелларин-N-триацетат; ланреотид; леинамицин; ленограстим, лентинан-сульфат; лептолстатин; летрозол; фактор, ингибирующий активность лейкозных клеток; интерферон-альфа лейкоцитов; лейпролин+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол; аналоги линейного полиамина; липофильный дисахаридный пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; ломотрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; lutetium texaphyrin; лизофуллин; литические пептиды; маитанзин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матричной металлопротеиназы; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксиновый фактор роста фибробластов сапорина; митоксантрон; мофаротен; молграмостим; эрбитукс; человеческий хорионический гонадотропин; монофосфориллипид А+стенка миобактериальных клеток sk; мопидамол; горчичный противоканцерогенный агент; mycaperoxide В; экстракт стенок микобактериальных клеток; мириапорон; N-ацетилдиналин; N-замещенный бензамид; нафарелин; нагрестип (nagrestip); налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновая кислота; нилутамид; низамицин; модуляторы оксида азота; антиоксидант нитроксида; нитруллин; облимерсен (Genasense®); О6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; пероральный цитокиновый индуктор; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаз; пелдесин; пентосан-натрийполисульфат; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин-гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор плазминогенного активатора; платиновый комплекс; соединения платины; комплекс платина-триамин; порфимер-натрий; порфиромицин; преднизон; пропил-бис-акридон; простагландин J2; ингибиторы протеасомы; иммуномодулятор на основе белка А; ингибитор протеинкиназы С; микроалгал; ингибиторы протеинтирозинфосфатазы; ингибиторы пуриннуклеозидфосфорилазы; пурпурины; пиразолакридин; пиридоксилированный гемоглобинполиоксиэтиленовый коньюгат; антагонисты raf; ралтитрексед; рамосетрон; ингибиторы raf фарнесилпротеинтрансферазы; ras ингибиторы; ингибитор ras-GAP; ретеллиптин деметилированный; рений Re 186 этидронат; ризоксин; рибозимы; R11 ретинамид; рохитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол А; сарграмостин; Sdi1 миметики; семустин; ингибитор 1, полученный из senescence; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; борокаптан-натрий; фенилацетат натрия; солверол; соматомедин-связывающий белок; сонермин; спарфозовая кислота; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; антагонисты гиперактивного вазоактивного интестинального пептида; сурадиста; сурамин; сваинсонин; таллимустин; тамоксифен-метиодид; тауромустин; тазаротен; текогалан-натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлородекаоксид; тетразомин; талибластин; тиокоралин; тромбопоиэтин; тромбопоэтиновый миметик; тималфазин; агонист рецептора тимопоэтина; тимотринан; тиреостимулирующий гормон; тин-этил этиопурпурин; тирапазамин; титаноцен-дихлорид; топсентин; торемифен; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимикс; полученный из мочеполовой пазухи ингибирующий ростовой фактор; антагонисты рецептора урокиназы; вапреотид; вариолин В; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; и зиностатин стималамер.
Конкретные вторые активные агенты включают, но не ограничиваются ими: 2-метоксиэстрадиол; теломестатин; индукторы апоптоза в клетках множественной миеломы (такие как, например, TRAIL), статины; семаксаниб; циклоспорин; этанерсепт; доксициклин; бортезомиб; облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мелфалан; дексаметазон (Decadron®), стероиды; гемцитабин; цисплатин; темозоломид; этопозид; циклофосфамид; темодар; карбоплатин; прокарбазин; глиадел, тамоксифен; топотекан; метотрексат; Arisa®; таксол; таксотер; флуороурацил; лейковорин; иринотекан; кселода; СРТ-11; интерферон-альфа; пегилированный интерферон альфа (например, PEG INTRON-A), капецитабин; цисплатин; тиотепа; флударабин; карбоплатин; липосомальный даунорубицин; цитарабин; доксетаксол; паклитаксел; винбластин; IL-2; GM-CSF, дакарбазин, винорелбин, золедроновая кислота, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустин-натрийфосфат (Emcyt®), сулиндак и этопозид.
В другом варианте осуществления примеры конкретных вторых агентов в соответствии с симптомами, которые подвергаются лечению, профилактике или регулированию, могут быть найдены в приведенных ниже ссылках, которые все включены в описание во всей их полноте: патенты США №№ 6281230 и 5635517; публикации США №№ 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154889, 2006/0122228 и 2005/0143344; и в предварительной заявке США № 60/631870.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования боли, включают, но не ограничиваются ими, обычные терапевтические средства, используемые для лечения или профилактики боли, такие как антидепрессанты, антиконвульсанты, антигипертензивные средства, анксиолитические средства, блокаторы кальциевых каналов, мышечные релаксанты, ненаркотические анальгетики, опиатные анальгетики, противовоспалительыне средства, ингибиторы СОХ-2, иммуномодулирующие агенты, агонисты или антагонисты альфа-адренергического рецептора, иммунодепрессивные средства, кортикостероиды, кислород под повышенным давлением, кетамин, другие анестезирующие средства, антагонисты NMDA и другие терапевтические средства, приведенные, например, в публикации Physician’s Desk Reference 2003. Конкретными примерами являются, но не ограничиваются ими, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), окскарбазепин (Trileptal®), валпроиновая кислота (Depakene®), морфин-сульфат, гидроморфон, преднизон, гризеофульвин, пентониум, алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилиум, кетансерин, резерпин; дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, виокс, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования дегенерации желтого пятна и сопутствующих синдромов, включают, но не ограничиваются ими, стероид, световой сенсибилизатор, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейротрофический фактор, регулятор неоваскуляризации, анти-VEGF-антитело, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или соединение против ангиогенеза, или их комбинация. Конкретными примерами являются, но не ограничиваются ими, вертепорфин, пурлитин, ангиостатический стероид, rhuFab, интерферон-2α, пентоксифиллин, тин этиопурпурин, мотексафин, lucentis lutetium, 9-фтор-11,21-дигидрокси-16, 17,1-метилэтилидинбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см., патент США № 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (патенты США №№ 6218369 и 6015803), генистеин, генистин, 6’-О-Mal генистин, 6’-О-Ас генистин, даидзеин, даидзин, 6’-О-Mal даидзин, 6’-О-Ас даидзин, глицитеин, глицитин, 6’-О-Mal глицитин, биоханин А, формононетин (патент США № 6001368), триамцинолон ацетомид, дексаметазон (патент США № 5770589), талидомид, глутатион (патент США № 5632984), основной фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), нейротропный фактор мозга (BDNF), фактор активатора плазминогена 2-го типа (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и имплант RETISERT (Bausch & Lomb). Все ссылки, цитируемые в описании, включены во всей их полноте в качестве ссылки.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования кожных заболеваний, включают, но не ограничиваются ими, кератолитики, ретиноиды, α-гидрокси-кислоты, антибиотики, коллаген, ботулинический токсин, интерферон, стероиды и иммуномодулирующие средства. Конкретными примерами являются, но не ограничиваются ими, 5-флуороурацил, мазопрокол, трихлоруксусная кислота, салициловая кислота, молочная кислота, лактат аммония, мочевина, третиноин, изотретиноин, антибиотики, коллаген, ботулинический токсин, интерферон, кортикостероид, транс-ретиноевая кислота и коллагены, такие как человеческий плацентарный коллаген, животный плацентарный коллаген, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования легочной гипертензии и сопутствующих нарушений, включают, но не ограничиваются ими, антикоагулянты, диуретики, сердечные гликозиды, блокаторы кальциевых каналов, вазодилататоры, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы PDE V), ингибиторы эндопептидазы, липидопонижающие средства, ингибиторы тромбоксана и другие терапевтические средства, известные как понижающие легочное артериальное давление. Конкретными примерами являются, но не ограничиваются ими, варфарин (Coumadin®), диуретик, сердечный гликозид, дигоксин-кислород, дилтиазем, нифедипин, вазодилатор, такой как простациклин (например, простагландин I2 (PGI2), эпопростенол (ЕРО, Floran®), трепростинил (Remodulin®), оксид азота (NO), бозентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования нарушений, связанных с асбестом, включают, но не ограничиваются ими, антрациклин, платин, алкилирующий агент, облимерсен (Genasense®), цисплатин, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновая кислота, пальмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидаза, митомицин С, мепакрин, тиотепа, тетрациклин и гемцитабин.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования паразитных заболеваний, включают, но не ограничиваются ими, хлороквин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлоквин, галофантрин, примаквин, гидроксихлороквин, прогуанил, атоваквон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин В, пентавалентные соединения сурьмы (например, стибоглюкуронат натрия), интерферон-гамма, итаконазол, комбинация неживых промастигот и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования нарушений иммунодефицита, включают, но не ограничиваются ими: антибиотики (терапевтические или профилактические), такие как, но без ограничения ими, ампициллин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но без ограничения ими, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; плазма; иммунологические усиливающие лекарства, такие как, но без ограничения ими, левамисол и изопринозин; биологические препараты, такие как, но без ограничения ими, гаммаглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но без ограничения ими, тимус; и другие иммунологические средства, такие как, но без ограничения ими, стимуляторы В клеток (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), ростовые факторы (например, TGF-α), антитела (например, анти-CD40 и IgM), олигонуклеотиды, содержащие неметилированные CpG мотивы, и вакцины (например, вакцины вирусных и опухолевых пептидов).
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования нарушений ЦНС, включают, но не ограничиваются ими: опиаты, агонисты или антагонисты допамина, такие как, но без ограничения ими, Леводопа, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам-мезилат, каберголин, прамипексол-дигидрохлорид, ропинорол, амантадин-гидрохлорид, селегилин-гидрохлорид, карбидопа, перголид-мезилат, Sinemet CR и Symmetrel; ингибиторы МАО, такие как, но без ограничения ими, ипрониазид, клоргилин, фенелзин и изокарбоксазид; ингибиторы COMT, такие как, но без ограничения ими, толкапон и энтакапон; ингибитор холинэстеразы, такой как, но без ограничения, физостигмин-салицилат, физостигмин-сульфат, физостигмин-бромид, неостигмин-бромид, неостигмин-метилсульфат, амбеноний-хлорид, хлорид эдрофония, такрин, пралидоксим-хлорид, обидоксим-хлорид, тримедоксим-бромид, диацетил-моноксим, эндрофоний, пиридостигмин и демекарий; противовоспалительный агент, такой как, но без ограничения, напроксен-натрий, дихлофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасализин, соли золота, Rho-D иммуноглобулин, микофенилат-мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасализин, ацетаминофен, индометацин, сулиндак, мефенаминовая кислота, меклофенамат-натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкоза, тиомалат золото-натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон, и другие глюкокортикоиды; и противорвотное средство, такое как, но без ограничения, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, methallatal, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования расстройств ЦНС и сопутствующих синдромов, включают, но не ограничиваются ими: иммуномодулирующие агенты, иммунодепрессивные агенты, антигипертензивные средства, антиконвульсанты, фибринолитические агенты, антитромбоцитарные агенты, антипсихотические агенты, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или обычные агенты, используемые в случае больных с травмой/поражением ЦНС и сопутствующими синдромами. Конкретными примерами являются, но не ограничиваются ими: стероиды (например, глюкокортикоиды, такие как, но без ограничения ими, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительные агенты, включая, но без ограничения ими, напроксен-натрий, диклофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D иммуноглобулин, микофенилат-мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовая кислота, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкоза, тиомалат золото-натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон; аналоги цАМФ, в том числе, но без ограничения, db-цАМФ; агент, содержащий лекарство на основе метилфенидата, который включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат, а также их смесь; и диуретический агент, такой как, но без ограничения, маннит, фуросемид, глицерин и мочевина.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования дисфункционального сна и сопутствующих синдромов, включают, но не ограничиваются ими: трициклический антидепрессантный агент, селективный ингибитор обратного захвата серотонина, противоэпилептический агент (габапентин, прегабалин, карбамазепин, окскарбазепин, левитирацетам, топирамат), антиаритмический агент, блокирующий натриевые каналы агент, селективный ингибитор медиатора воспалительного ответа, опиоидный агент, второе иммуномодулирующее соединение, комбинированный агент, а также другие известные или обычные средства, используемые при терапии сна. Конкретными примерами являются, но не ограничиваются ими, нейронтин, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, Леводопа, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам-мезилат, каберголин, прамипексол-дигидрохлорид, ропинорол, амантадин-гидрохлорид, селегилин-гидрохлорид, карбидопа, перголид-мезилат, Sinemet CR, Symmetrel, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмин-салицилат, физостигмин-сульфат, физостигмин-бромид, неостигмин-бромид, неостигмин-метилсульфат, амбенония хлорид, эдрофония хлорид, такрин, пралидоксим-хлорид, обидоксим-хлорид, тримедоксим-бромид, диацетил-моноксим, эндрофоний, пиридостигмин, демекарий, напроксен-натрий, дихлофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D иммуноглобулин, микофенилат-мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасализин, ацетаминофен, индометацин, сулиндак, мефенаминовая кислота, меклофенамат-натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон (apazone), зилейтон, ауротиоглюкоза, тиомалат золото-натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, methallatal, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или регулирования гемоглобинопатии и сопутствующих нарушений, включают, но не ограничиваются ими: интерлейкины, такие как IL-2 (включая рекомбинантный IL-II («rIL2») и IL-2 птичьего вируса (canarypox)), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2а, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-1а и интерферон гамма-1b; и G-CSF; гидроксимочевину; бутираты или производные бутиратов; оксид азота; гидроксимочевину; HEMOXINTM (NIPRISANTM; см. патент США № 5800819); антагонисты каналов Гардоса, такие как клотримазол и производные триарилметана; дефероксамин; белок С; и переливание крови или заменителей крови, таких как HemospanTM или HemospanTM PS (Sangart).
Введение соединения, предложенного в изобретении, или его фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства, и вторых активных агентов пациенту может быть осуществлено одновременно или последовательно по одному и тому же или по разным путям введения. Приемлемость конкретного пути введения, используемого для конкретного активного агента, будет зависеть от самого активного агента (например, может ли он быть введен перорально без разложения до поступления в кровяной поток) и от заболевания, подвергающегося лечению. Одним из способов введения предложенных соединений является пероральный. Пути введения вторых активных агентов или ингредиентов известны специалистам в данной области техники (см., например, Physicians’ Desk Reference (60th ed., 2006).
В одном из вариантов осуществления второй активный агент вводят внутривенно или подкожно и один или два раза в день в количестве приблизительно от 1 до 1000 мг, приблизительно от 5 до 500 мг, приблизительно от 10 до 350 мг, или приблизительно от 50 до 200 мг. Конкретное количество второго активного агента будут зависеть от конкретного используемого агента, типа заболевания, подвергающегося лечению или регулированию, серьезности стадии заболевания и количеств(а) соединений, предложенных в данном изобретении, а также от любых необязательных дополнительных активных агентов, одновременно вводимых пациенту.
Как уже обсуждалось в данном описании, также рассматривается способ уменьшения, лечения и/или предупреждения отрицательных или нежелательных эффектов, связанных с обычной терапией, в том числе, но без ограничения, с хирургическим вмешательством, химиотерапией, лучевой терапией, гормональной терапией, биологической терапией и иммунотерапией. Соединения, предложенные в изобретении, и другие активные ингредиенты могут быть введены больному до, во время или после проявления отрицательного эффекта, связанного с обычной терапией.
4.4. Циклическая терапия
В некоторых вариантах осуществления профилактические или терапевтические средства, предложенные в изобретении, пациенту вводят циклически. Циклическая терапия включает введение активного агента в течение некоторого периода времени, после чего следует отдых (то есть, введение с перерывами) в течение некоторого периода времени, и повторение такого последовательного введения. Циклическая терапия может уменьшить развитие устойчивости к одному или нескольким видам терапии, исключить или уменьшить побочные эффекты от одного из видов терапии и/или улучшить эффективность лечения.
Следовательно, в одном из вариантов осуществления изобретения предложенное соединение вводят ежедневно в разовой или в поделенных дозах в течение четырех-шести недельного цикла с периодом отдыха приблизительно одну или две недели. Циклическая терапия также дает возможность увеличить частоту, число и продолжительность циклов дозирования. Таким образом, другой вариант осуществления охватывает введения соединения, предложенного в изобретении, в течение большего числа циклов, чем обычно, когда оно вводится отдельно. В еще одном варианте осуществления соединение, предложенное в изобретении, вводят в течение большего числа циклов, чем число циклов, которое мотивировано ограничивающей дозу токсичностью у больного, которому второй активный ингредиент также не вводится.
В одном из вариантов осуществления соединение, предложенное в изобретении, вводят ежедневно и непрерывно в течение трех-четырех недель в дозе приблизительно от 0,1 до 500 мг в день, после чего следует отдых одну-две недели. В другом варианте осуществления доза может составлять приблизительно от 1 до 300 мг, приблизительно от 0,1 до 150 мг, приблизительно от 1 до 200 мг, приблизительно от 10 до 100 мг, приблизительно от 0,1 до 50 мг, приблизительно от 1 до 50 мг, приблизительно от 10 до 50 мг, приблизительно от 20 до 30 мг или приблизительно от 1 до 20 мг, после чего следует отдых.
В одном из вариантов осуществления соединение, предложенное в изобретении, и второй активный агент вводят перорально, причем введение соединения, предложенного в изобретении, имеет место за 30-60 минут до введения второго активного ингредиента, в течение четырех-шести недельного цикла. В другом варианте осуществления комбинацию соединения, предложенного в изобретении, и второго активного ингредиента вводят путем внутривенного вливания в течение приблизительно 90 минут каждого цикла.
Как правило, число циклов, во время которых проводят комбинированное лечение больного, будет составлять приблизительно от одного до 24 циклов, приблизительно от двух до 16 циклов, или приблизительно от четырех до трех циклов.
4.5. Фармацевтические композиции и дозированные лекарственные формы
Фармацевтические композиции могут быть использованы при получении отдельных, единичных дозированных лекарственных форм. Фармацевтические композиции и дозированные лекарственные формы, предложенные в изобретении, содержат соединение, предложенное в изобретении, или его фармацевтически приемлемую соль, сольват, стереоизомер, клатрат или пролекарство. Фармацевтические композиции и дозированные лекарственные формы также могут содержать один или несколько наполнителей.
Фармацевтические композиции и дозированные лекарственные формы, предложенные в изобретении, также могут включать один или несколько дополнительных активных ингредиентов. Примеры необязательных вторых или дополнительных активных ингредиентов описаны выше в разделе 4.3.
Единичные дозированные лекарственные формы, предложенные в изобретении, приемлемы для перорального, чрезслизистого (например, назального, подъязычного, вагинального, буккального или ректального введения), парентерального (например, подкожного, внутривенного введения, введения ударной инъекции, внутримышечного или внутриартериального введения), топикального (например, глазные капли или другие глазные препараты), трансдермального или чрезкожного введения пациенту. Примерами дозированных лекарственных форм являются, но не ограничиваются ими: таблетки, каплеты, капсулы, такие как мягкие эластичные желатиновые капсулы; саше; пастилки; лепешки; дисперсии; свечи; порошки; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие дозированные лекарственные формы, приемлемые для перорального или чрезслизистого введения пациенту, в том числе суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле); растворы и эликсиры; жидкие дозированные лекарственные формы, приемлемые для парентерального введения пациенту; глазные капли или другие глазные препараты, приемлемые для топикального введения; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть восстановлены с получением жидких дозированных лекарственных форм, приемлемых для парентерального введения пациенту.
Состав, форма и тип дозированных лекарственных форм обычно будут меняться в зависимости от их назначения. Например, дозированная лекарственная форма, используемая при остром лечении заболевания, может содержать большие количества одного или нескольких активных ингредиентов, чем дозированная лекарственная форма, используемая при хроническом лечении того же самого заболевания. Аналогично, парентеральная дозированная лекарственная форма может содержать меньшие количества одного или нескольких активных ингредиентов, чем пероральная дозированная лекарственная форма, используемая для лечения того же самого заболевания. Эти и другие пути, по которым используют конкретные дозированные лекарственные формы, будут меняться от одного к другому, что очевидно для специалиста в данной области техники (см., например, Remington’s Pharmaceutical Sciences, 18-ed., Mack Publishing, Easton PA (1990)).
В одном из вариантов осуществления фармацевтические композиции и дозированные лекарственные формы содержат один или несколько наполнителей. Подходящие наполнители хорошо известны специалистам в области фармацевтики и неограничивающие примеры подходящих наполнителей представлены в описании. Подходит ли конкретный наполнитель для введения в фармацевтическую композицию или дозированную форму зависит от ряда факторов, хорошо известных в данной области техники, в том числе, не без ограничения, путь, по которому дозированная форма будет вводиться больному. Например, пероральные дозированные лекарственные формы, такие как таблетки, могут содержать наполнители, неприемлемые для использования в парентеральных дозированных формах. Приемлемость конкретного наполнителя может также зависеть от конкретных активных ингредиентов в дозированной лекарственной форме. Например, разложение некоторых активных ингредиентов может быть ускорено некоторыми наполнителями, такими как лактоза, или при воздействии воды. Активные ингредиенты, которые содержат первичные или вторичные амины, особенно чувствительны к такому ускоренному разложению. Следовательно, готовят фармацевтические композиции и дозированные формы, которые содержат немного, если вообще содержат, лактозы или моно- или дисахариды. Как используется в данном описании, определение «не содержит лактозы» означает, что количество присутствующей лактозы, если она есть, является недостаточным, чтобы значительно увеличить скорость разложения активного ингредиента.
Несодержащие лактозу композиции могут включать наполнители, которые хорошо известные в данной области техники, и которые перечислены, например, в публикации U.S. Pharmacopeia (USP) 25-NF20 (2002). В общем случае несодержащие лактозу композиции содержат активные ингредиенты, связующее вещество/наполнитель и смазывающее вещество в фармацевтически совместимых и фармацевтически приемлемых количествах. В одном из вариантов осуществления несодержащие лактозу дозированные лекарственные формы содержат активные ингредиенты, микрокристаллическую целлюлозу, преджелатинизированный крахмал и стеарат магния.
Также предложены безводные фармацевтические композиции и дозированные лекарственные формы, содержащие активные ингредиенты, так как вода может ускорять разложение некоторых соединений. Например, добавление воды (например, 5%) широко принято в фармацевтической области в качестве средства, моделирующего долговременное хранение, для определения характеристик, таких как срок хранения или стабильность рецептуры во времени (см., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80). Действительно, вода и нагревание ускоряют разложение некоторых соединений. Следовательно, влияние воды на рецептуру может быть достаточно значимым, так как влага и/или влажные условия широко встречаются во время производства, обработки, упаковки, хранения, транспортировки и применения препаратов.
Безводные фармацевтические композиции и дозированные лекарственные формы могут быть получены с использованием безводных или содержащих мало влаги ингредиентов и в условиях с низким содержанием влаги или с низкой влажностью. Фармацевтические композиции и дозированные лекарственные формы, которые включают лактозу и, по меньшей мере, один активный ингредиент, который содержит первичный или вторичный амин, предпочтительно являются безводными, если ожидается значительный контакт с влагой и/или с влажными условиями во время производства, упаковки и/или хранения.
Безводную фармацевтическую композицию необходимо готовить и хранить так, чтобы ее безводная природа сохранялась. Соответственно, безводные композиции в одном из вариантов осуществления упаковывают с использованием материалов, которые, как известно, предотвращают воздействие воды так, что они могут быть включены в подходящие рецептурные наборы. Примерами подходящих упаковок являются, но не ограничиваются ими, герметично запаянная фольга, пластики, стандартные дозированные контейнеры (например, пузырьки), блистерные упаковки и контурные упаковки.
Также предложены фармацевтические композиции и дозированные лекарственные формы, содержащие одно или несколько соединений, которые снижают скорость, при которой активный ингредиент будет разлагаться. Такие соединения, которые называют в данном случае «стабилизаторами», представляют собой, но не ограничиваются ими, антиоксиданты, такие как аскорбиновая кислота, рН буферы или солевые буферы.
Подобно количествам и типам наполнителей, количества и конкретные типы активных ингредиентов в дозированной лекарственной форме могут меняться в зависимости от ряда факторов, таких как, но без ограничения ими, путь, по которому они должны быть введены больным. В одном из вариантов осуществления дозированные лекарственные формы содержат соединение, представленное в изобретении, в количестве приблизительно от 0,10 до 500 мг. В другом варианте дозированные лекарственные формы содержат соединение, представленное в изобретении, в количестве приблизительно 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг.
В другом варианте изобретения дозированные лекарственные формы содержат второй активный ингредиент в количестве приблизительно от 1 до 1000 мг, приблизительно от 5 до 500 мг, приблизительно от 10 до 350 мг или приблизительно от 50 до 200 мг. Конечно, конкретное количество второго активного агента будет зависеть от конкретного используемого агента, заболеваний или нарушений, которые подвергаются лечению или регулированию, количества соединения, предложенного в изобретении, и любых необязательных дополнительных активных агентов, одновременно вводимых больному.
4.5.1. Пероральные дозированные лекарственные формы
Фармацевтические композиции, которые приемлемы для перорального введения, могут быть получены в виде дискретных дозированных лекарственных форм, таких как, но без ограничения ими, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, сиропы с определенным вкусом). Такие дозированные лекарственные формы содержат предопределенные количества активных ингредиентов и могут быть получены способами фармацевтики, которые хорошо известны специалистам в данной области техники (см., например, Remington’s Pharmaceutical Sciences, 18-ed., Mack Publishing, Easton PA (1990)).
Пероральные дозированные лекарственные формы, предложенные в изобретении, получают путем объединения активных ингредиентов в однородную смесь, по меньшей мере, с одним наполнителем в соответствии с обычными фармацевтическими методиками составления смесей. Наполнители могут принимать большое число форм в зависимости от препарата, требуемого для введения. Например, наполнители, подходящие для применения в пероральной жидкости или в аэрозольных дозированных лекарственных формах, включают, но не ограничиваются ими, воду, гликоли, масла, спирты, ароматизирующие вкусовые агенты, консерванты и красящие агенты. Примерами наполнителей, приемлемых для использования в твердых пероральных дозированных лекарственных формах (таких как порошки, таблетки, капсулы и каплеты), являются, но не ограничиваются ими, крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие вещества, связующие вещества и диспергирующие агенты.
В одном из вариантов осуществления пероральные дозированные лекарственные формы представляют собой таблетки или капсулы, в которых используют твердые наполнители. В другом варианте осуществления на таблетки может быть нанесено покрытие с помощью стандартных водных или неводных методик. Такие дозированные лекарственные формы могут быть получены с помощью любых способов фармацевтики. В общем случае фармацевтические композиции и дозированные лекарственные формы получают путем равномерного и тщательного смешения активных ингредиентов с жидкими носителями, тонкоизмельченными твердыми носителями, или с обоими, и затем приданием продукту желаемой формы, если это необходимо.
Например, таблетка может быть получена путем прессования или формования. Прессованные таблетки могут быть получены путем прессования в подходящей машине активных ингредиентов в свободно текучей форме, такой как порошок или гранулы, необязательно смешанных с наполнителями. Формованные таблетки могут быть получены путем формования в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Примеры наполнителей, которые могут быть использованы в пероральных дозированных лекарственных формах, предложенных в изобретении, включают, но не ограничиваются ими, связующие вещества, наполнители, диспергирующие агенты и смазывающие вещества. Связующие вещества для применения в фармацевтических композициях и дозированных лекарственных формах представляют собой, но не ограничиваются ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновую кислоту, другие альгинаты, порошкообразный трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций-карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, преджелатинизированный крахмал, гидроксипропилметилцеллюлозу (например, №№ 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящими формами микрокристаллической целлюлозы являются, но не ограничиваются ими, материалы, продаваемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL-RC-581, AVICEL-PH-105 (поставляемые FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), а также их смеси. Типичным связующим веществом является смесь микрокристаллической целлюлозы и натрий-карбоксиметилцеллюлозы, продаваемая как AVICEL-RC-581. Подходящими безводными наполнителями или добавками или наполнителями или добавками с низким содержанием влаги являются AVICEL-РН-103ТМ и Starch 1500 LM.
Примерами наполнителей, приемлемых для применения в фармацевтических композициях и дозированных лекарственных формах, предложенных в изобретении, являются, но не ограничиваются ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстраты, каолин, маннит, салициловая кислота, сорбит, крахмал, преджелатинизированный крахмал и их смеси. Связующее вещество или наполнитель в фармацевтической композиции в одном из вариантов изобретения присутствует в количестве приблизительно от 50 до 99% масс. из расчета на фармацевтическую композицию или дозированную лекарственную форму.
Могут быть использованы диспергирующие агенты, чтобы получить таблетки, которые распадаются при воздействии водной среды. Таблетки, которые содержат слишком много диспергирующего агента, могут распадаться при хранении, тогда как таблетки, которые содержат слишком мало диспергирующего агента, не могут распадаться с желаемой скоростью или в желаемых условиях. Следовательно, достаточное количество диспергирующего агента, которое ни слишком велико, ни слишком мало, чтобы пагубно изменить высвобождение активных ингредиентов, может быть использовано для получения твердых пероральных дозированных лекарственных форм. Количество используемого диспергирующего агента меняется, исходя из типа препарата, и легко определяется специалистом в данной области техники. В одном из вариантов изобретения фармацевтическая композиция содержит приблизительно от 0,5 до 15% масс. диспергирующего агента или приблизительно от 1 до 5% масс. диспергирующего агента.
Диспергирующие агенты, которые могут быть использованы в фармацевтических композициях и дозированных лекарственных формах, включают, но не ограничиваются ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакриллин калия, крахмалгликолат натрия, картофельный крахмал или крахмал из тапиоки, преджелатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Смазывающие вещества, которые могут быть использованы в фармацевтических композициях и дозированных лекарственных формах, включают, но не ограничиваются ими, стеарат кальция, стеарат магния, минеральное масло, светлое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Другие смазывающие вещества представляют собой, например, силоидный силикагель (AEROSIL 200, производимый W.R. Grace Co., Baltimore, MD), коагулированный аэрозоль синтетического диоксида кремния (продаваемый Degussa Co., Plano, TX), CAB-O-SIL (пирогенетический диоксид кремния, продаваемый Cabot Co., Boston, MA) и их смеси. Если смазывающие вещества вообще используют, то их количество составляет менее чем приблизительно 1% масс. из расчета на фармацевтическую композицию или дозированную лекарственную форму, в которую они введены.
В одном из вариантов изобретения твердая пероральная дозированная лекарственная форма содержит соединение, представленное в изобретении, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидальный безводный диоксид кремния и желатин.
4.5.2. Дозированные лекарственные формы с контролируемым высвобождением
Активные ингредиенты, представленные в изобретении, могут быть введены с помощью контролирующих высвобождение средств или с помощью устройств доставки, которые хорошо известны специалистам в данной области техники. Примеры включают, но не ограничиваются ими, примеры, описанные в патентах США №№: 3845770, 3916899, 3536809, 3598123, 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 и 5733566, каждый из которых включен в описание в качестве ссылки. Такие дозированные лекарственные формы могут быть использованы для обеспечения медленного или контролируемого высвобождения одного или нескольких активных ингредиентов с использованием в меняющихся пропорциях, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинаций, чтобы получить желаемый профиль высвобождения. Подходящие контролирующие высвобождение препараты, известные специалистам в данной области техники, включая описанные в изобретении препараты, могут быть легко выбраны для применения с активными агентами, предложенными в изобретении. В одном из вариантов осуществления предложены единичные дозированные лекарственные формы для перорального введения, такие как, но без ограничения ими, таблетки, капсулы, гелькапы и каплеты, которые адаптированы для контролируемого высвобождения.
В одном из вариантов осуществления фармацевтические продукты с контролируемым высвобождением улучшают лекарственную терапию по сравнению с терапией, достигаемой с помощью из аналогов без контролируемого высвобождения. В другом варианте изобретения использование препарата с контролируемым высвобождением при медицинском лечении характеризуется минимальным количеством лекарственного вещества, которое используют для лечении или контроле состояния, при минимальном времени. Преимущества препаратов с контролируемым высвобождением включают продленную активность лекарства, уменьшенную частоту дозирования и повышенное приятие больным. Кроме того, препараты с контролируемым высвобождением могут быть использованы, чтобы повлиять на время наступления эффекта или на другие характеристики, такие как уровни лекарств в крови, и, следовательно, могут влиять на проявление побочных (например, вредных) эффектов.
В другом варианте изобретения препараты с контролируемым высвобождением выполнены так, чтобы вначале высвободить количество лекарства (активного ингредиента), которое сразу дает желаемый терапевтический или профилактический эффект, и затем постепенно и постоянно высвобождать другие количества лекарства для поддержания такого уровня терапевтического или профилактического эффекта в течение продолжительного периода времени. В одном из вариантов осуществления, чтобы сохранить постоянный уровень лекарства в крови, лекарство может высвобождаться из дозированной формы при скорости, при которой будет замещаться количество лекарства, подвергшееся метаболизму и выделившееся из организма. Контролируемое высвобождение активного ингредиента может быть стимулировано различными условиями, включающими, но без ограничения ими, рН, температуру, ферменты, воду или другие физиологические условия или соединения.
4.5.3. Парентеральные дозированные лекарственные формы
Парентеральные дозированные лекарственные формы могут быть введены больным различными путями, включающими, но без ограничения ими, подкожный, внутривенный (в том числе, ударную инъекцию), внутримышечный и внутриартериальный. В некоторых вариантах осуществления введение парентеральной дозированной лекарственной формы обходит естественные защитные механизмы пациентов от заражений, и, следовательно, в таких вариантах парентеральные дозированные формы являются стерильными или могут быть стерилизованы перед введением больному. Примерами парентеральных дозированных лекарственных форм являются, но не ограничиваются ими, растворы, готовые для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекций, суспензии, готовые для инъекций, и эмульсии.
Подходящие носители, которые могут быть использованы для создания парентеральных дозированных лекарственных форм, хорошо известны специалистам в данной области техники. Примерами являются, но не ограничиваются ими: вода для инъекций по USP; водные носители, такие как, но без ограничения ими, раствор хлористого натрия для инъекций, раствор Рингера для инъекций; раствор декстрозы для инъекций, раствор декстрозы и хлористого натрия для инъекций и лактированный раствор Рингера для инъекций; смешивающиеся с водой носители, такие как, но без ограничения ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но без ограничения ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые повышают растворимость одного или нескольких активных ингредиентов, рассмотренных в описании, также могут быть введены в парентеральные дозированные лекарственные формы. Например, циклодекстрин и его производные могут быть использованы для повышения растворимости соединения, предложенного в изобретении (см., например, патент США № 5134127, который включен в качестве ссылки).
4.5.4. Топикальные дозированные лекарственные формы и дозированные лекарственные формы для слизистых
Топикальные дозированные лекарственные формы и дозированные лекарственные формы для слизистых, предложенные в изобретении, включают, но не ограничиваются ими, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли или другие глазные препараты, или другие формы, известные специалистам в данной области техники (см., например, Remington’s Pharmaceutical Sciences, 16th & 18th eds., Mack Publishing, Easton PA (1980 & 1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985)). Дозированные лекарственные формы для обработки слизистых тканей в полости рта могут быть приготовлены в виде полосканий для рта или пероральных гелей.
Подходящие наполнители (например, носители и разбавители) и другие материалы, которые могут быть использованы для создания топикальных дозированных лекарственных форм и дозированных лекарственных форм для слизистых, охватываемых настоящим изобретением, хорошо известны в фармацевтической области, и определяются конкретной тканью, на которую данная фармацевтическая композиция или дозированная лекарственная форма будет наноситься. В одном из вариантов осуществления наполнители включают, но не ограничиваются ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси с получением растворов, эмульсий или гелей, которые нетоксичны и фармацевтически приемлемы. Увлажнители или смачивающие вещества также могут быть добавлены к фармацевтическим композициям или дозированным лекарственным формам. Примеры дополнительных ингредиентов хорошо известны в данной области техники (см., например, Remington’s Pharmaceutical Sciences, 16th & 18th eds., Mack Publishing, Easton PA (1980 & 1990)).
Значение рН фармацевтической композиции или дозированной лекарственной формы также может быть скорректировано, чтобы улучшить доставку одного или нескольких активных ингредиентов. Кроме того, полярность растворителя-носителя, его ионную силу или тоничность можно регулировать, чтобы улучшить доставку. Соединения, такие как стеараты, также могут быть добавлены к фармацевтическим композициям или дозированным лекарственным формам для изменения гидрофильности или липофильности одного или нескольких активных ингредиентов с тем, чтобы улучшить доставку. В других вариантах осуществления стеараты могут служить в качестве липидного носителя для препарата, в качестве эмульгирующего агента или поверхностно-активного вещества, или в качестве улучшающего доставку или усиливающего проникание агента. В других вариантах осуществления соли, сольваты, пролекарства, клатраты или стереоизомеры активных ингредиентов могут быть использованы, чтобы дополнительно скорректировать свойства конечной композиции.
4.6. Наборы
В одном из вариантов осуществления активные ингредиенты, предложенные в изобретении, не вводят больному в одно и то же время или по одному и тому же пути введения. В другом варианте, предложен набор, который может значительно упростить введение соответствующих количеств активных ингредиентов.
В одном из вариантов осуществления набор включает дозированную лекарственную форму соединения, предложенного в изобретении. Наборы могут также содержать дополнительные активные ингредиенты, такие как облимерсен (Genasense®), мелфалан, G-CSF, GM-CSF, EPO, топотекан, декарбазин, иринотекан, таксотер, IFN, ингибитор СОХ-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL2, IL8, IL18, Ara-C, винорелбин, изотретиноин, 13 цис-ретиноевая кислота или их фармакологически активный мутант или производное, или их комбинацию. Примеры дополнительных активных ингредиентов включают, но не ограничиваются ими, примеры, раскрытые в изобретении (см., раздел 4.3).
В других вариантах осуществления наборы дополнительно могут содержать устройства, которые используют для введения активных ингредиентов. Примерами таких устройств являются, но не ограничиваются ими, шприцы, капельные пакеты, пластыри и ингаляторы.
Кроме того, наборы могут содержать клетки или кровь для трансплантации, а также фармацевтически приемлемые носители, которые могут быть использованы для введения одного или нескольких активных ингредиентов. Например, если активный ингредиент представлен в твердой форме, которая должна быть восстановлена для парентерального введения, набор может содержать герметичный контейнер с подходящим носителем, в котором активный ингредиент может быть растворен с образованием несодержащего материал в форме частиц стерильного раствора, приемлемого для парентерального введения. Примерами фармацевтически приемлемых носителей являются, но не ограничиваются ими, вода для инъекций по USP; водные носители, такие как, но без ограничения ими, раствор хлористого натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлористого натрия для инъекций и лактированный раствор Рингера для инъекций; смешивающиеся с водой носители, такие как, но без ограничения, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но без ограничения, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
5. Примеры
Некоторые варианты изобретения проиллюстрированы с помощью приведенных ниже неограничивающих примеров.
5.1. 3-(5-Метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
Стадия 1: Смесь 2-амино-6-метилбензойной кислоты (10,75 г, 71,1 ммоль) и CDI (10,75 г, 66,3 ммоль) в ацетонитриле (150 мл) перемешивают при комнатной температуре 1 час. К суспензии добавляют гидрохлорид 3-аминопиперидин-2,6-диона (10,75 г, 65,3 ммоль) и гидрокарбонат натрия (8,0 г, 95 ммоль) и смесь нагревают при 50°С в течение 18 часов. Суспензию охлаждают до комнатной температуры, фильтруют и промывают ацетонитрилом (50 мл), водой (2×50 мл), метанолом (50 мл) и этилацетатом (50 мл), получают 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метил-бензамид в виде белого твердого вещества (9,89 г, выход 58%).
1H ЯМР (DMSO-d6) δ 1,98-2,17 (м, 5H, CH2, CH3) 2,51-2,56 (м, 1Η, CΗH), 2,74-2,86 (м, 1Η, CΗH), 4,68-4,77 (м, 1Η, NCH), 5,18 (с, 2H, NH2), 6,38 (д, J=7 Гц, 1H, Ar), 6,50 (д, J=7 Гц, 1H, Ar), 6,94 (т; J=7 Гц, 1H, Ar), 8,59 (д, J=8 Гц, 1H, NH), 10,90 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 19,14, 23,75, 30,99, 49,10, 112,37, 17,21, 122,28, 128,96, 134,61, 145,22, 168,36, 172,84, 173,00; LCMS: MH=262.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метилбензамида (0,60 г, 2,2 ммоль), триметилортоформиата (3 мл, 26,8 мл) и п-толуолсульфоновой кислоты (0,060 г) в ацетонитриле (20 мл) кипятят с обратным холодильником 30 часов. Смесь охлаждают до комнатной температуры. К смеси добавляют воду (75 мл) и эфир (20 мл) и полученную смесь перемешивают 2 часа. Суспензию фильтруют и промывают водой и эфиром (по 50 мл каждого), получают 3-(5-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (0,28 г, выход 47%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% Н3РО4, 3,08 мин (99%); т.пл. 262-264°С.
1H ЯМР (DMSO-d6) δ 2,09-2,16 (м, 1H, CHH), 2,62-2,84 (м, 6Η, CH2, CH3, CΗH), 5,42 (ушир.с, 1Η, NCH), 7,32 (д, J=7 Гц, 1H, Ar), 7,52 (д, J=8 Гц, 1H, Ar), 7,69 (т, J=8 Гц, 1H, Ar), 8,30 (с, 1H, CH), 11,12 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 22,35, 22,62, 30,88, 58,00, 119,81, 125,36, 129,57, 133,72, 140,15, 147,08, 149,07, 160,21, 169,91, 172,33, 172,44; LCMS: MH=272;
Элементный анализ. Вычислено для C14C13N3O3: C 61,99; Н 4,83; N 15,49. Найдено: C 61,67; Н 4,40; N 15,41.
5.2. 3-(2,5-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
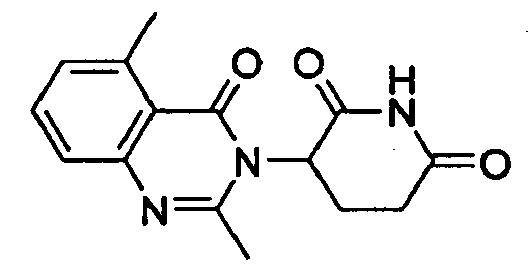
Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метил-бензамида (1,00 г, 3,8 ммоль) и триэтилортоацетата (0,9 мл, 4,9 ммоль) в ДМФА (10 мл) кипятят с обратным холодильником 1 час. Смесь охлаждают до комнатной температуры. К раствору добавляют целит (40 мл) и растворитель удаляют в вакууме. Твердое вещество загружают на SIM и очищают с помощью флеш гель-хроматографии ISCO (силикагель, СН3ОН/CH2Cl2), получают 3-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде почти белого твердого вещества (0,46 г, выход 43%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% Н3РО4, 2,95 мин (96%); т.пл. 292-294°С.
1H ЯМР (DMSO-d6) δ 2,11-2,18 (м, 1H, CHH), 2,55-2,65 (м, 2Η, CH2), 2,60 (с, 3Η, CH3), 2,69 (с, 3Η, CH3), 2,78-2,85 (м, 1Η, CΗH), 5,19 (дд, J=6, 11 Гц, 1H, NCH), 7,25 (д, J=8 Гц, 1H, Ar), 7,43 (д, J=8 Гц, 1H, Ar), 7,64 (т, J=8 Гц, 1H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,82, 22,43, 23,32, 30,55, 56,33, 118,69, 124,73, 128,82, 133,72, 139,82, 148,34, 154,58, 161,03, 169,61, 172,60; LCMS: MH=286;
Элементный анализ. Вычислено для C15C15N3O3+1Н2О: C 59,26; Н 5,68; N 13,66. Найдено: C 59,26; Н 5,68; N 13,66.
5.3. 3S-3-(2,5-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
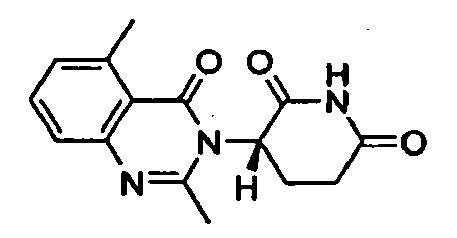
Стадия 1: При перемешивании суспензию 2,5-диметилбензо-[d][1,3]оксазин-4-она (7,4 г, 42 ммоль), трет.-бутилового эфира 4S-4-амино-4-карбамоилмасляной кислоты (Н-Glu(OtBu)-NH2) (10,0 г, 42 ммоль), имидазола (6,3 г, 92 ммоль) и трифенилфосфита (13,2 мл, 50 ммоль) в ацетонитриле (100 мл) кипятят с обратным холодильником 21 час. Смеси дают остыть до 30°С. К смеси добавляют воду (100 мл) и гексан (100 мл), получают три слоя. Нижние два слоя отделяют и экстрагируют метиленхлоридом (2×100 мл). Все три органических слоя объединяют. К раствору добавляют целит (2 чайные ложки). Растворитель удаляют в вакууме. Твердое вещество помещают в SIM и очищают с помощью колоночной хроматографии ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 50% за 20 минут), получают трет.-бутиловый эфир 4S-4-карбамоил-4-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты в виде белого твердого вещества (12,9 г, выход 86%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 2: Суспензию трет.-бутилового эфира 4S-4-карбамоил-4-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты (8,7 г 24 ммоль) и HCl в эфире (60 мл, 2 н., 120 ммоль) перемешивают при комнатной температуре 2 дня. Растворитель удаляют в вакууме. Твердое вещество перемешивают с эфиром (50 мл) 1 час. Суспензию фильтруют и промывают эфиром (20 мл), получают желтое твердое вещество. Твердое вещество перемешивают в метаноле (50 мл) в течение ночи. Суспензию фильтруют и промывают метанолом, получают 4S-4-карбамоил-4-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляную кислоту в виде белого твердого вещества (7,0 г, выход 96%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 3: При перемешивании к суспензии 4S-4-карбамоил-4-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты (7,2 г, 24 ммоль) в метиленхлориде (250 мл) добавляют тионилхлорид (7 мл, 96 ммоль) с использованием шприцевого насоса (2 мл/мин) при -40°С. Через 10 минут к смеси добавляют пиридин (7,7 мл, 96 ммоль) с использованием шприцевого насоса (2 мл/мин). Смесь перемешивают при -40°С в течение 5 часов. К смеси добавляют воду (20 мл). Через 5 минут к смеси добавляют гидрокарбонат натрия (насыщенный раствор, 100 мл). Через 10 минут смесь переносят в баню при 0°С и выдерживают 30 минут. Органический слой отделяют и концентрируют в вакууме, получают белое твердое вещество. Твердое вещество смешивают с первым водным слоем и суспензию перемешивают 10 минут. Суспензию фильтруют и промывают водой (50 мл), гидрокарбонатом натрия (насыщенный раствор, 50 мл) и водой (2×50 мл), получают почти белое твердое вещество. Твердое вещество растворяют в ацетонитриле (150 мл) и добавляют целит (3 чайные ложки). Растворитель удаляют в вакууме. Твердое вещество распределяют на три SIM и каждую SIM очищают колоночной хроматографией ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 50% за 15 минут), получают 3S-3-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,92 г, выход 43%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 4,50 мин (99,8%);
Хиральная ВЭЖХ: ChiralPak AD 1 мл/мин, 240 нм, 50/50 изо-PrOH/гексан, 12,62 (99,93%) (S-изомер), 18,58 (0,07%) (R-изомер); э.и. 99,86%; т.пл. 241-243°С.
1H ЯМР (DMSO-d6) δ 2,11-2,18 (м, 1H, CHH), 2,55-2,65 (м, 2H, CH2), 2,60 (с, 3H, CH3), 2,69 (с, 3Η, CH3), 2,78-2,85 (м, 1Η, CΗH), 5,19 (дд, J=6, 11 Гц, 1H, NCH), 7,25 (д, J=8 Гц, 1H, Ar), 7,43 (д, J=8 Гц, 1H, Ar), 7,64 (т, J=8 Гц, 1H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,82, 22,43, 23,32, 30,55, 56,33, 118,69, 124,73, 128,82, 133,72, 139,82, 148,34, 154,58, 161,03, 169,61, 172,60; LCMS: MH=286;
Элементный анализ. Вычислено для C15C15N3O3+0,5Н2О: C 61,22; Н 5,48; N 14,28; Н2О 3,06. Найдено: C 60,98; Н 5,54; N 14,21; Н2О 2,89.
5.4. 3R-3-(2,5-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
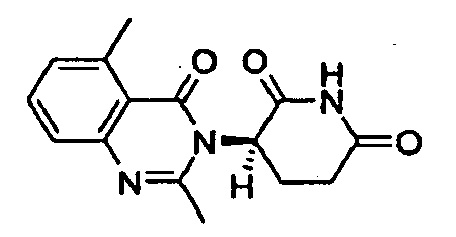
Стадия 1: При перемешивании суспензию 2,5-диметилбензо-[d][1,3]оксазин-4-она (7,8 г, 45 ммоль), трет.-бутилового эфира 2R-2-амино-4-карбамоилмасляной кислоты (9,0 г, 45 ммоль), имидазола (3,6 г, 53 ммоль) и трифенилфосфита (17 мл, 65 ммоль) в ацетонитриле (100 мл) кипятят с обратным холодильником 21 час. Смеси дают остыть до 30°С. К смеси добавляют воду (100 мл) и метиленхлорид (200 мл). Водный слой экстрагируют метиленхлоридом (200 мл). Объединенные органические слои промывают гидрокарбонатом натрия (насыщенный раствор, 100 мл). К органическому слою добавляют целит (2 чайные ложки). Растворитель удаляют в вакууме. Твердое вещество помещают в три SIM и очищают с помощью колоночной хроматографии ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 50% за 20 минут), получают трет.-бутиловый эфир 4R-4-карбамоил-2-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты в виде белого твердого вещества (3,4 г, выход 21%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 2: Суспензию трет.-бутилового эфира 4R-4-карбамоил-4-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты (3,4 г, 9,4 ммоль) и HCl в эфире (50 мл, 2 н., 100 ммоль) перемешивают при комнатной температуре 4 дня. Растворитель удаляют в вакууме. К твердому веществу добавляют метанол (30 мл). Растворитель снова удаляют в вакууме. Твердое вещество перемешивают в метиленхлориде (30 мл) в течение ночи. Суспензию фильтруют и промывают метиленхлоридом (20 мл), получают 4R-4-карбамоил-2-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляную кислоту в виде желтого твердого вещества (2,6 г, выход 91%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 3: При перемешивании к суспензии 4R-4-карбамоил-2-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)масляной кислоты (3,2 г, 11 ммоль) в метиленхлориде (130 мл) добавляют тионилхлорид (3,1 мл, 43 ммоль) с использованием шприцевого насоса (2 мл/мин) при -40°С. Через 10 минут к смеси добавляют пиридин (3,5 мл, 43 ммоль) с использованием шприцевого насоса (2 мл/мин). Смесь перемешивают при -40°С в течение 4 часов. К смеси добавляют воду (20 мл). Через 5 минут к смеси добавляют гидрокарбонат натрия (насыщенный раствор, 140 мл). Через 10 минут смесь переносят в баню при 0°С и выдерживают 30 минут. Органический растворитель удаляют в вакууме. Суспензию фильтруют и промывают водой (50 мл), получают почти белое твердое вещество. Твердое вещество растворяют в метаноле (150 мл) и добавляют целит (2 чайные ложки). Растворитель удаляют в вакууме. Твердое вещество распределяют на три SIM и каждую SIM очищают колоночной хроматографией ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 50% за 15 минут), получают 3R-3-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,4 г, выход 46%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% Н3РО4, 2,75 мин (99,3%);
Хиральная ВЭЖХ: ChiralPak AD 1 мл/мин, 240 нм, 50/50 изо-PrOH/гексан, 6,23 (4,22%) (S-изомер), 8,23 (95,38%) (R-изомер); э.и. 91,53%; т.пл. 280°С (разложение).
1H ЯМР (DMSO-d6) δ 2,11-2,18 (м, 1H, CHH), 2,55-2,65 (м, 2H, CH2), 2,60 (с, 3Η, CH3), 2,69 (с, 3Η, CH3), 2,78-2,85 (м, 1Η, CΗH), 5,19 (дд, J=6, 11 Гц, 1H, NCH), 7,25 (д, J=8 Гц, 1H, Ar), 7,43 (д, J=8 Гц, 1H, Ar), 7,64 (т, J=8 Гц, 1H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,82, 22,43, 23,32, 30,55, 56,33, 118,69, 124,73, 128,82, 133,72, 139,82, 148,34, 154,58, 161,03, 169,61, 172,60; LCMS: MH=286;
Элементный анализ. Вычислено для C15C15N3O3+0,35Н2О: C 61,78; Н 5,43; N 14,41; Н2О 2,16. Найдено: C 61,82; Н 5,08; N 14,32; Н2О 2,17.
5.5. 3-(2-Гидрокси-5-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
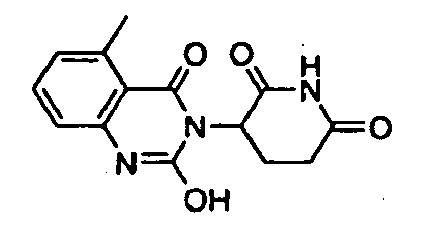
Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метил-бензамида (1,00 г, 3,8 ммоль), CDI (0,62 г, 3,8 ммоль) и DMAP (0,10 г, 0,82 ммоль) в ацетонитриле (12 мл) нагревают при 150°С в микроволновой печи в течение 10 минут. Суспензию фильтруют и промывают ацетонитрилом (2×20 мл), водой (2×20 мл), HCl (1 н., 25 мл), водой (25 мл), метанолом (2×20 мл) и этилацетатом (2×20 мл), получают 3-(2-гидрокси-5-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде почти белого твердого вещества (0,89 г, выход 81%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% Н3РО4, 5,72 мин (99%); т.пл. 373-375°С.
1H ЯМР (DMSO-d6) δ 1,90-1,97 (м, 1H, CHH), 2,49-2,58 (м, 2Η, CH2), 2,61 (с, 1,5Η, CH3), 2,69 (с, 1,5Η, CH3), 2,81-2,92 (м, 1Η, CΗH), 5,55 (дд, J=5, 11 Гц, 0,5H, NCH), 5,72 (дд, J=5, 11 Гц, 0,5H, NCH), 6,99-7,08 (м, 2Η, Ar), 7,50-7,55 (м, 1H, Ar), 10,92 (с, 0,5H, OH), 11,42 (с, 0,5Η, NH), 11,56 (с, 0,5Η, NH) (наблюдается при 350°К); 13C ЯМР (DMSO-d6) δ 20,90, 21,38, 22,11, 22,41, 30,72, 30,77, 49,74, 50,99, 111,52, 112,15, 113,38, 125,67, 134,26, 134,34, 140,29, 140,63, 141,09, 141,45, 148,77, 149,99, 161,60, 162,39, 170,00, 170,38, 172,74; LCMS: MΗ=288;
Элементный анализ. Вычислено для C14C13N3O4: C 58,53; Н 4,56; N 14,56. Найдено: C 58,40; Н 4,32; N 14,59.
5.6. 3S-3-(2,5-Диметил-4-оксо-4Н-хиназолин-3-ил)-3-метил-пиперидин-2,6-дион
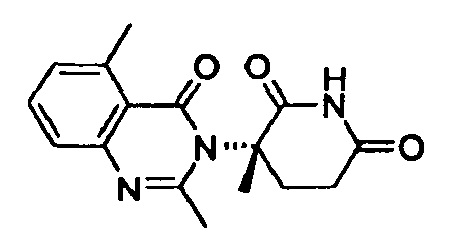
При перемешивании суспензию 2,5-диметилбензо[d][1,3]-оксазин-4-она (1,4 г, 8,1 ммоль), гидробромида 3S-3-амино-3-метилпиперидин-2,6-диона (1,8 г, 8,1 ммоль), имидазола (1,2 г, 18 ммоль) и трифенилфосфита (2,6 г, 9,7 ммоль) в ацетонитриле (50 мл) нагревают на масляной бане с температурой 65°С в течение ночи. Смеси дают охладиться до комнатной температуры. К смеси добавляют целит. Растворитель удаляют в вакууме. Твердое вещество помещают в SIM и очищают колоночной хроматографией ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 100% за 15 минут), получают 3S-3-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)-3-метилпиперидин-2,6-дион в виде белого твердого вещества (220 мг, выход 9%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 3,43 мин (99,4%); т.пл. 187-189°С (разложение).
1H ЯМР (DMSO-d6) δ 1,90 (с, 3H, CH3), 2,36-2,42 (м, 1 Η, CHH), 2,49-2,85 (м, 9Η, 2CH3, 3CΗH), 7,22 (д, J=7 Гц, 1H, Ar), 7,37 (д, J=8 Гц, 1H, Ar), 7,62 (т, J=8 Гц, 1H, Ar), 10,79 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 22,17, 24,42, 26,21, 28,13, 28,95, 62,59, 118,82, 123,96, 128,59, 133,64, 139,48, 147,44, 153,73, 163,77, 171,45, 173,10; LCMS: MH=300;
Элементный анализ. Вычислено для C16C17N3O3: C 64,20; Н 5,72; N 14,04. Найдено: C 64,08; Н 5,58; N 13,86.
5.7. 3R-3-(2,5-Диметил-4-оксо-4Н-хиназолин-3-ил)-3-метил-пиперидин-2,6-дион
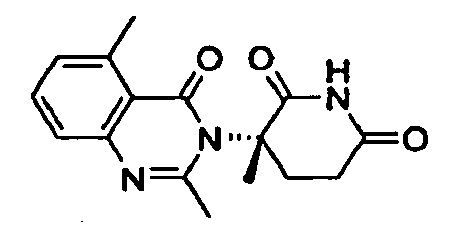
При перемешивании суспензию 2,5-диметилбензо[d][1,3]-оксазин-4-она (1,6 г, 9,0 ммоль), гидробромида 3R-3-амино-3-метилпиперидин-2,6-диона (2,0 г, 9,0 ммоль), имидазола (1,3 г, 20 ммоль) и трифенилфосфита (2,4 г, 9,0 ммоль) в ацетонитриле (50 мл) нагревают на масляной бане с температурой 65°С в течение ночи. Смеси дают охладиться до комнатной температуры. К смеси добавляют целит. Растворитель удаляют в вакууме. Твердое вещество помещают в SIM и очищают колоночной хроматографией ISCO (силикагель, CH3CN/CH2Cl2, 0% с градиентом до 100% за 15 минут), получают 3R-3-(2,5-диметил-4-оксо-4Н-хиназолин-3-ил)-3-метилпиперидин-2,6-дион в виде белого твердого вещества (90 мг, выход 3,4%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% Н3РО4, 6,46 мин (99,4%); т.пл. 298-301°С.
1H ЯМР (DMSO-d6) δ 1,90 (с, 3H, CH3), 2,36-2,42 (м, 1Η, CHH), 2,49-2,85 (м, 9Η, 2CH3, 3CΗH), 7,22 (д, J=7 Гц, 1H, Ar), 7,37 (д, J=8 Гц, 1H, Ar), 7,62 (т, J=8 Гц, 1H, Ar), 10,79 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 22,17, 24,42, 26,21, 28,13, 28,95, 62,59, 118,82, 123,96, 128,59, 133,64, 139,48, 147,44, 153,73, 163,77, 171,45, 173,10; LCMS: MH=300;
Элементный анализ. Вычислено для C16C17N3O3: C 64,20; Н 5,72; N 14,04. Найдено: C 63,81; Н 5,69; N 13,92.
5.8. 3-(5-Метокси-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
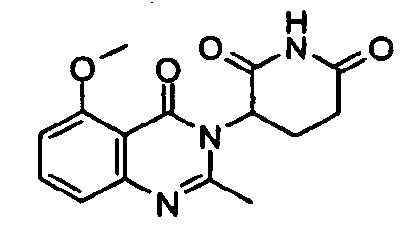
При перемешивании при комнатной температуре к смеси 2-амино-6-метоксибензойной кислоты (2,0 г, 12 ммоль) и имидазола (1,0 г, 14 ммоль) в ацетонитриле (20 мл) добавляют ацетилхлорид (1,0 мл, 14 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гидрохлорид 3-аминопиперидин-2,6-диона (2,0 г, 12 ммоль), имидазол (1,8 г, 26 ммоль) и трифенилфосфит (3,8 мл, 14 ммоль) и кипятят с обратным холодильником 22 часа. К смеси добавляют воду (60 мл). Суспензию фильтруют и промывают водой (2×50 мл), этилацетатом (2×50 мл), гидрокарбонатом натрия (насыщенный раствор, 50 мл) и водой (50 мл), получают 3-(5-метокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,3 г, выход 35%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% Н3РО4, 3,37 мин (99,4%); т.пл. 274-276°С.
1H ЯМР (DMSO-d6) δ 2,09-2,16 (м, 1H, CHH), 2,51-2,63 (м, 5Η, CH3, 2CΗH), 2,72-2,89 (м, 1Η, CΗH), 3,83 (с, 3Η, CH3), 5,14 (дд, J=6, 11 Гц, 1H, NCH), 6,98 (д, J=8 Гц, 1H, Ar), 7,12 (д, J=8 Гц, 1H, Ar), 7,69 (т, J=8 Гц, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,84, 23,36, 30,55, 55,85, 56,16, 107,96, 109,91, 118,26, 134,98, 149,24, 155,30, 158,13, 159,42, 169,63, 172,63; LCMS: MH=302;
Элементный анализ. Вычислено для C15C15N3O4+1,6Н2О: C 54,57; Н 5,56; N 12,73. Найдено: C 54,19; Н 5,42; N 12,55.
5.9. 3-(5-Фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
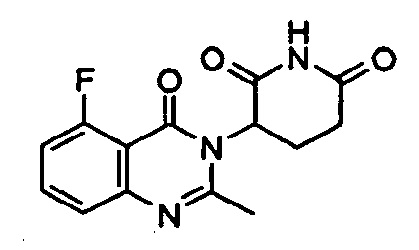
При перемешивании при комнатной температуре к смеси 2-амино-6-фторбензойной кислоты (5,3 г, 34 ммоль) и имидазола (2,8 г, 41 ммоль) в ацетонитриле (60 мл) добавляют ацетилхлорид (2,9 мл, 41 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гидрохлорид 3-аминопиперидин-2,6-диона (6,1 г, 37 ммоль), имидазол (5,1 г, 75 ммоль) и трифенилфосфит (10,6 мл, 41 ммоль) и кипятят с обратным холодильником 22 часа. К смеси добавляют воду (60 мл). Суспензию фильтруют и промывают водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получают белое твердое вещество, которое перемешивают в метаноле (50 мл) в течение ночи. Суспензию промывают метанолом (30 мл) и водой (30 мл), получают 3-(5-фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (7,6 г, выход 78%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 3,8 мин (99,6%); т.пл. 275-277°С.
1H ЯМР (DMSO-d6) δ 2,13-2,20 (м, 1H, CHH), 2,57-2,69 (м, 5Η, CH3, 2CΗH), 2,77-2,90 (м, 1Η, CΗH), 5,25 (дд, J=6, 11 Гц, 1H, NCH), 7,26 (ддд, J=0,6, 8, 11 Гц, 1H, Ar), 7,44 (д, J=8 Гц, 1H, Ar), 7,80 (дт, J=5, 8 Гц 1H, Ar), 11,04 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,73, 23,45, 30,57, 56,45, 109,79 (д, JC-F=6 Гц), 112,89 (д, JC-F=21 Гц), 122,64 (д, JC-F=4 Гц), 135,39 (д, JC-F=11 Гц), 148,86, 156,22, 157,46, 160,15 (д, JC-F=264 Гц), 169,38, 172,57; LCMS: MH=290;
Элементный анализ. Вычислено для C14C12N3O3F: C 58,13; Н 4,18; N 14,53; F 6,57. Найдено: C 57,98; Н 4,00; N 14,45; F 6,73.
5.10. 3-(5-Хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
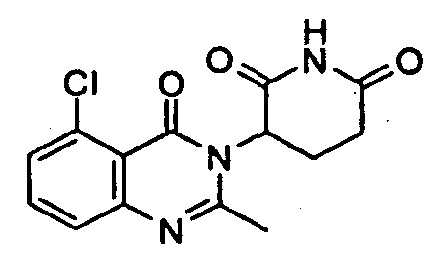
При перемешивании при комнатной температуре к смеси 2-амино-6-хлорбензойной кислоты (2,3 г, 13 ммоль) и имидазола (1,1 г, 16 ммоль) в ацетонитриле (25 мл) добавляют ацетилхлорид (1,1 мл, 16 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гидрохлорид 3-аминопиперидин-2,6-диона (2,2 г, 13 ммоль), имидазол (2,0 г, 30 ммоль) и трифенилфосфит (4,2 мл, 16 ммоль) и кипятят с обратным холодильником 22 часа. К смеси добавляют воду (60 мл). Суспензию фильтруют и промывают водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получают белое твердое вещество, которое очищают препаративной ВЭЖХ (С18 20/80 CH3CN/Н2О), получают 3-(5-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,3 г, выход 31%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% Н3РО4, 4,16 мин (99,9%); т.пл. 315°С (разложение).
1H ЯМР (DMSO-d6) δ 2,13-2,19 (м, 1H, CHH), 2,57-2,68 (м, 5Η, CH3, 2CΗH), 2,78-2,85 (м, 1H, CHH), 5,23 (дд, J=5, 11 Гц, 1H, NCH), 7,51-7,58 (м, 2Η, Ar), 7,74 (т, J=8 Гц, 1H, Ar), 11,03 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,63, 23,48, 30,53, 56,61, 117,14, 126,18, 128,98, 132,24, 134,52, 149,27, 155,99, 158,39, 169,38, 172,56; LCMS: MH=306, 308;
Элементный анализ. Вычислено для C14C12N3O3Cl+1Н2О: C 51,94; Н 4,36; N 12,98; Cl 10,95. Найдено: C 51,91; Н 4,24; N 12,93; Cl 10,20.
5.11. 3-(2-Метил-4-оксо-5-трифторметил-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
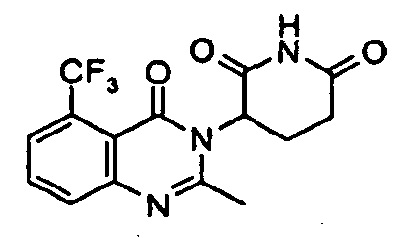
При перемешивании при комнатной температуре к смеси 2-амино-6-(трифторметил)бензойной кислоты (3,0 г, 15 ммоль) и имидазола (1,2 г, 18 ммоль) в ацетонитриле (30 мл) добавляют ацетилхлорид (1,3 мл, 18 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гидрохлорид 3-аминопиперидин-2,6-диона (2,4 г, 15 ммоль), имидазол (2,2 г, 32 ммоль) и трифенилфосфит (4,6 мл, 18 ммоль) и кипятят с обратным холодильником 22 часа. К смеси добавляют воду (100 мл). Суспензию фильтруют и промывают водой (2×50 мл), этилацетатом (2×50 мл), гидрокарбонатом натрия (насыщенный раствор, 50 мл) и водой (50 мл), получают 3-(2-метил-4-оксо-5-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,02 г, выход 51%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% Н3РО4, 4,84 мин (99,9%); т.пл. 268-270°С.
1H ЯМР (DMSO-d6) δ 2,14-2,22 (м, 1H, CHH), 2,55-2,70 (м, 5Η, CH3, 2CΗH), 2,76-2,92 (м, 1Η, CHH), 5,29 (дд, J=6, 11 Гц, 1H, NCH), 7,89-7,98 (м, 3Η, Ar), 11,06 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,45, 23,27, 30,43, 56,74, 117,19, 123,19 (кв., JC-F=273 Гц), 125,75 (кв., JC-F=7 Гц), 126,42 (кв., JC-F=32 Гц), 132,05, 133,97, 149,12, 156,58, 157,59, 169,19, 172,48; LCMS: MH=340;
Элементный анализ. Вычислено для C15C12N3O3F3 +Н2О: C 50,43; Н 3,95; N 11,76; F 15,95. Найдено: C 50,26; Н 3,82; N 11,66; F 15,71.
5.12. 3-(5-Хлор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
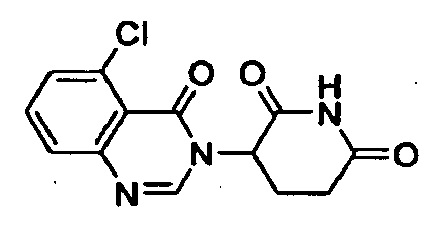
Стадия 1: Смесь 2-амино-6-хлорбензойной кислоты (3,0 г, 17 ммоль) и CDI (2,6 г, 16 ммоль) в ацетонитриле (40 мл) перемешивают при комнатной температуре 1,5 часа. К суспензии добавляют гидрохлорид 3-аминопиперидин-2,6-диона (2,6 г, 16 ммоль) и гидрокарбонат натрия (1,8 г, 21 ммоль) и смесь нагревают при 50°С в течение 21 часа. Суспензию охлаждают до комнатной температуры в течение 1 часа. Суспензию фильтруют и промывают водой (50 мл) и этилацетатом (20 мл). Твердое вещество сушат в вакуумной печи в течение ночи, получают 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-хлорбензамид в виде белого твердого вещества (1,7 г, выход 35%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 5/95 с градиентом до 95/5 в течение 5 минут, CH3CN/0,1% Н3РО4, 4,01 мин.
1H ЯМР (DMSO-d6) δ 1,92-1,98 (м, 1H, CHH), 2,05-2,20 (м, 1Η, CΗH), 2,49-2,57 (м, 1Η, CHH), 2,76-2,88 (м, 1Η, CΗH), 4,67-4,76 (м, 1Η, NCH), 5,61 (с, 2Η, NH2), 6,57 (д, J=8 Гц, 1H, Ar), 6,63 (д, J=8 Гц, 1H, Ar), 7,04 (т; J=8 Гц, 1H, Ar), 8,83 (д, J=8 Гц, 1H, NH), 10,95 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 23,50, 30,96, 49,31, 113,29, 115,51, 120,97, 130,03, 130,19, 147,03, 165,60, 172,92, 172,97; LCMS: MH=282, 284.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-хлорбензамида (0,8 г, 2,8 ммоль) и триметилортоформиата (4 мл) и п-толуолсульфоновой кислоты (280 мг) нагревают до 150°С с помощью микроволновой печи в течение 30 минут. К смеси добавляют метанол (15 мл) и смесь перемешивают 5 минут. Суспензию фильтруют и промывают метанолом, получают 3-(5-хлор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (400 мг, выход 48%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% Н3РО4, 2,35 мин (99,2%); т.пл. 308-310°С.
1H ЯМР (DMSO-d6) δ 2,13-2,19 (м, 1H, CHH), 2,57-2,72 (м, 2H, 2CHH), 2,83-2,89 (м, 1H, CHH), 5,43 (ушир., 1Η, NCH), 7,60 (дд, J=1,8 Гц, 1H, Ar), 7,66 (дд, J =1,8 Гц, 1H, Ar), 7,79 (т, J=8 Гц, 1H, Ar), 8,39 (с, 1H, CH), 11,16 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 22,18, 30,84, 56,16, 118,35, 126,81, 129,74, 132,45, 134,54, 148,18, 149,98, 157,62, 169,68, 172,39; LCMS: MH=292, 294;
Элементный анализ. Вычислено для C13C10N3O3Cl+0,15Н2О: C 53,04; Н 3,53; N 14,27. Найдено: C 52,68; Н 3,14; N 14,17.
5.13. 3-(2-Этил-5-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
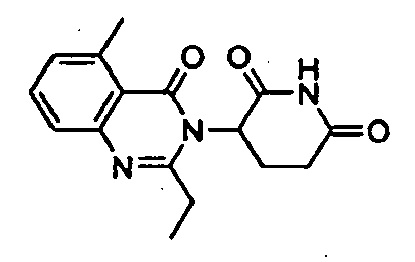
Стадия 1: Смесь 2-амино-6-метилбензойной кислоты (45 г, 297 ммоль) и CDI (45 г, 278 ммоль) в ацетонитриле (500 мл) перемешивают при комнатной температуре 1,5 часа. К суспензии добавляют гидрохлорид 3-аминопиперидин-2,6-диона (45 г, 273 ммоль) и гидрокарбонат натрия (34 г, 409 ммоль) и смесь нагревают при 50°С в течение 21 часа. Суспензию охлаждают до комнатной температуры в течение 1 часа. Суспензию фильтруют. Твердое вещество перемешивают с водой (150 мл) и этилацетатом (150 мл) 3 часа. Суспензию фильтруют и промывают водой (2×50 мл) и этилацетатом (2×50 мл). Твердое вещество сушат в вакуумной печи в течение ночи, получают 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метилбензамид в виде белого твердого вещества (41,3 г, выход 58%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 5/95 с градиентом до 95/5 в течение 5 минут, CH3CN/0,1% Н3РО4, 4,44 мин (91%).
1H ЯМР (DMSO-d6) δ 1,98-2,17 (м, 5H, CH2, CH3) 2,51-2,56 (м, 1Η, CΗH), 2,74-2,86 (м, 1Η, CΗH), 4,68-4,77 (м, 1Η, NCH), 5,18 (с, 2Η, NH2), 6,38 (д, J=7 Гц, 1H, Ar), 6,50 (д, J=7 Гц, 1H, Ar), 6,94 (т; J=7 Гц, 1H, Ar), 8,59 (д, J=8 Гц, 1H, NH), 10,90 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 19,14, 23,75, 30,99, 49,10, 112,37, 17,21, 122,28, 128,96, 134,61, 145,22, 168,36, 172,84, 173,00; LCMS: MH=262.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метилбензамида (0,5 г, 1,9 ммоль) и триэтилортопропионата (0,42 мл, 1 ммоль) в ДМФА (5 мл) нагревают при 150°С в микроволновой печи в течение 1,5 часов. К смеси добавляют воду (30 мл). Смесь охлаждают на водяной бане со льдом. Суспензию фильтруют, получают твердое вещество, которое перемешивают в метаноле (15 мл) в течение ночи. Суспензию фильтруют и промывают метанолом (10 мл) и этилацетатом (10 мл), получают 3-(2-этил-5-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (0,13 г, выход 22%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 с градиентом до 90/10 за 5 минут CH3CN/0,1% Н3РО4, 5,74 мин (98,9%); т.пл. 228-230°С.
1H ЯМР (DMSO-d6) δ 1,27 (т, J=7 Гц, 3H, CH3), 2,07-2,13 (м, 1Η, CΗH), 2,50 (с, 3Η, CH3), 2,51-2,65 (м, 2Η, 2CHH), 2,82-2,92 (м, 3Η, CH2, CΗH), 5,21 (дд, J=6, 11 Гц, 1H, NCH), 7,25 (д, J=8 Гц, 1H, Ar), 7,46 (д, J=8 Гц, 1H, Ar), 7,64 (т, J=8 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 11,18, 21,05, 22,48, 28,02, 35,51, 55,26, 118,64, 125,00, 128,86, 133,70, 139,82, 148,27, 157,69, 161,14, 169,75, 172,63; LCMS: MH=300;
Элементный анализ. Вычислено для C16C17N3O3: C 64,20; Н 5,72; N 14,04. Найдено: C 61,30; Н 5,34; N 13,28.
5.14. 3-(2-Бутил-5-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
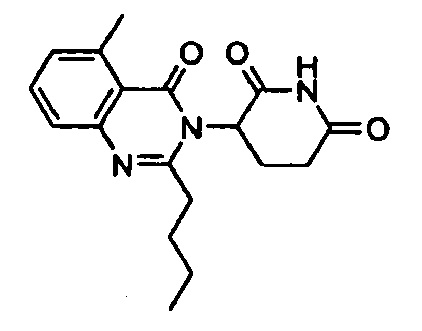
Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-6-метил-бензамида (0,65 г, 2,5 ммоль) и триметилортопентионата (0,66 мл, 3,8 ммоль) и п-толуолсульфоновой кислоты (140 мг) в ДМФА (7 мл) нагревают при 150°С в микроволновой печи в течение 20 минут. Смесь экстрагируют этилацетатом (50 мл) и водой (50 мл). Водный слой экстрагируют этилацетатом (50 мл). Объединенные органические слои промывают водой (50 мл), HCl (1 н., 50 мл) и рассолом (50 мл). Растворитель удаляют в вакууме, получают масло, которое очищают колоночной хроматографией (силикагель, метанол/метиленхлорид с градиентом от 0 до 5%, 5 минут), а затем колоночной хроматографией с обращенным слоем (С-18, ацетонитрил/вода с градиентом от 0 до 100%, 15 минут), получают 3-(2-бутил-5-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион в виде белого твердого вещества (80 мг, выход 10%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 с градиентом до 90/10 за 5 минут CH3CN/0,1% Н3РО4, 6,59 мин (95,4%); т.пл. 190-192°С.
1H ЯМР (DMSO-d6) δ 0,95 (т, J=8 Гц, 3H, CH3), 1,40-1,49 (м, 2Η, CH2), 1,67-1,75 (м, 2Η, CH2), 2,05-2,09 (м, 1Η, CHH), 2,51-2,67 (м, 3Η, CH2, CHH), 2,69 (с, 3Η, CH3), 2,81-2,90 (м, 3Η, CH2, CΗH), 5,20 (дд, J=5, 11 Гц, 1H, NCH), 7,25 (д, J=7 Гц, 1H, Ar), 7,44 (д, J=8 Гц, 1H, Ar), 7,64 (т, J=8 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 13,80, 21,11, 21,72, 22,48, 28,60, 30,50, 34,42, 55,41, 118,63, 124,98, 128,83, 133,70, 139,81, 148,25, 156,95, 161,17, 169,75, 172,65; LCMS: MH=328;
Элементный анализ. Вычислено для C18C21N3O3: C 66,04; Н 6,47; N 12,84. Найдено: C 65,87; Н 6,61; N 12,89.
5.15. 3-(5-Метил-4-оксо-2-трифторметил-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
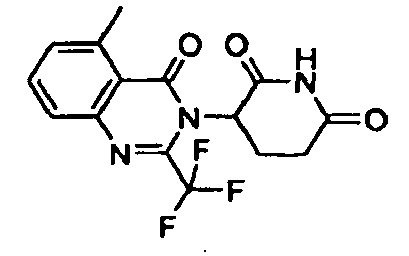
При перемешивании к суспензии 2-амино-N-(2,6-диоксо-пиперидин-3-ил)-6-метилбензамида (1,0 г, 3,8 ммоль) и триэтиламина (1,6 мл, 11,5 ммоль) в ацетонитриле (20 мл) при 0°С добавляют трифторуксусный ангидрид (0,9 мл, 6,4 ммоль). Смесь выдерживают при 0°С в течение 2 часов. Затем смесь нагревают при 50°С в течение 12 часов. К смеси добавляют воду (50 мл). Суспензию фильтруют и промывают водой (50 мл), получают коричневое твердое вещество. Твердое вещество перемешивают в реактивном спирте (10 мл) 3 часа. Суспензию фильтруют и промывают реактивным спиртом (10 мл), получают 3-(5-метил-4-оксо-2-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде почти белого твердого вещества (200 г, выход 15%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% Н3РО4, 6,39 мин (98,1%); т.пл. 308-310°С.
1H ЯМР (DMSO-d6) δ 2,06-2,12 (м, 1H, CHH), 2,51-2,75 (м, 2Η, 2CHH), 2,75 (с, 3Η, CH3), 2,89-2,99 (м, 1Η, CΗH), 5,12 (дд, J=6, 11 Гц, 1H, NCH), 7,53 (д, J=8 Гц, 1H, Ar), 7,69 (д, J=8 Гц, 1H, Ar), 7,83 (т, J=8 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 21,28, 22,37, 30,23, 56,37, 117,8 (кв., JC-F=277 Гц), 120,05, 126,43, 132,22, 134,76, 140,67, 141,31 (кв., JC-F=35 Гц), 145,57, 160,44, 168,84, 172,46; LCMS: MH=340;
Элементный анализ. Вычислено для C15C12N3O3F3: C 53,10; Н 3,57; N 12,39. Найдено: C 52,92; Н 3,49; N 12,14.
5.16. 3-(5-Метил-4-оксо-2-фенил-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
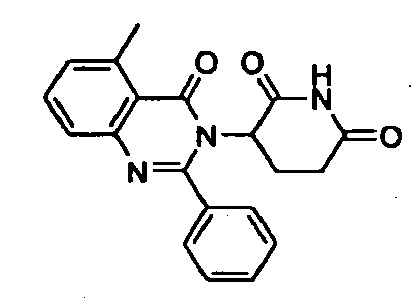
Стадия 1: Смесь 2-амино-6-метилбензойной кислоты (1,0 г, 6,6 ммоль) и бензойного ангидрида (3,3 г, 15 ммоль) в ацетонитриле (15 мл) кипятят с обратным холодильником 17 часов. Раствору дают остыть до комнатной температуры. Суспензию фильтруют, получают смесь 5-метил-2-фенилбензо-[d][1,3]оксазин-4-она и бензойной кислоты (1:0,4, 1,0 г). Твердое вещество используют на следующей стадии без дополнительной очистки.
Стадия 2: При перемешивании суспензию твердого вещества (1,0 г) со стадии 1, гидрохлорида 3-аминопиперидин-2,6-диона (0,71 г, 4,3 ммоль) и трифенилфосфита (1,3 мл, 5,1 ммоль) в пиридине (10 мл) кипятят с обратным холодильником 20 часов. К смеси добавляют целит (1 чайную ложку) и растворитель удаляют в вакууме. Полученное твердое вещество помещают в SIM и очищают колоночной хроматографией ISCO (силикагель, CH3CN/CH2Cl2, градиент от 5 до 100% за 15 минут). Пробирки, содержащие продукт, объединяют. Растворитель удаляют в вакууме, получают твердое вещество, которое перемешивают с реактивным спиртом (30 мл) в течение ночи. Суспензию фильтруют, получают 3-(5-метил-4-оксо-2-фенил-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (404 мг, выход 27%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% Н3РО4, 6,24 мин (100%); т.пл. 298-300°С.
1H ЯМР (DMSO-d6) δ 2,02-2,09 (м, 1H, CHH), 2,42-2,73 (м, 3Η, CH2, CΗH), 2,76 (с, 3Η, CH3), 4,81 (дд, J=6, 11 Гц, 1H, NCH), 7,34 (д, J=7 Гц, 1H, Ar), 7,51-7,64 (м, 6H, Ar), 7,71 (т, J=7 Гц, 1H, Ar), 10,94 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 21,14, 22,53, 30,25, 57,76, 118,95, 125,47, 127,76, 128,83, 128,58, 130,05, 134,06, 134,84, 140,07, 148,11, 155,92, 151,17, 159,69, 172,40; LCMS: MH=348;
Элементный анализ. Вычислено для C20C17N3O3: C 69,15; Н 4,93; N 12,10. Найдено: C 68,76; Н 4,81; N 12,14.
5.17. 3-(5-Амино-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
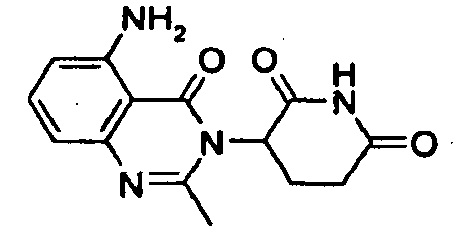
Стадия 1: К раствору гидроксида калия (16,1 г, 286 ммоль) в воде (500 мл) в одну порцию при 0°С добавляют 3-нитро-фталимид (25,0 г, 130 ммоль). Суспензию перемешивают при 0°С в течение 3 часов и затем нагревают при 30°С в течение 3 часов. К раствору добавляют HCl (100 мл, 6 н.). Полученную суспензию охлаждают до 0°С в течение 1 часа. Суспензию фильтруют и промывают холодной водой (2×10 мл), получают 3-нитро-фталаминовую кислоту в виде белого твердого вещества (24,6 г, выход 90%).
1H ЯМР (DMSO-d5) δ 7,69 (ушир.с, 1H, NHH), 7,74 (т, J=8 Гц, 1H, Ar), 7,92 (дд, J=1, 8 Гц, 1H, Ar), 8,13 (дд, J=1, 8 Гц, 1H, Ar), 8,15 (ушир.с, 1H, NHH), 13,59 (с, 1Η, OH); 13C ЯМР (DMSO-d6) δ 125,33, 129,15, 130,25, 132,54, 136,72, 147,03, 165,90, 167,31.
Стадия 2: К смеси 3-нитрофталаминовой кислоты (24,6 г, 117 ммоль) и гидроксида калия (6,56, 117 ммоль) в воде (118 мл) добавляют смесь брома (6 мл), гидроксида калия (13,2 г, 234 ммоль) в воде (240 мл) при 0°С, затем добавляют раствор гидроксида калия (19,8 г, 351 ммоль) в воде (350 мл). После выдерживания 5 минут при 0°С смесь нагревают на масляной бане с температурой 100°С в течение 1 часа. Реакционный раствор охлаждают до комнатной температуры и затем на водяной бане со льдом в течение 30 минут. К смеси по каплям при 0°С добавляют раствор HCl (240 мл, 2н.) и полученную смесь выдерживают 1 час. Суспензию фильтруют и промывают водой (5 мл), получают 2-амино-6-нитробензойную кислоту в виде желтого твердого вещества (15,6 г, выход 73%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, CH3CN/0,1% Н3РО4, с градиентом от 5 до 95% в течение 5 минут, 5,83 мин (85%).
1H ЯМР (DMSO-d6) δ 6,90 (дд, J=1, 8 J Гц, 1H, Ar), 7,01 (дд, J=1, 9 Гц, 1H, Ar), 7,31 (т, J=8 Гц, 1H, Ar), 8,5-9,5 (ушир.с, 3H, OH, NH2); 13C ЯМР (DMSO-d6) δ 105,58, 110,14, 120,07, 131,74, 149,80, 151,36, 166,30; LCMS: MH=183.
Стадия 3: Смесь 2-амино-6-нитробензойной кислоты (1,5 г, 8,2 ммоль) в уксусном ангидриде (15 мл) нагревают при 200°С в течение 30 минут в микроволновой печи. Смесь фильтруют и промывают этилацетатом (20 мл). Фильтрат концентрируют в вакууме. Твердое вещество перемешивают в эфире (20 мл) 2 часа. Суспензию фильтруют и промывают эфиром (20 мл), получают 2-метил-5-нитробензо[d][1,3]оксазин-4-он в виде светло-коричневого твердого вещества (1,4 г, выход 85%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, CH3CN/0,1% Н3РО4, с градиентом от 5 до 95% в течение 5 минут, 5,36 мин (92%).
1H ЯМР (DMSO-d6) δ 2,42 (с, 3H, CH3), 7,79 (дд, J=1, 8 Гц, 1H, Ar), 7,93 (дд, J=1, 8 Гц, 1H, Ar), 8,06 (т, J=8 Гц, 1H, Ar); 13C ЯМР (DMSO-d6) δ 20,87, 107,79, 121,54, 128,87, 137,19, 147,12, 148,46, 155,18, 161,78; LCMS: MH=207.
Стадия 4: Два пузырька, каждый с суспензией 5-нитро-2-метилбензо[d][1,3]оксазин-4-она (0,60 г, 2,91 ммоль) и гидрохлорида 3-аминопиперидин-2,6-диона (0,48 г, 2,91 ммоль) в пиридине (15 мл), нагревают в микроволновой печи при 170°С в течение 10 минут. Суспензию фильтруют и промывают пиридином (5 мл). Фильтрат концентрируют в вакууме. Полученную смесь перемешивают в HCl (30 мл, 1 н.), этилацетате (15 мл) и эфире (15 мл) в течение 2 часов. Суспензию фильтруют и промывают водой (30 мл) и этилацетатом (30 мл), получают темно-коричневое твердое вещество, которое перемешивают с метанолом (50 мл) при комнатной температуре в течение ночи. Суспензию фильтруют и промывают метанолом, получают 3-(2-метил-5-нитро-4-оксо-4Н-хиналозин-3-ил)пиперидин-2,6-дион в виде черного твердого вещества (490 мг, выход 27%). Твердое вещество используют на следующей стадии без дополнительной очистки.
Стадия 5: Смесь 3-(2-метил-5-нитро-4-оксо-4Н-хиналозин-3-ил)пиперидин-2,6-диона (250 мг) и Pd(ОН)2 на угле (110 мг) в ДМФА (40 мл) встряхивают в атмосфере водорода (50 фунт/кв.дюйм, 3,52 кг/см2) в течение 12 часов. Суспензию фильтруют через слой целита и промывают ДМФА (10 мл). Фильтрат концентрируют в вакууме и полученное масло очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид), получают 3-(5-амино-2-метил-4-оксо-4Н-хиналозин-3-ил)-пиперидин-2,6-дион в виде белого твердого вещества (156 мг, выход 69%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, 3,52 мин (99,9%); т.пл. 293-295°С.
1H ЯМР (DMSO-d6) δ 2,10-2,17 (м, 1H, CHH), 2,53 (с, 3Η, CH3), 2,59-2,69 (м, 2Η, CH2), 2,76-2,89 (м, 1Η, CΗH), 5,14 (дд, J=6, 11 Гц, 1H, NCH), 6,56 (д, J=8 Гц, 1H, Ar), 6,59 (д, J=8 Гц, 1H, Ar), 7,02 (с, 2H, NH2), 7,36 (т, J=8 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,98, 23,14, 30,52, 55,92, 104,15, 110,48, 111,37, 134,92, 148,17, 150,55, 153,62, 162,59, 169,65, 172,57; LCMS: MH=287;
Элементный анализ. Вычислено для C14C14N4O3+0,3Н2О: C 57,65; Н 5,05; N 19,21. Найдено: C 57,50; Н 4,73; N 19,00.
5.18. (S)-3-(5-Амино-2-метил-4-оксохиназолин-3(4Н)-ил)-3-метилпиперидин-2,6-дион
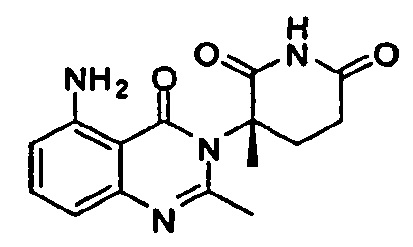
Стадия 1: Смесь 2-метил-5-нитро-4Н-бензо[d][1,3]оксазин-4-она (2,0 г, 9,7 ммоль), гидробромида (S)-3-амино-3-метил-пиперидин-2,6-диона (2,2 г, 9,7 ммоль), имидазола (1,5 г, 21 ммоль) и трифенилфосфита (3,7 г, 12 ммоль) в ДМФА (20 мл) перемешивают в атмосфере азота при 45°С в течение 40 часов. Смесь упаривают, остаток хроматографируют на силикагеле с использованием градиента дихлорметан/ацетонитрил. Продукт элюирует при 15% ацетонитрила, получают (S)-3-метил-3-(2-метил-5-нитро-4-оксохиназолин-3(4Н)-ил)пиперидин-2,6-дион в виде желтого твердого вещества (0,70 г, выход 22%).
1H ЯМР (DMSO-d6) δ 1,94 (с, 3H, CH3), 2,35-2,40 (м, 1Η, CHH), 2,45-2,59 (м, 2Η, 2CHH), 2,71-2,83 (м, 4Η, CH3, CΗH), 7,75-7,82 (м, 2Η, Ar), 7,95 (дд, J=8, 8 Гц, 1H, Ar), 10,86 (с, 1H, NH).
Стадия 2: Смесь (S)-3-метил-3-(2-метил-5-нитро-4-оксо-хиназолин-3(4Н)-ил)пиперидин-2,6-диона (0,30 г, 1,0 ммоль) и 10% Pd-C (0,2 г, 50%, влажный) в 200 мл смеси этилацетат/метанол, 3:1) встряхивают в атмосфере Н2 при 50 фунт/кв.дюйм (3,52 кг/см2) в течение 45 минут. Смесь фильтруют через целит и растворитель упаривают. Остаток повторно растворяют в 200 мл смеси дихлорметан/ацетон, 4:1, и добавляют диоксид марганца (0,20 г, 2,2 ммоль). Полученную смесь перемешивают 16 часов. Смесь фильтруют через целит, фильтрат упаривают. Остаток хроматографируют на силикагеле с использованием градиента дихлорметан/ацетонитрил, элюируют (S)-3-(5-амино-2-метил-4-оксохиназолин-3(4Н)-ил)-3-метил-пиперидин-2,6-дион в виде бежевого твердого вещества (0,10 г, выход 37%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 1,63 мин (99,20%); т.пл. 297-299°С.
1H ЯМР (DMSO-d6) δ 1,88 (с, 3H, CH3), 2,31-2,36 (м, 1H, CHH), 2,53-2,59 (м, 2H, 2CHH), 2,62 (с, 3Η, CH3), 2,71-2,84 (м, 1Η, CΗH), 6,53-6,56 (м, 2Η, Ar), 6,95 (ушир., 2H, NH2), 7,35 (т, J=8 Гц, 1H, Ar), 10,72 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 24,5, 26,3, 28,3, 29,0, 62,2, 104,2, 110,5, 110,8, 135,0, 147,4, 150,4, 152,9, 164,9, 171,5, 173,0;
Элементный анализ. Вычислено для C15C16N4O3: C 59,99; Н 5,37; N 18,66. Найдено: C 59,61; Н 5,43; N 18,59.
5.19. (R)-3-(5-Амино-2-метил-4-оксохиназолин-3(4Н)-ил)-3-метилпиперидин-2,6-дион
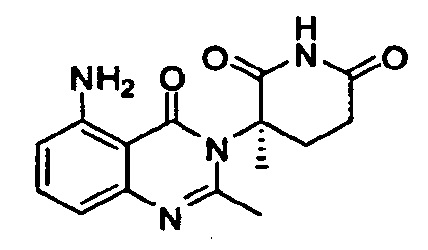
Стадия 1: Смесь 2-метил-5-нитро-4Н-бензо[d][1,3]оксазин-4-она (2,0 г, 9,7 ммоль), гидробромида (R)-3-амино-3-метил-пиперидин-2,6-диона (2,2 г, 9,7 ммоль), имидазола (1,5 г, 21 ммоль) и трифенилфосфита (3,7 г, 12 ммоль) в ДМФА (20 мл) перемешивают в атмосфере азота при 45°С в течение 40 часов. Смесь упаривают, остаток хроматографируют на силикагеле с использованием градиента дихлорметан/ацетонитрил. Продукт элюирует при 60% ацетонитрила, получают (R)-3-метил-3-(2-метил-5-нитро-4-оксохиназолин-3(4Н)-ил)пиперидин-2,6-дион в виде желтого твердого вещества (0,60 г, выход 19%).
1H ЯМР (DMSO-d6) δ 1,94 (с, 3H, CH3), 2,35-2,40 (м, 1Η, CΗH), 2,45-2,59 (м, 2Η, 2CHH), 2,71-2,83 (м, 4Η, CH3, CΗH), 7,75-7,82 (м, 2Η, Ar), 7,95 (дд, J=8, 8 Гц, 1H, Ar), 10,86 (с, 1H, NH).
Стадия 2: Смесь (R)-3-метил-3-(2-метил-5-нитро-4-оксо-хиназолин-3(4Н)-ил)пиперидин-2,6-диона (0,40 г, 1,2 ммоль) и 10% Pd-C (0,2 г, 50%, влажный) в 200 мл смеси этилацетат/метанол, 3:1) встряхивают в атмосфере Н2 при 50 фунт/кв.дюйм (3,52 кг/см2) в течение 3 часов. Смесь фильтруют через целит, растворитель упаривают. Остаток хроматографируют на силикагеле с использованием градиента дихлорметан/ацетонитрил, получают (R)-3-(5-амино-2-метил-4-оксохиназолин-3(4Н)-ил)-3-метил-пиперидин-2,6-дион в виде почти белого твердого вещества (0,16 г, выход 44%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 1,62 мин (98,71%); т.пл. 295-297°С.
1H ЯМР (DMSO-d6) δ 1,88 (с, 3H, CH3), 2,31-2,36 (м, 1Η, CΗH), 2,53-2,59 (м, 2H, 2CHH), 2,62 (с, 3Η, CH3), 2,71-2,84 (м, 1Η, CΗH), 6,53-6,56 (м, 2Η, Ar), 6,95 (ушир., 2H, NH2), 7,35 (т, J=8 Гц, 1H, Ar), 10,72 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 24,5, 26,3, 28,3, 29,0, 62,2, 104,2, 110,5, 110,8, 135,0, 147,4, 150,4, 152,9, 164,9, 171,5, 173,0;
Элементный анализ. Вычислено для C15C16N4O3: C 59,99; Н 5,37; N 18,66. Найдено: C 59,73; Н 5,26; N 18,69.
5.20. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]-2-метоксиацетамид
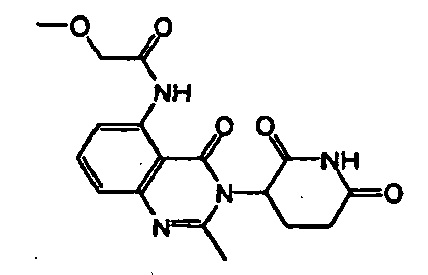
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,11 г, 0,35 ммоль) в тетрагидрофуране (4 мл) добавляют метоксиацетилхлорид (0,06 мл, 0,70 ммоль) и нагревают при 80°С в течение одного часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидро-хиназолин-5-ил]-2-метоксиацетамид (44 мг, выход 35%) в виде белого твердого вещества.
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 6,77 мин (96,3%); т.пл. 282-284°С.
1H ЯМР (DMSO-d6) δ 2,20-2,22 (м, 1H, CHH), 2,60-2,85 (м, 6Η, CHCH2, CH3), 3,40 (с, 3Η, °CH3), 4,04 (с, 2Η, °CH2), 5,30 (дд, J=6, 11 Гц, 1H, CH), 7,30-8,64 (м, 3Η, Ar), 11,09 (с, 1H, NH), 12,31 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,77, 23,31, 30,62, 56,71, 59,04, 71,88, 107,95, 115,39, 120,94, 135,51, 138,89, 147,90, 154,84, 162,69, 169,12, 169,34, 172,64. LCMS: MH=359;
Элементный анализ. Вычислено для C17C18N4O5+0,7Н2О; C 55,04; Н 5,27; N 15,10. Найдено: C 54,75; Н 5,32; N 14,91.
5.21. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид
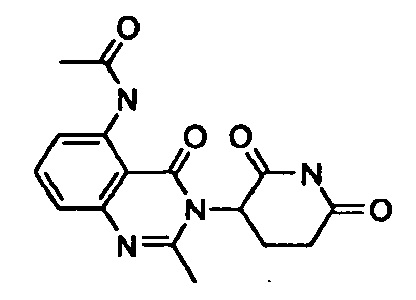
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,45 г, 1,5 ммоль) в тетрагидрофуране (10 мл) добавляют ацетилхлорид (0,63 мл, 8,8 ммоль) и нагревают при 80°С в течение одного часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]-ацетамид (80 мг, выход 16%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 5,15 мин (98,6%); т.пл. 320-322°С.
1H ЯМР (DMSO-d6) δ 2,16 (с, 3H, CH3), 2,18-2,24 (м, 1H, CHH), 2,59-2,90 (м, 6Η, CHCH2, CH3), 5,32 (дд, J=6, 11 Гц, 1H, CH), 7,28-8,54 (м, 3Η, Ar), 11,08 (с, 1H, NH), 11,70 (с, 1Η; NH); 13C ЯМР (DMSO-d6) δ 20,65, 23,35, 25,29, 30,57, 56,71, 107,39, 115,09, 120,38, 135,63, 139,84, 147,84, 154,71, 163,01, 168,67, 169,29, 172,60. LCMS: MH=329;
Элементный анализ. Вычислено для C16C16N4O4+2,2Н2О; C 52,23; Н 5,59; N 15,23. Найдено: C 52,20; Н 5,57; N 15,21.
5.22. 2-Циклопропил-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид
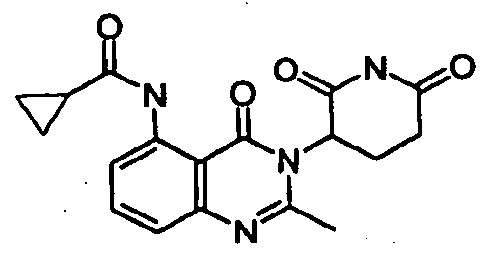
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,41 г, 1,3 ммоль) в тетрагидрофуране (8 мл) добавляют циклопропанкарбонилхлорид (0,24 мл, 2,7 ммоль) и нагревают при 80°С в течение 1 часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 2-цикло-пропил-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид в виде белого твердого вещества (110 мг, выход 23%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% Н3РО4, 2,78 мин (98,2%); т.пл. 239-241°С.
1H ЯМР (DMSO-d6) δ 0,87 (д, J=5 Гц, 4H, CH2CH2), 1,70-1,75 (кв., J=6 Гц, 1H, CH), 2,20-2,25 (м, 1Η, CHH), 2,59-2,88 (м, 5Η, CH2, CH3), 5,33 (дд, J=6, 12 Гц, 1H, CH), 7,26-8,52 (м, 3Η, Ar), 11,10 (с, 1H, NH), 12,03 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 7,88, 7,99, 16,26, 20,68, 23,34, 30,56, 56,73, 115,24, 120,29, 135,64, 139,80, 147,85, 154,72, 163,14, 169,34, 171,92, 172,60. LCMS: MH=355;
Элементный анализ. Вычислено для C18C18N4O4+1,7Н2О; C 56,16; Н 5,60; N 14,55. Найдено: C 55,90; Н 5,50; N 14,31.
5.23. [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]амид гептановой кислоты
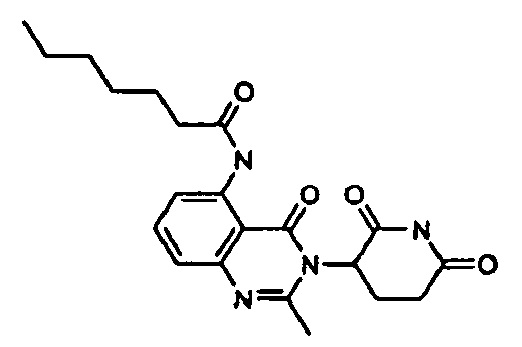
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,6 ммоль) в тетрагидрофуране (10 мл) добавляют гептаноилхлорид (0,88 мл, 5,7 ммоль) и нагревают при 80°С в течение двух часов. Смесь гасят несколькими каплями метанола. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]амид гептановой кислоты в виде белого твердого вещества (120 мг, выход 18%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 7,12 мин (95,5%); т.пл. 230-232°С.
1H ЯМР (DMSO-d6) δ 0,86 (т, J=7 Гц, 3H, CH3), 1,24-1,36 (м, 6H, 3CH2), 1,56-1,65 (м, 2Η, CH2), 2,18-2,23 (м, 1Η, CΗH), 2,40 (т, J=7 Гц, 2H, CH2), 2,59-2,88 (м, 6H, CHCH2, CH3), 5,32 (дд, J=6, 11 Гц, 1H, CH), 7,26-8,55 (м, 3Η, Ar), 11,09 (с, 1H, NH), 11,74 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 13,87, 20,65, 21,89, 23,35, 24,66, 28,05, 30,60, 30,95, 37,64, 56,73, 107,43, 115,12, 120,32, 135,63, 139,85, 147,86, 154,71, 163,07, 169,28, 171,51, 172,57. LCMS: MH=399;
Элементный анализ. Вычислено для C21C26N4O4+0,3Н2О; C 62,45; Н 6,64; N 13,87. Найдено: C 62,28; Н 6,66; N 13,61.
5.24. N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]-2-этоксиацетамид
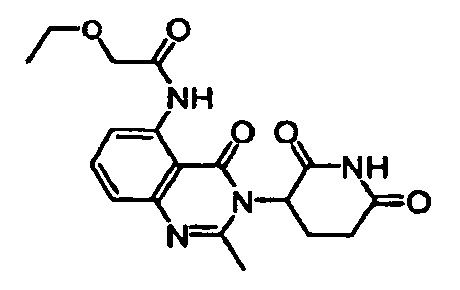
При перемешивании к раствору этоксиуксусной кислоты (0,39 г, 4,2 ммоль), оксалилхлорида (0,34 мл, 3,9 ммоль) в диэтиловом эфире (3 мл) добавляют ДМФА (0,02 мл). Смесь перемешивают при комнатной температуре два часа, после чего добавляют 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион (0,60 г, 2,0 ммоль) и тетрагидрофуран (20 мл). Смесь кипятят с обратным холодильником в течение ночи и затем охлаждают и гасят метанолом (~5 мл). Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидро-хиназолин-5-ил]-2-этоксиацетамид в виде белого твердого вещества (90 мг, выход 12%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 5,75 мин (99,6%); т.пл. 291-293°С.
1H ЯМР (DMSO-d6) δ 1,23 (т, J=6 Гц, 3H, CH2CH3), 2,18-2,25 (м, 1Η, CΗH), 2,58-2,92 (м, 6Η, CHCH2, CH3), 3,57 (кв., J=7 Гц, 2H, CH2CH3), 4,01-4,12 (дд, J=16 Гц, 2H, CH2O), 5,30 (дд, J=6, 11 Гц, 1H, CH), 7,30-8,64 (м, 3Η, Ar), 11,07 (с, 1H, NH), 12,52 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 14,61, 20,81, 23,25, 30,52, 56,64, 67,05, 70,09, 107,95, 115,13, 120,83, 135,55, 138,97, 147,90, 154,80, 162,61, 169,38, 169,54, 172,51. LCMS: MH=373;
Элементный анализ. Вычислено для C18C20N4O5; C 58,06; Н 5,41; N 15,05. Найдено: C 57,83; Н 5,37; N 14,92.
5.25. Гидрохлорид 2-диметиламино-N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]-ацетамида
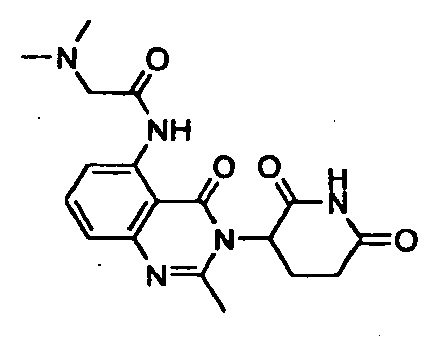
При перемешивании к суспензии 2-хлор-N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]-ацетамида (0,75 г, 2,1 ммоль) в ДМФА (3 мл) добавляют диметиламин в ТГФ (3,6 мл, 2 н., 7,2 ммоль) при комнатной температуре. Через 2 дня к смеси добавляют гидрокарбонат натрия (насыщенный раствор, 10 мл) и воду (10 мл). Через 1 час суспензию фильтруют и промывают водой (5 мл), получают белое твердое вещество. К суспензии описанного выше твердого вещества в метиленхлориде (20 мл) при перемешивании при комнатной температуре добавляют HCl в эфире (2 мл, 2 н., 4 ммоль). Через 18 часов суспензию фильтруют и промывают метиленхлоридом (2×20 мл), получают гидрохлорид 2-диметил-амино-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамида в виде белого твердого вещества (0,72 г, выход 85%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, 2,50 мин (62,2%) и 2,71 (37,7%); т.пл. 256-258°С.
1H ЯМР (DMSO-d6) δ 2,21-2,28 (м, 1H, CHH), 2,61-2,70 (м, 2Η, 2CHH), 2,73 (с, 3H, CH3), 2,88 (с, 6H, 2CH3), 2,93-3,00 (м, 1Η, CΗH), 4,40 (д, J=4 Гц, 2H, CH2), 5,44 (дд, J=6, 11 Гц, 1H, NCH), 7,45 (дд, J=1, 8 Гц, 1H, Ar), 7,88 (т, J=8 Гц, 1H, Ar), 8,46 (дд, J=1, 8 Гц, 1H, Ar), 10,48 (ушир.с, 1H, HCl), 11,11 (с, 1H, NH), 11,50 (ушир.с, 1Η, ΗCl), 11,86 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,57, 23,04, 30,52, 43,16, 56,83, 58,16, 107,98, 116,49, 120,95, 135,94, 138,34, 146,82, 155,92, 162,45 163,75, 169,02, 172,63; LCMS: MH=372;
Элементный анализ. Вычислено для C18C21N5O4+1,8HCl+0,5Н2О; C 48,47; Н 5,38; N 15,70; Cl 14,31. Найдено: C 48,34; Н 5,03; N 15,39; Cl 14,03.
5.26. 2-Хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид
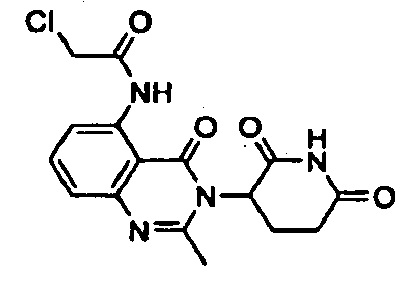
При перемешивании смесь 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (4,0 г, 14 ммоль) и хлор-ацетилхлорида (7,7 мл, 98 ммоль) нагревают на масляной бане при температуре 100°С в течение 15 минут. Смеси дают остыть до комнатной температуры. К смеси добавляют ацетонитрил (5 мл). Суспензию фильтруют и промывают этилацетатом (2×10 мл), получают белое твердое вещество. Твердое вещество перемешивают в метаноле (50 мл) в течение ночи. Суспензию фильтруют и промывают метанолом (20 мл), получают 2-хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид в виде белого твердого вещества (4,5 г, выход 90%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% Н3РО4, 12,79 мин (97,6%); т.пл. 275-277°С.
1H ЯМР (DMSO-d6) δ 2,18-2,25 (м, 1H, CHH), 2,61-2,80 (м, 5Η, CH3, 2CΗH), 2,86-2,91 (м, 1Η, CHH), 4,48-4,53 (м, 2Η, CH2), 5,36 (дд, J=6, 11 Гц, 1H, NCH), 7,39 (дд, J=1, 8 Гц, 1H, Ar), 7,83 (т, J=8 Гц, 1H, Ar), 8,57 (дд, J=1, 8 Гц, 1H, Ar), 10,7 (ушир.с, 1H, HCl), 11,11 (с, 1H, NH), 12,26 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,66, 23,10, 30,60, 43,56, 56,84, 107,89, 115,65, 120,87, 135,77, 138,87, 147,17, 155,49, 162,67, 165,55, 169,14, 172,60; LCMS: MH=363, 365;
Элементный анализ. Вычислено для C16C15N4O4Cl+1,05HCl; C 47,92; Н 4,03; N 13,97; Cl 18,12. Найдено: C 48,24; Н 3,79; N 13,84; Cl 18,27.
5.27. Этиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]карбаминовой кислоты
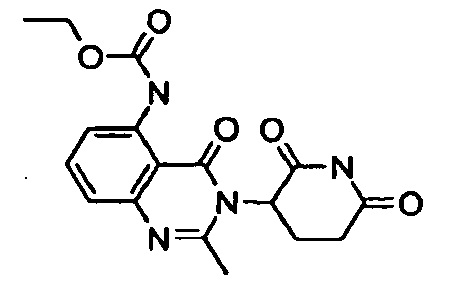
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,41 г, 1,3 ммоль) в тетрагидрофуране (10 мл) добавляют этилхлорформиат (0,45 мл, 4,7 ммоль) и нагревают при 80°С три часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают этиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидро-хиназолин-5-ил]карбаминовой кислоты в виде белого твердого вещества (130 мг, выход 27%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 6,26 мин (99,2%); т.пл. 284-286°С (разложение).
1H ЯМР (DMSO-d6) δ, 1,26 (т, J=7 Гц, 3H, CH2CH3), 2,15-2,19 (м, 1Η, CHH), 2,58-2,90 (м, 6Η, CHCH2, CH3), 4,16 (кв., J=7 Гц, 2H, CH2CH3), 5,31 (дд, J=6, 11 Гц, 1H, CH), 7,23-8,24 (м, 3Η, Ar), 11,08 (с, 1H, NH), 11,30 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 14,28, 20,72, 23,28, 30,53, 56,70, 60,99, 107,14, 113,36, 119,59, 135,73, 140,00, 147,95, 152,66, 154,73, 169,31, 172,54. LCMS: MH=359;
Элементный анализ. Вычислено для C17C18N4O5+0,8Н2О; C 54,78; Н 5,30; N 15,03. Найдено: C 54,67; Н 4,99; N 14,80.
5.28. трет.-Бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]карбаминовой кислоты
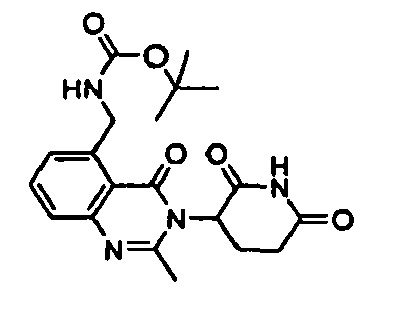
Стадия 1: Смесь метилового эфира 2-метил-6-нитробензойной кислоты (99 г, 508 ммоль), 1,3-дибром-5,5-диметилгидантоина (DBH) (80 г, 279 ммоль) в метилацетате (600 мл) нагревают при 78°С в течение 40 минут, перемешивая механической мешалкой. Затем добавляют раствор 2,2’-азобисизобутиронитрила (AIBN) (4,2 г, 25 ммоль) в метилацетате (80 мл) и нагревают при 75°С в течение 11 часов. Смеси дают остыть до 15°С и перемешивают 2 часа для вызревания осадка. Суспензию фильтруют, промывают метилацетатом с температурой 10°С (2×50 мл), получают коричневый фильтрат. К фильтрату добавляют гептан (500 мл). Раствор промывают 2%-ным рассолом (2×500 мл) и водой (2×500 мл). Органический слой концентрируют приблизительно на 2 объема, добавляют трет.-бутилметиловый эфир (300 мл), нагревают при 70°С в течение 15 минут, охлаждают раствор до 53°С один час, осаждают продукт (приблизительно 250 мг) при 45°С, затем при 20-25°С, продувая азот с помощью газовой пипетки в течение ночи. Полученную суспензию фильтруют через воронку со средними порами, промывают предварительно охлажденной до 10°С смесью гептан/MTBE (1/2 об./об.) и сушат с отсасыванием в вытяжном шкафу в течение ночи, получают метиловый эфир 2-бром-метил-6-нитробензойной кислоты в виде почти белого твердого вещества (49 г, выход 35%). Твердое вещество используют на следующей стадии без дополнительной очистки.
Стадия 2: При перемешивании смесь метилового эфира 2-бромметил-6-нитробензойной кислоты (36,6 г, 134 ммоль), ди-трет.-бутилиминодикарбоксилата (29,1 г, 134 ммоль) карбоната цезия (89,3 г, 274 ммоль) и йодида лития (0,89 г, 6,7 ммоль) в 2-бутаноне (400 мл) кипятят с обратным холодильником на масляной бане с температурой 100°С в течение 12 часов, перемешивая с помощью механической мешалки. Смеси дают остыть до комнатной температуры. К смеси добавляют рассол (300 мл), воду (300 мл), этилацетат (750 мл) и перемешивают 10 минут, затем суспензию фильтруют через слой целита. Два слоя разделяют, органический слой упаривают до меньшего объема, и водный слой экстрагируют этилацетатом (2×150 мл). Объединенные органические слои промывают рассолом (500 мл), сушат над сульфатом магния при одновременном обесцвечивании с помощью угля при комнатной температуре 30 минут. Черную смесь фильтруют через слой целита. Фильтрат упаривают, получают метиловый эфир 2-(ди-трет.-бутоксикарбониламинометил)-6-нитро-бензойной кислоты в виде коричневого масла (51,53 г, выход 94%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 3: При перемешивании к коричневому раствору метилового эфира 2-(ди-трет.-бутоксикарбониламинометил)-6-нитробензойной кислоты (51,53 г, 126 ммоль) в метиленхлориде (600 мл) добавляют трифторуксусную кислоту (18,2 мл, 245 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. К раствору добавляют насыщенный раствор бикарбоната натрия (400 мл), и смесь перемешивают 10 минут. Органический слой отделяют, сушат над сульфатом магния и упаривают, получают метиловый эфир 2-(трет.-бутоксикарбонил-аминометил)-6-нитробензойной кислоты в виде коричневого масла (41,4 г, выход 106% сырого продукта). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 4: Смесь метилового эфира 2-(трет.-бутокси-карбониламинометил)-6-нитробензойной кислоты (38,96 г, 126 ммоль) и гидроксида лития (3,61 г, 151 ммоль) в метаноле (450 мл) и воде (225 мл) перемешивают с помощью механической мешалки при комнатной температуре в течение ночи. Метанол упаривают и к водному раствору добавляют 1 н. HCl (200 мл) с образованием осадка. Добавляют эфир (300 мл) и смесь перемешивают при 0°С в течение 2 часов. Суспензию фильтруют, промывают водой (100 мл) и эфиром (100 мл) и сушат с отсасыванием в вытяжном шкафу в течение ночи, получают 2-(трет.-бутоксикарбониламинометил)-6-нитробензойную кислоту в виде желтого твердого вещества (22,4 г, выход 60%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 5: Смесь 2-(трет.-бутоксикарбониламинометил)-6-нитробензойной кислоты (2,19 г, 75 ммоль) в метаноле (530 мл) и палладия-на-угле (0,2 г) гидрируют в аппарате Парра в течение ночи при давлении 51 фунт/кв.дюйм (3,59 кг/см2). Черную смесь фильтруют через слой целита и фильтрат упаривают, получают вспененное коричневое масло, которое перемешивают в эфире (300 мл) в течение ночи. Суспензию фильтруют, получают 2-амино-6-(трет.-бутоксикарбониламинометил)бензойную кислоту в виде желтого твердого вещества (13,0 г, выход 65%). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 6: При перемешивании к раствору 2-амино-6-(трет.-бутоксикарбониламинометил)бензойной кислоты (13,0 г, 48,8 ммоль), имидазола (3,99 г, 58,6 ммоль) в ацетонитриле (160 мл) добавляют ацетилхлорид (4,18 мл, 58,6 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гидрохлорид 3-аминопиперидин-2,6-диона (8,03 г, 48,8 ммоль), имидазол (6,65 г, 97,6 ммоль) и трифенилфосфит (15,4 мл, 58,6 ммоль) и смесь кипятят с обратным холодильником 6 часов. Смесь охлаждают до комнатной температуры и добавляют воду (500 мл). Суспензию фильтруют, промывают водой (50 мл), этилацетатом (20 мл), эфиром (50 мл) и сушат с отсасыванием, получают трет.-бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]карбаминовой кислоты в виде коричневого твердого вещества (10,5 г, выход 54%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% Н3РО4, 5,50 мин (98,5%); т.пл. 206-208°С.
1H ЯМР (DMSO-d6) δ 1,40 (с, 9H, 3CH3), 2,15-2,20 (м, 1H, CHH), 2,55-2,68 (м, 5Η, CH3, 2CΗH), 2,79-2,86 (м, 1Η, CΗH), 4,63-4367 (м, 2Η, CH2), 5,22 (дд, J=6, 11 Гц, 1H, NCH), 7,20 (т, J=6 Гц, 1H, NH), 7,32 (д, J=8, Гц, 1H, Ar), 7,48 (д, J=8 Гц, 1H, Ar), 7,76 (т, J=8 Гц, 1H, Ar), 11,02 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,79, 23,27, 28,19, 30,57, 42,82, 56,47, 77,91, 117,53, 123,86, 125,33, 133,92, 141,76, 148,44, 154,76, 155,67, 161,01, 169,51, 172,59; LCMS: MH=401;
Элементный анализ. Вычислено для C20C24N4O5+0,5Н2О; C 58,67; Н 6,15; N 13,68. Найдено: C 58,45; Н 5,88; N 13,34.
5.29. 3-(5-Аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-дион
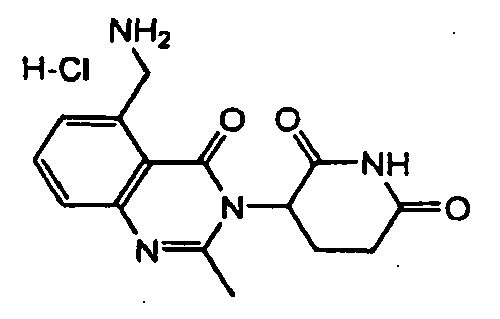
Стадия 1: При перемешивании к коричневому раствору трет.-бутилового эфира [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]карбаминовой кислоты (10,4 г, 25,9 ммоль) в метаноле (108 мл) и метиленхлориде (108 мл) добавляют 2М HCl в эфире (304 мл) и смесь перемешивают в течение ночи. Растворитель упаривают, остаток перемешивают в эфире (200 мл) 2 часа. Суспензию фильтруют, получают гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиналозин-3-ил)-пиперидин-2,6-диона в виде светло-желтого твердого вещества (8,9 г, выход 102% сырого продукта). Продукт используют на следующей стадии без дополнительной очистки.
Стадия 2: Гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиналозин-3-ил)пиперидин-2,6-диона (1,0 г) перемешивают в изопропаноле (10 мл) в течение ночи и суспензию фильтруют. Полученное твердое вещество дополнительно перемешивают в метаноле (10 мл) в течение ночи и суспензию фильтруют. Твердое вещество растворяют в чистой воде (60 мл) и раствор промывают этилацетатом (2×100 мл). Водный слой упаривают, получают гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиналозин-3-ил)-пиперидин-2,6-диона в виде почти белого твердого вещества (0,35 г, выход 35%).
ВЭЖХ: Waters Xterra RP 18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, Waters LC Module 1, 05/95 CH3CN/0,1% (НСО2)NH4, 8,04 мин (99,9%); т.пл. 256°С (разложение).
1H ЯМР (DMSO-d6) δ 2,14-2,20 (м, 1H, CHH), 2,58-2,92 (м, 6H, CHCH2, CH3), 4,25-4,32 (м, 1Η, NΗCHΗ), 4,58-4,64 (м, 1Η, NΗCHΗ), 5,33 (дд, J=6, 11 Гц, 1H, CH), 7,53-7,89 (м, 3Η, Ar), 8,31 (ушир.с, 3H, ClNH3), 11,06 (с, 1H, NH); 13C ЯМР (DMSO-d6) δ 20,58, 23,15, 30,508, 41,38, 56,64, 118,38, 127,51, 129,25, 134,20, 134,33, 147,86, 155,63, 160,86, 169,26, 172,59. LCMS: MH=301;
Элементный анализ. Вычислено для C15C17N4O3Cl+0,5Н2О+0,55HCl; C 49,25; Н 5,11; N 15,31; Cl 15,02. Найдено: C 49,23; Н 5,00; N 15,24; Cl 14,97.
5.30. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид
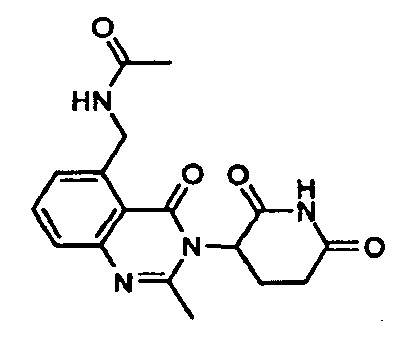
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиналозин-3-ил)пиперидин-2,6-диона (0,65 г, 1,9 ммоль) в ацетонитриле (10 мл) добавляют ацетилхлорид (0,13 мл, 1,8 ммоль) и N,N-диизопропилэтиламин (0,70 мл, 4,3 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид в виде светло-желтого твердого вещества (104 мг, выход 16%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 3,93 мин (99,0%); т.пл. 293-291°С.
1H ЯМР (DMSO-d6) δ 1,92 (с, 3H, CH3), 2,14-2,20 (м, 1Η, CHΗ), 2,57-2,86 (м, 6Η, CHCH2, CH3), 4,73-4,77 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 7,31-7,76 (м, 3Η, Ar), 8,22 (т, J=6 Гц, 1H, CH2NH); 13C ЯМР (DMSO-d6) δ 20,78, 22,60, 23,26, 30,58, 41,49, 56,48, 117,65, 124,48, 125,42, 133,83, 141,06, 148,44, 154,75, 160,95, 169,32, 169,51, 172,58. LCMS: MH=343;
Элементный анализ. Вычислено для C17C18N4O4; C 59,64; Н 5,30; N 16,37. Найдено: C 59,46; Н 5,05; N 16,24.
5.31. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бутирамид
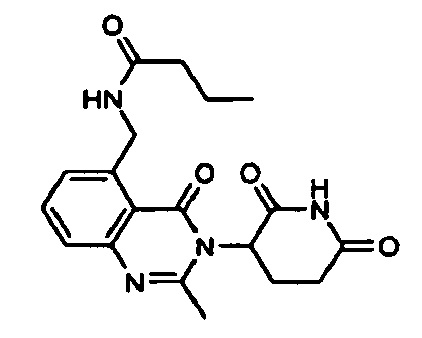
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,53 г, 1,6 ммоль) в ацетонитриле (10 мл) добавляют бутирилхлорид (0,25 мл, 2,4 ммоль) и N,N-диизопропилэтиламин (0,65 мл, 3,9 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бутирамид в виде светло-желтого твердого вещества (270 мг, выход 46%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 5,18 мин (98,6%); т.пл. 250-252°С.
1H ЯМР (DMSO-d6) δ 0,88 (т, J=7 Гц, 3H, CH3), 1,56 (м, J=7 Гц, 2H, CH2CH2CH3), 2,15-2,20 (м, 3H, CH2, CHΗ), 2,57-2,89 (м, 6Η, CHCH2, CH3), 4,77-4,85 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 7,30-7,76 (м, 3Η, Ar), 8,18 (т, J=5 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 13,65, 18,67, 20,77, 23,27, 30,58, 37,32, 41,39, 56,47, 117,63, 124,28, 125,38, 133,83, 141,23, 148,44, 154,76, 160,95, 169,51, 172,14, 172,60. LCMS: MH=371;
Элементный анализ. Вычислено для C19C22N4O4; C 61,61; Н 5,99; N 15,13. Найдено: C 61,49; Н 5,76; N 15,00.
5.32. [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]амид гептановой кислоты
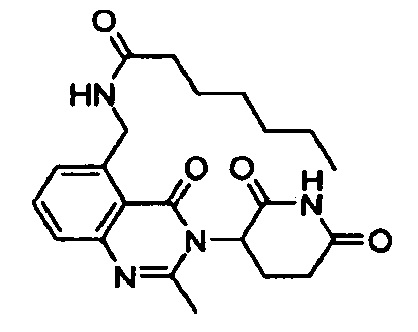
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляют гептаноилхлорид (0,34 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,60 мл, 3,7 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]амид гептановой кислоты в виде светло-желтого твердого вещества (280 мг, выход 47%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 6,10 мин (97,8%); т.пл. 208-210°С.
1H ЯМР (DMSO-d6) δ, 0,86 (т, J=6 Гц, 3H, CH3), 1,25-2,21 (м, 11Η, CH2CH2CH2CH2CH2, CH?), 2,57-2,89 (м, 6Η, CHCH2, CH3), 4,68-4,84 (м, 2Η, CH2NH), 5,23 (дд, J=6, 12 Гц, 1H, CH), 7,29-7,75 (м, 3Η, Ar), 8,18 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 13,87, 20,77, 21,98, 23,27, 25,22, 28,31, 30,59, 31,96, 35,37, 38,68, 38,96, 39,23, 39,51, 39,79, 40,07, 40,35, 41,39, 56,47, 117,63, 124,30, 125,39, 133,78, 141,23, 148,44, 154,75, 160,95, 169,51, 172,29, 172,59. LCMS: MH=413;
Элементный анализ. Вычислено для C22C28N4O4; C 64,06; Н 6,84; N 13,58. Найдено: C 64,05; Н 6,80; N 13,58.
5.33. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3,3-диметилбутирамид
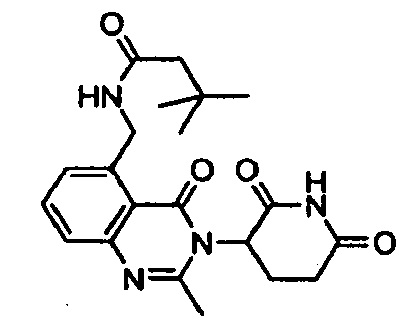
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляют трет.-бутилацетил-хлорид (0,31 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,60 мл, 3,7 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3,3-диметилбутирамид в виде светло-желтого твердого вещества (120 мг, выход 22%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 5,74 мин (97,8%); т.пл. 212-214°С.
1H ЯМР (DMSO-d6) δ 0,96 (с, 9H, 3CH3), 2,08 (с, 2Η, CH2Me3), 2,12-2,19 (м, 1Η, CHΗ), 2,57-2,86 (м, 6Η, CHCH2, CH3), 4,68-4,85 (м, 2Η, CH2NH), 5,24 (дд, J=6, 11 Гц, 1H, CH), 7,34-7,76 (м, 3Η, Ar), 8,11 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,76, 23,28, 29,69, 30,47, 30,58, 41,43, 48,76, 56,47, 117,65, 124,64, 125,42, 133,77, 141,19, 148,42, 154,75, 160,93, 169,51, 170,97, 172,60. LCMS: MH=399;
Элементный анализ. Вычислено для C21C26N4O4+0,1Н2О; C 63,02; Н 6,60; N 14,00. Найдено: C 62,86; Н 6,70; N 13,92.
5.34. [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]амид циклопропанкарбоновой кислоты
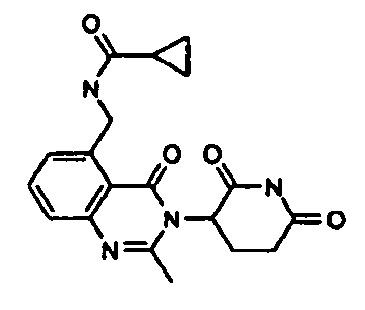
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,53 г, 1,6 ммоль) в ацетонитриле (10 мл) добавляют хлорангидрид циклопропанкарбоновой кислоты (0,16 мл, 1,7 ммоль) и N,N-диизопропилэтиламин (0,59 мл, 3,6 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают [3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]амид циклопентанкарбоновой кислоты в виде почти белого твердого вещества (310 мг, выход 54%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут, 5,50 мин (98,6%); т.пл. разложение при 298°С.
1H ЯМР (DMSO-d6) δ 0,67-0,70 (м, 4H, цикло-CH2CH2), 1,65-1,73 (м, 1Η, цикло-CH), 2,11-2,20 (м, 1Η, CHΗ), 2,57-2,89 (м, 6Η, CHCH2, CH3), 4,77-4,87 (м, 2Η, CH2NH), 5,23 (дд, J=6, 12 Гц, 1H, CH), 7,31-7,78 (м, 3Η, Ar), 8,44 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 6,28, 13,57, 20,76, 23,28, 30,58, 41,53, 56,47, 117,65, 124,50, 125,44, 133,89, 141,14, 148,44, 154,77, 160,94, 169,53, 172,60, 172,73. LCMS: MH=369;
Элементный анализ. Вычислено для C19C20N4O4+0,1Н2О; C 61,65; Н 5,50; N 15,13. Найдено: C 61,48; Н 5,47; N 14,97.
5.35. 2-Диметиламино-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид
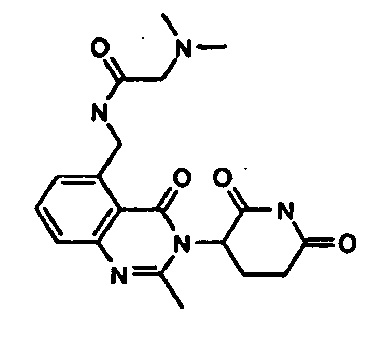
При перемешивании к раствору диметиламиноуксусной кислоты (0,27 г, 1,9 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,35 г, 2,1 ммоль) и перемешивают один час. Затем добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,65 г, 1,9 ммоль) и перемешивают 15 минут. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 2-диметиламино-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид в виде светло-желтого твердого вещества (340 мг, выход 46%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 05/95 CH3CN/0,1% Н3РО4, 7,29 мин (99,8%); т.пл. 275°С (разложение).
1H ЯМР (DMSO-d6) δ 2,16-2,19 (м, 7H, CHH и NMe2), 2,63-2,91 (м, 8H, CHCH2, CH3 и NCH2), 4,74-4,76 (м, 2Η, CH2NH), 5,25 (дд, J=6, 12 Гц, 1H, CH), 7,31-7,76 (м, 3Η, Ar), 8,26 (т, J=6 Гц, 1H, CH2NH), 11,03 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,68, 23,31, 30,59, 41,62, 45,54, 56,51, 62,81, 117,69, 125,53, 125,74, 133,96, 140,54, 148,52, 154,82, 161,03, 169,42, 169,63, 172,63. LCMS: MH=386;
Элементный анализ. Вычислено для C19C23N5O4; C 59,21; Н 6,01; N 18,17. Найдено: C 58,95; Н 6,05; N 17,79.
5.36. 3-Хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]бензамид
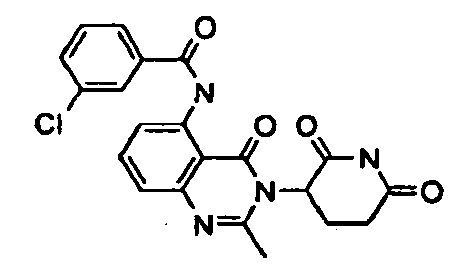
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,46 г, 1,5 ммоль) в тетрагидрофуране (10 мл) добавляют 3-хлорбензоилхлорид (0,68 мл, 5,3 ммоль) и нагревают при 80°C три часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 3-хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид в виде белого твердого вещества (300 мг, выход 46%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 7,04 мин (98,2%); т.пл. 326-328°С.
1H ЯМР (DMSO-d6) δ 2,18-2,28 (м, 1H, CHH), 2,61-2,92 (м, 6Η, CHCH2, CH3), 5,36 (дд, J=6, 11 Гц, 1H, CH), 7,37-8,70 (м, 7Η, Ar), 11,12 (с, 1H, NH), 12,72 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,39, 30,66, 40,41, 56,90, 115,69, 121,28, 125,21, 127,12, 131,13, 132,14, 135,78, 163,46, 169,30, 172,59, 172,62. LCMS: MH=425, 427;
Элементный анализ. Вычислено для C21C17N4O4Cl+0,3Н2О: C 58,62; Н 4,12; N 13,02; Cl 8,24. Найдено: C 58,46; Н 3,74; N 12,70; Cl 7,98.
5.37. 2-Бензилокси-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил]ацетамид
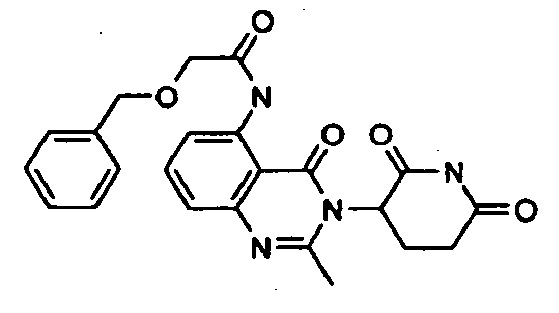
При перемешивании к смеси 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,42 г, 1,4 ммоль) в тетрагидрофуране (10 мл) добавляют бензилоксиацетилхлорид (0,75 мл, 4,8 ммоль) и нагревают при 80°C три часа. Смесь гасят несколькими каплями метанола. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 2-бензилокси-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидро-хиназолин-5-ил]ацетамид в виде белого твердого вещества (280 мг, выход 47%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,46 мин (99,2%); т.пл. 272-274°С.
1H ЯМР (DMSO-d6) δ 2,17-2,22 (м, 1H, CHH), 2,65-2,93 (м, 6Η, CHCH2, CH3), 4,13-4,30 (дд, J=15, 36 Гц, 2H, CH2), 4,64 (с, 2H, CH2), 5,33 (дд, J=5, 11 Гц, 1H, CH), 7,25-8,68 (м, 8Η, Ar), 11,10 (с, 1H, NH), 12,48 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,62, 23,38, 30,83, 56,93, 70,17, 72,80, 107,95, 115,38, 120,97, 127,47, 127,53, 128,13, 135,52, 137,33, 138,95, 147,90, 154,90, 162,73, 168,94, 169,28, 172,51, 172,62. LCMS: MH=435;
Элементный анализ. Вычислено для C23C22N4O5+0,6Н2О: C 62,04; Н 5,25; N 12,58. Найдено: C 61,82; Н 4,90; N 12,49.
5.38. N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-фенилацетамид
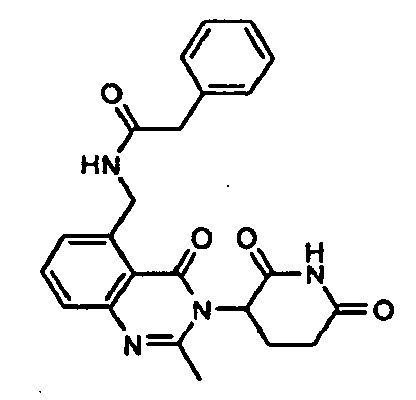
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,51 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляют фенилацетилхлорид (0,22 мл, 1,7 ммоль) и добавляют N,N-диизопропилэтиламин (0,57 мл, 3,5 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-фенилацетамид в виде светло-желтого твердого вещества (254 мг, выход 40%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 5,70 мин (98,5%); т.пл. 275-277°С.
1H ЯМР (DMSO-d6) δ 2,11-2,18 (м, 1H, CHH), 2,58-2,86 (м, 6H, CHCH2, CH3), 3,53 (с, 2Η, CH2), 4,74-4,78 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 7,21-7,71 (м, 8Η, Ar), 8,35 (т, J=6 Гц, 1H, CH2NH), 11,01 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,27, 30,58, 41,69, 42,41, 56,48, 117,69, 124,70, 125,56, 126,34, 128,20, 129,03, 133,80, 136,30, 140,74, 148,44, 154,79, 160,91, 169,48, 170,23, 172,58. LCMS: MH=419;
Элементный анализ. Вычислено для C23C22N4O4+0,2Н2О: C 65,45; Н 5,35; N 13,27. Найдено: C 65,32; Н 5,04; N 13,10.
5.39. [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]амид пиридин-2-карбоновой кислоты
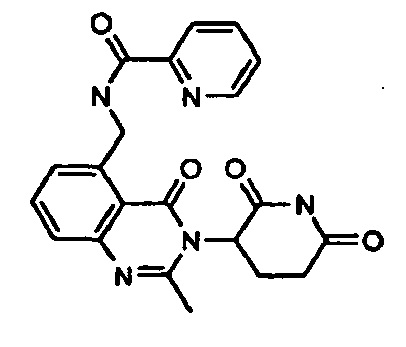
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,55 г, 1,6 ммоль) в ацетонитриле (10 мл) добавляют гидрохлорид пиколиноилхлорида (0,32 г, 1,8 ммоль) и добавляют N,N-диизопропилэтиламин (0,62 мл, 3,8 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают [3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]амид пиридин-2-карбоновой кислоты в виде почти белого твердого вещества (67 мг, выход 10%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,85 мин (99,4%); т.пл. 261-263°С.
1H ЯМР (DMSO-d6) δ 2,08-2,27 (м, 1H, CHH), 2,64-2,93 (м, 6H, CHCH2, CH3), 4,91-5,05 (м, 2Η, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 7,33-8,69 (м, 7Η, Ar), 9,32 (т, J=6 Гц, 1H, CH2NH), 11,06 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,73, 23,31, 30,62, 42,12, 56,57, 117,72, 121,86, 125,18, 125,76, 126,60, 134,05, 137,82, 140,30, 148,55, 149,77, 154,87, 161,17, 163,79, 169,47, 172,65. LCMS: MH=406;
Элементный анализ. Вычислено для C21C19N5O4+0,5Н2О: C 60,86; Н 4,86; N 16,90. Найдено: C 60,72; Н 4,62; N 16,69.
5.40. 2-(4-Хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид
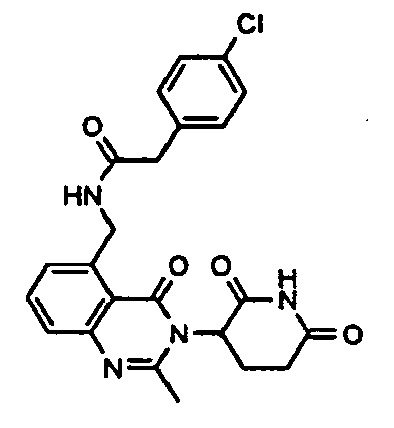
При перемешивании к раствору (4-хлорфенил)уксусной кислоты (0,31 г, 1,8 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,33 г, 2,0 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,62 г, 1,8 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 2-(4-хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид в виде почти белого твердого вещества (580 мг, выход 70%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,10 мин (98,5%); т.пл. 285°С (разложение).
1H ЯМР (DMSO-d6) δ 2,14-2,19 (м, 1H, CHH), 2,57-2,86 (м, 6H, CHCH2, CH3), 3,54 (с, 2Η, ArCH2), 4,74-4,78 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 7,26-7,72 (м, 7Η, Ar), 8,39 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,28, 30,59, 41,49, 41,72, 56,48, 117,68, 124,72, 125,59, 128,13, 130,92, 131,08, 133,82, 135,32, 140,64, 148,44, 154,80, 160,90, 169,50, 169,88, 172,59. LCMS: MH=453, 455;
Элементный анализ. Вычислено для C23C21N4O4Cl+0,15Н2О+0,06 CH2Cl2: C 60,12; Н 4,69; N 12,16; Cl 8,62. Найдено: C 59,78; Н 4,60; N 12,22; Cl 9,00.
5.41. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-трифторметоксифенил)ацетамид
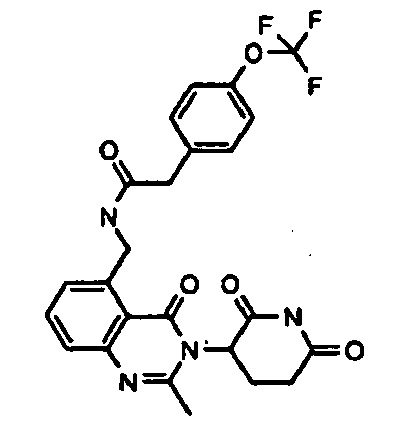
При перемешивании к раствору (4-хлорфенил)уксусной кислоты (0,35 г, 1,6 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,29 г, 1,8 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,54 г, 1,6 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-трифторметокси-фенил)ацетамид в виде белого твердого вещества (600 мг, выход 74%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,46 мин (99,1%); т.пл. 217-219°С.
1H ЯМР (DMSO-d6) δ 2,14-2,19 (м, 1H, CHH), 2,57-2,89 (м, 6H, CHCH2, CH3), 3,58 (с, 2Η, ArCH2), 4,69-4,85 (м, 2Η, CH2NH), 5,24 (дд, J=6, 11 Гц, 1H, CH), 7,26-7,71 (м, 7Η, Ar), 8,44 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,27, 30,58, 41,42, 41,70, 56,48, 117,69, 120,79, 124,67, 125,59, 130,89, 133,78, 135,86, 140,65, 147,00, 148,44, 154,81, 160,91, 169,50, 169,88, 172,59. LCMS: MH=503;
Элементный анализ. Вычислено для C24C21N4O5F3: C 57,37; Н 4,21; N 11,15; F 11,34. Найдено: C 57,10; Н 3,97; N 10,97; F 11,14.
5.42. 2-(3,4-Дихлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]ацетамид
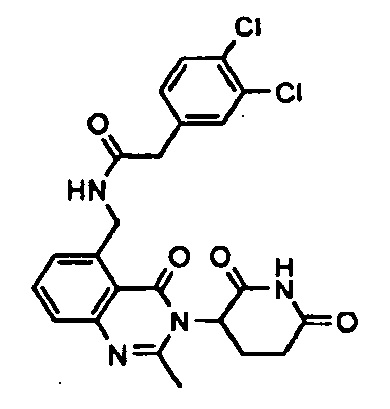
При перемешивании к раствору (3,4-дихлорфенил)уксусной кислоты (0,30 г, 1,5 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,26 г, 1,6 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,50 г, 1,5 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 2-(3,4-дихлорфенил)-N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]ацетамид в виде желтого твердого вещества (540 мг, выход 74%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,41 мин (98,4%); т.пл. 262-264°С.
1H ЯМР (DMSO-d6) δ, 2,14-2,19 (м, 1H, CHH), 2,57-2,89 (м, 6H, CHCH2, CH3), 3,57 (с, 2Η, ArCH2), 4,69-4,85 (м, 2Η, CH2NH), 5,24 (дд, J=6, 11 Гц, 1H, CH), 7,26-7,73 (м, 6Η, Ar), 8,42 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,73, 23,28, 30,60, 40,98, 41,76, 56,49, 117,70, 124,84, 125,65, 129,06, 129,55, 130,27, 130,63, 131,11, 133,82, 137,43, 140,52, 148,46, 154,81, 160,90, 169,42, 169,49, 172,59. LCMS: MH=487, 489;
Элементный анализ. Вычислено для C23C20N4O4Cl2: C 56,69; Н 4,14; N 11,50; Cl 14,55. Найдено: C 56,50; Н 3,95; N 11,25; Cl 14,29.
5.43. N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-фторфенил)ацетамид
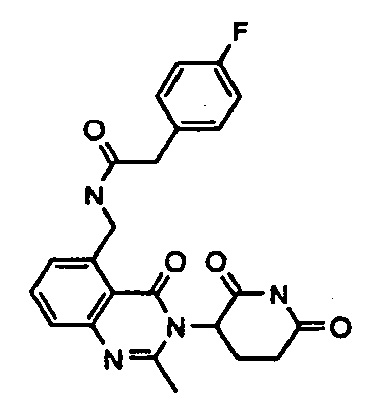
При перемешивании к раствору (4-фторфенил)уксусной кислоты (0,23 г, 1,5 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,26 г, 1,6 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,49 г, 1,5 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-фторфенил)ацетамид в виде белого твердого вещества (480 мг, выход 76%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 5,83 мин (99,2%); т.пл. разлагается при 290°С.
1H ЯМР (DMSO-d6) δ 2,12-2,19 (м, 1H, CHH), 2,57-2,91 (м, 6H, CHCH2, CH3), 3,53 (с, 2Η, ArCH2), 4,68-4,83 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 7,09-7,72 (м, 7H, Ar), 8,36 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,28, 30,58, 41,36, 41,70, 56,48, 114,89 (д, JC-F=21 Гц), 117,69, 124,72, 125,58, 130,86 (д, JC-F=7 Гц), 132,45 (д, JC-F=3 Гц), 133,82, 140,68, 148,44, 154,80, 160,91, 161,00 (д, JC-F=242 Гц), 169,50, 170,15, 172,59. LCMS: MH=437;
Элементный анализ. Вычислено для C23C21N4O4F: C 63,30; Н 4,85; N 12,84; F 4,35. Найдено: C 63,25; Н 4,66; N 12,73; F 4,21.
5.44. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(3-фтор-4-метилфенил)ацетамид
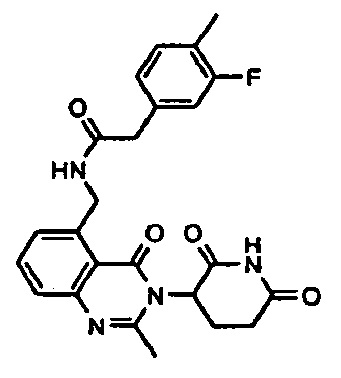
При перемешивании к раствору (3-фтор-4-метилфенил)уксусной кислоты (0,25 г, 1,5 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,27 г, 1,6 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,50 г, 1,5 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(3-фтор-4-метилфенил)ацетамид в виде желтого твердого вещества (500 мг, выход 74%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,10 мин (99,3%); т.пл. 264-266°С.
1H ЯМР (DMSO-d6) δ 2,15-2,20 (м, 4H, CHH и CH3Ar), 2,57-2,91 (м, 6Η, CHCH2, CH3), 3,51 (с, 2Η, ArCH2), 4,73-4,78 (м, 2Η, CH2NH), 5,23 (дд, J=6, 11 Гц, 1H, CH), 6,99-7,72 (м, 6Η, Ar), 8,34 (т, J=6 Гц, 1H, CH2NH), 11,01 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 13,76 (д, JC-F=3 Гц), 20,73, 23,27, 30,59, 41,60, 41,72, 56,48, 115,43 (д, JC-F=22 Гц), 117,69, 121,98 (д, JC-F=17 Гц), 124,82 (д, JC-F=7 Гц), 124,83, 125,59, 131,23 (д, JC-F=5 Гц), 133,80, 136,12 (д, JC-F=8 Гц), 140,64, 148,44, 154,80, 160,38 (д, JC-F=242 Гц), 160,91, 169,49, 169,90, 172,58. LCMS: MH=451;
Элементный анализ. Вычислено для C24C23N4O4F: C 63,99; Н 5,15; N 12,44; F 4,22. Найдено: C 63,61; Н 5,19; N 12,33; F 4,20.
5.45. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-трифторметилфенил)ацетамид
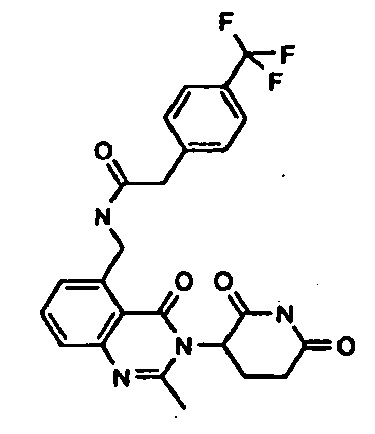
При перемешивании к раствору (4-трифторметилфенил)уксусной кислоты (0,26 г, 1,3 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,22 г, 1,4 ммоль) и перемешивают один час. К смеси добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,42 г, 1,3 ммоль) и смесь перемешивают 15 минут. Растворитель упаривают и остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-2-(4-трифторметилфенил)ацетамид в виде почти белого твердого вещества (450 мг, выход 74%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,36 мин (99,1%); т.пл. 199-201°С.
1H ЯМР (DMSO-d6) δ 2,14-2,19 (м, 1H, CHH), 2,57-2,87 (м, 6H, CHCH2, CH3), 3,66 (с, 2Η, ArCH2), 4,75-4,86 (м, 2Η, CH2NH), 5,24 (дд, J=6, 11 Гц, 1H, CH), 7,27-7,72 (м, 7Η, Ar), 8,48 (т, J=6 Гц, 1H, CH2NH), 11,02 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,74, 23,28, 30,58, 41,75, 41,93, 56,48, 117,69, 124,72, 125,01 (д, Jc-F=4 Гц), 125,01 (д, JC-F=10 Гц), 125,61, 129,91, 133,82, 140,58, 141,19, 148,45, 154,81, 160,90, 169,50, 169,54, 172,59. LCMS: MH=487;
Элементный анализ. Вычислено для C24C21N4O4F3: C 57,76; Н 4,52; N 11,23; F 11,42. Найдено: C 57,38; Н 4,49; N 11,07; F 11,64.
5.46. 1-(4-Хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]мочевина
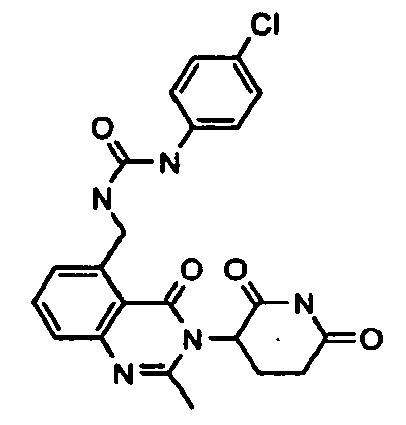
При перемешивании к суспензии гидрохлорида 3-(5-амино-метил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,44 г, 1,3 ммоль) и триэтиламина (0,25 мл, 1,8 ммоль) в ТГФ (8 мл) при 5-10°С добавляют 4-хлорфенилизоцианат (0,21 мл, 1,7 ммоль) и перемешивают десять минут. Затем смесь перемешивают при комнатной температуре в течение ночи. Смесь гасят метанолом (~1 мл) и растворитель упаривают. Остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 1-(4-хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидро-хиназолин-5-илметил]мочевину в виде желтого твердого вещества (390 мг, выход 66%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,34 мин (98,7%); т.пл. 255-257°С.
1H ЯМР (DMSO-d6) δ 2,17-2,23 (м, 1H, CHH), 2,59-2,94 (м, 6H, CHCH2, CH3), 4,72 (д, J=6 Гц, 2H, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 6,65 (т, J=5 Гц, 1H, CH2NH), 7,21-7,78 (м, 7Η, Ar), 8,92 (с, 1H, NH), 11,04 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,70, 23,31, 30,62, 42,30, 56,51, 117,81, 119,02, 124,42, 125,77, 126,21, 128,42, 133,99, 139,47, 141,32, 148,50, 154,76, 154,88, 161,02, 169,49, 172,65. LCMS: MH=454, 456;
Элементный анализ. Вычислено для C22C20N5O4Cl: C 58,22; Н 4,44; N 15,43; Cl 7,81. Найдено: C 58,11; Н 4,24; N 15,16; Cl 7,80.
5.47. 1-(3-Хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]мочевина
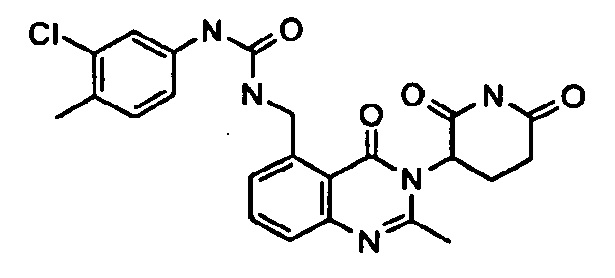
При перемешивании к суспензии гидрохлорида 3-(5-амино-метил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,51 г, 1,5 ммоль) и триэтиламина (0,30 мл, 2,1 ммоль) в ТГФ (15 мл) при 5-10°С добавляют 3-хлор-4-метилфенилизоцианат (0,27 мл, 1,9 ммоль). Затем смесь перемешивают при комнатной температуре в течение ночи. Смесь гасят метанолом (~1 мл) и растворитель упаривают. Остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 1-(3-хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]мочевину в виде почти белого твердого вещества (520 мг, выход 73%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,58 мин (99,1%); т.пл. 250-252°С.
1H ЯМР (DMSO-d6) δ 2,17-2,22 (м, 4H, CHH, ArCH3), 2,59-2,93 (м, 6Η, CHCH2, CH3), 4,71 (д, J=6 Гц, 2Η, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 6,64 (т, J=6 Гц, 1H, CH2NH), 7,06-7,78 (м, 6Η, Ar), 8,88 (с, 1H, NH), 11,04 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 18,69, 20,70, 23,31, 30,62, 42,31, 56,52, 116,24, 117,46, 117,81, 125,78, 126,28, 127,24, 130,98, 132,96, 133,99, 139,66, 141,30, 148,49, 154,76, 154,88, 161,02, 169,49, 172,65. LCMS: MΗ=468, 470;
Элементный анализ. Вычислено для C23C22N5O4Cl+0,2Н2О: C 58,59; Н 4,79; N 14,85; Cl 7,52. Найдено: C 58,42; Н 4,55; N 14,57; Cl 7,83.
5.48. 1-(3,4-Диметилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]мочевина
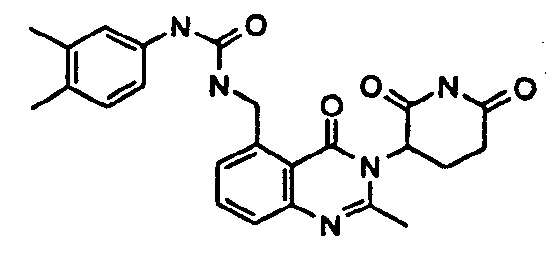
При перемешивании к суспензии гидрохлорида 3-(5-амино-метил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,53 г, 1,6 ммоль) и триэтиламина (0,31 мл, 2,2 ммоль) в ТГФ (15 мл) при 5-10°С добавляют 3,4-диметилфенилизоцианат (0,29 мл, 2,1 ммоль). Затем смесь перемешивают при комнатной температуре в течение ночи. Смесь гасят метанолом (~1 мл) и растворитель упаривают. Остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 1-(3,4-диметилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]мочевину в виде почти белого твердого вещества (520 мг, выход 73%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,14 мин (96,6%); т.пл. 241-243°С.
1H ЯМР (DMSO-d6) δ 2,11-2,21 (м, 7H, CHH, 2ArCH3), 2,59-2,94 (м, 6Η, CHCH2, CH3), 4,71 (д, J=5 Гц, 2H, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 6,56 (т, J=5 Гц, 1H, CH2NH), 6,92-7,78 (м, 6Η, Ar), 8,58 (с, 1H, NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 18,58, 19,59, 20,70, 23,24, 30,62, 42,26, 56,52, 115,18, 117,76, 118,99, 125,54, 126,28, 128,50, 129,46, 134,01, 136,03, 138,15, 141,69, 148,27, 154,87, 155,11, 160,94, 169,47, 172,65. LCMS: MH=448;
Элементный анализ. Вычислено для C24C25N5O4+2,0Н2О: C 59,62; Н 6,05; N 14,48. Найдено: C 59,36; Н 5,95; N 14,24.
5.49. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-4-метилбензамид
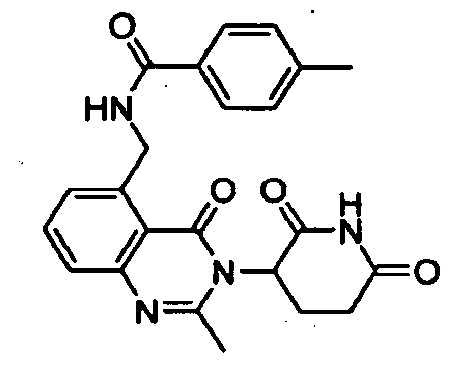
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,47 г, 1,4 ммоль) в тетрагидрофуране (10 мл) добавляют п-толуолил-хлорид (0,37 мл, 2,8 ммоль) и триэтиламин (0,79 мл, 5,6 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (360 мг, выход 61%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 5,97 мин (97,3%); т.пл. 283-285°С.
1H ЯМР (DMSO-d6) δ, 2,17-2,23 (м, 1H, CHH), 2,37 (с, 3Η, CH3), 2,58-2,92 (м, 6H, CHCH2, CH3), 4,90-5,07 (м, 2Η, CH2NH), 5,25 (дд, J=6, 11 Гц, 1H, CH), 7,29-7,84 (м, 7Η, Ar), 8,85 (т, 1H, J=6 Гц, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 20,93, 23,29, 30,60, 42,07, 56,53, 117,65, 120,97, 124,02, 125,40, 127,21, 128,89, 131,43, 133,92, 141,11, 141,17, 148,50, 154,80, 161,11, 166,14, 169,54, 172,62. LCMS: MH=419;
Элементный анализ. Вычислено для C23C22N4O4+0,4Н2О: C 64,90; Н 5,40; N 13,16. Найдено: C 64,96; Н 5,37; N 13,15.
5.50. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-метилбензамид
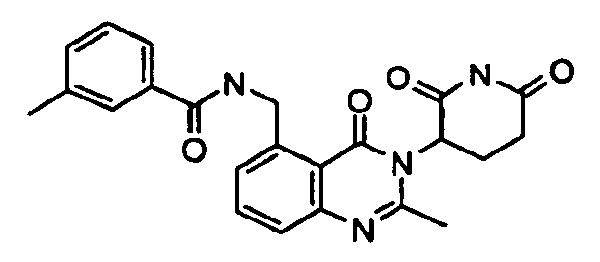
При перемешивании к раствору м-толуиловой кислоты (0,24 г, 1,8 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,31 г, 1,9 ммоль) и перемешивают один час. К смеси добавляют гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,59 г, 1,8 ммоль) и смесь перемешивают 45 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-метилбензамид в виде светло-зеленого твердого вещества (560 мг, выход 76%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,00 мин (99,2%); т.пл. 263-265°С.
1H ЯМР (DMSO-d6) δ 2,18-2,21 (м, 1H, CHH), 2,38 (с, 3H, CH3Ar), 2,59-2,88 (м, 6Η, CHCH2, CH3), 4,95-5,12 (м, 2Η, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,33-7,76 (м, 7Η, Ar), 8,89 (т, J=5 Гц, 1H, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,83, 20,92, 23,29, 30,60, 42,12, 56,52, 117,65, 123,98, 124,32, 125,40, 127,76, 128,26, 131,85, 133,93, 134,23, 137,65, 141,04, 148,50, 154,80, 161,11, 166,39, 169,53, 172,61. LCMS: MH=419;
Элементный анализ. Вычислено для C23C22N4O4+0,6Н2О: C 64,36; Н 5,45; N 13,05. Найдено: C 64,36; Н 5,24; N 13,22.
5.51. 4-Хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид
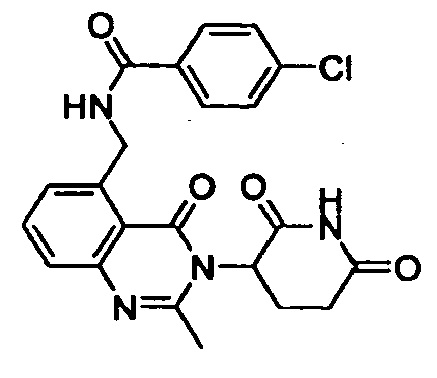
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,48 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляют 4-хлорбензоил-хлорид (0,27 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,62 мл, 3,6 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 4-хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид в виде белого твердого вещества (390 мг, выход 62%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,18 мин (98,0%); т.пл. 276-278°С.
1H ЯМР (DMSO-d6) δ 2,18-2,23 (м, 1H, CHH), 2,58-2,93 (м, 6Η, CHCH2, CH3), 4,97-5,08 (м, 2Η, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,33-7,96 (м, 7Η, Ar), 9,01 (т, 1H, J=6 Гц, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 23,29, 30,60, 42,21, 56,54, 117,66, 124,16, 125,52, 128,45, 129,17, 132,95, 133,95, 136,13, 140,69, 148,52, 154,84, 161,10, 165,23, 169,54, 172,63. LCMS: MH=439, 441;
Элементный анализ. Вычислено для C22C19N4O4Cl+0,1Н2О: C 59,96; Н 4,39; N 12,71; Cl 8,05. Найдено: C 59,80; Н 4,13; N 12,61; Cl 8,30.
5.52. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-фторбензамид
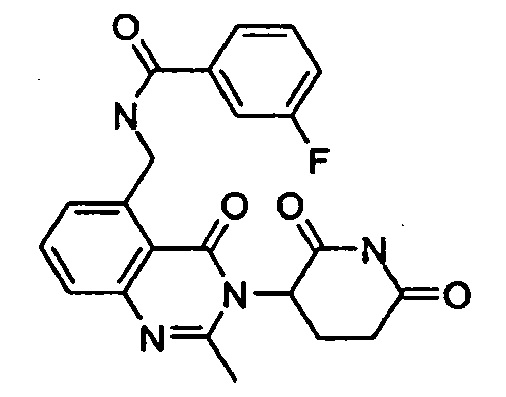
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,47 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляют 3-фторбензоил-хлорид (0,25 мл, 2,1 ммоль) и N,N-диизопропилэтиламин (0,61 мл, 3,5 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-фторбензамид в виде белого твердого вещества (230 мг, выход 40%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 5,80 мин (98,8%); т.пл. 240-242°С.
1H ЯМР (DMSO-d6) δ 2,18-2,24 (м, 1H, CHH), 2,59-2,93 (м, 6Η, CHCH2, CH3), 4,93-5,10 (м, 2H, CH2NH), 5,28 (дд, J=6, 11 Гц, 1H, CH), 7,36-7,80(м, 7Η, Ar), 9,08 (т, 1H, J=6 Гц, CH2NH), 11,06 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,79, 23,07, 30,58, 42,16, 56,58, 113,94, 114,24, 117,52, 118,09, 118,36, 123,38, 123,41, 124,16, 124,99, 130,52, 130,62, 134,12, 136,52, 136,61, 140,79, 147,84, 155,29, 160,39, 160,90, 163,62, 164,99, 165,02, 169,45, 172,60. LCMS: MH=423;
Элементный анализ. Вычислено для C22C19N4O4F+0,4Н2О: C 61,51; Н 4,65; N 13,04; F 4,42. Найдено: C 61,32; Н 4,44; N 12,97; F 4,27.
5.53. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-4-трифторметилбензамид
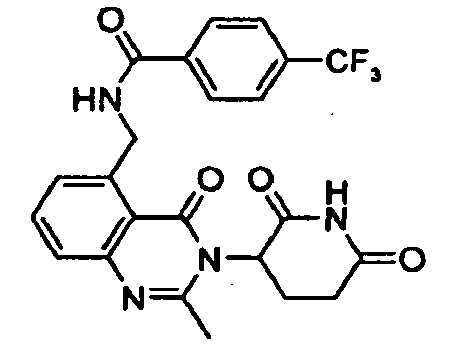
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,45 г, 1,3 ммоль) в ацетонитриле (10 мл) добавляют 4-трифторметил-бензоилхлорид (0,30 мл, 2,0 ммоль) и N,N-диизопропилэтиламин (0,58 мл, 3,3 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]-4-трифторметилбензамид в виде белого твердого вещества (420 мг, выход 67%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,46 мин (97,2%); т.пл. 253-255°С.
1H ЯМР (DMSO-d6) δ 2,18-2,24 (м, 1H, CHH), 2,59-2,94 (м, 6H, CHCH2, CH3), 4,94-5,11 (м, 2Η, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 7,36-8,13 (м, 7H, Ar), 9,16 (т, J=5 Гц, 1H, CH2NH), 11,06 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 23,28, 30,60, 42,31, 56,56, 117,68, 124,28, 125,39, 125,44, 125,57, 125,74, 128,16, 130,99, 131,41, 133,98, 137,96, 140,45, 148,50, 154,89, 161,10, 165,12, 169,54, 172,63. LCMS: MH=473;
Элементный анализ. Вычислено для C23C19N4O4F3+0,5Н2О: C 57,38; Н 4,19; N 11,64; F 11,84. Найдено: C 57,01; Н 4,05; N 11,53; F 11,56.
5.54. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-4-трифторметоксибензамид
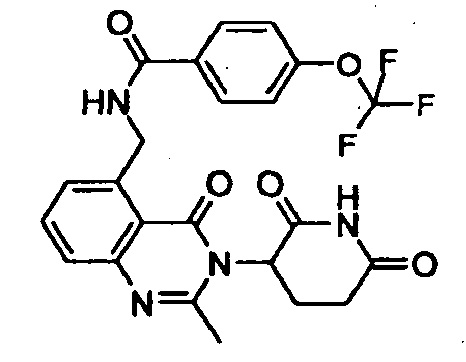
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляют 4-трифторметокси-бензоилхлорид (0,34 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,63 мл, 3,6 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]-4-трифторметоксибензамид в виде белого твердого вещества (370 мг, выход 54%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,54 мин (98,6%); т.пл. 258-260°С.
1H ЯМР (DMSO-d6) δ, 2,18-2,23 (м, 1H, CHH), 2,59-2,92 (м, 6Η, CHCH2, CH3), 4,98-5,09 (м, 2Η, GH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,34-8,07 (м, 7Η, Ar), 9,05 (т, J=5 Гц, 1H, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 23,29, 30,60, 42,22, 56,54, 117,66, 120,70, 124,15, 125,52, 129,59, 133,30, 133,96, 140,65, 148,51, 150,33, 154,84, 161,10, 165,05, 169,54, 172,63. LCMS: MH=489;
Элементный анализ. Вычислено для C23C19N4O5F3: C 56,56; Н 3,92; N 11,47; F 11,67. Найдено: C 56,32; Н 3,60; N 11,23; F 11,56.
5.55. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид
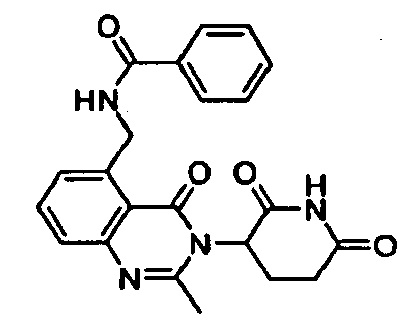
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,59 г, 1,8 ммоль) в ацетонитриле (10 мл) добавляют бензоилхлорид (0,31 мл, 2,1 ммоль) и N,N-диизопропилэтиламин (0,77 мл, 4,4 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]бензамид в виде белого твердого вещества (260 мг, выход 36%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 5,70 мин (99,6%); т.пл. 247-249°С.
1H ЯМР (DMSO-d6) δ 2,17-2,23 (м, 1H, CHH), 2,59-2,90 (м, 6H, CHCH2, CH3), 4,92-5,09 (м, 2Η, CH2NH), 5,26 (дд, J=6, 12 Гц, 1H, CH), 7,47-7,94 (м, 8Η, Ar), 8,93 (т, J=5 Гц, 1H, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 23,29, 30,60, 42,12, 56,53, 117,65, 124,01, 125,43, 127,20, 128,37, 131,30, 133,95, 134,21, 140,99, 148,50, 154,81, 161,11, 166,26, 169,54, 172,62. LCMS: MH=405;
Элементный анализ. Вычислено для C22C20N4O4+0,5Н2О: C 63,91; Н 5,12; N 13,55. Найдено: C 63,78; Н 4,82; N 13,45.
5.56. 3,4-Дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид
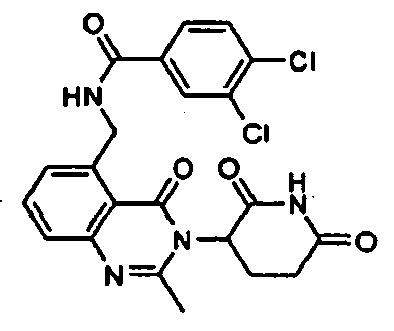
При перемешивании к смеси гидрохлорида 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,46 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляют 3,4-дихлорбензоил-хлорид (0,34 мл, 1,6 ммоль) и N,N-диизопропилэтиламин (0,54 мл, 3,3 ммоль). Смесь перемешивают при комнатной температуре 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают 3,4-дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид в виде белого твердого вещества (450 мг, выход 70%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,60 мин (99,6%); т.пл. 271-273°С.
1H ЯМР (DMSO-d6) δ 2,17-2,22 (м, 1H, CHH), 2,58-2,90 (м, 6H, CHCH2, CH3), 4,97-5,09 (м, 2Η, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,34-8,17 (м, 6Η, Ar), 9,14 (т, J=5 Гц, 1H, CH2NH), 11,04 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,80, 23,29, 30,60, 42,30, 56,52, 117,66, 124,17, 125,56, 127,58, 129,28, 130,76, 131,31, 133,97, 134,11, 134,56, 140,39, 148,50, 154,86, 161,06, 164,10, 169,53, 172,62. LCMS: MH=473, 475;
Элементный анализ. Вычислено для C22C18N4O4Cl2+0,1CH2Cl2: C 55,09; Н 3,81; N 11,63; Cl 16,19. Найдено: C 54,88; Н 3,60; N 11,46; Cl 16,38.
5.57. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-трифторметилбензамид
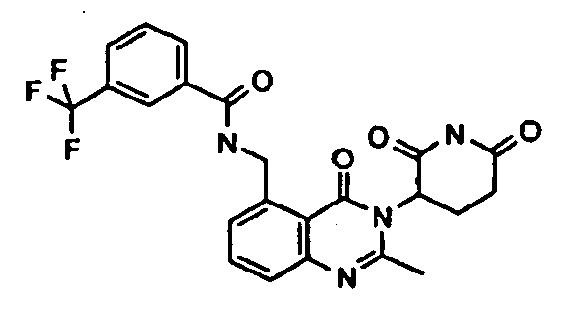
При перемешивании к раствору 3-трифторметилбензойной кислоты (0,28 г, 1,5 ммоль) в ДМФА (8 мл) на масляной бане с температурой 40°С добавляют 1,1’-карбонилдиимидазол (0,27 г, 1,6 ммоль) и перемешивают один час. Затем добавляют гидрохлорид 3-(5-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)-пиперидин-2,6-диона (0,50 г, 1,5 ммоль) и перемешивают 15 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-3-трифторметилбензамид в виде почти белого твердого вещества (440 мг, выход 62%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,37 мин (98,3%); т.пл. 233-235°С.
1H ЯМР (DMSO-d6) δ 2,17-2,23 (м, 1H, CHH), 2,58-2,91 (м, 6H, CHCH2, CH3), 4,95-5,12 (м, 2Η, CH2NH), 5,27 (дд, J=6, 11 Гц, 1H, CH), 7,36-8,27 (м, 7Η, Ar), 9,23 (т, J=5 Гц, 1H, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,79, 23,29, 30,60, 42,29, 56,52, 117,68, 123,85 (кв., JC-F=3 Гц), 123,98 (д, JC-F3=273 Гц), 124,15, 125,53, 127,90 (д, JC-F=3 Гц), 129,19 (д, JC-F=32 Гц), 129,72, 131,37, 133,97, 135,05, 140,50, 148,50, 154,86, 161,07, 164,85, 169,54, 172,62. LCMS: MH=473;
Элементный анализ. Вычислено для C23C19N4O4F3: C 58,48; Н 4,05; N 11,86; F 12,06. Найдено: C 58,19; Н 3,84; N 11,86; F 12,00.
5.58. N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]-4-трифторметилсульфанилбензамид
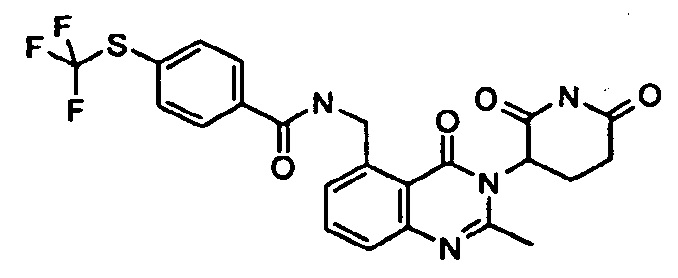
При перемешивании к суспензии гидрохлорида 3-(5-амино-метил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляют 4-трифторметилтиобензоилхлорид (0,37 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,60 мл, 3,7 ммоль). Смесь перемешивают при комнатной температуре 30 минут. Растворитель упаривают, остаток очищают флеш колоночной хроматографией (силикагель, метанол/метиленхлорид, 4%/96%), получают N-[3-(2,6-диоксо-пиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-ил-метил]-4-трифторметилсульфанилбензамид в виде почти белого твердого вещества (520 мг, выход 70%).
ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% Н3РО4, градиент до 95/5 за 5 минут, выдерживание 5 минут; 6,70 мин (98,3%); т.пл. 236-238°С.
1H ЯМР (DMSO-d6) δ 2,17-2,21 (м, 1H, CHH), 2,59-2,88 (м, 6H, CHCH2, CH3), 4,95-5,12 (м, 2Η, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,36-8,05 (м, 7Η, Ar), 9,12 (т, J=5 Гц, 1H, CH2NH), 11,05 (с, 1Η, NH); 13C ЯМР (DMSO-d6) δ 20,82, 23,28, 30,60, 42,28, 56,55, 117,66, 124,19, 125,56, 126,28 (д, JC-F=1 Гц), 128,66, 129,48 (кв., JC-F=308 Гц), 133,97, 135,91, 136,81, 140,50, 148,52, 154,85, 161,10, 165,28, 169,54, 172,63. LCMS: MH=505;
Элементный анализ. Вычислено для C23C19N4O4SF3+1,7H2O: C 51,63; Н 4,22; N 10,47; S 5,99; F 10,65. Найдено: C 51,34; Н 3,97; N 10,33; S 6,25; F 10,68.
5.59. Испытания
5.59.1. Оценка ингибирования TNFα в РВМС
Мононуклеары периферической крови (PBMC) от нормальных доноров получают центрифугированием по плотности на фиколл-гепаке (Ficoll Hypaque, Pharmacea, Piscataway, NJ, USA). Клетки культивируют в PRMI 1640 (Life Technologies, Grand Island, NY, USA), дополненной 10% АВ + человеческая сыворотка (Gemini Bio-products, Woodland, CA, USA), 2 мМ L-глутамина, 100 ед/мл пенициллина и 100 мкл/мл стрептомицина (Life Technologies).
РВМС (2×105 клеток) помещают в 96-луночные плоскодонные планшеты для культуральных тканей Costar (Corning, NY, USA) при трех повторах. Клетки стимулируют с помощью LPS (от Salmonella abortus equi, Sigma cat.no L-1887, St.Louis, MO, USA) при конечной концентрации 1 нг/мл в отсутствие или в присутствии соединений. Соединения, представленные в настоящем изобретении, растворяют в ДМСО (Sigma) и дополнительные растворения проводят в культуральной среде непосредственно перед применением. Конечная концентрация ДМСО во всех анализах может составлять приблизительно 0,25%. Соединения добавляют к клеткам в течение 1 часа до стимулирования LPS. Клетки затем выдерживают в течение 18-20 часов при 37°С в 5% СО2, собирают надосадочные жидкости, разбавляют культуральной средой и оценивают уровни TNFα с помощью ELISA (Endogen, Boston, MA, USA). Значения IC50 рассчитывают с использованием нелинейной регрессии, S-образной кривой доза-реакция, ограниченной в верхней части 100% и в нижней части 0%, допускающей переменный наклон (GraphPad Prism v3.02).
5.59.2. Продуцирование IL-2 и MIP-3α Т-клетками
РВМС очищают от прикрепленных моноцитов путем помещения 1×108 РВМС в 10 мл полной среды (RPMI 1640, дополнена 10% инактивированной нагревание сыворотки плода крупного рогатого скота, 2мМ L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина) на 10 см чашки для культуральных тканей в термостате при 37°С, 5% СО2, на 30-60 минут. Чашку промывают средой для удаления всех неприкрепленных РВМС. Т-Клетки очищают путем негативной селекции с использованием следующей смеси антител (Pharmingem) и Dynabead (Dynal) для каждых 1×108 неприкрепленных РВМС: 0,3 мл гранул анти-мышиного IgG овцы, 15 мкл анти-CD16, 15 мкл анти-CD33, 15 мкл анти-CD56, 0,23 мл гранул анти-CD19, 0,23 мл гранул класса II анти-HLA и 56 мкл гранул анти-CD14. Смесь клеток и гранул/антител вращают сверху вниз в течение 30-60 минут при 4°С. Очищенные Т-клетки удаляют с гранул с использованием магнита Dynal. Типичный выход составляет приблизительно 50% Т-клеток, 87-95% CD3+ по проточному цитометрическому анализу.
Плоскодонные 96-луночные планшеты для культуральных тканей покрывают анти-CD3 антителом OKT3 при 5 мкг/мл в PBS, 100 мкл на лунку, выдерживают при 37°С в течение 3-6 часов, затем промывают четыре раза полной средой из расчета 100 мкл/лунка непосредственно перед добавлением Т-клеток. Соединения разбавляют в 20 раз в круглодонном 96-луночном планшете для культуральных тканей. Конечные концентрации составляют приблизительно от 10 мкМ до 0,00064 мкМ. Исходный раствор (10 мМ) соединений, предложенных в изобретении, разбавляют целиком 1:50 для первого 20-ти кратного разбавления 200 мкМ в 2% ДМСО и последовательно разбавляют 1:5 в 2% ДМСО. Соединение добавляют при концентрации 10 мкл на 200 мкл культуры, получают конечную концентрацию ДМСО 0,1%. Культуры выдерживают при 37°С, 5% СО2, в течение 2-3 дней, надосадочные жидкости анализируют на IL-2 и MIP-3α с помощью ELISA (R&D Systems). Уровни IL-2 и MIP-3α нормализуют к количеству, продуцированному в присутствии количества соединения, предложенного в изобретении, и рассчитывают EC50 с использованием нелинейной регрессии, S-образной кривой доза-реакция, ограниченной в верхней части 100% и в нижней части 0%, допускающей переменный наклон (GraphPad Prism v3.02).
5.59.3. Оценка пролиферации клеток
Линии клеток Namalwa, MUTZ-5 и UT-7 получают из Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Braunschwing, Germany). Линию клеток KG-1 получают из American Type Culture Collection (Manassas, VA, USA). Пролиферацию клеток, которую устанавливают за счет введения 3Н-тимидина, измеряют на всех линиях клеток следующим образом.
Клетки помещают в 96-луночные планшеты из расчета 6000 клеток на лунку в среде. Клетки предварительно обрабатывают соединениями приблизительно при 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ в конечной концентрации приблизительно 0,25% ДМСО при трех повторах и выдерживают при 37°С во влажном термостате при 5% СО2 в течение 72 часов. Затем в каждую лунку добавляют один микроКюри 3Н-тимидина (Amersham) и клетки выдерживают снова при 37°С во влажном термостате при 5% СО2 в течение 6 часов. Клетки собирают на планшет-фильтр UniFilter GF/C (Perkin Elmer) с использованием сборщика клеток (Tomtec), и планшетам дают высыхать в течение ночи. Добавляют Microscint 20 (Packard) (25 мкл/лунка), и планшеты анализируют в TopCount NXT (Packard). Каждую лунку считывают в течение одной минуты. Процент ингибирования пролиферации клеток рассчитывают путем усреднения всех трех повторов и нормализуют к ДМСО контролю (0% ингибирования). Каждое соединение испытывают на каждой линии клеток в трех отдельных экспериментах. Конечные значения IC50 рассчитывают с использованием нелинейной регрессии, S-образной кривой доза-реакция, ограниченной в верхней части 100% и в нижней части 0%, допускающей переменный наклон (GraphPad Prism v3.02).
5.59.4. Иммунное осаждение и иммуноблот-анализ
Клетки Namalwa обрабатывают ДМСО или некоторым количеством соединения, предложенного в изобретении, в течение 1 часа, затем стимулируют с помощью 10 ед/мл Epo (R&D Systems) в течение 30 минут. Получают клеточный лизат и проводят или иммунное осаждение с помощью Epo рецептора Ab, или сразу же разделяют с помощью SDS-PAGE. Иммуноблоты зондируют с помощью Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS2, актина и IRF-1 Abs и анализируют на установке для визуализации Storm 860 Imager с использованием программного обеспечения ImageQuant (Molecular Denamics).
5.59.5. Анализ клеточного цикла
Клетки обрабатывают ДМСО или определенным количеством соединения, предложенного в изобретении, в течение ночи. Окрашивание с помощью йодида пропидия для клеточного цикла проводят с использованием CycleTEST PLUS (Becton Dickinson) в соответствии с инструкцией производителя. После окрашивания клетки анализируют с помощью проточного цитометра FACSCalibur с использованием программного обеспечения ModFit LT (Becton Dickinson).
5.59.6. Анализ апоптоза
Клетки обрабатывают ДМСО или определенным количеством соединения, предложенного в изобретении, при различных временных точках, затем промывают промывочным буфером для аннексина-V (BD Biosciences). Клетки выдерживают со связывающим аннексин-V белком и йодидом пропидия (BD Biosciences) в течение 10 минут. Образцы анализируют с использованием проточного цитометра.
5.59.7. Люциферазный анализ
Клетки Namalwa трансфекцируют с помощью 4 мкг AP1-люциферазы (Stratagene) на 1×106 клеток и 3 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с инструкциями производителей. Через шесть часов после трансфекции клетки обрабатывают ДМСО или некоторым количеством соединения, предложенного в изобретении. Активность люциферазы анализируют с использованием лизирующего люциферазу буфера и субстрата (Promega) и измеряют с использованием люминометра (Turner Designs).
Варианты осуществления настоящего изобретения, описанные выше, как подразумевается, являются только примерами, и специалисту в данной области будут очевидны, или он может обнаружить с использованием не более чем обычных опытов большое число эквивалентов конкретных соединений, материалов и методик. Все такие эквиваленты, как полагают, находятся в рамках объема изобретения и охвачены прилагаемой формулой изобретения.
Все патенты, патентные заявки и публикации, упоминаемые в изобретении, включены в описание во всей их полноте. Цитирование или идентификация любой ссылки в данной заявке не допускает, что такая ссылка пригодна как прототип настоящего изобретения. Весь объем изобретения более понятен при обращении к прилагаемой формуле изобретения.