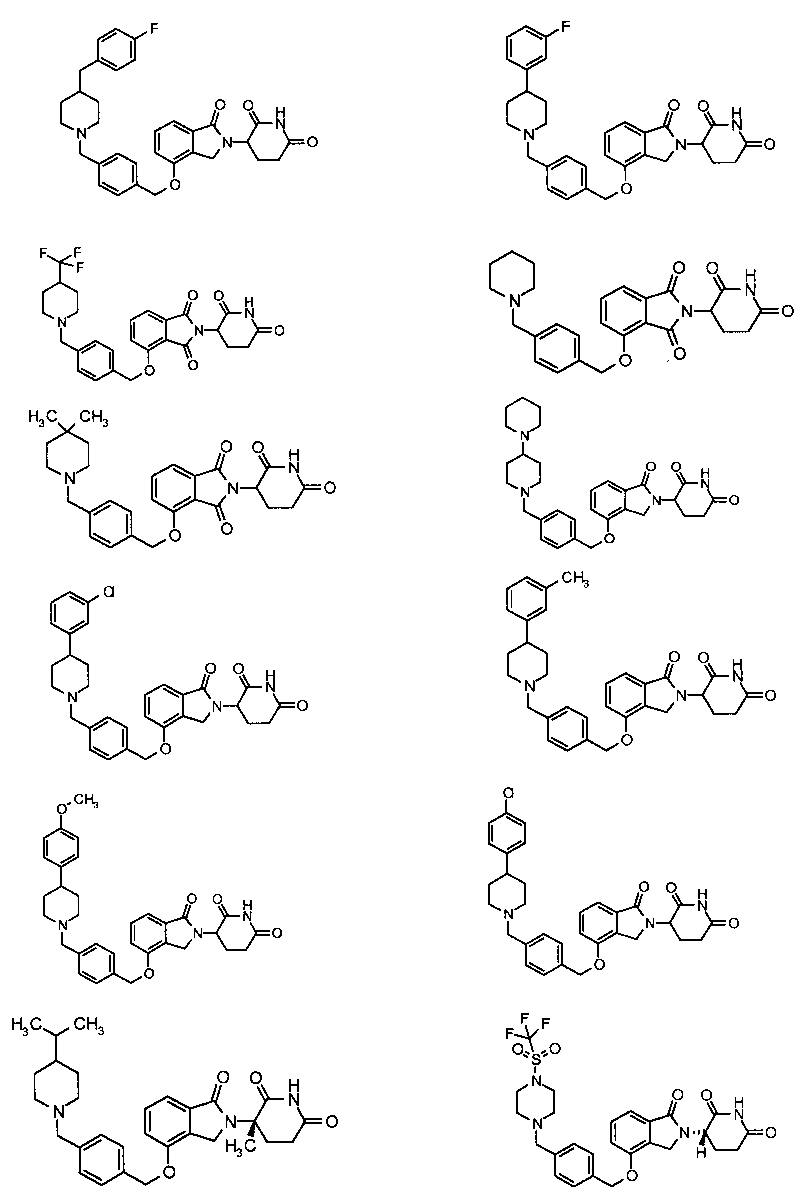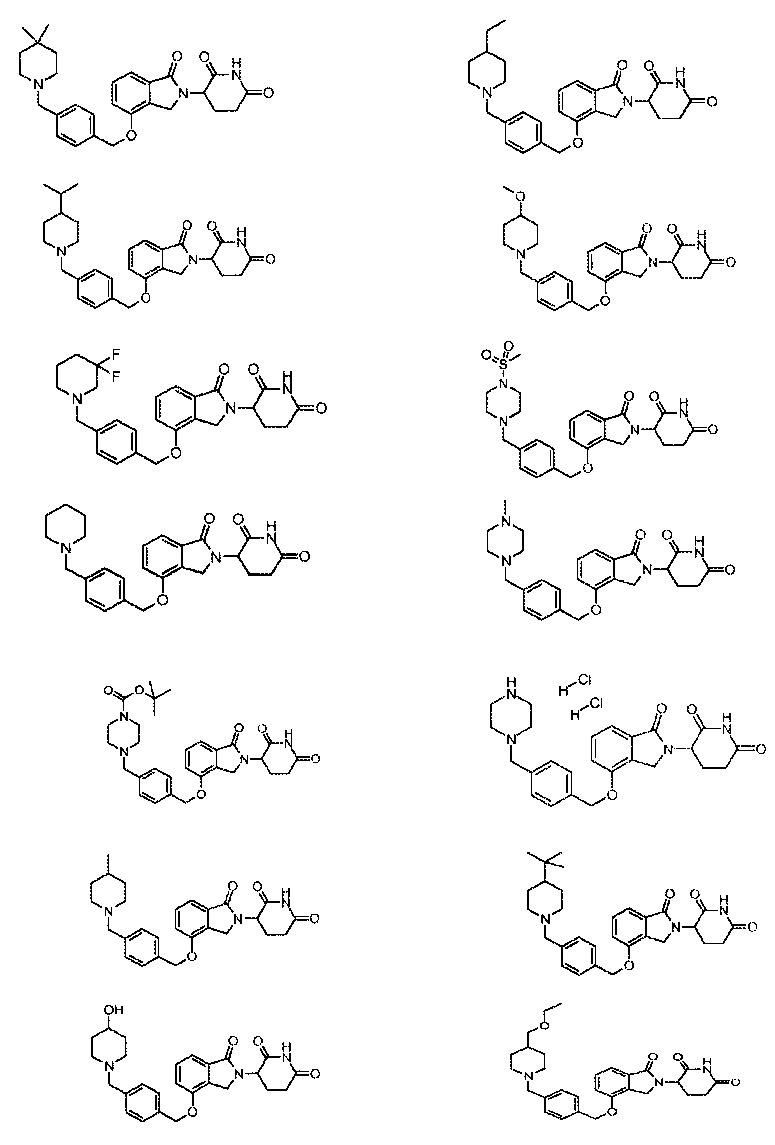Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ АРИЛМЕТОКСИ ИЗОИНДОЛИНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
1. ОБЛАСТЬ
Изобретение относится к производным 4'-арилметокси изоиндолина. Также раскрыты фармацевтические композиции, включающие эти соединения, и способы лечения, профилактики и контроля различных нарушений с использованием этих соединений и композиций.
2. УРОВЕНЬ ТЕХНИКИ
2.1 ПАТОЛОГИИ РАКА И ДРУГИХ ЗАБОЛЕВАНИЙ
Рак характеризуется прежде всего увеличением числа патологических клеток, происходящих из данной нормальной ткани, инвазией смежных тканей этими патологическими клетками или распространением лимфой или кровью злокачественных клеток в региональные лимфатические узлы и в отдаленные части (метастазирование). Клинические данные и молекулярные биологические исследования показывают, что рак представляет собой многостадийный процесс, который начинается с незначительных предопухолевых изменений, которые могут в определенных условиях развиться до неоплазии. Опухолевое поражение может развиваться клонально и проявлять увеличивающуюся способность к инвазии, росту, метастазированию и гетерогенности, особенно в условиях, в которых опухолевые клетки избегают действия иммунной защиты хозяина. Roitt, I., Brostoff, J. and Kale, D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное разнообразие видов рака, которые подробно описаны в медицинской литературе. Примеры включают рак легкого, толстой кишки, прямой кишки, предстательной железы, молочной железы, мозга и кишечного тракта. Частота рака продолжает увеличиваться по мере старения общей популяции, поскольку развиваются новые виды рака, и по мере возрастания чувствительной популяции (например, людей, зараженных СПИДом или чрезмерно подвергающихся действию солнечного света). Однако выборы для лечения рака ограничены. Например, в случае рака крови (например, множественной миеломы), доступно немного выборов лечения, особенно когда обычная химиотерапия оказывается неэффективной, и пересадка костного мозга не является выбором. Поэтому существует огромный спрос на новые способы и композиции, которые могут использоваться для лечения пациентов, страдающих раком.
Многие типы рака связаны с процессом нового формирования кровеносных сосудов, известным как ангиогенез. Некоторые из механизмов, участвующих в индуцированном опухолью ангиогенезе, были объяснены. Самым прямым из этих механизмов является секреция опухолевыми клетками цитокинов с ангиогенными свойствами. Примеры этих цитокинов включают кислый и основной фибробластный фактор роста (a,b-FGF), ангиогенин, сосудистый эндотелиальный фактор роста (VEGF), и TNF-α. Альтернативно, опухолевые клетки могут высвобождать ангиогенные пептиды через продукцию протеаз и последующий распад внеклеточного матрикса, где запасаются некоторые цитокины (например, b-FGF). Ангиогенез может также быть вызван косвенно через рекрутирование воспалительных клеток (особенно макрофагов) и последующее высвобождение ими ангиогенных цитокинов (например, TNF-α, b-FGF).
Различные другие заболевания и нарушения также связаны с нежелательным ангиогенезом или характеризуются им. Например, усиленный или нерегулируемый ангиогенез участвует в механизме множества заболеваний и медицинских состояний, включая, но не ограничиваясь ими, неоваскулярные заболевания глаз, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, рубеоз (образование новых сосудов угла передней камеры), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, но не ограничены ими: диабетическую ретинопатию; ретинопатию недоношенных; отторжение трансплантата роговицы; неоваскулярную глаукому; ретролентальную фиброплазию; артрит; и пролиферативную витреоретинопатию.
Соответственно, соединения, которые могут контролировать ангиогенез или ингибировать продукцию определенных цитокинов, включая TNF-α, могут быть использованы в лечении и профилактике различных заболеваний и состояний.
2.2 СПОСОБЫ ЛЕЧЕНИЯ РАКА
Существующая в настоящее время терапия рака может включать хирургию, химиотерапию, гормональную терапию и/или лучевую терапию, чтобы ликвидировать опухолевые клетки в организме пациента (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). С недавних пор терапия рака может также включать биологическую терапию или иммунотерапию. Все эти подходы имеют значительные недостатки для пациента. Хирургия, например, может иметь противопоказания вследствие состояния здоровья или возраста пациента или может быть неприемлема для пациента.
Дополнительно, хирургия может не полностью удалить опухолевую ткань. Лучевая терапия эффективна только тогда, когда опухолевая ткань показывает более высокую чувствительность к облучению, чем нормальная ткань. Лучевая терапия может также часто вызывать серьезные побочные эффекты. Гормональная терапия редко используется как единственное средство. Хотя гормональная терапия может быть эффективной, она часто используется для профилактики или задержки рецидива рака после того, как другие виды лечения позволили удалить большую часть раковых клеток. Биологические терапии и иммунотерапии ограничены в числе и могут производить побочные эффекты, такие как высыпания или набухания, гриппоподобные симптомы, включая лихорадку, озноб и усталость, проблемы пищеварительного тракта или аллергические реакции.
Относительно химиотерапии, существуют различные химиотерапевтические средства, доступные для лечения рака. Большинство противораковых химиотерапевтических средств действуют, ингибируя синтез ДНК, прямо или косвенно ингибируя биосинтез предшественников дезоксирибонуклеотид трифосфата, чтобы предотвратить репликацию ДНК и сопутствующее деление клетки. Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, New York).
Несмотря на доступность различных химиотерапевтических средств, химиотерапия имеет много недостатков. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., ch. 12, sect. 10, 1998. Почти все химиотерапевтические средства являются токсичными, и химиотерапия вызывает значительные и часто опасные побочные эффекты, включая тяжелую тошноту, подавление деятельности костного мозга и иммуносупрессию. Дополнительно, даже при введении комбинаций химиотерапевтических средств, многие опухолевые клетки являются резистентными, или у них развивается резистентность к химиотерапевтическим средствам. Фактически, клетки, резистентные к специфическим химиотерапевтическим средствам, используемым в протоколе лечения, часто оказываются резистентными к другим лекарственным средствам, даже если эти средства имеют другой механизм действия по сравнению с лекарственными средствами, используемыми в конкретном лечении. Этот феномен упоминается как плеотропная лекарственная или множественная лекарственная резистентность. Из-за лекарственной резистентности многие виды рака оказываются или становятся рефрактерными по отношению к стандартным химиотерапевтическим протоколам лечения.
Другие заболевания или состояния, связанные с нежелательным ангиогенезом или характеризующиеся им, также трудны в лечении. Однако было сделано предположение, что некоторые соединения, такие как протамин, гепаин и стероиды, могут быть использованы в лечении некоторых специфических заболеваний. Taylor et al., Nature 297:307 (1982); Folkman et al., Science 221:719 (1983); и патенты США 5001116 и 4994443.
Однако существует значительная потребность в безопасных и эффективных способах лечения, профилактики и контроля рака и других заболеваний и состояний, включая заболевания, которые являются рефрактерными по отношению к стандартным видам лечения, таким как хирургия, лучевая терапия, химиотерапия и гормональная терапия, с уменьшением или исключением токсичности и/или побочных эффектов, связанных с обычными терапиями.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к соединениям 4'-арилметокси изоиндолина и к их фармацевтически приемлемым солям, сольватам (например, гидратам), пролекарствам, клатратам или стереоизомерам.
Также изобретение относится к способам лечения и контроля различных заболеваний или нарушений. Эти способы включают введение пациенту, для которого существует потребность такого лечения или контроля, терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
Также изобретение относится к способам профилактики различных заболеваний и нарушений, которые включают введение пациенту, для которого существует потребность такой профилактики, профилактически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
Также изобретение относится к фармацевтическим композициям, разовым стандартным лекарственным формам, режимам введения и наборам, которые включают соединение по изобретению или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер.
4. ПОДРОБНОЕ ОПИСАНИЕ
В одном варианте осуществления изобретение относится к соединениям изоиндолина и к их фармацевтически приемлемым солям, сольватам, пролекарствам, клатрату и стереоизомерам.
В другом варианте осуществления изобретение относится к способам лечения, контроля и профилактики различных заболеваний и нарушений, которые включают введение пациенту, для которого существует потребность такого лечения или профилактики, терапевтически или профилактически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера. Примеры заболеваний и нарушений описаны здесь.
В других вариантах осуществления соединение по изобретению или его фармацевтически приемлемая соль, сольват, пролекарство, клатрат или стереоизомер вводят в комбинации с другим лекарственным средством (“второе активное средство”) или лечением. Вторые активные средства включают малые молекулы и большие молекулы (например, белки и антитела), примеры которых приведены здесь, а также стволовые клетки. Способы или терапии, которые могут использоваться в комбинации с введением соединений по изобретению, включают, но не ограничены ими, хирургию, переливания крови, иммунотерапию, биологическую терапию, лучевую терапию и другие не основанные на лекарственных средствах терапии, используемые в настоящее время для лечения, профилактики или контроля различных нарушений, описанных здесь.
Также изобретение относится к фармацевтическим композициям (например, разовым стандартным лекарственным формам), которые могут использоваться в способах по изобретению. В одном варианте осуществления фармацевтические композиции включают соединение по изобретению или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер, и в случае необходимости второе активное средство.
4.1 СОЕДИНЕНИЯ
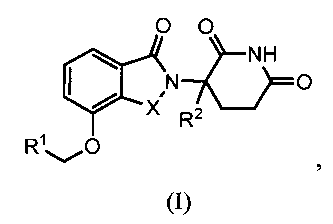
В одном варианте осуществления изобретение относится к соединению формулы (I):
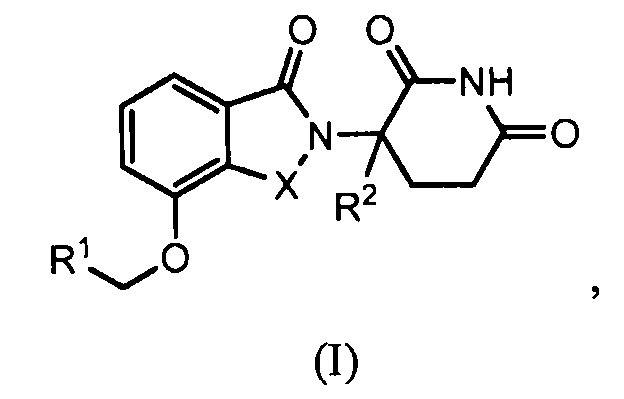
или к его фармацевтически приемлемой соли, сольвату или стереоизомеру, в которой:
X обозначает C=O или CH2;
R1 обозначает -Y-R3;
R2 обозначает H или (C1-C6)алкил;
Y обозначает 6-10-членный арил, гетероарил или гетероцикл, каждый из которых может быть замещен одним или более галогенами; или связь;
R3 обозначает -(CH2)n-арил, -O-(CH2)n-арил или -(CH2)n-O-арил, в которых арил может быть замещен одним или более из следующих заместителей: (C1-C6)алкил, который сам может быть замещен одним или более галогенами; (C1-C6)алкокси, который сам замещен одним или более галогенами; оксо; амино; карбоксил; циано; гидроксил; галоген; дейтерий; 6-10-членный арил или гетероарил, в случае необходимости замещенный одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами; -CONH2; или -COO-(C1-C6)алкил, причем алкил может быть замещен одним или более галогенами;
-(CH2)n-гетероцикл, -O-(CH2)n-гетероцикл или -(CH2)n-O-гетероцикл, причем гетероцикл может быть замещен одним или более из следующих заместителей: (C1-C6)алкил, сам в случае необходимости замещенный одним или более галогенами; (C1-C6)алкокси, сам замещенный одним или более галогенами; оксо; амино; карбоксил; циано; гидроксил; галоген; дейтерий; 6-10-членный арил или гетероарил, в случае необходимости замещенный одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами; -CONH2; или -COO-(C1-C6)алкил, причем алкил может быть замещен одним или более галогенами; или
-(CH2)n-гетероарил, -O-(CH2)n-гетероарил или -(CH2)n-O-гетероарил, причем гетероарил может быть замещен одним или более из следующих заместителей: (C1-C6)алкил, сам в случае необходимости замещенный одним или более галогенами; (C1-C6)алкокси, сам замещенный одним или более галогенами; оксо; амино; карбоксил; циано; гидроксил; галоген; дейтерий; 6-10-членный арил или гетероарил, в случае необходимости замещенный одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами; -CONH2; или -COO-(C1-C6)алкил, причем алкил может быть замещен одним или более галогенами; и
n=0, 1, 2 или 3.
В одном варианте осуществления X обозначает C=O. В другом варианте осуществления C обозначает CH2.
В одном варианте осуществления R2 обозначает H. В другом варианте осуществления, R2 обозначает (C1-C6)алкил.
В одном варианте осуществления Y обозначает арил. В другом варианте осуществления Y обозначает гетероарил. В другом варианте осуществления Y обозначает гетероцикл. В другом варианте осуществления Y обозначает связь.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-арил. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-арил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -O-(CH2)n-арил. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -O-(CH2)n-арил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-O-арил. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-O-арил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-гетероцикл. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-гетероцикл, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -O-(CH2)n-гетероцикл. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероцикл, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-O-гетероцикл. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероцикл, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-гетероарил. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-гетероарил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -O-(CH2)n-гетероарил. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -O-(CH2)n-гетероарил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления R3 обозначает незамещенный -(CH2)n-O-гетероарил. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более (C1-C6)алкилами, которые сами могут быть замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более (C1-C6)алкокси, которые сами замещены одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более оксо. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более амино. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более карбоксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более циано. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более гидроксилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более дейтериями. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более 6-10-членными арилами, в случае необходимости замещенными одним или более (C1-C6)алкилами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более 6-10-членными гетероарилами, в случае необходимости замещенными одним или более (C1-C6)алкилами, (C1-C6)алкокси или галогенами. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более -CONH2. В другом варианте осуществления R3 обозначает -(CH2)n-O-гетероарил, замещенный одним или более -COO-(C1-C6)алкилами, причем алкил может быть замещен одним или более галогенами.
В одном варианте осуществления n=0. В другом варианте осуществления n=1. В другом варианте осуществления n=2.
Все особые комбинации, которые могут следовать из определения, приведенного здесь для X, R1, R2, Y, R3 и n, входят в рамки изобретения.
В одном варианте осуществления X обозначает CH2.
В одном варианте осуществления Y обозначает арил. В другом варианте осуществления Y обозначает фенил.
В другом варианте осуществления когда Y обозначает фенил, R3 обозначает -(CH2)n-гетероцикл. В одном варианте осуществления гетероцикл представляет собой морфолинил, пиперидинил или пирролидинил.
В одном варианте осуществления Y обозначает гетероарил. В другом варианте осуществления Y обозначает 10-членный гетероарил. В другом варианте осуществления Y обозначает бензо[d]тиазол. В другом варианте осуществления Y обозначает бензофуран. В другом варианте осуществления Y обозначает хинолин.
В другом варианте осуществления когда Y обозначает гетероарил, R3 обозначает -(CH2)n-гетероцикл. В одном варианте осуществления гетероцикл представляет собой морфолинил, пиперидинил или пирролидинил.
В одном варианте осуществления Y обозначает связь. В другом варианте осуществления, когда Y обозначает связь, R3 обозначает -(CH2)n-гетероцикл или обозначает -(CH2)n-гетероарил.
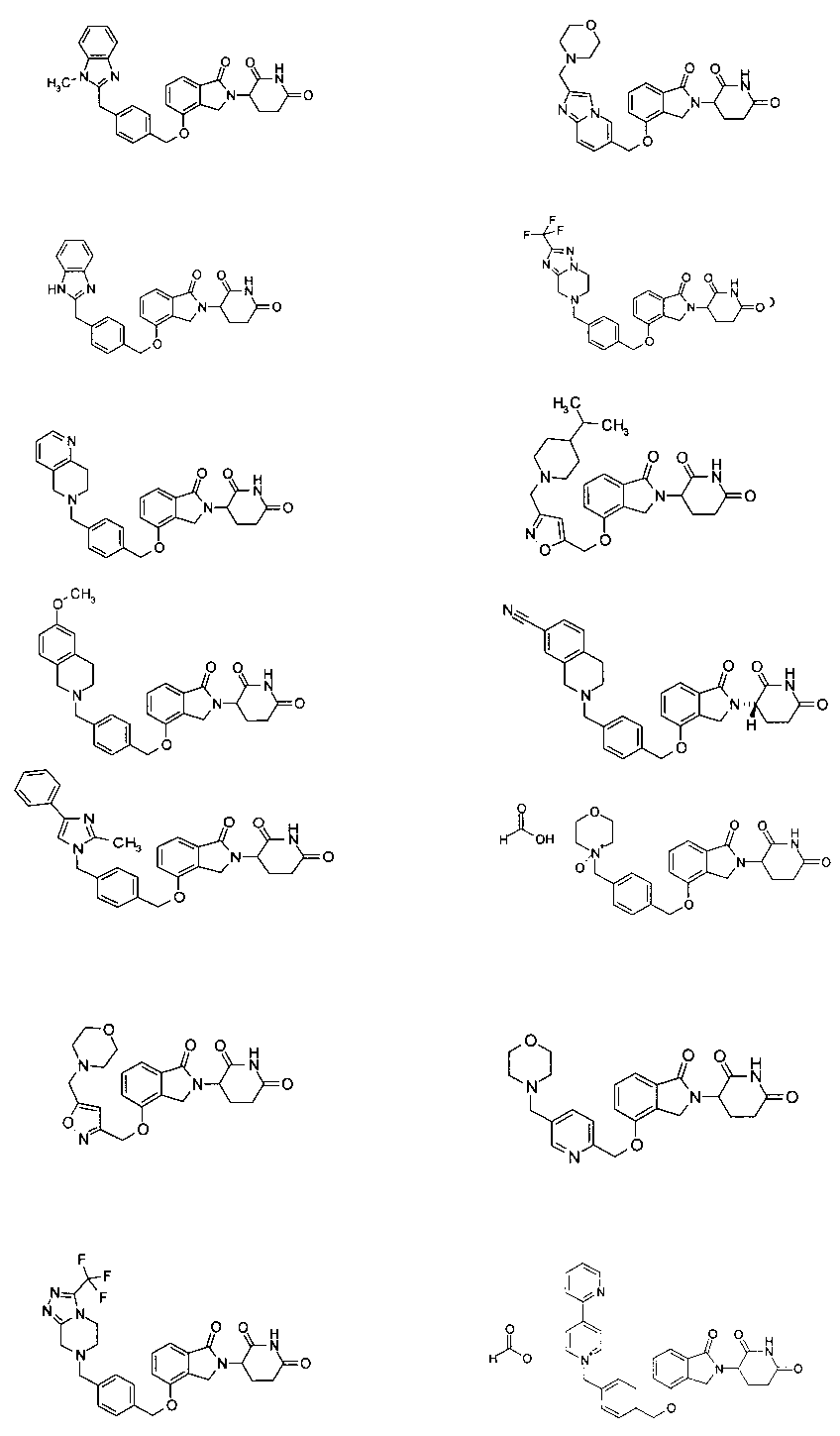
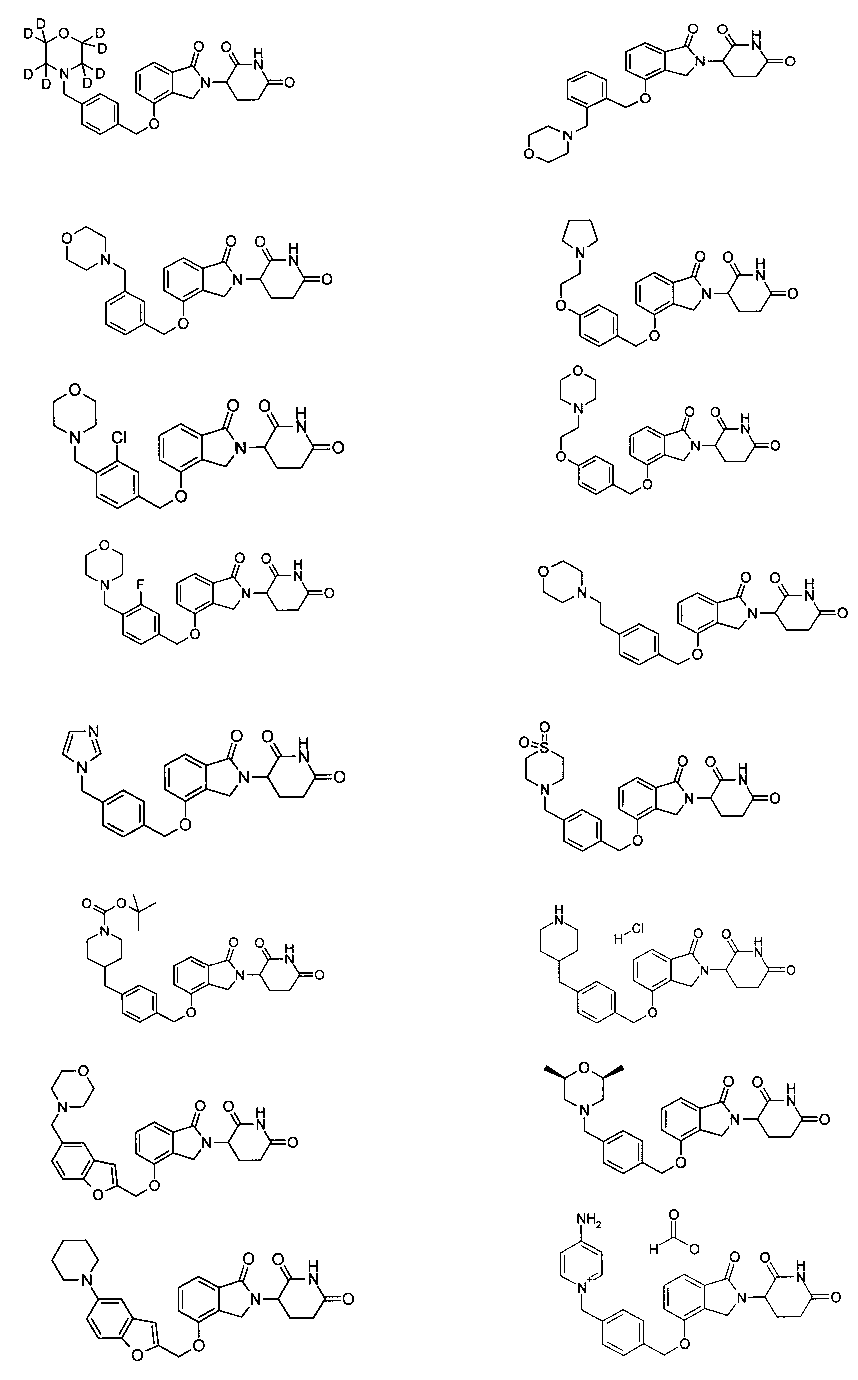
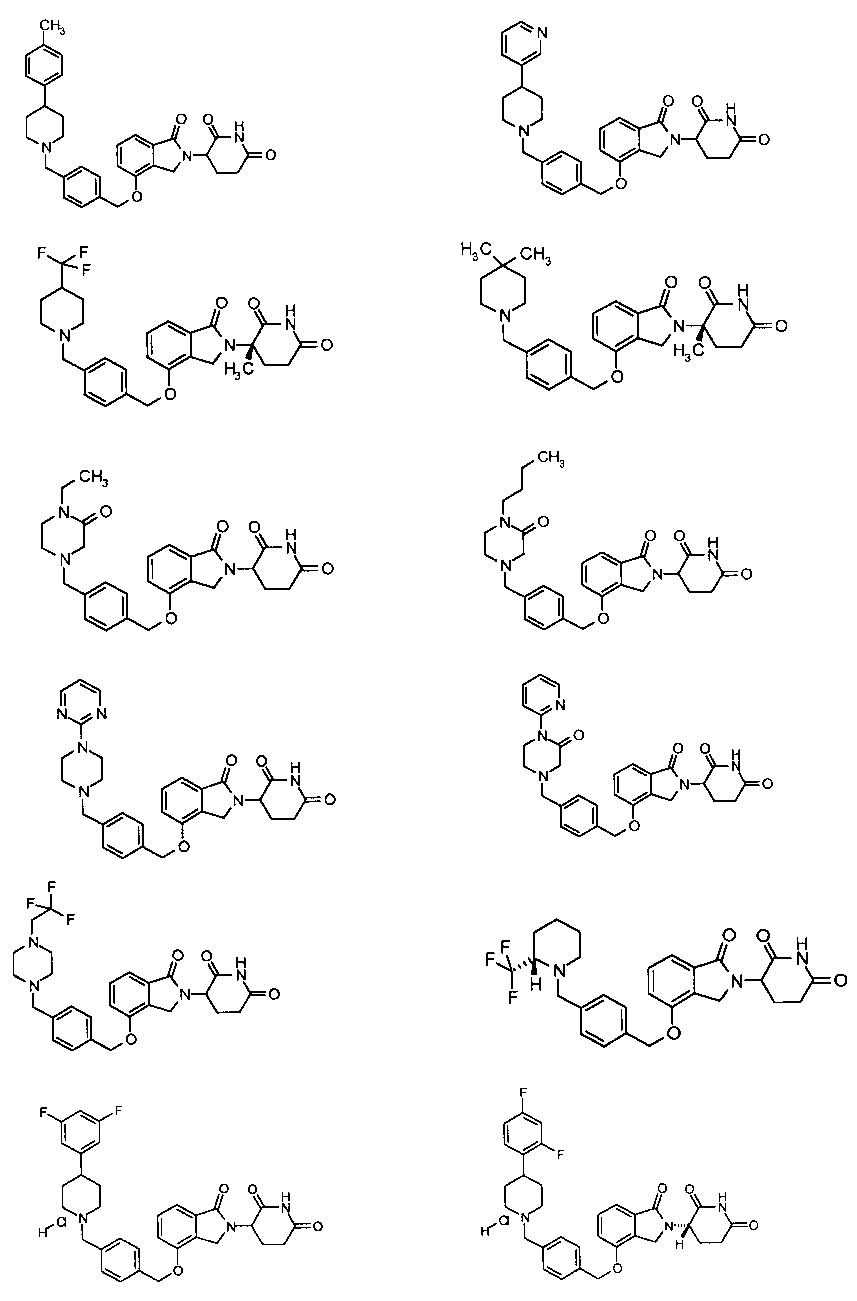
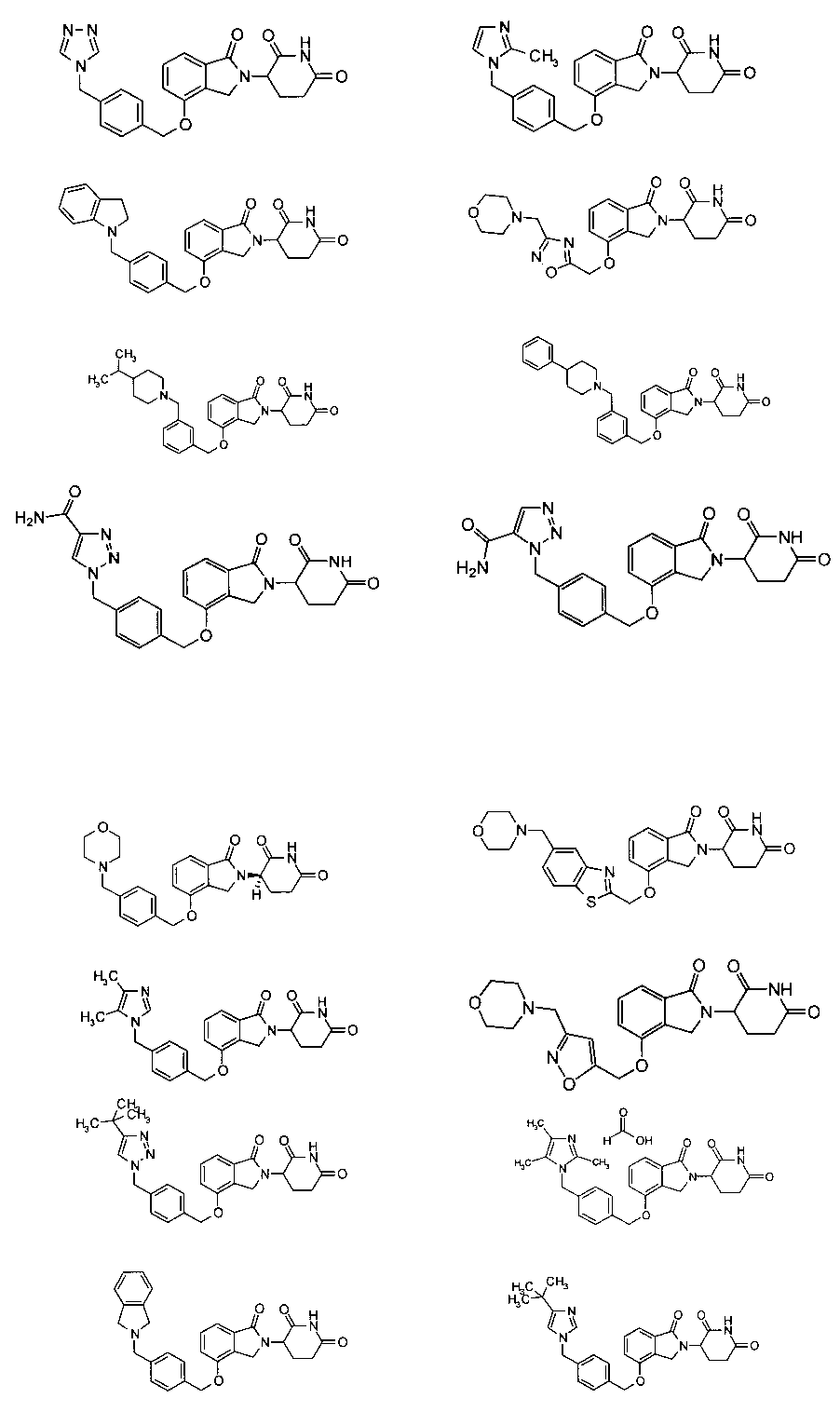
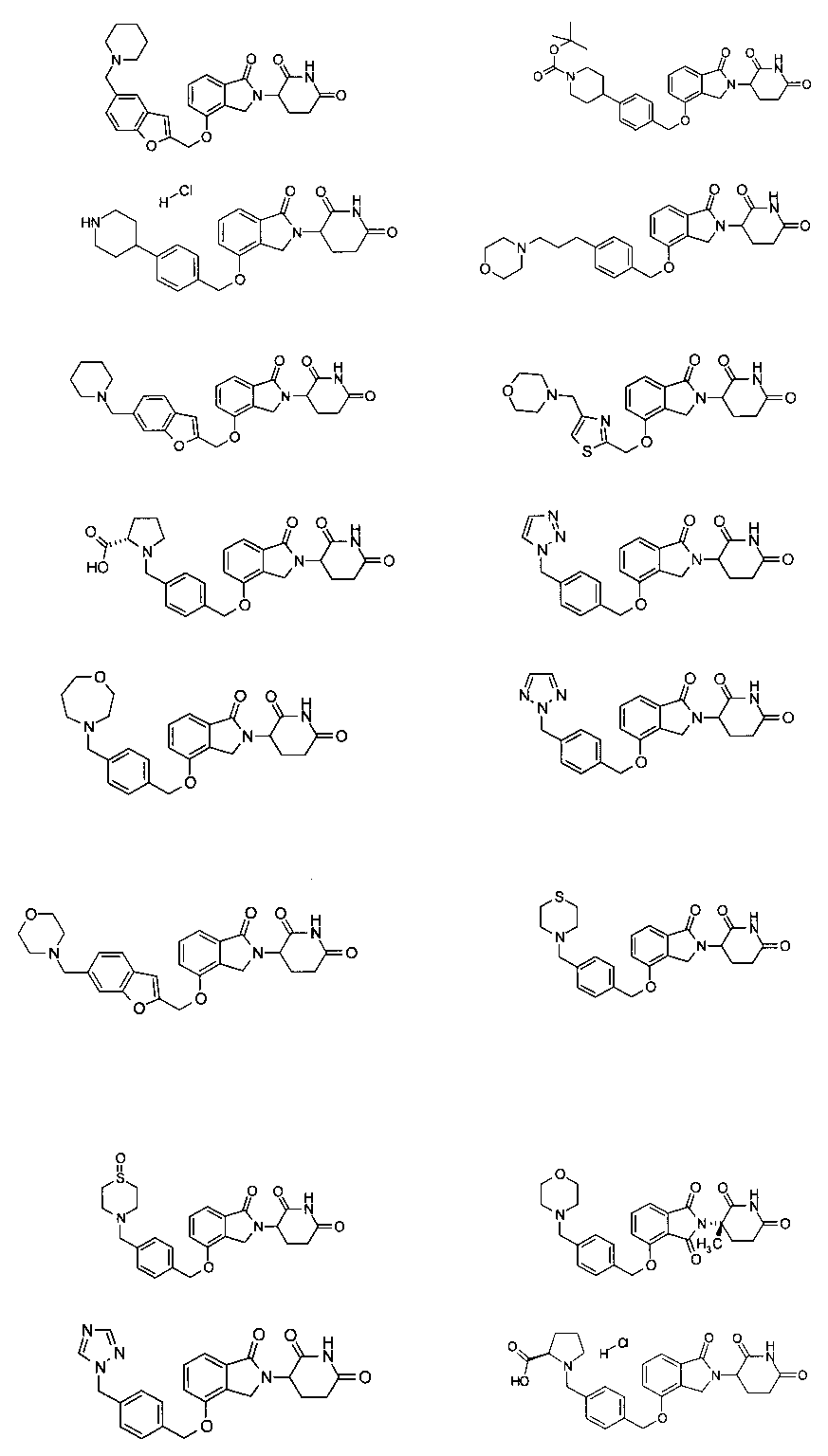
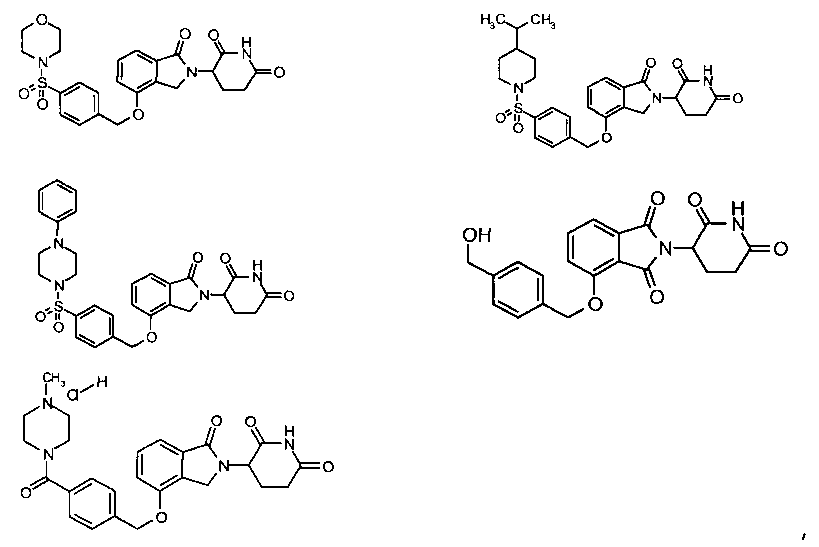
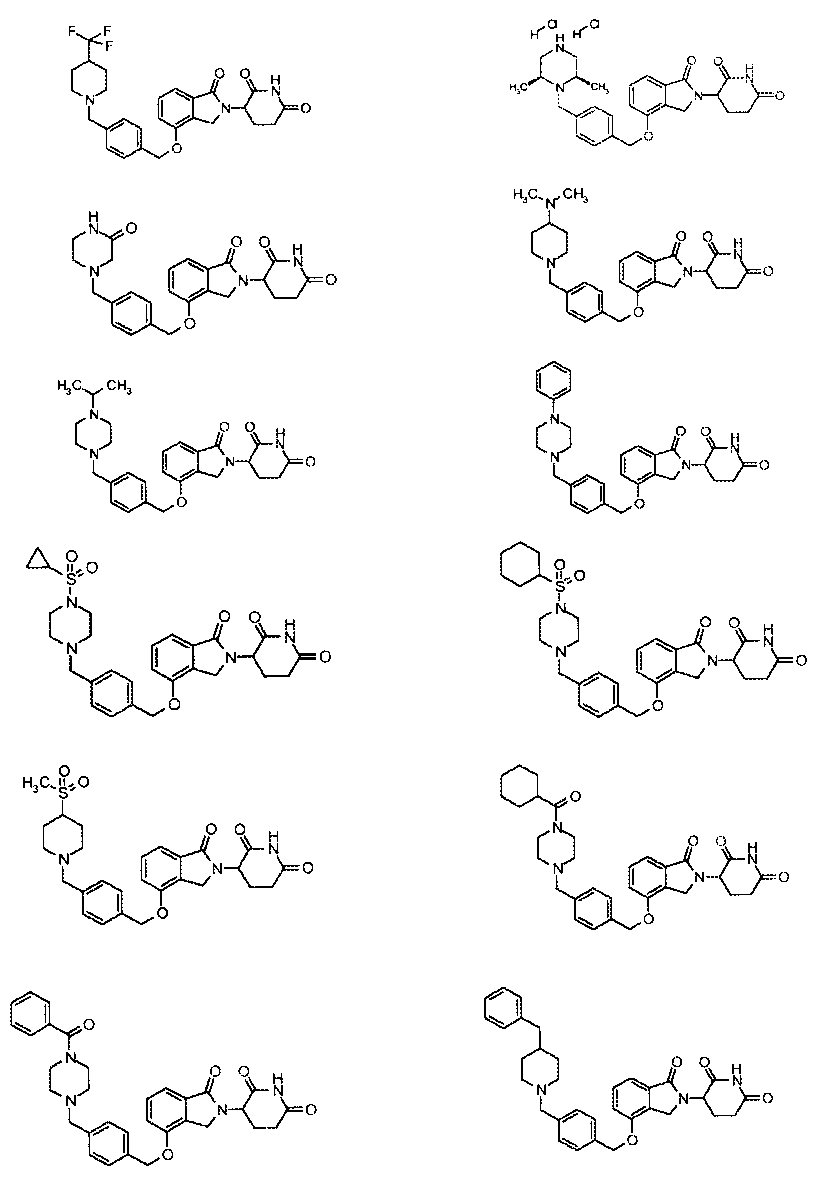
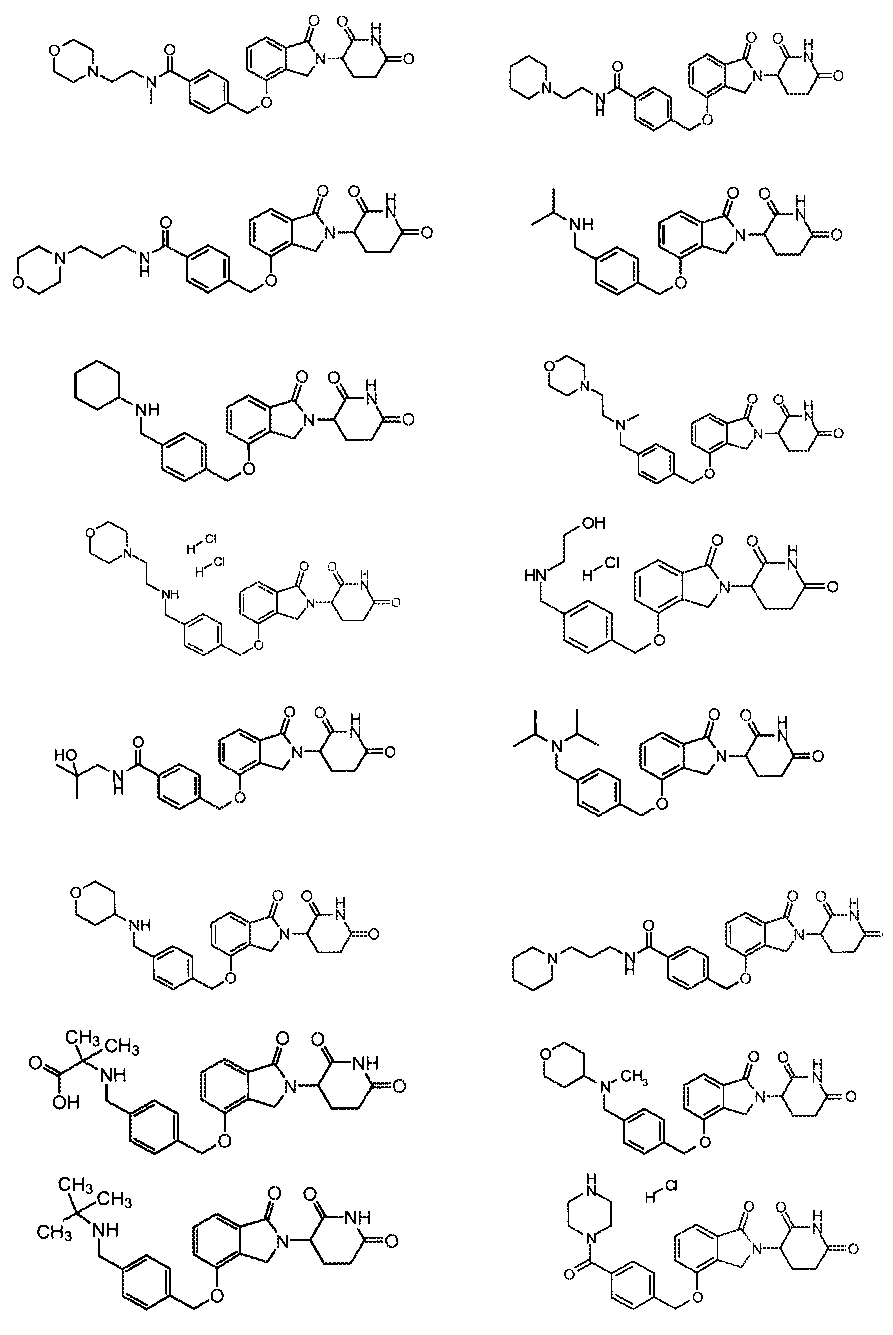
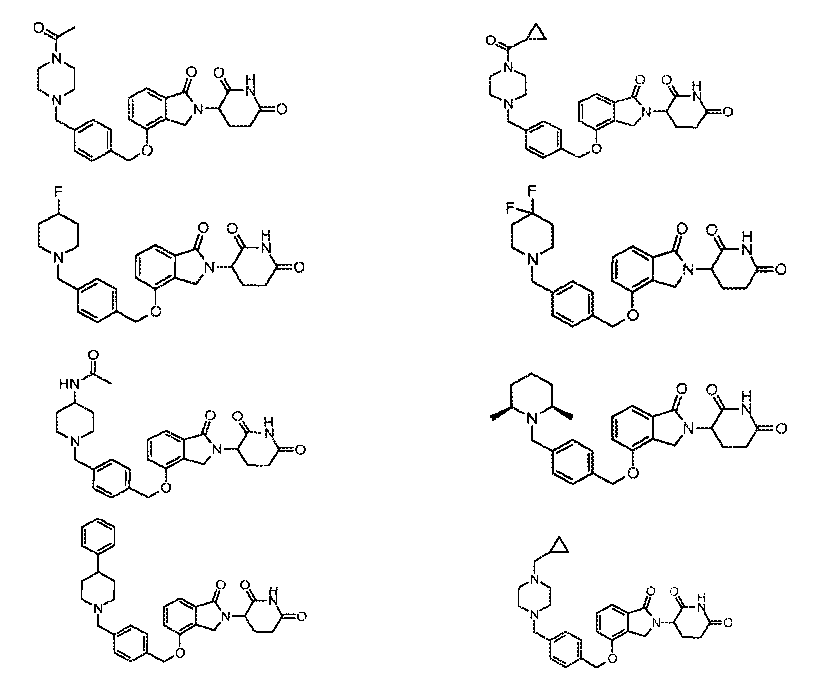
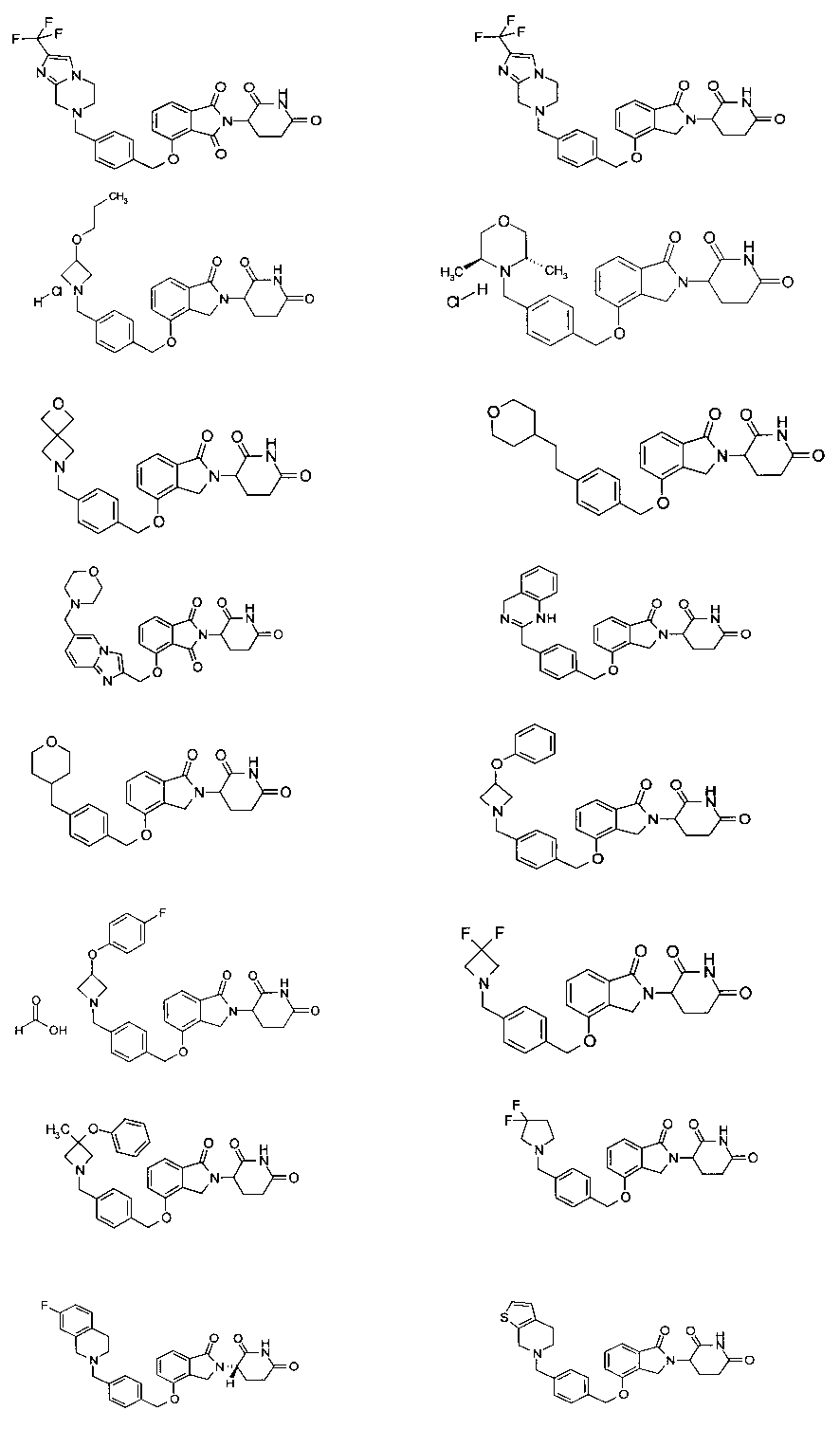
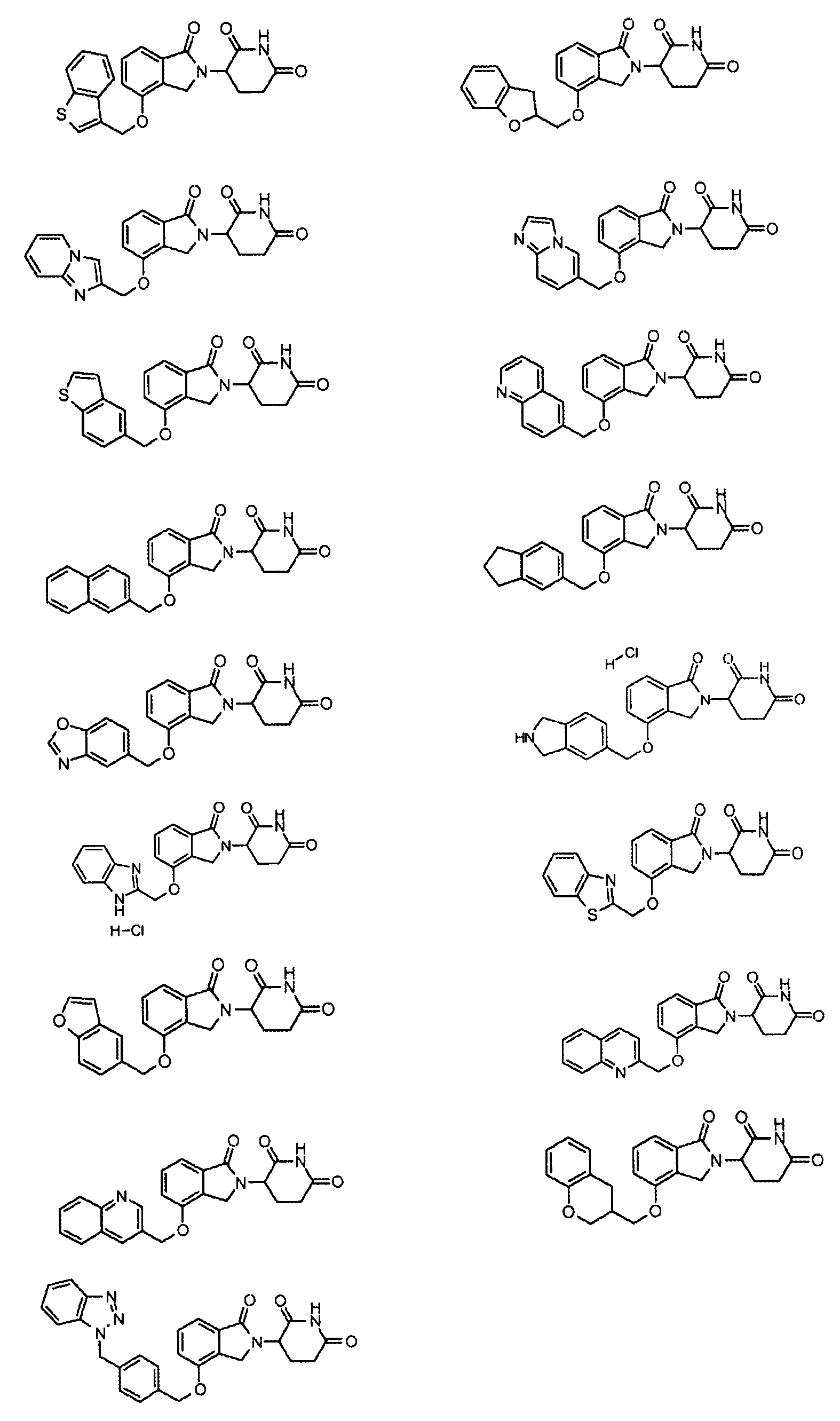
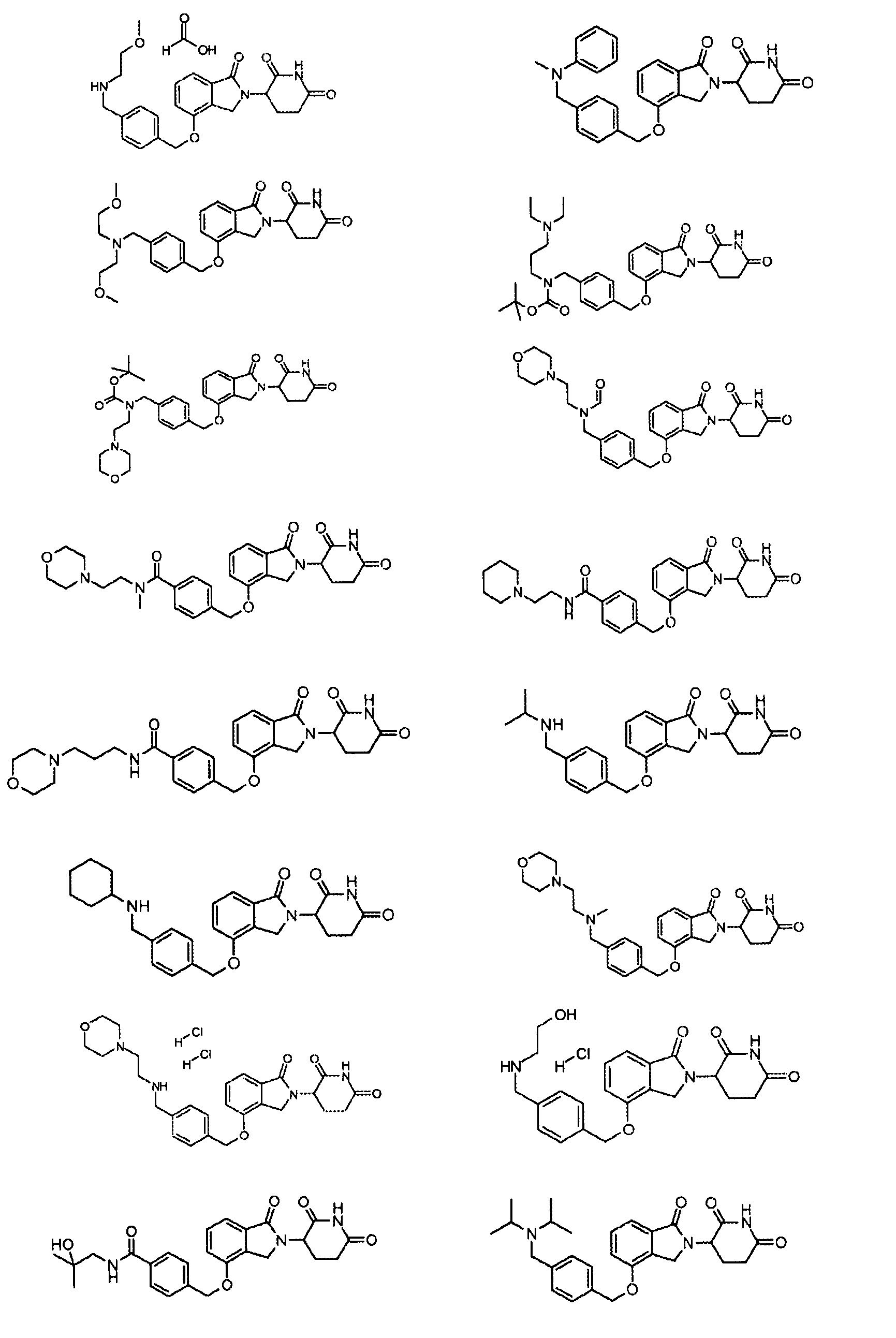
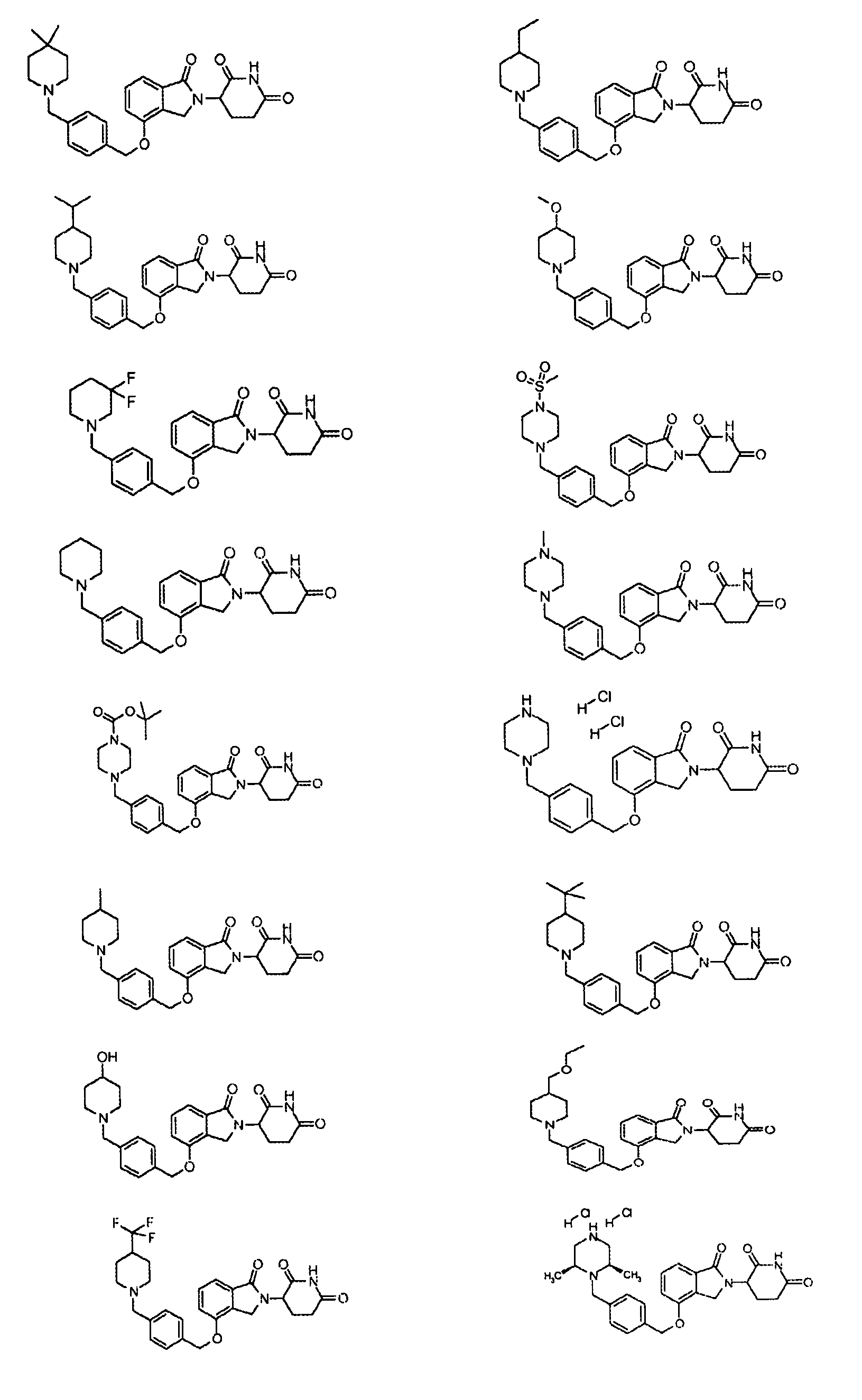
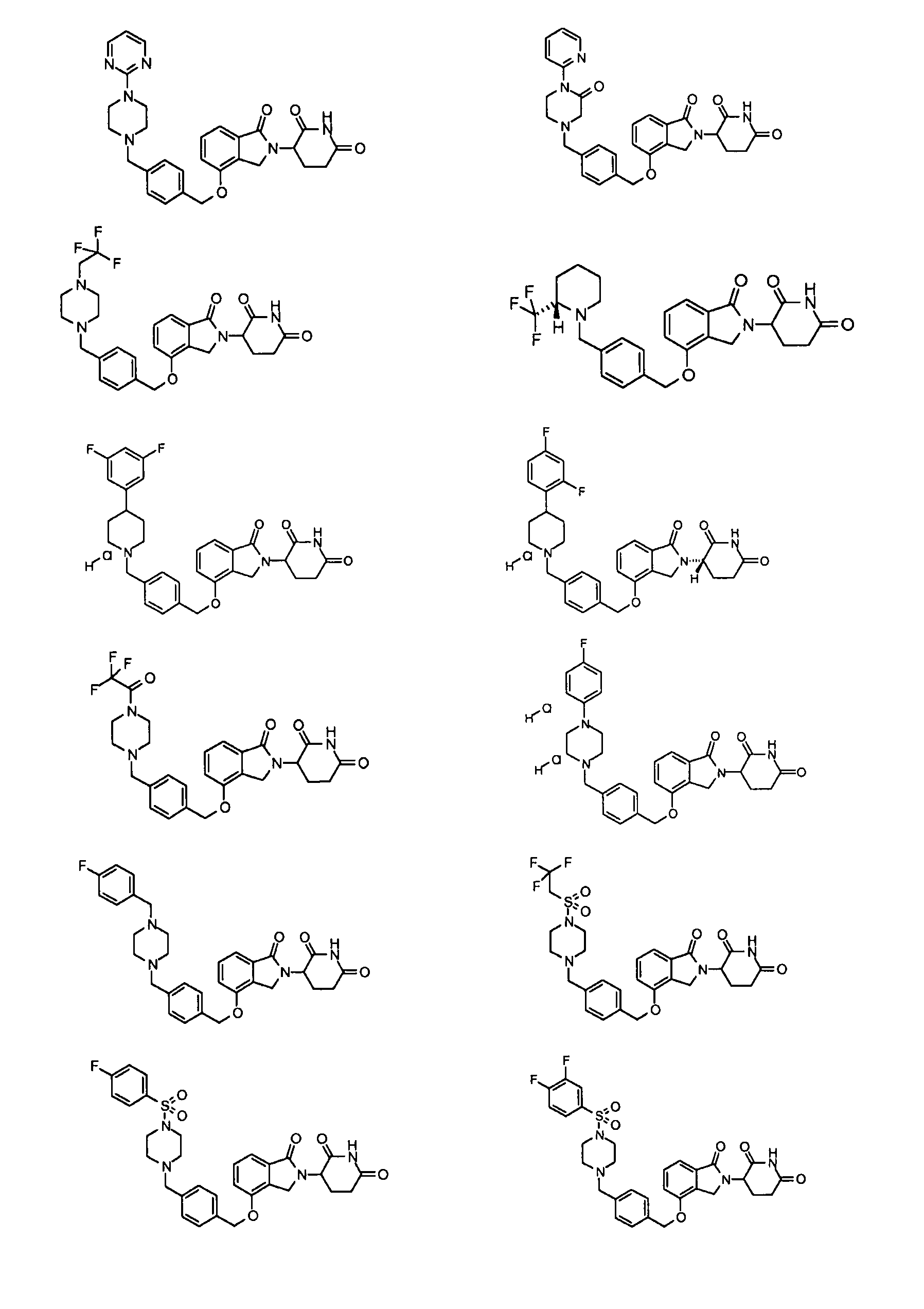
В одном варианте осуществления примеры включают, но не ограничены ими:
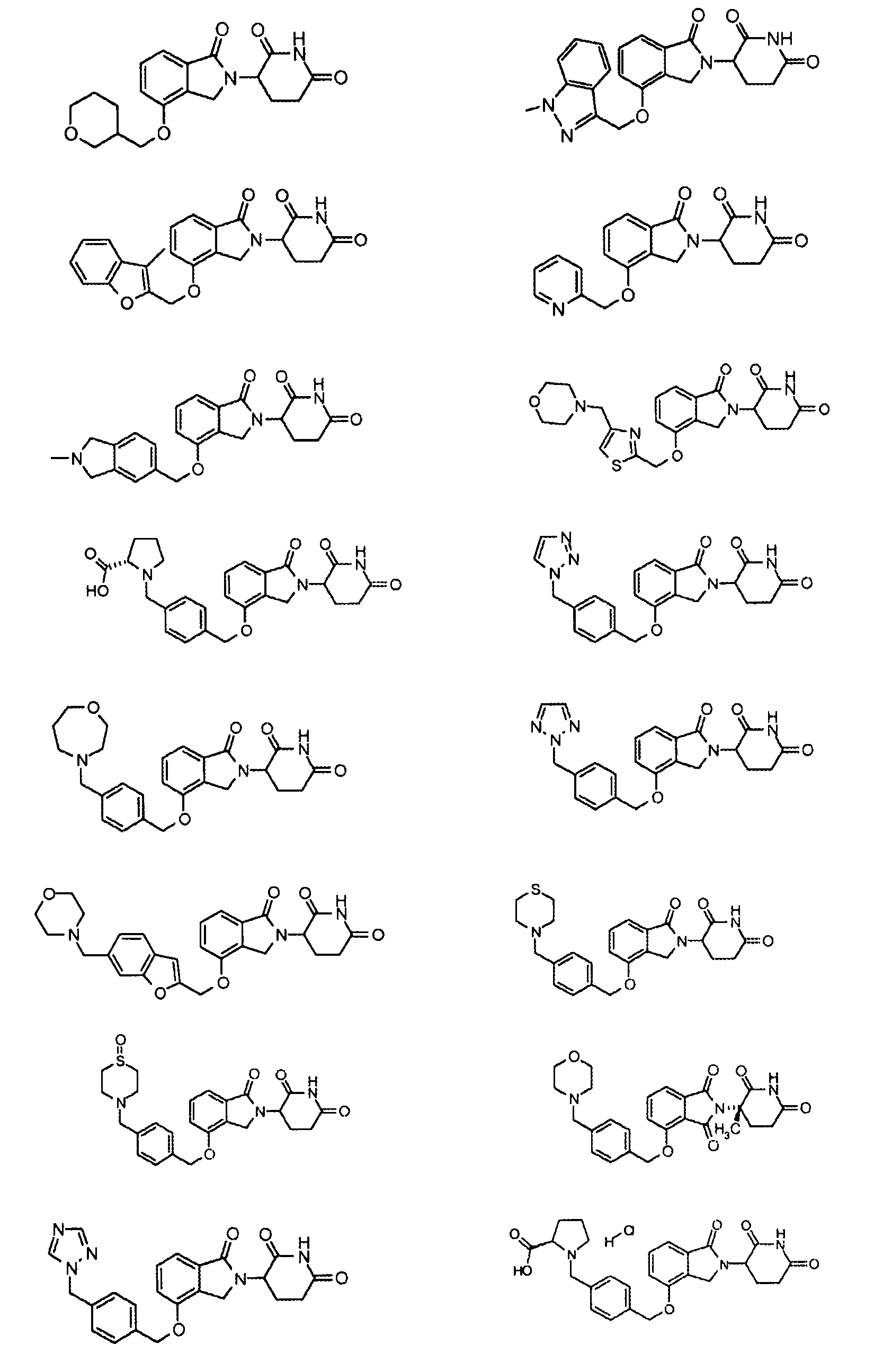
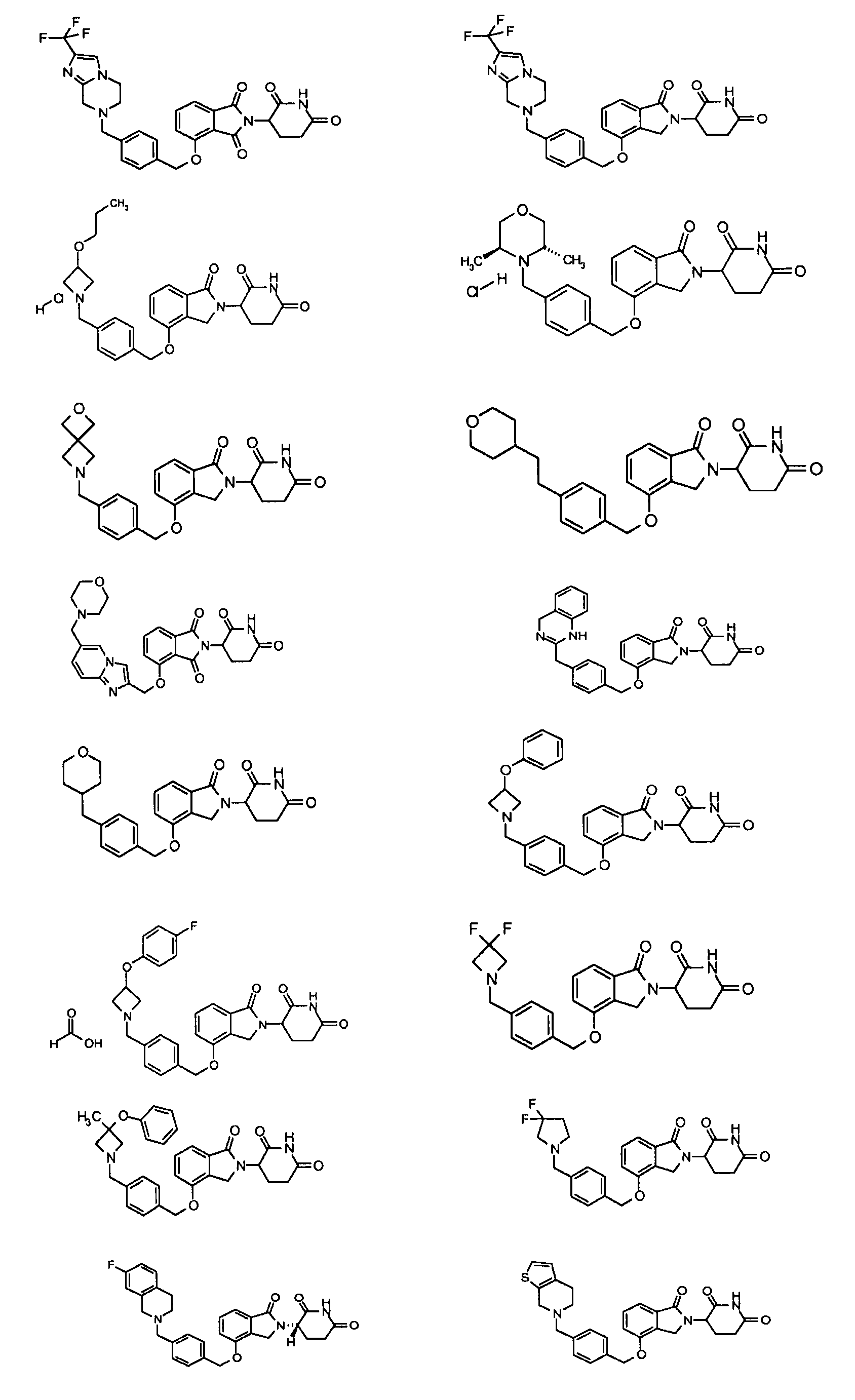
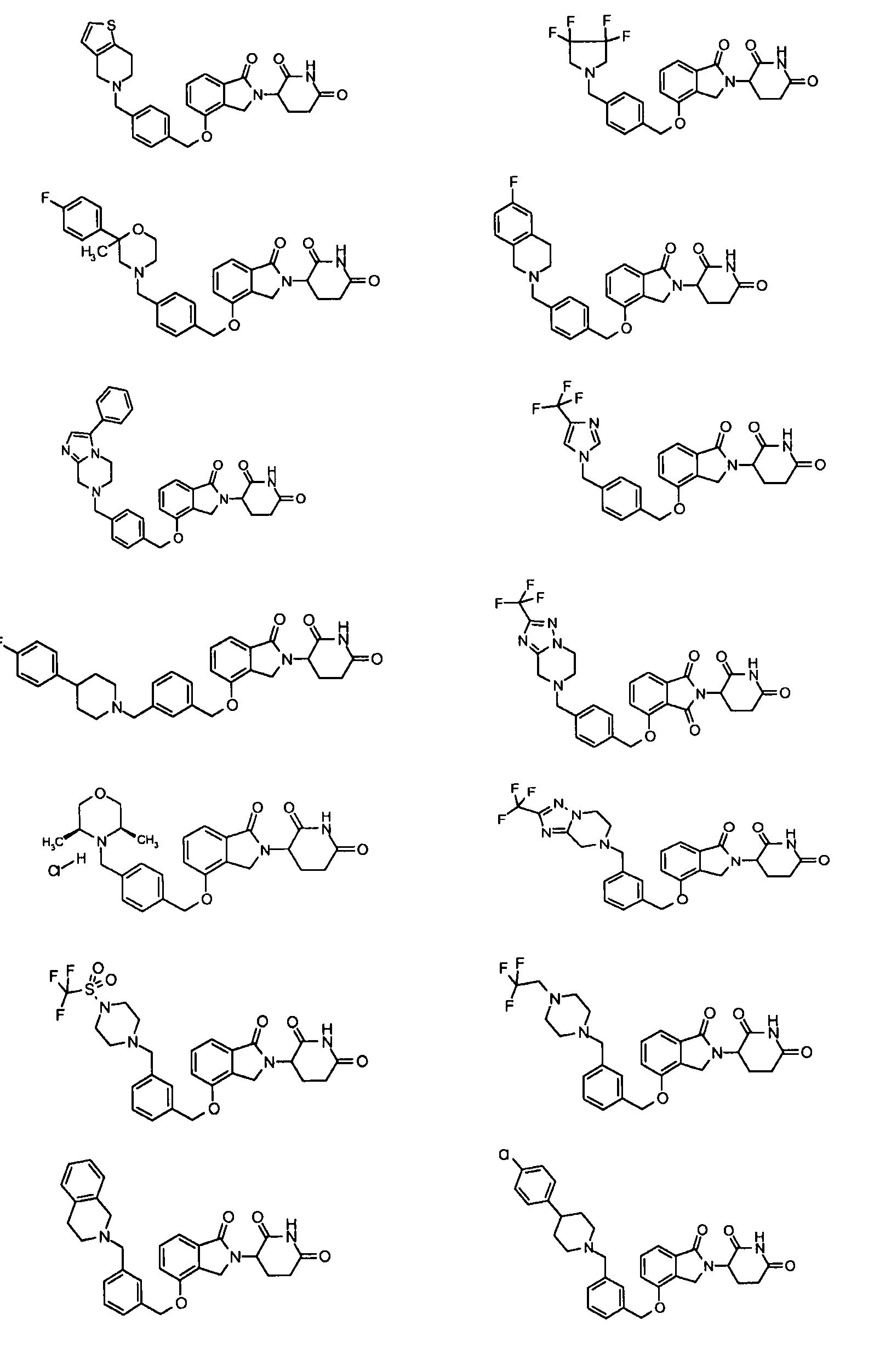
 ,
,
или их фармацевтически приемлемую соль, сольват или стереоизомер.
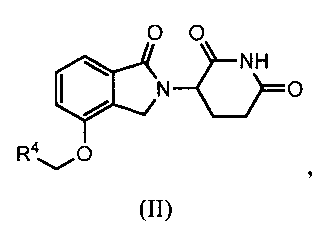
В другом варианте осуществления изобретение относится к соединению формулы (II):
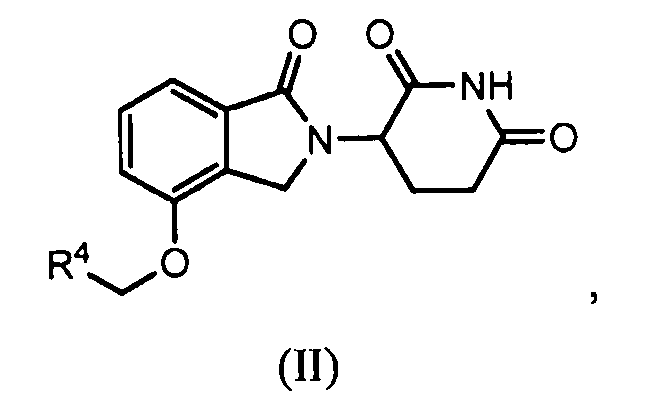
или к его фармацевтически приемлемой соли, сольвату или стереоизомеру, в которой:
R4 обозначает незамещенное 9-10-членное бициклическое кольцо, представляющее собой бензотиазол, хинолин, изохинолин, нафталин, 2,3-дигидро-1Н-инден, бензо[d][1,2,3]триазол, имидазо[1,2-а]пиридин, бензофуран, 2,3-дигидробензофуран, бензотиофен, бензо[d]оксазол изоиндолин или хроман;
при условии, что, если бициклическое кольцо представляет собой бензофуран или бензотиофен, то кольцо не связано с изоиндольным кольцом через положение 2.
В одном варианте осуществления R4 обозначает бензотиазол. В другом варианте осуществления R4 обозначает хинолин. В другом варианте осуществления R4 обозначает изохинолин. В другом варианте осуществления R4 обозначает нафталин. В другом варианте осуществления R4 обозначает 2,3-дигидро-1Н-инден. В другом варианте осуществления R4 обозначает бензо[d][1,2,3]триазол. В другом варианте осуществления R4 обозначает имидазо[1,2-a]пиридин. В другом варианте осуществления R4 обозначает бензофуран. В другом варианте осуществления R4 обозначает 2,3-дигидробензофуран. В другом варианте осуществления R4 обозначает бензотиофен. В другом варианте осуществления R4 обозначает бензо[d]оксазол изоиндолин. В другом варианте осуществления R4 обозначает хроман.
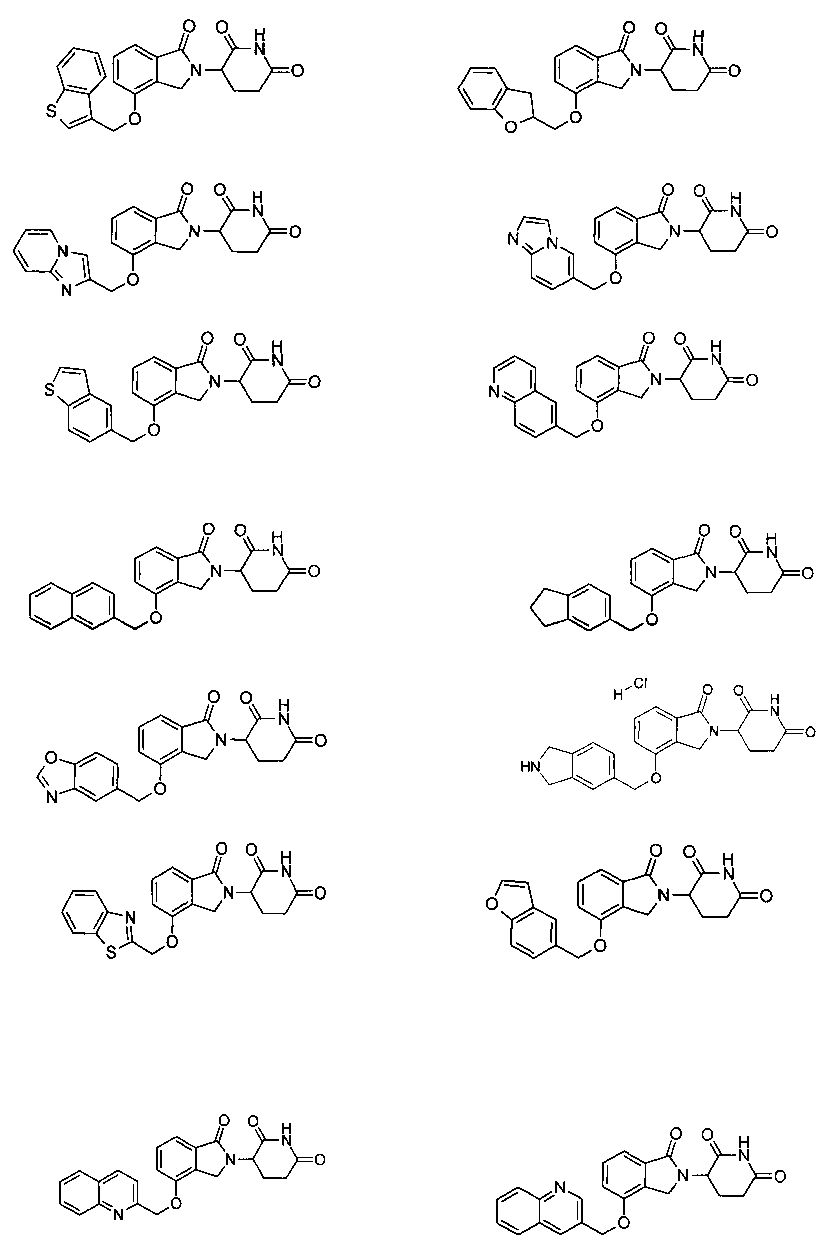
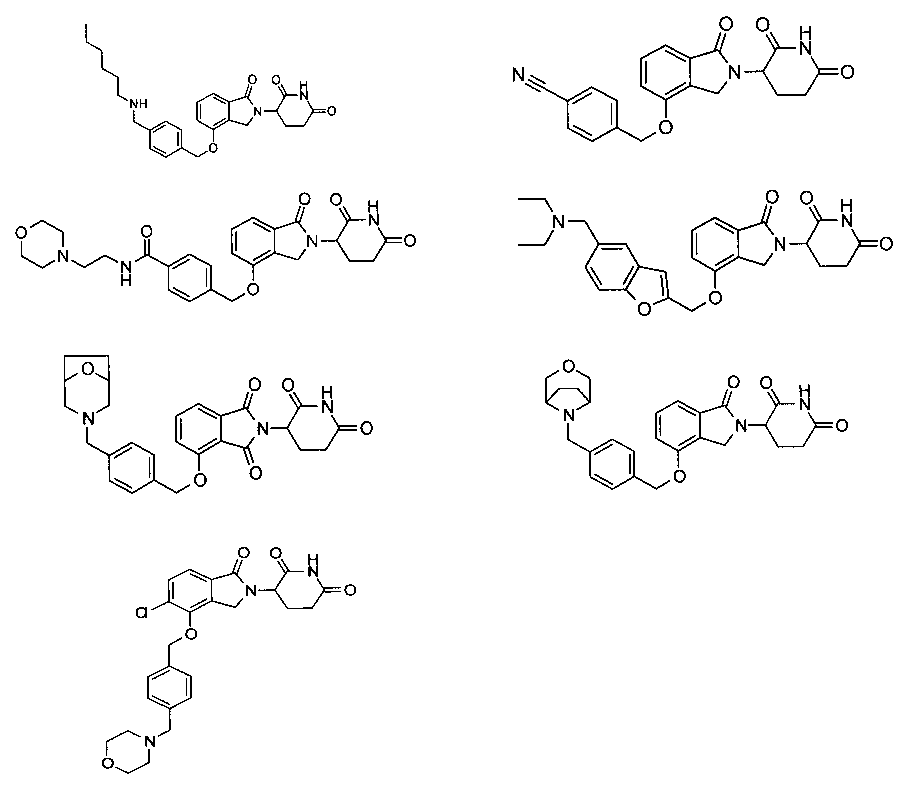
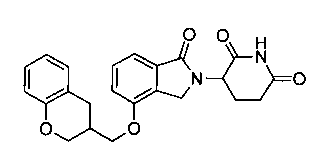
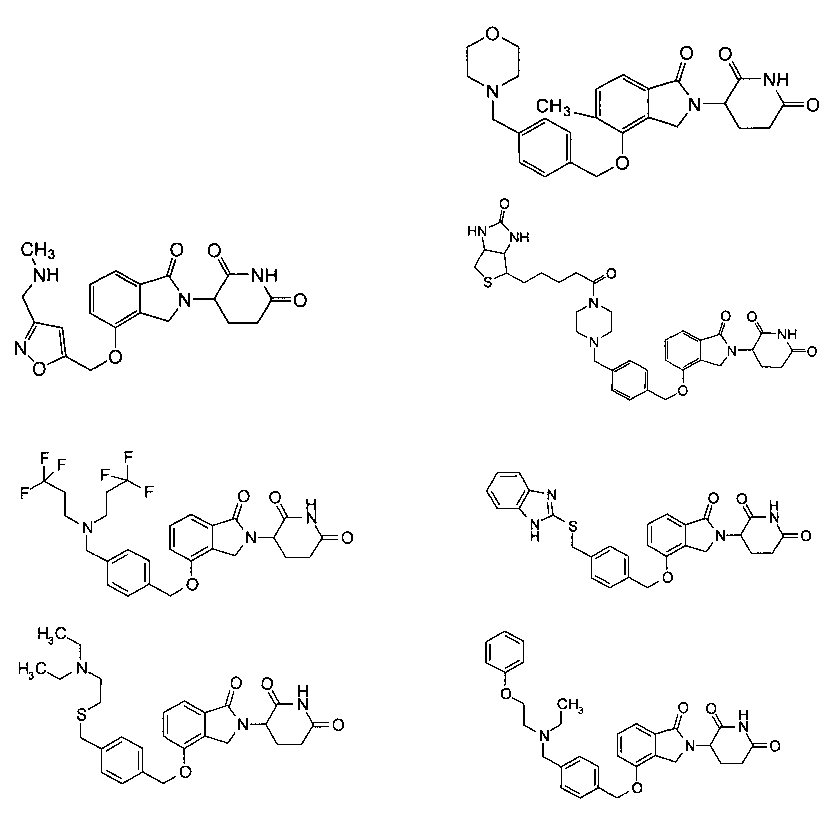
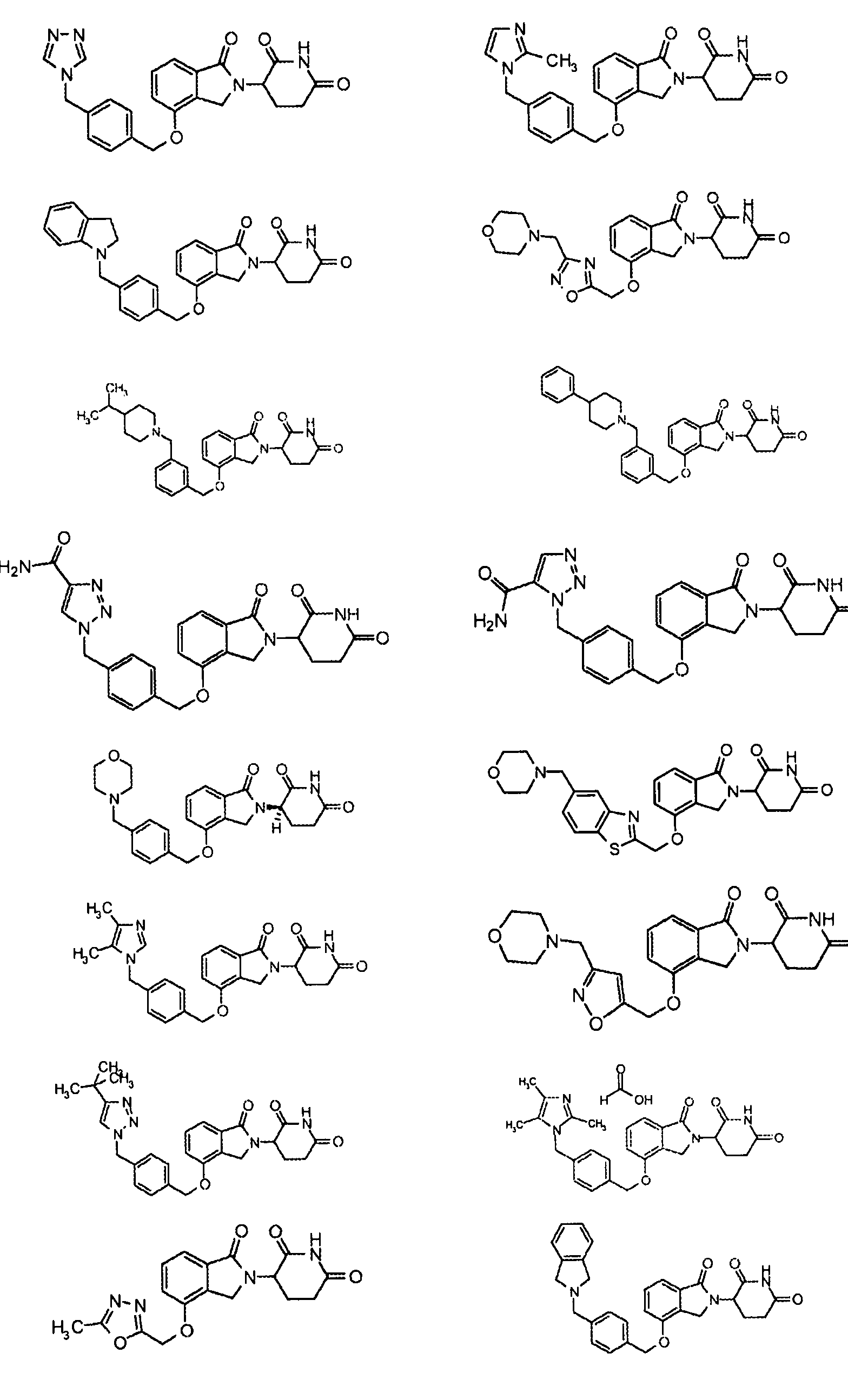
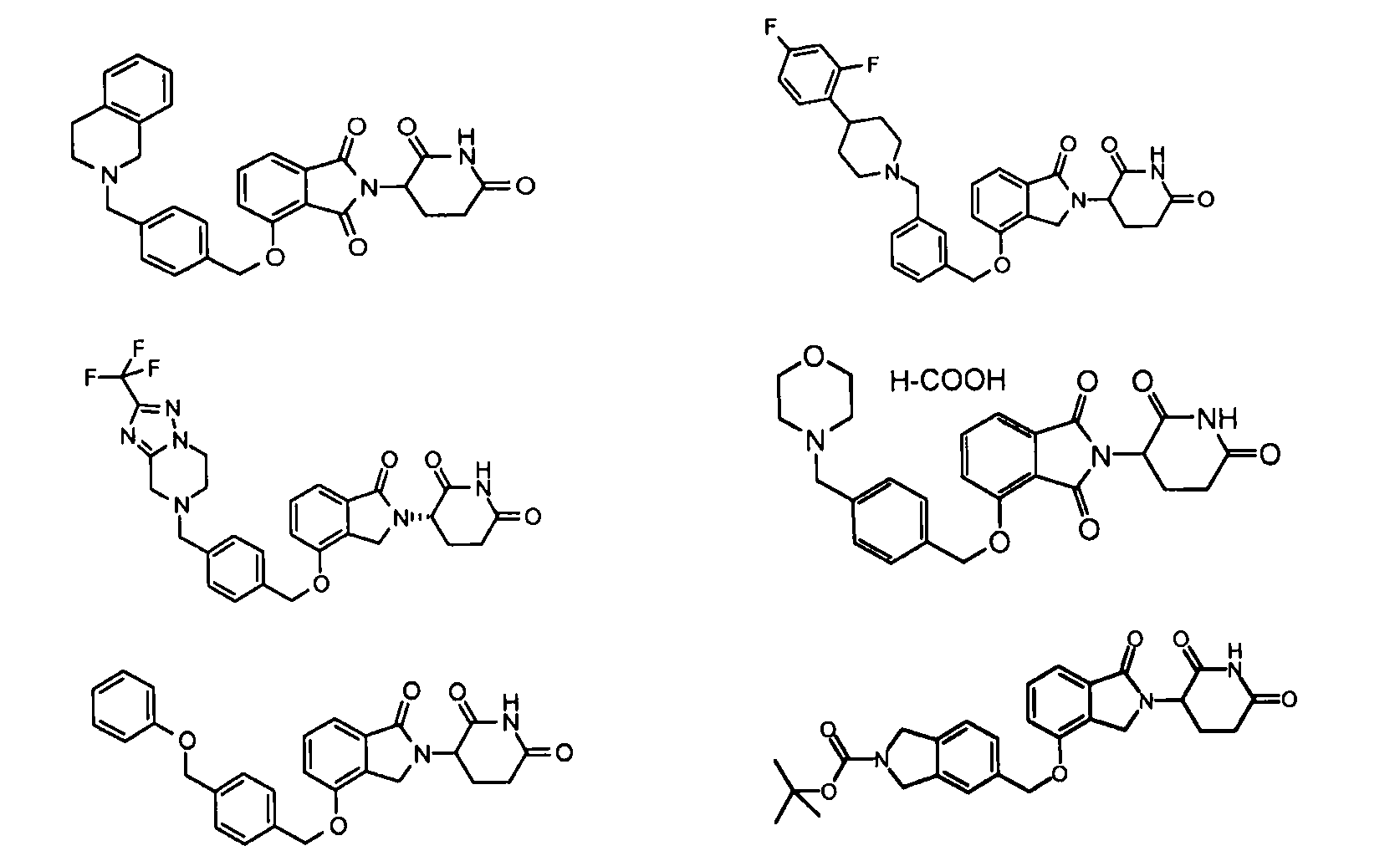
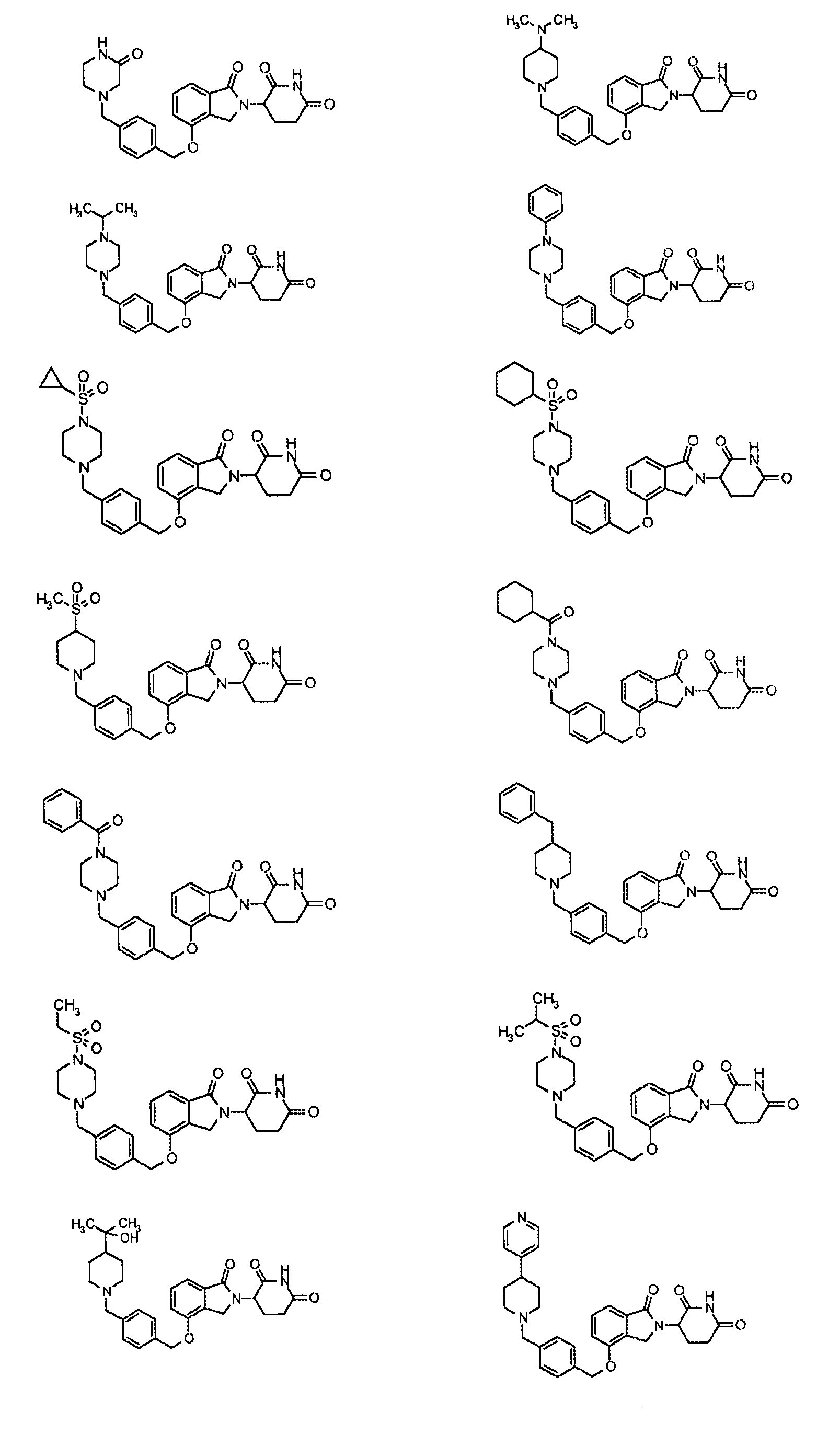
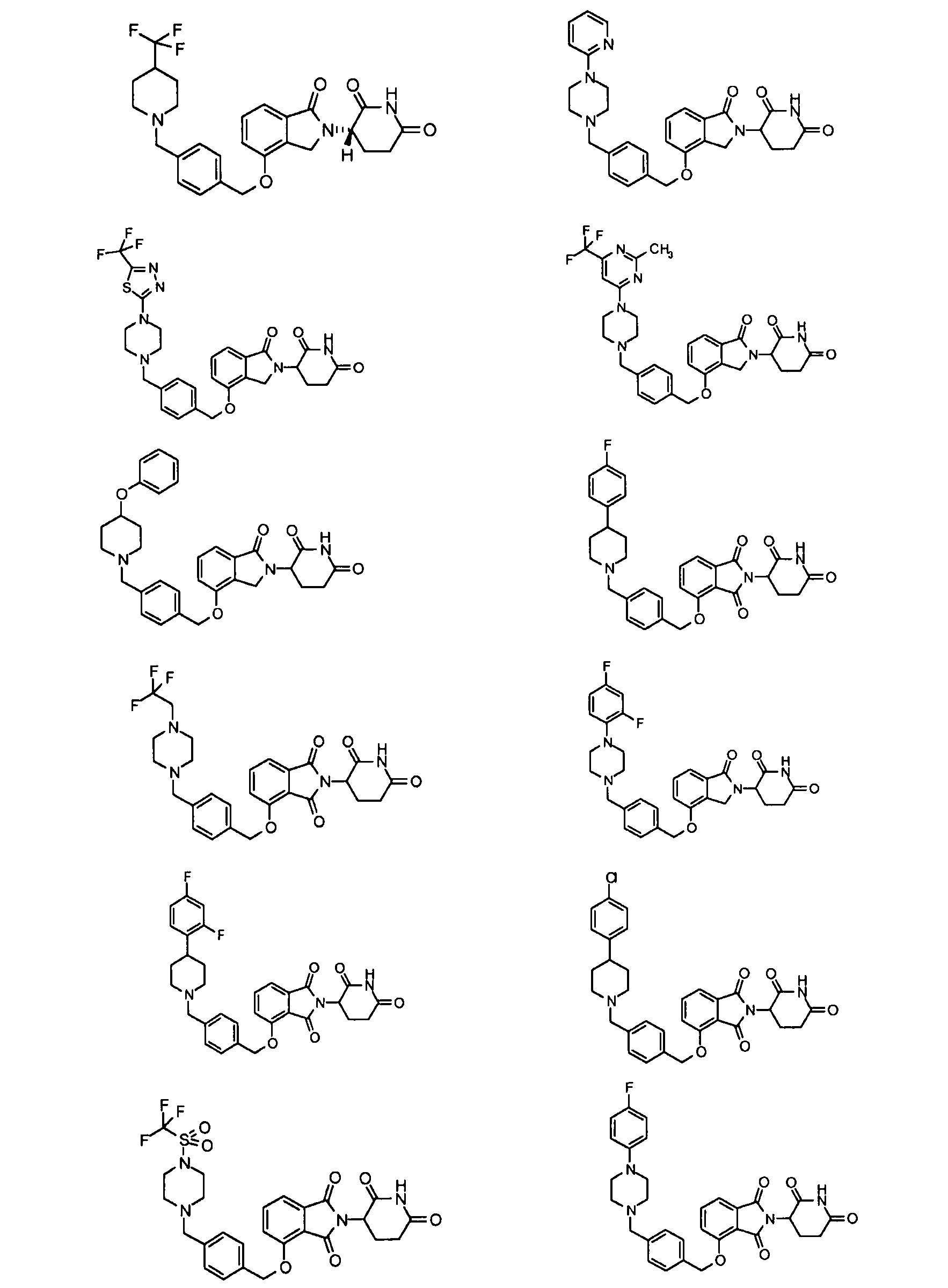
В одном варианте осуществления частные примеры включают, но не ограничены ими:
 ,
,
или их фармацевтически приемлемую соль, сольват или стереоизомер.
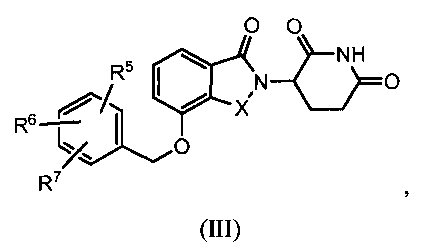
В другом варианте осуществления изобретение относится к соединению формулы (III):
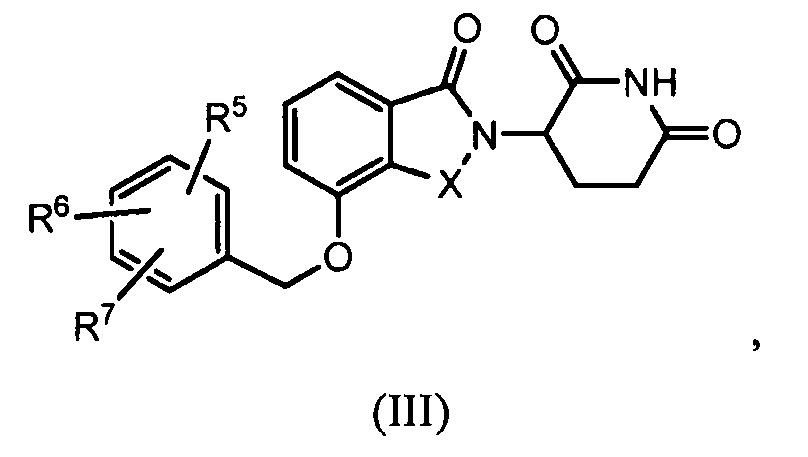
или к его фармацевтически приемлемой соли, сольвату или стереоизомеру, в которой:
X обозначает CH2 или C=O;
R5, R6 и R7 обозначают, каждый независимо, водород, галоген, нитро, карбамоил, амино, -SO2R8, -CONR9R10, -(C1-C6)алкил или -(C1-C6)алкокси, причем указанный алкил или алкокси может быть замещен одним или более галогенами, амино, гидроксилами или NR9R10;
R8 обозначает (C1-C6)алкил, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом; амино, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом; или 6-10-членный гетероцикл, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом;
R9 и R10 обозначают, каждый независимо, водород, 6-10-членный арил, -COO-(C1-C6)алкил, -(C0-C6)алкил-CHO, -(C0-C6)алкил-COOH, -(C0-C6)алкил-NR9'R10', -(C0-C6)алкил-(5-10-членный гетероцикл), -(C1-C6)алкил-ОН, -(C1-C6)алкил-О-(C1-C6)алкил, (C1-C6)алкил или (C3-C6)циклоалкил; или
R9 и R10 вместе могут образовывать в случае необходимости замещенное 5-6-членное кольцо, содержащее один или более гетероатомов; и
R9' и R10' обозначают, каждым независимо, водород или (C1-C6)алкил;
при условии, что все R5-R7 не могут быть водородом; и
при условии, что, если один из R5-R7 обозначает водород и остальные два из R5-R7 оба являются хлором, тогда два атома хлора не могут быть в положениях 3 и 4 фенильного кольца.
В одном варианте осуществления R5 обозначает водород. В другом варианте осуществления R5 обозначает галоген. В другом варианте осуществления R5 обозначает нитро. В другом варианте осуществления R5 обозначает карбамоил. В другом варианте осуществления R5 обозначает амино. В другом варианте осуществления R5 обозначает -SO2R8. В другом варианте осуществления R5 обозначает -CONR9R10. В другом варианте осуществления R5 обозначает -(C1-C6)алкил, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10. В другом варианте осуществления R5 обозначает -(C1-C6)алкокси, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10 .
В одном варианте осуществления R6 обозначает водород. В другом варианте осуществления R6 обозначает галоген. В другом варианте осуществления R6 обозначает нитро. В другом варианте осуществления R6 обозначает карбамоил. В другом варианте осуществления R6 обозначает амино. В другом варианте осуществления R6 обозначает -SO2R8. В другом варианте осуществления R6 обозначает -CONR9R10. В другом варианте осуществления R6 обозначает -(C1-C6)алкил, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10. В другом варианте осуществления R6 обозначает -(C1-C6)алкокси, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10 .
В одном варианте осуществления R7 обозначает водород. В другом варианте осуществления R7 обозначает галоген. В другом варианте осуществления R7 обозначает нитро. В другом варианте осуществления R7 обозначает карбамоил. В другом варианте осуществления R7 обозначает амино. В другом варианте осуществления R7 обозначает -SO2R8. В другом варианте осуществления R7 обозначает -CONR9R10. В другом варианте осуществления R7 обозначает -(C1-C6)алкил, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10. В другом варианте осуществления R7 обозначает -(C1-C6)алкокси, в случае необходимости замещенный одним или более галогенами, амино, гидроксилами или NR9R10 .
В одном варианте осуществления R8 обозначает (C1-C6)алкил, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом. В другом варианте осуществления R8 обозначает амино, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом. В другом варианте осуществления R8 обозначает 6-10 членный гетероцикл, в случае необходимости замещенный (C1-C6)алкилом или (C6-C10)арилом.
В одном варианте осуществления R9 обозначает водород. В другом варианте осуществления R9 обозначает 6-10-членный арил. В другом варианте осуществления R9 обозначает -COO-(C1-C6)алкил. В другом варианте осуществления R9 обозначает -(C0-C6)алкил-CHO. В другом варианте осуществления R9 обозначает -(C0-C6)алкил-COOH. В другом варианте осуществления R9 обозначает -(C0-C6)алкил-NR9'R10'. В другом варианте осуществления R9 обозначает -(C0-C6)алкил-(5-10-членный гетероцикл). В другом варианте осуществления R9 обозначает -(C1-C6)алкил-OH. В другом варианте осуществления R9 обозначает -(C1-C6)алкил-O-(C1-C6)алкил. В другом варианте осуществления R9 обозначает (C1-C6)алкил. В другом варианте осуществления R9 обозначает (C3-C6)циклоалкил.
В одном варианте осуществления R10 обозначает водород. В другом варианте осуществления R10 обозначает 6-10-членный арил. В другом варианте осуществления R10 обозначает -COO-(C1-C6)алкил. В другом варианте осуществления R10 обозначает -(C0-C6)алкил-CHO. В другом варианте осуществления R10 обозначает -(C0-C6)алкил-COOH. В другом варианте осуществления R10 обозначает -(C0-C6)алкил-NR9'R10'. В другом варианте осуществления R10 обозначает -(C0-C6)алкил-(5-10-членный гетероцикл). В другом варианте осуществления R10 обозначает -(C1-C6)алкил-OH. В другом варианте осуществления R10 обозначает -(C1-C6)алкил-O-(C1-C6)алкил. В другом варианте осуществления R10 обозначает -(C1-C6)алкил. В другом варианте осуществления R10 обозначает (C3-C6)циклоалкил.
В одном варианте осуществления R9 и R10 вместе образуют 5-6-членное кольцо. В одном варианте осуществления кольцо содержит один или более гетероатомов. В одном варианте осуществления гетероатомы выбраны из группы, состоящей из N, S и O.
В одном варианте осуществления R9' обозначает водород. В другом варианте осуществления R9' обозначает (C1-C6)алкил.
В одном варианте осуществления R10' обозначает водород. В другом варианте осуществления R10' обозначает (C1-C6)алкил.
В некоторых вариантах осуществления изобретение относится к соединениям, которые следуют из любой комбинации R5-R10 и R9'-R10'.
В одном варианте осуществления один из R5-R7 обозначает водород, и остальные два из R5-R7 обозначают галоген. В одном варианте осуществления один из R5-R7 обозначает водород, и остальные два из R5-R7 обозначают (C1-C6)алкокси. В одном варианте осуществления один из R5-R7 обозначает водород, и остальные два из R5-R7 обозначают (C1-C6)алкил. В одном варианте осуществления R5 обозначает водород, R6 обозначает галоген, и R7 обозначает (C1-C6)алкокси.
В одном варианте осуществления два из R5-R7 обозначают водород, и оставшийся из R5-R7 обозначает галоген. В одном варианте осуществления два из R5-R7 обозначают водород, и оставшийся из R5-R7 обозначает (C1-C6)алкокси. В одном варианте осуществления два из R5-R7 обозначают водород, и оставшийся из R5-R7 обозначает (C1-C6)алкил.
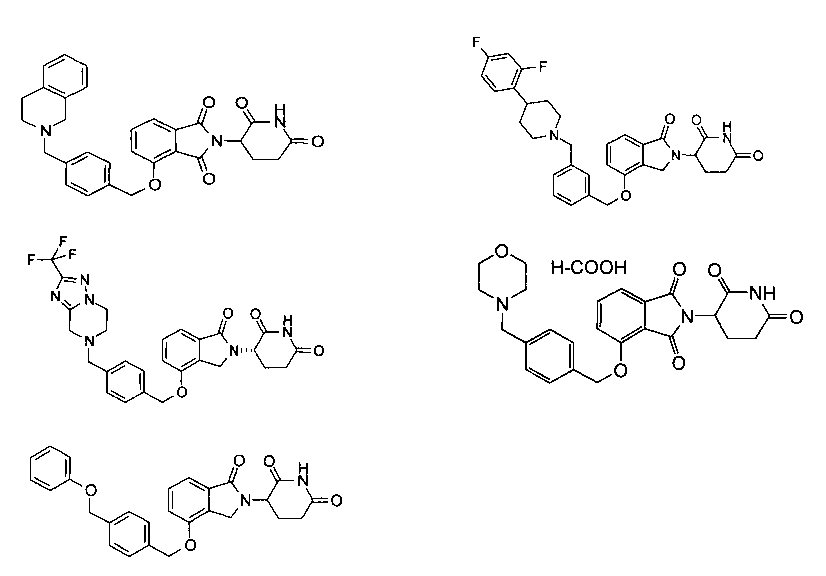
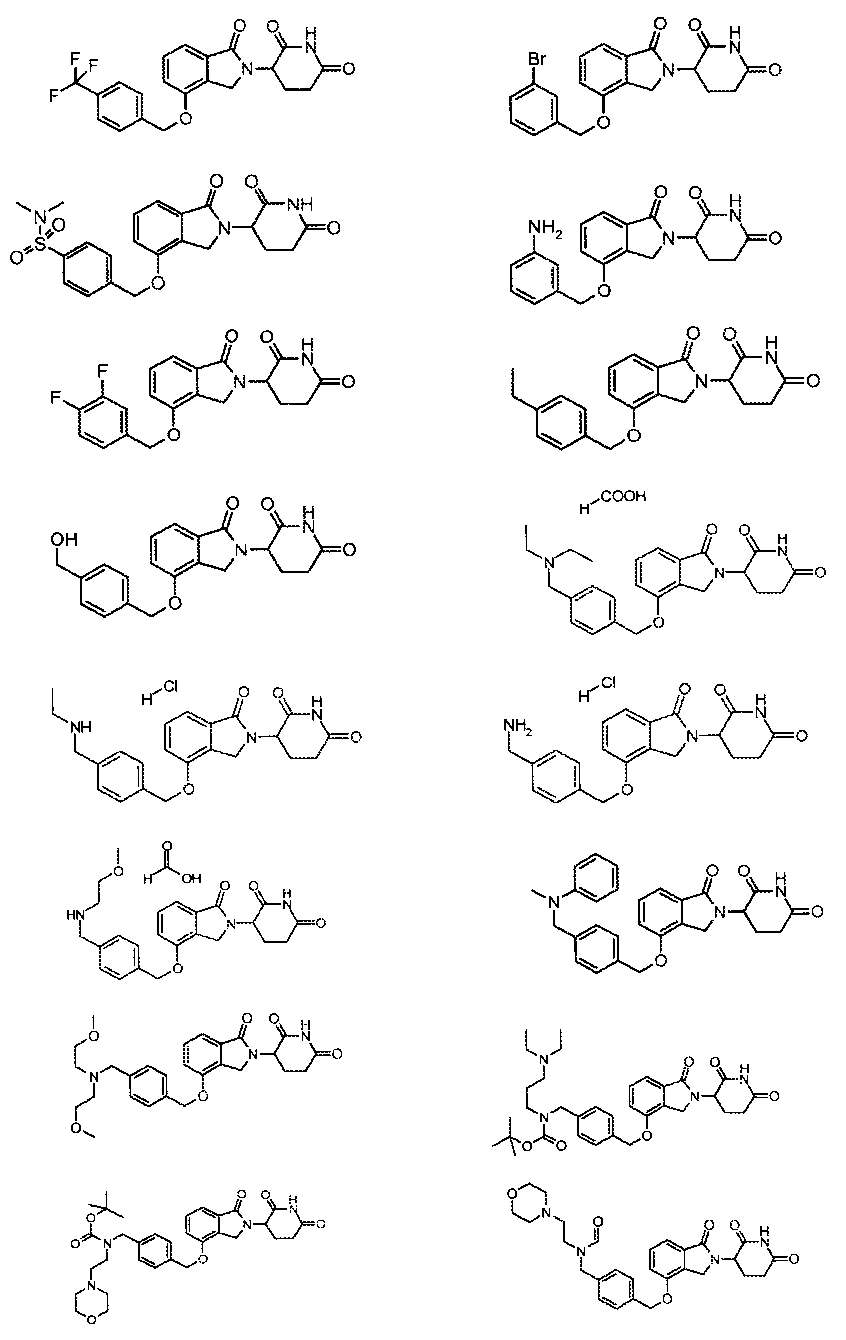
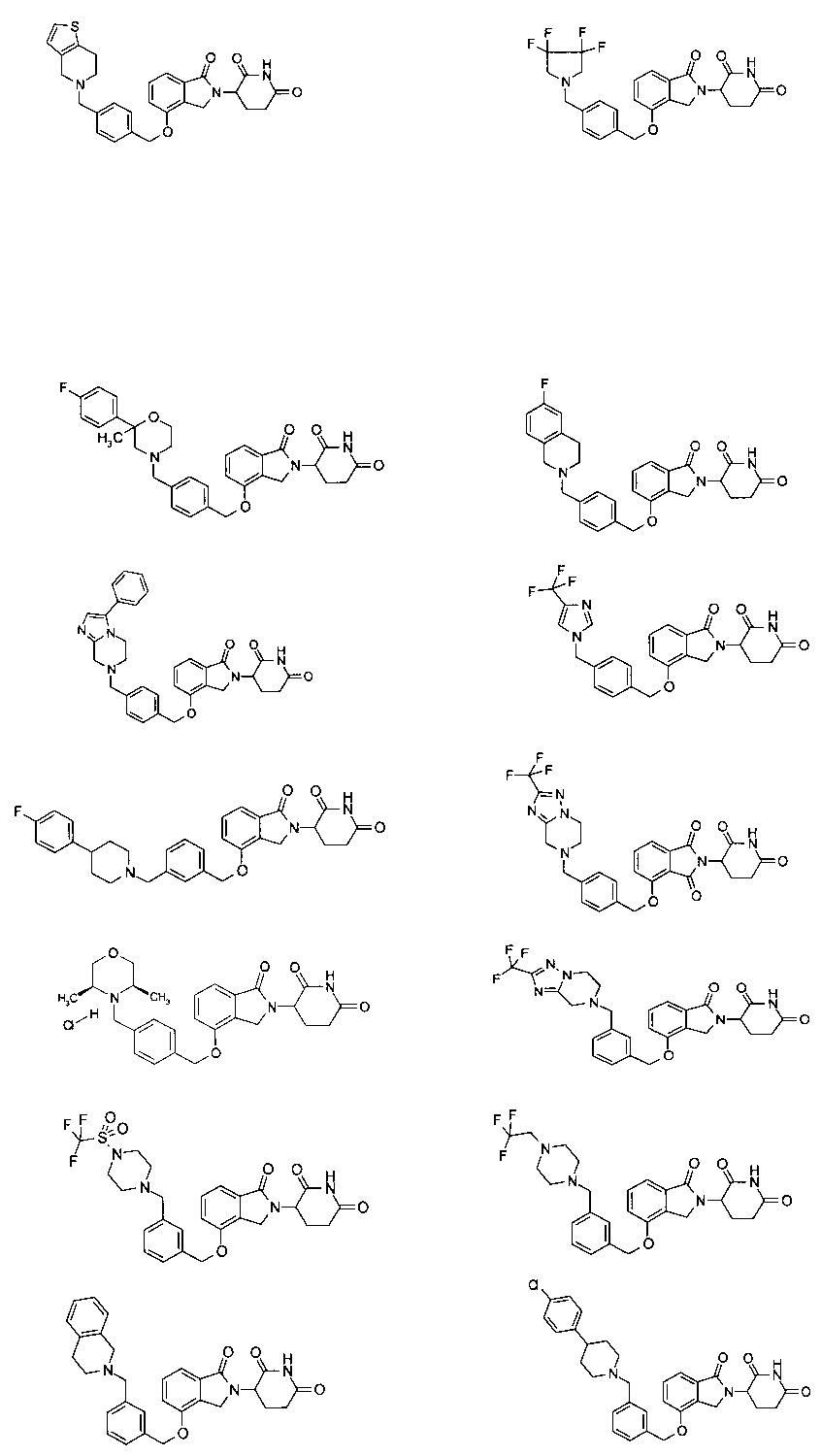
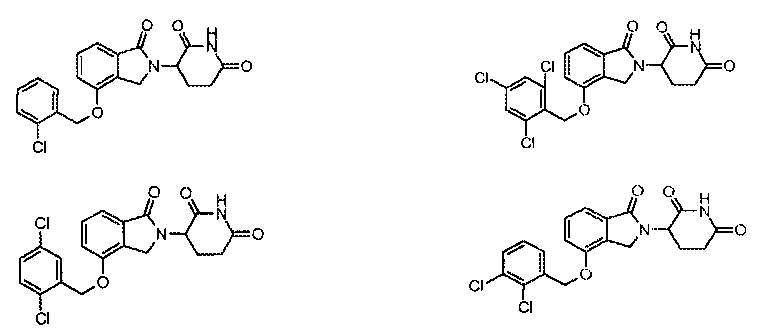
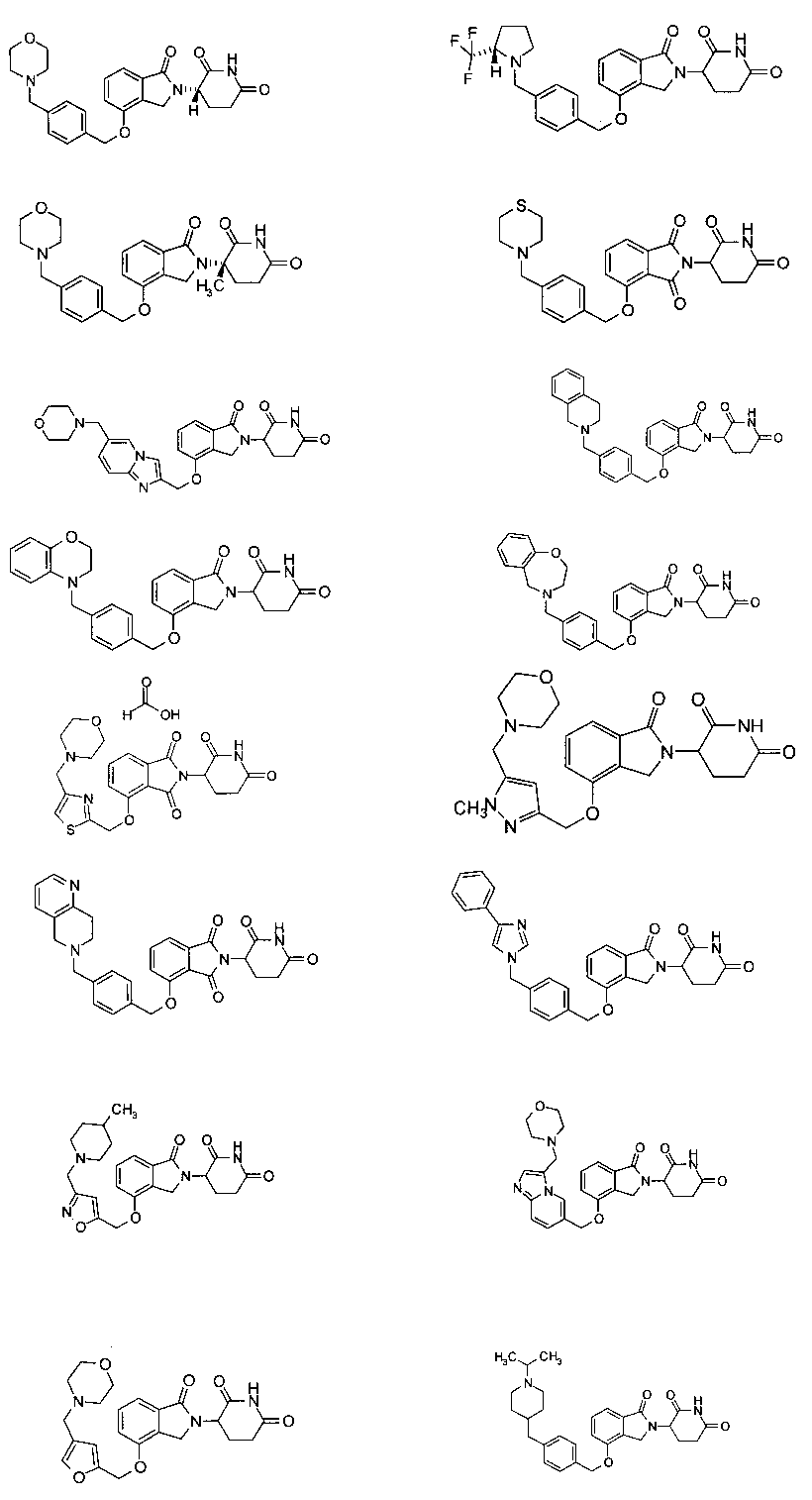
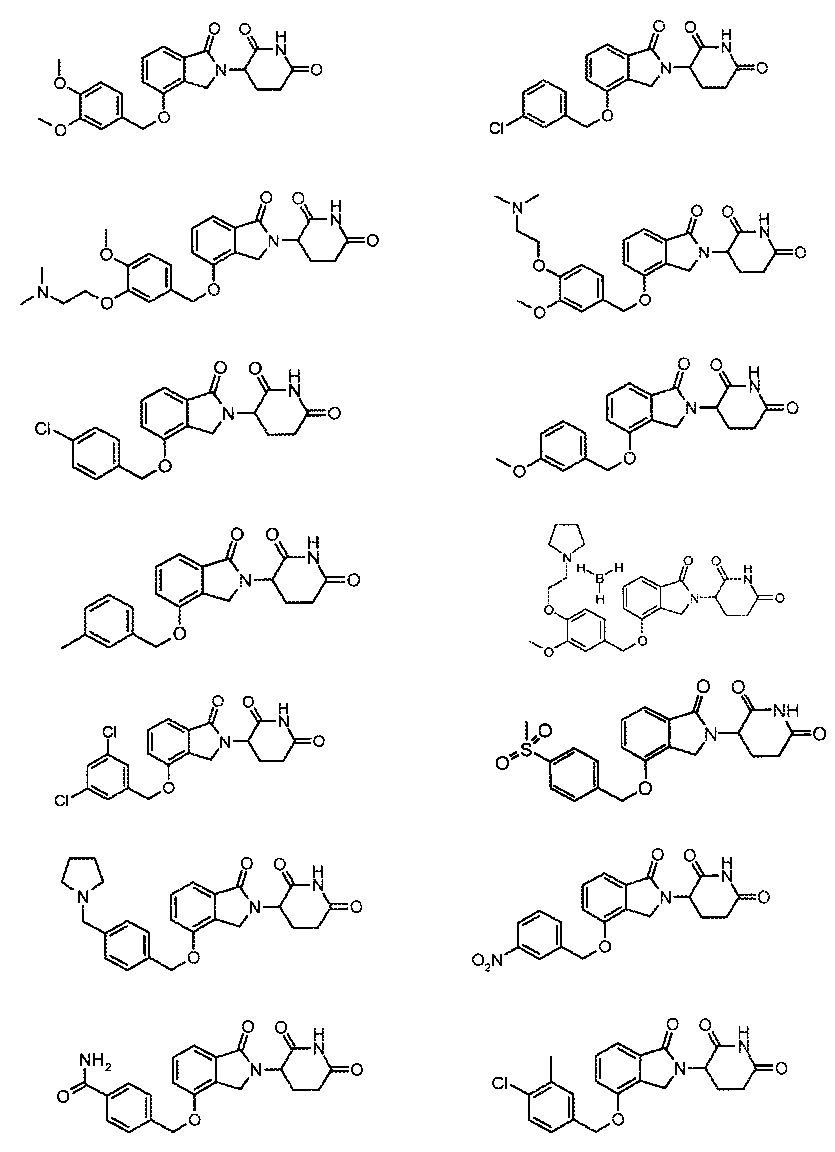
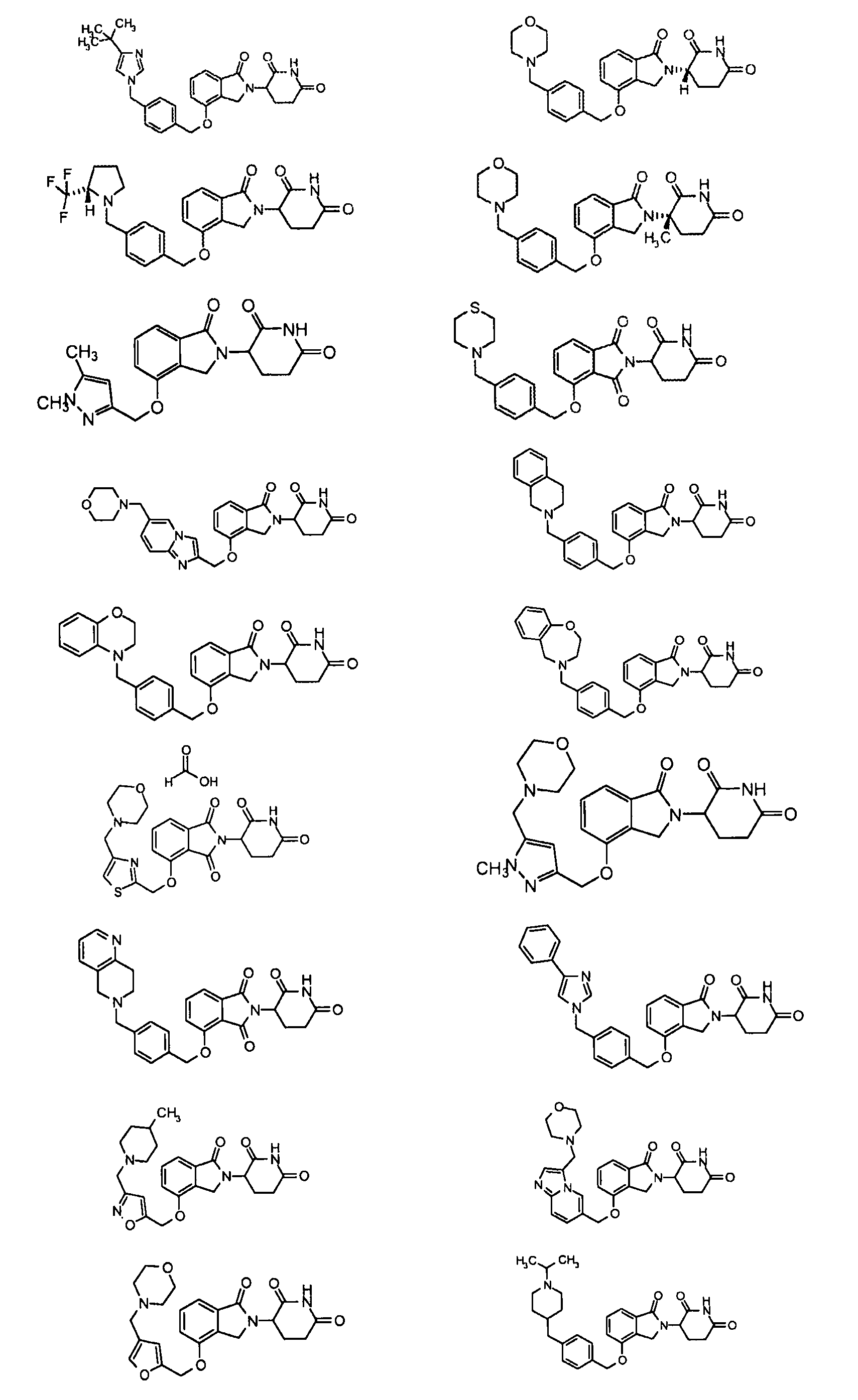
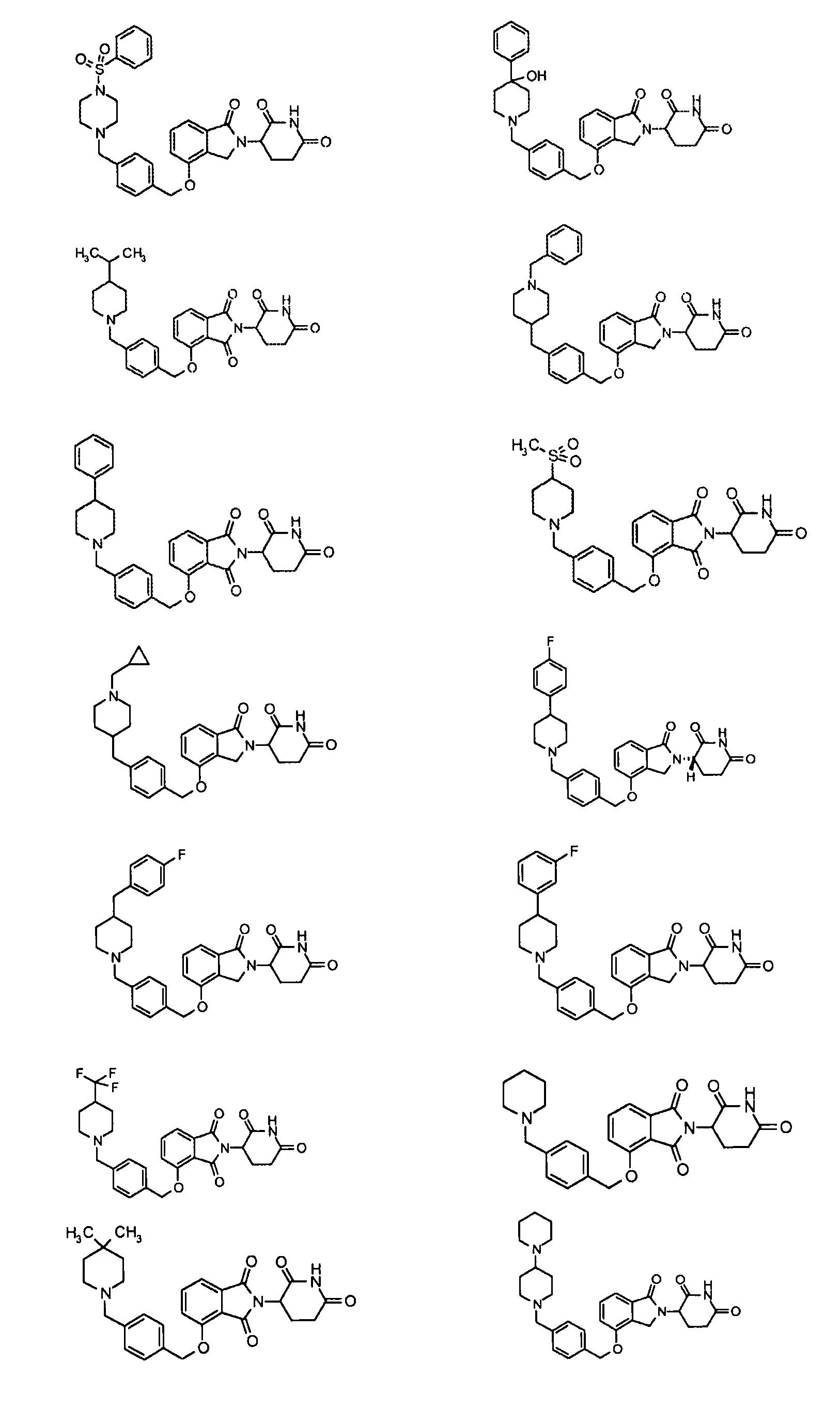
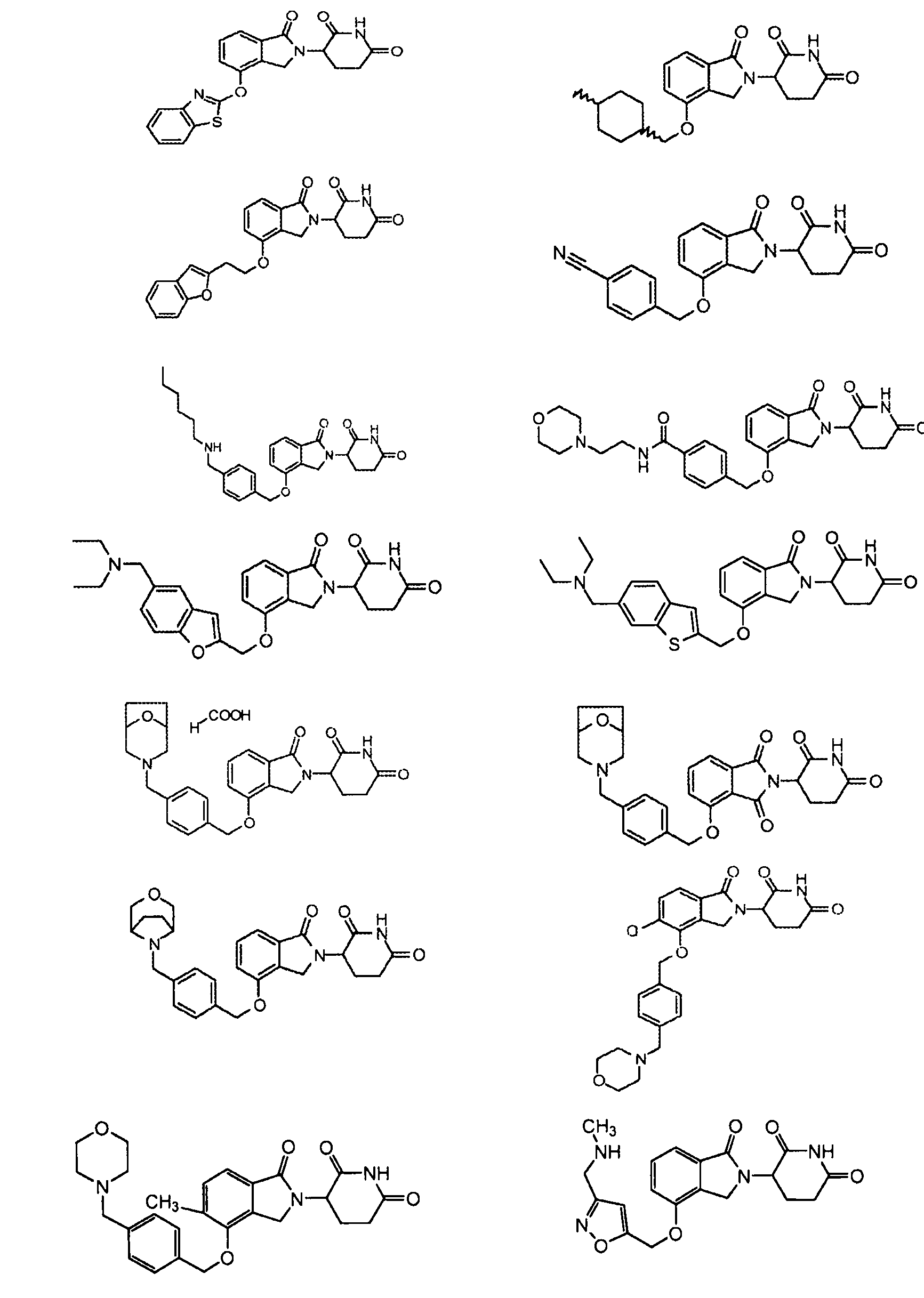
В одном варианте осуществления частные примеры включают, но не ограничены ими:
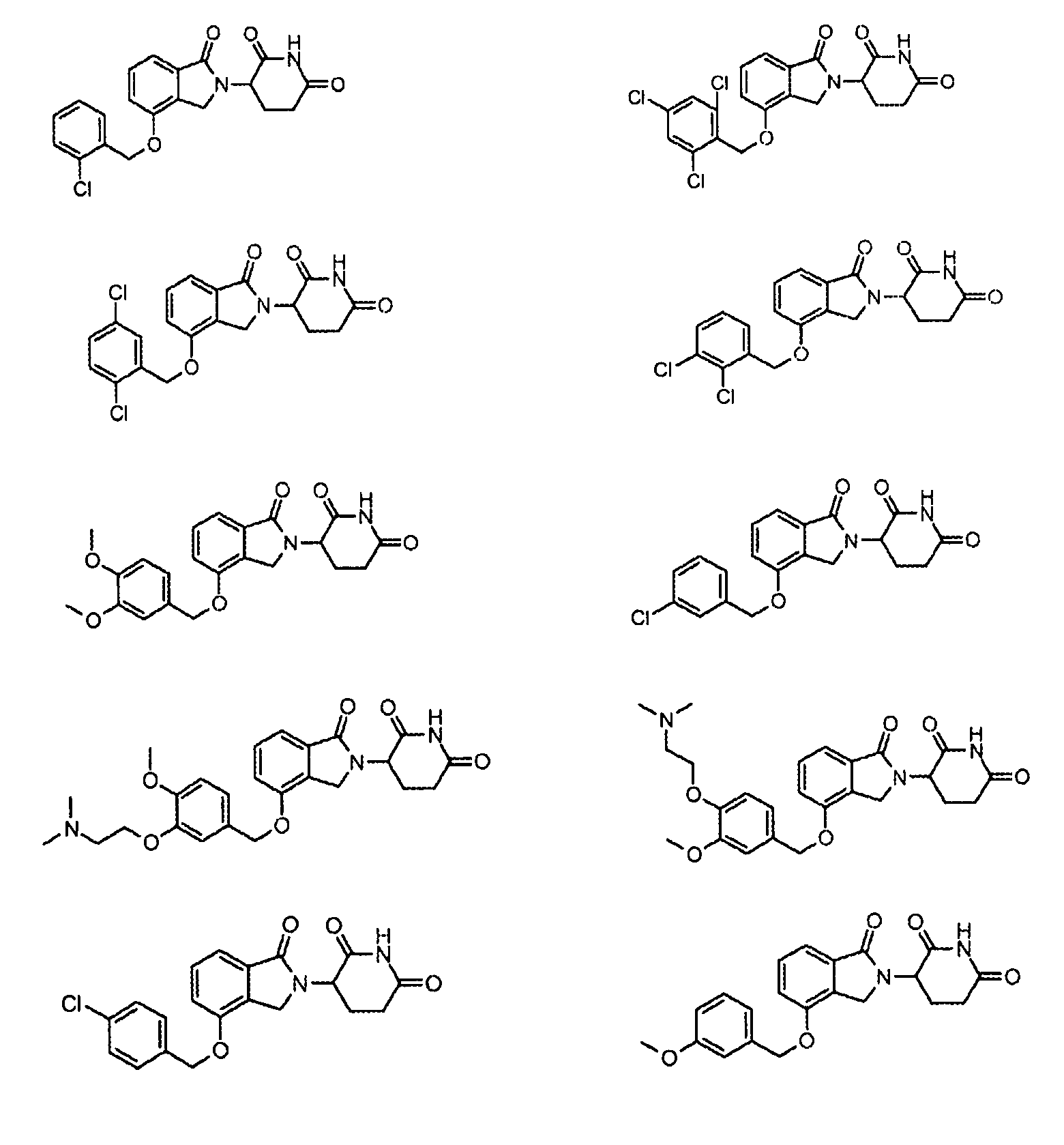
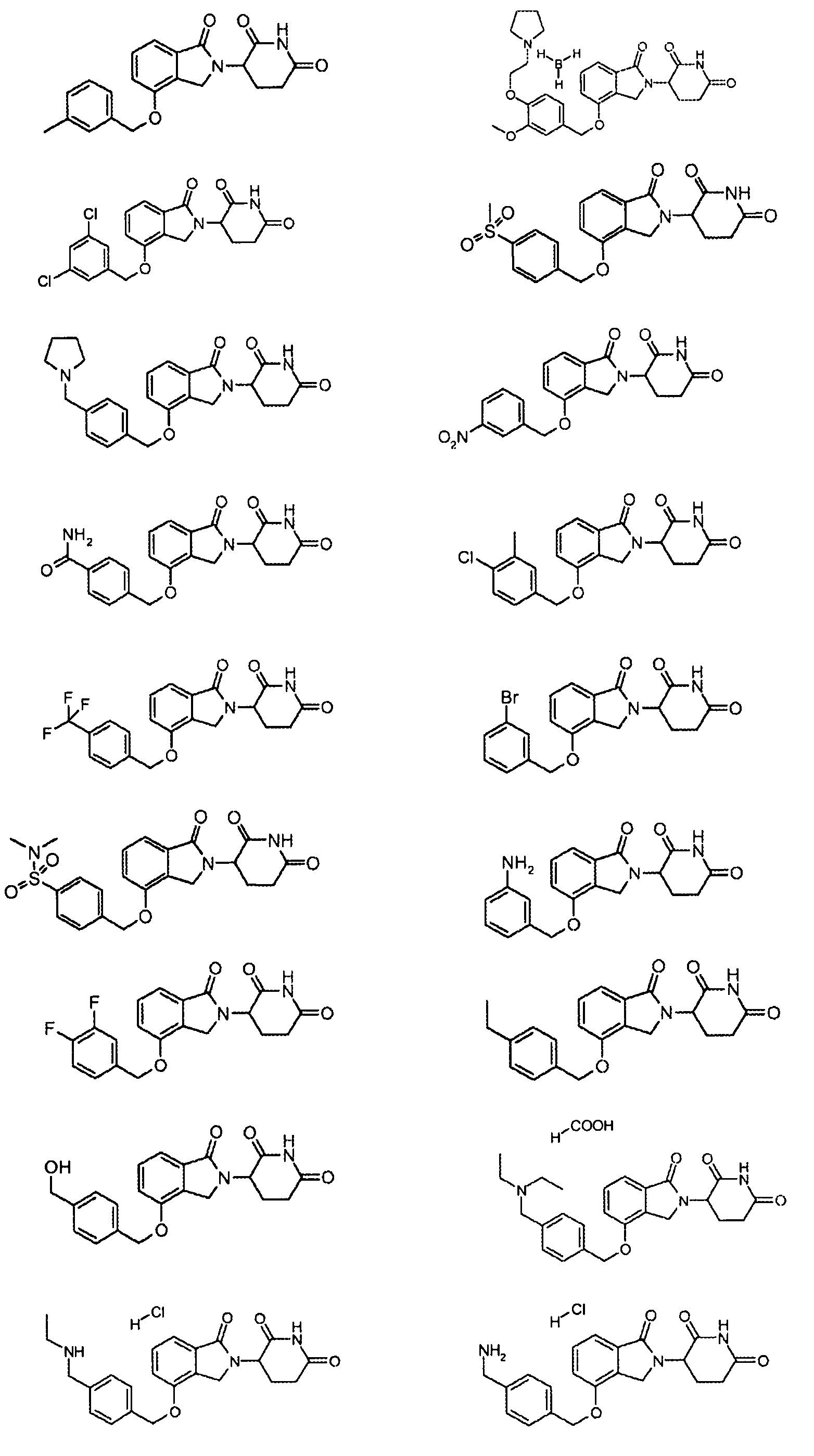
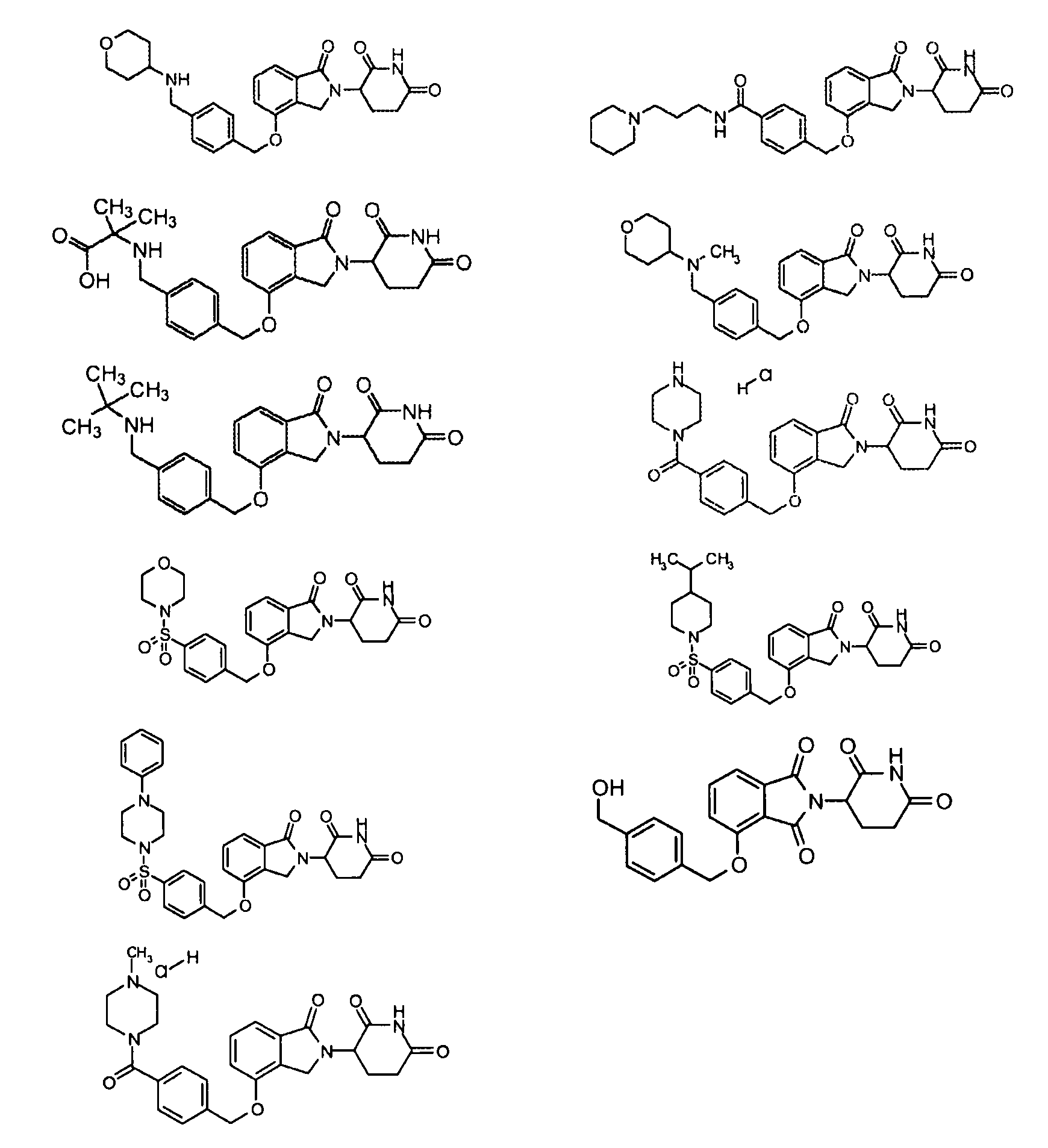 ,
,
или их фармацевтически приемлемую соль, сольват или стереоизомер.
В другом варианте осуществления изобретение относится к соединению формулы (IV):
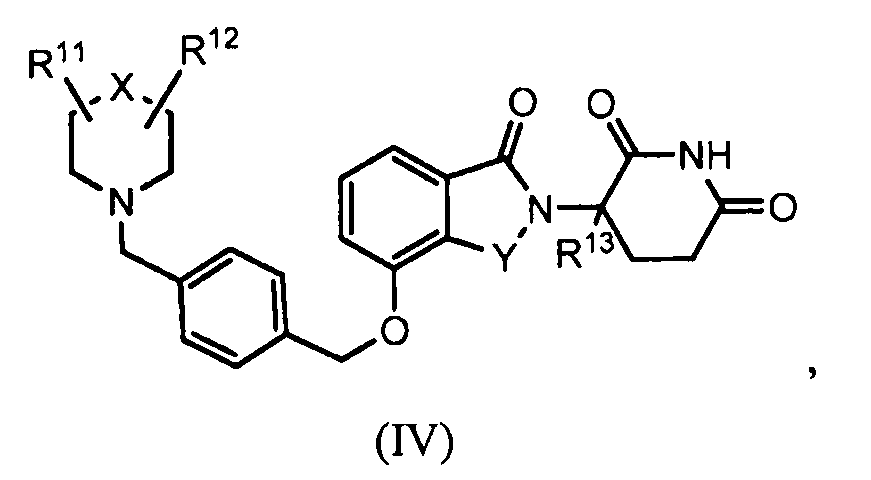
или к его фармацевтически приемлемой соли, сольвату или стереоизомеру, в которой:
X обозначает N или C;
Y обозначает CH2 или C=O;
R11 и R12 обозначают, каждый независимо, водород, -(C1-C6)алкил, -(C1-C6)алкил-(C3-C6)циклоалкил, -(C1-C6)алкокси, -(C6-C10)арил, -CO(C1-C6)алкил, -CO(C3-C6)циклоалкил, -CO(C6-C10)арил, -COO(C1-C6)алкил, галоген, гидроксил, оксо, 3-10-членный гетероцикл, 6-10-членный гетероарил, -NHCO(C1-C6)алкил, -(CH2)n-фенил, -SO2(C1-C6)алкил, -SO2(C3-C6)циклоалкил, -SO2(C6-C10)арил или -NR14R15, причем алкильная, арильная или гетероарильная часть каждой из групп может быть замещенной одним или более галогенами, гидроксилами или -(C1-C6)алкокси;
R13 обозначает водород или -(C1-C6)алкил;
R14 и R15 обозначают, каждый независимо, водород или -(C1-C6)алкил; и
n=0, 1, 2 или 3.
В одном варианте осуществления X обозначает N. В другом варианте осуществления X обозначает C.
В одном варианте осуществления Y обозначает CH2. В другом варианте осуществления Y обозначает C=O.
В одном варианте осуществления R11 обозначает водород. В другом варианте осуществления R11 обозначает -(C1-C6)алкил. В другом варианте осуществления R11 обозначает -(C1-C6)алкил-(C3-C6)циклоалкил. В другом варианте осуществления R11 обозначает -(C1-C6)алкокси. В другом варианте осуществления R11 обозначает -(C6-C10)арил. В другом варианте осуществления R11 обозначает -CO(C1-C6)алкил. В другом варианте осуществления R11 обозначает -CO(C3-C6)циклоалкил. В другом варианте осуществления R11 обозначает -CO(C6-C10)арил. В другом варианте осуществления R11 обозначает -COO(C1-C6)алкил. В другом варианте осуществления R11 обозначает галоген. В другом варианте осуществления R11 обозначает гидроксил. В другом варианте осуществления R11 обозначает оксо. В другом варианте осуществления R11 обозначает 3-10 членный гетероцикл. В другом варианте осуществления R11 обозначает 6-10-членный гетероарил. В другом варианте осуществления R11 обозначает -NHCO(C1-C6)алкил. В другом варианте осуществления R11 обозначает -(CH2)n-фенил. В другом варианте осуществления R11 обозначает -SO2(C1-C6)алкил. В другом варианте осуществления R11 обозначает -SO2(C3-C6)циклоалкил. В другом варианте осуществления R11 обозначает -SO2(C6-C10)арил. В другом варианте осуществления R11 обозначает -NR14R15. В другом варианте осуществления алкильная, арильная или гетероарильная часть R11 замещена одним или более галогенами, гидроксилами и/или -(C1-C6)алкокси.
В одном варианте осуществления R12 обозначает водород. В другом варианте осуществления R12 обозначает -(C1-C6)алкил. В другом варианте осуществления R12 обозначает -(C1-C6)алкил-(C3-C6)циклоалкил. В другом варианте осуществления R12 обозначает -(C1-C6)алкокси. В другом варианте осуществления R12 обозначает -(C6-C10)арил. В другом варианте осуществления R12 обозначает -CO(C1-C6)алкил. В другом варианте осуществления R12 обозначает -CO(C3-C6)циклоалкил. В другом варианте осуществления R12 обозначает -CO(C6-C10)арил. В другом варианте осуществления R12 обозначает -COO(C1-C6)алкил. В другом варианте осуществления R12 обозначает галоген. В другом варианте осуществления R12 обозначает гидроксил. В другом варианте осуществления R12 обозначает оксо. В другом варианте осуществления R12 обозначает 3-10-членный гетероцикл. В другом варианте осуществления R12 обозначает 6-10-членный гетероарил. В другом варианте осуществления R12 обозначает -NHCO(C1-C6)алкил. В другом варианте осуществления R12 обозначает -(CH2)n-фенил. В другом варианте осуществления R12 обозначает -SO2(C1-C6)алкил. В другом варианте осуществления R12 обозначает -SO2(C3-C6)циклоалкил. В другом варианте осуществления R12 обозначает -SO2(C6-C10)арил. В другом варианте осуществления R12 обозначает -NR14R15. В другом варианте осуществления алкильная, арильная или гетероарильная часть R12 замещена одним или более галогенами, гидроксилами и/или -(C1-C6)алкокси.
В одном варианте осуществления R13 обозначает водород. В другом варианте осуществления R13 обозначает -(C1-C6)алкил.
В одном варианте осуществления R14 обозначает водород. В другом варианте осуществления R14 обозначает -(C1-C6)алкил.
В одном варианте осуществления R15 обозначает водород. В другом варианте осуществления R15 обозначает -(C1-C6)алкил.
В одном варианте осуществления n=0. В другом варианте осуществления n=1. В другом варианте осуществления n=2. В другом варианте осуществления n=3.
В одном варианте осуществления изобретение относится к соединениям, которые следуют из любой комбинации X, Y, R11-R15 и n, как определено выше.
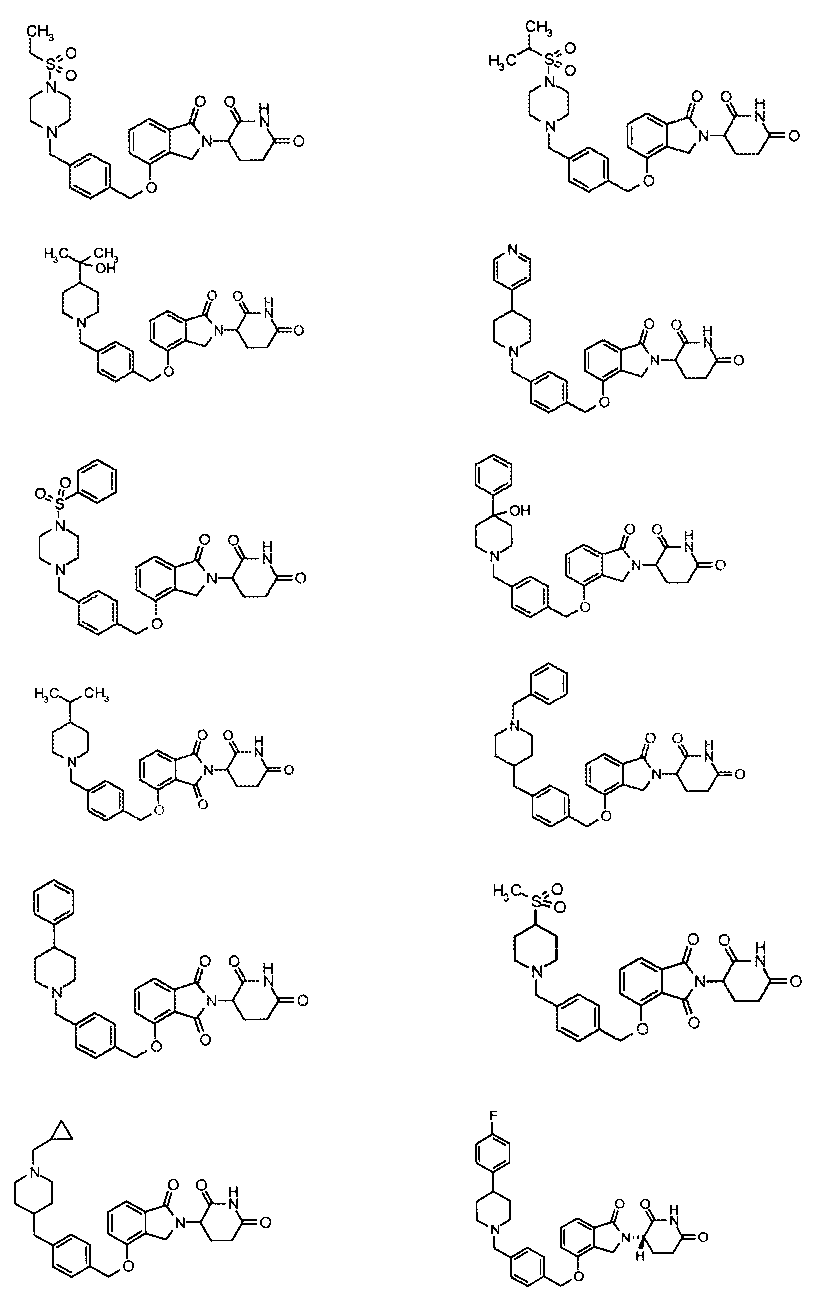
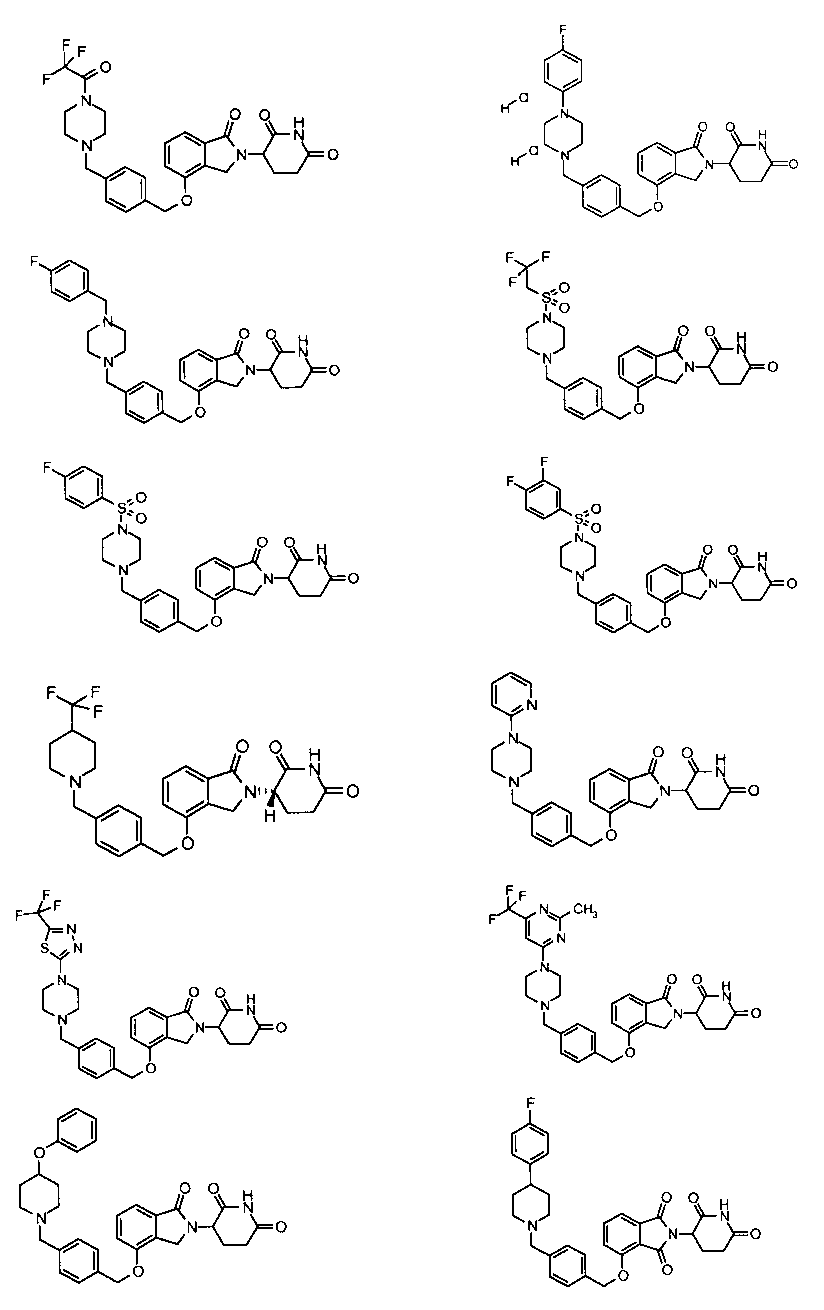
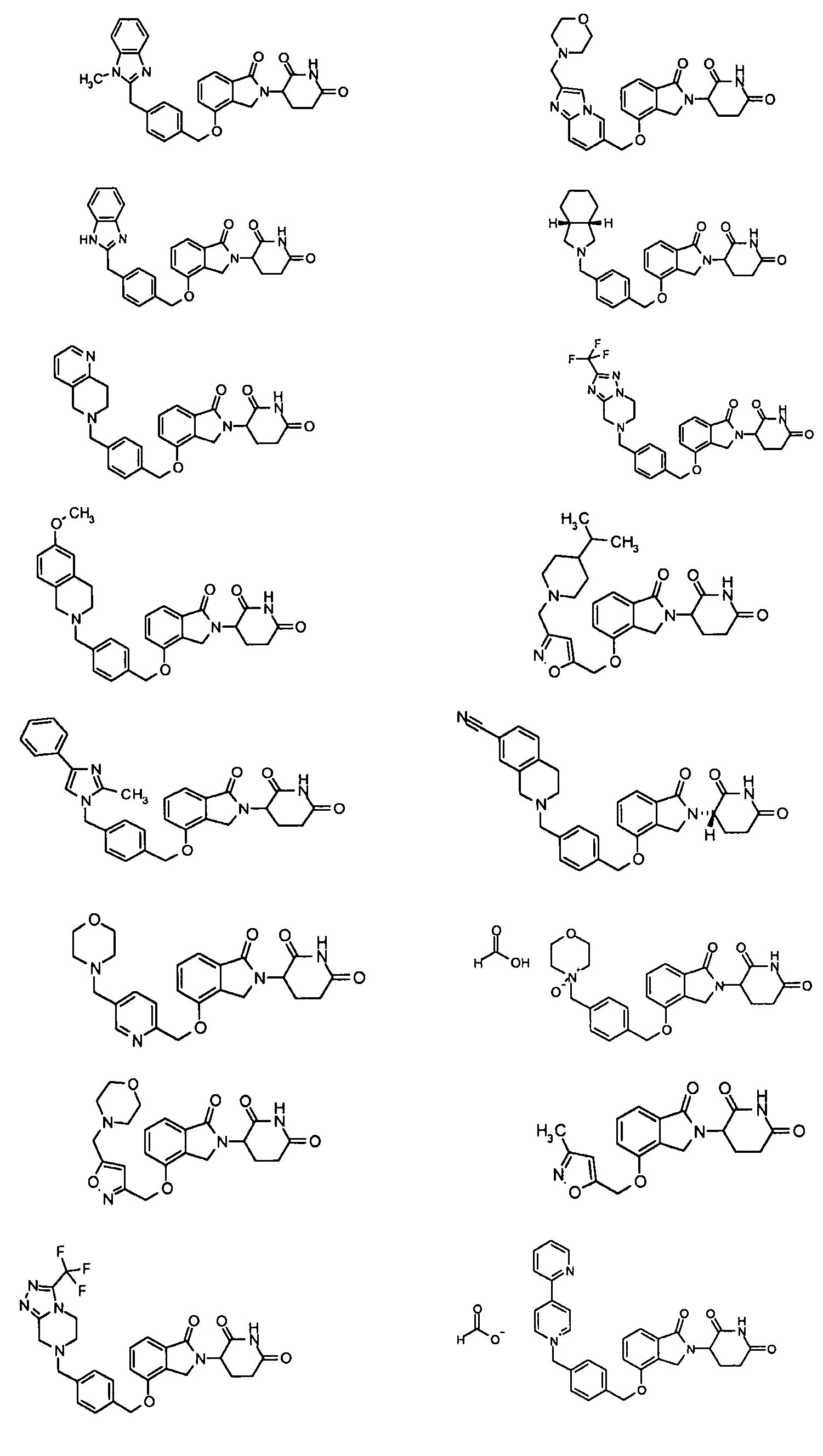
В одном варианте осуществления частные примеры включают, но не ограничены ими:
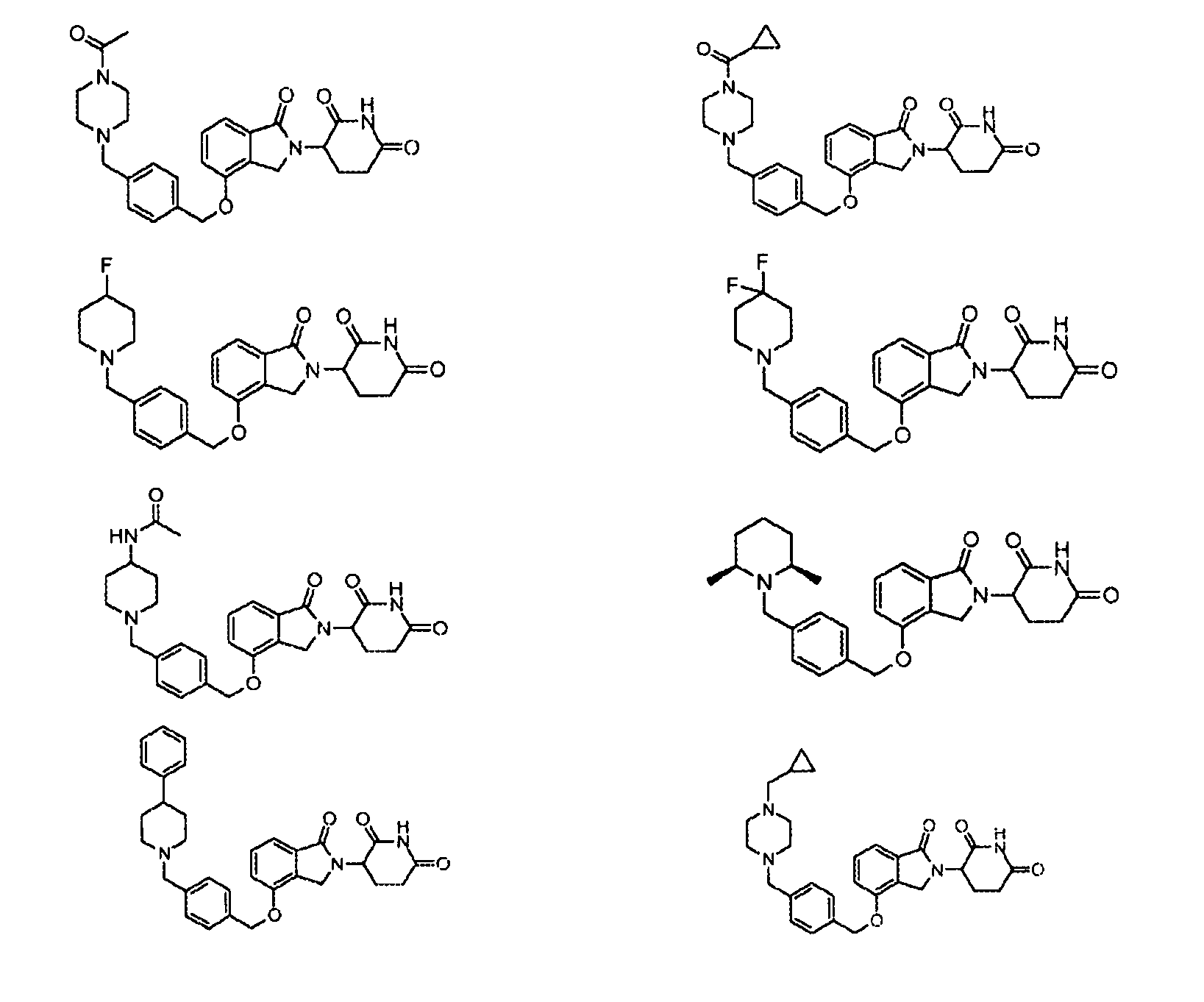
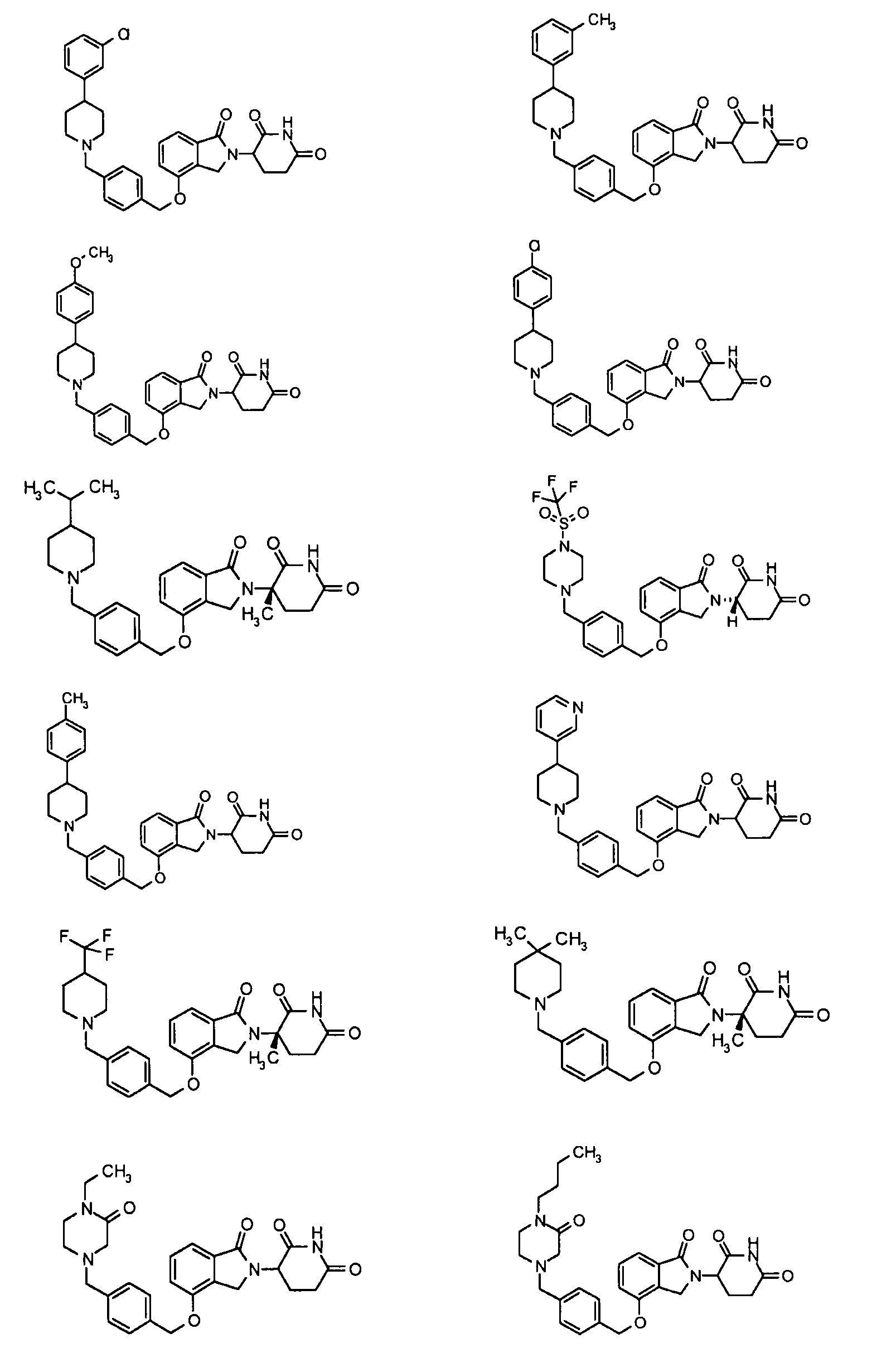
 ,
,
или их фармацевтически приемлемую соль, сольват или стереоизомер.
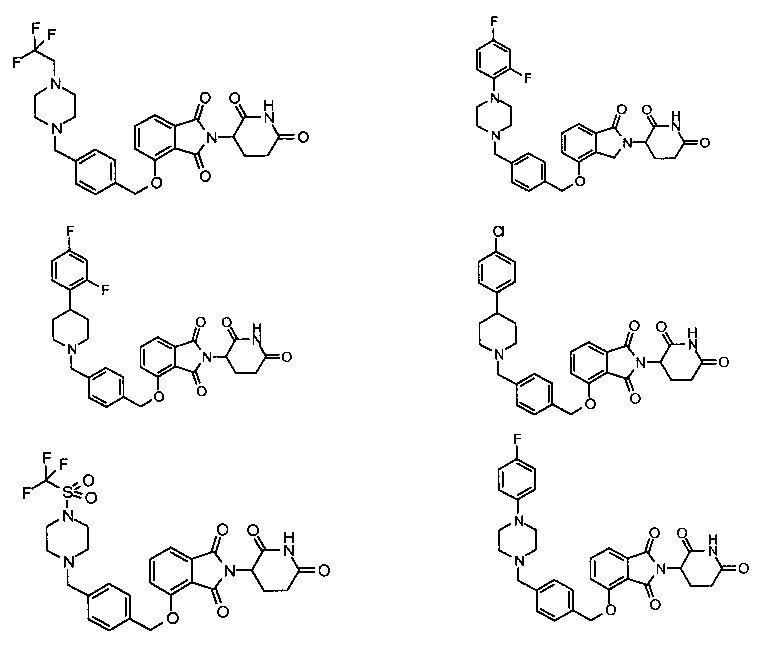
В другом варианте осуществления изобретение относится к соединениям формулы:
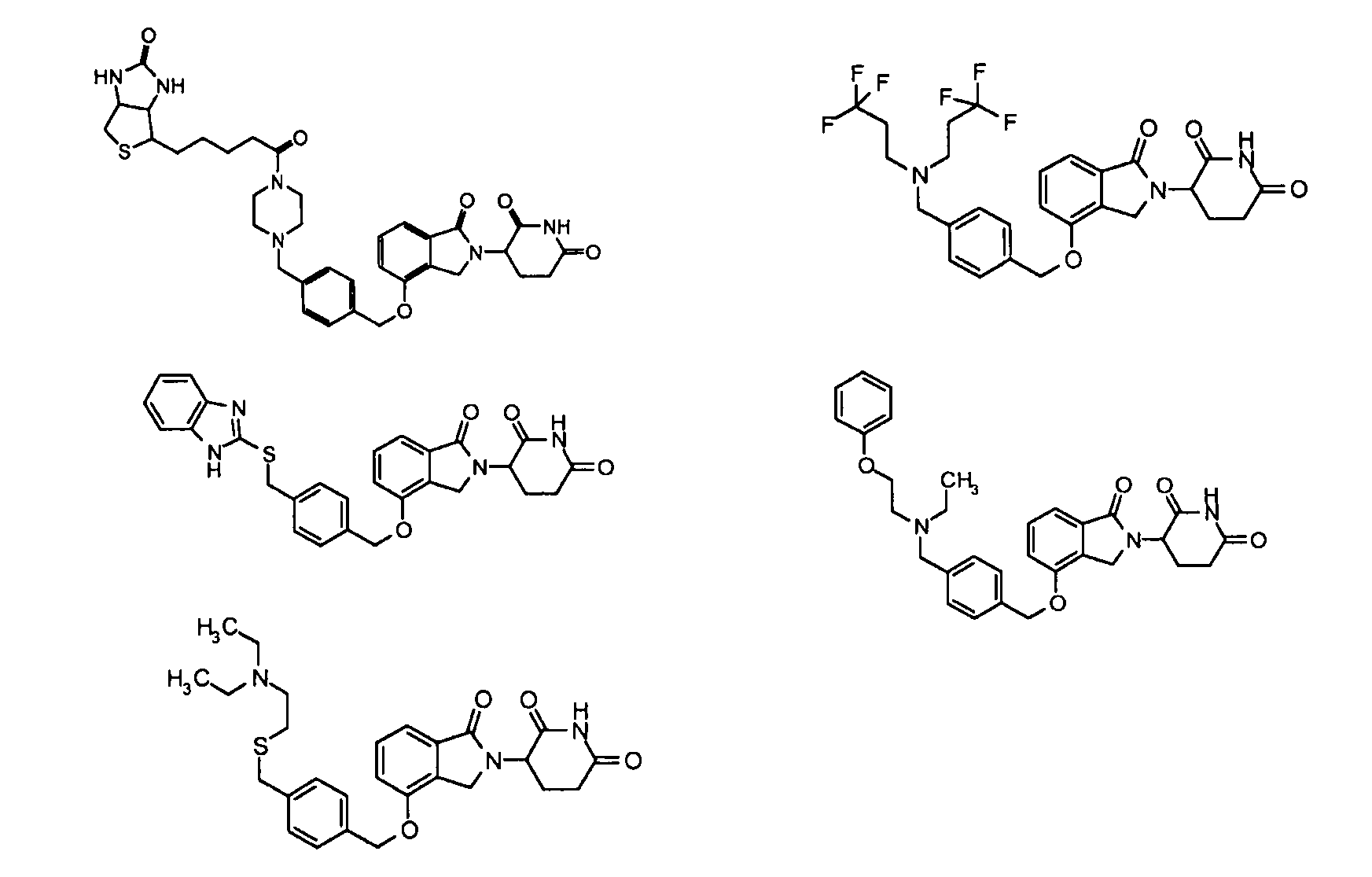 ,
,
или к их фармацевтически приемлемой соли, сольвату или стереоизомеру.
В рамках изобретения и если не определено иначе, термин “фармацевтически приемлемая соль” относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот, включая неорганические кислоты и органические кислоты. Подходящие нетоксичные кислоты включают неорганические и органические кислоты, такие как, но не ограниченные ими, уксусная, альгиновая, аминобензойная, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, глюконовая, глутаминовая, глюкуроновая, галактуроновая, глицидная, бромистоводородная, хлористоводородная, изэтиновая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муциновая, азотная, памовая, пантотеновая, фенилуксусная, пропионовая, фосфорная, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислота, п-толуолсульфоновая и т.п. В одном варианте осуществления подходящими являются хлористоводородная, бромистоводородная, фосфорная и серная кислоты.
В рамках изобретения и если не определено иначе, термин "сольват" означает соединение, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными силами межмолекулярного взаимодействия. Если растворителем является вода, сольват представляет собой гидрат.
В рамках изобретения и если не определено иначе, термин "пролекарство" означает производное соединения, которое может гидролизоваться, окисляться или иначе реагировать в биологических условиях (in vitro или in vivo), обеспечивая это соединение. Примеры пролекарств включают, но не ограничены ими, соединения, которые включают биогидролизуемые группы, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают соединения, которые включают группы -NO, -NO2, -ONO или -ONO2. Пролекарства могут обычно быть получены с использованием известных способов, таких как описанные в Burger's Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed. 1995), и Design of Prodrugs (H. Bundgaard ed., Elselvier, New York 1985).
В рамках изобретения и если не определено иначе, термины “биогидролизуемый карбамат”, “биогидролизуемый карбонат”, “биогидролизуемый уреид” и “биогидролизуемый фосфат” означают карбамат, карбонат, уреид и фосфат, соответственно, соединение, которыое либо: 1) не противодействует биологической активности соединения, но может придать этому соединению выгодные свойства in vivo, такие как захват, продолжительность действия или начало действия; либо 2) биологически неактивен, но превращается in vivo в биологически активное соединение. Примеры биогидролизуемых карбаматов включают, но не ограничены ими, карбаматы, которые включают низший алкиламин, замещенный этилендиамин, аминокислоту, гидроксиалкиламин, гетероциклический и гетероароматический амин и простые полиэфираминогруппы.
В рамках изобретения и если не определено иначе, термин "стереоизомер" охватывает все энантиомерно/стереомерно чистые и энантиомерно/стереомерно обогащенные здесь соединения по изобретению.
В рамках изобретения и если не указано иное, термин “стереомерно чистый” означает композицию, которая включает один стереоизомер соединения и в основном не содержит других стереоизомеров этого соединения. Например, стереомерно чистая композиция соединения, имеющего один хиральный центр, в основном не содержит противоположного энантиомера соединения. Стереомерно чистая композиция соединения, имеющего два хиральных центра, в основном не содержит других диастереомеров соединения. Типичное стереомерно чистое соединение включает более чем приблизительно 80 вес.% одного стереоизомера соединения и менее чем приблизительно 20 вес.% других стереоизомеров соединения, более чем приблизительно 90 вес.% одного стереоизомера соединения и менее чем приблизительно 10 вес.% других стереоизомеров соединения, более чем приблизительно 95 вес.% одного стереоизомера соединения и менее чем приблизительно 5 вес.% других стереоизомеров соединения, более чем приблизительно 97 вес.% одного стереоизомера соединения и менее чем приблизительно 3 вес.% других стереоизомеров соединения, более чем приблизительно 98 вес.% одного стереоизомера соединения и менее чем приблизительно 2 вес.% других стереоизомеров соединения или более чем приблизительно 99 вес.% одного стереоизомера соединения и менее чем приблизительно 1 вес.% других стереоизомеров соединения.
В рамках изобретения и если не указано иное, термин “стереомерно обогащенная” обозначает композицию, которая включает более чем приблизительно 55 вес.% одного стереоизомера соединения, более чем приблизительно 60 вес.% одного стереоизомера соединения, более чем приблизительно 70 вес.% или более чем приблизительно 80 вес.% одного стереоизомера соединения.
В рамках изобретения и если не указано иное, термин “энантиомерно чистая” означает стереомерно чистую композицию соединения, имеющего один хиральный центр. Точно так же термин "энантиомерно обогащенная" означает стереомерно обогащенную композицию соединения, имеющего один хиральный центр.
В рамках изобретения и если не указано иное, термин "алкил" относится к насыщенному углеводороду с прямой или разветвленной цепью, имеющему множество атомов углерода, как определено здесь. В некоторых вариантах осуществления алкильные группы имеют от 1 до 15, от 1 до 10, от 1 до 6 или от 1 до 3 атомов углерода. Примеры насыщенных алкилов с прямой цепью включают -метил, -этил, н-пропил, н-бутил, н-пентил и н-гексил; в то время как насыщенные разветвленные алкилы включают -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил и т.п. Термин алкил также охватывает циклоалкил.
В рамках изобретения алкенил относится к углеводороду с прямой или разветвленной цепью, содержащему одну или более двойных связей. Примеры углеродной цепи алкенила содержат от 2 до 20 атомов углерода, и в некоторых вариантах осуществления содержат от 1 до 8 двойных связей, и углеродные цепи алкенила, содержащие от 2 до 16 атомов углерода, в некоторых вариантах осуществления содержат от 1 до 5 двойных связей.
В рамках изобретения алкинил относится к углеводороду с прямой или разветвленной цепью, содержащему одну или более тройных связей. Углеродные цепи алкинила, содержащие от 2 до 20 атомов углерода, в некоторых вариантах осуществления содержат от 1 до 8 тройных связей, и углеродные цепи алкинила, содержащие от 2 до 16 атомов углерода, в некоторых вариантах осуществления содержат от 1 до 5 тройных связей. Примеры алкенильных и алкинильных групп включают, но не ограничены ими, этилен, пропилен, бутен, пентен, ацетилен и гексин. В рамках изобретения, низший алкил, низший алкенил и низший алкинил относятся к углеродным цепям, имеющим от приблизительно 1 или приблизительно 2 атомов углерода до приблизительно 6 атомов углерода.
В рамках изобретения и если не определено иначе, термин "циклоалкил" означает формы алкила, которые являются циклическими и содержат от 3 до 15, от 3 до 9, от 3 до 6 или от 3 до 5 атомов углерода, без чередующихся или резонирующих двойных связей между атомами углерода. Они могут содержать от 1 до 4 колец. Примеры незамещенных циклоалкилов включают, но не ограничены ими, циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Циклоалкил может быть замещен одним или более заместителями. В некоторых вариантах осуществления циклоалкил может быть циклоалкилом, конденсированным с арильными или гетероарильными группами.
В рамках изобретения и если не определено иначе, термин “гетероциклоалкил” означает циклоалкил, в котором один или более атомов углерода заменены гетероатомами, такими как, но не ограничиваясь ими, N, S и O. В некоторых вариантах осуществления гетероциклоалкильная группа содержит от 2 до 14, от 2 до 8, от 2 до 7, от 2 до 5 или от 2 до 4 атомов углерода. В некоторых вариантах осуществления гетероциклоалкил может быть гетероциклоалкилом, конденсированным с арильными или гетероарильными группами.
В рамках изобретения термин "арил" означает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 кольцевых атомов. Все кольцевые атомы карбоциклической арильной группы являются атомами углерода. Кольцевые арильные структуры включают соединения, имеющие одну или более кольцевых структур, такие как моно-, би- или трициклические соединения, а также бензо-конденсированные карбоциклические группы, такие как 5,6,7,8-тетрагидронафтил и т.п. В частности, арильная группа может представлять собой моно-, би- или трициклическое кольцо. Примеры арильных групп включают фенил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил.
В рамках изобретения "гетероарил" относится к моноциклической или полициклической ароматической кольцевой системе, в некоторых вариантах осуществления включающей от приблизительно 5 до приблизительно 15 членов, где один или более, в одном варианте осуществления от 1 до 3, атомов в кольцевой системе представляют собой гетероатом, то есть элемент, отличный от углерода, включая, но не ограничиваясь ими, азот, кислород или серу. Гетероарильная группа может быть в случае необходимости конденсирована с бензольным кольцом. Гетероарильные группы включают, но не ограничены ими, фурил, имидазолил, индолинил, пирролидинил, пиримидинил, тетразолил, тиенил, пиридил, пирролил, N-метилпирролил, хинолинил и изохинолинил.
В рамках изобретения "гетероциклил" относится к моноциклической или полициклической неароматической кольцевой системе, в одном варианте осуществления включающей от 3 до 10 членов, в другом варианте осуществления от 4 до 7 членов, в другом варианте осуществления от 5 до 6 членов, где один или более, в некоторых вариантах осуществления от 1 до 3, атомов в кольцевой системе представляют собой гетероатом, то есть элемент, отличный от углерода, включая, но не ограничиваясь ими, азот, кислород или серу. В вариантах осуществления, где гетероатом(ы) представляет(ют) собой азот, азот может быть замещен алкилом, алкенилом, алкинилом, арилом, гетероарилом, аралкилом, гетероаралкилом, циклоалкилом, гетероциклилом, циклоалкилалкилом, гетероциклилалкилом, ацилом, гуанидино, или азот может быть кватернизован с образованием группы аммония, где заместители выбраны, как указано выше.
В рамках изобретения "аралкил" относится к алкильной группе, в которой один из атомов водорода алкила заменен арильной группой.
В рамках изобретения "гетероаралкил" относится к алкильной группе, в которой один из атомов водорода алкила заменен гетероарильной группой.
В рамках изобретения "алкиламинокарбонил" относится к C(O)NHR, в котором R обозначает алкил, включая низший алкил. В рамках изобретения "диалкиламинокарбонил" относится к C(O)NR'R, в котором R' и R независимо обозначают алкил, включая низший алкил; "карбоксамид" относится к группам формулы -NR'COR, в которых R' и R независимо обозначают алкил, включая низший алкил.
В рамках изобретения "ариламинокарбонил" относится к -C(O)NHR, в котором R обозначает арил, включая низший арил, такой как фенил.
В рамках изобретения "галоген" или "галогенид" относится к F, Cl, Br или I.
Если число любого данного заместителя не определено (например, "галогеналкил"), могут присутствовать один или более заместителей. Например, "галогеналкил" может включать один или более одинаковых или разных галогенов.
Следует отметить, что, если есть несоответствие между изображенной структурой и названием, приведенным для этой структуры, изображенная структура имеет больший вес. Кроме того, если стереохимия структуры или части структуры не обозначена, например, жирными или пунктирными линиями, структура или часть структуры должна интерпретироваться как затрагивающая все ее стереоизомеры.
4.2 СПОСОБЫ ЛЕЧЕНИЯ, ПРОФИЛАКТИКИ И КОНТРОЛЯ
Изобретение относится к способам лечения, профилактики и/или контроля различных заболеваний или нарушений с использованием соединения по изобретению или его фармацевтически приемлемой соли, сольвата (например, гидрата), пролекарства, клатрата или стереоизомера.
Примеры заболеваний или нарушений включают, но не ограничены ими, рак, нарушения, связанные с ангиогенезом, боль, включая, но не ограничиваясь этим, комплексный регионарный болевой синдром (“CRPS”), дегенерацию желтого пятна (“MD”) и связанные синдромы, кожные заболевания, легочные нарушения, связанные с асбестом нарушения, паразитарные заболевания, иммунодефициты, нарушения ЦНС, повреждение ЦНС, атеросклероз и связанные нарушения, дисфункциональный сон и связанные нарушения, гемоглобинопатию и связанные нарушения (например, анемию), связанные с TNF-α нарушения и другие различные заболевания и нарушения.
В рамках изобретения и если не определено иначе, термины "лечить" и "лечение" относятся к устранению или облегчению заболевания или нарушения, или одного или более симптомов, связанных с заболеванием или нарушением. В некоторых вариантах осуществления эти термины относятся к минимизации распространения или ухудшения заболевания или нарушения вследствие введения одного или более профилактических средств или терапевтических средств пациенту с таким заболеванием или нарушением.
В рамках изобретения если не определено иначе, термин "профилактика" относится к лечению с помощью или ко введению соединения по изобретению, с или без другого дополнительного активного соединения, до начала симптомов, особенно пациентам с риском развития рака и/или других нарушений, описанных здесь. Термин "профилактика" включает ингибирование или уменьшение симптома специфического заболевания. Пациенты с семейным анамнезом заболевания в особенности являются кандидатами на профилактические режимы в некоторых вариантах осуществления. Кроме того, пациенты, которые имеют в анамнезе рецидивирующие симптомы, также являются потенциальными кандидатами на профилактику. В этом отношении, термин "профилактика" может использоваться взаимозаменяемо с термином “профилактическое лечение”.
В рамках изобретения и если не определено иначе, термины "контролировать" и "контроль" относятся к профилактике или замедлению прогрессии, распространения или ухудшения заболевания или нарушения, или одного или более его симптомов. В некоторых случаях благоприятные воздействия, которые пациент получает от профилактического или терапевтического средства, не приводят к излечению от заболевания или нарушения.
В рамках изобретения и если не определено иначе, “терапевтически эффективное количество” соединения представляет собой количество, достаточное для того, чтобы обеспечить терапевтическую выгоду в лечении или контроле заболевания или нарушения, или чтобы задержать или минимизировать один или более симптомов, связанных с заболеванием или нарушением. Терапевтически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими терапиями, которое обеспечивает терапевтическую выгоду в лечении или контроле заболевания или нарушения. Термин “терапевтически эффективное количество” может охватывать количество, которое улучшает общую терапию, уменьшает или устраняет симптомы или причины заболевания или нарушения, или усиливает терапевтическую эффективность другого терапевтического средства.
В рамках изобретения и если не определено иначе, “профилактически эффективное количество” соединения представляет собой количество, достаточное для того, чтобы ингибировать или уменьшить симптом заболевания или предотвратить рецидив заболевания. Профилактически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими средствами, которое обеспечивает профилактическую выгоду при ингибировании или уменьшении симптома заболевания или рецидива заболевания. Термин “профилактически эффективное количество” может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Примеры рака и предраковых состояний включают, но не ограничены ими, описанные в патентах США 6281230 и 5635517 на имя Muller et al., в различных патентных публикациях США на имя Zeldis, включая номера публикаций 2004/0220144A1, опубликовано 4 ноября 2004 (Лечение Миелодиспластического Синдрома); 2004/0029832A1, опубликовано 12 февраля 2004 (Лечение Различных Типов Рака); и 2004/0087546, опубликовано 6 мая 2004 (Лечение Миелопролиферативных Заболеваний). Примеры также включают описанные в WO2004/103274, опубликовано 2 декабря 2004. Все эти ссылки полностью включены в настоящее описание путем ссылки.
Частные примеры рака включают, но не ограничены ими, рак кожи, такой как меланома; лимфатических узлов; молочной железы; шейки матки; матки; желудочно-кишечного тракта; легкого; яичника; предстательной железы; толстой кишки; прямой кишки; рта; мозга; головы и шеи; глотки; яичек; почки; поджелудочной железы; кости; селезенки; печени; мочевого пузыря; гортани; носовых путей; и связанный со СПИДом рак. Соединения также могут быть использованы для лечения рака крови и костного мозга, такого как множественная миелома и острые и хронические лейкозы, например, лимфобластного, миелогенного, лимфоцитарного и миелоцитарного лейкозов. Соединения по изобретению могут использоваться для лечения, профилактики или контроля как первичных, так и метастатических опухолей.
Другие конкретные виды рака включают, но не ограничены ими, рак в продвинутой стадии, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы в мозг, мультиформы глиобластомы, глиобластому, глиому ствола мозга, злокачественную опухоль головного мозга с плохим прогнозом, злокачественную глиому, рекуррентную злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, ректальную аденокарциному, колоректальный рак Dukes C & D, неоперабельный колоректальный рак, метастатический гепатоцеллюлярный рак, саркому Капоши, кариотипный острый миелобластный лейкоз, хронический лимфоцитарный лейкоз (CLL), лимфому Ходжкина, неходжкинскую лимфому, кожную Т-клеточную лимфому, кожную B-клеточную лимфому, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому с низкой степенью злокачественности, метастатическую меланому (локализованная меланома, включая, но не ограничиваясь ей, глазную меланому), злокачественную мезотелиому, злокачественный плевральный эффузионный мезотелиомный синдром, перитонеальный рак, сосочковый серозный рак, гинекологическую саркому, саркому мягких тканей, склеродермию, кожный васкулит, гистиоцитоз клеток Лангерганса, лейомиосаркому, оссифицирующую прогрессивную фибродисплазию, гормональный рефрактерный рак предстательной железы, резекцированную высокорисковую саркому мягких тканей, неоперабельный гепатоцеллюлярный рак, макроглобулинемию Вальденстрема, тлеющую миелому, безболезненную миелому, рак маточной трубы, андрогеннезависимый рак предстательной железы, андрогензависимую стадию IV неметастатического рака предстательной железы, гормон-нечувствительный рак предстательной железы, нечувствительный к химиотерапии рак предстательной железы, сосочковый рак щитовидной железы, фолликулярный рак щитовидной железы, медуллярный рак щитовидной железы и лейомиому. В частном варианте осуществления рак является метастатическим. В другом варианте осуществления рак является рефрактерным или резистентным к химиотерапии или облучению.
В одном варианте осуществления изобретение относится к способам лечения, профилактики или контроля различных форм лейкозов, таких как хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз, включая лейкозы, которые являются релапсирующими, рефрактерными или резистентными, как раскрыто в публикации США 2006/0030594, опубликованной 9 февраля 2006, которая полностью включена путем ссылки.
Термин "лейкоз" относится к злокачественным опухолям кроветворных тканей. Лейкоз включает, но не ограничен ими, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз. Лейкоз может быть релапсирующим, рефрактерным или резистентным к обычной терапии. Термин "релапсирующий" относится к ситуации, когда у пациентов, у которых лейкоз проходил после терапии, наблюдалось возвращение лейкозных клеток в костном мозге и уменьшение количества нормальных клеток крови. Термин “рефрактерный или резистентный” относится к обстоятельству, когда у пациентов, даже после интенсивного лечения, имеются остаточные лейкозные клетки в костном мозге.
В другом варианте осуществления изобретение относится к способам лечения, профилактики или контроля различных типов лимфом, включая неходжкинскую лимфому (НХЛ). Термин "лимфома" относится к гетерогенной группе опухолей, возникающих в ретикулоэндотелиальных и лимфатических системах. "НХЛ" относится к злокачественной моноклональной пролиферации лимфоидных клеток в участках иммунной системы, включая лимфатические узлы, костный мозг, селезенку, печень и желудочно-кишечный тракт. Примеры НХЛ включают, но не ограничены ими, лимфому клеток мантии (MCL), лимфоцитарную лимфому промежуточной дифференцировки, промежуточную лимфоцитарную лимфому (ILL), диффузную низкодифференцированную лимфоцитарную лимфому (PDL), центроцитарную лимфому, диффузную лимфому небольших расщепленных клеток (DSCCL), фолликулярную лимфому и любой тип лимфом клеток мантии, которые могут быть замечены под микроскопом (узелковую, диффузную, бластную и лимфому зоны мантии).
Примеры заболеваний и нарушений, связанных с нежелательным ангиогенезом или характеризующихся им, включают, но не ограничены ими, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и рубеоз (образование новых сосудов угла передней камеры). Частные примеры заболеваний и нарушений, связанных с нежелательным ангиогенезом или характеризующихся им, включают, но не ограничены ими, артрит, эндометриоз, болезнь Крона, сердечную недостаточность, сердечную недостаточность в продвинутой стадии, нарушения почек, эндотоксемию, синдром токсического шока, остеоартрит, репликацию ретровирусов, истощение, менингит, кремнезем-индуцированный фиброз, асбест-индуцированный фиброз, ветеринарное нарушение, связанную со злокачественным процессом гиперкальцемию, инсульт, циркуляторный инсульт, периодонтит, гингивит, макроцитарную анемию, рефрактерную анемию и синдром 5q-делеции.
Примеры боли включают, но не ограничены ими, описанные в патентной публикации США 2005/0203142, опубликованной 15 сентября 2005, которая включена в настоящее описание путем ссылки. Частные типы боли включают, но не ограничены ими, ноцицептивную боль, нейропатическую боль, смешанную боль из ноцицептивной и нейропатической боли, висцеральную боль, мигрень, головную боль и послеоперационную боль.
Примеры ноцицептивной боли включают, но не ограничены ими, боль, связанную с химическими или термическими ожогами, порезы кожи, ушибы кожи, остеоартрит, ревматоидный артрит, тендонит и миофасциальную боль.
Примеры нейропатической боли включают, но не ограничены ими, CRPS типа I, CRPS типа II, рефлекторную симпатическую дистрофию (RSD), рефлекторную нейроваскулярную дистрофию, рефлекторную дистрофию, симпатический болевой синдром, каузалгию, атрофию костей Зудека, алгонейродистрофию, синдром плечо-рука, посттравматическую дистрофию, невралгию тройничного нерва, постгерпетическую невралгию, боль, связанную с раком, фантомную боль в конечности, фибромиалгию, синдром хронической усталости, боль при повреждении спинного мозга, центральную боль после инсульта, радикулопатию, диабетическую нейропатию, боль после инсульта, сифилитическую нейропатию и другие болезненные нейропатические состояния, такие как индуцируемые лекарственными средствами, такими как винкристин и велкад.
В рамках изобретения, термины “комплексный регионарный болевой синдром”, “CRPS” и “CRPS и связанные синдромы” означают хроническое болевое нарушение, характеризующееся одним или более из следующего: боль, спонтанная или вызванная, включая аллодинию (болезненная реакция на стимул, который обычно не является болезненным) и гипералгезию (обостренную реакцию на стимул, который обычно является только мягкоболезненным); боль, которая является непропорциональной провоцирующему событию (например, годы сильной боли после растяжения связок голеностопного сустава); регионарную боль, которая не ограничена единственным местом распространения периферических нервов; и автономную дисрегуляцию (например, отек, альтерацию кровотока и гипергидроз), связанную с трофическими изменениями кожи (аномалии роста волос и ногтей и изъязвления кожи).
Примеры MD и связанных синдромов включают, но не ограничены ими, описанные в патентной публикации США 2004/0091455, опубликованной 13 мая 2004, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, атрофическую (сухую) MD, экссудативную (влажную) MD, возрастную макулопатию (ARM), хориоидальную неоваскуляризацию (CNVM), отслоение пигментного эпителия сетчатки (PED) и атрофию пигментного эпителия сетчатки (RPE).
Примеры кожных заболеваний включают, но не ограничены ими, описанные в публикации США 2005/0214328A1, опубликованной 29 сентября 2005, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, кератоз и связанные симптомы, кожные заболевания или нарушения, характеризующиеся разрастаниями эпидермиса, угрей и морщин.
В рамках изобретения, термин "кератоз" относится к любому поражению на эпидермисе, отмеченному наличием очерченных разрастаний рогового слоя, включая, но не ограничиваясь ими, актинический кератоз, себорейный кератоз, кератоакантому, фолликулярный кератоз (болезнь Дарье), инвертированный фолликулярный кератоз, ладонно-подошвенную кератодермию (PPK, keratosis palmaris и plantaris), keratosis pilaris и кератоз по типу штукатурки. Термин “актинический кератоз” также относится к сенильному кератозу, keratosis senilis, сенильным бородавкам, plana senilis, солнечному кератозу, кератодермии или кератоме. Термин “себорейный кератоз” также относится к себорейным бородавкам, сенильным бородавкам или базальноклеточной папилломе. Кератоз характеризуется одним или более следующих симптомов: неровно выглядящие чешуйчатые эритематозные папулы, чешуйки, спикулы или узелки на экспонируемых поверхностях (например, лицо, руки, уши, шея, ноги и грудная клетка), разрастания кератина, называемые кожными ороговениями, гиперкератоз, телеангиэктазии, эластоз, окрашенные пятна, акантоз, паракератоз, дискератозы, папилломатоз, гиперпигментация нижних клеток, клеточная атипия, митотические фигуры, патологическая межклеточная адгезия, плотные воспалительные инфильтраты, и в незначительном числе случаев плоскоклеточный рак.
Примеры кожных заболеваний или нарушений, характеризующихся разрастаниями эпидермиса, включают, но не ограничены ими, любые состояния, заболевания или нарушения, отмеченные наличием разрастаний эпидермиса, включая, но не ограничиваясь ими, инфекции, связанные с вирусом папилломы, мышьяковые кератозы, симптом Лезера-Трела, бородавчатую дискератому (WD), trichostasis spinulosa (TS), erythrokeratodermia variabilis (EKV), фетальный ихтиоз (ихтиоз шута), врожденную узловатость пальцев, меланоакантому кожи, прокератоз, псориаз, плоскоклеточный рак, конфлюентный и ретикулированный папилломатоз (CRP), акрохордоны, ороговение кожи, болезнь Каудена (синдром полиморфной гамартомы), папулезный дерматоз чернокожих (DPN), эпидермальный синдром невуса (ENS), обыкновенный ихтиоз, контагиозный моллюск, prurigo nodularis и черный акантоз.
Примеры легочных нарушений включают, но не ограничены ими, описанные в публикации США 2005/0239842A1, опубликованной 27 октября 2005, которая включена в настоящее описание путем ссылки. Частные примеры примеры включают легочную гипертензию и связанные нарушения. Примеры легочной гипертензии и связанных нарушений включают, но не ограничены ими: первичную легочную гипертензию (PPH); вторичную легочную гипертензию (SPH); семейную PPH; спорадическую PPH; прекапиллярную легочную гипертензию; легочную артериальную гипертензию (РАН); гипертензию легочной артерии; идиопатическую легочную гипертензию; тромбическую легочную артериопатию (TPA); плексогенную легочную артериопатию; функциональные классы I-IV легочной гипертензии; и легочную гипертензию, связанную с, относящуюся к или вторичную по отношению к левожелудочковой дисфункции, заболеванию митрального клапана, стенозирующему перикардиту, аортальному стенозу, кардиомиопатии, средостенному фиброзу, аномальному легочному венозному дренажу, легочному веноокклюзионному заболеванию, коллагенному васкулярному заболеванию, врожденному пороку сердца, вирусная инфекции ВИЧ, лекарственным средствам и токсинам, таким как фенфлурамины, врожденному пороку сердца, легочной венозной гипертензии, хроническому обструктивному заболеванию легих, интерстициальному заболеванию легких, нарушениям дыхания во сне, нарушению, связанному с альвеолярной гиповентиляцией, хроническому нахождению на большой высоте, неонатальному заболеванию легких, альвеолярно-капиллярной дисплазии, серповидноклеточному заболеванию, другому нарушению коагуляции, хроническому тромбоэмболу, коллагенозу, волчанке, включая системную и кожную волчанку, шистосомиазу, саркоидозу или гемангиоматозу легочных капилляров.
Примеры связанных с асбестом нарушений включают, но не ограничены ими, описанные в публикации США 2005/0100529, опубликованной 12 мая 2005, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, мезотелиому, асбестоз, злокачественную плевральную эффузию, доброкачественную экссудативную эффузию, плевральные бляшки, плевральный кальциноз, диффузное плевральное наслоение, круглый ателектаз, фиброзные массы и рак легкого.
Примеры паразитарных заболеваний включают, но не ограничены ими, описанные в публикации США 2006/0154880, опубликованной 13 июля 2006, которая включена в настоящее описание путем ссылки. Паразитарные заболевания включают заболевания и нарушения, вызываемые внутриклеточными паразитами человека, такими как, но не ограничиваясь ими, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. и O. volvulus. Другие заболевания и нарушения, вызываемые нечеловеческими внутриклеточными паразитами, такими как, но не ограничиваясь ими, Babesia bovis, Babesia canis, Banesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. и Theileria ssp., также охвачены настоящим изобретением. Частные примеры включают, но не ограничены ими, малярию, бабезиоз, трипаносомиаз, лейшманиаз, токсоплазмоз, менингоэнцефалит, кератит, амебиаз, гиардиаз, криптоспоридиоз, изоспориаз, циклоспориаз, микроспоридиоз, аскаридоз, трихоцефалез, анцилостомиаз, стронгилоидоз, токсокариаз, трихинеллез, лимфатический филяриатоз, онхоцерциаз, филяриатоз, шистосомиаз и дерматит, вызванный шистосомами животных.
Примеры иммунодефицитов включают, но не ограничены ими, описанные в заявке на патент США 11/289723, поданной 30 ноября 2005. Частные примеры включают, но не ограничены ими, дефицит аденозиндезаминазы, дефицит антител с нормальным или повышенным Igs, атаксию-телеангиэктазию, синдром голых лимфоцитов, вариабельный неклассифицируемый иммуннодефицит, дефицит Ig с гипер-IgM, делецию тяжелой цепи Ig, дефицит IgA, иммуннодефицит с тимомой, ретикулярный дисгенез, синдромом Незелофа, селективный дефицит подкласса IgG, транзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдрича, X-связанную агаммаглобулинемию, X-связанный тяжелый комбинированный иммуннодефицит.
Примеры нарушений ЦНС включают, но не ограничены ими, описанные в публикации США 2005/0143344, опубликованной 30 июня 2005, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, рассеянный склероз, другие нейроиммунологические нарушения, такие как синдром Туретта, делирий или краткосрочные расстройства сознания и амнестическое расстройство или дискретные нарушения памяти, которые имеют место в отсутствие других нарушений центральной нервной системы.
Примеры повреждений ЦНС и связанных синдромов включают, но не ограничены ими, описанные в публикации США 2006/0122228, опубликованной 8 июня 2006, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, нарушение/повреждение ЦНС и связанные синдромы, включают, но не ограничены ими, первичное повреждение головного мозга, вторичное повреждение головного мозга, травматическое повреждение головного мозга, фокальное повреждение головного мозга, диффузное аксональное повреждение, черепно-мозговую травму, сотрясение, синдром после сотрясения, контузию и лацерацию мозга, субдуральную гематому, эпидермальную гематому, посттравматическую эпилепсию, хроническое вегетативное состояние, полное повреждение спинного мозга (SCI), неполное повреждение SCI, острое повреждение SCI, подострое повреждение SCI, хроническое повреждение SCI, синдром центрального паралича, синдром Брауна-Секварда, синдром передней спинномозговой артерии, синдром мозгового конуса, синдром конского хвоста, нейрогенный шок, спинальный шок, изменение уровня сознания, головную боль, тошноту, рвоту, потерю памяти, головокружение, диплопию, расфокусированное зрение, эмоциональную лабильность, расстройства сна, раздражительность, неспособность сконцентрироваться, нервозность, поведенческое расстройство, когнитивный дефицит и судороги.
Другие заболевания или нарушения включают, но не ограничены ими, вирусные, генетические, аллергические, и аутоиммунные заболевания. Частные примеры включают, но не ограничены ими, ВИЧ, гепатит, респираторный дистресс-синдром взрослых, болезни резорбции костей, хронические легочные воспалительные заболевания, дерматит, муковисцидоз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, септический синдром, постишемическое реперфузионное повреждение, менингит, псориаз, фиброзное заболевание, кахексию, заболевание трансплантат против хозяина, отторжение трансплантата, аутоиммунное заболевание, ревматоидный спондилит, болезнь Крона, неспецифический язвенный колит, болезнь воспаленного кишечника, рассеянный склероз, системную красную волчанку, ENL при лепре, лучевое повреждение, рак, астму или гипероксическое альвеолярное повреждение.
Примеры атеросклероза и связанных состояний включают, но не ограничены ими, раскрытые в публикации США 2002/0054899, опубликованной 9 мая 2002, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, все формы состояний, включающих атеросклероз, включая рестеноз после сосудистой интервенции, такой как пластическая операция на сосудах, стентирование, атерэктомия и трансплантация. Все формы сосудистого вмешательства рассмотрены здесь, включая заболевания сердечно-сосудистой и почечной системы, такие как, но не ограничиваясь ими, пластическая операция на сосудах почек, чрескожное коронарное вмешательство (PCI), чрескожная транслюминальная коронарная пластическая операция на сосудах (PTCA), каротидная чрескожная транслюминальная пластическая операция на сосудах (РТА), коронарная байпасная трансплантация, пластическая операция на сосудах с имплантацией стента, периферическое чрескожное транслюминальное вмешательство на подвздошной, бедренной или подколенной артериях и хирургическое вмешательство с использованием пропитанных искусственных трансплантатов. В следующей таблице приведен список главных системных артерий, для которых может потребоваться лечение, которые все рассмотрены здесь:
|
Примеры дисфункциональных расстройств сна и связанные синдромы включают, но не ограничены ими, раскрытые в публикации США 2005/0222209A1, опубликованной 6 октября 2005, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, храп, апноэ во сне, бессонницу, нарколепсию, синдром беспокойных ног, ночные кошмары, сомнамбулию, расстройство пищевого поведения во время сна и дисфункциональные расстройства сна, связанные с хроническими неврологическими или воспалительными состояниями. Хронические неврологические или воспалительные состояния включают, но не ограничены ими, комплексный регионарный болевой синдром, хроническую боль в области поясницы, скелетно-мышечную боль, артрит, радикулопатию, боль, связанную с раком, фибромиалгию, синдром хронической усталости, висцеральную боль, боль в мочевом пузыре, хронический панкреатит, невропатию (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные нарушения, такие как болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, рассеянный склероз, болезнь Гентингтона, брадикинезию; ригидность мышц; паркинсонический тремор; паркинсоническую походку; замороженное движение; депрессию; дефектную долговременную память, синдром Рубинштейна-Тейби (RTS); деменцию; постуральную нестабильность; гипокинетические нарушения; синуклеиновые нарушения; мультисистемные атрофии; стриатонигральную дегенерацию; оливопонтоцеребеллярную атрофию; синдром Шая-Дрейджера; заболевание двигательных нейронов с паркинсоническими признаками; деменцию с тельцами Леви; нарушения, связанные с патологией Tau; прогрессивный надъядерный паралич; кортикобазальную дегенерацию; лобно-височную деменцию; нарушения, связанные с амилоидной патологией; умеренное когнитивное расстройство; болезнь Альцгеймера с паркинсонизмом; болезнь Вилсона; болезнь Галлервордена-Шпатца; болезнь Чедиака-Хигаси; SCA-3 спиноцеребеллярную атаксию; X-связанную дистонию паркинсонизма; прионное заболевание; гиперкинезы; хорею; баллизм; дистонический тремор; боковой амиотрофический склероз (ALS); травмы ЦНС и миоклонус.
Примеры гемоглобинопатии и связанных нарушений включают, но не ограничены ими, описанные в публикации США 2005/0143420A1, опубликованной 30 июня 2005, которая включена в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, гемоглобинопатию, серповидноклеточную анемию и любые другие нарушения, связанные с дифференцировкой клеток CD34+.
Примеры связанных с TNFα нарушений включают, но не ограничены ими, описанные в WO98/03502 и WO98/54170, которые обе полностью включены в настоящее описание путем ссылки. Частные примеры включают, но не ограничены ими, эндотоксемию или синдром токсического шока; кахексию; респираторный дистресс-синдром взрослых; заболевания резорбции костей, такие как артрит; гиперкальцемию; реакцию трансплантат против хозяина; малярию мозга; воспаление; рост опухоли; хронические легочные воспалительные заболевания; реперфузионное повреждение; инфаркт миокарда; инсульт; циркуляторный шок; ревматоидный артрит; болезнь Крона; ВИЧ-инфекцию и СПИД; другие нарушения, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит, псориатический артрит и другие артритические состояния, септический шок, сепсис, эндотоксиновый шок, заболевание трансплантат против хозяина, истощение, болезнь Крона, неспецифический язвенный колит, рассеянный склероз, системную красную волчанку, ENL при лепре, ВИЧ, СПИД и условно-патогенные инфекции при СПИДе; такие нарушения, как септический шок, сепсис, эндотоксиновый шок, гемодинамический шок и септический синдром, постишемическое реперфузионное повреждение, малярию, микобактериальную инфекцию, менингит, псориаз, застойную сердечную недостаточность, фиброзное заболевание, кахексию, отторжение трансплантата, опухолеродные или злокачественные состояния, астму, аутоиммунное заболевание, лучевые повреждения и гипероксическое альвеолярное повреждение; вирусные инфекции, такие как вызванные вирусами герпеса; вирусный конъюнктивит; или аллергический дерматит.
В других вариантах осуществления изобретение относится к применению соединений по изобретению в различных иммунологических применениях, то есть к применению соединений по изобретению в комбинации с вакцинацией, например, как вакцинный адъювант. Хотя любые способы и образы использования соединений по изобретению в комбинации с вакциной рассматривается здесь, неограничивающим примером таких применений является применение соединений по изобретению в качестве вакцинных адъювантов, согласно режимам введения, раскрытым во временной заявке на патент США 60/712823, поданной 1 сентября 2005, которая полностью включена в настоящее описание путем ссылки. Эти варианты осуществления также касаются применения соединений по изобретению в комбинации с вакцинами для лечения или профилактики рака или инфекционных болезней, и других различные применений соединений по изобретению, таких как, но не ограничиваясь этим, уменьшение или десенсибилизация аллергических реакций.
Дозы соединения по изобретению или их фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства варьируют в зависимости от таких факторов, как: конкретное показание, по которому проводят лечение, профилактику или контроль; возраст и состояние пациента; и количество используемого второго активного средства, если применимо. Вообще, соединение по изобретению или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство может использоваться в количестве от приблизительно 0,1 мг до приблизительно 500 мг в сутки, и может быть приспособлено обычным способом (например, то же самое количество, вводимое каждый день периода лечения, профилактики или контроля), в циклах (например, одну неделю вводят, одну неделю нет), или в количестве, которое увеличивается или уменьшается в течение лечения, профилактики или контроля. В других вариантах осуществления доза может составлять от приблизительно 1 мг до приблизительно 300 мг, от приблизительно 0,1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 200 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 0,1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 20 мг до приблизительно 30 мг или от приблизительно 1 мг до приблизительно 20 мг.
4.3 ВТОРЫЕ АКТИВНЫЕ СРЕДСТВА
Соединение по изобретению или его фармацевтически приемлемая соль, сольват, пролекарство, клатрат или стереоизомер может быть скомбинировано с другими фармакологически активными соединениями (“вторые активные средства”) в способах и композициях по изобретению. Некоторые комбинации могут работать синергически при лечении специфических типов заболеваний или нарушений и состояний и симптомов, связанных с такими заболеваниями или нарушениями. Соединение по изобретению или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство может также работать таким образом, чтобы облегчить неблагоприятные эффекты, связанные с некоторыми вторыми активными средствами, и наоборот.
Один или более вторых активных ингредиентов или средств могут использоваться в способах и композициях по изобретению. Вторые активные средства могут быть большими молекулами (например, белками) или небольшими молекулами (например, синтетическими неорганическими, металлорганическими или органическими молекулами).
Примеры активных средств, представляющих собой большую молекулу, включают, но не ограничены ими, гематопоэтические факторы роста, цитокины и моноклональные и поликлональные антитела. Частными примерами активных средств являются моноклональные антитела анти-CD40 (такие как, например, SGN-40); ингибиторы гистон деацетилазы (такие как, например, SAHA и LAQ 824); ингибиторы белка теплового шока-90 (такие как, например, 17-AAG); ингибиторы киназы рецептора инсулиноподобного фактора роста 1; ингибиторы киназы рецептора фактора роста сосудистого эндотелия (такие как, например, PTK787); ингибиторы рецептора фактора роста инсулина; ингибиторы ацилтрансферазы лизофосфатидиновой кислоты; ингибиторы киназы IkB; ингибиторы p38MAPK; ингибиторы EGFR (такие как, например, гефитиниб и эрлотиниб HCL); антитела HER-2 (такие как, например, трастузумаб (Herceptin®) и пертузумаб (Omnitarg™)); антитела VEGFR (такие как, например, бевацизумаб (Avastin™)); ингибиторы VEGFR (такие как, например, flk-1-специфические ингибиторы киназы, SU5416 и ptk787/zk222584); ингибиторы PI3K (такие как, например, вортманнин); ингибиторы C-Met (такие как, например, PHA-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и антиTNF-α антитела. Примеры активных средств, представляющих собой малые молекулы, включают, но не ограничены ими, противораковые средства и антибиотики (например, кларитромицин).
Некоторые вторые активные соединения, которые могут быть скомбинированы с соединениями по изобретению, варьируют в зависимости от определенного показания, которое подвергают лечению, профилактике или контролю.
Например, для лечения, профилактики или контроля рака, вторые активные средства включают, но не ограничены ими, семаксаниб; циклоспорин; этанерцепт; доксициклин; бортезомиб; лапатиниб (Tykerb®); ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелезин; альдеслейкин; альтретамин; амбомицин; аметантрон ацетат; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепу; азотомицин; батимастат; бензодепу; бикалутамид; бисантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; бреквинар натрия; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карцелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; эльсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбулозол; эзорубицин гидрохлорид; эстрамустин; эстрамустин натрий фосфат; этанидазол; этопозид; этопозид фосфат; этоприн; гидрохлорид фадрозол; фазарабин; фенретинид; флоксуридин; флударабин фосфат; фторурацил; флуроцитабин; фосхидон; фостриецин натрий; гемцитабин; гемцитабин гидрохлорид; гидроксимочевина; идарубицин гидрохлорид; ифосфамид; илмофозин; ипроплатин; иринотекан; иринотекан гидрохлорид; ланреотид ацетат; летрозол; лейпролид ацетат; лиарозол гидрохлорид; лометрексол натрия; ломустин; лозоксантрон гидрохлорид; мазопрокол; майтансин; мехлорэтамин гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепу; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофеноловая кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфозат натрия; спарсомицин; спирогерманий гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрия; таксотер; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифен цитрат; трестолон ацетат; трицирибин фосфат; триметрексат; триметрексат глюкуронат; трипторелин; тубулозол гидрохлорид; урамустин; уредепу; вапреотид; вертепорфин; винбластин сульфат; винкристин сульфат; виндезин; виндезин сульфа; винепидин сульфат; винглицинат сульфат; винлеурозин сульфат; винорелбин тартрат; винрозидин сульфат; винзолидин сульфат; ворозол; зениплатин; зиностатин; и зорубицин гидрохлорид.
Другие вторые средства включают, но не ограничены ими, 20-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфулвен; адеципенол; адозелезин; альдеслейкин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; анти-дорсализирующий морфогенетический белок-1; антиандроген рака предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин глицинат; модуляторы генов апоптоза; регуляторы апоптоза; апуриновая кислота; ара-CDP-DL-PTBA; аргинин дезаминаза; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бетакламицин B; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен A; бизелезин; брефлат; бропиримин; будотитан; бутионин сульфоксимин; кальципотриол; кальфостин C; производные камптотецина; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest M3; CARN 700; ингибитор хрящевого происхождения; карзелезин; ингибиторы казеин киназы (ICOS); кастаноспермин; цекропин B; цетрореликс; хлорины; хлорхиноксалин сульфамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналог комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин A; циклопентантрахиноны; циклоплатам; ципемицин; цитарабин окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенил спиромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эдельфозин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; флуородауноруницин гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; тексафирин гадолиний; галлий нитрат; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; циклогексан бисацетамид; гиперицин; ибандроновая кислота; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; иматиниб (Gleevec®), имихимод; иммуностимулирующие пептиды; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; йододоксорубицин; ипомеанол, 4-; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итасетрон; йасплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинан сульфат; лептолстатин; летрозол; лейкоз-ингибирующий фактор; лейкоцитарный альфа-интерферон; лейпролид+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол; линейный аналог полиамина; пептид липофильного дисахарида; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; лютеций тексафирин; лизофиллин; литические пептиды; майтанзин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матриксной металлопротеиназы; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин,сапорин-фактор роста фибробластов; митоксантрон; мофаротен; молграмостим; Erbitux, человеческий хорионический гонадотропин; монофосфорил липид A+ клеточная оболочка myobacterium sk; мопидамол; горчичное противораковое средство; микапероксид B; экстракт клеточных оболочек микобактерий; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновая кислота; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; облимерсен (Genasense®); O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; пероральный индуктор цитокинов; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаза; пелдезин; пентозан полисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин гидрохлорид; пирарубицин; пиритрексим; плацетин A; плацетин B; ингибитор активатора плазминогена; платиновые комплексы; платиновые соединения; комплекс платина-триамин; порфимер натрия; порфиромицин; преднизон; пропил бис-акридон; простагландин J2; ингибиторы протеасомы; иммунный модулятор на основе А-белка; ингибитор протеинкиназы C; ингибиторы протеинкиназы C, микроводорослевые; ингибиторы тирозин протеин фосфатазы; ингибиторы пурин нуклеозид фосфорилазы; пурпурины; пиразолоакридин; пиридоксилированный конъюгат гемоглобина и полиоксиэтилена; raf-антагонисты; ралтитрексед; рамосетрон; ингибиторы ras фарнезил протеин трансферазы; ингибиторы ras; ингибитор ras-GAP; деметилированный ретеллиптин; рений Re 186 этидронат; ризоксин; рибозимы; RII ретинамид; рогитукин; ромуртид; рохинимекс; рубигинон B1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семустин; происходящий из стареющих клеток ингибитор 1; смысловые олигонуклеотиды; ингибиторы трансдукции сигнала; сизофиран; собузоксан; натрий боркаптат; натрий фенилацетат; солверол; соматомединсвязывающий белок; сонермин; спарфозовая кислота; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; антагонист суперактивного вазоактивного интестинального пептида; сурадиста; сурамин; свайнсонин; таллимустин; тамоксифен метиодид; тауромустин; тазаротен; натрий текогалан; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тималфазин; агонист рецептора тимопоэтина; тимотринан; тироидстимулирующий гормон; этиопурпурин этилолова; тирапазамин; титаноцен бихлорид; топсентин; торемифен; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; ингибирующий рост фактор, происходящий из урогенитального синуса; антагонисты рецептора урокиназы; вапреотид; вариолин B; веларесол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; и стималамер зиностатина.
Частные примеры вторых активных средств включают, но не ограничены ими, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза в клетках множественной миеломы (таких как, например, TRAIL), статины, семаксаниб, циклоспорин, этанерцепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселоду, СРТ-11, альфа-интерферон, ПЭГилированный альфа-интерферон (например, PEG INTRON-A), капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, паклитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бисульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустин натрий фосфат (Emcyt®), сулиндак и этопозид.
В другом варианте осуществления частные примеры вторых средств согласно показаниям для лечения, профилактики или контроля могут быть найдены в следующих ссылках, которые все полностью включены в настоящее описание: патенты США 6281230 и 5635517; публикации США 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154880, 2006/0122228 и 2005/0143344; и временная заявка на патент США 60/631870.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или устранения боли, включают, но не ограничены ими, обычные терапевтические средства, обычно используемые для лечения или профилактики боли, такие как антидепрессанты, противосудорожные средства, гипотензивные средства, транквилизаторы, блокаторы кальциевых каналов, миорелаксанты, ненаркотические аналгезирующие средства, опиоидные аналгезирующие средства, противовоспалительные средства, ингибиторы сох-2, иммуномодулирующие средства, агонисты или антагонисты альфа-адренергических рецепторов, иммуносупрессивные средства, кортикостероиды, гипербарический кислород, кетамин, другие анестезирующие средства, антагонисты NMDA и другие терапевтические средства, которые можно найти, например, в Physician's Desk Reference 2003. Частные примеры включают, но не ограничены ими, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), окскарбазепин (Trileptal®), вальпроевую кислоту (Depakene®), морфин сульфат, гидроморфон, преднизон, гризеофулвин, пентоний, алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тиреокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилий, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лигнокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, виокс, циконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тризанидин и феноксибензамин
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля дегенерации желтого пятна и связанных синдромов, включают, но не ограничены ими, стероид, сенсибилизатор света, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейтротрофиновый фактор, регулятор неоваскуляризации, анти-VEGF антитело, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или соединения, подавляющие ангиогенез, или их комбинации. Частные примеры включают, но не ограничены ими, вертепорфин, пурлитин, ангиостатический стероид, rhuFab, интерферон-2α, пентоксифиллин, этиопурпурин олова, мотексафин, люцентис, лютеций, 9-фтор-11,21-дигидрокси-16, 17-1-метилэтилиденбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. патент США 6225348), тетрациклин и его производные, рифамицин и его производные, вещества с макроциклическим лактонным кольцом, метронидазол (патенты США 6218369 и 6015803), генистеин, генистин, 6'-O-Mal генистин, 6'-O-Ac генистин, даидзеин, даидзин, 6'-O-Mal даидзин, 6'-O-Ac даидзин, глицитеин, глицитин, 6'-O-Mal глицитин, биоханин A, формононетин (патент США 6001368), триамцинолон ацетомид, дексаметазон (патент США 5770589), талидомид, глутатион (патент США 5632984), основной фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), нейротрофный фактор мозгового происхождения (BDNF), фактора активатора плазмогена типа 2 (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и имплантат RETISERT (BausCH и Lomb). Все ссылки, процитированные здесь, полностью включены путем ссылки.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля кожных заболеваний, включают, но не ограничены ими, кератолитики, ретиноиды, α-гидроксикислоты, антибиотики, коллаген, ботулический токсин, интерферон, стероиды и иммуномодулирующие средства. Частные примеры включают, но не ограничены ими, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислоту, молочную кислоту, лактат аммония, мочевину, третиноин, изотретиноин, антибиотики, коллаген, ботулический токсин, интерферон, кортикостероид, трансретиноевую кислоту и коллагены, такие как человеческий плацентарный коллаген, животный плацентарный коллаген, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля легочной гипертензии и связанных нарушений, включают, но не ограничены ими, антикоагулирующие средства, мочегонные средства, сердечные гликозиды, блокаторы кальциевых каналов, сосудорасширяющие средства, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы ФДЭ V), ингибиторы эндопептидазы, липидпонижающие средства, ингибиторы тромбоксана и другие терапевтические средства, известные как снижающие давление в легочной артерии. Частные примеры включают, но не ограничены ими, варфарин (Coumadin®), мочегонное средство, сердечный гликозид, дигоксин-кислород, дилтиазем, нифедипин, сосудорасширяющие средства, такие как простациклин (например, простагландин I2 (PGI2), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), босентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля связанных с асбестом нарушений, включают, но не ограничены ими, антрациклин, платину, алкилирующий агент, облимерсен (Genasense®), цисплатин, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, паклитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бисульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин C, мепакрин, тиотепу, тетрациклин и гемцитабин.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля паразитарных заболеваний, включают, но не ограничены ими, хлорохин, хинин, хинидин, периметамин, сульфадиазин, доксициклин, клиндамицин, мефлохин, галофантрин, примахин, гидроксихлорохин, прогуанил, атоваквон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин B, пятивалентные соединения сурьмы (например, натрий стибоглюкуронат), гамма-интерферон, итраконазол, комбинацию мертвых промастиготов и БЦЖ, лейковорин, кортикостероиды, сульфамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля иммунодефицитов, включают, но не ограничены ими, антибиотики (терапевтические или профилактические), такие как, но не ограничиваясь ими, ампициллин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но не ограничиваясь ими, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; гемолимфу; лекарственные средства, усиливающие иммунную систему, такие как, но не ограничиваясь ими, левамизол и изопринозин; биопрепараты, такие как, но не ограничиваясь ими, гаммаглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но не ограничиваясь ими, тимусный; и другие иммунологические средства, такие как, но не ограничиваясь ими, B-лимфоцитарные стимуляторы (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-α), антитела (например, анти-CD40 и IgM), олигонуклеотиды, содержащие неметилированные звенья CpG, и вакцины (например, вакцины на основе вирусного и опухолевого пептида).
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля нарушений ЦНС, включают, но не ограничены ими, опиоиды; агонист или антагонист допамина, такой как, но не ограничиваясь ими, Леводопа, L-ДОПА, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам мезилат, каберголин, прамипексол дигидрохлорид, ропинорол, амантадин гидрохлорид, селегилин гидрохлорид, карбидопу, перголид мезилат, Sinemet CR и Symmetrel; ингибитор MAO, такой как, но не ограничиваясь ими, ипрониазид, клоргилин, фенелзин и изокарбоксазид; ингибитор COMT, такой как, но не ограничиваясь ими, толкапон и энтакапон; ингибитор холинэстеразы, такой как, но не ограничиваясь ими, физостигмин саликлат, физостигмин сульфат, физостигмин бромид, меостигмин бромид, неостигмин метилсульфат, амбеноним хлорид, эдрофоний хлорид, такрин, пралидоксим хлорид, обидоксим хлорид, тримедоксим бромид, диацетил моноксим, эндрофоний, пиридостигмин и демекарий; противовоспалительное средство, такое как, но не ограничиваясь ими, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D-Иммуно Глобулин, мофетил микофенилат, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрия, толметин, кеторолак, дихлофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотное средство, такое как, но не ограничиваясь ими, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлаталь, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смесь.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля повреждений ЦНС и связанных синдромов, включают, но не ограничены ими, иммуномодулирующие средства, иммуносупрессивные средства, гипотензивные средства, противосудорожные средства, фибринолитические средства, антитромбоцитарные средства, нейролептики, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или обычные средства, используемые у больных с травмой/повреждением ЦНС и связанными синдромами. Частные примеры включают, но не ограничены ими, стероиды (например, глюкокортикоиды, такие как, но не ограничиваясь ими, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительное средство, включая, но не ограничиваясь ими, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D-Иммуно Глобулин, мофетил микофенилат, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрия, толметин, кеторолак, дихлофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон; аналог цАМФ, включая, но не ограничиваясь ими, db-цАМФ; средство, включающее метилфенидатовое лекарственное средство, которое включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат и их смесь; и мочегонное средство, такое как, но не ограничиваясь ими, маннит, фуросемид, глицерин и мочевина.
Примеры второго активного средства, которое может использоваться для лечения, профилактики и/или контроля дисфункциональных расстройств сна и связанных синдромов, включают, но не ограничены ими, трициклическое антидепрессантное средство, селективный ингибитор обратного захвата серотонина, антиэпилептическое средство (габапентин, прегабалин, карбамазепин, окскарбазепин, левитирацетам, топирамат), антиаритмическое средство, средство, блокирующее натриевые каналы, селективный ингибитор медиатора воспаления, опиоидное средство, второе иммуномодулирующее соединение, комбинированное средство и другие известные или обычные средства, используемые в терапии сна. Частные примеры включают, но не ограничены ими, нейронтин, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, Леводопу, L-ДОПУ, кокаин, α-метил-тирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам мезилат, каберголин, прамипексол дигидрохлорид, ропинорол, амантадин гидрохлорид, селегилин гидрохлорид, карбидопу, перголид мезилат, Sinemet CR, Symmetrel, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмин саликлат, физостигмин сульфат, физостигмин бромид, меостигмин бромид, неостигмин метилсульфат, амбеноним хлорид, эдрофоний хлорид, такрин, пралидоксим хлорид, обидоксим хлорид, тримедоксим бромид, диацетил моноксим, эндрофоний, пиридостигмин, демекарий, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D-Иммуно Глобулин, мофетил микофенилат, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрия, толметин, кеторолак, дихлофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смесь.
Примеры вторых активных средств, которые могут использоваться для лечения, профилактики и/или контроля гемоглобинопатии и связанных нарушений, включают, но не ограничены ими, интерлейкины, такие как IL-2 (включая рекомбинантный IL-II (“rIL2”) и канарипокс IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-I a и интерферон гамма-I b; и G-CSF; гидроксимочевину; бутираты или производные бутирата; закись азота; гидроксимочевину; HEMOXIN™ (NIPRISAN™; см. патент США 5800819); антагонисты каналов Gardos, такие как клотримазол и производные триарил метана; дефероксамин; белок C; и переливания крови, или заменитель крови, такой как Hemospan™ или Hemospan™ PS (Sangart).
Введение соединения по изобретению или его фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства и вторых активных средств пациенту может проводиться одновременно или последовательно одним и тем же или разными путями введения. Пригодность конкретного пути введения, используемого для конкретного активного средства, зависит непосредственно от активного средства (например, от того, может ли оно вводиться перорально, не распадаясь до поступления в кровоток), и подвергаемого лечению заболевания. Одним из путей введения для соединений по изобретению является пероральный. Пути введения для вторых активных средств или ингредиентов известны специалисту в данной области техники. См., например, Physicians' Desk Reference (60th ed., 2006).
В одном варианте осуществления второе активное средство вводят внутривенно или подкожно и несколько раз в сутки в количестве от приблизительно 1 до приблизительно 1000 мг, от приблизительно 5 до приблизительно 500 мг, от приблизительно 10 до приблизительно 350 мг или от приблизительно 50 до приблизительно 200 мг. Конкретное количество второго активного средства зависит от конкретного используемого средства, типа заболевания, подвергаемого лечению или контролю, серьезности и стадии заболевания и количества соединений по изобретению и любых возможных дополнительных активных средств, одновременно вводимых пациенту.
Как обсуждается в других местах настоящего описания, изобретение также относится к способу ослабления, лечения и/или предотвращения неблагоприятных или нежелательных эффектов, связанных с обычной терапией, включая, но не ограничиваясь ими, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Соединения по изобретению и другие активные ингредиенты могут вводиться пациенту до, в течение или после возникновения неблагоприятного эффекта, связанного с обычной терапией.
4.4 ЦИКЛИЧЕСКАЯ ТЕРАПИЯ
В некоторых вариантах осуществления профилактическое или терапевтическое средства по изобретению циклически вводят пациенту. Циклическая терапия включает введение активного средства в течение определенного срока с последующим перерывом (то есть, прекращением введения) в течение определенного времени и повторением этого последовательного введения. Циклическая терапия может уменьшить развитие резистентности к одной или более терапиям, избежать или уменьшить побочные эффекты одной из терапий и/или улучшить эффективность лечения.
Следовательно, в одном варианте осуществления соединение по изобретению вводят ежедневно в единственной дозе или раздельных дозах в цикле от четырех до шести недель с периодом приблизительно недели или двух недель покоя. Циклическая терапия дополнительно позволяет увеличить частоту, число и длительность циклов введения. Таким образом, другой вариант осуществления охватывает введение соединения по изобретению в течение большего числа циклов, чем обычно, когда его вводят индивидуально. В еще одном варианте осуществления, соединение по изобретению вводят в течение большего числа циклов, чем обычно вызвающее ограничивающую дозу токсичность у пациента, которому также не вводят второй активный ингредиент.
В одном варианте осуществления соединение по изобретению вводят ежедневно и непрерывно в течение трех или четырех недель в дозе от приблизительно 0,1 мг до приблизительно 500 мг в сутки, с последующим отдыхом в течение одной или двух недель. В других вариантах осуществления доза может составлять от приблизительно 1 мг до приблизительно 300 мг, от приблизительно 0,1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 200 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 0,1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 20 мг до приблизительно 30 мг или от приблизительно 1 мг до приблизительно 20 мг, с последующим отдыхом.
В одном варианте осуществления соединение по изобретению и второй активный ингредиент вводят перорально, причем введение соединения по изобретению осуществляют за 30-60 минут до второго активного ингредиента, в течение цикла от четырех до шести недель. В другом варианте осуществления комбинацию соединения по изобретению и второго активного ингредиента вводят внутривенной инфузией приблизительно в течение 90 минут за каждый цикл.
Как правило, число циклов, в течение которых комбинированное лечение вводят пациенту, составляет от приблизительно одного до приблизительно 24 циклов, от приблизительно двух до приблизительно 16 циклов или от приблизительно четырех до приблизительно трех циклов.
4.5 ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ЛЕКАРСТВЕННЫЕ ФОРМЫ
Фармацевтические композиции могут использоваться для получения индивидуальных разовых лекарственных форм. Фармацевтические композиции и лекарственные формы по изобретению включают соединение по изобретению или его фармацевтически приемлемую соль, сольват, стереоизомер, клатрат или пролекарство. Фармацевтические композиции и лекарственные формы могут дополнительно включать один или более эксципиентов.
Фармацевтические композиции и лекарственные формы по изобретению могут также включать один или более дополнительных активных ингредиентов. Примеры дополнительного второго или дополнительных активных ингредиентов раскрыты выше в Разделе 4.3.
Разовые стандартные лекарственные формы по изобретению являются подходящими для перорального, мукозального (например, назального, подъязычного, влагалищного, щечного или ректального), парентерального (например, подкожного, внутривенного, болюсного вливания, внутримышечного или внутриартериального), топического (например, глазные капли или другие глазные препараты), трансдермального или чрескожного введение пациенту. Примеры лекарственных форм включают, но не ограничены ими: таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; таблетки для рассасывания; дисперсии; суппозитории; порошки; аэрозоли (например, назальный спрей или составы для ингаляции); гели; жидкие лекарственные формы, подходящие для перорального или мукозального введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; глазные капли или другие глазные препараты, подходящие для топического введения; и стерильные твердые продукты (например, кристаллические или аморфные твердые вещества), которые могут быть ресуспендированы с образованием жидких лекарственных форм, подходящих для парентерального введения пациенту.
Состав, форма и тип лекарственных форм обычно варьируют в зависимости от их использования. Например, лекарственная форма, используемая при остром лечении заболевания, может содержать большие количества одного или более активных ингредиентов, которые она включает, чем лекарственная форма, используемая при хроническом лечении того же самого заболевания. Точно так же, парентеральная лекарственная форма может содержать меньшие количества одного или более активных ингредиентов, которые она включает, чем пероральная лекарственная форма, используемая для лечения того же самого заболевания. Эти и другие пути, которыми используются определенные лекарственные формы, могут варьировать, что очевидно для специалиста. См., например, Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing, Easton PA (2000).
В одном варианте осуществления фармацевтические композиции и лекарственные формы включают один или более эксципиентов. Подходящие эксципиенты известны специалисту в области фармации, и неограничивающие примеры подходящих эксципиентов приведены здесь. Является ли специфический эксципиент подходящим для включения в фармацевтическую композицию или лекарственную форму, зависит от различных факторов, известных в данной области техники, включая, но не ограничиваясь ими, путь, которым лекарственную форму вводят пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать эксципиенты, не подходящие для использования в парентеральных лекарственных формах. Пригодность конкретного эксципиента может также зависеть от определенных активных ингредиентов в лекарственной форме. Например, разложение некоторых активных ингредиентов может быть ускорено некоторыми эксципиентами, такими как лактоза, или под действием воды. Активные ингредиенты, которые включают первичные или вторичные амины, являются особенно склонными к такому ускоренному разложению. Следовательно, изобретение относится к фармацевтическим композициям и лекарственным формам, которые содержат немного, если таковые вообще имеются, лактозы или других моно- или дисахаридов. В рамках изобретения термин "без лактозы" означает, что количество присутствующей лактозы, если таковая вообще имеется, является недостаточным, чтобы по существу увеличить скорость разложения активного ингредиента.
Композиции без лактозы могут включать эксципиенты, которые являются известными в данной области техники и перечислены, например, в U.S. Pharmacopeia (USP) 25-NF20 (2002). В общем, композиции без лактозы включают активные ингредиенты, связующее/наполнитель и лубрикант в фармацевтически совместимых и фармацевтически приемлемых количествах. В одном варианте осуществления лекарственные формы без лактозы включают активные ингредиенты, микрокристаллическую целлюлозу, предварительно желатинизированный крахмал и стеарат магния.
Также изобретение относится к безводным фармацевтическим композициям и лекарственным формам, включающим активные ингредиенты, так как вода может способствовать разложению некоторых соединений. Например, добавление воды (например, 5%) широко принято в фармацевтической области, как средство моделирования длительного хранения для определения таких характеристик, как срок хранения или стабильность составов в течение долгого времени. См., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В действительности, вода и высокая температура ускоряют разложение некоторых соединений. Таким образом, влияние воды на состав может иметь большое значение, так как с влагой и/или влажностью обычно сталкиваются в течение производства, обращения, упаковки, хранения, отгрузки и использования составов.
Безводные фармацевтические композиции и лекарственные формы могут быть получены с использованием безводных или содержащих малое количество влаги ингредиентов и условий низкой влажности. Фармацевтические композиции и лекарственные формы, которые включают лактозу и по меньшей мере один активный ингредиент, который включает первичный или вторичный амин, являются безводными, если ожидается реальный контакт с влагой и/или влажностью в ходе производства, упаковки и/или хранения.
Безводная фармацевтическая композиция должна быть получена и храниться так, чтобы ее безводная природа была сохранена. Соответственно, безводные композиции, в одном варианте осуществления, упаковывают с использованием материалов, известных как предотвращающие контакт с водой так, что они могут быть включены в подходящие наборы. Примеры подходящей упаковки включают, но не ограничены ими, герметично герметизированную фольгу, пластические массы, контейнеры с разовой дозой (например, ампулы), блистерные упаковки и контурные упаковки.
Также изобретение относится к фармацевтическим композициям и лекарственным формам, которые включают одно или более соединений, которые уменьшают скорость, с которой распадется активный ингредиент. Такие соединения, которые упомянуты здесь как "стабилизаторы", включают, но не ограничены ими, антиоксиданты, такие как аскорбиновая кислота, буферы или солевые буферы.
Как количества и типы эксципиентов, количества и определенные типы активных ингредиентов в лекарственной форме могут отличаться в зависимости от таких факторов, как, но не ограничиваясь ими, путь, которым ее вводят пациентам. В одном варианте осуществления лекарственные формы включают соединение по изобретению в количестве от приблизительно 0,10 до приблизительно 500 мг. В других вариантах осуществления лекарственные формы включают соединение по изобретению в количестве приблизительно 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг.
В других вариантах осуществления лекарственные формы включают второй активный ингредиент в количестве от 1 до приблизительно 1000 мг, от приблизительно 5 до приблизительно 500 мг, от приблизительно 10 до приблизительно 350 мг или от приблизительно 50 до приблизительно 200 мг. Конечно, определенное количество второго активного средства зависит от определенного используемого средства, заболеваний или нарушений, подвергаемых лечению или контролю, и количества соединения по изобретению и любых дополнительных активных средств, одновременно вводимых пациенту.
4.5.1 Пероральные лекарственные формы
Фармацевтические композиции, которые являются подходящими для перорального введения, можно получить как отдельные лекарственные формы, такие как, но не ограничиваясь ими, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат предопределенные количества активных ингредиентов и могут быть получены способами, известным специалистам в области фармации. См. в целом, Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing, Easton PA (2000).
Пероральные лекарственные формы по изобретению получают, комбинируя активные ингредиенты в тесной смеси по меньшей мере с одним эксципиентом согласно обычным фармацевтическим методикам компаундирования. Эксципиенты могут принимать широкую разновидность форм в зависимости от формы препарата, желательной для введения. Например, эксципиенты, подходящие для использования в пероральных жидких или аэрозольных лекарственных формах, включают, но не ограничены ими, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители. Примеры эксципиентов, подходящих для использования в твердых пероральных лекарственных формах (например, порошках, таблетках, капсулах и каплетах), включают, но не ограничены ими, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие средства, лубриканты, связующие и дезинтеграторы.
В одном варианте осуществления пероральные лекарственные формы представляют собой таблетки или капсулы, когда используются твердые эксципиенты. В другом варианте осуществления таблетки могут быть покрыты стандартными водными или неводными методиками. Такие лекарственные формы могут быть получены любым из фармацевтических способов. В общем, фармацевтические композиции и лекарственные формы получают однородным и тесным смешением активных ингредиентов с жидкими носителями, тонкодисперсными твердыми носителями или обоими, и затем формированием продукта в желательную форму в случае необходимости.
Например, таблетка может быть получена прессованием или формованием. Прессованные таблетки могут быть получены прессованием в подходящем механизме активных ингредиентов в сыпучей форме, такой как порошок или гранулы, в случае необходимости смешанных с эксципиентом. Формованные таблетки могут быть получены формованием в подходящем механизме смеси порошкового соединения, увлажненного инертным жидким разбавителем.
Примеры эксципиентов, которые могут использоваться в пероральной лекарственной форме по изобретению, включают, но не ограничены ими, связующие, наполнители, дезинтеграторы и лубриканты. Связующие, подходящие для использования в фармацевтических композициях и лекарственных формах, включают, но не ограничены ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, натуральные и синтетические смолы, такие как гуммиарабик, альгинат натрия, альгиновая кислота, другие альгинаты, порошковый трагакант, гуаровую смолу, целлюлозу и ее производные (например, этилцеллюлозу, ацетилцеллюлозу, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, предварительно желатинизированный крахмал, гидроксипропил метилцеллюлозу (например, №№ 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящие формы микрокристаллической целлюлозы включают, но не ограничены ими, материалы, выпускаемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Частным примером связующего является смесь микрокристаллической целлюлозы и натрий карбоксиметилцеллюлозы, выпускаемой как AVICEL RC-581. Подходящие безводные или содержащие малое количество влаги эксципиенты или добавки включают AVICEL-PH-103™ и Starch 1500 LM.
Примеры наполнителей, подходящих для использования в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничены ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, предварительно желатинизированный крахмал и их смеси. Связующее или наполнитель в фармацевтических композициях, в одном варианте осуществления, присутствуют в количестве от приблизительно 50 до приблизительно 99 процентов от массы фармацевтической композиции или лекарственной формы.
Дезинтеграторы могут использоваться в композициях для получения таблеток, которые распадаются под действием водной среды. Таблетки, которые содержат слишком много дезинтеграторов, могут распадаться при хранении, в то время как те, которые содержат слишком мало дезинтеграторов, могут не распадаться с желаемой скоростью или в желаемых условиях. Таким образом, достаточное количество дезинтеграторов, которое не является ни слишком большим, ни слишком маленьким для неблагоприятного изменения высвобождения активных ингредиентов, может использоваться для получения твердых пероральных лекарственных форм. Количество используемых дезинтеграторов варьирует в зависимости от типа состава и легко может быть определено специалистом в данной области техники. В одном варианте осуществления фармацевтические композиции включают от приблизительно 0,5 до приблизительно 15 весовых процентов дезинтеграторов или от приблизительно 1 до приблизительно 5 весовых процентов дезинтеграторов.
Дезинтеграторы, которые могут использоваться в фармацевтических композициях и лекарственных формах, включают, но не ограничены ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия, гликолят крахмала натрия, картофельный крахмал или крахмал тапиоки, другие крахмалы, предварительно желатинированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, смолы и их смеси.
Лубриканты, которые могут использоваться в фармацевтических композициях и лекарственных формах, включают, но не ограничены ими, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурил сульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар-агар и их смеси. Дополнительные лубриканты включают, например, силоидный силикагель (AEROSIL200, выпускаемый W.R. Grace Co. Балтимор, MD), коагулированный аэрозоль синтетического диоксида кремния (выпускаемый Degussa Co. Plano, TX), CAB-O-SIL (пирогенный продукт диоксида кремния, выпускаемый Cabot Co. Бостон, MA) и их смеси. Если они вообще используются, лубриканты могут использоваться в количестве менее чем приблизительно 1 весовой процент от массы фармацевтических композиций или лекарственных форм, в которые они включены.
В одном варианте осуществления твердая пероральная лекарственная форма включает соединение по изобретению, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидный безводный диоксид кремния и желатин.
4.5.2 Лекарственные формы контролируемого высвобождения
Активные ингредиенты, такие как соединения по изобретению, могут вводиться средствами контролируемого высвобождения или устройствами для доставки, которые являются известными специалисту в данной области техники. Примеры включают, но не ограничены ими, описанные в патентах США №№: 3845770; 3916899; 3536809; 3598123 и 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556; 5639480; 5733566; 5739108; 5891474; 5922356; 5972891; 5980945; 5993855; 6045830; 6087324; 6 113 943; 6197350; 6248363; 6264970; 6267 981; 6376461; 6419961; 6589548; 6613358; 6699500, каждый из которых включен в настоящее описание путем ссылки. Такие лекарственные формы могут использоваться для обеспечения медленного или контролируемого высвобождения одного или более активных ингредиентов с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинации, чтобы обеспечить желаемый профиль высвобождения в варьирующих соотношениях. Подходящие составы контролируемого высвобождения, известные специалисту в данной области техники, включая описанные здесь, могут быть легко выбраны для использования с активными ингредиентами по изобретению. Таким образом, композиции по изобретению охватывают лекарственные формы разовой дозы, подходящие для перорального приема, такие как, но не ограничиваясь ими, таблетки, капсулы, желатиновые капсулы и каплеты, которые адаптированы для контролируемого высвобождения.
Все фармацевтические продукты контролируемого высвобождения имеют общую цель улучшения лекарственной терапии по сравнению с достигаемой их аналогами неконтролируемого высвобождения. В идеале, использование оптимально разработанного препарата контролируемого высвобождения в лечении характеризуется минимумом вещества лекарственного средства, используемого для лечения или контроля состояния за минимальное время. Преимущества составов контролируемого высвобождения включают расширенную активность лекарственного средства, уменьшенную частоту введения и увеличенный комплаенс пациента. Кроме того, составы контролируемого высвобождения могут использоваться для изменения времени начала действия или других характеристик, таких как уровни в крови лекарственного средства, и могут таким образом влиять на возникновение побочных (например, неблагоприятных) эффектов.
Большинство составов контролируемого высвобождения разработано таким образом, чтобы первоначально высвобождать количество лекарственного средства (активного ингредиента), которое быстро производит желаемый терапевтический эффект, и постепенно и непрерывно высвобождать другие количества лекарственного средства, чтобы поддержать этот уровень терапевтического или профилактического эффекта в течение расширенного промежутка времени. Чтобы поддержать этот постоянный уровень лекарственного средства в организме, лекарственное средство должно быть высвобождено из лекарственных форм со скоростью, которая позволяет замещать количество метаболизированного и выделенного из организма лекарственного средства. Контролируемое высвобождение активного ингредиента может стимулироваться различными условиями, включая, но не ограничиваясь ими, температуру, ферменты, воду или другие физиологические условия или соединения.
В некоторых вариантах осуществления лекарственное средство можно вводить, используя внутривенную инфузию, имплантируемый осмотический насос, трансдермальный пластырь, липосомы или другие способы введения. В одном варианте осуществления может использоваться насос (см., Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)). В другом варианте осуществления могут использоваться полимерные материалы. В еще одном варианте осуществления система контролируемого высвобождения может быть размещена у пациента на подходящем участке тела, определенном специалистом, то есть, таким образом требуя только часть системной дозы (см., например, Goodson, Medical Applications of Controlled Release, vol. 2, pp. 115-138 (1984)). Другие системы контролируемого высвобождения обсуждаются в обзоре Langer (Science 249:1527-1533 (1990)). Активный ингредиент может быть диспергирован в твердой внутренней матрице, например, из полиметилметакрилата, полибутилметакрилата, пластифицированного или непластифицированного поливинилхлорида, пластифицированного нейлона, пластифицированного полиэтилентерефталата, натурального каучука, полиметилбутадиена, полиизобутилена, полибутадиена, полиэтилена, сополимеров этилен-винилацетата, силиконовых каучуков, полидиметилсилоксанов, сополимеров карбоната силикона, гидрофильных полимеров, таких как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллагена, поперечно сшитого поливинилового спирта и поперечно сшитого частично гидролизованного поливинилацетата, которая окружена внешней полимерной мембраной из, например, полиэтилена, полипропилена, сополимеров этилен/пропилен, сополимеров этилен/этилакрилат, сополимеров этилен/винилацетат, силиконовых каучуков, полидиметилсилоксанов, неопренового каучука, хлорированного полиэтилена, поливинилхлорида, сополимеров винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, полиэтилентерефталата ионосодержащего полимера, эпихлоргидрин бутилкаучука, сополимера этилен/виниловый спирт, тройного сополимера этилен/винилацетата/виниловый спирт и сополимера этилен/винилоксиэтанол, который является нерастворимым в жидкостях организма. Активный ингредиент затем диффундирует через внешнюю полимерную мембрану на стадии высвобождения с контролируемой скоростью. Процент активного ингредиента в таких парентеральных композициях чрезвычайно зависит от его конкретной природы, а также потребностей пациента.
4.5.3 Парентеральные лекарственные формы
Парентеральные лекарственные формы могут вводиться пациентам различными путями, включая, но не ограничиваясь ими, подкожный, внутривенный (включая болюсное вливание), внутримышечный и внутриартериальный. В некоторых вариантах осуществления введение парентеральной лекарственной формы обходит естественную защиту пациентов против загрязняющих примесей, и таким образом, в этих вариантах осуществления, парентеральные лекарственные формы являются стерильными или могут быть стерилизованы до введения пациенту. Примеры парентеральных лекарственных форм включают, но не ограничены ими, растворы, готовые для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции, суспензии, готовые для инъекции, и эмульсии.
Подходящие носители, которые могут использоваться для получения парентеральных лекарственных форм, известны специалисту. Примеры включают, но не ограничены ими, воду для инъекций USP; водные носители, такие как, но не ограничиваясь ими, раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и лактатсодержащий раствор Рингера для инъекций; водорастворимые носители, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые увеличивают растворимость одного или более активных ингредиентов, раскрытых здесь, могут также быть включены в парентеральные лекарственные формы. Например, циклодекстрин и его производные могут использоваться для увеличения растворимости соединения по изобретению. См., например, патент США 5134127, который включен в настоящее описание путем ссылки.
4.5.4 Топические и мукозальные лекарственные формы
Топические и мукозальные лекарственные формы по изобретению включают, но не ограничены ими, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли или другие глазные препараты, или другие формы, известные специалисту в данной области техники. См., например, Remington's Pharmaceutical Sciences, 16th, 18th and 20th eds., Mack Publishing, Easton PA (1980, 1990 and 2000); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Лекарственные формы, подходящие для обработки относящихся к слизистой оболочке тканей в пределах полости рта, могут быть составлены как жидкости для полоскания рта или как пероральные гели.
Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут использоваться для получения топических и мукозальных лекарственных форм, охваченных настоящим изобретением, известны специалисту в области фармации и зависят от конкретной ткани, на которую будут нанесены данная фармацевтическая композиция или лекарственная форма. В одном варианте осуществления эксципиенты включают, но не ограничены ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, чтобы образовывать растворы, эмульсии или гели, которые являются нетоксичными и фармацевтически приемлемыми. Увлажняющие крема или увлажнители могут также быть добавлены к фармацевтическим композициям и лекарственным формам. Примеры дополнительных ингредиентов известны в данной области техники. См., например, Remington's Pharmaceutical Sciences, 16th,18th and 20th eds., Mack Publishing, Easton PA (1980, 1990 и 2000).
Величина рН фармацевтической композиции или лекарственной формы может также быть отрегулирована так, чтобы улучшить доставку одного или более активных ингредиентов. Кроме того, полярность носителя растворителя, его ионная сила или тоничность может быть отрегулирована так, чтобы улучшить доставку. Такие соединения, как стеараты, могут также быть добавлены к фармацевтическим композициям или лекарственным формам, чтобы изменить гидрофильность или липофильность одного или более активных ингредиентов для улучшения доставки. В других вариантах осуществления стеараты могут служить липидным носителем для состава, эмульгатором или поверхностно-активным веществом, или средством, улучшающим доставку или усиливающим проникновение. В других вариантах осуществления соли, сольваты, пролекарства, клатраты или стереоизомеры активных ингредиентов могут использоваться для дальнейшей корректировки свойств конечной композиции.
4.6 НАБОРЫ
В одном варианте осуществления активные ингредиенты по изобретению не вводят пациенту в одно и то же время или одним и тем же путем введения. В другом варианте осуществления изобретение относится к наборам, которые могут упростить введение подходящих количеств активных ингредиентов.
В одном варианте осуществления набор включает лекарственную форму соединения по изобретению. Наборы могут далее включать дополнительные активные ингредиенты, такие как облимерсен (Genasense®), мелфалан, G-CSF, GM-CSF, EPO, топотекан, дакарбазин, иринотекан, таксотер, IFN, ингибитор СОХ-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL2, IL8, IL18, Ara-C, винорелбин, изотретиноин, 13 цис-ретиноевую кислоту или ее фармакологически активный мутант или производное, или их комбинацию. Примеры дополнительных активных ингредиентов включают, но не ограничены ими, раскрытые здесь (см., например, Раздел 4.3).
В других вариантах осуществления наборы могут дополнительно включать устройства, которые используются для введения активных ингредиентов. Примеры таких устройств включают, но не ограничены ими, шприцы, капельницы, пластыри и ингаляторы.
Наборы могут дополнительно включать клетки или кровь для трансплантации, а также фармацевтически приемлемые носители, которые могут использоваться для введения одного или более активных ингредиентов. Например, если активный ингредиент находится в твердой форме, которая должна быть ресуспендирована для парентерального введения, набор может включать закрытый контейнер с подходящим носителем, в котором активный ингредиент может быть растворен с образованием не содержащего частиц стерильного раствора, который является подходящим для парентерального введения. Примеры фармацевтически приемлемых носителей включают, но не ограничены ими, воду для инъекций USP; водные носители, такие как, но не ограничиваясь ими, раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и лактатсодержащий раствор Рингера для инъекций; водорастворимые носители, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
5. ПРИМЕРЫ
Некоторые варианты заявленного объекта иллюстрируются следующими неограничивающими примерами.
5.1 МЕТИЛОВЫЙ ЭФИР 4-КАРБАМОИЛ-4-(4-ГИДРОКСИ-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-МАСЛЯНОЙ КИСЛОТЫ
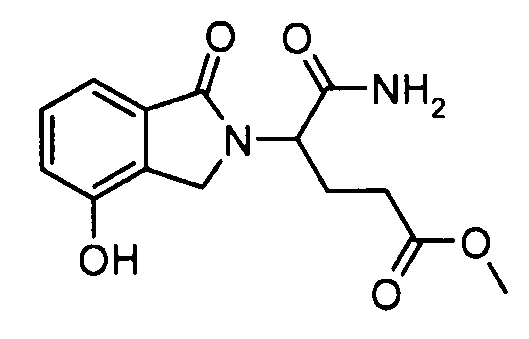
5.1.1 Метиловый эфир 3-гидрокси-2-метил-бензойной кислоты
3-Гидрокси-2-метилбензойную кислоту (105 г, 690 ммоль) добавляли к MeOH (800 мл) в круглодонную трехгорлую колбу на 2 л, оборудованную конденсатором, термометром и мешалкой, с последующим добавлением MeOH (250 мл). К вышеописанному раствору добавляли H2SO4 (10 мл, 180 ммоль). Реакционную смесь перемешивали при 62°C в течение 17 часов. Растворитель удаляли в вакууме. Остаток (200 мл) медленно при температуре окружающей среды добавляли к воде (600 мл), и образовывалось твердое вещество белого цвета. Суспензию перемешивали в ванне со льдом в течение 30 минут и фильтровали. Твердое вещество промывали водой (5×250 мл) и высушивали, получая метиловый эфир 3-гидрокси-2-метил-бензойной кислоты как твердое вещество белого цвета (100 г, 87%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=167; 1H ЯМР (ДМСО-d6) δ 2,28 (с, 3Н, CH3), 3,80 (с, 3Н, СН3), 6,96-7,03 (м, 1Н, Ar), 7,09 (т, J=7,8 Гц, 1H, Ar), 7,14-7,24 (м, 1H, Ar), 9,71 (с, 1H, OH).
5.1.2 метиловый эфир 3-(трет-бутил-диметил-силанилокси)-2-метилбензойной кислоты
В круглодонную трехгорлую колбу на 1 л, оборудованную мешалкой и термометром, добавляли DMF (300 мл), 3-гидрокси-2-метилметилбензоат (90 г, 542 ммоль) и имидазол (92 г, 1,354 ммоль). К вышеописанному раствору добавляли частями TBDMS-Cl (90 г, 596 ммоль), чтобы поддержать внутреннюю температуру 15-19°C в течение 20 минут, и после добавления внутреннюю температуру понижали до менее 1°C. Ванну со льдом удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь добавляли к воде со льдом (500 мл), и полученный раствор разделяли на две части (700 мл×2). Каждую часть экстрагировали EtOAc (700 мл). Каждый органический слой промывали холодной водой (350 мл) и солевым раствором (350 мл). Органические слои объединяли и высушивали MgSO4. Объединенный органический слой концентрировали, получая метиловый эфир 3-(трет-бутил-диметил-силанилокси)-2-метилбензойной кислоты как светло-коричневое масло (160 г, 100%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=281; 1H ЯМР (ДМСО-d6) δ -0,21 (с, 6H, CH3, CH3), 0,73-0,84 (м, 9Н, СН3, СН3, СН3), 2,10 (с, 3Н, СН3), 3,60 (с, 3Н, СН3), 6,82 (дд, 1Н, Ar), 6,97 (т, J=7,9 Гц, 1Н, Ar), 7,13 (дд, J=1,1, 7,7 Гц, 1H, Ar).
5.1.3 метиловый эфир 2-бромметил-3-(трет-бутил-диметил-силанилокси)-бензойной кислоты
NBS (49,8 г, 280 ммоль) при температуре окружающей среды добавляли к 3-(трет-бутил диметилсилилокси)-2-метилметилбензоату (78,4 г, 280 ммоль) в метилацетате (500 мл), получая суспензию оранжевого цвета. Полученную реакционную смесь нагревали в масляной бане при 40°C и облучали 300-Вт лампой дневного света при нагревании с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали и промывали раствором Na2SO3 (2×600 мл, насыщенная концентрация 50%), водой (500 мл) и солевым раствором (600 мл). Органический слой высушивали MgSO4 и обесцвечивали активированным углем. Органический слой концентрировали, получая метиловый эфир 2-бромметил-3-(трет-бутил-диметил-силанилокси)-бензойной кислоты как светло-коричневое масло (96 г, 91%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS M-Br=279; 1H ЯМР (ДМСО-d6) δ 0,05-0,11 (м, 6H, CH3, СН3), 0,82 (с, 9Н, СН3, СН3, СН3), 3,65 (с, 3Н, СН3), 4,74 (с, 2Н, СН2), 6,94 (дд, J=1,3, 8,1 Гц, 1Н, Ar), 7,10-7,20 (м, 1H, Ar), 7,21-7,29 (м, 1H, Ar).
5.1.4 метиловый эфир 4-карбамоил-масляной кислоты
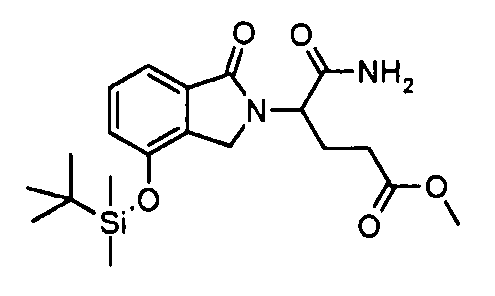
К перемешиваемому раствору 2-(бромметил)-3-(трет-бутилдиметилсилилокси)метилбензоата (137,5 г, 325 ммоль) в ацетонитриле (1100 мл) в круглодонной колбе на 2 л добавляли 4,5-диамино-5-оксометилпентаноат гидрохлорид (70,4 г, 358 ммоль). К суспензии добавляли DIPEA (119 мл, 683 ммоль) через воронку для добавления за 10 минут, и суспензию перемешивали при температуре окружающей среды в течение 1 часа, после чего смесь нагревали в масляной бане при 40°C в течение 23 часов. Реакционную смесь концентрировали под вакуумом. Остаток перемешивали в простом эфире (600 мл), и осаждали твердое вещество белого цвета. Смесь фильтровали, и твердое вещество промывали простым эфиром (400 мл). Фильтрат промывали HCl (1н., 200 мл), NaHCO3 (насыщ. 200 мл) и солевым раствором (250 мл). Водный кислотный слой и основной слой сохраняли отдельно. Затем твердое вещество дополнительно промывали простым эфиром (250 мл), и жидкость промывали вышеупомянутым кислым раствором и основным раствором. Два органических слоя объединяли и концентрировали под вакуумом, получая метиловый эфир 4-[4-(трет-бутил-диметил-силанилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты как коричневое масло (152 г, 115%-ый сырой выход, 77%-ая чистота Н ЯМР). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=407.
5.1.5 метиловый эфир 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты
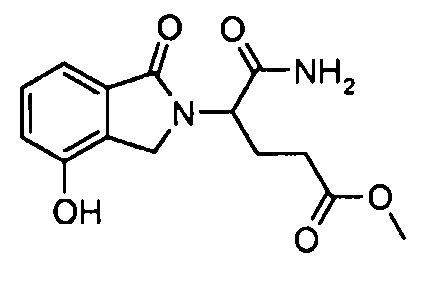
К перемешиваемому холодному раствору 5-амино-4-(4-(трет-бутилдиметилсилилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (152 г, 288 ммоль) в DMF (500 мл) и воде (55 мл) частями за 5 минут добавляли K2CO3 (19,89 г, 144 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 40 минут. Реакционную смесь охлаждали в ванне со льдом. К смеси медленно добавляли HCl (12M, 23,99 мл, 288 ммоль). После добавления, к смеси добавляли ацетонитрил (280 мл), и твердое вещество осаждали. Смесь перемешивали при температуре окружающей среды в течение 10 минут и фильтровали. Твердое вещество промывали ацетонитрилом (50 мл×4). Фильтрат концентрировали под высоким вакуумом, получая желтое масло (168 г). Масло растворяли в ацетонитриле (600 мл) и перемешивали при температуре окружающей среды в течение 10 минут. Смесь фильтровали, и твердое вещество промывали ацетонитрилом (25 мл×2). Фильтрат концентрировали под высоким вакуумом, получая желтое масло (169г), которое добавляли к смеси воды (1200 мл) и простого эфира (1000 мл). Смесь перемешивали в течение 3 минут, и слои разделяли. Водный раствор концентрировали под высоким вакуумом, и остаток перемешивали в ацетонитриле (160 мл), и твердое вещество белого цвета образовывалось после перемешивания в течение ночи. Смесь фильтровали, получая метиловый эфир 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты как твердое вещество белого цвета (46 г, 54%-ый выход). Фильтрат концентрировали, и остаток далее кристаллизовали в ацетонитриле (60 мл), получая дополнительное количество метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты как твердое вещество белого цвета (11,7 г, 14%-ый выход). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая дополнительное количество метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты как твердое вещество белого цвета (13,2 г, 15%-ый выход). Полное количество полученного продукта составило 70,9 г при 83%-ом выходе: LCMS MH=293; 1H ЯМР (ДМСО-d6) δ 1,95-2,34 (м, 4H, СН2, СН2), 3,51 (с, 3Н, СН3), 4,32 (д, J=17,6 Гц, 1Н, CHH), 4,49 (д, J=17,4 Гц, 1H, CHH), 4,73 (дд, J=4,7, 10,2 Гц, 1H, CHH), 6,99 (дд, J=0,8, 7,9 Гц, 1H, Ar), 7,10-7,23 (м, 2H, Ar, NHH), 7,25-7,38 (м, 1H, Ar), 7,58 (с, 1H, NHH), 10,04 (с, 1H, OH).
5.2 3-[4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО- 1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
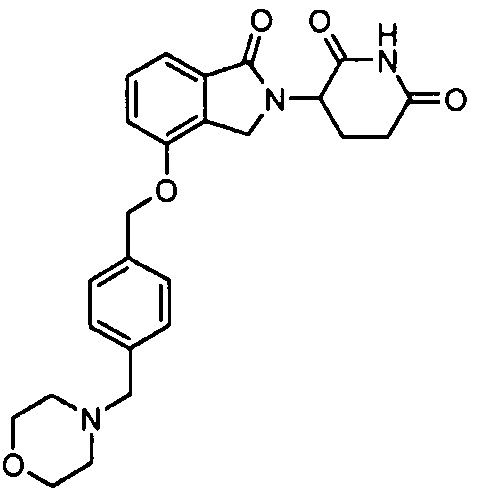
5.2.1 Процедура 1
Стадия 1: К раствору 3-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (2,5 г, 8,56 ммоль) в THF (60 мл) добавляли трифенилфосфин (на полимерной подложке 1,6 ммоль/г, 12 г, 18,8 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 минут. Диизопропил азодикарбоксилат (3,96 мл, 18,8 ммоль) добавляли при 0°C, и смесь перемешивали при 0°C в течение 30 минут. (4-Морфолин-4-илметил-фенил)-метанол (2,62 г, 12,4 ммоль) добавляли при 0°C, и смеси давали нагреться до температуры окружающей среды и перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и фильтрат концентрировали. Полученное масло очищали на колонке с силикагелем, элюируя метиленхлоридом и метанолом (градиент, продукт вышел в 6%-ом метаноле), получая метиловый эфир 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (2,2 г, 54%-ый выход). Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (2,2 г, 4,57 ммоль) в THF (50 мл) при 0°C добавляли трет-бутоксид калия (0,51 г, 4,57 ммоль). Смесь перемешивали при 0°C в течение 10 минут и гасили 1н. HCl (5 мл, 5 ммоль), затем насыщенным NaHCO3 (25 мл). Смесь экстрагировали EtOAc (2×50 мл). Органический слой промывали водой (30 мл), солевым раствором (30 мл), высушивали над MgSO4 и концентрировали. К полученному твердому веществу добавляли EtOAc (10 мл), затем гексан (10 мл) при перемешивании. Суспензию фильтровали, получая 3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (1,5 г, 73%-ый выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 95/5 ацетонитрил/0,1% H3PO4 за 5 мин,: tR=4,78 мин (97,5%); Т. пл.: 210-212°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,09 (м, 1H, CHH), 2,29-2,38 (м, 4H, CH2, CH2), 2,44 (дд, J=4,3, 13,0 Гц, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,82-2,99 (м, 1H, CHH), 3,46 (с, 2H, CH2), 3,52-3,61 (м, 4H, CH2, CH2), 4,18-4,51 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,27-7,38 (м, 5H, Ar), 7,40-7,53 (м, 3H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,09, 51,58, 53,14, 62,10, 66,17, 69,41, 114,97, 115,23, 127,64, 128,99, 129,81, 129,95, 133,31, 135,29, 137,68, 153,50, 168,01, 170,98, 172,83; LCMS: 465; Вычислено для C25H27N305+0,86 H2O: C, 64,58; H, 6,23; N, 9,04; Найдено: С, 64,77; H, 6,24; N, 8,88.
5.2.2 Процедура 2
Стадия 1: В круглодонную колбу на 2 л загружали 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (30 г, 103 ммоль), 1,4-бис(бромметил)бензол (81 г, 308 ммоль) и карбонат калия (14,19 г, 103 ммоль) и ацетонитрил (1,2 л). Смесь перемешивали при температуре окружающей среды в течение 10 минут и нагревали до 50°C в течение 12 часов. Реакционной смеси давали охладиться до температуры окружающей среды. Смесь фильтровали, и фильтрат концентрировали на роторном испарителе. Полученное твердое вещество растворяли в CH2Cl2 и загружали на 2 колонки с силикагелем (330 г каждая), и элюировали с использованием CH2Cl2/MeOH, получая метиловый эфир 4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты как твердое вещество белого цвета (40 г, 82%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,98-2,13 (м, 1H, CHH), 2,14-2,23 (м, 1H, CHH), 2,23-2,32 (м, 2H, CHH, CHH), 3,50 (с, 3H, CH3), 4,34-4,63 (м, 2H, CH2), 4,67-4,80 (м, 3H, CH2, NCH), 5,25 (с, 4H, CH2), 7,19 (с, 1H, NHH), 7,24-7,34 (м, 2H, Ar), 7,41-7,54 (м, 5H, Ar), 7,58 (уш.с, 1H, NHH).
Стадия 2: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (36,5 г, 77 ммоль) в CH2Cl2 при температуре окружающей среды добавляли морфолин (14,72 мл, 169 ммоль). Смесь перемешивали при температуре окружающей среды в течение 1 часа. Полученную суспензию фильтровали, и фильтрат концентрировали на роторном испарителе. Полученное масло растворяли в 350 мл EtOAc и промывали водой (50 мл×3). Органический слой концентрировали на роторном испарителе, получая метиловый эфир 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как пенистое твердое вещество (39 г, 100%-ый выход): 1Н ЯМР (ДМСО-d6) δ 2,00-2,12 (м, 1H, CHH), 2,14-2,22 (м, 1H, CHH), 2,22-2,29 (м, 2H, CHH, CHH), 2,30-2,39 (м, 4H, CH2, CH2), 3,46 (с, 2H, CH2), 3,50 (с, 3H, CH3), 3,53-3,63 (м, 4H, CH2, CH2), 4,28-4,59 (м, 2H, CH2), 4,73 (дд, J=4,7, 10,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,14-7,23 (м, 1Н, NHH), 7,26-7,39 (м, 4H, Ar), 7,41-7,51 (м, 3H, Ar), 7,58 (с, 1H, NHH).
Стадия 3: К раствору 5-амино-4-(4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (40 г, 83 ммоль) в THF добавляли частями при 0°C 2-метилпропан-2-олат калия (9,80 г, 87 ммоль). Смесь перемешивали при этой температуре в течение 30 минут. К реакционной смеси добавляли 45 мл 1н. раствора HCl, затем 200 мл насыщенного раствора NaHCO3. Смесь разбавляли 500 мл EtOAc при 0°C, перемешивали в течение 5 минут и разделяли. Органический слой промывали водой (50 мл×3) и солевым раствором (100 мл) и концентрировали на роторном испарителе, получая твердое вещество белого цвета, которое перемешивали в простом диэтиловом эфире (300 мл), получая суспензию. Суспензию фильтровали, получая 3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (28,5 г, 72%-ый выход): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм градиент 95/5 ацетонитрил/0,1% H3PO4 за 5 мин,: tR=4,78 мин (98,5%); Т. пл.: 209-211°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,09 (м, 1H, CHH), 2,29-2,38 (м, 4H, CH2, CH2), 2,44 (дд, J=4,3, 13,0 Гц, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,82-2,99 (м, 1H, CHH), 3,46 (с, 2H, CH2), 3,52-3,61 (м, 4H, CH2, CH2), 4,18-4,51 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,27-7,38 (м, 5H, Ar), 7,40-7,53 (м, 3Н, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,09, 51,58, 53,14, 62,10, 66,17, 69,41, 114,97, 115,23, 127,64, 128,99, 129,81, 129,95, 133,31, 135,29, 137,68, 153,50, 168,01, 170,98, 172,83; LCMS: 465; Вычислено для C25H27N3O5+0,86 H2O: С, 64,63; H, 6,22; N, 9,04; Найдено: С, 64,39; H, 6,11; N, 8,89; H2O, 3,24.
5.3 3-{4-[4-(2,2,3,3,4,4,5,5,6,6-ДЕКАДЕЙТЕРО-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
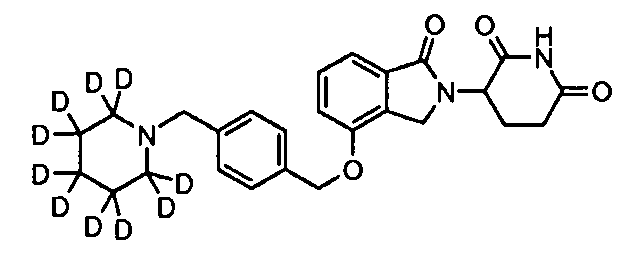
Стадия 1: Пердейтеро-пиперидин (d11, 98% D, 136 мг, 1,42 ммоль) добавляли к раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (450 мг, 0,95 ммоль) и N,N-диизопропилэтиламина (0,24 мл, 1,42 ммоль) в сухом MeCN (9 мл). Реакционную смесь нагревали до 60°C при перемешивании в течение 2 часов. Смеси давали остыть до температуры окружающей среды и затем сохраняли при 4°C в течение ночи. После охлаждения образовывалось твердое вещество, и суспензию разделяли между EtOAc (150 мл) и 1н. NaHCO3 (40 мл). Водный слой промывали EtOAc (100 мл), и объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая трет-бутиловый эфир 4-карбамоил-2-{4-[4-(2,2,3,3,4,4,5,5,6,6-декадейтеро-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (490 мг, 97%-ый выход): LCMS MH=532. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору трет-бутилового эфира 4-карбамоил-2-{4-[4-(2,2,3,3,4,4,5,5,6,6-декадейтеро-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (490 мг, 0,92 ммоль) в THF (10 мл) при температуре окружающей среды добавляли KOtBu (109 мг, 0,96 ммоль) в форме твердого вещества в одной части. Раствор менял цвет от светлого до глубокого желтого цвета после добавления, и смесь перемешивали при температуре окружающей среды в течение приблизительно 30 минут. К реакционной смеси добавляли дополнительное количество KOtBu (14 мг), и перемешивание продолжали в течение ночи. Приблизительно через 17 часов добавляли другую часть KOtBu (28 мг), и реакционную смесь перемешивали при температуре окружающей среды в течение дополнительных 2 часов. Реакционную смесь гасили уксусной кислотой (0,158 мл, 2,76 ммоль) при 0°C. Полученную суспензию концентрировали в вакууме, и остаток разделяли между EtOAc (75 мл) и 1н. NaHCO3 (30 мл). Водный слой промывали большим количеством EtOAc (75 мл). Объединенные органические слои промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество желто-коричневого цвета. Et2O (20 мл) добавляли к твердому сырому продукту, и суспензию растирали в порошок путем обработки ультразвуком, с последующей фильтрацией и промыванием твердого вещества дополнительным количеством Et2O. Корку высушивали отсасыванием, получая 3-{4-[4-(2,2,3,3,4,4,5,5,6,6-декадейтеро-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества светло-желтого цвета (205 мг, 49%-ый выход): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 5 мин, ацетонитрил/0,1% H3PO4, 4,69 мин (95,6%); Т. пл.: 186-188°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,06 (м, 1H, CHH), 2,37-2,48 (м, 1H, CHH), 2,52-2,63 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 3,41 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,38-7,57 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,07, 51,55, 62,42, 69,42, 114,94, 115,19, 127,57, 128,78, 129,78, 129,93, 133,28, 135,00, 138,58, 153,51, 167,99, 170,95, 172,80; сигналы углерода CD2 отсутствуют в 13C ЯМР; LCMS MH=458; Вычислено для C26H19D10N3O4+0,25 H2O: C, 67,58; H, 6,43; N, 9,09, Найдено: C, 67,51; H, 6,32; N, 9,16.
5.4 3-{4-[4-(2,2,3,3,5,5,6,6-ОКТАДЕЙТЕРО-МОРФОЛИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
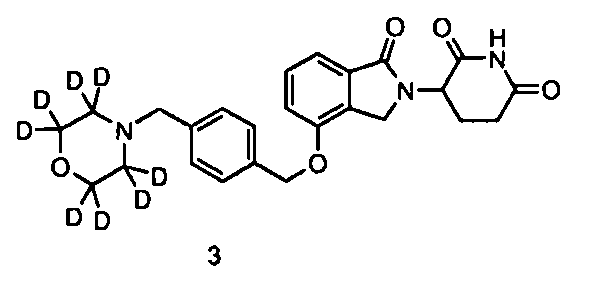
Стадия 1: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (450 мг, 0,95 ммоль) и N,N-диизопропилэтиламина (0,24 мл, 1,42 ммоль) в MeCN (9 мл) добавляли 2,2,3,3,5,5,6,6-октадейтеро-морфолин (d8, 98% D, 136 мг, 1,42 ммоль). Реакционную смесь перемешивали при 60°C в течение 2,5 часов. Смесь (белую суспензию) концентрировали досуха, и твердый остаток разделяли между EtOAc (150 мл) и 1н. NaHCO3 (35 мл). Водный слой промывали дополнительным количеством EtOAc (150 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая трет-бутиловый эфир 4-карбамоил-2-{4-[4-(2,2,3,3,5,5,6,6-октадейтеро-морфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (0,5 г, 99%-ый выход): LCMS MH=532. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К охлажденному раствору трет-бутилового эфира 4-карбамоил-2-{4-[4-(2,2,3,3,5,5,6,6-октадейтеро-морфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (0,5 г, 0,94 ммоль) в THF (10 мл) при 0°C добавляли KOtBu (0,137 г, 1,22 ммоль) в форме твердого вещества в одной части. Раствор приобретал глубокий желтый цвет. Ванну со льдом немедленно удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение приблизительно 90 минут. Смесь охлаждали в ванне со льдом и гасили добавлением уксусной кислоты (0,162 мл, 2,82 ммоль).
Летучие компоненты удаляли в вакууме, получая твердое вещество белого цвета, которое разделяли между EtOAc (125 мл) и 1н. NaHCO3 (30 мл). Водный слой промывали дополнительным количеством EtOAc (приблизительно 75 мл). Слои EtOAc объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 400 мг твердого вещества. Это твердое вещество белого цвета суспендировали в Et2O (25 мл) и энергично перемешивали в вортексе, и обрабатывали ультразвуком для облегчения измельчения. Суспензию затем фильтровали и высушивали отсасыванием на воронке с фильтром в течение приблизительно 1/2 час. Корку сохраняли в вакуумном сушильном шкафу при 60°C в течение нескольких часов, получая 3-{4-[4-(2,2,3,3,5,5,6,6-октадейтеро-морфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (236 мг, 55%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 10 мин, ацетонитрил/0,1% H3PO4, 5,55 мин (96,5%); Т. пл.: 206-208°C; lH ЯМР (ДМСО-d6) δ 1,88-2,07 (м, 1H, CHH), 2,34-2,49 (м, 1H, CHH), 2,52-2,65 (м, 1H, CHH), 2,80-3,01 (м, 1H, CHH), 3,46 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,23-7,38 (м, 4H, Ar), 7,39-7,54 (м, 3H, Ar), 10,97 (с, 1H, CH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 51,55, 62,01, 69,38, 114,96, 115,20, 127,61, 128,97, 129,78, 129,93, 133,28, 135,25, 137,72, 153,48, 167,99, 170,96, 172,81; сигналы углерода CD2 отсутствуют из-за соединения и расщепления дейтерием; LCMS MH=458; Вычислено для C25H19D8N3O5+0,25 H2O: C, 64,98; H, 6,00; N, 9,09, Найдено: C, 64,91; H, 5,71; N, 9,04.
5.5 3-[4-(2-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
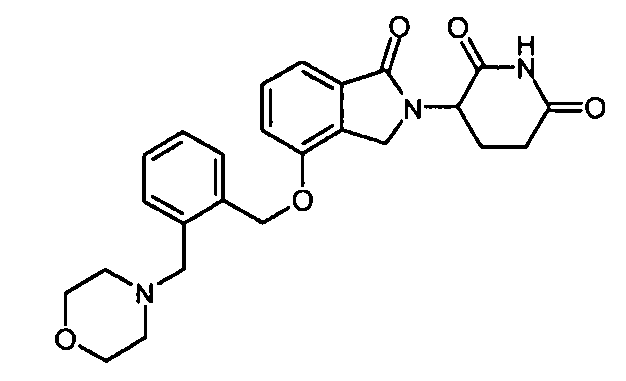
Стадия 1: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,3 г, 1 ммоль) в THF (15 мл) при 0°C добавляли трифенилфосфиновую смолу (1,38 г, загрузка 2,2 ммоль/г, 2,2 ммоль) и DIAD (0,43 мл, 2,2 ммоль) и сохраняли в течение 10 минут. К смеси добавляли (2-морфолин-4-илметил-фенил)-метанол (0,31 г, 1,5 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл), солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[4-(2-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,07 г, 15%-ый выход).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(2-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,07 г, 0,15 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (20 мг, 0,18 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая 3-[4-(2-морфолин-4-илметил-бензилокси)-1-ОКСО-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (30 мг, 50%-ый выход): Т. пл.: 188-190°C; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и при 100/0 в течение 5 мин: tR=4,8 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,84-2,11 (м, 1H, CHH), 2,22-2,44 (м, 5H, CHH, CH2, CH2), 2,54-2,64 (м, 1H, CHH), 2,89 (д, J=12,5 Гц, 1H, CHH), 3,42-3,62 (м, 6H, CH2, CH2 , CH2), 4,17-4,52 (м, 2H, CH2), 5,12 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,43 (с, 2H, CH2), 7,17-7,40 (м, 5H, Ar), 7,42-7,65 (м, 2H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 0,03, 22,29, 31,13, 45,05, 51,52, 53,13, 60,10, 66,15, 67,17, 114,77, 115,09, 127,29, 127,54, 127,90, 129,76, 130,08, 133,25, 135,62, 135,75, 153,46, 167,94, 170,91, 172,75; LCMS MH=450; Вычислено для C25H27N3O5+0,2H2O: C, 66,27; 6,10; N, 9,27; Найдено: С, 66,06%; H, 5,85; N, 9,14%
5.6 3-[4-(3-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
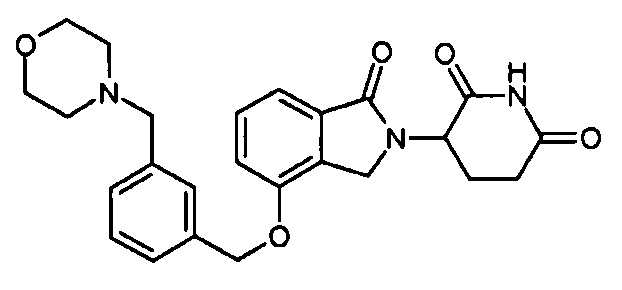
Стадия 1: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (1,0 г, 3,42 ммоль) в THF (10 мл) при 0°C добавляли трифенилфосфиновую смолу (2,3 г, загрузка 2,2 ммоль/г, 6,84 ммоль) и DIAD (1,33 мл, 6,84 ммоль) и сохраняли в течение 10 минут. К смеси добавляли (3-морфолин-4-илметил-фенил)-метанол (1,06 г, 3,42 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[4-(3-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,50 г, 30%).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(3-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,3 г, 0,6 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (г на 0,6 мл, 0,6 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая 3-[4-(3-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (120 мг, 44%-ый выход): Т. пл.: 247-249°C; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и при 100/0 в течение 5 мин: tR=4,8 мин (96%); 1H ЯМР (ДМСО-d6) δ 1,93-2,03 (м, 1H, CHH), 2,26-2,38(м, 4H, СН2, СН2), 2,40-2,48 (м, 1Н, CHH), 2,54-2,63 (м, 1H, CHH), 2,84-2,98 (м, 1H, CHH), 3,48-3,59 (м, 4H, CH2, CH2), 4,20-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,4 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,24-7,42 (м, 6H, Ar), 7,44-7,51 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 45,10, 51,59, 53,11, 62,21, 66,16, 69,58, 115,20, 115,27, 126,37, 128,09, 128,38, 128,53, 129,79, 129,98, 133,31, 136,54, 138,06, 153,44, 167,99, 170,98, 172,85; LCMS MH=450; Вычислено для C25H27N3O5+0,4 H2O: C, 65,75; H, 6,14; N, 9,20; Найдено: С, 65,38; H, 5,95; N, 9,21.
5.7 3-(1-ОКСО-4-(4-(2-(ПИРРОЛИДИН-1-ИЛ)ЭТОКСИ)-БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
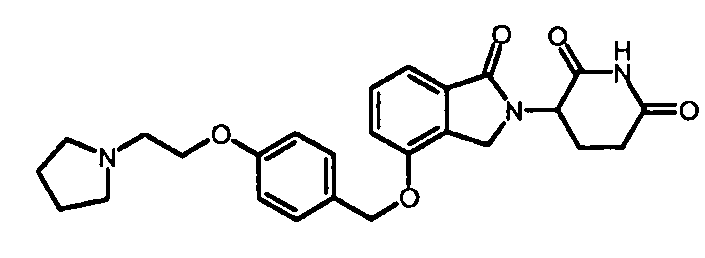
Стадия 1: Смесь 4-гидроксибензальдегида (4,0 г, 32,8 ммоль) и Cs2CO3 (26,7 г, 81,9 ммоль) в DMF (80 мл) перемешивали в течение 10 минут при температуре окружающей среды. К этой смеси добавляли 1-(2-хлорэтил)пирролидин гидрохлорид (6,7 г, 39,3 ммоль). Смесь нагревали при 60°C в течение 2 часов, затем при 80°C в течение ночи. Реакционную смесь охлаждали и фильтровали, и твердое вещество промывали EtOAc (100 мл). Фильтрат перемешивали с холодной водой (200 мл), и водный слой экстрагировали EtOAC (3×50 мл). Объединенные растворы EtOAc промывали 2н. NaOH (40 мл), водой (3×40 мл) и солевым раствором (40 мл) и высушивали (K2CO3). Растворитель удаляли, получая 4-(2-пирролидин-1-ил-этокси)бензальдегид (5,9 г, 81%-ый выход): 1H ЯМР (CDCl3) δ 1,76-1,84 (м, 4H), 2,60-2,65 (м, 4Н), 2,91-2,95 (м, 2Н), 4,19 (т, J=6,0 Гц, 2H), 7,00-7,04 (м, 2H), 7,80-7,95 (м, 2H), 9,88 (с, 1H).
Стадия 2: Раствор 4-(2-пирролидин-1-ил-этокси)бензальдегида (5,8 г, 26,5 ммоль) в реакционном спирте (60 мл) охлаждали до -60°C в ванне сухой лед/ацетон. При -60°C медленно добавляли LiBH4/THF (2M, 15,9 мл, 31,9 ммоль). Смесь перемешивали при -60°C в течение 1 часа. Реакционную смесь медленно гасили водой (20 мл) и затем нагревали до температуры окружающей среды. Смесь концентрировали, и остаток перемешивали с EtOAc (80 мл) и 2н. NaOH (20 мл). Водный слой экстрагировали EtOAc (2×30 мл), и объединенные растворы EtOAc промывали водой (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, NH4OH:CH3OH:CH2Cl2 0,5:3:97), получая 4-[(2-пирролидин-1-ил-этокси)-фенил]-метанол (2,5 г, 42%-ый выход): 1H ЯМР (CDCl3) δ 1,74-1,83 (м, 4H), 2,56-2,63 (м, 4Н), 2,86 (т, J=6,1 Гц, 2H), 4,03 (т, J=6,0 Гц, 2H), 4,57 (с, 2H), 6,82-6,87 (м, 2H), 7,23-7,27 (м, 2H).
Стадия 3: Диизопропил азодикарбоксилат (1,1 г, 5,5 ммоль) медленно добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), 4-[(2-пирролидин-1-ил-этокси)-фенил]-метанола (0,9 г, 4,1 ммоль) и связки трифенилфосфин-полимер (1,8 г, 5,5 ммоль) в THF (60 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2=3:97), получая метил 5-амино-5-оксо-4-(1-оксо-4-(4-(2-пирролидин-1-ил)этокси)бензилокси)изоиндолин-2-ил)пентаноат (1,0 г, 77%).
Стадия 4: Раствор KO-t-Bu/THF (1M, 2,5 мл, 2,5 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(2-пирролидин-1-ил)этокси)бензилокси)изоиндолин-2-ил)метилпентаноата (1,0 г, 2,1 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (4 мл). Смесь перемешивали с EtOAc (40 мл) и насыщ. Na2CO3 (25 мл). Водный слой экстрагировали EtOAc (3×40 мл), и объединенный раствор EtOAc промывали водой (40 мл) и солевым раствором (40 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2=5:95), получая 3-(1-оксо-4-(4-(2-пирролидин-1-ил)этокси)-бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 20%-ый выход): Т. пл. 153-155°C; 1H ЯМР (ДМСО-d6) δ 1,66-1,69 (м, 4H), 1,94-1,99 (м, 1H), 2,40-2,59 (м, 2H), 2,77 (т, J=5,7 Гц, 2H), 2,84-2,90 (м, 1H), 4,06 (т, J=6,0 Гц, 2H), 4,24 (д, J=17,4 Гц, 1H), 4,35 (д, J=17,7 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,15 (с, 2H), 6,92-6,97 (м, 2H), 7,30-7,50 (м, 5H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 23,09, 31,17, 45,06, 51,54, 53,93, 54,24, 66,69, 69,34, 114,35, 115,04, 115,12, 128,42, 129,50, 129,75, 129,95, 133,25, 153,50, 158,33, 168,00, 170,96, 172,81; Вычислено для C26H29N3O5+0,5 Et20: C, 66,65; H, 6,63; N, 8,64, Найдено: C, 66,95; H, 6,62; N, 8,71.
5.8 3-[4-(3-ХЛОР-4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
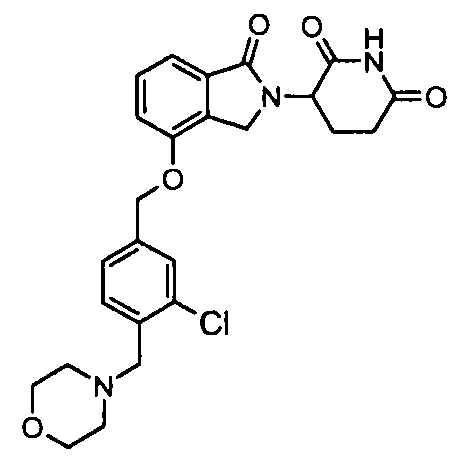
Стадия 1: В круглодонную колбу загружали 3-хлор-4-метил-бензойную кислоту (1,5 г, 9 ммоль) и триметил ортоацетат (25 мл). Смесь нагревали при 100°C в течение ночи. Реакционную смесь концентрировали в вакууме. Полученное масло, 3-хлор-4-метил-бензойной кислоты метиловый эфир, использовали на следующей стадии без очистки.
Стадия 2: К раствору метилового эфира 3-хлор-4-метил-бензойной кислоты (1,66 г, 0,9 ммоль) в CCl4 (50 мл) добавляли NBS (1,58 г, 9 моль). Суспензию облучали 300-Вт лампой дневного света и нагревали при 65°C в течение 1 часа. Смесь фильтровали, и фильтрат концентрировали в вакууме. Полученное масло, метиловый эфир 4-бромметил-3-хлор-бензойной кислоты, использовали на следующей стадии без дальнейшей очистки.
Стадия 3: К раствору метилового эфира 4-бромметил-3-хлор-бензойной кислоты в ацетонитриле (30 мл) добавляли морфолин (3 мл). Смесь перемешивали при температуре окружающей среды в течение 0,5 часов и концентрировали на роторном испарителе. Полученное масло экстрагировали EtOAc (30 мл) и водой (20 мл). Органический слой концентрировали и очищали на колонке с силикагелем, элюируя EtOAc и гексаном, получая метиловый эфир 3-хлор-4-морфолин-4-илметил-бензойной кислоты (1,0 г, 42% за три стадии) как желтое масло.
Стадия 4: К раствору метилового эфира 3-хлор-4-морфолин-4-илметил-бензойной кислоты (1,0 г, 3,7 ммоль) в THF (30 мл) по каплям при 0°C добавляли LiAlH4 (3,7 мл, 1 М в THF, 3,7 ммоль). Смесь перемешивали при 0°C в течение 30 минут. Реакционную смесь гасили насыщ. NaHCO3 (5 мл) и затем разбавляли EtOAc (30 мл) и водой (20 мл). После экстракции органический слой концентрировали и очищали на колонке с силикагелем, элюируя EtOAc и гексаном, получая (3-хлор-4-морфолин-4-илметил-фенил)-метанол в форме масла (0,6 г, 70%).
Стадия 5: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,32 г, 1,1 ммоль) в THF при 0°C добавляли трифенилфосфиновую смолу (1,94 г, загрузка 1,6 ммоль/г, 2,42 ммоль) и DIAD (0,477 мл, 2,42 ммоль). При перемешивании при 0°C в течение 10 минут, к смеси добавляли (3-хлор-4-морфолин-4-илметил-фенил)-метанол (0,40 г, 1,66 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[4-(3-хлор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,40 г, 73%).
Стадия 6: К раствору метилового эфира 4-карбамоил-4-[4-(3-хлор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,64 г, 1,2 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (0,14 г, 1,2 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное твердое вещество перемешивали в MeOH (5 мл) и фильтровали, получая 3-[4-(3-хлор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион (300 мг, 50%) как твердое вещество белого цвета: Т. пл.: 240-242°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и затем при 100/0 в течение 5 мин: tR=4,81 мин (96%); 1H ЯМР (ДМСО-d6) δ 1,86-2,10 (м, 1H, CHH), 2,37-2,45 (м, 5H, CH2, CH2, CHH), 2,54-2,63 (м, 1H, CHH), 2,84-2,99 (м, 1H, CHH), 3,42-3,69 (м, 6H, CH2, CH2, CH2), 4,07-4,58 (м, 2H, CHH), 4,98-5,17 (м, 1H, NCH), 5,25 (с, 2H, CH2), 7,22-7,38 (м, 2H, Ar), 7,40-7,61 (м, 4H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,26, 31,10, 44,99, 51,49, 53,10, 58,68, 66,09, 68,38, 114,86, 115,31, 126,13, 128,22, 129,75, 129,88, 130,91, 133,23, 133,32, 134,85, 137,37, 153,19, 167,86, 170,88, 172,75; LCMS MH=484; Вычислено для C25H26N3O5C1: C, 62,05; H, 5,42; N, 8,68; Найдено: С, 61,71; H, 5,08; N, 8,62.
5.9 3-(4-(4-(2-МОРФОЛИН-4-ИЛ-ЭТОКСИ)-БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
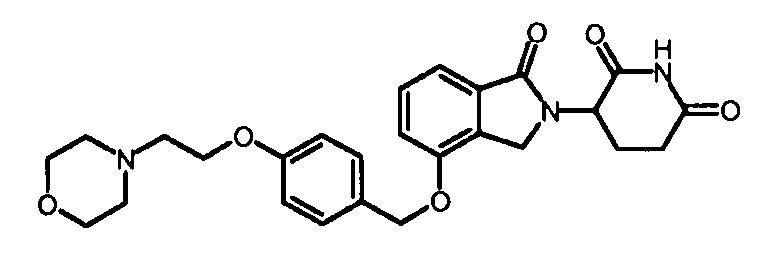
Стадия 1: Смесь 4-гидроксибензальдегида (4,0 г, 32,8 ммоль) и Cs2CO3 (26,7 г, 81,9 ммоль) в DMF (80 мл) перемешивали при температуре окружающей среды в течение 10 минут. К этой смеси добавляли 4-(2-хлорэтил)морфолин гидрохлорид (7,3 г, 39,3 ммоль). Полученную смесь нагревали при 80°C в масляной бане в течение ночи. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали, и твердое вещество промывали EtOAc (100 мл). Фильтрат разбавляли холодной водой (200 мл), и водный слой экстрагировали EtOAc (3×50 мл). Объединенный раствор EtOAc промывали 2н. NaOH (25 мл), водой (3×40 мл) и солевым раствором (40 мл) и высушивали (K2CO3). Растворитель удаляли, получая 4-(2-морфолин-4-ил-этокси)-бензальдегид (6,2 г, 81%-ый выход): 1H ЯМР (CDCl3) δ 2,57-2,60 (м, 4H), 2,83 (т, J=5,7 Гц, 2H), 3,70-3,75 (м, 4Н), 4,19 (т, J=5,7 Гц, 2H), 6,98-7,03 (м, 2H), 7,81-7,85 (м, 2H), 9,88 (с, 1H); 13C ЯМР (CDCl3) δ 53,52, 56,73, 65,77, 66,11, 114,93, 129,58, 131,73, 163,40, 191,21.
Стадия 2: LiBH4/THF (2M, 15,9 мл, 31,7 ммоль) медленно при -60°C добавляли к перемешиваемому раствору 4-(2-морфолин-4-ил-этокси)-бензальдегида (6,2 г, 26,4 ммоль) в реакционном спирте (60 мл). Полученную смесь перемешивали при -60°C в течение 1 часа, затем гасили водой (20 мл). Смесь концентрировали, и остаток перемешивали с EtOAc (80 мл) и 1н. NaOH (30 мл). Водный слой экстрагировали EtOAc (2×30 мл), и объединенный раствор EtOAc промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, NH4OH:CH3OH:CH2Cl2 0,5:3: 100), получая [4-(2-морфолин-4-ил-этокси)-фенил]-метанол (4,2 г, 67%-ый выход): 1H ЯМР (CDCl3) δ 2,25 (с, 1H), 2,54-2,57 (м, 4H), 2,78 (т, J=5,7 Гц, 2H), 3,70-3,73 (м, 4H), 4,08 (т, J=5,7 Гц, 2H), 4,59 (с, 2H), 6,85-6,89 (м, 2H), 7,25-7,29 (м, 2H); 13C ЯМР (CDCl3) δ 54,06, 57,61, 65,79, 66,85, 114,62, 128,57, 133,52, 158,24.
Стадия 3: Связку трифенилфосфин-полимер (1,8 г, 5,5 ммоль) перемешивали с сухим CH2Cl2 (20 мл) в течение 10 минут. К этой смеси добавляли раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль) и [4-(2-морфолин-4-ил-этокси)-фенил]-метанола (1,0 г, 4,1 ммоль) в THF (60 мл). Полученную смесь охлаждали до 5°C, и при 5-8°C медленно добавляли диизопропил азодикарбоксилат (1,1 г, 5,5 ммоль). После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(4-(2-морфолиноэтокси)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-метилпентаноат (1,0 г, 71%).
Стадия 4: Раствор трет-бутоксид калия/THF (1M, 2,6 мл, 2,6 ммоль) медленно добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-(4-(2-морфолиноэтокси)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,1 г, 2,1 ммоль) в THF (30 мл). Реакционную смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (4 мл). Смесь перемешивали с EtOAc (40 мл) и насыщ. Na2CO3 (25 мл). Водный слой экстрагировали EtOAc (3×40 мл), и объединенный раствор EtOAc промывали водой (40 мл) и солевым раствором (40 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (Al2O3, CH3OH:CH2Cl2 3:97), получая 3-(4-(4-(2-морфолиноэтокси)-бензилокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,2 г, 16%-ый выход): Т. пл.: 203-205°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H), 2,40-2,70 (м, 8H), 2,84-2,96 (м, 1H), 3,55-3,58 (м, 4H), 4,06-4,10 (м, 2H), 4,24 (д, J=17,4 Гц, 1H), 4,35 (д, J=17,4 Гц, 1H), 5,07-5,15 (м, 3H), 6,97 (д, J=8,4 Гц, 2H), 7,30-7,50 (м, 5H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,32, 31,17, 45,06, 51,55, 53,56, 56,92, 65,29, 66,11, 63,31, 114,41, 115,04, 115,11, 128,50, 129,47, 129,74, 129,94, 133,25, 153,49, 158,27, 167,99, 170,94, 172,80; Вычислено для C26H29N3O6+0,2 H2O: C, 64,64; H, 6,10; N, 8,70, Найдено: С, 64,54; H, 6,06; N, 8,63.
5.10 3-[4-(3-ФТОР-4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
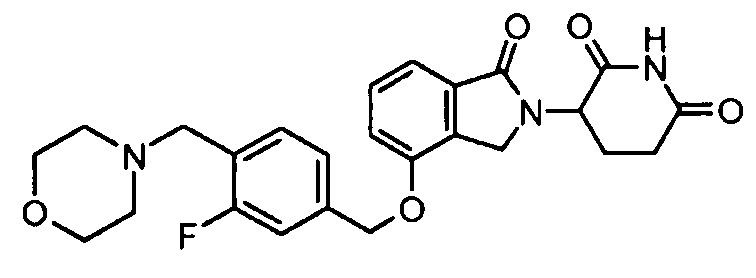
Стадия 1: К перемешиваемому раствору метилового эфира 3-фтор-4-метил-бензойной кислоты (5,45 г, 32,4 ммоль) в тетрахлорметане (30 мл) добавляли N-бромсукцинимид (5,48 г, 30,8 ммоль). Смесь нагревали до 80°C с помощью 300-Вт лампы дневного света. Смесь нагревали в течение двух часов и затем фильтровали. Фильтрат упаривали, получая метиловый эфир 4-бромметил-3-фтор-бензойной кислоты как светло-зеленое масло (9,1 г, 113%-ый сырой выход).
Стадия 2: Морфолин (28,3 мл, 324,4 ммоль) при температуре окружающей среды добавляли к перемешиваемому раствору метилового эфира 4-бромметил-3-фтор-бензойной кислоты (8,01 г, 32,4 ммоль) в ацетонитриле (40 мл). Смесь перемешивали в течение десяти минут, и растворитель выпаривали. К остатку добавляли воду (40 мл), и затем смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы упаривали и очищали на колонке с силикагелем (градиент EtOAc/Гексаны от 10% до 40% за 40 минут), получая метиловый эфир 3-фтор-4-морфолин-4-илметил-бензойной кислоты в форме твердого вещества желтого цвета (5,58 г, 68%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,35-2,44 (м, 4H, CH2, СН2), 3,53-3,65 (м, 6Н, СН2, СН2, СН2), 3,87 (с, 3Н, СН3), 7,55-7,63 (м, 1Н, Ar), 7,63-7,70 (м, 1Н, Ar), 7,75-7,82 (м, 1H, Ar); 13C ЯМР (ДМСО-d6) δ 52,36, 52,98, 53,22, 54,64, 65,84, 66,10, 66,35, 115,45, 115,75, 124,97, 129,95, 130,16, 130,44, 130,54, 131,72, 131,78, 158,73, 162,00, 165,09.
Стадия 3: Литий-алюминийгидрид (1,0 М в THF, 8,06 мл, 8,06 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 3-фтор-4-морфолин-4-илметил-бензойной кислоты (1,02 г, 4,03 ммоль) в THF (20 мл). Смесь перемешивали в течение 30 минут и гасили добавлением по каплям насыщенного бикарбоната натрия. К смеси добавляли воду (30 мл), и смесь экстрагировали этилацетатом (3×100 мл). Полученный осадок фильтровали. Объединенный фильтрат этилацетата упаривали и очищали на колонке с силикагелем (градиент EtOAc/Гексаны от 20% до 90% за 35 минут), получая (3-фтор-4-морфолин-4-илметил-фенил)-метанол в форме маслянистого твердого вещества (0,81 г, 89%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,31-2,42 (м, 4H, CH2, СН2), 3,46-3,50 (м, 2Н, СН2), 3,51-3,59 (м, 4Н, СН2, СН2), 4,49 (уш.с, 2Н, СН2), 5,27 (уш.с, 1Н, ОН), 7,04-7,14 (м, 2Н, Ar), 7,29-7,38 (м, 1Н, Ar); 13C ЯМР (ДМСО-d6) δ 52,89, 54,80, 62,02, 66,13, 112,63, 112,93, 121,80, 121,96, 122,17, 131,31, 131,38, 144,40, 144,50, 159,14, 162,38.
Стадия 4: Трифенилфосфин (1,6 ммоль/г, 1,60 г, 2,60 ммоль) на полимерной подложке при 0°C добавляли к перемешиваемой суспензии (3-фтор-4-морфолин-4-илметил-фенил)-метанола (0,39 г, 1,71 ммоль) в THF (20 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,37 мл, 1,88 ммоль). После перемешивания в течение 30 минут, добавляли метиловый эфир 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,50 г, 1,71 ммоль). Смесь перемешивали в течение трех часов, затем фильтровали, промывали MeOH (3×20 мл) и метиленхлоридом (3×20 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 40 минут), получая метиловый эфир 4-карбамоил-4-[4-(3-фтор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как прозрачное масло (0,54 г, 63%-ый выход).
Стадия 5: Трет-бутоксид калия (0,12 г, 1,08 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(3-фтор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,54 г, 1,08 ммоль) в THF (15 мл). Смесь перемешивали в течение десяти минут и гасили 1н. HCl (3 мл), нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7) и быстро экстрагировали этилацетатом (2×30 мл). Объединенные этилацетатные фазы упаривали и очищали на колонке с силикагелем (MeOH/CH2Cl2, градиент от 1% до 5% за 90 минут), получая 3-[4-(3-фтор-4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,36 г, 72%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 в течение 5 мин (ацетонитрил/0,1% H3PO4), 4,90 мин (97,8%); Т. пл.: 263-265°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,05 (м, 1H, CHH), 2,32-2,48 (м, 5H, CHH, CH2CH2), 2,54-2,65 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 3,47-3,61 (м, 6H, CH2, CH2, CH2), 4,23-4,50 (м, 2H, CH2), 5,12 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,25-7,56 (м, 6H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 45,09, 51,59, 52,93, 54,74, 66,13, 68,56, 114,09, 114,40, 114,92, 115,39, 123,22, 123,70, 123,89, 129,84, 130,00, 131,69, 131,75, 133,37, 138,16, 138,26, 153,28, 159,08, 162,33, 167,98, 170,96, 172,83; LCMS MH=468; Вычислено для C25H26N3O5F: C, 64,23; H, 5,61; N, 8,99, Найдено: С, 63,95; H, 5,41; N, 8,92.
5.11 3-{4-[4-(2-МОРФОЛИН-4-ИЛ-ЭТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
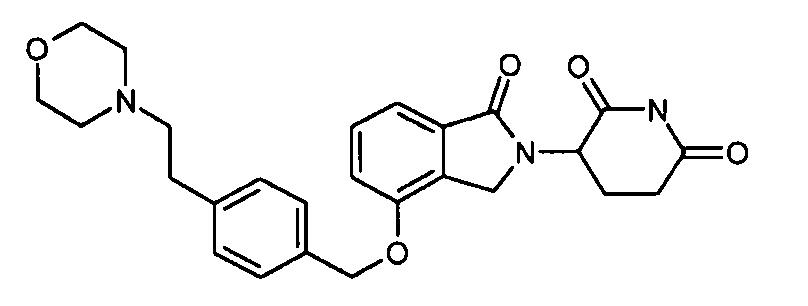
Стадия 1: К раствору 4-(2-бромэтил)бензойной кислоты (25 г, 109 ммоль) и трифторборан эфирата (13,71 мл, 109 ммоль) в THF по каплям через воронку при 0°C в течение 2 часов добавляли гидрид бора (196 мл, 196 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи, и MeOH добавляли по каплям при температуре окружающей среды, пока мутная суспензия не становилась прозрачной и прекращалось образование пузырьков. Этот прозрачный раствор концентрировали на роторном испарителе, и полученное твердое вещество перемешивали в воде (100 мл) в течение 30 минут при температуре окружающей среды. Суспензию фильтровали, получая 4-(2-хлорэтил)-бензойную кислоту как твердое вещество белого цвета (25 г, 107%).
Стадия 2: К раствору (4-(2-бромэтил)фенил)метанола (25 г, 116 ммоль) в ацетонитриле добавляли морфолин (25,3 мл, 291 ммоль). NaI добавляли за один раз. Смесь перемешивали в течение выходных при температуре окружающей среды. Реакционную суспензию фильтровали. Фильтрат концентрировали и перемешивали в простом эфире (100 мл) при температуре окружающей среды в течение 30 минут. Суспензию фильтровали. Полученное твердое вещество растворяли в 1н. HCl и экстрагировали EtOAc (50 мл×2). Водный слой нейтрализовали 1н. NaOH до рН=7-8. Полученную суспензию фильтровали, получая [4-(2-морфолин-4-ил-этил)-фенил]-метанол как твердое вещество белого цвета (13 г, 60%).
Стадия 3: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,5 г, 1,7 ммоль) в THF при 0°C добавляли трифенилфосфиновую смолу (2,3 г, загрузка 1,6 ммоль/г, 3,74 ммоль) и DIAD (0,73 мл, 3,74 ммоль). После перемешивания при 0°C в течение 10 минут, смесь добавляли к [4-(2-морфолин-4-ил-этил)-фенил]-метанолу (0,65 г, 2,94 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-{4-[4-(2-морфолин-4-ил-этил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (0,74 г, 88%).
Стадия 4: К раствору метилового эфира 4-карбамоил-4-{4-[4-(2-морфолин-4-ил-этил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (0,74 г, 1,5 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (0,16 г, 1,5 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая 3-{4-[4-(2-морфолин-4-ил-этил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (620 мг, 87%-ый выход): Т. пл.: 230-232°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/ 0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и при 100/0 в течение 5 мин: tR=4,86 минуты (97%); 1H ЯМР (ДМСО-d6) δ 1,80-2,12 (м, 1H, CHH), 2,40-2,44 (м, 4H, CH2, CH2), 2,45-2,48 (м, 1H, CHH), 2,55-2,64 (м, 1H, CHH), 2,69-2,80 (м, 2H, CH2), 2,81-3,00 (м, 1H, CHH), 3,52-3,61 (м, 4H, CH2, CH2), 4,18-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,19-7,54 (м, 7H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 32,04, 45,10, 51,58, 53,21, 59,93, 66,13, 69,47, 114,98, 115,19, 127,80, 128,70, 128,74, 129,79, 129,95, 133,29, 134,08, 140,25, 153,50, 168,01, 170,96, 172,82; LCMS MH=464; Вычислено для C26H29N3O5+0,5 H2O: C, 66,09; H, 6,40; N, 8,89; Найдено: С, 65,96; H, 6,33; N, 9,07.
5.12 3-[4-(4-ИМИДАЗОЛ-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
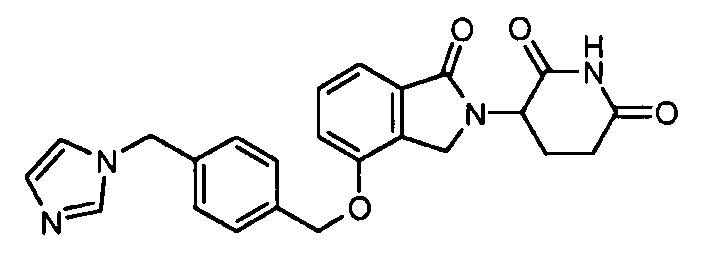
Стадия 1: Трифенилфосфин (1,6 ммоль/г, 10 г, 16 ммоль) на полимерной подложке при 0°C добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,49 г, 8,52 ммоль) в THF (100 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (3,36 мл, 17,04 ммоль). После перемешивания в течение 30 минут, добавляли (4-(хлорметил)фенил)метанол (2,00 г, 12,78 ммоль). Смесь перемешивали в течение одного часа, затем фильтровали. Смолу промывали метанолом (3×30 мл) и метиленхлоридом (3×30 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 30 минут), получая метиловый эфир 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (3,38 г, 92%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,97-2,35 (м, 4H, CH2, CH2), 3,50 (с, 3Н, СН3), 4,35-4,62 (м, 2Н, СН2), 4,73 (дд, J=4,8, 10,3 Гц, 1Н, NCH), 4,78 (с, 2H, CH2), 5,26 (с, 2H, CH2), 7,19 (д, 1H, NHH), 7,25-7,35 (м, 2H, Ar), 7,41-7,54 (м, 5H, Ar), 7,58 (д, J=0,4 Гц, 1H, NHH).
Стадия 2: Имидазол (0,19 г, 2,84 ммоль) и диизопропилэтиламин (0,24 мл, 1,42 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,61 г, 1,42 ммоль) в ацетонитриле (15 мл). Смесь нагревали при 70°C в течение ночи. К смеси добавляли карбонат калия (0,20 г, 1,48 ммоль), и смесь нагревали при 80°C в течение трех часов. Смесь концентрировали и затем очищали на колонке с силикагелем (MeOH/CH2Cl2 от 1% до 10% за 30 минут), получая 3-[4-(4-Имидазол-1-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,12 г, 37%-ый выход):
ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 18/2 в течение 10 минут (ацетонитрил/0,1% H3PO4), 2,50 мин (96,8%); Т. пл.: 248-250°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,07 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,82-2,99 (м, 1H, CHH), 4,17-4,47 (м, 2H, CH2), 5,10 (дд, J=5,2, 13,3 Гц, 1H, NCH), 6,92 (с, 1H, Ar), 7,20 (т, J=1,2 Гц, 1H, Ar), 7,24-7,37 (м, 4H, Ar), 7,42-7,54 (м, 3Н, Ar), 7,78 (с, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,20, 45,08, 49,20, 51,58, 69,19, 114,95, 115,27, 119,56, 127,58, 128,07, 128,54, 129,81, 129,97, 133,31, 136,14, 137,35, 137,59, 153,40, 167,99, 170,96, 172,83; LCMS MH=431; Вычислено для C24H22N4O4+0,5 H2O: C, 65,59; H, 5,28; N, 12,75, Найдено: С, 65,43; H, 5,15; N, 12,64.
5.13 3-{4-[4-(1,1-ДИОКСО-1-ТИОМОРФОЛИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
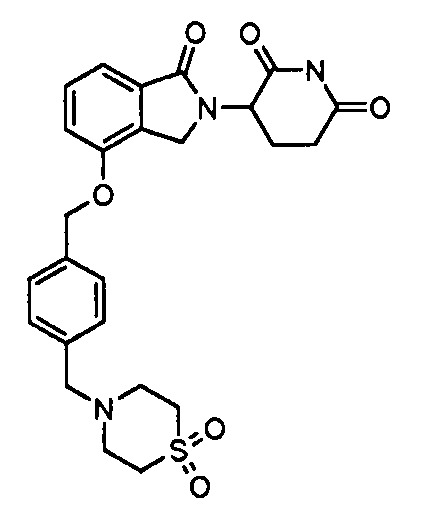
Стадия 1: Суспензию трет-бутилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (1,5 г, 4,49 ммоль), N,N-диизопропилэтиламина (784 мкл, 4,49 ммоль) и K2CO3 (620 мг, 4,49 ммоль) в DMF (15 мл) перемешивали в течение 5 минут при температуре окружающей среды, с последующим добавлением (4-хлорметил-фенил)-метанола (902 мг, 4,49 ммоль). Смесь перемешивали при температуре окружающей среды в течение приблизительно 15 часов, затем нагревали до 70°C в течение 3 часов. К смеси добавляли пиперидин (800 мкл), чтобы удалить непрореагировавший (4-хлорметил-фенил)-метанол. Смесь перемешивали в течение дополнительных 18 часов при 70°C. Смесь разбавляли водой (50 мл) и EtOAc (200 мл). Величину рН водной фазы подкисляли до приблизительно рН 4 с использованиям 1н. HCl, и фазы разделяли в делительной воронке. Водный слой насыщали NaCl и экстрагировали дополнительным количеством EtOAc (200 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали на роторном испарителе, получая 3,5 г желто-коричневого масла. Часть этого масла (2,1 г) очищали на колонке для флэш-хроматографии SiO2 (CombiFlash, 80 г предварительно заполненная SiO2 колонка, градиент MeOH/дихлорметан), получая трет-бутиловый эфир 4-карбамоил-2-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме белой пены (1,1 г, 90%-ый выход, в расчете на очищенную часть): 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, тBu), 2,00-2,13 (м, 3Н, CHH, CH2), 2,13-2,31 (м, 1H, CHH), 4,41 (с, 2H, CH2), 4,50 (д, J=5,7 Гц, 2H, CH2), 4,69 (дд, J=4,6, 10,3 Гц, 1H, CH), 5,19 (т, J=5,7 Гц, 1H, OH), 5,24 (с, 2H, CH2), 6,75 (уш.с, 1H, NH), 7,22 (уш.с, 1H, NH), 7,25-7,37 (м, 4H, Ar), 7,42-7,53 (м, 3H, Ar); 13C ЯМР (ДМСО-d6) δ 24,69, 27,56, 31,50, 44,78, 54,08, 62,60, 69,45, 81,42, 114,97, 115,18, 126,52, 127,57, 129,71, 130,03, 133,27, 134,86, 142,40, 153,42, 168,12, 169,85, 172,94; LCMS MH=455
Стадия 2: К раствору трет-бутилового эфира 4-карбамоил-2-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (250 мг, 0,55 ммоль) в дихлорметане (5 мл), охлажденному в ванне со льдом до 0°C, добавляли N,N-диизопропилэтиламин (115 мкл, 0,66 ммоль), затем метансульфонил хлорид (47 мкл, 0,605 ммоль). Через 5 минут смеси давали нагреться до температуры окружающей среды. Смесь перемешивали приблизительно в течение 45 минут при температуре окружающей среды, затем добавляли дополнительное количество MsCl (20 мкл). Реакция была полной после 10 минут по оценке с помощью LCMS. Сырую смесь концентрировали, и остаток высушивали далее в вакуумном сушильном шкафу при 40°C в течение ночи, получая сырой продукт как твердое вещество белого цвета (320 мг). LCMS показала, что полученное твердое вещество содержало приблизительно 5:1 смесь трет-бутилового эфира 4-карбамоил-2-[4-(4-метансульфонилоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты и трет-бутилового эфира 4-карбамоил-2-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (МН=533 и 473, соответственно). Смесь использовали на следующей стадии без дальнейшей очистки. К раствору сырого продукта (293 мг, 0,55 ммоль, предполагая количественный выход с предыдущей стадии) и N,N-диизопропилэтиламина (240 мкл, 1,375 ммоль) в ацетонитриле (5 мл) добавляли тиоморфолин-1,1-диоксид (82 мг, 0,605 ммоль). Смесь перемешивали при температуре окружающей среды в течение приблизительно 45 минут, и затем добавляли дополнительное количество тиоморфолин-1,1-диоксида (82 мг, 0,605 ммоль). После 3 часов смесь нагревали с обратным холодильником в течение приблизительно 4 часов и затем перемешивали при температуре окружающей среды в течение 2 дней. Летучие компоненты удаляли в вакууме, и остаток разделяли между EtOAc (150 мл) и 1н. NaHCO3 (30 мл). Водный слой промывали дополнительным количеством EtOAc (150 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали на роторном испарителе, получая трет-бутиловый эфир 4-карбамоил-2-{4-[4-(1,1-диоксо-1-тиоморфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества грязно-белого цвета (340 мг). LCMS MH=572. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 3: К перемешиваемому раствору трет-бутилового эфира 4-карбамоил-2-{4-[4-(1,1-диоксо-1-тиоморфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (230 мг, 0,40 ммоль) в THF (10 мл) добавляли 1М раствор KOtBu (402 мкл, 0,402 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение приблизительно 2 часов, затем добавляли дополнительное количество KOtBu (100 мл). После приблизительно еще 2,5 часов реакционную смесь охлаждали в ванне со льдом и затем переносили в 1н. водный раствор HCl. Смесь концентрировали досуха, и остаток повторно растворяли в минимальном DMF и 1н. HCl (1:1) и фильтровали. Фильтрат, содержащий сырой продукт, очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-{4-[4-(1,1-диоксо-1-тиоморфолин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (113 мг, 56%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 ацетонитрил/0,1% H3PO4, 4,91 мин (97,5%); Т. пл.: 156-158°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,04 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,74-3,01 (м, 5H, 2CH2, CHH), 3,03-3,16 (м, 4H, 2СН2), 3,68 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,25-7,40 (м, 4H, Ar), 7,42-7,56 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,24, 30,06, 43,97, 48,93, 49,12, 50,46, 58,16, 68,23, 113,87, 114,13, 126,60, 127,76, 128,70, 128,83, 132,18, 134,44, 136,40, 152,36, 166,87, 169,84, 171,71; LCMS MH=498; Вычислено для C25H27N3O6S: C, 60,35; H, 5,47; N, 8,44; S, 6,44, Найдено: С, 55,59; H, 5,24; N, 7,92; S, 5,96.
5.14 ТРЕТ-БУТИЛОВЫЙ ЭФИР 4-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИПЕРИДИН-1-КАРБОНОВОЙ КИСЛОТЫ
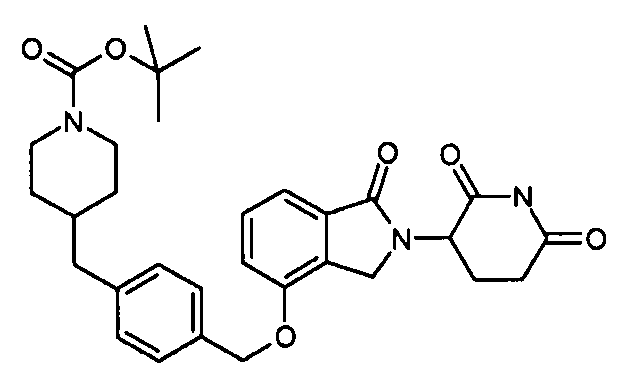
Стадия 1: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,45 г, 1,5 ммоль) в THF при 0°C добавляли трифенилфосфиновую смолу (1,75 г, загрузка 1,6 ммоль/г, 2,86 ммоль) и DIAD (0,55 мл, 2,86 ммоль). После перемешивания при 0°C в течение 10 минут к смеси добавляли трет-бутиловый эфир 4-(4-гидроксиметил-бензил)-пиперидин-1-карбоновой кислоты, и полученную смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты в форме масла (0,85 г, 90%).
Стадия 2: К раствору 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты трет-бутилового эфира (0,85 г, 1,5 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (0,16 г, 1,5 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая трет-бутиловый эфир 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты в форме масла (660 мг, 80%). Т. пл.: 180-182°C.
ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в Н2О от 5/95 до 100/0 в течение 5 мин и остановка при 100/0 на 5 мин: tR=7?69 мин (98%), 1H ЯМР (ДМСО-d6) δ 0,92-1,12 (м, 2H, CH2), 1,16-1,24 (м, 1H, CHH), 1,38 (с, 9Н, СН3, СН3, СН3), 1,46-1,58 (м, 2Н, СН2), 1,59-1,74 (м, 1Н, СН), 1,89-2,06 (м, 1Н, СНН), 2,35-2,47 (м, 1Н, СНН), 2,56-2,71 (м, 4H, СН2, СНН, CHH), 2,79-3,01 (м, 1H, CHH), 3,79-4,00 (м, 2H, CH2), 4,18-4,51 (м, 2H, CH2), 5,01-5,16 (м, 1H, NCH), 5,20 (с, 2H, CH2), 7,20 (д, J=8,1 Гц, 2H, Ar), 7,28-7,36 (м, 2Н, Ar), 7,32-7,32 (м, 1Н, Ar), 7,40 (д, J=8,1 Гц, 2H, Ar), 7,43-7,56 (т, J=8,3 Гц, 1H, Ar), 10,91-11,07 (м, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 28,01, 31,13, 31,39, 37,18, 41,74, 45,02, 51,51, 69,0, 78,31, 114,90, 115,13, 127,64, 129,06, 129,89, 133,24, 134,00, 139,87, 153,46, 153,74, 167,94, 170,91, 172,76; LCMS MH=548; Вычислено для C31H37N3O6+0,8Н2О: C, 66,25; H, 6,92; N, 7,48; Найдено: С, 66,09; H, 6,83; N, 7,67.
5.15 3-[1-ОКСО-4-(4-ПИПЕРИДИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
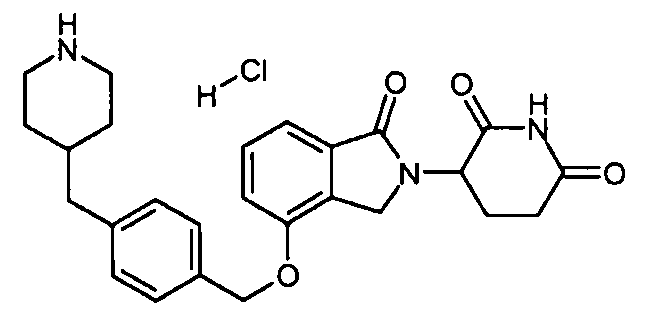
К раствору трет-бутилового эфира 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты (0,5 г, 1,0 ммоль) в CH2Cl2 (10 мл) добавляли гидрохлорид в растворе простого эфира (2,0 М, 5 мл, 10 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали. Полученное твердое вещество перемешивали с простым эфиром, получая 3-[1-оксо-4-(4-пиперидин-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (194 мг, 50%). Т. пл.: 200-202°C. ВЭЖХ: Waters Symmetry C-l8, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,90 мин (96%), 1H ЯМР (ДМСО-d6) δ 1,35 (д, J=11,9 Гц, 2H, CH2), 1,62-1,73 (м, 2H, CH2), 1,74-1,87 (м, 1H, CH), 1,91-2,05 (м, 1H, CHH), 2,33-2,48 (м, 1H, CHH), 2,52-2,64 (м, 3Н, CH2, CHH), 2,77 (д, J=10,8 Гц, 2H, CH2), 2,84-3,01 (м, 1H, CHH), 3,21 (д, J=12,1 Гц, 2H, CH2), 4,11-4,51 (м, 2H, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,21 (с, 2H, CH2), 7,21 (д, J=8,1 Гц, 2H, Ar), 7,28-7,37 (м, 2H, Ar), 7,42 (д, J=8,1 Гц, 2H, Ar), 7,45-7,54 (м, 1H, Ar), 8,50-8,75 (м, 1H, HCl), 8,80-9,02 (м, 1H, HCl), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 28,04, 31,14, 34,82, 41,23, 42,89, 45,01, 51,51, 69,34, 114,93, 115,16, 127,71, 129,09, 129,76, 129,87, 133,24, 134,25, 139,25, 153,43, 167,92, 170,91, 172,78; LCMS MH=448, Вычислено для C26H29N3O4HCl+1,1 H2O: C, 61,98; H, 6,44; N, 8,34; Cl, 7,04; Найдено: С, 61,96; H, 6,63; N, 8,00; Cl, 7,06.
5.16 3-(4-((5-(МОРФОЛИНОМЕТИЛ)БЕНЗОФУРАН-2-ИЛ)МЕТИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
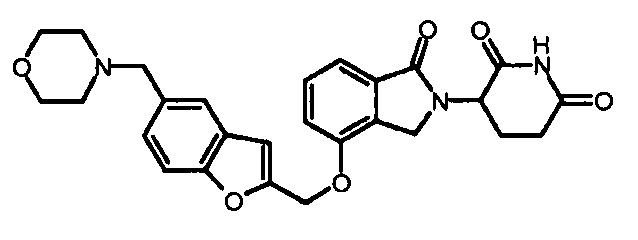
Стадия 1: Гексаметилентетрамин (14,0 г, 100 ммоль) добавляли в одной части под N2 к перемешиваемому раствору 4-гидроксибензальдегида (12,2 г, 100 ммоль) в трифторуксусной кислоте (100 мл). После добавления смесь нагревали в масляной бане при 90°C в течение 24 часов. Реакционную смесь гасили 140 мл 3н. HCl и охлаждали до температуры окружающей среды за 1 час. Смесь экстрагировали CH2Cl2 (4×100 мл), и объединенный раствор CH2Cl2 концентрировали. Этанол (15 мл) к остатку добавляли при 40°C и затем охлаждали в ванне со льдом в течение 30 минут. Смесь фильтровали, и твердое вещество промывали холодным этанолом (10 мл), получая 5-формилсалицилальдегид (5,0 г, 33%-ый выход): 1H ЯМР (ДМСО-d6) δ 7,16 (д, J=8,4 Гц, 1H), 8,00-8,04 (дд, J=2,4 и 8,7 Гц, 1H), 8,21 (д, J=2,4 Гц, 1H), 9,89 (с, 1H), 10,34 (с, 1H), 11,79 (с, 1H).
Стадия 2: Смесь 5-формилсалицилальдегида (3,9 г, 26,0 ммоль), этилбромацетата (4,4 г, 26,0 ммоль), карбоната калия (5,4 г, 39,0 ммоль) и молекулярного сита (3,9 г) в DMF (40 мл) нагревали при 85°C на масляной бане в течение 2 часов, затем при 120°C в течение 5 часов. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc (100 мл). Смесь фильтровали, и твердое вещество промывали EtOAc (50 мл). Фильтрат промывали водой (3×50 мл) и солевым раствором (50 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с простым эфиром (20 мл) и гексаном (20 мл), получая 5-формилбензофуран-2-этилкарбоксилат (3,3 г, 59%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,35 (т, J=7,2 Гц, 3H), 4,35-4,42 (кв, J=6,9 Гц, 2H), 7,92-7,95 (м, 2H), 8,03-8,07 (дд, J=1,5 и 8,7 Гц, 1H), 8,42 (уш., 1H), 10,10 (с, 1H).
Стадия 3: Морфолин (1,2 г, 13,8 ммоль) добавляли к перемешиваемому раствору 5-формилбензофуран-2-этилкарбоксилата (1,5 г, 6,9 ммоль) в метаноле (60 мл). Добавляли молекулярное сито (4A, 1,5 г), затем уксусную кислоту (0,4 г, 6,9 ммоль) и натрия цианоборгидрид (0,7 г, 10,3 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь фильтровали, и твердое вещество промывали метанолом (40 мл). Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл). Раствор EtOAc промывали насыщ. NaHCO3 (30 мл) и солевым раствором (30 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc: CH2Cl2 40:60), получая этиловый эфир 5-морфолин-4-илметил-бензофуран-2-карбоновой кислоты (1,2 г, 61%-ый выход): 1H ЯМР (CDCl3) δ 1,43 (т, J=6,9 Гц, 3Н), 2,45 (т, J=4,5 Гц, 4H), 3,58 (с, 2H), 3,71 (т, J=4,5 Гц, 4H), 4,41-4,48 (кв, J=6,9 Гц, 2H), 7,42-7,45 (дд, J=1,8 и 8,7 Гц, 1H), 7,49 (д, J=0,9 Гц, 1H), 7,52 (д, J=8,4Гц, 1H), 7,61 (д, J=0,9 Гц, 1H).
Стадия 4: Раствор LiAlH4/THF (1M, 8 мл, 8,0 ммоль) в THF (10 мл) охлаждали в ванне со льдом до 5°C. Раствор 5-морфолин-4-илметил-бензофуран-2-карбоновой кислоты этилового эфира (1,8 г, 6,2 ммоль) в THF (20 мл) добавляли по каплям при 5-10°C. После добавления смесь перемешивали в ванне со льдом в течение 30 минут. Реакционную смесь тщательно гасили насыщ. Na2CO3 (50 мл) в ванне со льдом, и смесь разбавляли CH2Cl2 (50 мл). Водный слой экстрагировали CH2Cl2 (3×40 мл), и объединенный раствор CH2Cl2 промывали насыщ. NaHCO3 (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 5:95), получая (5-морфолин-4-илметил-бензофуран-2-ил)-метанол (1,3 г, 86%-ый выход): 1H ЯМР (CDCl3) δ 2,45 (т, J=4,5 Гц, 4H), 2,70 (уш., 1H), 3,55 (с, 2H), 3,71 (т, J=4,8 Гц, 4H), 4,74 (с, 2H), 6,59 (с, 1H), 7,20-7,24 (дд, J=1,5 и 8,4 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,47 (д, J=1,2 Гц, 1H).
Стадия 5: Диизопропил азодикарбоксилат (0,8 г, 4,1 ммоль) медленно добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,5 г, 4,4 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль) и 5-морфолин-4-илметил-бензофуран-2-ил)-метанола (0,9 г, 3,6 ммоль) в THF (60 мл) медленно добавляли при 3-6°C. После перемешивания при 3°C в течение 5 минут, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (40 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (40 мл), водой (2×30 мл) и солевым раствором (30 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 5:95), получая 5-амино-4-(4-((5-морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,9 г, 64%-ый выход): 1H ЯМР (CDCl3) δ 2,13-2,47 (м, 8H), 3,57 (с, 2H), 3,63 (с, 3Н), 3,70-3,72 (м, 4H), 4,35 (д, J=17,7 Гц, 1H), 4,44 (д, J=17,7 Гц, 1H), 4,86-4,91 (д, J=5,7 и 8,7 Гц, 1H), 5,24 (с, 2H), 5,36 (уш., 1H), 6,30 (уш., 1H), 6,77 (с, 1H), 7,17-7,19 (дд, J=1,8 и 6,9 Гц, 1H), 7,28-7,31 (дд, J=1,5 и 8,4 Гц, 1H), 7,41-7,48 (м, 3H), 7,52 (д, J=1,2 Гц, 1H).
Стадия 6: Раствор трет-бутоксида калия/THF (1M, 1,9 мл, 1,9 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-4-(4-((5-морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 1,7 ммоль) в THF (25 мл). Реакционную смесь перемешивали при 5°C в течение 1 часа, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (50 мл) и водой (15 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (30 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 5:95), получая 3-(4-((5-морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 25%-ый выход): Т. пл. 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,95-2,09 (м, 1H), 2,35-2,59 (м, 6H), 2,89-2,92 (м, 1H), 3,54-3,57 (м, 6H), 4,25 (д, J=15 Гц, 1H), 4,36 (д, J=18 Гц, 1H), 5,07-5,13 (дд, J=6 и 12 Гц, 1H), 5,42 (с, 2H), 7,08 (с, 1H), 7,27-7,57 (м, 6H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,28, 31,16, 45,03, 51,56, 53,06, 62,32, 62,52, 66,15, 107,05, 110,80, 115,14, 115,66, 121,61, 126,00, 127,48, 129,81, 129,95, 132,58, 133,41, 152,80, 152,95, 153,82, 167,88, 170,93, 172,79; Вычислено для C27H27N3O6+1,0H2O: C, 63,90; H, 5,76; N, 8,28, Найдено: С, 63,97; H, 5,40; N, 8,20.
5.17 3-(4-(4-(((2S,6R)-2,6-ДИМЕТИЛМОРФОЛИНО)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
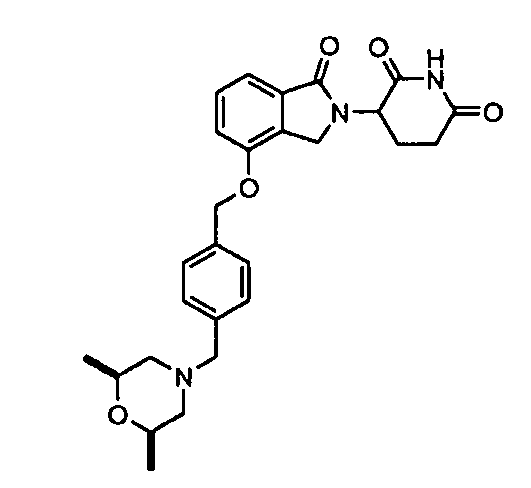
Стадия 1: В круглодонной колбе на 250 мл α-трет-бутиловый эфир L-глутамина (7,83 г, 32,8 ммоль) и N,N-диизопропилэтиламин (11,46 мл, 65,6 ммоль) суспендировали в ацетонитриле (100 мл) при температуре окружающей среды. Суспензию перемешивали в течение приблизительно 10 минут, и затем раствор 2-(бромметил)-3-(трет-бутилдиметилсилилокси)метилбензоата (11,4 г, 29,8 ммоль) в ацетонитриле (20 мл) добавляли по каплям приблизительно за 10 минут. Реакционную смесь медленно нагревали в масляной бане до кипения (80°C) в течение 4 часов. Реакционной смеси давали охладиться до температуры окружающей среды в течение приблизительно 1 часа, и затем добавляли раствор фторида цезия (4,53 г, 29,8 ммоль) в воде (15 мл). Полученную смесь энергично перемешивали при температуре окружающей среды в течение приблизительно 1 часа, после чего LCMS показала, что десилилирование было полным. Реакционную смесь разбавляли ацетонитрилом и фильтровали, чтобы удалить нерастворенные твердые частицы. Твердые частицы промывали дополнительным количеством ацетонитрила. Фильтрат и смывы (полный объем 200 мл) разбавляли далее EtOAc (300 мл), переносили на 1-л делительную воронку и промывали 0,5н. водным раствором KH2PO4 (100 мл, рН ~5). К водному слою добавляли 1н. HCl частями (~20 мл, рН изменялся от 7-8 до ~5 с использованием бумаги). К водному слою добавляли NaCl (~10 г) и EtOAc (~200 мл). Смесь энергично встряхивали в делительной воронке. Органические слои объединяли, промывали солевым раствором (50 мл), высушивали (Na2SO4) и концентрировали на роторном испарителе, получая 15 г твердого вещества грязно-белого цвета. Это твердое вещество, содержащее сырой продукт, суспендировали в ацетонитриле (200 мл), и суспензию нагревали в масляной бане с обратным холодильником (85°C) в течение 30 минут при перемешивании. Смеси давали охладиться до температуры окружающей среды за 1 час, затем выдерживали при 4°C в течение еще 2 часов. Образовавшееся твердое вещество собирали аспирационной фильтрацией. Оставшееся твердое вещество в колбе переносили на воронку с фильтром, используя некоторое количество MTBE. Корку промывали дополнительным количеством MTBE (полный объем фильтрата ~300 мл), высушивали всасыванием и затем помещали в вакуумный сушильный шкаф при 40°C на несколько часов, получая 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат как твердое вещество белого цвета (7,3 г, выход 72%, отрегулированный в отношении чистоты исходного материала и продукта): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 ацетонитрил/0,1% H3PO4, 2,91 мин (96,9%); Т. пл.: 198-200°C; 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, tBu), 1,93-2,14 (м, 3Н, СН2, СНН), 2,15-2,33 (м, 1Н, СНН), 4,35 (с, 2Н, СН2), 4,61-4,83 (м, 1Н, СН), 6,76 (уш.с, 1Н, NH), 6,97-7,07 (м, 1Н, Ar), 7,11-7,20 (м, 1Н, Ar), 7,26 (уш.с, 1H, NH), 7,29-7,36 (м, 1H, Ar), 10,10 (с, 1H, OH); 13C ЯМР (ДМСО-d6) δ 24,81, 27,56, 31,44, 44,71, 54,02, 81,38, 113,72, 117,96, 127,99, 129,36, 133,36, 152,50, 168,36, 169,88, 172,94; LCMS MH=335; Вычислено для C17H22N2O5+0,19 H2O: C, 60,45; H, 6,68; N, 8,29, Найдено: С, 60,44; H, 6,62; N, 8,27.
Стадия 2: В круглодонной колбе на 250 мл 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (3 г, 8,79 ммоль) и трифенилфосфин на полистироле (1,6 ммоль/г смолы, 10,99 г, 17,59 ммоль) суспендировали в THF (100 мл, 1220 ммоль) при температуре окружающей среды. Смоле давали набухнуть при мягком перемешивании в течение 5 минут, затем смесь охлаждали в ванне со льдом при 0°C. К смеси добавляли DIAD (3,42 мл, 17,59 ммоль), используя шприц, быстрым капельным способом. Через 10 минут (4-(хлорметил)фенил)метанол (2,066 г, 13,19 ммоль) добавляли в форме твердого вещества в одной части. Ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение 6 часов. Смолу аспирационно фильтровали и промывали на воронке с фильтром последовательно дихлорметаном и MeOH (2X, ~50 мл, каждый). Объединенные фильтраты и смывы концентрировали в вакууме до сиропа, который разделяли между EtOAc (~300 мл) и водой (~100 мл). Органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая сырой продукт в форме желто-коричневого масла (~10 г). Масло очищали на колонке для флэш-хроматографии SiO2 (CombiFlash, 330 г предварительно заполненная колонка SiO2, от 0% до 5% MeOH в градиенте дихлорметана), получая 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат в форме белой пены, которую измельчали до тонкодисперсного порошка (3,6 г, 87%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, tBu), 2,00-2,14 (м, 3Н, СНН, СН2), 2,14-2,35 (м, 1Н, СНН), 4,43 (с, 2Н, СН2), 4,70 (дд, J=4,7, 10,4 Гц, 1Н, CH), 4,78 (с, 2H, CH2), 5,27 (с, 2Н, СН2), 6,66-6,83 (м, 1Н, NH), 7,18-7,28 (м, 1H, NH), 7,29 (д, J=2,3 Гц, 1H, Ar), 7,32 (д, J=2,6 Гц, 1H, Ar), 7,40-7,58 (м, 5H, Ar); 13C ЯМР (ДМСО-d6) δ 24,69, 27,56, 31,50, 44,78, 45,83, 54,08, 69,13, 81,41, 114,91, 115,26, 127,92, 129,00, 129,73, 130,03, 133,31, 136,78, 137,38, 153,35, 168,09, 169,85, 172,93.
Стадия 3: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (250 мг, 0,529 ммоль) в ацетонитриле (10 мл) добавляли (2S,6R)-2,6-диметилморфолин (183 мг, 1,586 ммоль) и DIEA (0,138 мл, 0,793 ммоль). Полученную смесь перемешивали при 60°C в течение 3 часов. Реакционную смесь концентрировали в вакууме и далее высушивали в вакуумном сушильном шкафу, получая 5-амино-2-(4-(4-(((2S,6R)-2,6-диметилморфолино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат в форме прозрачного стекловидного твердого вещества (360 мг). LCMS MH=552. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 4: 5-Амино-2-(4-(4-(((2S,6R)-2,6-диметилморфолино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (0,528 ммоль, предполагая теоретический выход с предыдущей стадии) забирали в сухом THF (5 мл). К перемешиваемому раствору при температуре окружающей среды по каплям добавляли KOtBu (0,581 мл, 0,581 ммоль, 1,0 М в THF). Полученную смесь (светло-желтый прозрачный раствор) перемешивали в течение 1 часа при температуре окружающей среды. Добавляли еще 1,1 экв. KOtBu (0,581 мл, 0,581 ммоль, 1,0 М THF), и смесь перемешивали в течение еще 1 часа (LCMS показала, что реакция была полной). Реакционную смесь охлаждали на льду и затем переносили частями в колбу с 2М муравьиной кислоты в MeCN (50 мл). Сырую реакционную смесь концентрировали в вакууме, получая масляный остаток, который растворяли в минимальной смеси вода/DMF (~2 мл/8 мл) и фильтровали, и фильтрат, содержащий сырой продукт, очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, 5%-ый MeCN за 12 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(4-(4-(((2S,6R)-2,6-диметилморфолино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (55 мг, 22%-ый выход со стадии 3 и стадии 4): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 10 мин, ацетонитрил/0,1% H3PO4, 5,84 мин (95,6%); Т. пл.: 164-166°C; 1H ЯМР (ДМСО-d6) δ 1,00 (с, 3Н, CH3), 1,02 (с, 3Н, СН3), 1,52-1,74 (м, 2Н, СНН, СНН), 1,88-2,12 (м, 1Н, СНН), 2,32-2,47 (м, 1Н, СНН), 2,53-2,62 (м, 1Н, СНН), 2,62-2,71 (м, 2Н, СНН, СНН), 2,83-3,03 (м, 1Н, СНН), 3,44 (с, 2Н, CH2N), 3,48-3,63 (м, 2Н, 2×СН2), 4,25 (д, J=17,4 Гц, 1Н, СНН), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2O), 7,20-7,39 (м, 4H, Ar), 7,39-7,59 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 18,93, 22,33, 31,18, 45,06, 51,55, 58,89, 61,66, 69,39, 70,94, 114,96, 115,22, 127,63, 128,95, 129,80, 129,92, 133,30, 135,25, 137,69, 153,49, 167,99, 170,96, 172,81; LCMS MH=478; Вычислено для C27H31N3O5+0,34 H2O: C, 67,05; H, 6,60; N, 8,69; H2O, 1,27, Найдено: С, 67,20; H, 6,63; N, 8,52; H2O, 1,27
5.18 3-(1-ОКСО-4-((5-(ПИПЕРИДИН-1-ИЛ)БЕНЗОФУРАН-2-ИЛ)МЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
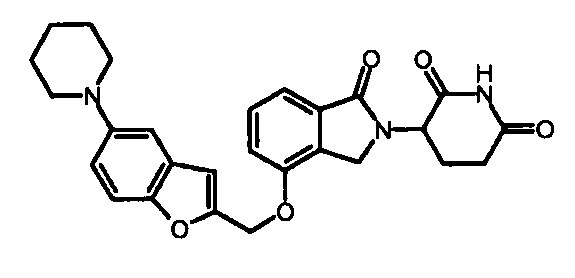
Стадия 1: Смесь 5-нитробензофуран-2-этилкарбоксилата (5,0 г, 21,2 ммоль) и 10% Pd/C (0,5 г) в EtOAc (300 мл) гидрировали при 50 psi в течение ночи. Реакционную смесь фильтровали через целит и промывали EtOAc (100 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 4:6), получая 5-аминобензофуран-2-этилкарбоксилат (4,5 г, 100%-ый выход): 1H ЯМР (CDCl3) δ 1,41 (т, J=7,2 Гц, 3H), 3,68 (уш., 2H), 4,38-4,45 (кв., J=7,2 Гц, 2H), 6,80-6,84 (дд, J=2,4 и 9,0 Гц, 1H), 6,88 (д, J=2,1 Гц, 1H), 7,35-7,36 (д, J=3,3 Гц, 1H), 7,38 (с, 1H).
Стадия 2: N,N-диизопропилэтиламин (3,8 г, 29,2 ммоль) добавляли к перемешиваемому раствору 5-аминобензофуран-2-этилкарбоксилата (2,5 г, 12,2 ммоль) и 1,5-дибромпентана (5,0 г, 21,9 ммоль) в толуоле (40 мл). Полученную смесь нагревали при 110°C на масляной бане в течение ночи. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали, и твердое вещество промывали толуолом (25 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 1:9), получая 5-пиперидин-1-ил-бензофуран-2-этилкарбоксилат (3,0 г, 89%); 1H ЯМР (CDCl3) δ 1,42 (т, J=6,2 Гц, 3H), 1,53-1,61 (м, 2H), 1,71-1,79 (м, 4H), 3,09-3,13 (т, J=5,4 Гц, 4H), 4,39-4,46 (кв, J=6,9 Гц, 2H), 7,09-7,10 (д, J=2,4 Гц, 1H), 7,15-7,19 (дд, J=2,7 и 9,3 Гц, 1H), 7,42-7,46 (м, 2H).
Стадия 3: Раствор LiAlH4/THF (1M, 11 мл, 11 ммоль) в THF (10 мл) охлаждали до 3°C. Раствор 5-пиперидин-1-ил-бензофуран-2-этилкарбоксилата (2,9 г, 10,7 ммоль) в THF (30 мл) медленно добавляли при 3-10°C. Реакционную смесь перемешивали при 3°C в течение 30 минут, затем гасили насыщ. Na2CO3 (50 мл). Смесь перемешивали с CH2Cl2 (50 мл), и водный слой экстрагировали CH2Cl2 (3×40 мл). Объединенный раствор CH2Cl2 промывали насыщ. NaHCO3 (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:CH2Cl2 3:7), получая (5-пиперидин-1-ил-бензофуран-2-ил)-метанол (2,4 г, 95%-ый выход): 1H ЯМР (CDCl3) δ 1,23-1,27 (м, 2H), 1,54-1,60 (м, 4H), 2,82 (уш., 1H), 3,07 (т, J=6,0 Гц, 4H), 4,68 (с, 2H), 6,45 (с, 1H), 6,95-7,00 (м, 2H), 7,29 (д, J=9,0 Гц, 1H); 13C ЯМР (CDCl3) δ 24,20, 26,14, 53,10, 58,11, 104,20, 108,83, 111,19, 117,01, 128,53, 149,07, 150,30, 156,94.
Стадия 4: Диизопропил азодикарбоксилат (0,8 г, 4,1 ммоль) медленно добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,5 г, 4,4 ммоль) в THF (40 мл) при 3-6°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль) и (5-пиперидин-1-ил-бензофуран-2-ил)-метанола (0,8 г, 3,6 ммоль) в THF (60 мл) медленно добавляли при 3-6°C. После перемешивания при 3°C в течение 10 минут, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (80 мл) и промывали насыщ. NaHCO3 (40 мл), водой (2×35 мл) и солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-5-оксо-4-(1-оксо-4-((5-пиперидин-1-ил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноат (0,7 г, 51%-ый выход): 1H ЯМР (CDCl3) δ 1,55-1,59 (м, 2H), 1,72-1,77 (м, 4H), 2,31-2,39 (м, 4H), 3,08-3,11 (м, 4H), 4,40 (д, J=18 Гц, 1H), 4,44 (д, J=18 Гц, 1H), 4,87-4,92 (дд, J=6,0 и 9,0 Гц, 1H), 5,21 (с, 2H), 5,49 (с, 1H), 6,38 (с, 1H), 6,71 (с, 1H), 7,02-7,18 (м, 3H), 7,36-7,46 (м, 2H).
Стадия 5: Раствор трет-бутоксид калия/THF (1M, 1,5 мл, 1,5 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-((5-пиперидин-1-ил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноата (0,6 г, 1,2 ммоль) в THF (20 мл) и перемешивали в течение 30 минут, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (50 мл) и водой (15 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали водой (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(1-оксо-4-((5-(пиперидин-1-ил)бензофуран-2-ил)метокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 43%-ый выход): Т. пл. 242-244°C; 1H ЯМР (ДМСО-d6) δ 1,09 (м, 2H), 1,50-1,64 (м, 4H), 1,90-2,02 (м, 2H), 2,49-2,51 (м, 2H), 2,80-2,95 (м, 1H), 3,03-3,07 (м, 4H), 4,25 (д, J=17,7 Гц, 1H), 4,35 (д, J=17,4 Гц, 1H), 5,05-5,15 (м, 1H), 5,37 (с, 2H), 6,97-7,09 (м, 3H), 7,35-7,51 (м, 4H), 10,96 (с, 1H); l3C ЯМР (ДМСО-d6) δ 22,28, 23,78, 25,53, 31,16, 45,04, 51,51, 62,61, 107,29, 107,71, 111,12, 115,15, 116,69, 127,96, 129,78, 129,95, 133,40, 148,89, 149,23, 152,57, 152,99, 167,88, 170,93, 172,70; Вычислено для C27H27N3O5+0,2 H2O: C, 67,97; H, 5,79; N, 8,81, Найдено: C, 67,88; H, 5,75; N, 8,62.
5.19 4-АМИНО-1-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИРИДИНИЯ ФОРМИАТ
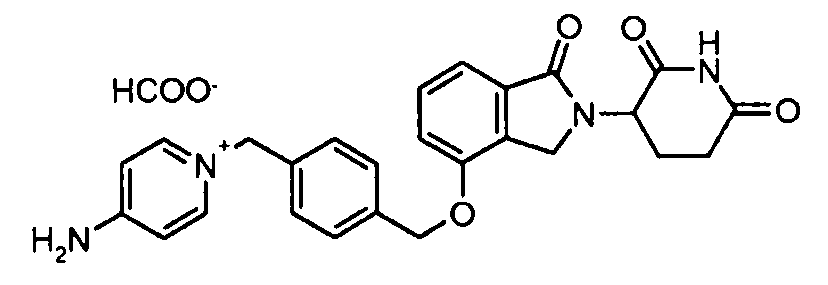
Пиридин-4-амин (0,82 г, 8,70 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,75 г, 1,74 ммоль) в DMF (15 мл) при 50°C в течение трех часов. К смеси добавляли карбонат калия (0,24 г, 1,74 ммоль), и смесь нагревали при 75°C в течение пяти часов. Смесь очищали препаративной ВЭЖХ, получая 4-амино-1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиридиния формиат в форме твердого вещества коричневого цвета (0,20 г, 26%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4): 5,00 мин (99,1%); Т. пл.: 300-302°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,26 (с, 2H, NH2 или CH2), 5,36 (с, 2H, CH2 или NH2), 6,86 (д, J=7,4 Гц, 2H, СН2), 7,27-7,58 (м, 7Н, Ar), 8,22-8,43 (м, 4H, Ar), 11,00 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,15, 45,09, 51,58, 59,39, 69,00, 109,56, 115,00, 115,36, 128,12, 128,32, 129,85, 129,94, 133,29, 135,35, 137,21, 142,93, 153,31, 158,57, 158,67, 168,02, 170,89, 172,80; LCMS M+=457; Вычислено для C26H25N4O4 HCOO: C, 64,53; H, 5,22; N, 11,15; Найдено: С, 56,18; H, 5,07; N, 10,01.
5.20 3-(1-ОКСО-4-((5-ПИПЕРИДИН-1-ИЛМЕТИЛ)БЕНЗОФУРАН-2-ИЛ)МЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
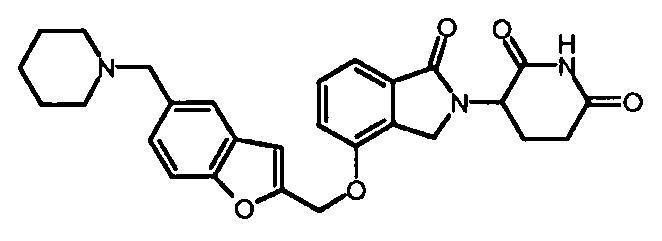
Стадия 1: Пиперидин (1,2 г, 14,1 ммоль) добавляли к перемешиваемому раствору 5-формилбензофуран-2-этилкарбоксилата (1,5 г, 6,9 ммоль) в метаноле (60 мл). Добавляли молекулярное сито (1,5 г), затем уксусную кислоту (0,4 г, 6,9 ммоль) и натрий цианоборгидрид (0,7 г, 10,3 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 3 часов. Смесь фильтровали, и твердое вещество промывали метанолом (40 мл). Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл) и промывали насыщ. NaHCO3 (35 мл) и солевым раствором (35 мл) и высушивали (K2CO3). Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая этиловый эфир 5-пиперидин-1-илметил-бензофуран-2-карбоновой кислоты (1,0 г, 49%-ый выход): 1H ЯМР (CDCl3) δ 1,40-1,48 (м, 3Н), 1,57-1,64 (м, 4H), 2,44 (уш., 1H), 3,60 (с, 2H), 3,97-3,98 (м, 2H), 4,40-4,47 (кв, 2H), 7,40-7,63 (м, 4H).
Стадия 2: Раствор этилового эфира 5-пиперидин-1-илметил-бензофуран-2-карбоновой кислоты (1,0 г, 3,4 ммоль) в THF (15 мкл) медленно добавляли к перемешиваемому раствору LiAlH4/THF (1M, 4,4 мл, 4,4 ммоль) в THF (10 мл) при 5-8°C. После добавления смесь перемешивали при 5°C в течение 30 минут, затем гасили насыщ. Na2CO3 (50 мл). Смесь перемешивали с CH2Cl2 (50 мл), и водный слой экстрагировали CH2Cl2 (2×30 мл). Объединенный раствор CH2Cl2 промывали насыщ. NaHCO3 (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая (5-пиперидин-1-илметил-бензофуран-2-ил)-метанол (0,5 г, 63%-ый выход): 1H ЯМР (CDCl3) δ 1,45-1,46 (м, 2H), 1,55-1,62 (м, 4H), 2,40 (с, 4H), 3,46 (с, 1H), 3,52 (с, 2H), 4,71 (с, 2H), 6,55 (с, 1H), 7,20 (д, J=8,4 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,45 (с, 1H).
Стадия 3: Диизопропил азодикарбоксилат (0,6 г, 3,1 ммоль) медленно добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (2,5 г, 3,1 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 2,0 ммоль) и (5-пиперидин-1-илметил-бензофуран-2-ил)-метанола (0,5 г, 2,0 ммоль) в THF (40 мл) медленно добавляли при 3-6°C. Реакционную смесь перемешивали при 3°C в течение 5 минут, затем нагревали до температуры окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (40 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (30 мл), водой (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-5-оксо-4-(1-оксо-4-((5-(пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноат (0,6 г, 56%-ый выход): 1H ЯМР (CDCl3) δ 1,42-1,46 (м, 2H), 1,53-1,60 (м, 4H), 2,12-2,45 (м, 8H), 3,55 (с, 2H), 3,62 (с, 3Н), 4,40 (д, J=17,7 Гц, 1H), 4,44 (д, J=17,7 Гц, 1H), 4,87-4,92 (дд, J=5,7 и 8,7 Гц, 1H), 5,23 (с, 2H), 5,47 (с, 1H), 6,40 (с, 1H), 6,77 (с, 1H), 7,15-7,18 (дд, J=2,1 и 6,6 Гц, 1H), 7,26-7,32 (м, 1H), 7,40-7,51 (м, 4H).
Стадия 4: Смесь 5-амино-5-оксо-4-(1-оксо-4-((5-пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноата (0,6 г, 1,1 ммоль) и K2CO3 (0,2 г, 1,1 ммоль) в DMF (10 мл) нагревали при 80°C на масляной бане в течение 3 часов. Реакционную смесь концентрировали, и остаток перемешивали с водой (10 мл) и EtOAc (10 мл). Твердое вещество собирали и ресуспендировали в ацетоне (10 мл) и гексане (10 мл), получая 3-(1-оксо-4-((5-пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 50%-ый выход): Т. пл. 202-204°C; 1H ЯМР (ДМСО-d6) δ 1,46-1,47 (м, 6H), 1,96-2,00 (м, 1H), 2,31-2,58 (м, 6H), 2,84-2,96 (м, 1H), 3,48 (с, 2H), 4,25 (д, J=17,4 Гц, 1H), 4,35 (д, J=17,4 Гц, 1H), 5,06-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,41 (с, 2H), 7,07 (с, 1H), 7,23-7,27 (дд, J=1,5 и 8,4 Гц, 1H), 7,34-7,37 (дд, J=0,9 и 6,9 Гц, 1H), 7,46-7,53 (м, 4H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,25, 23,98, 25,50, 31,16, 45,03, 51,55, 53,74, 62,55, 62,70, 107,05, 110,68, 115,13, 115,65, 121,39, 125,89, 127,42, 129,81, 129,94, 133,41, 152,72, 152,97, 153,74, 167,88, 170,93, 172,79; Вычислено для C28H29N3O5: C, 68,98; H, 6,00; N, 8,62, Найдено: С, 68,67; H, 6,03; N, 8,5.
5.21 4-(4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)ФЕНИЛ)ПИПЕРИДИН-1-ТРЕТ-БУТИЛКАРБОКСИЛАТ
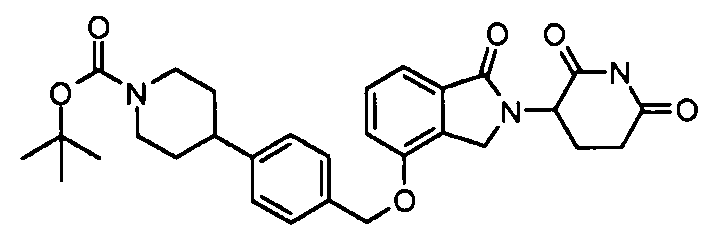
Стадия 1: BH3.THF (2,88 мл, 2,88 ммоль, 1,0 М в THF) добавляли по каплям при 0°C к раствору 4-(1-(трет-бутоксикарбонил)пиперидин-4-ил)бензойной кислоты (800 мг, 2,62 ммоль) в THF (10 мл). Через 15 минут ванну со льдом удаляли, и прозрачный раствор перемешивали в течение ночи (~17 часов). Реакционную смесь охлаждали в ванне со льдом и гасили H2O (25 мл). Добавляли EtOAc (100 мл) и смесь промывали 1н. NaHCO3 (~40 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме. Масляный остаток растворяли в дихлорметане и снова концентрировали и затем высушивали в вакуумном сушильном шкафу при 40°C, получая 4-(4-(гидроксиметил)фенил)пиперидин-1-трет-бутилкарбоксилат в форме прозрачного масла (707 мг, 93%-ый выход). Масло отверждалось при отстаивании, и его использовали на следующей стадии без дальнейшей очистки. LCMS MH=292, 218; 1H ЯМР (ХЛОРОФОРМ-d) δ 1,48 (с, 9H, tBu), 1,56-1,72 (м, 3Н, СНН, СНН, ОН), 1,75-1,89 (м, 2Н, СНН, СНН), 2,53-2,71 (м, 1Н, СН), 2,73-2,92 (м, 2Н, СНН, СНН), 4,17-4,32 (м, 2Н, СНН, СНН), 4,67 (д, J=5,9 Гц, 2Н, СН2), 7,21 (д, J=8,1 Гц, 2H, Ar), 7,32 (д, J=8,3 Гц, 2H, Ar); 13C ЯМР (ХЛОРОФОРМ-d) δ 28,50, 33,22, 42,49, 65,21, 77,22, 79,47, 127,02, 127,34, 138,96, 145,40.
Сигнал углерода карбамата не наблюдается.
Стадия 2: К раствору 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (0,7 г, 1,96 ммоль) в THF (25 мл) добавляли трифенилфосфин на полистироле (1,6 мг/ммоль, 1,845 г, 2,95 ммоль). Смоле давали набухнуть в течение нескольких минут при температуре окружающей среды, и затем реакционную смесь охлаждали в ванне со льдом при 0°C. DIAD (0,574 мл, 2,95 ммоль) добавляли по каплям при перемешивании. Приблизительно через 15 минут 4-(4-(гидроксиметил)фенил)пиперидин-1-трет-бутилкарбоксилат (0,70 г, 2,40 ммоль) добавляли в форме раствора в сухом THF (5 мл). Приблизительно через 10 минут ванну со льдом удаляли, и полученную смесь перемешивали при температуре окружающей среды в течение 48 часов. Реакционную смесь отсасывали, и смолу промывали последовательно дихлорметаном, затем MeOH (3x цикла набухания/высушивания). После финальной промывки MeOH, объединенный фильтрат концентрировали в вакууме. Масляный остаток разделяли между EtOAc (~200 мл) и Na2CO3 (насыщ. ~70 мл). Слой EtOAc промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая пену, которую сохраняли в вакуумном сушильном шкафу при 40°C в течение ночи, получая 4-(4-((2-(5-амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)пиперидин-1-трет-бутилкарбоксилат) (1,9 г, предположительный теоретический выход). Полученную пену использовали на следующей стадии без дальнейшей очистки.
Стадия 3: KOtBu (0,722 мл, 0,722 ммоль, 1,0 М в THF) добавляли по каплям к раствору 4-(4-((2-(5-амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)пиперидин-1-трет-бутилкарбоксилата (400 мг, 0,408 ммоль) в сухом THF (5 мл) при температуре окружающей среды. Дополнительное количество KOtBu (0,722 мл, 0,722 ммоль) к реакционной смеси добавляли через 2,5 часа, и перемешивание продолжали при температуре окружающей среды. Приблизительно через 20 минут смесь переносили в охлажденный 0,5н. водный раствор HCl (~50 мл). Добавляли EtOAc (250 мл) и смесь переносили на делительную воронку. Слой EtOAc промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, и остаток высушивали далее в вакуумном сушильном шкафу, получая 380 мг желто-коричневого масла. Сырой продукт растворяли в минимальном количестве DMF (~10 мл) и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, 30%-ый MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)пиперидин-1-трет-бутилкарбоксилат как твердое вещество белого цвета (84 мг, 39%-ый выход для стадии 2 и стадии 3): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 60/40 ацетонитрил/0,1% H3PO4, 4,76 мин (98,7%); Т. пл.: 214-216°C; 1H ЯМР (ДМСО-d6) δ 1,29-1,44 (м, 9H, tBu), 1,44-1,58 (м,2H, 2×CHH), 1,72 (уш.с, 2H, CHH, CHH), 1,87-2,08 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,99 (м, 5H, 5×CHH), 3,89-4,14 (м, 2H, 2×CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,4 Гц, 1H, CHH), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,20 (с, 2H, CH2), 7,18-7,37 (м, 4H, Ar), 7,37-7,55 (м, 3Н, Ar), 10,96 (с, 1H, NH); ,3C ЯМР (ДМСО-d6) δ 22,33, 28,07, 31,18, 32,66, 41,35, 43,89, 45,06, 51,55, 69,35, 78,53, 114,90, 115,16, 126,81, 127,95, 129,78, 129,92, 133,28, 134,39, 145,62, 153,48, 153,86, 167,99, 170,97, 172,84; LCMS MH=534; Вычислено для C30H35N3O6+1,5 H2O: C, 64,27; H, 6,83; N, 7,49, Найдено: С, 64,22; H, 6,72; N, 7,36.
5.22 3-(1-ОКСО-4-(4-(ПИПЕРИДИН-4-ИЛ)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
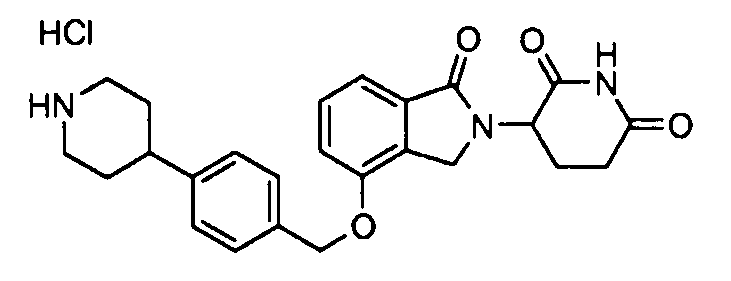
2н. HCl (10 мл, 20,00 ммоль) в Et2O добавляли к 4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)пиперидин-1-трет-бутилкарбоксилату (54 мг, 0,101 ммоль). Реакционную колбу обрабатывали ультразвуком, чтобы ослабить твердое вещество, налипшее на стенках колбы, и полученную суспензию закрывали и перемешивали при температуре окружающей среды. Приблизительно через 4 часа LCMS показала, что реакция была полной. Реакционную смесь разбавляли дополнительным количеством Et2O и затем фильтровали через воронку из спеченного стекловолокна с отсасыванием. Оставшееся твердое вещество в реакционной колбе переносили на воронку и промывали дополнительным количеством Et2O. Корку высушивали в вакуумном сушильном шкафу при 40°C, получая 3-(1-оксо-4-(4-(пиперидин-4-ил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-диона гидрохлорид в форме пушистой грязно-белой твердой гидрохлоридной соли (47 мг, 99%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 ацетонитрил/0,1% H3PO4, 3,62 мин (96,0%); Т. пл.: 280-282°C; 1H ЯМР (ДМСО-d6) 1,67-2,12 (м, 5H, 5×CHH), 2,32-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,76-3,08 (м, 4H, 4×CHH), 3,26-3,46 (м, 2H, 2×CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,22 (с, 2H, С H2O), 7,26 (д, J=8,1 Гц, 2H, Ar), 7,33 (д, J=7,7 Гц, 2H, Ar), 7,40-7,54 (м, 3Н, Ar), 8,48-9,01 (м, 2H, 2×NH), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) 22,34, 29,30, 31,18, 43,48, 45,03, 51,55, 69,28, 114,94, 115,22, 126,61, 128,08, 129,80, 129,92, 133,28, 134,86, 144,42, 153,45, 167,97, 170,96, 172,81, 1 сигнал углерода отсутствовал из-за перекрывания ДМСО-d6; LCMS MH=434; Вычислено для C25H27N3O4+2 HCl+1,7 H2O: С, 55,91; H, 6,08; N, 7,82, Найдено: С, 55,84; H, 5,82; N, 7,70.
5.23 3-{4-[4-(3-МОРФОЛИН-4-ИЛ-ПРОПИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
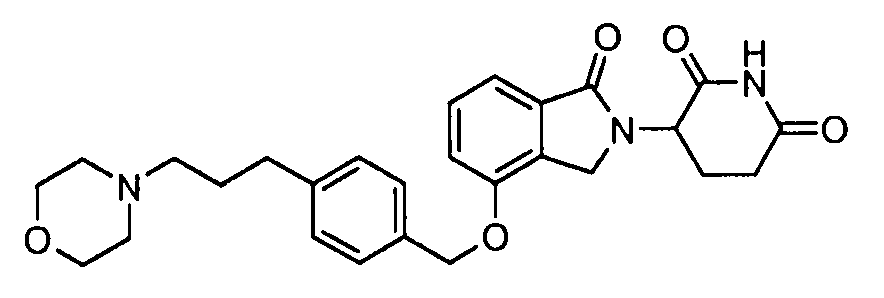
Стадия 1: (Трифенилфосфоранилиден)ацетальдегид (500 мг, 1,64 ммоль) добавляли к перемешиваемому раствору 4-формилметилбензоата (2,0 г, 12,18 ммоль) в тетрагидрофуране (50 мл). Реакционную смесь нагревали с обратным холодильником в течение двух часов, после чего к реакционной смеси добавляли (трифенилфосфоранилиден)ацетальдегид (500 мг, 1,64 ммоль). Реакционную смесь сохраняли при нагревании с обратным холодильником в течение 21 часа и затем к реакционной смеси добавляли(трифенилфосфоранилиден)ацетальдегид (3,5 г, 11,45 ммоль), и смесь сохраняли при нагревании с обратным холодильником в течение 8 часов. Реакционную смесь разбавляли EtOAc (80 мл) и затем промывали NH4Cl (насыщ. 40 мл), водой (40 мл) и солевым раствором (40 мл), соответственно. Органический слой высушивали MgSO4 и концентрировали, получая твердое вещество темного цвета. Темное твердое вещество суспендировали в простом диэтиловом эфире (50 мл) и фильтровали через целит, и твердое вещество промывали диэтиловым эфиром (50 мл×3). Фильтрат концентрировали и очищали хроматографией на силикагеле, получая метиловый эфир 4-(3-оксо-пропенил)-бензойной кислоты в форме твердого вещества грязно-белого цвета (1,04 г, 33%-ый выход); LCMS MH=191; 1H ЯМР (ДМСО-d6) δ 3,88 (с, 3Н, CH3), 6,97 (дд, J=7,6, 16,0 Гц, 1H, CH), 7,82 (д, J=16,1 Гц, 1H, CH), 7,90 (д, J=8,5 Гц, 2H, Ar), 8,02 (д, J=8,3 Гц, 2H, Ar), 9,72 (д, J=7,6 Гц, 1H, CHO).
Стадия 2: Морфолин (0,715 мл, 8,20 ммоль) добавляли к перемешиваемому раствору (E)-4-(3-оксопроп-1-енил)метилбензоата (520 мг, 2,73 ммоль). Прозрачный раствор добавляли к молекулярным ситам (2,2 г) и уксусной кислоте (0,157 мл, 2,73 ммоль). Тридцать минут спустя к вышеописанной желтой суспензии реакции добавляли натрия цианоборгидрид (258 мг, 4,10 ммоль). Реакция была полной через 15 минут при температуре окружающей среды. Реакционную смесь объединяли с другой реакционной загрузкой, начиная с (E)-4-(3-оксопроп-1-енил)метилбензоата (512 мг), добавляли воду (2 мл) и перемешивали в течение 10 минут, после чего фильтровали через целит. Фильтрат концентрировали и очищали хроматографией ISCO, получая метиловый эфир 4-(3-морфолин-4-ил-пропенил)-бензойной кислоты в форме желтой жидкости (550 мг, 39%-ый выход); LCMS MH=262.
Стадия 3: Палладий на углероде (120 мг, 0,056 ммоль) добавляли к перемешиваемому раствору (E)-4-(3-морфолинопроп-1-енил)метилбензоата (710 мг, 2,72 ммоль) в MeOH (20 мл). Реакционную колбу закупоривали и помещали под вакуум. В реакционную смесь загружали H2 (1 атм.) и перемешивали при температуре окружающей среды, и реакция была полной за 1 час. Реакционную смесь объединяли с другой реакционной загрузкой, начиная с (E)-4-(3-морфолинопроп-1-енил)метилбензоата (50 мг), и фильтровали через целит. И твердое вещество промывали MeOH (20 мл×3). Фильтрат концентрировали и очищали хроматографией ISCO, получая метиловый эфир 4-(3-морфолин-4-ил-пропил)-бензойной кислоты как прозрачное твердое вещество (690 мг, 90%-ый выход), и соединение переносили на следующую стадию без дальнейшей очистки; LCMS MH=264.
Стадия 4: раствор LiAlH4 (1,3 мл, 2,62 ммоль) в THF (2 M) по каплям при -78°C добавляли к перемешиваемому раствору 4-(3-морфолинопропил)метилбензоата (690 мг, 2,62 ммоль) в тетрагидрофуране (25 мл). Реакционную смесь перемешивали при -78°C в течение 30 минут и затем медленно давали нагреться до 0°C. Два часа спустя реакционную смесь охлаждали до -78°C, и к реакционной смеси добавляли 1,3 мл LiAlH4 (2M в THF). И холодную ванну удаляли после добавления, и реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа, и реакция была полной. К реакционной смеси добавляли NaOH (0,6 мл, 10н.) и воду (0,4 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение 20 минут, после чего ее фильтровали через целит. Твердое вещество промывали EtOAc (40 мкл×4) и концентрировали под вакуумом, получая [4-(3-морфолин-4-ил-пропил)-фенил]-метанол как прозрачное масло (600 мг, 97%-ый сырой выход), которое использовали без дальнейшей очистки; LCMS MH=236.
Стадия 5: Сцепленный с полимером PPh3 (727 мг, 2,77 ммоль, 1,6 ммоль/г) добавляли при 0°C к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (450 мг, 1,540 ммоль) в THF (17 мл). Реакционную смесь перемешивали при 0°C в течение 20 минут, после чего добавляли по каплям DIAD (0,539 мл, 2,77 ммоль). Полученную реакционную смесь перемешивали в течение 20 минут, и к смеси добавляли (4-(3-морфолинопропил)фенил)метанол (471 мг, 2,001 ммоль) в THF (3 мл). Тридцать минут спустя ванну со льдом удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов, после чего реакция прекратила развиваться. Реакционную смесь, объединенную с другой загрузкой реакции, начиная с 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (100 мг), фильтровали и промывали дихлорметаном (25 мл×6). Фильтрат концентрировали и очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-{4-[4-(3-морфолин-4-ил-пропил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме стекловидного твердого вещества (450 мг, 47%-ый выход); LCMS MH=510; 1H ЯМР (ДМСО-d6) δ 1,72 (квинт, J=7,5 Гц, 2H, CH2), 2,00-2,21 (м, 2H, CHH, CHH), 2,21-2,40 (м, 8H, CH2, CH2, CH2, CH2), 2,60 (т, J=7,6 Гц, 2H, CH2), 3,50 (с, 3H, CH3), 3,52-3,62 (м, 4H, CH2, CH2), 4,31-4,45 (м, 1H, CHH), 4,45-4,61 (м, 1H, CHH), 4,72 (дд, J=4,7, 10,2 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 7,11-7,32 (м, 5H, Ar, NH), 7,35-7,49 (м, 3H, Ar), 7,58 (с, 1H, NH).
Стадия 6: К перемешиваемому раствору 5-амино-4-(4-(4-(3-морфолинопропил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (400 мг, 0,785 ммоль) в тетрагидрофуране (18 мл) при 0°C добавляли 2-метилпропан-2-олат калия (88 мг, 0,785 ммоль). Смесь перемешивали при 0°C в течение 1,5 часов, и реакция была полной. Холодную реакционную смесь разбавляли EtOAc (30 мл), с последующим добавлением HCl (водный раствор, 1н., 1 мл), NaHCO3 (насыщ. 0,6 мл) и солевого раствора (3 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (5 мл). Органический слой объединяли с органическим слоем от другой загрузки реакционной смеси, начиная с 5-амино-4-(4-(4-(3-морфолинопропил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (50 мг). Смесь высушивали MgSO4 и концентрировали, получая твердое вещество (460 мг). Это твердое вещество растирали в простом эфире (15 мл), получая 3-{4-[4-(3-морфолин-4-ил-пропил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (165 мг, 41%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (ацетонитрил/0,1% H3PO4), 4,0 мин (97%); Т. пл.: 190-192°C; 1H ЯМР (ДМСО-d6) δ 1,71 (квинт, J=7,5 Гц, 2H, CH2), 1,91-2,04 (м, 1H, CHH), 2,21-2,36 (м, 6H, M01), 2,39-2,47 (м, 1H, CHH), 2,59 (т, J=7,6 Гц, 3H, CHH, CH2), 2,81-3,00 (м, 1H, CHH), 3,50-3,62 (м, 4H, CH2, CH2), 4,19-4,30 (м, 1H, CHH), 4,33-4,48 (м, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 7,23 (д, J=7,9 Гц, 2H, Ar), 7,32 (д, J=7,7 Гц, 2H, Ar), 7,39 (д, J=7,9 Гц, 2H, Ar), 7,43-7,55 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 27,72, 31,16, 32,53, 45,07, 51,56, 53,28, 57,52, 66,17, 69,45, 114,97, 115,16, 127,79, 128,39, 129,77, 129,93, 133,27, 133,87, 141,92, 153,49, 168,00, 170,95, 172,81; LCMS MH=478; Вычислено для C27H31N3O5+1 H2O+0,26 простой эфир: C, 65,42; H, 6,97; N, 8,16; Найдено: C, 65,41; H, 6,77; N, 8,19.
5.24 3-(1-ОКСО-4-((6-ПИПЕРИДИН-1-ИЛМЕТИЛ)БЕНЗОФУРАН-2- ИЛ)МЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
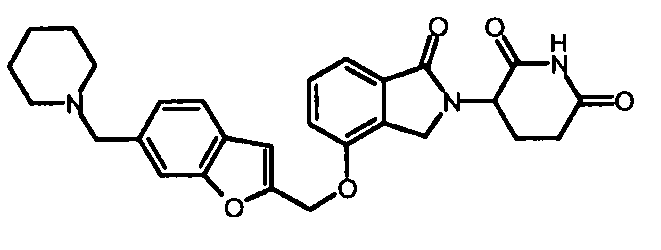
Стадия 1: Смесь 2-гидрокси-4-метилбензальдегида (4,6 г, 33,9 ммоль), 2-бромэтилацетата (5,7 г, 33,9 ммоль), K2CO3 (7,0 г, 50,9 ммоль) и молекулярного сита (4,6 г) в DMF (40 мл) нагревали при 85°C в течение 2 часов, затем при 120°C в течение 5 часов. Реакционную смесь охлаждали и разбавляли EtOAc (100 мл). Смесь фильтровали, и фильтрат промывали водой (3×50 мл) и солевым раствором (50 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:гексан=1:9), получая 6-метилбензофуран-2-этилкарбоксилат (3,1 г, 44%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,34 (т, J=7,2 Гц, 3H), 4,32-4,39 (кв, J=6,9 Гц, 2H), 7,35-7,58 (м, 2H), 7,66-7,70 (м, 2H).
Стадия 2: N-бромсукцинимид (5,6 г, 31,5 ммоль) добавляли к перемешиваемому раствору 6-метилбензофуран-2-этилкарбоксилата (3,1 г, 15,0 ммоль) в CCl4 (50 мл). Полученную смесь нагревали при 70°C на масляной бане с облучением 300-Вт лампой в течение 5 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, EtOAC:Гексан=1:9), получая 6-(бромметил)бензофуран-2-этилкарбоксилат (2,8 г, 66%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,34 (т, J=7,2 Гц, 3H), 4,38 (кв, J=7,2 Гц, 2H), 4,86 (с, 2H), 7,40-7,45 (м, 1H), 7,76-7,84 (м, 3H).
Стадия 3: Смесь пиперидина (1,0 г, 11,3 ммоль), K2CO3 (3,6 г, 26 ммоль) и 18-crown-6 (каталитическое количество) в ацетоне (10 мл) нагревали при 60°C на масляной бане. Раствор 6-(бромметил)бензофуран-2-этилкарбоксилата (2,0 г, 7,1 ммоль) в ацетоне (10 мл) добавляли по каплям и смесь перемешивали при 60°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл) и промывали водой (2×35 мл) и солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 6-(пиперидин-1-илметил)бензофуран-2-этилкарбоксилат (1,5 г, 73%-ый выход): 1H ЯМР(CDCl3) δ 1,40-1,46 (м, 5H), 1,53-1,61 (м, 4H), 2,37-2,40 (м, 4H), 3,59 (с, 2H), 4,40-4,47 (кв, J=6,9 Гц, 2H), 7,26-7,30 (м, 1H), 7,49 (д, J=0,9 Гц, 1H), 7,56-7,60 (м, 2H).
Стадия 4: Раствор 6-(пиперидин-1-илметил)бензофуран-2-этилкарбоксилата (1,5 г, 5,2 ммоль) в THF (20 мл) при 3-8°C медленно добавляли к перемешиваемому раствору LiAlH4/THF (1M, 6,7 мл, 6,7 ммоль) в THF (10 мл). После добавления смесь перемешивали при 3°C в течение 30 минут, затем гасили насыщ. Na2CO3 (50 мл). Смесь разбавляли CH2Cl2 (50 мл), и водный слой экстрагировали CH2Cl2 (3×40 мл). Объединенный раствор CH2Cl2 промывали солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая [6-(пиперидин-1-илметил)бензофуран-2-ил]метанол (0,9 г, 68%-ый выход): 1H ЯМР (CDCl3) δ 1,41-1,46 (м, 2H), 1,54-1,61 (м, 4Н), 2,39 (м, 4Н), 3,56 (с, 2Н), 4,72 (с, 2Н), 6,60 (с, 1Н), 7,14-7,17 (дд, J=1,2 и 7,8 Гц, 1H), 7,42-7,47 (м, 2H); 13C ЯМР (CDCl3) δ 24,34, 25,83, 54,42, 57,92, 63,95, 103,88, 111,95, 120,36, 124,36, 127,09, 135,02, 155,38, 156,71.
Стадия 5: Диизопропил азодикарбоксилат (0,8 г, 4,0 ммоль) добавляли при 3-6°C к перемешиваемой суспензии связки трифенилфосфин-полимер (3,4 г, 4,3 ммоль) в THF (40 мл). После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль) и [6-(пиперидин-1-илметил)бензофуран-2-ил]метанола (0,9 г, 3,5 ммоль) в THF (60 мл) медленно добавляли при 3-6°C. После перемешивания при 3°C в течение 5 минут, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (40 мл), водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-5-оксо-4-(1-оксо-4-((6-пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноат (0,9 г, 64%).
Стадия 6: Смесь 5-амино-5-оксо-4-(1-оксо-4-((6-пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)метилпентаноата (0,9 г, 1,7 ммоль) и K2CO3 (0,2 г, 1,7 ммоль) в DMF (10 мл) нагревали при 80°C на масляной бане в течение 2,5 часов. Реакционную смесь охлаждали и концентрировали. Остаток перемешивали с водой (20 мл) и EtOAc (10 мл). Твердое вещество собирали и ресуспендировали с горячим ацетоном (10 мл), получая 3-(1-оксо-4-((6-пиперидин-1-илметил)бензофуран-2-ил)метокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,19 г, 22%-ый выход): Т. пл. 216-218°C; 1H ЯМР (ДМСО-d6) δ 1,39-1,49 (м, 6H), 1,95-1,99 (м, 1H), 2,33-2,58 (м, 6H), 2,86-2,94 (м, 1H), 3,53 (с, 2H), 4,25 (д, J=15 Гц, 1H), 4,36 (д, J=18 Гц, 1H), 5,07-5,13 (дд, J=6 и 15 Гц, 1H), 5,41 (с, 2H), 7,08 (с, 1H), 7,22 (д, J=9 Гц, 1H), 7,37 (д, J=6 Гц, 1H), 7,49-7,59 (м, 4H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,28, 23,92, 25,47, 31,16, 45,04, 51,55, 53,74, 62,52, 62,70, 107,01, 111,17, 115,09, 115,63, 120,86, 124,05, 126,34, 129,80, 129,93, 133,41, 135,94, 152,41, 152,97, 154,73, 167,88, 170,92, 172,79; Вычислено для C28H29N3O5+0,8 H20: C, 67,00; H, 6,14; N, 8,37, Найдено: С, 66,96, H, 5,96, N, 8,03.
5.25 3-(4-((1-МЕТИЛ-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
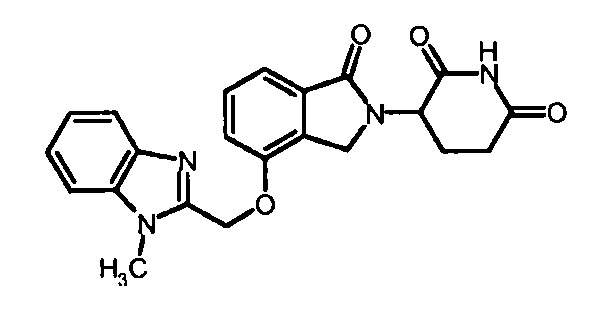
Стадия 1: Смесь N-метил-1,2-фенилендиамина (5,4 г, 44,0 ммоль) и гликолевой кислоты (5,0 г, 66,0 ммоль) в 4н. HCl (50 мл) нагревали с обратным холодильником в течение 45 минут, затем охлаждали до температуры окружающей среды. Реакционную смесь фильтровали, и фильтрат разбавляли водой (100 мл). Смесь охлаждали в ванне со льдом с энергичным перемешиванием и тщательно нейтрализовали твердым бикарбонатом натрия. Твердое вещество собирали и перекристаллизовывали из 1,4-диоксана (40 мл), получая (1-метил-1Н-бензо[d]имидазол-2-ил)метанол (5,7 г, 80%-ый выход): 1H ЯМР (ДМСО-d6) δ 3,82 (с, 3H, N-CH3), 4,70 (д, J=5,7 Гц, 2H, СН2О), 5,75 (т, J=5,7 Гц, 1H, OH), 7,14-7,26 (м, 2H, Ar), 7,50-7,57 (м, 2H, Ar); 13C ЯМР (ДМСО-d6) δ 29,75, 56,39, 109,83, 118,85, 121,28, 122,01, 136,02, 141,77, 153,90.
Стадия 2: Диизопропил азодикарбоксилат (1,0 г, 4,9 ммоль) добавляли при температуре окружающей среды к перемешиваемой суспензии 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 2,5 ммоль), (1-метил-1Н-бензо[d]имидазол-2-ил)метанола (0,6 г, 3,7 ммоль) и связки трифенилфосфин-полимер (1,6 г, 4,9 ммоль) в THF (150 мл). После добавления смесь перемешивали в течение 2 часов. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-2-(4-((1-метил-1Н-бензо[d]имидазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,7 г, 60%).
Стадия 3: Трет-бутоксид калия/THF (1M, 1,5 мл, 1,5 ммоль) добавляли к перемешиваемому раствору 5-амино-2-(4-((1-метил-1Н-бензо[d]имидазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 1,5 ммоль) в THF (30 мл) и DMF (10 мл). После добавления смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили водой (30 мл). Смесь перемешивали с метиленхлоридом (30 мл), и водный слой экстрагировали метиленхлоридом (2×35 мл). Объединенный органический раствор промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с водой (20 мл). Твердое вещество собирали и ресуспендировали с простым эфиром (10 мл), получая 3-(4-((1-метил-1Н-бензо[d]имидазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 42%) как твердое вещество белого цвета: Т. пл. 233-235°C; lH ЯМР (ДМСО-d6) δ 1,94-1,99 (м, 1H), 2,39-2,59 (м, 2H), 2,86-2,90 (м, 1H), 3,88 (с, 3H), 4,28 (д, J=17,4 Гц, 1H), 4,38 (д, J=17,4 Гц, IH), 5,06-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,57 (с, 2H), 7,22 (дт, J=1,1 и 7,3 Гц, 1H), 7,30 (дт, J=1,3 и 8,1 Гц, 1H), 7,36 (т, J=4,3 Гц, 1H), 7,53 (д, J=3,8 Гц, 2H), 7,58 (д, J=7,7 Гц, 1H), 7,65 (д, J=7,6 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,29, 30,30, 31,13, 44,99, 51,56, 62,87, 110,26, 115,17, 115,76, 119,29, 121,78, 122,74, 129,83, 129,95, 133,40, 135,98, 141,70, 149,16, 152,91, 167,84, 170,88, 172,79; Вычислено для: C22H20N4O4+0,1 H2O: C, 65,05; H, 5,01; N, 13,79, Найдено: C, 65,01; H, 5,08; N, 13,58.
5.26 ТРЕТ-БУТИЛОВЫЙ ЭФИР 4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-ПИПЕРИДИН-1-КАРБОНОВОЙ КИСЛОТЫ
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,76 г, 2,19 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,29 г, 1,01 ммоль) в THF (15 мл), с последующим добавлением диизопропилдиазен-1,2-дикарбоксилата (0,44 мл, 2,19 ммоль). После перемешивания в течение 30 минут добавляли трет-бутиловый эфир 4-гидроксиметил-пиперидин-1-карбоновой кислоты (0,43 г, 2,00 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 60 минут), получая трет-бутиловый эфир 4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты как прозрачное масло (0,27 г, 55%-ый выход).
Стадия 2: Трет-бутоксид калия (0,06 г, 0,55 ммоль) добавляли к перемешиваемому раствору трет-бутилового эфира 4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты (0,27 г, 0,55 ммоль) в THF (10 мл) при 0°C в течение 10 минут. Смесь гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8). Смесь промывали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и затем очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая трет-бутиловый эфир 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты в форме твердого вещества грязно-белого цвета (0,15 г, 60%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 50/50 за 10 мин (ацетонитрил/0,1% H3P04), 3,81 мин (96,5%); Т. пл.: 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,07-1,29 (м, 2H, CH2), 1,40 (с, 9Н, (СН3)3), 1,71-1,83 (м, 2Н, СН2), 1,87-2,06 (м, 2Н, CHH, СНН), 2,36-2,47 (м, 1Н, СНН), 2,54-2,64 (м, 1Н, СНН), 2,66-2,82 (м, 2Н, СН2), 2,83-3,01 (м, 1Н, СНН), 3,92-4,07 (м, 4Н, СН2, СН2), 4,17-4,45 (м, 2Н, Ar СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,23 (д, J=7,9 Гц, 1H, Ar), 7,30 (д, J=7,4 Гц, 1H, Ar), 7,43-7,53 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 28,09, 28,14, 31,20, 35,28, 43,1l (уш.с из-за ротамера), 44,94, 51,55, 71,97, 78,50, 114,51, 114,98, 129,74, 129,84, 133,21, 153,73, 153,89, 168,03, 170,99, 172,83; LCMS MH=358; Вычислено для C24H31N3O6+0,1 H2O: C, 62,76; H, 6,85; N, 9,15; Найдено: С, 62,75; H, 6,92; N, 8,90.
5.27 3-[1-ОКСО-4-(ПИПЕРИДИН-4-ИЛМЕТОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОНА ГИДРОХЛОРИД
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,76 г, 2,19 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,29 г, 1,01 ммоль) в THF (15 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,44 мл, 2,19 ммоль). После перемешивания в течение 30 минут добавляли трет-бутиловый эфир 4-гидроксиметил-пиперидин-1-карбоновой кислоты (0,43 г, 2,00 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 60 минут), получая трет-бутиловый эфир 4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты как прозрачное масло (0,27 г, 55%-ый выход).
Стадия 2: Трет-бутоксид калия (0,060 г, 0,55 ммоль) добавляли к перемешиваемому раствору трет-бутилового эфира 4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты (0,27 г, 0,55 ммоль) в THF (10 мл) при 0°C в течение 10 минут. Смесь гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8). Смесь промывали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и затем очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая трет-бутиловый эфир 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты в форме твердого вещества грязно-белого цвета (0,15 г, 60%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 50/50 за 10 мин (ацетонитрил/0,1% H3P04), 3,81 мин (96,5%); Т. пл.: 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,07-1,29 (м, 2H, CH2), 1,40 (с, 9Н, (СН3)3), 1,71-1,83 (м, 2Н, СН2), 1,87-2,06 (м, 2Н, СНН, СНН), 2,36-2,47 (м, 1Н, СНН), 2,54-2,64 (м, 1Н, СНН), 2,66-2,82 (м, 2Н, СН2), 2,83-3,01 (м, 1Н, СНН), 3,92-4,07 (м, 4Н, СН2, СН2), 4,17-4,45 (м, 2Н, ArCH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,23 (д, J=7,9 Гц, 1H, Ar), 7,30 (д, J=7,4 Гц, 1H, Ar), 7,43-7,53 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 28,09, 28,14, 31,20, 35,28, 43,11 (уш.с из-за ротамера), 44,94, 51,55, 71,97, 78,50, 114,51, 114,98, 129,74, 129,84, 133,21, 153,73, 153,89, 168,03, 170,99, 172,83; LCMS MH =358; Вычислено для C24H3,N3O6+0,1 H2O: C, 62,76; H, 6,85; N, 9,15; Найдено: С, 62,75; H, 6,92; N, 8,90.
Стадия 3: 2М HCl/простой эфир (20 мл) добавляли к перемешиваемому раствору трет-бутилового эфира 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-пиперидин-1-карбоновой кислоты (0,090 г, 0,196 ммоль) в дихлорметане (3 мл). Смесь перемешивали в течение трех часов и фильтровали, затем высушивали, получая 3-[1-оксо-4-(пиперидин-4-илметокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона гидрохлорид как твердое вещество белого цвета (0,076 г, 98%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 9/91 за 10 мин (ацетонитрил/0,1% H3PO4), 6,22 мин (98,0%); Т. пл.: 298-300°C; 1H ЯМР (ДМСО-d6) δ 1,43-1,66 (м, 2H, CH2), 1,83-2,20 (м, 3Н, СН2, СНН), 2,32-2,46 (м, 1Н, СНН), 2,58 (д, J=16,8 Гц, 1Н, CHH), 2,80-3,02 (м, 2H, CH2), 3,19-3,44 (м, 2H, CH2), 4,02 (д, J=6,2 Гц, 2H, OCH2), 4,16-4,48 (м, 2H, ArCH2), 5,13 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,26 (д, J=8,1 Гц, 1H, Ar), 7,32 (д, J=7,4 Гц, 1H, Ar), 7,42-7,55 (м, 1H, Ar), 8,69 (д, J=3,4 Гц, 2H, NH2Cl), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 25,00, 31,18, 33,00, 42,60, 44,91, 51,55, 71,39, 114,60, 115,13, 129,72, 129,88, 133,22, 153,60, 168,01, 171,02, 172,85; LCMS MH=358; Вычислено для C19H24N3O4Cl+1,0 H2O: C, 55,41; H, 6,36; N, 10,20; Cl, 8,61; Найдено: С, 55,72; H, 6,16; N, 9,82; Cl, 8,69.
5.28 3-[1-ОКСО-4-(ТЕТРАГИДРО-PYRAN-3-ИЛМЕТОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
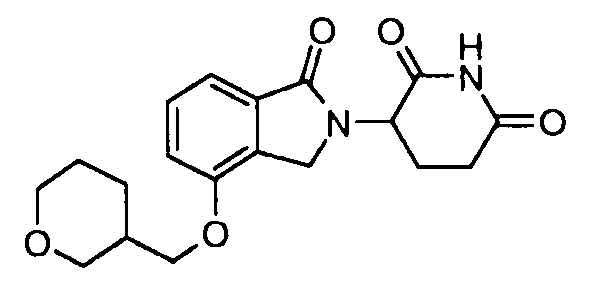
Стадия 1: Сцепленный с полимером трифенилфосфин (1,6 г, 2,06 ммоль, 1,25 ммоль/г) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (300 мг, 1,03 ммоль) в THF (10 мл). Полученную смесь перемешивали при 0°C в течение 10 минут, с последующим добавлением DIAD (412 мг, 2,06 ммоль). Пятнадцать минут спустя к смеси добавляли (тетрагидро-пиран-3-ил)-метанол (239 мг, 2,06 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 17 часов, и реакция была полной. Реакционную смесь фильтровали, и твердое вещество промывали дихлорметаном (6×20 мл). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(тетрагидро-пиран-3-илметокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как прозрачное масло (256 мг, 64%-ый выход): LCMS MH=391.
Стадия 2: KOtBu (72 мг, 0,64 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[1-оксо-4-(тетрагидро-пиран-3-илметокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (250 мг, 0,64 ммоль) в тетрагидрофуране (18 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа, и к реакционной смеси добавляли HCl (водный раствор. 0,1н., 6 мл) с последующим добавлением воды (10 мл). Смесь экстрагировали дихлорметаном (2×20 мл). Органические слои высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO и препаративной ВЭЖХ, получая 3-[1-оксо-4-(тетрагидро-пиран-3-илметокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (36 мг, 16%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70, (ацетонитрил/0,1% H3PO4): tR=4,5 (100%); Т. пл.: 118-120°C; 1H ЯМР (ДМСО-d6) δ 1,25-1,72 (м, 3Н, CH2, СНН), 1,79-1,92 (м, 1Н, СНН), 1,92-2,09 (м, 2Н, СН2), 2,36-2,48 (м, 1Н, СНН), 2,53-2,64 (м, 1Н, CHH), 2,74-3,10 (м, 1H, CHH), 3,66-3,81 (м, 1H, CHH), 3,83-4,08 (м, 3H, CH2, CHH), 4,13-4,47 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 7,23 (д, J=7,9 Гц, 1H, Ar), 7,31 (д, J=7,0 Гц, 1H, Ar), 7,43-7,53 (м, 1H, Ar), 10,97 (с, 1H, NH) *два протона перекрывали пик Ме ДМСО и это подтверждалось HMQC; 13C ЯМР (ДМСО-d6) δ 22,32, 24,59, 25,42, 31,16, 35,42, 44,90, 51,53, 67,48, 69,26, 69,44, 114,45, 115,00, 129,73, 129,81, 133,07, 153,43, 167,98, 170,99, 172,83; LCMS MH=359; Вычислено для C19H22N2O5+0,57 H2O+0,015CH2Cl2+0,04HCOOH: C, 61,56; H, 6,3; N, 7,53; Найдено: C, 61,16; H, 5,9; N, 7,35.
5.29 3-(4-((1-МЕТИЛ-1Н-ИНДАЗОЛ-3-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
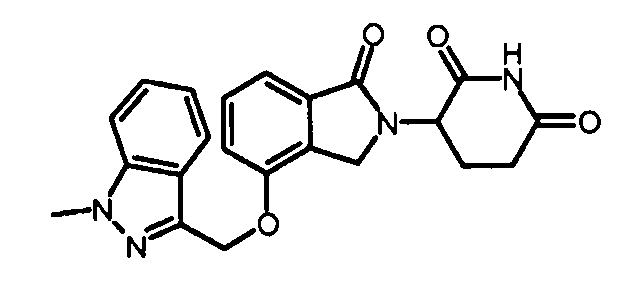
Стадия 1: Йодметан (10,9 г, 77,1 ммоль) медленно добавляли к перемешиваемой смеси 1H-индазол-3-карбоновой кислоты (5,0 г, 30,8 ммоль) и карбоната калия (12,8 г, 92,5 ммоль) в DMF (30 мл). Полученную смесь нагревали при 50°C на масляной бане в течение 4 часов. Реакционную смесь охлаждали и вливали в воду со льдом (200 мл). Смесь экстрагировали EtOAc (4×50 мл), и объединенный раствор EtOAc промывали водой (3×40 мл) и солевым раствором (40 мл) и высушивали (MgSO4). Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 2:8), получая 1-метил-1Н-индазол-3-метилкарбоксилат (3,9 г, 66%-ый выход): 1H ЯМР (ДМСО-d6) δ 3,93 (с, 3Н), 4,17 (с, 3Н), 7,33-7,38 (ддд, J=1,8, 6,9 и 8,1 Гц, 1H), 7,48-7,53 (ддд, J=1,1, 6,9 и 8,4 Гц, 1H), 7,77-7,80 (тд, J=0,8 и 8,5 Гц, 1H), 8,06-8,09 (тд, J=1,0 и 8,2 Гц, 1H); l3C ЯМР (ДМСО-d6) δ 36,26, 51,54, 110,75, 120,99, 122,75, 123,10, 126,61, 133,25, 140,64, 162,28.
Стадия 2: Раствор 1-метил-1Н-индазол-3-метилкарбоксилата (3,8 г, 20,0 ммоль) в простом эфире (100 мл) охлаждали до 5°C. Раствор LiBH4/THF (2M, 15,0 мл, 30 ммоль) медленно добавляли при 5-10°C. Смесь перемешивали при температуре окружающей среды в течение 2,5 часов и затем охлаждали в ванне со льдом и гасили водой (30 мл). Водный слой экстрагировали CH2Cl2 (50 мл), и объединенный органический раствор промывали водой (2×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 4:6), получая (1-метил-1Н-индазол-3-ил)-метанол (2,8 г, 86%-ый выход): 1H ЯМР (ДМСО-d6) δ 3,98 (с, 3Н), 4,79 (д, J=6,0 Гц, 2H), 5,24 (т, J=6,0 Гц, 1H), 7,09-7,14 (дт, J=0,9 и 6,0 Гц, 1H), 7,35-7,40 (дт, J=1,2 и 6,0 Гц, 1H), 7,54-7,58 (дт, J=9,0 и 0,6 Гц, 1H), 7,83-7,86 (дт, J=9,0 и 0,9 Гц, 1H); 13C ЯМР (ДМСО-d6) δ 34,96, 56,43, 109,39, 119,71, 120,72, 121,90, 125,91, 140,58, 144,42.
Стадия 3: Диизопропил азодикарбоксилат (1,3 г, 6,4 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 3,2 ммоль), (1-метил-1Н-индазол-3-ил)-метанола (0,8 г, 4,8 ммоль) и связки трифенилфосфин-полимер (2,1 г, 6,4 ммоль) в THF (60 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((1-метил-1Н-индазол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,5 г, 36%).
Стадия 4: Раствор трет-бутоксид калия/THF (1M, 0,9 мл, 0,9 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-((1-метил-1Н-индазол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,4 г, 0,9 ммоль) в THF (30 мл). Реакционную смесь перемешивали при 5°C в течение 5 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили насыщ. NH4Cl (10 мл). Смесь разбавляли CH2Cl2 (50 мл) и водой (20 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-((1-метил-1Н-индазол-3-илметокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,2 г, 51%-ый выход): Т. пл. 14-142°C; 1H ЯМР (ДМСО-d6) δ 1,93-1,97 (м, 1H), 2,38-2,57 (м, 2H), 2,84-2,88 (м, 1H), 4,05 (с, 3H), 4,21 (д, J=17,4 Гц, 1H), 4,31 (д, J=17,4 Гц, 1H), 5,04-5,10 (дд, J=4,8 и 13,2 Гц, 1H), 5,56 (с, 2H), 7,14-7,19 (дт, J=0,6 и 6,9 Гц, 1H), 7,31-7,34 (дд, J=3,9 и 4,8 Гц, 1H), 7,30-7,45 (дт, J=3,9 и 4,8 Гц, 1H), 7,39-7,45 (дт, J=0,9 и 6,6 Гц, 1H), 7,50-7,52 (м, 2H), 7,63 (д, J=8,7 Гц, 1H), 7,83 (д, J=7,2 Гц, 1H), 10,93 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,24, 31,15, 35,32, 45,08, 51,56, 63,13, 109,88, 115,10, 115,32, 120,06, 120,67, 122,15, 126,28, 129,78, 129,90, 133,30, 139,14, 140,58, 153,45, 167,92, 170,91, 172,77; Вычислено для C22H20N4O4: C, 65,34; H, 4,98; N, 13,85, Найдено: C, 64,96; H, 4,96; N, 13,74.
5.30 3-(4-((3-МЕТИЛБЕНЗОФУРАН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
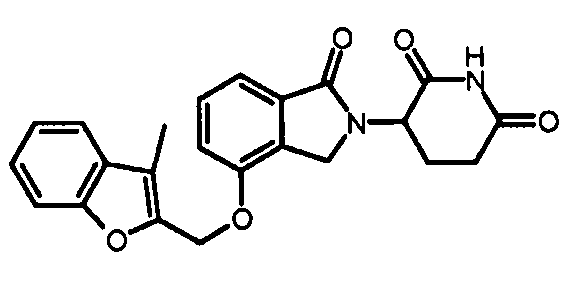
Стадия 1: Гидрид бора/THF (1M, 22,7 мл, 22,7 ммоль) медленно добавляли к перемешиваемому раствору 3-метилбензофуран-2-карбоновой кислоты (2 г, 11,4 ммоль) в THF (30 мл) при 5-7°C. После добавления смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 5 часов. Реакционную смесь охлаждали в ванне со льдом и медленно гасили водой (15 мл). Смесь разбавляли CH2Cl2 (35 мл) и водой (15 мл), и водный слой экстрагировали CH2Cl2 (2×35 мл). Объединенный раствор CH2Cl2 промывали насыщ. NaHCO3 (25 мл), водой (25 мл) и солевым раствором (25 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2), получая (3-метил-бензофуран-2-ил)-метанол (1,4 г, 78%); 1H ЯМР (ДМСО-d6) δ 2,21 (с, 3Н), 4,56 (д, J=5,7 Гц, 2H), 5,29 (т, J=5,7 Гц, 1H), 7,20-7,31 (м, 2H), 7,47-7,56 (м, 2H); 13C ЯМР (ДМСО-d6) δ 7,46, 53,83, 110,71, 111,33, 119,48, 122,20, 124,14, 129,51, 152,98, 153,27.
Стадия 2: Диизопропил азодикарбоксилат (1,3 г, 6,2 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксо-изоиндолин-2-ил)-5-оксо-метилпентаноата (0,9 г, 3,1 ммоль), (3-метил-бензофуран-2-ил)-метанола (0,8 г, 4,6 ммоль) и связки трифенилфосфин-полимер (2,1 г, 6,2 ммоль) в THF (60 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((3-метил-бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-оксометилпентаноат (1,0 г, 72%).
Стадия 3: Раствор трет-бутоксид калия/THF (1M, 2,2 мл, 2,2 ммоль) медленно добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-((3-метил-бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 2,2 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 5 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 1н. HCl (10 мл). Смесь разбавляли CH2Cl2 (50 мл) и водой (10 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-((3-метилбензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,5 г, 60%-ый выход): Т. пл. 210-212°C; 1H ЯМР (ДМСО-d6) δ 1,96-1,98 (м, 1H), 2,28 (с, 3H), 2,27-2,57 (м, 2H), 2,83-2,90 (м, 1H), 4,23 (д, J=17,4 Гц, 1H), 4,33 (д, J=17,7 Гц, 1H), 5,06-5,12 (дд, J=5,1 и 13,2 Гц, 1H), 5,40 (с, 2H), 7,25-7,37 (м, 3H), 7,45-7,48 (дд, J=0,6 и 8,1 Гц, 1H), 7,51-7,56 (дт, J=0,9 и 8,1 Гц, 2H), 7,61-7,63 (дд, J=0,9 и 7,8 Гц, 1H), 10,94 (с, 1H); 13C ЯМР (ДМСО-d6) δ 7,55, 22,25, 31,16, 45,04, 51,54, 60,93, 111,04, 115,23, 115,64, 119,98, 122,60, 125,08, 128,95, 129,81, 130,00, 133,38, 147,64, 153,17, 153,68, 167,89, 170,82, 170,91, 172,78; Вычислено для C23H20N2O5: C, 68,31; H, 4,98; N, 6,93, Найдено: C, 68,09; H, 5,00; N, 6,81.
5.31 3-(1-ОКСО-4-(ПИРИДИН-2-ИЛМЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
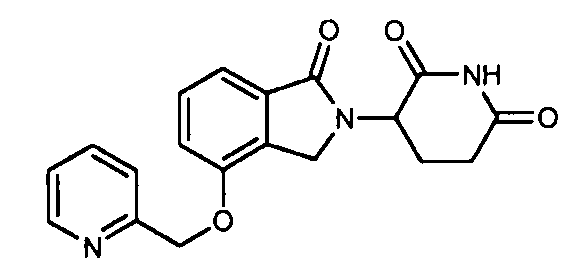
К смеси трифенилфосфина на полимерной подложке (0,63 г, 1,88 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,25 г, 0,86 ммоль) в THF (15 мл), охлажденной до 0°C, добавляли по каплям DIAD (0,37 мл, 1,88 ммоль). Затем добавляли 3-пиридилкарбинол (0,10 мл, 1,03 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа и затем при температуре окружающей среды в течение ночи. Реакционную смесь затем фильтровали через целит. Целит промывали этилацетатом (100 мл). Этилацетатную фазу промывали водой, высушивали с использованием MgSO4, и растворитель выпаривали. Остаток очищали ISCO-флэш (колонка 40 г, градиент MeOH/CH2Cl2 от 0/100 до 5/95 за 30 минут, элюируя продукт при 5/95). Растворитель выпаривали, и сырой продукт переносили на следующую стадию.
К сырому продукту, перемешиваемому в THF (10 мл) и охлажденному до 0°C, добавляли KOtBu (0,064 г, 0,57 ммоль) и реакционную смесь перемешивали в течение 1 часа и 30 минут. К реакционной смеси добавляли уксусную кислоту (5 капель). Добавляли этилацетат (100 мл), и продукт промывали насыщенным раствором бикарбоната натрия (2×100 мл) и солевым раствором (100 мл) и высушивали (MgSO4). После фильтрации осушителя, растворитель концентрировали, получая 3-(1-оксо-4-(пиридин-2-илметокси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,13 г, 43%-ый выход): ВЭЖХ: Waters XTerra RP18, 3,9×150 мм, 5 мкм,1 мл/мин, 240 нм, 25/75 ацетонитрил/0,1% HCOONH4, 3,58 мин (98,63%); Т. пл. 235-237ºC; 1H ЯМР (ДМСО-d6) δ 1,86-2,16 (м, 1H, CHH), 2,18-2,47 (м, 1H, CHH), 2,53-2,70 (м, 1H, CHH), 2,78-3,06 (м, 1H, CHH), 4,16-4,35 (м, 1H, CHH), 4,36-4,52 (м, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,31 (с, 2H, CH2), 7,36 (дд, J=4,3, 7,7 Гц, 2H, Ar), 7,41-7,69 (м, 2H, Ar), 7,93 (д, J=7,7 Гц, 1H, Ar), 8,65 (д, J=49,3 Гц, 2H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,03, 51,56, 67,25, 114,97, 115,47, 123,62, 129,83, 130,02, 132,25, 133,36, 135,69, 148,94, 149,19, 153,23, 167,93, 170,93, 172,81; LCMS MH=352; Вычислено для C19H17N3O4+0,4 H2O: C, 63,64; H, 5,00; N, 11,72; Найдено: С, 63,34; H, 5,12; N, 11,48.
5.32 3-(4-((2-МЕТИЛИЗОИНДОЛИН-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
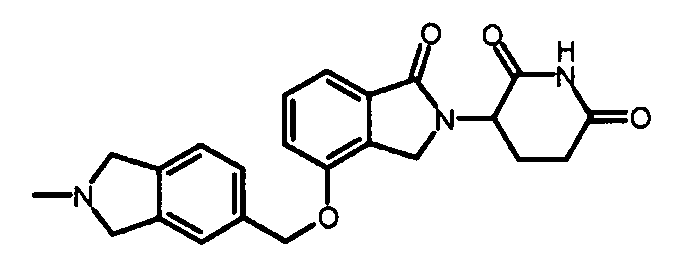
Стадия 1: Раствор LiAlH4/THF (1M, 24 мл, 24 ммоль) при 5°C медленно добавляли к перемешиваемому раствору трет-бутилового эфира 5-гидроксиметил-1,3-дигидро-изоиндол-2-карбоновой кислоты (3,0 г, 12,0 ммоль) в THF (30 мл). После добавления реакционную смесь медленно нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили водой (20 мл). Смесь разбавляли EtOAc (25 мл) и фильтровали через целит. Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл). Раствор EtOAc промывали водой (2×25 мл) и солевым раствором (25 мл) и высушивали. Растворитель удаляли, получая (2-метил-2,3-дигидро-1Н-изоиндол-5-ил)-метанол (1,2 г, 62%-ый выход): 1H ЯМР (CDCl3) δ 2,55 (с, 3Н), 3,76 (с, 2Н), 3,85 (с, 2Н), 4,10 (уш., 1Н), 4,55 (с, 2H), 6,96 (с, 1H), 7,04-7,10 (м, 2H).
Стадия 2: Диизопропил азодикарбоксилат (0,9 г, 4,6 ммоль) медленно добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,9 г, 4,9 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 3,1 ммоль) и (2-метил-2,3-дигидро-1Н-изоиндол-5-ил)-метанола (0,7 г, 4,0 ммоль) в THF (60 мл) медленно добавляли при 3-6°C. Реакционную смесь перемешивали при 3°C в течение 5 минут, затем нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл). Раствор CH2Cl2 промывали насыщ. NaHCO3 (40 мл), водой (2×30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((2-метилизоиндолин-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,5 г, 39%-ый выход): 1H ЯМР (CDCl3) δ 2,14-2,46 (м, 4H), 2,60 (с, 3Н), 3,63 (с, 3Н), 3,92 (с, 4Н), 4,34-4,48 (м, 2Н), 4,88-4,92 (дд, J=3,3 и 8,7 Гц, 1H), 5,12 (с, 2H), 5,56 (с, 1H), 6,34 (с, 1H), 7,05-7,08 (дд, J=1,5 и 6,9 Гц, 1H), 7,22-7,26 (м, 3H), 7,36-7,44 (м, 2H).
Стадия 3: Смесь 5-амино-4-(4-((2-метилизоиндолин-5-ил)метокси)-1-оксо-изоиндолин-2-ил)-5-оксометилпентаноата (0,3 г, 0,6 моль) и K2CO3 (0,09 г, 0,6 ммоль) в DMF (10 мл) нагревали при 80°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали и концентрировали, и остаток перемешивали с водой (20 мл). Твердое вещество собирали и ресуспендировали с ацетоном (10 мл), получая 3-(4-((2-метилизоиндолин-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 66%-ый выход): Т. пл. 262-264°C; 1H ЯМР (ДМСО-d6) δ 1,97-1,99 (м, 1H), 2,41-2,59 (м, 5H), 2,91 (м, 1Н), 3,80 (с, 4H), 4,27 (д, J=17,7 Гц, 1H), 4,37 (д, J=17,7 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,21 (с, 2H), 7,22-7,51 (м, 6H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,31, 31,16, 41,83, 45,08, 51,56, 60,01, 60,13, 69,65, 115,00, 115,17, 121,54, 122,02, 126,25, 129,77, 129,93, 133,28, 134,96, 140,64, 141,08, 153,46, 167,98, 170,96, 172,81; Вычислено для C23H23N3O4+0,4 H2O: С, 66,94; H, 5,81; N, 10,18, Найдено: С, 66,80; H, 5,52; N, 10,14.
5.33 3-(4-((4-(морфолинометил)ТИАЗОЛ-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
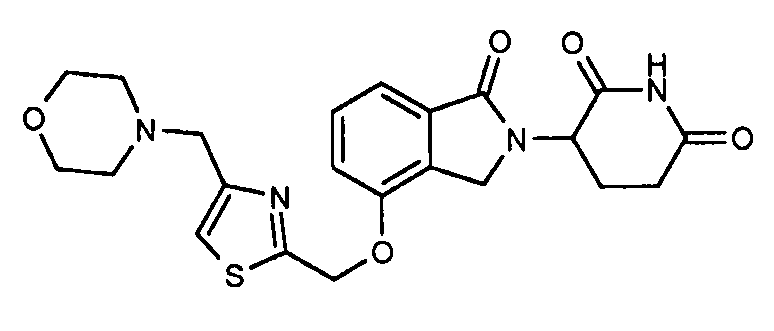
Стадия 1: Смесь 2-амино-2-тиоксоэтилацетата (2 г, 15,02 ммоль) и 1,3-дихлорпропан-2-она (2,193 г, 17,27 ммоль) в толуоле (20 мл) нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали до температуры окружающей среды, добавляли этилацетат (50 мл). Смесь промывали насыщенным водным NaHCO3 (30 мл) и солевым раствором (30 мл) и высушивали над MgSO4. Растворитель выпаривали, и продукт очищали ISCO (120 г колонка с силикагелем, градиент EtOAc/гексаны от 0% до 20% за 30 минут), получая 4-(хлорметил)тиазол-2-этилкарбоксилат как желтое масло (2,07 г, 67%-ый выход); Т. пл.: 218-220°C; 1H ЯМР (ХЛОРОФОРМ-d) 1,45 (т, J=7,2 Гц, 3H, CH3), 4,50 (кв, J=7,1 Гц, 2H, CH2), 4,78 (с, 2H, CH2), 7,64 (с, 1H, Ar).
Стадия 2: К раствору 4-(хлорметил)тиазол-2-этилкарбоксилата (1,5 г, 7,29 ммоль) в ацетонитриле (30 мл) добавляли морфолин (1,27 г, 14,59 ммоль) и триэтиламин (2,03 мл, 14,59 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли под вакуумом, остаток растворяли в этилацетате (100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×20 мл), водой (2×50 мл), солевым раствором (30 мл) и высушивали над MgSO4. Растворитель удаляли, получая 4-(морфолинометил)тиазол-2-этилкарбоксилат (1,72 г, 92%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 1,45 (т, J=7,1 Гц, 3H, CH3), 2,47-2,66 (м, 4H, CH2, CH2), 3,68-3,78 (м, 4H, CH2, CH2), 3,80 (с, 2H, CH2), 4,49 (кв, J=7,1 Гц, 2H, CH2), 7,53 (с, 1H, Ar).
Стадия 3: К раствору 4-(морфолинометил)тиазол-2-этилкарбоксилата (0,8 г, 3,12 ммоль) в THF (10 мл) медленно добавляли при 0°C раствор диизобутилалюминия гидрида (1 М в толуоле, 9,36 мл, 9,36 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли раствор соли Рочелла (1,0 М, 50 мл) и этилацетат (50 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение 2 часов. Было достигнуто четкое разделение фаз. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (3×40 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (5 мл) и солевым раствором, высушивали над MgSO4 и концентрировали, получая (4-(морфолинометил)тиазол-2-ил)метанол (600 мг, 90%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 2,44-2,63 (м, 4H, CH2, СН2), 3,64 (с, 2Н, СН2), 3,71-3,81 (м, 4Н, СН2, СН2), 4,95 (с, 2Н, СН2), 7,12 (с, 1Н, Ar).
Стадия 4: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 4,13 г, 6,61 ммоль) при 0°C добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (966 мг, 3,31 ммоль) в THF (40 мл), с последующим добавлением диизопропил азодикарбоксилата (1,34 г, 6,61 ммоль). После перемешивания в течение 10 минут добавляли (4-(морфолинометил)тиазол-2-ил)метанол (850 мг, 3,97 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали дихлорметаном и метанолом (2×50 мл каждый). Объединенные фильтраты и смывы концентрировали и очищали ISCO (80 г колонка с силикагелем, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 5-амино-4-(4-((4-(морфолинометил)тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (360 мг, 22%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,98-2,34 (м, 4H, CH2, CH2), 2,34-2,46 (м, 4H, CH2, CH2), 3,50 (с, 3H, СН3), 3,53-3,59 (м, 4H, CH2, CH2), 3,60 (с, 2H, CH2), 4,33-4,65 (м, 2H, CH2), 4,74 (д, J=5,5 Гц, 1H, CH), 5,55 (с, 2H, CH2), 7,20 (с, 1H, NHH), 7,35 (т, J=7,2 Гц, 2H, Ar), 7,44-7,57 (м, 2H, Ar), 7,61 (с, 1H, NHH).
Стадия 5: К раствору 5-амино-4-(4-((4-(морфолинометил)тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (320 мг, 0,65 ммоль) в THF (10 мл) при 0°C добавляли трет-бутоксид калия (73 мг, 0,65 ммоль). Сформированную смесь нагревали до температуры окружающей среды и перемешивали в течение 2 часов. Реакционную смесь гасили уксусной кислотой (0,5 мл). Растворитель удаляли под вакуумом. Остаток разделяли между этилацетатом (20 мл) и насыщенным водным бикарбонатом натрия (10 мл). Органическую фазу промывали солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали, и сырой продукт ресуспендировали с ацетонитрилом (4 мл), получая 3-(4-((4-(морфолинометил)тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (200 мг, 67%-ый выход); Т. пл.: 218-220°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,42 (д, J=4,5 Гц, 4H, CH2), 2,44-2,49 (м, 1H, CHH), 2,55 (уш.с, 1H, CHH), 2,82-3,08 (м, 1H, CHH), 3,57 (дд, J=5,2, 9,7 Гц, 6H, CH2, CH2, CH2), 4,18-4,55 (м, 2H, CH2), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,56 (с, 2H, CH2), 7,38 (дд, J=5,6, 7,5 Гц, 2H, Ar), 7,45-7,65 (м, 2H, Ar), 10,98 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,31, 31,18, 45,03, 51,62, 52,97, 57,52, 66,10, 66,93, 115,47, 115,99, 118,09, 129,86, 129,99, 133,46, 152,71, 152,88, 165,07, 167,81, 170,93, 172,81; LCMS MH=457; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент (CH3CN/0,1% HCOONH4) 5/95-95/5 за 5 мин, 95/5 за 10 мин: tR=3,95 (99,07%); Вычислено для C22H24N4O5S: С, 57,88; H, 5,30; N, 12,27; Найдено: С, 57,64; H, 5,36; N, 12,14.
5.34 1-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИРРОЛИДИН-2-КАРБОНОВАЯ КИСЛОТА
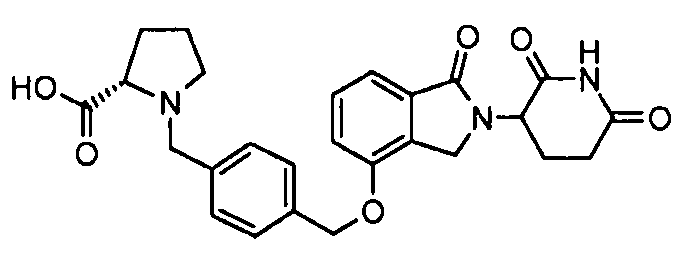
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (900 мг, 1,89 ммоль) в ацетонитриле (18 мл) добавляли (S)-трет-бутил пирролидин-2-карбоксилат (357 мг, 2,08 ммоль) и DIPEA (0,661 мл, 3,79 ммоль). Полученный желтый раствор перемешивали при температуре окружающей среды в течение ночи, и реакция была полной. Реакционную смесь концентрировали и растворяли в DCM (30 мл). Раствор промывали NaHCO3 (водный раствор, насыщ., 15 мл). Органический слой высушивали MgSO4 и концентрировали, получая сырой трет-бутиловый эфир 1-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты как светло-коричневое масло (1,23 г). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=566.
Стадия 2: К перемешиваемому раствору (2S)-трет-бутил-1-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пирролидин-2-карбоксилата (1,071 г, 1,89 ммоль) в тетрагидрофуране (18 мл) добавляли трет-бутилоксид калия (0,212 г, 1,89 ммоль) в одной части при 0°C. Раствор немедленно менял цвет на желтый. Смесь перемешивали при 0°C в течение 10 мин и при температуре окружающей среды в течение 1 часа, после чего реакционную смесь разбавляли DCM (70 мл). Смесь подкисляли HCl (1н., водным раствором, 3 мл) и затем подщелачивали NaHCO3 (водный раствор, насыщ., 3 мл). К смеси добавляли солевой раствор (15 мл) и экстрагировали. Водный слой экстрагировали DCM (25 мл). Органические слои объединяли и высушивали над MgSO4. Смесь фильтровали и концентрировали, получая твердое вещество белого цвета. Это твердое вещество белого цвета перемешивали в DCM (2 мл) и простом эфире (40 мл) в течение ночи и фильтровали, получая трет-бутиловый эфир 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты как твердое вещество белого цвета (700 мг, 69%-ый выход). Фильтрат концентрировали, получая второй выход трет-бутилового эфира 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты с небольшим количеством примесей в форме твердого вещества грязно-белого цвета (301 мг, 30%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H, CH3, CH3, CH3), 1,62-1,88 (м, 3Н, CHH, CH2), 1,91-2,10 (м, 2H, CH2), 2,29-2,48 (м, 2H, CHH, CHH), 2,52-2,64 (м, 1H, CHH), 2,75-3,00 (м, 2H, CHH, CHH), 3,06-3,21 (м, 1H, CHH), 3,45-3,59 (м, 1H, CHH), 3,89 (д, J=13,0 Гц, 1H, CHH), 4,18-4,48 (м, 2H, CHH, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,32 (д, J=7,6 Гц, 4H, Ar), 7,39-7,54 (м, 3Н, Ar), 10,97 (с, 1H, NH); LCMS MH=534.
Стадия 3: К перемешиваемому раствору (2S)-трет-бутил-1-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пирролидин-2-карбоксилата (620 мг, 1,16 ммоль) в DCM (5 мл) добавляли гидрохлорид, 2M в простом диэтиловом эфире (5,81 мл, 11,62 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней, и реакция была полной.
Реакционную смесь концентрировали, и остаток очищали хроматографией ISCO и препаративной ВЭЖХ, получая 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновую кислоту (170 мг, 31%-ый выход) в форме твердого вещества грязно-белого цвета: ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80 (CH3CN/0,1% H3PO4): tR=3,81 (96,0%); Т. пл.: 260-262°C; 1H ЯМР (ДМСО-d6) δ 1,66-1,81 (м, 1H, CHH), 1,82-2,09 (м, 3H, CHH, CHH, CHH), 2,21 (д, кв, J=8,5, 12,7 Гц, 1H, CHH), 2,36-2,50 (м, 1H, CHH), 2,57-2,69 (м, 1H, CHH), 2,80-3,02 (м, 1H, CHH), 3,24-3,38 (м, 1H, CHH), 3,47-3,56 (м, 1H, CHH), 4,04 (д, J=12,8 Гц, 1H, CHH), 4,04-4,04 (м, 1H, CHH), 4,21-4,36 (м, 2H, CHH, CHH), 4,47 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,28 (с, 2H, CH2), 7,32-7,41 (м, 2H, Ar), 7,47-7,58 (м, 5H, Ar); 13C ЯМР (ДМСО-d6) δ 22,33, 22,72, 28,52, 31,18, 45,10, 51,56, 52,81, 56,90, 65,76, 69,32, 114,99, 115,25, 127,67, 129,38, 129,80, 129,95, 133,30, 135,95, 136,03, 153,45, 167,97, 170,96, 172,35, 172,81; LCMS MH=478; Вычислено для C26H27N3O6+3H2O+0,2CH2Cl2: С, 57,37; H, 6,14; N, 7,66; Найдено: С, 57,08; H, 5,74; N, 7,36.
5.35 3-[1-ОКСО-4-(4-[1,2,3]ТРИАЗОЛ-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
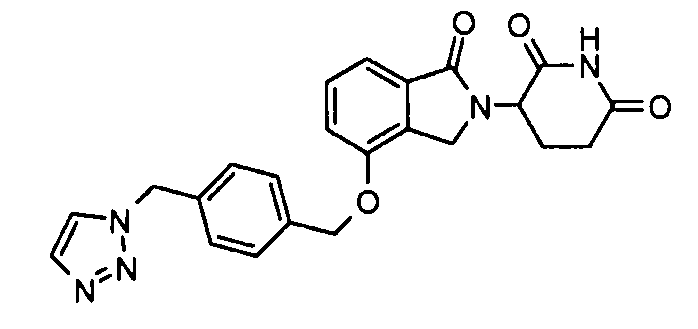
Стадия 1: К перемешиваемому раствору 1H-1,2,3-триазола (139 мг, 2,020 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (800 мг, 1,683 ммоль) и DIPEA (0,588 мл, 3,37 ммоль). Полученный прозрачный раствор перемешивали при температуре окружающей среды в течение 19 часов. К смеси добавляли DCM (50 мл). Органический слой экстрагировали NaHCO3 (насыщ. водный раствор, 5 мл) и солевым раствором (10 мл). Органический слой концентрировали для очистки ISCO, получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-[1,2,3]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как твердое вещество белого цвета (710 мг, 70%-ый выход); LCMS MH=464; 1H ЯМР (ДМСО-d6) δ 1,96-2,31 (м, 4H, CH2, СН2), 3,50 (с, 3Н, СН3), 4,39 (д, J=17,8 Гц, 1Н, CHH), 4,52 (д, J=17,6 Гц, 1H, CHH), 4,67-4,78 (м, 1H, CHH), 5,23 (с, 2H, CH2), 5,63 (с, 2H, CH2), 7,18 (с, 1H, Ar), 7,23-7,37 (м, 4H, Ar), 7,40-7,53 (м, 3H, Ar), 7,57 (с, 1H, NHH), 7,75 (д, J=0,8 Гц, 1H, Ar), 8,20 (д, J=0,8 Гц, 1H, Ar).
Стадия 2: К перемешиваемому раствору 4-(4-(4-((1H-1,2,3-триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (710 мг, 1,53 ммоль) в тетрагидрофуране (15 мл) при 0°C добавляли KOtBu (200 мг, 1,78 ммоль). Реакционную смесь перемешивали при 0°C в течение 4 часов, добавляли KOtBu (40 мг, 0,36 ммоль). Через 30 мин реакционную смесь разбавляли EtOAc (50 мл) и подкисляли HCl (1н., водный раствор, 4 мл) с последующим добавлением NaHCO3 (насыщ., водный раствор, 4 мл) и солевого раствора (15 мл). Смесь экстрагировали, и органический слой высушивали над MgSO4. Смесь фильтровали, и фильтрат концентрировали под вакуумом, получая твердое вещество белого цвета. Это твердое вещество белого цвета суспендировали в простом эфире (30 мл) и перемешивали в течение выходных. Суспензию фильтровали, получая 3-[1-оксо-4-(4-[1,2,3]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (440 мг, 67%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70, CH3CN/0,1% Н3РО4 4,84 мин (98,4%); Т. пл.: 133-135°C; 'H ЯМР (ДМСО-d6) δ 1,90-2,03 (м, 1H, M01), 2,35-2,48 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 5,63 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,43-7,53 (м, 3H, Ar), 7,75 (д, J=0,8 Гц, 1H, CH), 8,20 (д, J=0,9 Гц, 1H, CH), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,18, 45,06, 51,56, 52,26, 69,12, 114,90, 115,26, 124,94, 127,95, 128,06, 129,78, 129,93, 133,30, 133,52, 135,95, 136,51, 153,36, 167,97, 170,95, 172,81; LCMS MH=432; Вычислено для C23H21N5O4+0,7 H2O: C, 62,21; H, 5,08; N, 15,77; Найдено: С, 62,07; H, 4,88; N, 15,46,
5.36 3-[4-(4-[1,4]ОКСАЗЕПАН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
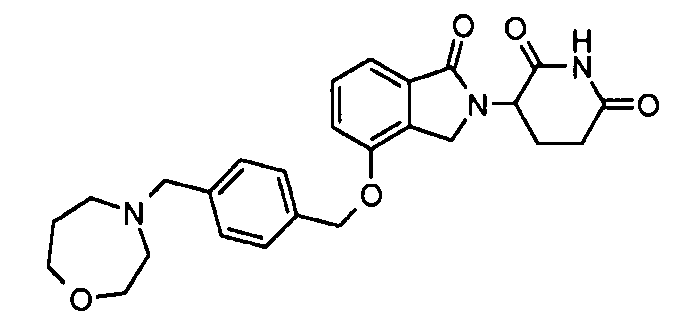
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 1,26 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли 1,4-оксазепан гидрохлорид (208 мг, 1,51 ммоль) и DIPEA (0,44 мл, 2,52 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи и разбавляли DCM (50 мл). Смесь промывали NaHCO3 (водный раствор, насыщ. 5 мл) и солевым раствором (15 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая сырой метиловый эфир 4-карбамоил-4-[4-(4-[1,4]оксазепан-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме вязкого масла (810 мг). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=496.
Стадия 2: К перемешиваемой суспензии 4-(4-(4-((1,4-оксазепан-4-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (625 мг, 1,26 ммоль) в тетрагидрофуране (10 мл) при 0°C добавляли KOtBu (142 мг, 1,26 ммоль) в одной части. Реакционную смесь перемешивали при 0°C в течение 1 часа и добавляли KOtBu (70 мг). Через 15 минут реакционную смесь разбавляли EtOAc (50 мл) и подкисляли HCl (водный раствор, 1н., 3 мл) с последующим добавлением NaHCO3 (водный раствор, насыщ., 3 мл) и солевого раствора (10 мл). Смесь экстрагировали, и органический слой высушивали MgSO4. Смесь фильтровали, и фильтрат концентрировали, получая твердое вещество белого цвета. Это твердое вещество перемешивали в простом диэтиловом эфире (20 мл) и фильтровали, получая 3-[4-(4-[1,4]оксазепан-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (484 мг, 83%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 5-95% за 10 мин, (CH3CN/0,1% H3PO4), 5,7 мин (95,9%); Т. пл.: 119-121°C; 1H ЯМР (ДМСО-d6) δ 1,72-1,88 (м, 2H, CH2), 1,92-2,04 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,53-2,69 (м, 5H, CH2, CH2, CHH), 2,83-2,99 (м, 1H, CHH), 3,54-3,65 (м, 4H, CH2, CH2), 3,69 (т, J=6,0 Гц, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,26-7,39 (м, 4H, Ar), 7,40-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 29,28, 31,18, 45,07, 51,55, 53,24, 57,10, 60,98, 67,69, 68,33, 69,38, 114,94, 115,22, 127,66, 128,73, 129,78, 129,93, 133,30, 135,24, 139,05, 153,49, 167,99, 170,96, 172,81; LCMS MH=464; Вычислено для C26H29N3O5+0,5 H2O: C, 66,09; H, 6,40; N, 8,89, Найдено: С, 65,83; H, 6,04; N, 8,60.
5.37 3-[1-ОКСО-4-(4-[1,2,3]ТРИАЗОЛ-2-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
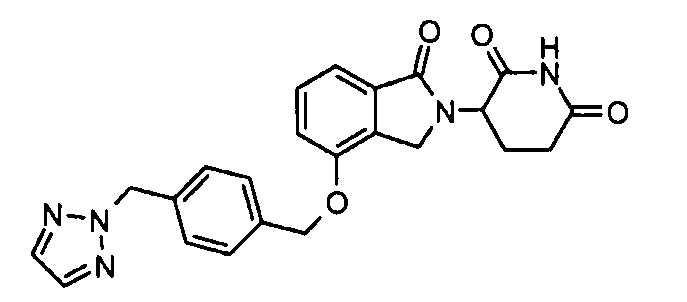
Стадия 1: К перемешиваемому раствору 1H-1,2,3-триазола (139 мг, 2,020 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (800 мг, 1,683 ммоль) и DIPEA (0,588 мл, 3,37 ммоль). Полученный прозрачный раствор перемешивали при температуре окружающей среды в течение 19 часов, и добавляли такую же реакционную смесь (масштаб 12,5%) с последующим добавлением 1H-1,2,3-триазола (60 мг, 0,87 ммоль). Объединенную реакционную смесь перемешивали при температуре окружающей среды в течение ночи и затем добавляли DCM (50 мл), NaHCO3 (насыщ. водный раствор, 5 мл) и солевой раствор (10 мл). Смесь экстрагировали, и органический слой концентрировали для очистки ISCO, получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-[1,2,3]триазол-2-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как липкое прозрачное масло (102 мг, 9%-ый выход); LCMS MH=464; 1H ЯМР (ДМСО-d6) δ 1,97-2,31 (м, 4H, СН2, СН2), 3,50 (с, 3Н, СН3), 4,39 (д, J=17,6 Гц, 1Н, CHH), 4,52 (д, J=17,8 Гц, 1H, CHH), 4,66-4,78 (м, 1H, CHH), 5,23 (с, 2H, CH2), 5,67 (с, 2H, CH2), 7,13-7,22 (м, 1H, NHH), 7,23-7,32 (м, 4H, Ar), 7,40-7,52 (м, 3H, Ar), 7,58 (с, 1H, NHH), 7,81 (с, 2H, Ar).
Стадия 2: К перемешиваемому раствору 4-(4-(4-((2H-1,2,3-триазол-2-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (100 мг, 0,216 ммоль) в тетрагидрофуране (Объем: 4 мл) при 0°C добавляли KOtBu (29,1 мг, 0,259 ммоль) в одной части. Реакционную смесь перемешивали при 0°C в течение 1 часа. К реакционной смеси добавляли KOtBu (30 мг, 0,26 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 минут и затем разбавляли EtOAc (40 мл). Полученный раствор подкисляли HCl (водный раствор, 1н., 2 мл) и затем подщелачивали NaHCO3 (водный раствор, насыщ., 2 мл), и с последующим добавлением солевого раствора (10 мл). Смесь экстрагировали, и органический слой высушивали над MgSO4. Суспензию фильтровали и концентрировали, получая твердое вещество белого цвета. Это твердое вещество белого цвета суспендировали в простом диэтиловом эфире (10 мл) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, получая 3-[1-оксо-4-(4-[1,2,3]триазол-2-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (56 мг, 32%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60, (CH3CN/0,1% H3PO4), 3,71 мин (96,8%); Т. пл.: N/A; 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,54-2,63 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 5,67 (с, 2H, CH2), 7,21-7,38 (м, 4H, Ar), 7,41-7,54 (м, 3Н, Ar), 7,81 (с, 2H, триазол), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,16, 45,04, 51,55, 57,23, 69,14, 114,90, 115,25, 127,95, 129,78, 129,94, 133,19, 134,70, 135,70, 136,39, 152,69, 167,98, 170,93, 172,80; LCMS MH=432; Вычислено для C23H21N5O4: C, 64,03; H, 4,91; N, 16,23; Найдено: N/A.
5.38 ПОЛУЧЕНИЕ 3-(4-((6-(морфолинометил)БЕНЗОФУРАН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА
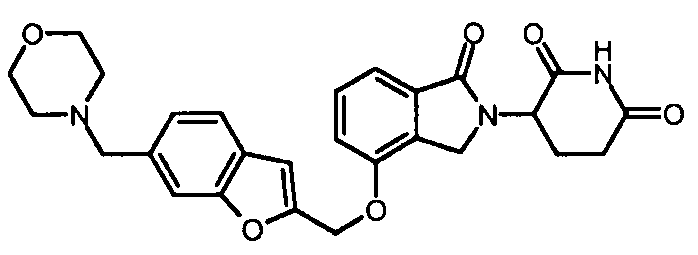
Стадия 1: Смесь 2-гидрокси-4-метилбензальдегида (4,2 г, 31,1 ммоль), карбоната калия (5,6 г, 40,5 ммоль) и молекулярного сита (4,0 г) в DMF (40 мл) нагревали до 50°C. Бромэтилацетат (5,2 г, 31,1 ммоль) медленно добавляли при 50-55°C. Реакционную смесь нагревали при 75°C в течение 20 минут, затем при 110°C в течение 1 часа. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc (100 мл). Смесь фильтровали, и твердое вещество промывали EtOAc (50 мл). Фильтрат промывали водой (3×60 мл), солевым раствором (60 мл) и высушивали. Растворитель удаляли в вакууме, и сырую смесь очищали хроматографией (SiO2, CH2Cl2), получая 6-метилбензофуран-2-этилкарбоксилат (1 г, 16%): 1H ЯМР (CDCl3) δ 1,42 (т, J=6 Гц, 3H), 2,49 (с, 3H), 4,40-4,47 (кв, J=6 Гц, 2H), 7,11-7,14 (д, J=9 Гц, 1H), 7,38 (с, 1H), 7,48 (с, 1H), 7,53-7,56 (т, J=9 Гц, 1H).
Стадия 2: смесь 6-метилбензофуран-2-этилкарбоксилата (0,9 г, 4,6 ммоль) и N-бромсукцинимида (1 г, 6,0 ммоль) в CCl4 (20 мл) нагревали при 70°C в масляной бане при облучении реакционной смеси с помощью 300-Вт лампы в течение 4 часов. Реакционную смесь охлаждали и фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали в вакууме, и сырую смесь очищали хроматографией (SiO2, 10% EtOAc/гексан), получая 6-(бромметил)бензофуран-2-этилкарбоксилат (1,3 г, 100%): 1H ЯМР (ДМСО-d6) δ 1,34 (т, J=6 Гц, 3Н), 4,34-4,41 (кв, J=6 Гц, 2H), 4,87 (с, 2H), 7,44-7,53 (м, 1H), 7,76-7,96 (м, 3H).
Стадия 3: Смесь карбоната калия (3,6 г, 26 ммоль), морфолина (1,0 г, 11,3 ммоль) и каталитического количества 18-crown-6 в ацетоне (15 мл) нагревали при 60°C в масляной бане. Медленно добавляли раствор 6-(бромметил)бензофуран-2-этилкарбоксилата (2,0 г, 7,1 ммоль) в ацетоне (15 мл) и смесь нагревали при 60°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл) и промывали водой (2×30 мл), солевым раствором (30 мл) и высушивали. Растворитель удаляли в вакууме, и остаток очищали хроматографией (SiO2, 30% EtOAc/гексан в течение 15 минут, затем 60% за 20 минут, и поддерживали в течение 15 минут), получая 6-(морфолинометил)бензофуран-2-этилкарбоксилат (1,2 г, 60%): 1H ЯМР (CDCl3) δ 1,43 (т, 6 Гц, 3H), 2,45-2,48 (м, 4H), 3,62 (с, 2H), 3,71-3,73 (м, 4H), 4,41-4,48 (кв, J=6 Гц, 2H), 7,27-7,31 (м, 1H), 7,50 (с, 1H), 7,58-7,62 (м, 2H).
Стадия 4: Раствор LiAlH4/THF (1M, 5,4 мл, 5,4 ммоль) в THF (10 мл) охлаждали в ванне со льдом до 5°C. Раствор 6-(морфолинометил)бензофуран-2-этилкарбоксилата (1,2 г, 4,2 ммоль) в THF (20 мл) добавляли по каплям при 5-10°C. Реакционную смесь перемешивали в ванне со льдом в течение 30 минут, затем тщательно гасили водой (10 мл). Смесь разбавляли насыщ. Na2CO3 (40 мл) и CH2Cl2 (50 мл), и водный слой экстрагировали CH2Cl2 (3×30 мл). Объединенный раствор CH2Cl2 промывали водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, получая (6-(морфолинометил)бензофуран-2-ил)метанол (0,9 г, 88%): 1H ЯМР (CDCl3) δ 2,40 (уш., 1H), 2,44-2,47 (м, 4H), 3,59 (с, 2H), 3,71-3,72 (м, 4H), 4,75 (с, 2H), 6,63 (с, 1H), 7,18-7,20 (м, 1H), 7,45-7,48 (м, 2H).
Стадия 5: Смесь связки трифенилфосфин-полимер (3,5 г, 4,3 ммоль) в THF (40 мл) охлаждали в ванне со льдом до 3°C. Диизопропил азодикарбоксилат (0,8 г, 4,6 ммоль) медленно добавляли при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор (6-(морфолинометил)бензофуран-2-ил)метанола (0,9 г, 3,6 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 3,1 ммоль) в THF (60 мл) добавляли при 3-8°C. После перемешивания в течение 10 минут, ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Объединенные фильтраты концентрировали, и полученный остаток растворяли в CH2Cl2 (80 мл) и промывали насыщ. NaHCO3 (40 мл), водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли в вакууме, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем 3% CH3OH/CH2Cl2 за 5 минут, и поддерживали в течение 20 минут, затем 5% за 5 мин, и поддерживали в течение 20 минут), получая 5-амино-4-(4-((6-(морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,0 г, 44%).
Стадия 6: Смесь 5-амино-4-(4-((6-(морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 1,9 ммоль) и карбоната калия (0,3 г, 1,9 ммоль) в DMF (10 мл) нагревали при 80°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc (80 мл). Смесь фильтровали, и фильтрат промывали водой (3×35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем 3% CH3OH/CH2Cl2 за 5 минут, и поддерживали в течение 15 минут, затем 5% за 5 мин, и поддерживали в течение 20 минут), получая 3-(4-((6-(морфолинометил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,24 г, 26%): Т. пл. 142-144°C; 1H ЯМР (ДМСО-d6) δ 1,95-1,99 (м, 1H), 2,35-2,59 (м, 1H), 2,84-2,96 (м, 1H), 3,33 (с, 4H), 3,56 (уш., 2H), 4,26 (д, J=17,7 Гц, 1H), 4,36 (д, J=17,4 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,42 (с, 2H), 7,09 (с, 1H), 7,23 (уш., 1H), 7,34-7,37 (дд, J=0,9 и 6,9 Гц, 1H), 7,46-7,61 (м, 4H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,29, 31,17, 45,04, 51,56, 53,05, 62,50, 66,15, 107,01, 111,38, 115,10, 115,66, 121,02, 124,22, 126,55, 129,81, 129,93, 133,43, 135,00, 152,55, 152,96, 154,67, 167,87, 170,93, 172,80; Вычислено для C27H27N3O6+0,5 H2O: C, 65,06; H, 5,66; N, 8,43, Найдено: С, 64,97; H, 5,49; N, 8,39.
5.39 3-(1-ОКСО-4-(4-(ТИОМОРФОЛИНОМЕТИЛ)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
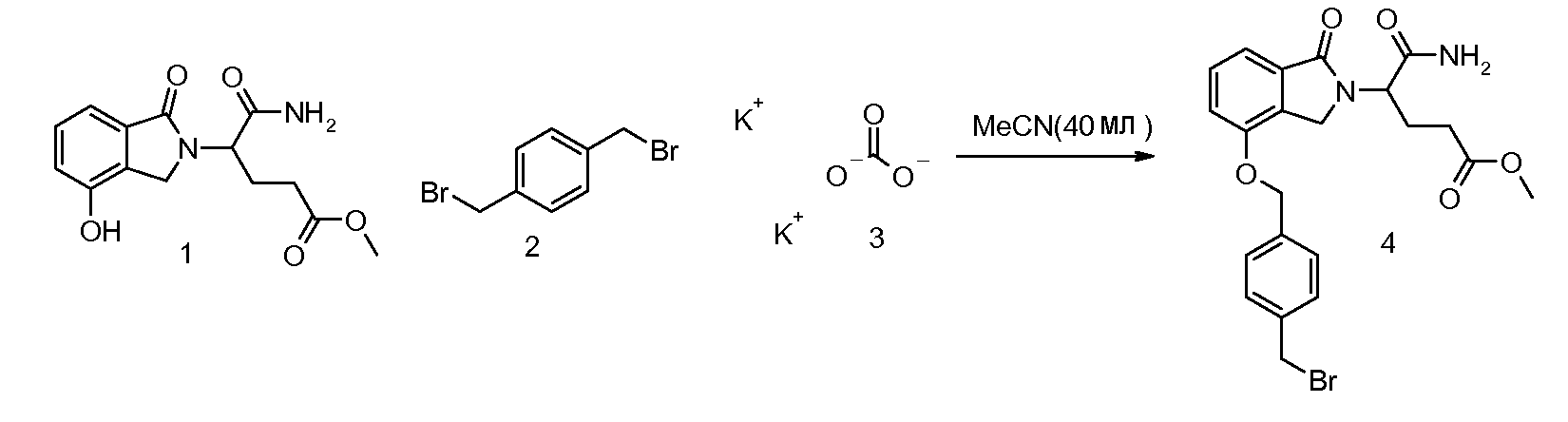
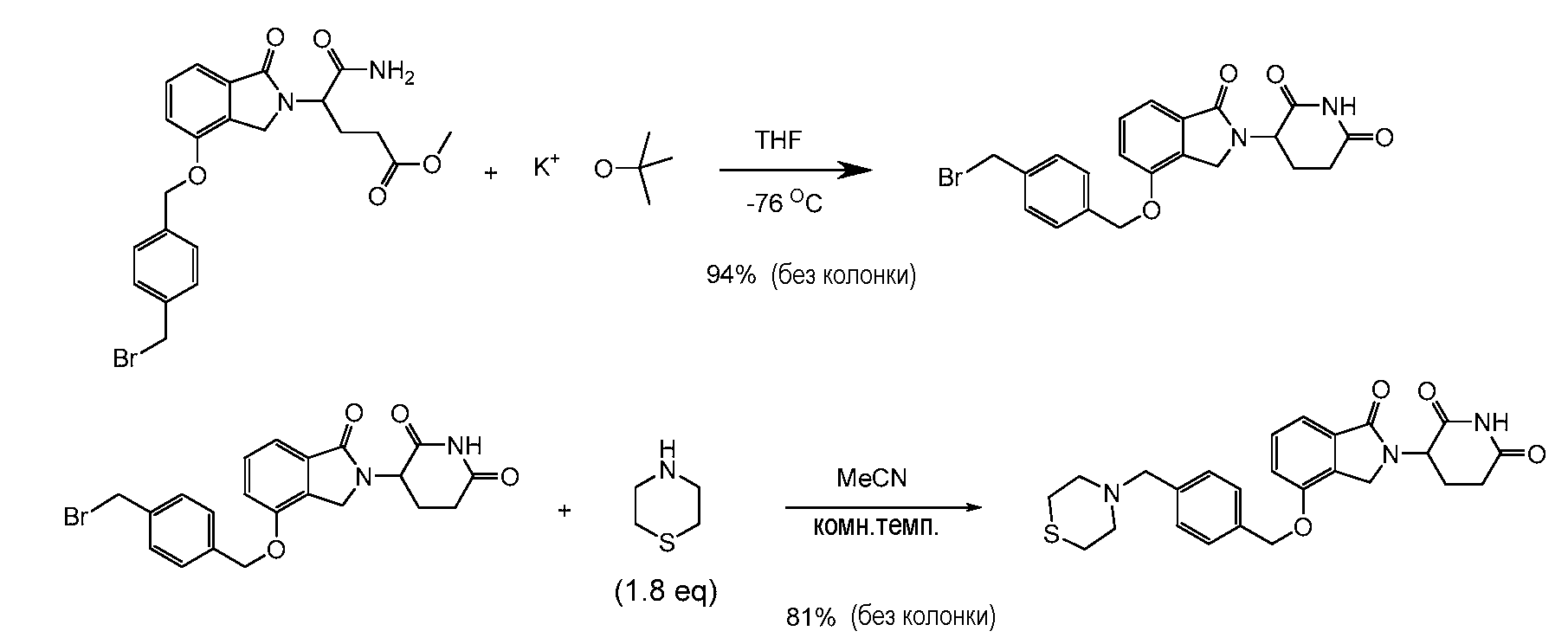
Стадия 1: 5-Амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат:
1,4-бис(Бромметил)бензол (2,71 г, 10,26 ммоль) суспендировали в сухом ацетонитриле (40 мл). Суспензию нагревали до 60°C, пока не происходило полное растворение (~15 минут). Температуру уменьшали до 50°C, и к раствору добавляли K2CO3 (0,473 г, 3,42 ммоль) в форме твердого вещества, с последующим добавлением 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1 г, 3,42 ммоль, получение описано здесь). Полученную белую суспензию перемешивали при 50°C в течение ~3 часов, после чего LCMS показала, что исходный фенол был потреблен. Сырую реакционную смесь перемешивали и отсасывали. Оставшееся твердое вещество в колбе и на воронке с фильтром промывали минимальным количеством MeCN (~5 мл). Фильтрат концентрировали в вакууме, получая 2,6 г твердого вещества белого цвета. Это твердое вещество растворяли в минимальном количестве DCM и очищали с использование колонки для флэш-хроматографии SiO2 (CombiFlash, предварительно заполненная колонка 40 г SiO2). Колонку элюировали 100%-ым DCM в течение ~15 минут, градиент до 5% MeOH в DCM за 5 минут, и затем поддерживали при 5% MeOH в DCM. Фракции объединяли и концентрировали, получая 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как твердое вещество белого цвета (1,3 г, 80%-ый выход): lH ЯМР (ДМСО-d6) δ 1,94-2,34 (м, 4H, СН2, СН2), 3,50 (с, 3Н, СН3), 4,33-4,62 (м, 2Н, СН2), 4,72 (с, 2Н, СН2), 5,25 (с, 2Н, СН2), 5,27-5,36 (м, 1Н, СН), 7,19 (уш.с, 1Н, NH), 7,23-7,36 (м, 2Н, Ar), 7,40-7,70 (м, 6Н, Ar, NH); LC/MS M+H=475, 477.
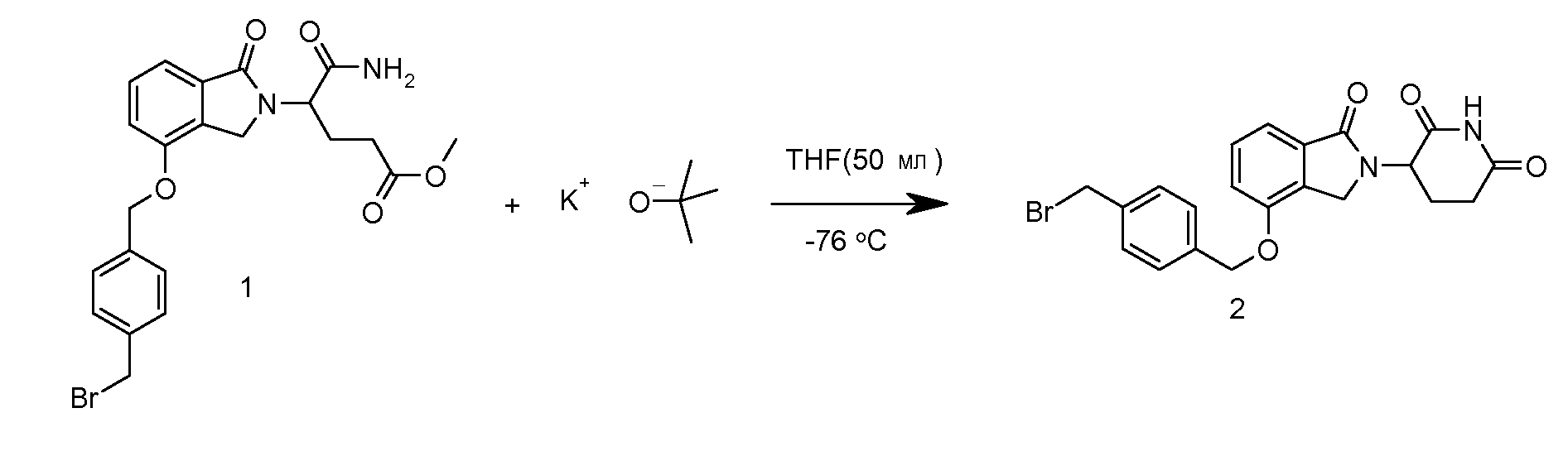
Стадия 2. 3-(4-(4-(Бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион:
5-Амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (2,05 г, 4,31 ммоль) растворяли в THF (50 мл), и раствор охлаждали в ванне сухой лед/ацетон до -76°C. Перемешивая, твердый KOtBu (0,532 г, 4,74 ммоль) добавляли к прозрачному раствору в одной части. Реакционная смесь стала светло-желтой, и ее перемешивали в течение ~90 минут при -76°C. Охлажденный водный раствор 1н. HCl (20 мл) быстро переносили в реакционную смесь, поддерживая температуру при -76°C. Смесь немедленно стала молочно-белой, и ванну CO2/ацетон удаляли, позволяя смеси нагреться при перемешивании. Смесь концентрировали на роторном испарителе, чтобы удалить большую часть THF (концентрировали до фиксированного объема при 160 мбар и на водяной бане ~35°C). После концентрации реакционной смеси осаждалось твердое вещество белого цвета. Белую суспензию разбавляли большим количеством воды (~80 мл) и затем фильтровали отсасыванием. Корку промывали обильной водой (полный объем фильтрата ~150 мл) и высушивали отсасыванием. Корку промывали Et2O (~50 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 40°C на ночь, получая 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (1,8 г, 94%-ый выход): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,70 мин (97,9%); Т.пл.: 123-125°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,32-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,78-3,04 (м, 1H, CHH), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,43 (д,J=17,6 Гц, 1H, CHH), 4,72 (с, 2H, CH2), 5,11 (дд, 5,0, 13,1 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,24-7,36 (м, 2H, Ar), 7,41-7,54 (м, 5H, Ar), 10,83-11,07 (м, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 34,15, 45,06, 51,56, 69,12, 114,94, 115,28, 127,95, 128,33, 129,41, 129,80, 131,93, 133,31, 136,78, 153,36, 167,97, 170,95, 172,81; LC/MS M+H=443, 445.
Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
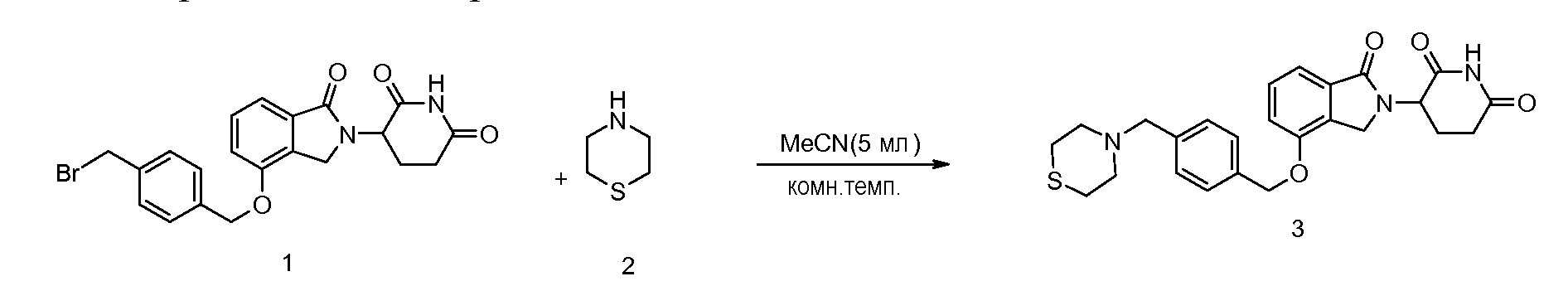
Стадия 3: 3-(1-Оксо-4-(4-(тиоморфолинометил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион:
В реакционной ампуле на 20 мл тиоморфолин (62,8 мг, 0,609 ммоль) добавляли к раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (150 мг, 0,338 ммоль) в MeCN (5 мл). Прозрачную реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь охлаждали до 0°C и гасили добавлением 1,5 мл ледяной уксусной кислоты. Образовывалась суспензия, которую разделяли между EtOAc (100 мл) и 1н. NaHCO3 (30 мл). Органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая стекловидное твердое вещество. Это твердое вещество растирали с водой и обрабатывали ультразвуком, получая свободнотекущие твердые частицы. Это твердое вещество собирали фильтрацией, высушивали отсасыванием и затем высушивали в вакуумном сушильном шкафу при 40°C, получая 3-(1-оксо-4-(4-(тиоморфолинометил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (127 мг, 81%-ый выход): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83 CH3CN/0,1% H3PO4, 5,05 мин (97,0%); Т.пл.: 134-136°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,05 (м, 1H, CHH), 2,32-2,47 (м, 1H, CHH), 2,60 (с, 9H, 4×CH2, CHH), 2,80-3,00 (м, 1H, CHH), 3,49 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=4,8, 12,9 Гц, 1H, CH), 5,22 (с, 2H, CH2), 7,01-7,38 (м, 4H, Ar), 7,38-7,65 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 27,14, 31,16, 45,06, 51,55, 54,36, 62,23, 69,38, 114,94, 115,20, 127,63, 128,84, 129,78, 129,93, 133,28, 135,22, 137,89, 153,48, 167,97, 170,95, 172,81; LC/MS M+H=466; Вычислено для C25H27N3O4S+0,25 H2O: C, 63,88; H, 5,90; N, 8,94; S, 6,82, Найдено: С, 63,85; H, 5,93; N, 8,67; S, 6,50.
5.40 3-{1-ОКСО-4-[4-(1-ОКСО-ТИОМОРФОЛИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
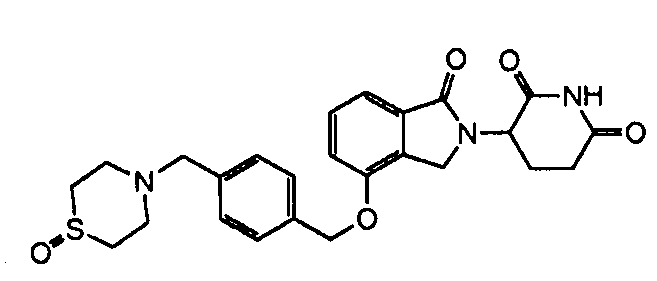
В реакционной ампуле на 20 мл N,N-диизопропилэтиламин (0,197 мл, 1,128 ммоль) добавляли к суспензии 1-оксо-тиоморфолин гидрохлорида (97 мг, 0,620 ммоль) в MeCN (5 мл). Смесь обрабатывали ультразвуком при температуре окружающей среды, чтобы разбить твердое вещество. После полного растворения 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (250 мг, 0,564 ммоль) добавляли к раствору в одной части, и полученную смесь перемешивали при температуре окружающей среды. Приблизительно через 1 час добавляли MeCN (~5 мл), чтобы улучшить перемешивание. Смесь перемешивали в течение еще 4 часов при температуре окружающей среды и затем разбавляли EtOAc (15 мл). Суспензию перемешивали в течение нескольких минут, затем фильтровали на воронке с тонкопористым фильтром с отсасыванием. Корку промывали небольшой частью EtOAc (~5 мл), высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 40°C, получая 3-{1-оксо-4-[4-(1-оксо-тиоморфолин-4-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (110 мг, 40%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 4,25 мин (98,9%); Т. пл.: 170-172°C, 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,53-2,66 (м, 3H, CH2, CHH), 2,66-2,77 (м, 2H, CH2), 2,79-3,01 (м, 5H, CH2, CH2, CHH), 3,57 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,26-7,39 (м, 4H, Ar), 7,40-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 43,56, 45,07, 45,51, 51,55, 61,15, 69,36, 114,96, 115,22, 127,67, 128,92, 129,80, 129,95, 133,28, 135,38, 137,67, 153,48, 167,97, 170,96, 172,81; LC/MS M+H=482; Вычислено для C25H27N3O5S+1,0 H2O: C, 60,10; H, 5,85; N, 8,41; S, 6,42, Найдено: С, 59,94; H, 5,52; N, 8,26; S, 6,45.
5.41 (S)-2-(3-МЕТИЛ-2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-(4-морфолинометил)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
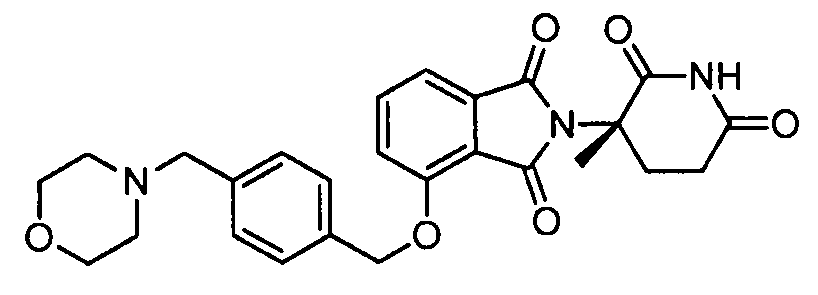
Стадия 1: В круглодонной колбе на 250 мл, 3-гидроксидиметилфталат (1 г, 4,76 ммоль) и трифенилфосфин на полистироле (1,6 ммоль/г смолы) (2,98 г, 4,76 ммоль) суспендировали в THF (40 мл) при температуре окружающей среды. Смесь охлаждали при 0°C, и DIAD (1,850 мл, 9,52 ммоль) добавляли через шприц, через 10 минут добавляли (4-(морфолинометил)фенил)метанол (0,986 г, 4,76 ммоль) в THF (10 мл), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, смолу промывали DCM и MeOH (2×50 мл, каждый), объединенные фильтраты и смывы концентрировали в вакууме до сиропа. Остаток очищали ISCO (80 г колонка, MeOH в градиенте DCM от 0-5 за 50 минут, 5% MeOH в DCM 20 минут), получая 3-(4-(морфолинометил)бензилокси)диметилфталат (770 мг, 41%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,29-2,40 (м, 4H, CH2, СН2), 3,45 (с, 2Н, СН2), 3,53-3,60 (м, 4Н, СН2, СН2), 3,79 (с, 3Н, СН3), 3,82 (с, 3Н, СН3), 5,21 (с, 2Н, СН2), 7,33 (д, J=0,9 Гц, 4Н, Ar), 7,44-7,59 (м, 3Н, Ar).
Стадия 2: К раствору 3-(4-(морфолинометил)бензилокси)диметилфталата (770 мг, 1,928 ммоль) в EtOH (20 мл, 343 ммоль) добавляли NaOH (3н., 10 мл, предварительно полученный из 12н. раствора). Смесь нагревали с обратным холодильником в течение 1 часа. Реакционную смесь упаривали досуха в вакууме. HCl (1н.) к остатку добавляли и устанавливали рН 3, и осадок собирали фильтрацией, получая 3-(4-(морфолинометил)бензилокси)фталевую кислоту как твердое вещество белого цвета (350 мг, 49%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,27-2,43 (м, 4H, СН2, СН2), 3,49 (с, 2Н, СН2), 3,53-3,65 (м, 4Н, СН2, СН2), 5,17 (с, 2Н, СН2), 7,16-7,63 (м, 7Н, Ar).
Стадия 3: Смесь 3-(4-(морфолинометил)бензилокси)фталевой кислоты (300 мг, 0,808 ммоль) и (S)-3-амино-3-метилпиперидин-2,6-дион гидробромида (198 мг, 0,889 ммоль) в пиридине (20 мл) нагревали с обратным холодильником в течение 2 дней и охлаждали до температуры окружающей среды. Пиридин удаляли при пониженном давлении, остаток разделяли между EtOAc (50 мл) и бикарбонатом натрия (10 мл), органический слой отделяли и промывали водой (2×10 мл), солевым раствором (10 мл) и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении, остаток очищали ISCO (12 г колонка, MeOH в градиенте DCM от 0-3% за 25 минут), получая (S)-2-(3-метил-2,6-диоксопиперидин-3-ил)-4-(4-(морфолинометил)бензилокси)изоиндолин-1,3-дион (100 мг, 26%-ый выход). Т. пл.: 178-180°C; 1H ЯМР (ДМСО-d6) δ 1,88 (с, 3Н, CH3), 1,98-2,12 (м, 1Н, СНН), 2,29-2,42 (м, 4H, CH2, СН2), 2,52-2,83 (м, 3Н, СНН, СНН, СНН), 3,47 (с, 2Н, СН2), 3,53-3,66 (м, 4Н, СН2, СН2), 5,31 (с, 2Н, СН2), 7,29-7,51 (м, 5Н, Ar), 7,57 (д, J=8,5 Гц, 1H, Ar), 7,80 (дд, J=7,4, 8,5 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,96, 28,55, 29,03, 53,11, 58,53, 62,06, 66,13, 69,93, 115,09, 116,14, 119,86, 127,35, 129,01, 133,24, 134,74, 136,83, 137,69, 155,33, 166,06, 167,42, 172,10, 172,27; MH=478; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент (CH3CN/0,1% HCOONH4) 5/95-95/5 за 5 мин, 95/5 10 мин: tR=3,72 (100%); Вычислено для C26H27N3O6: С, 65,40; H, 5,70; N, 8,80; Найдено: С 65,28; H 5,67; N 8,60.
5.42 3-[1-ОКСО-4-(4-[1,2,4]ТРИАЗОЛ-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
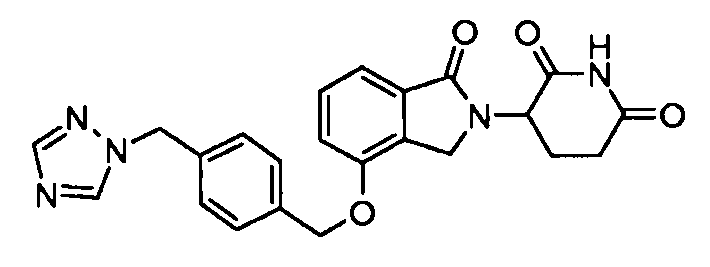
Стадия 1: Получение метилового эфира 4-карбамоил-4-[1-оксо-4-(4-[1,2,4]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,804 г, 1,691 ммоль) в ацетонитриле (20 мл) при температуре окружающей среды добавляли 1H-1,2,4-триазол (0,350 г, 5,07 ммоль) и N-этил-N-изопропилпропан-2-амин (0,839 мл, 5,07 ммоль). Смесь перемешивали при температуре окружающей среды в течение двух дней и затем разбавляли метиленхлоридом (50 мл) и промывали насыщенным раствором бикарбоната натрия (10 мл) и солевым раствором (10 мл). Органический слой концентрировали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-[1,2,4]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (0,53 г, 67%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,96-2,36 (м, 4H, CHH, CHH, CHH, CHH), 3,50 (с, 3H, CH3), 4,32-4,58 (м, 2H, CH2), 4,72 (дд, J=4,9, 10,4 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 5,37-5,50 (м, 2H, CH2), 7,13-7,21 (м, 1H, NHH), 7,24-7,36 (м, 4H, Ar), 7,40-7,53 (м, 3H, Ar), 7,57 (уш.с, 1H, NHH), 7,98 (с, 1H, Ar), 8,66 (с, 1H, Ar).
Это соединение использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-[1-оксо-4-(4-[1,2,4]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона
К перемешиваемому раствору 4-(4-(4-((1H-1,2,4-триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (0,49 г, 1,057 ммоль) в THF (20 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,119 г, 1,057 ммоль). После перемешивания в течение 10 минут добавляли 1н. HCl (2 мл), нейтрализовали насыщенным раствором бикарбоната натрия (3 мл) и перемешивали с этилацетатом (50 мл). Органическую фазу отделяли, промывали солевым раствором (10 мл) и упаривали до твердого вещества белого цвета, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 4% за 40 минут), получая 3-[1-оксо-4-(4-[1,2,4]триазол-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,177 г, 39%-ый выход); Т. пл.: 233-235°C; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 5,43 мин (96,4%); 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,82-2,99 (м, 1H, CHH), 4,17-4,48 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 5,43 (с, 2H, CH2), 7,25-7,37 (м, 4H, Ar), 7,42-7,55 (м, 3Н, Ar), 7,98 (с, 1H, Ar), 8,67 (с, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,20, 45,08, 51,58, 51,78, 69,19, 114,95, 115,27, 128,02, 129,81, 129,97, 133,32, 136,09, 136,35, 144,23, 151,72, 153,40, 167,99, 170,96, 172,82; LC/MS (M+l)+=432; Вычислено для C23H21N5O4+0,2 H2O: С, 63,50; H, 4,96; N, 16,10, Найдено: С, 63,11; H, 4,89; N, 16,00.
5.43 1-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИРРОЛИДИН-2-КАРБОНОВАЯ КИСЛОТА
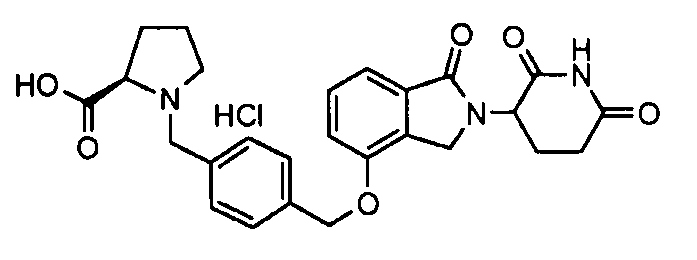
Стадия 1: Трет-бутиловый эфир 1-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты
К перемешиваемой смеси 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (798 мг, 1,679 ммоль) и (R)-трет-бутил-пирролидин-2-карбоксилата гидрохлорида (418 мг, 2,015 ммоль) в ацетонитриле (12 мл) при температуре окружающей среды добавляли DIPEA (0,586 мл, 3,36 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 19 часов, после чего разбавляли DCM (50 мл). Раствор промывали NaHCO3 (насыщ. водный раствор, 5 мл) и солевым раствором (15 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO, получая трет-бутиловый эфир 1-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты как прозрачное масло (840 мг, 88%-ый выход), которое использовали на следующей стадии без дальнейшей очистки; LCMS MH=566; 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H, СН3, СН3), 1,64-1,86 (м, 3Н, СН, СН2), 1,93-2,12 (м, 2Н, СН2), 2,13-2,22 (м, 1Н, СНН), 2,22-2,30 (м, 2Н, СН2), 2,36 (кв, J=7,7 Гц, 1Н, CHH), 2,77-2,92 (м, 1H, CHH), 3,13 (дд, J=5,0, 8,8 Гц, 1H, CHH), 3,44-3,59 (м, 4H, CHH, CH3), 3,88 (д, J=13,2 Гц, 1H, CHH), 4,39 (д, J=17,8 Гц, 1H, CHH), 4,53 (д, J=17,6 Гц, 1H, CHH), 4,72 (дд, J=4,7, 10,2 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 7,18 (с, 1H, NHH), 7,24-7,37 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 7,58 (с, 1H, NHH).
Трет-бутиловый эфир 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты
К перемешиваемому раствору (2R)-трет-бутил 1-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пирролидин-2-карбоксилата (840 мг, 1,485 ммоль) в тетрагидрофуране (13 мл) при 0°C добавляли KOtBu (167 мг, 1,485 ммоль). Реакционную смесь перемешивали при 0°C в течение 20 минут, после чего разбавляли EtOAc (50 мл). Смесь подкисляли HCl (1н. водным раствором, 3 мл) с последующим добавлением NaHCO3 (водный раствор, насыщ., 3 мл) и солевого раствора (15 мл). Смесь экстрагировали, и органический слой промывали NaCl (10 мл солевого раствора + 10 мл воды). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая трет-бутиловый эфир 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновой кислоты как клейкое прозрачное масло (810 мг, 102%-ый сырой выход), которое использовали на следующей стадии без дальнейшей очистки; LCMS MH=534.
Стадия 3: 1-{4-[2-(2,6-Диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновая кислота
К раствору (2R)-трет-бутил-1-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пирролидин-2-карбоксилата (0,795 г, 1,489 ммоль) в DCM (Объем: 5 мл) добавляли HCl, 2M в простом диэтиловом эфире (11,17 мл, 22,34 ммоль) при температуре окружающей среды в течение 4 дней, и реакционную смесь концентрировали в вакууме и затем добавляли свежую 2M HCl (простой эфир, 15 мл). Суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали в вакууме, и остаток перемешивали в ацетонитриле (15 мл) в течение 4 часов. Смесь фильтровали, получая 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пирролидин-2-карбоновую кислоту в форме твердого вещества грязно-белого цвета (420 мг, выход 57,5%); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 18/82, (CH3CN/0,1% H3PO4), 4,84 мин (96,67%); Т. пл.: 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,75-2,06 (м, 4H, CHH, CHH, CH2), 2,45 (д, J=13,4 Гц, 2H, CHH, CHH), 2,54-2,65 (м, 1H, CHH), 2,83-3,02 (м, 1H, CHH), 3,11-3,27 (м, 1H, CHH), 3,32-3,46 (м, 1H, CHH), 4,18-4,34 (м, 3H, CHH, CHH, CHH), 4,39-4,52 (м, 2H, CHH, CHH), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,29 (с, 2H, CH2), 7,33 (дд, J=4,9, 7,7 Гц, 2H, Ar), 7,45-7,53 (м, 1H, Ar), 7,56 (с, 4H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 22,36, 27,90, 31,18, 45,06, 51,58, 54,00, 56,96, 65,32, 69,01, 115,00, 115,36, 127,79, 129,81, 129,95, 130,78, 130,95, 133,34, 137,83, 153,33, 167,94, 169,95, 170,96, 172,83; LCMS MH=478; Вычислено для C26H27N3O6·0,95HCl+1,2 H2O: C, 58,51; H, 5,73; N, 7,87; Cl, 6,31; Найдено: С, 58,57; H, 5,46; N,7,89; Cl, 6,14.
5.44 3-[1-ОКСО-4-(4-[1,2,4]ТРИАЗОЛ-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
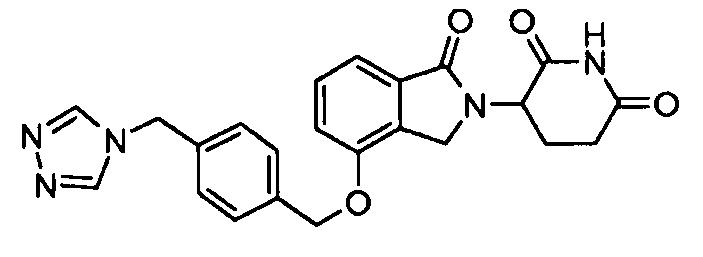
Стадия 1: Получение метилового эфира 4-карбамоил-4-[1-оксо-4-(4-[1,2,4]триазол-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,804 г, 1,691 ммоль) в ацетонитриле (20 мл) при температуре окружающей среды добавляли 1H-1,2,4-триазол (0,350 г, 5,07 ммоль) и N-этил-N-изопропилпропан-2-амин (0,839 мл, 5,07 ммоль). Смесь перемешивали при температуре окружающей среды в течение двух дней и затем разбавляли метиленхлоридом (50 мл) и промывали насыщенным раствором бикарбоната натрия (10 мл) и солевым раствором (10 мл). Органический слой концентрировали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-[1,2,4]триазол-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (0,25 г, 32%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,98-2,33 (м, 4H, CHH, CHH, CHH, CHH), 3,50 (с, 3H, CH3), 4,34-4,58 (м, 2H, CH2), 4,72 (дд, J=4,9, 10,4 Гц, 1H, NCH), 5,26 (д, J=17,9 Гц, 4H, CH2, CH2), 7,18 (уш.с, 1H, NHH), 7,22-7,38 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 7,58 (уш.с, 1H, NHH), 8,62 (с, 2H, Ar).
Это соединение использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-[1-оксо-4-(4-[1,2,4]триазол-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона
К перемешиваемому раствору 4-(4-(4-((4H-1,2,4-триазол-4-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (0,23 г, 0,496 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,134 г, 1,19 ммоль). Смесь перемешивали в течение 10 минут и добавляли 1н. HCl (2 мл до pH=2), затем нейтрализовали насыщенным раствором бикарбоната натрия (3 мл до pH=7). К смеси добавляли этилацетат (40 мл) и перемешивали в течение пяти минут. Органическую фазу отделяли, промывали солевым раствором (10 мл) и упаривали, получая твердое вещество белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2 от 0% до 10% за 30 минут), получая 3-[1-оксо-4-(4-[1,2,4]триазол-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (58 мг, 27%-ый выход); Т.пл. 173-175°C; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 5,05 мин (95,2%); 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 4,18-4,46 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 5,29 (с, 2H, CH2), 7,26-7,38 (м, 4H, Ar), 7,43-7,54 (м, 3Н, Ar), 8,62 (с, 2H, 2NH), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,20, 45,08, 47,26, 51,59, 69,13, 114,97, 115,29, 127,81, 128,18, 129,81, 129,97, 133,32, 136,53, 143,22, 153,37, 167,98, 170,96, 172,83, LC/MS (M+l)+=432; Вычислено для C23H21N5O4: C, 64,03; H, 4,91; N, 16,23, Найдено: С, 61,85; H, 5,06; N, 14,92.
5.45 3-(4-((4-((2-МЕТИЛ-1Н-ИМИДАЗОЛ-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
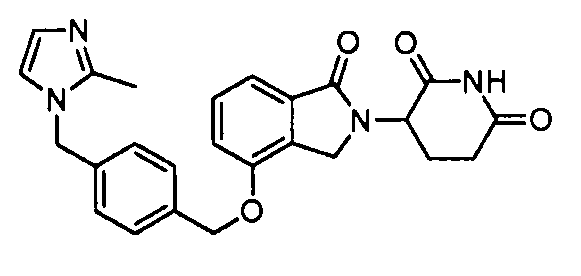
К суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,5 г, 1,128 ммоль) и 2-метил-1Н-имидазола (0,108 г, 1,315 ммоль) в ацетонитриле (5 мл) при температуре окружающей среды добавляли DIEA (0,22 мл, 1,260 ммоль). Суспензию перемешивали при температуре окружающей среды в течение ночи. К суспензии добавляли воду (15 мл). Суспензию перемешивали при температуре окружающей среды в течение 15 мин Суспензию фильтровали и промывали водой (3×10 мл), получая твердое вещество. Это твердое вещество очищали препаративной ВЭЖХ (Xbridge C18, 10 мкм, 50×250 мм, 143 мл/мин, 240 нм, 2/98/2 мин, градиент до 95/5 0,1% муравьиной кислоты в CH3CN/0,1% муравьиной кислоты в H2O за 13 минут), и желаемые фракции собирали. Растворитель удаляли в вакууме, получая масло. К маслу добавляли EtOAc (20 мл), получая твердое вещество, и суспензию перемешивали при температуре окружающей среды в течение 30 мин Суспензию фильтровали и промывали EtOAc (10 мл) и эфиром (10 мл), получая 3-(4-((4-((2-метил-1Н-имидазол-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (43 мг, выход 8,6%): ВЭЖХ: (Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4): RT=3,18 мин (99,4%); Т. пл.: 275-277°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,07 (м, 1H, CHH), 2,22 (с, 3H, CH3), 2,33-2,49 (м, 1H, CHH), 2,52-2,63 (м, 1H, CHH), 2,79-3,03 (м, 1H, CHH), 4,16-4,30 (м, 1H, CHH), 4,33-4,46 (м, 1H, CHH), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,15 (с, 2H, CH2), 5,22 (с, 2H, CH2), 6,76 (уш.с, 1H, Ar), 7,08-7,20 (м, 3Н, Ar), 7,26-7,36 (м, 2H, Ar), 7,43-7,52 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 12,70, 22,31, 31,16, 45,04, 48,31, 51,53, 69,16, 114,93, 115,25, 120,23, 126,46, 127,04, 128,06, 129,78, 129,95, 133,28, 135,88, 137,34, 153,39, 167,97, 170,95, 172,81; LCMS: MH=445; Вычислено для C25H24N4O4+0,3 H2O: C, 66,74; H, 5,51; N, 12,45; Найдено: С, 66,69; H, 5,24; N, 12,23.
5.46 3-{4-[4-(2,3-ДИГИДРО-INDOL-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
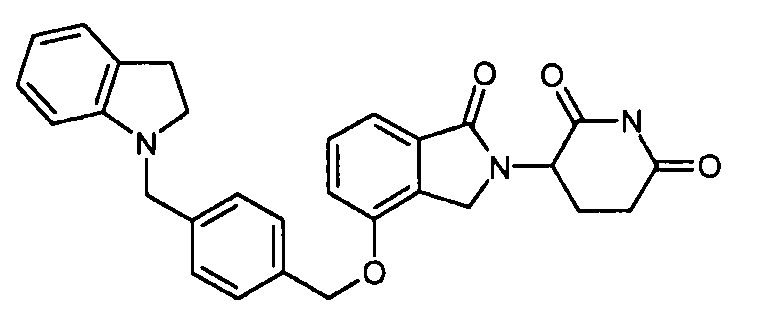
Стадия 1: Получение метилового эфира 4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
В круглодонную колбу на 1000 мл загружали 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (9,76 г, 33,4 ммоль), 1,4-бис(бромметил)бензол (26,4 г, 100 ммоль) и карбонат калия (4,61 г, 33,4 ммоль), добавляли 500 мл CH3CN. Смесь перемешивали при 50°C в течение пяти часов и фильтровали, промывали CH3CN (20 мл). Фильтрат упаривали, получая твердое вещество белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая метиловый эфир 4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты как твердое вещество белого цвета (13,4 г, 84%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,97-2,13 (м, 1H, CHH), 2,13-2,35 (м, 3H, CH2, CHH), 3,50 (с, 3H, CH2), 4,32-4,63 (м, 2H CH2), 4,65-4,84 (м, 3Н, CH2, NCH), 5,25 (с, 2H, CH2), 7,19 (с, 1Н, NHH), 7,23-7,36 (м, 2H, Ar), 7,38-7,52 (м, 5H, Ar), 7,58 (уш.с, 1H, NHH).
Стадия 2: Получение метилового эфира 4-карбамоил-4-{4-[4-(2,3-дигидро-индол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,052 ммоль) в CH3CN добавляли индолин (0,142 мл, 1,262 ммоль) и DIPEA (0,220 мл, 1,262 ммоль). Смесь перемешивали в течение ночи. Смесь концентрировали и экстрагировали водой (15 мл) и EtOAc (20 мл). Органический слой промывали NaHCO3 (насыщ. 15 мл), солевым раствором (15 мл) и концентрировали на роторном испарителе, получая метиловый эфир 4-карбамоил-4-{4-[4-(2,3-дигидро-индол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества (0,5 г, 93%). Это твердое вещество использовали непосредственно на следующей стадии.
Стадия 3: Получение 3-{4-[4-(1,3-дигидро-изоиндол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К раствору 5-амино-4-(4-(4-(индолин-1-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 0,974 ммоль) в THF при 0°C добавляли KOtBu (0,131 г, 1,168 ммоль). После перемешивания при 0°C в течение 15 мин к смеси добавляли 2 мл 1н. HCl, затем 10 мл насыщ. NaHCO3 и 25 мл EtOAc. Смесь разделяли, и органический слой промывали водой (10 мл), солевым раствором (10 мл) и концентрировали. Полученное твердое вещество белого цвета очищали на колонке с силикагелем, элюируя DCM и MeOH, получая 3-{4-[4-(1,3-дигидро-изоиндол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (200 мг, 43%). Температура плавления: 173-175°C. LCMS m/e=482. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 7,58 мин (93%). 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,33-2,47 (м, 1H, CHH), 2,56-2,65 (м, 1H, CHH), 2,79-3,02 (м, 4H, CH2, CHH), 3,13-3,30 (м, 2H, CH2), 3,32 (с, 3H, CH2), 4,10-4,59 (м, 4H, CH2, CH2), 4,99-5,18 (м, 1H, NCH), 5,23 (с, 2H, CH2), 6,49-6,65 (м, 2H, Ar), 6,82-7,16 (м, 2H, Ar), 7,25-7,43 (м, 4H, Ar), 7,42-7,62 (м, 3H, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,35, 27,92, 31,20, 45,09, 51,58, 52,15, 52,76, 69,39, 106,89, 114,98, 115,24, 117,20, 124,24, 127,04, 127,85, 128,07, 129,47, 129,81, 129,97, 133,31, 135,30, 138,16, 152,16, 153,48, 168,01, 170,96, 172,83. Вычислено для C27H29N3O4: C%: 72,33, H%: 5,65, N%: 8,73. Найдено: C%: 72,14, H%: 5,51, N%: 8,47.
5.47 3-(4-((3-(морфолинометил)-1,2,4-ОКСАДИАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
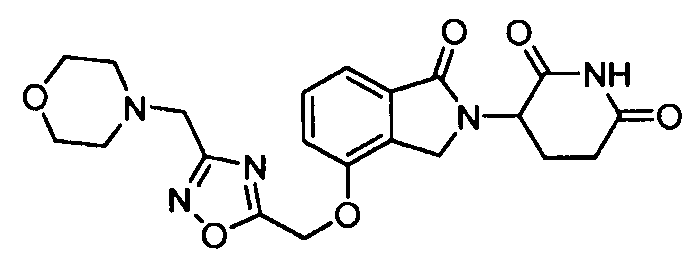
Стадия 1: Боргидрид натрия (179 мг, 4,72 ммоль) добавляли к раствору 3-(хлорметил)-1,2,4-оксадиазол-5-этилкарбоксилата (900 мг, 4,72 ммоль) в этаноле (10 мл) при 0°C. Смесь перемешивали при 0°C в течение 1 часа и затем гасили HCl (1н., 5 мл). Растворитель выпаривали, остаток разделяли между этилацетатом (30 мл) и водой (10 мл), органический слой промывали солевым раствором, высушивали над сульфатом магния, и растворитель выпаривали, получая 510 мг (3-(хлорметил)-1,2,4-оксадиазол-5-ил)метанола, сырой продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,16 г, 5,05 ммоль) добавляли при 0°C к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (984 мг, 3,37 ммоль) в THF (30 мл), с последующим добавлением диизопропил азодикарбоксилата (1,02 г, 5,05 ммоль), после перемешивания в течение 10 минут добавляли (3-(хлорметил)-1,2,4-оксадиазол-5-ил)метанол (500 мг, 3,37 ммоль), смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали этилацетатом (10×20 мл). Объединенный фильтрат упаривали досуха. Сырой продукт очищали ISCO (80 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 5-амино-4-(4-((3-(хлорметил)-1,2,4-оксадиазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (480 мг, 34%-ый выход).
1H ЯМР (ДМСО-d6) δ 1,20 (д, J=1,0 Гц, 2H, CH2), 1,95-2,22 (м, 2H, CH2), 3,50 (с, 3H, CH3), 4,38-4,62 (м, 2H, CH2), 4,73 (д, J=5,7 Гц, 1H, CH), 4,94 (с, 2H, CH2), 5,72 (с, 2H, CH2), 7,21 (уш.с, 1H, NHH), 7,32-7,41 (м, 2H, Ar), 7,49 (д, J=7,7 Гц, 1H, Ar), 7,61 (уш.с, 1H, NHH).
Стадия 3: К раствору 5-амино-4-(4-((3-(хлорметил)-1,2,4-оксадиазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (460 мг, 1,088 ммоль) в ацетонитриле (10 мл) добавляли морфолин (0,114 мл, 1,306 ммоль) и триэтиламин (0,182 мл, 1,306 ммоль). Сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали досуха, сырой продукт разделяли между этилацетатом (50 мл) и водой (10 мл), органический слой отделяли и промывали солевым раствором, высушивали над сульфатом магния. Растворитель выпаривали, получая 5-амино-4-(4-((3-(морфолинометил)-1,2,4-оксадиазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (410 мг, 80%-ый выход).
1H ЯМР (ДМСО-d6) δ 1,18 (д, J=5,3 Гц, 2H, CH2), 1,96-2,23 (м, 2H, CH2), 2,42-2,50 (м, 4H, CH2, CH2), 3,50 (с, 3H, CH3), 3,53-3,62 (м, 4H, CH2, CH2), 3,68 (с, 2H, CH2), 4,30-4,65 (м, 2H, CH2), 4,67-4,83 (м, 1H, CH), 5,68 (с, 2H, CH2), 7,21 (уш.с, 1H, NHH), 7,28-7,42 (м, 2H, Ar), 7,48 (д, J=7,7 Гц, 1H, Ar), 7,61 (уш.с, 1H, NHH).
Стадия 4: К раствору 5-амино-4-(4-((3-(морфолинометил)-1,2,4-оксадиазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (350 мг, 0,739 ммоль) в THF при 0°C добавляли трет-бутоксид калия (83 мг, 0,739 ммоль). Смесь перемешивали при 0°C в течение 1 часа, добавляли дополнительный трет-бутоксид калия (20 мг, 0,27 ммоль), смесь перемешивали при температуре окружающей среды в течение еще 1 часа. Реакционную смесь гасили уксусной кислотой (1 мл), растворитель выпаривали досуха, остаток разделяли между этилацетатом (50 мл) и насыщенным раствором бикарбоната натрия (10 мл). Органический слой отделяли и промывали солевым раствором, высушивали над сульфатом магния, растворитель выпаривали под вакуумом, сырой продукт очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 3-(4-((3-(морфолинометил)-1,2,4-оксадиазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (230 мг, 70%-ый выход). Т. пл.: 150-152°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,31-2,44 (м, 1H, CHH), 2,44-2,49 (м, 4H, CH2, CH2), 2,53 (уш.с, 1H, CHH), 2,79-3,05 (м, 1H, CHH), 3,48-3,63 (м, 4H, CH2, CH2), 3,69 (с, 2H, CH2), 4,21-4,52 (м, 2H, CH2), 5,12 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,69 (с, 2H, CH2), 7,38 (дд, J=7,6, 11,0 Гц, 2H, Ar), 7,47-7,66 (м, 1H, Ar); 13C ЯМР (ДМСО-d6) δ 22,28, 31,18, 45,00, 51,62, 51,93, 52,58, 61,11, 65,95, 115,25, 116,41, 129,90, 130,00, 133,58, 152,43, 166,98, 167,69, 170,92, 172,81, 174,88; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% HCOONH4 tR=4,65 (100%); Вычислено для C21H23N5O6: С, 57,14; H, 5,26; N, 15,86; Найдено: С, 56,99; H, 4,95; N, 15,90.
5.48 3-{4-[3-(4-ИЗОПРОПИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
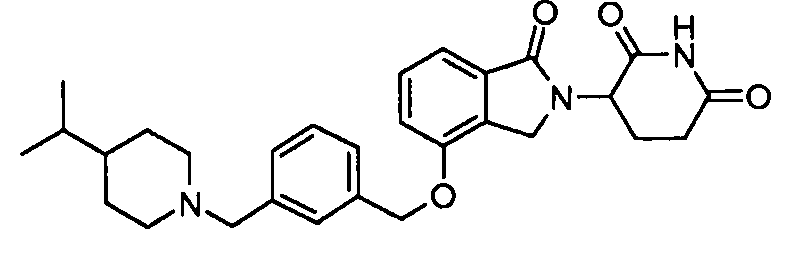
К раствору CH3CN (15 мл) 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,43 г, 0,970 ммоль) при температуре окружающей среды добавляли 4-изопропилпиперидин (0,160 г, 1,261 ммоль) и N-этил-N-изопропилпропан-2-амин (0,321 мл, 1,940 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение 2 часов. Белую суспензию упаривали под вакуумом, чтобы избавиться от CH3CN. Полученное твердое вещество белого цвета перемешивали в воде (50 мл) и экстрагировали метиленхлоридом (3×80 мл). Объединенные фазы метиленхлорида промывали насыщенным раствором бикарбоната натрия (2×50 мл), высушивали над сульфатом натрия и концентрировали, получая твердое вещество грязно-белого цвета (72 мг, 50%-ый выход); Т. пл.: 153-155°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 4,74 мин (96,3%). 1H ЯМР (ДМСО-d6) δ 0,83 (д, J=6,8 Гц, 6H, 2СН3), 0,89-1,02 (м, 1Н, CH), 1,14 (кв. д, J=3,9, 12,2 Гц, 2H, CH2), 1,37 (д кв, J=6,6, 13,2 Гц, 1H, CH), 1,55 (дд, J=1,4, 10,9 Гц, 2H, CH2), 1,75-1,91 (м, 2H, CH2), 1,92-2,05 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,80 (д, J=11,5 Гц, 2H, CH2), 2,84-3,00 (м, 1H, CHH), 3,43 (с, 2H, CH2), 4,20-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,20-7,28 (м, 1H, Ar), 7,28-7,41 (м, 5H, Ar), 7,43-7,53 (м, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 19,68, 22,39, 28,89, 31,21, 31,95, 41,85, 45,09, 51,59, 53,62, 62,25, 69,63, 115,17, 115,26, 126,13, 127,87, 128,29, 129,78, 129,95, 133,31, 136,44, 139,01, 153,46, 167,99, 170,95, 172,80. LC/MS (M+l)+=490; Вычислено для C29H35N3O4+0,2 H2O: C, 70,62; H, 7,23; N, 8,52; Найдено: С, 70,41; H, 7,26; N,8,44.
5.49 3-{1-ОКСО-4-[3-(4-ФЕНИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
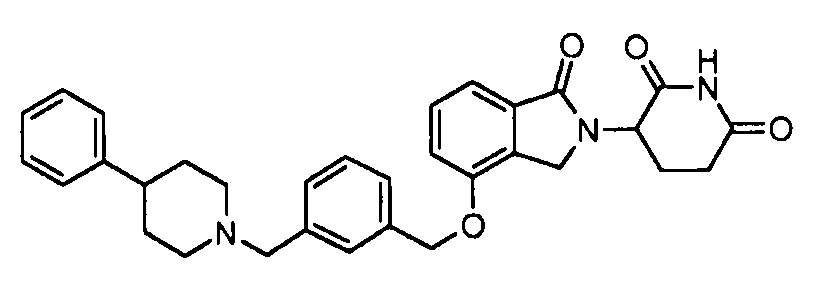
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,442 г, 0,997 ммоль) в CH3CN (15 мл) при температуре окружающей среды добавляли 4-фенилпиперидин (0,209 г, 1,296 ммоль) и N-этил-N-изопропилпропан-2-амин (0,330 мл, 1,994 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали в вакууме, получая твердое вещество грязно-белого цвета, которое перемешивали в воде (50 мл) и экстрагировали метиленхлоридом (3×50 мл). Объединенные фазы метиленхлорида снова промывали водой (50 мл), солевым раствором (50 мл), высушивали над сульфатом натрия и упаривали до твердого вещества грязно-белого цвета (~0,5 г), которое перемешивали в ацетонитриле (10 мл) при 50°C на масляной бане в течение 10 минут, затем фильтровали и высушивали в вакуумном сушильном шкафу, получая 3-{1-оксо-4-[3-(4-фенил-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,36 г, 69%-ый выход); Т. пл.: 226-228°C. ВЭЖХ Waters Symmetry С-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% Н3РО4, 4,79 мин, 96,0%, 1H ЯМР (ДМСО-d6) δ 1,53-1,79 (м, 4H, 2СН2), 1,89-2,11 (м, 3Н, CHH, СН2), 2,33-2,47 (м, 2Н, CHH, CHH), 2,53-2,62 (м, 1H, CHH), 2,80-2,99 (м, 3H, CH2, CHH), 3,51 (с, 2H, CH2), 4,21-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,12-7,53 (м, 12H, Ar), 10,97 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 33,05, 41,81, 45,13, 51,59, 53,57, 62,23, 69,63, 115,19, 115,26, 125,94, 126,24, 126,67, 128,04, 128,29, 128,45, 129,78, 129,97, 133,32, 136,49, 138,82, 146,21, 153,46, 167,99, 170,95, 172,80, LC/MS (M+l)+=524; Вычислено для C32H33N3O4+0,3 H2O: С, 72,65; H, 6,40; N, 7,94, Найдено: С, 72,48; H, 6,33; N, 7,78.
5.50 АМИД 1-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-1Н-[1,2,3]ТРИАЗОЛ-4- КАРБОНОВОЙ КИСЛОТЫ
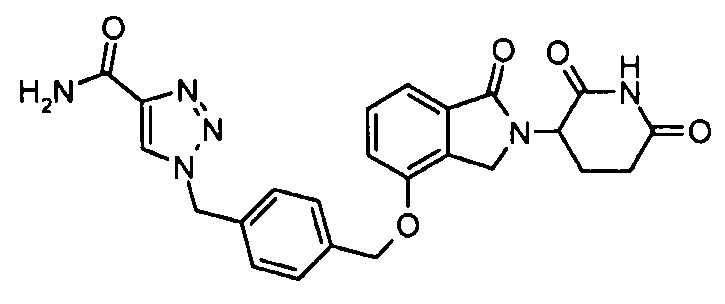
Стадия 1: Метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К смеси азида натрия (0,226 г, 3,47 ммоль) в этаноле (40 мл) при температуре окружающей среды добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,5 г, 3,16 ммоль). Полученную суспензию нагревали с обратным холодильником в течение 4 часов, после чего охлаждали и добавляли воду (50 мл) и EtOAc (200 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (50 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты как липкое твердое вещество желтого цвета (1,5 г, 109%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=439.
Стадия 2: Амид пропиновой кислоты
Этилпропиолат (2 г, 20,39 ммоль) добавляли к перемешиваемому водному раствору гидроксида аммония (5,99 г, 102 ммоль) при -78°C по каплям за 7 минут. Полученную смесь перемешивали при -78°C в течение 1 часа и давали нагреться до температуры окружающей среды. Реакционную смесь концентрировали под высоким вакуумом, получая амид пропиновой кислоты как желтое масло (1,41 г, 100%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; 1H ЯМР (ДМСО-d6) δ 4,07 (с, 1H, CH), 7,62 (уш. с, 1H, NHH), 8,07 (уш. с, 1H, NHH); 13C ЯМР (ДМСО-d6) δ 75,37, 78,51, 153,23.
Стадия 3: Метиловый эфир 4-карбамоил-4-{4-[4-(4-карбамоил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
В микроволновую ампулу добавляли 5-амино-4-(4-(4-(азидометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (300 мг, 0,69 ммоль) и пропиоламид (81 мг, 1,17 ммоль) в этаноле (2 мл). Смесь нагревали в микроволновой печи в течение 15 мин при 150°C. Реакционную смесь концентрировали и перемешивали в EtOAc (20 мл). Смесь фильтровали, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-карбамоил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества (255 мг, 73%-ый сырой выход); LCMS MH=507.
Стадия 4: Амид 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-1Н-[1,2,3]триазол-4-карбоновой кислоты
К перемешиваемой суспензии 5-амино-4-(4-(4-((4-карбамоил-1Н-1,2,3-триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (250 мг, 0,49 ммоль) в тетрагидрофуране (15 мл) при температуре окружающей среды добавляли трет-бутоксид калия (55,4 мг, 0,49 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение двух часов и сохраняли в холодильнике в течение ночи. К реакционной смеси добавляли две части трет-бутоксида калия (110 мг, 1,0 ммоль) и перемешивали при температуре окружающей среды в течение 1 часа, после чего разбавляли EtOAc (30 мл). К суспензии добавляли HCl (водный раствор, 1н., 4 мл) и фильтровали. Фильтрат экстрагировали, и органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO, и продукт перемешивали в CH3CN (5 мл). Смесь фильтровали, получая амид 1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-1Н-[1,2,3]триазол-4-карбоновой кислоты как твердое вещество белого цвета (21 мг, 9%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70, (CH3CN/0,1% H3PO4), 3,5 мин (97,4%); Т. пл.: N/A; 1H ЯМР (ДМСО-d6) δ 1,90-2,03 (м, 1H, CHH), 2,44 (дд, J=4,3, 13,2 Гц, 1H, CHH), 2,54-2,63 (м, 1H, CHH), 2,82-2,98 (м, 1H, CHH), 4,24 (д, J=17,4 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,10 (дд, J=5,0, 13,3 Гц, 1H, CHH), 5,24 (с, 2H, CH2), 5,66 (с, 2H, CH2), 7,25-7,41 (м, 4H, Ar), 7,42-7,57 (м, 4H, NHH, Ar), 7,85 (с, 1H, NHH), 8,61 (с, 1H, триазол), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,32, 31,19, 45,07, 51,57, 52,75, 69,12, 114,94, 115,29, 126,66, 128,15, 129,82, 129,97, 133,32, 135,45, 136,73, 143,12, 153,38, 161,39, 167,99, 170,97, 172,83; LCMS MH=475; Вычислено для C24H22N6O5: С, 60,75; H, 4,67; N, 17,71; Найдено: N/A.
5.51 АМИД 3-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-3H-[1,2,3]ТРИАЗОЛ-4-КАРБОНОВОЙ КИСЛОТЫ
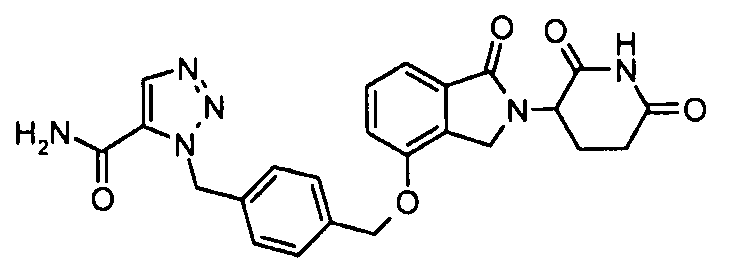
Стадия 1: Метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К смеси азида натрия (0,226 г, 3,47 ммоль) в этаноле (40 мл) при температуре окружающей среды добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,5 г, 3,16 ммоль). Полученную суспензию нагревали с обратным холодильником в течение 4 часов, после чего охлаждали и добавляли воду (50 мл) и EtOAc (200 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (50 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме липкого твердого вещества желтого цвета (1,5 г, 109%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=439.
Стадия 2: Амид пропиновой кислоты
Этилпропиолат (2 г, 20,39 ммоль) добавляли к перемешиваемому водному раствору гидроксида аммония (5,99 г, 102 ммоль) при -78°C по каплям за 7 минут. Полученную смесь перемешивали при -78°C в течение 1 часа и давали нагреться до температуры окружающей среды. Реакционную смесь концентрировали под высоким вакуумом, получая амид пропиновой кислоты как желтое масло (1,41 г, 100%-ый сырой выход). Соединение затем использовали на следующей стадии без дальнейшей очистки; 1H ЯМР (ДМСО-d6) δ 4,07 (с, 1H, CH), 7,62 (уш.с, 1H, NHH), 8,07 (уш.с, 1H, NHH); 13C ЯМР (ДМСО-d6) δ 75,37, 78,51, 153,23.
Стадия 3: Метиловый эфир 4-карбамоил-4-{4-[4-(5-карбамоил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
В микроволновую ампулу добавляли 5-амино-4-(4-(4-(азидометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (300 мг, 0,686 ммоль) и пропиоламид (81 мг, 1,166 ммоль) в этаноле (2 мл). Смесь нагревали в микроволновой печи в течение 15 мин при 150°C. Реакционную смесь концентрировали и перемешивали в EtOAc (20 мл). Смесь фильтровали, и фильтрат концентрировали под вакуумом, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-{4-[4-(5-карбамоил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества (50 мг, 14%-ый выход); LCMS MH=507.
Стадия 4: Амид 3-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-3H-[1,2,3]триазол-4-карбоновой кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-((5-карбамоил-1Н-1,2,3-триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (50,0 мг, 0,099 ммоль) в тетрагидрофуране (10 мл) при температуре окружающей среды добавляли 2-метилпропан-2-олат калия (41,00 мг, 0,37 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов, после чего добавляли EtOAc (15 мл), с последующим добавлением HCl (1н., водного раствора, 2 мл). Смесь экстрагировали, и органический слой промывали NaHCO3 (водный раствор, насыщ., 5 мл) и солевым раствором (5 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая твердое вещество белого цвета. Это твердое вещество белого цвета перемешивали в CH3CN (4 мл) и простом эфире (15 мл). Смесь фильтровали, получая амид 3-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-3H-[1,2,3]триазол-4-карбоновой кислоты как твердое вещество белого цвета (40 мг, 85%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70, (CH3CN/0,1% H3PO4), 3,88 мин (95,7%); Т. пл.: 280-282°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,03 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,59 (уш.с, 1H, CHH), 2,81-2,99 (м, 1H, CHH), 4,23 (д, J=17,6 Гц, 1H, NHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,10 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 5,94 (с, 2H, CH2), 7,24 (д, J=8,1 Гц, 2H, M01), 7,31 (дд, J=4,2, 7,6 Гц, 2H, Ar), 7,41-7,53 (м, 3H, Ar), 7,81 (с, 1H, NHH), 8,23 (с, 1H, NHH), 8,26 (с, 1H, триазол), 10,96 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,30, 31,16, 45,04, 51,53, 51,65, 69,14, 114,85, 115,25, 127,69, 127,98, 129,78, 129,93, 130,34, 133,28, 134,67, 136,10, 136,27, 153,39, 158,90, 167,97, 170,93, 172,81; LCMS MH=475; Вычислено для C24H22N6O5+0,5H2O: C, 59,62; H, 4,80; N, 17,38; Найдено: С, 59,82; H, 4,65; N, 17,09.
5.52 (R)-3-[4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
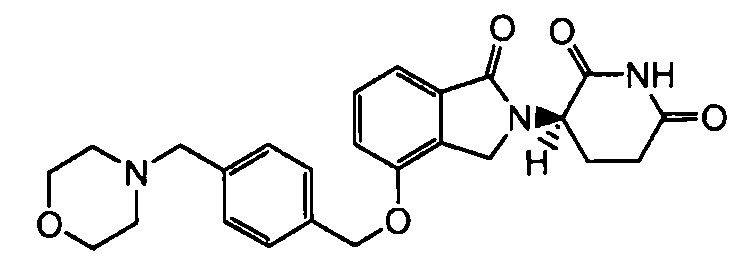
Стадия 1: Метиловый эфир 3-гидрокси-2-метил-бензойной кислоты
3-Гидрокси-2-метилбензойную кислоту (105 г, 690 ммоль) добавляли к MeOH (800 мл) в круглодонную трехгорлую колбу на 2 л, оборудованную конденсатором, термометром и мешалкой, с последующим добавлением MeOH (250 мл). И к вышеописанному раствору добавляли H2SO4 (10 мл, 180 ммоль). Реакционную смесь перемешивали при 62°C в течение 17 часов, после чего концентрировали. Остаток (200 мл) медленно добавляли к воде (600 мл) при температуре окружающей среды, и образовывалось твердое вещество белого цвета. Суспензию перемешивали в ванне со льдом в течение 30 мин и фильтровали. Твердое вещество промывали водой (5×250 мл) и высушивали, получая метиловый эфир 3-гидрокси-2-метил-бензойной кислоты как твердое вещество белого цвета (100 г, 87%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=167; 1H ЯМР (ДМСО-d6) δ 2,28 (с, 3H, CH3), 3,80 (с, 3H, CH3), 6,96-7,03 (м, 1H, Ar), 7,09 (т, J=7,8 Гц, 1H, Ar), 7,14-7,24 (м, 1H, Ar), 9,71 (с, 1H, ОН).
Стадия 2: Метиловый эфир 3-(трет-бутил-диметил-силанилокси)-2-метилбензойной кислоты
В круглодонную трехгорлую колбу на 1 л, оборудованную мешалкой и термометром, добавляли DMF (300 мл), 3-гидрокси-2-метилметилбензоат (90 г, 542 ммоль) и имидазол (92 г, 1354 ммоль). К вышеописанному раствору добавляли частями TBDMS-Cl (90 г, 596 ммоль), чтобы поддержать внутреннюю температуру 15-19°C в течение 20 мин, и после добавления внутреннюю температуру понижали ниже 10°C. Ванну со льдом удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь добавляли к воде со льдом (500 мл), и полученный раствор разделяли на две части (700 мл×2). Каждую часть экстрагировали EtOAc (700 мл). И каждый органический слой промывали холодной водой (350 мл) и солевым раствором (350 мл). Органические слои объединяли и высушивали MgSO4. Органический слой концентрировали, получая метиловый эфир 3-(трет-бутил-диметил-силанилокси)-2-метилбензойной кислоты как светло-коричневое масло (160 г, 100%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=281; 1H ЯМР (ДМСО-d6) δ -0,21 (с, 6H, CH3, CH3), 0,73-0,84 (м, 9H, CH3, CH3, CH3), 2,10 (с, 3H, CH3), 3,60 (с, 3H, CH3), 6,82 (дд, 1H, Ar), 6,97 (т, J=7,9 Гц, 1H, Ar), 7,13 (дд, J=1,1, 7,7 Гц, 1H, Ar).
Стадия 3: Метиловый эфир 2-бромметил-3-(трет-бутил-диметил-силанилокси)-бензойной кислоты
NBS (49,8 г, 280 ммоль) при температуре окружающей среды добавляли к 3-(трет-бутил диметилсилилокси)-2-метилметилбензоату (78,4 г, 280 ммоль) в метилацетате (500 мл), получая суспензию оранжевого цвета. Полученную реакционную смесь нагревали в масляной бане до 40°C и облучали 300-Вт лампой дневного света при нагревании с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали и промывали дважды раствором Na2SO3 (600 мл, 50%-ая насыщенная концентрация), водой (500 мл) и солевым раствором (600 мл). Органический слой высушивали MgSO4 и обесцвечивали активированным углем. Органический слой концентрировали, получая метиловый эфир 2-бромметил-3-(трет-бутил-диметил-силанилокси)-бензойной кислоты как светло-коричневое масло (96 г, 91%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS M-Br=279; 1H ЯМР (ДМСО-d6) δ 0,05-0,11 (м, 6H, CH3, СН3), 0,82 (с, 9Н, СН3, СН3, СН3), 3,65 (с, 3Н, СН3), 4,74 (с, 2Н, СН2), 6,94 (дд, J=1,3, 8,1 Гц, 1Н, Ar), 7,10-7,20 (м, 1H, Ar), 7,21-7,29 (м, 1H, Ar).
Стадия 4: Бензиловый эфир (R)-4-[4-(трет-бутил-диметил-силанилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемому раствору 2-(бромметил)-3-(трет-бутилдиметилсилилокси)метилбензоата (15,32 г, 36,7 ммоль) в ацетонитриле (130 мл) при температуре окружающей среды добавляли (R)-бензил-4,5-диамино-5-оксопентаноат гидрохлорид (10 г, 36,7 ммоль). К полученной суспензии добавляли DIPEA (13,45 мл, 77 ммоль) через воронку для добавления за 5 минут, и суспензия стала прозрачным раствором. Реакционную смесь нагревали при 40°C в течение 31 часа и при температуре окружающей среды 18 часов, после чего концентрировали под вакуумом. Остаток перемешивали в простом диэтиловом эфире (120 мл), и образовывалось твердое вещество белого цвета. Смесь фильтровали, и твердое вещество промывали простым диэтиловым эфиром (80 мл×4). Фильтраты последовательно промывали HCl (1н. водный раствор, 80 мл) и NaHCO3 (водный раствор., насыщ., 80 мл), после чего концентрировали под вакуумом. Остаток очищали хроматографией ISCO, получая бензиловый эфир (R)-4-[4-(трет-бутил-диметил-силанилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме липкого твердого вещества светло-желтого цвета (15,0 г, 101%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; 1H ЯМР (ДМСО-d6) δ 0,00 (с, 3Н, СН3), 0,01 (с, 3Н, СН3), 0,75 (с, 9Н, СН3, СН3, СН3), 1,73-2,16 (м, 4Н, СН2, СН2), 4,03-4,35 (м, 2Н, СНН, СНН), 4,53 (дд, J=5,1, 10,4 Гц, 1H, CHH), 4,64-4,82 (м, 2H, CH2), 6,77-6,89 (м, 1H, Ar), 6,97 (с, 1H, NHH), 7,01-7,23 (м, 7H, Ar), 7,37 (с, 1H, NHH); LCMS MH=483.
Стадия 5: Бензиловый эфир (R)-4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты
К перемешиваемому раствору (R)-бензил-5-амино-4-(4-(трет-бутилдиметилсилилокси)-1-оксоизоиндолин-2-ил)-5-оксопентаноата (8,37 г, 17,3 ммоль) в DMF (40 мл) и воде (4,4 мл) при ~15°C добавляли карбонат калия (1,20 г, 8,7 ммоль) в одной части. Полученную светло-желтую суспензию перемешивали при температуре окружающей среды в течение 1 ч, после чего добавляли ацетонитрил (50 мл), с последующим добавлением хлорида водорода (водный раствор, 12н., 1,7 мл, 20,8 ммоль), и образовывалось твердое вещество белого цвета. Смесь фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали ISCO, получая бензиловый эфир (R)-4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты как стекло в форме липкого твердого вещества (5,75 г, 90%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,01-2,39 (м, 4H, CH2, СН2), 4,34 (д, J=17,4 Гц, 1H, CHH), 4,49 (д, J=17,4 Гц, 1H, CHH), 4,75 (дд, J=5,0, 10,3 Гц, 1H, CHH), 4,96 (д, J=12,5 Гц, 1H, CHH), 5,03 (д, J=12,5 Гц, 1H, CHH), 6,99 (д, J=7,7 Гц, 1H, Ar), 7,10-7,24 (м, 2H, NHH, Ar), 7,25-7,41 (м, 6H, Ar), 7,58 (с, 1H, NHH), 10,03 (с, 1H, OH); LCMS: MH=369.
Стадия 6: Бензиловый эфир (R)-4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемому раствору (R)-бензил-5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксопентаноата (1 г, 2,71 ммоль) в ацетонитриле (35 мл) при температуре окружающей среды добавляли 1,4-бис(бромметил)бензол (2,15 г, 8,1 ммоль) и карбонат калия (0,375 г, 2,7 ммоль). Полученную суспензию перемешивали при 50°C в течение 1 часа и при температуре окружающей среды в течение ночи, после чего фильтровали. Фильтрат концентрировали, и остаток очищали ISCO, получая бензиловый эфир (R)-4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме прозрачного липкого твердого вещества (1,18 г, 78%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,04-2,42 (м, 4H, CH2, СН2), 4,44 (д, J=17,8 Гц, 1H, CHH), 4,55 (д, J=17,8 Гц, 1H, CHH), 4,68-4,80 (м, 3H, CHH, CH2), 4,96 (д, J=12,5 Гц, 1H, CHH), 5,03 (д, J=12,5 Гц, 1H, CHH), 5,25 (с, 2H, CH2), 7,20 (с, 1H, NHH), 7,24-7,38 (м, 7H, Ar), 7,40-7,52 (м, 5H, Ar), 7,58 (с, 1H, NHH); LCMS MH=551, 553.
Стадия 7: Бензиловый эфир (R)-4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К раствору (R)-бензил-5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксопентаноата (395 мг, 0,716 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли морфолин (0,187 мл, 2,1 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 2,5 часов, и реакция была закончена. К реакционной смеси добавляли EtOAc (50 мл) и NaHCO3 (насыщ. водный раствор, 15 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали, получая бензиловый эфир (R)-4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме липкого твердого вещества (350 мг, 88%-ый сырой выход). Продукт использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 2,01-2,40 (м, 8H, CH2, CH2, CH2, CH2), 3,46 (с, 2H, CH2), 3,56 (т, J=4,5 Гц, 4H, CH2, CH2), 4,42 (д, J=17,8 Гц, 1H, CHH), 4,54 (д, J=17,8 Гц, 1H, CHH), 4,75 (дд, J=5,0, 10,5 Гц, 1H, CHH), 4,95 (д, J=12,5 Гц, 1H, CHH), 5,02 (д, J=12,5 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,19 (с, 1H, NHH), 7,26-7,38 (м, 9H, Ar), 7,41-7,50 (м, 3H, Ar), 7,59 (с, 1H, NHH); LCMS MH=558.
Стадия 8: (R)-3-[4-(4-Морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион
К перемешиваемому раствору (R)-бензил-5-амино-4-(4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксопентаноата (350 мг, 0,6 ммоль) в тетрагидрофуране (10 мл) при 0°C добавляли трет-бутоксид калия (70,4 мг, 0,6 ммоль). Смесь перемешивали при 0°C в течение 1 часа и добавляли KOtBu (10 мг). И реакция была закончена еще через 1 час. Реакционную смесь разбавляли EtOAc (40 мл) и подкисляли HCl (2 мл, 1н.) и нейтрализовали NaHCO3 (насыщ. водный раствор, 5 мл). Смесь дополняли солевым раствором (10 мл) и экстрагировали. Органический слой высушивали MgSO4 и концентрировали под вакуумом. Липкое твердое вещество белого цвета, которое перемешивали в простом эфире (40 мл), получая (R)-3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (252 мг, 89%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 15/85, (CH3CN/0,1% H3PO4), 5,41 мин (99,7%); Т. пл.: 141-143°C; lH ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,25-2,47 (м, 5H, CHH, CH2, CH2), 2,53-2,65 (м, 1Н, CHH), 2,81-3,02 (м, 1H, CHH), 3,46 (с, 2H, CH2), 3,50-3,62 (м, 4H, CH2, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,41 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 4H, Ar), 7,39-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 51,55, 53,11, 62,07, 66,14, 69,38, 114,94, 115,20, 127,61, 128,97, 129,78, 129,93, 133,28, 135,27, 137,66, 153,48, 167,99, 170,96, 172,81; LCMS MH=450; Вычислено для C25H27N3O5+0,3H2O: C, 66,01; H, 6,12; N, 9,24; Найдено: С, 66,00; H, 6,03; N, 9,12; хиральная ВЭЖХ Chiral AGP, 4×150 мм, 5 мкм, 0,8 мл, 240 нм, 5/95 iPOH/10 мМ NH4OAc; R-изомер=92% ее.
5.53 3-(4-((5-морфолинометил)БЕНЗО[D]ТИАЗОЛ-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
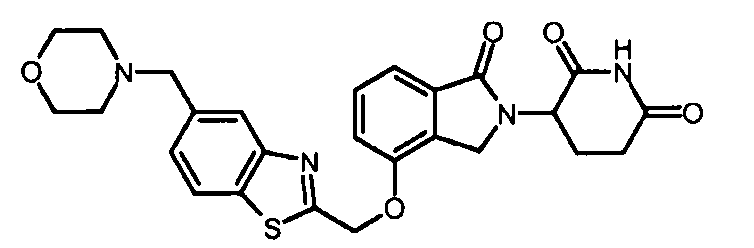
Стадия 1: 2,3-Дихлор-5Н-1,2,3-дитиазолия хлорид (6,7 г, 32,2 ммоль) добавляли к перемешиваемому раствору 2-бром-5-метиланилина (6,0 г, 32,2 ммоль) в CH2Cl2 (130 мл) и перемешивали в течение 2 часов. Добавляли пиридин (5,1 г, 64,5 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь промывали водой (2×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с простым эфиром (20 мл) и гексаном (20 мл), получая (Z)-2-бром-N-(4-хлор-5Н-1,2,3-дитиазол-5-илиден)-5-метиланилин (7,9 г, 76%): 1H ЯМР (CDCl3) δ 2,33 (с, 3Н), 6,90=6,92 (м, 2H), 7,53-7,56 (д, J=9 Гц, 1H).
Стадия 2: Смесь (Z)-2-бром-N-(4-хлор-5Н-1,2,3-дитиазол-5-илиден)-5-метиланилина (7,9 г, 24,6 ммоль) и йодида меди(I) (5,2 г, 27,1 ммоль) в пиридине (100 мл) нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали. Остаток растворяли в EtOAc (150 мл) и воде (100 мл). Слой EtOAc промывали водой (3×50 мл), солевым раствором (50 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 4/6 гексан/CH2Cl2 в течение 20 минут, затем до 2/8 в течение 15 минут), получая 5-метилбензо[d]тиазол-2-карбонитрил (3,1 г, 71%): 1H ЯМР (CDCl3) δ 2,56 (с, 3Н), 7,44-7,48 (дд, J=3 и 9 Гц, 1H), 7,84-7,87 (д, J=9 Гц, 1H), 8,01 (с, 1H).
Стадия 3: Смесь 5-метилбензо[d]тиазол-2-карбонитрила (3,0 г, 17,2 ммоль) в метаноле (100 мл) охлаждали в ванне со льдом. Медленно добавляли раствор метилат натрия/метанол (25 вес.%, 13 мл), и смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь охлаждали в ванне со льдом и гасили 6н. HCl (15 мл). Смесь концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали водой (2×35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 2/8 гексан/CH2Cl2 в течение 15 минут, затем к CH2Cl2 за 10 минут и поддерживали в течение 10 минут), получая 5-метилбензо[d]тиазол-2-метилкарбоксилат (3,2 г, 88%): lH ЯМР (CDCl3) δ 2,54 (с, 3Н), 4,08 (с, 3Н), 7,36-7,39 (дд, J=3 и 9 Гц, 1H), 7,83-7,86 (д, J=9 Гц, 1H), 8,02 (с, 1H).
Стадия 4: Смесь 5-метилбензо[d]тиазол-2-метилкарбоксилата (3,1 г, 15,1 ммоль) и N-бромсукцинимида (3,0 г, 16,6 ммоль) в метилацетате (50 мл) нагревали при 60°C на масляной бане с облучением реакционной смеси 300-Вт лампой в течение 3 часов. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc (50 мл). Смесь промывали водой (2×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 2/8 CH2Cl2/гексан в течение 15 минут, затем к CH2Cl2 в течение 15 минут), получая 5-(бромметил)бензо[d]тиазол-2-метилкарбоксилат (2,8 г, 65%): 1H ЯМР (CDCl3) δ 4,09 (с, 3Н), 4,66 (с, 2Н), 7,59-7,62 (дд, J=3 и 9 Гц, 1H), 7,95-7,98 (д, J=9 Гц, 1H), 8,22-8,23 (д, J=3 Гц, 1H).
Стадия 5: Раствор 5-(бромметил)бензо[d]тиазол-2-метилкарбоксилата (2,8 г, 9,8 ммоль) в ацетоне (30 мл) медленно добавляли к перемешиваемой суспензии морфолина (1,3 г, 14,7 ммоль) и карбоната калия (4,7 г, 34,2 ммоль) и каталитического количества 18-crown-6 в ацетоне (20 мл) при 60°C на масляной бане. Реакционную смесь перемешивали при 60°C на масляной бане в течение 3 часов, затем охлаждали и фильтровали. Фильтрат концентрировали, и остаток растворяли в EtOAc (100 мл) и промывали водой (2×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 10 минут, затем к 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем к 5% за 5 минут и поддерживали в течение 20 минут), получая 5-(морфолинометил)бензо[d]тиазол-2-метилкарбоксилат (2,3 г, 80%): 1H ЯМР (CDCl3) δ 2,47-2,50 (м, 4H), 3,67-3,73 (м, 6H), 4,09 (с, 3Н), 7,57-7,60 (дд, J=3 и 9 Гц, 1H), 7,91-7,94 (д, J=9 Гц, 1H), 8,19 (с, 1H).
Стадия 6: Раствор 5-(морфолинометил)бензо[d]тиазол-2-метилкарбоксилата (2,2 г, 2,5 ммоль) в THF (50 мл) медленно добавляли к перемешиваемому раствору LiAlH(t-BuO)3/THF (1M, 15,3 мл, 15,3 ммоль) в THF (20 мл), и реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь охлаждали и аккуратно гасили водой (20 мл). Смесь разбавляли EtOAc (150 мл) и водой (35 мл). Органический слой промывали водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 10 минут, затем к 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем к 5% за 5 мин и поддерживали в течение 20 минут), получая (5-(морфолинометил)бензо[d]тиазол-2-ил)метанол (1,8 г, 90%): 1H ЯМР (CDCl3) δ 2,46-2,49 (м, 4H), 3,63 (с, 2H), 3,71-3,73 (м, 4H), 3,94 (уш., 1H), 5,04 (с, 2H), 7,37-7,41 (дд, J=3 и 9 Гц, 1H), 7,81-7,83 (д, J=9 Гц, 1H), 7,91 (с, 1H); 13C ЯМР (CDCl3) δ 53,56, 62,56, 63,16, 66,98, 121,55, 123,14, 126,38, 133,51, 136,31, 153,13, 173,12.
Стадия 7: Суспензию смеси связки трифенилфосфин-полимер (4,1 г, 4,9 ммоль) в THF (40 мл) охлаждали до 3°C. Диизопропил азодикарбоксилат (0,9 г, 4,6 ммоль) медленно добавляли при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 3,4 ммоль) и (5-(морфолинометил)бензо[d]тиазол-2-ил)метанола (1,1 г, 4,1 ммоль) в THF (60 мл) медленно добавляли при 3-8°C. Реакционную смесь перемешивали при 3°C в течение 10 мин, затем нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь фильтровали, и фильтрат концентрировали. Остаток растворяли в CH2Cl2 (80 мл) и промывали насыщ. NaHCO3 (30 мл), водой (30 мл), солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 10 минут, затем к 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 20 минут), получая 5-амино-4-(4-((5-(морфолинометил)бензо[d]тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,95 г, 52%); 1H ЯМР (CDCl3) δ 2,23 (м, 1H), 2,35-2,50 (м, 7H), 3,64-3,74 (м, 6Н), 4,46-4,52 (д, J=18 Гц, 1H), 4,57-4,63 (д, J=18 Гц, 1H), 4,92-4,95 (, 1H), 5,30 (с, 3Н), 5,58 (с, 2Н), 5,65 (уш., 1Н), 6,53 (уш., 1H), 7,11-7,14 (д, J=9 Гц, 1H), 7,40-7,48 (м, 2H), 7,81-7,87 (м, 2H), 7,99 (с, 1H).
Стадия 8: Трет-бутоксид калия/THF (1M, 1,7 мл, 1,7 ммоль) медленно добавляли к перемешиваемому раствору 5-амино-4-(4-((5-(морфолинометил)бензо[d]тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 1,7 ммоль) в THF (25 мл) при 5°C. Реакционную смесь перемешивали при 5°C в течение 1 часа, затем гасили насыщ. NH4Cl (5 мл). Смесь разбавляли CH2Cl2 (50 мл) и водой (15 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток перекристаллизовывали из ацетона, получая 3-(4-((5-(морфолинометил)бензо[d]тиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,4 г, 55%): Т. пл. 228-230°C; 1H ЯМР (ДМСО-d6) δ 2,00-2,04 (м, 1H), 2,37-2,63 (м, 6H), 2,88-2,94 (м, 1Н), 3,56-3,62 (м, 6H), 4,32-4,38 (д, J=18 Гц, 1H), 4,47-4,53 (д, J=18 Гц, 1H), 5,11-5,17 (дд, J=3 и 12 Гц, 1H), 5,75 (с, 2H), 7,38-7,52 (м, 4H), 7,94 (с, 1H), 8,04-8,07 (д, J=9 Гц, 1H), 11,00 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,00, 51,63, 53,08, 62,00, 66,17, 67,41, 115,29, 116,12, 122,00, 122,74, 126,50, 129,96, 132,95, 133,52, 136,61, 152,60, 152,68, 167,80, 168,03, 170,96, 172,83; Вычислено для C26H26N4O5S+0,35 H2O: C, 60,89; H, 5,25; N, 10,92; S, 6,25, Найдено: С, 60,59; H, 5,11; N, 10,85; S, 6,30.
5.54 3-(4-((4-((4,5-ДИМЕТИЛ-1Н-ИМИДАЗОЛ-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
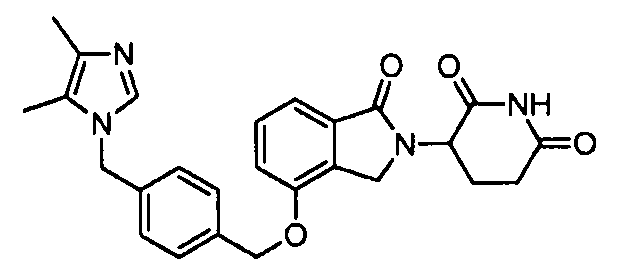
К смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,40 г, 0,90 ммоль) и 4,5-диметил-1Н-имидазола (0,24 г, 2,49 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли N,N-диизопропилэтил амин (0,16 мл, 0,90 ммоль). Раствор перемешивали при температуре окружающей среды в течение 24 часов. К суспензии добавляли 0,2 М фосфатного буфера рН 7,4 (50 мл), получая суспензию. К суспензии добавляли EtOAc (30 мл), и суспензию перемешивали в течение 10 мин Часть растворителя удаляли, получая суспензию. Суспензию фильтровали и промывали водой, получая твердое вещество. Это твердое вещество очищали препаративной ВЭЖХ (Xbridge C18, 10 мкм, 50×250 мм, 143 мл/мин, 240 нм, 2/98/2 мин, градиент к 98/2 CH3CN 0,1% муравьиной кислоты/H2O 0,1% муравьиной кислоты за 13 минут), получая масло. К этому маслу добавляли простой эфир (10 мл) и EtOAc (10 мл), получая суспензию. Суспензию фильтровали и промывали простым эфиром (10 мл), получая 3-(4-((4-((4,5-диметил-1Н-имидазол-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (110 мг, 27%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5/95-95/5 за 5 мин CH3CN/01% Н3РО4, 4,91 (97,5%); Т. пл.: 180-182°C; 1H ЯМР (ДМСО-d6) δ 1,87-2,09 (м, 7H, CHH, СН3, СН3), 2,31-2,48 (м, 1Н, CHH), 2,52-2,65 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 4,14-4,30 (м, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,01-5,17 (м, 3H, CH2, NCH), 5,22 (с, 2H, CH2), 7,12 (д, J=8,1 Гц, 2H, Ar), 7,25-7,38 (м, 2H, Ar), 7,41-7,54 (м, 3H, Ar), 7,56 (с, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 8,05, 12,67, 22,31, 31,16, 45,03, 47,19, 51,53, 69,17, 114,93, 115,25, 121,69, 126,87, 128,04, 129,78, 129,95, 132,92, 133,28, 135,54, 135,79, 137,53, 153,39, 167,97, 170,95, 172,81; LCMS MH=459; Вычислено для C26H26N4O4+0,5 H2O: C, 66,80; H, 5,82; N, 11,98; Найдено: С, 66,81; H, 5,66; N, 11,91.
5.55 3-(4-((3-(морфолинометил)ИЗОКСАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
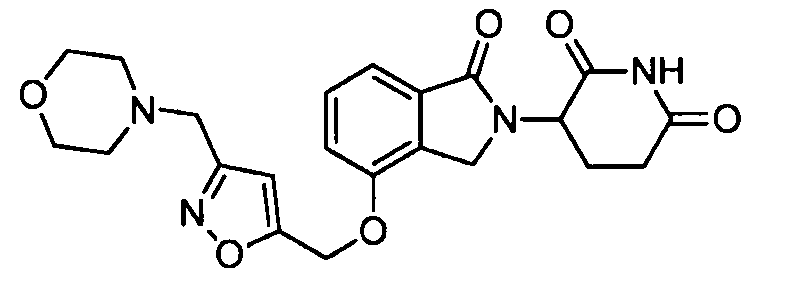
Стадия 1: (3-((Тетрагидро-2H-пиран-2-илокси)метил)изоксазол-5-ил)метанол
Раствор 3-((тетрагидро-2H-пиран-2-илокси)метил)изоксазол-5-этилкарбоксилата (3,7 г, 14,49 ммоль) в THF (100 мл) охлаждали до 0°C, и затем 1M раствор DIBALH в толуоле (43,5 мл) добавляли по каплям за 30 минут, и затем смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь гасили 1M водным раствором тартрата натрия-калия (100 мл) и затем экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (150 мл) и солевым раствором (150 мл), высушивали (MgSO4) и упаривали, получая 2,5 г продукта в форме оранжевого масла, при 81%-ом выходе; 1H ЯМР (CDCl3) δ 1,56-1,86 (м, 6H), 2,31 (уш., 1Н), 3,50-3,61 (м, 1H), 3,83-3,95 (м, 1H), 4,61 (д, J=12,8 Гц, 1H), 4,68-4,83 (м, 4H), 6,32 (с, 1H).
Стадия 2: (4S)-5-амино-5-оксо-4-(1-оксо-4-((3-((тетрагидро-2H-пиран-2-илокси)метил)-изоксазол-5-ил)метокси)изоиндолин-2-ил)метилпентаноат
Смесь (S)-5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-4-метил-5-оксометилпентаноата (3,4 г, 11,7 ммоль), (3-((тетрагидро-2H-пиран-2-илокси)метил)изоксазол-5-ил)метанола (2,5 г, 11,7 ммоль) и трифенилфосфина, связанного с полимером, 3 ммоль/г (7,8 г, 23 ммоль) в THF (200 мл), охлаждали до 0°C и добавляли DIAD (4,6 мл, 23,5 ммоль). Через 60 минут ванну со льдом удаляли, и смесь перемешивали в течение 16 часов при температуре окружающей среды. Затем смесь фильтровали, и фильтрат упаривали. Остаток хроматографировали в градиенте метиленхлорид-метанол. Продукт элюировали в 2%-ом MeOH, 3,4 г, при 60%-ом выходе; 1H ЯМР (CDCl3) δ 1,51-1,87 (м, 6H), 2,09-2,51 (м, 4H), 3,46-3,60 (м, 1H), 3,64 (с, 3H), 3,81-3,94 (м, 1H), 4,31-4,57 (м, 2H), 4,59-4,66 (м, 1H), 4,67-4,85 (м, 2H), 4,87-4,98 (м, 1H), 5,12-5,32 (м, 2H), 5,52 (уш.с, 1H), 6,30-6,53 (м, 2H), 7,08 (д, J=7,6 Гц, 1H), 7,35-7,52 (м, 2H).
Стадия 3: 3-(4-((3-(Гидроксиметил)изоксазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
Раствор (4S)-5-амино-5-оксо-4-(1-оксо-4-((3-((тетрагидро-2H-пиран-2-илокси)метил)изоксазол-5-ил)метокси)изоиндолин-2-ил)метилпентаноата (2,75 г, 5,64 ммоль) охлаждали до 0°C и добавляли трет-бутоксид калия (0,633 г, 5,64 ммоль). Через 30 минут добавляли AcOH (100 мл) и воду (25 мл), и смесь нагревали до 45°C. Смесь перемешивали при этой температуре в течение 24 часов и затем упаривали под вакуумом. Часть высушенного промежуточного соединения (1,86 г, 5,0 ммоль) растворяли в ацетонитриле (100 мл) и обрабатывали метансульфонил хлоридом (0,389 мл, 5,00 ммоль) и TEA (0,730 мл, 5,25 ммоль). После перемешивания в течение 2 часов при температуре окружающей среды снова добавляли метансульфонилхлорид (0,438 мл, 5,64 ммоль) и TEA (0,823 мл, 5,92 ммоль). После дополнительного 1 часа, смесь гасили AcOH (1 мл) и упаривали под вакуумом. Остаток разделяли между EtOAc (100 мл) и насыщенным водным раствором NaHCO3 (100 мл), и водный слой экстрагировали EtOAc (50 мл). Объединенные органические фазы промывали насыщенным водным NaHCO3 (100 мл), водой (100 мл) и высушивали (MgSO4). Смесь упаривали и хроматографировали с использованием градиента метиленхлорид-метанол. Продукт элюировали в ~2% MeOH. Выход после высушивания составил 1,6 г (71%); 1H ЯМР (ДМСО-d6) δ 1,93-2,05 (м, 1H), 2,35-2,48 (м, 1H), 2,55-2,63 (м, 1H), 2,83-3,00 (м, 1Н), 3,33 (с, 3Н), 4,19-4,30 (м, 1H), 4,35-4,48 (м, 1H), 5,11 (дд, J=4,9, 13,2 Гц, 1H), 5,38 (с, 2H), 5,49 (с, 2H), 6,84 (с, 1H), 7,40 (т, J=8,0 Гц, 2H), 7,48-7,57 (м, 1H).
Стадия 4: 3-(4-((3-(Морфолинометил)изоксазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
Смесь (5-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)изоксазол-3-ил)метил метансульфоната (0,5 г, 1,113 ммоль) в ацетонитриле (10 мл) охлаждали до 0°C. Добавляли морфолин (0,116 мл, 1,335 ммоль) и DIEA (0,252 мл, 1,446 ммоль) и смесь перемешивали при этой температуре. Через 16 часов полученную суспензию фильтровали, и твердое вещество высушивали под вакуумом. Продукт получали как твердое вещество белого цвета, 0,4 г при 82%-ом выходе; Т. пл. 228-230°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-90/10 CH3CN/0,1% H3PO4 за 10 мин: 4,38 (99,82%). 1H ЯМР (ДМСО-d6) δ 1,82-2,12 (м, 1H), 2,22-2,48 (м, 5H), 2,54-2,67 (м, 1H), 2,79-3,05 (м, 1H), 3,55 (уш., 6H), 4,16-4,49 (м, 2H), 5,11 (дд, J=4,9, 13,2 Гц, 1H), 5,43 (с, 2H), 6,64 (с, 1H), 7,32-7,46 (м, 2H), 7,46-7,61 (м, 1H), 10,98 (с, 1H). 13C ЯМР (ДМСО-d6) δ 22,30, 31,16, 45,00, 51,58, 52,51, 52,87, 60,67, 65,98, 104,55, 115,09, 115,96, 129,84, 129,96, 133,49, 152,63, 167,26, 167,80, 170,92, 172,81. Вычислено для C22H24N4O6: С, 59,99%; H, 5,49%; N, 12,72%; Найдено: С, 59,69%; H, 5,43%; N, 12,66%.
5.56 3-{4-[4-(4-ТРЕТ-БУТИЛ-[1,2,3]ТРИАЗОЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
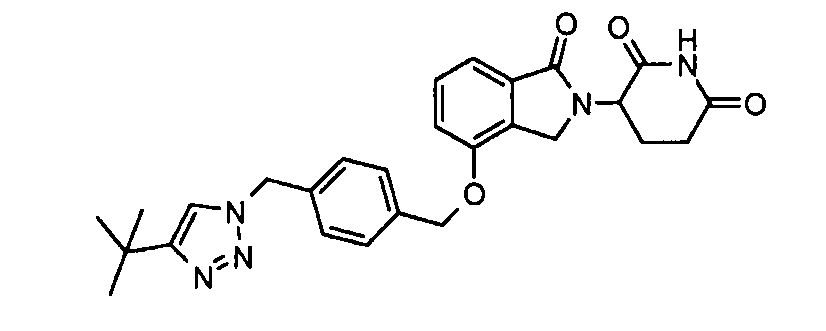
Стадия 1: Метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К смеси азида натрия (0,226 г, 3,47 ммоль) в этаноле (40 мл) при температуре окружающей среды добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,5 г, 3,16 ммоль). Полученную суспензию нагревали с обратным холодильником в течение 4 часов, после чего охлаждали и добавляли воду (50 мл) и EtOAc (200 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (50 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая метиловый эфир 4-[4-(4-азидометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме липкого твердого вещества желтого цвета (1,5 г, 109%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=439.
Стадия 2: Метиловый эфир 4-{4-[4-(4-трет-бутил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты
3,3-Диметилбут-1-ин (752 мг, 9,2 ммоль), 5-амино-4-(4-(4-(азидометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (400 мг, 0,9 ммоль) и толуол (4 мл) закрывали в микроволновой ампуле и нагревали в микроволновой печи при 125°C в течение 3 часов. Реакционную смесь концентрировали, и остаток очищали ISCO, получая метиловый эфир 4-{4-[4-(4-трет-бутил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты в форме светлого стекловидного твердого вещества (160 мг, 34%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=520.
Стадия 3: 3-{4-[4-(4-Трет-бутил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 5-амино-4-(4-(4-((4-трет-бутил-1Н-1,2,3-триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (160 мг, 0,3 ммоль) в тетрагидрофуране (5 мл) при 0°C добавляли трет-бутоксид калия (34,6 мг, 0,3 ммоль). Полученный раствор перемешивали при 0°C в течение 10 минут, и реакция была закончена. Реакционную смесь разбавляли EtOAC (30 мл) и затем подкисляли HCl (1н., водным раствором, 2 мл). К полученной смеси добавляли NaHCO3 (водный раствор, насыщ., 2 мл) и солевой раствор (5 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали. Остаток очищали ISCO и препаративной ВЭЖХ, получая 3-{4-[4-(4-трет-бутил-[1,2,3]триазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (15 мг, 10%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 45/55, (CH3CN/0,1% H3PO4), 3,67 мин (97,5%); Т. пл.: N/A; 1H ЯМР (ДМСО-d6) δ 1,26 (с, 9H, СН3, СН3, СН3), 1,86-2,04 (м, 1Н, СНН), 2,33-2,45 (м, 1Н, CHH), 2,54-2,66 (м, 1H, CHH), 2,79-3,02 (м, 1H, CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 5,10 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 5,53 (с, 2H, CH2), 7,24-7,40 (м, 4H, Ar), 7,41-7,56 (м, 3H, Ar), 7,92 (с, 1H, триазол H), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 30,24, 31,16, 45,06, 51,55, 52,33, 69,12, 114,88, 115,25, 119,84, 128,04, 129,78, 129,93, 133,30, 136,01, 136,45, 153,38, 156,50, 167,96, 170,95, 172,81; LCMS MH=488.
5.57 3-(1-ОКСО-4-((4-((2,4,5-ТРИМЕТИЛ-1Н-ИМИДАЗОЛ-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ФОРМИАТ
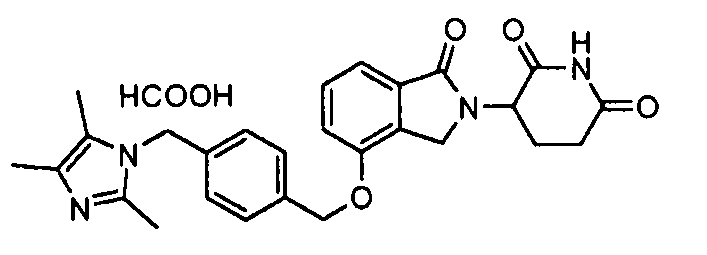
Стадия 1: 2,4,5-Триметил-1Н-имидазол
Уксусный альдегид (0,32 мл, 5,8 ммоль) добавляли к смеси биацетила (0,51 мл, 5,8 ммоль), ацетата аммония (4,03 г, 52,3 ммоль) и уксусной кислоты (8 мл) в микроволновой ампуле (20 мл). Ампулу закрывали и помещали в микроволновую печь на 5 мин при 180°C. Реакционную смесь медленно добавляли к смеси льда и водного раствора NH4OH (30 мл), и полученный коричневый раствор разбавляли водой (50 мл), и смесь экстрагировали EtOAC (3×35 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая 2,4,5-триметил-1Н-имидазол как коричневое масло (460 мг, 77%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; lH ЯМР (ДМСО-d6) δ 1,75 (с, 3Н, CH3), 1,96 (с, 3Н, СН3), 2,12 (с, 3Н, СН3), 11,10 (уш.с, 1H, NH).
Стадия 2: 3-(1-Оксо-4-((4-((2,4,5-триметил-1Н-имидазол-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион формиат
К перемешиваемому раствору 2,4,5-триметил-1Н-имидазола (447 мг, 4,1 ммоль) в ацетонитриле (8 мл) добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (400 мг, 0,9 ммоль) и N-этил-N-изопропилпропан-2-амин (0,482 мл, 2,7 ммоль). Полученный раствор перемешивали при температуре окружающей среды 18 часов, после чего добавляли EtOAC (70 мл) и NaHCO3 (водный раствор, насыщ., 25 мл). Образовывалось некоторое количество твердого вещества, которое отфильтровывали. Фильтрат экстрагировали, и органический слой концентрировали. Остаток, объединенный с твердым веществом, очищали препаративной ВЭЖХ, получая твердое вещество светло-коричневого цвета, которое далее очищали перемешиванием в CH3CN (4 мл) и простом диэтиловом эфире (30 мл), получая 3-(1-оксо-4-((4-((2,4,5-триметил-1Н-имидазол-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион формиат в форме твердого вещества грязно-белого цвета (93 мг, 20%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3PO4), 6,09 мин (99,8%); 254-256°C; 1H ЯМР (ДМСО-d6) δ 1,98 (д, J=9,1 Гц, 7H, CHH, CH3, CH3), 2,18 (с, 3H, CH3), 2,34-2,47 (м, 1H, CHH), 2,60 (уш.с, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 4,99-5,16 (м, 3H, CHH, CH2), 5,22 (с, 2H, CH2), 7,00 (д, J=8,1 Гц, 2H, Ar), 7,25-7,38 (м, 2H, Ar), 7,46 (д, J=8,3 Гц, 3H, Ar), 8,20 (с, 1H, HCOOH), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 12,31, 12,78, 22,33, 31,16, 45,03, 45,89, 51,53, 69,16, 114,91, 115,23, 121,53, 126,10, 128,11, 129,78, 129,93, 130,18, 133,28, 135,60, 137,32, 141,81, 153,41, 163,55, 167,97, 170,95, 172,81; LCMS MH=473; Вычислено для C27H28N4O4 HCOOH+1H2O: C, 62,68; H, 6,01; N, 10,44; Найдено: С, 62,54; H, 5,63; N, 10,35.
5.58 3-(4-((5-МЕТИЛ-1,3,4-ОКСАДИАЗОЛ-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
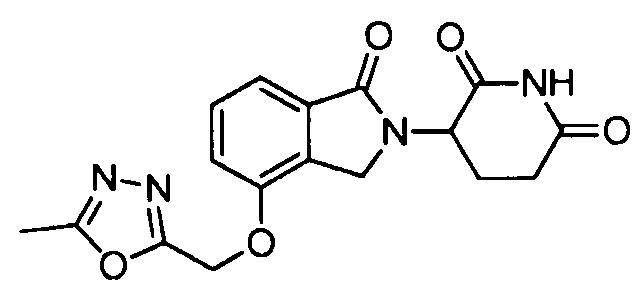
Стадия 1: К раствору 2-(хлорметил)-5-метил-1,3,4-оксадиазола (500 мг, 3,77 ммоль) в DMF (10 мл) добавляли 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1103 мг, 3,77 ммоль) и K2CO3 (573 мг, 4,15 ммоль), сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали под вакуумом, остаток разделяли между водой (10 мл) и этилацетатом (100 мл), органический слой промывали насыщенным карбонатом натрия (10 мл), солевым раствором, высушивали над сульфатом магния, и растворитель выпаривали досуха. Остаток очищали ISCO (80 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 50 минут), получая 5-амино-4-(4-((5-метил-1,3,4-оксадиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (860 мг, 59%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,25 (д, J=6,8 Гц, 4H, CH2, CH2), 2,53 (с, 3H, CH3), 3,49 (с, 3Н, CH3), 4,29-4,61 (м, 2Н, СН2), 4,68-4,80 (м, 1Н, СН), 5,52 (с, 2Н, СН2), 7,20 (с, 1Н, NHH), 7,31-7,45 (м, 2H, Ar), 7,49 (д, J=7,7 Гц, 1H, Ar), 7,59 (с, 1H, NHH).
Стадия 2: К смеси 5-амино-4-(4-((5-метил-1,3,4-оксадиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (422 мг, 1,087 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (146 мг, 1,304 ммоль). Сформированную смесь нагревали до температуры окружающей среды и перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь гасили водным раствором HCl (1н., 1,5 мл), растворитель выпаривали, остаток разделяли между насыщенным водным раствором бикарбоната натрия (10 мл) и этилацетатом (50 мл). Органический слой промывали солевым раствором, высушивали над сульфатом магния. Растворитель выпаривали под вакуумом, и сырой продукт ресуспендировали с ацетонитрилом (5 мл) и фильтровали, получая 3-(4-((5-метил-1,3,4-оксадиазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (250 мг, 33%-ый выход). Т. пл.: 206-208°C; 1H ЯМР (ДМСО-d6) δ 1,99 (с, 1H, CHH), 2,34-2,48 (м, 1H, СНН), 2,53 (с, 3Н, CH3), 2,55-2,68 (м, 1Н, СНН), 2,79-3,04 (м, 1H, СНН), 4,17-4,49 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,53 (с, 2H, CH2), 7,33-7,48 (м, 2H, Ar), 7,49-7,61 (м, 1H, Ar), 10,98 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 10,46, 22,30, 31,16, 44,96, 51,59, 59,78, 115,29, 116,30, 129,90, 129,97, 133,53, 152,47, 162,12, 164,82, 167,71, 170,93, 172,80; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% HCOONH4 tR=3,08 (100%); Вычислено для C17H16N4O5+0,2 H2O C, 56,73; H, 4,59; N, 15,57; Найдено: С, 56,88; H, 4,52; N, 15,31.
5.59 3-{4-[4-(1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1- ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
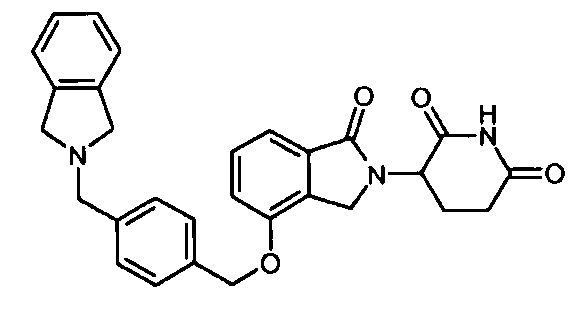
К раствору 5-амино-4-(4-(4-(изоиндолин-2-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 0,974 ммоль) в THF при 0°C добавляли трет-бутоксид калия (0,131 г, 1,168 ммоль). Смесь перемешивали в течение 30 минут и добавляли 2 мл 1н. HCl, затем 10 мл насыщ. NaHCO3 и 25 мл EtOAc. Смесь экстрагировали, и органический слой концентрировали, и полученное твердое вещество очищали на колонке с силикагелем, элюируя DCM и MeOH, получая твердое вещество. Это твердое вещество перекристаллизовывали из 2 мл CH3CN, получая 3-{4-[4-(1,3-дигидро-изоиндол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион (60 мг, 13%). Т.пл.: 153-155°C. LCMS m/e=482. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 4,99 мин (95%); 1H ЯМР (ДМСО-d6) δ 1,89-2,04 (м, 1H, CHH), 2,35-2,45 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 3,83 (с, 4H, CH2, CH2), 3,87 (с, 2H, CH2), 4,19-4,50 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,10-7,25 (м, 4H, Ar), 7,27-7,54 (м, 8H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО): δ 22,32, 31,17, 45,08, 49,30, 51,54, 58,16, 69,32, 114,89, 115,24, 122,29, 122,84, 123,50, 127,78, 127,82, 127,89, 129,94, 131,38, 133,50, 136,30, 137,50, 170,96, 172,82. Вычислено для C29H27N304; C% 72,33, H% 5,65, N% 8,73. Найдено: C% 70,89, H% 5,31, N% 8,37.
5.60 3-{4-[4-(4-ТРЕТ-БУТИЛ-ИМИДАЗОЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
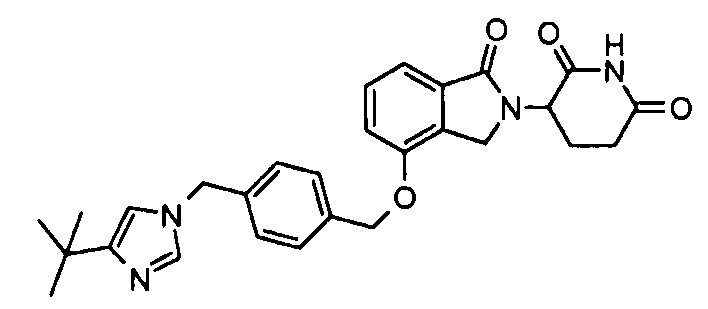
Стадия 1: 5-Трет-бутил-1Н-имидазол
1-Бром-3,3-диметилбутан-2-он (2,0 г, 11,2 ммоль) и формамид (1,11 г, 24,6 ммоль) смешивали в микроволновой ампуле и нагревали при 147°C в закрытой пробирке в течение 5,5 часов. Реакционную смесь охлаждали и разбавляли водой (40 мл). Смесь экстрагировали гептаном (50 мл). Водный слой дополняли K2CO3 (10 вес.% водный раствор, ~25 мл) до рН 10. Полученный раствор экстрагировали DCM (3×50 мл). Органический слой высушивали MgSO4 и концентрировали, получая 5-трет-бутил-1Н-имидазол в форме липкого желтого масла (560 мг, 40%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки; 1H ЯМР (ДМСО-d6) δ 1,21 (с, 9H, CH3, CH3, CH3), 6,66 (с, 1H, Ar), 7,47 (д, J=0,9 Гц, 1H, Ar), 11,70 (уш.с, 1H, NH).
Стадия 2: Метиловый эфир 4-{4-[4-(4-трет-бутил-имидазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты
К перемешиваемому раствору 4-трет-бутил-1Н-имидазола (549 мг, 4,4 ммоль) в ацетонитриле (10 мл) добавляли 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (600 мг, 1,3 ммоль) и DIPEA (0,66 мл, 3,8 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 2 дней. Реакционную смесь разбавляли EtOAc (60 мл), и смесь промывали NaHCO3 (водный раствор, насыщ., 20 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали. Остаток очищали ISCO, получая метиловый эфир 4-{4-[4-(4-трет-бутил-имидазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты как твердое вещество белого цвета (540 мг, 82%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,17 (с, 9H, CH3, CH3, CH3), 1,95-2,33 (м, 4H, CH2, CH2), 3,49 (с, 3H, CH3), 4,31-4,58 (м, 2H, CHH, CHH), 4,72 (дд, J=4,5, 10,2 Гц, 1H, CHH), 5,11 (с, 2H, CH2), 5,23 (с, 2H, CH2), 6,83 (д, 1,3 Гц, 1H, Ar), 7,18 (с, 1H, NHH), 7,24-7,35 (м, 4H, Ar), 7,38-7,53 (м, 3Н, Ar), 7,53-7,64 (м, 2H, NHH, Ar); LCMS MH=519.
Стадия 3: 3-{4-[4-(4-Трет-бутил-имидазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 5-амино-4-(4-(4-((4-трет-бутил-1Н-имидазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (540 мг, 1,0 ммоль) в тетрагидрофуране (15 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 25 минут, после чего разбавляли EtOAc (50 мл) и затем подкисляли HCl (1н., водным раствором, 4 мл) с последующим добавлением NaHCO3 (водный раствор, насыщ., 10 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали, получая твердое вещество белого цвета. Это твердое вещество очищали, после перемешивания в ацетонитриле (5 мл) и простом диэтиловом эфире (30 мл), получая 3-{4-[4-(4-трет-бутил-имидазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (327, 64%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 3,71 мин (97,9%); 227-229°C; 1H ЯМР (ДМСО-d6) δ 1,17 (с, 9H, CH3, СН3, СН3), 1,88-2,04 (м, 1Н, СНН), 2,33-2,47 (м, 1Н, СНН), 2,53-2,64 (м, 1Н, СНН), 2,82-3,00 (м, 1Н, СНН), 4,24 (д, J=17,6 Гц, 1Н, СНН), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,11 (с, 3H, CHH, CH2), 5,22 (с, 2H, CH2), 6,83 (д, J=1,3 Гц, 1H, имидазол H), 7,31 (т, J=7,4 Гц, 4H, Ar), 7,48 (д, J=8,1 Гц, 3H, Ar), 7,60 (д, J=1,1 Гц, 1H, имидазол H), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,24, 30,10, 31,11, 31,34, 44,99, 49,04, 51,48, 69,11, 112,48, 114,83, 115,17, 127,65, 127,97, 129,72, 129,86, 133,23, 135,97, 136,21, 137,62, 151,40, 153,32, 167,90, 170,88, 172,74; LCMS MH=487; Вычислено для C28H30N4O4: С, 69,12; H, 6,21; N, 11,51; Найдено: С, 69,02; H, 6,05; N, 11,45.
5.61 (S)-3-[4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
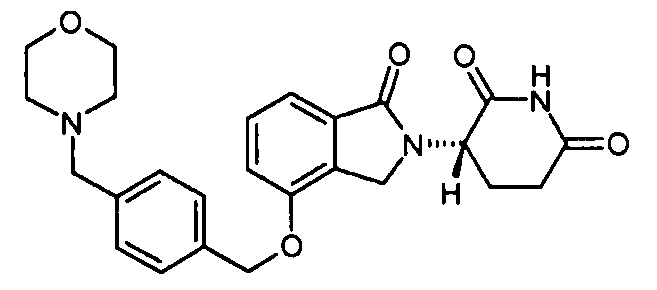
Стадия 1: Получение метилового эфира (S)-4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
В круглодонную колбу на 2 л загружали 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (30 г, 103 ммоль), 1,4-бис(бромметил)бензол (81 г, 308 ммоль), карбонат калия (14,19 г, 103 ммоль) и ацетонитрил (1,2 л). Смесь перемешивали при температуре окружающей среды в течение 10 минут и нагревали до 50°C в течение 12 часов. Реакционной смеси давали охладиться до температуры окружающей среды. Смесь фильтровали, и фильтрат концентрировали на роторном испарителе. Полученное твердое вещество растворяли в CH2Cl2 и загружали на 2 колонки с силикагелем (330 г каждая), элюируя с использованием CH2Cl2/MeOH, получая метиловый эфир 4-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты как твердое вещество белого цвета (40 г, 82%). lH ЯМР (ДМСО-d6) δ 1,98-2,13 (м, 1H, CHH), 2,14-2,23 (м, 1H, CHH), 2,23-2,32 (м, 2H, CHH, CHH), 3,50 (с, 3H, CH3), 4,34-4,63 (м, 2H, CH2), 4,67-4,80 (м, 3H, CH2, NCH), 5,25 (с, 4H, CH2), 7,19 (с, 1H, NHH), 7,24-7,34 (м, 2H, Ar), 7,41-7,54 (м, 5H, Ar), 7,58 (уш.с, 1H, NHH).
Стадия 2: Получение метилового эфира (S)-4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К раствору в CH2Cl2 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (36,5 г, 77 ммоль) при 0°C добавляли морфолин (14,72 мл, 169 ммоль). Смесь перемешивали при 0°C в течение 1 часа. К смеси добавляли 200 мл CH2Cl2, промывали водой (100 мл×2) и солевым раствором (100 мл), высушивали на Na2SO4 и концентрировали, получая метиловый эфир (S)-4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме белой пены (39 г, 100%). Т.пл. 66-68°C; ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 15/85 CH3CN/0,1% H3PO4 в H2O: 7,92 мин (99%). 1H ЯМР (ДМСО-d6) δ 2,00-2,12 (м, 1H, CHH), 2,14-2,22 (м, 1H, CHH), 2,22-2,29 (м, 2H, CHH, CHH), 2,30-2,39 (м, 4H, CH2, CH2), 3,46 (с, 2H, CH2), 3,50 (с, 3H, CH3), 3,53-3,63 (м, 4H, CH2, CH2), 4,28-4,59 (м, 2H, CH2), 4,73 (дд, J=4,7, 10,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,14-7,23 (м, 1H, NHH), 7,26-7,39 (м, 4H, Ar), 7,41-7,51 (м, 3Н, Ar), 7,58 (с, 1H, NHH). 13C ЯМР (ДМСО-d6) δ 24,82, 30,33, 44,78, 51,24, 53,12, 53,38, 62,09, 66,14, 69,35, 114,66, 115,12, 127,60, 129,00, 129,55, 130,18, 133,43, 135,31, 137,66, 153,42, 167,84, 171,73, 172,46; Вычислено для C26H31N3O6+0,3 H2O: C% 64,13; H% 6,54; N% 8,63; Найдено: C% 63,89; H% 6,39; N% 8,56.
Стадия 3: Получение (S)-3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона
К раствору (S)-5-амино-4-(4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (45 г, 93 ммоль) в THF при -78°C по каплям добавляли 2-метилпропан-2-олат калия (10,49 г, 93 ммоль) (2 г×5). Смесь перемешивали при этой температуре в течение 30 минут, затем добавляли 250 мл 1н. раствора HCl, затем 200 мл насыщенного раствора NaHCO3. Смесь экстрагировали CH2Cl2 (150 мл×2). Органический слой промывали водой (50 мл×3) и солевым раствором (100 мл), концентрировали на роторном испарителе, получая твердое вещество белого цвета, которое затем перекристаллизовывали из CH3CN (100 мл), получая (S)-3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (32 г, 76%). Т. пл.: 140-142°C. LCMS m/e=450. ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, изократический 15/85 CH3CN/0,1% H3PO4 за 5 мин,: tR=5,61 мин (99,5%); Chiral AGP C-18 4,0×150 мм, 5 мкм 10/90 изопропанол/10 мМ NH4Ac за 20 мин,: tR=10,07 мин (99,5%); lH ЯМР (ДМСО-d6) δ 2,28-2,38 (м, 4H, CH2, CH2), 2,44 (дд, 4,2, 13,1 Гц, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,79-3,02 (м, 1H, CHH), 3,49-3,69 (м, 4H, CH2, CH2), 4,11-4,52 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,33 (д, J=7,7 Гц, 4H, Ar), 7,40-7,52 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,06, 51,55, 53,11, 62,07, 66,14, 69,38, 114,96, 115,20, 127,61, 128,97, 129,78, 129,93, 133,28, 135,27, 137,67, 153,48, 167,97, 170,95, 172,80, LC-MS: 465; Вычислено для C25H27N3O5 C: 66,80%; H: 6,05%; N: 9,35%, Найдено: C: 66,59%; H: 5,79%; N: 9,26%.
5.62 3-(1-ОКСО-4-((4-(((S)-2-(TRIФТОРМЕТИЛ)ПИРРОЛИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
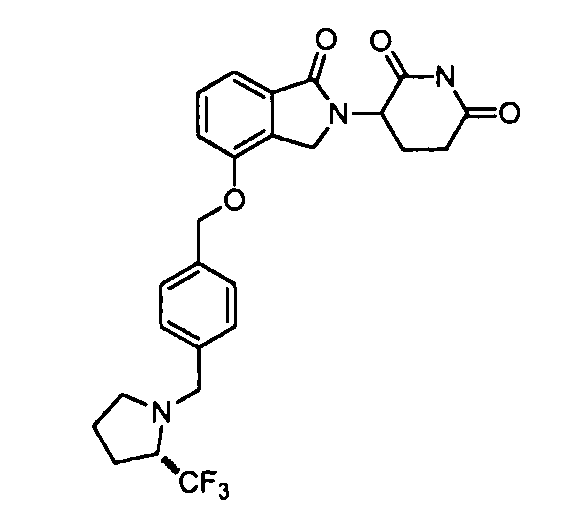
Стадия 1: (S)-2-(Трифторметил)пирролидин (198 мг, 1,420 ммоль) добавляли в форме твердого вещества к раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (450 мг, 0,947 ммоль) в ацетонитриле (5 мл). Полученный раствор перемешивали в течение 4 часов при температуре окружающей среды и затем в течение 24 часов при 70°C. Загружали дополнительные части DIEA (0,165 мл, 0,947 ммоль) и (S)-2-(трифторметил)пирролидина (60 мг, 0,43 ммоль), и полученную смесь перемешивали при 70°C в течение дополнительных ~16 часов. Смесь охлаждали и затем концентрировали в вакууме. Остаток разделяли между EtOAc (50 мл) и 1н. NaHCO3 (30 мл), и водный слой промывали дополнительным количеством EtOAc (50 мл). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 5-амино-5-оксо-4-(1-оксо-4-((4-(((S)-2-(трифторметил)пирролидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)метилпентаноат в форме желтого стекловидного твердого вещества (500 мг, 99%-ый сырой выход). Сырой продукт использовали на следующей стадии без дальнейшей очистки: LCMS: МН=534.
Стадия 2: К раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(((S)-2-(трифторметил)пирролидин-1-ил)метил)бензилокси)изоиндолин-2-ил)метилпентаноата (500 мг, 0,937 ммоль) в DMF (5 мл) добавляли безводный карбонат калия (155 мг, 1,125 ммоль), и смесь перемешивали при 85°C в течение ~17 часов. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли EtOAc (~150 мл) и промывали 1н. водным раствором NaHCO3 (30 мл). Органический слой промывали водой (30 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая желто-коричневое масло. Масло растворяли в DMF (6 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, 5%-80% MeCN за 30 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и затем концентрировали в вакууме, получая твердое вещество белого цвета. Дальнейшее высушивание этого твердого вещества в вакуумном сушильном шкафу дало 3-(1-оксо-4-((4-(((S)-2-(трифторметил)пирролидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (275 мг, 58%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 5,80 мин (99,6%); Т. пл.: 178-180°C; 1H ЯМР (ДМСО-d6) δ 1,57-1,91 (м, 3Н, CHH, CHH, CHH), 1,92-2,15 (м, 2H, CHH, CHH), 2,31-2,48 (м, 2H, CHH, CHH), 2,53-2,65 (м, 1H, CHH), 2,75-3,03 (м, 2H, CHH, CHH), 3,44-3,60 (м, 1H, CHH), 3,65 (д, J=13,6 Гц, 1H, CHH), 4,07 (д, J=13,6 Гц, 1H, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д,J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,7 Гц, 4H, Ar), 7,40-7,54 (м, 3Н, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 24,12, 25,84, 31,18, 45,04, 51,55, 53,56, 59,08, 62,79 (кв, J=27,5 Гц, CCF3), 69,38, 114,94, 115,20, 127,66 (кв, J=280,6 Гц, CF3), 127,71, 128,27, 129,78, 129,95, 133,28, 135,24, 139,00, 153,48, 167,99, 170,96, 172,81; LCMS: MH=502; Вычислено для C26H26F3N3O4: C, 62,27; H, 5,23; N, 8,38; F, 11,36; Найдено: С, 61,99; H, 5,17; N, 8,32; F, 11,37.
5.63 (S)-3-МЕТИЛ-3-(4-((4-(морфолинометил)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
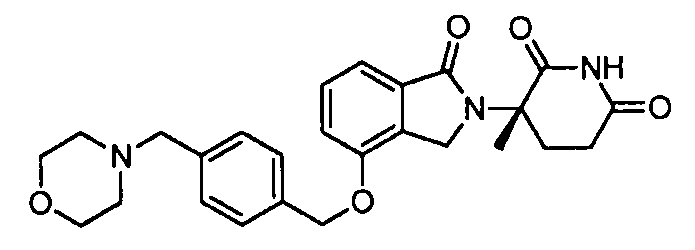
Стадия 1: (S)-3-(4-гидрокси-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-дион
К смеси 2-(бромметил)-3-(трет-бутилдиметилсилилокси)метилбензоата (4,31 г, 12 ммоль) и бромида (S)-3-метил-2,6-диоксопиперидин-3-аминия (2,68 г, 12,00 ммоль) в ацетонитриле (100 мл) добавляли DIEA (3,4 г, 26,4 ммоль). Смесь нагревали до 60°C в течение 48 часов. Затем добавляли 50 мл AcOH и смесь нагревали до 80°C. Через 15 минут смесь упаривали, чтобы удалить ацетонитрил, и оставшийся раствор уксусной кислоты нагревали с обратным холодильником. Через 1 час смесь охлаждали до температуры окружающей среды и фильтровали, и фильтр промывали уксусной кислотой (30 мл) и водой (50 мл) и высушивали под вакуумом, получая 2,6 г (79%) как твердое вещество белого цвета. 1H ЯМР (ДМСО-d6) δ 1,68 (с, 3H), 1,81-1,97 (м, 1H), 2,51-2,84 (м, 3H), 4,48 (д, J=17,2 Гц, 1H), 4,59 (д, J=17,4 Гц, 1H), 7,00 (д, J=7,9 Гц, 1H), 7,09 (д, J=7,4 Гц, 1H), 7,31 (т, J=7,7 Гц, 1H), 10,13 (с, 1H), 10,85 (с, 1H).
Стадия 2: (S)-3-(4-((4-(бромметил)бензил)окси)-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-дион
Смесь (S)-3-(4-гидрокси-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-диона (0,3 г, 1,094 ммоль), 1,4-бис(бромметил)бензола (0,866 г, 3,28 ммоль) и карбоната натрия (0,116 г, 1,094 ммоль) в DMF (10 мл) перемешивали при температуре окружающей среды под азотом в течение 16 часов. Смесь разделяли между водой (75 мл) и этилацетатом (75 мл), и органическую фазу упаривали под вакуумом. Остаток хроматографировали, используя градиент метиленхлорид-метанол. Продукт элюировали в 2% MeOH. После высушивания выход составил 190 мг (38%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,69 (с, 3Н), 1,82-1,94 (м, 1H), 2,52-2,76 (м, 3H), 4,50-4,76 (м, 4H), 5,27 (с, 2H), 7,26 (дд, J=7,8, 18,2 Гц, 2H), 7,39-7,59 (м, 5H), 10,84 (с, 1H).
Стадия 3: (S)-3-метил-3-(4-((4-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
(S)-3-(4-(4-(Бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-дион (100 мг, 0,219 ммоль) растворяли в ацетонитриле (5 мл) и добавляли морфолин (0,021 мл, 0,241 ммоль) и DIEA (0,046 мл, 0,262 ммоль). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Затем смесь разделяли между EtOAc (50 мл) и водой (50 мл), и органическую фазу промывали водой (50 мл) и затем экстрагировали 1н. HCl (2×50 мл). Объединенные кислые водные экстракты промывали EtOAc (2×50 мл) и затем подщелачивали добавлением твердого карбоната натрия, и затем экстрагировали EtOAc (2×50 мл). Объединенные органические экстракты высушивали (MgSO4) и упаривали, обеспечивая 90 мг как твердое вещество белого цвета, при 89%-ом выходе; Т. пл. 178-180°C. ВЭЖХ: Waters X-Terra, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 5/95-95/5 CH3CN-0,1% NH4 (HCO2) в течение 5 мин, затем 10 мин 95/5 CH3CN-0,1% NH4(HCO2): 4,63 (96,34%). 1H ЯМР (ДМСО-d6) δ 1,68 (с, 3Н), 1,83-1,93 (м, 1H), 2,28-2,40 (м, 4H), 2,52-2,80 (м, 3H), 3,46 (с, 2H), 3,51-3,62 (м, 4H), 4,55 (д, J=17,8 Гц, 1H), 4,68 (д, J=17,8 Гц, 1H), 5,24 (с, 2H), 7,22 (д, J=7,4 Гц, 1H), 7,27-7,38 (м, 3H), 7,40-7,50 (м, 3H), 10,85 (с, 1H). 13C ЯМР (ДМСО-d6) δ 20,68, 27,77, 29,01, 45,60, 53,15, 57,19, 62,10, 66,17, 69,39, 114,79, 127,71, 129,01, 129,74, 129,98, 133,91, 135,28, 137,72, 153,35, 167,00, 172,47, 173,53, Вычислено для C26H29N3O5+2,0 H2O: C, 62,51%; H, 6,66%; N, 8,41%; Найдено: С, 62,52%; H, 6,29%; N, 8,19%.
5.64 3-(4-((1,5-ДИМЕТИЛ-1Н-ПИРАЗОЛ-3-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
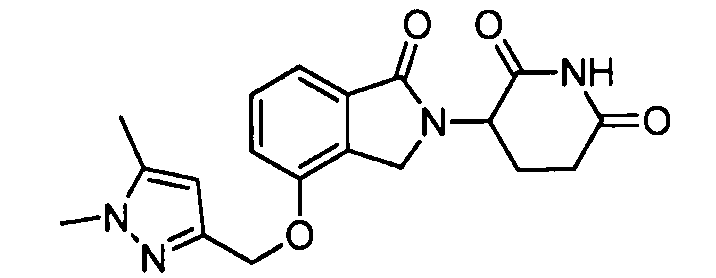
Стадия 1: К раствору 1,5-диметил-1Н-пиразол-3-метилкарбоксилата (1 г, 6,49 ммоль) в THF (20 мл) при 0°C добавляли dibal-Н (1 М в толуоле, 19,46 мл, 19,46 ммоль), смесь перемешивали при температуре окружающей среды в течение ночи. К раствору добавляли соли Рочелла (1,0 М, 50 мл), затем этилацетат (50 мл), полученную суспензию перемешивали при температуре окружающей среды, пока не было достигнуто четкое разделение фаз, органическую фазу отделяли, и водную фазу экстрагировали EtOAc (3×40 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (5 мл) и солевым раствором, высушивали над MgSO4 и концентрировали, получая (1,5-диметил-1Н-пиразол-3-ил)метанол (700 мг, 86%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,20 (с, 3Н, CH3), 3,63 (с, 3Н, СН3), 4,29 (д, J=5,9 Гц, 2H, CH2), 4,84 (т, J=5,8 Гц, 1H, OH), 5,93 (с, 1H, Ar).
Стадия 2: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,96 г, 6,34 ммоль) при 0°C добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (927 мг, 3,17 ммоль) в THF (30 мл) с последующим добавлением диизопропил азодикарбоксилата (1,28 г, 6,34 ммоль), после перемешивания в течение 10 минут добавляли (1,5-диметил-1Н-пиразол-3-ил)метанол (400 мг, 3,17 ммоль), смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали этилацетатом (10×20 мл). Объединенный фильтрат упаривали досуха, остаток очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 5-амино-4-(4-((1,5-диметил-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (340 мг 27%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,99-2,29 (м, 7H, СН2, СН2, СН3), 3,50 (с, 3Н, СН3), 3,70 (с, 2Н, СН3), 4,26-4,57 (м, 2Н, СН2), 4,70 (с, 1Н, СН), 5,06 (с, 2Н, СН2), 6,14 (с, 1Н, Ar), 7,18 (уш.с, 1Н, NHH), 7,27 (д, J=7,2 Гц, 1H, Ar), 7,32-7,40 (м, 1H, Ar), 7,41-7,50 (м, 1H, Ar), 7,57 (с, 1H, NHH).
Стадия 3: К раствору 5-амино-4-(4-((1,5-диметил-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (340 мг, 0,849 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (105 мг, 0,934 ммоль). Смесь нагревали до температуры окружающей среды и перемешивали при температуре окружающей среды в течение 1 часа. HCl (1н., 1,5 мл) добавляли для остановки реакции, растворитель выпаривали, остаток разделяли между этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (5 мл). Органический слой отделяли, промывали солевым раствором, высушивали над сульфатом магния, растворитель удаляли под вакуумом, остаток растворяли в этилацетате (3 мл), гексаны (5 мл) добавляли по каплям, сформированный осадок собирали фильтрацией, получая 3-(4-((1,5-диметил-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (150 мг, 48%-ый выход); Т. пл.: 214-216°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,04 (м, 1H, CHH), 2,22 (с, 3Н, СН3), 2,34-2,48 (м, 1Н, CHH), 2,53-2,67 (м, 1Н, CHH), 2,80-3,01 (м, 1H, CHH), 3,70 (с, 3Н, СН3), 4,11-4,43 (м, 2H, CH2), 5,00-5,18 (м, 3Н, СН, СН2), 6,13 (с, 1Н, Ar), 7,31 (д, J=12 Гц, 1H, Ar), 7,35-7,43 (м, 1H, Ar), 7,43-7,59 (м, 1H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 10,62, 22,31, 31,19, 35,78, 45,07, 51,55, 64,00, 104,81, 114,93, 115,07, 129,73, 129,84, 133,21, 139,29, 145,31, 153,46, 168,00, 170,96, 172,81; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% HCOONH4 tR=4,51 (98,77%); Вычислено для C19H20N4O4+0,2 H2O: C, 61,35; H, 5,53; N, 15,06; Найдено: С, 61,29; H, 5,30; N, 14,86.
5.65 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-(тиоморфолинометил)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
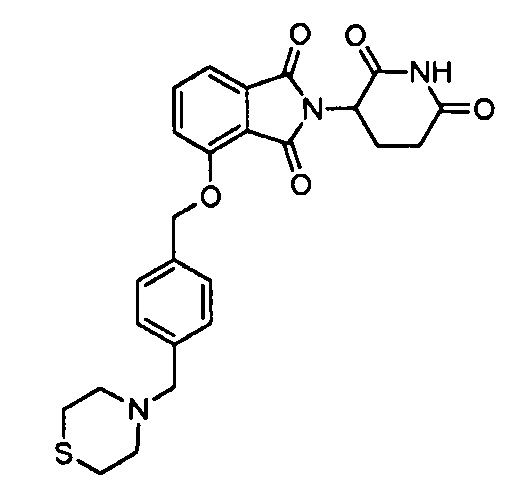
Стадия 1: 3-((4-(Гидроксиметил)бензил)окси)диметилфталат
3-Гидроксидиметилфталат (10 г, 47,6 ммоль) и (4-(хлорметил)фенил)метанол (7,82 г, 50,0 ммоль) растворяли в сухом DMF (60 мл). К раствору добавляли K2CO3 (6,90 г, 50,0 ммоль) и смесь перемешивали при 80°C в течение 16 часов. DMF удаляли в вакууме, и остаток разделяли между EtOAc (300 мл) и водой (100 мл). Органический слой промывали дополнительным количеством воды (100 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме до 3-((4-(гидроксиметил)бензил)окси)-диметилфталата в форме вязкого янтарного масла (19 г): LCMS: МН=331; сырой продукт использовали на следующей стадии без дальнейшей очистки
Стадия 2: 3-((4-(Гидроксиметил)бензил)окси)фталевая кислота
3-(4-(Гидроксиметил)бензилокси)диметилфталат (19 г фактический вес, 15,72 г, 47,6 ммоль, предполагая количественный выход с предыдущей стадии) растворяли в THF (30 мл). К раствору добавляли воду (30 мл). Добавляли водный раствор NaOH (10н., 25 мл, 250 ммоль), и смесь энергично перемешивали при 70°C в течение 2,5 часов. Смеси давали охладиться до температуры окружающей среды, концентрировали в вакууме до сиропа и затем помещали в колбу, содержащую 6н. HCl (45 мл) на льду. Твердое вещество немедленно осаждалось, и суспензию разбавляли водой (~60 мл). Смесь фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Корку промывали дополнительным количеством воды (~60 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 4 часа, получая 3-((4-(гидроксиметил)бензил)окси)фталевую кислоту в форме твердого вещества светло-желтого цвета (13,9 г, 97%-ый выход из 3-гидродиметилфталата): 1H ЯМР (ДМСО-d6) δ 4,41-4,58 (м, 2H, CH2), 5,17 (с, 3Н, СН2, ОН), 7,20-7,64 (м, 7Н, Ar), 13,02 (уш.с, 2Н, 2×СООН); 13С ЯМР (ДМСО-d6) δ 62,63, 69,73, 117,03, 121,56, 126,46, 126,88, 127,13, 128,91, 129,57, 134,87, 142,19, 154,50, 166,45, 167,71; LCMS: MH=303, 94% при 240 нм.
Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 3: 2-(2,6-диоксопиперидин-3-ил)-4-((4-(гидроксиметил)бензил)окси)изоиндолин-1,3-дион
3-Аминопиперидин-2,6-дион гидрохлорид (0,915 г, 5,56 ммоль) добавляли к раствору 3-(4-(гидроксиметил)бензилокси)фталевой кислоты (1,4 г, 4,63 ммоль) в сухом пиридине (15 мл), и смесь нагревали до 118°C в масляной бане в течение 16 часов. Темной реакционной смеси давали охладиться до температуры окружающей среды и подкисляли медленным добавлением 1н. HCl (~25 мл). Смесь далее разбавляли водой (~170 мл) и затем обрабатывали ультразвуком в течение ~30 минут, чтобы помочь разбить твердые агрегаты. Полученную темную суспензию фильтровали на воронке из спеченного стекла со средним размером пор, и темное твердое вещество промывали дополнительным количеством воды (70 мл). Корку высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 2,5 часа, получая 1,6 г твердого вещества темно-синего цвета. Это твердое вещество растворяли в смеси DCM, MeCN и MeOH (~100 мл каждый) и обрабатывали активированным углем для обесцвечивания. Смесь перемешивали и затем фильтровали под действием силы тяжести с использованием фильтровальной бумаги. Фильтрат/смывы (темно-янтарного цвета) обрабатывали еще раз с обесцвечиванием активированным углем и затем фильтровали на слое целита. Прозрачный фильтрат концентрировали в вакууме досуха, получая твердое вещество, которое растирали с водой и отсасывали. Корку промывали дополнительным количеством воды (~100 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 4 часа, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(гидроксиметил)бензил)окси)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (1,2 грамма, 68%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 5,08 мин (99,9%); Т. пл.: 250-252; 1H ЯМР (ДМСО-d6) δ 1,95-2,07 (м, 1H, CHH), 2,41-2,67 (м, 2H, СНН, CHH), 2,78-3,00 (м, 1H, CHH), 4,50 (д, J=5,1 Гц, 2H, CH2OH), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,19 (т, J=5,6 Гц, 1H, OH), 5,36 (с, 2H, CH20), 7,24-7,40 (м, 2H, Ar), 7,41-7,53 (м, 3H, Ar), 7,59 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,88, 30,83, 48,67, 62,53, 69,91, 115,40, 116,52, 120,18, 126,44, 127,09, 133,17, 134,31, 136,86, 142,32, 155,42, 165,21, 166,68, 169,81, 172,66, LCMS: M+Na=417; MH отсутствует при положительной ионизации; Вычислено для C21H18N2O6: С, 63,96; H, 4,60; N, 7,10; Найдено: С, 63,77; H, 4,52; N, 7,32.
Стадия 4: 4-((4-(Бромметил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион
Суспензию 2-(2,6-диоксопиперидин-3-ил)-4-(4-(гидроксиметил)бензилокси)изоиндолин-1,3-диона (1,05 г, 2,66 ммоль) в смеси DCM и MeCN (25 мл, 10 мл) перемешивали в ванне со льдом. К смеси добавляли PBr3 (0,502 мл, 5,32 ммоль) в одной части. Через 5 минут ванну со льдом удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение ~20 часов. К реакционной смеси добавляли NaBr (0,822 г, 7,99 ммоль) и тетрабутиламмония бромид (0,077 г, 0,240 ммоль), и перемешивание продолжали в течение дополнительных 14 часов при температуре окружающей среды. Реакционную смесь концентрировали в вакууме до твердого вещества грязно-белого цвета, и это твердое вещество ресуспендировали в воде с энергичным перемешиванием и затем фильтровали (на воронке из спеченного стекла со средним размером пор). Корку промывали обильно водой (~250 мл, полный объем фильтрата и смывов) и затем высушивали в вакуумном сушильном шкафу при 50°C, получая 4-((4-(бромметил)бензил)-окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион как твердое вещество белого цвета (1,21 г, 99%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,85 мин (99,5%); 1H ЯМР (ДМСО-d6) δ 1,94-2,15 (м, 1H, CHH), 2,42-2,70 (м, 2H, CHH, CHH), 2,79-2,99 (м, 1H, CHH), 4,72 (с, 2H, CH2), 5,10 (дд, J=5,4, 12,9 Гц, 1H, CH), 5,38 (с, 2H, CH2), 7,38-7,54 (м, 5H, Ar), 7,59 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,3, 8,4 Гц, 1H, Ar), 11,11 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 21,95, 30,91, 34,12, 48,75, 69,64, 115,57, 116,62, 120,18, 127,48, 129,42, 133,26, 136,33, 136,99, 137,72, 155,37, 165,27, 166,73, 169,87, 172,72; LCMS: M+Na=479, 481; MH отсутствует.
Стадия 5: 2-(2,6-Диоксопиперидин-3-ил)-4-((4-(тиоморфолинометил)бензил)окси)изоиндолин-1,3-дион
К жидкому раствору 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) в MeCN (10 мл) добавляли тиоморфолин (62,1 мг, 0,601 ммоль), затем DIEA (0,143 мл, 0,820 ммоль). Полученную суспензию перемешивали при температуре окружающей среды. Реакционная смесь стала прозрачной после ~15 минут перемешивания, и затем постепенно твердые частицы осаждались из раствора. После ~2 часов реакционную смесь обрабатывали большим количеством DIEA (0,143 мл, 0,820 ммоль), и суспензию нагревали до 80°C с длительным перемешиванием в течение ~1 часа. Смеси медленно давали охладиться до температуры окружающей среды при аккуратном перемешивании. Через 2 часа суспензию фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Остаточное твердое вещество в реакционной ампуле промывали на воронке минимальным количеством MeCN (1 мл). Корку промывали водой (3×10 мл). Оставшееся твердое вещество высушивали в вакуумном сушильном шкафу при 60ºC в течение 4 часов, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(тиоморфолинометил)-бензил)окси)изоиндолин-1,3-дион как твердое вещество белого цвета (225 мг, 86%): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 18/82 CH3CN/0,1% H3PO4, 6,96 мин (99,3%); Т. пл.: 221-223°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,10 (м, 1H, CHH), 2,41-2,66 (м, llH, 4×CH2, 3×CHH), 2,80-2,97 (м, 1H, CHH), 3,50 (с, 2H, CH2N), 5,09 (дд, J=5,3, 12,8 Гц, 1H, CH), 5,35 (с, 2H, CH20), 7,26-7,40 (м, 2H, Ar), 7,42-7,53 (м, 2H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,21, 26,38, 30,16, 47,99, 53,65, 61,49, 69,19, 114,75, 115,82, 119,45, 126,52, 128,12, 132,51, 134,00, 136,23, 137,16, 154,78, 164,55, 166,00, 169,13, 171,98; LCMS: MH=480; Вычислено для C25H25N3O5S+0,28 H20: С, 61,96; H, 5,32; N, 8,67; S, 6,62; Найдено: С, 61,97; H, 5,12; N, 8,63; S, 6,55.
5.66 3-(4-((6-(морфолинометил)ИМИДАЗО[1,2-A]ПИРИДИН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
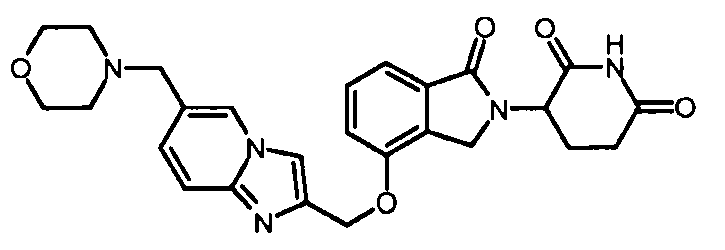
Стадия 1: 3-Бром-2-оксоэтилпропаноат (9,0 г, 46,2 ммоль) добавляли к перемешиваемому раствору 5-метилпиридин-2-амина (5,0 г, 46,2 ммоль) в этаноле (50 мл). Полученную смесь нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали и концентрировали. Остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (40 мл), водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 20% EtOAc/CH2Cl2 в течение 20 минут, затем до 100% EtOAc за 30 минут), получая 6-метилимидазо[1,2-a]пиридин-2-этилкарбоксилат (3,8 г, 40%): 1H ЯМР (CDCl3) δ 1,44 (т, J=6 Гц, 3H), 2,33 (с, 3H), 4,42-4,49 (кв, J=6 Гц, 2H), 7,07-7,11 (дд, J=3 и 12 Гц, 1H), 7,56-7,59 (д, J=9 Гц, 1H), 7,90-7,91 (д, J=3 Гц, 1H), 8,10 (с, 1H).
Стадия 2: Смесь 6-метилимидазо[1,2-a]пиридин-2-этилкарбоксилата (3,7 г, 18,2 ммоль) и N-бромсукцинимида (3,2 г, 18,2 ммоль) в метилацетате (50 мл) нагревали при 60°C на масляной бане с облучением реакционной смеси 300-Вт лампой в течение 3 часов. Реакционную смесь охлаждали и разбавляли EtOAc (50 мл), и промывали водой (2×35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 20%-ый EtOAc/CH2Cl2 в течение 25 минут), получая 3-бром-6-метилимидазо[1,2-a]пиридин-2-этилкарбоксилат (4,7 г, 90%): 1H ЯМР (CDCl3) δ 1,46 (т, J=6 Гц, 3Н), 2,41 (с, 3Н), 4,45-4,52 (кв, J=6 Гц, 2H), 7,16-7,19 (дд, J=3 и 9 Гц, 1H), 7,58-7,61 (д, J=9 Гц, 1H), 7,98 (с, 1H); 13C ЯМР (CDCl3) δ 14,41, 18,45, 61,35, 99,75, 118,46, 121,90, 124,57, 129,95, 133,55, 144,27, 162,45.
Стадия 3: Смесь 3-бром-6-метилимидазо[1,2-a]пиридин-2-этилкарбоксилата (4,5 г, 15,8 ммоль), N-бромсукцинимида (2,8 г, 17,8 ммоль) и 2,2'-азобисизобутиронитрила (0,6 г) в CCl4 (75 мл) нагревали при 75°C на масляной бане с облучением 300-Вт лампой реакционной смеси в течение 3 часов. Реакционную смесь охлаждали и фильтровали и промывали твердое вещество CH2Cl2 (40 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали водой (2×30 мл), солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 10% EtOAc/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 20% за 5 минут и поддерживали в течение 15 минут), получая 3-бром-6-(бромметил)имидазо[1,2-a]пиридин-2-этилкарбоксилат (2,5 г, 44%);1H ЯМР (CDCl3) δ 1,47 (т, J=6 Гц, 3H), 4,46-4,52 (кв, J=6 Гц, 2H), 4,54 (с, 2H), 7,35-7,39 (дд, J=3 и 9 Гц, 1H), 7,68-7,71 (д, J=9 Гц, 1H), 8,23 (с, 1H); l3C ЯМР (CDCl3) δ 14,35, 29,60, 61,54, 100,79, 119,60, 123,28, 125,38, 128,28, 134,56, 144,45, 162,09.
Стадия 4: Раствор 3-бром-6-(бромметил)имидазо[1,2-a]пиридин-2-этилкарбоксилата (2,4 г, 6,7 ммоль) в ацетоне (50 мл) и DMF (40 мл) добавляли к перемешиваемой смеси морфолина (0,9 г, 10,1 моль), карбоната калия (3,3 г, 23,6 ммоль) и каталитического количества 18-crown-6 в ацетоне (50 мл) при 60°C на масляной бане. Реакционную смесь перемешивали при 60°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат концентрировали, и остаток растворяли в EtOAC (100 мл) и промывали водой (2×35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и твердый остаток перемешивали с простым эфиром, получая 3-бром-6-(морфолинометил)имидазо[1,2-a]пиридин-2-этилкарбоксилат (1,4 г, 55%): 1H ЯМР (CDCl3) δ 1,47 (т, J=6 Гц, 3H), 2,48-2,51 (м, 4H), 3,55 (с, 2H), 3,72-3,75 (м, 4H), 4,46-4,53 (кв, J=6 Гц, 2H), 7,39-7,42 (д, J=9 Гц, 1H), 7,63-7,66 (д, J=9 Гц, 1H), 8,12 (с, 1H).
Стадия 5: LiAlH4/THF (1M, 3,9 мл, 3,9 ммоль) медленно добавляли к перемешиваемому раствору 3-бром-6-(морфолинометил)имидазо[1,2-a]пиридин-2-этилкарбоксилата (1,2 г, 3,3 ммоль) в THF (40 мл) при 0-5°C. Реакционную смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь гасили водой (1 мл), 2н. NaOH (1 мл), водой (4 мл). Смесь фильтровали и твердое вещество промывали CH2Cl2 (40 мл). Фильтрат промывали солевым раствором (35 мл) и высушивали. Растворитель удаляли, получая (6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метанол (0,6 г, 75%): 1H ЯМР (CDCl3) δ 2,45-2,50 (м, 4H), 3,46 (с, 2H), 3,70-3,74 (м, 4H), 4,84 (с, 2H), 7,19-7,22 (дд, J=3 и 9 Гц, 1H), 7,47-7,52 (м, 2H), 8,02 (с, 1H).
Стадия 6: Связку трифенилфосфин-полимер (2,5 г, 3,4 ммоль) в THF (30 мл) охлаждали в ванне со льдом до 3°C. Диизопропил азадикарбоксилат (0,6 г, 3,2 ммоль) медленно добавляли при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 2,3 ммоль) и (6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метанола (0,6 г, 2,3 ммоль) в THF (70 мл) медленно добавляли при 5-10°C. После перемешивания в течение 5 минут, ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и фильтрат концентрировали. Остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (35 мл), водой (35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут, затем до 10% за 5 минут и поддерживали в течение 10 минут), получая 5-амино-4-(4-((6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,5 г, 43%).
Стадия 7: Раствор 5-амино-4-(4-((6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 0,9 ммоль) в THF (15 мл) охлаждали в ванне сухой лед/ацетон в течение 5 мин Добавляли раствор трет-бутоксид калия/THF (1M, 1,0 мл, 1,0 ммоль). Реакционную смесь перемешивали при -78°C в ванне в течение 1 часа. Реакционную смесь гасили 1н. HCl (3 мл) и нагревали до температуры окружающей среды. Добавляли воду (20 мл) и подщелачивали насыщ. NaHCO3 (8 мл) до pH=8. Смесь экстрагировали CH2Cl2 (3×30 мл), и объединенный органический раствор промывали солевым раствором (25 мл) и высушивали. Растворитель удаляли, и остаток осаждали простым эфиром, получая 3-(4-((6-(морфолинометил)имидазо[1,2-a]пиридин-2ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,4 г, 83%): Т. пл. 155-157°C; 1H ЯМР (ДМСО-d6) δ 1,97-2,01 (м, 1H), 2,36-2,39 (м, 4H), 2,39-2,60 (м, 2H), 2,85-2,96 (м, 1H), 3,44 (с, 2H), 3,55-3,58 (м, 4H), 4,20-4,26 (д, J=18 Гц, 1H), 4,36-4,41 (д, J=18 Гц, 1H), 5,08-5,14 (дд, J=6 и 12 Гц, 1H), 5,34 (с, 2H), 7,21-7,24 (м, 1H), 7,31-7,33 (д, J=9 Гц, 1H), 7,46-7,51 (м, 3H), 8,02 (с, 1H), 8,43 (с, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,36, 31,18, 45,06, 51,55, 52,97, 59,13, 64,61, 66,13, 111,89, 115,03, 115,18, 116,24, 122,06, 125,67, 126,91, 129,77, 133,27, 141,58, 143,90, 153,45, 167,99, 170,96, 172,81; Вычислено для C26H27N505+0,2CH2Cl2: С, 62,13; H, 5,45; N, 13,83, Найдено: С, 62,16; H, 5,74; N,13,13.
5.67 3-{4-[4-(3,4-ДИГИДРО-1Н-ISOХИНОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
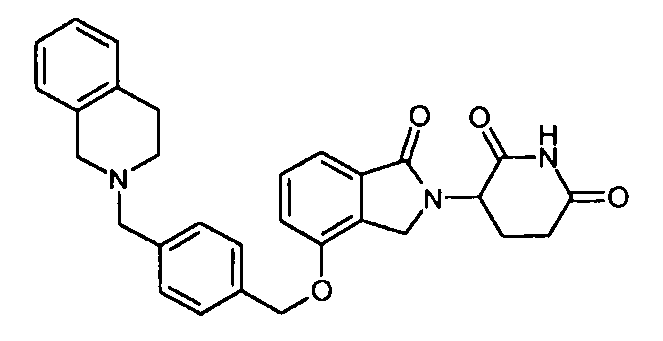
Стадия 1: Получение метилового эфира 4-карбамоил-4-{4-[4-(3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,37 г, 0,778 ммоль) в CH3CN добавляли 1,2,3,4-тетрагидроизохинолин (0,124 г, 0,934 ммоль) и DIPEA (0,272 мл, 1,557 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали, затем экстрагировали CH2Cl2 и водой. Органический слой концентрировали и получали метиловый эфир 4-карбамоил-4-{4-[4-(3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (0,4 г, 97%). Его использовали непосредственно на следующей стадии.
Стадия 2: Получение 3-{4-[4-(3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К раствору 5-амино-4-(4-(4-((3,4-дигидроизохинолин-2(1H)-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,4 г, 0,758 ммоль) в CH3CN при 0°C добавляли трет-бутоксид калия (0,094 г, 0,834 ммоль). Смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь гасили, добавляя 5 мл 1н. HCl, затем NaHCO3 (насыщ., 5 мл). К смеси добавляли CH2Cl2 (20 мл), воду (20 мл) и экстрагировали. Органический слой концентрировали и получали твердое вещество белого цвета. Это твердое вещество повторно кристаллизовали из 4 мл CH3CN, получая 170 мг твердого вещества белого цвета (45%). Т.пл.: 173-175°C. LCMS m/e=496. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H20 в течение 5 мин и остановка при 95/5 на 5 мин: 6,43 мин (97%). 1H ЯМР (ДМСО-d6) δ 1,86-2,11 (м, 1H, CHH), 2,35-2,48 (м, J=4,4, 13,3 Гц, 1H, CHH), 2,52-2,62 (м, 1H, CHH), 2,63-2,74 (м, 2H, CH2), 2,74-2,84 (м, 2H, CH2), 2,84-3,02 (м, 1H, CHH), 3,54 (с, 2H, CH2), 3,65 (с, 2H, CH2), 4,13-4,54 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,82-7,20 (м, 4H, Ar), 7,26-7,68 (м, 7H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 28,64, 31,20, 45,10, 50,16, 51,58, 55,40, 61,48, 69,44, 114,98, 115,23, 125,43, 125,94, 126,32, 127,72, 128,41, 128,82, 129,82, 129,95, 134,05, 134,69, 135,29, 138,10, 153,51, 170,98, 172,83. Вычислено для C30H29N304+0,3 H20; C% 71,92; H% 5,96; N% 8,39; Найдено:C% 71,55; H% 5,72; N% 8,22.
5.68 3-{4-[4-(2,3-ДИГИДРО-БЕНЗО[1,4]ОКСАЗИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
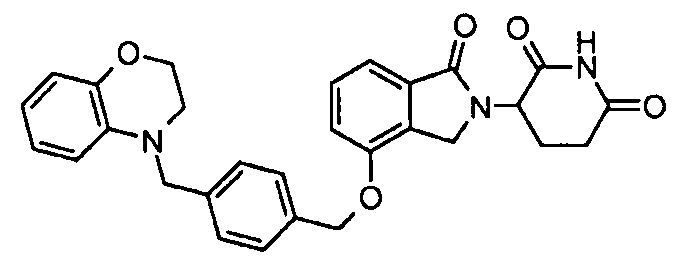
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,79 ммоль) в ацетонитриле (8 мл) при температуре окружающей среды добавляли раствор 3,4-дигидро-2H-бензо[b][1,4]оксазина (128 мг, 0,9 ммоль) в ацетонитриле (2 мл) и DIPEA (0,21 мл, 1,2 ммоль). Полученный светло-желтый раствор перемешивали при температуре окружающей среды в течение 18 часов и перемешивали при 40°C в течение 24 часов. Продукт очищали препаративной ВЭЖХ, получая 3-{4-[4-(2,3-дигидро-бензо[1,4]оксазин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (208 мг, 53%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 55/45, (CH3CN/0,1% H3PO4), 4,50 мин (99,0%); Т. пл.: 145-147°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,33-2,47 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,80-3,01 (м, 1H, CHH), 3,35-3,43 (м, 2H, CH2), 4,14-4,45 (м, 4H, CHH, CHH, CH2), 4,47 (с, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 6,44-6,56 (м, 1H, Ar), 6,57-6,76 (м, 3Н, Ar), 7,22-7,39 (м, 4H, Ar), 7,39-7,59 (м, 3Н, Ar), 10,96 (с, 1H, NHH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,16, 45,06, 47,06, 51,55, 53,57, 64,03, 69,32, 112,27, 114,91, 115,20, 115,77, 116,91, 121,24, 127,20, 127,96, 129,78, 129,95, 133,28, 135,17, 135,21, 138,23, 143,46, 153,45, 167,99, 170,95, 172,81; LCMS MH=498; Вычислено для C29H27N3O5+0,3H20: C, 69,25; H, 5,53; N, 8,35; Найдено: С, 69,01; H, 5,29; N, 8,25.
5.69 3-{4-[4-(2,3-ДИГИДРО-5Н-БЕНЗО[F][1,4]ОКСАЗЕПИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
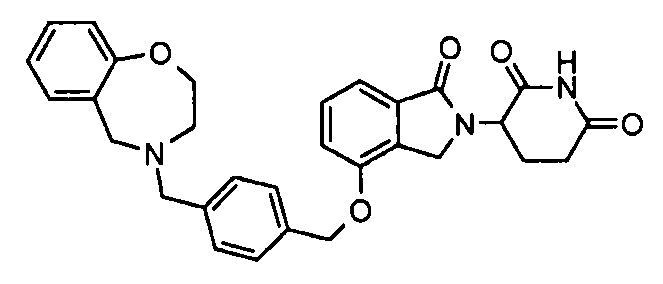
К перемешиваемому раствору 2,3,4,5-тетрагидробензо[f][1,4]оксазепина (141 мг, 0,9 ммоль) в ацетонитриле (8 мл) при температуре окружающей среды добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (350 мг, 0,79 ммоль) и DIPEA (0,21 мл, 1,1 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3,5 часов, после чего добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (30 мг, 0,07 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 17 часов, и смесь очищали препаративной ВЭЖХ, получая 3-{4-[4-(2,3-дигидро-5Н-бензо[f][1,4]оксазепин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (216 мг, 54%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 23/77, (CH3CN/0,1% H3P04), 4,16 мин (99,7%); Т. пл.: 148-150°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,57 (д, J=17,8 Гц, 1H, CHH), 2,81-3,04 (м, 3H, CH2, CHH), 3,62 (с, 2H, CH2), 3,75 (с, 2H, CH2), 3,95-4,06 (м, 2H, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,03-5,17 (м, 1H, CHH), 5,24 (с, 2H, CH2), 6,91-7,09 (м, 3H, Ar), 7,13-7,25 (м, 1H, Ar), 7,33 (д, J=7,2 Гц, 4H, Ar), 7,39-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,07, 51,55, 57,28, 57,73, 57,87, 69,41, 69,87, 115,00, 115,22, 120,38, 123,08, 127,66, 128,36, 128,68, 129,78, 129,95, 130,53, 131,62, 133,30, 135,25, 138,62, 153,48, 159,60, 167,99, 170,96, 172,81; LCMS MH=512; Вычислено для C30H29N3O5+O,4H2O: С, 69,46; H, 5,79; N, 8,10; Найдено: С, 69,25; H, 5,53; N, 8,35.
5.70 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-(морфолинометил)ТИАЗОЛ-2-ИЛ)МЕТОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
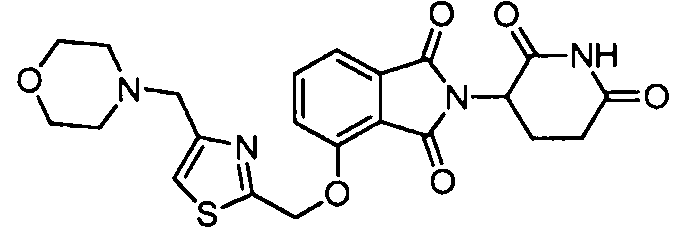
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,5 г, 5,6 ммоль) при 0°C добавляли к перемешиваемому раствору 3-гидроксидиметилфталата (647 мг, 3,08 ммоль) в THF (30 мл), с последующим добавлением диизопропил азодикарбоксилата (1,13 г, 5,6 ммоль), после перемешивания в течение 10 минут добавляли (4-(морфолинометил)тиазол-2-ил)метанол (600 мг, 2,80 ммоль), смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали этилацетатом (10×30 мл). Объединенные органические слои упаривали под вакуумом. Остаток очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 50 минут), получая 3-((4-(морфолинометил)тиазол-2-ил)метокси)диметилфталат (800 мг, 70%-ый выход).
Стадия 2: Смесь 3-((4-(морфолинометил)тиазол-2-ил)метокси)диметилфталата (320 мг, 0,787 ммоль) и гидроксида натрия (10 мл, 30,0 ммоль) в этаноле (20 мл) нагревали с обратным холодильником в течение 1 часа. Реакционную смесь упаривали досуха под вакуумом, добавляли воду (20 мл), смесь экстрагировали этилацетатом (2×10 мл), водный слой отделяли и подкисляли HCl (3н., 15 мл), затем упаривали под вакуумом досуха. Сырой продукт использовали для следующей стадии без дальнейшей очистки.
Стадия 3: Смесь 3-((4-(морфолинометил)тиазол-2-ил)метокси)фталевой кислоты (298 мг, 0,787 ммоль) и 3-аминопиперидин-2,6-дион гидрохлорида (155 мг, 0,944 ммоль) в пиридине (20 мл) нагревали с обратным холодильником в течение ночи. Пиридин выпаривали досуха под вакуумом, остаток разделяли между насыщенным раствором бикарбоната натрия (20 мл) и этилацетатом (50 мл), органический слой отделяли, промывали солевым раствором, высушивали над сульфатом магния, растворитель выпаривали, и продукт очищали препаративной ВЭЖХ (условия градиента: 0-20% ацетонитрила в воде, 0,1% муравьиной кислоты за 15 минут), получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(морфолинометил)тиазол-2-ил)метокси)изоиндолин-1,3-дион (39 мг, 11%-ый выход); Т. пл.: 210-212°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,14 (м, 1H, CHH), 2,42 (д, J=4,2 Гц, 5H, CHH, CH2, CH2), 2,55-2,65 (м, 1H, CHH), 2,77-3,02 (м, 1H, CHH), 3,49-3,58 (м, 4H, CH2, CH2), 3,60 (с, 2H, CH2), 4,95-5,22 (м, 1H, CH), 5,66 (с, 2H, CH2), 7,44-7,58 (м, 2H, Ar), 7,65 (д, J=8,5 Гц, 1H, Ar), 7,83 (д, J=7,7 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,93, 30,90, 48,78, 52,99, 57,52, 66,11, 67,56, 116,18, 116,82, 118,28, 120,45, 133,26, 136,97, 152,88, 154,60, 164,44, 165,07, 166,64, 169,84, 172,72; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% HCOONH4 tR=4,34 (99,30%); Вычислено для C23H24N4O8S: C, 53,48; H, 4,68; N, 10,85; Найдено: C, 49,86; H, 4,42; N, 10,50.
5.71 3-(4-((1-МЕТИЛ-5-(морфолинометил)-1Н-ПИРАЗОЛ-3-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
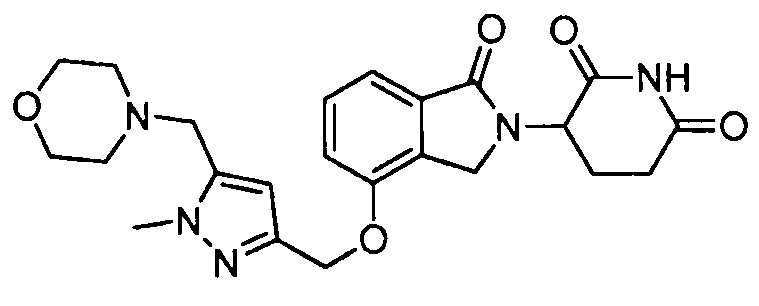
Стадия 1: В круглую колбу на 250 мл загружали 1,5-диметил-1Н-пиразол-3-метилкарбоксилат (2 г, 12,97 ммоль), NBS (2,309 г, 12,97 ммоль), AIBN (0,213 г, 1,297 ммоль), а также CCl4 (40 мл, 415 ммоль). Смесь нагревали с обратным холодильником под азотом в течение ночи. Реакционную смесь охлаждали, твердое вещество фильтровали, фильтрат упаривали досуха, остаток очищали ISCO (120 г колонка, градиент этилацетат/гексаны от 0% до 30% за 50 минут, 30% 30 минут), получая 5-(бромметил)-1-метил-1Н-пиразол-3-метилкарбоксилат (500 мг, 17%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 3,93 (с, 3Н, CH3), 3,99 (с, 3Н, СН3), 4,47 (с, 2Н, СН2), 6,83 (с, 1Н, Ar).
Стадия 2: К раствору 5-(бромметил)-1-метил-1Н-пиразол-3-метилкарбоксилата (500 мг, 2,145 ммоль) в ацетонитриле (30 мл) добавляли морфолин (0,280 мл, 3,22 ммоль) и триэтиламин (0,449 мл, 3,22 ммоль). Смесь перемешивали при температуре окружающей среды в течение 7 часов. Растворитель выпаривали досуха, остаток разделяли между этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (20 мл), органический слой промывали солевым раствором, высушивали над сульфатом магния, растворитель выпаривали, получая 1-метил-5-(морфолинометил)-1Н-пиразол-3-метилкарбоксилат (450 мг, 88%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 2,45 (уш.с, 4H, CH2, CH2), 3,52 (уш.с, 2H, CH2), 3,70 (уш.с, 4H, CH2, СН2), 3,93 (с, 3Н, СН3), 4,00 (с, 3Н, СН3), 6,54-6,87 (м, 1Н, Ar).
Стадия 3: К смеси 1-метил-5-(морфолинометил)-1Н-пиразол-3-метилкарбоксилата (450 мг, 1,881 ммоль) в THF (15 мл) при 0°C добавляли Dibal-Н (5,64 мл, 5,64 ммоль). Сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали под вакуумом, остаток разделяли между солью Рочелла (1,0 М, 10 мл) и этилацетатом (50 мл), органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (5 мл) и солевым раствором, высушивали (MgSO4) и концентрировали, получая (1-метил-5-(морфолинометил)-1Н-пиразол-3-ил)метанол (300 мг, 76%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 2,47 (уш.с, 4H, CH2, CH2), 3,52 (уш.с, 2H, CH2), 3,72 (д, J=2,1 Гц, 4H, CH2, CH2), 3,90 (с, 3H, CH3), 4,65 (с, 2H, CH2), 6,17 (уш.с, 1H, Ar).
Стадия 4: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,78 г, 2,84 ммоль) добавляли при 0°C к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (415 мг, 1,420 ммоль) в THF (30 мл), с последующим добавлением DIAD (574 мг, 2,84 ммоль), после перемешивания в течение 10 минут добавляли раствор (1-метил-5-(морфолинометил)-1Н-пиразол-3-ил)метанол (300 мг, 1,420 ммоль) в THF (10 мл), смесь перемешивали при температуре окружающей среды в течение ночи. Смолуа фильтровали и промывали этилацетатом (10×30 мл). Объединенный фильтрат упаривали досуха, остаток очищали ISCO (40 г колонка, MeOH в градиенте DCM 0-5% за 40 минут), получая 5-амино-4-(4-((1-метил-5-(морфолинометил)-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (270 мг, 39%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,92-2,30 (м, 4H, CH2, СН2), 2,30-2,42 (м, 4Н, СН2, СН2), 3,49 (с, 5Н, СН2, СН3), 3,52-3,63 (м, 4Н, СН2, СН2), 3,80 (с, 3Н, СН3), 4,25-4,57 (м, 2Н, СН2), 4,25-4,57 (м, 2Н, СН2), 4,71 (дд, J=4,7, 10,2 Гц, 1H, CH), 5,09 (с, 2H, CH2), 5,02-5,19 (м, 2H, CH2), 6,27 (с, 1H, Ar), 7,18 (с, 1H, NHH), 7,28 (д, J=7,2 Гц, 1H, Ar), 7,32-7,40 (м, 1H, Ar), 7,40-7,51 (м, 1H, Ar), 7,57 (с, 1H, NHH).
Стадия 5: К раствору 5-амино-4-(4-((1-метил-5-(морфолинометил)-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (250 мг, 0,515 ммоль) в THF при 0°C добавляли трет-бутоксид калия (63,6 мг, 0,566 ммоль), сформированную смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь гасили, добавляя водный раствор HCl (1н., 1,5 мл). Растворитель удаляли под вакуумом, остаток разделяли между насыщенным раствором бикарбоната натрия (5 мл) и этилацетатом (30 мл), органический слой отделяли и промывали солевым раствором, высушивали над сульфатом магния и фильтровали, фильтрат упаривали досуха, твердое вещество ресуспендировали с простым эфиром (10 мл) и фильтровали, получая 3-(4-((1-метил-5-(морфолинометил)-1Н-пиразол-3-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (130 мг, 56%-ый выход); Т. пл.: 125-127°C; 1H ЯМР (ДМСО-d6) δ 1,99 (д, 1H, CHH), 2,35 (д, J=4,0 Гц, 4H, CH2, CH2), 2,46 (уш.с, 1H, CHH), 2,52-2,65 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 3,49 (с, 2H, CH3), 3,51-3,62 (м, 4H, CH2, CH2), 3,80 (с, 3H, CH3), 4,12-4,43 (м, 2H, CH2), 5,03-5,17 (м, 3H, CH2, CH), 6,26 (с, 1H, Ar), 7,31 (д, J=1A Гц, 1H, Ar), 7,35-7,43 (м, 1H, Ar), 7,43-7,55 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 30,38, 31,18, 36,41, 45,07, 51,55, 52,23, 52,93, 64,00, 66,08, 106,66, 115,07, 115,18, 129,74, 129,89, 133,24, 139,35, 145,27, 153,46, 167,97, 170,96, 172,81; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% HCOONH4 tR=3,31 (97,56%); Вычислено для C23H27N5O5+0,4 EtOAc: C, 60,45; H, 6,23; N, 14,33; Найдено: С, 60,10; H, 6,04; N, 14,70.
5.72 4-((4-((7,8-ДИГИДРО-1,6-НАФТИРИДИН-6(5H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИН-1,3-ДИОН
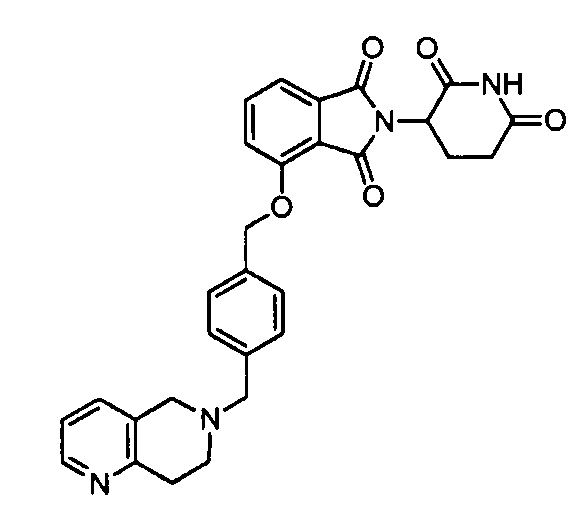
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 5,6,7,8-тетрагидро-1,6-нафтиридина (81 мг, 0,601 ммоль) в сухом MeCN (10 мл) добавляли DIEA (0,334 мл, 1,914 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение 17 часов. Реакционную смесь нагревали до 80°C с удаленным колпачком ампулы. Большая часть твердых частиц растворялась, и смесь концентрировали до ~1/2 первоначального объема. После ~2,5 часов смеси давали охладиться до температуры окружающей среды с аккуратным перемешиванием. Образовывалась густая суспензия, которую выдерживали при 4°C в течение ночи. Суспензию обрабатывали DIEA (250 мкл), и смесь перемешивали при температуре окружающей среды в течение 30 мин Суспензию затем фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием, и корку промывали водой (~30 мл). Собранное твердое вещество высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 50°C в течение 6 часов, получая 4-((4-((7,8-дигидро-1,6-нафтиридин-6(5H)-ил)метил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (275 мг, 99%): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 5,08 мин (99,9%); Т. пл.: 165-167°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,15 (м, 1H, CHH), 2,38-2,65 (м, 2H, CHH, CHH), 2,73-3,01 (м, 5H, CH2, CH2, CHH), 3,58 (с, 2H, CH2), 3,70 (с, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,37 (с, 2H, CH2O), 7,12 (дд, J=4,7, 7,7 Гц, 1H, Ar), 7,34-7,54 (м, 6H, Ar), 7,61 (д, J=8,3 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 8,33 (дд, J=1,7, 4,7 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 31,89, 48,73, 50,02, 54,26, 61,13, 69,95, 115,50, 116,58, 120,19, 120,95, 127,36, 128,84, 129,81, 133,26, 134,17, 134,87, 136,99, 138,05, 147,15, 154,38, 155,53, 165,29, 166,75, 169,87, 172,72; LCMS: MH=511; Вычислено для C29H26N4O5+0,6 H2O: C, 66,81; H, 5,26; N, 10,57; Найдено: С, 66,75; H, 5,28; N, 10,84.
5.73 3-{1-ОКСО-4-[4-(4-ФЕНИЛ-ИМИДАЗОЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
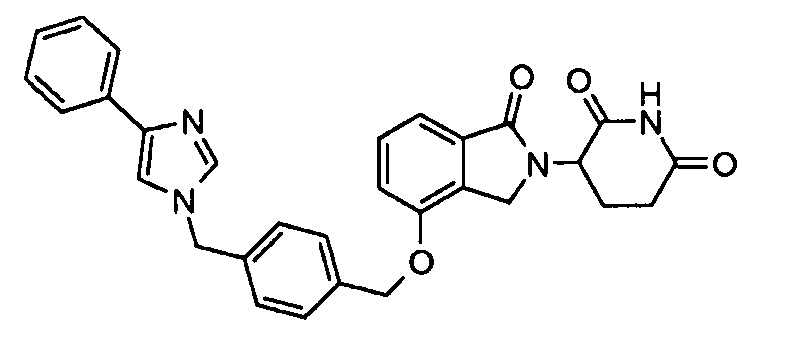
К перемешиваемому раствору 4-фенил-1Н-имидазола (179 мг, 1,2 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (500 мг, 1,1 ммоль) и DIPEA (0,30 мл, 1,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 19 часов и нагревали при 40°C в течение 7 часов, после чего добавляли EtOAc (60 мл), воду (15 мл) и солевой раствор (15 мл). Затем добавляли ацетонитрил (20 мл), чтобы растворить твердое вещество. Полученный раствор экстрагировали, и органический слой концентрировали под вакуумом. Остаток очищали ISCO, получая 3-{1-оксо-4-[4-(4-фенил-имидазол-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (190 мг, 33%-ый выход). ROESY подтвердил изомерную структуру продукта. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% Н3РО4), 4,84 мин (99,9%); Т. пл.: 246-248°C; 1H ЯМР (ДМСО-d6) δ 1,99 (уш.с, 1H, CHH), 2,33-2,47 (м, 1H, CHH), 2,53-2,60 (м, 1H, CHH), 2,81-2,99 (м, 1H, CHH), 4,23 (д, J=17,6 Гц, 1H, CHH), 4,39 (д, J=17,6 Гц, 1H, CHH), 5,09 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,23 (с, 4H, CH2, CH2), 7,12-7,23 (м, 1H, Ar), 7,23-7,39 (м, 6H, Ar), 7,39-7,54 (м, 3Н, Ar), 7,68 (д, J=1,3 Гц, 1H, имидазол H), 7,70-7,78 (м, 2H, Ar), 7,83 (д, J=1,3 Гц, 1H, имидазол H), 10,95 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,30, 31,15, 45,04, 49,45, 51,53, 69,17, 114,90, 115,23, 115,79, 124,11, 126,17, 127,63, 128,12, 128,40, 129,78, 129,93, 133,28, 134,44, 136,17, 137,45, 137,94, 140,90, 153,38, 167,96, 170,93, 172,80; LCMS MH=507; Вычислено для C30H26N404+0,1 Н2О: С, 70,88; H, 5,19; N, 11,00; Найдено: С, 70,66; H, 4,87; N, 10,83.
5.74 3-(4-((3-((4-МЕТИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)ИЗОКСАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
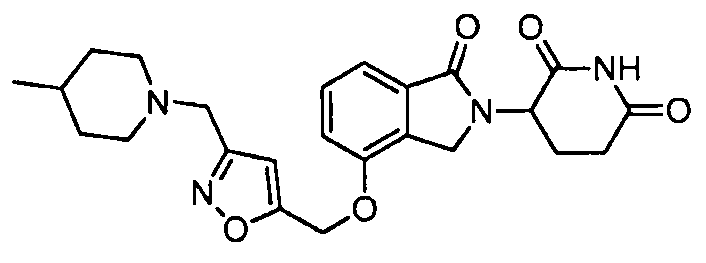
Смесь (5-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)изоксазол-3-ил)метил метансульфоната (0,25 г, 0,556 ммоль) в ацетонитриле (10 мл) охлаждали до 0°C. Добавляли 4-метилпиперидин (0,066 г, 0,668 ммоль) и TEA (0,073 г, 0,719 ммоль), ванну со льдом удаляли, и смесь перемешивали в течение 16 часов. Смесь разделяли между EtOAc (100 мл) и водой (100 мл), и органическую фазу промывали водой (100 мл). Затем органическую фазу экстрагировали 1%-ым водным раствором HCl (100 мл), и этот экстракт подщелачивали 5%-ым водным раствором Na2CO3 (50 мл) и экстрагировали в EtOAc (2×75 мл). Объединенные органические экстракты промывали водой (100 мл), высушивали (MgSO4) и упаривали, получая 180 мг (72%) твердого вещества белого цвета; Т. пл. 168-170ºC. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-90/10 CH3CN/0,1% H3PO4 за 10 мин: 4,95 (97,98%). 1H ЯМР (ДМСО-d6) δ 0,87 (д, J=6,4 Гц, 3H), 1,01-1,19 (м, 2H), 1,21-1,38 (м, 1H), 1,49-1,65 (м, 2H), 1,88-2,04 (м, 3H), 2,36-2,47 (м, 1H), 2,54-2,62 (м, 1H), 2,68-2,80 (м, 2H), 2,83-2,99 (м, 1H), 3,50 (с, 2H), 4,24 (д, J=17,6 Гц, 1H), 4,41 (д, J=17,6 Гц, 1H), 5,11 (дд, J=5,1, 13,2 Гц, 1H), 5,42 (с, 2H), 6,60 (с, 1H), 7,33-7,44 (м, 2H), 7,46-7,57 (м, 1H), 10,97 (с, 1H). 13C ЯМР (ДМСО-d6) δ 21,73, 22,33, 29,97, 31,20, 33,79, 45,05, 51,61, 52,64, 53,14, 60,72, 104,53, 115,10, 115,97, 129,85, 129,98, 133,51, 152,67, 161,56, 167,06, 167,82, 170,94, 172,82. Вычислено для C24H28N4O5+H2O: C, 61,26%; H, 6,43%; N, 11,91%; Найдено: C, 61,41%; H, 6,33%; N, 12,10%.
5.75 3-(4-((3-(морфолинометил)ИМИДАЗО[1,2-A]ПИРИДИН-6-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
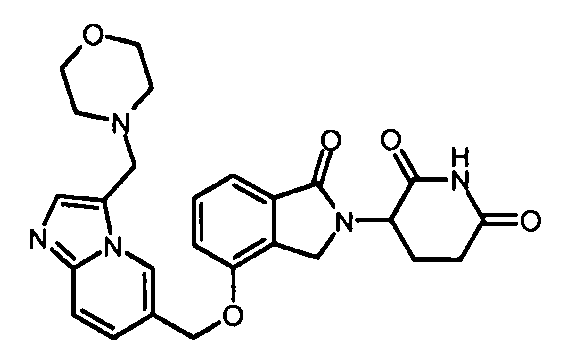
Стадия 1: Смесь 6-аминоэтилниктината (8,3 г, 49,9 ммоль) и хлорацетальдегида (50% в воде, 15,7 г, 99,9 ммоль) в CH3CN (200 мл) нагревали с обратным холодильником в течение 17 часов. Реакционную смесь охлаждали и концентрировали. Остаток перемешивали с CH2Cl2 (100 мл) и подщелачивали насыщ. NaHCO3 (120 мл). Водный слой экстрагировали CH2Cl2 (2×40 мл), и объединенный раствор CH2Cl2 промывали водой (50 мл), солевым раствором (50 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 мин и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая имидазо[1,2-a]пиридин-6-этилкарбоксилат (8,3 г, 87%): 1H ЯМР (CDCl3) δ 1,42 (т, J=6 Гц, 3H), 4,38-4,45 (кв, J=6 Гц, 2H), 7,61-7,75 (м, 4H), 8,93 (с, 1H); 13C ЯМР (CDCl3) δ 14,33, 61,48, 113,49, 116,89, 117,13, 124,09, 130,02, 135,33, 145,93, 164,87.
Стадия 2: Смесь имидазо[1,2-a]пиридин-6-этилкарбоксилата (2,9 г, 15,4 ммоль), 37%-го водного раствора формальдегида (1,3 г, 15,4 ммоль) и морфолина (1,4 г, 15,4 ммоль) в ледяной уксусной кислоте (5 мл) нагревали при 50°C в течение 3 часов, затем перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли CH2Cl2 (40 мл) и подщелачивали 2н. NaOH до pH=8. Водный слой экстрагировали CH2Cl2 (2×40 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, получая 3-(морфолинометил)имидазо[1,2-a]пиридин-6-этилкарбоксилат (4,1 г, 92%): 1H ЯМР (CDCl3) δ 1,36 (т, J=6 Гц, 3Н), 2,37-2,40 (м, 4Н), 3,54-3,57 (м, 4Н), 3,92 (с, 2Н), 4,33-4,40 (кв, J=6 Гц, 2H), 7,63-7,65 (м, 3H), 9,18-9,19 (д, J=3 Гц, 1H); 13C ЯМР (CDCl3) δ 14,07, 51,06, 52,81, 60,99, 66,18, 115,12, 116,58, 121,62, 122,95, 129,67, 134,98, 145,71, 164,47.
Стадия 3: Раствор 3-(морфолинометил)имидазо[1,2-a]пиридин-6-этилкарбоксилата (4,1 г, 14,2 ммоль) в THF (50 мл) охлаждали в ванне со льдом. Медленно добавляли раствор литий-три-трет-бутоксиалюминий гидрид/THF (1M, 29 мл, 29 ммоль). После перемешивания в течение 5 минут, ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь охлаждали и гасили водой (1,5 мл), 2н. NaOH (1,5 мл) и водой (4,5 мл). Смесь фильтровали, и фильтр промывали CH2Cl2 (100 мл). Фильтрат промывали насыщ. NaHCO3 (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 3% CH3OH/CH2Cl2 в течение 10 минут, затем до 10% за 10 минут и поддерживали в течение 30 минут), получая (3-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метанол (1,5 г, 42%): 1H ЯМР (CDCl3) δ 2,42-2,45 (м, 4H), 3,64-3,67 (м, 4H), 3,78 (с, 2H), 4,75 (с, 2H), 7,18-7,22 (дд, J=3 и 9 Гц, 1H), 7,48 (с, 1H), 7,53-7,56 (д, J=9 Гц, 1H), 8,33 (с, 1H).
Стадия 4: Смесь связки трифенилфосфин-полимер (6,2 г, 8,7 ммоль) в THF (40 мл) охлаждали в ванне со льдом до 3°C. Диизопропил азадикарбоксилат (1,5 г, 7,6 ммоль) медленно добавляли при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор (3-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метанола (1,4 г, 5,8 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,7 г, 5,8 ммоль) в THF (120 мл) медленно добавляли при 5-8°C. После перемешивания в течение 10 минут, ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и фильтрат концентрировали. Остаток растворяли в CH2Cl2 (120 мл) и промывали насыщ. NaHCO3 (40 мл), водой (40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 10 минут, затем до 5% за 5 минут и поддерживали в течение 20 минут), получая 5-амино-4-(4-((3-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,3 г, 43%): 1H ЯМР (CDCl3) δ 2,17-2,18 (м, 1H), 2,37-3,45 (м, 7H), 3,62-3,65 (м, 7Н), 3,82 (с, 2Н), 4,38-4,43 (д, J=15 Гц, 1H), 4,51-4,57 (д, J=18 Гц, 1H), 4,94-4,96 (м, 1H), 5,18 (с, 2H), 5,68 (уш., 1H), 6,51 (уш., 1H), 7,13-7,16 (дд, J=6 и 9 Гц, 1H), 7,26-7,28 (м, 1H), 7,42-7,47 (м, 2H), 7,54 (с, 1H), 7,65-7,68 (д, J=9 Гц, 1H), 8,44 (с, 1H); 13C ЯМР (CDCl3) δ 24,24, 30,45, 45,22, 51,80, 52,61, 53,36, 53,89, 66,93, 68,07, 114,09, 116,25, 118,08, 120,30, 120,59, 123,97, 124,45, 129,92, 130,23, 133,65, 134,44, 146,03, 163,47, 169,14, 171,55, 172,83.
Стадия 5: Раствор 5-амино-4-(4-((3-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,2 г, 2,4 ммоль) в THF (30 мл) охлаждали в ванне сухой лед/ацетон в течение 15 мин Медленно добавляли раствор трет-бутоксид калия/THF (1M, 2,6 мл, 2,6 ммоль). Реакционную смесь перемешивали при -78°C ванне в течение 1 часа, затем нагревали до 0°C в течение 1 часа. Реакционную смесь гасили 1н. HCl (5 мл) и добавляли воду (20 мл). Смесь подщелачивали насыщ. NaHCO3 до pH=8 и экстрагировали CH2Cl2 (3×30 мл). Объединенный раствор CH2Cl2 промывали солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 10 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая 3-(4-((3-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,8 г, 69%): Т. пл. 170-172°C; lH ЯМР (ДМСО-d6) δ 1,96-2,01 (м, 1H), 2,36-2,60 (м, 6H), 2,85-2,93 (м, 1H), 3,33-3,49 (м, 4H), 4,29 (д, J=18 Гц, 1H), 4,40 (д, J=18 Гц, 1H), 5,09-5,15 (дд, J=6 и 12 Гц, 1H), 5,33 (с, 2H), 7,35-7,62 (м, 6H), 8,63 (с, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,39, 31,16, 44,98, 51,04, 52,79, 66,07, 67,25, 115,04, 115,44, 116,92, 120,45, 120,58, 124,43, 124,77, 129,83, 133,34, 133,79, 144,80, 153,20, 167,94, 170,93, 172,80; Вычислено для C26H27N5O5+0,2Et2O+0,1 CH2Cl2: С, 63,00; H, 5,74; N, 13,66, Найдено: С, 62,94; H, 5,98; N, 13,50.
5.76 3-(4-((4-(морфолинометил)ФУРАН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
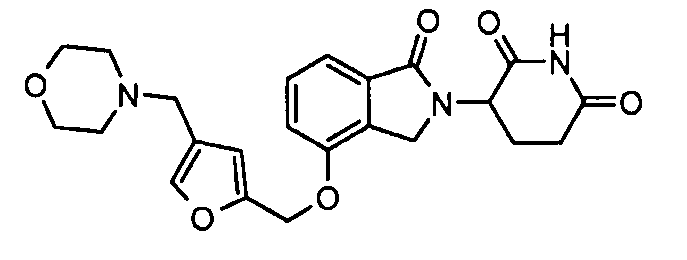
Стадия 1: Дважды перегнанный морфолин (3,81 мл, 43,7 ммоль) растворяли в THF (300 мл) и охлаждали до -78°C в условиях газообразного азота. К этому раствору добавляли по каплям н-бутиллитий (27,3 мл, 43,7 ммоль) (1,6 М в гексанах), и полученный раствор перемешивали еще 20 мин Затем медленно добавляли фуран-3-карбальдегид (4 г, 41,6 ммоль) в THF (8 мл), Затем добавляли по каплям еще 20 мин втор-бутиллитий (31,2 мл, 43,7 ммоль) (1,4 М в циклогексане), полученную смесь перемешивали при -78°C в течение 2,5 часов. Медленно вводили метил хлорформиат (4,33 г, 45,8 ммоль), растворенный в THF (8 мл), и реакционную смесь перемешивали в течение 45 минут при -78°C и дополнительно 20 минут при температуре окружающей среды, раствор вливали в ледяную 10%-ую HCl (400 мл, 2,87 M). Слои разделяли, и водную фазу экстрагировали простым эфиром (4×100 мл), объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении досуха, сырой продукт очищали ISCO (330 г колонка, градиент EtOAc/гексаны от 0% до 20% за 60 минут, 20% за течение 20 минут), получая 4-формилфуран-2-метилкарбоксилат (1,5 г, 23%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 3,89 (с, 3Н, СН3), 7,09-7,30 (м, 2Н, Ar), 9,75 (с, 1H, CHO).
Стадия 2: К раствору 4-формилфуран-2-метилкарбоксилата (800 мг, 5,19 ммоль) в дихлорметане (30 мл) добавляли морфолин (1,357 мл, 15,57 ммоль) и уксусную кислоту (1,783 мл, 31,1 ммоль). Реакционную смесь перемешивали в течение 10 минут, добавляли натрия триацетоксиборгидрид (3300 мг, 15,57 ммоль), смесь перемешивали в течение ночи. Реакционную смесь разбавляли дихлорметаном (50 мл) и промывали водой (2×30 мл), насыщенным раствором бикарбоната натрия (30 мл), солевым раствором (30 мл) и высушивали над сульфатом магния, после фильтрации растворитель выпаривали под вакуумом, получая 4-(морфолинометил)фуран-2-метилкарбоксилат; 1H ЯМР (ХЛОРОФОРМ-d) δ 2,46-2,59 (м, 4H, CH2, СН2), 3,62 (с, 2Н, СН2), 3,69-3,79 (м, 4Н, СН2, СН2), 3,89 (с, 3Н, СН3), 6,37 (д, J=3,2 Гц, 1Н, Ar), 7,14 (д, J=3,4 Гц, 1H, Ar).
Стадия 3: К раствору 4-(морфолинометил)фуран-2-метилкарбоксилата (1,12 г, 4,97 ммоль) в THF (30 мл) добавляли Dibal-Н (14,92 мл, 14,92 ммоль) в толуоле при 0°C. Сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли раствор соли Рочелла (1,0 М, 50 мл), затем этилацетат (50 мл), полученную суспензию перемешивали при температуре окружающей среды. Органическую фазу отделяли, и водную фазу экстрагировали EtOAc (3×40 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (5 мл) и солевым раствором, высушивали (MgSO4) и концентрировали, получая (4-(морфолинометил)фуран-2-ил)метанол; 1H ЯМР (ХЛОРОФОРМ-d) δ 2,43-2,65 (м, 4H, CH2, СН2), 3,57 (с, 2Н, СН2), 3,68-3,85 (м, 4Н, СН2, СН2), 4,61 (с, 2Н, СН2), 6,17-6,30 (м, 2Н, Ar).
Стадия 4: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,98 г, 3,16 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (615 мг, 2,104 ммоль) в THF (50 мл) при 0°C, с последующим добавлением DIAD (638 мг, 3,16 ммоль), после перемешивания в течение 10 минут добавляли (4-(морфолинометил)фуран-2-ил)метанол (415 мг, 2,104 ммоль) в THF (10 мл), смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, смолу промывали этилацетатом (10×20 мл), метанолом (5×10 мл), объединенную органическую фазу упаривали досуха, сырой продукт очищали ISCO (80 г колонка, MeOH в градиенте DCM 0-5% за 45 минут), получая 5-амино-4-(4-((4-(морфолинометил)фуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (440 мг, 44%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,24 (д, J=6,6 Гц, 4H, CH2, CH2), 2,32-2,40 (м, 4H, CH2), 3,46-3,52 (м, 5H, CH2, CH3), 3,52-3,57 (м, 4H, CH2, CH2), 4,26-4,55 (м, 2H, CH2), 4,71 (д, J=5,5 Гц, 1H, CHH), 5,18 (с, 2H, CH2), 6,29 (д, J=3,0 Гц, 1H, Ar), 6,56 (д, J=3,2 Гц, 1H, Ar), 7,18 (с, 1H, NHH), 7,30 (д, J=7,4 Гц, 1H, Ar), 7,35-7,42 (м, 1H, Ar), 7,46 (д, J=7,7 Гц, 1H, Ar), 7,57 (с, 1H, NHH).
Стадия 5: К раствору 5-амино-4-(4-((4-(морфолинометил)фуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (440 мг, 0,933 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (126 мг, 1,120 ммоль), смесь перемешивали при 0°C в течение 1 часа, добавляли дополнительный трет-бутоксид калия (20 мг, 0,27 ммоль), смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь гасили, добавляя водный раствор HCl (1н., 3 мл). Растворитель удаляли под вакуумом, остаток разделяли между насыщенным раствором бикарбоната натрия (10 мл) и этилацетатом (50 мл), органический слой отделяли и промывали солевым раствором, высушивали над сульфатом магния и фильтровали, фильтрат упаривали досуха, получая твердое вещество, твердое вещество ресуспендировали в ацетонитриле (4 мл) и фильтровали, получая 3-(4-((4-(морфолинометил)фуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (160 мг, 39%-ый выход); Т.пл.: 168-170°C; 1H ЯМР (ДМСО-d6) δ 1,85-2,05 (м, 1H, CHH), 2,17-2,50 (м, 5H, CH2, CH2, CHH), 2,54-2,65 (м, 1H, CHH), 2,88 (д, J=12,3 Гц, 1H, CHH), 3,32 (уш.с, 2H, CH2), 3,56 (уш.с, 4H, CH2, CH2), 4,13-4,42 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 6,09-6,52 (м, 1H, Ar), 6,58 (уш.с, 1H, Ar), 7,34 (д, J=1,2 Гц, 1H, Ar), 7,38-7,46 (м, 1H, Ar), 7,46-7,56 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,18, 45,06,51,55,52,44, 54,08, 62,16, 65,81, 109,72, 111,65, 115,42, 115,54, 129,73, 129,99, 133,34, 149,29, 152,31, 152,98, 167,90, 170,95, 172,81; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% HCOONH4 tR=3,13 (96,19%); Вычислено для C23H25N3O6+0,5 H2O: C, 61,60; H, 5,84; N, 9,37; Найдено: С, 61,28; H, 5,79; N,9,31.
5.77 3-{4-[4-(1-ИЗОПРОПИЛ-ПИПЕРИДИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
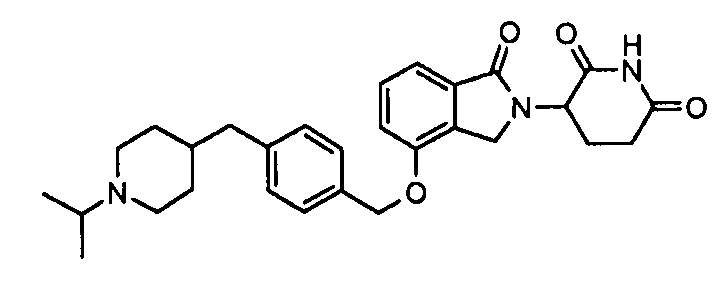
Стадия 1: Получение трет-бутилового эфира 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты
Трифенилфосфин (на полимерной подложке, 1,6 ммоль/г, 3,3 г) добавляли к перемешиваемой белой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,444 г, 8,36 ммоль) в THF (100 мл) при 0°C. Через десять минут добавляли диизопропил-диазен-1,2-дикарбоксилат (2,470 мл, 12,54 ммоль) и перемешивали в течение 40 минут, и затем добавляли 4-(4-(гидроксиметил)бензил)пиперидин-1-трет-бутилкарбоксилат (3,32 г, 10,87 ммоль) в THF (20 мл). Смесь перемешивали при 0°C и нагревали до температуры окружающей среды в течение ночи. Суспензию фильтровали, промывали MeOH (2×20 мл), CH2Cl2 (2×30 мл), и фильтрат упаривали, получая масло, которое растворяли в CH2Cl2 (80 мл), промывали насыщ. NaHCO3 (50 мл), концентрировали и затем очищали на колонке с силикагелем, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты как пенистое масло (2,2 г, 45%-ый выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение метилового эфира 4-карбамоил-4-[1-оксо-4-(4-пиперидин-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 4-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пиперидин-1-трет-бутилкарбоксилата (2,2 г, 3,80 ммоль) в CH2Cl2 (10 мл) при температуре окружающей среды добавляли гидрохлорид (2 М в простом эфире) (10 мл, 38,0 ммоль). Через четыре часа суспензию фильтровали, промывали простым эфиром, и полученное твердое вещество желтого цвета высушивали, получая 2,02 г, 111%-ый сырой выход (соль HCl). Продукт использовали позднее на следующей стадии без дальнейшей очистки.
Стадия 3: Получение метилового эфира 4-карбамоил-4-{4-[4-(1-изопропил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(пиперидин-4-илметил)бензилокси)изоиндолин-2-ил)метилпентаноат гидрохлорида (1,24 г, 2,403 ммоль) в MeOH (15 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,397 мл, 2,403 ммоль), пропан-2-он (1,252 мл, 16,82 ммоль), уксусную кислоту (0,069 мл, 1,201 ммоль) и натрия цианоборгидрид (0,302 г, 4,81 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Воду со льдом (30 мл) лили в смесь, образовавшийся осадок экстрагировали этилацетатом (100 мл), промывали насыщенным раствором бикарбоната натрия (2×40 мл), солевым раствором (30 мл), высушивали и концентрировали до коричневого пенистого масла (1,11 г, 89%-ый сырой выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение 3-{4-[4-(1-изопропил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(4-(4-((1-изопропилпиперидин-4-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,09 г, 2,090 ммоль) в тетрагидрофуране (12 мл) в ванне со льдом (0°C) добавляли 2-метилпропан-2-олат калия (0,246 г, 2,194 ммоль). Смесь перемешивали при 0°C в течение 10 минут. К смеси добавляли 1н. HCl (до pH=1), затем нейтрализовали насыщенным раствором бикарбоната натрия (до pH=7) и экстрагировали этилацетатом (3×30 мл), промывали солевым раствором (20 мл), высушивали над сульфатом натрия и концентрировали до пенистого твердого вещества, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(1-изопропил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как пенистое твердое вещество грязно-белого цвета (0,33 г, 32%-ый выход); Т. пл.: 182-184°C. ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический за 5 мин (CH3CN/0,1% H3PO4), 5,19 мин (97,4%). 1H ЯМР (ДМСО-d6) δ 0,92 (д, J=6,4 Гц, 6H, CH3, CH3), 1,03-1,22 (м, 2H, CH2), 1,35-1,60 (м, 3Н, CH, CH2), 1,90-2,10 (м, 3Н, CHH, CH2), 2,34-2,48 (м, 2H, CHH, CH), 2,53-2,57 (м, 1H, CHH), 2,57-2,78 (м, 4H, CH2, CH2), 2,83-3,00 (м, 1H, CHH), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,17 (д, J=8,1 Гц, 2H, Ar), 7,36 (дд, J=7,9, 18,9 Гц, 4H, Ar), 7,44-7,54 (м, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 17,94, 22,36, 31,21, 32,13, 37,77, 42,14, 45,09, 48,18, 51,56, 53,78, 69,49, 114,95, 115,19, 127,67, 129,05, 129,81, 129,94, 133,29, 133,91, 140,32, 153,54, 168,01, 170,96, 172,83, LC/MS m/e=490, Вычислено для C29H35N3O4 (+0,3 Н2О): С, 70,36; H, 7,26; N, 8,49, Найдено: С, 70,18; H, 7,06; N, 8,36.
5.78 3-{4-[4-(1-МЕТИЛ-1Н-БЕНЗОИМИДАЗОЛ-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
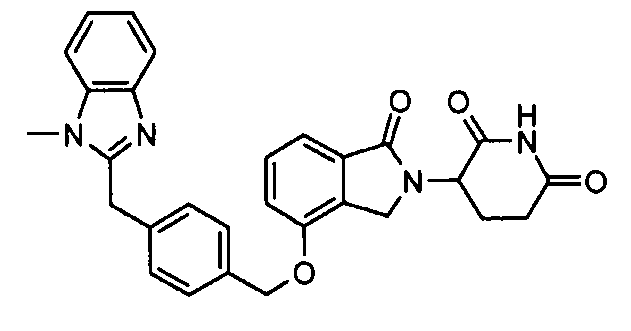
Стадия 1: Трет-бутиловый эфир (4-бромметил-фенил)-уксусной кислоты
Перемешивали раствор 2-(4-(бромметил)фенил)уксусной кислоты (2,6 г, 11,35 ммоль) в тионилхлориде (20 мл, 274 ммоль) нагревали с обратным холодильником в течение 2,5 часов. Реакционную смесь концентрировали под вакуумом, получая твердое вещество белого цвета. Это твердое вещество белого цвета добавляли к перемешиваемому раствору 2-метилпропан-2-ола (20 мл, 213 ммоль) в DCM (2 мл) в ванне лед/вода. И смесь перемешивали в ванне лед/вода в течение 2 часов и при температуре окружающей среды в течение 18 часов. Реакционную смесь добавляли к CH2Cl2 (40 мл). Органическую фазу промывали последовательно H2O (20 мл), NaHCO3 (насыщ., водный раствор, 20 мл) и солевым раствором (25 мл) и высушивали над MgSO4. Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир (4-бромметилфенил)-уксусной кислоты в форме светло-желтой жидкости (2,4 г, 74%-ый сырой выход). 1H ЯМР (ДМСО-d6): 1,39 (с, 9H, tBu), 3,54 (с, 2H, CH2CO2), 4,69 (с, 2H, CH2Br), 7,23, 7,39 (м, 4H, из-за примесей).
Стадия 2: Метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемой смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,5 г, 5,13 ммоль) и 2-(4-(бромметил)фенил)трет-бутилацетата (2,2 г, 7,7 ммоль) в ацетонитриле (30 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль). Полученную реакционную смесь перемешивали при 50°C в течение 27 часов и 2-(4-(бромметил)фенил)трет-бутилацетат (800 мг, 2,9 ммоль) добавляли в 2 частях. Реакционную смесь фильтровали, и светло-коричневое твердое вещество промывали ацетонитрилом (2×20 мл). Фильтрат концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме липкого твердого вещества светло-желтого цвета (2,1 г, 82%-ый сырой выход) LCMS MH=497.
Стадия 3: Метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-(2-трет-бутокси-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,1 г, 4,2 ммоль) в DCM (20 мл) при температуре окружающей среды добавляли воду (0,38 мл, 21,1 ммоль) с последующим медленным добавлением TFA (1,63 мл, 21,1 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 5 часов и добавляли TFA (3,2 мл) и воду (0,15 мл). Смесь сохраняли в холодильнике в течение ночи, и реакционную смесь концентрировали под вакуумом, получая метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме твердого вещества грязно-белого цвета (2,3 г, 123%-ый сырой выход). 1H ЯМР (ДМСО-d6) δ 1,97-2,31 (м, 4H, СН2, СН2), 3,50 (с, 3Н, СН3), 3,58 (с, 2Н, СН2), 4,41 (д, J=17,8 Гц, 1Н, CHH), 4,53 (д, J=17,8 Гц, 1H, CHH), 4,72 (дд, J=4,6, 10,3 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,18 (уш.с, 1H, NHH), 7,24-7,34 (м, 4H, Ar), 7,40-7,50 (м, 3H, Ar), 7,57 (уш.с, 1H, NHH); LCMS MH=441.
Стадия 4: Метиловый эфир 4-карбамоил-4-{4-[4-(1-метил-1Н-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
Смесь 2-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)уксусной кислоты (500 мг, 1,1 ммоль) и CDI (166 мг, 1,0 ммоль) в THF (3 мл). Смесь перемешивали при 50°C в течение 25 минут, затем добавляли N1-метилбензол-1,2-диамин (125 мг, 1,022 ммоль) в THF (6 мл). Полученный коричневый раствор перемешивали при 50°C в течение 21 часа, и реакционную смесь разбавляли EtOAc (40 мл) и промывали NH4OH (водный раствор, 10 вес.%, 2×20 мл). Органический слой концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-карбамоил-4-{4-[4-(1-метил-1Н-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как розовое твердое вещество (185 мг, 31%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,96-2,34 (м, 4H, СН2, СН2), 3,49 (с, 3Н, СН3), 3,71 (с, 3Н, СН3), 4,25-4,58 (м, 4Н, CHH, СНН, СН2), 4,65-4,78 (м, 1Н, СНН), 5,21 (с, 2Н, СН2), 7,09-7,24 (м, J=1,3, 7,4, 7,4, 7,4, 7,4 Гц, 3Н, Ar), 7,25-7,37 (м, 4H, Ar, NHH), 7,39-7,51 (м, 4H, Ar, NHH), 7,52-7,62 (м, 2H, Ar); LCMS MH=527.
Стадия 5: 3-{4-[4-(1-Метил-1Н-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 5-амино-4-(4-(4-((1-метил-1Н-бензо[d]имидазол-2-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (660 мг, 1,25 ммоль) в тетрагидрофуране (15 мл) при 0°C (вода/ванна со льдом) добавляли трет-бутоксид калия (155 мг, 1,4 ммоль) в одной части. Полученную смесь перемешивали при 0°C в течение 1 часа, и реакционную смесь разбавляли DCM (100 мл), с последующим добавлением HCl (водный раствор, 1н., 5 мл). Смесь перемешивали и добавляли NaHCO3 (водный раствор., насыщ., 20 мл). Смесь экстрагировали, и водный слой экстрагировали DCM (20 мл). Органические слои объединяли и промывали солевым раствором (2×25 мл). Органический слой высушивали MgSO4 и концентрировали для очистки ISCO, получая твердое вещество белого цвета. Это твердое вещество белого цвета затем очищали перемешиванием в ацетонитриле (5 мл), получая 3-{4-[4-(1-метил-1Н-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (328 мг, 34%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3PO4), 7,80 мин (99,2%); Т. пл.: 240-242°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,03 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,80-2,99 (м, 1H, CHH), 3,71 (с, 3H, CH3), 4,15-4,45 (м, 4H, CHH, CHH, CHH, CHH), 5,09 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 7,10-7,24 (м, J=1,4, 7,4, 7,4, 7,4, 7,4 Гц, 2H, Ar), 7,32 (д, J=7,4 Гц, 4H, Ar), 7,40-7,53 (м, 4H, Ar), 7,53-7,60 (м, 1H, Ar), 10,95 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,30, 29,75, 31,16, 32,65, 45,06, 51,53, 69,35, 109,81, 114,91, 115,20, 118,41, 121,24, 121,59, 128,06, 128,84, 129,78, 129,93, 133,27, 134,83, 135,81, 136,74, 142,19, 153,46, 153,59, 167,99, 170,95, 172,80; LCMS MH=495; Вычислено для C29H26N4O4: С, 70,43; H, 6,30; N, 11,33; Найдено: С, 70,16; H, 5,03; N, 11,31.
5.79 3-(4-((2-(морфолинометил)ИМИДАЗО[1,2-A]ПИРИДИН-6-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
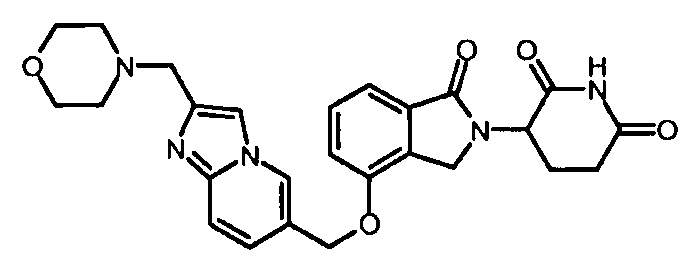
Стадия 1: Смесь 6-аминоэтилникотината (5,0 г, 30,1 ммоль) и 1,3-дихлорпропан-2-она (5,7 г, 45,1 ммоль) в ацетонитриле (100 мл) нагревали с обратным холодильником в течение 17 часов. Смесь концентрировали, и остаток перемешивали с CH2Cl2 (100 мл) и насыщ. NaHCO3 (35 мл). Органический слой промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 30%-ый EtOAc/CH2Cl2 в течение 25 минут, затем до 100% EtOAc за 15 минут), получая 2-(хлорметил)имидазо[1,2-a]пиридин-6-этилкарбоксилат (4,7 г, 65%): 1H ЯМР (CDCl3) δ 1,42 (т, J=6 Гц, 3H), 4,38-4,45 (кв, J=6 Гц, 2H), 4,77 (с, 2H), 7,56-7,59 (д, J=9 Гц, 1H), 7,70 (с, 1H), 7,74-7,77 (дд, J=3 и 9 Гц, 1H), 8,86-8,87 (д, J=3 Гц, 1H).
Стадия 2: Диизобутилалюминий гидрид/толуол (1M, 22,0 мл, 22,0 ммоль) медленно добавляли к перемешиваемому раствору 2-(хлорметил)имидазо[1,2-a]пиридин-6-этилкарбоксилата (2,1 г, 8,8 ммоль) в THF (60 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 4 часов, затем гасили метанолом (5 мл). Добавляли CH2Cl2 (70 мл) и насыщ. NaHCO3 (40 мл), и смесь нагревали до температуры окружающей среды. Водный слой экстрагировали CH2Cl2 (60 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с простым эфиром (25 мл), получая (2-(хлорметил)имидазо[1,2-a]пиридин-6-ил)метанол (1,1 г, 65%): 1H ЯМР (ДМСО-d6) δ 4,60 (с, 2H), 4,75 (с, 2H), 5,22 (уш., 1H), 7,19-7,22 (дд, J=3 и 9 Гц, 1H), 7,44-7,47 (д, J=9 Гц, 1H), 7,75 (с, 1H), 8,24 (с, 1H).
Стадия 3: Суспензию смеси (2-(хлорметил)имидазо[1,2-a]пиридин-6-ил)метанола (1,5 г, 7,4 ммоль), морфолина (1,0 г, 11,1 ммоль) и N,N-диизопропилэтиламина (1,4 г, 11,1 ммоль) в ацетонитриле (30 мл) нагревали при 70°C на масляной бане в течение 20 мин Реакционную смесь концентрировали, и остаток растворяли в CH2Cl2 (80 мл) и промывали солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 3% CH3OH/CH2Cl2 в течение 10 минут, затем до 10% за 10 минут и поддерживали в течение 40 минут), получая (2-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метанол (1,0 г, 54%): 1H ЯМР (CDCl3) δ 2,54-2,57 (м, 4H), 3,66-3,74 (м, 6Н), 4,40 (уш., 1Н), 4,67 (с, 2H), 7,05-7,09 (дд, J=3 и 9 Гц, 1H), 7,30-7,44 (м, 2H), 8,02 (с, 1H).
Стадия 4: Смесь связки трифенилфосфин-полимер (4,3 г, 6,1 ммоль) в THF (40 мл) охлаждали в ванне со льдом до 3°C. Диизопропил азадикарбоксилат (1,1 г, 5,3 ммоль) медленно добавляли при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,2 г, 4,0 ммоль) и (2-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метанола (1,1 г, 4,0 ммоль) в THF (80 мл) медленно добавляли при 5-8°C. После перемешивания при 3°C в течение 5 минут, ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали и твердое вещество промывали CH2Cl2 (60 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (120 мл) и промывали насыщ. NaHCO3 (35 мл), водой (35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая 5-амино-4-(4-((2-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,2 г, 57%): 1H ЯМР (CDCl3) δ 2,18-2,44 (м, 4H), 2,57-2,60 (м, 4H), 3,63 (с, 3Н), 3,72-3,76 (м, 6H), 4,38-4,44 (д, J=18 Гц, 1H), 4,49-4,55 (д, J=18 Гц, 1H), 4,90-4,95 (дд, J=6 и 9 Гц, 1H), 5,14 (с, 2H), 5,50 (уш., 1H), 6,38 (уш., 1H), 7,12-7,20 (м, 2H), 7,42-7,47 (м, 2H), 7,50-7,63 (м, 2H), 8,18 (с, 1H); 13C ЯМР (CDCl3) δ 24,12, 30,45, 45,21, 51,83, 53,82, 53,90, 57,00, 66,98, 67,75, 111,50, 114,32, 116,64, 117,79, 120,97, 124,13, 124,26, 129,99, 130,20, 133,65, 144,40, 144,75, 153,35, 169,17, 171,46, 172,87.
Стадия 5: Раствор 5-амино-4-(4-((2-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,2 г, 2,2 ммоль) в THF (30 мл) охлаждали в ванне со льдом в течение 15 мин Медленно добавляли раствор трет-бутоксид калия/THF (1M, 2,5 мл, 2,5 ммоль), и смесь перемешивали в ванне со льдом в течение 2 часов. Реакционную смесь гасили 1н. HCl (5 мл), и смесь разбавляли CH2Cl2 (30 мл) и водой (20 мл). Смесь подщелачивали насыщ. NaHCO3 (7 мл) до рН=8. Водный слой экстрагировали CH2Cl2 (3×30 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток кристаллизовали из ацетона (10 мл), получая 3-(4-((2-(морфолинометил)имидазо[1,2-a]пиридин-6-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,6 г, 53%): Т. пл. 278-280°С; 1H ЯМР (ДМСО-d6) δ 1,97-2,01 (м, 1H), 2,40-2,61 (м, 6H), 2,90-2,95 (м, 1H), 3,55-3,59 (м, 6H), 4,29 (д, J=18 Гц, 1H), 4,39 (д, J=15 Гц, 1H), 5,08-5,14 (дд, J=6 и 15 Гц, 1H), 5,25 (с, 2H), 7,30-7,41 (м, 3H), 7,49-7,51 (м, 2H), 7,83 (с, 1H), 8,66 (с, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,36, 31,16, 45,04, 51,56, 53,19, 56,27, 66,18, 67,31, 111,68, 115,09, 115,44, 116,34, 120,69, 124,87, 125,69, 129,83, 130,02, 133,34, 134,51, 134,58, 153,26, 167,96, 170,95, 172,80; Вычислено для C26H27N5O5: C, 63,79; H, 5,56; N, 14,31, Найдено: С, 63,38; H, 5,64; N, 14,09.
5.80 3-{4-[4-(1H-БЕНЗОИМИДАЗОЛ-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
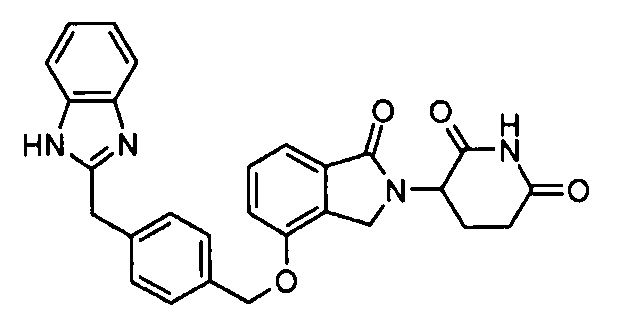
Стадия 1: Трет-бутиловый эфир (4-бромметил-фенил)-уксусной кислоты
Перемешивали раствор 2-(4-(бромметил)фенил)уксусной кислоты (2,6 г, 11,35 ммоль) в тионилхлориде (20 мл, 274 ммоль) нагревали с обратным холодильником в течение 2,5 часов. Реакционную смесь концентрировали под вакуумом, получая твердое вещество белого цвета. Это твердое вещество белого цвета добавляли к перемешиваемому раствору 2-метилпропан-2-ола (20 мл, 213 ммоль) в DCM (2 мл) в ванне лед/вода. И смесь перемешивали в ванне лед/вода в течение 2 часов и при температуре окружающей среды в течение 18 часов. Реакционную смесь добавляли к CH2Cl2 (40 мл). Органическую фазу промывали последовательно H2O (20 мл), NaHCO3 (насыщ., водный раствор, 20 мл) и солевым раствором (25 мл) и высушивали над MgSO4. Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир (4-бромметилфенил)-уксусной кислоты в форме светло-желтой жидкости (2,4 г, 74%-ый сырой выход). 1H ЯМР (ДМСО-d6): 1,39 (с, 9H, tBu), 3,54 (с, 2H, CH2C02), 4,69 (с, 2H, CH2Br), 7,23, 7,39 (м, 4H, из-за примесей).
Стадия 2: Метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемой смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,5 г, 5,13 ммоль) и 2-(4-(бромметил)фенил)трет-бутилацетата (2,2 г, 7,7 ммоль) в ацетонитриле (30 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль). Полученную реакционную смесь перемешивали при 50°C в течение 27 часов, и 2-(4-(бромметил)фенил)трет-бутилацетат (800 мг, 2,9 ммоль) добавляли в 2 частях. Реакционную смесь фильтровали, и светло-коричневое твердое вещество промывали ацетонитрилом (2×20 мл). Фильтрат концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме липкого твердого вещества светло-желтого цвета (2,1 г, 82%-ый сырой выход) LCMS MH=497.
Стадия 3: Метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-(2-трет-бутокси-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,1 г, 4,2 ммоль) в DCM (20 мл) при температуре окружающей среды добавляли воду (0,38 мл, 21,1 ммоль) с последующим медленным добавлением TFA (1,63 мл, 21,1 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 5 часов и добавляли TFA (3,2 мл) и воду (0,15 мл). Смесь сохраняли в холодильнике в течение ночи, и реакционную смесь концентрировали под вакуумом, получая метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме твердого вещества грязно-белого цвета (2,3 г, 123%-ый сырой выход). 1H ЯМР (ДМСО-d6) δ 1,97-2,31 (м, 4H, CH2, СН2), 3,50 (с, 3Н, СН3), 3,58 (с, 2Н, СН2), 4,41 (д, J=17,8 Гц, 1Н, CHH), 4,53 (д, J=17,8 Гц, 1H, CHH), 4,72 (дд, J=4,6, 10,3 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,18 (уш.с, 1H, NHH), 7,24-7,34 (м, 4H, Ar), 7,40-7,50 (м, 3H, Ar), 7,57 (уш.с, 1H, NHH); LCMS MH=441.
Стадия 4: Метиловый эфир 4-{4-[4-(1H-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты
Раствор 2-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)уксусной кислоты (621 мг, 1,4 ммоль) в THF (4 мл) добавляли к CDI (208 мг, 1,28 ммоль) в одной части. Смесь перемешивали при температуре окружающей среды в течение 3 часов и при 50°C в течение 1 часа, после чего добавляли раствор бензол-1,2-диамина (139 мг, 1,28 ммоль) в THF (6 мл). Реакционную смесь перемешивали при 50°C в течение 20 часов и затем перемешивали при 65°C в течение 30 часов. Реакционную смесь разбавляли EtOAc (40 мл) и промывали NH4OH (водный раствор, 10 вес.%, 2×20 мл). Органический слой концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-{4-[4-(1H-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты в форме твердого вещества желтого цвета (266 мг, 40%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,96-2,32 (м, 4H, CH2, СН2), 3,42-3,57 (м, 3Н, СН3), 4,18 (с, 2Н, СН2), 4,30-4,58 (м, 2Н, СНН, СНН), 4,71 (дд, J=4,7, 10,2 Гц, 1Н, CHH), 5,21 (с, 2H, CH2), 7,05-7,22 (м, 3Н, NHH, Ar), 7,22-7,32 (м, 2H, Ar), 7,32-7,49 (м, 6H, Ar), 7,49-7,62 (м, 2H, Ar, NHH), 12,26 (с, 1H, NH); LCMS MH=513.
Стадия 5: 3-{4-[4-(1H-Бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 4-(4-(4-((1H-бензо[d] имидазол-2-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (260 мг, 0,5 ммоль) в тетрагидрофуране (10 мл) при 0°C добавляли трет-бутоксид калия (62,6 мг, 0,56 ммоль). Полученную смесь перемешивали при 0°C в течение 2 часов, и KOtBu (50 мг, 0,4 mммоль) добавляли в двух частях. Полученную реакционную смесь разбавляли EtOAc (50 мл) с последующим добавлением HCl (водный раствор, 1н., 3 мл). К полученной смеси добавляли NaHCO3 (насыщ., водный раствор, 20 мл) и экстрагировали. Органический слой концентрировали под вакуумом, и остаток очищали ISCO, получая твердое вещество грязно-белого цвета (110 мг). Это твердое вещество грязно-белого цвета очищали, нагревая в EtOAc (10 мл) при нагревании с обратным холодильником, получая 3-{4-[4-(1H-бензоимидазол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (33 мг, 14%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% Н3РО4), 6,03 мин (99,3%); Т. пл.: 203-205°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,04 (м, 1H, СНН), 2,33-2,47 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,81-2,99 (м, 1H, CHH), 4,11-4,44 (м, 4H, CHH, CHH, CH2), 5,09 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 6,99-7,21 (м, 2H, Ar), 7,26-7,60 (м, 9H, Ar), 10,94 (с, 1H, NH), 12,27 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,28, 31,16, 34,62, 45,06, 51,55, 69,35, 110,84, 114,90, 115,18, 118,22, 120,89, 121,58, 128,02, 128,88, 129,77, 129,93, 133,27, 134,82, 137,50, 153,38, 153,45, 167,97, 170,93, 172,78; LCMS MH=481; Вычислено для C28H24N4O4: C, 69,99; H, 5,03; N, 11,66; Найдено: С, 69,97; H, 4,70; N, 11,58.
5.81 3-{4-[4-(ОКТАГИДРО-ИЗОИНДОЛ-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
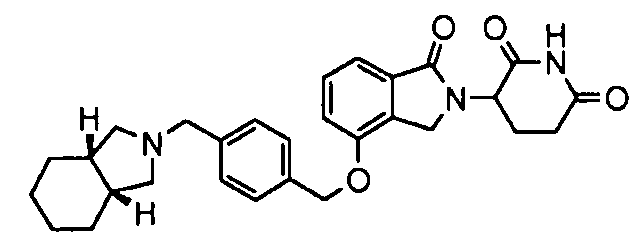
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,357 г, 0,805 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли цис-октагидро-изоиндол гидрохлорид (0,195 г, 1,208 ммоль) и N-этил-N-изопропилпропан-2-амин (0,466 мл, 2,82 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и полученное твердое вещество грязно-белого цвета перемешивали в метиленхлориде (100 мл), промывали насыщенным раствором бикарбоната натрия (2×80 мл), солевым раствором (50 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(октагидро-изоиндол-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (20 мг, 5%-ый выход); Т. пл. не определяли. ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 10/90-70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 5,17 мин (97,7%). 1H ЯМР (ДМСО-d6) δ 1,18-1,34 (м, 2H, СН2), 1,35-1,62 (м, 6Н, СН2, СН2, СН2), 1,92-2,03 (м, 1Н, СНН), 2,04-2,22 (м, 2Н, СН2), 2,36-2,48 (м, 1Н, СНН), 2,53-2,80 (м, 4Н, СН2, СН, СНН), 2,83-3,00 (м, 1Н, СНН), 3,58-3,86 (м, 2Н, СН2), 4,17-4,49 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,22 (с, 2H, CH2), 7,26-7,54 (м, 7H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,27, 22,36, 31,21, 36,52, 45,10, 51,59, 57,64, 69,41, 114,98, 115,23, 127,67, 129,81, 129,95, 133,32, 153,50, 168,01, 170,96, 172,82. LC/MS m/e=488. Вычислено для C29H33N3O4: С, 71,44; H, 6,82; N, 8,62.
5.82 3-(4-((4-((7,8-ДИГИДРО-1,6-НАФТИРИДИН-6(5H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
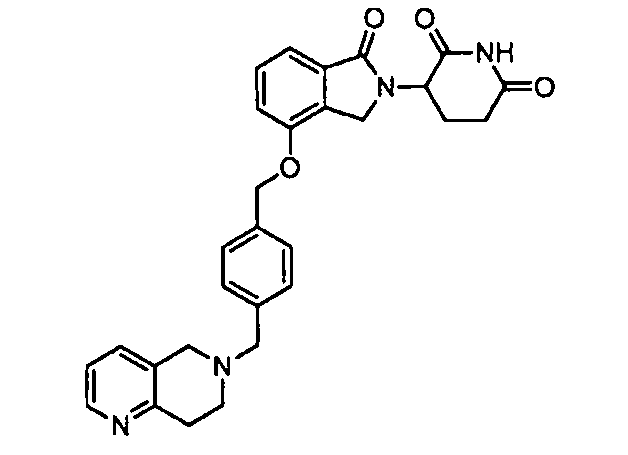
Стадия 1: (S)-5-Амино-4-(4-((4-(бромметил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат
1,4-бис(Бромметил)бензол (2,71 г, 10,26 ммоль) суспендировали в сухом ацетонитриле (40 мл). Суспензию нагревали до 60°C, пока не происходило полное растворение (~15 минут). Температуру уменьшали до 50°C, и к раствору добавляли K2CO3 (0,473 г, 3,42 ммоль) в форме твердого вещества, с последующим добавлением (S)-5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1 г, 3,42 ммоль, получение описано здесь). Полученную белую суспензию перемешивали при 50°C в течение ~3 часов, после чего LCMS показала, что исходный фенол был потреблен. Сырую реакционную смесь перемешивали и отсасывали. Оставшееся в колбе и на воронке с фильтром твердое вещество промывали минимальным количеством MeCM (~5 мл). Фильтрат концентрировали в вакууме, получая 2,6 г твердого вещества белого цвета. Это твердое вещество растворяли в минимальном количестве DCM и очищали с использованием колонки для флэш-хроматографии SiO2 (CombiFlash, 40 г предварительно заполненная колонка SiO2). Колонку элюировали 100%-ым DCM в течение ~15 минут, градиент до 5% MeOH в DCM за 5 минут, и затем поддерживали при 5% MeOH в DCM. Фракции объединяли и концентрировали, получая (S)-5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как твердое вещество белого цвета (1,3 г, 80%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,94-2,34 (м, 4H, CH2, СН2), 3,50 (с, 3Н, СН3), 4,33-4,62 (м, 2Н, СН2), 4,72 (с, 2Н, СН2,), 5,25 (с, 2Н, СН2), 5,27-5,36 (м, 1Н, СН), 7,19 (уш.с, 1Н, NH), 7,23-7,36 (м, 2Н, Ar), 7,40-7,70 (м, 6Н, Ar, NH); LCMS: MH=475, 477.
Стадия 2: (S)-3-(4-(4-(Бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
(S)-5-Амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (2,05 г, 4,31 ммоль) растворяли в THF (50 мл), и раствор охлаждали в ванне сухой лед/ацетон до -76°C. При перемешивании твердый KOtBu (0,532 г, 4,74 ммоль) добавляли в одной части к прозрачному раствору. Реакционная смесь приобрела светло-желтый цвет, и ее перемешивали в течение ~90 минут при -76°C. Охлажденный раствор 1н. водного раствора HCl (20 мл) быстро добавляли к реакционной смеси, поддерживая температуру при -76°C. Смесь немедленно становилась молочно-белой, и ванну сухой CO2/ацетон удаляли, давая смеси нагреться при перемешивании. Смесь концентрировали на роторном испарителе, чтобы удалить большую часть THF (концентрировали до фиксированного объема при 160 мбар и на водяной бане при ~35°C). После концентрации реакционной смеси осаждалось твердое вещество белого цвета. Белую суспензию разбавляли большим количеством воды (~80 мл) и затем фильтровали отсасыванием. Корку промывали обильно водой (полный объем фильтрата ~150 мл) и высушивали отсасыванием. Корку промывали Et2O (~50 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 40°C на ночь, получая (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (1,8 г, 94%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,70 мин (97,9%); Т. пл.: 123-125°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,32-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,78-3,04 (м, 1H, CHH), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 4,72 (с, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,24-7,36 (м, 2H, Ar), 7,41-7,54 (м, 5H, Ar), 10,83-11,07 (м, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 31,18, 34,15, 45,06, 51,56, 69,12, 114,94, 115,28, 127,95, 128,33, 129,41, 129,80, 131,93, 133,31, 136,78, 153,36, 167,97, 170,95, 172,81; LCMS: MH=443, 445.
Это твердое вещество использовали на следующей стадии без дальнейшей очистки. Стереохимию продукта бензилбромида выводили из стереохимического результата продуктов, полученных из него.
Стадия 3: 3-(4-((4-((7,8-Дигидро-1,6-нафтиридин-6(5H)-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
В ампуле для сцинтилляции на 20 мл MeCN (5 мл, 96 ммоль) добавляли к смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) и 5,6,7,8-тетрагидро-1,6-нафтиридина (72,6 мг, 0,541 ммоль). К смеси добавляли DIEA (0,236 мл, 1,354 ммоль). Смесь перемешивали при температуре окружающей среды в течение 1 ч. Суспензию фильтровали. Твердое вещество промывали Et2O и высушивали в вакуумном сушильном шкафу, получая 3-(4-((4-((7,8-дигидро-1,6-нафтиридин-6(5H)-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (198 мг, 88%-ый выход): Т. пл.: 163-165°C; ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 3,66 мин (99,2%); 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,70-2,82 (м, 2H, CH2), 2,82-3,04 (м, 3H, CHH, CH2), 3,57 (с, 2H, CH2), 3,69 (с, 2H, CH2), 4,26 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2O), 7,12 (дд, J=4,8, 7,6 Гц, 1H, Ar), 7,27-7,36 (м, 2H, Ar), 7,37-7,58 (м, 6H, Ar), 8,33 (дд, J=1,5, 4,7 Гц, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 31,92, 45,07, 50,00, 51,56, 54,27, 61,14, 69,41, 114,97, 115,22, 120,95, 127,73, 128,79, 129,80, 129,83, 129,93, 133,30, 134,16, 135,35, 138,10, 147,15, 153,49, 154,40, 167,99, 170,96, 172,80; LCMS: MH=497; Вычислено для C29H28N4O4+1,14 H2O: C, 67,36; H, 5,90; N, 10,83; Найдено: С, 67,36; H, 5,93; N, 10,68.
5.83 3-(1-ОКСО-4-((4-((2-(ТРИФТОРМЕТИЛ)-5,6-ДИГИДРО-[1,2,4]ТРИАЗОЛО[1,5-A]ПИРАЗИН-7(8H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
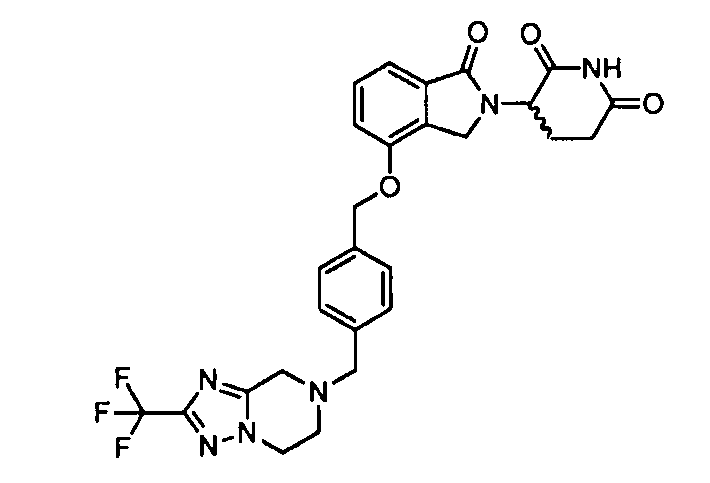
Стадия 1: 3-[4-(4-Гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион
В круглодонную колбу, загруженную 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноатом (5 г, 17,11 ммоль), (4-(хлорметил)фенил)метанолом (2,81 г, 17,96 ммоль) и безводным карбонатом калия (2,60 г, 18,82 ммоль), добавляли DMF (50 мл). Реакционную смесь перемешивали при температуре окружающей среды, и прогресс реакции отслеживали с помощью LCMS. После ~3 часов добавляли DIEA (3,29 мл, 18,82 ммоль), и реакционную смесь перемешивали в течение ночи. После ~18 часов добавляли твердый KI (1,6 г, 9,64 ммоль) и смесь нагревали до 40°C и перемешивали в течение ~2 дней. Реакционную смесь, содержащую смесь желаемого продукта и нециклизованного предшественника глутаримида, нагревали далее до 80°C в течение ~30 часов. Сырую реакционную смесь охлаждали до температуры окружающей среды, фильтровали на воронке из спеченного стекла, и удаленные твердые частицы промывали минимальным количеством MeCN. Объединенный фильтрат и смывы концентрировали на роторном испарителе, пока DMF не начал дистиллироваться. Концентрированную смесь разбавляли водным 1н. раствором HCl (~150 мл) и водой (~700 мл) и экстрагировали EtOAc (2×700 мл). Объединенный органический слой промывали 1н. HCl (200 мл), 1н. Na2CO3 (2×300 мл) и солевым раствором. Этот раствор высушивали (Na2SO4) и концентрировали в вакууме до ~400 мл. Добавляли активированный уголь (~11 г), и суспензию перемешивали в течение ~15 минут, затем фильтровали на слое Целита на воронке из спеченного стекла со средним размером пор с отсасыванием. Прозрачный фильтрат концентрировали в вакууме, получая твердое вещество грязно-белого цвета (4,1 г). Это твердое вещество суспендировали в MeCN (60 мл) с помощью ультразвука и мягкого нагревания. Смесь нагревали в течение ~30 минут при 60°C при перемешивании и затем давали охладиться до температуры окружающей среды. Добавляли Et2O (~30 мл) и суспензию перемешивали при периодической обработке ультразвуком. Твердое вещество собирали фильтрацией на воронке из спеченного стекла со средним размером пор, и корку промывали дополнительным количеством Et2O и затем высушивали отсасыванием. Оставшееся твердое вещество высушивали в вакуумном сушильном шкафу при 40°C, получая 3-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (3,4 г, 52%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,34-2,49 (м, 1H, CHH), 2,57 (д, J=18,1 Гц, 1H, CHH), 2,81-3,01 (м, 1H, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,4 Гц, 1H, CHH), 4,50 (д, J=5,9 Гц, 2H, CH2), 5,11 (дд, J=5,1, 13,0 Гц, 1H, CH), 5,18 (т, J=5,8 Гц, 1H, OH), 5,23 (с, 2H, CH2), 7,28-7,39 (м, 4H, Ar), 7,41-7,56 (м, 3H, Ar), 10,96 (с, 1H, NH); LCMS: MH=381.
Стадия 2: 3-[4-(4-Бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион
К хорошо перемешиваемой суспензии 3-(4-(4-(гидроксиметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (2,4 г, 6,31 ммоль) в сухом MeCN (40 мл) при 0°C через шприц добавляли PBr3 (1,19 мл, 12,6 ммоль). К перемешиваемой смеси добавляли тетрабутил аммоний бромид (0,203 г, 0,631 ммоль). После ~5 минут ванну со льдом удаляли, и реакционной смеси давали перемешаться при температуре окружающей среды в течение ~4,5 часов. Реакционную смесь вливали в колбу с водой (200 мл) на льду. Полученную густую суспензию фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Остаточное твердое вещество в колбе переносили на воронку с фильтром с дополнительным количеством воды. Корку промывали обильно водой и гексанами (~150 мл) и затем высушивали отсасыванием. Твердое вещество суспендировали с Et2O (~50 мл) и перемешивали в течение 10 минут, затем собирали фильтрацией отсасыванием. Корку промывали дополнительным количеством Et2O (~50 мл) и затем высушивали в вакуумном сушильном шкафу при 40°C в течение ночи, получая 3-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (2,61 г, 93%): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,78 мин (96,6%); 1H ЯМР (MeCN-d3) δ 2,08-2,22 (м, J=2,5, 5,2, 5,2, 12,8 Гц, 1H, CHH), 2,45 (кв.д, J=4,9, 13,1 Гц, 1H, CHH), 2,62-2,94 (м, 2H, CHH, CHH), 4,31 (д, J=17,0 Гц, 1H, CHH), 4,41 (д, J=17,2 Гц, 1H, CHH), 4,62 (с, 2H, CH2), 5,09 (дд, J=5,1, 13,4 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,24 (д, J=8,1 Гц, 1H, Ar), 7,38 (д, J=7,0 Гц, 1H, Ar), 7,42-7,55 (м, 5H, Ar), 8,83 (уш.с, 1H, NH); 13C ЯМР (MeCN-d3) δ 22,37, 30,89, 33,02, 44,83, 51,64, 69,26, 114,62, 115,21, 127,79, 129,01, 129,55, 130,12, 133,27, 136,87, 137,98, 153,52, 168,29, 170,13, 171,79; LCMS: MH=443, 445.
Стадия 3: 3-(1-Оксо-4-((4-((2-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[1,5-a]пиразин-7(8H)-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион
К суспензии (3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль)) и 2-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[1,5-a]пиразина (95 мг, 0,496 ммоль) в сухом MeCN (5 мл, 96 ммоль) добавляли DIEA (0,197 мл, 1,128 ммоль), и полученную белую суспензию перемешивали при температуре окружающей среды в течение 2 ч и нагревали до 40°C в течение 4 дополнительных часов. Смесь охлаждали при 0°C. Суспензию фильтровали. Твердое вещество промывали водой (~50 мл) и высушивали в вакуумном сушильном шкафу при 50°C, получая 3-(1-оксо-4-((4-((2-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[1,5-a]пиразин-7(8H)-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (135 мг, 54%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,33 мин (98,2%); Т. пл.: 139-142°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,57 (д, J=19,1 Гц, 1H, CHH), 2,82-2,98 (м, 1H, CHH), 3,02 (т, J=5,5 Гц, 2H, CH2), 3,80 (с, 2H, CH2), 3,82 (с, 2H, CH2), 4,20-4,31 (м, 3H, CHH, CH2), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,30-7,36 (м, 2H, Ar), 7,38-7,44 (м, 2H, Ar), 7,45-7,54 (м, 3H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,16, 45,07, 46,54, 47,73,49,17, 51,56, 59,42, 69,35, 114,99, 115,23, 127,80, 128,92, 129,80, 129,95, 133,30, 135,73, 137,05, 152,82, 153,46, 167,97, 170,95, 172,80; Два сигнала углерода не наблюдают (возможно из-за расщепления CF3 и CCF3); LCMS: MH=555; Вычислено для C27H25F3N6O4+0,5 H2O: C, 57,55; H, 4,65; N, 14,91; F, 10,11; Найдено: C, 57,42; H, 4,32; N, 14,60; F, 9,92.
5.84 3-{4-[4-(6-МЕТОКСИ-3,4-ДИГИДРО-1Н-ИЗОХИНОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
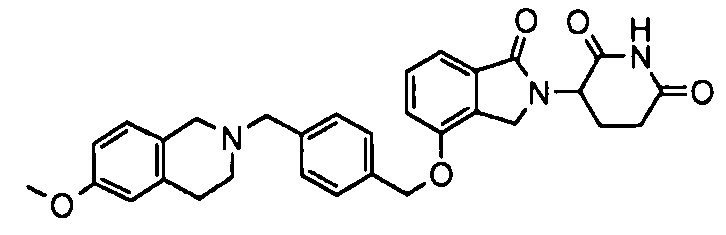
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,365 г, 0,823 ммоль) в CH3CN (10 мл) при температуре окружающей среды в течение ночи добавляли 6-метокси-1,2,3,4-тетрагидроизохинолин гидрохлорид (0,247 г, 1,235 ммоль) и N-этил-N-изопропилпропан-2-амин (0,408 мл, 2,470 ммоль). Растворитель выпаривали, и остаток перемешивали в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (2×30 мл), солевым раствором (20 мл) и упаривали до масла, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(6-метокси-3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион (0,26 г, 60%-ый выход); Т. пл.: 169-171°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 4,72 мин (98,3%), 1H ЯМР (ДМСО-d6) δ 1,90-2,06 (м, 1H, CHH), 2,32-2,46 (м, 1H, CHH), 2,53-2,71 (м, 3H, CH2, CHH), 2,71-2,83 (м, 2H, CH2), 2,83-3,02 (м, 1H, CHH), 3,46 (уш.с, 2H, CH2), 3,55-3,81 (м, 5H, CH2, CH3), 4,18-4,50 (м, 2H, CH2), 5,12 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,23 (уш.с, 2H, CH2), 6,58-6,74 (м, 2H, Ar), 6,89 (д, J=9,1 Гц, 1H, Ar), 7,24-7,62 (м, 7H, Ar), 10,98 (уш.с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,36, 28,94, 31,21, 45,10, 50,12, 51,58, 54,92, 61,51, 69,45, 111,91, 112,93, 114,97, 115,24, 126,73, 127,26, 127,72, 128,82, 129,81, 129,94, 131,81, 133,31, 135,22, 138,28, 153,51, 157,45, 168,01, 169,07, 170,96, 172,83, LC/MS m/e=526, Вычислено для C31H31N3O5 (+1,1 H2O): C, 68,27; H, 6,14; N, 7,70, Найдено: С, 68,08; H, 5,92; N, 7,47.
5.85 3-(4-((3-((4-ИЗОПРОПИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)ИЗОКСАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
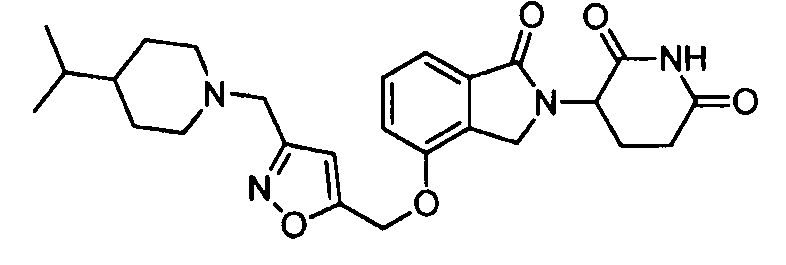
Смесь (5-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)изоксазол-3-ил)метил метансульфоната (0,28 г, 0,623 ммоль) в ацетонитриле (10 мл) перемешивали при температуре окружающей среды. Добавляли 4-изопропилпиперидин (0,095 г, 0,748 ммоль) и DIEA (0,11 г, 0,810 ммоль) и смесь перемешивали при температуре окружающей среды в течение 3 часов. Затем смесь упаривали под вакуумом. Остаток разделяли между EtOAc (75 мл) и водой (75 мл), и органическую фазу промывали водой (75 мл). Затем органическую фазу экстрагировали 1н. HCl (2×50 мл). Объединенные водные экстракты промывали EtOAc (75 мл) и затем подщелачивали твердым карбонатом натрия, и полученную смесь экстрагировали EtOAc (2×50 мл). Объединенные органические экстракты промывали водой (75 мл), высушивали (MgSO4) и упаривали, получая 180 мг (60%) твердого вещества белого цвета; Т. пл. 173-175°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-90/10 CH3CN/0,1% Н3РО4 за 10 мин: 5,65 (96,83%). 1H ЯМР (ДМСО-d6) δ 0,83 (д, J=6,6 Гц, 6H), 0,97 (уш.с, 1H), 1,09-1,24 (м, 2H), 1,30-1,46 (м, 1H), 1,58 (д, J=11,9 Гц, 2H), 1,80-2,06 (м, 3H), 2,36-2,47 (м, 1H), 2,52-2,64 (м, 1H), 2,72-3,01 (м, 3H), 3,41-3,63 (м, 2H), 4,25 (д, J=17,6 Гц, 1H), 4,41 (д, J=17,6 Гц, 1H), 5,11 (дд, J=5,0, 13,1 Гц, 1H), 5,43 (с, 2H), 6,62 (с, 1H), 7,39 (т, J=7,0 Гц, 2H), 7,46-7,57 (м, 1H), 10,97 (с, 1H). 13C ЯМР (ДМСО-d6) δ 19,62, 22,35, 28,69, 31,21, 31,85, 41,46, 45,05, 51,61, 52,58, 53,49, 60,72, 104,57, 115,11, 115,99, 129,85, 129,98, 133,51, 152,67, 161,50, 167,12, 167,82, 170,92, 172,80. Вычислено для C26H32N4O5+0,2 H2O: C, 64,50%; H, 6,75%; N, 11,57%; Найдено: С, 64,48%; H, 6,73%; N, 11,31%.
5.86 3-{4-[4-(2-МЕТИЛ-4-ФЕНИЛ-ИМИДАЗОЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
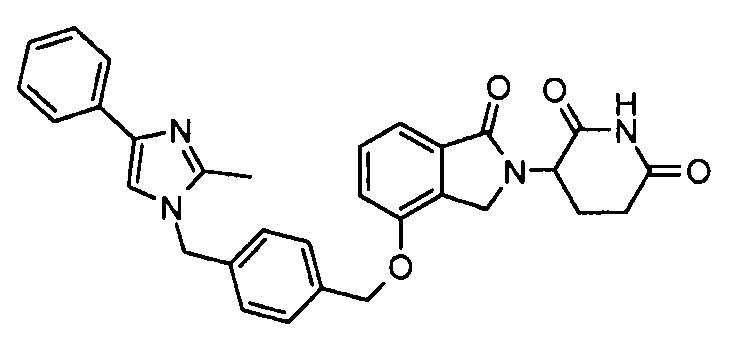
К перемешиваемому раствору 2-метил-4-фенил-1Н-имидазола (157 мг, 0,99 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (400 мг, 0,9 ммоль) и DIPEA (0,24 мл, 1,35 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 4 дней, после чего реакционную смесь разбавляли EtOAc (40 мл) и NaHCO3 (водный раствор, насыщ., 20 мл). Смесь экстрагировали. Образовывалось некоторое количество твердого вещества, и смесь фильтровали. И твердое вещество растворяли в DCM (20 мл) и MeOH (5 мл). Все органические слои объединяли и высушивали MgSO4 и концентрировали. Остаток очищали ISCO, получая 3-{4-[4-(2-метил-4-фенил-имидазол-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (310 мг, 66%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/1% Н3РО4), 5,26 мин (99,6%); Т. пл.: 270-272°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,03 (м, 1H, CHH), 2,30 (с, 3H, СН3), 2,43 (дд, J=4,3, 13,0 Гц, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,82-2,97 (м, 1H, CHH), 4,23 (д, J=17,6 Гц, 1H, CHH), 4,39 (д, J=17,6 Гц, 1H, CHH), 5,04-5,16 (м, 1H, CHH), 5,18 (с, 2H, CH2), 5,23 (с, 2H, CH2), 7,10-7,20 (м, 1H, Ar), 7,20-7,26 (м, J=8,1 Гц, 2H, Ar), 7,26-7,36 (м, 4H, Ar), 7,42-7,54 (м, 3H, Ar), 7,62 (с, 1H, NH), 7,64-7,75 (м, 2H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 12,76, 22,31, 31,16, 45,04, 48,59, 51,55, 69,17, 114,93, 115,25, 116,49, 123,92, 125,88, 127,15, 128,14, 128,36, 129,78, 129,95, 133,30, 134,58, 135,98, 137,15, 138,50, 144,57, 153,39, 167,97, 170,93, 172,80; LCMS MH=521; Вычислено для C31H28N4O4+0,3 H2O: C, 70,79; H, 5,48; N, 10,65; Найдено: С, 70,68; H, 5,21; N, 10,52.
Региоизомерную структуру подтверждали с помощью ROESY.
5.87 2-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-1,2,3,4-ТЕТРАГИДРО-ИЗОХИНОЛИН-7-КАРБОНИТРИЛ
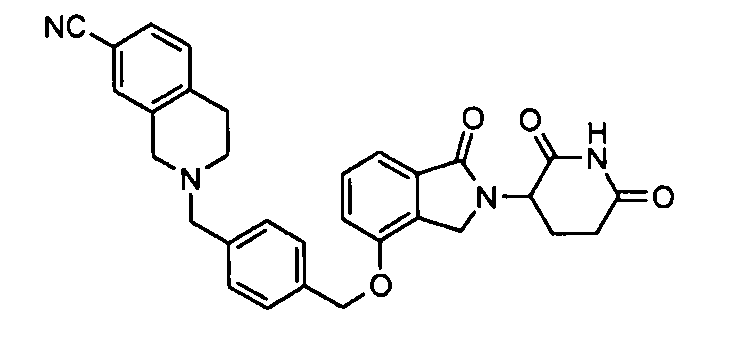
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,358 г, 0,808 ммоль) в CH3CN (10 мл) добавляли 1,2,3,4-тетрагидроизохинолин-7-карбонитрил (0,192 г, 1,211 ммоль), образовывалась суспензия. Затем добавляли N-этил-N-изопропилпропан-2-амин (0,267 мл, 1,615 ммоль), получая прозрачный раствор. Он снова стал мутным через 10 минут. Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, к полученному твердому веществу добавляли простой эфир (30 мл), перемешивали, фильтровали, и фильтр очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 2-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-1,2,3,4-тетрагидро-изохинолин-7-карбонитрил (0,324 г, 77%-ый выход); Т. пл.: 145-147°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN/0,1% H3PO4), 4,62 мин (95,8%). 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,64-2,75 (м, 2H, CH2), 2,82-3,00 (м, 3H, CHH, CH2), 3,58 (с, 2H, CH2), 3,67 (с, 2H, CH2), 4,20-4,48 (м, 2H, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 7,26-7,42 (м, 5H, Ar), 7,43-7,61 (м, 5H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 28,88, 31,20, 45,09, 49,39, 61,14, 69,42, 108,23, 114,98, 115,24, 119,01, 127,77, 128,80, 129,49, 129,69, 129,82, 129,94, 130,32, 133,31, 135,38, 136,40, 137,99, 140,51, 153,51, 168,01, 170,98, 172,83, LC/MS m/e=521. Вычислено для C31H28N4O4 (+0,8 H2O): C, 69,60; H, 5,58; N, 10,47, Найдено: С, 69,21; H, 5,21; N, 10,22.
5.88 3-(4-((5-(Морфолинометил)ПИРИДИН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
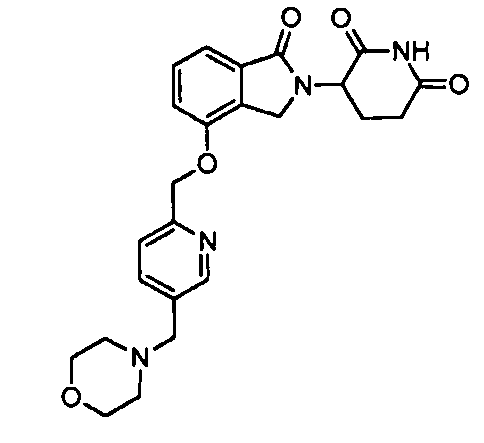
Стадия 1: Раствор 5-(хлорметил)метилпиколината (3,00 г, 16,14 ммоль) в ацетонитриле (30 мл) добавляли к морфолину (4,5 мл, 51,7 ммоль). Полученный темный раствор перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь разбавляли Et2O (~100 мл), и образовавшееся твердое вещество удаляли фильтрацией. Фильтрат концентрировали, и масляный остаток разделяли между EtOAc (125 мл) и 1н. NaHCO3 (50 мл). Водный слой промывали большим количеством EtOAc (~100 мл). Объединенные органические слои промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 5-(морфолинометил)метилпиколинат как темное масло (3,4 г, 89%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,29-2,42 (м, 4H, CH2, СН2), 3,54-3,61 (м, 6Н, СН2, СН2, СН2), 3,88 (с, 3Н, СН3), 7,91 (дд, J=2,2, 8,0 Гц, 1Н, Pyr), 8,03 (д, J=8,5 Гц, 1Н, Pyr), 8,64 (д, J=1,5 Гц, 1H, Pyr); 13C ЯМР (ДМСО-d6) δ 52,28, 53,02, 59,03, 66,08, 124,51, 137,47, 137,57, 146,28, 150,08, 165,11.
Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К хорошо перемешиваемому раствору 5-(морфолинометил)метилпиколината (3,4 г, 14,39 ммоль) в THF (30 мл) при 2°C (в ванне со льдом) добавляли через шприц 1М раствор литий-алюминийгидрида (15,83 мл, 15,83 ммоль) в THF. Выделялся газ, и измененную реакционную смесь перемешивали при ~2°C в течение ~1 часа. Реакционную смесь гасили медленным добавлением 1н. NaHCO3 (20 мл) при 0°C и затем разбавляли EtOAc (~300 мл) и H2O (100 мл). Смесь перемешивали и затем добавляли 1н. водный раствор соли Рочелла, чтобы разбить эмульсию. Водный слой экстрагировали EtOAc (300 мл). Водный слой насыщали твердым NaCl и экстрагировали еще раз EtOAc. Объединенный органический слой промывали минимальным солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая сырой продукт (5-(морфолинометил)пиридин-2-ил)метанол в форме оранжевого масла (1,7 г, 56%-ый сырой выход). Этот сырой продукт использовали на следующей стадии без очистки. 1H ЯМР (ДМСО-d6) δ 2,30-2,38 (м, 4H, СН2, СН2), 3,47 (с, 2Н, СН2), 3,51-3,63 (м, 4Н, СН2, СН2), 4,54 (д, J=5,5 Гц, 2Н, СН2ОН), 5,36 (т, J=5,8 Гц, 1H, OH), 7,42 (д, J=7,9 Гц, 1H, Pyr), 7,70 (дд, J=2,2, 8,0 Гц, 1H, Pyr), 8,38 (д,J=1,7 Гц, 1H, Pyr).
Стадия 3: 5-Амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,0 г, 3,42 ммоль) и трифенилфосфин на полистироле (1,6 ммоль/г смолы) (4,28 г, 6,84 ммоль) суспендировали в THF (30 мл) при температуре окружающей среды. Смоле давали набухнуть при аккуратном перемешивании в течение приблизительно 5 минут, затем смесь охлаждали в ванне со льдом при 0°C и добавляли DIAD (1,330 мл, 6,84 ммоль), используя шприц, быстрым капельным способом. Приблизительно через 10 минут добавляли (5-(морфолинометил)пиридин-2-ил)метанол (1,069 г, 5,13 ммоль) в THF (5 мл). Полученную смесь перемешивали при температуре окружающей среды. Приблизительно через 1,5 часа смолу фильтровали на воронке из спеченного стекла, и смолу промывали 3х с последовательными циклами набухания/высушивания (смывы DCM/MeOH). Фильтрат (янтарного цвета) концентрировали в вакууме, получая сырой 5-амино-4-(4-((5-(морфолинометил)пиридин-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как коричневое масло (3,3 г). Сырой продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 4: К перемешиваемому раствору сырого 5-амино-4-(4-((5-(морфолинометил)пиридин-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1 г, 1,036 ммоль) в сухом THF (10 мл) при 0°C (ванна со льдом) добавляли трет-бутоксид калия (0,233 г, 2,072 ммоль). Полученную смесь перемешивали при 0°C в течение ~10 минут, затем давали нагреться до температуры окружающей среды. После ~3 часов реакционную смесь переносили в охлажденный раствор 20%-го AcOH в MeCN (~50 мл) на льду. Полученный раствор концентрировали досуха, и коричневый масляный остаток разделяли между EtOAc (150 мл) и 1н. NaHCO3 (35 мл). Водный слой экстрагировали дополнительным EtOAc (~150 мл). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали досуха, получая стекловидное твердое вещество. Это твердое вещество перекристаллизовывали из MeCN/Et2O, фильтровали и промывали дополнительным Et2O, получая 3-(4-((5-(морфолинометил)пиридин-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество светло-желто-коричневого цвета (78 мг, 17%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, 6,45 мин (97,3%); Т. пл.: 194-196°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,05 (м, 1H, CHH), 2,30-2,41 (м, 4H, CH2, CH2), 2,40-2,48 (м, 1H, CHH), 2,55-2,67 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,51 (уш.с, 2H, CH2N), 3,53-3,70 (м, 4H, CH2, CH2), 4,30 (д, J=17,6 Гц, 1H, CHH), 4,46 (д, J=17,6 Гц, 1H, CHH), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,31 (с, 2H, CH2O), 7,25-7,39 (м, 2H, Ar), 7,43-7,52 (м, 1H, Ar), 7,55 (д, J=7,9 Гц, 1H, Ar), 7,76 (д, J=7,6 Гц, 1H, Ar), 8,50 (с, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,16, 45,06, 51,56, 52,96, 59,16, 66,08, 70,37, 114,96, 115,41, 121,31, 129,84, 129,92, 132,53, 133,34, 137,50, 149,56, 153,27, 155,02, 167,94, 170,96, 172,83; LCMS: MH=451; Вычислено для: C24H26N4O5: C, 63,99; H, 5,82; N, 12,44; Найдено: С, 58,77; H, 5,34; N, 11,46; Cl, 1,10.
5.89 МЕТИЛОВЫЙ ЭФИР МАСЛЯНОЙ КИСЛОТЫ 4-КАРБАМОИЛ-4-(4-ГИДРОКСИ-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-МУРАВЬИНОЙ КИСЛОТЫ
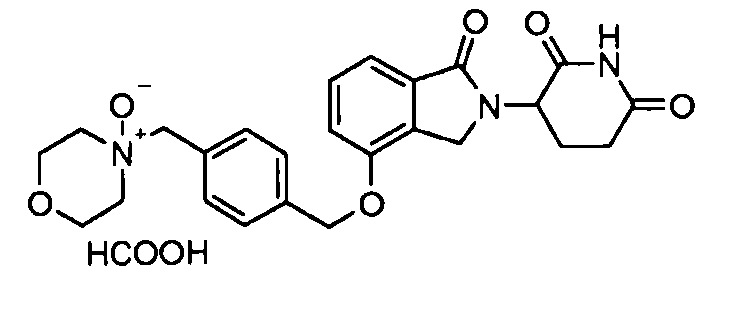
Стадия 1: Получение метилового эфира 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,0 г, 3,78 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,50 г, 1,72 ммоль) в THF (30 мл) при 0°C. Через 5 минут добавляли диизопропил-диазен-1,2-дикарбоксилат (0,75 мл, 3,78 ммоль). Через 30 минут добавляли (4-морфолин-4-илметил-фенил)-метанол (0,71 г, 3,43 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды, затем фильтровали, промывали смесью вода/MeOH (10 мл), метиленхлоридом (10 мл) и еще три раза вода/MeOH (10 мл), метиленхлорид (10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали хроматографией на колонке для флэш-хроматографии ISCO (120 г, градиент MeOH/CH2Cl2 от 0% до 5% за 60 минут), получая метиловый эфир 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как пенистое твердое вещество белого цвета (0,62 г, 75%-ый выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион
Трет-бутоксид калия (0,14 г, 1,25 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,60 г, 1,25 ммоль) в THF (15 мл) при 0°C в течение 10 минут. Смесь гасили парой пипеток 1н. HCl и нейтрализовали насыщенным раствором бикарбоната натрия до рН=8. Смесь обрабатывали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и затем очищали хроматографией на колонке для флэш-хроматографии ISCO (40 г, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 3-[4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,13 г, 23%-ый выход); Т. пл.: 208-210°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 15/85 за 10 мин (CH3CN/0,1% H3PO4): tR=3,86 мин (98,1%), LC/MS (Acquity UPLC ВЕН С18, 2,1×50 мм, 0,8 мл/мин, 1,7 мкм, градиент 5/95-85/15 за 5 мин, изократический при 85/15 за 1 мин (CH3CN/0,1% HCOOH: вода/0,1% HCOOH)): m/e=450. 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CH), 2,28-2,40 (м, 4H, 2CH2), 2,40-2,46 (м, 1H, CH), 2,54-2,65 (м, 1H, CH), 2,82-3,00 (м, 1H, CH), 3,46 (с, 2H, CH2), 3,51-3,65 (м, 4H, 2CH2), 4,20-4,48 (м, 2H, ArCH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, ArCH2O), 7,33 (д, J=7,6 Гц, 4H, ArH), 7,39-7,55 (м, 3H, ArH), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 45,09, 51,58, 53,14, 62,10, 66,17,69,41, 114,98, 115,24, 127,65, 128,99, 129,82, 129,95, 133,32, 135,30, 137,70, 153,50, 167,99, 170,98, 172,83. Вычислено для C25H27N3O5: С, 66,80; H, 6,05; N, 9,35. Найдено: С, 66,49; H, 5,90; N, 9,29.
Стадия 3: Получение метилового эфира масляной кислоты 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-муравьиной кислоты
Пероксид водорода (10,24 г, 90,2 ммоль) добавляли к перемешиваемому раствору 3-(4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,507 г, 1,128 ммоль) в ацетонитриле (30 мл) и воде (10 мл) при температуре окружающей среды. Раствор перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и остаток очищали препаративной ВЭЖХ (MeCN/вода, с 0,1% HCOOH), получая метиловый эфир масляной кислоты 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-муравьиной кислоты (0,23 г, 44%-ый выход); Т. пл.: 154-156°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN/0,1% H3PO4), 4,35 мин (98,7%). 1H ЯМР (ДМСО-d6) δ 1,91-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 3,04 (д, J=12,3 Гц, 2H, CH2), 3,54 (тд, J=3,8, 11,8 Гц, 2H, CH2), 3,71-3,82 (м, 2H, CH2), 3,92-4,07 (м, 2H, CH2), 4,22-4,49 (м, 2H, CH2), 4,63 (с, 2H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,28 (с, 2H, CH2), 7,29-7,38 (м, 2H, Ar), 7,44-7,66 (м, 5H, Ar), 11,02 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,38, 31,20, 45,08, 51,59, 60,67, 62,05, 69,15, 71,81, 114,95, 115,33, 127,21, 128,77, 129,84, 129,97, 133,12, 133,35, 137,87, 153,40, 164,93, 167,98, 170,98, 172,83, LC/MS m/e=466. Вычислено для C25H27N3O6 ((+1,0 HCOOH+1,3 H2O): С, 58,38; H, 5,95; N, 7,85. Найдено: С, 58,21; H, 6,30; N, 7,81.
5.90 3-(4-((5-(морфолинометил)ИЗОКСАЗОЛ-3-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
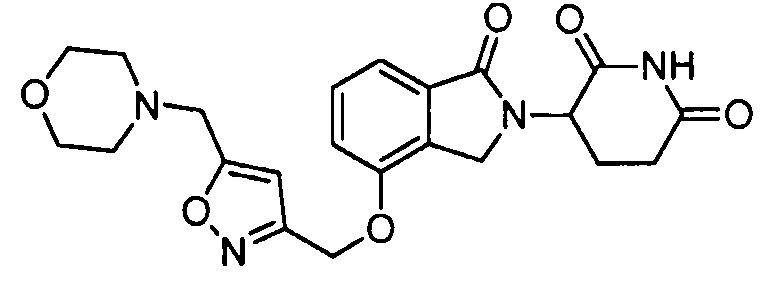
Стадия 1: 5-(Гидроксиметил)изоксазол-3-этилкарбоксилат (2 г, 11,69 ммоль) растворяли в DCM (30 мл) и трифенилфосфине (3,37 г, 12,85 ммоль), и CBr4 (3,68 г, 11,10 ммоль) добавляли при 0°C. Смесь перемешивали в течение 2 часов при 0°C. Смесь концентрировали под вакуумом, остаток очищали ISCO (80 г колонка, этилацетат в градиенте гексанов 0-20% за 40 минут), получая 5-(бромметил)изоксазол-3-этилкарбоксилат (2,5 г, 91%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 1,43 (т, J=7,1 Гц, 3H, CH3), 4,46 (кв, J=7,2 Гц, 2H, CH2), 4,50 (с, 2H, CH2), 6,74 (с, 1H, Ar).
Стадия 2: Смесь 5-(бромметил)изоксазол-3-этилкарбоксилата (2,3 г, 9,83 ммоль), морфолина (1,284 мл, 14,74 ммоль) и триэтиламина (2,055 мл, 14,74 ммоль) в ацетонитриле перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали досуха под вакуумом, остаток разделяли между этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (30 мл), органический слой отделяли и промывали солевым раствором, высушивали над MgSO4, растворитель удаляли при пониженном давлении, получая 5-(морфолинометил)изоксазол-3-этилкарбоксилат (2,3 г, 95%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 1,43 (т, J=7,2 Гц, 3H, CH3), 2,45-2,64 (м, 4H, CH2, CH2), 3,67-3,81 (м, 6H, CH2, CH2, CH2), 4,45 (кв, J=7,2 Гц, 2H, CH2), 6,65 (с, 1H, Ar).
Стадия 3: К раствору 5-(морфолинометил)изоксазол-3-этилкарбоксилата (2,3 г, 9,57 ммоль) в THF (50 мл) при 0°C добавляли Dibal-Н (28,7 мл, 28,7 ммоль). Сформированную смесь нагревали до температуры окружающей среды и перемешивали при температуре окружающей среды. Смесь гасили 1M солью Рочелла и экстрагировали EtOAc (3×50) мл, объединенный органический слой промывали насыщенным раствором бикарбоната натрия, солевым раствором и высушивали над сульфатом магния. Органический растворитель выпаривали, получая (5-(морфолинометил)изоксазол-3-ил)метанол (1,48 г, 78%-ый выход); 1H ЯМР (ХЛОРОФОРМ-d) δ 2,50-2,66 (м, 4H, CH2), 3,70 (с, 2H, CH2), 3,72-3,82 (м, 4H, CH2, CH2), 4,76 (уш.с, 2H, CH2), 6,29 (с, 1H, Ar).
Стадия 3: Смесь (5-(морфолинометил)изоксазол-3-ил)метанола (740 мг, 3,73 ммоль), 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1091 мг, 3,73 ммоль) и трифенилфосфина на полимерной подложке (1,86 г, 5,6 ммоль, 3 ммоль/г) в THF (100 мл) охлаждали до 0°C и добавляли DIAD (1132 мг, 5,6 ммоль), сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали через целит, смолу промывали этилацетатом (5×200 мл), объединенный органический слой выпаривали досуха, остаток очищали ISCO (80 г колонка, MeOH в градиенте DCM 0-5% за 50 минут), получая 5-амино-4-(4-((5-(морфолинометил)изоксазол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (600 мг, 34%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,98-2,32 (м, 4H, CH2, CH2), 2,36-2,45 (м, 4Н, СН2, СН2), 3,50 (с, 3Н, СН3), 3,53-3,62 (м, 4Н, СН2, СН2), 3,69 (с, 2Н, СН2), 4,29-4,60 (м, 2Н, СН2), 4,66-4,82 (м, 1Н, СН), 5,33 (с, 2Н, СН2), 6,59 (с, 1Н, Ar), 7,19 (с, 1Н, NHH), 7,33 (дд, J=4,2, 7,6 Гц, 2H, Ar), 7,47 (д, J=7,6 Гц, 1H, Ar), 7,59 (с, 1H, NHH).
Стадия 4: К смеси 5-амино-4-(4-((5-(морфолинометил)изоксазол-3-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (580 мг, 1,228 ммоль) в THF (30 мл) при 0°C добавляли трет-бутоксид калия (152 мг, 1,350 ммоль). Сформированную смесь перемешивали при 0°C в течение 0,5 часов и нагревали до температуры окружающей среды за 0,5 часа. Реакционную смесь гасили HCl (1н., 3 мл), THF выпаривали под вакуумом, добавляли насыщенный раствор бикарбоната натрия (20 мл), сформированный осадок собирали фильтрацией и ресуспендировали в ацетонитриле (7 мл), получая 3-(4-((5-(морфолинометил)изоксазол-3-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (325 мг, 60 выход); Т. пл. 218-220°C. ВЭЖХ: (Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% HCOONH4): 3,45 (98,98%). 1H ЯМР (ДМСО-d6) δ 1,86-2,08 (м, 1H), 2,31-2,48 (м, 5H), 2,52-2,68 (м, 1H), 2,81-3,01 (м, 1H), 3,48-3,64 (м, 4H), 3,69 (с, 2H), 4,26 (д, J=17,6 Гц, 1H), 4,34-4,53 (м, J=17,6 Гц, 1H), 5,11 (дд, J=5,1, 13,2 Гц, 1H), 5,34 (с, 2H), 6,57 (с, 1H), 7,25-7,43 (м, 2H), 7,44-7,59 (м, 1H), 10,98 (с, 1H). 13C ЯМР (ДМСО-d6) δ 22,38, 31,20, 45,03, 51,61, 52,51, 52,73, 61,62, 66,03, 103,25, 115,13, 115,83, 129,87, 130,01, 133,42, 152,95, 160,09, 167,86, 169,84, 170,94, 172,82. Вычислено для C22H24N4O6: С, 59,99%; H, 5,49%; N, 12,72%; Найдено: С, 59,00%; H, 5,03%; N, 12,14%.
5.91 3-(4-((3-МЕТИЛИЗОКСАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
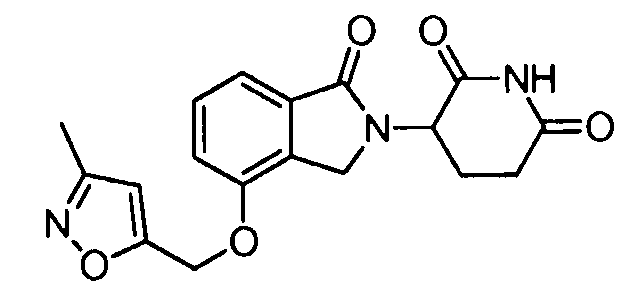
Стадия 1: Смесь 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1 г, 3,42 ммоль) и (3-метилизоксазол-5-ил)метанола (0,387 г, 3,42 ммоль) в THF (50 мл) охлаждали до 0°C. Добавляли трифенилфосфин, связанный с полимером, 3 ммоль/г (2,3 г, 6,84 ммоль), затем DIAD (1,347 мл, 6,84 ммоль). Ванне со льдом давали растаять, и смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали досуха, и остаток загружали в сухом виде непосредственно на колонку с силикагелем, разгоняя градиент гексаны-EtOAc. Продукт элюировали в 100%-ом EtOAc, и выход таким образом полученной сырой смеси составил 0,75 г (57%).
Стадия 2: Остаток от стадии 1 растворяли в THF (50 мл) и охлаждали до 0°C. Затем добавляли трет-бутоксид калия (0,230 г, 2,053 ммоль). Через 30 минут реакционную смесь гасили добавлением AcOH (0,5 мл), и смесь упаривали под вакуумом. Затем смесь суспендировали в смеси EtOAc (100 мл) и 10%-го водного раствора карбоната натрия (100 мл), и эту бифазную смесь перемешивали в течение 1 часа и затем фильтровали, и фильтр промывали водой (50 мл) и этилацетатом (50 мл). После высушивания под вакуумом, продукт получали как твердое вещество белого цвета, 510 мг, при 42%-ом выходе; Т. пл. 278-280°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4: 3,27 (96,63%). 1H ЯМР (ДМСО-d6) δ 1,91-2,07 (м, 1H), 2,24 (с, 3H), 2,34-2,48 (м, 1H), 2,52-2,68 (м, 1H), 2,80-3,01 (м, 1H), 4,24 (д, J=17,6 Гц, 1H), 4,33-4,47 (м, J=17,6 Гц, 1H), 5,10 (дд, J=4,9, 13,0 Гц, lH), 5,40(с, 2H), 6,54 (с, 1H), 7,28-7,45 (м, 2H), 7,46-7,60 (м, 1H), 10,99 (с, 1H). 13C ЯМР (ДМСО-d6) δ 10,89, 22,39, 31,24, 45,00, 51,64, 60,65, 105,05, 115,03, 115,93, 129,85, 129,95, 133,51, 152,68, 159,68, 166,88, 167,83, 171,05, 172,96. Вычислено для C18H17N3O5+0,3 CH2Cl2: C, 57,72%; H, 4,66%; N, 11,03%; Найдено: С, 57,61%; H, 4,47%; N, 10,70%.
5.92 3-(1-ОКСО-4-((4-((3-(ТРИФТОРМЕТИЛ)-5,6-ДИГИДРО-[1,2,4]триазоло[4,3-A]ПИРАЗИН-7(8H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
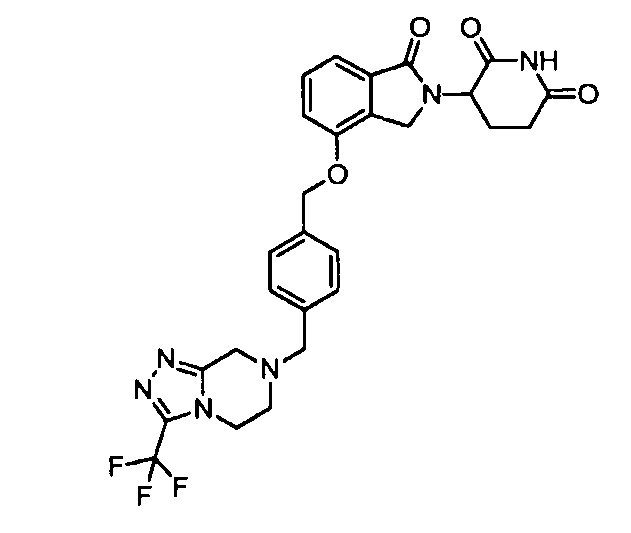
К смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) и 3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразина гидрохлорида (113 мг, 0,496 ммоль) в сухом MeCN (5 мл, 96 ммоль) при температуре окружающей среды добавляли DIEA (0,276 мл, 1,579 ммоль), и затем полученную смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли тетрабутиламмония бромид (10,18 мг, 0,032 ммоль) и повышали температуру до 40°C в течение выходных. Реакционную смесь переносили частями при перемешивании в колбу с водой (~50 мл). Полученную суспензию перемешивали при температуре окружающей среды с периодической обработкой ультразвуком, чтобы разбить твердые агрегаты. Через ~1 час перемешивания твердое вещество фильтровали и промывали небольшой частью воды. Сырую смесь очищали препаративной ВЭЖХ, получая 3-(1-оксо-4-((4-((3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-a]пиразин-7(8H)-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (120 мг, 48%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×50 мм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 4,86 мин (97,7%); Т. пл.: 142-144°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 0H, CHH), 2,45 (дд, J=4,3, 13,0 Гц, 0H, CHH), 2,57 (дд, J=2,3, 15,5 Гц, 0H, CHH), 2,81-2,99 (м, 3H, CH2, CHH), 3,78 (с, 2H, CH2), 3,84 (с, 2H, CH2) 4,15 (т, J=5,4 Гц, 2H, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 2H, Ar), 7,38-7,44 (м, 2H, Ar), 7,45-7,58 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,16, 43,03, 45,06, 47,30, 48,09, 51,56, 59,51, 69,35, 114,99, 115,23, 116,80 (кв, J=269,6 Гц, M10), 127,79, 128,94, 129,78, 129,93, 133,30, 135,75, 136,99, 142,31 (кв, J=38,5 Гц, M24), 152,28, 153,46, 167,97, 170,95, 172,80; LCMS: MH=555; Вычислено для C27H25F3N6O4+0,75 H2O: С, 57,09; H, 4,70; N, 14,79; F, 10,03; Найдено: С, 57,09; H, 4,55; N, 14,74; F, 9,76.
5.93 1'-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-[2,4']БИПИРИДИНИЛ-1'-ИЙ ФОРМИАТ
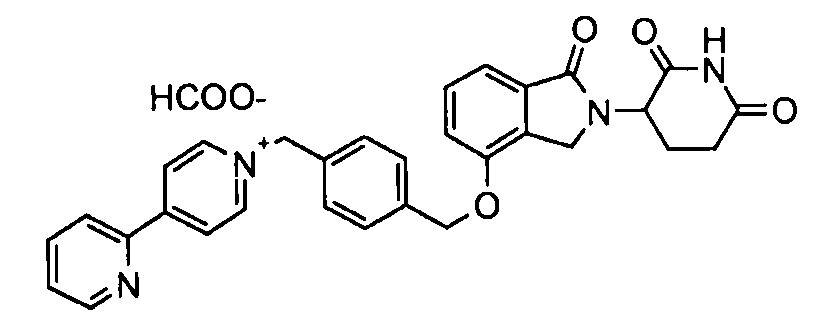
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,52 г, 1,173 ммоль) в CH2Cl2 (10 мл) добавляли 2,4'-бипиридин (0,220 г, 1,408 ммоль) и N-этил-N-изопропилпропан-2-амин (0,388 мл, 2,346 ммоль). Получали светло-зеленый прозрачный раствор и перемешивали его при температуре окружающей среды в течение ночи. Маслянистое твердое вещество/масло перемешивали в воде (20 мл) и CH2Cl2 (25 мл) в течение одного часа. Водную фазу отделяли и далее промывали CH2Cl2 (2×30 мл). Объединенные фазы CH2Cl2 экстрагировали водой (2×10 мл). Объединенные водные фазы упаривали при 50°C на водяной бане, получая твердое вещество грязно-белого цвета, которое очищали препаративной ВЭЖХ (MeCN/вода в 0,1% HCOOH), получая 1'-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-[2,4']бипиридинил-1'-ий формиат (0,213 г, 35%-ый выход); Т. пл.: 132-134°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN/0,1% H3PO4), 4,58 мин (96,3%). 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,33-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 4,17-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,28 (с, 2H, CH2), 5,91 (с, 2H, CH2), 7,27-7,37 (м, 2H, Ar), 7,43-7,52 (м, 1H, Ar), 7,54-7,64 (м, 4H, Ar), 7,64-7,72 (м, 1H, Ar), 8,08-8,18 (м, 1H, Ar), 8,39-8,50 (м, 2H, Ar), 8,77-8,92 (м, 3H, Ar), 9,33 (д, J=6,8 Гц, 2H, Ar), 10,99 (уш.с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,38, 31,18, 45,03, 51,58, 62,47, 68,94, 114,97, 115,36, 123,50, 124,75, 126,66, 128,41, 128,92, 129,82, 129,94, 133,34, 134,04, 137,93, 138,21, 145,31, 149,68, 150,64, 153,22, 153,30, 164,91,167,93, 170,95, 172,82, LC/MS m/e=519. 520, Вычислено для C31H27N4O4 +·HCOO-: С, 68,08; H, 5,00; N, 9,92. Найдено: С, 61,92; H, 5,05; N, 8,98.
5.94 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((2-(ТРИФТОРМЕТИЛ)-5,6-ДИГИДРОИМИДАЗО[1,2-A]ПИРАЗИН-7(8H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
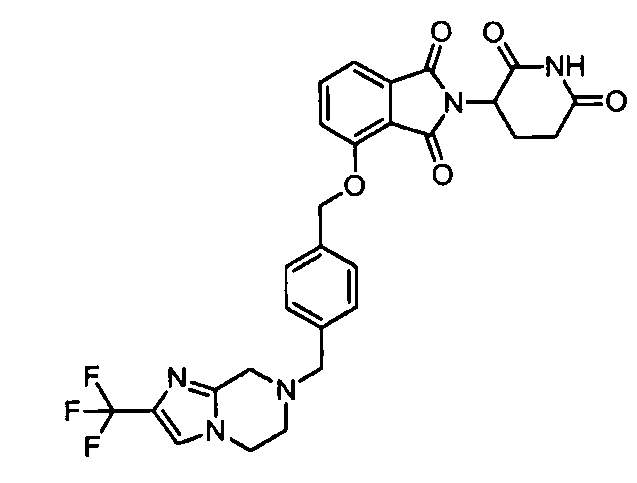
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 2-(трифторметил)-5,6,7,8-тетрагидроимидазо[1,2-a]пиразина гидрохлорида (137 мг, 0,601 ммоль) в сухом MeCN (10 мл) добавляли DIEA (0,334 мл, 1,914 ммоль), и полученную суспензию перемешивали при температуре окружающей среды в течение 3 дней. Воду добавляли частями (общее количество ~35 мл), чтобы образовывать осадок. Смесь экстенсивно обрабатывали ультразвуком с мягким нагреванием и затем перемешивали в течение нескольких часов при температуре окружающей среды, пока не получали тонкодисперсное твердое вещество. Смесь фильтровали на воронке из спеченного стекла со средним размером пор, и корку промывали дополнительным количеством воды (~50 мл), высушивали отсасыванием и помещали в вакуумный сушильный шкаф при 50°C на ночь, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((2-(трифторметил)-5,6-дигидроимидазо[1,2-a]пиразин-7(8H)-ил)метил)бензил)-окси)изоиндолин-1,3-дион как твердое вещество светло-желто-коричневого цвета (275 мг, 89%-ый выход): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,44 мин (97,2%); Т. пл.: 178-180°C; 1H ЯМР (ДМСО-d6) δ 1,95-2,14 (м, 1H, CHH), 2,42-2,66 (м, 2H, CHH, CHH), 2,80-2,99 (м, 3H, CH2, CHH), 3,62 (с, 2H, CH2), 3,74 (с, 2H, CH2), 4,02 (т, J=5,4 Гц, 2H, CH2), 5,09 (дд, J=5,3, 12,8 Гц, 1H, CH), 5,37 (с, 2H, CH2), 7,35-7,44 (м, 2H, Ar), 7,49 (т, 3H, Ar), 7,61 (д, J=8,5 Гц, 1H, Ar), 7,73 (д, J=1,1 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 44,10, 48,37, 48,73, 50,63, 60,16, 69,89, 115,51, 116,58, 119,35, 119,40, 120,19, 123,98, 127,38, 128,92, 133,24, 135,15, 136,99, 137,31, 144,00, 155,49, 165,27, 166,75, 169,87, 172,72. не все сигналы углерода Ar наблюдают из-за расщепления фтором; LCMS: MH=568; Вычислено для C28H24F3N5O5+0,2 H2O: C, 58,89; H, 4,31; N, 12,26; F, 9,98; Найдено: C, 58,91; H, 3,99; N, 11,91; F, 9,37.
5.95 3-(1-ОКСО-4-((4-((2-(ТРИФТОРМЕТИЛ)-5,6-ДИГИДРОИМИДАЗО[1,2-A]ПИРАЗИН-7(8H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
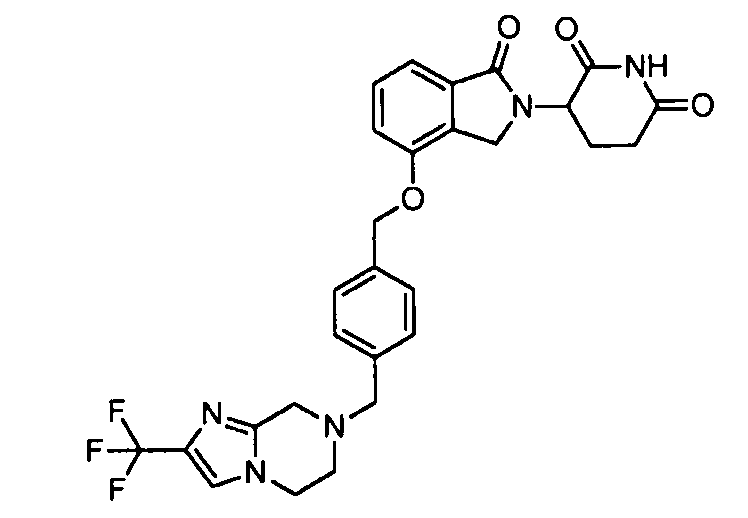
К суспензии (S)-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) и 2-(трифторметил)-5,6,7,8-тетрагидроимидазо[1,2-a]пиразиан гидрохлорида (113 мг, 0,496 ммоль) в сухом MeCN (5 мл) добавляли DIEA (0,276 мл, 1,579 ммоль). Полученный раствор перемешивали в течение 3 дней при температуре окружающей среды и затем нагревали до 50°C в течение 16 часов. Реакционную смесь разбавляли водой (~35 мл), и осажденное твердое вещество экстенсивно обрабатывали ультразвуком при 50°C, чтобы помочь разбить твердые агрегаты. Полученную суспензию фильтровали, и твердое вещество промывали дополнительным количеством воды (~50 мл) и Et2O (~50 мл). Твердое вещество снова промывали водой (~75 мл) и Et2O (~30 мл) и затем высушивали в вакуумном сушильном шкафу при 50°C в течение ночи, получая 3-(1-оксо-4-((4-((2-(трифторметил)-5,6-дигидроимидазо[1,2-a]пиразин-7(8H)-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество желто-коричневого цвета (189 мг, 76%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 6,99 мин (95,8%); Т. пл.: 148-150°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,09 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,80-3,06 (м, 3H, CH2, CHH), 3,61 (с, 2H, CH2), 3,73 (с, 2H, CH2), 4,02 (т, J=5,4 Гц, 2H, CH2), 4,26 (д, J=17,4 Гц, 1H, CHH), 4,44 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,30-7,37 (м, 2H, Ar), 7,37-7,45 (м, 2H, Ar), 7,45-7,56 (м, 3Н, Ar), 7,73 (д, J=1,3 Гц, 1H, имидазол, 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 44,10, 45,07, 48,44, 50,55, 51,55, 60,18, 69,36, 114,96, 115,23, 123,98 (кв, J=266,3 Гц, CF3), 119,37 (кв, J=4,4 Гц, CCF3), 127,79, 128,93 (кв, J=37,4 Гц, CCF3), 128,90, 129,80, 129,93, 133,30, 135,63, 137,31, 143,99, 153,48, 167,97, 170,96, 172,81, квартеты при 119,37 и 127,79 являются неполными; LCMS: MH=554; Вычислено для C28H26F3N5O4+0,58 H2O: C, 59,63; H, 4,85; N, 12,42; F, 10,11; Найдено: C, 59,25; H, 4,46; N, 12,41; F, 10,85.
5.96 3-(1-ОКСО-4-((4-((3-ПРОПОКСИАЗЕТИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
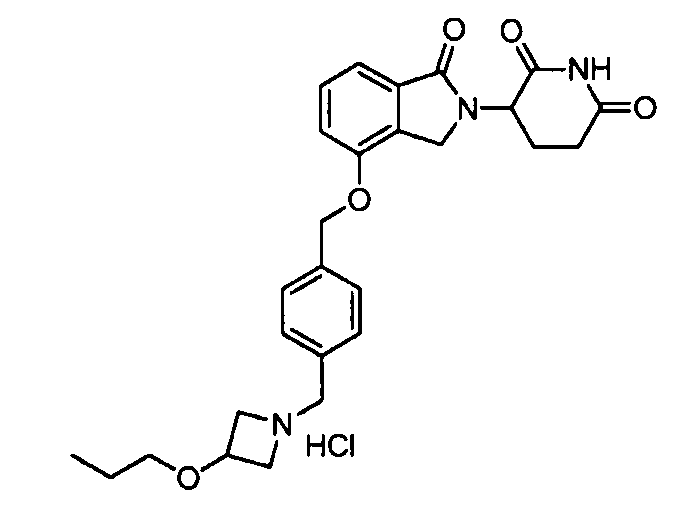
К раствору (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) в сухом MeCN (5 мл) добавляли 3-пропоксиазетидин гидрохлорид (75 мг, 0,496 ммоль) и DIEA (0,276 мл, 1,579 ммоль). Смесь перемешивали при температуре окружающей среды в течение 3 часов, и LCMS показала, что исходный бензилбромид был потреблен. Смесь нагревали до 50°C в течение ~30 минут, медленно охлаждали до температуры окружающей среды и затем сохраняли при 4°C в течение ночи. Смесь, содержащую сырой продукт, концентрировали в вакууме, и остаток растворяли в минимальном количестве DMF (~5 мл) для очистки препаративной ВЭЖХ. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 60% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая прозрачный стекловидный остаток. Добавляли 1н. HCl (2-3 мл), и смесь концентрировали досуха в вакууме. Этот процесс повторяли дважды, чтобы получить соль HCl. К прозрачному остатку добавляли MeCN и Et2O в небольших частях, и смесь обрабатывали ультразвуком, пока не получали твердое вещество белого цвета. Суспензию концентрировали досуха в вакууме и дважды упаривали из Et2O (части по 3-4 мл), пока не получали свободнотекучее твердое вещество белого цвета. Это твердое вещество высушивали в вакуумном сушильном шкафу в течение ночи, получая 3-(1-оксо-4-((4-((3-пропоксиазетидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (52 мг, 22%): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 6,60 мин (99,8%); Т. пл.: 142-144°C; 1H ЯМР (ДМСО-d6) δ 0,87 (т, J=7,4 Гц, 3Н, СН3), 1,40-1,59 (м, 2Н, СН2), 1,91-2,06 (м, 1Н, СНН), 2,35-2,47 (м, 1Н, СНН), 2,53-2,65 (м, 1Н, СНН), 2,84-3,01 (м, 1Н, СНН), 3,28-3,39 (м, 2Н, СН2О, перекрывались ДМСО), 3,89 (уш.с, 2H, СН2), 4,06-4,23 (м, 2Н, СН2), 4,23-4,32 (м, 2Н, СНН, СНН), 4,36 (с, 2Н, СН2), 4,44 (д, J=17,6 Гц, 1Н, СНН), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,28 (с, 2H, CH2), 7,27-7,38 (м, 2H, Ar), 7,44-7,53 (м, 1H, Ar), 7,55 (с, 4H, Ar), 10,97 (с, 1H, NH), 11,09 (уш.с, 1H, HCl); 13C ЯМР (ДМСО-d6) δ -0,01, 12,34, 24,22, 32,97, 47,32, 53,70, 62,70, 63,30, 69,33, 71,21, 71,67, 117,13, 117,29, 129,67, 130,77, 131,82, 131,96, 134,99, 137,66, 138,23, 155,27, 170,35, 172,81, 174,98; LCMS: MH=478; Вычислено для C27H31N3O5+3,2 H2O+1,3 HCl: C, 55,66; H, 6,70; N, 7,21; Cl, 7,91; H2O, 9,89; Найдено: С, 53,73; H, 6,33; N, 6,90; Cl, 7,63; H2O, 9,62.
5.97 ((S)-3-(4-((4-(((3S,5S)-3,5-диметилморфолино)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
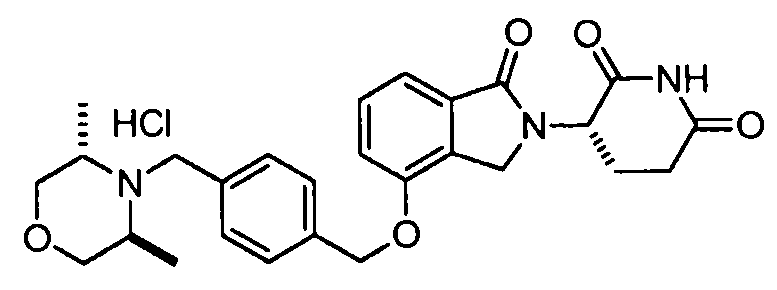
К суспензии (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (250 мг, 0,564 ммоль) в MeCN (5 мл) добавляли (3S,5S)-3,5-диметилморфолин (71,4 мг, 0,620 ммоль). Смесь перемешивали и кратко обрабатывали ультразвуком, получая прозрачный раствор, затем немедленно добавляли DIEA (0,197 мл, 1,128 ммоль), и полученную смесь перемешивали при температуре окружающей среды в течение 2 дней. Реакционную смесь концентрировали в вакууме, и масляный остаток разделяли между EtOAc (150 мл) и 1н. NaHCO3 (30 мл). Органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество белого цвета. Это твердое вещество растворяли в DMF (8 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 50% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме. 1н. HCl (8 мл) добавляли к концентрату, и все растворители выпаривали, получая липкое твердое вещество. Это твердое вещество повторно растворяли в минимальном количестве воды, замораживали и лиофилизировали, получая ((S)-3-(4-((4-(((3S,5S)-3,5-диметилморфолино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как белое пушистое твердое вещество (160 мг, 55%-ый выход): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 10 мин, CH3CN/0,1% H3PO4, 5,89 мин (97,0%); Т. пл.: 230-232; 1H ЯМР (ДМСО-d6) δ 1,28 (д, J=6,8 Гц, 3H, CH3), 1,38 (д, J=6,2 Гц, 3H, CH3), 1,86-2,08 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,58 (д, J=17,4 Гц, 1H, CHH), 2,80-3,01 (м, 1H, CHH), 3,03-3,22 (м, 1H, CH), 3,48-3,84 (м, 3H, CH2, CH), 3,91 (дд, J=3,2, 12,3 Гц, 1H, CHH), 3,98-4,18 (м, 2H, CHH, CHH), 4,29 (д, J=17,4 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 4,72 (дд, J=3,8, 13,6 Гц, 1H, CHH), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,29 (с, 2H, CH2), 7,28-7,41 (м, 2H, Ar), 7,45-7,54 (м, 1H, Ar), 7,58 (д, J=8,1 Гц, 2H, Ar), 7,83 (д, J=8,1 Гц, 2H, Ar), 10,97 (с, 1H, NH), 11,40 (дд, J=1,2, 3,1 Гц, 1H, HCl); l3C ЯМР (ДМСО-d6) 9,35, 11,92, 22,27, 31,09, 44,99, 51,38, 51,49, 53,34, 67,65, 67,88, 68,90, 114,89, 115,30, 127,81, 129,25, 129,75, 129,89, 130,93, 133,27, 137,63, 153,29, 167,87, 170,89, 172,76; LCMS: MH=478; Вычислено для C27H31N3O5+1,3 H2O+2HCl: C, 56,46; H, 6,25; N, 7,31; Найдено: С, 56,55; H, 5,93; N,7,33.
5.98 3-{4-[4-(2-ОКСА-6-АЗА-СПИРО[3.3]ГЕПТ-6-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
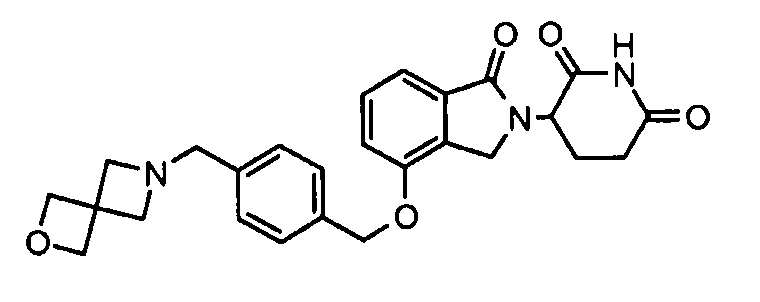
К суспензии 2-окса-6-аза-спиро[3.3]гептан оксалата (0,124 г, 0,857 ммоль) в дихлорметане (10 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,425 мл, 2,57 ммоль). Смесь перемешивали при температуре окружающей среды в течение 5 мин Затем добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,380 г, 0,857 ммоль), причем смесь была все еще суспензией. Добавляли приблизительно 3 мл ацетонитрила и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь очищали препаративной ВЭЖХ (MeCN/вода в 0,1% HCOOH), получая 3-{4-[4-(2-окса-6-аза-спиро[3.3]гепт-6-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион (39 мг, 10%-ый выход); Т. пл.: не определяли. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN)/0,1% Н3РО4), 4,32 мин (95,2%). 1H ЯМР (ДМСО-d6) δ 1,93-2,04 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,84-2,99 (м, 1H, CHH), 3,30 (с, 3H, CH2, CH2), 3,51 (с, 1H, CH2), 4,20-4,47 (м, 2H, CH2), 4,59 (с, 3H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 1H, CH2), 7,23-7,36 (м, 4H, Ar), 7,38-7,53 (м, 3H, Ar), 10,97 (уш.с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,39, 31,21, 38,54, 45,13, 51,66, 61,97, 62,85, 69,47, 79,96, 115,05, 115,26,127,62, 128,35, 129,79, 130,00, 133,35, 135,23, 137,96, 153,51, 167,99, 170,92, 172,76, LC/MS m/e=462.
5.99 3-(1-ОКСО-4-{4-[2-(ТЕТРАГИДРО-ПИРАН-4-ИЛ)-ЭТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
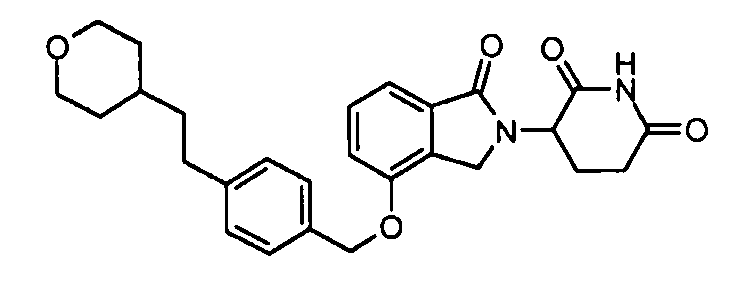
Стадия 1: Получение метилового эфира 4-[2-(тетрагидро-пиран-4-ил)-винил]-бензойной кислоты
Гидрид натрия (60% в масле) (0,378 г, 9,46 ммоль) добавляли в перемешиваемый раствор безводного ДМСО (50 мл). Смесь перемешивали при температуре окружающей среды в течение 20 мин Добавляли (4-метоксикарбонилбензил)трифенилфосфония бромид (4,65 г, 9,46 ммоль) (белый порошок) к смеси при 5~12°C на холодной водяной бане. Через два часа добавляли тетрагидро-2H-пиран-4-карбальдегид (0,9 г, 7,88 ммоль). Смесь перемешивали при температуре окружающей среды в течение двух дней. К смеси добавляли воду (50 мл) и экстрагировали этилацетатом (2×30 мл), промывали солевым раствором (50 мл), высушивали и концентрировали до маслянистого твердого вещества, которое очищали на колонке с силикагелем (EtOAc/Гексаны), получая метиловый эфир 4-[2-(тетрагидро-пиран-4-ил)-винил]-бензойной кислоты как твердое вещество белого цвета (1,2 г, 61%-ый выход). LC/MS m/e=247. Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение метилового эфира 4-[2-(тетрагидро-пиран-4-ил)-этил]-бензойной кислоты
Смесь метилового эфира 4-[2-(тетрагидро-пиран-4-ил)-винил]-бензойной кислоты (1,36 г, 5,52 ммоль) и палладия на активированном угле 10 вес.% (50% влаж.) (0,21 г, 8,92 ммоль) в метаноле (50 мл) гидрировали с водородным баллоном при температуре окружающей среды в течение ночи. Черную суспензию фильтровали через Целит, фильтрат упаривали, получая метиловый эфир 4-[2-(тетрагидро-пиран-4-ил)-этил]-бензойной кислоты как твердое вещество белого цвета (1,33 г, 97%-ый выход). LC/MS m/e=217. Его использовали на следующей стадии без дальнейшей очистки.
Стадия 3: Получение {4-[2-(тетрагидро-пиран-4-ил)-этил]-фенил}-метанола
Литий-алюминийгидрид (2,0M в THF) (2,29 мл, 4,58 ммоль) добавляли по каплям к перемешиваемому раствору метилового эфира 4-[2-(тетрагидро-пиран-4-ил)-этил]-бензойной кислоты (0,64 г, 2,58 ммоль) в тетрагидрофуране (8 мл) в ванне со льдом при 0°C. Смесь перемешивали при 0°C в течение 30 минут, раствор охлаждали в ванне со льдом и добавляли воду по каплям, чтобы образовывать белый гель, выделялся газ. Добавляли дополнительное количество воды (30 мл). Смесь экстрагировали EtOAc (3×30 мл) и разделяли эти две фазы, добавляя "1н. раствор соли Рочелла". Органическую фазу упаривали, получая {4-[2-(тетрагидро-пиран-4-ил)-этил]-фенил}-метанол как твердое вещество белого цвета (0,58 г, 102%-ый сырой выход). LC/MS m/e=203. Его использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение 4-[2-(4-бромметил-фенил)-этил]-тетрагидро-пиран
К перемешиваемой суспензии (4-(2-(тетрагидро-2H-пиран-4-ил)этил)фенил)метанола (0,57 г, 2,59 ммоль) в сухом MeCN (8 мл) при 0°C добавляли трибромфосфин (0,466 мл, 4,94 ммоль). Полученную смесь перемешивали при 0°C в течение 20 минут, затем давали нагреться до температуры окружающей среды. Мутную суспензию гасили водой (~5 мл) в ванне со льдом, добавляли дополнительное количество воды (20 мл), экстрагировали этилацетатом (2×30 мл). Объединенные органические фазы промывали солевым раствором (20 мл), высушивали над сульфатом натрия и концентрировали, получая 4-[2-(4-бромметил-фенил)-этил]-тетрагидро-пиран в форме масла (0,74 г, 101%-ый сырой выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 5: Получение метилового эфира 4-карбамоил-4-(1-оксо-4-{4-[2-(тетрагидро-пиран-4-ил)-этил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-масляной кислоты
Белую суспензию 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,764 г, 2,61 ммоль), 4-(4-(бромметил)фенетил)тетрагидро-2H-пирана (0,74 г, 2,61 ммоль) и карбоната калия (0,361 г, 2,61 ммоль) в ацетонитриле (15 мл) перемешивали при 50°C на масляной бане в течение ночи. Белую суспензию фильтровали, и фильтрат упаривали до твердого вещества белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая метиловый эфир 4-карбамоил-4-(1-оксо-4-{4-[2-(тетрагидро-пиран-4-ил)-этил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-масляной кислоты как твердое вещество белого цвета (0,96 г, 74%-ый выход). LC/MS m/e=495. Его использовали на следующей стадии без дальнейшей очистки.
Стадия 6: Получение 3-(1-оксо-4-{4-[2-(тетрагидро-пиран-4-ил)-этил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(2-(тетрагидро-2H-пиран-4-ил)этил)бензилокси)изоиндолин-2-ил)метилпентаноата (0,96 г, 1,941 ммоль) в тетрагидрофуране (10 мл) при 0°C в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,218 г, 1,941 ммоль). Смесь перемешивали в течение десяти минут, затем гасили 1н. HCl (до рН=1), нейтрализовали насыщенным раствором бикарбоната натрия до рН=7, экстрагировали метиленхлоридом (3×30 мл). Объединенные фазы метиленхлорида промывали (2×20 мл), высушивали и концентрировали до твердого вещества белого цвета. Его перемешивали в простом эфире (20 мл) в течение нескольких часов и фильтровали, получая 3-(1-оксо-4-{4-[2-(тетрагидро-пиран-4-ил)-этил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,64 г, 71%-ый выход); Т. пл.: 254-256°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (СН3СМ/0,1% Н3РО4), 7,18 мин (96,7%). 1H ЯМР (ДМСО-d6) δ 1,13-1,28 (м, 2H, СН2), 1,45-1,54 (м, 3Н, СН2, СН), 1,61 (д, J=13,0 Гц, 2Н, СН2), 1,87-2,09 (м, 1Н, СНН), 2,33-2,44 (м, 1Н, CHH), 2,60 (т, J=7,6 Гц, 3H, CH2, CHH), 2,91 (уш.с, 1H, CHH), 3,24 (тд, J=1,7, 11,6 Гц, 2H, CH2), 3,82 (дд, J=3,0, 11,1 Гц, 2H, CH2), 4,14-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,22 (д, J=8,1 Гц, 2H, Ar), 7,31-7,67 (м, 5H, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 31,63, 32,64, 33,89, 38,24, 45,10, 51,59, 67,03, 69,49, 115,01, 115,20, 127,85, 128,34, 129,79, 129,97, 133,31, 133,86, 142,20, 153,53, 168,01, 170,96, 172,82. LC/MS m/e=463, Вычислено для C27H30N2O5 (+0,1 H2O): C, 69,84; H, 6,56; N, 6,03, Найдено: С, 69,57; H, 6,64; N, 5,93.
5.100 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((6-(морфолинометил)ИМИДАЗО[1,2-A]ПИРИДИН-2-ИЛ)МЕТОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
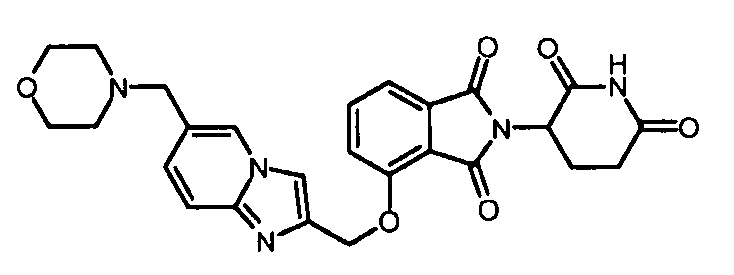
Стадия 1: Смесь 3-гидроксифталевого ангидрида (1,6 г, 9,8 ммоль) в метаноле (25 мл) нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали и концентрировали. Остаток и NaHCO3 (2,3 г, 27,3 ммоль) перемешивали в DMF (20 мл). Добавляли йодметан (3,3 г, 23,4 ммоль) и реакционную смесь нагревали при 50°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали и разбавляли EtOAc (80 мл) и водой (40 мл). Смесь подкисляли 4н. HCl, и водный слой экстрагировали EtOAc (2×40 мл). Объединенный раствор EtOAc промывали водой (×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 10%-ый EtOAc/гексан в течение 15 минут, затем до 20% за 5 минут и поддерживали в течение 15 минут, затем до 30% за 5 минут и поддерживали в течение 15 минут), получая 3-гидроксидиметилфталат (1,8 г, 89%): 1H ЯМР (CDCl3) δ 3,89 (с, 3Н), 3,92 (с, 3Н), 6,95-6,98 (дд, J=3 и 9 Гц, 1H), 7,06-7,10 (дд, J=3 и 9 Гц, 1H), 7,41-7,48 (т, J=9 Гц, 1H), 10,55 (с, 1H); 13C ЯМР (CDCl3) δ 52,64, 52,90, 110,19, 119,11, 119,83, 134,58, 135,46, 161,08, 169,33, 169,39.
Стадия 2: Смесь 6-аминоэтилникотината (5,0 г, 30,1 ммоль) и 1,3-дихлорпропан-2-она (5,7 г, 45,1 ммоль) в ацетонитриле (100 мл) нагревали с обратным холодильником в течение 17 часов. Смесь концентрировали, и остаток перемешивали с CH2Cl2 (100 мл) и насыщ. NaHCO3 (35 мл). Органический слой промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 30% EtOAc/CH2Cl2 в течение 25 минут, затем до 100% EtOAc за 15 минут), получая 2-(хлорметил)имидазо[1,2-a]пиридин-6-этилкарбоксилат (4,7 г, 65%): 1H ЯМР (CDCl3) δ 1,42 (т, J=6 Гц, 3Н), 4,38-4,45 (кв, J=6 Гц, 2H), 4,77 (с, 2H), 7,56-7,59 (д, J=9 Гц, 1H), 7,74-7,77 (дд, J=3 и 9 Гц, 1H), 8,86-8,87 (д, J=3 Гц, 1H).
Стадия 3: Раствор 2-(хлорметил)имидазо[1,2-a]пиридин-6-этилкарбоксилата (2,1 г, 8,8 ммоль) в безводном CH2Cl2 (60 мл) охлаждали в ванне сухой лед/ацетон. Раствор диизобутилалюминия гидрид/CH2Cl2 (1M, 26,4 мл, 26,4 ммоль) медленно добавляли при -70°C. После добавления реакционную смесь перемешивали при -70°C в течение 1,5 часов, затем гасили метанолом (5 мл). Смесь разбавляли CH2Cl2 (40 мл) и насыщ. NaHCO3 (40 мл) и нагревали до температуры окружающей среды. Смесь фильтровали и твердое вещество промывали CH2Cl2 (50 мл). Слои разделяли, и органический слой промывали водой (35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, получая 2-(хлорметил)имидазо[1,2-a]пиридин-6-карбальдегид (1,5 г, 89%), который использовали на следующей стадии без очистки.
Стадия 4: Раствор 2-(хлорметил)имидазо[1,2-a]пиридин-6-карбальдегида (1,5 г, 7,9 ммоль), морфолина (0,7 г, 7,9 ммоль) и уксусной кислоты (0,6 г, 9,4 ммоль) в THF (60 мл) перемешивали при температуре окружающей среды в течение 15 мин Добавляли натрий триацетоксиборгидрид (3,3 г, 15,7 ммоль), и смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь разбавляли CH2Cl2 (50 мл) и охлаждали в ванне со льдом и гасили насыщ. NaHCO3 (40 мл). Органический слой промывали солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая 4-((2-(хлорметил)имидазо[1,2-a]пиридин-6-ил)метил)морфолин (1,1 г, 53%): 1H ЯМР (CDCl3) δ 2,45-2,49 (м, 4H), 3,47 (с, 2H), 3,70-3,73 (м, 4H), 4,76 (с, 2H), 7,22-7,25 (дд, J=3 и 9 Гц, 1H), 7,53-7,57 (м, 2H), 8,03 (с, 1H).
Стадия 5: Смесь 4-((2-(хлорметил)имидазо[1,2-a]пиридин-6-ил)метил)морфолина (1,1 г, 4,2 ммоль), 3-гидроксидиметилфталата (0,9 г, 4,2 ммоль) и карбоната калия (0,6 г, 4,2 ммоль) в DMF (20 мл) нагревали при 55°C на масляной бане в течение 7 часов. Реакционную смесь охлаждали и разбавляли EtOAc (100 мл) и промывали водой (3×30 мл), солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая 3-((6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метокси)диметилфталат (0,6 г, 32%): 1H ЯМР (CDCl3) δ 2,43-2,45 (м, 4H), 3,45 (с, 2H), 3,70-3,73 (м, 4H), 3,89 (с, 3Н), 3,91 (с, 3Н), 5,39 (с, 2H), 7,19 (м, 1H), 7,30-7,38 (м, 2H), 7,45-7,61 (м, 3H), 8,01 (с, 1H).
Стадия 6: Гидроксид натрия (0,3 г, 6,5 ммоль) добавляли к перемешиваемому раствору 3-((6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метокси)диметилфталата (1,0 г, 2,3 ммоль) в этаноле (20 мл). Полученную смесь нагревали с обратным холодильником в течение 1 часа, затем охлаждали и нейтрализовали уксусной кислотой (0,5 г, 8,3 ммоль). Смесь концентрировали, и остаток растворяли в пиридине (30 мл). К этому раствору добавляли α-аминоглутаримид гидрохлорид (0,4 г, 2,3 ммоль), и полученную смесь нагревали с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали и концентрировали. Остаток перемешивали с EtOAc (50 мл) и водой (30 мл). Смесь фильтровали, и твердое вещество промывали EtOAc (20 мл). Слои разделяли, и водный слой экстрагировали EtOAc (2×40 мл). Объединенный раствор EtOAc промывали водой (2×30 мл), солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH2Cl2 в течение 5 минут, затем до 3% CH3OH/CH2Cl2 за 5 минут и поддерживали в течение 10 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут), получая 2-(2,6-диоксопиперидин-3-ил)-4-((6-(морфолинометил)имидазо[1,2-a]пиридин-2-ил)метокси)изоиндолин-1,3-дион (0,12 г, 10%): Т. пл. 255-257°C; 1H ЯМР (ДМСО-d6) δ 1,99-2,05 (м, 1H), 2,36-2,39 (м, 4H), 2,54-2,61 (м, 2H), 2,85-2,89 (м, 1H), 3,44-3,58 (м, 6H), 5,05-5,11 (дд, J=6 и 15 Гц, 1H), 5,46 (с, 2H), 7,22-7,25 (дд, J=3 и 6 Гц, 1H), 7,45-7,49 (м, 2H), 7,73-7,82 (м, 2H), 8,01 (с, 1H), 8,47 (с, 1H), 11,11 (с, 1H); 13C ЯМР (ДМСО-d6) δ 21,95, 30,89, 48,72, 52,97, 59,11, 65,32, 66,13, 111,95, 115,41, 116,24, 115,40, 120,31, 122,31, 125,79, 127,03, 133,21, 136,87, 141,13, 143,91, 155,55, 165,24, 166,76, 169,87, 172,74; Вычислено для C26H25N5O6+O,9 H2O: C, 60,09; H, 5,20; N, 13,47, Найдено: С, 60,05; H, 5,01; N, 13,22.
5.101 3-{4-[4-(1,4-ДИГИДРО-ХИНАЗОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
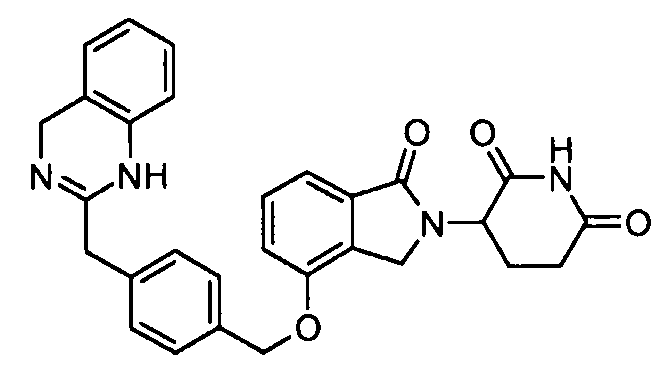
Стадия 1: Трет-бутиловый эфир (4-бромметил-фенил)-уксусной кислоты
Перемешивали раствор 2-(4-(бромметил)фенил)уксусной кислоты (2,6 г, 11,35 ммоль) в тионилхлориде (20 мл, 274 ммоль) нагревали с обратным холодильником в течение 2,5 часов. Реакционную смесь концентрировали под вакуумом, получая твердое вещество белого цвета. Это твердое вещество белого цвета добавляли к перемешиваемому раствору 2-метилпропан-2-ола (20 мл, 213 ммоль) в DCM (2 мл) в ванне лед/вода. И смесь перемешивали в ванне лед/вода в течение 2 часов и при температуре окружающей среды в течение 18 часов. Реакционную смесь добавляли к CH2Cl2 (40 мл). Органическую фазу промывали последовательно H2O (20 мл), NaHCO3 (насыщ., водный раствор, 20 мл) и солевым раствором (25 мл) и высушивали над MgSO4. Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир (4-бромметилфенил)-уксусной кислоты в форме светло-желтой жидкости (2,4 г, 74%-ый сырой выход). 1Н ЯМР (ДМСО-d6): 1,39 (с, 9H, tBu), 3,54 (с, 2H, СН2СО2), 4,69 (с, 2Н, CH2Br), 7,23, 7,39 (м, 4H, из-за примесей).
Стадия 2: Метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемой смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,5 г, 5,13 ммоль) и 2-(4-(бромметил)фенил)трет-бутилацетата (2,2 г, 7,7 ммоль) в ацетонитриле (30 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль). Полученную реакционную смесь перемешивали при 50°C в течение 27 часов и 2-(4-(бромметил)фенил)трет-бутилацетат (800 мг, 2,9 ммоль) добавляли в 2 частях. Реакционную смесь фильтровали, и светло-коричневое твердое вещество промывали ацетонитрилом (2×20 мл). Фильтрат концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-[4-(4-трет-бутоксикарбонилметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме светло-желтого липкого твердого вещества (2,1 г, 82%-ый сырой выход). LCMS MH=497.
Стадия 3: Метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-(2-трет-бутокси-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,1 г, 4,2 ммоль) в DCM (20 мл) при температуре окружающей среды добавляли воду (0,38 мл, 21,1 ммоль) с последующим медленным добавлением TFA (1,63 мл, 21,1 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 5 часов и добавляли TFA (3,2 мл) и воду (0,15 мл). Смесь сохраняли в холодильнике в течение ночи, и реакционную смесь концентрировали под вакуумом, получая метиловый эфир 4-карбамоил-4-[4-(4-карбоксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме твердого вещества грязно-белого цвета (2,3 г, 123%-ый сырой выход). 1H ЯМР (ДМСО-d6) δ 1,97-2,31 (м, 4H, CH2, СН2), 3,50 (с, 3Н, СН3), 3,58 (с, 2Н, СН2), 4,41 (д, J=17,8 Гц, 1Н, CHH), 4,53 (д, J=17,8 Гц, 1H, CHH), 4,72 (дд, J=4,6, 10,3 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,18 (уш.с, 1H, NHH), 7,24-7,34 (м, 4H, Ar), 7,40-7,50 (м, 3H, Ar), 7,57 (уш.с, 1H, NHH); LCMS MH=441.
Стадия 4: 5-Амино-4-(4-(4-(2-(2-аминобензиламино)-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксопентаноат
К перемешиваемому раствору 2-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)фенил)уксусной кислоты (820 мг, 1,9 ммоль) в DMF (10 мл при температуре окружающей среды добавляли HOBT (285 мг, 1,9 ммоль). Минуту спустя добавляли 2-(аминометил)анилин (227 мг, 1,9 ммоль), EDC (357 мг, 1,9 ммоль) и DIEA (0,81 мл, 4,65 ммоль).
Полученный раствор перемешивали при температуре окружающей среды в течение 17 часов, после чего добавляли воду (40 мл) и EtOAc (60 мл). Смесь экстрагировали, и водный слой экстрагировали EtOAc (50 мл). Органические слои объединяли, высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая 5-амино-4-(4-(4-(2-(2-аминобензиламино)-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксопентаноат в форме вязкого масла (300 мг, 30%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки. LCMS MH=545.
Стадия 5: 5-Амино-4-(4-((4-(2-((2-аминобензил)амино)-2-оксоэтил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат
Раствор 5-амино-4-(4-(4-(2-(2-аминобензиламино)-2-оксоэтил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (300 мг, 0,55 ммоль) в уксусной кислоте (4 мл, 69,9 ммоль) нагревали в микроволновой печи при 125°C в течение 10 минут. Реакционную смесь медленно добавляли к NaHCO3 (водный раствор, насыщ., 50 мл), чтобы контролировать формирование CO2. Полученную смесь экстрагировали DCM (100 мл). Органический слой промывали NaHCO3 (водный раствор, насыщ., 15 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая 5-амино-4-(4-((4-(2-((2-аминобензил)амино)-2-оксоэтил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как светло-коричневое твердое вещество (240 мг, 83%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,00-2,31 (м, 4H, CH2, СН2), 3,46 (с, 2Н, СН2), 3,49 (с, 3Н, СН3), 4,33-4,57 (м, 4Н, CHH, СНН, СН2), 4,71 (дд, J=4,8, 10,3 Гц, 1Н, CHH), 5,21 (с, 2H, CH2), 6,75 (д, J=7,7 Гц, 1H, Ar), 6,88 (д, J=4,2 Гц, 2H, Ar), 7,00-7,13 (м, 1H, Ar), 7,13-7,23 (м, 1H, NHH), 7,23-7,33 (м, 2H, Ar), 7,33-7,49 (м, 6H, Ar), 7,57 (с, 1H, NHH); LCMS MH=527.
Стадия 6: 3-{4-[4-(1,4-Дигидро-хиназолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 5-амино-4-(4-(4-((1,4-дигидрохиназолин-2-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (240 мг, 0,46 ммоль) в тетрагидрофуране (10 мл) при 0°C (ванна лед/вода) добавляли трет-бутоксид калия (56,3 мг, 0,5 ммоль). Полученную смесь перемешивали при 0°C в течение 2 часов, и к реакционной смеси добавляли KOtBu (37 мг, 0,33 ммоль) для дальнейшей реакции при 0°C. Через 1,5 часа реакционную смесь разбавляли DCM (50 мл) с последующим добавлением HCl (2 мл, 1н., водный раствор). Смесь перемешивали в течение 1 минуты и добавляли NaHCO3 (водный раствор, насыщ., 20 мл). Смесь фильтровали, чтобы получить некоторое количество твердого вещества желтого цвета. Фильтрат экстрагировали, и водный слой экстрагировали DCM (30 мл). Объединенные органические слои высушивали на MgSO4 и фильтровали. Фильтрат концентрировали, и остаток очищали ISCO, получая 3-{4-[4-(1,4-дигидро-хиназолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (25 мг, 11%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 23/77, (CH3CN/0,1% Н3РО4), 3,90 мин (96,3%); Т. пл.: 153-155°C; 1H ЯМР (ДМСО-d6) δ 1,98 (уш.с, 1H, CHH), 2,35-2,46 (м, 1H, CHH), 2,54-2,62 (м, 1H, CHH), 2,87 (дд, J=4,7, 12,8 Гц, 1H, CHH), 3,45 (с, 2H, CH2), 4,23 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 4,48 (с, 2H, CH2), 5,09 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 6,74 (д, J=7,7 Гц, 1H, Ar), 6,88 (д, J=4,2 Гц, 2H, Ar), 6,99-7,10 (м, 1H, Ar), 7,25-7,56 (м, 8H, Ar, NH), 10,95 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,23, 31,09, 40,98, 45,02, 51,48, 69,32, 114,83, 115,11, 122,98, 125,44, 127,34, 127,78, 127,88, 128,75, 129,10, 129,72, 129,88, 133,22, 134,62, 137,18, 153,41, 167,92, 170,86, 172,73; LCMS MH=495; Вычислено для C29H25N4O4: С, 70,43; H, 5,30; N, 11,33; Найдено: N/A.
5.102 3-(1-ОКСО-4-{4-[2-(ТЕТРАГИДРО-ПИРАН-4-ИЛ)-ЭТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
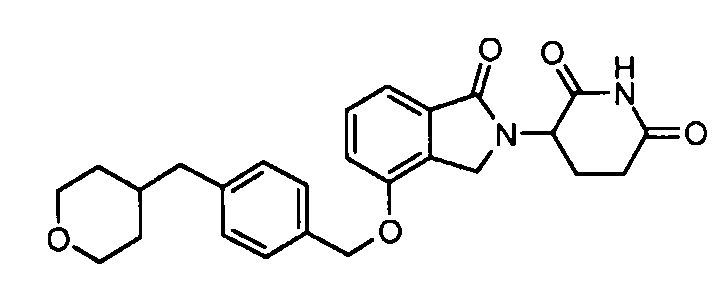
Стадия 1: Получение метилового эфира 4-(тетрагидро-пиран-4-илиденметил)-бензойной кислоты
Гидрид натрия (60% в масле) (0,240 г, 5,99 ммоль) добавляли в перемешиваемый раствор безводного ДМСО (50 мл). Смесь перемешивали при температуре окружающей среды в течение 20 минут. К смеси добавляли (4-метоксикарбонилбензил)трифенилфосфония бромид (2,94 г, 5,99 ммоль) (белый порошок) при 5~12°C на холодной водяной бане. Через два часа добавляли дигидро-2H-пиран-4(3H)-он (0,5 г, 4,99 ммоль) в ДМСО (3 мл). Смесь перемешивали при температуре окружающей среды в течение ночи, затем медленно разбавляли водой (80 мл) и экстрагировали этилацетатом (3×80 мл). Объединенные фазы этилацетата далее промывали водой (2×100 мл). Фазу этилацетата упаривали до твердого вещества грязно-белого цвета и очищали на колонке с силикагелем (EtOAc/Гексаны), получая метиловый эфир 4-(тетрагидро-пиран-4-илиденметил)-бензойной кислоты в форме масла (0,74 г, 63%-ый выход). H-ЯМР показал чистоту 72%. Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение метилового эфира 4-(тетрагидро-пиран-4-илметил)-бензойной кислоты
Смесь метилового эфира 4-(тетрагидро-пиран-4-илиденметил)-бензойной кислоты (0,743 г, 3,20 ммоль) и палладия на активированном угле 10 вес.% (влажность 50%) (0,14 г, 69,4 ммоль) в метаноле (30 мл) гидрировали двумя водородными баллонами в течение трех часов. Суспензию фильтровали через слой Целита, фильтрат упаривали, получая метиловый эфир 4-(тетрагидро-пиран-4-илметил)-бензойной кислоты в форме маслянистого твердого вещества (0,71 г, 95%-ый выход). Н-ЯМР показал чистоту 70%. Это соединение использовали на следующей стадии без дальнейшей очистки.
Стадия 3: Получение [4-(тетрагидро-пиран-4-илметил)-фенил]-метанола
Литий-алюминийгидрид (2,0 М в THF) (1,494 мл, 2,99 ммоль) добавляли по каплям к перемешиваемому раствору метилового эфира 4-(тетрагидро-пиран-4-илметил)-бензойной кислоты (0,7 г, 2,99 ммоль) в тетрагидрофуране (8 мл) в ванне со льдом при 0°C. Смесь перемешивали в течение 20 минут. Раствор охлаждали в ванне со льдом и по каплям добавляли воду (30 мл), чтобы образовать белый гель, выделялся газ. Смесь экстрагировали EtOAc (2×40 мл) и разделяли две фазы, добавляя "1н. раствор соли Рочелла". Органическую фазу упаривали и очищали на колонке с силикагелем (EtOAc/Гексаны), получая [4-(тетрагидро-пиран-4-илметил)-фенил]-метанол в форме масла (0,16 г, 26%-ый выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение 4-(4-бромметил-бензил)-тетрагидро-пирана
К перемешиваемой суспензии (4-((тетрагидро-2H-пиран-4-ил)метил)фенил)метанола (0,16 г, 0,776 ммоль) в (безводном) ацетонитриле (8 мл, 0,776 ммоль) при 0°C добавляли трибромфосфин (0,110 мл, 1,163 ммоль). Полученную смесь перемешивали при 0°C в течение 10 минут. Суспензию гасили водой (25 мл) в ванне со льдом, экстрагировали этилацетатом (2×30 мл). Объединенные орг. фазы промывали солевым раствором (20 мл), высушивали над сульфатом натрия и концентрировали, получая 4-(4-бромметил-бензил)-тетрагидро-пиран в форме масла (0,206 г, 99%-ый сырой выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 5: Получение метилового эфира 4-карбамоил-4-{1-оксо-4-[4-(тетрагидро-пиран-4-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
Белую суспензию 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,195 г, 0,669 ммоль), 4-(4-(бромметил)бензил)тетрагидро-2H-пирана (0,18 г, 0,669 ммоль) и карбоната калия (0,092 г, 0,669 ммоль) в ацетонитриле (10 мл) перемешивали при 50°C на масляной бане в течение ночи. Суспензию фильтровали, и фильтрат упаривали до масла, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая метиловый эфир 4-карбамоил-4-{1-оксо-4-[4-(тетрагидро-пиран-4-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме масла (~0,15 г, 46%-ый выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 6: Получение 3-{1-оксо-4-[4-(тетрагидро-пиран-4-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-((тетрагидро-2H-пиран-4-ил)метил)бензилокси)изоиндолин-2-ил)метилпентаноата (0,15 г, 0,312 ммоль) в тетрагидрофуране (8 мл) при 0°C в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,035 г, 0,312 ммоль). Раствор перемешивали в течение десяти минут и гасили 1н. HCl до рН=1, затем нейтрализовали насыщенным раствором бикарбоната натрия до рН=7 и экстрагировали этилацетатом (2×30 мл). Фазы EtOAc промывали водой (20 мл), солевым раствором (20 мл), высушивали и концентрировали до масла, которое очищали на колонке с силикагелем (40 г, MeOH/CH2Cl2), получая 3-(1-оксо-4-{4-[2-(тетрагидро-пиран-4-ил)-этил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (64 мг, 46%-ый выход); Т. пл.: 172-174°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN/0,1% H3PO4), 6,88 (96,1%). 1H ЯМР (ДМСО-d6) δ 1,12-1,29 (м, 2H, CH2), 1,39-1,53 (м, 2Н, СН2), 1,61-1,82 (м, 1Н, СН), 1,91-2,04 (м, 1Н, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,16-3,28 (м, 0H, CH2), 3,75-3,87 (м, J=0,9, 0,9, 4,7, 11,4 Гц, 0H, CH2), 4,18-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,20 (д, J=7,9 Гц, 2H, Ar), 7,32 (д, J=7,7 Гц, 2H, Ar), 7,40 (д, J=8,1 Гц, 2H, Ar), 7,44-7,54 (м, 1H, Ar), 10,97 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 32,46, 36,36, 42,28, 45,09, 51,58, 66,91, 69,48, 114,97, 115,20, 127,68, 129,11, 129,81, 129,94, 133,29, 134,04, 139,81, 153,53, 168,01, 170,96, 172,82, LC/MS m/e=449, Вычислено для C26H28N2O5 (+0,4 H2O): C, 68,53; H, 6,37; N, 6,15, Найдено: С, 68,35; H, 6,44; N, 6,03.
5.103 3-{1-ОКСО-4-[4-(3-ФЕНОКСИ-АЗЕТИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
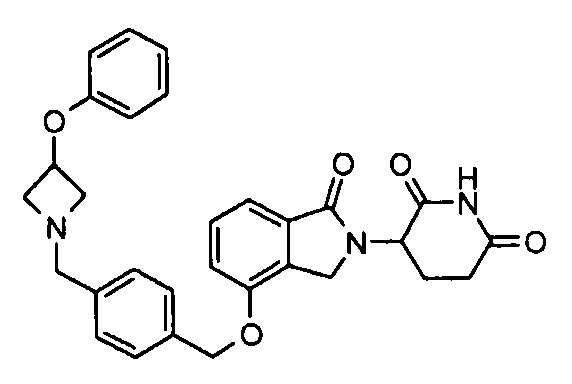
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,36 г, 0,812 ммоль) в CH3CN (10 мл) добавляли 3-феноксиазетидин (0,158 г, 1,056 ммоль) и N-этил-N-изопропилпропан-2-амин (0,268 мл, 1,624 ммоль). Раствор перемешивали при температуре окружающей среды в течение одного часа. Растворитель выпаривали и смешивали с метиленхлоридом (80 мл). Смесь промывали водой (2×40 мл), высушивали и концентрировали до масла, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{1-оксо-4-[4-(3-фенокси-азетидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,237 г, 57%-ый выход); Т. пл.: 150-152°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN, 1% Н3РО4), 4,83 мин (96,0%). 1H ЯМР (ДМСО-d6) δ 1,91-2,06 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,83-2,98 (м, 1H, CHH), 3,04 (ддд, J=1,8, 5,3, 6,9 Гц, 2H, CH2), 3,65 (с, 2H, CH2), 3,68-3,79 (м, 2H, CH2), 4,19-4,48 (м, 2H, CH2), 4,80 (квинт, J=5,7 Гц, 1H, CH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 6,82 (дд, J=1,0, 8,8 Гц, 2H, Ar), 6,89-6,98 (м, 1H, Ar), 7,22-7,37 (м, 5H, Ar), 7,40-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,10, 51,59, 60,56, 62,35, 66,23, 69,41, 114,49, 114,98, 115,23, 120,89, 127,68, 128,39, 129,60, 129,81, 129,95, 133,32, 135,23, 138,05, 153,50, 156,68, 168,01, 170,96, 172,82. LC/MS m/e=512. Вычислено для C30H29N3O5(+0,9 H2O): С, 68,27; H, 5,88; N, 7,96, Найдено: С, 67,93; H, 5,69; N, 7,84.
5.104 3-(4-{4-[3-(4-ФТОРФЕНОКСИ)-АЗЕТИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН ФОРМИАТ
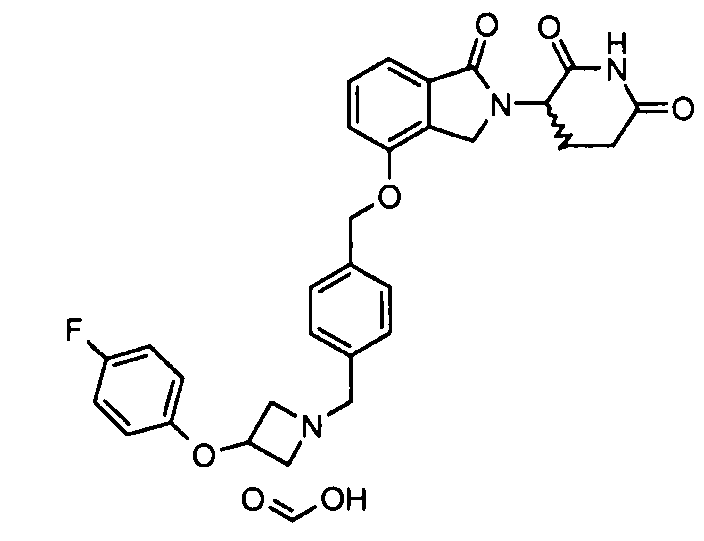
В реакционную ампулу на 20 мл, загруженную 3-(4-((4-(бромметил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дионом (300 мг, 0,677 ммоль) и 3-(4-фторфенокси)азетидин гидрохлоридом (145 мг, 0,711 ммоль), добавляли сухой MeCN (10 мл), затем DIEA (0,355 мл, 2,0 ммоль). Полученную суспензию нагревали до 50°C, получая прозрачный раствор. Через ~30 минут температуру повышали до 70°C, и реакционную смесь перемешивали в течение ~16 часов при 70°C. Реакционную смесь охлаждали до температуры окружающей среды и затем концентрировали под вакуумом. Остаток разбавляли в EtOAc (~100 мл) и затем экстрагировали 1н. NaHCO3 (2×35 мл) и солевым раствором. Высушивание (Na2SO4) и концентрация на роторном испарителе дали стекловидное твердое вещество. Et2O (~15 мл) добавляли к стекловидному твердому веществу в небольших частях и при периодической обработке ультразвуком, пока не образовывалось хорошо диспергированное твердое вещество. Суспензию энергично перемешивали и затем фильтровали на мелкопористой воронке из спеченного стекла на 15 мл. Твердое вещество растворяли в DMF (7 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 95% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(4-{4-[3-(4-фторфенокси)-азетидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион формиат как твердое вещество белого цвета (204 мг, 52%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 27/73 CH3CN/0,1% H3PO4, 3,62 мин (98,4%); Т. пл.: 166-168°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,04 (м, 1H, CHH), 2,36-2,49 (м, 1H, CHH), 2,52-2,63 (м, 1H, CHH), 2,91 (ддд, J=5,3, 13,5, 17,4 Гц, 1H, CHH), 3,03 (дд, J=5,6, 8,2 Гц, 2H, CHH, CHH), 3,64 (с, 2H, CH2N), 3,71 (дд, J=6,2, 8,3 Гц, 2H, CHH, CHH), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 4,77 (квинт, J=5,7 Гц, 1H, OCH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,22 (с, 2H, CH2), 6,75-6,91 (м, 2H, Ar), 7,00-7,21 (м, 2H, Ar), 7,28-7,38 (м, 4H, Ar), 7,39-7,62 (м, 3Н, Ar), 8,16 (с, 1H, НСООН), 10,97 (с, 1H, NH), наблюдали ~1,8 экв. HCOOH при 8,16 м.д. 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,07, 51,56, 60,41, 62,29, 66,70, 69,36, 115,20, 115,70, 115,80, 116,09, 127,66, 128,39, 129,78, 129,93, 133,30, 135,24, 153,23 (д, J=35,2 Гц, CF), 158,22, 163,15, 167,97, 170,95, 172,80; LCMS: MH=530; Вычислено для C30H28FN3O5+1,8 HCOOH+1,25 H2O: C, 60,16; H, 5,41; N, 6,62; Найдено: С, 60,08; H, 5,05; N, 6,56.
5.105 3-{4-[4-(3,3-ДИФТОР-АЗЕТИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
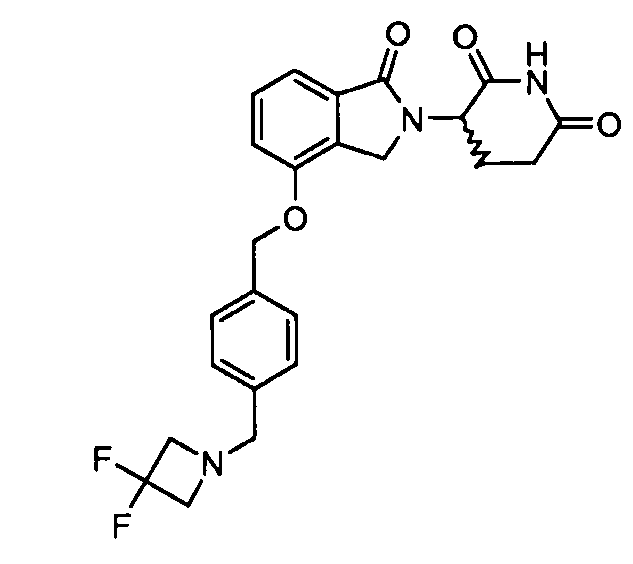
В реакционную ампулу на 20 мл, загруженную 3-(4-((4-(бромметил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дионом (300 мг, 0,677 ммоль) и 3,3-дифторазетидина гидрохлоридом (92 мг, 0,711 ммоль), добавляли сухой MeCN (10 мл), затем DIEA (0,355 мл, 2,0 ммоль). Полученную суспензия нагревали до 50°C. Через ~30 минут температуру повышали до 70°C, и реакционная смесь стала прозрачной. Перемешивание продолжали в течение ~16 часов при 70°C. Реакционную смесь охлаждали до температуры окружающей среды и затем концентрировали под вакуумом. Остаток разбавляли в EtOAc (~100 мл) и затем экстрагировали 1н. NaHCO3 (2×35 мл) и солевым раствором. Высушивание (Na2SO4) и концентрация на роторном испарителе дали стекловидное твердое вещество. Et2O (~20 мл) добавляли к стекловидному твердому веществу в небольших частях и с периодической обработкой ультразвуком, пока не получали хорошо диспергированное твердое вещество. Суспензию энергично перемешивали и затем фильтровали на воронке из спеченного стекла со средним размером пор на 15 мл. Корку промывали дополнительным количеством Et2O (~50 мл) и затем водой (~50 мл). Оставшееся твердое вещество высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 60°C в течение нескольких часов, получая 3-{4-[4-(3,3-дифтор-азетидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (187 мг, 61%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 18/82 CH3CN/0,1% H3PO4, 4,20 мин (99,1%); Т. пл.: 175-177°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,34-2,49 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,81-3,04 (м, 1H, CHH), 3,59 (т, J=12,5 Гц, 4H, CH2, CF2, CH2, CF2), 3,72 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,25-7,39 (м, 4H, Ar), 7,41-7,59 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 51,56, 61,30, 63,55 (т, J=22,0 Гц, CF2(CH2)2), 69,31, 117,29 (т, J=275,1 Гц, CF2), 114,96, 115,22, 127,71, 128,36, 129,78, 129,93, 133,30, 135,49, 137,59, 153,45, 167,97, 170,95, 172,80; LCMS: MH=456; Вычислено для C24H23F2N3O4+0,65 H2O: C, 61,70; H, 5,24; N, 8,99; Найдено: С, 61,70; H, 5,01; N, 8,77.
5.106 3-{4-[4-(3-МЕТИЛ-3-ФЕНОКСИ-АЗЕТИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
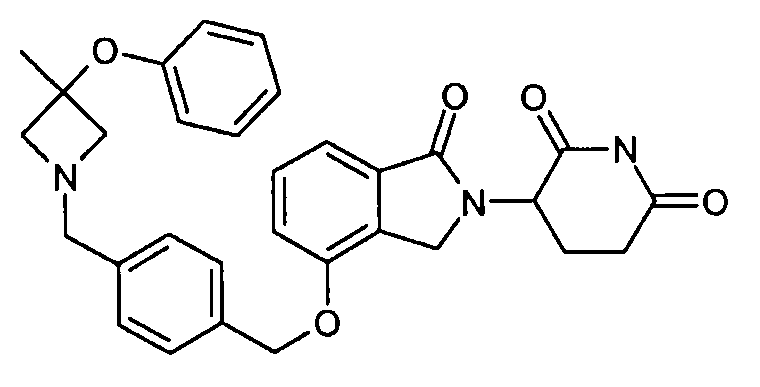
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,35 г, 0,790 ммоль) в CH2Cl2 добавляли 3-метил-3-феноксиазетидин (0,142 г, 0,869 ммоль) и N-этил-N-изопропилпропан-2-амин (0,336 мл, 1,974 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду (10 мл) и CH2Cl2 (10 мл), затем экстрагировали. Органический слой концентрировали и очищали на колонке с силикагелем, получая 3-{4-[4-(3-метил-3-фенокси-азетидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (250 мг, 60%). Температура плавления: 127-129°C. LCMS m/e=526. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 6,82 мин (94%); 1H ЯМР (ДМСО-d6) δ 1,58 (с, 3Н, СН3), 1,87-2,14 (м, 1Н, CHH), 2,36-2,44 (м, 0Н, CHH), 2,54-2,64 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,17 (д, J=7,6 Гц, 2H, CH2), 3,49 (д, J=7,9 Гц, 2H, CH2), 3,64 (с, 2H, CH2), 4,16-4,50 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 6,71 (д, J=7,7 Гц, 2H, Ar), 6,84-7,00 (м, 1H, Ar), 7,18-7,29 (м, 2H, Ar), 7,29-7,37 (м, 4H, Ar), 7,39-7,60 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,57, 22,33, 31,16, 45,06, 51,55, 62,12, 65,47, 69,36, 73,05, 114,94, 115,20, 116,40, 120,69, 127,67, 128,41, 129,48, 129,78, 129,93, 133,28, 135,21, 138,05, 153,46, 154,73, 167,97, 170,95, 172,80; Вычислено для C31H31N3O5+0,5 H2O: C: 69,65%; H: 6,03%; N: 7,83%; Найдено: С: 69,52%; H: 5,87%; N: 7,80%.
5.107 3-{4-[4-(3,3-ДИФТОР-ПИРРОЛИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
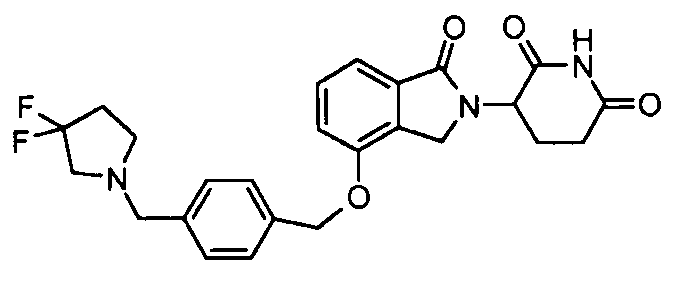
К перемешиваемой смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,8 ммоль) и 3,3-дифторпирролидин гидрохлорида (136 мг, 0,8 ммоль) в DCM (10 мл) добавляли DIPEA (0,28 мл, 1,6 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 22 часов, и реакционную смесь разбавляли DCM (30 мл). Смесь промывали водой (20 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали. Остаток очищали ISCO, получая 3-{4-[4-(3,3-дифтор-пирролидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (256 мг, 69%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3P04), 3,59 мин (98,6%); Т. пл.: 126-128°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,15-2,34 (м, 2H, CH2), 2,35-2,44 (м, 1H, CHH), 2,60 (уш.с, 1H, CHH), 2,69 (т, J=7,0 Гц, 2H, CH2), 2,76-3,01 (м, 3H, CHH, CH2), 3,62 (с, 2H, CH2), 4,20-4,32 (м, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,22-7,37 (м, 4H, Ar), 7,39-7,63 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 34,92, 35,55 (т, JC-F=22,50 Гц,), 51,30, 51,56, 58,24, 60,99 (т, JC-F=27,57 Гц,), 69,35, 114,97, 115,22, 127,69, 128,62, 129,78, 129,93, 130,38, 133,30, 135,44, 137,63, 153,46, 167,97, 170,95, 172,80; LCMS MH=470; Вычислено для C25H25F2N3O4+0,2 Н2О: С, 63,47; H, 5,41; N, 8,88; Найдено: С, 63,41; H, 5,46; N, 8,78.
5.108 3-{4-[4-(7-ФТОР-3,4-ДИГИДРО-1Н-ИЗОХИНОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
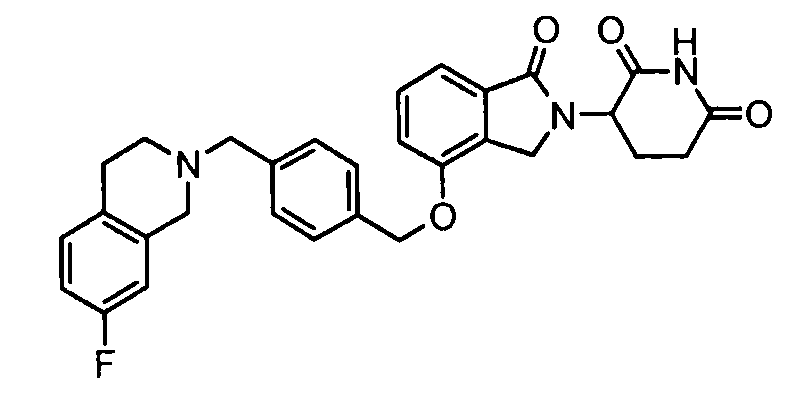
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,36 г, 0,812 ммоль) в CH3CN (10 мл) добавляли 7-фтор-1,2,3,4-тетрагидроизохинолин гидрохлорид (0,198 г, 1,056 ммоль) и N-этил-N-изопропилпропан-2-амин (0,403 мл, 2,436 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали и добавляли метиленхлорид (100 мл). Смесь промывали водой (2×50 мл), солевым раствором (50 мл), высушивали и концентрировали до пенистого твердого вещества, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(7-фтор-3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,205 г, 49%-ый выход); Т. пл.: 132-134°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 на 5 мин (CH3CN/0,1% Н3РО4), 4,75 мин (95,6%). 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,63-2,72 (м, 2H, CH2), 2,73-2,82 (м, 2H, CH2), 2,83-3,00 (м, 1H, CHH), 3,54 (с, 2H, CH2), 3,65 (с, 2H, CH2), 4,21-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,84-7,00 (м, 2H, Ar), 7,09-7,17 (м, 1H, Ar), 7,29-7,42 (м, 4H, Ar), 7,43-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 27,90, 31,20, 45,10, 50,02, 51,59, 55,13, 61,21, 69,44, 112,49, 112,78, 113,07, 115,00, 115,24, 127,74, 128,80, 129,82, 129,93 (д, JC-F=18), 130,19, 133,32, 135,33, 136,95 (д, JC-F=8), 138,13, 153,51, 160,20 (д, JC-F=240), 168,01, 170,96, 172,82, LC/MS m/e=514. Вычислено для C30H28N3O4F (+0,2 H2O): C, 69,67; H, 5,54; N, 8,12. Найдено: С, 69,34; H, 5,57; N, 7,96.
5.109 3-{4-[4-(4,7-ДИГИДРО-5Н-ТИЕНО[2,3-C]ПИРИДИН-6-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
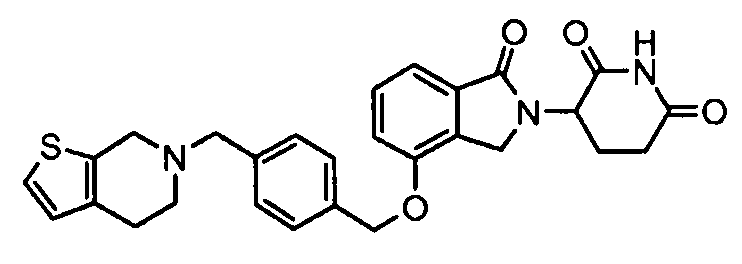
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,359 г, 0,810 ммоль) в CH3CN (10 мл) добавляли 4,5,6,7-тетрагидротиено[2,3-c]пиридин гидрохлорид (0,171 г, 0,972 ммоль) и N-этил-N-изопропилпропан-2-амин (0,402 мл, 2,430 ммоль). Смесь стала прозрачным раствором после добавления DIPEA. Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и к остатку добавляли метиленхлорид (80 мл). Смесь промывали водой (2×60 мл), солевым раствором (50 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(4,7-дигидро-5Н-тиено[2,3-c]пиридин-6-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,304 г, 74%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 на 5 мин (CH3CN/0,1% H3PO4), 4,61 мин (98,1%). 1H ЯМР (ДМСО-d6) δ 1,89-2,08 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,68 (м, 3H, CHH, CH2), 2,68-2,77 (м, 2H, CH2), 2,82-3,00 (м, 1H, CHH), 3,59 (с, 2H, CH2), 3,68 (с, 2H, CH2), 4,20-4,48 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,82 (д, J=5,1 Гц, 1H, Ar), 7,28 (д, J=5,1 Гц, 1H, Ar), 7,31-7,42 (м, 4H, Ar), 7,43-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 25,12, 31,20, 45,10, 49,59, 51,36, 51,59, 60,50, 69,45, 115,00, 115,24, 122,61, 126,99, 127,72, 128,83, 129,81, 129,95, 132,46, 133,32, 133,47, 135,35, 138,29, 153,53, 168,01, 170,96, 172,82. LC/MS m/e=502. Вычислено для C28H27N3O4S (+0,5 H2O): C, 65,86; H, 5,53; N, 8,23. Найдено: С, 65,64; H, 5,44; N, 8,04.
5.110 3-{4-[4-(6,7-ДИГИДРО-4H-ТИЕНО[3,2-C]ПИРИДИН-5-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
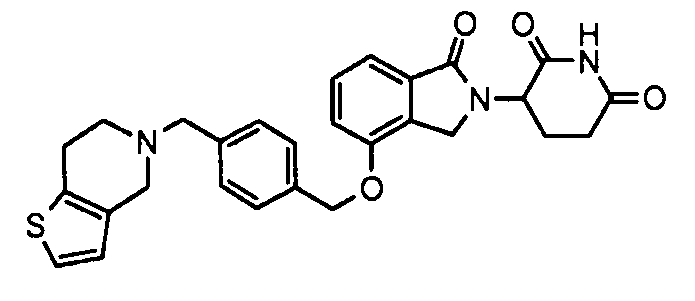
К суспензии 4,5,6,7-тетрагидротиено[3,2-c]пиридина (0,145 г, 1,038 ммоль) в CH3CN (10 мл) добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,354 г, 0,799 ммоль) и N-этил-N-изопропилпропан-2-амин (0,264 мл, 1,597 ммоль). Смесь стала прозрачным раствором после добавления DIPEA. Смесь перемешивали при температуре окружающей среды в течение двух часов. Растворитель выпаривали и добавляли метиленхлорид (80 мл). Смесь промывали водой (2×50 мл), солевым раствором (50 мл), высушивали и концентрировали до масла, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[4-(6,7-дигидро-4H-тиено[3,2-c]пиридин-5-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,312 г, 78%-ый выход); Т. пл.: 143-145°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 на 5 мин (CH3CN/0,1% H3PO4), 4,51 мин (97,0%). 1H ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,68-2,83 (м, 4H, CH2, CH2), 2,84-3,00 (м, 1H, CHH), 3,42-3,49 (м, 2H, CH2), 3,68 (с, 2H, CH2), 4,20-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,76 (д, J=5,1 Гц, 1H, Ar), 7,25 (д, J=5,1 Гц, 1H, Ar), 7,30-7,41 (м, 4H, Ar), 7,43-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 24,99, 31,20, 45,10, 50,18, 51,59, 52,42, 60,91, 69,45, 115,00, 115,24, 122,91, 125,42, 127,72, 128,82, 129,82, 129,95, 132,77, 133,32, 133,96, 135,30, 138,38, 153,53, 168,01, 170,96, 172,83. LC/MS m/e=502. Вычислено для C28H27N3O4S (+0,4 H2O): C, 66,10; H, 5,51; N, 8,26. Найдено: С, 65,92; H, 5,45; N, 8,00.
5.111 3-{1-ОКСО-4-[4-(3,3,4,4-ТЕТРАФТОР-ПИРРОЛИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
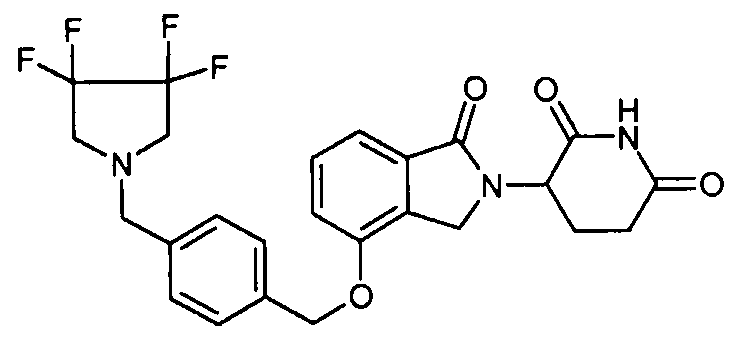
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,35 г, 0,790 ммоль) в CH2Cl2 добавляли 3,3,4,4-тетрафторпирролидин гидрохлорид (0,142 г, 0,79 ммоль) и N-этил-N-изопропилпропан-2-амин (336 мкл, 1,974 ммоль). Смесь нагревали до 70°C в течение 3 дней. Реакционную смесь концентрировали, и полученное твердое вещество забирали в CH2Cl2 (20 мл) и экстрагировали водой (20 мл). Органический слой концентрировали и очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 3-{1-оксо-4-[4-(3,3,4,4-тетрафтор-пирролидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (120 мг, 30%). Температура плавления: 164-166°C. LCMS m/e=506. ВЭЖХ Waters Symmetry С-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H20 в течение 5 мин и остановка при 95/5 на 5 мин: 6,67 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,86-2,09 (м, 1H, CHH), 2,34-2,44 (м, 1H, CHH), 2,55-2,67 (м, 1H, CHH), 2,81-3,03 (м, 1H, CHH), 3,15 (т, J=13,4 Гц, 4H, CH2, CH2), 3,72 (с, 2H, CH2), 4,19-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 7,26-7,39 (м, 4H, Ar), 7,43-7,58 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 51,56, 57,01, 57,47, 57,82, 58,15, 69,29, 114,97, 115,25, 119,39, 122,84, 127,80, 128,75, 129,80, 129,95, 133,30, 135,88, 136,13, 153,45, 167,97, 170,95, 172,80; Вычислено для C25H23F4N3O4+0,4 H2O: C: 58,57%; H: 4,67%; N: 8,20%; Найдено: С; 58,46%; H: 4,35%; N: 8,08%.
5.112 3-(4-{4-[2-(4-ФТОРФЕНИЛ)-2-МЕТИЛ-МОРФОЛИН-4-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
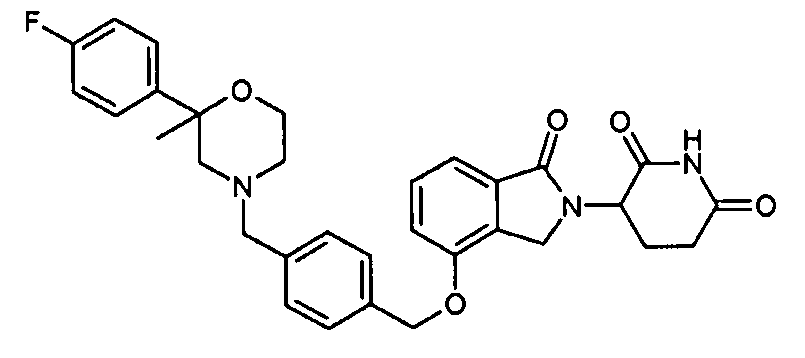
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,35 г, 0,790 ммоль) в CH2Cl2 добавляли 2-(4-фторфенил)-2-метилморфолин (0,170 г, 0,869 ммоль) и N-этил-N-изопропилпропан-2-амин (0,336 мл, 1,974 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли воду и CH2Cl2, затем экстрагировали. Органический слой концентрировали и очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 3-(4-{4-[2-(4-фторфенил)-2-метил-морфолин-4-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,27 г, 61%). Температура плавления: 118-120°C. LCMS m/e=558. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 6,90 мин (94%); 1H ЯМР (ДМСО-d6) δ 1,32 (с, 3Н, CH3), 1,87-2,09 (м, 1Н, CHH), 2,22-2,46 (м, 4H, CHH, CH2, CHH), 2,57 (д, J=18,5 Гц, 1H, CHH), 2,93 (уш.с, 2H, CHH, CHH), 3,35-3,55 (м, J=1,9 Гц, 3H, CH2, CHH), 3,57-3,76 (м, 1H, CHH), 4,16-4,54 (м, 2H, CH2), 5,00-5,19 (м, 1H, NCH), 5,24 (с, 2H, CH2), 7,12 (тд, J=1,5, 8,9 Гц, 2H, Ar), 7,27-7,41 (м, 6H, Ar), 7,41-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 27,95, 31,16, 45,06, 51,56, 52,70, 60,63, 61,07, 61,77, 69,39, 74,52, 114,40, 114,68, 115,00, 115,22, 127,57, 127,76, 127,86, 128,98, 129,77, 129,95, 133,30, 135,37, 137,59, 141,20, 153,46, 159,21, 162,42, 167,97, 170,93, 172,80. Вычислено для C32H32FN3O5: C: 68,93%; H: 5,78%; N: 7,54%; Найдено: С: 67,20%; H: 5,26%; N: 7,17%.
5.113 3-{4-[4-(6-ФТОР-3,4-ДИГИДРО-1Н-ИЗОХИНОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
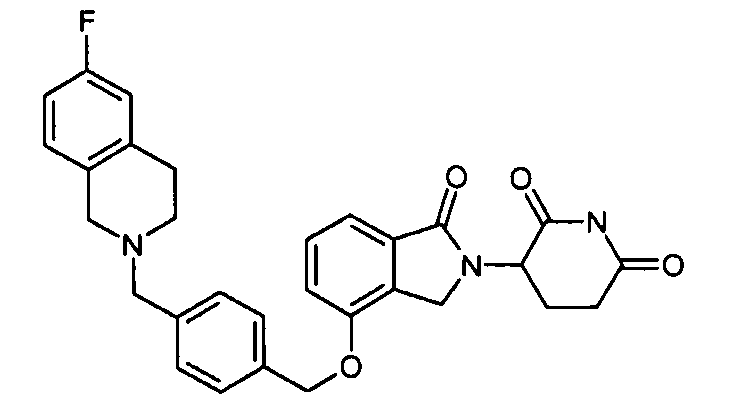
К 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диону (0,35 г, 0,790 ммоль) в CH2Cl2 добавляли 6-фтор-1,2,3,4-тетрагидроизохинолин гидрохлорид (0,163 г, 0,869 ммоль) и N-этил-N-изопропилпропан-2-амин (0,336 мл, 1,974 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. У смеси добавляли воду и CH2Cl2 и экстрагировали. Органический слой концентрировали, получая твердое вещество. Это твердое вещество перемешивали с простым эфиром, и суспензию фильтровали, получая 3-{4-[4-(6-фтор-3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,28 г, 69%). Температура плавления: 123-125°C. LCMS m/e=514. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 6,6 мин (94%), 1H ЯМР (ДМСО-d6) δ 1,88-2,06 (м, 1H, CHH), 2,34-2,48 (м, J=13,4 Гц, 1H, CHH), 2,57 (д, J=18,3 Гц, 1H, CHH), 2,62-2,71 (м, 2H, CH2), 2,76-3,00 (м, 3H, CH2, CHH), 3,51 (с, 2H, CH2), 3,65 (с, 2H, CH2), 4,11-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,93 (д, J=9,3 Гц, 2H, Ar), 6,99-7,12 (м, 1H, Ar), 7,28-7,43 (м, 4H, Ar), 7,43-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 28,70, 31,16, 45,07, 49,65, 51,55, 54,75, 61,33, 69,42, 112,29, 112,57, 114,36, 114,64, 114,97, 115,22, 127,70, 128,02, 128,14, 128,78, 129,78, 129,93, 130,78, 133,30, 135,30, 136,51, 136,61, 138,17, 153,49, 158,83, 162,04, 167,97, 170,95, 172,80; Вычислено для C30H28FN3O4+0,5 H2O: C: 68,95%; H: 5,59%; N: 8,04%, Найдено: С: 68,68%; H: 5,31%; N: 7,89%.
5.114 3-{1-ОКСО-4-[4-(3-ФЕНИЛ-5,6-ДИГИДРО-8H-ИМИДАЗО[1,2-A]ПИРАЗИН-7-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
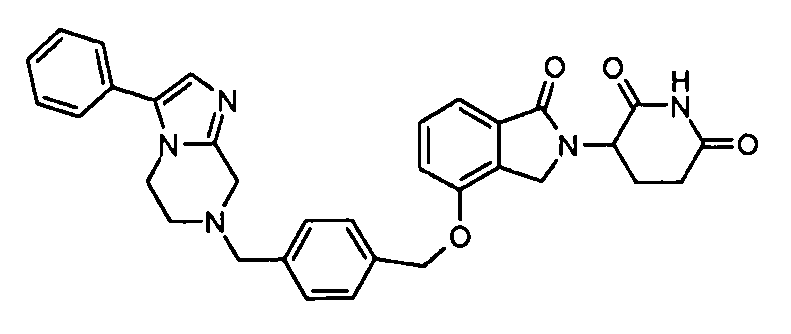
К смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,8 ммоль) и 3-фенил-5,6,7,8-тетрагидроимидазо[1,2-a]пиразина (157 мг, 0,8 ммоль) в DCM (10 мл) добавляли DIPEA (0,28 мл, 1,6 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 23 часов и затем добавляли 3-фенил-5,6,7,8-тетрагидроимидазо[1,2-a]пиразин (94 мг, 0,45 ммоль) и DIPEA (0,1 мл, 0,6 ммоль). Смесь концентрировали и перемешивали в ацетонитриле (7 мл), DCM (2 мл) и DIPEA (0,2 мл) при 60°C в течение 16 часов. Реакционную смесь разбавляли DCM (30 мл) и промывали водой (20 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали. Остаток очищали ISCO, получая 3-{1-оксо-4-[4-(3-фенил-5,6-дигидро-8H-имидазо[1,2-a]пиразин-7-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как светло-желтое твердое вещество (82 мг, 18%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 27/73, (CH3CN/0,1% H3PO4), 4,89 мин (98,3%); Т. пл.: 131-133°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,84 (т, J=5,4 Гц, 2H, CH2), 2,88-2,99 (м, 1H, CHH), 3,64 (с, 2H, CH2), 3,74 (с, 2H, CH2), 4,03 (т, J=5,2 Гц, 2H, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CHH), 5,26 (с, 2H, CH2), 7,02 (с, 1H, Ar), 7,29-7,38 (м, 3H, Ar), 7,39-7,46 (м, 4H, Ar), 7,46-7,54 (м, 5H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,43, 30,26, 42,58, 44,17, 48,31, 50,64, 59,57, 68,52, 114,13, 114,33, 125,24, 126,26, 126,33, 126,87, 127,83, 128,04, 128,83, 128,90, 129,06, 130,23, 132,40, 134,69, 136,60, 142,49, 152,59, 167,08, 170,04, 171,90; LCMS MH=562; Вычислено для C33H31N5O4+0,8 H2O+0,31 CH2Cl2: C, 66,42; H, 5,56; N, 11,63; Найдено: С, 66,10; H, 5,25; N, 11,49.
5.115 3-{1-ОКСО-4-[4-(4-ТРИФТОРМЕТИЛ-ИМИДАЗОЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
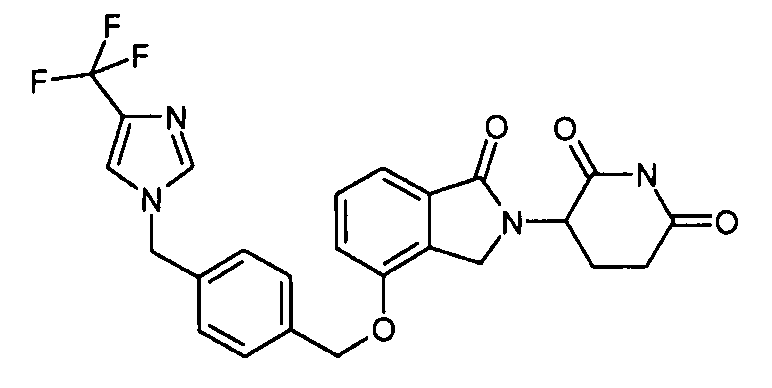
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,35 г, 0,790 ммоль) в CH3CN добавляли 4-(трифторметил)-1Н-имидазол (0,118 г, 0,869 ммоль) и N-этил-N-изопропилпропан-2-амин (0,336 мл, 1,974 ммоль). Смесь нагревали при 70°C в течение 2 дней. К реакционной смеси затем добавляли CH2Cl2 и воду и экстрагировали. Органический слой концентрировали, и полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 3-{1-оксо-4-[4-(4-трифторметил-имидазол-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (80 мг, 20%). Температура плавления 148-150°C. LCMS m/e=499. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 8,89 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,33-2,48 (м, J=4,3, 13,0 Гц, 1H, CHH), 2,57 (д, J=17,9 Гц, 1H, CHH), 2,80-2,99 (м, 1H, CHH), 4,18-4,47 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 5,27 (с, 2H, CH2), 7,25-7,41 (м, 4H, Ar), 7,43-7,57 (м, 3H, Ar), 7,91 (д, J=1,1 Гц, 1H, Ar), 8,00 (с, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,16, 45,04, 49,62, 1,55, 69,10, 114,91, 115,26, 120,53, 127,83, 128,14, 129,78, 129,95, 133,30, 136,49, 136,64, 139,07, 153,36, 167,96, 170,93, 172,80. Вычислено для C25H21F3N4O4+0,5 H2O: С; 59,17%; H, 4,37%; N, 11,04%. Найдено: С; 59,21%; H, 4,11%; N, 10,90%.
5.116 3-(4-{3-[4-(4-ФТОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
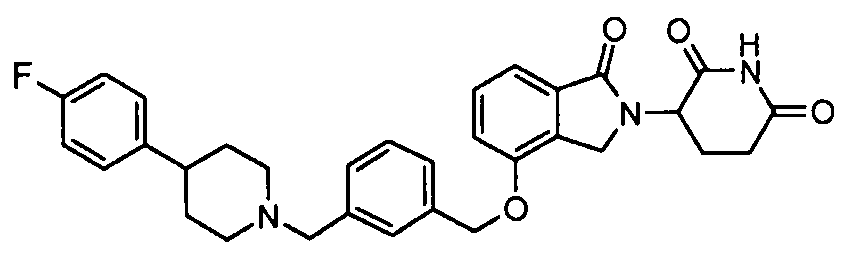
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,31 г, 0,699 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(4-фторфенил)пиперидин гидрохлорид (0,181 г, 0,839 ммоль) и N-этил-N-изопропилпропан-2-амин (0,347 мл, 2,098 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение одного часа. Растворитель выпаривали, и полученный остаток очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(4-{3-[4-(4-фторфенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,176 г, 47%-ый выход); Т. пл.: 139-141°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 на 5 мин (CH3CN/0,1% H3PO4), 4,95 мин (95,5%). 1H ЯМР (ДМСО-d6) δ 1,49-1,77 (м, 4H, СН2, СН2), 1,89-2,09 (м, 3Н, СН2, СНН), 2,35-2,47 (м, 1Н, СНН), 2,53-2,62 (м, 1Н, СНН), 2,81-2,99 (м, 3Н, СН2, СНН), 3,51 (с, 2Н, СН2), 4,20-4,49 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,04-7,15 (м, 2H, Ar), 7,21-7,53 (м, 9H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 15,14, 22,36, 31,18, 33,13, 41,01, 45,12, 51,59, 53,50, 62,18, 69,63, 114,75, 115,01, 115,20, 115,26, 126,22, 128,00, 128,34, 128,44, 129,76, 129,98, 133,31, 136,47, 138,79, 142,35, 153,44, 160,58 (д, JC-F=242 Гц,), 167,99, 170,95, 172,79. LC/MS m/e=542. Вычислено для C32H32N304F (+0,2 H20): C, 70,49; H, 5,99; N, 7,71. Найдено: С, 70,24; H, 6,14; N, 7,58.
5.117 2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-4-[4-(2-ТРИФТОРМЕТИЛ-5,6,8,8A-ТЕТРАГИДРО-1Н-[1,2,4]ТРИАЗОЛО[1,5-A]ПИРАЗИН-7-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-ИЗОИНДОЛ-1,3-ДИОН
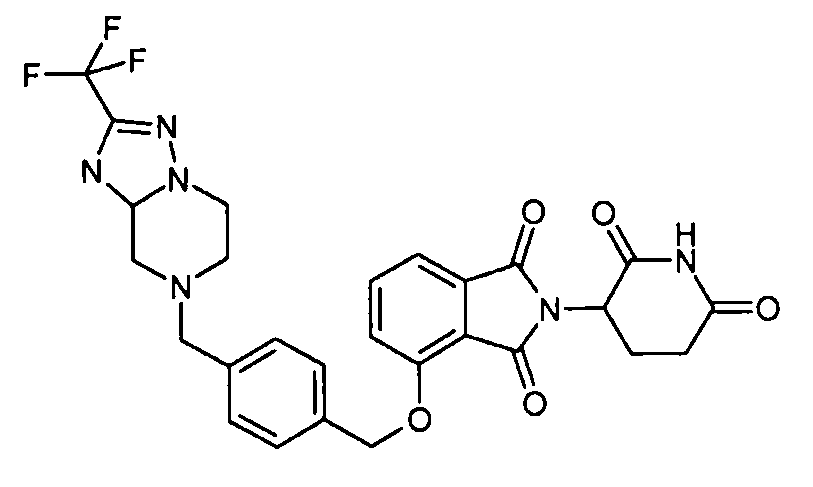
Стадия 1: Получение 3-((4-(гидроксиметил)бензил)окси)диметилфталата
3-Гидроксидиметилфталат (10 г, 47,6 ммоль) и (4-(хлорметил)фенил)метанол (7,82 г, 50,0 ммоль) растворяли в сухом DMF (60 мл). К раствору добавляли K2CO3 (6,90 г, 50,0 ммоль) и смесь перемешивали при 80°C в течение 16 часов. DMF удаляли в вакууме, и остаток разделяли между EtOAc (300 мл) и водой (100 мл). Органический слой промывали дополнительным количеством воды (100 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме до 3-((4-(гидроксиметил)бензил)окси)-диметилфталата в форме вязкого масла янтарного цвета (19 г): LCMS: МН=331; сырой продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-((4-(гидроксиметил)бензил)окси)фталевой кислоты
3-(4-(Гидроксиметил)бензилокси)диметилфталат (19 г фактический вес, 15,72 г, 47,6 ммоль, предполагая количественный выход с предыдущей стадии) растворяли в THF (30 мл). К раствору добавляли воду (30 мл). Добавляли водный раствор NaOH (10н., 25 мл, 250 ммоль), и смесь энергично перемешивали при 70°C в течение 2,5 часов. Смеси давали охладиться до температуры окружающей среды, концентрировали в вакууме до сиропа и затем переносили в колбу, содержащую 6н. HCl (45 мл), на льду. Немедленно осаждалось твердое вещество, и суспензию разбавляли водой (~60 мл). Смесь фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Корку промывали дополнительным количеством воды (~60 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C в течение 4 часов, получая 3-((4-(гидроксиметил)бензил)окси)фталевую кислоту в форме твердого вещества светло-желтого цвета (13,9 г, 97%-ый выход из 3-гидроксидиметилфталата): 1H ЯМР (ДМСО-d6) δ 4,41-4,58 (м, 2H, CH2), 5,17 (с, 3Н, СН2, ОН), 7,20-7,64 (м, 7Н, Ar), 13,02 (уш.с, 2Н, 2×СООН); 13С ЯМР (ДМСО-d6) δ 62,63, 69,73, 117,03, 121,56, 126,46, 126,88, 127,13, 128,91, 129,57, 134,87, 142,19, 154,50, 166,45, 167,71; LCMS: MH=303, 94% площади при 240 нм.
Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 3: Получение 2-(2,6-диоксопиперидин-3-ил)-4-((4-(гидроксиметил)бензил)окси)изоиндолин-1,3-диона
3-Аминопиперидин-2,6-дион гидрохлорид (0,915 г, 5,56 ммоль) добавляли к раствору 3-(4-(гидроксиметил)бензилокси)фталевой кислоты (1,4 г, 4,63 ммоль) в сухом пиридине (15 мл) и смесь нагревали до 118°C в масляной бане в течение 16 часов. Темной реакционной смеси давали охладиться до температуры окружающей среды и подкисляли медленным добавлением 1н. HCl (~25 мл). Смесь далее разбавляли водой (~170 мл) и затем обрабатывали ультразвуком в течение ~30 минут, чтобы помочь разбить твердые агрегаты. Полученную темную суспензию фильтровали на воронке из спеченного стекла со средним размером пор, и темное твердое вещество промывали дополнительным количеством воды (70 мл). Корку высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 2,5 часа, получая 1,6 г твердого вещества темно-синего цвета. Это твердое вещество растворяли в смеси DCM, MeCN и MeOH (~100 мл каждый) и обрабатывали для обесцвечивания активированным углем. Смесь перемешивали и затем фильтровали под действием силы тяжести с использованием фильтровальной бумаги. Фильтрат/смывы (темно-янтарного цвета) обрабатывали еще раз с обесцвечиванием активированным углем и затем фильтровали на слое целита. Прозрачный фильтрат концентрировали в вакууме досуха, получая твердое вещество, которое растирали с водой и отсасывали. Корку промывали дополнительным количеством воды (~100 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 4 часа, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(гидроксиметил)бензил)окси)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (1,2 грамма, 68%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 5,08 мин (99,9%); Т. пл.: 250-252; 1Н ЯМР (ДМСО-d6) δ 1,95-2,07 (м, 1H, CHH), 2,41-2,67 (м, 2H, CHH, CHH), 2,78-3,00 (м, 1H, CHH), 4,50 (д, J=5,1 Гц, 2H, CH2OH), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,19 (т, J=5,6 Гц, 1H, OH), 5,36 (с, 2H, CH2O), 7,24-7,40 (м, 2H, Ar), 7,41-7,53 (м, 3H, Ar), 7,59 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,88, 30,83, 48,67, 62,53, 69,91, 115,40, 116,52, 120,18, 126,44, 127,09, 133,17, 134,31, 136,86, 142,32, 155,42, 165,21, 166,68, 169,81, 172,66. LCMS: M+Na=417; MH отсутствует в положительной ионизации; Вычислено для C21H18N2O6: C, 63,96; H, 4,60; N, 7,10; Найдено: С, 63,77; H, 4,52; N, 7,32.
Стадия 4: Получение 4-((4-(бромметил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
Суспензию 2-(2,6-диоксопиперидин-3-ил)-4-(4-(гидроксиметил)бензилокси)изоиндолин-1,3-диона (1,05 г, 2,66 ммоль) в смеси DCM и MeCN (25 мл, 10 мл) перемешивали в ванне со льдом. К смеси добавляли PBr3 (0,502 мл, 5,32 ммоль) в одной части. Через 5 минут ванну со льдом удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение ~20 часов. К реакционной смеси добавляли NaBr (0,822 г, 7,99 ммоль) и тетрабутиламмония бромид (0,077 г, 0,240 ммоль), и перемешивание продолжали в течение дополнительных 14 часов при температуре окружающей среды. Реакционную смесь концентрировали в вакууме до твердого вещества грязно-белого цвета, и это твердое вещество ресуспендировали в воде с энергичным перемешиванием и затем фильтровали (на воронке из спеченного стекла со средним размером пор). Корку промывали обильно водой (~250 мл, полный объем фильтрата и смывов) и затем высушивали в вакуумном сушильном шкафу при 50°C, получая 4-((4-(бромметил)бензил)-окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион как твердое вещество белого цвета (1,21 г, 99%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,85 мин (99,5%); 1H ЯМР (ДМСО-d6) δ 1,94-2,15 (м, 1H, CHH), 2,42-2,70 (м, 2H, CHH, CHH), 2,79-2,99 (м, 1H, CHH), 4,72 (с, 2H, CH2), 5,10 (дд, J=5,4, 12,9 Гц, 1H, CH), 5,38 (с, 2H, CH2), 7,38-7,54 (м, 5H, Ar), 7,59 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,3, 8,4 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 30,91, 34,12, 48,75, 69,64, 115,57, 116,62, 120,18, 127,48, 129,42, 133,26, 136,33, 136,99, 137,72, 155,37, 165,27, 166,73, 169,87, 172,72; LCMS: M+Na=479, 481; MH отсутствовал.
Стадия 5: Получение 2-(2,6-диоксо-пиперидин-3-ил)-4-[4-(2-трифторметил-5,6,8,8a-тетрагидро-1Н-[1,2,4]триазоло[1,5-a]пиразин-7-илметил)-бензилокси]-изоиндол-1,3-диона
К раствору 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,13 г, 0,284 ммоль) в CH2Cl2 добавляли 2-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[1,5-a]пиразин (0,060 г, 0,313 ммоль) и N-этил-N-изопропилпропан-2-амин (0,152 мл, 0,853 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду (10 мл) и CH2Cl2 (10 мл) и экстрагировали. Органический слой концентрировали, и полученное масло очищали на колонке с силикагелем, элюируя MeOH и CH2Cl2, получая 2-(2,6-диоксо-пиперидин-3-ил)-4-[4-(2-трифторметил-5,6,8,8a-тетрагидро-1Н-[1,2,4]триазоло[1,5-a]пиразин-7-илметил)-бензилокси]-изоиндол-1,3-дион как твердое вещество белого цвета (120 мг, 74%). Температура плавления: 128-130°C. LCMS m/e=569. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 50/50 CH3CN/0,1% H3PO4 в H2O: tR=3,64 мин (99%); 1H ЯМР (ДМСО-d6) δ 1,94-2,12 (м, 1H, CHH), 2,41-2,47 (м, 1H, CHH), 2,54-2,67 (м, 1H, CHH), 2,77-2,95 (м, 1H, CHH), 3,01 (т, J=5,4 Гц, 2H, CH2), 3,81 (д, J=7,6 Гц, 4H, CH2, CH2), 4,24 (т, J=5,1 Гц, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, NCH), 5,37 (с, 2H, CH2), 7,37-7,55 (м, 5H, Ar), 7,61 (д, J=8,5 Гц, 1H, Ar), 7,76-7,88 (м, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 46,54, 47,67, 48,73, 49,21, 59,42, 69,89, 115,53, 116,59, 120,21, 127,42, 128,95, 133,26, 135,25, 136,99, 137,06, 152,84, 155,50, 165,29, 166,75, 169,87, 172,71. Вычислено для C27H23F3N6O5+0,5 H2O+0,2 Et2O: C: 56,37%; H: 4,42%; N: 14,19%; Found C: 56,27%; H: 4,20%; N: 14,05%.
5.118 3-(4-((4-(((3R,5S)-3,5-диметилморфолино)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
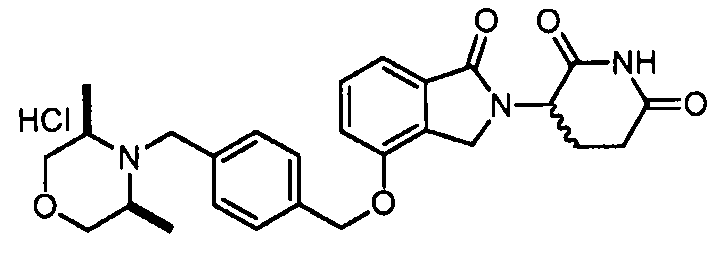
Стадия 1: К суспензии 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (250 мг, 0,526 ммоль) в ацетонитриле (5 мл) добавляли (3R,5S)-3,5-диметилморфолин (79 мг, 0,684 ммоль) в форме твердого вещества. Смесь перемешивали с периодической обработкой ультразвуком, получая прозрачный раствор, и затем добавляли DIEA (0,197 мл, 1,128 ммоль). Полученный прозрачный раствор перемешивали при температуре окружающей среды. Приблизительно через 24 часа добавляли дополнительное количество (3R,5S)-3,5-диметилморфолина (79 мг, 0,526 ммоль), и смесь перемешивали в течение дополнительных 24 часов при температуре окружающей среды. Реакционную смесь концентрировали в вакууме, получая (S)-5-амино-4-(4-((4-(((3R,5S)-3,5-диметилморфолино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как масляный остаток (268 мг). Сырой продукт использовали на следующей стадии без дальнейшей очистки, LCMS: МН=510.
Стадия 2: Масло, полученное на стадии 1, 5-амино-4-(4-(4-(((3R,5S)-3,5-диметилморфолино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (268 мг, 0,526 ммоль, предполагая количественный выход с предыдущей стадии) растворяли в DMF (5 мл). К раствору добавляли безводный карбонат калия (189 мг, 1,367 ммоль) и смесь перемешивали при 85°C приблизительно в течение 6 часов. Нагревание прекращали в течение выходных (образец сохраняли при 4°C) и затем возобновляли еще в течение 24 часов. Охлажденную реакционную смесь разбавляли EtOAc (~100 мл) и затем промывали 1н. водным раствором NaHCO3 (30 мл) и солевым раствором. Органический слой высушивали над Na2SO4 и затем концентрировали в вакууме, получая желто-коричневое масло. Это масло растворяли в DMF (8 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, 5% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли, обрабатывали 1н. HCl (3 мл) и затем концентрировали в вакууме, получая стекловидное твердое вещество. Это твердое вещество обрабатывали 2н. HCl в Et2O (1 мл) и концентрировали в вакууме. Полученное твердое вещество помещали в вакуумный сушильный шкаф при 60°C на несколько часов, получая 3-(4-((4-(((3R,5S)-3,5-диметилморфолино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (130 мг, 48%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 10 мин, CH3CN/0,1% H3PO4, 5,90 мин (96,2%); Т. пл.: 235-237°C; 1H ЯМР (ДМСО-d6 с D2O) δ 0,89 (д, J=6,2 Гц, 6H, CH3, CH3), 1,96-2,15 (м, 1H, CHH), 2,41-2,53 (м, 3H, CHH, CH, CH), 2,58-2,70 (м, 1H, CHH), 2,80-2,98 (м, 1H, CHH), 3,00-3,19 (м, 2H, morph, CHH, CHH), 3,65 (дд, J=2,9, 11,2 Гц, 2H, morph, CHH, CHH), 3,78 (уш.с, 2H, CH2), 4,31 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 5,09 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,29-7,58 (м, 7H, Ar); 13C ЯМР (ДМСО-d6) δ 17,73, 24,16, 32,97, 47,23, 50,90, 53,61, 55,17, 56,71, 71,34, 74,46, 117,03, 117,20, 129,39, 129,90, 131,81, 131,90, 134,99, 136,37, 142,45, 155,36, 170,27, 172,80 174,91; LCMS: MH=478; Вычислено для C27H31N3O5+0,95 HCl: С, 63,31; H, 6,29; N, 8,20; Найдено: С, 63,51; H, 6,20; N, 7,91.
5.119 3-(1-ОКСО-4-((3-((2-(ТРИФТОРМЕТИЛ)-5,6-ДИГИДРО-[1,2,4]ТРИАЗОЛО[1,5-A]ПИРАЗИН-7(8H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
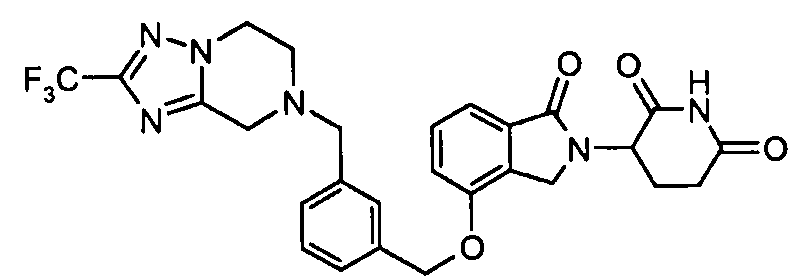
К перемешиваемому раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (500 мг, 1,13 ммоль) в DCM (10 мл) добавляли 2-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[1,5-a]пиразин (238 мг, 1,24 ммоль) и DIPEA (0,59 мл, 3,38 ммоль). Полученный раствор перемешивали при 40°C в течение 27 часов. К реакционной смеси добавляли DCM (30 мл) и солевой раствор (20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали. Остаток очищали, получая стеклоподобное твердое вещество. Это твердое вещество перемешивали в EtOAc (5 мл) и перемешивали в простом диэтиловом эфире (40 мл), получая 3-(1-оксо-4-((3-((2-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[1,5-a]пиразин-7(8H)-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (391 мг, 62%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50, (CH3CN/0,1% H3PO4), 3,25 мин (95,7%); Т. пл.: 213-215°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,34-2,47 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,82-3,07 (м, 3H, CHH, CH2), 3,81 (с, 4H, CH2, CH2), 4,17-4,49 (м, 4H, CHH, CHH, CH2), 5,05-5,16 (м, 1H, CHH), 5,27 (с, 2H, CH2), 7,28-7,54 (м, 7H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,09, 46,52, 47,73, 49,14, 51,58, 59,55, 69,55, 115,13, 115,28, 126,72, 128,06, 128,44, 128,59, 129,77, 129,96, 133,30, 136,81, 137,47, 152,82, 153,45, 167,96, 170,95, 172,78; LCMS MH-555; Вычислено для C27H25F3N6O4: C, 58,48; H, 4,54; N, 15,16; Найдено: C, 58,53; H, 4,21; N, 14,89.
5.120 3-{1-ОКСО-4-[3-(4-ТРИФТОРМЕТАНСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
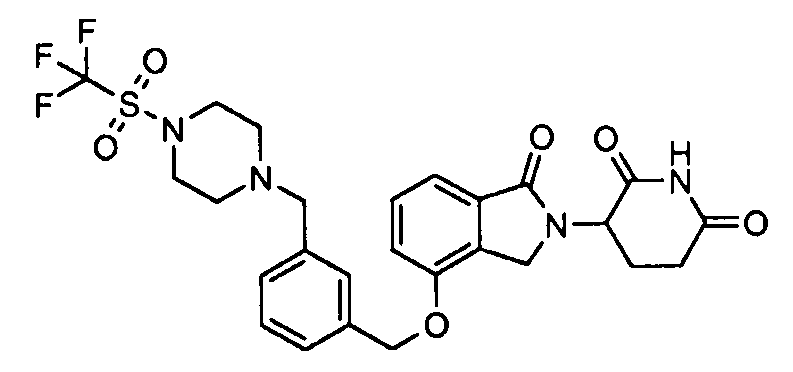
К перемешиваемому раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (500 мг, 1,13 ммоль) в DCM (10 мл) добавляли 1-(трифторметилсульфонил)пиперазин (320 мг, 1,47 ммоль) и DIPEA (0,59 мл, 3,38 ммоль). Полученный раствор перемешивали при 40°C в течение 22 часов. К реакционной смеси добавляли DCM (30 мл) и солевой раствор (20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали. Остаток очищали ISCO, получая стеклоподобное твердое вещество. Это твердое вещество перемешивали в EtOAc (5 мл) и простом диэтиловом эфире (40 мл), получая 3-{1-оксо-4-[3-(4-трифторметансульфонил-пиперазин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (257 мг, 39%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 27/73, (CH3CN/0,1% H3PO4), 4,82 мин (99,9%); Т. пл.: 150-152°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,35-2,48 (м, 5H, CH2, CH2, CHH), 2,52-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,41-3,53 (м, 4H, CH2, CH2), 3,57 (с, 2H, CH2), 4,26 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,3 Гц, 1H, CHH), 5,25 (с, 2H, CH2), 7,25-7,35 (м, 3H, Ar), 7,35-7,43 (м, 3H, Ar), 7,44-7,53 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 46,36, 51,56, 51,81, 61,11, 69,54, 115,13, 115,26, 126,49, 128,04, 128,46, 129,77, 129,95, 133,30, 136,64, 137,67, 153,43, 167,96, 170,93, 172,78; LCMS MH=581; Вычислено для C26H27F3N4O6S+0,1 EtOAC+0,1 Et2O: С, 53,94; H, 4,86; N, 9,39; Найдено: С, 54,05; H, 4,77; N, 9,16.
5.121 3-(1-ОКСО-4-{3-[4-(2,2,2-ТРИФТОР-ЭТИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
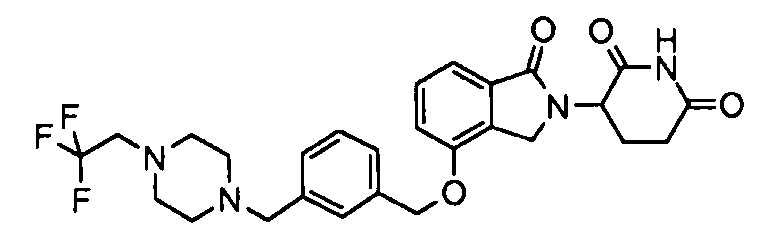
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,495 г, 1,117 ммоль) (фактически 0,55 г, но вычитая 10 вес.% THF) в CH3CN (10 мл) при температуре окружающей среды добавляли 1-(2,2,2-трифторэтил)пиперазин дигидрохлорид (0,323 г, 1,340 ммоль) и N-этил-N-изопропилпропан-2-амин (0,738 мл, 4,47 ммоль). Мутная смесь стала прозрачной, как только добавляли DIPEA. Раствор перемешивали в течение 15 минут и упаривали под вакуумом, чтобы избавиться от CH3CN. Полученный остаток очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(1-оксо-4-{3-[4-(2,2,2-трифтор-этил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,485 г, 82%-ый выход); Т. пл.: 112-114°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 20/80 на 10 мин, (CH3CN/0,1% H3PO4), 5,64 мин (99,9%). 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,28-2,48 (м, 5H, CHH, CH2, CH2), 2,53-2,66 (м, 5Н, CHH, СН2, СН2), 2,83-3,00 (м, 1Н, CHH), 3,12 (кв, J=10,3 Гц, 2H, CH2), 3,47 (с, 2H, CH2), 4,21-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,20-7,28 (м, 1H, Ar), 7,28-7,41 (м, 5H, Ar), 7,44-7,52 (м, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,38, 31,20, 45,10, 51,59, 52,42, 53,09, 56,27, 56,65, 57,04, 57,42, 61,67, 69,58, 115,17, 115,26, 124,09, 126,27, 127,81, 127,93, 128,35, 129,78, 129,97, 133,32, 136,53, 138,37, 153,44, 167,99, 170,95, 172,80. LCMS: m/e=531. Вычислено для C27H29N4O4F3 (+0,1 H2O+0,1 EtOAc): C, 60,81; H, 5,59; N, 10,35. Найдено: С, 60,72; H, 5,65; N, 10,09.
5.122 3-{4-[3-(3,4-ДИГИДРО-1Н-ИЗОХИНОЛИН-2-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
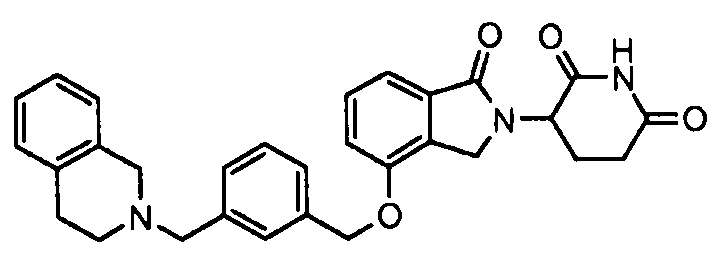
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,222 г, 0,501 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 1,2,3,4-тетрагидроизохинолин гидрохлорид (0,102 г, 0,601 ммоль) и N-этил-N-изопропилпропан-2-амин (0,207 мл, 1,253 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение 40 минут и упаривали под вакуумом, чтобы избавиться от CH3CN. Полученный остаток очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{4-[3-(3,4-дигидро-1Н-изохинолин-2-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,198 г, 80%-ый выход); Т. пл.: 117-119°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 20/80 на 10 мин, (CH3CN/0,1% H3PO4), 6,88 мин (99,9%). 1H ЯМР (ДМСО-d6) δ 1,90-1,99 (м, 1H, CHH), 2,32-2,47 (м, 1H, CHH), 2,53-2,62 (м, 1H, CHH), 2,63-2,71 (м, 2H, CH2), 2,75-2,83 (м, 2H, CH2), 2,84-2,98 (м, 1H, CHH), 3,53 (с, 2H, CH2), 3,67 (с, 2H, CH2), 4,20-4,45 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,26 (с, 2H, CH2), 6,94-7,15 (м, 4H, Ar), 7,28-7,53 (м, 7H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 14,07, 22,35, 28,64, 31,21, 45,09, 50,15, 51,59, 55,38, 61,58, 69,63, 115,14, 115,26, 125,43, 125,93, 126,29, 126,35, 127,88, 128,34, 128,42, 129,79, 129,95, 133,32, 134,05, 134,74, 136,62, 138,70, 153,47, 167,99, 170,95, 172,80. LC/MS m/c=496. Вычислено для C30H29N3O4 (+0,3 H2O, +0,3 EtOAc): C, 71,05; H, 6,12; N, 7,97. Найдено: С, 71,00; H, 6,14; N,7,91.
5.123 3-(4-((3-((4-(4-ХЛОРФЕНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
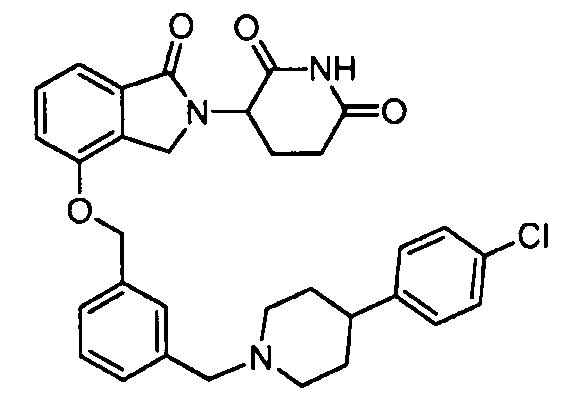
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,5 г, 1,128 ммоль) в CH2Cl2 добавляли 4-(4-хлорфенил)пиперидин (0,232 г, 1,184 ммоль) и N-этил-N-изопропилпропан-2-амин (0,602 мл, 3,38 ммоль). Раствор перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли воду (10 мл), CH2Cl2 (15 мл) и экстрагировали. Органический слой концентрировали, затем очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 3-(4-((3-((4-(4-хлорфенил)пиперидин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (340 мг, 54%). Температура плавления: 180-182°C. LCMS m/e=558, 560. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4 в H2O: 4,34 мин (99%). 1H ЯМР (ДМСО-d6) δ 1,49-1,78 (м, 4H, CH2, СН2), 1,89-2,10 (м, 3Н, СНН, СН2), 2,33-2,47 (м, 2Н, СНН, СН), 2,53-2,61 (м, J=13,8 Гц, 1Н, CHH), 2,79-2,98 (м, J=11,5 Гц, 3Н, СН2, CHH), 3,51 (с, 2Н, СН2), 4,20-4,50 (м, 2Н, СН2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,19-7,53 (м, 11Н, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,34, 31,16, 32,85, 41,09, 45,09, 51,55, 53,40, 62,13, 69,58, 115,16, 115,23, 126,20, 127,95, 128,17, 128,30, 128,40, 128,56, 129,74, 129,96, 130,41, 133,30, 136,46, 138,75, 145,17, 153,42, 167,97, 170,93, 172,78. Вычислено для C32H32ClN3O4: C%: 68,87; H%: 5,78; N%: 7,53; Найдено: C%: 68,59; H%: 5,83; N%: 7,39.
5.124 4-((4-((3,4-ДИГИДРОИЗОХИНОЛИН-2(1H)-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИН-1,3-ДИОН
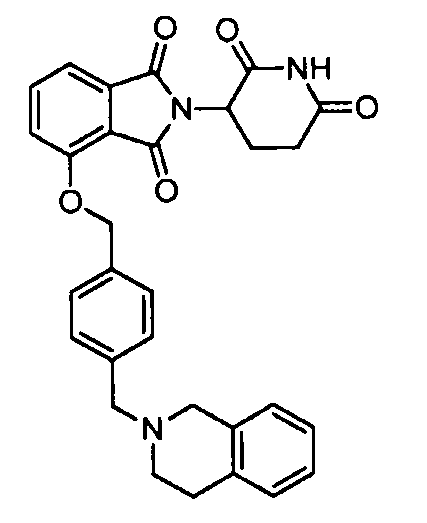
К суспензии 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,25 г, 0,547 ммоль) в CH2Cl2 добавляли 1,2,3,4-тетрагидроизохинолин (0,080 г, 0,601 ммоль) и N-этил-N-изопропилпропан-2-амин (0,212 г, 1,640 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли CH2Cl2 и воду и экстрагировали. Органический слой концентрировали и очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая твердое вещество. Это твердое вещество перекристаллизовывали из CH3CN (3 мл), получая 4-((4-((3,4-дигидроизохинолин-2(1H)-ил)метил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион в форме твердого вещества желтого цвета (90 мг, 32%). Температура плавления 124-126°C. LCMS m/e=510. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4 в H2O: 3,52 мин (98,5 %). 1H ЯМР (ДМСО-d6) δ 1,97-2,11 (м, 1H, CHH), 2,42-2,47 (м, 1H, CHH), 2,54-2,62 (м, 3H, CHH, CH2), 2,64-2,71 (м, 2H, CH2), 2,76-2,98 (м, 3H, CHH, CH2), 3,54 (с, 2H, CH2), 3,66 (с, 2H, CH2), 5,03-5,16 (м, 1H, NCH), 5,37 (с, 2H, CH2), 6,94-7,12 (м, 3H, Ar), 7,37-7,44 (м, 2H, Ar), 7,45-7,53 (м, 3H, Ar), 7,61 (д, J=8,3 Гц, 1H, Ar), 7,83 (дд, J=7,5, 8,4 Гц, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,09, 21,11, 30,06, 47,89, 49,30, 54,57, 60,62, 69,13, 114,65, 119,38, 124,57, 125,06, 125,46, 126,48, 127,54, 127,95, 132,41, 133,21, 133,87, 133,94, 136,13, 137,43, 154,69, 164,45, 165,90, 169,02, 171,87. Вычислено для C30H27N3O5: C: 70,71%; H: 5,34%; N: 8,25%, Найдено: С: 67,07%; H: 5,12%; N: 7,81%.
5.125 3-(4-((3-((4-(2,4-ДИФТОРФЕНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
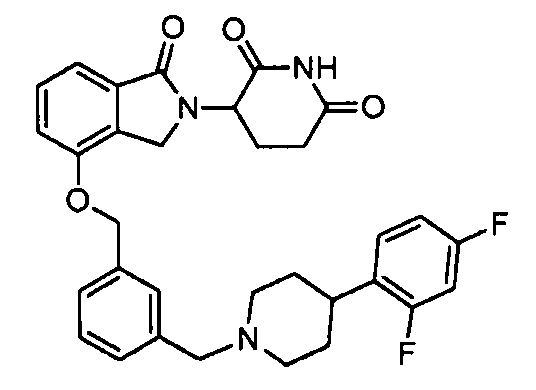
К раствору 3-(4-(3-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,45 г, 1,015 ммоль) в CH2Cl2 добавляли 4-(2,4-дифторфенил)пиперидин (0,210 г, 1,066 ммоль) и N-этил-N-изопропилпропан-2-амин (0,542 мл, 3,05 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли воду и CH2Cl2, экстрагировали и очищали на колонке с силикагелем, элюируя MeOH и CH2Cl2, получая 3-(4-((3-((4-(2,4-дифторфенил)пиперидин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (250 мг, 44%). Температура плавления: 211-213°C. LCMS m/e=560. ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4: 4,68 мин (97,6%). 1H ЯМР (ДМСО-d6) δ 1,66 (уш.с, 4H, CH2, СН2), 1,89-2,07 (м, 3Н, СН2, СНН), 2,43 (дд, J=4,3, 13,0 Гц, 1Н, CHH), 2,53-2,61 (м, J=19,3 Гц, 1H, CHH), 2,73 (квинт, J=7,5 Гц, 1H, CH), 2,82-3,03 (м, 3H, CH2, CHH), 3,51 (с, 2H, CH2), 4,11-4,52 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,02 (тд, J=2,2, 8,5 Гц, 1H, Ar), 7,10-7,21 (м, 1H, Ar), 7,24-7,54 (м, 8H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,34, 31,16, 31,61, 34,62, 51,58, 53,43, 62,12, 69,60, 103,20, 103,54, 103,90, 111,21, 111,49, 115,16, 115,25, 126,21, 127,96, 128,31, 128,41, 128,62, 128,68, 128,87, 128,98, 129,07, 129,74, 129,96, 133,30, 136,48, 138,74, 153,43, 158,17, 158,33, 158,84, 159,02, 161,42, 161,58, 162,08, 162,26, 167,97, 170,93, 172,77. Вычислено для C32H31F2N3O4: C%: 68,68; H%: 5,58; N%: 7,51, Найдено: C%: 68,57; H%: 5,52; N%: 7,60.
5.126 3-{1-ОКСО-4-[4-(2-ТРИФТОРМЕТИЛ-5,6-ДИГИДРО-8H-[1,2,4]ТРИАЗОЛО[1,5-A]ПИРАЗИН-7-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
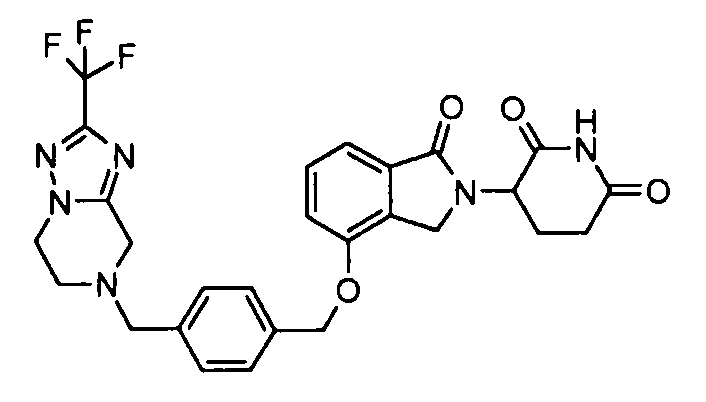
К перемешиваемой смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (1,0 г, 2,256 ммоль) и 2-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[1,5-a]пиразина (0,477 г, 2,481 ммоль) в MeCN (15 мл) добавляли DIPEA (1,0 мл, 5,6 ммоль). Полученную смесь нагревали при 50°C в течение 16 часов и концентрировали до приблизительно 3 мл, с последующим добавлением Et2O (40 мл). Смесь перемешивали при температуре окружающей среды, и образовывалось твердое вещество. Это твердое вещество очищали, после перемешивания в CH3CN (17 мл) при нагревании с обратным холодильником, получая 3-{1-оксо-4-[4-(2-трифторметил-5,6-дигидро-8H-[1,2,4]триазоло[1,5-a]пиразин-7-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (580 мг, 46%-ый выход). ВЭЖХ: Waters Symmetry C-l8, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60, (CH3CN/1% Н3РО4), 6,32 мин (99,8%); Т. пл.: 215-217°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,83-2,98 (м, 1H, CHH), 3,02 (т, J=5,4 Гц, 2H, CH2), 3,81 (д, J=5,3 Гц, 4H, CH2, CH2), 4,19-4,32 (м, 3H, CHH, CH2), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,25 (с, 2H, CH2), 7,29-7,37 (м, 2H, Ar), 7,37-7,44 (м, 2H, Ar), 7,45-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 31,11, 45,02, 46,49, 47,67, 49,12, 51,52, 59,38, 69,29, 114,93, 115,19, 127,75, 128,87, 129,75, 129,89, 133,26, 135,69, 136,99, 152,77, 153,42, 167,92, 170,89, 172,74; LCMS MH=555; Вычислено для C27H25F3N6O4: С, 58,48; H, 4,54; N, 15,16; Найдено: С, 58,50; H, 4,23; N, 15,08; хиральная ВЭЖХ: Chiral AGP/C18, 4,0×150 мм, 5 мкм, 0,8 мл/мин, UV 240 нм, мобильная фаза A: MeOH, мобильная фаза B: NH4OAc 10 мМ, 20/80, при 8,78 мин (1,37%) и 11,51 мин (93,56%); ee%=(93,56-1,37)/(93,56+1,37)* 100%=97%.
5.127 2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-ИЗОИНДОЛ-1,3-ДИОН
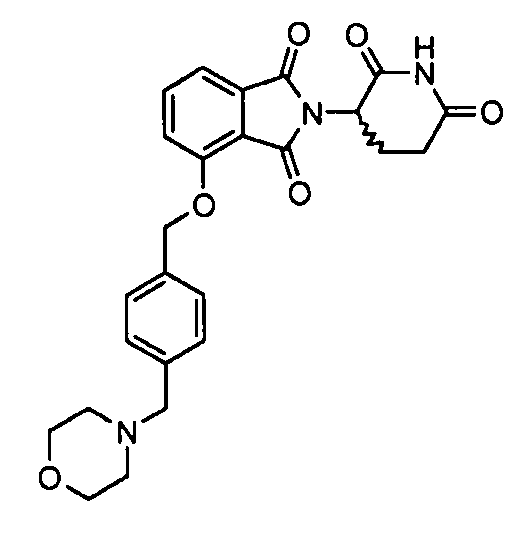
Стадия 1: К раствору 3-гидроксидиметилфталата (1,0 г, 4,76 ммоль) в THF (40 мл, 488 ммоль) добавляли трифенилфосфин на полистирольной смоле (1,6 мг/ммоль, 4,76 г, 7,61 ммоль). После набухания смолы в течение нескольких минут при температуре окружающей среды, реакционную смесь охлаждали в ванне со льдом при 0°C. К перемешиваемой смеси добавляли по каплям DIAD (1,48 мл, 7,61 ммоль). Приблизительно через 10 минут (4-(морфолинометил)фенил)метанол (1,48 г, 7,14 ммоль) добавляли в одной части. Полученную смесь перемешивали при температуре окружающей среды в течение 20 мин Смолу удаляли фильтрацией и промывали на воронке из спеченного стекла с отсасыванием с использованием попеременно промывки MeOH и DCM дважды. Объединенный фильтрат концентрировали в вакууме, получая сырой продукт как желтое масло (4 г). Это масло разделяли между EtOAc (200 мл) и 0,25н. HCl (150 мл). Органический слой промывали дополнительными 100 мл 0,25н. HCl. Водный слой, содержащий продукт, концентрировали на роторном испарителе до сиропа (приблизительно 10 мл). Сироп разделяли между EtOAc (300 мл) и 1н. NaOH (100 мл). Водный слой промывали другой частью EtOAc (приблизительно 200 мл). Объединенные органические слои промывали солевым раствором, высушивали (Na2SO4), концентрировали в вакууме и высушивали в вакуумном сушильном шкафу при 40°C в течение ночи, получая диметиловый эфир 3-(4-морфолин-4-илметил-бензилокси)-фталевой кислоты как светло-желтое масло (2,6 г). Сырой продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору 3-(4-(морфолинометил)бензилокси)диметилфталата (1,9 г, 4,76 ммоль) в THF (20 мл, 244 ммоль) добавляли воду (0,180 мл, 9,99 ммоль). При перемешивании при температуре окружающей среды, добавляли по каплям KOtBu (9,99 мл, 9,99 ммоль, 1M в THF). Приблизительно через 24 часа, добавляли воду (1 мл) и смесь нагревали до 45°C. Приблизительно через 22 часа смесь разбавляли Et2O (100 мл) и фильтровали через воронку из спеченного стекла. Твердое вещество подкисляли водным 1н. раствором HCl (10 мл), и полученную смесь концентрировали досуха на роторном испарителе, получая твердое вещество белого цвета (2,2 г), которое по данным LCMS было ~1:3 смесью 1-метилового эфира 3-(4-морфолин-4-илметил-бензилокси)-фталевой кислоты и 3-(4-морфолин-4-илметил-бензилокси)-фталевой кислоты, соответственно. Эту смесь использовали на следующей стадии без дальнейшей очистки.
Стадия 3: К суспензии 1-метилового эфира 3-(4-морфолин-4-илметил-бензилокси)-фталевой кислоты и 3-(4-морфолин-4-илметил-бензилокси)-фталевой кислоты (1,7 г, 3,75 ммоль, предполагая 82 вес.%) в пиридине (30 мл) добавляли рац. 3-аминопиперидин-2,6-дион гидрохлорид (0,803 г, 4,88 ммоль) в форме твердого вещества. Обратный холодильник помещали в круглодонную колбу, и полученную смесь нагревали в масляной бане при 118°C приблизительно в течение 24 часов. Реакционной смеси давали остыть до температуры окружающей среды и затем концентрировали в вакууме, чтобы удалить большую часть пиридина. Оставшийся темный твердый остаток суспендировали в EtOAc (приблизительно 100 мл), перемешивали в течение ночи при температуре окружающей среды, затем фильтровали на воронке из спеченного стекла со средним размером пор. Твердое вещество промывали обильно EtOAc и затем высушивали отсасыванием. Оставшееся твердое вещество помещали в колбу с EtOAc (400 мл) и 0,5н. водным раствором NaHCO3 (100 мл). Смесь энергично перемешивали в течение ночи. Фазы разделяли, и водный слой экстрагировали дополнительным количеством EtOAc (~300 мл). Объединенные органические слои промывали солевым раствором и затем обрабатывали активированным углем для обесцвечивания и Na2SO4. Суспензию смешивали и затем фильтровали на слое Supercell. Прозрачный фильтрат концентрировали в вакууме, и полученную белую пену растворяли в минимальном количестве MeCN (~3 мл). К раствору добавляли Et2O в небольших частях (приблизительно 25 мл, общее количество), получая белый осадок. Суспензию обрабатывали ультразвуком, чтобы разбить все твердые агрегаты в хорошо диспергированную суспензию. Эту суспензию затем фильтровали, и корку промывали несколькими небольшими частями Et2O (~50 мл, общее количество). Корку высушивали отсасыванием и затем далее высушивали в вакуумном сушильном шкафу при 55°C, получая 2-(2,6-диоксо-пиперидин-3-ил)-4-(4-морфолин-4-илметил-бензилокси)-изоиндол-1,3-дион как твердое вещество белого цвета (950 мг, 55%-ый выход со стадий 1-3): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83 CH3CN/0,1% H3PO4, 5,34 мин (99,8%); Т. пл.: 205-207°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,14 (м, 1H, CHH), 2,28-2,42 (м, 4H, CH2, CH2), 2,43-2,66 (м, 2H, CHH, CHH), 2,78-3,00 (м, 1H, CHH), 3,46 (с, 2H, CH2), 3,52-3,64 (м, 4H, CH2, CH2), 5,09 (дд, J=5,4, 12,9 Гц, 1H, CH), 5,35 (с, 2H, CH2), 7,29-7,39 (м, 2H, Ar), 7,42-7,52 (м, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,88, 30,84, 48,67, 53,06, 62,01, 66,08, 69,85, 115,42, 116,50, 120,11, 127,18, 128,93, 133,18, 134,72, 136,91, 137,61, 155,44, 165,21, 166,68, 169,80, 172,66; LCMS: MH=464; Вычислено для C25H25N3O6+0,06 H2O: C, 64,64; H, 5,45; N, 9,04; H2O, 0,23; Найдено: С, 64,75; H, 5,13; N, 8,91; H2O, 0,23.
5.128 3-[1-ОКСО-4-(4-PHENОКСИМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
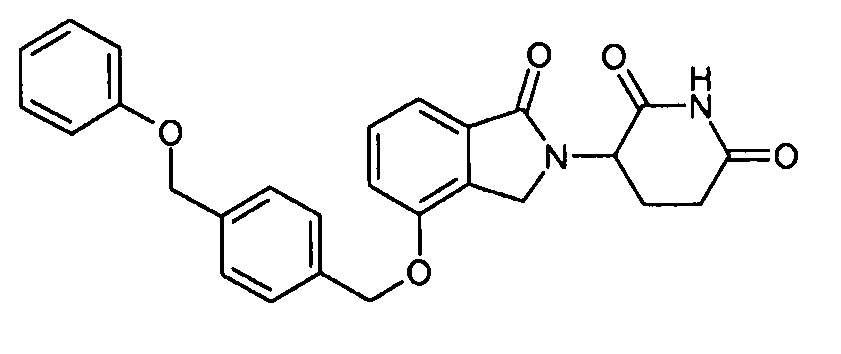
Стадия 1: Получение 5-амино-5-оксо-4-(1-оксо-4-(4-(феноксиметил)бензилокси)изоиндолин-2-ил)метилпентаноата
К раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,711 ммоль) в ацетонитриле добавляли 1-(бромметил)-4-(феноксиметил)бензол (0,474 г, 1,711 ммоль) и карбонат калия (0,236 г, 1,711 ммоль). Смесь перемешивали при 50°C в течение 3 дней. Смесь охлаждали до температуры окружающей среды, концентрировали и очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 5-амино-5-оксо-4-(1-оксо-4-(4-(феноксиметил)бензилокси)изоиндолин-2-ил)метилпентаноат как твердое вещество белого цвета (0,8 г, 47%).
Стадия 2: Получение 3-[1-оксо-4-(4-феноксиметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона
К раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(феноксиметил)бензилокси)изоиндолин-2-ил)метилпентаноата (0,8 г, 1,638 ммоль) в THF при -78°C добавляли трет-бутоксид калия (0,202 г, 1,801 ммоль). Смесь перемешивали при этой температуре в течение 1 часа, затем добавляли воду и CH2Cl2. После экстракции органический слой концентрировали, получая 3-[1-оксо-4-(4-феноксиметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,70 г, 94%). Температура плавления: 110-112°C. LCMS m/e=457. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 10,48 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,31-2,48 (м, J=4,3, 13,2 Гц, 1H, CHH), 2,52-2,65 (м, 1H, CHH), 2,80-3,01 (м, 1H, CHH), 4,16-4,50 (м, 2H, CH2), 5,03-5,16 (м, 3H, NCH, CH2), 5,26 (с, 2H, CH2), 6,88-7,05 (м, 3H, Ar), 7,21-7,37 (м, 4H, Ar), 7,42-7,56 (м, 5H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6): δ 15,11 ,22,33, 31,17, 45,077, 51,57, 68,72, 69,28, 114,73, 114,97, 115,25, 120,68, 127,76, 129,45, 129,79, 129,96, 133,31, 136,16, 136,94, 153,41, 158,22, 167,98, 170,94, 170,94, 172,80. Вычислено для C27H24N2O5+0,3 H2O: С 71,04%, H 5,30%, N 6,14%, Найдено: С 69,89%, H 5,48%, N 5,82%.
5.129 5-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)ИЗОИНДОЛИН-2-ТРЕТ-БУТИЛКАРБОКСИЛАТ
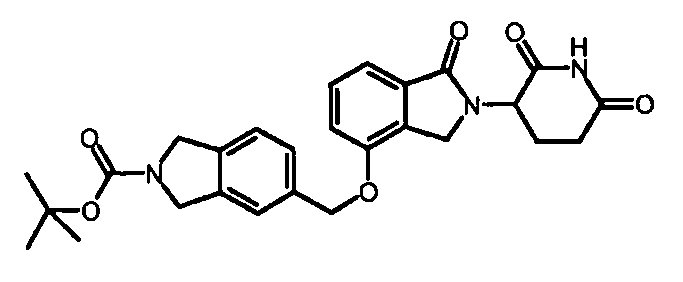
Стадия 1: Гидрид натрия (60%, 3,6 г, 90,5 ммоль) добавляли к перемешиваемому раствору N-BOC-пропаргиламина (10,8 г, 69,6 ммоль) в THF (80 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение 30 минут и добавляли по каплям раствор пропаргил бромид/толуол (80%, 16,6 г, 111,3 ммоль) (небольшой экзотермический!). Смесь перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь концентрировали, и остаток растворяли в EtOAc (150 мл) и промывали водой (4×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 30:70-80:20), получая N-BOC-дипроп-2-инил-амин (8,5 г, 63%-ый выход): 1H ЯМР (CDCl3) δ 1,48 (с, 9H), 2,22 (с, 2H), 4,17 (уш., 4H).
Стадия 2: Пропаргиловый спирт (7,3 г, 144,9 ммоль) при 3°C добавляли по каплям к перемешиваемому раствору N-BOC-дипроп-2-инил-амина (7,0 г, 36,2 ммоль) в абсолютном этаноле (150 мл). Трис(трифенилфосфин)родий дихлорид (1,0 г) добавляли в одной части. Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 10:90-40:60), получая трет-бутиловый эфир 5-гидроксиметил-1,3-дигидро-изоиндол-2-карбоновой кислоты (5,2 г, 57%-ый выход): 1H ЯМР (CDCl3) δ 1,51 (с, 9H), 2,07 (уш., 1H), 4,62 (с, 4H), 4,68 (д, J=5,7 Гц, 2H), 7,20-7,27 (м, 3H).
Стадия 3: Диизопропил азодикарбоксилат (1,0 г, 5,0 ммоль) добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (4,3 г, 5,3 ммоль) в THF (40 мл) при 3-5°C. Смесь перемешивали при 3°C в течение 10 минут и добавляли раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 3,3 ммоль) и трет-бутилового эфира 5-гидроксиметил-1,3-дигидро-изоиндол-2-карбоновой кислоты (1,1 г, 4,3 ммоль) в THF (60 мл) при 3-6°C. После перемешивания при 3°C в течение 5 минут, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (80 мл) и промывали насыщ. NaHCO3 (25 мл), водой (2×25 мл) и солевым раствором (25 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)изоиндолин-2-трет-бутилкарбоксилат (1,3 г, 73%-ый выход): 1H ЯМР (CDCl3) δ 1,52 (с, 9H), 2,17-2,41 (м, 4H), 3,64 (с, 3Н), 4,36-4,46 (дд, J=17,7 и 29,4 Гц, 2H), 4,67-4,71 (м, 4Н), 4,91 (м, 1Н), 5,15 (с, 2H), 5,43 (с, 1H), 6,35 (с, 1H), 7,05-7,08 (м, 1H), 7,26-7,32 (м, 3H), 7,40-7,45 (м, 2H); 13C ЯМР (CDCl3) δ 24,04, 28,55, 30,45, 45,28, 51,82, 52,27, 53,89, 70,02, 70,16, 79,81, 114,44, 116,18, 121,59, 121,98, 122,93, 123,08, 126,64, 129,90, 133,43, 135,50, 137,69, 153,70, 154,51, 169,36, 171,49, 172,88.
Стадия 4: Раствор трет-бутоксид калия/THF (1M, 2,4 мл, 2,4 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)изоиндолин-2-трет-бутилкарбоксилата (1,3 г, 2,4 ммоль) в THF (20 мл). Реакционную смесь перемешивали при 5°C в течение 30 минут, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (50 мл) и водой (15 мл), и водный слой экстрагировали CH2Cl2 (30 мл). Объединенный раствор CH2Cl2 промывали насыщ. NaHCO3 (30 мл), водой (2×30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-((2-(2,6-диоксо-пиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)изоиндолин-2-трет-бутилкарбоксилат (0,6 г, 50%-ый выход): Т. пл. 178-180°C; 1H ЯМР (ДМСО-d6) δ 1,45 (с, 9H), 1,96-2,02 (м, 1H), 2,41-2,60 (м, 2H), 2,86-2,91 (м, 1H), 4,28 (д, J=17,4 Гц, 1H), 4,38 (д, J=17,4 Гц, 1H), 4,59 (уш., 4H), 5,07-5,14 (дд, J=5,1 и 13,5 Гц, 1H), 5,24 (с, 2H), 7,31-7,51 (м, 6H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,34, 28,12, 31,18, 45,08, 51,48, 51,65, 69,42, 78,80, 115,01, 115,25, 122,15, 122,88, 126,94, 129,79, 129,95, 133,30, 135,82, 136,41, 136,96, 137,44, 138,40, 167,97, 170,96, 172,82; Вычислено для C27H29N3O6: C, 65,98; H, 5,95; N, 8,55, Найдено: C, 65,76; H, 6,10; N, 8,33.
5.130 3-(4-(БЕНЗО[B]ТИОФЕН-3-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
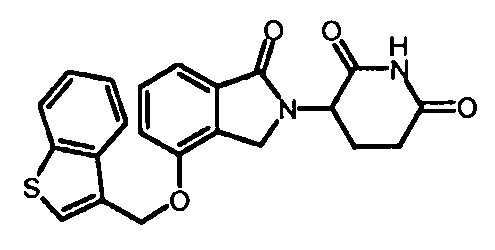
Стадия 1: Диизопропил азодикарбоксилат (1,1 г, 5,5 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), 1-бензотиофен-3-илметанола (0,7 г, 4,1 ммоль) и связки трифенилфосфин-полимер (1,8 г, 5,5 ммоль) в THF (60 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(бензо[b]тиофен-3-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1 г, 77%).
Стадия 2: Раствор трет-бутоксид калия/THF (1M, 2,3 мл, 2,3 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-(бензо[b]тиофен-3-илметокси)-1-оксоизоиндолин-2-ил]-5-оксометилпентаноата (1,0 г, 2,3 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 1н. HCl (10 мл). Смесь перемешивали с CH2Cl2 (50 мл) и водой (10 мл), и водный слой экстрагировали CH2Cl2 (30 мл). Объединенный раствор CH2Cl2 промывали водой (2×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-бензо[b]тиофен-3-илметокси)-1-оксоизоиндолин-2ил)-пиперидин-2,6-дион (0,3 г, 32%-ый выход): Т.пл. 231-233°C; 1H ЯМР (ДМСО-d6) δ 1,94-1,98 (м, 1H), 2,28-2,58 (м, 2H), 2,85-2,95 (м, 1H), 4,24 (д, J=17,4 Гц, 1H), 4,34 (д, J=17,7 Гц, 1H), 5,06-5,12 (дд, J=5,1 и 13,2 Гц, 1H), 5,52 (с, 2H), 7,33-7,52 (м, 5H), 7,92-8,03 (м, 3H), 10,94 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,28, 31,13, 45,04, 51,52, 64,29, 115,05, 115,31, 122,11, 122,96, 124,04, 124,64, 126,79, 129,80, 129,93, 131,36, 133,31, 137,71, 139,76, 153,34, 167,94, 170,94, 172,78; Вычислено для C22H18N2O4S+0,5 H2O: C, 63,30; H, 4,61; N, 6,74; S, 7,72, Найдено: С, 63,85; H, 4,41; N, 6,75; S, 7,96.
5.131 3-[4-(2,3-ДИГИДРО-БЕНЗОФУРАН-2-ИЛМЕТОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
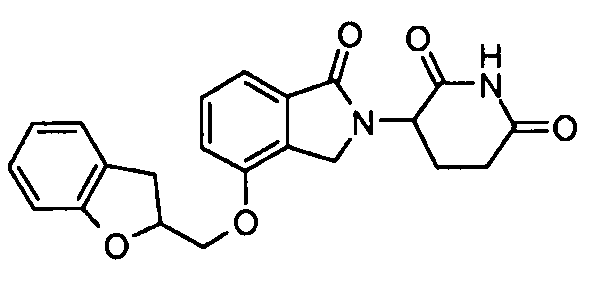
Стадия 1: Сцепленный с полимером трифенилфосфин (1,6 г, 2,06 ммоль, 1,25 ммоль/г) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (300 мг, 1,03 ммоль) в THF (10 мл). Полученную смесь перемешивали при 0°C в течение 10 минут, с последующим добавлением DIAD (412 мг, 2,06 ммоль). Десять минут спустя к смеси добавляли (2,3-дигидро-бензофуран-2-ил)-метанол (250 мг, 1,66 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 7,5 часов, и реакция была полной. Реакционную смесь фильтровали, и твердое вещество промывали дихлорметаном (7×20 мл). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-[4-(2,3-дигидро-бензофуран-2-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (380 мг, 87%-ый выход): LCMS MH=425.
Стадия 2: KOtBu (100,5 мг, 0,89 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(2,3-дигидро-бензофуран-2-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (380 мг, 0,89 ммоль) в тетрагидрофуране (18 мл). Смесь перемешивали при 0°C в течение 0,5 часов, и реакция была полной. К холодной реакционной смеси добавляли HCl (водный раствор, 0,1н., 10 мл), с последующим добавлением дихлорметана (25 мл) и солевого раствора (10 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO, получая 3-[4-(2,3-дигидро-бензофуран-2-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (243 мг, 70%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 (ацетонитрил/0,1% H3PO4): tR=4,32 (98%); Т. пл.: 258-260°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,28-2,46 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,82-2,99 (м, 1H, CHH), 3,04-3,20 (м, 1H, CHH), 3,35-3,43 (м, 1H, CHH), 3,97-4,45 (м, 4H, CHH, CHH, CHH, CHH), 5,03-5,22 (м, 2H, CNH, СОН), 6,75 (д, J=7,9 Гц, 1H, Ar), 6,79-6,88 (м, 1H, Ar), 7,02-7,13 (м, 1H, Ar), 7,19-7,37 (м, 3Н, Ar), 7,42-7,55 (м, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 44,75, 51,52, 70,33, 80,31, 108,89, 114,88, 115,36, 120,29, 124,94, 126,61, 127,74, 127,79, 129,72, 129,76, 129,84, 133,24, 153,54, 159,08, 167,93, 170,96, 172,81; LCMS MH=393; Вычислено для C22H20N2O5+0,3 H2O: С, 66,42; H, 5,22; N, 7,04, Найдено: С, 66,28; H, 5,12; N, 7,34.
5.132 3-(4-(ИМИДАЗО[1,2-A]ПИРИДИН-2-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
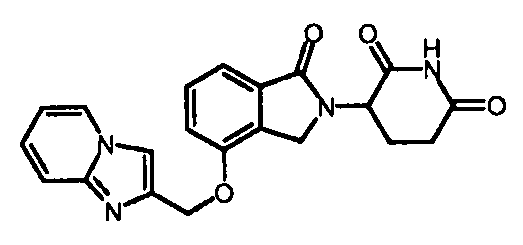
Стадия l: Диизопропил азодикарбоксилат (1,1 г, 5,5 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), имидазо[1,2-a]пиридин-2-илметанола (0,6 г, 4,1 ммоль) и связки трифенилфосфин-полимер (1,8 г, 5,5 ммоль) в THF (100 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (колонка с амином, CH3OH:CH2C12 3:97), получая 5-амино-4-(4-(имидазо[1,2-a]пиридин-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,5 г, 41%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,99-2,28 (м, 4H), 3,50 (с, 3H), 4,41 (д, J=18,0 Гц, 1H), 4,51 (д, J=18,0 Гц, 1H), 4,71-4,75 (м, 1H), 5,35 (с, 2H), 6,89 (т, J=6,0 Гц, 1H), 7,18-7,30 (м, 3H), 7,41-7,58 (м, 4H), 8,05 (с, 1H), 8,55 (д, J=6,0 Гц, 1H).
Стадия 2: Трет-бутоксид калия/THF (lM, 1,1 мл, 1,1 ммоль) добавляли к перемешиваемому раствору 5-амино-2-(4-(имидазо[1,2-a]пиридин-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,4 г, 1,1 ммоль) в THF (30 мл) и DMF (20 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили водой (30 мл). Смесь перемешивали с метиленхлоридом (40 мл), и водный слой экстрагировали метиленхлоридом (2×40 мл). Объединенный органический раствор промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с водой (20 мл). Смесь фильтровали, и твердое вещество ресуспендировали с метиленхлоридом (15 мл), получая 3-(4-(имидазо[1,2-а]пиридин-2-илметокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,1 г, 28%) как твердое вещество белого цвета: Т. пл. 222-224°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,01 (м, 1H), 2,35-2,51 (м, 2H), 2,58-2,91 (м, 1H), 4,26 (д, J=17,4 Гц, 1H), 4,36 (д, J=17,4 Гц, 1H), 5,08-5,14 (дд, J=5,1 и 13,5 Гц, 1H), 5,36 (с, 2H), 6,87-6,91 (дт, J=0,9 и 6,6 Гц, 1H), 7,21-7,55 (м, 5H), 8,03 (с, 1H), 8,51-8,53 (дд, J=0,9 и 6,6 Гц, 1H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,35, 31,17, 45,06, 51,54, 64,63, 111,79, 112,14, 115,01, 115,18, 116,65, 124,90, 126,95, 129,78, 129,84, 133,26, 141,54, 144,28, 153,45, 167,98, 170,96, 172,81; Вычислено для: C21H18N4O4+0,25 H2O: C, 63,87, H, 4,72; N, 14,19, Найдено: С, 63,99, H, 4,60; N, 14,20.
5.133 3-(4-(ИМИДАЗО[1,2-A]ПИРИДИН-6-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
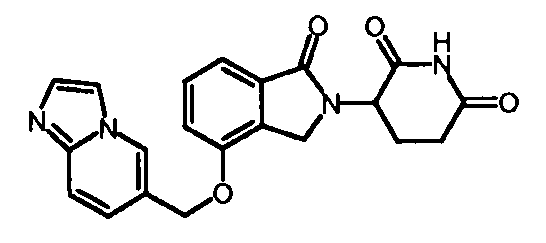
Стадия 1: Диизопропил азодикарбоксилат (1,3 г, 6,2 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксо-изоиндолин-2-ил)-5-оксо-метилпентаноата (0,9 г, 3,1 ммоль), имидазо[1,2-a]пиридин-6-илметанола (0,7 г, 4,6 ммоль) и связки трифенилфосфин-полимер (2,1 г, 6,2 ммоль) в THF (70 мл) при 5-8°C. После добавления смесь перемешивали при 5°C в течение 5 минут, затем нагревали до температуры окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(имидазо[1,2-a]пиридин-6-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,8 г, 65%).
Стадия 2: Раствор трет-бутоксид калия/THF (1M, 2,0 мл, 2,0 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-(имидазо[1,2-a]пиридин-6-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,0 ммоль) в THF (50 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили водой (30 мл). Смесь экстрагировали CH2Cl2 (3×30 мл), и объединенный раствор CH2Cl2 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(имидазо[1,2-a]пиридин-6-илметокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,25 г, 32%-ый выход): Т. пл. 270-272°C; 1H ЯМР (ДМСО-d6) δ 2,00 (м, 1H), 2,26-2,53 (м, 2H), 2,85-2,97 (м, 1H), 4,29 (д, J=17,4 Гц, 1H), 4,39 (д, J=17,7 Гц, 1H), 5,08-5,14 (дд, J=5,1 и 13,2 Гц, 1H), 5,26 (с, 2H), 7,28-7,41 (м, 3H), 7,51 (т, J=7,8 Гц, 1H), 7,58-7,61 (м, 2H), 7,97 (с, 1H), 8,72 (с, 1H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,35, 31,15, 45,04, 51,54, 67,26, 113,45, 115,07, 115,45, 116,84, 120,99, 125,10, 125,95, 129,83, 130,01, 133,34, 133,44, 144,01, 153,26, 167,94, 170,94, 172,80; Вычислено для C21H18N4O4+0,15 H2O: C, 64,19; H, 4,69; N, 14,25, Найдено: С, 64,10; H, 4,60; N, 14,32.
5.134 3-(4-(БЕНЗО[B]ТИОФЕН-3-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
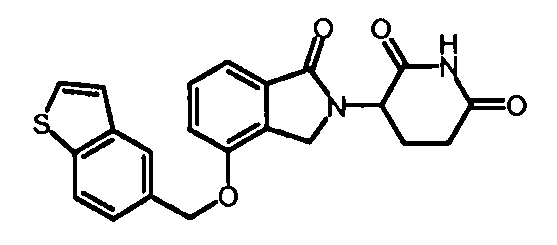
Стадия 1: Диизопропил азодикарбоксилат (1,1 г, 5,47 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), 1-бензотиофен-5-илметанола (0,7 г, 4,1 ммоль) и связки трифенилфосфин-полимер (1,8 г, 5,5 ммоль) в THF (60 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(бензо[b]тиофен-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,8 г, 56%).
Стадия 2: раствор трет-бутоксид калия/THF (1M, 2,3 мл, 2,3 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-(бензо[b]тиофен-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 2,3 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 1н. HCl (10 мл). Смесь разбавляли CH2Cl2 (50 мл) и водой (10 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали водой (2×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-бензо[b]тиофен-5-илметокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,4 г, 36%-ый выход): Т. пл. 213-215°C; 1H ЯМР (ДМСО-d6) δ 1,95-2,01 (м, 1H), 2,36-2,52 (м, 2H), 2,85-2,95 (м, 1H), 4,30 (д, J=17,4 Гц, 1H), 4,40 (д, J=17,4 Гц, 1H), 5,08-5,14 (дд, J=5,1 и 13,5 Гц, 1H), 5,37 (с, 2H), 7,31-7,37 (2д, J=8,1 и 7,5 Гц, 2H), 7,46-7,51 (м, 3H), 7,79 (д, J=5,4 Гц, 1H), 8,00-8,04 (м, 2H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 31,17, 45,09, 51,57, 69,67, 115,05, 115,23, 122,68, 122,77, 123,89, 124,11, 128,09, 129,79, 129,97, 132,84, 133,31, 138,75, 139,50, 153,46, 167,98, 170,95, 172,80; Вычислено для C22H18N2O4S: C, 65,01; H, 4,46; N, 6,89; S, 7,89, Найдено: С, 64,66; H, 4,07; N, 6,76; S, 7,87.
5.135 3-(1-ОКСО-4-(ХИНОЛИН-6-ИЛМЕТОКСИ)-ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
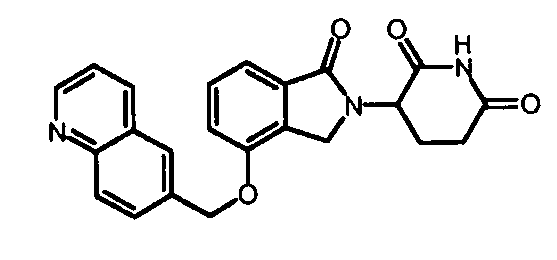
Стадия 1: DIBAL/толуол (1M, 16 мл, 16 ммоль) при -60°C медленно добавляли к перемешиваемому раствору хинолин-6-метилкарбоксилата (1,0 г, 5,3 ммоль) в THF (30 мл). Полученный раствор перемешивали при -20°C в течение 1,5 часов и затем тщательно гасили водой (15 мл). Смесь концентрировали, и остаток перемешивали в EtOAc (80 мл) и насыщ. NaHCO3 (20 мл). Смесь фильтровали, и водный слой экстрагировали EtOAc (2×30 мл). Объединенный раствор EtOAc промывали водой (30 мл) и солевым раствором (30 мл) и высушивали (MgSO4). Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:CH2Cl2 1:1), получая хинолин-6-ил-метанол (0,5 г, 62%-ый выход): 1H ЯМР (ДМСО-d6) δ 4,69 (д, J=5,1 Гц, 2H), 5,42 (т, J=5,4 Гц, 1H), 7,49-7,53 (дд, J=4,5 и 8,4 Гц, 1H), 7,69-7,72 (дд, J=1,8 и 8,7 Гц, 1H), 7,88 (д, J=0,9 Гц, 1H), 7,96 (д, J=8,7 Гц, 1H), 8,32-8,36 (дд, J=0,9 и 8,4 Гц, 1H), 8,85-8,87 (дд, J=1,8 и 4,2 Гц, 1H).
Стадия 2: Диизопропил азодикарбоксилат (0,7 г, 3,6 ммоль) добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3 г, 3,8 ммоль) в THF (40 мл) при 3-6°C. После перемешивания в течение 10 минут при 3°C, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 2,4 ммоль) и хинолин-6-ил-метанола (0,5 г, 3,1 ммоль) в THF (40 мл) медленно добавляли при 3-7°C. Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 5:95), получая 5-амино-5-оксо-4-(1-оксо-4-(хинолин-6-илметокси)-изоиндолин-2-ил)метилпентаноат (0,5 г, 46%).
Стадия 3: KO-t-Bu/THF (1M, 1,1 мл, 1,1 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(хинолин-6-илметокси)изоиндолин-2-ил)метилпентаноата (0,5 г, 1,1 ммоль). Реакционную смесь перемешивали 30 минут при 5°C, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (50 мл) и насыщ. NaHCO3 (15 мл). Водный слой экстрагировали CH2Cl2 (30 мл), и объединенный раствор CH2Cl2 промывали водой (20 мл) и солевым раствором (30 мл) и высушивали (MgSO4). Растворитель удаляли, и остаток перемешивали с CH2Cl2 (3 мл) и простым эфиром (3 мл). Твердое вещество собирали, получая 3-(1-оксо-4-(хинолин-6-илметокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 60%-ый выход): Т. пл. 267-269°C; 1H ЯМР (ДМСО-d6) δ 1,97-2,02 (м, 1H), 2,42-2,62 (м, 2H), 2,86-2,92 (м, 1Н), 4,35 (д, J=17,4 Гц, 1H), 4,45 (д, J=17,4 Гц, 1H), 5,10-5,16 (дд, J=5,1 и 13,2 Гц, 1H), 5,47 (с, 2H), 7,33-7,37 (м, 2H), 7,47-7,57 (м, 2H), 7,86-7,89 (дд, J=1,8 и 8,7 Гц, 1H), 8,04-8,09 (м, 2H), 8,38-8,41 (дд, J=0,9 и 8,4 Гц, 1H), 8,90-8,92 (дд, J=1,8 и 4,2 Гц, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,36, 31,17, 45,10, 51,58, 69,27, 115,08, 115,39, 121,74, 126,41, 127,60, 129,02, 129,22, 129,84, 120,02, 133,37, 134,96, 136,01, 147,36, 150,71, 153,40, 167,97, 170,98, 172,82; Вычислено для C23H19N3O4+0,2 H2O: C, 68,21; H, 4,83; N, 10,37, Найдено: С, 68,04; H, 4,78; N, 10,10.
5.136 3-(4-(НАФТАЛИН-2-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
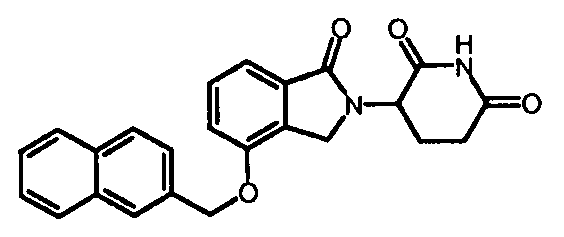
Стадия 1: Диизопропил азодикарбоксилат (0,8 г, 4,1 ммоль) медленно добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,0 г, 4,5 ммоль) в THF (40 мл) при 3-6°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), 2-нафталин-метанола (0,7 г, 4,1 ммоль) и триэтиламина (0,4 г, 4,1 ммоль) в THF (40 мл) добавляли при 3-6°C. После добавления, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(нафталин-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,6 г, 50%).
Стадия 2: Раствор трет-бутоксид калия/THF (1M, 1,4 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-4-(4-(нафталин-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,4 ммоль) в THF (20 мл). Полученный раствор перемешивали при 5°C в течение 30 минут, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (40 мл) и водой (15 мл). Водный слой экстрагировали CH2Cl2 (40 мл), и объединенный раствор CH2Cl2 промывали водой (20 мл) и солевым раствором (20 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(нафталин-2-илметокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,2 г, 36%-ый выход): Т. пл. 277-279°C; 1H ЯМР (ДМСО-d6) δ 1,97-2,02 (м, 1H), 2,42-2,61 (м, 2H), 2,85-2,95 (м, 1H), 4,33 (д, J=17,4 Гц, 1H), 4,43 (д, J=17,4 Гц, 1H), 5,09-5,15 (дд, J=5,1 и 13,2 Гц, 1H), 5,42 (с, 2H), 7,32-7,39 (м, 2H), 7,46-7,56 (м, 3H), 7,60-7,64 (м, 1H), 7,91-7,96 (м, 3H), 8,02 (с, 1H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,34, 31,17, 45,11, 51,58, 69,67, 115,08, 115,29, 125,58, 126,18, 126,31, 127,57, 127,77, 128,12, 129,81, 130,00, 132,57, 132,71, 133,34, 134,21, 153,47, 167,98, 170,96, 172,81; Вычислено для C24H20N2O4: C, 71,99; H, 5,03; N, 7,00, Найдено: С, 71,71; H, 5,09; N, 6,93.
5.137 3-(4-((2,3-ДИГИДРО-1Н-ИНДАН-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
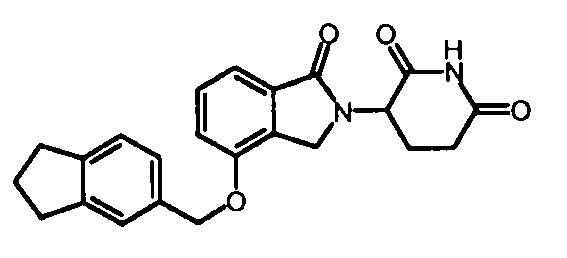
Стадия 1: Диизопропил азодикарбоксилат (0,8 г, 4,1 ммоль) добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,5 г, 4,4 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль) и 5-гидроксиметилиндана (0,5 г, 3,6 ммоль) в THF (40 мл) медленно добавляли при 3-5°C. Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (80 мл) и промывали насыщ. NaHCO3 (30 мл), водой (2×30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((2,3-дигидро-1Н-индан-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,7 г, 60%-ый выход): 1H ЯМР (CDCl3) δ 2,05-2,45 (м, 6H), 2,89-2,96 (м, 4H), 3,64 (с, 3Н), 4,35-4,49 (дд, J=17,4 и 26,4 Гц, 2H), 4,87-4,92 (дд, J=6,0 и 8,7 Гц, 1H), 5,10 (с, 2H), 5,37 (с, 1H), 6,33 (с, 1H), 7,08-7,28 (м, 4H), 7,37-7,44 (м, 2H).
Стадия 2: Раствор трет-бутоксид калия/THF (1M, 1,5 мл, 1,5 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-4-(4-((2,3-дигидро-1Н-индан-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,5 ммоль) в THF (20 мл). Полученный раствор перемешивали при 5°C в течение 30 минут, затем гасили насыщ. NH4Cl (5 мл). Смесь перемешивали с CH2Cl2 (50 мл) и водой (15 мл), и водный слой экстрагировали CH2Cl2 (30 мл). Объединенный раствор CH2Cl2 промывали водой (20 мл) и солевым раствором (20 мл) и высушивали. Растворитель удаляли, и твердый остаток перемешивали с ацетоном (10 мл), получая 3-(4-((2,3-дигидро-1Н-индан-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 58%-ый выход): Т. пл. 216-218°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,08 (м, 3H), 2,41-2,60 (м, 2H), 2,82-2,96 (м, 5H), 4,26 (д, J=17,7 Гц, 1H), 4,36 (д, J=17,7 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,5 Гц, lH),5,19 (с, 2H), 7,23-7,25 (м, 2H), 7,30-7,33 (м, 3H), 7,47 (т, J=7,8 Гц, 1H), 10,86 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,31, 25,05, 31,17, 32,00, 32,17, 45,08, 51,56, 69,76, 114,98, 115,11, 123,77, 124,15, 125,84, 129,76, 129,92, 133,26, 134,32, 143,60, 143,98, 153,50, 167,99, 170,96, 172,81; Вычислено для C23H22N2O4+0,3 H2O: C, 69,79; H, 5,75; N, 7,08, Найдено: C, 69,72; H, 5,67; N, 6,91.
5.138 3-(4-(БЕНЗО[D]ОКСАЗОЛ-5-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
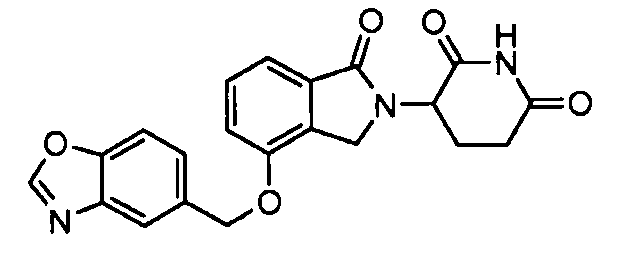
Стадия 1: Смесь 5-метилбензо[d]оксазола (2 г, 15 ммоль), NBS (2,67 г, 15 ммоль) и пероксида бензоила (50 мг, 0,21 ммоль) нагревали с обратным холодильником в CCl4 (50 мл) в течение ночи. Смесь охлаждали до температуры окружающей среды, и полученный осадок удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении, и остаток очищали ISCO (40 г колонка, градиент EtOAc/гексаны от 0% до 20% за 40 минут), получая 5-(бромметил)бензо[d]оксазол (1,6 г, 50%-ый выход); 1H ЯМР (ДМСО-d6): 4,88 (с, 2H, CH2), 7,55 (дд, J=1,7, 8,5 Гц, 1H, Ar), 7,77 (д, J=8,5 Гц, 1H, Ar), 7,91 (д, J=1,5 Гц, 1H, Ar), 8,79 (с, 1H, Ar).
Стадия 2: К суспензии карбоната калия (189 мг, 1,37 ммоль) в DMF (5 мл) добавляли 5-(бромметил)бензо[d]оксазол (261 мг, 1,23 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (400 мг, 1,37 ммоль). Сформированную смесь перемешивали при температуре окружающей среды в течение выходных. Добавляли дополнительное количество 5-(бромметил)бензо[d]оксазола (87 мг, 0,41 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь гасили водой (40 мл) при 0°C, продукт экстрагировали этилацетатом (3×30 мл), и объединенные органические слои промывали водой (20 мл) и солевым раствором (20 мл). Растворитель выпаривали под вакуумом, и продукт очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 5-амино-4-(4-(бензо[d]оксазол-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (440 мг, 76%-ый выход); 1H ЯМР (ДМСО-d6): 1,82-2,37 (м, 4H, CH2, СН2), 3,50 (с, 3Н, СН3), 4,34-4,64 (м, 2Н, СН2), 4,67-4,83 (м, 1Н, СН), 5,38 (с, 2Н, СН2), 7,18 (с, 1Н, NHH), 7,26-7,41 (м, 2Н, Ar), 7,45 (д, J=7,7 Гц, 1H, Ar), 7,59 (дд, J=1,4, 8,4 Гц, 2H, Ar), 7,81 (д, J=8,3 Гц, 1H, Ar), 7,96 (д, J=0,9 Гц, 1H, NHH), 8,78 (с, 1H, Ar).
Стадия 3: К смеси 5-амино-4-(4-(бензо[d]оксазол-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (450 мг, 1,06 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (119 мг, 1,06 ммоль). Сформированную смесь нагревали до температуры окружающей среды и перемешивали в течение ночи. Добавляли дополнительное количество трет-бутоксида калия (48 мг, 0,43 ммоль), и смесь перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь гасили уксусной кислотой (1 мл) при 0°C, растворитель выпаривали досуха, остаток забирали в ацетонитрил (5 мл) и добавляли по каплям воду (10 мл), затем добавляли насыщенный раствор бикарбоната натрия, чтобы установить рН 7. Смесь перемешивали в течение ночи, полученное твердое вещество отфильтровывали и ресуспендировали с ацетонитрилом (3 мл), получая 3-(4-(бензо[d]оксазол-5-илметокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (180 мг, 43%-ый выход); Т. пл.: 209-211°C; 1H ЯМР (ДМСО-d6): 1,89-2,07 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,60 (уш.с, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 4,22-4,54 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,38 (с, 2H, CH2), 7,35 (дд, J=7,6, 10,6 Гц, 2H, Ar), 7,44-7,55 (м, 1H, Ar), 7,58 (дд, J=1,5, 8,5 Гц, 1H, Ar), 7,80 (д, J=8,5 Гц, 1H, Ar), 7,95 (д, J=0,9 Гц, 1H, Ar), 8,78 (с, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6): 22,33, 31,16, 45,10, 51,58, 69,32, 111,09, 115,03, 115,29, 119,48, 125,56, 129,78, 130,02, 133,33, 133,40, 139,83, 149,05, 153,35, 154,75, 167,99, 170,95, 172,81; LCMS MH=392; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 ацетонитрил/0,1% H3PO4 tR=4,59 (98,54%); Вычислено для C21H17N3O5+0,3 H2O: C, 63,57; H, 4,47; N, 10,59; Найдено: С, 63,54; H, 4,31; N, 10,58.
5.139 3-(4-(ИЗОИНДОЛИН-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
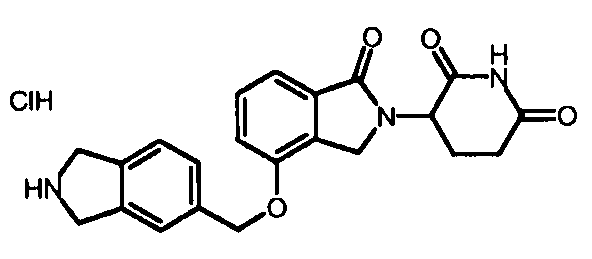
Раствор 5-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)изоиндолин-2-трет-бутилкарбоксилата (0,6 г, 1,3 ммоль) в THF (20 мл) обрабатывали смесью HCl/простой эфир (2M, 1,9 мл, 3,8 ммоль) и перемешивали при температуре окружающей среды в течение 8 часов. Добавляли простой эфир (10 мл) и собирали твердое вещество. Это твердое вещество ресуспендировали с CH2Cl2 (15 мл), получая 3-(4-(изоиндолин-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид (0,5 г, 88%-ый выход): Т.пл. 270-272°C; 1H ЯМР (ДМСО-d6) δ 1,97-2,00 (м, 1H), 2,41-2,61 (м, 2H), 2,87-2,93 (м, 1H), 4,28 (д, J=15 Гц, 1H), 4,39 (д, J=18 Гц, 1H), 4,50 (с, 4H), 5,08-5,14 (дд, J=6 и 15 Гц, 1H), 5,28 (с, 2H), 7,32-7,52 (м, 6H), 10,01 (с, 2H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,35, 31,18, 45,08, 49,73, 49,79, 51,57, 69,19, 115,01, 115,33, 122,14, 123,01, 127,77, 129,81, 129,93, 133,32, 134,89, 135,47, 136,95, 153,31, 167,95, 170,96, 172,83; Вычислено для C22H23N3O4Cl+0,5 H2O: C, 60,48; H, 5,31; N, 9,62; Cl, 8,11, Найдено: С, 60,11; H, 5,21; N, 9,38; Cl, 8,27.
5.140 3-(4-((1H-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
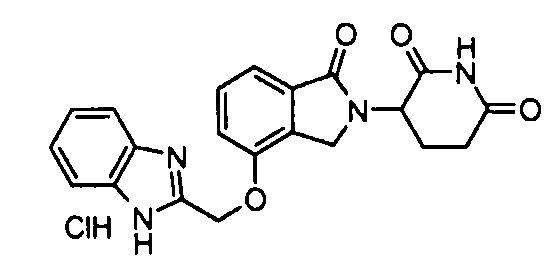
Стадия 1: К перемешиваемому раствору 2-(хлорметил)-1Н-бензо[d]имидазола (1 г, 6,00 ммоль) в DMF (10 мл, 129 ммоль) при температуре окружающей среды добавляли ди-трет-бутил бикарбонат (1,375 г, 6,30 ммоль). Приблизительно через 10 минут к смеси добавляли кат. количество DMAP (0,05 г, 0,409 ммоль). Полученный раствор перемешивали в течение дополнительных 5 минут при температуре окружающей среды (LCMS показала, что реакция перешла к завершению), и смесь инкубировали при 4°C в течение ночи. Реакционную смесь концентрировали в вакууме до масла, которое разбавляли EtOAc (~200 мл), переносили на делительную воронку и промывали 1М водным раствором KH2PO4 (pH~5, 2×50 мл). Органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме. Остаток высушивали в вакуумном сушильном шкафу, получая 2-(хлорметил)-1Н-бензо[d]имидазол-1-трет-бутилкарбоксилат в форме масла янтарного цвета (1,6 г, 97%-ый выход). Это масло использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 1,59-1,76 (м, 9H, tBu), 5,13 (с, 2H, CH2), 7,33-7,51 (м, 2H, Ar), 7,62-7,84 (м, 1H, Ar), 7,87-8,10 (м, 1H, Ar); 13C ЯМР (ДМСО-d6) δ 27,36, 86,28, 114,88, 119,99, 124,52, 125,61, 132,77, 141,16, 147,47, 150,23.
Один сигнал углерода (CH2Cl) не наблюдается вследствие перекрытия с ДМСО-d6; подтвержденный HMQC; LCMS MH=267, 269 (главным образом см. - фрагментацию Вос).
Стадия 2: 5-Амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (500 мг, 1,495 ммоль) и карбонат калия (227 мг, 1,645 ммоль) суспендировали в DMF (7 мл) при температуре окружающей среды. К перемешиваемой смеси при температуре окружающей среды добавляли 2-(хлорметил)-1Н-бензо[d]имидазол-1-трет-бутилкарбоксилат (439 мг, 1,645 ммоль) как раствор в DMF (3 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение приблизительно 15 часов. Сырую реакционную смесь разделяли между EtOAc (150 мл) и водой (~50 мл). Органический слой промывали солевым раствором (50 мл), высушивали (Na2SO4) и концентрировали в вакууме. Масляный остаток разбавляли дихлорметаном (~10 мл), концентрировали досуха (2х от дихлорметана), и полученное масло помещали в вакуумный сушильный шкаф при 40°C на несколько часов, получая 2-((2-(5-амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)-1Н-бензо[d]имидазол-1-трет-бутилкарбоксилат (1 г) как желто-коричневое масло, которое использовали на следующей стадии без дальнейшей очистки. LCMS MH (-Вос)=465.
Стадия 3: 2-((2-(5-Амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)-1Н-бензо[d]имидазол-1-трет-бутилкарбоксилат (844 мг, 1,495) растворяли в THF (10 мл, 122 ммоль). К перемешиваемому раствору при температуре окружающей среды добавляли KOtBu (2 мл, 2,0 ммоль, 1,0 М в THF) быстрым капельным способом через шприц, и прогресс реакции проверяли с помощью LCMS. Приблизительно через 50 минут добавляли дополнительное количество KOtBu (1 мл, 1 ммоль), и перемешивание смеси продолжали при температуре окружающей среды в течение приблизительно 15 минут. Реакционную смесь сохраняли при -20°C в течение ночи. Следующим утром добавляли дополнительное количество KOtBu (0,5 мл, 5 ммоль), с последующей другой обработкой KOtBu (0,5 мл, 0,5 ммоль) через 3 часа. Приблизительно через 80 минут реакционную смесь переносили в раствор 2н. HCl в Et2O (50 мл). Полученную светло-желтую суспензию перемешивали при температуре окружающей среды. Приблизительно через 1 час суспензию фильтровали, и твердое вещество промывали дополнительным Et2O и затем высушивали отсасыванием на воронке с фильтром. Сушка в печи дала ~1 г сырого продукта в форме твердого вещества желто-коричневого цвета. Это твердое вещество растворяли в смеси DMF/вода (10 мл/3 мл), обрабатывали ультразвуком и затем фильтровали. Фильтрат очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 30% MeCN за 12 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая твердый остаток, который повторно растворяли в 1н. HCl/ацетонитрил (~1:1, 40 мл). Смесь концентрировали в вакууме, и твердое вещество переносили в сцинтилляционную ампулу. Суспензию замораживали и лиофилизировали, получая твердое вещество грязно-белого цвета (145 мг). Это твердое вещество суспендировали в воде (5 мл), и смесь перемешивали в течение нескольких часов, затем фильтровали. Твердое вещество высушивали отсасыванием и затем сохраняли в вакуумном сушильном шкафу в течение ночи, получая 3-(4-((1H-бензо[d]имидазол-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (90 мг, 15%-ый выход). ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 13/87 ацетонитрил/0,1% H3PO4, 4,01 мин (96,6%); Т. пл.: 229-231°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,12 (м, 1H, CHH), 2,32-2,47 (м, 1H, CHH), 2,54-2,70 (м, 1H, CHH), 2,84-3,04 (м, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 4,55 (д, J=17,6 Гц, 1H, CHH), 5,16 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,73 (с, 2H, CH2), 7,29-7,65 (м, 5H, Ar), 7,68-7,85 (м, 2H, Ar), 11,02 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,18, 45,13, 51,58, 62,19, 114,56, 114,93, 116,34, 124,67, 129,97, 130,21, 133,50, 133,55, 149,24, 152,50, 167,74, 170,99, 172,81; LCMS MH=391; Вычислено для C21H18N4O4+0,76 HCl+3,4 H2O: C, 52,62; H, 5,37; N, 11,69; Cl, 5,62, Найдено: С, 52,72; H, 4,98; N, 11,33; Cl, 5,45.
5.141 3-(4-(БЕНЗО[D]ТИАЗОЛ-2-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
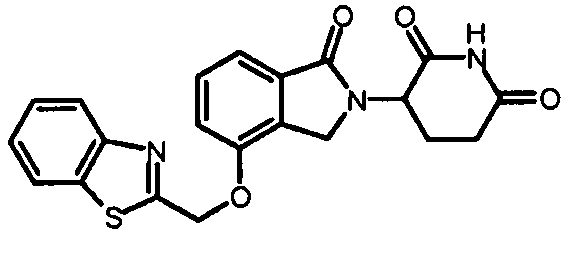
Стадия 1: Диизопропил азодикарбоксилат (l,3 г, 6,2 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 3,1 ммоль), 1,3-бензотиазол-2-метанола (0,8 г, 4,7 ммоль) и связки трифенилфосфин-полимер (2,1 г, 6,2 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (20 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2C12 3:97), получая 5-амино-4-(4-бензо[d]тиазол-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,6 г, 42%).
Стадия 2: Трет-бутоксид калия (0,2 г, 1,4 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-бензо[d]тиазол-2-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,4 ммоль) в THF (40 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (3 мл). Смесь разбавляли CH2Cl2 (80 мл) и промывали водой (20 мл), солевым раствором (20 мл) и высушивали. Растворитель удаляли, и остаток перемешивали с CH2Cl2 (1 0 мл), получая 0,4 г твердого вещества. Это твердое вещество ресуспендировали с горячим метанолом (15 мл), получая 3-(4-(бензо[d]тиазол-2-илметокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,35 г, 63%-ый выход): Т. пл. 253-255°C; 1H ЯМР (ДМСО-d6) δ 1,99-2,04 (м, 1H), 2,45-2,62 (м, 2H), 2,86-2,94 (м, 1H), 4,39 (д, J=17,4 Гц, 1H), 4,47 (д, J=17,7 Гц, 1H), 5,11-5,17 (дд, J=5,1 и 13,2 Гц, 1H), 5,76 (с, 2H), 7,32-7,75 (м, 5H), 8,02-8,05 (дд, J=0,6 и 8,1 Гц, 1H), 8,11-8,14 (дд, J=0,6 и 7,8 Гц, 1H), 11,00 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,44, 31,28, 45,10, 51,73, 67,53, 115,41, 116,24, 122,48, 122,86, 125,52, 126,47, 130,07, 133,63, 134,47, 152,58, 152,72, 167,89, 171,07, 172,94; Вычислено для C21H17N3O4S: C, 61,91; H, 4,21; N, 10,31; S, 7,87, Найдено: С, 61,76; H, 4,01; N, 10,24; S, 7,85.
5.142 3-(4-(БЕНЗОФУРАН-5-ИЛМЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
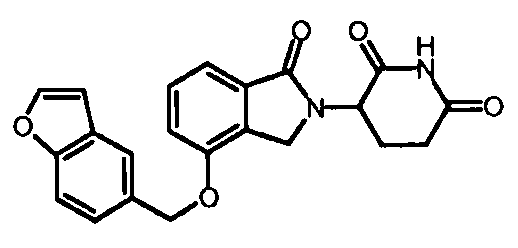
Стадия 1: Раствор 1-бензофуран-5-карбоновой кислоты (1,0 г, 6,2 ммоль) и триметилбората (5 мл) в THF (20 мл) перемешивали в течение 10 минут. BH3(CH3)2S/THF (2M, 3,7 мл, 7,4 ммоль) добавляли по каплям. Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь гасили метанолом (5 мл) и концентрировали. Остаток растворяли в метиленхлориде (75 мл) и промывали водой (25 мл) и солевым раствором (25 мл) и высушивали. Растворитель удаляли, получая бензофуран-5-метанол (2,6 г, 95%).
Стадия 2: Диизопропил азодикарбоксилат (1,4 г, 6,8 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 3,4 ммоль), бензофуран-5-метанола (0,8 г, 5,1 ммоль) и связки трифенилфосфин-полимер (2,3 г, 6,8 ммоль) в THF (80 мл) при 3-6°C. После добавления реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (20 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(бензофуран-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,9 г, 63%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,09-1,30 (м, 1H), 2,08-2,25 (м, 3H), 3,49 (с, 3H), 4,43 (д, J=17,7 Гц, 1H), 4,50 (д, J=17,6 Гц, 1H), 4,71-4,75 (дд, J=5,0 и 10,4 Гц, 1H), 5,33 (с, 2H), 6,98-6,99 (дд, J=1,0 и 2,2 Гц, 1H), 7,18 (с, 1H), 7,27-7,35 (м, 2H), 7,43-7,48 (м, 2H), 7,58-7,79 (м, 2H), 8,01 (с, 1H), 8,02 (с, 1H).
Стадия 3: Трет-бутоксид калия (0,3 г, 2,1 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-бензофуран-5-илметокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 2,1 ммоль) в THF (40 мл). Реакционную смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (3 мл). Смесь разбавляли метиленхлоридом (80 мл) и промывали водой (20 мл) и солевым раствором (20 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(бензофуран-5-илметокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,5 г, 57%) как твердое вещество белого цвета: Т. пл. 168-170°C; 1H ЯМР (ДМСО-d6) δ 1,97-2,00 (м, 1H), 2,42-2,59 (м, 2H), 2,90-2,91 (м, 1H), 4,28 (д, J=17,4 Гц, 1H), 4,39 (д, J=17,4 Гц, 1H), 5,08-5,14 (дд, J=5,4 и 13,5 Гц, 1H), 5,33 (с, 2H), 6,97-6,98 (дд, J=0,9 и 2,1 Гц, 1H), 7,31-7,51 (м, 4H), 7,60 (д, J=8,4 Гц, 1H), 7,79 (д, J=0,9 Гц, 1H), 8,0 (д, J=2,1 Гц, 1H), 10,97 (с, 1H); 13C (ДМСО-d6) δ 22,32, 31,16, 45,09, 51,56, 69,75, 106,70, 111,23, 115,03, 115,18, 120,79, 124,40, 127,28, 129,78, 129,95, 131,25, 133,28, 146,55, 153,49, 153,99, 168,00, 170,96, 172,81; Вычислено для C22H18N2O5+0,2 H2O: C, 67,07; H, 4,71; N, 7,11, Найдено: С, 67,05; H, 4,57; N, 6,97.
5.143 3-(1-ОКСО-4-(ХИНОЛИН-2-ИЛМЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
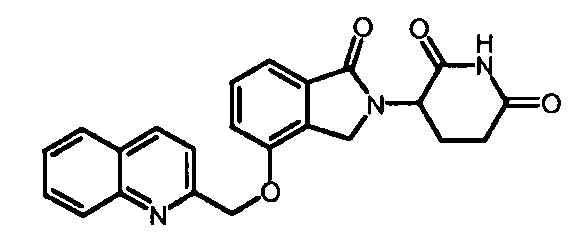
Стадия 1: Наствор 2-хинолин-карбоксальдегида (1,0 г, 6,4 ммоль) в реакционном спирте (40 мл) охлаждали в ванне сухой лед/ацетон до -60°C. LiBH4/THF (2M, 3,8 мл, 7,6 ммоль) добавляли по каплям при -60°C. Реакционную смесь перемешивали при -60°C в течение l часа, затем гасили водой (10 мл). Смесь концентрировали, и остаток растворяли в EtOAc (60 мл). Раствор EtOAc промывали солевым раствором (35 мл) и высушивали. Растворитель удаляли, получая хинолин-2-илметанол (0,9 г, 89%).
Стадия 2: Диизопропил азодикарбоксилат (1,4 г, 6,8 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 3,4 ммоль), хинолин-2-илметанола (0,9 г, 5,7 ммоль) и связки трифенилфосфин-полимер (2,3 г, 6,8 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (25 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-5-оксо-4-(1-оксо-4-(хинолин-2-илметокси)изоиндолин-2-ил)метилпентаноат (0,7 г, 47%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,08-2,31 (м, 4H), 3,51 (с, 3H), 4,54 (д, J=17,4 Гц, 1H), 4,61 (д, J=17,6 Гц, 1H), 4,73-4,78 (дд, J=5,0 и 10,4 Гц, 1H), 5,52 (с, 2H), 7,21 (с, 1H), 7,29-7,32 (м, 2H), 7,45 (т, J=7,8 Гц, 1H), 7,60-7,65 (м, 2H), 7,73-7,82 (м, 2H), 7,99-8,05 (т, J=8,4 Гц, 2H), 8,42 (д, J=8,5 Гц, 1H); 13C ЯМР (ДМСО-d6) δ 24,83, 30,34, 44,82, 51,25, 53,42, 71,05, 114,79, 115,44, 119,44, 126,63, 127,21, 127,94, 128,51, 129,63, 129,90, 130,29, 133,54, 137,16, 146,90, 153,23, 157,13, 167,81, 171,74, 172,48.
Стадия 3: Трет-бутоксид калия (0,2 г, 1,6 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(хинолин-2-илметокси)изоиндолин-2-ил)метилпентаноата (0,7 г, 1,6 ммоль) в THF (50 мл). Реакционную смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (3 мл). Смесь разбавляли метиленхлоридом (80 мл) и промывали насыщенным раствором NaHCO3 (25 мл). Органический слой промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и твердый остаток суспендировали с CH2Cl2 (20 мл), получая 3-(1-оксо-4-(хинолин-2-илметокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 26%) как твердое вещество белого цвета: Т.пл. 269-271°C; 1H ЯМР (ДМСО-d6) δ 1,99-2,04 (м, 1H), 2,44-2,63 (м, 2H), 2,88-2,93 (м, 1H), 4,39 (д, J=17,5 Гц, 1H), 4,50 (д, J=17,5 Гц, 1H), 5,11-5,17 (дд, J=5,1 и 13,3 Гц, 1H), 5,25 (с, 2H), 7,32-7,36 (дд, J=2,6 и 6,9 Гц, 2H), 7,48 (т, J=7,8 Гц, 1H), 7,60-7,65 (дт, J=1,2 и 6,9 Гц, 1H), 7,72-7,82 (м, 2H), 7,99-8,04 (т, J=8,0 Гц, 2H), 8,41-8,44 (д, J=8,5 Гц, 1H), 10,99 (с, lH); 13C ЯМР (ДМСО-d6) δ 22,37, 31,17, 45,12, 51,60, 71,05, 115,05, 115,52, 119,44, 126,64, 127,20, 127,93, 128,51, 129,87, 129,91, 130,03, 133,40, 137,11, 146,89, 153,29, 157,09, 167,94, 170,97, 172,83; Вычислено для C23H19N3O4: С, 68,82; H, 4,77; N, 10,47, Найдено: С, 68,66; H, 4,49; N, 10,24.
5.144 3-(1-ОКСО-4-(ХИНОЛИН-3-ИЛМЕТОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
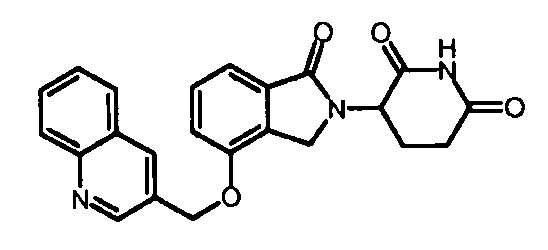
Стадия 1: Раствор 3-хинолинекарбоксальдегида (1,2 г, 7,6 ммоль) в реакционном спирте (60 мл) охлаждали в ванне сухой лед/ацетон до -40°C. LiBH4/THF (2 М, 4,6 мл, 9,2 ммоль) добавляли по каплям при температуре от -40 до -60°C. Реакционную смесь перемешивали при -60°C в течение 1 часа, затем гасили водой (10 мл). Смесь концентрировали, и остаток растворяли в EtOAc (90 мл). Раствор EtOAc промывали насыщенным NaHCO3 (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, получая хинолин-3-илметанол (1,2 г, 100%).
Стадия 2: Диизопропил азодикарбоксилат (1,6 г, 7,7 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,1 г, 3,8 ммоль), хинолин-3-илметанола (1,2 г, 7,9 ммоль) и связки трифенилфосфин-полимер (2,6 г, 7,7 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (25 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-5-оксо-4-(1-оксо-4-(хинолин-3-илметокси)изоиндолин-2-ил)метилпентаноат (l,0 г, 24%).
Стадия 3: Трет-бутоксид калия (0,3 г, 2,4 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(хинолин-3-илметокси)изоиндолин-2-ил)метилпентаноата (1,0 г, 2,4 ммоль) в THF (50 мл). Реакционную смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (4 мл). Смесь разбавляли метиленхлоридом (80 мл) и промывали насыщенным NaHCO3 (30 мл) и водой (40 мл) и высушивали. Растворитель удаляли, и твердое вещество суспендировали с горячим метанолом (10 мл), получая 3-(1-оксо-4-(хинолин-3-илметокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,1 г, 47%) как твердое вещество белого цвета: Т. пл. 270-273°C; 1H ЯМР (ДМСО-d6) δ 1,99-2,01 (м, 1H), 2,43-2,60 (м, 2H), 2,9l (м, 1H), 4,33 (д, J=17,4 Гц, 1H), 4,40 (д, J=17,7 Гц, 1H), 5,09-5,15 (дд, J=5,1 и 13,2 Гц, 1H), 5,49 (с, 2H), 7,37 (д, J=7,2 Гц, 1H), 7,44 (д, J=7,7 Гц, 1H), 7,52 (т, J=7,8 Гц, 1H), 7,64 (дт, J=1,0 и 8,0 Гц, 1H), 7,79 (дт, J=1,5 и 6,9 Гц, 1H), 8,03 (т, J=8,5 Гц, 2H), 8,48 (д, J=1,3 Гц, 1H), 9,04 (д, J=2,1 Гц, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,08, 51,57, 67,52, 115,07, 115,51, 126,94, 127,24, 128,09, 128,72, 129,68, 129,72, 129,87, 130,06, 133,38, 134,68, 147,22, 150,52, 153,28, 167,95, 170,94, 172,81; Вычислено для C23H19N3O4+0,2H2O: C, 68,21; H, 4,83; N, 10,37, Найдено: C, 68,29; H, 4,87; N, 10,15.
5.145 3-[4-(ХРОМАН-3-ИЛМЕТОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
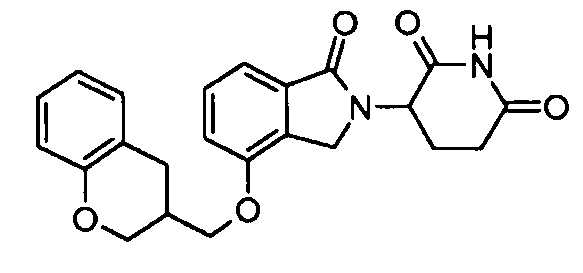
Стадия 1: Сцепленный с полимером трифенилфосфин (1,6 г, 2,04 ммоль, 1,25 ммоль/г) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (300 мг, 1,02 ммоль) в THF (10 мл). Полученную смесь перемешивали при 0°C в течение 10 минут, с последующим добавлением DIAD (412 мг, 2,04 ммоль). Десять минут спустя к смеси добавляли хроман-3-ил-метанол (336 мг, 2,04 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов, и реакция была полной. Реакционную смесь фильтровали, и твердое вещество промывали дихлорметаном (5×20 мл). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-[4-(хроман-3-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме твердого стекловидного вещества желтого цвета (400 мг, 90%-ый выход): LCMS MH=439.
Стадия 2: KOtBu (102,4 мг, 0,91 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(хроман-3-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (400 мг, 0,91 ммоль) в тетрагидрофуране (20 мл). Смесь перемешивали при температуре окружающей среды в течение 5 часов, с последующим добавлением HCl (водный раствор, 1н., 1,3 мл) и затем воды (10 мл). Смесь экстрагировали дихлорметаном (2×25 мл). Органические слои высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO и препаративной ВЭЖХ, получая 3-[4-(хроман-3-илметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (30 мг, выход 7,9%). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 (ацетонитрил/0,1% H3PO4): tR=7,07 (100%); Т. пл.: 258-260°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,08 (м, 1H, CHH), 2,34-2,45 (м, 1H, CHH), 2,54-2,65 (м, 2H, CH2), 2,66-2,81 (м, 1H, CHH), 2,82-3,02 (м, 2H, CH2), 3,97-4,48 (м, 6H, CH2, CH2, CH2), 5,04-5,19 (м, 1H, CHN), 6,70-6,89 (м, 2H, Ar), 7,01-7,15 (м, 2H, Ar), 7,29 (дд, J=7,7, 18,1 Гц, 2H, Ar), 7,42-7,52 (м, 1H, Ar), 10,99 (с, 1H, NH), *один протон перекрыт ДМСО, что подтверждено HMQC; 13C ЯМР (ДМСО-d6) δ 22,37, 26,66, 31,15, 31,72, 31,75, 44,89, 51,52, 66,88, 68,18, 114,48, 115,18, 116,14, 120,26, 121,02, 127,07, 129,86, 129,99, 133,20, 153,52, 154,11, 167,99, 170,97, 172,83; LCMS MH=407
5.146 3-[4-(4-БЕНЗОТРИАЗОЛ-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
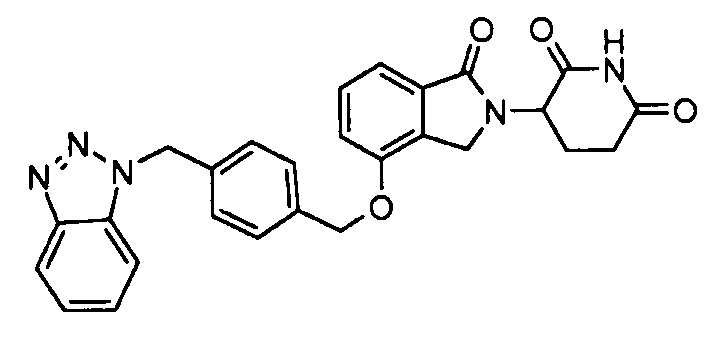
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,683 г, 1,43 ммоль) в ацетонитриле (10 мл) добавляли 1H-бензо[d][1,2,3]триазол (0,205 г, 1,72 ммоль) и N-этил-N-изопропилпропан-2-амин (0,285 мл, 1,724 ммоль). Смесь перемешивали в течение ночи и затем концентрировали, получая сырой 4-(4-(4-((1H-бензо[d][1,2,3]триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноат как белое пенистое твердое вещество (1,30 г). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемой белой суспензии 4-(4-(4-((1H-бензо[d][1,2,3]триазол-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (0,73 г, 1,43 ммоль) в THF (12 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,46 г, 4,11 ммоль). Смесь перемешивали в течение 15 минут и гасили 1н. HCl (~3 мл) и затем нейтрализовали насыщенным раствором бикарбоната натрия (6 мл до рН=7). Смесь перемешивали с этилацетатом (20 мл) и затем фильтровали, получая твердое вещество белого цвета. Его очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 30 минут), получая 3-[4-(4-бензотриазол-1-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как белый порошок (340 мг, 49%-ый выход); Т. пл.: 228-230°C; ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический за 5 мин, (CH3CN/0,1% H3PO4), 6,44 мин (98,2%); 1H ЯМР (ДМСО-d6) δ 1,89-2,03 (м, 1H, CH), 2,33-2,47 (м, 1H, CH), 2,52-2,62 (м, 1H, CH), 2,81-2,98 (м, 1H, CH), 4,14-4,45 (м, 2H, CH2), 5,09 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 6,00 (с, 2H, CH2), 7,26-7,58 (м, 11H, ArH), 7,86 (д, J=8,5 Гц, 1H, ArH), 8,06 (д, J=8,3 Гц, 1H, ArH), 10,95 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,20, 45,06, 50,64, 51,55, 69,12, 110,65, 114,89, 115,27, 119,22, 124,04, 127,45, 127,88, 128,15, 129,79, 129,94, 132,64, 133,31, 135,65, 136,53, 145,31, 153,37, 167,98, 170,94, 172,82. LC/MS MH=482; Вычислено для C27H23N5O4+0,7 H2O: C, 65,63; H, 4,98; N, 14,17, Найдено: С, 65,39; H, 4,79; N, 13,96.
5.147 3-(4-(2-ХЛОРБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
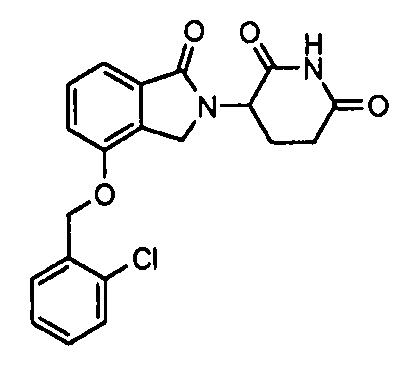
К суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (200 мг, 0,684 ммоль) и Cs2CO3 (233 мг, 0,677 ммоль) в сухом DMF (5 мл) добавляли 1-хлор-2-хлорметил-бензол (820 мкл, 10%-ый раствор в DMF, 0,650 ммоль). Реакционную смесь перемешивали при температуре окружающей среды, и прогресс проверяли с использованием LCMS. Через 2 часа добавляли N,N-диизопропилэтиламин (120 мкл, 0,684 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Через 14 часов смесь нагревали в масляной бане до 80°C и перемешивали в течение 8 часов. Сырую реакционную смесь охлаждали на ванне со льдом и затем переносили в небольших частях в охлажденный 0,5н. водный раствор HCl (40 мл). Образовавшееся твердое вещество белого цвета собирали фильтрацией, промывали дополнительным количеством воды на воронке с фильтром и высушивали в вакуумном сушильном шкафу, получая 220 мг сырого продукта. Это твердое вещество растворяли в минимальном количестве DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 30% до 75% ацетонитрила за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(4-(2-хлорбензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (175 мг, 70%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 ацитонитрил/0,1% H3PO4, 4,08 мин (98,7%); Т. пл.: 213-215°C; 1H ЯМР (ДМСО-d6) δ 1,87-2,05 (м, 1H, CHH), 2,32-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,46 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,31 (с, 2H, CH2), 7,27-7,46 (м, 4H, Ar), 7,48-7,59 (м, 2H, Ar), 7,62-7,72 (м, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,30, 31,16, 45,03, 51,55, 67,25, 114,93, 115,51, 127,38, 129,42, 129,90, 129,95, 130,03, 130,22, 132,72, 133,37, 133,85, 153,26, 167,91, 170,96, 172,80; LCMS MH=385, 387; Вычислено для C20H17ClN2O4+0,35 H2O: С, 61,42; H, 4,56; N, 7,16; Cl, 9,06, Найдено: С, 61,26; H, 4,32; N, 7,19; Cl, 9,18.
5.148 3-(1-ОКСО-4-(2,4,6-ТРИХЛОРБЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
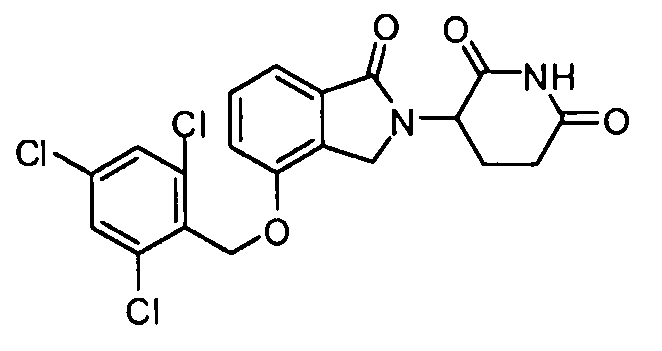
Стадия 1: Раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,50 г, 1,7 ммоль) и 2,4,6-трихлорбензилового спирта (0,72 г, 3,4 ммоль) в THF (30 мл) охлаждали до 0°C. Добавляли полимер-связанный трифенилфосфин (загрузка 3 ммоль/г, 1,2 г, 3,7 ммоль), затем DIAD (0,76 грамма 3,7 ммоль). Через один час охлаждающую ванну удаляли, и смесь перемешивали под азотом в течение 20 часов. Смесь фильтровали, и фильтр промывали этилацетатом (50 мл). Фильтрат разбавляли дополнительным этилацетатом (50 мл) и промывали солевым раствором (3×100 мл) и упаривали. Остаток хроматографировали в градиенте метиленхлорид-метанол, элюируя продукт в 5%-ом метаноле. Сырой 5-амино-5-оксо-4-(1-оксо-4-(2,4,6-трихлорбензилокси)изоиндолин-2-ил)метилпентаноат (1,15 г (>100%)) получали в форме клейкого вещества.
Стадия 2: Сырой материал, полученный на стадии 1, растворяли в THF (25 мл) и охлаждали до 0°C. Затем добавляли трет-бутоксид калия (0,19 г, 1,7 ммоль), и смесь перемешивали под азотом в течение 3 часов. Смесь гасили добавлением 5 капель уксусной кислоты. Полученную смесь разбавляли этилацетатом (75 мл) и промывали насыщенным водным раствором бикарбоната натрия (75 мл) и упаривали под вакуумом. Остаток хроматографировали в градиенте метиленхлорид-метанол, элюируя продукт в 5%-ом метаноле. После упаривания подходящих фракций, остаток суспендировали в простом эфире (15 мл) в течение 1 часа, фильтровали и высушивали под вакуумом, получая продукт как твердое вещество белого цвета, 0,53 г, при 68%-ом за две стадии; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 (ацетонитрил/0,1% H3PO4): tR=6,94 (97,86%); Т. пл. 138-140°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,02 (м, 1H, CHH), 2,33-2,47 (м, 1H, CHH), 2,53-2,62 (м, 1H, CHH), 2,79-2,98 (м, 1H, CHH), 4,16 (д, J=17,6 Гц, 1H, CHH), 4,32 (д, J=17,6 Гц, 1H, СНН), 5,09 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,33 (д, J=10,6 Гц, 1H, CHH), 5,39 (д, J=10,8 Гц, 1H, CHH), 7,39 (д, J=7,2 Гц, 1H, Ar), 7,45-7,61 (м, 2H, Ar), 7,81 (с, 2H, Ar), 10,94 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,26, 31,18, 44,99, 51,58, 65,00, 115,07, 115,89, 128,58, 129,90, 130,03, 130,62, 133,44, 135,09, 136,85, 153,40, 167,83, 170,95, 172,79; LCMS MH=453/455/457. Вычислено для: C20H15Cl3N2O4+0,4 Et2O: C, 53,67; H, 3,96; N, 5,80; Найдено: С, 53,65; H, 3,89; N, 5,71.
5.149 3-[4-(2,5-ДИХЛОР-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
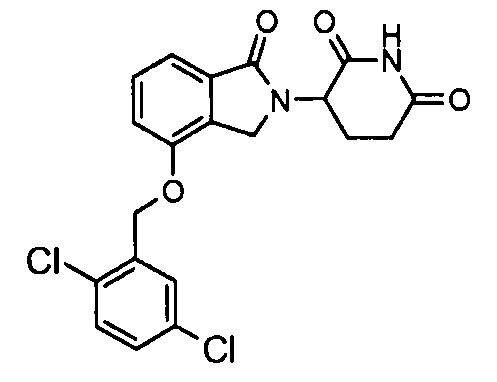
Стадия 1: К раствору 3-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (0,5 г, 1,7 ммоль) в THF (30 мл) добавляли трифенилфосфин (на полимерной подложке 2,2 ммоль/г, 1,64 г, 3,74 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 минут. Диизопропил азодикарбоксилат (0,76 мл, 3,74 ммоль) добавляли при 0°C, и смесь перемешивали при 0°C в течение 30 минут. 2,5-Дихлорфенилметанол (0,45 г, 2,57 ммоль) добавляли при 0°C, и смеси давали нагреться до температуры окружающей среды и перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и фильтрат концентрировали. Полученное масло очищали на колонке с силикагелем, элюируя метиленхлоридом и метанолом (градиент, продукт вышел в 6%-ом метаноле), получая метиловый эфир 4-карбамоил-4-[4-(2,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,7 г, 92%).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(2,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,7 г, 1,5 ммоль) в THF (30 мл) при 0°C добавляли трет-бутоксид калия (0,17 г, 1,7 ммоль). Смесь перемешивали при 0°C в течение 10 минут и гасили 1н. HCl (5 мл, 5 ммоль), затем насыщенным раствором NaHCO3 (25 мл). Смесь экстрагировали EtOAc (50 мл×2). Органический слой промывали водой (30 мл) и солевым раствором (30 мл), высушивали над MgSO4 и концентрировали. К полученному твердому веществу добавляли EtOAc (10 мл), затем гексан (10 мл) при перемешивании. Суспензию фильтровали, получая 3-[4-(2,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,26 г, 37%). Т. пл.: 256-258°C; ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент до 95/5 ацетонитрил/0,1% H3PO4 за 5 мин,: tR=6,87 мин (96,5%); 1H ЯМР (ДМСО-d6) δ 1,67-2,16 (м, 1H, CHH), 2,36-2,46 (м, J=4,2 Гц, 1H, CHH), 2,53-2,65 (м, J=19,5 Гц, 1H, CHH), 2,76-3,09 (м, 1H, CHH), 4,13-4,60 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,29 (с, 2H, CH2), 7,34-7,43 (м, 2H, Ar), 7,46-7,63 (м, 3H, Ar), 7,73 (д, J=2,5 Гц, 1H, Ar), 10,97 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,27, 31,14, 45,02, 51,56, 66,75, 114,95, 115,68, 129,66, 129,78, 129,88, 129,94, 131,11, 131,37, 131,91, 133,41, 136,01, 153,05, 167,83, 170,91, 172,76; LCMS: 465; Вычислено для: C26H16Cl2N2O4+0,2 H2O: C, 56,81; H, 3,91; N, 6,62; Найдено: С, 56,75; H, 4,19; N, 6,70.
5.150 3-[4-(3-МЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
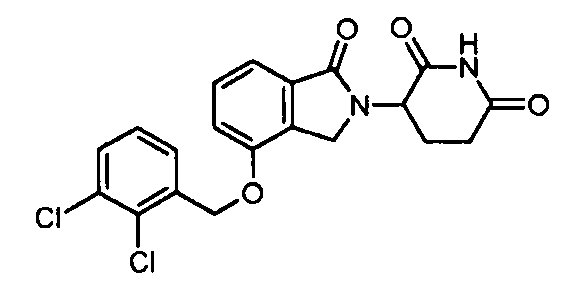
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 2,40 г, 3,80 ммоль) добавляли при 0°C к перемешиваемому раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,50 г, 1,71 ммоль) в THF (10 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,75 мл, 3,80 ммоль). После перемешивания в течение 30 минут добавляли (2,3-дихлорфенил)-метанол (0,45 г, 2,60 ммоль). Смесь перемешивали в течение одного часа, затем фильтровали, промывали метанолом (3×10 мл), метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент EtOAc/Гексаны от 20% до 100% за 90 минут), получая метиловый эфир 4-карбамоил-4-[4-(2,3-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как твердое вещество белого цвета (0,35 г, 45%-ый выход).
Стадия 2: Трет-бутоксид калия (0,17 г, 1,50 ммоль) добавляли при 0°C к перемешиваемой суспензии метилового эфира 4-карбамоил-4-[4-(2,3-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,34 г, 0,75 ммоль) в THF (20 мл). Смесь перемешивали в течение десяти минут и гасили 1н. HCl (3 мл), нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7) и быстро экстрагировали этилацетатом (2×30 мл). Объединенные фазы этилацетата упаривали и очищали на колонке с силикагелем (MeOH/CH2Cl2, градиент от 1% до 9% за 60 минут), получая 3-[4-(2,3-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,03 г, 9%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 50/50 за 10 мин (CH3CN/0,1% H3PO4), 5,84 мин (96,1%); Т. пл.: 272-274°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,37-2,47 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-3,01 (м, 1H, CHH), 4,22-4,50 (м, 2H, CH2), 5,12 (дд, J=5,2, 13,1 Гц, 1H, NCH), 5,35 (с, 2H, CH2), 7,32-7,73 (м, 6H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,20, 45,05, 51,59, 67,56, 114,97, 115,68, 128,41, 128,51, 129,95, 130,30, 130,60, 131,98, 133,44, 136,57, 153,09, 167,90, 170,96, 172,83; LCMS MH=419, 421; Вычислено для: C20H16N2O4Cl2: С, 57,30; H, 3,85; N, 6,68; Cl, 16,91; Найдено: С, 57,31; H, 3,86; N, 6,46; Cl, 17,02.
5.151 3-(4-(3,4-ДИМЕТОКСИБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
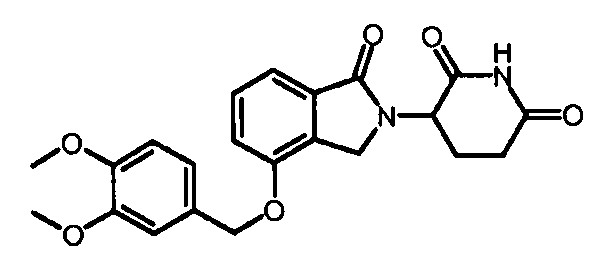
Стадия 1: Диизопропил азодикарбоксилат (1,3 г, 6,1 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,9 г, 3,1 ммоль), 3,4-диметоксибензилового спирта (0,8 г, 4,6 ммоль) и связки трифенилфосфин-полимер (2,1 г, 6,2 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(3,4-диметоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,5 г, 3,8%).
Стадия 2: Раствор трет-бутоксид калия в THF (l М, 1,2 мл, 1,2 ммоль) добавляли при 5°C к перемешиваемому раствору 5-амино-4-(4-(3,4-диметоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,2 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (4 мл). Смесь разбавляли метиленхлоридом (70 мл) и водой (20 мл). Органический слой промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(3,4-диметоксибензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 32%) как твердое вещество белого цвета: Т. пл. 205-207°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,00 (м, 1H), 2,41-2,60 (м, 2H), 2,91 (м, 1H), 3,76 (с, 6H), 4,26 (д, J=17,7 Гц, 1H), 4,37 (д, J=17,4 Гц, 1H), 5,07-5,13 (м, 3Н), 6,94-7,09 (м, 3Н), 7,31-7,35 (м, 2Н), 7,48 (т, J=7,8 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,30, 31,17; 45,11, 51,56, 55,47, 69,67, 111,59, 111,90, 115,07, 115,12, 120,51, 128,80, 129,75, 129,96, 133,24, 148,65, 153,51, 168,00, 170,96, 172,82; Вычислено для: C22H22N2O6: C, 64,38; H, 5,40; N, 6,83, Найдено: C, 64,36; H, 5,25; N, 6,85.
5.152 3-[4-(3-ХЛОР-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО- ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
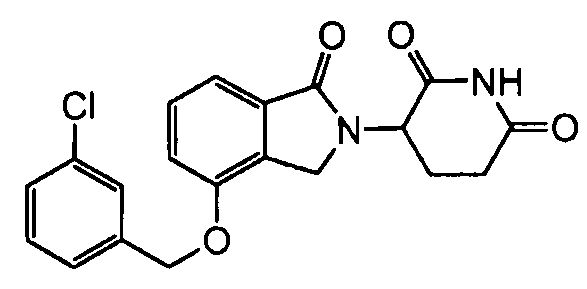
Стадия 1: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (1,0 г, 3,42 ммоль) в THF при 0°C добавляли трифенилфосфиновую смолу (2,3 г, загрузка 2,2 ммоль/г, 6,84 ммоль) и DIAD (1,33 мл, 6,84 ммоль). После перемешивания при 0°C в течение 10 минут, к смеси добавляли (3-хлор-4-илметил-фенил)-метанол (0,61 мл, 5,13 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[4-(3-хлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (0,24 г, 20%).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(3-хлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,24 г, 0,57 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (г на 0,57 мл, 0,57 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая 3-[4-(4-хлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (60 мг, 27%). Т. пл.: 224-226°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,9 мин (97%). 1H ЯМР (ДМСО-d6) δ 1,88-2,05 (м, J=1,9 Гц, 1H, CHH), 2,34-2,46 (м, 1H, CHH), 2,57-2,65 (м, J=3,6 Гц, 1H, CHH), 2,79-3,02 (м, 1H, CHH), 4,16-4,61 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,1 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,19-7,38 (м, 2H, Ar), 7,38-7,54 (м, 4H, Ar), 7,56 (с, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,09, 51,61, 68,59, 114,95, 115,43, 126,19, 127,33, 127,91, 129,84, 129,98, 130,42, 133,13, 133,39, 139,20, 153,24, 167,95, 170,99, 172,87; LCMS MH=385. Вычислено для C20H17N2O4Cl: C, 62,42; H, 4,45; N, 7,28; Найдено: С, 61,51% H, 4,04; N, 7,12.
5.153 3-(4-(3-(2-(ДИМЕТИЛАМИНО)ЭТОКСИ)-4-МЕТОКСИ БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
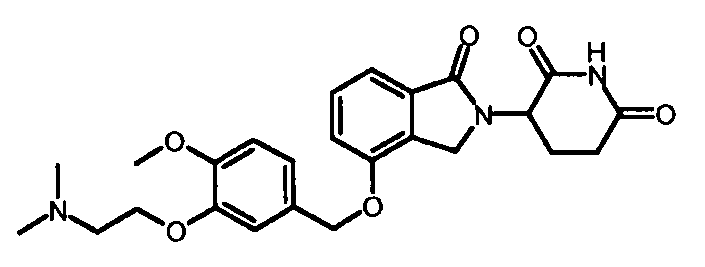
Стадия 1: Смесь 3-гидрокси-4-метоксибензальдегида (4,2 г, 27,3 ммоль) и Cs2CO3 (22,2 г, 68,2 ммоль) в DMF (80 мл) перемешивали в течение 10 минут. К этой смеси добавляли диметиламиноэтил хлорид гидрохлорид (4,7 г, 32,7 ммоль). Реакционную смесь перемешивали при 50°C на масляной бане в течение 18 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат разбавляли водой (200 мл) и экстрагировали EtOAc (4×50 мл). Объединенный раствор EtOAc промывали водой (3×50 мл) и солевым раствором (50 мл) и высушивали. Растворитель удаляли, получая 3-(2-(диметиламино)этокси)-4-метоксибензальдегид (3,8 г, 62%).
Стадия 2: Раствор 3-(2-(диметиламино)этокси)-4-метоксибензальдегида (3,8 г, 16,8 ммоль) в THF (20 мл) добавляли к перемешиваемому раствору LiBH4/THF (2,0M, 10,1 мл) в THF (20 мл) при 6-10°C. После добавления смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь охлаждали в ванне со льдом и гасили водой (15 мл). Смесь экстрагировали EtOAc (3×50 мл), и объединенный раствор EtOAc промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:CH2Cl2 3:7), получая 3-(2-(диметиламино)этокси-4-метоксифенил)метанол (3,6 г, 94%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,62 (с, 6H), 3,13 (т, J=5,4 Гц, 2H), 3,73 (с, 3Н), 4,31 (т, J=5,4 Гц, 2H), 4,42 (д, J=5,7 Гц, 2H), 5,08 (т, J=5,7 Гц, 1H), 6,84-6,97 (м, 3H); 13C ЯМР (ДМСО-d6) δ 51,74, 55,70, 61,89, 62,63, 64,07, 111,91, 112,38, 119,38, 135,12, 147,15, 147,97.
Стадия 3: Диизопропил азодикарбоксилат (0,9 г, 4,4 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 2,2 ммоль), 3-(2-(диметиламино)этокси-4-метоксифенил)метанола (0,8 г, 3,3 ммоль) и связки трифенилфосфин-полимер (1,5 г, 4,4 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(3-(2-(диметиламино)этокси)-4-метоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,6 г, 54%).
Стадия 4: Трет-бутоксид калия/THF (l М, 1,3 мл, 1,3 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-(3-(2-(диметиламино)этокси)-4-метоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,3 ммоль) в THF (20 мл) при 5°C. Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили насыщенным NH4Cl (6 мл). Смесь разбавляли метиленхлоридом (70 мл) и насыщенным раствором NaHCO3 (20 мл). Органический слой промывали водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(3-(2-(диметиламино)этокси)-4-метоксибензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,2 г, 39%) как твердое вещество белого цвета: Т. пл. 201-203°C; 1H ЯМР (ДМСО-d6) δ 1,95-2,00 (м, 1H), 2,40-2,52 (м, 2H), 2,61 (с, 6H), 2,84-2,95 (м, 1H), 3,1 1-3,17 (м, 2H), 3,76 (c, 3H), 4,26 (д, J=17,7 Гц, 1H), 4,34 (т, J=5,4 Гц, 2H), 4,37 (д, J=17,7 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,15 (с, 2H), 7,00 (д, J=8,4 Гц, 1H), 7,05-7,08 (дд, J=1,8 и 8,1 Гц, 1H), 7,16 (д, J=1,8 Гц, 1H), 7,31-7,35 (м, 2H), 7,48 (т, J=7,8 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,09, 51,54, 51,73, 55,67, 61,76, 64,10, 69,55, 112,01, 113,75, 115,09, 115,16, 121,31, 128,89, 129,77, 129,96, 133,25, 147,25, 149,00, 153,50, 168,00, 170,95, 172,80; Вычислено для: C25H29N3O6+0,1 H2O: С, 61,84; H, 6,44; N, 8,65; Найдено: С, 62,02; H, 6,67; N,8,58.
5.154 3-(4-(4-(2-(ДИМЕТИЛАМИНО)ЭТОКСИ)-3-МЕТОКСИБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
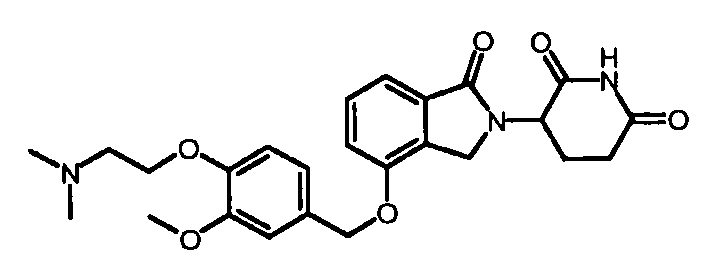
Стадия 1: Смесь ванилина (2 г, 27,3 ммоль) и Cs2CO3 (22,2 г, 68,2 ммоль) в DMF (80 мл) перемешивали в течение 10 минут. К этой смеси добавляли диэтиламиноэтил хлорид (4,7 г, 32,7 ммоль). Смесь перемешивали при 50°C на масляной бане в течение 18 часов. Реакционную смесь фильтровали. Фильтрат разбавляли водой (100 мл) и экстрагировали EtOAc (4×50 мл). Раствор EtOAc промывали водой (3×50 мл) и солевым раствором (50 мл) и высушивали. Растворитель удаляли, получая 4-(2-(диметиламино)этокси)-3-метоксибензальдегид (2,1 г, 34%).
Стадия 2: Раствор 4-(2-(диметиламино)этокси)-3-метоксибензальдегид (1,8 г, 8,1 ммоль) в THF (15 мл) добавляли к перемешиваемому раствору LiBH4/THF (2M, 4,8 мл, 9,7 ммоль) в THF (15 мл) при температуре от 8 до 10°C. После добавления, реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь охлаждали в ванне со льдом и гасили водой (10 мл). Смесь перемешивали с насыщенным NaHCO3 (25 мл) и EtOAc (50 мл). Водный слой экстрагировали EtOAc (2×30 мл). Объединенный раствор EtOAc промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:CH2Cl2 3:7), получая (4-(2-(диметиламино)этокси)-3-метоксифенил)метанол (2,6 г, 93%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,61 (с, 6H), 3,11 (т, J=5,4 Гц, 2H), 3,75 (с, 3H), 4,30 (т, J=5,4 Гц, 2H), 4,41 (д, J=5,7 Гц, 2H), 5,09 (т, J=5,7 Гц, 1H), 6,81-6,96 (м, 3H); 13C ЯМР (ДМСО-d6) δ 51,69, 55,48, 61,85, 62,69, 64,29, 110,81, 113,61, 118,51, 136,02, 146,11, 149,01.
Стадия 3: Диизопропил азодикарбоксилат (1,4 г, 6,8 ммоль) добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,0 г, 3,4 ммоль), (4-(2-(диметиламино)этокси)-3-метоксифенил)метанола (1,2 г, 5,1 ммоль) и связки трифенилфосфин-полимер (2,3 г, 6,8 ммоль) в THF (80 мл) при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали метиленхлоридом (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(4-(2-диметиламино)этокси)-3-метоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,4 г, 8 1%).
Стадия 4: Раствор трет-бутоксид калия/THF (l М, 3,0 мл, 3,0 ммоль) при 5°C добавляли к перемешиваемому раствору 5-амино-4-(4-(4-(2-(диметиламино)этокси)-3-метоксибензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,5 г, 3,0 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили насыщенным раствором NH4Cl (10 мл). Смесь разбавляли CH2Cl2 (50 мл) и насыщенным раствором NaHCO3 (25 мл). Водный слой экстрагировали CH2Cl2 (2×30 мл), и объединенный раствор CH2C12 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(4-(2-(диметиламино)этокси)-3-метоксибензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,6 г, 39%) как твердое вещество белого цвета: Т. пл. 190-192°C; 1H ЯМР (ДМСО-d6) δ 1,95-2,00 (м, 1H), 2,41-2,55 (м, 2H), 2,61 (с, 6Н), 2,84-2,91 (м, 1H), 3,13 (т, J=5,4 Гц, 2H), 3,77(с, 3Н), 4,27 (д, J=17,5 Гц, 1H), 4,33 (т, J=5,4 Гц, 2H), 4,37 (д, J=17,5 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,16 (с, 2H), 7,02 (м, 2H), 7,12 (уш., 1H), 7,31-7,35 (м, 2H), 7,48 (т, J=7,8 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,31, 31,17, 45,11, 51,56, 51,72, 55,67, 61,77, 64,14, 69,59, 112,24, 113,42, 115,05, 115,16, 120,50, 129,77, 129,95, 133,25, 147,22, 149,06, 153,50, 168,00, 170,96, 172,82; Вычислено для: C25H29N3O6+1,0 H2O: С, 61,34; H, 6,44; N, 8,65, Найдено: С, 61,98; H, 6,84; N, 8,67.
5.155 3-[4-(4-ХЛОР-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
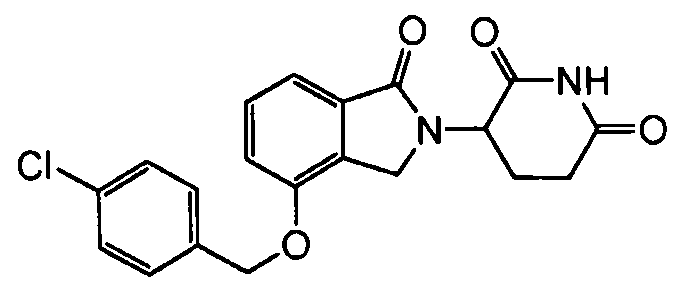
Стадия 1: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (1,0 г, 3,42 ммоль) в THF добавляли при 0°C трифенилфосфиновую смолу (2,3 г, загрузка 2,2 ммоль/г, 6,84 ммоль) и DIAD (1,33 мл, 6,84 ммоль). После перемешивания при 0°C в течение 10 минут, к смеси добавляли (4-хлор-4-илметил-фенил)-метанол (0,73 г, 5,13 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[4-(4-хлор-бензилокси)-1-оксо-1,3-дигидроизоиндол-2-ил]-масляной кислоты (0,13 г, 13%).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(3-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,18 г, 0,43 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (г на 0,6 мл, 0,6 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая 3-[4-(4-хлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (70 мг, 42%). Т. пл.: 238-240°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=3,9 мин (97%). 1H ЯМР (ДМСО-d6) δ 1,81-2,08 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,80-3,01 (м, 1H, CHH), 4,15-4,51 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,26 (с, 2H, CH2), 7,13-7,39 (м, 2H, Ar), 7,41-7,58 (м, 5H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,38, 31,20, 45,06, 51,58, 68,65, 115,00, 115,38, 128,47, 129,47, 129,82, 129,97, 132,55, 133,35, 135,70, 153,27, 167,96, 170,98, 172,83; LCMS MH=385, Вычислено для C20H17ClN2O4+0,1 H2O: C, 62,13; H, 4,48; N, 7,25; Найдено: С, 61,76% H, 4,45; N, 7,28.
5.156 3-[4-(3-МЕТОКСИ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
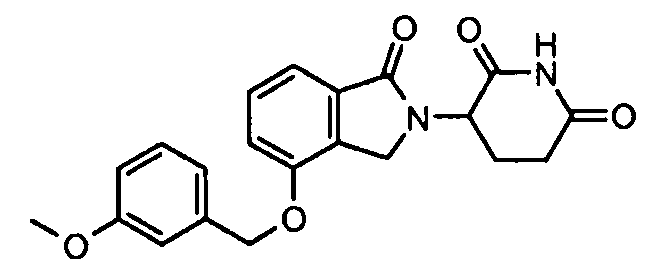
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,84 г, 4,78 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,78 г, 2,66 ммоль) в THF (15 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,95 мл, 4,78 ммоль). После перемешивания в течение 30 минут, добавляли (3-метоксифенил)-метанол (0,56 мл, 4,52 ммоль). Смесь перемешивали в течение одного часа, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 60 минут), получая метиловый эфир 4-карбамоил-4-[4-(3-метокси-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (0,32 г, 36%-ый выход).
Стадия 2: Трет-бутоксид калия (0,10 г, 0,92 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(3-метокси-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (1,13 г, 2,60 ммоль) в THF (10 мл) при 0°C в течение 10 минут. Смесь гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8). Смесь экстрагировали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и затем очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 3-[4-(3-метокси-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,23 г, 65%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 40/60 за 10 мин (ацетонитрил/0,1% H3PO4), 5,32 мин (98,9%); Т. пл.: 225-227°C; lH ЯМР (ДМСО-d6) δ 1,88-2,09 (м, 1H, CHH), 2,37-2,47 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 3,76 (с, 3H, CH3), 4,20-4,52 (м, 2H, ArCH2N), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,23 (с, 2H, ArCH2O), 6,91 (дд, J=1,7, 8,1 Гц, 1H, Ar), 7,00-7,12 (м, 2H, Ar), 7,23-7,38 (м, 3H, Ar), 7,43-7,55 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 31,21, 45,12, 51,61, 55,05, 69,38, 113,26, 115,00, 115,26, 119,68, 129,59, 129,79, 129,97, 133,32, 138,19, 153,41, 159,35, 167,99, 170,98, 172,83 (пропущен один ароматический углерод вследствие перекрывания, подтвержденного HMQC); LCMS MH=381; Анал. Вычислено для C21H20N2O5+0,1 H2O: C, 65,99; Н, 5,33; N, 7,33. Найдено: C, 65,71; Н, 5,36; N, 7,25.
5.157 3-[4-(3-МЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
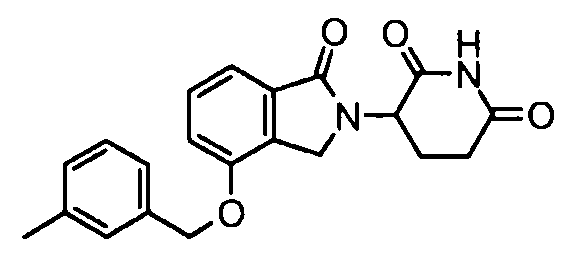
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 3,76 г, 4,68 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,75 г, 2,60 ммоль) в THF (15 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,93 мл, 4,68 ммоль). После перемешивания в течение 30 минут добавляли м-толил-метанол (0,53 мл, 4,40 ммоль). Смесь перемешивали в течение одного часа, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 60 минут), получая метиловый эфир 4-карбамоил-4-[4-(3-метил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (1,13 г, 137%-ый сырой выход).
Стадия 2: Трет-бутоксид калия (0,30 г, 2,60 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(3-метил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (1,13 г, 2,60 ммоль) в THF (10 мл) при 0°C в течение 10 минут. Смесь гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8). Смесь экстрагировали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 5% за 40 минут), получая 3-[4-(3-метил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,21 г, 29% за две стадии); ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, изократический при 40/60 за 10 мин (ацетонитрил/0,1% H3PO4), 7,89 мин (99,4%); Т. пл.: 244-246°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,06 (м, 1H, CHH), 2,32 (с, 3H, CH3), 2,36-2,47 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 4,19-4,49 (м, 2H, ArCH2N), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,21 (с, 2H, ArCH2O), 7,11-7,20 (м, 1H, Ar), 7,23-7,37 (м, 5H, Ar), 7,43-7,55 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,99, 22,36, 31,21, 45,12, 51,59, 69,61, 114,98, 115,23, 124,78, 128,25, 128,38, 128,61, 129,81, 129,94, 133,32, 136,53, 137,64, 153,50, 168,01, 170,98, 172,83; LCMS MH=365; Вычислено для C21H20N2O4+0,2 H2O: C, 68,54; H, 5,59; N, 7,61, Найдено: С, 68,18; H, 5,49; N,7,52.
5.158 3-(4-(3-МЕТОКСИ-4-(2-ПИРРОЛИДИН-1-ИЛ)ЭТОКСИ)-БЕНЗИЛОКСИ)-1-ОКСО-ИЗОИНДОЛИН-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
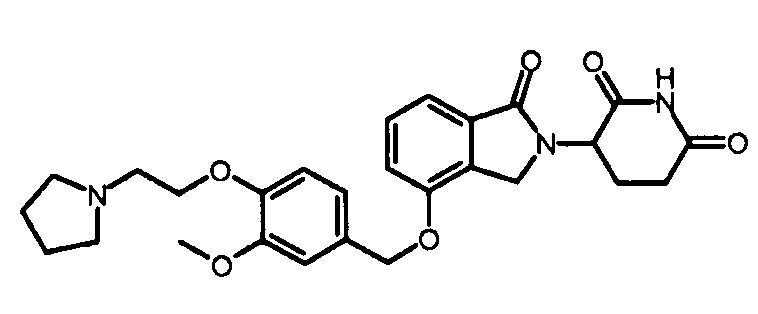
Стадия 1: Смесь Ванилина (4,2 г, 27,3 ммоль) и Cs2CO3 (22,2 г, 68,3 ммоль) в DMF (80 мл) перемешивали в течение 10 минут при температуре окружающей среды. К этой смеси добавляли 1-(2-хлорэтил)пирролидин гидрохлорида (5,6 г, 32,7 ммоль). Смесь нагревали при 50°C в течение ночи. Реакционную смесь охлаждали и фильтровали, и твердое вещество промывали EtOAc (100 мл). Фильтрат разбавляли водой (200 мл), и водный слой экстрагировали EtOAc (3×50 мл). Объединенный раствор EtOAc промывали водой (2×50 мл) и солевым раствором (50 мл) и высушивали. Растворитель удаляли, получая 3-метокси-4-(2-пирролидин-1-ил-этокси)бензальдегид (6,2 г, 91%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,65-1,71 (м, 4H), 2,50-2,55 (м, 4H), 2,81 (т, J=6,0 Гц, 2H), 4,17 (т, J=6,0 Гц, 2H), 7,20 (д, J=8,1 Гц, 1H), 7,40 (д, J=1,8 Гц, 1H), 7,52-7,55 (дд, J=1,8 и 8,1 Гц, 1H), 9,84 (с, 1H).
Стадия 2: Раствор LiBH4/THF (2,0M, 14,7 мл, 29,4 ммоль) в THF (20 мл) охлаждали в ванне со льдом до 5°C. Раствор 3-метокси-4-(2-пирролидин-1-ил-этокси)бензальдегида (6,1 г, 24,5 ммоль) в THF (20 мл) медленно добавляли при 5-8°C. После добавления смесь перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь охлаждали в ванне со льдом и гасили водой (15 мл). Смесь перемешивали с EtOAc (50 мл) и насыщ. NaHCO3 (25 мл). Водный слой экстрагировали EtOAc (2×40 мл), и объединенный раствор EtOAc промывали водой (40 мл) и солевым раствором (40 мл) и высушивали (MgSO4). Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:CH2Cl2 2:8), получая [3-метокси-4-(2-пирролидин-1-ил-этокси)-фенил]-метанол (4,8 г, 77%-ый выход): 1H ЯМР (ДМСО-d6) δ 1,85-2,01 (м, 4H), 2,96-3,08 (м, 4H), 3,12 (т, J=5,7 Гц, 2H), 3,74 (с, 3Н), 4,34 (т, J=5,7 Гц, 2H), 4,41 (д, J=5,6 Гц, 2H), 5,07 (т, J=5,7 Гц, 1H), 6,80-6,84 (дд, J=1,8 и 8,1 Гц, 1H), 6,94 (д, J=8,1 Гц, 2H); 13C ЯМР (ДМСО-d6) δ 22,28, 55,48, 61,34, 62,58, 62,70, 64,65, 110,78, 113,26, 118,52, 135,84, 146,23, 148,91.
Стадия 3: Диизопропил азодикарбоксилат (1,1 г, 5,5 ммоль) медленно добавляли к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,7 ммоль), [3-метокси-4-(2-пирролидин-1-ил-этокси)-фенил]-метанола (1,0 г, 4,1 ммоль) и связки трифенилфосфин-полимер (1,8 г, 5,5 ммоль) в THF (60 мл) при 5-7°C. После добавления смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (30 мл). Фильтрат концентрировали, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-(3-метокси-4-(2-(пирролидин-1-ил)этокси)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,9 г, 59%).
Стадия 4: Раствор трет-бутоксида калия/THF (1M, 1,6 мл, 1,6 ммоль) при 5°C медленно добавляли к перемешиваемому раствору 5-амино-4-(4-(3-метокси-4-(2-(пирролидин-1-ил)этокси)бензоилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 1,6 ммоль) в THF (30 мл). Смесь перемешивали при 5°C в течение 10 минут, затем нагревали до температуры окружающей среды в течение 2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили 4н. HCl (3 мл). Смесь перемешивали с CH2Cl2 (40 мл) и насыщ. NaHCO3 (25 мл). Водный слой экстрагировали CH2Cl2 (40 мл), и объединенный раствор CH2Cl2 промывали водой (2×25 мл) и солевым раствором (25 мл) и высушивали (MgSO4). Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 3-(4-(3-метокси-4-(2-(пирролидин-1-ил)этокси)бензилокси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион (0,4 г, 49%-ый выход): Т. пл. 160-162°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,01 (м, 5H), 2,42-2,59 (м, 2H), 2,95-3,16 (м, 7H), 3,76 (с, 3H), 4,27 (д, J=17,4 Гц, 1H), 4,35-4,42 (м, 3H), 5,07-5,13 (дд, J=5,4 и 13,5 Гц, 1H), 5,16 (с, 2H), 6,98-7,02 (м, 2H), 7,11 (д, J=1,2 Гц, 1H), 7,30-7,35 (м, 2H), 7,48 (т, J=7,8 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,27, 31,17, 45,12, 51,56, 55,57, 55,67, 60,48, 61,38, 64,55, 69,62, 112,24, 113,14, 115,05, 115,15, 120,54, 129,53, 129,77, 129,95, 133,25, 147,34, 149,00, 153,52, 168,00, 170,96, 172,81; Вычислено для C27H31N3O6+BH3: C, 63,91; H, 6,75; N, 8,28, Найдено: С, 63,90; H, 6,76; N, 8,17.
5.159 3-[4-(3,5-ДИХЛОР-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
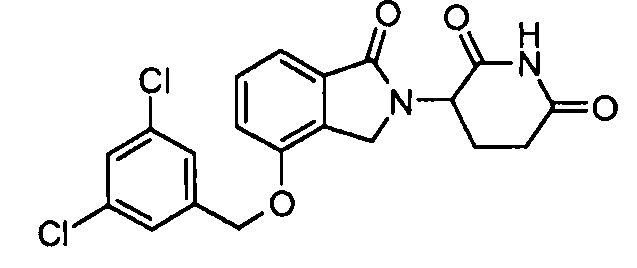
Стадия 1: Сцепленный с полимером трифенилфосфин (1,6 г, 1,92 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (300 мг, 1,03 ммоль) в THF (10 мл). Полученную смесь перемешивали при 0°C в течение 10 минут, с последующим добавлением DIAD (412 мг, 2,06 ммоль). Десять минут спустя к смеси добавляли (3,5-дихлорфенил)-метанол (364,7 мг, 2,06 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа, и реакция была полной. Реакционную смесь фильтровали, и твердое вещество промывали дихлорметаном (5×25 мл). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-[4-(3,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как твердое вещество белого цвета (410 мг, 88%-ый выход): LCMS MH=451, 453.
Стадия 2: KOtBu (102 мг, 0,91 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(3,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (410 мг, 0,91 ммоль) в THF (20 мл). Полученную смесь перемешивали при 0°C в течение 5 минут, и реакция была полной. К реакционной смеси добавляли HCl (0,1н. водный раствор, 14 мл), и смесь экстрагировали дихлорметаном (25 мл×2). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO, получая твердое вещество. Твердое вещество растирали с простым диэтиловым эфиром (15 мл), получая 3-[4-(3,5-дихлор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (230 мг, 60%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 60/40 (ацетонитрил/0,1% H3PO4): tR=3,5 (98%); Т. пл.: 271-273°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,07 (м, 1H, CHH), 2,37-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 4,22-4,56 (м, 2H, CHH, CHH), 5,12 (дд, J=5,1, 13,0 Гц, 1H, NCH), 5,27 (с, 2H, CH2), 7,29 (д, J=7,9 Гц, 1H, Ar), 7,35 (д, J=7,2 Гц, 1H, Ar), 7,46-7,54 (м, 1H, Ar), 7,57 (д, 2H, Ar), 7,58-7,63 (м, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,09, 51,60, 67,92, 114,88, 115,57, 126,15, 127,57, 129,83, 129,99, 133,43, 134,14, 140,97, 153,03, 167,90, 170,95, 172,81; LCMS MH=419, 421; Вычислено для C20H16Cl2N2O4+0,045 CH2Cl2+0,06 MeOH: C, 56,82; H, 3,87; N, 6,59; Cl, 17,43; Найдено: С, 56,58; H,3,86; N, 6,52; Cl, 17,15.
5.160 3-[4-(4-МЕТАНСУЛЬФОНИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
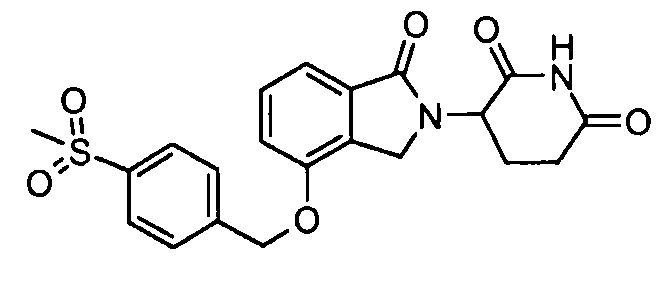
Стадия 1: Сцепленный с полимером трифенилфосфин (1,5 г, 1,92 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (280 мг, 0,96 ммоль) в THF (10 мл). Полученную смесь перемешивали при 0°C в течение 15 минут, с последующим добавлением DIAD (388 мг, 1,92 ммоль). Пять минут спустя к вышеупомянутой смеси добавляли (4-метансульфонил-фенил)-метанол (357 мг, 1,92 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 4 часов и затем при 0°C в течение ночи, и реакция была полной. Реакционную смесь фильтровали, и твердое вещество промывали дихлорметаном (20 мл×5). Фильтрат концентрировали, и остаток очищали хроматографией ISCO, получая метиловый эфир 4-карбамоил-4-[4-(4-метансульфонил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как твердое вещество белого цвета (310 мг, 70%-ый выход): LCMS MH=461.
Стадия 2: KOtBu (75,2 мг, 0,67 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-метансульфонил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (310 мг, 0,67 ммоль) в THF (18 мл). Полученную смесь перемешивали при 0°C в течение 1,5 часов, и к реакционной смеси добавляли KOtBu (35 мг, 0,31 ммоль). Реакцию останавливали через 30 минут. К реакционной смеси добавляли HCl (1н. водный раствор, 10 мл),и смесь экстрагировали дихлорметаном (30 мл×2). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали хроматографией ISCO, получая твердое вещество. Твердое вещество растирали с простым диэтиловым эфиром (30 мл), получая 3-[4-(4-этансульфонил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (195 мг, 68%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 (ацетонитрил/0,1% H3PO4): tR=3,98 (98%); Т. пл.: 248-250°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,81-3,04 (м, 1H, CHH), 3,22 (с, 3H, CH3), 4,20-4,57 (м, 2H, CHH, CHH), 5,13 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,40 (с, 2H, CH2), 7,26-7,39 (м, 2H, Ar), 7,48 (д, 1H, Ar), 7,76 (д, J=8,3 Гц, 2H, Ar), 7,96 (д, J=8,3 Гц, 2H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,37, 31,16, 43,45, 45,04, 51,58, 68,52, 114,94, 115,51, 127,16, 128,05, 129,86, 129,97, 133,40, 140,27, 142,62, 153,13, 167,91, 170,95, 172,81; LCMS MH=429; Вычислено для C21H20N2O6S: C, 58,87; H, 4,71; N, 6,54; Найдено: C, 58,98; H, 4,97; N, 6,21.
5.161 3-[1-ОКСО-4-(4-ПИРРОЛИДИН-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
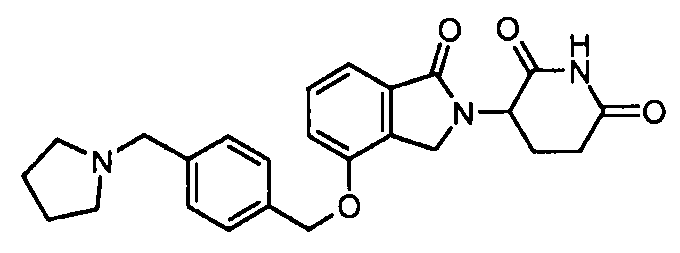
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,83 г, 2,30 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,31 г, 1,04 ммоль) в THF (20 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,46 мл, 2,30 ммоль). После перемешивания в течение 30 минут, добавляли (4-пирролидин-1-илметил-фенил)-метанол (0,40 г, 2,09 ммоль). Смесь перемешивали в течение одного часа, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали препаративной ВЭЖХ, получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-пирролидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как прозрачное масло (0,17 г, 35%-ый выход).
Стадия 2: Трет-бутоксид калия (0,08 г, 0,74 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[1-оксо-4-(4-пирролидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,17 г, 0,37 ммоль) в THF (10 мл). Смесь перемешивали в течение десяти минут и гасили 1н. HCl (3 мл), нейтрализовали насыщенным раствором бикарбоната натрия (6 мл до рН=7) и быстро экстрагировали этилацетатом (2×15 мл). Объединенные фазы этилацетата упаривали до светло-зеленого пенистого масла, которое перемешивали в воде (15 мл) в течение одного часа, фильтровали и высушивали, получая 3-[1-оксо-4-(4-пирролидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,033 г, 20%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 15/85 за 10 мин (ацетонитрил/0,1% H3PO4), 5,51 мин (98,2%); Т. пл.: N/A в связи с ограниченным размером доступного образца; 1H ЯМР (ДМСО-d6) δ 1,64-1,84 (м, 4H, СН2, СН2), 1,97-2,12 (м, 1Н, CHH), 2,53-2,72 (м, 6H, CHH, CHH, CH2, CH2), 2,85-3,09 (м, 1H, CHH), 3,63 (с, 2H, CH2), 4,24-4,56 (м, 2H, CH2), 5,17 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,28 (с, 2H, CH2), 7,30-7,62 (м, 7H, Ar), 11,03 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 23,10, 31,21, 45,10, 51,58, 53,47, 59,29, 69,45, 115,00, 115,21, 127,61, 128,51, 129,81, 129,95, 133,31, 135,00, 139,36, 153,51, 168,01, 170,98, 172,83; LCMS MH=434.
5.162 3-(4-(3-НИТРОБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2- ИЛ)ПИПЕРИДИН-2,6-ДИОН
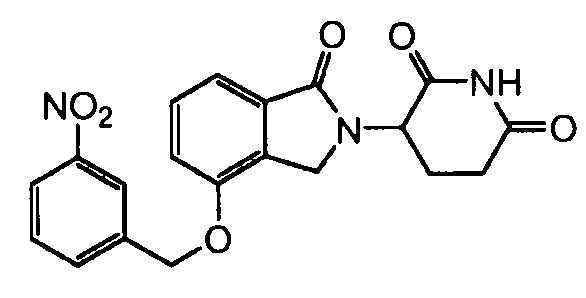
К смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 2,05 ммоль) и N,N-диизопропилэтиламина (358 мкл, 2,05 ммоль) в безводном DMF (10 мл) добавляли 1-(бромметил)-3-нитробензол (421 мг, 1,95 ммоль). Смесь перемешивали при температуре окружающей среды в течение 16 часов, затем нагревали до 80°C в течение 24 часов. Реакционную смесь охлаждали на ванне со льдом и затем помещали в охлажденный 0,5н. раствор HCl (~120 мл). Образованное твердое вещество собирали фильтрацией и высушивали в вакуумном сушильном шкафу, получая 720 мг сырого продукта. Часть сырого продукта очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(4-(3-нитробензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (60 мг, 37%-ый выход, в расчете на очищенную часть): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 ацетонитрил/0,1% H3PO4, 4,20 мин (99,0%); Т. пл.: 237-240°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,67 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 4,30 (д, J=17,6 Гц, 1H, CHH), 4,46 (д, J=17,4 Гц, 1H, CH), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,42 (с, 2H, Ar), 7,23-7,45 (м, 2H, Ar), 7,45-7,59 (м, 1H, Ar), 7,66-7,84 (м, 1H, Ar), 7,98 (д, J=7,7 Гц, 1H, Ar), 8,15-8,29 (м, 1H, Ar), 8,29-8,43 (м, 1H, Ar), 10,98 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,38, 31,20, 45,10, 51,62, 68,33, 115,08, 115,61, 122,18, 122,90, 129,90, 130,00, 130,14, 133,45, 134,14, 139,01, 147,86, 153,15, 167,92, 170,96, 172,83; LCMS MH=396; Вычислено для C20H17N3O6+0,9 H2O: C, 58,36; H, 4,60; N, 10,21, Найдено: С, 58,30; H, 4,21; N, 10,05.
5.163 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)БЕНЗАМИД
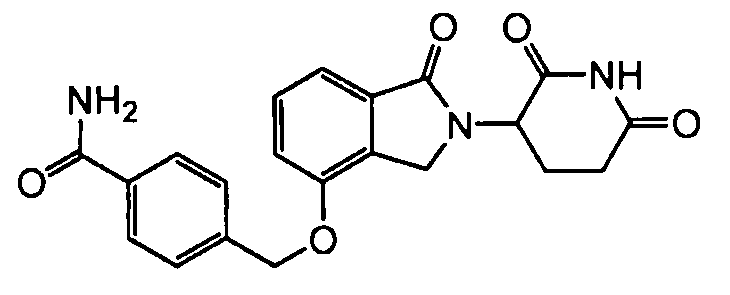
Стадия 1: В круглодонной колбе на 250 мл α-трет-бутиловый эфир L-глутамина (7,83 г, 32,8 ммоль) и N,N-диизопропилэтиламин (11,46 мл, 65,6 ммоль) суспендировали в ацетонитриле (100 мл) при температуре окружающей среды. Суспензию перемешивали в течение приблизительно 10 минут, и затем раствор 2-(бромметил)-3-(трет-бутилдиметилсилилокси)метилбензоата (11,4 г, 29,8 ммоль) в ацетонитриле (20 мл) добавляли по каплям за 10 минут. Реакционную смесь нагревали в масляной бане при температуре медленного кипения растворителя (~80°C) в течение 4 часов. Реакционной смеси давали охладиться до температуры окружающей среды в течение приблизительно 1 часа и затем добавляли раствор фторида цезия (4,53 г, 29,8 ммоль) в воде (15 мл). Полученную смесь энергично перемешивали при температуре окружающей среды в течение 1 часа, после чего LCMS показала, что десилилирование было полным. Реакционную смесь разбавляли ацетонитрилом и фильтровали, чтобы удалить нерастворенные твердые частицы. Твердые частицы промывали дополнительным ацетонитрилом. Фильтрат и смывы (полный объем 200 мл) разбавляли далее EtOAc (300 мл), переносили на 1-л делительную воронку и промывали 0,5н. водным раствором KH2PO4 (100 мл, рН~5). К водному слою частями добавляли 1н. HCl (~20 мл, рН менялся с рН 7-8 до рН~5 с использованием бумажного индикатора рН). К водному слою добавляли NaCl (~10 г) и EtOAc (~200 мл). Смесь энергично встряхивали в делительной воронке. Органические слои объединяли, промывали солевым раствором (50 мл), высушивали (Na2SO4) и концентрировали на роторном испарителе, получая 15 г твердого вещества грязно-белого цвета. Это твердое вещество, содержащее сырой продукт, суспендировали в ацетонитриле (200 мл), и суспензию нагревали в масляной бане с обратным холодильником (~85°C) в течение приблизительно 30 минут при перемешивании. Смеси давали охладиться до температуры окружающей среды за 1 час, затем выдерживали при 4°C в течение еще 2 часов. Образованное твердое вещество собирали аспирационной фильтрацией. Оставшееся твердое вещество в колбе переносили на воронку с фильтром, используя некоторое количество MTBE. Корку промывали дополнительным количеством MTBE (полный объем фильтрата ~300 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 40°C на несколько часов, получая 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат как твердое вещество белого цвета (7,3 выход 72% г, отрегулированный в отношении чистоты исходного материала и продукта): Т. пл.: 198-200°C; 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, tBu), 1,93-2,14 (м, 3H, CH2, CHH), 2,15-2,33 (м, 1H, CHH), 4,35 (с, 2H, CH2), 4,61-4,83 (м, 1H, CH), 6,76 (уш.с, 1H, NH), 6,97-7,07 (м, 1H, Ar), 7,11-7,20 (м, 1H, Ar), 7,26 (уш.с, 1H, NH), 7,29-7,36 (м, 1H, Ar), 10,10 (с, 1H, OH); 13C ЯМР (ДМСО-d6) δ 24,81, 27,56, 31,44, 44,71, 54,02, 81,38, 113,72, 117,96, 127,99, 129,36, 133,36, 152,50, 168,36, 169,88, 172,94; LCMS MH=335; Вычислено для C17H22N2O5+0,19 H2O: C, 60,45; H, 6,68; N, 8,29, Найдено: С, 60,44; H, 6,62; N, 8,27.
Стадия 2: 5-Амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (300 мг, 0,897 ммоль), N,N-диизопропилэтиламин (157 мкл, 0,897 ммоль) и K2CO3 (124 мг, 0,897 ммоль) суспендировали в DMF (5 мл). Через 10 минут добавляли 4-(бромметил)бензамид (192 мг, 0,897 ммоль), и реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней. Удаление DMF в вакууме дало остаток, который разделяли между EtOAc и 0,2н. водным раствором HCl. Водный слой насыщали NaCl и промывали дополнительным количеством EtOAc. Органические слои объединяли (полный объем ~400 мл), промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 400 мг 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата в форме масла. LCMS MH=420. Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 3: К раствору 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (400 мг) в дихлорметане (5 мл) добавляли TFA (1,5 мл), и полученную смесь перемешивали при температуре окружающей среды в течение 3,5 часов (LCMS показала, что удаление защитной группы было полным). Реакционную смесь концентрировали в вакууме, и следовые количества летучих компонентов удаляли небольшой частью дихлорметана (2х) и снова концентрировали, получая 400 мг 4-карбамоил-2-[4-(4-карбамоил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме твердого вещества белого цвета. Этот материал использовали без дальнейшей очистки. 4-Карбамоил-2-[4-(4-карбамоил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляную кислоту (369 мг, 0,897 ммоль, предполагая теоретический выход с предыдущей стадии) растворяли в DMF (10 мл). К раствору добавляли CDI (167 мг, 1,03 ммоль), и смесь перемешивали при температуре окружающей среды в течение 12 часов и затем нагревали до 80°C в течение 6 часов. Реакционную смесь охлаждали на ванне со льдом и медленно добавляли 0,1н. HCl раствор, пока не был получен белый осадок. Твердое вещество отфильтровывали и промывали минимальным количеством воды, затем высушивали в вакуумном сушильном шкафу, получая 150 мг сырого продукта. Сырой продукт растворяли в DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 60% ацетонитрила за 30 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензамид как твердое вещество белого цвета (85 мг, 24% объединенный выход для стадии 2 и стадии 3): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 асетонитрил/0,1% H3PO4, 3,41 мин (98,8%); Т. пл.: 278-280°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,52-2,68 (м, 1H, CHH), 2,83-3,01 (м, 1H, CHH), 4,29 (д, J=17,4 Гц, 1H, CHH), 4,45 (д, J=17,4 Гц, 1H, CHH), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,32 (с, 2H, CH2), 7,19-7,41 (м, 3H, Ar, NH), 7,43-7,52 (м, 1H, Ar), 7,56 (д, J=8,1 Гц, 2H, Ar), 7,89 (д, J=8,3 Гц, 2H, Ar), 7,97 (уш.с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,27, 30,11, 44,00, 50,50, 67,88, 113,91, 114,26, 126,08, 126,53, 128,72, 128,91, 132,26, 132,79, 138,72, 152,21, 166,42, 166,87, 169,88, 171,73; LCMS MH=394; Вычислено для C21H19N3O5+0,8 H2O+0,28 ацетонитрил+1,1 HCOOH: C, 57,57; H, 4,68; N, 9,95, Найдено: C, 57,92; H, 5,07; N, 9,78.
5.164 3-(4-(4-ХЛОР-3-МЕТИЛБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
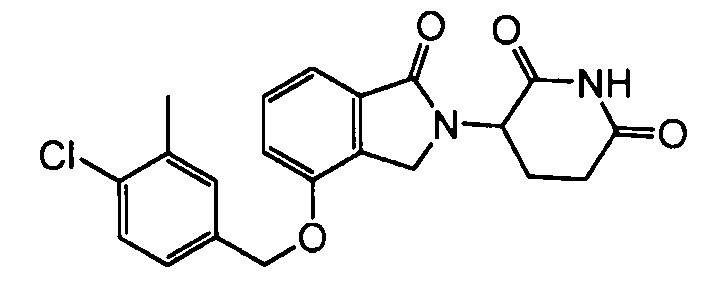
Стадия 1: К раствору 4-хлор-3-метилбензойной кислоты (1 г, 5,86 ммоль) в THF (10 мл) медленно добавляли раствор гидрида бора в THF (1M, 8,79 мл, 8,79 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь гасили, добавляя по каплям воду (1 мл), и затем добавляли 30 мл воды. Смесь насыщали избытком карбоната калия, экстрагировали этилацетатом (2×50 мл), объединенные органические слои высушивали над MgSO4, и растворитель выпаривали под вакуумом, получая (4-хлор-3-метилфенил)метанол (900 мг, 98%-ый выход).
1H ЯМР (ДМСО-d6) δ 2,32 (с, 3Н, CH3), 4,45 (д, J=5,7 Гц, 2H, CH2), 5,22 (т, J=5,7 Гц, 1H, OH), 7,15 (дд, J=1,6, 8,2 Гц, 1H, Ar), 7,28 (с, 1H, Ar), 7,34 (д, J=8,1 Гц, 1H, Ar).
Стадия 2: Трифенилфосфин на полимерной подложке (3 ммоль/г, 0,69 г, 2,06 ммоль) добавляли при 0°C к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксаметилпентаноата (300 мг, 1,03 ммоль) в THF (10 мл), с последующим добавлением диизопропил азодикарбоксилата (416 мг, 2,06 ммоль). После перемешивания в течение 10 минут, добавляли (4-хлор-3-метилфенил)метанол (322 мг, 1,03 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали этилацетатом (7×10 мл). Объединенный фильтрат промывали водой и солевым раствором, растворитель выпаривали, и сырой продукт очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 3% за 40 минут), получая 5-амино-4-(4-(4-хлор-3-метилбензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (430 мг, 97%-ый выход).
1H ЯМР (ДМСО-d6) δ 2,25 (д, 4H, CH2, CH2), 2,35 (с, 3H, CH3), 3,50 (с, 3H, CH3), 4,33-4,63 (м, 2H, CH2), 4,69-4,78 (м, 1H, CH), 5,21 (с, 2H, CH2), 7,19 (с, 1H, NH), 7,24-7,39 (м, 3H, Ar), 7,39-7,51 (м, 3Н, Ar), 7,59 (уш.с, 1H, NH).
Стадия 3: К раствору 5-амино-4-(4-(4-хлор-3-метилбензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата в THF (10 мл) при 0°C добавляли трет-бутоксид калия (112 мг, 1 ммоль), и смесь перемешивали при 0°C в течение 10 минут, нагревали до температуры окружающей среды и перемешивали в течение 3 часов. Реакционную смесь гасили, добавляя водный раствор HCl (1н., 2 мл). Смесь разбавляли водой (30 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали солевым раствором (20 мл), высушивали по MgSO4, растворитель выпаривали под вакуумом, и сырой продукт ресуспендировали в ацетонитриле (5 мл) в течение 2 часов и фильтровали, получая 3-(4-(4-хлор-3-метилбензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (180 мг, 45%-ый выход); Т. пл.: 217-219°C; 1H ЯМР (ДМСО-d6) δ 2,35 (с, 3Н, CH3), 2,48 (уш.с, 1H, CHH), 2,61 (уш.с, 1H, СНН), 2,80-3,03 (м, 1H, СНН), 4,19-4,52 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 7,25-7,39 (м, 3H, Ar), 7,39-7,57 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 19,56, 22,34, 31,16, 45,07, 51,58, 68,77, 114,97, 115,32, 126,87, 128,88, 129,80, 129,95, 130,43, 132,77, 133,33, 135,52, 135,66, 153,32, 167,96, 170,96, 172,81; LCMS MH=399; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 ацетонитрил/0,1% H3PO4 tR=5,29 (99,50%); Вычислено для C21H19ClN2O4; C, 63,24; H, 4,80; N, 7,02; Найдено: С, 62,99; H, 4,94; N, 6,86.
5.165 3-(1-ОКСО-4-(4-(ТРИФТОРМЕТИЛ)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
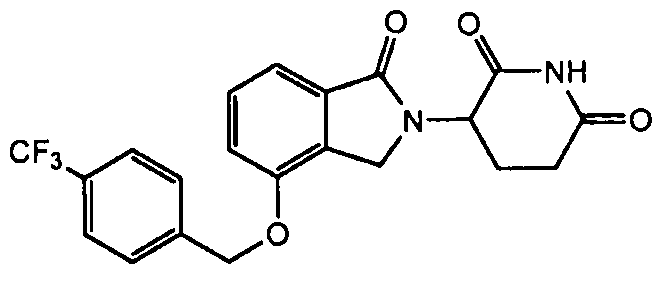
К смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,10 г, 0,34 ммоль) и K2CO3 (0,05 г, 0,34 ммоль) в DMF (10 мл) медленно добавляли 4-(трифторметил)бензил бромид (0,07 г, 0,31 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли дополнительное количество 4-(трифторметил)бензил бромида (0,008 г, 0,03 ммоль), и реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли дополнительное количество K2CO3 (0,05 г, 0,34 ммоль), и реакционную смесь нагревали при 80°C в течение 24 часов. К реакционной смеси добавляли уксусную кислоту (5 капель). Растворитель выпаривали, и к реакционной смеси добавляли этилацетат (100 мл). Затем смесь промывали насыщенным раствором бикарбоната натрия (2×100 мл) и солевым раствором (100 мл) и высушивали (MgSO4). После фильтрации осушителя, растворитель концентрировали, и остаток очищали флэш ISCO (40 г колонка, градиент метанол/метиленхлорид от 0/100 до 5/95 за 20 минут, элюируя продукт при 5/95). Растворитель выпаривали. Остаток перемешивали в простом эфире, и твердое вещество отфильтровывали и высушивали, получая 3-(1-оксо-4-(4-(трифторметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,09 г, 72%-ый выход). Этот эксперимент повторяли с 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксопентаноатом (0,30 г, 1,03 ммоль), получая 3-(1-оксо-4-(4-(трифторметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,12 г) и еще раз с 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксопентаноатом (0,10 г, 0,34 ммоль), получая 3-(1-оксо-4-(4-(трифторметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,05 г). 3 загрузки объединяли. Твердые частицы растворяли в этилацетате (20 мл). Растворитель выпаривали. Остаток перемешивали в простом эфире, и твердое вещество отфильтровывали и высушивали, получая 3-(1-оксо-4-(4-(трифторметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,24 г): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, ацетонитрил/0,1% H3PO4: градиент 10/90-90/10 за 15 мин; 5 мин при 90/10: 12,68 мин (98,97%); Т. пл.: 241-243°C; 1H ЯМР (ДМСО-d6) δ 1,17 (т, J=7,1 Гц, 1H, этилацетат (5%)), 1,82-2,18 (м, 1H, CHH), 2,29-2,47 (м, 1H, CHH), 2,58 (д, J=19,1 Гц, 1H, CHH), 2,79-3,12 (м, 1H, CHH), 4,03 (д, J=7,2 Гц, 1H, этилацетат (5%)), 4,17-4,39 (м, 1H, CHH), 4,38-4,69 (м, 1H, CHH), 5,13 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,38 (с, 2H, CH2), 7,33 (дд, J=7,8, 10,5 Гц, 2H, Ar), 7,41-7,59 (м, 1H, Ar), 7,75 (кв, J=8,3 Гц, 4H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,37, 31,16, 45,03, 51,56, 68,58, 114,94, 115,47, 124,16 (кв, J=270,8 Гц), 125,33 (кв, J=3,8 Гц), 128,01, 128,41 (кв, J=31,5 Гц), 129,84, 129,96, 133,39, 141,52, 153,17, 167,91, 170,96, 172,81; LCMS MH=419; Вычислено для C21H17N2O4F3+0,2 H2O: С, 59,77, H, 4,16, N, 6,64; Найдено: С, 59,66, H, 4,12, N,6,52.
5.166 3-[4-(3-БРОМ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
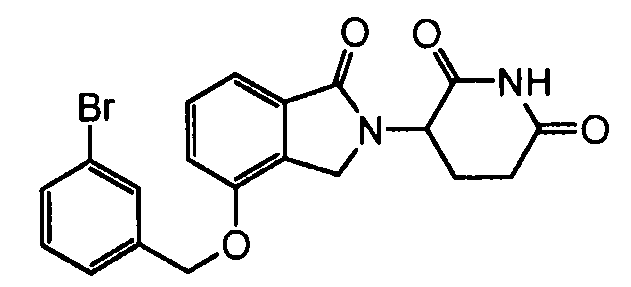
Стадия 1: 5-Амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (300 мг, 0,897 ммоль), N,N-диизопропилэтиламин (157 мкл, 0,897 ммоль) и K2CO3 (124 мг, 0,897 ммоль) суспендировали в DMF (5 мл). Через 10 минут добавляли 1-бром-3-бромметил-бензол (224 мг, 0,897 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней. Удаление DMF в вакууме дало остаток, который разделяли между EtOAc и 0,2н. водным раствором HCl. Слой EtOAc промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 450 мг трет-бутилового эфира 2-[4-(3-бром-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме желто-коричневого масла. LCMS MH=503, 505. Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору трет-бутилового эфира 2-[4-(3-бром-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты (450 мг) в дихлорметане (5 мл) добавляли TFA (1,5 мл), и полученную смесь перемешивали при температуре окружающей среды в течение 4 часов (LCMS показала, что удаление защитной группы было полным). Реакционную смесь концентрировали в вакууме, и полученное твердое вещество растирали с Et2O и затем собирали фильтрацией. Высушивание твердого вещества в вакууме дало 400 мг 2-[4-(3-бром-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме твердого вещества желто-коричневого цвета. Этот материал использовали без дальнейшей очистки.
Стадия 3: К раствору 2-[4-(3-бром-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты (400 мг, 0,897 ммоль, предполагая теоретический выход с предыдущей стадии) в DMF (5 мл) добавляли CDI (145 мг, 0,897 ммоль). Реакционную смесь нагревали до 70°C и перемешивали в течение ночи. Через 21 час добавляли каталитическое количество DMAP, затем другой эквивалент CDI. Смесь перемешивали при 80°C в течение дополнительных 15 часов. Реакционную смесь охлаждали на ванне со льдом, и сырой продукт осаждали добавлением 0,2н. водного раствора HCl. Твердое вещество собирали фильтрацией, промывали обильно водой и высушивали в вакууме, получая 150 мг сырого продукта. Этот сырой продукт растворяли в DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-[4-(3-бром-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (80 мг, 21% объединенный выход для стадии 1 и стадии 2): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 ацетонитрил/0,1% H3PO4, 4,59 мин (95,5%); Т. пл.: 238-240°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 4,28 (д, J=17,4 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,26 (с, 2H, CH2), 7,25-7,42 (м, 3H, Ar), 7,45-7,59 (м, 3H, Ar), 7,70 (д, J=1,7 Гц, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,26, 31,09, 45,00, 51,51, 68,48, 114,87, 115,34, 121,61, 126,52, 129,75, 129,88, 130,15, 130,61, 130,74, 133,30, 139,36, 153,15, 167,86, 170,88, 172,74; LCMS MH=429, 431; Вычислено для C20H17N2O4+0,8 H2O: C, 54,14; H, 4,23; N, 6,31; Br, 18,01, Найдено: С, 53,92; H, 3,88; N, 6,32; Br, 18,16.
5.167 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)-N,N-ДИМЕТИЛБЕНЗОЛ СУЛЬФОНАМИД
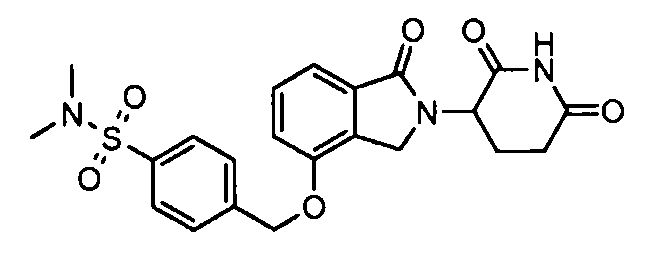
Стадия 1: К раствору 4-(N,N-диметилсульфамоил)бензойной кислоты (1 г, 4,36 ммоль) в THF (10 мл) медленно добавляли раствор гидрида бора в THF (1M, 8,72 мл, 8,72 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь гасили, добавляя по каплям воду (1 мл), и затем добавляли 30 мл воды. Смесь насыщали избытком карбоната калия и экстрагировали этилацетатом (3×40 мл), и объединенные органические слои высушивали над MgSO4. Растворитель выпаривали под вакуумом, получая 4-(гидроксиметил)-N,N-диметилбензолсульфонамид (700 мг, 75%-ый выход).
1H ЯМР (ДМСО-d6) δ 2,59 (с, 6H, CH3, СН3), 4,61 (д, J=5,9 Гц, 2H, CH2), 5,44 (с, 1Н, ОН), 7,54-7,62 (м, 2H, Ar), 7,67-7,75 (м, 2H, Ar).
Стадия 2: Трифенилфосфин на полимерной подложке (3 ммоль/г, 0,69 г, 2,06 ммоль) добавляли при 0°C к перемешиваемой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (300 мг, 1,03 ммоль) в THF (10 мл), с последующим добавлением диизопропил азодикарбоксилата (416 мг, 2,06 ммоль). После перемешивания в течение 10 минут, добавляли 4-(гидроксиметил)-N,N-диметилбензолсульфонамид (443 мг, 2,06 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали этилацетатом (7×10 мл). Объединенный фильтрат промывали водой и солевым раствором, растворитель выпаривали, и сырой продукт очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 4% за 40 минут), получая 5-амино-4-(4-(4-(N,N-диметилсульфамоил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (340 мг, 68%-ый выход).
1H ЯМР (ДМСО-d6) δ 1,93-2,36 (м, 4H, CH2, CH2), 2,62 (с, 6H, CH3, CH3), 3,50 (с, 3H, CH3), 4,40-4,66 (м, 2H, CH2), 4,75 (дд, J=4,7, 10,2 Гц, 1H, СНН), 5,39 (с, 2H, CH2), 7,21 (с, 1H, NHH), 7,27-7,36 (м, 2H, Ar), 7,43-7,53 (м, 1H, Ar), 7,60 (с, 1H, NHH), 1,13-7,85 (м, 4H, Ar).
Стадия 3: К раствору 5-амино-4-(4-(4-(N,N-диметилсульфамоил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (573 мг, 1,17 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (131 мг, 1 ммоль). Смесь перемешивали при 0°C в течение 10 минут, нагревали до температуры окружающей среды и перемешивали в течение 4 часов. Добавляли дополнительное количество трет-бутоксид калия (40 мг, 0,4 ммоль) и смесь сохраняли, перемешивая в течение 2 часов. Реакционную смесь гасили, добавляя водный раствор HCl (1н., 2 мл), и добавляли по каплям воду (50 мл). Образовавшийся осадок корректировали фильтрацией, и сырой продукт ресуспендировали с ацетонитрилом (10 мл), получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)-N,N-диметилбензолсульфонамид как твердое вещество белого цвета (260 мг, 48%-ый выход); Т. пл.: 261-263°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,10 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,56 (д, J=3,4 Гц, 1H, CHH), 2,62 (с, 6H, CH3, CH3), 2,82-3,03 (м, 1H, CHH), 4,25-4,56 (м, 2H, CH2), 5,13 (дд, J=4,9, 13,2 Гц, 1H, CHH), 5,39 (с, 2H, CH2), 7,28-7,41 (м, 2H, Ar), 7,45-7,57 (м, 1H, Ar), 7,73-7,83 (м, 4H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,37, 31,15, 37,51, 45,04, 51,56, 68,56, 114,99, 115,54, 127,71, 127,95, 129,87, 129,96, 133,37, 134,20, 142,02, 153,19, 167,94, 170,96, 172,84; LCMS MH=458; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 ацетонитрил/0,1% H3PO4 tR=3,61 (98,56%); Вычислено для C22H23N3O6S+0,5 H2O: C, 56,64; H, 5,19; N, 9,01; Найдено: С, 56,62; H, 5,18; N, 8,89.
5.168 3-[4-(3-АМИНО-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
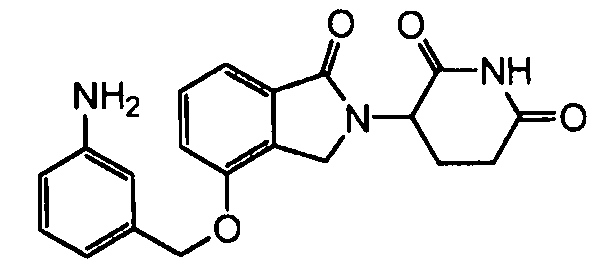
К суспензии 3-(4-(3-нитробензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,759 ммоль) в этаноле (10 мл) добавляли раствор дитионита натрия (661 мг, 3,79 ммоль) в воде (5 мл). Смесь перемешивали в течение 20 минут при температуре окружающей среды, затем концентрировали в вакууме. Остаток растворяли в DMF, раствор пропускали через фильтр шприца, и фильтрат вводили на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 60% ацетонитрила за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-[4-(3-амино-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион (10 мг, 3%-ый выход) как твердое вещество белого цвета: ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 ацетонитрил/0,1% H3PO4, 4,17 мин (95,6%); Т. пл.: 109-113°C; 1H ЯМР (ДМСО-d6) δ 1,87-2,07 (м, 1H, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,4 Гц, 1H, CHH), 5,00-5,20 (м, 5H, CH2, NH2, CH), 6,46-6,55 (м, 1H, Ar), 6,59 (д, J=7,6 Гц, 1H, Ar), 6,62-6,70 (м, 1H, Ar), 7,01 (т, J=7,7 Гц, 1H, Ar), 7,30 (дд, J=7,6, 9,8 Гц, 2H, Ar), 7,41-7,53 (м, 1H, Ar), 10,94 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,38, 31,21, 45,10, 51,58, 69,95, 112,74, 113,49, 114,84, 114,98, 115,08, 128,93, 129,78, 129,87, 133,26, 137,14, 148,80, 153,60, 168,02, 170,99, 172,83; LCMS MH=366; Вычислено для C20H19N3O4: C, 65,74; H, 5,24; N, 11,50, Найдено: C, 58,81; H, 5,20; N, 9,99.
5.169 3-[4-(3,4-ДИФТОР-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
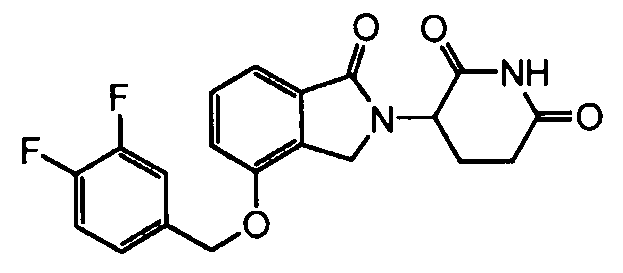
Стадия 1: Раствор метилового эфира 3-ацетокси-2-бромметил-бензойной кислоты (1,0 г, 3,48 ммоль) в ацетонитриле (10 мл) добавляли к перемешиваемой суспензии 4,5-диамино-5-оксо-трет-бутилпентаноат гидрохлорида и N,N-диизопропилэтиламина (1,4 мл, 7,66 ммоль) в ацетонитриле (20 мл). Смесь перемешивали при температуре окружающей среды в течение 3,5 часов при температуре окружающей среды. Добавляли уксусную кислоту (0,5 мл), и температуру повышали до 60°C. Через 3 дня к реакционной смеси добавляли воду (2 мл), температуру повышали до 80°C, и смесь перемешивали в течение еще 3 дней. Реакционную смесь охлаждали до температуры окружающей среды. Добавляли пиперидин (1 мл), и перемешивание продолжали в течение дополнительных 6 часов при температуре окружающей среды. Смесь концентрировали в вакууме, чтобы удалить большую часть летучих компонентов. Полученное вязкое масло разделяли между EtOAc (200 мл) и 0,2н. HCl (50 мл). Водный слой экстрагировали дополнительным EtOAc (150 мл). Слои EtOAc объединяли, высушивали (Na2SO4) и концентрировали на роторном испарителе, получая 1,16 г сырого продукта в форме грязно-белой пены. Очистка этой пены на колонке для флэш-хроматографии SiO2 (CombiFlash, 40 г предварительно заполненная колонка SiO2, градиент EtOAc/Гексаны) давала трет-бутиловый эфир 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты в форме белой пены (740 мг, 63%-ый выход). LCMS MH=335. 1H ЯМР (ДМСО-d6) δ 1,24-1,37 (м, 9H, tBu), 1,81-2,06 (м, 3H, CHH, СН2), 2,08-2,27 (м, 1Н, CHH), 4,32 (д, J=17,4 Гц, 1H, CHH), 4,49 (д, J=17,4 Гц, 1H, CHH), 4,71 (дд, J=4,1, 10,1 Гц, 1H, CH), 6,88-7,04 (м, 1H, Ar), 7,08-7,23 (м, 2H, Ar, NH), 7,26-7,40 (м, 1H, Ar), 7,55 (уш.с, 1H, NH), 10,02 (с, 1H, OH).
Стадия 2: Суспензию трет-бутилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (250 мг, 0,748 ммоль), N,N-диизопропилэтиламина (130 мкл, 0,748 ммоль) и Cs2CO3 (244 мг, 0,748 ммоль) в DMF (5 мл) перемешивали в течение 10 минут при температуре окружающей среды, с последующим добавлением 4-хлорметил-1,2-дифторбензола (122 мг, 0,748 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 часов, затем концентрировали в вакууме, получая сырой продукт трет-бутиловый эфир 4-карбамоил-4-[4-(3,4-дифтор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как твердое вещество желто-коричневого цвета (344 мг). Это твердое вещество забирали в сухом THF (5 мл), и твердый KOtBu (84 мг, 0,747 ммоль) добавляли в одной части при перемешивании. Смесь перемешивали при температуре окружающей среды в течение 40 минут, затем реакционную смесь гасили добавлением 1н. водного раствора HCl (15 мл). Полученную суспензию разбавляли далее водой, и твердое вещество собирали фильтрацией, промывали дополнительным количеством воды, и высушивали отсасыванием на воронке с фильтром. Твердое вещество растворяли в минимальном количестве DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-[4-(3,4-дифтор-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион (140 мг, 48%-ый выход) как твердое вещество белого цвета: ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 ацетонитрил/0,1% H3PO4, 5,53 мин (97,9%); Т. пл.: 228-230°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,32-2,48 (м, 1H, CHH), 2,52-2,67 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,23-7,41 (м, 3H, Ar), 7,41-7,54 (м, 2H, Ar), 7,59 (ддд, J=1,9, 8,0, 11,4 Гц, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,16, 45,04, 51,56, 68,17, 114,93, 115,44, 116,76 (д, JC-F=17,6 Гц,), 117,52 (д, JC-F=17,6 Гц,), 124,52 (дд, JC-F=3,3, 6,6 Гц,), 129,81, 130,00, 133,36, 134,42 (дд, JC-F=3,3, 5,5 Гц,), 149,12 (дд, JC-F=23,2, 245,3 Hz), 149,44 (дд, JC-F=23,2, 245,8 Гц,), 153,14, 167,93, 170,95, 172,81; LCMS MH=387; Вычислено для C20H16F2N2O4+0,7 H2O: C, 60,21; H, 4,39; N, 7,00; F, 9,52, Найдено: С, 60,13; H, 4,09; N, 6,91; F, 9,45.
5.170 3-(4-(4-ЭТИЛБЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
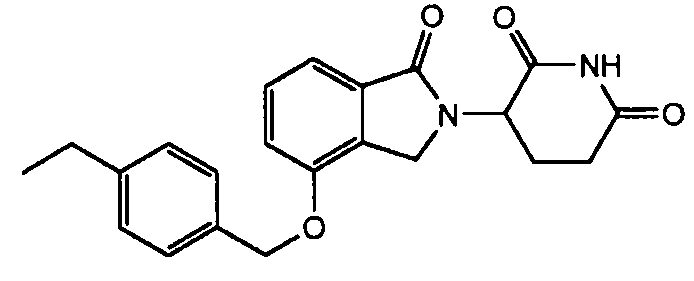
К смеси трифенилфосфина на полимерной подложке (0,75 г, 2,26 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,30 г, 1,03 ммоль) в THF (20 мл), охлажденной до 0°C, добавляли по каплям DIAD (0,45 мл, 2,26 ммоль). Затем добавляли 4-этилбензиловый спирт (0,16 мл, 1,23 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа и затем при температуре окружающей среды в течение ночи. Реакционную смесь затем фильтровали через целит. Целит промывали этилацетатом (100 мл). Фазу этилацетата промывали водой, высушивали с использованием MgSO4, и растворитель выпаривали. Остаток очищали флэш-ISCO (40 г колонка, градиент EtOAc/Гексаны от 50/50 до 100/0 за 20 минут, элюируя продукт при 100/0). Растворитель выпаривали, и 5-амино-4-(4-(4-этилбензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат получали в форме липкого прозрачного твердого вещества (0,20 г, 48%-ый выход). К этому твердому веществу, перемешиваемому в THF (10 мл) и охлажденному до 0°C, добавляли KOtBu (0,05 г, 0,46 ммоль), и реакционную смесь перемешивали в течение 3 часов. К реакционной смеси добавляли уксусную кислоту (1 мл). Добавляли этилацетат (100 мл) и смесь промывали насыщенным раствором бикарбоната натрия (2×100 мл) и солевым раствором (100 мл) и высушивали (MgSO4). После фильтрации осушителя, растворитель концентрировали, получая 3-(4-(4-этилбензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,12 г, 69%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент: ацетонитрил/0,1% H3PO4, 10/90-90/10 за 15 мин, 90/10 на 5 мин, 12,96 мин (98,16%); Т. пл.: 158-160°C; 1H ЯМР (ДМСО-d6) δ 1,17 (т, J=7,6 Гц, 3H, CH3), 1,82-2,13 (м, 1H, CHH), 2,31-2,47 (м, 1H, CHH), 2,53-2,72 (м, 3H, CHH, CH2), 2,78-3,10 (м, 1H, CHH), 4,24 (д, J=17,4 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CH), 5,20 (с, 2H, CH2), 6,83-7,95 (м, 7H, Ar), 10,97 (с, 4H, NH); 13C ЯМР (ДМСО-d6) δ 15,58, 22,33, 27,85, 31,18, 45,06, 51,55, 69,44, 114,96, 115,15, 127,82, 127,86, 129,77, 129,93, 133,27, 133,82, 143,59, 153,48, 167,99, 170,96, 172,81; LCMS MH=379; Вычислено для C22H22N2O4+0,7 H2O: C, 67,57; H, 6,03; N, 7,16; Найдено: С, 67,40; H, 5,87; N, 7,12.
5.171 3-[4-(4-ГИДРОКСИМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
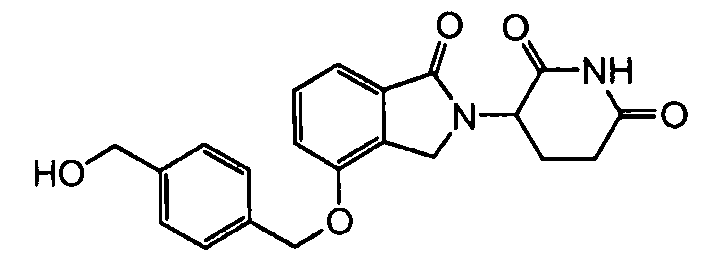
Стадия 1: Суспензию трет-бутилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (1,5 г, 4,49 ммоль), N,N-диизопропилэтиламина (784 мкл, 4,49 ммоль) и K2CO3 (620 мг, 4,49 ммоль) в DMF (15 мл) перемешивали в течение 5 минут при температуре окружающей среды, с последующим добавлением (4-хлорметил-фенил)-метанола (902 мг, 4,49 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 часов, затем нагревали до 70°C в течение 3 часов. К смеси добавляли пиперидин (800 мкл), чтобы удалить непотребленный (4-хлорметил-фенил)-метанол. Смесь перемешивали в течение дополнительных 18 часов при 70°C. Смесь разбавляли водой (50 мл) и EtOAc (200 мл). Величину рН водного раствора доводили до рН 4 с использованием 1н. HCl, и фазы разделяли в делительной воронке. Водный слой насыщали NaCl и экстрагировали дополнительным EtOAc (200 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали на роторном испарителе, получая 3,5 г желто-коричневого масла. Часть этого масла (2,1 г) очищали на колонке для флэш-хроматографии SiO2 (CombiFlash, 80 г предварительно заполненная колонка SiO2, градиент MeOH/дихлорметан), получая трет-бутиловый эфир 4-карбамоил-2-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме белой пены (1,1 г, 90%-ый выход, в расчете на очищенную часть): 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, tBu), 2,00-2,13 (м, 3H, CHH, СН2), 2,13-2,31 (м, 1Н, CHH), 4,41 (с, 2H, CH2), 4,50 (д, J=5,7 Гц, 2H, CH2), 4,69 (дд, J=4,6, 10,3 Гц, 1H, CH), 5,19 (т, J=5,7 Гц, 1H, OH), 5,24 (с, 2H, CH2), 6,75 (уш.с, 1H, NH), 7,22 (уш.с, 1H, NH), 7,25-7,37 (м, 4H, Ar), 7,42-7,53 (м, 3H, Ar); 13C ЯМР (ДМСО-d6) δ 24,69, 27,56, 31,50, 44,78, 54,08, 62,60, 69,45, 81,42, 114,97, 115,18, 126,52, 127,57, 129,71, 130,03, 133,27, 134,86, 142,40, 153,42, 168,12, 169,85, 172,94; LCMS MH=455.
Стадия 2: KOtBu (1,1 мл, 1,1 ммоль, 1 М в THF) добавляли через шприц к перемешиваемой смеси трет-бутилового эфира 4-карбамоил-2-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (500 мг, 1,1 ммоль) в TNF (20 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа и затем добавляли еще 100 мкл KOtBu. Через 6 часов реакционную смесь гасили, перенося в 1н. водный раствор HCl (10 мл). Смесь разбавляли EtOAc (150 мл) и 1н. NaHCO3 (35 мл). Водный слой промывали дополнительным EtOAc (100 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали на роторном испарителе, получая сырой продукт в форме твердого вещества (300 мг). Часть этого твердого вещества (~127 мг) растворяли в минимальном количестве DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 60% ацетонитрила за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли, концентрировали в вакууме, и остаточную воду лиофилизировали, получая 3-[4-(4-гидроксиметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (115 мг, 55%-ый выход, в расчете на очищенную часть): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 ацетонитрил/0,1% H3PO4, 3,30 мин (97,2%); Т. пл.: 220-222°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,81-2,99 (м, 1H, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,41 (д, J=17,6 Гц, 1H, CHH), 4,50 (д, J=5,5 Гц, 2H, CH2), 5,10 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,18 (т, J=5,8 Гц, 1H, OH), 5,23 (с, 2H, CH2), 7,25-7,38 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,18, 45,07, 51,56, 62,60, 69,42, 115,01, 115,18, 126,49, 127,52, 129,76, 129,96, 133,28, 134,87, 142,38, 153,43, 167,99, 170,96, 172,81. LCMS MH=381; Вычислено для C21H20N2O5+0,3 H2O: C, 65,38; H, 5,38; N, 7,26, Найдено: С, 65,44; H, 5,43; N, 7,29.
5.172 3-[4-(4-ДИЭТИЛАМИНОМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН СОЛЬ МУРАВЬИНОЙ КИСЛОТЫ
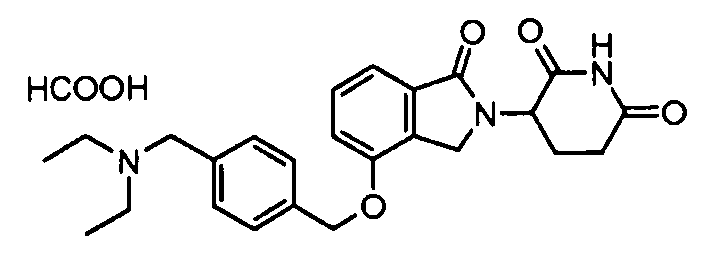
К перемешиваемому раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,50 г, 1,72 ммоль) в DMF (10 мл) добавляли карбонат калия (0,24 г, 1,72 ммоль) и (4-бромметил-бензил)-диэтиламин (0,88 г, 2,42 ммоль) в DMF (3 мл). Смесь перемешивали при температуре окружающей среды в течение ночи и нагревали при 70°C в течение трех часов. Смесь очищали препаративной ВЭЖХ, получая 3-[4-(4-диэтиламинометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как соль муравьиной кислоты в форме твердого вещества грязно-белого цвета (0,15 г, 20%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 15/85 in 10 мин (ацетонитрил/0,1% H3PO4), 7,31 мин (95,5%); Т. пл.: 210-212ºC; 1H ЯМР (ДМСО-d6) δ 0,98 (т, J=7,1 Гц, 6H, 2CH3), 1,92-2,04 (м, 1H, CHH), 2,41-2,49 (м, 5H, 2CH2, CH), 2,53-2,63 (м, 1H, CHH), 2,83-2,98 (м, 1H, CHH), 3,56 (с, 2H, CH2), 4,21-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,29-7,39 (м, 4H, Ar), 7,40-7,53 (м, 3H, Ar), 10,97 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 11,95, 22,83, 31,68, 45,59, 46,52, 52,06, 56,93, 69,93, 115,46, 115,70, 128,07, 129,14, 130,29, 130,42, 133,77, 135,48, 139,85, 153,98, 168,49, 171,45, 173,31; LCMS MH=436; Вычислено для C25H29N3O4·2,5HCOOH: С, 59,99; H, 6,22; N, 7,63; Найдено: С, 51,24; H, 5,88; N, 6,38.
5.173 3-[4-(4-ЭТИЛАМИНОМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
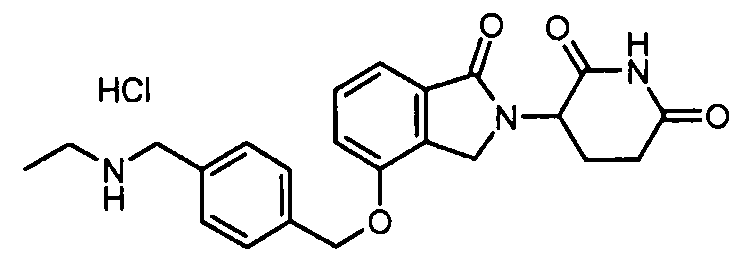
Этиламин (4,24 мл, 8,48 ммоль, 2,0 М в THF) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,73 г, 1,70 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды в течение ночи. Смесь концентрировали и обменивали в DMF (10 мл). К раствору добавляли карбонат калия (0,23 г, 1,70 ммоль), и смесь нагревали при 80°C в течение трех часов. Растворитель выпаривали и затем перемешивали в 2М HCl в простом эфире (5 мл) в течение одного часа, фильтровали и перемешивали в метиленхлориде (8 мл) в течение двух часов, снова фильтровали и высушивали в вакуумном сушильном шкафу, получая 3-[4-(4-этиламинометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (0,126 г, 29%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,89 мин (93,2%); Т. пл.: 273-275ºC; 1H ЯМР (ДМСО-d6) δ 1,93-2,05 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,83-3,01 (м, 3H, CH2, CHH), 4,11 (т, J=5,9 Гц, 2H, CH2), 4,22-4,51 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,29 (с, 2H, CH2), 7,27-7,38 (м, 2H, Ar), 7,43-7,63 (м, 5H, Ar), 9,20 (уш.с, 2H, NH2Cl), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 10,83, 22,38, 31,21, 41,63, 45,12, 49,11, 51,62, 69,01, 115,03, 115,33, 127,80, 129,81, 130,00, 130,10, 131,83, 133,35, 137,37, 153,30, 167,98, 170,98, 172,85; LCMS MH=408; Вычислено для C23H25N3O4·HCl+0,5 H2O: С, 60,99; H, 6,01; N, 9,28; Cl, 7,83, Найдено: С, 60,65; H, 6,01; N, 9,12; Cl, 7,66.
5.174 3-(4-(4-((ХЛОРАМИНО)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
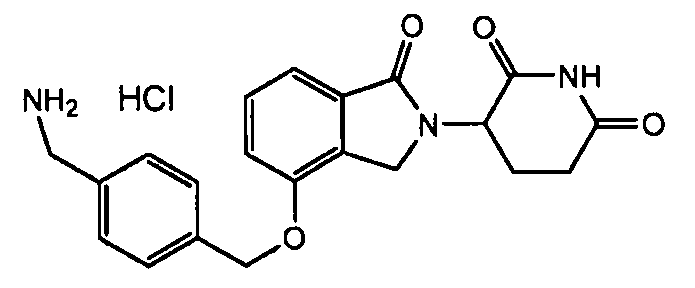
Стадия 1: К смеси трифенилфосфина на полимерной подложке (0,93 г, 3,54 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,47 г, 1,61 ммоль) в THF (20 мл), охлажденной до 0°C, добавляли по каплям DIAD (0,70 мл, 3,54 ммоль). Затем добавляли трет-бутиловый эфир 4-гидроксиметил-бензил)-карбаминовый кислоты (0,46 г, 1,93 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа и затем при температуре окружающей среды в течение ночи. Реакционную смесь затем фильтровали через целит. Целит промывали этилацетатом (100 мл). Растворитель выпаривали. Остаток очищали флэш-ISCO (40 г колонка, градиент EtOAc/Гексаны от 50/50 до 100/0 за 30 минут, элюируя продукт при 80/20). Растворитель выпаривали, и 5-амино-4-(4-(4-((трет-бутоксикарбониламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат получали как липкое прозрачное твердое вещество (0,34 г, 41%-ый выход). К этому твердому веществу, перемешиваемому в THF (15 мл) и охлажденному до 0°C, добавляли KOtBu (0,07 г, 0,65 ммоль), и реакционную смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли уксусную кислоту (1 мл). Добавляли этилацетат (100 мл) и смесь промывали насыщенным раствором бикарбоната натрия (2×100 мл) и солевым раствором (100 мл) и высушивали (MgSO4). После фильтрации осушителя растворитель концентрировали, получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил-трет-бутилкарбамат как светло-розовое твердое вещество (0,25 г, 81%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент: ацетонитрил/0,1% H3PO4, 10/90-90/10 за 15 мин, 90/10 на 5 мин, 12,06 мин (98,12%).
Стадия 2: К раствору 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил-трет-бутилкарбамата (0,10 г, 0,2 ммоль) в THF (40 мл) в течение 15 минут барботировали газообразную HCl. Растворитель затем упаривали. К остатку добавляли воду (10 мл) и смесь фильтровали. Фильтрат концентрировали, и остаток перемешивали в простом эфире в течение ночи. Твердое вещество затем отфильтровывали и высушивали в сушильном шкафу при 40°C, получая 3-(4-(4-((хлорамино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (0,08 г, 94%-ый выход); Т. пл.: 198-200°C; 1H ЯМР (ДМСО-d6) δ 1,86-2,12 (м, 1H, CHH), 2,34-2,49 (м, 1H, CHH), 2,53-2,69 (м, 1H, CHH), 2,81-3,05 (м, 1H, CHH), 4,02 (кв, J=5,6 Гц, 2H, CH2), 4,27 (д, J=17,6 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,28 (с, 2H, CH2), 7,21-7,40 (м, 2H, Ar), 7,40-7,73 (м, 4H, Ar), 8,45 (уш.с, 3H, NH3Cl), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 41,85, 45,09, 51,59, 69,01, 115,00, 115,28, 127,77, 129,06, 129,77, 129,97, 133,33, 133,75, 136,87, 153,26, 167,96, 170,96, 172,83; LCMS MH=380; Вычислено для C21H22N3O4Cl+1,5 H2O: C, 56,95; H, 5,69; N, 9,49; Найдено: С, 56,81; H, 5,61; N,9,37.
5.175 3-(4-(4-((2-МЕТОКСИЭТИЛАМИНО)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ФОРМИАТ
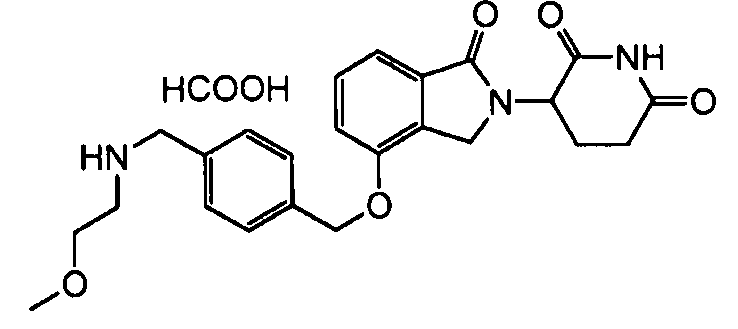
Стадия 1: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (250 мг, 0,529 ммоль) в ацетонитриле (10 мл) добавляли 2-метоксиэтанамин (0,068 мл, 0,793 ммоль) и DIEA (0,138 мл, 0,793 ммоль). Полученную смесь перемешивали при 50°C в течение 1,5 часов, затем добавляли дополнительное количество 2-метоксиэтанамина (150 мкл). Температуру повышали до 60°C, и смесь перемешивали в течение еще 2,5 часов. Реакционную смесь концентрировали в вакууме, используя роторный испаритель, получая 5-амино-2-(4-(4-((2-метоксиэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат в форме белой пены (295 мг, предполагаемый теоретический выход). LCMS MH=512. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: 5-Амино-2-(4-(4-((2-метоксиэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (0,528 ммоль, предполагаемый теоретический выход с предыдущей стадии) забирали в сухом THF (5 мл). К перемешиваемой суспензии при температуре окружающей среды по каплям добавляли KOtBu (0,581 мл, 0,581 ммоль, 1,0 М в THF). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов, и затем добавляли дополнительное количество KOtBu (176 мкл). Смесь перемешивали в течение ночи при температуре окружающей среды, затем обрабатывали дополнительным количеством KOtBu (176 мкл). Через 6 часов добавляли заключительную часть KOtBu, и смесь перемешивали в течение 2 часов. Реакционную смесь гасили, перенося в 2 М раствор муравьиной кислоты в MeCN на ванне со льдом. Смесь концентрировали в вакууме, используя роторный испаритель, получая масло, которое растворяли в минимальном DMF и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 30% MeCN за 12 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, и остаточную воду лиофилизировали, получая 3-(4-(4-((2-метоксиэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион формиат как твердое вещество белого цвета (80 мг, 35%-ый выход): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 10 мин, ацетонитрил/0,1% H3PO4, 5,64 мин (95,6%); Т. пл.: 200-202°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,62 (м, 1H, CHH), 2,65 (т, J=5,6 Гц, 2H, CH2), 2,82-3,01 (м, 1H, CHH), 3,23 (с, 3H, OCH3), 3,40 (т, J=5,7 Гц, 2H, CH2O), 3,73 (с, 2H, CH2N), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,01-5,16 (м, 1H, CH), 5,22 (с, 2H, CH2O), 7,23-7,39 (м, 4H, Ar), 7,40-7,55 (м, 3H, Ar), 8,07-8,55 (м, 1H, НСООН), 10,39-11,40 (м, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,31, 31,18, 45,07, 47,62, 51,56, 52,33, 57,95, 69,41, 71,33, 114,97, 115,18, 127,61, 128,09, 129,77, 129,95, 133,28, 134,92, 140,17, 153,45, 167,99, 170,95, 172,81; LCMS MH=438; Вычислено для C24H27N3O5·HCOOH+2,8 H2O: C, 56,24; H, 6,53; N, 7,87, Найдено: С, 56,13; H, 6,18; N, 7,75.
5.176 3-(4-{4-[(МЕТИЛФЕНИЛАМИНО)-МЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
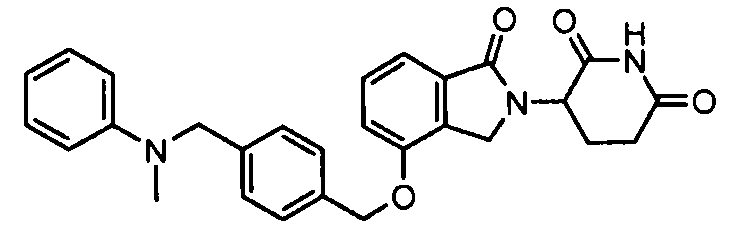
N-Метиланилин (0,55 мл, 5,00 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,72 г, 1,67 ммоль) в DMF (15 мл). Смесь перемешивали при 50°C в течение двух дней. К смеси добавляли карбонат калия (0,23 г, 1,67 ммоль), и смесь нагревали при 70°C в течение ночи. Реакционную смесь концентрировали в вакууме, и остаток очищали на колонке с силикагелем (градиент CH2Cl2/EtOAc от 5% EtOAc в CH2Cl2 до 50%), получая 3-(4-{4-[(метилфениламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,29 г, 37%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4): 6,20 мин (98,4%); Т. пл.: 201-203°C, 1H ЯМР (ДМСО-d6) δ 1,91-1,98 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,53-2,62 (м, 1H, CHH), 2,82-2,97 (м, 1H, CHH), 3,01 (с, 3H, CH3), 4,19-4,45 (м, 2H, CH2), 4,57 (с, 2H, CH2), 5,10 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 6,60 (т, J=7,3 Гц, 1H, Ar), 6,70 (дд, J=0,9, 8,9 Гц, 2H, Ar), 7,09-7,18 (м, 2H, Ar), 7,22 (д, J=8,1 Гц, 2H, Ar), 7,29-7,36 (м, 2H, Ar), 7,39-7,53 (м, 3H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,20, 38,60, 45,09, 51,56, 55,05, 69,36, 111,99, 114,92, 115,21, 115,84, 126,85, 127,97, 128,95, 129,81, 129,95, 133,29, 134,95, 139,02, 148,97, 153,48, 168,01, 170,96, 172,83; LCMS MH=470; Вычислено для C28H27N3O4+0,3 H2O: С, 70,81; H, 5,86; N, 8,85; Найдено: С, 70,51; H, 5,66; N, 8,71.
5.177 3-(4-(4-((БИС(2-МЕТОКСИЭТИЛ)АМИНО)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
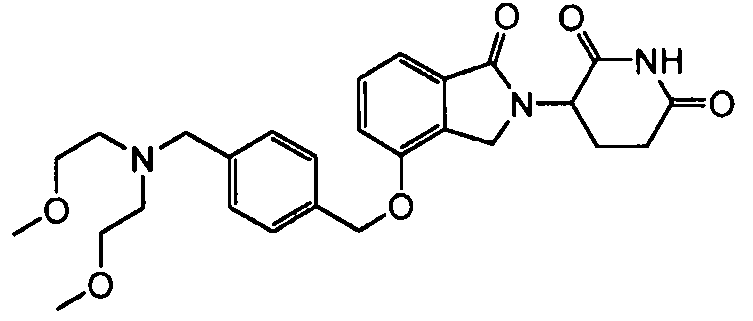
Стадия 1: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (250 мг, 0,529 ммоль) в ацетонитриле (10 мл) добавляли бис(2-метоксиэтил)амин (106 мг, 0,793 ммоль) и N,N-диизопропилэтиламин (0,138 мл, 0,793 ммоль). Полученную смесь перемешивали при 60°C в течение 2 дней. Смесь концентрировали в вакууме, используя роторный испаритель и далее высушивали в вакуумном сушильном шкафу в течение ночи, получая 5-амино-2-(4-(4-((бис(2-метоксиэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат в форме масла янтарного цвета (320 мг). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: 5-Амино-2-(4-(4-((бис(2-метоксиэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (0,528 ммоль, предполагаемый теоретический выход с предыдущей стадии) забирали в сухом THF (5 мл). К перемешиваемой суспензии при температуре окружающей среды добавляли по каплям KOtBu (0,581 мл, 0,581 ммоль, 1,0 М в THF). Полученную смесь перемешивали при температуре окружающей среды в течение 48 часов, затем к реакционной смеси добавляли дополнительный KOtBu (200 мкл, 0,2 ммоль), и смесь перемешивали в течение 3 часов. Добавляли другую часть KOtBu (400 мкл, 0,4 ммоль) (общее количество KOtBu 1,18 ммоль). Приблизительно через 15 минут LCMS показала, что циклизация была полной. Реакционную смесь охлаждали при 0°C и гасили муравьиной кислотой (500 мкл), и концентрировали с использованием роторного испарителя, получая масляный остаток, который растворяли в H2O и DMF (2 мл/6 мл) и фильтровали на шприцевом фильтре (0,2 μ полипропилена). Фильтрат очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 30% MeCN за 12 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, и остаточную воду лиофилизировали, получая 3-(4-(4-((бис(2-метоксиэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (110 мг, 42%-ый выход для стадии 1 и стадии 2): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 ацетонитрил/0,1% H3PO4, 3,22 мин (95,4%); Т. пл.: 105-107°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,60 (м, 1H, CHH), 2,62 (т, J=6,1 Гц, 4H, 2×CH2), 2,80-2,99 (м, 1H, CHH), 3,20 (с, 6H, 2×CH3), 3,39 (т, J=6,1 Гц, 4H, 2×CH2), 3,62 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CHH), 5,22 (с, 2H, CH2O), 7,28-7,37 (м, 4H, Ar), 7,38-7,53 (м, 3H, Ar), 10,97 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 45,07, 51,55, 52,99, 57,98, 58,52, 69,44, 70,57, 114,97, 115,18, 127,55, 128,52, 129,77, 129,93, 133,27, 134,95, 139,67, 153,48, 167,99, 170,95, 172,81; Вычислено для C27H33N3O6-+0,7 HCOOH+2 H2O: C, 59,01; H, 6,86; N, 7,45, Найдено: С, 58,72; H, 6,49; N, 7,32.
5.178 3-(ДИЭТИЛАМИНО)ПРОПИЛ(4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)БЕНЗИЛ)ТРЕТ-БУТИЛКАРБАМАТ
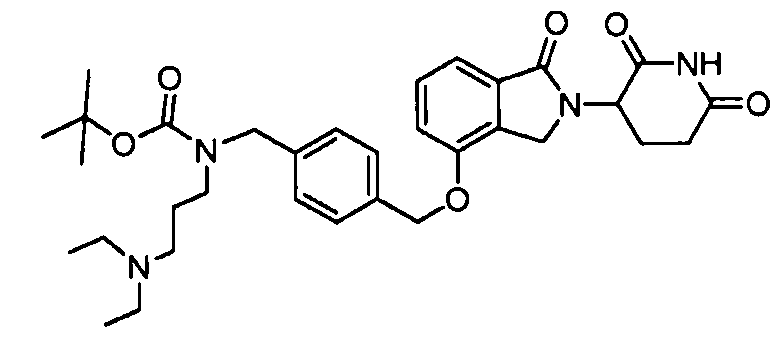
Стадия 1: В круглодонную колбу помещали 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (1,0 г, 2,321 ммоль) в ацетонитриле (Объем: 30 мл), получая бесцветный раствор. Добавляли N1,N1-диэтилпропан-1,3-диамин (0,907 г, 6,96 ммоль). Смесь перемешивали при температуре окружающей среды в течение выходных. Реакционную смесь концентрировали на роторном испарителе. Полученное масло использовали на следующей стадии без какой-либо очистки.
Стадия 2: К раствору 5-амино-4-(4-(4-((3-(диэтиламино)-пропиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,218 г, 2,32 ммоль) в CH2Cl2 (30 мл) добавляли BOC2O (2,70 мл, 11,61 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали и очищали на колонке с силикагелем, элюируя метиленхлоридом и метанолом, получая 5-амино-4-(4-(4-((трет-бутоксикарбонил(3-(диэтиламино)пропил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как прозрачное масло (500 мг, 35%).
Стадия 3: К раствору 5-амино-4-(4-(4-((трет-бутоксикарбонил-(3-(диэтиламино)пропил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 0,80 ммоль) в THF (20 мл) добавляли трет-бутоксид калия (0,090 г, 0,80 ммоль). Смесь перемешивали при 0°C в течение 10 минут и гасили, добавляя 1н. HCl (2 мл), затем насыщенный NaHCO3 (15 мл) и EtOAc (30 мл). Смесь экстрагировали и разделяли. Органический слой промывали солевым раствором и концентрировали на роторном испарителе. Полученное масло очищали на колонке с силикагелем и элюировали смесью CH2Cl2/MeOH, получая 3-(диэтиламино)пропил(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)трет-бутилкарбамат в форме твердого вещества белого цвета (0,23 г, 49%). Т. пл.: 140-142°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=5,15 мин (95%). 1H ЯМР (ДМСО-d6) δ 0,89 (т, J=7,2 Гц, 6H, СН3, СН3), 1,29-1,47 (м, 9Н, СН3, СН3, СН3), 1,48-1,62 (м, 2Н, СН2), 1,89-2,06 (м, 1Н, СНН), 2,29 (т, J=7,0 Гц, 2Н, СН2), 2,37 (кв, J=7,2 Гц, 4H, CH2, СН2), 2,42-2,47 (м, 1Н, CHH), 2,54-2,63 (м, 1H, CHH), 2,80-2,98 (м, 1H, CHH), 3,00-3,23 (м, 2H, CH2), 4,03-4,61 (м, 4H, CH2, CH2), 4,95-5,18 (м, 1H, NCH), 5,23 (с, 2H, CH2), 7,12-7,38 (м, 4H, Ar), 7,39-7,65 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 11,52, 28,01, 31,16, 45,06, 46,01, 49,58, 51,55, 69,29, 78,64, 114,94, 115,20, 127,29, 127,83, 129,77, 129,93, 133,28, 135,30, 138,66, 153,42, 167,99, 170,95, 172,81; LCMS MH=593, Вычислено для C33H44N4O6+0,1 H2O: C, 66,87; H, 7,49; N, 9,42; Найдено: С, 66,40; H, 7,43; N, 9,27.
5.179 ТРЕТ-БУТИЛОВЫЙ ЭФИР [{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1H-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-(2-МОРФОЛИН-4-ИЛ-ЭТИЛ)-АМИНО]-УКСУСНОЙ КИСЛОТЫ
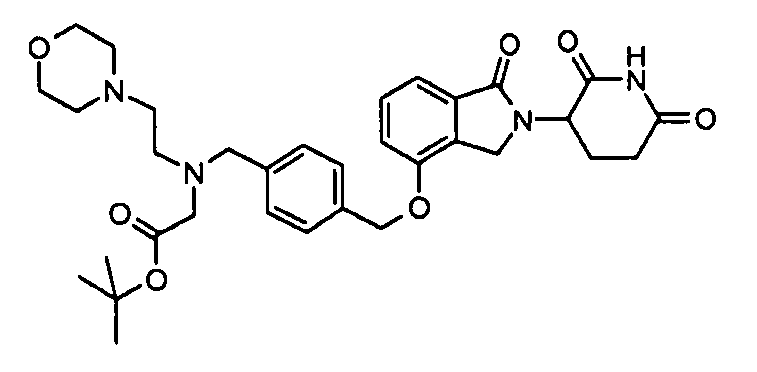
Стадия 1: К перемешиваемому бесцветному раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,18 г, 2,75 ммоль) в ацетонитриле (15 мл) добавляли 2-морфолиноэтанамин (1,08 мл, 8,24 ммоль). Реакционная смесь немедленно превратилась в светло-зеленый раствор. Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Раствор упаривали, получая светло-зеленое масло, которое не было дополнительно охарактеризовано и которое использовали на следующей стадии без очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((2-морфолиноэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,442 г, 2,75 ммоль) в дихлорметане (15 мл) добавляли ди-трет-бутил бикарбонат (1,80 г, 8,25 ммоль). Массу лимитирующего SM принимали за 1,44 г, что соответствовало теоретическому выходу с предыдущей стадии. Масло очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-[4-(4-{[трет-бутоксикарбонилметил-(2-морфолин-4-ил-этил)-амино]-метил}-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме маслянистого твердого вещества (0,88 г, 51% за две стадии).
Стадия 3: К перемешиваемому раствору 5-амино-4-(4-(4-((трет-бутоксикарбонил(2-морфолиноэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,36 г, 0,58 ммоль) в THF (10 мл) при 0°C добавляли 2-метилпропан-2-олат калия (0,07 г, 0,58 ммоль). Реакционную смесь перемешивали в течение десяти минут и гасили 1н. HCl (2 мл), получая прозрачный бесцветный раствор. Этот раствор нейтрализовали насыщенным раствором бикарбоната натрия (до рН=7), получая мутную смесь, которую экстрагировали этилацетатом (2×20 мл). Фазу этилацетата концентрировали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 30 минут), получая трет-бутиловый эфир [{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-(2-морфолин-4-ил-этил)-амино]-уксусной кислоты как пенистое твердое вещество белого цвета (0,21 г, 62%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% Н3РО4), 5,38 мин (97,4%); Т. пл.: 110-112°C; 1H ЯМР (ДМСО-d6) δ 1,29-1,49 (м, 9H, 3СН3), 1,92-2,05 (м, 1Н, CHH), 2,25-2,39 (м, 6H, 3CH2), 2,44 (дд, J=4,5, 13,0 Гц, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,15-3,29 (м, 2H, CH2), 3,52 (т, J=4,6 Гц, 4H, 2CH2), 4,19-4,49 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,23-7,37 (м, 4H, Ar), 7,41-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 28,02, 31,21, 43,30, 45,09, 49,37, 50,05, 51,58, 53,33, 55,95, 56,39, 66,17, 69,32, 78,84, 115,00, 115,23, 127,39, 127,83, 129,78, 129,97, 133,31, 135,30, 138,56, 153,43, 155,02, 168,01, 170,96, 172,83 (2 дополнительных пика в алкильной области, возможно от двух атомов алкила, близких к атому азота из-за присутствия ротамера); LCMS MH=593; Вычислено для C32H40N4O7+0,1 H2O: C, 64,65; H, 6,82; N, 9,42, Найдено: C, 64,31; H, 6,82; N, 9,24.
5.180 N-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1H-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-N-(2-МОРФОЛИН-4-ИЛ-ЭТИЛ)-ФОРМАМИД
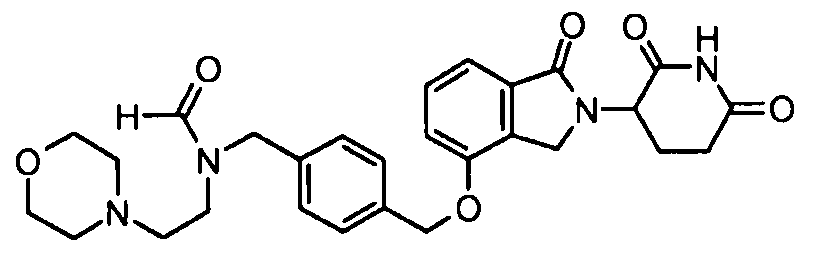
Стадия 1: К перемешиваемому бесцветному раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,18 г, 2,75 ммоль) в ацетонитриле (15 мл) добавляли 2-морфолиноэтанамин (1,08 мл, 8,24 ммоль). Реакционная смесь немедленно превратилась в светло-зеленый раствор. Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционный раствор упаривали, получая светло-зеленое масло, которое не было далее охарактеризовано и которое использовали на следующей стадии без очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((2-морфолиноэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,442 г, 2,75 ммоль) в дихлорметане (15 мл) добавляли ди-трет-бутил бикарбонат (1,80 г, 8,25 ммоль). Массу лимитирующего SM принимали за 1,44 г, что соответствовало теоретическому выходу с предыдущей стадии. Масло очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-[4-(4-{[трет-бутоксикарбонилметил-(2-морфолин-4-ил-этил)-амино]-метил}-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме маслянистого твердого вещества (0,88 г, 51% за две стадии).
Стадия 3: К перемешиваемому раствору 5-амино-4-(4-(4-((трет-бутоксикарбонил(2-морфолиноэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,36 г, 0,58 ммоль) в THF (10 мл) при 0°C добавляли 2-метилпропан-2-олат калия (0,07 г, 0,58 ммоль). Реакционную смесь перемешивали в течение десяти минут и гасили 1н. HCl (2 мл), получая прозрачный бесцветный раствор. Этот раствор нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7), получая мутную смесь, которую экстрагировали этилацетатом (2×20 мл). Фазу этилацетата концентрировали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 30 минут), получая трет-бутиловый эфир [{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-(2-морфолин-4-ил-этил)-амино]-уксусной кислоты как пенистое твердое вещество (0,213 г, 62%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,38 мин (97,4%); Т. пл.: 110-112°C; 1H ЯМР (ДМСО-d6) δ 1,29-1,49 (м, 9H, 3СН3), 1,92-2,05 (м, 1H, CHH), 2,25-2,39 (м, 6H, 3CH2), 2,44 (дд, J=4,5, 13,0 Гц, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,15-3,29 (м, 2H, CH2), 3,52 (т, J=4,6 Гц, 4H, 2CH2), 4,19-4,49 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,23-7,37 (м, 4H, Ar), 7,41-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 28,02, 31,21, 43,30, 45,09, 49,37, 50,05, 51,58, 53,33, 55,95, 56,39, 66,17, 69,32, 78,84, 115,00, 115,23, 127,39, 127,83, 129,78, 129,97, 133,31, 135,30, 138,56, 153,43, 155,02, 168,01, 170,96, 172,83 (2 дополнительных пика в алкильной области, возможно от двух атомов алкила, близких к атому азота из-за присутствия ротамера); LCMS MH=593; Вычислено для C32H40N4O3+0,1 H2O: C, 64,65; H, 6,82; N, 9,42, Найдено: C, 64,31; H, 6,82; N, 9,24.
Стадия 5: К перемешиваемому раствору 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил(2-морфолиноэтил)трет-бутилкарбамата (0,42 г, 0,71 ммоль) в дихлорметане (5 мл) добавляли смесь 2M HCl/простой эфир (4 мл). Белый осадок формировался почти немедленно. Суспензию перемешивали в течение ночи и фильтровали, получая твердое вещество белого цвета, которое очищали препаративной ВЭЖХ, получая прозрачное масло (0,22 г, 58%-ый выход). Было обнаружено, что оно является смесью желаемого продукта (16% Н-ЯМР) и амида на бензиле NH с муравьиной кислотой (84% Н-ЯМР).
Стадия 6: К перемешиваемой смеси 3-(4-(4-((2-морфолиноэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,04 г, 0,08 ммоль) в дихлорметане (3 мл) при температуре окружающей среды добавляли этил формиат (6,04 мкл, 0,075 ммоль). Смесь перемешивали в течение одного часа, и добавляли 0,12 мл этилформиата и перемешали в течение шести часов. Смесь упаривали, получая твердое вещество белого цвета, к которому добавляли простой диэтиловый эфир (5 мл), перемешивали и упаривали снова, получая твердое вещество белого цвета. Это вещество перемешивали в этилацетате (2 мл) и упаривали. Это повторяли еще два раза (добавляя 2 мл EtOAc и затем упаривая). Полученное твердое вещество белого цвета высушивали в вакуумном сушильном шкафу в течение ночи, получая N-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-N-(2-морфолин-4-ил-этил)-формамид как твердое вещество белого цвета (0,16 г, 79%-ый выход); ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% Н3РО4), 5,23 мин (95,4%); Т. пл.: 216-218°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,05 (м, 1H, CH), 2,23-2,36 (м, 6H, CH2, СН2, СН2), 2,36-2,47 (м, 1Н, СН), 2,53-2,66 (м, 1Н, СН), 2,83-3,00 (м, 1Н, СН), 3,20 (т, J=6,6 Гц, 1Н, СН), 3,27 (т, J=6,0 Гц, 1H, CH), 3,51 (т, J=4,6 Гц, 4H, CH2, CH2), 4,20-4,46 (м, 2H, CH2), 4,50 (д, J=5,1 Гц, 2H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,24 (д, J=6,8 Гц, 2H, CH2), 7,24-7,37 (м, 4H, ArH), 7,41-7,54 (м, 3H, ArH), 8,15 (с, 0,5H, HCON, из-за ротамера), 8,29 (с, 0,5H, HCON, из-за ротамера), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 38,09, 43,31, 44,74, 45,08, 50,21, 51,58, 53,14, 55,02, 56,11, 66,11, 66,17, 69,29, 115,01, 115,24, 127,78, 127,85, 127,99, 129,79, 129,97, 133,31, 135,47, 136,05, 137,11, 137,36, 153,41, 163,00, 163,31, 167,99, 170,96, 172,83 (4 дополнительных пика в ароматической области и 6 дополнительных пиков в алкильной области из-за ротамера); LCMS MH=521; Вычислено для C28H32N4O6+0,6 H2O: C, 63,29; H, 6,30; N, 10,54, Найдено: C, 63,06; H, 6,24; N, 10,35.
5.181 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)-N-МЕТИЛ-N-(2-морфолиноэтил)БЕНЗАМИД
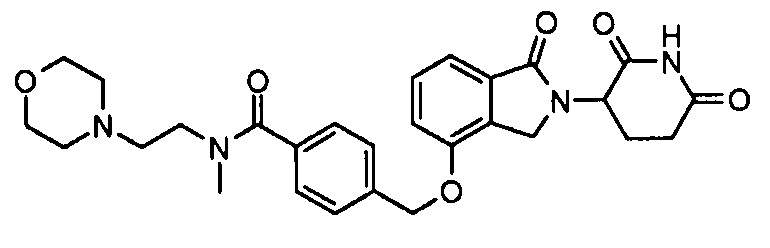
Стадия 1: 4-(Хлорметил)бензоил хлорид (655 мг, 3,47 ммоль) добавляли к перемешиваемому раствору N-метил-2-морфолиноэтанамина (500 мг, 3,47 ммоль) в ацетонитриле (20 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 15 минут, и реакция была полной. К реакционной смеси добавляли NaHCO3 (водный раствор, насыщ. 30 мл). Раствор экстрагировали EtOAc (40 мл×3). Органические слои объединяли и высушивали на MgSO4. Смесь фильтровали и концентрировали, получая 4-хлорметил-N-метил-N-(2-морфолин-4-ил-этил)-бензамид как светло-коричневое масло (1,0 г, 97%-ый сырой выход): LCMS MH=297; 1H ЯМР (ДМСО-d6) d 2,07-2,25 (м, 2H, CH2), 2,32-2,47 (м, 2H, CH2), 2,82-3,01 (м, 3H, CH2), 3,31 (с, 3H, CH3), 3,39-3,67 (м, 5H, CH2), 4,80 (с, 2H, CH2), 7,39 (д, J=8,1 Гц, 2H, Ar), 7,49 (д, J=8,1 Гц, 2H, Ar).
Стадия 2: К перемешиваемой смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (400 мг, 1,369 ммоль), 4-(хлорметил)-N-метил-N-(2-морфолиноэтил)бензамида (406 мг, 1,369 ммоль) и K2CO3 (189 мг, 1,369 ммоль) в DMF (10 мл) добавляли DIPEA (0,239 мл, 1,369 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 3 дней и затем нагревали при 50°C в течение 24 часов, после чего добавляли K2CO3 (100 мг, 0,82 ммоль) и нагревали при 80°C в течение 3,5 часов. Реакционную смесь, объединенную с другой загрузкой реакции с 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноатом (100 мг, 0,34 ммоль), концентрировали и очищали хроматографией ISCO, получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)-N-метил-N-(2-морфолиноэтил)бензамид как твердое вещество белого цвета (135 мг, 15%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (ацетонитрил/0,1% H3PO4), 2,1 l мин (98%); Т. пл.: 120-122°C; 1H ЯМР (ДМСО-d6) δ 1,96-2,09 (м, 1H, CHH), 2,28-2,37 (м, 4H, CH2, CH2), 2,39-2,46 (м, 1H, CHH), 2,44-2,52 (м, 2H, CH2), 2,54-2,66 (м, 1H, CHH), 2,79-2,91 (м, 1H, CHH), 2,94 (с, 3H, CH3), 3,44 (т, J=6,4 Гц, 2H, CH2), 3,52 (т, J=4,7 Гц, 4H, CH2, CH2), 4,32 (д, J=17,2 Гц, 1H, CHH), 4,43 (д, J=17,2 Гц, 1H, CHH), 5,04 (дд, J=5,3, 13,0 Гц, 1H, CHH), 5,28 (с, 2H, CH2), 7,24-7,57 (м, 7H, Ar), 10,62 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,16, 37,28, 43,50, 45,06, 51,56, 53,28, 55,04, 66,16, 69,03, 114,99, 115,32, 126,87, 127,29, 129,78, 129,96, 133,33, 136,39, 137,66, 153,32, 167,96, 170,95, 172,81; LCMS MH=521; Вычислено для C28H32N4O6+1,3 H2O: C, 61,82; H, 6,41; N, 10,30; Найдено: С,61,73; H,6,29; N,10,11.
5.182 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)-N-(2-(ПИПЕРИДИН-1- ИЛ)ЭТИЛ)БЕНЗАМИД
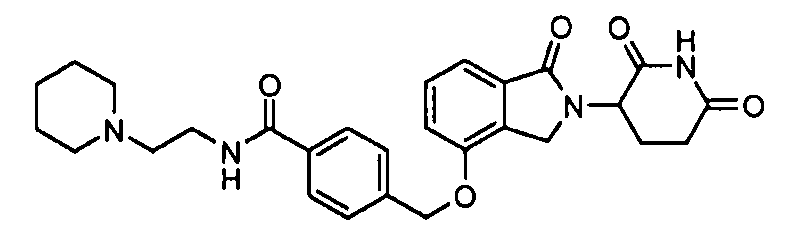
Стадия 1: 4-(Хлорметил)бензоил хлорид (1,474 г, 7,80 ммоль) добавляли при температуре окружающей среды к перемешиваемому раствору 2-(пиперидин-1-ил)этанамина (1 г, 7,80 ммоль) в ацетонитриле (20 мл). Полученный прозрачный раствор перемешивали при температуре окружающей среды в течение 20 минут, и реакция была полной. Реакционную смесь разбавляли EtOAc (50 мл) и экстрагировали NaHCO3 (водный раствор, насыщ. 30 мл). Водный слой снова экстрагировали EtOAc (2×25 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали, получая 4-хлорметил-N-(2-пиперидин-1-ил-этил)-бензамид как светло-коричневое твердое вещество (2,46 г, 109%-ый сырой выход): LCMS MH=281; 1H ЯМР (ДМСО-d6) δ 1,29-1,57 (м, 6H, CH2, СН2, СН2), 2,30-2,46 (м, 6Н, СН2, СН2, СН2), 3,26-3,45 (м, 2Н, СН2), 4,80 (с, 2Н, СН2), 7,51 (д, J=8,3 Гц, 2Н, Ar), 7,82 (д, J=8,3 Гц, 2H, Ar), 8,40 (т, J=5,5 Гц, 1H, NH).
Стадия 2: K2CO3 (284 мг, 2,053 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 2,053 ммоль) и 4-(хлорметил)-N-(2-(пиперидин-1-ил)этил)бензамида (576 мг, 2,053 ммоль) в DMF (12 мл), с последующим добавлением при температуре окружающей среды DIPEA (0,359 мл, 2,053 ммоль). Полученную реакционную суспензию перемешивали при температуре окружающей среды в течение 2 дней и нагревали при 50°C в течение 1 дня, после чего к реакционной смеси добавляли K2CO3 (120 мг, 0,87 ммоль). Полученную реакционную смесь нагревали при 80°C в течение 3 часов, и реакция была полной. Реакционную смесь подкисляли HCl (1н., 8 мл) до рН=3. К прозрачному раствору добавляли NaHCO3 (водный раствор, насыщ., 8 мл) до рН=8, после чего добавляли дихлорметан (40 мл) и солевой раствор (10 мл). Смесь экстрагировали, и водный слой снова экстрагировали дихлорметаном (30 мкл×2). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали, и фильтрат концентрировали. Остаток очищали хроматографией ISCO, получая твердое вещество белого цвета (220 мг). Это твердое вещество растворяли в дихлорметане (2 мл) и осаждали в EtOAC (10 мл). Твердое вещество отфильтровывали и высушивали, получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)-N-(2-(пиперидин-1-ил)этил)бензамид как твердое вещество белого цвета (205 мг, выход 19,8%): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (ацетонитрил/0,1% Н3РО4), 2,91мин (97,6%); Т. пл.: 220-222°C; 'H ЯМР (ДМСО-d6) δ 1,31-1,42 (м, 2H, CH2), 1,43-1,56 (м, 4H, CH2, CH2), 1,92-2,06 (м, 1H, CHH), 2,30-2,47 (м, 7H, CHH, CH2, CH2, CH2), 2,58 (д, J=17,6 Гц, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 3,34-3,40 (м, 2H, CH2), 4,28 (д, 1H, CHH), 4,45 (д, J=17,6Гц, 1H, CHH), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,32 (с, 2H, CH2), 7,26-7,37 (м, 2H, Ar), 7,42-7,52 (м, 1H, Ar), 7,56 (д, J=8,3 Гц, 2H, Ar), 7,84 (д, J=8,3 Гц, 2H, Ar), 8,38 (т, J=5,6 Гц, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 23,97, 25,53, 31,18, 36,92, 45,07, 51,58, 54,02, 54,93, 57,61, 68,97, 115,01, 115,35, 127,23, 129,78, 129,97, 133,34, 134,19, 139,64, 153,27, 165,73, 167,97, 170,96, 172,81; LCMS MH=505; Вычислено для C28H32N4O5+0,1 H2O+0,42CH2Cl2: C, 62,92; H, 6,14; N, 10,34; Найдено: С,62,85; H,6,26; N, 10,17.
5.183 4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-N-(3-МОРФОЛИН-4-ИЛ-ПРОПИЛ)- БЕНЗАМИД
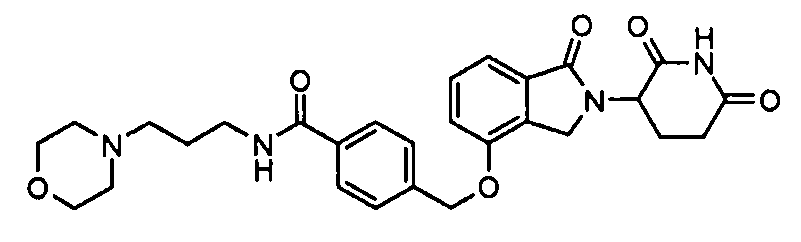
Стадия 1: 4-(Хлорметил)бензоил хлорид (1,311 г, 6,93 ммоль) добавляли при температуре окружающей среды к перемешиваемому раствору 3-морфолинопропан-1-амина (1 г, 6,93 ммоль) в ацетонитриле (20 мл). Полученный реакционный раствор перемешивали при температуре окружающей среды в течение 2 часов, и реакция была полной. Реакционную смесь разбавляли EtOAc (50 мл), и раствор экстрагировали NaHCO3 (водный раствор, насыщ., 40 мл). Водный слой снова экстрагировали EtOAc (2×20 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали, получая 4-хлорметил-N-(3-морфолин-4-ил-пропил)-бензамид в форме светло-красной прозрачной жидкости (2,23 г, 117%-ый сырой выход), которую переносили на следующую стадию без дальнейшей очистки: LCMS MH=297; 1H ЯМР (ДМСО-d6) δ 1,68 (квинт, J=7,1 Гц, 2H, CH2), 2,24-2,41 (м, 6Н, СН2, СН2, СН2), 3,19-3,39 (м, 2Н, СН2), 3,48-3,64 (м, 4Н, СН2, СН2), 4,81 (с, 2Н, M01), 7,52 (д, J=8,1 Гц, 2H, Ar), 7,83 (д, J=8,3 Гц, 2H, Ar), 8,51 (т, J=5,4 Гц, 1H, NH).
Стадия 2: DIPEA (0,359 мл, 2,053 ммоль) добавляли при температуре окружающей среды к перемешиваемой смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 2,053 ммоль), 4-(хлорметил)-N-(3-морфолинопропил)бензамида (640 мг, 2,155 ммоль) и K2CO3 (284 мг, 2,053 ммоль) в DMF (12 мл). Полученную смесь вводили в реакцию при 50°C в течение 8 часов и при температуре окружающей среды в течение 2 дней, после чего добавляли K2CO3 (100 мг, 0,72 ммоль). Смесь нагревали при 80°C в течение 9 часов, по истечении которых реакция прекращалась. Реакционную смесь фильтровали, и фильтрат разбавляли дихлорметаном (50 мл). Полученный раствор экстрагировали солевым раствором (15 мл). Водный слой снова экстрагировали дихлорметаном (25 мл). Органические слои объединяли и высушивали с MgSO4. Смесь фильтровали, и фильтрат концентрировали. Остаток очищали хроматографией ISCO, получая прозрачное твердое вещество (480 мг), который растирали в EtOAC (15 мл) и фильтровали, получая 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-N-(3-морфолин-4-ил-пропил)-бензамид как твердое вещество белого цвета (426 мг, 82%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 15/85, (ацетонитрил/0,1% H3PO4), 6,63 мин (99,9%); Т. пл.: 160-162°C; 1H ЯМР (ДМСО-d6) δ 1,67 (квинт, J=7,0 Гц, 2H, CH2), 1,93-2,06 (м, 1H, CH2), 2,28-2,38 (м, 6H, CH2, CH2, CH2), 2,39-2,47 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,23-3,31 (м, 2H, CH2), 3,56 (т, J=4,7 Гц, 4H, CH2, CH2), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,32 (с, 2H, CH2), 7,32 (дд, J=7,6, 8,3 Гц, 2H, Ar), 7,48 (т, J=7,7 Гц, 1H, Ar), 7,56 (д, J=8,1 Гц, 2H, Ar), 7,85 (д, J=8,3 Гц, 2H, Ar), 8,48 (т, J=5,5 Гц, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 25,91, 31,18, 37,71, 45,07, 51,58, 53,31, 56,02, 66,17, 68,98, 115,03, 115,35, 127,22, 127,28, 129,78, 129,97, 133,34, 134,22, 139,60, 153,27, 165,76, 167,94, 170,96, 172,81; LCMS MH=521; Вычислено для C28H32N4O6+1,0 H2O: C, 62,44; H, 6,36; N, 10,40; Найдено: C, 62,29; H,6,41; N, 10,26.
5.184 3-{4-[4-(ИЗОПРОПИЛАМИНО-МЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
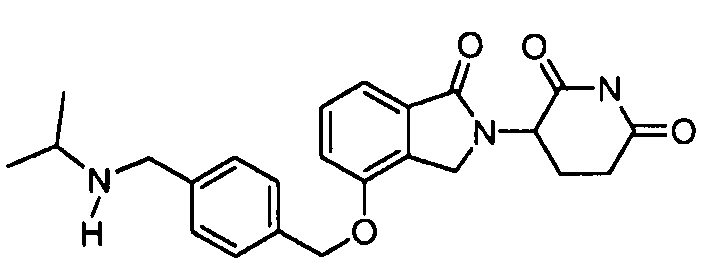
Стадия 1: К раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,160 ммоль) в ацетонитриле добавляли по каплям при температуре окружающей среды пропан-2-амин (0,593 мл, 6,96 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Смесь концентрировали на роторном испарителе, и полученное масло использовали непосредственно на следующей стадии.
Стадия 2: К суспензии 5-амино-4-(4-(4-((изопропиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,45 г, 0,992 ммоль) в THF при 0°C добавляли трет-бутоксид калия (0,223 г, 1,984 ммоль). Смесь перемешивали в течение 5 минут и гасили, добавляя 2 мл 1н. HCl, затем 10 мл насыщ. NaHCO3 и 20 мл CH2Cl2. Смесь экстрагировали и разделяли. Органический слой концентрировали на роторном испарителе, и полученное масло перемешивали с простым эфиром (20 мл), получая 3-{4-[4-(изопропиламинометил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества желтого цвета (150 мг, 31%). Т. пл.: 165-167°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O 5/95-100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,56 мин (96%). 1H ЯМР (ДМСО-d6) δ 0,98 (д, J=6,2 Гц, 6H, CH3, CH3), 1,88-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,62 (м, 1H, CHH), 2,63-2,74 (м, 1H, CH), 2,80-2,99 (м, 1H, CH), 3,68 (с, 2H, CH2), 4,15-4,51 (м, 2H, CH2), 5,10 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,24-7,62 (м, 7H, Ar), 11,00-11,10 (уш., 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,37, 22,73, 31,21, 45,06, 47,08, 50,10, 51,57, 114,97, 115,16, 127,55, 127,92, 129,76, 129,94, 133,30, 134,56, 141,36, 153,46, 167,98, 171,08, 172,96. LCMS MH=422. Вычислено для C24H27N3O4+0,9 H2O: C, 65,86; H, 6,63; N, 9,60; Найдено: С, 66,02; H, 6,46; N, 9,25.
5.185 3-[4-(4-ЦИКЛОГЕКСИЛАМИНОМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
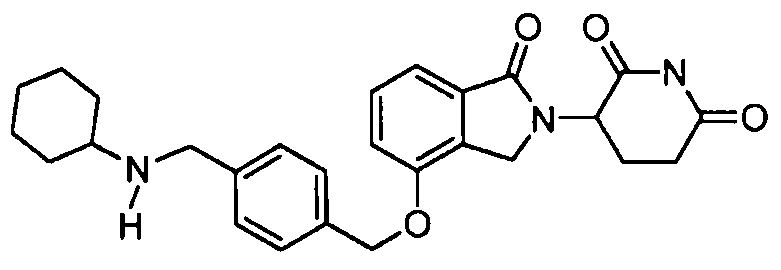
Стадия 1: К раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,160 ммоль) в ацетонитриле (10 мл) по каплям при температуре окружающей среды добавляли циклогексанамин (0,798 мл, 6,96 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и концентрировали на роторном испарителе. Полученную смесь использовали непосредственно на следующей стадии.
Стадия 2: К раствору 5-амино-4-(4-(4-((циклогексиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,4 г, 0,810 ммоль) в THF (20 мл) при 0°C добавляли 2-метилпропан-2-олат калия (0,136 г, 1,216 ммоль). Смесь перемешивали при температуре окружающей среды в течение 5 минут. К смеси добавляли 2 мл 1н. HCl, затем 10 мл насыщ. NaHCO3 и 20 мл CH2Cl2. Смесь экстрагировали и разделяли. Органический слой концентрировали на роторном испарителе, и полученное твердое вещество перемешивали с простым эфиром (20 мл), получая 3-[4-(4-циклогексиламинометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (250 мг, 47%). Т. пл.: 175-177°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O 5/95-100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,80мин (95%). 1H ЯМР (ДМСО-d6) δ 0,94-1,20 (м, 4H, CH2, СН2, СНН), 1,42-1,58 (м, 1Н, СНН), 1,58-1,73 (м, 2Н, СН2), 1,80-1,84 (м, 2Н, СН2), 1,91-2,06 (м, 1H, CHH), 2,27-2,40 (м, 1H, CH), 2,40-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,79-3,04 (м, 1H, CHH), 3,71 (с, 2H, CH2), 4,10-4,60 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,24-7,63 (м, 7H, Ar). 13C ЯМР (ДМСО-d6) δ 22,29, 24,34, 25,84, 31,14, 32,81, 45,04, 49,51, 51,53, 55,05, 69,43, 114,94, 115,12, 127,51, 127,83, 129,71, 129,90, 133,24, 134,50, 141,46, 153,43, 167,94, 170,90, 172,75; LCMS MH=462, Вычислено для C27H31N3O4+0,4 H2O: C, 69,18; H, 6,84; N, 8,96; Найдено: С, 69,02; H, 7,11; N, 8,79.
5.186 3-(4-(4-((МЕТИЛ(2-морфолиноэтил)АМИНО)-МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
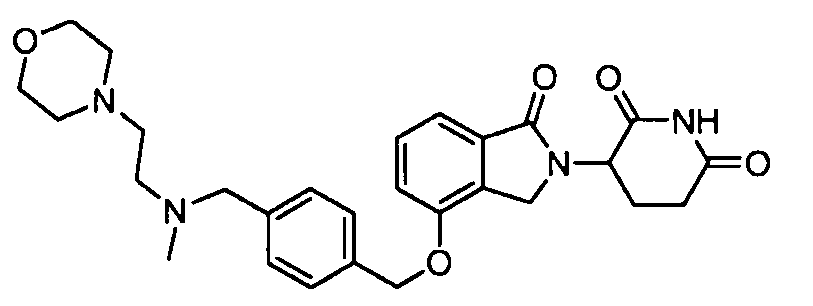
Стадия 1: К раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,160 ммоль) в ацетонитриле (10 мл) добавляли N-метил-2-морфолиноэтанамин (0,201 г, 1,392 ммоль), затем DIPEA (0,243 мл, 1,392 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали и экстрагировали CH2Cl2 (30 мл) и водой (30 мл). Органический слой концентрировали на роторном испарителе, получая метиловый эфир 4-карбамоил-4-[4-(4-{[метил-(2-морфолин-4-ил-этил)-амино]-метил}-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как пенистое твердое вещество. Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору 5-амино-4-(4-(4-((метил(2-морфолиноэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,114 ммоль) в THF (20 мл) добавляли трет-бутоксид калия (0,150 г, 1,337 ммоль). Смесь перемешивали при 0°C в течение 5 минут. К реакционной смеси добавляли 1н. HCl (2 мл), затем насыщ. NaHCO3 (10 мл) и CH2Cl2 (30 мл). Смесь экстрагировали и разделяли. Органический слой высушивали над Na2SO4 и концентрировали. Полученное пенистое твердое вещество очищали на колонке с силикагелем и элюировали CH2Cl2/MeOH, получая 3-(4-(4-((метил(2-морфолиноэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,34 г, 60%). Т. пл.: 193-195°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O 5/95-100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,25 мин (98%). 1H ЯМР (ДМСО-d6) δ 1,94-2,05 (м, 1H, CHH), 2,14 (с, 3Н, CH3), 2,30-2,38 (уш.с, 4H, CH2, СН2), 2,38-2,49 (уш.с, 5Н, CH2, CH2, CHH), 2,54-2,60 (т, 1Н, CHH), 2,89 (м, 1H, CHH), 3,43-3,63 (м, 6H, CH2, СН2, СН2), 4,22-4,45 (м, 2Н, СН2), 5,11 (дд, J=4,9, 13,2 Гц, 1Н, NCH), 5,23 (с, 2H, CH2), 7,31-7,51 (м, 6H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 42,19, 45,10, 51,58, 53,63, 53,88, 56,11, 61,43, 66,16, 69,44, 115,01, 115,23, 127,58, 128,77, 129,79, 129,95, 133,31, 135,13, 139,01, 153,50, 168,01, 170,96, 172,83. Вычислено для C28H34N4O5+0,4 H2O: C, 65,45; H, 6,83; N, 10,90; Найдено: С, 65,71; H, 7,11; N, 10,95.
5.187 3-(4-{4-[(2-МОРФОЛИН-4-ИЛ-ЭТИЛАМИНО)-МЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН БИС-ГИДРОХЛОРИД
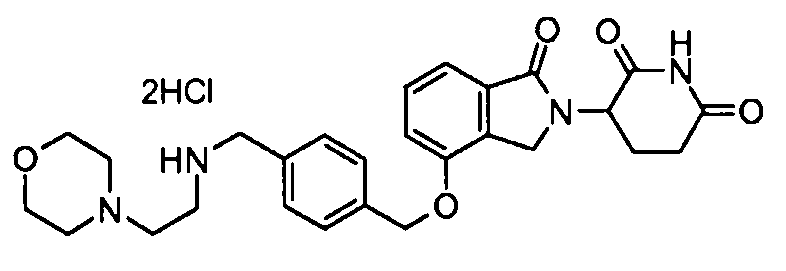
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,18 г, 2,75 ммоль) в ацетонитриле (15 мл) добавляли 2-морфолиноэтанамин (1,08 мл, 8,24 ммоль). Реакционная смесь немедленно превратилась в светло-зеленый раствор. Смесь перемешивали при температуре окружающей среды в течение ночи и затем упаривали, получая светло-зеленое масло, которое не было далее охарактеризовано и которое использовали на следующей стадии без очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((2-морфолиноэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,44 г, 2,75 ммоль) в дихлорметане (15 мл) добавляли ди-трет-бутил-бикарбонат (1,80 г, 8,25 ммоль). Массу лимитирующего SM принимали за 1,44 г, что соответствовало теоретическому выходу с предыдущей стадии. Масло очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-[4-(4-{[трет-бутоксикарбонилметил-(2-морфолин-4-ил-этил)-амино]-метил}-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме маслянистого твердого вещества (0,88 г, 51% за две стадии).
Стадия 3: К перемешиваемому раствору 5-амино-4-(4-(4-((трет-бутоксикарбонил(2-морфолиноэтил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,36 г, 0,58 ммоль) в THF (10 мл) при 0°C добавляли 2-метилпропан-2-олат калия (0,07 г, 0,58 ммоль). Реакционную смесь перемешивали в течение десяти минут и гасили 1н. HCl (2 мл), получая прозрачный бесцветный раствор. Этот раствор нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8), получая мутную смесь, которую экстрагировали этилацетатом (2×20 мл). Фазу этилацетата концентрировали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 5% за 30 минут), получая трет-бутиловый эфир [{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-(2-морфолин-4-ил-этил)-амино]-уксусной кислоты как пенистое твердое вещество (0,21 г, 62%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,38 мин (97,4%); Т. пл.: 110-112°C; 1H ЯМР (ДМСО-d6) δ 1,29-1,49 (м, 9H, 3СН3), 1,92-2,05 (м, 1Н, CHH), 2,25-2,39 (м, 6H, 3CH2), 2,44 (дд, J=4,5, 13,0 Гц, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,15-3,29 (м, 2H, CH2), 3,52 (т, J=4,6 Гц, 4H, 2CH2), 4,19-4,49 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,23-7,37 (м, 4H, Ar), 7,41-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 28,02, 31,21, 43,30, 45,09, 49,37, 50,05, 51,58, 53,33, 55,95, 56,39, 66,17, 69,32, 78,84, 115,00, 115,23, 127,39, 127,83, 129,78, 129,97, 133,31, 135,30, 138,56, 153,43, 155,02, 168,01, 170,96, 172,83 (2 дополнительных пика в алкильной области, возможно от двух атомов алкила, близких к атому азота из-за присутствия ротамера); LCMS MH=593; Вычислено для C32H40N4O7+0,1 H2O: C, 64,65; H, 6,82; N, 9,42, Найдено: C, 64,31; H, 6,82; N, 9,24.
Стадия 4: К перемешиваемому раствору 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил(2-морфолиноэтил)трет-бутилкарбамата (0,27 г, 0,45 ммоль) в дихлорметане (3 мл) добавляли смесь 2M HCl/простой эфир (2,5 мл). Белый осадок формировался почти немедленно. Его перемешивали при температуре окружающей среды в течение ночи и затем фильтровали, получая 3-(4-{4-[(2-морфолин-4-ил-этиламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион бис-гидрохлорид в форме твердого вещества желтого цвета (176 мг, 74%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 05/95 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,89 мин (95,4%); Т. пл.: 258-260°C; 1H ЯМР (ДМСО-d6) δ 1,94-2,06 (м, 1H, CHH), 2,36-2,44 (м, 1H, CHH), 2,55-2,66 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,03-3,23 (м, 2H, CH2), 3,47 (уш.с, 6H, CH2, CH2, CH2), 3,80 (уш.с, 2H, CH2), 3,92-4,10 (м, 2H, CH2), 4,15-4,51 (м, 4H, CH2, CH2), 5,12 (дд, J=5,2, 13,1 Гц, 1H, NCH), 5,30 (с, 2H, CH2), 7,27-7,38 (м, 2H, Ar), 7,44-7,52 (м, 1H, Ar), 7,53-7,65 (м, 4H, ArH), 9,43-9,67 (уш.с, 1,3Н, NH или HCl), 10,97 (с, 1H, NH), 11,06-11,23 (уш.с, 0,6H, NH или HCl); 13C ЯМР (ДМСО-d6) δ 22,36, 31,22, 40,67, 45,15, 49,89, 51,62, 52,06, 54,93, 63,28, 69,03, 115,01, 115,33, 127,78, 129,81, 130,00, 130,17, 131,44, 133,35, 137,48, 153,30, 167,98, 170,96, 172,85; LCMS MH=493; Вычислено для C27H32N4O5·2НС1:+1,1 H2O+0,1CH2Cl2: С, 54,82; H, 6,18; N, 9,44; Cl, 13,13; Найдено: С, 54,56; H, 6,04; N, 9,31; Cl, 12,82.
5.188 3-(4-{4-[(2-ГИДРОКСИ-ЭТИЛАМИНО)-МЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
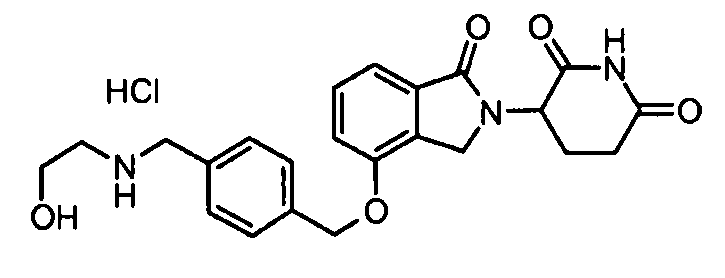
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,52 г, 1,21 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды, добавляли 2-аминоэтанол (0,15 мл, 2,41 ммоль) и N-этил-N-изопропилпропан-2-амин (0,60 мл, 3,62 ммоль). Реакционную смесь нагревали при 40°C в течение ночи и упаривали в вакууме, получая масло, которое смешивали с метиленхлоридом (40 мл), промывали водой (3×20 мл) и упаривали до прозрачного масла (0,61 г, 111%-ый сырой выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемой смеси 5-амино-4-(4-(4-((2-гидроксиэтиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,61 г, 1,34 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,65 г, 4,91 ммоль), и смесь перемешивали в течение десяти минут. Смесь быстро гасили 1н. HCl (~3 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (6 мл до рН=7) и затем экстрагировали метиленхлоридом (3×30 мл). Органические фазы объединяли, промывали солевым раствором (20 мл) и концентрировали до грязно-белого пенистого твердого вещества (0,31 г, 54%-ый выход). Это вещество перемешивали в воде (15 мл) и экстрагировали метиленхлоридом (4×20 мл). Водную фазу быстро замораживали смесью ацетон/сухой лед и лиофилизировали в течение ночи. Вес белого пушистого твердого вещества после лиофилизации составил 83 мг. Это вещество смешивали с метиленхлоридом (2 мл, частично растворенный), добавляли смесь 2M HCl/простой эфир (1,2 мл, 6 экв.) и перемешивали в течение ночи. Суспензию фильтровали и промывали простым диэтиловым эфиром. Отфильтрованное твердое вещество грязно-белого цвета высушивали в вакуумном сушильном шкафу, получая 3-(4-{4-[(2-гидрокси-этиламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион (57 мг, 10% за две стадии); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,13 мин (92,2%); Т. пл.: 251-253°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,37-2,47 (м, 1H, CHH), 2,54-2,65 (м, 1H, CHH), 2,83-3,00 (м, 3H, CH2, CHH), 3,68 (т, J=5,4 Гц, 2H, CH2), 4,11-4,20 (м, 2H, CH2), 4,23-4,50 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,29 (с, 2H, CH2), 7,29-7,37 (м, 2H, Ar), 7,43-7,64 (м, 5H, Ar), 9,18-9,41 (м, 2H, HClNH), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,13, 48,40, 49,49, 51,62, 56,30, 69,07, 115,01, 115,32, 127,74, 129,81, 130,00, 130,33, 131,65, 133,35, 137,30, 153,34, 167,98, 170,98, 172,85; LCMS MH=424; Вычислено для C23H25N3O5·HCl: С, 60,06; H, 5,70; N, 9,14; Cl, 7,71, Найдено: С, 48,95; H, 5,00; N, 7,28; Cl, 14,92.
5.189 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)-N-(2-ГИДРОКСИ-2МЕТИЛПРОПИЛ)БЕНЗАМИД
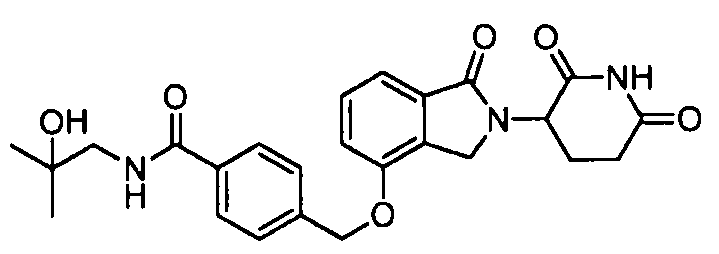
К раствору 4-(хлорметил)-N-(2-гидрокси-2-метилпропил)бензамида (0,73 г, 3,02 ммоль) и 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,839 г, 2,87 ммоль) в DMF (10 мл) при температуре окружающей среды добавляли DIEA (0,527 мл, 3,02 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Раствор нагревали до 40°C. К смеси добавляли K2CO3 (0,417 г, 3,02 ммоль). Смесь перемешивали при температуре окружающей среды в течение 4 дней. Реакционную смесь нагревали до 35°C в течение 1 дня. Смесь нагревали до 80°C в течение ночи. Смесь охлаждали до температуры окружающей среды. Суспензию фильтровали и промывали ацетонитрилом (15 мл). Фильтрат подкисляли HCOOH (2 мл). Раствор очищали препаративной ВЭЖХ (Xbridge C18, 10 мкм, 50×250 мм, 143 мл/мин, 240 нм, 2/98/2 мин, градиент до 95/5 ацетонитрил 0,1% FA/H2O 0,1% муравьиной кислоты за 30 минут), получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)-N-(2-гидрокси-2-метилпропил)бензамид как твердое вещество белого цвета (0,18 г, выход 12,8%): ВЭЖХ: (Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 ацетонитрил/0,1% H3PO4), 4,72 (95,2%); Т. пл.: 165-167°C; 1H ЯМР (ДМСО-d6) δ 1,10 (с, 6H, СН3, СН3), 1,87-2,11 (м, 1Н, CHH), 2,36-2,47 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,77-3,04 (м, 1H, CHH), 3,25 (д, J=6,0 Гц, 2H, CH2), 4,31 (с, 1H, CHH), 4,42 (с, 1H, CHH), 4,55 (с, 1H, OH), 5,00-5,20 (м, 1H, NCH), 5,33 (с, 2H, CH2), 7,33 (дд, J=5,7, 7,0 Гц, 2H, Ar), 7,48 (т, J=7,7 Гц, 1H, Ar), 7,57 (д, J=8,3 Гц, 2H, Ar), 7,88 (д, J=8,3 Гц, 2H, Ar), 8,24 (т, J=6,1 Гц, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,27, 27,28, 31,11, 45,01, 50,12, 51,52, 68,92, 69,72, 114,96, 115,28, 127,15, 127,40, 129,73, 129,92, 133,28, 134,27, 139,59, 153,21, 166,30, 167,87, 170,89, 172,74; LCMS MH=466; Вычислено для C25H27N3O6+1 H2O: C, 62,10; H, 6,05; N, 8,69; Найдено: С, 62,00; H, 5,74; N, 8,65.
5.190 3-(4-{4-[(ДИИЗОПРОПИЛАМИНО)-МЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
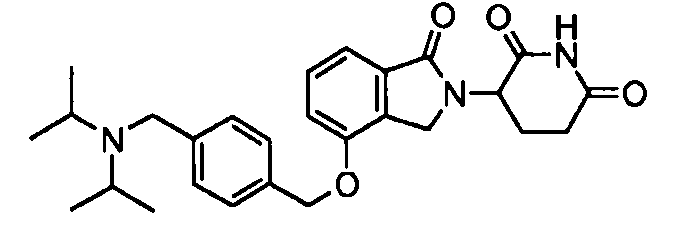
Стадия 1: К перемешиваемому бесцветному раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,00 г, 2,32 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли диизопропиламин (2,95 мл, 20,88 ммоль). Смесь перемешивали при 100°C в течение двух дней. Реакция не могла прийти к завершению, и смесь использовали на следующей стадии обменом растворителя с DMF без какой-либо очистки.
Стадия 2: Смесь 5-амино-4-(4-(4-((диизопропиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,15 г, 2,32 ммоль) и карбоната калия (0,32 г, 2,32 ммоль) в DMF (15 мл) нагревали при 80°C в течение ночи. Суспензию фильтровали и промывали DMF, получая коричневый фильтрат и твердое вещество грязно-белого цвета. Фильтрат упаривали до масла и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая 3-(4-{4-[(диизопропиламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (38 мг, 7%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,35 мин (95,8%); Т. пл.: 201-203°C; 1H ЯМР (ДМСО-d6) δ 0,98 (д, J=6,6 Гц, 12H, 4CH3), 1,90-2,05 (м, 1H, CHH), 2,35-2,46 (м, 1H, CHH), 2,53-2,65 (м, 2H, CHH, CHH), 2,82-3,05 (м, 2H, CHH, CHH), 3,61 (с, 2H, CH2), 4,18-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,26-7,55 (м, 7H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,60, 22,35, 31,21, 45,10, 47,35, 48,03, 51,58, 69,52, 114,95, 115,19, 127,56, 127,64, 129,81, 129,95, 133,29, 134,39, 142,81, 153,56, 168,02, 170,96, 172,83; LCMS MH=464; Вычислено для C27H33N3O4+1,1 H2O: C, 67,09; H, 7,34; N, 8,69, Найдено: С, 66,73; H, 6,99; N, 8,56.
5.191 3-(1-ОКСО-4-{4-[(ТЕТРАГИДРО-ПИРАН-4-ИЛАМИНО)-МЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
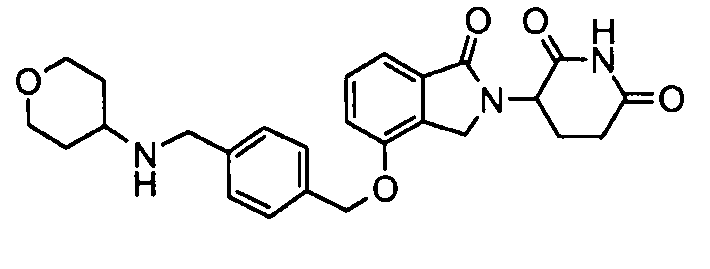
Стадия 1: К раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,16 ммоль) в THF (10 мл) при температуре окружающей среды добавляли тетрагидро-2H-пиран-4-амин (0,29 г, 2,90 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и затем нагревали при 45°C в течение трех часов. Реакционную смесь фильтровали, чтобы избавиться от твердого вещества. Фильтрат концентрировали и экстрагировали водой и дихлорметаном. Органический слой концентрировали, получая желтое пенистое твердое вещество (0,50 г, 87%-ый выход), которое очищали на силикагеле (градиент MeOH/CH2Cl2 от 1% до 10% за 30 минут), получая метиловый эфир 4-карбамоил-4-(1-оксо-4-{4-[(тетрагидро-пиран-4-иламино)-метил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-масляной кислоты в форме масла (0,40 г, 70%-ый выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-((тетрагидро-2H-пиран-4-иламино)метил)бензилокси)изоиндолин-2-ил)метилпентаноата (0,40 г, 0,81 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,10 г, 0,90 ммоль). Смесь перемешивали в течение десяти минут и затем гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (3 мл до рН=7). Смесь перемешивали с этилацетатом (30 мл) и разделяли. Органическую фазу промывали солевым раствором (20 мл) и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 10% за 30 минут), получая 3-(1-оксо-4-{4-[(тетрагидро-пиран-4-иламино)-метил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (80,8 мг, 22%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,89 мин (98,7%); Т. пл.: 231-233°C; 1H ЯМР (ДМСО-d6) δ 1,19-1,32 (м, 3H, NH, CH2), 1,74-1,79 (м, 2H, CH2), 1,96-2,00 (м, 1H, CHH), 2,37-2,47 (м, 1H, CHH), 2,51-2,60 (м, 2H, 2CH), 2,85-2,97 (м, 1H, CHH), 3,20-3,28 (м, 2H, CH2), 3,73 (с, 2H, CH2), 3,78-3,84 (м, 2H, CH2), 4,22-4,44 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,31-7,51 (м, 7H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,32, 31,17, 33,10, 45,08, 49,08, 51,56, 52,36, 65,76, 69,45, 115,00, 115,18, 127,57, 127,94, 129,77, 129,95, 133,28, 134,64, 141,20, 153,46, 167,99, 170,95, 172,81; LCMS MH=464; Вычислено для C26H29N3O5 (0,5 H2O): C, 66,09; H, 6,40; N, 8,89, Найдено: C, 65,90; H, 6,21; N, 8,62.
5.192 4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-N-(3-ПИПЕРИДИН-1-ИЛ-ПРОПИЛ)-БЕНЗАМИД
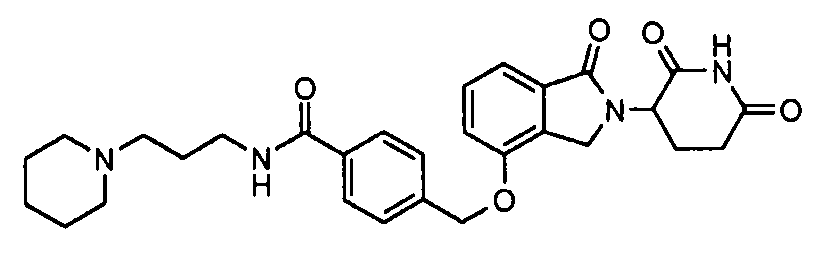
Стадия 1: 3-(Пиперидин-1-ил)пропан-1-амин (411 мг, 2,89 ммоль) добавляли через шприц к перемешиваемому раствору 4-(хлорметил)бензоил хлорида (546 мг, 2,89 ммоль) в ацетонитриле (10 мл). После добавления раствор перемешивали при температуре окружающей среды в течение 20 минут, и реакция была полной. К реакционной смеси добавляли NaHCO3 (водный раствор, насыщ., 20 мл). Прозрачный раствор снова экстрагировали EtOAc (3×25 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали под вакуумом, получая 4-хлорметил-N-(3-пиперидин-1-ил-пропил)-бензамид как светло-коричневое масло (700 мг, 82%). Это соединение использовали на следующей стадии: 1H ЯМР (ДМСО-d6) δ 1,37 (д, J=5,1 Гц, 2H, CH2), 1,42-1,54 (м, 4H, CH2, CH2), 1,66 (т, J=7,0 Гц, 2H, CH2), 2,23-2,39 (м, 6H, CH2, CH2, CH2), 3,19-3,31 (м, 2H, CH2), 4,80 (с, 2H, CH2), 7,51 (д, J=8,1 Гц, 2H, Ar), 7,83 (д, J=8,1 Гц, 2H, Ar), 8,53 (т, J=5,4 Гц, 1H, NH); LCMS MH=295.
Стадия 2: К смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (694 мг, 2,374 ммоль), 4-(хлорметил)-N-(3-(пиперидин-1-ил)пропил)бензамида (700 мг, 2,374 ммоль) и K2CO3 (328 мг, 2,374 ммоль) добавляли DMF (10 мл). Реакционную смесь перемешивали при 50°C в течение ночи и добавляли K2CO3 (150 мг, 1,08 ммоль). Полученную смесь нагревали при 80°C в течение 2 часов. Реакционную смесь подкисляли HCl (1н., водный раствор, 8 мл) с последующим добавлением NaHCO3 (водный раствор, насыщ. 8 мл) и солевого раствора (10 мл). Водный слой снова экстрагировали дихлорметаном (3×35 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали. Остаток очищали хроматографией ISCO, получая твердое вещество белого цвета. Это твердое вещество растирали в дихлорметане (1 мл) и простом эфире (15 мл), получая 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-N-(3-пиперидин-1-ил-пропил)-бензамид как твердое вещество белого цвета (84 мг, выход 6,8%): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 18/82, (ацетонитрил/0,1% H3PO4), 4,54 мин (98,5%); Т. пл.: 183-185°C; 1H ЯМР (ДМСО-d6) δ 1,37 (д, J=5,1 Гц, 2H, CH2), 1,43-1,54 (м, 4H, CH2, CH2), 1,67 (квинт, J=7,0 Гц, 2H, CH2), 1,93-2,07 (м, 1H, CHH), 2,31 (д, J=5,7 Гц, 5H, CH2, CH2), 2,40-2,47 (м, 1H, CHH), 2,53-2,66 (м, 1H, CHH), 2,83-3,01 (м, 1H, CHH), 3,21-3,37 (м, 3H, CH2, CHH), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,4 Гц, 1H, CHH), 5,12 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,32 (с, 2H, CH2), 7,32 (дд, J=7,6, 8,3 Гц, 2H, Ar), 7,48 (т, J=7,7 Гц, 1H, Ar), 7,56 (д, J=8,3 Гц, 2H, Ar), 7,84 (д, J=8,1 Гц, 2H, Ar), 8,50 (т, J=5,4 Гц, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 24,05, 25,52, 26,19, 31,18, 37,97, 45,07, 51,59, 54,01, 56,43, 68,98, 115,03, 115,35, 127,25, 127,21, 129,78, 129,97, 133,34, 134,29, 139,58, 153,29, 165,73, 167,91, 170,96, 172,81; LCMS MH=519; Вычислено для C29H34N4O5+0,4 H2O: С, 66,24; H, 6,67; N, 10,66; Найдено: С, 66,17; H, 6,43; N, 10,53.
5.193 2-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛАМИНО}-2-МЕТИЛ-ПРОПИОНОВАЯ КИСЛОТА
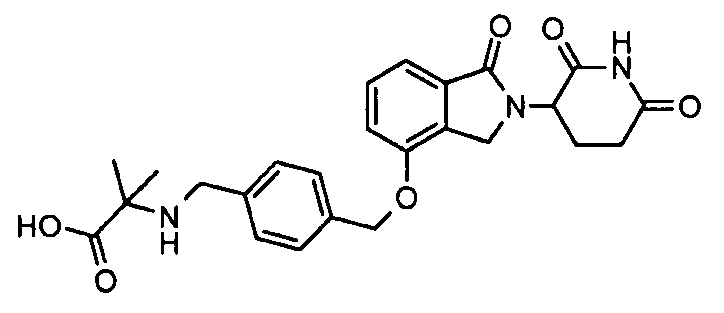
Стадия 1: Метиловый эфир 4-(4-{4-[(1-трет-бутоксикарбонил-1-метил-этиламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-4-карбамоил-масляной кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 1,262 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли 2-амино-2-метил-трет-бутилпропаноат гидрохлорид (272 мг, 1,389 ммоль) и DIPEA (0,551 мл, 3,16 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи в течение 5 дней и добавляли EtOAc (50 мл), NaHCO3 (водный раствор, насыщ., 5 мл) и солевой раствор (15 мл). Смесь экстрагировали, и органический слой концентрировали в вакууме. Остаток очищали хроматографией ISCO, получая метиловый эфир 4-(4-{4-[(1-трет-бутоксикарбонил-1-метил-этиламино)-метил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-4-карбамоил-масляной кислоты в форме прозрачного липкого твердого вещества (470 мг, 67%-ый выход); LCMS MH=554; 1H ЯМР (ДМСО-d6) δ 1,21 (с, 6H, CH3, CH3), 1,44 (с, 9Н, СН3, СН3, СН3), 1,97-2,32 (м, 4Н, СН2, СН2, СН), 3,50 (с, 3Н, СН3), 3,58 (д ,J=5,7 Гц, 2Н, СН2), 4,39 (д, J=17,6 Гц, 1H, CHH), 4,52 (д, J=17,6 Гц, 1H, CHH), 4,72 (дд, J=4,6, 10,1 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,18 (с, 1H, NHH), 7,25-7,32 (м, 2H, Ar), 7,32-7,39 (м, 2H, Ar), 7,40-7,49 (м, 3H, Ar), 7,58 (с, 1H, NHH).
Стадия 2: Трет-бутиловый эфир 2-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензиламино}-2-метилпропионовой кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-((1-трет-бутокси-2-метил-1-оксопропан-2-иламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (470 мг, 0,849 ммоль) в тетрагидрофуране (Объем: 10 мл) при 0°C добавляли трет-бутоксид калия (95 мг, 0,849 ммоль) в одной части. Смесь перемешивали при 0°C в течение 15 мин Реакционную смесь разбавляли EtOAc (50 мл) и гасили HCl (1н., водным раствором, 3 мл) с последующим добавлением NaHCO3 (водный раствор, насыщ., 3 мл) и солевого раствора (15 мл). Смесь экстрагировали, и органический слой высушивали MgSO4. Смесь фильтровали и концентрировали в вакууме, получая трет-бутиловый эфир 2-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензиламино}-2-метилпропионовой кислоты как твердое вещество белого цвета (460 мг, 104%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=522.
Стадия 3: 2-{4-[2-(2,6-Диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензиламино}-2-метилпропионовая кислота
К суспензии 2-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензиламино)-2-метил-трет-бутилпропаноата (360 мг, 0,690 ммоль) в DCM (2 мл) добавляли гидрохлорид, 2M в простом эфире (8 мл, 16,00 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение 5 дней, после чего концентрировали под вакуумом. Остаток очищали препаративной ВЭЖХ, получая 2-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензиламино}-2-метилпропионовую кислоту как твердое вещество белого цвета (125 мг, 39%); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 5-95% за 10 мин, (CH3CN/0,1% H3PO4), 5,96 мин (98,4%); Т. пл.: 271-272°C; 1H ЯМР (ДМСО-d6) δ 1,32 (с, 6H, CH3, СН3), 1,93-2,05 (м, 1Н, CHH), 2,35-2,48 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,88 (д, J=18,5 Гц, 1H, CHH), 3,89 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,27 (с, 2H, CH2), 7,26-7,37 (м, 2H, Ar), 7,40-7,58 (м, 5H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 23,26, 23,33, 31,18, 45,07, 46,38, 51,58, 61,65, 69,26, 115,16, 115,29, 127,66, 129,41, 129,77, 130,03, 133,30, 135,37, 136,33, 153,33, 167,97, 170,99, 172,81, 173,07; LCMS MH=466; Вычислено для C25H27N3O6+1,9 H2O: C, 60,09; H, 6,21; N, 8,41; Найдено: С, 60,01; H, 5,98; N, 8,23.
5.194 3-(4-(4-((МЕТИЛ(ТЕТРАГИДРО-2H-ПИРАН-4-ИЛ)АМИНО)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ФОРМИАТ
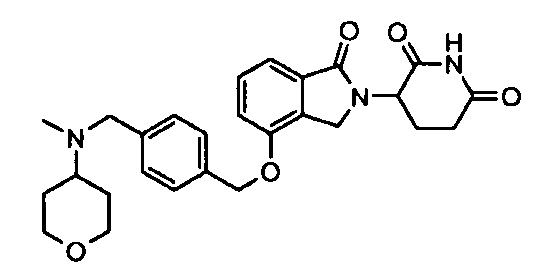
(3-(4-(4-(Бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (150 мг, 0,338 ммоль) суспендировали в MeCN (5 мл). К смеси добавляли N-метилтетрагидро-2H-пиран-4-амин (136 мг, 1,184 ммоль) и полученную смесь перемешивали при температуре окружающей среды в течение ~15 мин Реакционную смесь разбавляли EtOAc (100 мл) и 1н. NaHCO3 (30 мл). Мутный органический слой концентрировали в вакууме, и оставшийся остаток растирали с водой (100 мл) и Et2O (~100 мл). Твердое вещество собирали фильтрацией и высушивали отсасыванием на воронке с фильтром и затем помещали в вакуумный сушильный шкаф при 40°C на ночь, получая 125 мг твердого вещества белого цвета. Это твердое вещество растворяли в DMF/1н. HCl (12 мл/1 мл) и очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 50% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(4-(4-((метил(тетрагидро-2H-пиран-4-ил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион формиат как твердое вещество белого цвета (25 мг, 15%-ый выход): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83 CH3CN/0,1% H3PO4, 4,48 мин (98,1%); 1H ЯМР (ДМСО-d6) δ 1,43-1,59 (м, 2H, CHH, CHH), 1,62-1,76 (м, 2H, CHH, CHH), 1,92-2,04 (м, 1H, CHH), 2,09 (с, 3H, CH3), 2,35-2,48 (м, 1H, CHH), 2,52-2,71 (м, 2H, CHH, CH), 2,82-2,99 (м, 1H, CHH), 3,18-3,32 (м, 2H, CHH, CHH), 3,55 (с, 2H, CH2), 3,90 (дд, J=3,8, 11,1 Гц, 2H, CHH, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,37-7,55 (м, 3Н, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 28,89, 31,18, 37,14, 45,07, 51,55, 56,77, 59,08, 66,61, 69,45, 114,99, 115,19, 127,60, 128,47, 129,78, 129,95, 133,28, 134,92, 139,93, 153,49, 167,99, 170,96, 172,81; LC/MSM+H=478.
5.195 3-{4-[4-(ТРЕТ-БУТИЛАМИНО-МЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
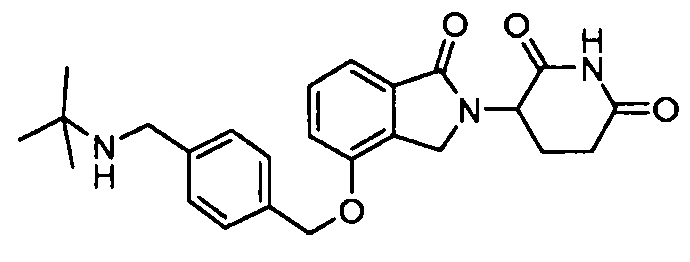
Стадия 1: Получение метилового эфира 4-{4-[4-(трет-бутиламино-метил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты
К перемешиваемому раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,611 г, 1,285 ммоль) в ацетонитриле (15 мл) добавляли 2-метилпропан-2-амин (0,406 мл, 3,86 ммоль). Смесь перемешивали в течение шести часов, и затем растворитель выпаривали, получая масло, которое перемешивали в воде (20 мл) и метиленхлориде (30 мл). Полученную белую суспензию фильтровали, получая метиловый эфир 4-{4-[4-(трет-бутиламино-метил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты как твердое вещество белого цвета (0,523 г, 87%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,37 (с, 9H, 3СН3), 1,97-2,34 (м, 4H, CH2, CH2), 3,50 (с, 3H, CH3), 4,06-4,22 (м, 2H, CH2), 4,35-4,61 (м, 2H, CH2), 4,74 (дд, J=5,0, 10,3 Гц, 1H, NCH), 5,24-5,37 (м, 2H, CH2), 7,19 (уш.с, 1H, NHH), 7,25-7,35 (м, 2H, Ar), 7,41-7,50 (м, 1H, Ar), 7,52-7,70 (м, 5H, NHH, Ar), 8,61 (уш.с, 2H, NHHCl); 13C ЯМР (ДМСО-d6) δ 24,96, 25,17, 30,36, 44,32, 44,77, 51,30, 53,40, 56,96, 69,01, 114,72, 115,24, 127,99, 129,59, 130,26, 132,17, 133,48, 137,55, 153,22, 167,80, 171,75, 172,51.
Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-{4-[4-(трет-бутиламино-метил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(4-(4-((трет-бутиламино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,069 ммоль) в THF (20 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,240 г, 2,14 ммоль). Смесь перемешивали в течение десяти минут и добавляли 1н., HCl (3 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (6 мл) до рН=7. К смеси добавляли этилацетат (50 мл) и перемешивали в течение 5 мин Органическую фазу отделяли, промывали солевым раствором (10 мл) и упаривали до белого пенистого твердого вещества (0,38 г). Это вещество перемешивали в простом эфире (20 мл) в течение одного часа, затем фильтровали, получая 3-{4-[4-(трет-бутиламино-метил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,279 г, 60%-ый выход); Т. пл. 194-196°C; ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 4,42 мин (95,4%); 1H ЯМР (ДМСО-d6) δ 1,04-1,21 (м, 9H, 3СН3), 1,92-2,06 (м, 1Н, CHH), 2,36-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 3,68 (уш.с, 2H, CH2), 4,18-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,27-7,53 (м, 7H, Ar), 10,88-11,20 (слабый, OH, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 28,62, 31,21, 45,10, 45,88, 51,59, 69,45, 115,04, 115,19, 127,55, 128,19, 129,78, 129,97, 133,31, 134,69, 153,46, 168,01, 170,96, 172,82; LC/MS (M+l)+=436; Вычислено для C25H29N3O4+0,2 H2O: C, 68,38; H, 6,75; N, 9,57, Найдено: С, 68,16; H, 6,62; N, 9,52.
5.196 3-{1-ОКСО-4-[4-(ПИПЕРАЗИН-1-КАРБОНИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
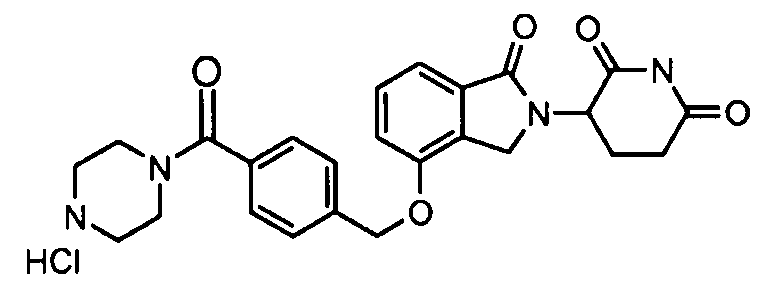
Стадия 1: К перемешиваемому раствору 4-(хлорметил)бензоил хлорида (1,890 г, 10 ммоль) в MeCN (30 мл) при температуре окружающей среды добавляли пиперазин-1-трет-бутилкарбоксилат (1,9 г, 10,20 ммоль) и N-метилморфолин (1,1 мл, 10,01 ммоль). Смесь перемешивали в течение 5 мин Реакционную смесь сохраняли при -20°C в течение ночи, и образовывалось твердое вещество. Смесь разбавляли равным объемом воды (приблизительно 30 мл), и твердое вещество собирали аспирационной фильтрацией и промывали другой частью воды (приблизительно 20 мл). Оставшееся твердое вещество на фильтре высушивали в вакуумном сушильном шкафу, получая твердое вещество белого цвета (1,93 г). Второй выход твердого вещества, образовавшегося в объединенном фильтрате/смывах, собирали фильтрацией и высушивали, получая трет-бутиловый эфир 4-(4-хлорметил-бензоил)-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (917 мг, 27%-ый выход). Анализ LCMS показал, что второй выход имел более высокую чистоту, и его использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 1,41 (с, 9H, tBu), 3,11-3,72 (м, 8H, 4×CH2), 4,80 (с, 2H, CH2), 7,42 (д, J=8,3 Гц, 2H, Ar), 7,51 (д, J=8,1 Гц, 2H, Ar); 13C ЯМР (ДМСО-d6) δ 27,97, 43,35, 45,48, 79,15, 127,32, 128,81, 135,56, 139,00, 153,76, 168,70; LCMS: MH=339, 341.
Стадия 2: К раствору 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,400 г, 1,369 ммоль) в DMF (5,01 мл), добавляли DIEA (0,239 мл, 1,369 ммоль) и карбонат калия (0,189 г, 1,369 ммоль). После перемешивания при температуре окружающей среды в течение приблизительно 5 минут, добавляли трет-бутиловый эфир 4-(4-хлорметил-бензоил)-пиперазин-1-карбоновой кислоты (0,455 г, 1,342 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Приблизительно через 17 часов смесь нагревали до 50°C в течение 3 часов и затем до 60°C в течение 22 часов. Смесь нагревали далее до 80°C приблизительно в течение 24 часов. Сырую смесь помещали в мензурку с 10%-ым раствором AcOH в H2O (50 мл). Немедленно после переноса образовывалось твердое вещество белого цвета. Суспензию энергично перемешивали и обрабатывали ультразвуком в течение 5 минут, затем фильтровали на воронке из спеченного стекла с фильтром со средним размером пор. Твердое вещество промывали обильно водой (полный объем фильтрата приблизительно 220 мл) и высушивали отсасыванием, получая твердое вещество грязно-белого цвета, которое очищали флэш-хроматографией на силикагеле (колонка ISCO на 80 грамм, элюируя MeCN в градиенте DCM), получая трет-бутиловый эфир 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил-оксиметил]-бензоил}-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (350 мг, 46%-ый выход). LCMS: МН=563. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 3: К перемешиваемому раствору трет-бутилового эфира 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил-оксиметил]-бензоил}-пиперазин-1-карбоновой кислоты (350 мг, 0,622 ммоль) в DCM (3 мл) при температуре окружающей среды добавляли HCl (2 мл, 4,00 ммоль, 2н. в Et2O). Смесь стала все более и более мутной со значительным образованием твердого вещества. Густую суспензию кратко обрабатывали ультразвуком и затем перемешивали при температуре окружающей среды в течение 26 часов. Суспензию разбавляли Et2O (~40 мл) и затем фильтровали. Собирали твердое вещество белого цвета, которое высушивали отсасыванием и затем промывали на воронке с фильтром с использованием EtOAc (50 мл), затем MeCN (~50 мл). Оставшееся твердое вещество высушивали отсасыванием на воронке с фильтром, затем высушивали в вакуумном сушильном шкафу, получая 3-{1-оксо-4-[4-(пиперазин-1-карбонил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (300 мг, 97%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 4,73 мин (96,7%); Т. пл.: 285-287°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, CHH), 2,33-2,46 (м, 1H, CHH), 2,54-2,65 (м, 1H, CHH), 2,83-3,02 (м, 1H, CHH), 3,02-3,24 (м, 4H, CH2, CH2), 3,50-4,03 (м, 4H, CH2, CH2), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 5,13 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,32 (с, 2H, CH2), 7,21-7,39 (м, 2H, Ar), 7,42-7,62 (м, 5H, Ar), 9,11 (уш.с, 2H, NH2 соль), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 24,11, 32,89, 46,57, 47,35, 53,72, 70,93, 117,11, 117,41, 128,97, 129,46, 131,79, 132,02, 134,89, 137,07, 139,91, 155,13, 171,08, 172,79, 175,11, 179,00; LCMS: MH=463; Вычислено для C25H26N4O5·HCl+0,6 H2O: C, 58,90; H, 5,58; N, 10,99; Найдено: С, 58,91; H, 5,58; N, 10,78.
5.197 3-{4-[4-(МОРФОЛИН-4-СУЛЬФОНИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
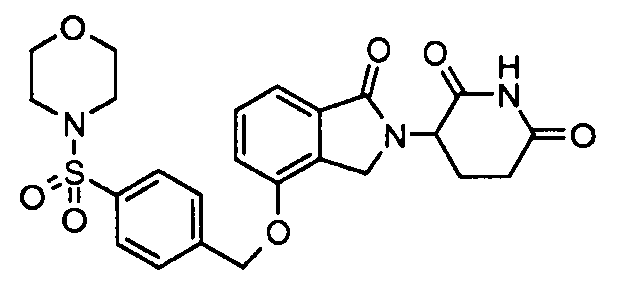
Стадия 1: 4-(4-Бромметил-бензолсульфонил)-морфолин
К перемешиваемому раствору морфолина (0,30 мл, 3,4 ммоль) и триэтиламина (0,53 мл, 3,8 ммоль) в простом эфире (5 мл) при 0°C добавляли по каплям раствор 4-(бромметил)бензол-1-сульфонил хлорида (0,928 г, 3,4 ммоль) в простом эфире (5 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение 17,5 часов, после чего растворяли в ацетонитриле (80 мл) и EtOAC (20 мл). Смесь промывали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая 4-(4-бромметил-бензолсульфонил)-морфолин как твердое вещество белого цвета (800 мг, 73%). Это соединение использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 2,77-2,94 (м, 4H, CH2, CH2), 3,54-3,70 (м, 4H, CH2, CH2), 4,81 (с, 2H, CH2), 7,74 (с, 4H, Ar); LCMS MH=320, 322.
Стадия 2: Метиловый эфир 4-карбамоил-4-{4-[4-(морфолин-4-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
5-Амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (350 мг, 1,2 ммоль), 4-(4-(бромметил)фенилсульфонил)морфолин (498 мг, 1,6 ммоль) и K2CO3 (165 мг, 1,2 ммоль) смешивали в ацетонитриле (15 мл) при температуре окружающей среды. Полученную смесь перемешивали при 50°C в течение 16 часов и добавляли K2CO3 (15 мг, 0,1 ммоль). Реакционную смесь перемешивали при 50°C в течение 3,5 часов. Реакционную смесь фильтровали, и твердое вещество промывали DCM (2×20 мл). Фильтрат концентрировали, и остаток очищали ISCO, получая метиловый эфир 4-карбамоил-4-{4-[4-(морфолин-4-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (560 мг, 88%-ый выход); 1H ЯМР (ДМСО-de) δ 2,01-2,33 (м, 4H, CH2, СН2), 2,82-2,93 (м, 4Н, СН2, СН2), 3,50 (с, 3Н, СН3), 3,59-3,68 (м, 4Н, СН2, СН2), 4,47 (д, J=17,8 Гц, 1Н, CHH), 4,60 (д, J=17,6 Гц, 1H, CHH), 4,75 (дд, J=4,7, 10,2 Гц, 1H, CHH), 5,41 (с, 2H, CH2), 7,20 (с, 1H, NHH), 7,26-7,36 (м, 2H, Ar), 7,42-7,52 (м, 1H, Ar), 7,60 (с, 1H, NHH), 7,79 (с, 4H, Ar); LCMS MH=532.
Стадия 3: 3-{4-[4-(Морфолин-4-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 5-амино-4-(4-(4-(морфолиносульфонил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (560 мг, 1,1 ммоль) в тетрагидрофуране (15 мл) при 0°C добавляли трет-бутоксид калия (130 мг, 1,2 ммоль). Реакционную смесь перемешивали в течение 1 часа и добавляли трет-бутоксид калия (30 мг, 0,28 ммоль). Реакционную смесь перемешивали при 0°C в течение 15 мин и затем добавляли MeOH (20 мл), с последующим добавлением HCl (водный раствор, 1н., 5 мл). К смеси добавляли солевой раствор (15 мл) и EtOAc (25 мл). Смесь фильтровали, и фильтрат концентрировали, пока твердое вещество не начало осаждаться. Смесь фильтровали, и твердое вещество очищали перемешиваемым в смеси растворителей MeOH (5 мл), DCM (15 мл) и EtOAc (15 мл), получая 3-{4-[4-(морфолин-4-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (209 мг, 39%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 35/65, (CH3CH)/1% Н3РО4), 5,06 мин (95,4%); Т. пл.: 308-310°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,09 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,54-2,67 (м, 1H, CHH), 2,80-3,03 (м, 5H, CHH, CH2, CH2), 3,55-3,69 (м, 4H, CH2, CH2), 4,32 (д, J=17,6 Гц, 1H, CHH), 4,48 (д, J=17,4 Гц, 1H, CHH), 5,13 (дд, J=4,9, 13,2 Гц, 1H, CHH), 5,41 (с, 2H, CH2), 7,34 (дд, J=7,7, 10,0 Гц, 2H, Ar), 7,43-7,56 (м, 1H, Ar), 7,78 (с, 4H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 31,16, 45,01, 45,85, 51,56, 65,22, 68,55, 114,97, 115,54, 127,87, 128,04, 129,87, 129,96, 133,40, 133,82, 142,44, 153,19, 167,91, 170,96, 172,83; LCMS MH=500; Вычислено для C24H25N3O7S+0,5 H2O: C, 56,68; H, 5,15; N, 8,26; Найдено: С, 56,71; H, 5,00; N, 8,16.
5.198 3-{4-[4-(4-ИЗОПРОПИЛ-ПИПЕРИДИН-1-СУЛЬФОНИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
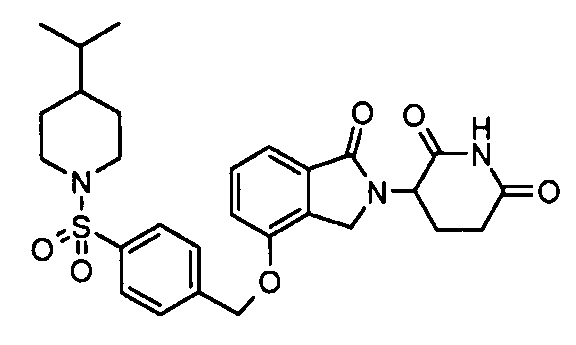
Стадия 1: 1-(4-Бромметил-бензолсульфонил)-4-изопропил пиперидин
К перемешиваемому раствору 4-изопропилпиперидина (0,22 г, 1,7 ммоль) и триэтиламина (0,26 мл, 1,9 ммоль) в простом эфире (5 мл) при 0°C добавляли по каплям раствор 4-(бромметил)бензол-1-сульфонил хлорида (0,466 г, 1,7 ммоль) в простом эфире (5 мл). После добавления реакционную смесь перемешивали при 0°C в течение 3 часов. Реакционную смесь промывали водой (15 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая 1-(4-бромметил-бензолсульфонил)-4-изопропил пиперидин как твердое вещество белого цвета (580 мг, 93%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 0,78 (д, J=6,8 Гц, 6H, CH3, CH3), 0,89-1,04 (м, 1H, CH), 1,06-1,25 (м, 2H, CH2), 1,28-1,46 (м, 1H, CH), 1,55-1,73 (м, 2H, CH2), 2,16 (тд, J=2,2, 11,9 Гц, 2H, CH2), 3,68 (д, J=11,7 Гц, 2H, CH2), 4,79 (с, 2H, CH2), 7,71 (д, J=2,6 Гц, 4H, Ar); LCMS MH=360, 362.
Стадия 2: Метиловый эфир 4-карбамоил-4-{4-[4-(4-изопропил-пиперидин-1-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
5-Амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (360 мг, 1,2 ммоль), 1-(4-(бромметил)фенилсульфонил)-4-изопропилпиперидин (577 мг, 1,6 ммоль) и карбонат калия (187 мг, 1,4 ммоль) смешивали в ацетонитриле (15 мл) при температуре окружающей среды. Полученную смесь перемешивали при 50°C в течение 8 часов и к реакционной смеси добавляли K2CO3 (30 мг, 0,2 ммоль). Полученную смесь нагревали при 50°C в течение 2 часов, после чего к реакционной смеси добавляли EtOAc (60 мл) и воду (20 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (20 мл) и высушивали с MgSO4. Органический слой концентрировали, и остаток очищали ISCO, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-изопропил-пиперидин-1-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (700 мг, 99%-ый выход). 1H ЯМР (ДМСО-d6) δ 0,78 (д, J=6,8 Гц, 6H, CH3, CH3), 0,88-1,04 (м, 1H, CH), 1,07-1,25 (м, 2H, CH2), 1,29-1,43 (м, 1H, CH), 1,57-1,73 (м, 2H, CH2), 2,02-2,32 (м, 6H, CH2, CH2, CH2), 3,50 (с, 3H, CH3), 3,69 (д, J=11,1 Гц, 2H, CH2), 4,46 (д, J=17,8 Гц, 1H, CHH), 4,59 (д,J=17,6 Гц, 1H, CHH), 4,75 (дд, J=4,7, 10,2 Гц, 1H, CHH), 5,38 (с, 2H, CH2), 7,20 (с, 1H, NHH), 7,26-7,35 (м, 2H, Ar), 7,42-7,52 (м, 1H, Ar), 7,60 (с, 1H, NHH), 7,71-7,83 (м, 4H, Ar); LCMS MH=572.
Стадия 3: 3-{4-[4-(4-Изопропил-пиперидин-1-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 5-амино-4-(4-(4-(4-изопропилпиперидин-1-илсульфонил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (700 мг, 1,2 ммоль) в тетрагидрофуране (12 мл) при 0°C добавляли трет-бутоксид калия (151 мг, 1,3 ммоль) в одной части. Раствор перемешивали при 0°C в течение 30 минут. Реакционную смесь разбавляли EtOAc (80 мл) и добавляли HCl (1н., водный раствор, 3 мл). К смеси добавляли NaHCO3 (насыщ. водный раствор, 15 мл) и экстрагировали. Органический слой промывали солевым раствором (30 мл) и высушивали MgSO4. Органический слой концентрировали, и полученное твердое вещество белого цвета очищали, после перемешивания в EtOAc (10 мл) и ацетонитриле (10 мл), получая 3-{4-[4-(4-изопропил-пиперидин-1-сульфонил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (386 мг, 58%-ый выход). ВЭЖХ: Waters Symmetry C-l8, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 55/45, (CH3CN/0,1% H3PO4), 5,76 мин (96,6%); Т. пл.: 245-247°C; 1H ЯМР (ДМСО-d6) δ 0,78 (д, J=6,8 Гц, 6H, CH3, СН3), 0,97 (дд, J=5,5, 11,7 Гц, 1H, CH), 1,06-1,27 (м, 2H, CH2), 1,36 (д,кв, J=6,5, 13,1 Гц, 1H, CH), 1,57-1,71 (м, 2H, CH2), 1,93-2,08 (м, 1H, CHH), 2,06-2,24 (м, 2H, CH2), 2,36-2,48 (м, 1H, CHH), 2,54-2,65 (м, 1H, CHH), 2,83-3,01 (м, 1H, CHH), 3,62-3,78 (м, 2H, CH2), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,47 (д, J=17,6 Гц, 1H, CHH), 5,13 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,38 (с, 2H, CH2), 7,25-7,42 (м, 2H, Ar), 7,43-7,58 (м, 1H, Ar), 7,68-7,86 (м, 4H, Ar), 10,99 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 19,28, 22,30, 27,75, 31,08, 31,39, 44,92, 46,29, 51,43, 68,45, 114,86, 115,44, 127,56, 127,89, 129,80, 129,86, 133,30, 134,91, 141,89, 153,10, 167,84, 170,92, 172,79; LCMS MH=540; Вычислено для C28H33N3O6S +0,3 H2O: C, 61,70; H, 6,21; N, 7,71; Найдено: С, 61,78; H, 6,00; N, 7,68.
5.199 3-{1-ОКСО-4-[4-(4-ФЕНИЛ-ПИПЕРАЗИН-1-СУЛЬФОНИЛ)- БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
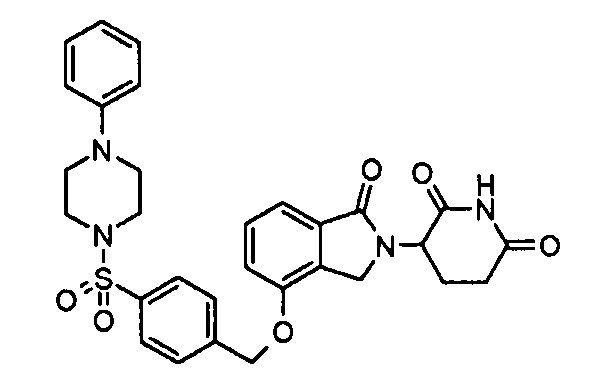
Стадия 1: 1-(4-Бромметил-бензолсульфонил)-4-фенил пиперазин
К перемешиваемому раствору 1-фенилпиперазина (0,51 г, 3,14 ммоль) и триэтиламина (0,482 мл, 3,46 ммоль) в простом диэтиловом эфире (10 мл) при 0°C добавляли по каплям раствор 4-(бромметил)бензол-1-сульфонил хлорида (0,847 г, 3,14 ммоль) в простом эфире (5 мл). Полученную суспензию перемешивали при 0°C в течение 1,5 часов. К реакционной смеси добавляли ацетонитрил (30 мл) и EtOAC (100 мл), с последующим добавлением воды (30 мл). Смесь фильтровали, получая твердое вещество белого цвета. Фильтрат экстрагировали. Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток, объединенный с твердым веществом белого цвета, очищали ISCO, получая 1-(4-бромметил-бензолсульфонил)-4-фенил-пиперазин как твердое вещество белого цвета (760 мг, 61%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,95-3,08 (м, 4H, CH2, CH2), 3,13-3,25 (м, 4H, CH2, CH2), 4,80 (с, 2H, CH2), 6,75-6,85 (м, 1H, Ar), 6,90 (д, J=7,9 Гц, 2H, Ar), 7,10-7,29 (м, 2H, Ar), 7,57-7,90 (м, 4H, Ar); LCMS MH=395, 397.
Стадия 2: Метиловый эфир 4-карбамоил-4-{1-оксо-4-[4-(4-фенил-пиперазин-1-сульфонил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
5-Амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (360 мг, 1,2 ммоль), 1-(4-(бромметил)фенилсульфонил)-4-фенилпиперазин (584 мг, 1,5 ммоль) и карбонат калия (204 мг, 1,5 ммоль) смешивали в ацетонитриле (15 мл) при температуре окружающей среды. Полученную смесь перемешивали при 50°C в течение 20 часов, и к реакционной смеси добавляли K2CO3 (15 мг, 0,1 ммоль). Полученную смесь перемешивали при 50°C в течение 1,5 часов, после чего добавляли EtOAc (50 мл) и воду (20 мл). Полученную смесь экстрагировали, и органический слой промывали солевым раствором (20 мл). Органический слой концентрировали под вакуумом, и остаток очищали ISCO, получая метиловый эфир 4-карбамоил-4-{1-оксо-4-[4-(4-фенил-пиперазин-1-сульфонил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как твердое вещество белого цвета (730 мг, 98%-ый выход); 1H ЯМР (ДМСО-d6) δ 2,01-2,33 (м, 4H, CH2, СН2), 2,96-3,09 (м, 4Н, СН2, СН2), 3,14-3,26 (м, 4Н, СН2, СН2), 3,50 (с, 3Н, СН3), 4,46 (д, J=17,8 Гц, 1Н, СНН), 4,59 (д, J=17,8 Гц, 1Н, CHH), 4,74 (дд, J=4,7, 10,2 Гц, 1H, CHH), 5,40 (с, 2H, CH2), 6,80 (т, J=7,3 Гц, 1H, Ar), 6,90 (д, J=7,9 Гц, 2H, Ar), 7,15-7,24 (м, 3H, Ar, NH), 7,25-7,35 (м, 2H, Ar), 7,40-7,51 (м, 1H, Ar), 7,59 (с, 1H, NHH), 7,74-7,89 (м, 4H, Ar); LCMS MH=607.
Стадия 3: 3-{1-Оксо-4-[4-(4-фенил-пиперазин-1-сульфонил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-(4-фенилпиперазин-1-илсульфонил)бензилокси)изоиндолин-2-ил)метилпентаноата (730 мг, 1,2 ммоль) в тетрагидрофуране (15 мл) при 0°C добавляли трет-бутоксид калия (127 мг, 1,3 ммоль) в одной части. Смесь перемешивали при 0°C в течение 10 минут, после чего при 0°C добавляли HCl (1н., водный раствор, 3 мл), с последующим добавлением DCM (50 мл) и NaHCO3 (насыщ. водный раствор, 15 мл). Твердое вещество белого цвета осаждали. Смесь фильтровали, и фильтрат экстрагировали. Органический слой концентрировали под вакуумом. Остаток, объединенный с твердым веществом, очищали, после перемешивания в смеси растворителей THF (3 мл) и DCM (25 мл), с последующим растиранием в DMF (5 мл) при 80°C, получая 3-{1-оксо-4-[4-(4-фенил-пиперазин-1-сульфонил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (256 мг, 37%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50, (CH3CN/0,1% H3PO4), 5,15 мин (98,9%); Т. пл.: 302-304°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,06 (м, 1H, CHH), 2,35-2,47 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,83-3,08 (м, 5H, CH2, CH2, CHH), 3,14-3,26 (м, 4H, CH2, CH2), 4,30 (д, J=17,6 Гц, 1H, CHH), 4,47 (д, J=17,6 Гц, 1H, CHH), 5,12 (дд, J=5,0, 13,3 Гц, 1H, CHH), 5,40 (с, 2H, CH2), 6,80 (т, J=7,3 Гц, 1H, Ar), 6,90 (д, J=7,9 Гц, 2H, Ar), 7,20 (дд, J=7,3, 8,6 Гц, 2H, Ar), 7,27-7,40 (м, 2H, Ar), 7,44-7,56 (м, 1H, Ar), 7,72-7,85 (м, 4H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,30, 31,08, 44,95, 45,70, 47,82, 51,46, 68,46, 114,87, 115,46, 116,04, 119,58, 127,79, 127,98, 128,86, 129,79, 129,88, 133,32, 133,96, 142,34, 150,22, 153,10, 167,83, 170,88, 172,74; LCMS MH=575; Вычислено для C30H30N4O6S+0,3 H2O: C, 62,12; H, 5,32; N, 9,66; Найдено: С, 62,05; H, 5,18; N, 9,63.
5.200 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-(ГИДРОКСИМЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
3-Аминопиперидин-2,6-дион гидрохлорид (0,915 г, 5,56 ммоль) добавляли к раствору 3-(4-(гидроксиметил)бензилокси)фталевой кислоты (1,4 г, 4,63 ммоль) в сухом пиридине (15 мл), и смесь нагревали до 118°C в масляной бане в течение 16 часов. Темной реакционной смеси давали охладиться до температуры окружающей среды и подкисляли медленным добавлением 1н. HCl (~25 мл). Смесь далее разбавляли водой (~170 мл) и затем обрабатывали ультразвуком в течение ~30 минут, чтобы помочь разбить твердые агрегаты. Полученную темную суспензию фильтровали на воронке из спеченного стекла со средним размером пор, и темное твердое вещество промывали дополнительным количеством воды (70 мл). Корку высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 2,5 часа, получая 1,6 г твердого вещества темно-синего цвета. Это твердое вещество растворяли в смеси DCM, MeCN и MeOH (~100 мл каждый) и обрабатывали активированным углем для обесцвечивания. Смесь перемешивали и затем фильтровали под силой тяжести с использованием фильтровальной бумаги. Фильтрат/смывы (темно-янтарного цвета) обрабатывали еще раз с обесцвечиванием активированным углем и затем фильтровали на слое целита. Прозрачный фильтрат концентрировали в вакууме досуха, получая твердое вещество, которое растирали с водой и отсасывали. Корку промывали дополнительным количеством воды (~100 мл), высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на 4 часа, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(гидроксиметил)бензил)окси)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (1,2 грамма, 68%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 5,08 мин (99,9%); Т. пл.: 250-252; 1H ЯМР (ДМСО-d6) δ 1,95-2,07 (м, 1H, CHH), 2,41-2,67 (м, 2H, CHH, CHH), 2,78-3,00 (м, 1H, CHH), 4,50 (д, J=5,1 Гц, 2H, CH2OH), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,19 (т, J=5,6 Гц, 1H, OH), 5,36 (с, 2H, CH20), 7,24-7,40 (м, 2H, Ar), 7,41-7,53 (м, 3H, Ar), 7,59 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,88, 30,83, 48,67, 62,53, 69,91, 115,40, 116,52, 120,18, 126,44, 127,09, 133,17, 134,31, 136,86, 142,32, 155,42, 165,21, 166,68, 169,81, 172,66, LCMS: M+Na=417; MH отсутствует в положительной ионизации; Вычислено для C21H18N2O6: С, 63,96; H, 4,60; N, 7,10; Найдено: С, 63,77; H, 4,52; N, 7,32.
5.201 3-(4-((4-(4-МЕТИЛПИПЕРАЗИН-1-КАРБОНИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
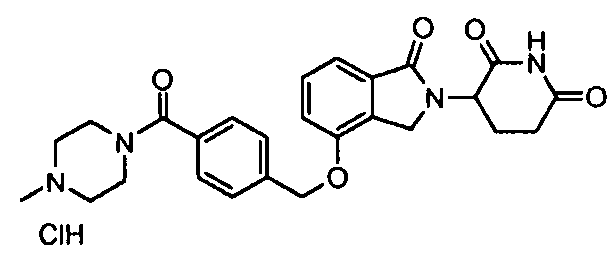
К перемешиваемой суспензии 3-(1-оксо-4-(4-(пиперазин-1-карбонил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион гидрохлорида (100 мг, 0,200 ммоль) в DMF (2 мл) добавляли 1н. водный раствор бикарбоната натрия (0,441 мл, 0,441 ммоль), затем йодметан (0,014 мл, 0,220 ммоль). Смесь перемешивали при температуре окружающей среды. Приблизительно через 24 часа загружали дополнительные 5 мкл йодметана, и смесь перемешивали при температуре окружающей среды в течение 3 дней. Реакционную смесь концентрировали в вакууме, и остаток разделяли между EtOAc (100 мл) и 1н. водным раствором NaHCO3 (10 мл). Органический слой промывали дополнительным количеством воды (40 мл) и солевым раствором, затем высушивали над Na2SO4 и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ, и продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 30% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и обрабатывали 1н. HCl (4 мл). Раствор концентрировали досуха, и остаток обрабатывали 2н. HCl в Et2O (0,5 мл). Летучие компоненты снова концентрировали досуха, и оставшееся твердое вещество высушивали в вакуумном сушильном шкафу, получая 3-(4-((4-(4-метилпиперазин-1-карбонил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид в форме твердого вещества грязно-белого цвета (41 мг, 39%): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 4,88 мин (95,7%); Т. пл.: 360-362°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,09 (м, 1H, CHH), 2,33-2,47 (м, 1H, CHH), 2,53-2,67 (м, 1H, CHH), 2,67-2,83 (м, 3H, CH3), 2,83-3,00 (м, 1H, CHH), 3,02-3,22 (м, 2H, CH2), 3,23-3,64 (м, 4H, CH2, CH2), 4,28 (д, J=17,6 Гц, 1H, CHH), 4,45 (д, J=17,6 Гц, 1H, CHH), 4,98-5,21 (м, 1H, CH), 5,32 (с, 2H, CH2), 7,22-7,42 (м, 2H, Ar), 7,46-7,55 (м, 3H, Ar), 7,56-7,63 (м, 2H, Ar), 10,98 (с, 1H, NH), 11,31-11,77 (м, 1H, HCl); 13C ЯМР (ДМСО-d6) δ 24,21, 33,00, 43,95, 47,07, 53,53, 53,79, 70,87, 73,78, 116,96, 117,34, 129,26, 129,44, 131,81, 135,14, 136,04, 140,55, 155,19, 170,00, 170,91, 172,79, 174,75; LCMS: MH=477; Вычислено для C26H28N4O5 HCl: C, 60,88; H, 5,70; N, 10,92; Найдено: С, 37,90; H, 4,33; N, 6,65.
5.202 3-{4-[4-(4-АЦЕТИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
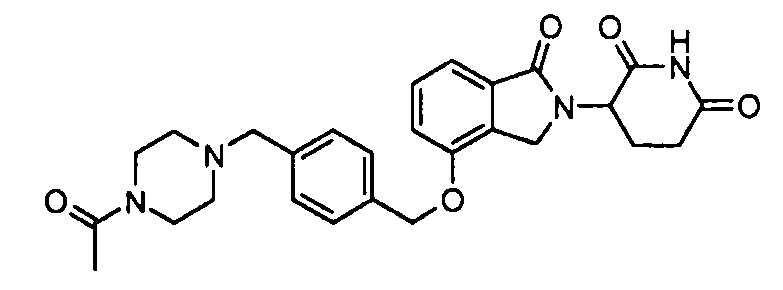
Стадия 1: К перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (600 мг, 1,392 ммоль) в ацетонитриле (10 мл) добавляли 1-(пиперазин-1-ил)этанон (178 мг, 1,392 ммоль) и DIPEA (0,608 мл, 3,48 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 20 часов, при 40°C в течение 2,5 часов и при 50°C в течение 3 часов, после чего реакция прекращалась. Реакционную смесь разбавляли дихлорметаном (40 мл) и промывали водой (15 мл) и солевым раствором (15 мл). Органический слой высушивали MgSO4 и концентрировали, получая метиловый эфир 4-{4-[4-(4-ацетил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты как прозрачное масло (840 мг, 115%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=523.
Стадия 2: KOtBu (156 мг, 1,393 ммоль) добавляли при 0°C к перемешиваемому раствору 4-(4-(4-((4-ацетилпиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксометилпентаноата (728 мг, 1,393 ммоль) в тетрагидрофуране (10 мл). Реакционную смесь перемешивали при 0°C в течение 1 часа, после чего добавляли KOtBu (30 мг, 0,27 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 10 минут, и реакция была полной. Реакционную смесь разбавляли дихлорметаном (50 мл) и подкисляли HCl (1н. водный раствор, 4 мл). Смесь экстрагировали NaHCO3 (10 мл) и солевым раствором (10 мл). Водный слой снова экстрагировали дихлорметаном (2×15 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали, получая твердое вещество белого цвета. Это твердое вещество растирали в простом диэтиловом эфире (30 мл) и фильтровали, получая 3-{4-[4-(4-ацетил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (500 мг, выход 67,5%): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 15/85, (ацетонитрил/0,1% H3PO4), 4,03 мин (99,4%); Т. пл.: 208-210°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 4H, CH3, CHH), 2,23-2,40 (м, 4H, CH2, СН2), 2,40-2,48 (м, 1Н, CHH), 2,53-2,64 (м, 1H, CHH), 2,80-3,00 (м, 1H, CHH), 3,36-3,46 (м, 4H, CH2, CH2), 3,49 (с, 2H, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 4H, Ar), 7,37-7,61 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,12, 22,33, 31,18, 40,77, 45,06, 45,60, 51,55, 52,19, 52,74, 61,49, 69,36, 114,96, 115,22, 127,64, 128,94, 129,80, 129,93, 133,28, 135,33, 137,70, 153,48, 167,97, 168,03, 170,96, 172,81; LCMS MH=491; Вычислено для C27H30N4O5+0,3 H2O: C, 65,39; H, 6,22; N, 11,30; Найдено: С, 65,31; H, 6,34; N, 11,32.
5.203 3-{4-[4-(4-ЦИКЛОПРОПАНКАРБОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
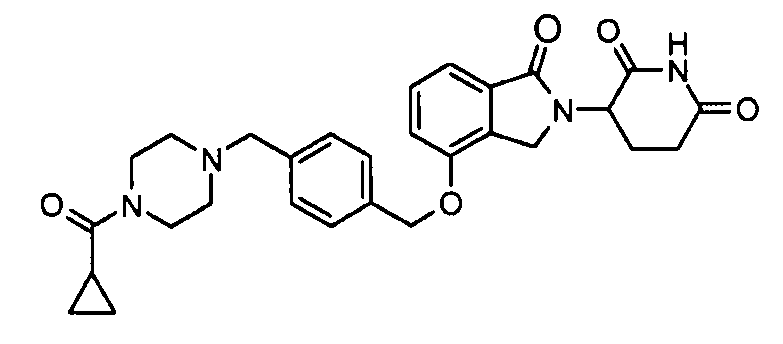
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 1,392 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли циклопропил(пиперазин-1-ил)метанон (0,257 мл, 1,810 ммоль) и DIPEA (0,608 мл, 3,48 ммоль). Полученный светло-зеленый раствор перемешивали при температуре окружающей среды в течение 3 дней, и реакция была полной. Реакционную смесь разбавляли дихлорметаном (40 мл) и экстрагировали водой (15 мл) и солевым раствором (15 мл). Органический слой высушивали MgSO4. Смесь концентрировали, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-циклопропанкарбонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как прозрачное масло (900 мг, 118%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки: LCMS MH=549.
Стадия 2: KOtBu (203 мг, 1,810 ммоль) добавляли к перемешиваемому раствору метилового эфира 5-4-карбамоил-4-{4-[4-(4-циклопропанкарбонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-метилмасляной кислоты (764 мг, 1,392 ммоль) в тетрагидрофуране (10 мл) при 0°C. Полученный желтый раствор перемешивали при 0°C в течение 30 минут, и реакция была полной. Реакционную смесь разбавляли дихлорметаном (60 мл) и гасили при 0°C с помощью HCl (1н., водный раствор, 3 мл) до рН=2. К смеси добавляли NaHCO3 (водный раствор, насыщ., 10 мл) и солевой раствор (15 мл). Смесь экстрагировали, и водный слой снова экстрагировали дихлорметаном (2×25 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали. Остаток растирали в простом диэтиловом эфире (50 мл) и фильтровали, получая 3-{4-[4-(4-циклопропанекарбонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (578 мг, 80%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 15/85, (ацетонитрил/0,1% H3PO4), 7,29 мин (99,8%); Т. пл.: 233-235°C; 1H ЯМР (ДМСО-d6) δ 0,60-0,77 (м, 4H, CH2, СН2), 1,87-2,08 (м, 2Н, СН2), 2,24-2,48 (м, 5Н, СНН, СН2, СН2), 2,54-2,63 (м, 1Н, СНН), 2,82-3,00 (м, 1Н, СНН), 3,39-3,55 (м, 4Н, СН2, СН2), 3,57-3,74 (м, 2Н, СН2), 4,26 (д, J=17,4 Гц, 1Н, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, СН2), 7,28-7,39 (м, 4Н, Ar), 7,41-7,54 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 6,83, 10,05, 22,27, 31,11, 41,46, 44,70, 44,99, 51,48, 52,20, 52,87, 61,44, 69,30, 114,89, 115,15, 127,57, 128,89, 129,73, 129,86, 133,23, 135,26, 137,65, 153,41, 167,92, 170,78, 170,89, 172,74; LCMS MH=517; Вычислено для C29H32N4O5+0,2 H2O: C, 66,96; H, 6,28; N, 10,77; Найдено: С, 66,90; H, 6,41; N, 10,71.
5.204 3-{4-[4-(4-ФТОР-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
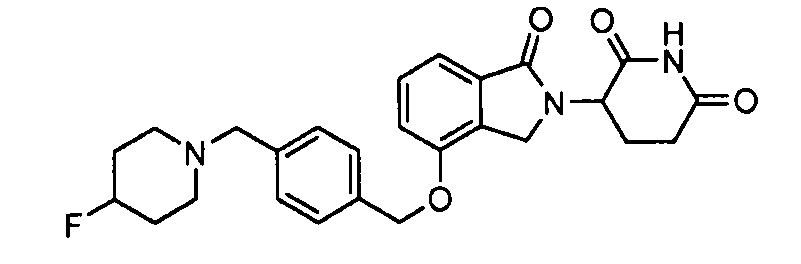
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 1,392 ммоль) и 4-фторпиперидина гидрохлорида (233 мг, 1,671 ммоль) в ацетонитриле (10 мл) под атмосферой N2 добавляли DIPEA (0,608 мл, 3,48 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 2 часов и при 70°C в течение 3 часов, после чего к реакционной смеси добавляли K2CO3 (192 мг, 1,392 ммоль). Полученную смесь нагревали при 50°C в течение ночи. К реакционной смеси добавляли K2CO3 (40 мг, 0,29ммоль) и 4-фторпиперидин гидрохлорид (35 мг, 0,25 ммоль), и смесь перемешивали при 60°C в течение 7 часов. Реакционную смесь разбавляли дихлорметаном (50 мл) и экстрагировали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-фтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как густое светло-зеленое масло (760 мг, 110%-ый сырой выход). Это соединение использовали на следующей стадии, как: LCMS MH=498.
Стадия 2: KOtBu (203 мг, 1,810ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-{4-[4-(4-фтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (693 мг, 1,392 ммоль) в тетрагидрофуране (10 мл) при 0°C под атмосферой N2. Реакционную смесь перемешивали при 0°C в течение 30 минут, и реакция была полной. Реакционную смесь разбавляли дихлорметаном (50 мл) и добавляли HCl (1н., водный раствор, 4 мл) до рН=1. Смесь экстрагировали смесью NaHCO3 (водный раствор, насыщ., 10 мл) и солевого раствора (15 мл). Водный слой снова экстрагировали дихлорметаном (2×25 мл). Органические слои объединяли и высушивали MgSO4. Смесь фильтровали и концентрировали. Остаток очищали хроматографией ISCO, получая 3-{4-[4-(4-фтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (215 мг, 33%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 18/82, ацетонитрил/0,1% H3PO4, 4,02 мин (98,9%); Т. пл.: 141-143°C; 1H ЯМР (ДМСО-d6) δ 1,57-2,06 (м, 5H, CHH, CH2, CH2), 2,19-2,34 (м, 2H, CH2), 2,35-2,55 (м, 3H, CH2, CHH), 2,54-2,63 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,47 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 4,52-4,82 (м, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,40-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 31,09 (д, J=19,8 Гц, M19), 31,10, 45,00, 48,92 (д, JC-F=6,6 Гц,), 51,49, 61,43, 69,34, 88,43 (д, J=168,4 Гц, M14), 114,87, 115,15, 127,56, 28,74, 129,73, 129,87, 133,23, 135,12, 138,21, 153,44, 167,93, 170,90, 172,76; LCMS MH=466; Вычислено для C26H28FN3O4+0,2 H2O: C, 66,57; H, 6,10; N, 8,96; Найдено: С, 66,35; H, 6,29; N, 8,79.
5.205 3-{4-[4-(4,4-ДИФТОР-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
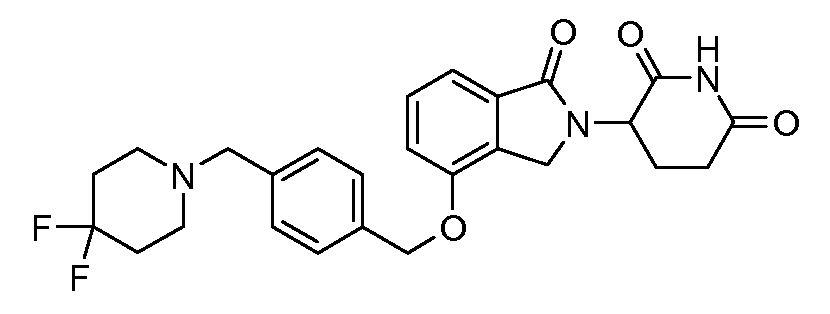
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (500 мг, 1,160 ммоль) и 4,4-дифторпиперидин гидрохлорида (274 мг, 1,741 ммоль) в ацетонитриле (10 мл) под атмосферой N2 добавляли Na2CO3 (160 мг, 1,160 ммоль) и DIPEA (0,507 мл, 2,90 ммоль). Полученный раствор перемешивали при 50°C в течение 8 часов, и реакцию останавливали. Реакционную смесь разбавляли дихлорметаном (50 мл) и экстрагировали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая метиловый эфир 4-карбамоил-4-{4-[4-(4,4-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества грязно-белого цвета (630 мг, 105%-ый сырой выход). Продукт использовали на следующей стадии: LCMS MH=516.
Стадия 2: К перемешиваемому раствору метилового эфира 4-карбамоил-4-{4-[4-(4,4-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (630 мг, 1,222 ммоль) в THF (10 мл) при 0°C добавляли KOtBu (151 мг, 1,344 ммоль). Смесь перемешивали при 0°C в течение 5 минут, и реакция была полной. Реакционную смесь разбавляли дихлорметаном (50 мл) и подкисляли HCl (1н., водный раствор, 3 мл) до рН=2. Смесь экстрагировали смесью NaHCO3 (водный раствор, насыщ., 5 мл) и солевого раствора (10 мл). Органический слой высушивали MgSO4 и концентрировали. Остаток перемешивали в простом эфире (50 мл), и смесь фильтровали, получая твердое вещество белого цвета. Это твердое вещество растирали в EtOAc (5 мл) и фильтровали, получая 3-{4-[4-(4,4-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (215 мг, 36%): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 18/82 (ацетонитрил/0,1% H3PO4): tR=4,17 (99,4%); Т. пл.: 193-195°C; 1H ЯМР (ДМСО-d6) δ 1,84-2,09 (м, 5H, CH2, СН2, СНН), 2,34-2,49 (м, 5Н, СНН, СН2, СН2), 2,54-2,64 (м, 1Н, СНН), 2,81-3,02 (м, 1Н, СНН), 3,55 (с, 2Н, СН2), 4,25 (д, J=17,6 Гц, 1Н, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, 4H, M01), 7,40-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 31,12, 33,25 (т, JC-F=20,9 Гц,), 45,00, 49,12, 51,51, 60,40, 69,29, 114,89, 115,16, 122,68 (т, JC-F=239,9 Гц,), 127,60, 128,84, 129,73, 129,88, 133,24, 135,32, 137,72, 153,42, 167,93, 170,91, 172,76; LCMS MH=484; Вычислено для C26H27F2N3O5+1H2O: C, 62,27; H, 5,83; N, 8,39, Найдено: С, 62,09; H, 5,73; N, 8,17.
5.206 N-(1-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИПЕРИДИН-4-ИЛ)- АЦЕТАМИД
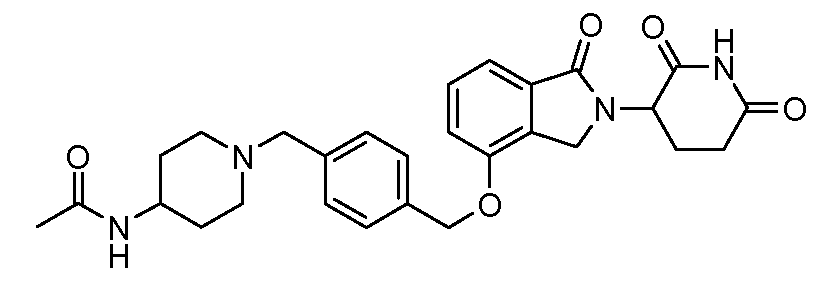
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (500 мг, 1,160 ммоль) в ацетонитриле (10 мл) добавляли N-(пиперидин-4-ил)ацетамид (215 мг, 1,509 ммоль), N-этил-N-изопропил-пропан-2-амин (0,405 мл, 2,321 ммоль) и K2CO3 (160 мг, 1,160 ммоль). Полученную реакционную смесь перемешивали при 50°C в течение 2 часов и при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли дихлорметаном (70 мл) и экстрагировали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали, получая метиловый эфир 4-{4-[4-(4-ацетиламино-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты как вязкое масло (705 мг, 113%-ый сырой выход). Это соединение использовали в полученном виде: LCMS MH=537.
Стадия 2: KOtBu (130 мг, 1,160 ммоль) добавляли при 0°C к суспензии метилового эфира 4-{4-[4-(4-ацетиламино-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты (622 мг, 1,16 ммоль) в тетрагидрофуране (10 мл). Полученную желтую смесь перемешивали при температуре окружающей среды в течение 7 часов, и к реакционной смеси при температуре окружающей среды добавляли KOtBu (60 мг, 0,46 ммоль). Реакция была полной через 10 минут. Реакционную смесь разбавляли дихлорметаном (30 мл) и подкисляли HCl (1н., водный раствор, 4 мл) и затем нейтрализовали NaHCO3 (насыщ., водный раствор, 5 мл). Смесь экстрагировали солевым раствором (10 мл). Органический слой высушивали MgSO4 и концентрировали, получая твердое вещество белого цвета, которое растирали простым эфиром (30 мл). Смесь фильтровали, получая N-(1-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-4-ил)-ацетамид как твердое вещество белого цвета (293 мг, 50%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 15/85, (ацетонитрил/0,1% H3PO4), 4,85 мин (99,1%); Т. пл.: 270-272°C; 1H ЯМР (ДМСО-d6) δ 1,26-1,44 (м, 2H, CH2), 1,62-1,73 (м, 2H, CH2), 1,77 (с, 3H, CH3), 1,89-2,05 (м, 3H, CHH, CH2), 2,34-2,47 (м, 1H, CHH), 2,54-2,64 (м, 1H, CHH), 2,65-2,79 (м, 2H, CH2), 2,81-2,99 (м, 1H, CHH), 3,40-3,57 (м, 3H, CH2, CHH), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,22 (с, 2H, CH2), 7,24-7,38 (м, 4H, Ar), 7,38-7,56 (м, 3H, Ar), 7,74 (д, J=7,7 Гц, 1H, NH), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 22,69, 31,18, 31,60, 45,07, 45,86, 51,55, 51,94, 61,80, 69,41, 114,94, 115,20, 127,61, 128,78, 129,80, 129,93, 133,28, 135,12, 138,50, 153,49, 167,99, 168,23, 170,96, 172,81; LCMS MH=505; Вычислено для C28H32N4O5+0,5 H2O: C, 65,48; H, 6,48; N, 10,91; Найдено: С, 65,58; H, 6,40; N, 10,76.
5.207 3-(4-(4-((2,6-ДИМЕТИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
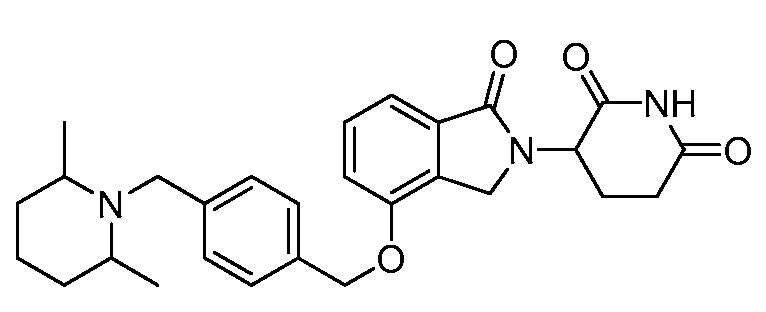
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,052 ммоль) в CNCH3 добавляли цис-2,6-диметилпиперидин (0,354 мл, 2,63 ммоль). Смесь перемешивали при 50°C в течение ночи. Реакционную смесь фильтровали. Фильтрат концентрировали на роторном испарителе, получая 5-амино-4-(4-(4-((2,6-диметилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат в форме твердого вещества (0,6 г, 112%). Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору 5-амино-4-(4-(4-((2,6-диметилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,6 г, 1,182 ммоль) в THF при 0°C добавляли трет-бутоксид калия (0,133 г, 1,182 ммоль). Смесь перемешивали при 0°C в течение 10 минут. Смесь гасили 1н. раствором HCl (2 мл), затем 20 мл (насыщенного) NaHCO3 и EtOAc (20 мл). После экстракции органический слой промывали 20 мл воды, затем солевым раствором (10 мл) и концентрировали, получая 3-(4-(4-((2,6-диметилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (0,33 г, 59%). Т. пл.: 205-207°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% Н3РО4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,74мин (96%). 1H ЯМР (ДМСО-d6) δ 0,94 (д, J=6,2 Гц, 6H, CH3, CH3), 1,14-1,38 (м, 3H, CHH, CH2), 1,42-1,74 (м, 3H, CH2, CHH), 1,87-2,06 (м, 1H, CHH), 2,34-2,47 (м, 3H, CH2, CHH), 2,53-2,65 (м, 1H, CHH), 2,81-3,02 (м, 1H, CHH), 3,70 (с, 2H, CH2), 4,19-4,48 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,33 (дд, J=2,6, 7,7 Гц, 2H, Ar), 7,39 (с, 4H, Ar), 7,43-7,56 (м, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) 21,98, 22,31, 23,66, 31,15, 34,04, 45,03, 51,51, 53,56, 57,41, 69,50, 114,88, 115,13, 127,26, 127,41, 129,75, 129,90, 133,24, 134,00, 142,84, 153,52, 167,96, 170,91, 172,76; LCMS: 476; Вычислено для C28H33N3O4+0,4 H2O: С, 69,66; H, 7,06; N, 8,70; Найдено: С, 69,46; H, 7,10; N, 8,41.
5.208 3-{1-ОКСО-4-[4-(4-ФЕНИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)- БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
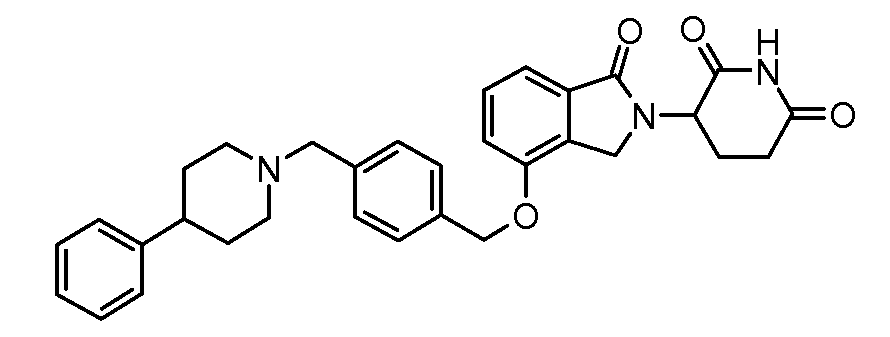
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,60 г, 1,39 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 4-фенилпиперидин (0,27 г, 1,67 ммоль) и N-этил-N-изопропилпропан-2-амин (0,28 мл, 1,67 ммоль). Смесь перемешивали при 50°C в течение нескольких часов и упаривали, получая масло (1,20 г, 86%-ый сырой выход).
Стадия 2: К перемешиваемому раствору 5-амино-5-оксо-4-(1-оксо-4-(4-((4-фенилпиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)метилпентаноата (0,77 г, 1,39 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,31 г, 2,79 ммоль), и смесь перемешивали в течение десяти минут. Смесь быстро гасили 1н. HCl (4 мл) и немедленно нейтрализовали насыщенным раствором бикарбоната натрия (5,5 мл до рН=7). Смесь затем перемешивали с этилацетатом (25 мл). Органическую фазу отделяли, промывали солевым раствором (15 мл) и концентрировали до твердого вещества светло-желтого цвета, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 7% за 20 минут), получая 3-{1-оксо-4-[4-(4-фенил-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,42 г, 58%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,80 мин (96,3%); Т. пл.: 220-222°C; 1H ЯМР (ДМСО-d6) δ 0,08-0,10 (д, 2H, CH2), 1,64-1,72 (м, 4H, CH2, СН2), 1,96-2,07 (м, 3Н, CH, СН2), 2,39-2,42 (м, 1Н, CHH), 2,51-2,60 (м, 1H, CHH), 2,85-2,97 (3H, CHH, CH2), 3,52 (уш.с, 2H, CH2), 4,23-4,45 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 7,15-7,52 (м, 12H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 32,94, 41,69, 45,07, 51,55, 53,52, 62,05, 69,40, 114,96, 115,22, 125,97, 126,64, 127,64, 128,29, 129,00, 129,81, 129,94, 133,30, 135,21, 138,37, 146,19, 153,50, 167,99, 170,97, 172,82; LCMS MH=524; Вычислено для C32H33N3O4: (+0,50 H2O): C, 72,16; H, 6,43; N, 7,89, Найдено: С, 71,83; H, 6,31; N, 7,80.
5.209 3-{4-[4-(4-ЦИКЛОПРОПИЛМЕТИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
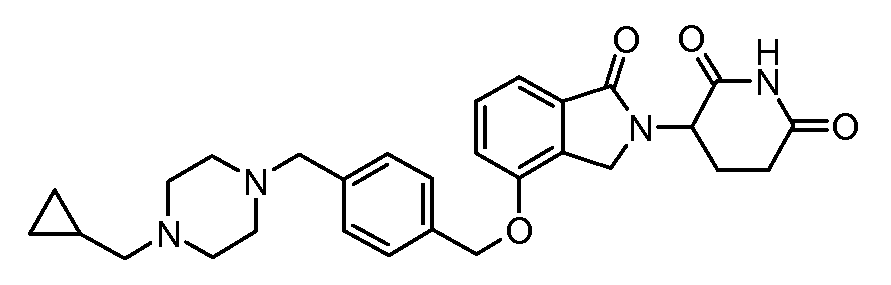
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,50 г, 1,06 ммоль) в ацетонитриле (50 мл) добавляли 1-(циклопропилметил)пиперазин (0,35 мл, 2,33 ммоль). Смесь перемешивали в течение 1,5 часов и затем концентрировали, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-циклопропилметил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как белое пенистое твердое вещество (0,83 г, 146%-ый сырой выход). Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((4-(циклопропилметил)пиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,57 г, 1,06 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,29 г, 2,57 ммоль). Смесь перемешивали в течение 15 минут и гасили 1н. HCl (~3 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (6 мл до рН=7). Смесь перемешивали с этилацетатом (20 мл), и затем органическую фазу промывали солевым раствором (15 мл), разделяли и концентрировали до грязно-белого пенистого твердого вещества. Это вещество очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 70 минут), получая 3-{4-[4-(4-циклопропилметил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как белый порошок (270 мг, 51%-ый выход); Т. пл.: 176-178°C; ВЭЖХ: Waters Symmetry С-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,05 мин (97,0%); 1H ЯМР (ДМСО-d6) δ 0,08-0,10 (д, 2H, СН2), 0,45-0,47 (д, 2H, СН2), 0,80-0,83 (м, 1H, CHH), 1,96-2,00 (м, 1H, CHH), 2,27-2,60 (перекрывающиеся множественные пики, 12H, CH2, CH2, CH2, CH2, CH2, CHH, CHH), 2,85-2,97 (м, 1H, CHH), 3,48 (с, 2H, CH2), 4,22-4,44 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,30-7,34 (м, 4H, Ar), 7,45-7,51 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 3,69, 7,75, 22,34, 31,18, 45,07, 51,55, 52,03, 52,37, 61,54, 62,36, 69,40, 114,96, 115,22, 127,63, 128,89, 129,80, 129,93, 133,29, 135,24, 137,92, 153,49, 167,99, 170,96, 172,82; LCMS MH=503; Вычислено для C29H34N4O4: (+1,0 H2O): С, 66,90; H, 6,97; N, 10,76, Найдено: С, 66,67; H, 6,63; N, 10,42.
5.210 3-{4-[4-(4,4-ДИМЕТИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
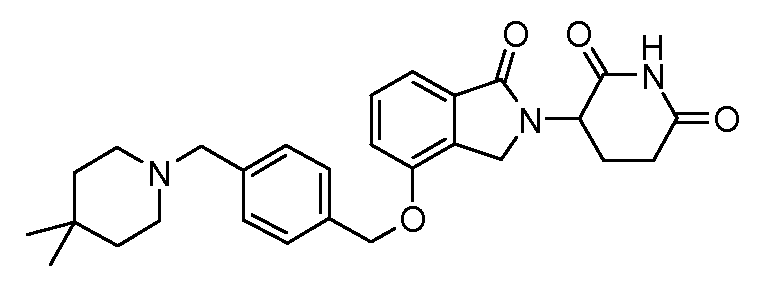
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,55 г, 1,28 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли 4,4-диметилпиперидин гидрохлорид (0,23 г, 1,53 ммоль) и N-этил-N-изопропилпропан-2-амин (0,46 мл, 2,81 ммоль). Смесь перемешивали в течение ночи и затем концентрировали, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 60 минут), получая метиловый эфир 4-карбамоил-4-{4-[4-(4,4-диметил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как светло-желтое твердое вещество (0,60 г, 92%-ый выход). Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((4,4-диметилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,59 г, 1,16 ммоль) в THF (15 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,33 г, 2,94 ммоль). Смесь перемешивали в течение десяти минут и быстро гасили 1н. HCl (4 мл) и немедленно нейтрализовали насыщенным раствором бикарбоната натрия (5,5 мл до рН=7). Смесь затем перемешивали с этилацетатом (25 мл). Органическую фазу отделяли, промывали солевым раствором (15 мл) и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 40 минут), получая 3-{4-[4-(4,4-диметил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как тонкодисперсный белый порошок (150 мг, 27%-ый выход); ВЭЖХ: Waters Symmetry С-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 in 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 4,64 мин (96,2%); Т. пл.: 168-170°C; 1H ЯМР (ДМСО-d6) δ 0,95 (с, 6H, 2CH3), 1,49 (уш.с, 4H, CH2, СН2), 1,96-2,00 (м, 1H, CHH), 2,37-2,43 (м, 1H, CHH), 2,51-2,60 (м, 1H, CHH), 2,86-2,98 (3H, CHH, CH2), 3,50 (уш.с, 2H, CH2), 4,23-4,45 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,25 (с, 2H, CH2), 7,31-7,51 (м, 7H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,35, 27,94, 31,18, 37,16, 45,06, 48,91, 51,56, 69,28, 114,97, 115,26, 127,69, 129,80, 129,94, 133,31, 153,44, 167,98, 170,97, 172,82; LCMS MH=476; Вычислено для C28H33N3O4: C, 70,71; H, 6,99; N, 8,84, Найдено: С, 66,15; H, 6,50; N, 8,02.
5.211 3-(4-(4-((4-ЭТИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
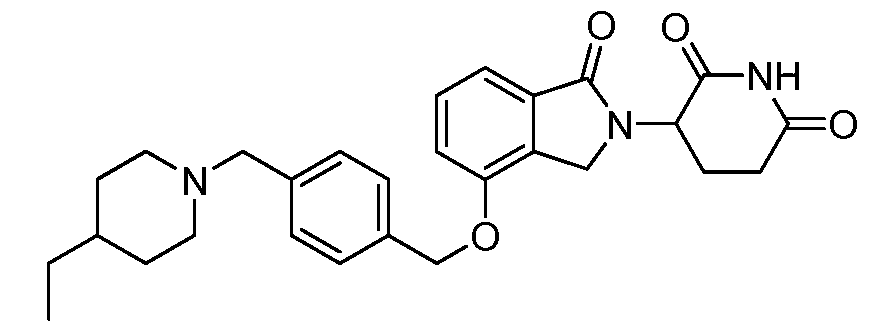
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,64 г, 1,346 ммоль) в ацетонитриле добавляли 4-этилпиперидин (0,34 г, 3,00 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и концентрировали на роторном испарителе. Полученное твердое вещество экстрагировали CH2Cl2 (25 мл) и водой (25 мл). Органический слой промывали водой (10 мл), затем солевым раствором (10 мл), высушивали над Na2SO4 и концентрировали, получая 5-амино-4-(4-(4-((4-этилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат как грязно-белое пенистое твердое вещество (0,67 г, 98%). Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору 5-амино-4-(4-(4-((4-этилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,67 г, 1,320 ммоль) в THF при 0°C добавляли 2-метилпропан-2-олат калия (0,148 г, 1,320 ммоль). Реакционную смесь гасили, добавляя насыщ. NaHCO3 (5 мл) после перемешивания при 0°C в течение 1,5 часов. Смесь разбавляли EtOAc (20 мл) и 10 мл воды, экстрагировали, промывали солевым раствором. Органический слой концентрировали на роторном испарителе, получая твердое вещество желтого цвета. Это твердое вещество частично растворяли в CH2Cl2 (10 мл) и добавляли простой эфир (5 мл). Смесь перемешивали и фильтровали, получая 3-(4-(4-((4-этилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион в форме твердого вещества (250 мг, 40%). Т. пл.: 180-182°C. ВЭЖХ: Waters Symmetry С-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,85 мин (96%), 1H ЯМР (ДМСО-d6) δ 0,66-0,94 (м, 3H, CH3), 0,99-1,14 (м, 3H, CH, CH2), 1,15-1,29 (м, 2H, CH2), 1,47-1,71 (м, 2H, CH2), 1,78-1,92 (м, 2H, CH2), 1,93-2,06 (м, 1H, CH), 2,36-2,48 (м, 1H, CHH), 2,53-2,65 (м, 1H, CHH), 2,77 (д, J=10,8 Гц, 2H, CH2), 2,83-3,03 (м, 1H, CHH), 3,43 (с, 2H, CH2), 4,13-4,50 (м, 2H, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,21-7,38 (м, 4H, Ar), 7,39-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 11,18, 22,36, 28,76, 31,21, 31,65, 36,97, 45,09, 51,58, 53,37, 62,19, 69,47, 114,97, 115,21, 127,61, 128,79, 129,81, 129,95, 133,31, 135,06, 138,66, 153,53, 168,01, 170,96, 172,82; LCMS: 476; Вычислено для C28H38N3O4+0,8 H2O: С, 68,63; H, 7,12; N, 8,58; Найдено: С, 68,66; H, 6,83; N, 8,44.
5.212 3-(4-(4-((4-ИЗОПРОПИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
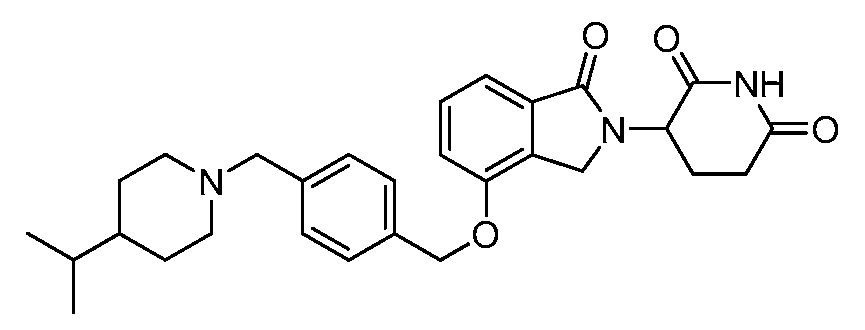
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,052 ммоль) в ацетонитриле добавляли 4-изопропилпиперидин (0,294 г, 2,314 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали на роторном испарителе. Полученное масло забирали в EtOAc (15 мл) и экстрагировали водой (20 мл). Органический слой промывали солевым раствором (10 мл), высушивали над Na2SO4 и концентрировали, получая 5-амино-4-(4-(4-((4-изопропилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат в форме масла. Эту смесь использовали без дальнейшей очистки на следующей стадии.
Стадия 2: К раствору 5-амино-4-(4-(4-((4-изопропилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,548 г, 1,05 ммоль) в THF при 0°C добавляли 2-метилпропан-2-олат калия (0,12 г, 1,069 ммоль). Смесь перемешивали при 0°C в течение 30 минут. Реакционную смесь гасили, добавляя 2 мл HCl (1н.) и 5 мл NaHCO3 (насыщенного), затем 20 мл EtOAc и 10 мл воды. Смесь экстрагировали, и органический слой промывали водой (10 мл) и солевым раствором (10 мл) и концентрировали. Полученное твердое вещество очищали на колонке ISCO, получая 3-(4-(4-((4-изопропилпиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (65 мг, 13%). Т. пл.: 124-126°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=4,98 мин (96,2%). 1H ЯМР (ДМСО-d6) δ 0,83 (д, J=6,8 Гц, 6H, CH3, CH3), 0,90-1,06 (м, 1H, CH), 1,07-1,25 (м, 2H, CH2), 1,31-1,47 (м, 1H, CH), 1,51-1,63 (м, 2H, CH2), 1,76-1,92 (м, 2H, CH2), 1,93-2,04 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,74-2,88 (м, 2H, CH2), 2,88-3,00 (м, 1H, CHH), 3,40-3,46 (уш.с, 2H, CH2), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,25-7,37 (м, 4H, Ar), 7,38-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 19,66, 22,36, 28,88, 31,21, 31,94, 41,84, 45,09, 51,58, 53,63, 62,13, 69,45, 114,97, 115,21, 127,61, 128,80, 129,81, 129,95, 133,31, 135,04, 153,51, 168,01, 170,96, 172,82; LCMS: 490; Вычислено для C29H35N3O4+0,4 H2O: C, 70,11; H, 7,26; N, 8,46; Найдено: С, 70,10; H, 7,37; N, 8,36.
5.213 3-{4-[4-(4-МЕТОКСИ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
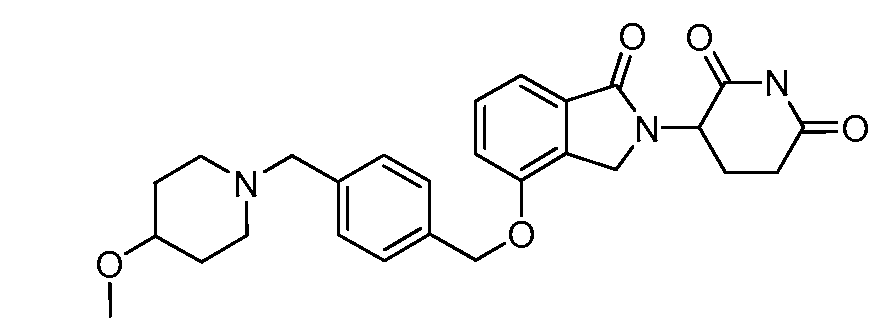
Стадия 1: К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 1,052 ммоль) в ацетонитриле добавляли 4-метоксипиперидин (0,133 г, 1,157 ммоль) и DIPEA (0,276 мл, 1,578 ммоль). После перемешивания при температуре окружающей среды в течение ночи, реакционную смесь концентрировали на роторном испарителе, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-метокси-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме масла. Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К раствору 5-амино-4-(4-(4-((4-метоксипиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,536 г, 1,052 ммоль) в THF при 0°C добавляли 2-метилпропан-2-олат калия (0,236 г, 2,104 ммоль). Смесь перемешивали при этой температуре в течение 15 минут. Реакционную смесь гасили, добавляя 10 мл 1н. HCl, затем 25 мл NaHCO3 (насыщ.). Смесь экстрагировали EtOAc (30 мл). Органический слой концентрировали, получая твердое вещество желтоватого цвета. Это твердое вещество перемешивали с простым эфиром в течение ночи. Полученную суспензию фильтровали, получая 3-{4-[4-(4-метокси-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,34 г, 71%). Т. пл.: 149-151°C. ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент до 95/5 ацетонитрил/0,1% H3PO4 за 5 мин: tR=4,60 мин (96%); 1H ЯМР (ДМСО-d6) δ 1,28-1,51 (м, 2H, CH2), 1,70-1,87 (м, 2H, CH2), 1,90-2,15 (м, 3H, CHH, CH2), 2,34-2,45 (м, 1H, CHH), 2,56-2,69 (м, 3H, CHH, CH2), 2,80-3,01 (м, 1H, CHH), 3,08-3,19 (м, 1H, CH), 3,21 (с, 3H, ОСН3), 3,44 (с, 2H, CH2), 4,18-4,53 (м, 2H, CH2), 5,03-5,16 (м, 1H, NCH), 5,22 (с, 2H, CH2), 7,23-7,38 (м, 4H, Ar), 7,39-7,57 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 30,63, 31,21, 50,48, 51,58, 54,77, 61,72, 69,44, 75,68, 114,95, 115,21, 127,62, 128,79, 128,83, 129,81, 129,95, 133,31, 135,12, 138,51, 153,51, 168,01, 170,96, 172,83; LCMS: 478; Вычислено для C27H31N3O5+0,1 H2O: C, 67,40; H, 6,58; N, 8,73; Найдено: С, 67,32; H, 6,39; N, 8,52.
5.214 3-{4-[4-(3,3-ДИФТОР-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
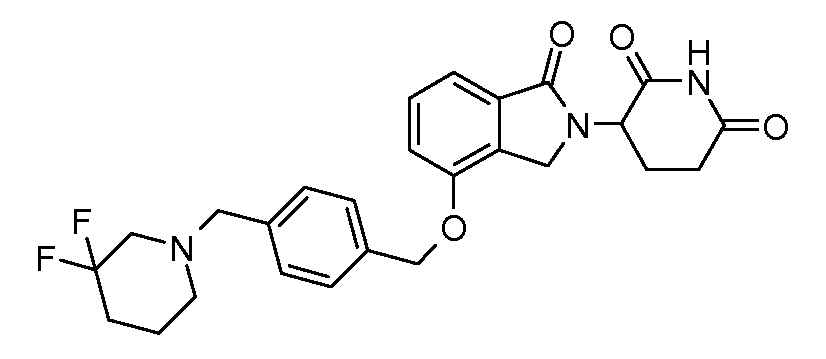
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (600 мг, 1,262 ммоль) в ацетонитриле (10 мл) добавляли 3,3-дифторпиперидин гидрохлорид (199 мг, 1,262 ммоль) и DIPEA (0,441 мл, 2,52 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение двух дней. Смесь концентрировали и растворяли в дихлорметане (30 мл) и снова экстрагировали NaHCO3 (водный раствор, насыщ. 15 мл). Органический слой концентрировали, получая метиловый эфир 4-карбамоил-4-{4-[4-(3,3-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества грязно-белого цвета (651 мг, 100%-ый сырой выход). Это твердое вещество переваодили на следующую стадию без дальнейшей очистки: LCMS MH=516.
Стадия 2: KOtBu (142 мг, 1,262 ммоль) при 0°C добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-{4-[4-(3,3-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (651 мг, 1,262 ммоль) в тетрагидрофуране (10 мл). Полученную реакционную смесь перемешивали при 0°C в течение 30 минут, после чего разбавляли дихлорметаном (20 мл). Смесь подкисляли HCl (1н., 2 мл, водный раствор.) и нейтрализовали NaHCO3 (насыщ. водный раствор, 2 мл) с последующим добавлением солевого раствора (8 мл) и дихлорметана (30 мл). Смесь экстрагировали, и водный слой снова экстрагировали дихлорметаном (2×40 мл). Органические слои объединяли и высушивали с MgSO4. Смесь фильтровали, и фильтрат концентрировали. Остаток растирали в простом диэтиловом эфире (50 мл) и фильтровали, получая 3-{4-[4-(3,3-дифтор-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (540 мг, 77%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 18/82, (ацетонитрил/0,1% H3PO4), 4,44 мин (99,9%); Т. пл.: 140-142°C; 1H ЯМР (ДМСО-d6) δ 1,57-1,71 (м, 2H, CH2), 1,76-2,08 (м, 3Н, СН2, CHH), 2,34-2,45 (м, 2Н, СН2), 2,45-2,47 (м, 1H, CHH), 2,53-2,68 (м, 3Н, CH2, CHH), 2,81-3,01 (м, 1H, CHH), 3,57 (с, 2H, CH2), 4,20-4,32 (м, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,28-7,38 (м, 4H, Ar), 7,41-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 21,38-21,71, 22,33, 31,18, 31,61 (т, JC-F=23,1 Гц,), 45,07, 51,12, 51,55, 57,48 (т, JC-F=27,5 Гц,), 60,56, 69,38, 114,94, 115,22, 121,05 (т, JC-F=241,0 Гц,), 127,67, 128,82, 129,78, 129,93, 133,30, 135,40, 137,34, 153,49, 167,99, 170,96, 172,81; LCMS MH=484; Вычислено для C26H27F2N3O4+1,3 H2O: C, 61,6; H, 5,89; N, 8,29; Найдено: С, 61,39; H, 5,61; N, 8,00.
5.215 3-(4-(4-((4-(МЕТИЛСУЛЬФОНИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
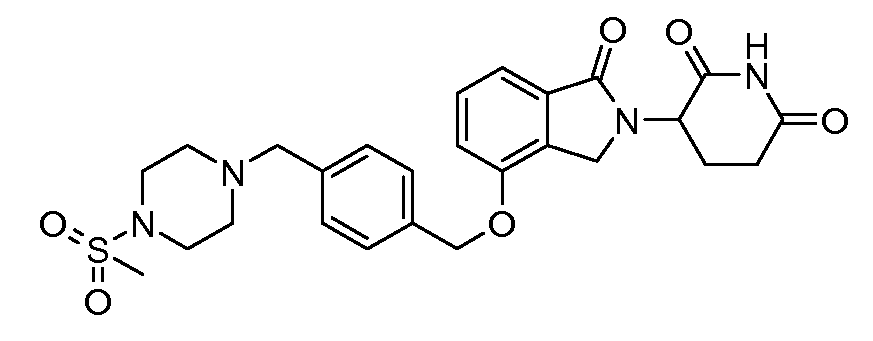
К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,455 г, 1,056 ммоль) в ацетонитриле (10 мл) добавляли 1-(метилсульфонил)пиперазин (0,225 г, 1,373 ммоль) и DIPEA (0,436 мл, 2,64 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 5,5 дней. Реакционную смесь разбавляли дихлорметаном (40 мл) и промывали водой (20 мл) и солевым раствором (20 мл). Органический слой затем высушивали (MgSO4) и, после фильтрации осушителя, растворитель концентрировали, получая 5-амино-4-(4-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат. Сырой продукт использовали на следующей стадии без дальнейшей очистки.
Трет-бутоксид калия (0,154 г, 1,373 ммоль) добавляли при 0°C к перемешиваемому раствору 5-амино-4-(4-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,590 г, 1,056 ммоль) в THF (20 мл). Реакционную смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь затем разбавляли дихлорметаном (50 мл) и подкисляли HCl (1н. водный раствор, 4 мл). Смесь промывали NaHCO3 (20 мл) и солевым раствором (20 мл). Водный слой снова экстрагировали дихлорметаном (2×30 мл). Объединенные органические слои были высушивали с MgSO4. После фильтрации осушителя растворитель выпаривали. Остаток перемешивали в смеси метанол/дихлорметан: 50/50. Фильтрат очищали флэш-Isco (сухая загрузка, градиент, метанол/дихлорметан: от 0/100 до 5/95 за 30 минут), элюируя продукт при 5/95. Растворитель затем упаривали, и остаток перемешивали в простом эфире. Твердое вещество отфильтровывали и высушивали, получая 3-(4-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,32 г, 2 стадии 58%-ый выход); Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, ацетонитрил/0,1% H3PO4: градиент 10/90-90/10 за 15 мин; 5 мин при 90/10: 6,23 мин (97,27%), 8,02 мин (2,25%); Т. пл.: 158-160°C; 1H ЯМР (ДМСО-d6) δ 1,87-2,08 (м, 1H, CHH), 2,31-2,48 (м, 5H, CH2, CH2, CHH), 2,53-2,69 (м, 1H, CHH), 2,86 (с, 3Н, CH3), 2,89-3,02 (м, 1H, CHH), 3,02-3,20 (м, 4H, CH2, CH2), 3,53 (с, 2H, CH2), 4,16-4,33 (м, 1H, CHH), 4,34-4,53 (м, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,25-7,40 (м, 4H, Ar), 7,40-7,55 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 33,55, 45,06, 45,41, 51,55, 51,71, 61,14, 69,35, 114,96, 115,22, 127,66, 128,90, 129,80, 129,93, 133,28, 135,38, 137,69, 153,46, 167,97, 170,96, 172,81; Вычислено для C26H30N4O6S+0,2 H2O: C, 58,90, H, 5,78, N, 10,57; Найдено: С, 58,62, H, 5,51, N, 10,40.
5.216 3-[1-ОКСО-4-(4-ПИПЕРИДИН-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
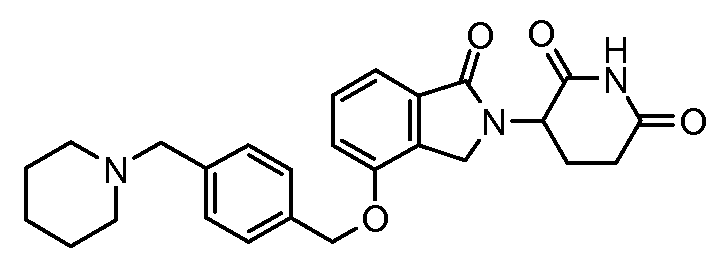
Стадия 1: Трифенилфосфин на полимерной подложке (1~1,5 ммоль/г, 2,10 г, 2,63 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты в THF (20 мл), с последующим добавлением диизопропил азодикарбоксилата (0,52 мл, 2,63 ммоль). После перемешивания в течение 15 минут, добавляли (4-пиперидин-1-илметил-фенил)-метанол (0,49 г, 2,39 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и затем фильтровали. Фильтрат упаривали и очищали на колонке с силикагелем, получая метиловый эфир 4-карбамоил-4-[1-оксо-4-(4-пиперидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты в форме масла (0,51 г, 88%-ый выход).
Стадия 2: Трет-бутоксид калия (0,12 г, 1,06 ммоль) добавляли в течение 10 минут при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-[1-оксо-4-(4-пиперидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,51 г, 1,06 ммоль) в THF (8 мл). Смесь гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=8). Смесь промывали этилацетатом (3×20 мл). Объединенные фазы этилацетата упаривали и очищали препаративной ВЭЖХ, получая 3-[1-оксо-4-(4-пиперидин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,07 г, 15%-ый выход); ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83 ацетонитрил/0,1% H3PO4, 4,88 мин (98,8%); Т. пл.: 186-188°C; 1H ЯМР (ДМСО-d6) d, 1,30-1,60 (м, 6H, 3CH2), 1,91-2,05 (м, 1H, CHH), 2,22-2,36 (м, 4H, 2CH2), 2,37-2,47 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 3,41 (с, 2H, CH2), 4,19-4,48 (м, 2H, ArCH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 23,99, 25,55, 31,21, 45,10, 51,58, 53,88, 62,54, 69,45, 114,97, 115,21, 127,59, 128,80, 129,81, 129,95, 133,31, 135,03, 138,58, 153,51, 168,01, 170,96, 172,83; LCMS MH=448; Вычислено для C26H29N3O4: C, 69,78; H, 6,53; N, 9,39, Найдено: С, 66,86; H, 6,15; N, 8,99.
5.217 3-{4-[4-(4-МЕТИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
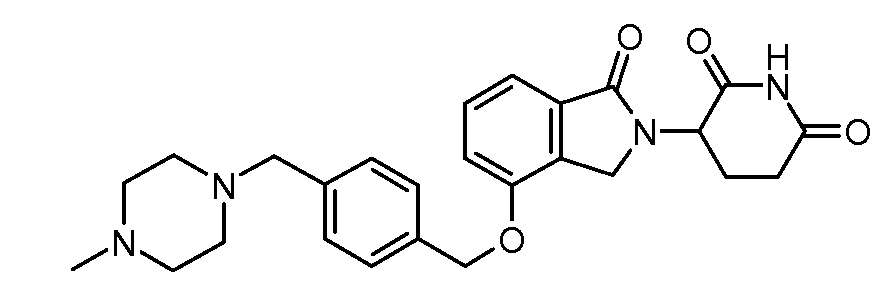
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,36 г, 1,85 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,45 г, 1,54 ммоль) в THF (20 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,37 мл, 1,88 ммоль). После перемешивания в течение 30 минут добавляли [4-(4-метил-пиперазин-1-илметил)-фенил]-метанол (0,41 г, 1,85 ммоль). Смесь перемешивали в течение трех часов, затем фильтровали, промывали метанолом (3×10 мл) и метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (колонка с амином, градиент MeOH/CH2Cl2 от 0% до 2% за 60 минут), получая метиловый эфир 4-карбамоил-4-{4-[4-(4-метил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как прозрачное масло (0,50 г, 66%-ый выход).
Стадия 2: Трет-бутоксид калия (0,11 г, 1,01 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-{4-[4-(4-метил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты (0,50 г, 1,01 ммоль) в THF (15 мл). Смесь перемешивали в течение десяти минут и гасили 1н. HCl (3 мл), нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7) и быстро экстрагировали этилацетатом (2×30 мл). Объединенные фазы этилацетата упаривали, получая твердое вещество грязно-белого цвета, которое перемешивали в этилацетате (10 мл) в течение одного часа. Суспензию фильтровали, получая 3-{4-[4-(4-метил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,12 г, 26%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 10/90 за 15 мин (ацетонитрил/0,1% H3PO4), 9,82 мин (99,7%); Т. пл.: 188-190°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,14 (с, 3H, CH3), 2,20-2,46 (м, 9H, CHH, CH2, CH2, CH2, CH2), 2,55-2,66 (м, 1H, CHH), 2,80-3,05 (м, 1H, CHH), 3,45 (с, 2H, CH2), 4,17-4,50 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,1 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,23-7,56 (м, 7H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,09, 45,72, 51,58, 52,52, 54,71, 61,74, 69,44, 114,98, 115,23, 127,62, 128,88, 129,81, 129,95, 133,31, 135,17, 138,18, 153,51, 168,01, 170,96, 172,82; LCMS MH=463; Вычислено для C26H30N4O4: C, 67,51; H, 6,54; N, 12,11; Найдено: C, 67,23; H, 6,67; N, 11,78.
5.218 ТРЕТ-БУТИЛОВЫЙ ЭФИР 4-{4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-БЕНЗИЛ}-ПИПЕРАЗИН-1-КАРБОНОВОЙ КИСЛОТЫ
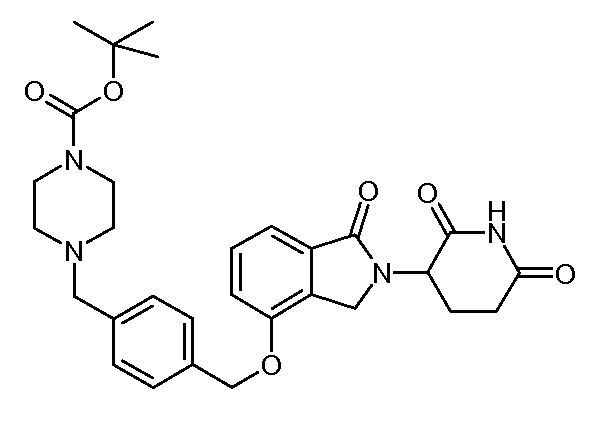
Стадия 1: К раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,8 г, 1,8 ммоль) в ацетонитриле добавляли трет-бутил-пиперазин-карбоксилат (0,86 г, 4,6 ммоль) и DIPEA (0,62 мл, 4,6 ммоль). После перемешивания при температуре окружающей среды в течение ночи, смесь концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл), концентрировали, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты в форме масла, которое использовали на следующей стадии без очистки.
Стадия 2: К раствору трет-бутилового эфира 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты (1,04 г, 1,8 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (0,3 г, 2,7 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая трет-бутиловый эфир 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты в форме масла (170 мг, 18%). Т. пл.: 180-182°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=5,03 мин (94%); LCMS MH=549, 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H, CH3, СН3, СН3), 1,87-2,13 (м, 1H, CHH), 2,30 (т, J=4,8 Гц, 4H, CH2, CH2), 2,40-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 3,30 (уш.с, 4H, CH2, CH2), 3,48 (с, 2H, CH2), 4,14-4,57 (м, 2H, CH2), 5,00-5,17 (м, 1H, NCH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,7 Гц, 4H, Ar), 7,45 (д, J=8,7 Гц, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 27,96, 31,13, 45,02, 51,51, 52,28, 61,55, 69,33, 78,64, 114,91, 115,18, 127,58, 128,90, 129,76, 129,89, 133,25, 135,25, 137,70, 153,43, 153,71, 167,92, 170,91, 172,76; Вычислено для C30H36N4O6+0,2 H2O: C, 65,25; H, 6,64; N, 10,15; Найдено: С, 64,96; H, 6,51; N, 10,11.
5.219 3-[1-ОКСО-4-(4-ПИПЕРАЗИН-1-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
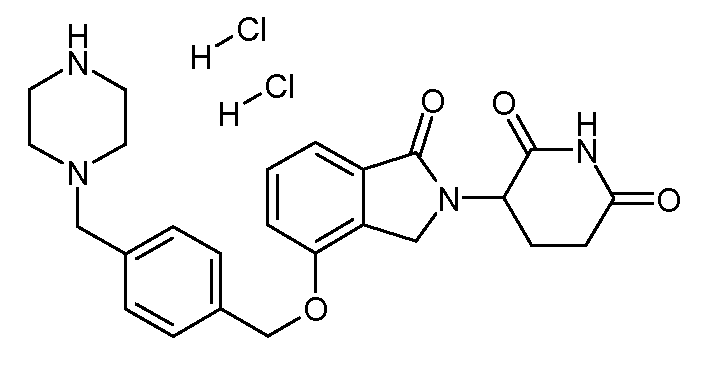
Стадия 1: К раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,8 г, 1,8 ммоль) в ацетонитриле добавляли трет-бутил-пиперазин-карбоксилат (0,86 г, 4,6 ммоль) и DIPEA (0,62 мл, 4,6 ммоль). После перемешивания при температуре окружающей среды в течение ночи, смесь концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты в форме масла, которое использовали на следующей стадии без очистки.
Стадия 3: К раствору трет-бутилового эфира 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты (1,04 г, 1,8 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (0,3 г, 2,7 ммоль). Смесь перемешивали в течение 15 минут при 0°C и гасили 5 мл 1н. раствора HCl, затем 15 мл насыщенного раствора NaHCO3. Смесь экстрагировали EtOAc (20 мл). Органический слой концентрировали в вакууме. Полученное масло очищали на колонке с силикагелем, элюируя CH2Cl2 и метанолом, получая трет-бутиловый эфир 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты в форме масла (170 мг, 18%). Т. пл.: 180-182°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=5,03 мин (94%); LCMS MH=549. 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H, СН3, СН3, СН3), 1,87-2,13 (м, 1Н, СНН), 2,30 (т, J=4,8 Гц, 4Н, СН2, СН2), 2,40-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 3,30 (уш.с, 4H, CH2, CH2), 3,48 (с, 2H, CH2), 4,14-4,57 (м, 2H, CH2), 5,00-5,17 (м, 1H, NCH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,7 Гц, 4H, Ar), 7,45 (д, J=8,7 Гц, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 27,96, 31,13, 45,02, 51,51, 52,28, 61,55, 69,33, 78,64, 114,91, 115,18, 127,58, 128,90, 129,76, 129,89, 133,25, 135,25, 137,70, 153,43, 153,71, 167,92, 170,91, 172,76. Вычислено для C30H36N4O6+0,2 H2o: C, 65,25; H, 6,64; N, 10,15; Найдено: С, 64,96; H, 6,51; N, 10,11.
Стадия 4: К раствору трет-бутилового эфира 4-{4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперазин-1-карбоновой кислоты (0,37 г, 0,675 ммоль) в CH2Cl2 (10 мл) добавляли гидрохлорид в растворе простого эфира (2,0 м, 1,6 мл, 8 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали. Полученное твердое вещество перемешивали с простым эфиром, получая 3-[1-оксо-4-(4-пиперазин-1-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (240 мг, 69%). Т. пл.: 196-198°C; Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=5,10 мин (96%); 1H ЯМР (ДМСО-d6) δ 1,90-2,07 (м, 1H, CHH), 2,35-2,45 (м, 1H, CHH), 2,59 (д, J=15,7 Гц, IH, CHH), 2,84-3,02 (м, 1H, CHH), 3,09-3,32 (уш., 2H, CH2), 3,41-3,51 (уш., 4H, CH2, CH2), 4,22-4,53 (м, 4H, CH2, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,29 (с, 7H, CH2), 7,28-7,38 (м, 7H, Ar), 7,43-7,54 (м, 4H, Ar), 7,55-7,71 (м, 14H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 15,05, 22,32, 31,13, 45,02, 47,29, 51,52, 68,94, 114,90, 115,31, 127,79, 129,78, 129,90, 131,44, 133,30, 153,30, 167,89, 170,91, 172,76; LCMS MH=449. Вычислено для C25H28N4O4+2,1 HCl+1 H2O: С, 55,29; H, 5,96; N, 10,32; Cl, 13,71%, Найдено: С, 55,39; H, 6,13; N, 10,19; Cl: 13,61.
5.220 3-{4-[4-(4-МЕТИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
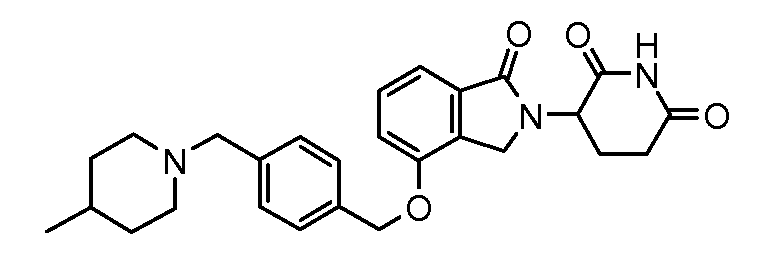
4-Метилпиперидин (0,49 г, 4,94 ммоль) добавляли к перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,71 г, 1,65 ммоль) в DMF (15 мл) при 50°C в течение ночи. К смеси добавляли карбонат калия (0,23 г, 1,65 ммоль), и смесь нагревали при 90°C в течение ночи. Смесь концентрировали, получая масло, которое перемешивали в этилацетате (10 мл) в течение ночи. Суспензию фильтровали, получая коричневый фильтрат, который упаривали и очищали на колонке с силикагелем с MeOH (растворитель B)/дихлорметан (растворитель A) в качестве элюентов, получая 3-{4-[4-(4-метил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,22 г, 30% выход за 3 стадии); Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,16 мин (98,1%); Т. пл.: 189-191ºC; 1H ЯМР (ДМСО-d6) δ 0,88 (д, J=6,4 Гц, 3H, CH3), 1,04-1,20 (м, 2H, CHH), 1,23-1,41 (м, 1H, CHH), 1,49-1,63 (м, 2H, CH2), 1,81-2,04 (м, 3H, CH, CH2), 2,36-2,48 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,69-2,82 (м, 2H, CH2), 2,83-2,99 (м, 1H, CHH), 3,38-3,52 (м, 2H, CH2), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,79, 22,36, 30,23, 31,21, 33,89, 45,10, 51,58, 53,22, 62,10, 69,44, 114,97, 115,23, 127,61, 128,86, 129,81, 129,94, 133,31, 135,12, 153,51, 168,01, 170,96, 172,83; LCMS MH=462; Вычислено для C27H31N3O4+0,1 H2O: С, 69,99; H, 6,79; N, 9,07, Найдено: С, 69,84; H, 6,81; N, 9,12.
5.221 3-{4-[4-(4-ТРЕТ-БУТИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
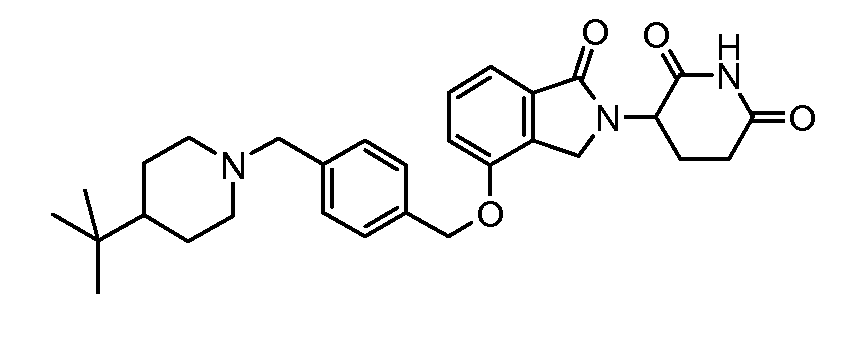
Стадия 1: Метиловый эфир 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,63 г, 1,46 ммоль) добавляли при 70°C к перемешиваемому раствору 4-трет-бутилпиперидин гидрохлорида (0,78 г, 4,37 ммоль) и диизопропилэтиламина (0,96 мл, 5,83 ммоль) в DMF (15 мл). Смесь нагревали в течение 5 часов и затем упаривали и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-{4-[4-(4-трет-бутил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты как светло-коричневое маслянистое твердое вещество (1,23 г), которое использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемому раствору метилового эфира 4-{4-[4-(4-трет-бутил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты в THF (15 мл) при температуре окружающей среды добавляли трет-бутоксид калия (0,33 г, 2,90 ммоль). Смесь перемешивали в течение 30 минут или пока LCMS не показала отсутствие исходного материала. Смесь гасили 1н. HCl (2 мл), получая прозрачный коричневый раствор, и затем нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7). Смесь экстрагировали этилацетатом (2×30 мл), промывали солевым раствором и концентрировали до твердого вещества коричневого цвета. Это вещество очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая 3-{4-[4-(4-трет-бутил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как светло-коричневое твердое вещество (0,56 г, 76%-ый выход); Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 in 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% Н3РО4), 5,62 мин (96,6%); Т. пл.: 208-210°C; 1H ЯМР (ДМСО-d6) δ 0,82 (с, 9H, 3CH3), 0,88-1,05 (м, 1H, CHH), 1,09-1,31 (м, 2H, CH2), 1,49-1,65 (м, 2H, CH2), 1,83 (т, J=11,5 Гц, 2H, CH2), 1,92-2,06 (м, 1H, CHH), 2,34-2,47 (м, 1H, CHH), 2,54-2,65 (м, 1H, CHH), 2,79-3,00 (м, 3H, CH, CH2), 3,38-3,47 (м, 2H, CH2), 4,20-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,25-7,37 (м, 4H, Ar), 7,39-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 26,44, 27,19, 31,21, 31,84, 45,09, 45,94, 51,58, 53,98, 62,09, 69,45, 114,97, 115,21, 127,61, 128,77, 129,81, 129,94, 133,31, 135,04, 138,64, 153,51, 168,01, 170,96, 172,82; LCMS MH=504; Вычислено для C30H37N3O4+0,1 H2O: C, 71,29; H, 7,42; N, 8,31, Найдено: С, 70,96; H, 7,63; N, 8,32.
5.222 3-{4-[4-(4-ГИДРОКСИ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
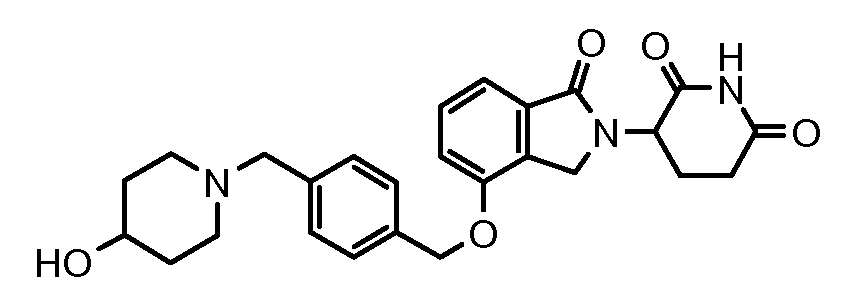
Стадия 1: К перемешиваемому бесцветному раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,51 г, 1,19 ммоль) в ацетонитриле (15 мл) добавляли пиперидин-4-ол гидрохлорид (0,16 г, 1,19 ммоль) и N-этил-N-изопропилпропан-2-амин (0,49 мл, 2,98 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли пиперидин-4-ол гидрохлорид (0,09 г) и DIPEA (0,4 мл) и нагревали при 50°C в течение ночи. Смесь очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-карбамоил-4-{4-[4-(4-гидрокси-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме твердого вещества грязно-белого цвета (0,75 г, 78%-ый выход).
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((4-гидроксипиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,67 г, 1,35 ммоль) в THF (30 мл) при температуре окружающей среды добавляли 2-метилпропан-2-олат калия (0,61 г, 5,41 ммоль). Смесь перемешивали в течение десяти минут и затем гасили 1н. HCl (2 мл) и нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7). Смесь экстрагировали этилацетатом (2×20 мл). Объединенные фазы этилацетата очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая 3-{4-[4-(4-гидрокси-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,24 г, 38%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,16 мин (97,3%); Т. пл.: 204-206°C; 1H ЯМР (ДМСО-d6) δ 1,28-1,48 (м, 2H, CH2), 1,58-1,79 (м, 2Н, СН2), 1,89-2,15 (м, 3Н, CHH, СН2), 2,37-2,47 (м, 1Н, CHH), 2,53-2,71 (м, 4H, CH2, CHH, CHH), 2,83-2,99 (м, 1H, CHH), 3,39-3,49 (м, 3H, CH2, CHH), 4,21-4,47 (м, 2H, CH2), 4,53 (д, J=4,2 Гц, 1H, OH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 34,37, 45,10, 50,82, 51,58, 61,77, 66,26, 69,44, 114,97, 115,21, 127,62, 128,80, 129,81, 129,95, 133,31, 135,10, 138,58, 153,51, 168,01, 170,98, 172,83; LCMS MH=464; Вычислено для C26H29N3O5+0,5 H2O: C, 66,09; H, 6,40; N, 8,89, Найдено: С, 65,95; H, 6,31; N, 8,74.
5.223 3-{4-[4-(4-ЭТОКСИМЕТИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
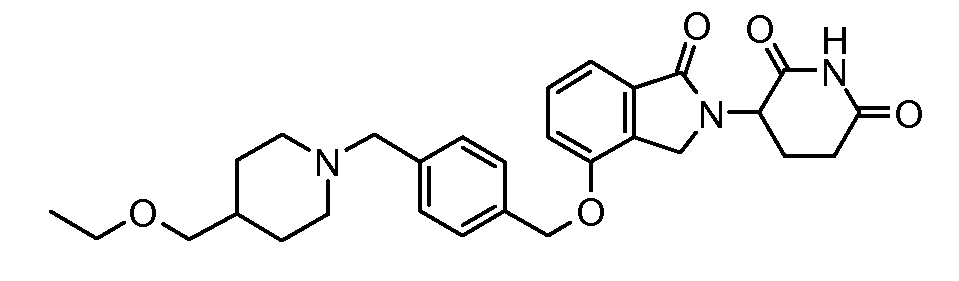
Стадия 1: К перемешиваемому раствору 5-амино-4-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,67 г, 1,54 ммоль) в ацетонитриле (15 мл) в ванне со льдом добавляли 4-(этоксиметил)пиперидин (0,44 г, 3,09 ммоль). Смесь перемешивали при температуре окружающей среды в течение получаса, с последующим добавлением одного эквивалента DIPEA (0,26 мл), и раствор перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли 0,17 г 4-(этоксиметил)пиперидина и 0,30 мл DIPE. Смесь нагревали при 70°C в течение трех часов и затем охлаждали до температуры окружающей среды. Раствор выпаривали до масла, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая метиловый эфир 4-карбамоил-4-{4-[4-(4-этоксиметил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты как пенистое твердое вещество, которое использовали на следующей стадии без дальнейшей очистки.
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-(4-((4-(этоксиметил)пиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,83 г, 1,54 ммоль) в THF (10 мл) в ванне со льдом добавляли калия 2-метилпропан-2-олат (0,52 г, 6,18 ммоль). Смесь перемешивали в течение десяти минут и гасили 1н. HCl (4 мл), получая прозрачный раствор, затем нейтрализовали насыщенным раствором бикарбоната натрия (7 мл до рН=8). Полученную смесь экстрагировали этилацетатом (2×20 мл) и очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 1% до 9% за 50 минут), получая 3-{4-[4-(4-этоксиметил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,45 г, 58%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (ацетонитрил/0,1% H3PO4), 5,38 мин (96,7%); Т. пл.: 168-170°C; 1H ЯМР (ДМСО-d6) δ 1,08 (т, J=7,0 Гц, 3H, CH3), 1,12-1,23 (м, 2H, CH2), 1,40-1,54 (м, 1H, CHH), 1,55-1,67 (м, 2H, CH2), 1,81-2,04 (м, 3H, CHH, CH2), 2,36-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,72-2,82 (м, 2H, CH2), 2,84-2,99 (м, 1H, CHH), 3,19 (д, J=6,2 Гц, 2H, CH2), 3,34-3,48 (м, 4H, CH2, CH2), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,26-7,37 (м, 4H, Ar), 7,39-7,54 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 15,10, 22,36, 28,92, 31,20, 35,80, 45,10, 51,58, 52,93, 62,19, 65,44, 69,45,74,83, 114,97, 115,23, 127,61, 128,80, 129,81, 129,95, 133,31, 135,07, 138,64, 153,53, 168,01, 170,98, 172,83; LCMS MH=506; Вычислено для C29H35N3O5+0,5 H2O: С, 67,68; H, 7,05; N, 8,17, Найдено: С, 67,42; H, 7,20; N, 8,05.
5.224 3-(1-ОКСО-4-(4-((4-(ТРИФТОРМЕТИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
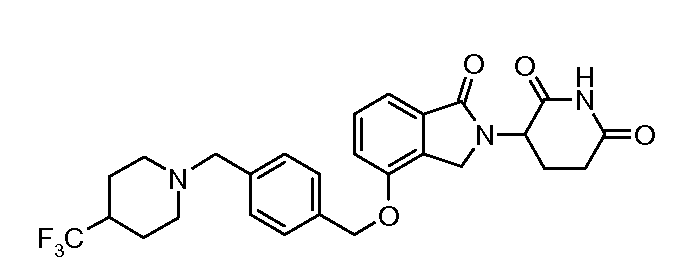
Стадия 1: 5-Амино-5-оксо-2-(1-оксо-4-(4-((4-(трифторметил)пиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)трет-бутилпентаноат
К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (450 мг, 0,95 ммоль) и N,N-диизопропилэтиламина (0,42 мл, 2,38 ммоль) в MeCN (9 мл) добавляли 4-(трифторметил)пиперидин гидрохлорид (271 мг, 1,43 ммоль). Смесь перемешивали в течение 5 часов при 60°C. Сырую смесь разделяли между EtOAc (150 мл) и 1н. NaHCO3 (30 мл). Основной водный слой промывали дополнительным количеством EtOAc (~100 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая 5-амино-5-оксо-2-(1-оксо-4-(4-((4-(трифторметил)пиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)трет-бутилпентаноат в форме масла (570 мг). LC/MS M+H=590. Сырой продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 2: 3-(1-оксо-4-(4-((4-(трифторметил)пиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион
К охлажденному раствору 5-амино-5-оксо-2-(1-оксо-4-(4-((4-(трифторметил)пиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)трет-бутилпентаноата (561 мг, 0,95 ммоль) в THF (10 мл) в ванне со льдом добавляли KOtBu (128 мг, 1,14 ммоль) в форме твердого вещества в одной части. Ванну со льдом удаляли, и реакционную смесь перемешивали в течение ~2 часов при температуре окружающей среды. Добавляли дополнительное количество KOtBu (28 мг), и реакционную смесь перемешивали в течение ~2 часов. Реакционную смесь охлаждали в ванне со льдом и гасили уксусной кислотой (0,163 мл, 2,85 ммоль). Смесь концентрировали в вакууме, и полученное твердое вещество разделяли между EtOAc (100 мл) и 1н. NaHCO3 (30 мл). Водный слой экстрагировали EtOAc (50 мл), и объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество белого цвета (~400 мг). Твердое вещество растирали с Et2O (40 мл) при помощи разрушения ультразвуком, собирали фильтрацией и промывали дополнительным количеством Et2O. Твердое вещество высушивали отсасыванием, и осуществляли второе растирание, используя воду (120 мл). Оставшееся твердое вещество высушивали отсасыванием и затем высушивали в вакуумном сушильном шкафу при 40°C в течение ночи, получая 3-(1-оксо-4-(4-((4-(трифторметил)пиперидин-1-ил)метил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (328 мг, 67%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 6,16 мин (96,5%); Т. пл.: 178-180°C; 1H ЯМР (ДМСО-d6) δ 1,34-1,55 (м, 2H, CHH, CHH), 1,66-1,82 (м, 2H, CHH, CHH), 1,87-2,05 (м, 3H, CHH, CHH, CHH), 2,14-2,35 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,65 (м, 1H, CHH), 2,78-3,00 (м, 3H, CHH, CHH, CHH), 3,48 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH),4,42 (д, J=17,4Гц, 1H, CHH),5,11 (дд, J=5,0, 13,3 Гц, 1H, CHH), 5,17-5,28 (м, 2H, CH2), 7,21-7,39 (м, 4H, Ar), 7,39-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 24,19, 31,18, 38,35, 39,07, 45,06, 51,39, 51,55, 61,59, 69,39, 114,96, 115,20, 127,64, 127,82 (кв, J=278 Гц, CF3), 128,79, 129,80, 129,93, 133,30, 135,22, 138,11, 153,49, 167,99, 170,96, 172,81; Часть квартета (2 сигнала) от CF3C замаскирована пиком ДМСО около δ 40 м.д., LC/MS M+H=516; Вычислено для C27H28F3N3O4+0,35 H2O: C, 62,15; H, 5,54; N, 8,05; F, 10,92, Найдено: C, 62,13; H, 5,48; N,8,06; F, 9,84.
5.225 3-(4-(4-(((2R,6S)-2,6-ДИМЕТИЛПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
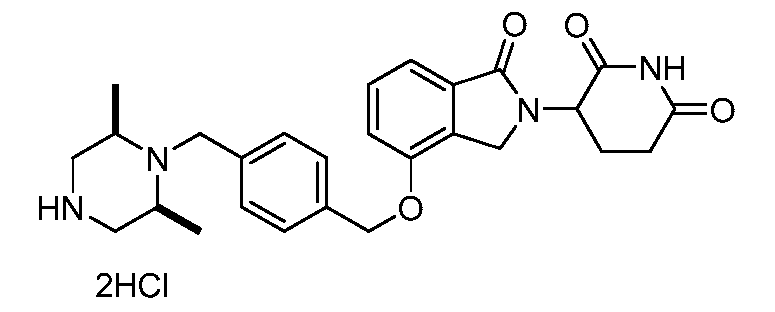
Стадия 1: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (400 мг, 0,846 ммоль) в ацетонитриле (10 мл) добавляли (3R,5S)-трет-бутил 3,5-диметилпиперазин-1-карбоксилат (236 мг, 1,099 ммоль), N,N-диизопропилэтиламин (328 мг, 2,54 ммоль) и йодид натрия (25 мг, 0,17 ммоль). Сформированную смесь нагревали при 70°C в течение 2 дней. Реакционную смесь концентрировали, остаток разделяли между этилацетатом (50 мл) и водным насыщенным раствором бикарбоната натрия (10 мл), органический слой промывали водой, солевым раствором и высушивали над MgSO4, и растворитель выпаривали под вакуумом, остаток очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 50 минут), получая (3R,5S)-4-(4-((2-(5-амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)-3,5-диметилпиперазин-1-трет-бутилкарбоксилат (480 мг, 87% выход).
Стадия 2: К смеси (3R,5S)-4-(4-((2-(5-амино-1-трет-бутокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)-3,5-диметилпиперазин-1-трет-бутилкарбоксилата (480 мг, 0,738 ммоль) в THF добавляли при 0°C трет-бутоксид калия (83 мг, 0,738 ммоль). Смесь перемешивали при 0°C в течение 10 минут, нагревали до температуры окружающей среды и перемешивали в течение 4 часов. Добавляли дополнительное количество трет-бутоксида калия (25 мг, 0,22 ммоль) и смесь перемешивали в течение еще 2 часов. Реакционную смесь гасили уксусной кислотой (0,2 мл), THF выпаривали, и остаток разделяли между этилацетатом (100 мл) и водным насыщенным раствором бикарбоната натрия (10 мл). Органическую фазу промывали солевым раствором, высушивали над MgSO4. Растворитель удаляли, и остаток очищали ISCO (40 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 50 минут), получая (3R,5S)-4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метанол-ил)бензил)-3,5-диметилпиперазин-1-трет-бутилкарбоксилат (120 мг, 28%-ый выход); 1H ЯМР (ДМСО-d6) δ 0,94 (д, J=6,0 Гц, 6H, CH3, CH3), 1,38 (с, 9H, CH3, CH3, CH3), 1,84-2,11 (м, 1H, CHH), 2,36-2,49 (м, 3H, СНН, CH2), 2,52-2,75 (м, 3H, СНН, CH2), 2,81-3,06 (м, 1H, СНН), 3,62-3,80 (м, 4H, CH2, CH, CH), 4,18-4,51 (м, 2H, CH2), 5,06-5,16 (м, 1H, CH), 5,18-5,26 (м, 2H, CH2), 7,29-7,52 (м, 7H, Ar), 10,84-11,10 (м, 1H, NH).
Стадия 3: К смеси (3R,5S)-4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)-3,5-диметилпиперазин-1-трет-бутилкарбоксилата (120 мг, 0,208 ммоль) в дихлорметане (40 мл) добавляли раствор HCl в простом эфире (2н., 5 мл, 10 ммоль), смесь перемешивали при температуре окружающей среды в течение 2 дней. Сформированный осадок отделяли фильтрацией, получая 3-(4-(4-(((2R,6S)-2,6-диметилпиперазин-1-ил)метил)-бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (80 мг, 75%-ый выход); Т. пл.: 253-255°C; 1H ЯМР (ДМСО-d6) δ 1,16-1,40 (м, 6H, CH3, СН3), 1,97 (д, J=5,3 Гц, 1H, CHH), 2,24-2,43 (м, 1H, CHH), 2,58 (д, J=2,1 Гц, 1H, CHH),2,71-3,06 (м, 3H, CH2, CHH), 3,07-3,59 (м, 4H, CH2, CH, CH), 4,04-4,54 (м, 4H, CH2, CH2), 5,02 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,22 (с, 2H, CH2), 7,21-7,34 (м, 2H, Ar), 7,38-7,56 (м, 5H, Ar); 13C ЯМР (ДМСО-d6) δ 15,82, 22,27, 31,03, 38,23, 45,25, 45,90, 50,32, 51,69, 68,96, 115,10, 115,39, 127,82, 129,70, 129,86, 129,97, 133,11, 136,86, 153,24, 168,25, 170,87, 172,94; LCMS MH-2HCl=477; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент (CH3CN/0,1% HCOONH4) 5/95-95/5 за 5 мин, 95/5 10 мин: tR=4,21 (100%); Вычислено для C27H34N4O4Cl2+0,9 H2O: C, 57,33; H, 6,38; N, 9,90; Найдено: С, 57,36; H, 6,36; N, 9,80.
5.226 3-(1-ОКСО-4-(4-((3-ОКСОПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
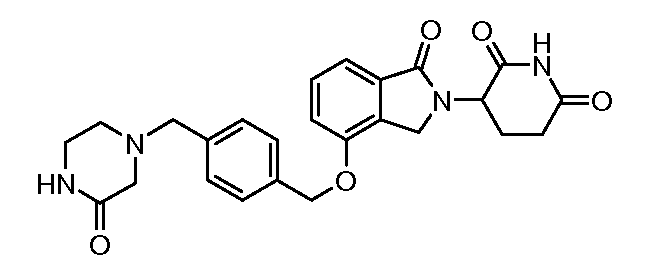
К суспензии 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (450 мг, 0,951 ммоль, получение описано здесь) в MeCN (9 мл) добавляли пиперазин-2-он (191 мг, 1,903 ммоль) и N,N-диизопропилэтиламин (0,249 мл, 1,427 ммоль). Смесь нагревали до 60°C и перемешивали в течение ~18 часов и затем давали охладиться до температуры окружающей среды. После охлаждения образовывалось твердое вещество, которое диспергировали добавлением DMF (3 мл) и обработкой ультразвуком. Смесь охлаждали в ванне со льдом, и твердый KOtBu (299 мг, 2,66 ммоль) добавляли в одной части. Добавляли сухой THF (2 мл), и ванну со льдом удаляли. Смесь перемешивали при температуре окружающей среды в течение ночи. Смесь охлаждали до 0°C в ванне со льдом и затем гасили уксусной кислотой (254 мкл, 4,44 ммоль). Смесь концентрировали в вакууме, и масляный остаток разделяли между EtOAc (200 мл) и 1н. NaHCO3 (40 мл). Продукт разделяли в водном и в органическом слоях. Все слои объединяли, подкисляли HCl и концентрировали, получая твердое вещество. Это твердое вещество растирали с обильным количеством DMF, смесь фильтровали, и нерастворенные твердые частицы промывали дополнительным количеством DMF (полный объем фильтрата ~150 мл). Фильтрат концентрировали до масляного остатка, который повторно растворяли в DMF/1н. HCl (6 мл/4 мл) и затем очищали инъекцией на колонку для препаративной ВЭЖХ C-18. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 30% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, получая 3-(1-оксо-4-(4-((3-оксопиперазин-1-ил)метил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (177 мг, 43%-ый выход): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 4,58 мин (98,3%); Т. пл.: 245-247°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,51-2,63 (м, 3H, CHH, CH2), 2,80-2,99 (м, 3H, CHH, CH2), 3,06-3,23 (м, 2H, CH2), 3,54 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,21-7,39 (м, 4H, Ar), 7,41-7,56 (м, 3H, Ar), 7,74 (с, 1H, NH), 10,96 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,07, 48,35, 51,55, 56,62, 60,40, 69,38, 114,97, 115,22, 127,70, 128,91, 129,80, 129,95, 133,30, 135,49, 137,28, 153,48, 167,56, 167,99, 170,96, 172,81; LC/MS M+H=463; Вычислено для C25H26N4O5: С, 64,92; H, 5,67; N, 12,11, Найдено: С, 61,40; H, 5,38; N, 11,45.
5.227 3-{4-[4-(4-ДИМЕТИЛАМИНО-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
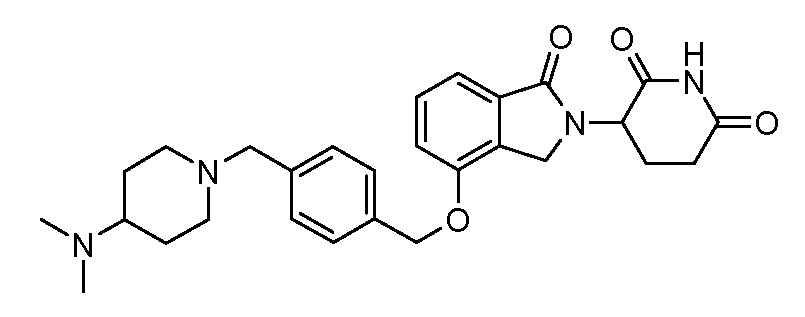
Стадия 1: Получение метилового эфира 4-карбамоил-4-{4-[4-(4-изопропил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,674 г, 1,418 ммоль) в ацетонитриле (15 мл) при температуре окружающей среды добавляли N,N-диметилпиперидин-4-амин (0,545 г, 4,25 ммоль). Смесь перемешивали в течение десяти минут и упаривали, получая масло. Это масло перемешивали в метиленхлориде (30 мл) и воде (10 мл). Фазу метиленхлорида отделяли и упаривали, получая метиловый эфир 4-карбамоил-4-{4-[4-(4-изопропил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме масла (0,76 г, 103%-ый сырой выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение 3-{4-[4-(4-диметиламино-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(4-(4-((4-(диметиламино)пиперидин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,76 г, 1,454 ммоль) в THF (20 мл) в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,32 г, 2,90 ммоль). Смесь перемешивали в течение десяти минут и добавляли 1н. HCl (2 мл до рН=3), затем нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7). Смесь перемешивали с этилацетатом (50 мл). Органическую фазу отделяли и промывали солевым раствором (20 мл) и концентрировали, получая твердое вещество грязно-белого цвета. Это вещество перемешивали в ацетонитриле (4 мл) при 70°C в течение получаса и фильтровали, получая 3-{4-[4-(4-диметиламино-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,18 г, 25%-ый выход); Т. пл. 209-211°C; 1H ЯМР (ДМСО-d6) δ 1,35 (кв.д, J=3,8, 11,8 Гц, 2H, CH2), 1,61-1,76 (м, 2H, CH2), 1,82-2,08 (м, 4H, CH2, CHH, CH), 2,14 (с, 6H, 2CH3), 2,34-2,47 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,74-3,01 (м, 3H, CH2, CHH), 3,43 (с, 2H, CH2), 4,19-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,27-7,37 (м, 4H, Ar), 7,39-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); I3C ЯМР (ДМСО-d6) δ 22,36, 28,05, 31,21, 41,49, 45,09, 51,58, 52,41, 61,61, 61,80, 69,45, 114,97, 115,21, 127,62, 128,77, 129,81, 129,95, 133,31, 135,09, 138,58, 153,51, 168,01, 170,96, 172,82, LC/MS (M+l)+=491; Вычислено для C28H34N4O4+0,2 H2O: C, 68,05; H, 7,02; N, 11,34, Найдено: С, 67,88; H, 6,88; N, 11,19.
5.228 3-{4-[4-(4-ИЗОПРОПИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
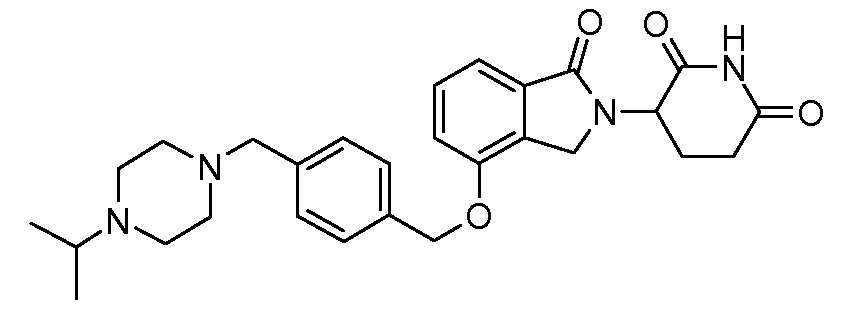
К раствору смеси (~1:1) 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,25 г, 0,564 ммоль) и 3-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,225 г, 0,564 ммоль) в ацетонитриле при температуре окружающей среды добавляли N-этил-N-изопропилпропан-2-амин (0,292 г, 2,256 ммоль), затем 1-изопропилпиперазин (0,174 г, 1,354 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение ночи. Белую суспензию упаривали под вакуумом, чтобы избавиться от ацетонитрила. Полученное твердое вещество белого цвета перемешивали в воде (40 мл) и метиленхлориде (2×40 мл). Объединенные фазы метиленхлорида снова промывали водой (50 мл) и затем упаривали в вакууме, получая белое маслянистое твердое вещество, которое перемешивали в простом диэтиловом эфире (25 мл) в течение ночи. Суспензию фильтровали, получая твердое вещество грязно-белого цвета, которое смешивали с ацетонитрилом (4 мл) и перемешивали при 50°C на масляной бане в течение получаса, затем суспензию фильтровали, получая 3-{4-[4-(4-изопропил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,187 г, 34%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 3,94 мин (95,8%); Т. пл.: 193-195°C; 1H ЯМР (ДМСО-d6) δ 0,94 (д, J=6,4 Гц, 6H, 2CH3), 1,91-2,04 (м, 1H, CHH), 2,21-2,48 (м, 9H, 4CH2, CH), 2,53-2,67 (м, 2H, CHH, CHH), 2,82-2,99 (м, 1H, CHH), 3,44 (с, 2H, CH2), 4,20-4,47 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,1 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,26-7,36 (м, 4H, Ar), 7,38-7,54 (м, 3Н, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,22, 22,36, 31,21, 45,09, 47,95, 51,58, 53,04, 53,55, 61,81, 69,44, 114,97, 115,23, 127,62, 128,86, 129,81, 129,95, 133,31, 135,13, 138,24, 153,51, 168,01, 170,98, 172,83. Вычислено для C28H34N4O4+0,1 H2O: C, 68,30; H, 7,00; N, 11,38, Найдено: С, 68,21; H, 6,61; N, 11,19.
5.229 3-{1-ОКСО-4-[4-(4-ФЕНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
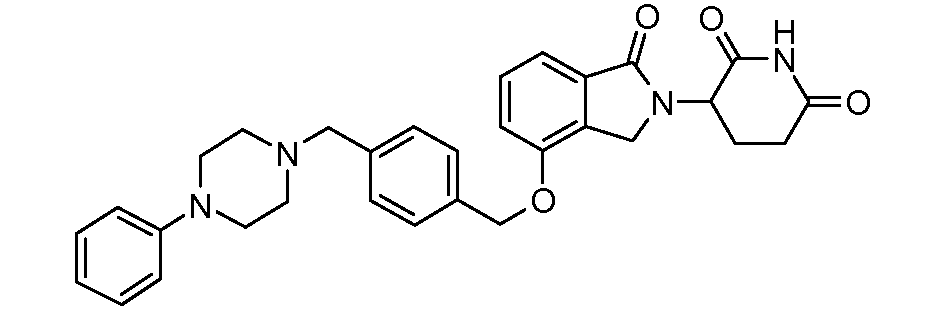
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,50 г, 1,13 ммоль) в CH3CN (15 мл) при температуре окружающей среды добавляли N-этил-N-изопропилпропан-2-амин (0,373 мл, 2,256 ммоль), затем 1-фенилпиперазин (0,257 мл, 1,692 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и полученное твердое вещество белого цвета перемешивали в воде (50 мл) и экстрагировали метиленхлоридом (2×80 мл). Объединенные фазы метиленхлорида снова промывали водой (50 мл), солевым раствором (30 мл) и упаривали до твердого вещества белого цвета, которое перемешивали в ацетонитриле (8 мл) при 50°C в течение одного часа, затем фильтровали, высушивали в вакуумном сушильном шкафу, получая 3-{1-оксо-4-[4-(4-фенил-пиперазин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,316 г, 53%-ый выход); Т. пл.: 195-197°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 4,70 мин (95,43%). 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,53-2,65 (м, 2H, CHH, CHH), 2,83-2,99 (м, 1H, CHH), 3,12 (т, J=5,1 Гц, 4H, CH2, CH2), 3,50-3,62 (м, 2H, CH2), 4,20-4,48 (м, 2H, CH2), 5,11 (дд, 5,1, 13,2 Гц, 1H, NCH), 5,20-5,30 (м, 2H, CH2), 6,76 (т, J=7,3 Гц, 1H, Ar), 6,91 (д, J=7,9 Гц, 2H, Ar), 7,15-7,25 (м, 2H, Ar), 7,28-7,41 (м, 4H, Ar), 7,42-7,55 (м, 3Н, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,09, 48,18, 51,58, 52,52, 61,71, 69,41, 114,97, 115,24, 115,35, 118,76, 127,68, 128,86, 129,01, 129,82, 129,95, 133,32, 135,30, 137,93, 150,98, 153,50, 168,01, 170,98, 172,83, LC/MS (M+l)+=525; Вычислено для C31H32N4O4: C, 70,97; H, 6,15; N, 10,68, Найдено: С, 70,69; H, 6,01; N, 10,49.
5.230 3-{4-[4-(4-ЦИКЛОПРОПАНСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
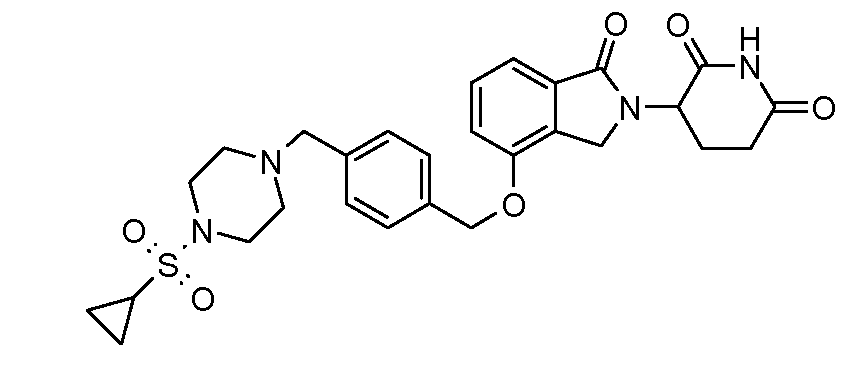
Стадия 1: Трет-бутиловый эфир 4-циклопропансульфонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (1,3 г, 6,98 ммоль) в безводном DCM (10 мл) при температуре окружающей среды добавляли TEA (1,167 мл, 8,38 ммоль) и циклопропансульфонил хлорид (1,079 г, 7,68 ммоль). Образовывалось твердое вещество белого цвета, и смесь перемешивали в течение 2 часов. Реакционную смесь разбавляли DCM (40 мл) и промывали водой (25 мл). Органический слой высушивали MgSO4 и концентрировали, получая трет-бутиловый эфир 4-циклопропансульфонил-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (2,3 г, 113%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки.
LCMS MH=291.
Стадия 2: 1-(Циклопропилсульфонил)пиперазин гидрохлорид
К перемешиваемому раствору 4-(циклопропилсульфонил)пиперазин-1-трет-бутилкарбоксилата (2,3 г, 7,92 ммоль) в DCM (Объем: 10 мл) при температуре окружающей среды добавляли HCl в простом эфире (11,88 мл, 23,76 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 22 часов, и твердое вещество образовывалось в течение реакции. К суспензии добавляли простой диэтиловый эфир (20 мл) и перемешивали в течение 10 минут, после чего отфильтровывали. Твердое вещество белого цвета промывали простым диэтиловым эфиром (2×15 мл) и высушивали при отсасывании, получая 1-(циклопропилсульфонил)пиперазин гидрохлорид в форме твердого вещества (1,51 г, 84%-ый выход); LCMS MH=191; 1H ЯМР (ДМСО-d6) δ 0,85-1,09 (м, 4H, СН2, СН2), 2,63-2,81 (м, 1Н, СН), 3,06-3,23 (м, 4Н, СН2, СН2), 3,33-3,57 (м, 4Н, СН2, СН2), 9,54 (уш.с, 2Н, NH2Cl).
Стадия 3: 3-{4-[4-(4-Циклопропансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,677 ммоль) и 1-(циклопропилсульфонил)пиперазин гидрохлорида (230 мг, 1,015 ммоль) в ацетонитриле (Объем: 10 мл) при температуре окружающей среды добавляли DIPEA (0,355 мл, 2,030 ммоль). Суспензия становилась прозрачной, и полученную смесь перемешивали при температуре окружающей среды для дальнейшей реакции. Реакционную смесь перемешивали при температуре окружающей среды в течение 20 часов, после чего добавляли EtOAc (50 мл) и NaHCO3 (водный раствор, насыщ., 20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4. Органический слой концентрировали, и остаток очищали силикагель-хроматографией, получая 3-{4-[4-(4-циклопропансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (227 мг, 61%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, CH3CN/0,1% H3PO4, 4,09 мин (99,9%); Т. пл. 145-147°C; 1H ЯМР (ДМСО-d6) δ 0,86-1,05 (м, 4H, CH2, СН2), 1,91-2,04 (м, 1Н, CHH), 2,34-2,47 (м, 5H, CH2, CH2, CHH), 2,53-2,66 (м, 2H, CHH, СН), 2,81-3,01 (м, 1Н, СНН), 3,11-3,24 (м, 4Н, СН2, СН2), 3,52 (с, 2Н, СН2), 4,25 (д, J=17,6 Гц, 1Н, СНН), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,27-7,38 (м, 4H, Ar), 7,40-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 3,75, 22,34, 24,46, 31,16, 45,06, 45,80, 51,55, 51,85, 61,20, 69,35, 114,94, 115,22, 127,67, 128,90, 129,80, 129,93, 133,28, 135,37, 137,69, 153,46, 167,97, 170,96, 172,81; LCMS MH=553; Вычислено для C28H32N4O6S+0,5 H2O+0,15 CH2Cl2: C, 58,86; H, 5,84; N, 9,75; Найдено: С, 58,53; H, 5,47; N, 9,57.
5.231 3-{4-[4-(4-ЦИКЛОГЕКСАНСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
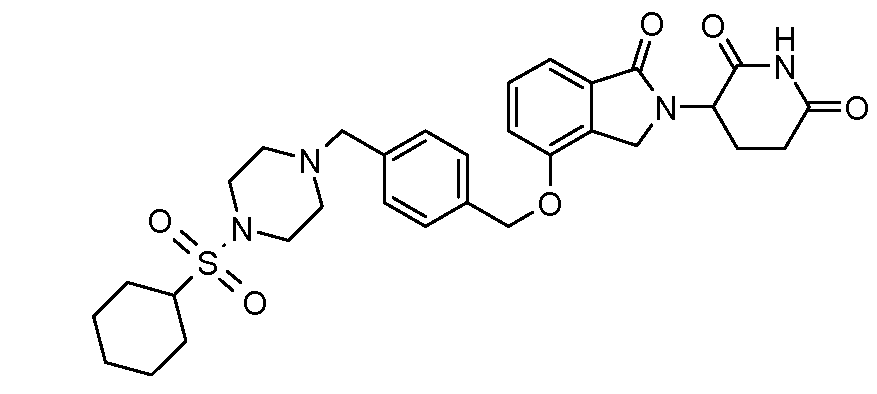
Стадия 1: Трет-бутиловый эфир 4-циклогексансульфонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (450 мг, 2,416 ммоль) в безводном DCM (10 мл) добавляли циклогексансульфонил хлорид (485 мг, 2,66 ммоль) и триэтиламин (0,370 мл, 2,66 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 20 минут, и реакция была закончена. Реакция была полной. Реакционную смесь разбавляли DCM (40 мл), и смесь промывали водой (20 мл) и солевым раствором (20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали под вакуумом, получая трет-бутиловый эфир 4-циклогексансульфонил-пиперазин-1-карбоновой кислоты в форме твердого вещества грязно-белого цвета (750 мг, 93%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH (без группы ВОС)=233.
Стадия 2: 1-Циклогексансульфонил-пиперазин гидрохлорид
К раствору 4-(циклогексилсульфонил)пиперазин-1-трет-бутилкарбоксилата (750 мг, 2,256 ммоль) в DCM (5 мл) добавляли HCl (2M в простом эфире, 5 мл, 10,00 ммоль) и простой диэтиловый эфир (5,0 мл). Полученный раствор перемешивали при температуре окружающей среды в течение 4 дней и концентрировали под вакуумом. К остатку добавляли HCl (2M в простом эфире, 15 мл), и полученную суспензию перемешивали при температуре окружающей среды в течение ночи, и реакция была закончена. Реакционную смесь фильтровали, и твердое вещество промывали простым эфиром (2×15 мл), получая 1-циклогексансульфонил-пиперазин гидрохлорид в форме твердого вещества грязно-белого цвета (450 мг, 74%-ый выход) и соединение было проверено Н-ЯМР. 1H ЯМР (ДМСО-d6) δ 1,03-1,45 (м, 5H, CH2, CH2) СН), 1,54-1,69 (м, 1Н, СН), 1,70-1,84 (м, 2Н, СН2), 1,90-2,05 (м, 2Н, СН2), 3,03-3,16 (м, 4Н, СН2) СН2), 3,17-3,28 (м, 1Н, СНН), 3,41-3,57 (м, 4Н, СН2, СН2), 9,42 (уш.с, 2Н, NH2Cl); LCMS МН=233.
Стадия 3: 3-{4-[4-(4-Циклогексансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 1-(циклогексилсульфонил)пиперазин гидрохлорида (273 мг, 1,01 ммоль) в ацетонитриле (8 мл) при температуре окружающей среды добавляли DIPEA (0,36 мл, 2,03 ммоль). Суспензия немедленно стала прозрачным раствором. И к прозрачному раствору добавляли 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (300 мг, 0,68 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 20 часов. К реакционной смеси добавляли EtOAc (50 мл) и NaHCO3 (насыщ. водный раствор, 20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4. Органический слой концентрировали, и остаток очищали ISCO, получая 3-{4-[4-(4-циклогексансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (150 мг, 37%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, CH3CN/0,1% H3PO4, 5,03 мин (99,9%); Т. пл.: 245-247°C; 1H ЯМР (ДМСО-d6) δ 1,03-1,21 (м, 1H, CHH), 1,21-1,45 (м, 4H, CH2, CH2), 1,59 (уш.с, 1H, CHH), 1,78 (уш.с, 2H, CH2), 1,97 (д, J=7,6 Гц, 3H, CHH, CH2), 2,32-2,47 (м, 5H, CHH, CH2, CH2), 2,53-2,65 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 3,09 (т, J=11,4 Гц, 1H, CH), 3,17-3,28 (м, 4H, CH2, CH2), 3,51 (с, 2H, CH2), 4,18-4,32 (м, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 4H, Ar), 7,40-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 24,43, 24,75, 26,18, 31,16, 45,06, 45,52, 51,55, 52,54, 59,29, 61,31, 69,35, 114,96, 115,22, 127,64, 128,92, 129,80, 129,93, 133,28, 135,35, 137,64, 153,48, 167,97, 170,96, 172,81; LCMS MH=595; Вычислено для C31H38N4O6S: C, 62,61; H, 6,44; N, 9,42; Найдено: С, 62,63; H, 6,21; N, 9,56.
5.232 3-(4-((4-((4-(МЕТИЛСУЛЬФОНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
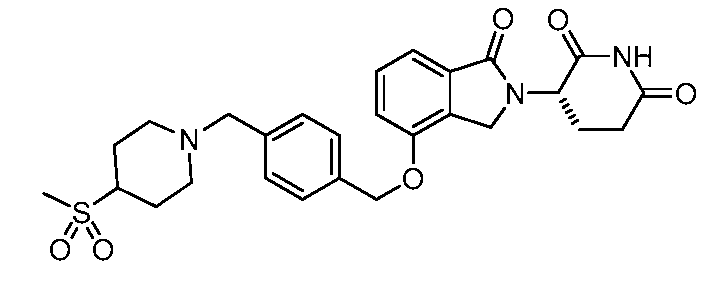
К прозрачному раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) в ацетонитриле (5 мл, 96 ммоль) добавляли 4-(метилсульфонил)пиперидин (110 мг, 0,677 ммоль), и полученную суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли EtOAc (10 мл), перемешивали в течение 5 минут, затем фильтровали. Твердое вещество промывали EtOAc (2 мл) и водой (2 мл) и высушивали далее в вакуумном сушильном шкафу при 50°C, получая 3-(4-((4-((4-(метилсульфонил)пиперидин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (140 мг, 59%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83 CH3CN/0,1% H3PO4, 3,92 мин (98,2%); Т. пл.: 173-175°C; 1H ЯМР (ДМСО-d6) δ 1,47-1,69 (м, 2H, CHH, CHH), 1,84-2,07 (м, 5H, CHH, CHH, CHH, CHH, CHH), 2,35-2,48 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,83-2,97 (м, 6H, CHH, CHH, CHH, CH3), 2,98-3,11 (м, 1H, CH), 3,49 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,2 Гц, 4H, Ar), 7,41-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,26, 24,34, 31,09, 37,25, 44,99, 51,38, 51,48, 58,64, 61,29, 69,31, 114,90, 115,15, 127,57, 128,71, 129,73, 129,86, 133,23, 135,17, 138,03, 153,41, 167,90, 170,89, 172,74; LCMS: MH=526; Вычислено для C27H31N3O6S+0,4 H2O: C, 60,86; H, 6,02; N, 7,89; S, 6,02; Найдено: С, 60,79; H, 5,77; N, 7,78; S, 5,82.
5.233 3-{4-[4-(4-ЦИКЛОГЕКСАНКАРБОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
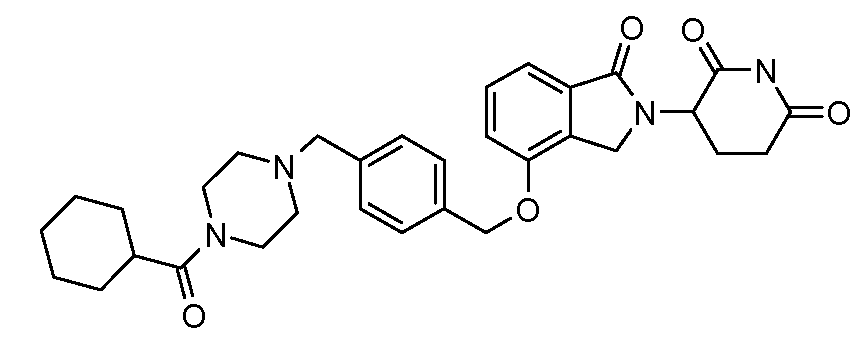
Стадия 1: Трет-бутиловый эфир 4-циклогексанкарбонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (1,207 г, 6,48 ммоль) в DCM (Объем: 15 мл) добавляли циклогексанкарбонил хлорид (1 г, 6,82 ммоль) и DIPEA (1,187 мл, 6,82 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 1,5 часов, после чего разбавляли DCM (20 мл). Смесь промывали водой (20 мл) и солевым раствором (20 мл), соответственно. Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая трет-бутиловый эфир 4-циклогексанкарбонил-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (1,92 г, 95%-ый сырой выход); LCMS MH=296.
Стадия 2: Циклогексил(пиперазин-1-ил)метанон гидрохлорид
Суспензию 4-(циклогексанкарбонил)пиперазин-1-трет-бутилкарбоксилата (1,92 г, 6,48 ммоль) в HCl (2M в простом эфире, 25 мл) перемешивали при температуре окружающей среды в течение выходных и фильтровали. Твердое вещество белого цвета промывали простым диэтиловым эфиром (15 мл×2) и высушивали под отсасыванием, получая циклогексил(пиперазин-1-ил)метанон гидрохлорид (1,5 г, 99%-ый сырой выход). 1H ЯМР (ДМСО-d6) δ 0,99-1,46 (м, 5H, СН2, СН2 СНН), 1,52-1,82 (м, 5Н, СН2, СН2, СНН), 2,54-2,68 (м, 1Н, СНН), 2,85-3,19 (м, 4Н, СН2, СН2), 3,53-3,94 (м, 4Н, СН2, СН2), 9,52 (уш.с, 2Н, NHHCl); LCMS МН=197.
Стадия 3: 3-{4-[4-(4-Циклогексанкарбонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой смеси циклогексил(пиперазин-1-ил)метанон гидрохлорида (239 мг, 1,03 ммоль) в ацетонитриле (10 мл) добавляли DIPEA (0,345 мл, 1,97 ммоль) с последующим добавлением 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,79 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли EtOAc (70 мл) и промывали NaHCO3 (водный раствор, насыщ. 25 мл) и солевым раствором (15 мл). Органический слой высушивали MgSO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией ISCO, получая 3-{4-[4-(4-циклогексанкарбонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (271 мг, 61%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 3,18 мин (98,9%); Т. пл.: 215-217°C; 1H ЯМР (ДМСО-d6) δ 1,05-1,41 (м, 5H, CH2, СН2, СНН), 1,52-1,76 (м, 5Н, СН2, СН2, СНН), 1,91-2,05 (м, 1Н, СНН), 2,21-2,40 (м, 5Н, СНН, СН2, СН2), 2,60 (уш.с, 2Н, СНН, СНН), 2,82-3,01 (м, 1Н, СНН), 3,37-3,54 (м, 6Н, СН2, СН2, СН2), 4,26 (д, J=17,4 Гц, 1Н, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,4 Гц, 4H, Ar), 7,38-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 25,10, 25,52, 29,08, 31,18, 44,74, 45,06, 51,55, 52,36, 53,18, 61,50, 69,36, 114,94, 115,20, 127,63, 128,97, 129,78, 129,93, 133,28, 135,31, 137,70, 153,46, 167,97, 170,96, 172,81, 173,22; LCMS MH=559; Вычислено для C32H38N4O5+0,2 H2O: C, 68,36; H, 6,88; N, 9,96; Найдено: С, 68,39; H, 6,75; N, 9,89.
5.234 3-{4-[4-(4-БЕНЗОИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
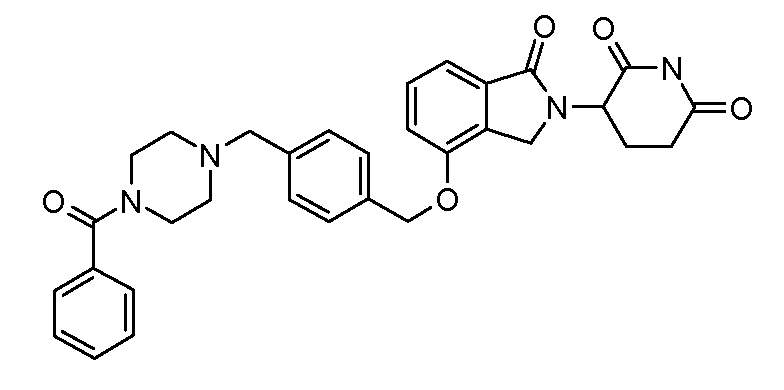
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,422 г, 0,952 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли фенил(пиперазин-1-ил)метанон гидрохлорид (0,324 г, 1,428 ммоль) и N-этил-N-изопропилпропан-2-амин (0,472 мл, 2,86 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и полученное твердое вещество перемешивали в воде (30 мл) и метиленхлориде (50 мл). Орг. фазу промывали насыщенным раствором бикарбоната натрия (2×20 мл), солевым раствором (20 мл), высушивали и концентрировали до светло-желтого пенистого твердого вещества (0,55 г) и перемешивали в простом диэтиловом эфире (15 мл) при температуре окружающей среды в течение ночи. Эфирную суспензию фильтровали и перемешивали в ацетонитриле (8 мл) при 55°C в течение одного часа, затем охлаждали и фильтровали, получая 3-{4-[4-(4-бензоил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,258 г, 49%-ый выход); Т. пл.: 194-196°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CH)/0,1% Н3РО4, 4,67 мин (95,3%), 1H ЯМР (ДМСО-d6) δ 1,90-2,05 (м, 1H, CHH), 2,23-2,48 (м, 5H, 2CH2, СНН), 2,57 (д, J=14,9 Гц, 1H, CHH), 2,81-3,01 (м, 1H, CHH), 3,18-3,44 (м, 3H, CH2, CH), 3,55-3,77 (м, 1H, CH), 4,18-4,48 (м, 2H, CH2),5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,17-5,28 (м, 2H, CH2), 7,25-7,54 (м, 12H, Ar), 10,97 (с, 1H, NH), I3C ЯМР (ДМСО-d6) δ 22,36, 31,20, 45,09, 41,53, 47,14, 51,58, 52,58, 61,51, 69,38, 114,97, 115,23, 126,85, 127,68, 127,90, 128,38, 128,98, 129,44, 129,81, 129,94, 133,31, 135,36, 135,89, 137,68, 153,50, 167,99, 168,87, 170,87, 170,98, 172,73, 172,83, LC/MS (M+l)+=553; Вычислено для C32H32N4O5+0,6 H2O: C, 68,22; H, 5,94; N, 9,94, Найдено: С, 67,95; H, 5,68; N, 9,84.
5.235 3-{4-[4-(4-БЕНЗИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
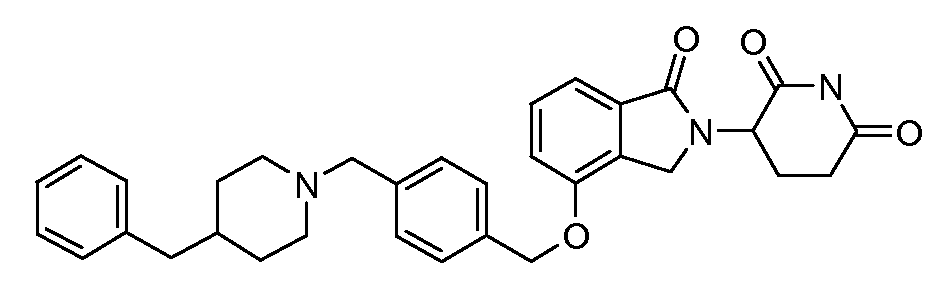
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,44 г, 0,993 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли 4-бензилпиперидин (0,230 мл, 1,290 ммоль) и N-этил-N-изопропилпропан-2-амин (0,328 мл, 1,985 ммоль). Смесь через несколько минут стала мутной. Ее перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, получая твердое вещество белого цвета, которое перемешивали в воде (30 мл) и метиленхлориде (50 мл). Орг. фазу промывали насыщенным раствором бикарбоната натрия (2×20 мл), солевым раствором (20 мл), высушивали и концентрировали до светло-желтого твердого вещества (0,5 г). Это твердое вещество перемешивали в ацетонитриле (8 мл) при 55°C в течение одного часа, затем фильтровали, получая 3-{4-[4-(4-бензил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,245 г, 46%-ый выход); Т. пл.: 169-171°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 5,15 мин (94,1%). 1H ЯМР (ДМСО-d6) δ 1,08-1,29 (м, 2H, CH2), 1,38-1,62 (м, 3Н, СН2, СН), 1,77-1,91 (м, 2Н, СН2), 1,92-2,05 (м, 1Н, СНН), 2,35-2,48 (м, 2Н, СНН, СН), 2,57 (дд, J=1,3, 11,7 Гц, 1Н, CHH), 2,69-2,81 (м, 2H, CH2), 2,83-3,01 (м, 1H, CHH), 3,41 (с, 2H, CH2), 4,19-4,49 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,21 (с, 2H, CH2), 7,10-7,20 (м, 3H, Ar), 7,21-7,37 (м, 7H, Ar), 7,38-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 31,72, 37,32, 42,36, 45,09, 51,56, 53,18, 62,09, 69,45, 114,97, 115,21, 125,68, 127,62, 128,07, 128,73, 128,93, 129,81, 129,94, 133,31, 135,03, 138,66, 140,32, 153,51, 168,01, 170,98, 172,83, LC/MS (M+l)+=538; Вычислено для C33H35N3O4: C, 73,72; H, 6,56; N, 7,82, Найдено: С, 72,17; H, 6,08; N, 7,53.
5.236 3-{4-[4-(4-ЭТАНСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
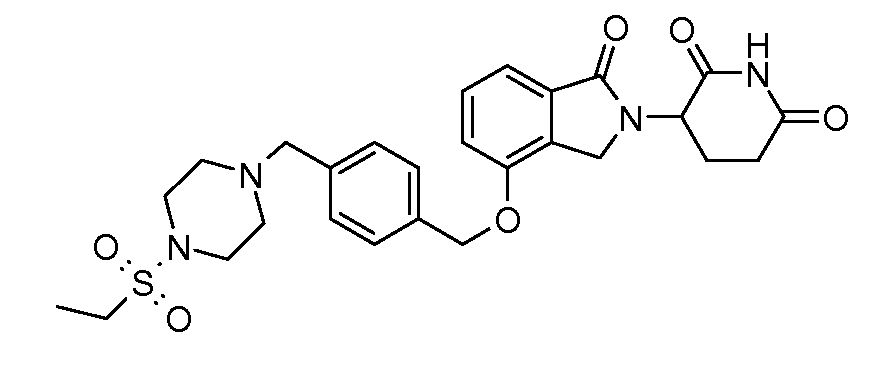
Стадия 1: Трет-бутиловый эфир 4-этансульфонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (1,0 г, 5,37 ммоль) в безводном DCM (10 мл) при температуре окружающей среды добавляли этансульфонил хлорид (0,56 мл, 5,91 ммоль) и TEA (0,898 мл, 6,44 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 22,5 часов, после чего разбавляли DCM (40 мл). Смесь промывали водой (20 мл) и солевым раствором (20 мл). Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир 4-этансульфонил-пиперазин-1-карбоновой кислоты как светло-желтое масло (1,7 г, 114%-ый сырой выход). LCMS MH (без ВОС)=179.
Стадия 2: 1-(Этилсульфонил)пиперазин гидрохлорид
К перемешиваемому раствору 4-(этилсульфонил)пиперазин-1-трет-бутилкарбоксилата (1,7 г, 6,11 ммоль) в DCM (5 мл) добавляли HCl (2M в простом диэтиловом эфире, 30 мл, 60,0 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 22,5 часов и фильтровали. Твердое вещество белого цвета промывали простым диэтиловым эфиром (2×15 мл) и высушивали под отсасыванием, получая 1-(этилсульфонил)пиперазин гидрохлорид как твердое вещество белого цвета (1,03 г, 79%-ый выход). Продукт использовали на следующей стадии без дальнейшей очистки. Данные спектров Н ЯМР: 1H ЯМР (ДМСО-d6) δ 1,21 (т, J=7,4 Гц, 3H, CH3), 3,04-3,25 (м, 6H, CH2, СН2, СН2), 3,33-3,54 (м, 4Н, СН2, СН2), 9,50 (уш.с, 2Н, NHHCl); LCMS MH=179.
Стадия 3: 3-{4-[4-(4-Этансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 1-(этилсульфонил)пиперазин гидрохлорида (203 мг, 0,947 ммоль) в ацетонитриле (10 мл) добавляли DIPEA (0,414 мл, 2,369 ммоль) с последующим добавлением 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,790 ммоль). Полученный прозрачный раствор перемешивали при температуре окружающей среды для дальнейшей реакции. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов, после чего разбавляли EtOAc (70 мл) и NaHCO3 (насыщ., водный раствор, 20 мл). В смеси образовалось некоторое количество твердого вещества. Смесь фильтровали, и фильтрат экстрагировали. Органический слой высушивали MgSO4 и фильтровали. Фильтрат, объединенный с твердым веществом, концентрировали, и остаток очищали хроматографией ISCO, получая 3-{4-[4-(4-этансульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (240 мг, 56%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3PO4), 3,82 мин (99,9%); Т. пл.: 135-137°C; 1H ЯМР (ДМСО-d6) δ 1,20 (т, J=7,4 Гц, 3Н, СН3), 1,90-2,06 (м, 1Н, СНН), 2,32-2,48 (м, 5Н, СНН, СН2, СН2), 2,60 (уш.с, 1Н, СНН), 2,82-2,99 (м, 1Н, CHH), 3,04 (кв, J=7,4 Гц, 2H, CH2), 3,11-3,21 (м, 4H, CH2, CH2), 3,52 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,26-7,38 (м, 4H, Ar), 7,40-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 7,40, 22,34, 31,16, 42,16, 45,06, 45,22, 51,55, 52,07, 61,23, 69,35, 114,96, 115,22, 127,66, 128,92, 129,80, 129,93, 133,30, 135,37, 137,64, 153,48, 167,97, 170,96, 172,81; LCMS MH=541; Вычислено для C27H32N4O6S: C, 59,98; H, 5,97; N, 10,36; Найдено: С, 59,67; H, 5,93; N, 10,21.
5.237 3-(1-ОКСО-4-{4-[4-(ПРОПАН-2-СУЛЬФОНИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
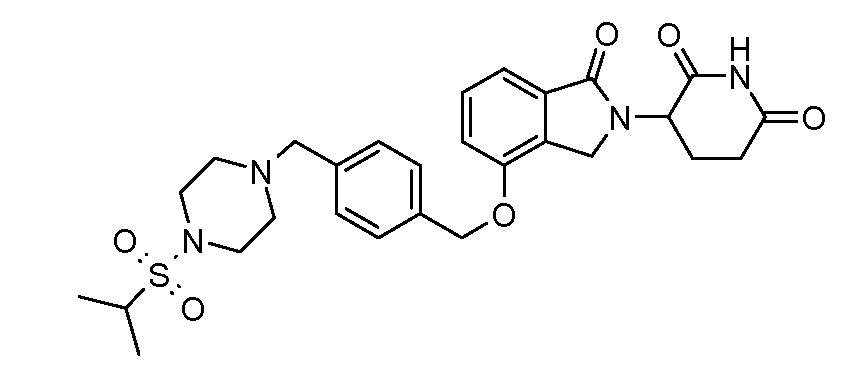
Стадия 1: Трет-бутиловый эфир 4-(пропан-2-сульфонил)-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (1,0 г, 5,4 ммоль) в безводном DCM (10 мл) при температуре окружающей среды добавляли пропан-2-сульфонил хлорид (0,7 мл, 5,9 ммоль) и TEA (0,89 мл, 6,44 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов, после чего разбавляли DCM (40 мл), промывали водой (20 мл) и солевым раствором (20 мл). Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир 4-(пропан-2-сульфонил)-пиперазин-1-карбоновой кислоты как светло-коричневое твердое вещество (1,63 г, 104%-ый сырой выход). Сырой продукт использовали на следующей стадии без дальнейшей очистки; LCMS MH=293.
Стадия 2: 1-(Изопропилсульфонил)пиперазин гидрохлорид
К перемешиваемому раствору 4-(изопропилсульфонил)пиперазин-1-трет-бутилкарбоксилата (1,63 г, 5,6 ммоль) в DCM (5 мл) добавляли HCl (2M в простом диэтиловом эфире, 30 мл, 60,0 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 21 часа, после чего отфильтровывали. Твердое вещество белого цвета промывали простым диэтиловым эфиром (2×15 мл) и высушивали под отсасыванием, получая 1-(изопропилсульфонил)пиперазин гидрохлорид как твердое вещество белого цвета (0,84 г, 66%-ый сырой выход). Продукт использовали на следующей стадии без дальнейшей очистки; 1H ЯМР (ДМСО-d6) δ 1,23 (д, J=6,8 Гц, 6H, CH3, CH3), 2,99-3,21 (м, 4H, СН2, СН2), 3,28-3,57 (м, 5Н, СН, СН2, СН2), 9,35-9,66 (м, 2Н, NHHCl); LCMS МН=179.
Стадия 3: 3-(1-Оксо-4-{4-[4-(пропан-2-сульфонил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион
К перемешиваемой суспензии 1-(изопропилсульфонил)пиперазин гидрохлорида (217 мг, 0,9 ммоль) в ацетонитриле (10 мл) добавляли DIPEA (0,4 мл, 2,4 ммоль) с последующим добавлением 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,8 ммоль). Полученный прозрачный раствор перемешивали при температуре окружающей среды в течение 17 часов, после чего добавляли EtOAc (70 мл) и NaHCO3 (насыщ., водный раствор, 20 мл). В смеси образовалось некоторое количество твердого вещества. Смесь фильтровали, и фильтрат экстрагировали. Органический слой высушивали MgSO4 и фильтровали. Фильтрат, объединенный с твердым веществом, концентрировали, и остаток очищали ISCO, получая 3-(1-оксо-4-{4-[4-(пропан-2-сульфонил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (249 мг, 57%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3PO4), 5,03 мин (99,2%); Т. пл.: 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,21 (д, J=6,8 Гц, 6H, CH3, CH3), 1,91-2,06 (м, 1H, CHH), 2,34-2,48 (м, 5H, CHH, CH2, CH2), 2,54 (уш.с, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 3,17-3,28 (м, 4H, CH2, CH2), 3,28-3,37 (м, 1H, CH), 3,52 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 4H, Ar), 7,39-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 16,41, 22,34, 31,16, 45,06, 45,60, 51,55, 51,62, 52,52, 61,33, 69,35, 114,94, 115,22, 127,64, 128,94, 129,80, 129,93, 133,28, 135,37, 137,60, 153,48, 167,97170,96, 172,81; LCMS MH=555; Вычислено для C28H34N4O6S: С, 60,63; H, 6,18; N,10,10; Найдено: С, 60,41; H, 6,03; N, 9,94.
5.238 3-(4-{4-[4-(1-ГИДРОКСИ-1-МЕТИЛ-ЭТИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
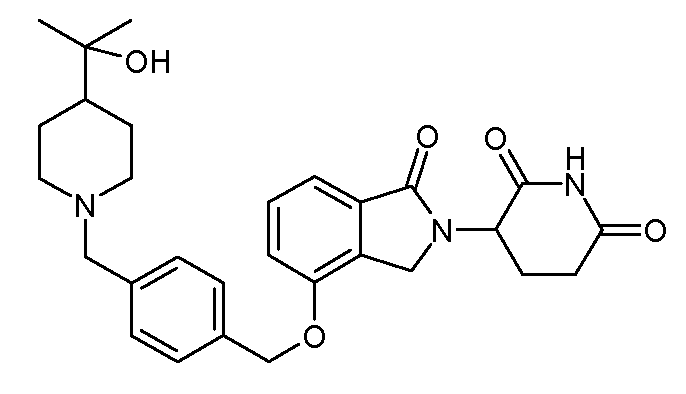
К раствору смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,50 г, 1,12 ммоль) в CH3CN при температуре окружающей добавляли DIPEA (0,394 мл, 2,256 ммоль), затем 2-(пиперидин-4-ил)пропан-2-ол (0,194 г, 1,354 ммоль) среды. Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали, затем экстрагировали с использованием воды (20 мл) и DCM (20 мл). Органический слой концентрировали, и полученное твердое вещество кристаллизовали из 2 мл CH3CN, получая 3-(4-{4-[4-(1-гидрокси-1-метил-этил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион (240 мг, 42%). Т.пл.: 160-162°C. LC-MS m/e=506. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 4,78 мин (95,2%), 1ЯМР (ДМСО-d6) δ 0,94-1,06 (м, 6H, CH3, СН3), 1,07-1,33 (м, 3Н, СН, СН2), 1,62 (д, J=10,8 Гц, 2Н, СН2), 1,82 (т, J=10,9 Гц, 2Н, СН2), 1,91-2,07 (м, 1Н, CHH), 2,35-2,47 (м, 1H, CHH), 2,57 (д, J=18,3 Гц, 1H, CHH), 2,84 (д, J=11,7 Гц, 2H, CH2), 2,89-2,99 (м, 1H, CHH), 3,42 (с, 2H, CH2), 4,02 (с, 1H, OH), 4,18-4,47 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,23-7,38 (м, 4H, Ar), 7,39-7,58 (м, 3H, Ar), 10,96 (с, 1H, Ar) 13C ЯМР (ДМСО-d6) δ 22,33, 26,54, 26,86, 31,18, 45,07, 46,94, 51,55, 53,82, 62,10, 69,44, 70,19, 114,96, 115,19, 127,58, 128,75, 129,78, 129,93, 133,28, 135,00, 138,71, 153,51, 167,99, 170,96, 172,81; Вычислено для C29H35N3O5+0,2 H2O: C%: 68,40; H%: 7,01; N%: 8,25; Найдено: C%: 68,20; H%: 7,05; N%: 8,12.
5.239 3-{1-ОКСО-4-[4-(3,4,5,6-ТЕТРАГИДРО-2H-[4,4']БИПИРИДИНИЛ-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
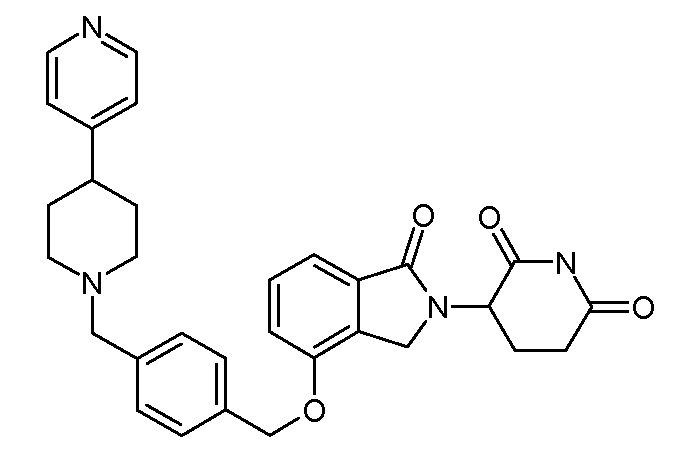
К раствору смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,36 г, 0,82 ммоль) в CH3CN добавляли N-этил-N-изопропилпропан-2-амин (0,284 мл, 1,624 ммоль) и 4-(пиперидин-4-ил)пиридин (0,158 г, 0,975 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи, затем концентрировали на роторном испарителе. Полученное твердое вещество добавляли к воде 30 мл и перемешивали при температуре окружающей среды в течение 2 часов. Суспензию фильтровали, затем перекристаллизовывали из CH3CN (3 мл), получая 3-{1-оксо-4-[4-(3,4,5,6-тетрагидро-2H-[4,4']бипиридинил-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета. Т.пл.: 198-200°C. LCMS m/e=525. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 4,36 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,48-1,86 (м, 4H, CH2, СН2), 1,90-2,17 (м, 3Н, СН2, СНН), 2,32-2,44 (м, 0Н, СНН), 2,51-2,65 (м, 2Н, СНН, СН), 2,80-3,08 (м, 3Н, СНН, СН2), 3,41-3,63 (м, 2Н, СН2), 4,15-4,57 (м, 2Н, СН2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,12-7,70 (м, 9Н, Ar), 8,45 (дд, J=1,5, 4,5 Гц, 2H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 31,98, 40,86, 45,09, 51,58, 53,21, 69,42, 114,98, 115,23, 122,31, 127,65, 129,01, 129,82, 129,95, 133,32, 135,25, 149,56, 153,51, 168,01, 170,98, 172,83; Вычислено для C31H32N4O4+0,3 H2O: C%: 70,25; H%: 6,20; N%: 10,57; Найдено C%: 70,05; H%: 5,92; N%: 10,25
5.240 3-{4-[4-(4-БЕНЗОЛСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)- БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
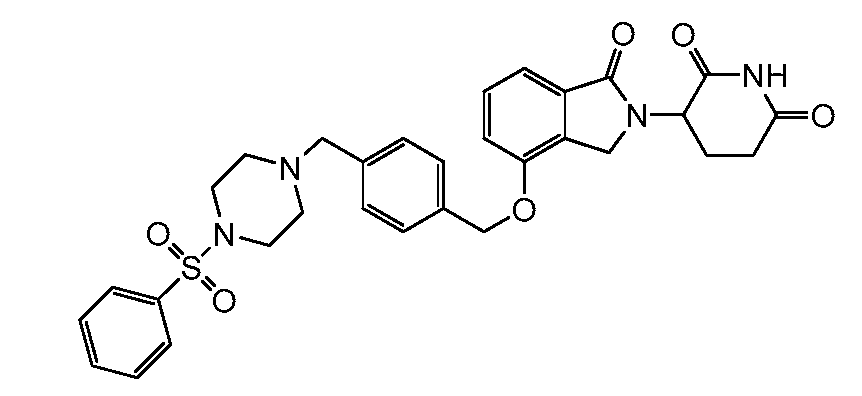
Стадия 1: Трет-бутиловый эфир 4-бензолсульфонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (1,0 г, 5,4 ммоль) в безводном DCM (10 мл) при температуре окружающей среды добавляли бензолсульфонил хлорид (0,75 мл, 5,9 ммоль) и TEA (0,90 мл, 6,4 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 18 часов, после чего разбавляли EtOAc (40 мл) и NaHCO3 (водный раствор, насыщ., 15 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (20 мл) и высушивали MgSO4. Органический слой концентрировали под вакуумом, получая трет-бутиловый эфир 4-бензолсульфонил-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (2,0 г, 114%-ый сырой выход). Это вещество использовали на следующей стадии без дальнейшей очистки; LCMS MH (226, потеря группы ВОС в ходе LCMS).
Стадия 2: 1-(Фенилсульфонил)пиперазин гидрохлорид
К перемешиваемому раствору 4-(фенилсульфонил)пиперазин-1-трет-бутилкарбоксилата (сырой продукт) (1,75 г, 5,4 ммоль) в DCM (4,5 мл) добавляли HCl (2M в простом диэтиловом эфире) (20 мл, 40,0 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 3 дней, после чего отфильтровывали, и твердое вещество белого цвета промывали простым эфиром (2×30 мл) и высушивали под отсасыванием, получая 1-(фенилсульфонил)пиперазин гидрохлорид как твердое вещество белого цвета (1,4 г, 100%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 3,16 (с, 8H, CH2, СН2, СН2, СН2), 7,61-7,84 (м, 5Н, Ar), 9,42 (уш.с, 2Н, NHHCl); LCMS MH=227.
Стадия 3: 3-{4-[4-(4-Бензолсульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемой суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (360 мг, 0,8 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли DIPEA (0,43 мл, 2,4 ммоль) и 1-(фенилсульфонил)пиперазин гидрохлорид (256 мг, 0,98 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 21 часа, после чего добавляли EtOAc (50 мл) и NaHCO3 (насыщ., водный раствор, 20 мл). Смесь экстрагировали, и органический слой высушивали MgSO4. Органический слой концентрировали, и остаток очищали ISCO. Твердый продукт очищали далее, после перемешивания в DCM (5 мл) и простом диэтиловом эфире (30 мл), получая 3-{4-[4-(4-бензолсульфонил-пиперазин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (392 мг, 82%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 3,79 мин (99,0%); Т. пл.: 220-222°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H, CHH), 2,33-2,47 (м, 5H, CHH, CH2, CH2), 2,54-2,63 (м, 1H, CHH), 2,80-2,94 (м, 5H, CH2, CH2, CHH), 3,46 (с, 2H, CH2), 4,23 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,3 Гц, 1H, CHH), 5,20 (с, 2H, CH2), 7,14-7,54 (м, 7H, Ar), 7,56-7,86 (м, 5H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,04, 45,92, 51,37, 51,53, 60,98, 69,32, 114,93, 115,20, 127,51, 127,63, 128,78, 129,36, 129,78, 129,90, 133,23, 133,28, 134,68, 135,33, 137,53, 153,45, 167,97, 170,95, 172,81; LCMS MH=589; Вычислено для C31H32N4O6S+0,4 H2O: C, 62,49; H, 5,55; N, 9,40; Найдено: С, 62,59; H, 5,40; N, 9,33.
5.241 3-{4-[4-(4-ГИДРОКСИ-4-ФЕНИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
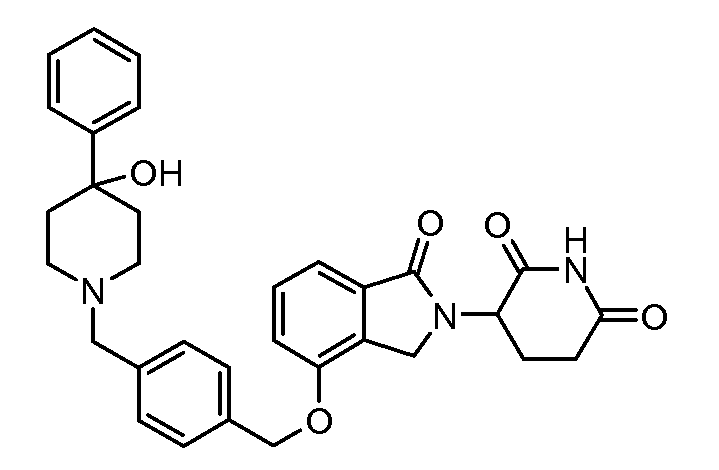
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,28 г, 0,62 ммоль) в CH3CN (10 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,22 мл, 1,24 ммоль), затем 4-фенилпиперидин-4-ол (0,13 г, 0,76 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали на роторном испарителе, и полученное твердое вещество экстрагировали, используя CH2Cl2 и воду. Органический слой концентрировали, получая твердое вещество, которое перекристаллизовывали из CH3CN (3 мл), получая 3-{4-[4-(4-гидрокси-4-фенил-пиперидин-1-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (154 мг, 44%). Температура плавления: 140-142°C. LCMS m/e=540. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 5,02 мин (95%), 1Н ЯМР (ДМСО-d6) δ 1,58 (д, J=13,0 Гц, 2H, CH2), 1,80-2,10 (м, 3H, CH2, CHH), 2,32-2,43 (м, 3H, CHH, CH2), 2,60 (уш.с, 3H, CHH, CH2), 2,79-3,06 (м, 1H, CHH), 3,57 (уш.с, 2H, CH2), 4,04-4,56 (м, 2H, CHH), 4,80 (уш.с, 1H, OH), 5,11 (д, J=8,1 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 7,06-7,66 (м, 12H, Ar), 10,97 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,33, 31,18, 31,25, 45,06, 48,89, 51,55, 69,41, 114,94, 115,20, 124,71, 126,13, 127,63, 127,77, 129,80, 129,93, 133,28, 153,49, 161,07, 167,99, 170,96, 172,81, Вычислено для C32H33N3O5+0,6 H2O: C%: 69,64; H%: 5,70; N%: 7,27; Найдено C%: 69,83; H%: 6,26; N%: 7,63.
5.242 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((4-ИЗОПРОПИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
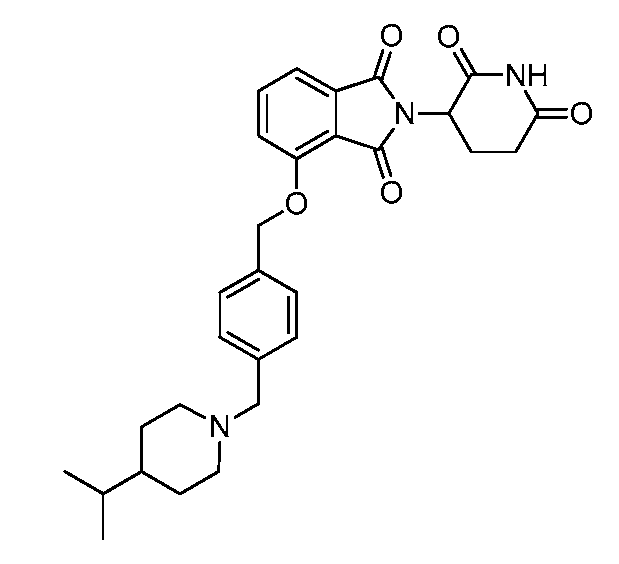
4-(4-(Бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион (250 мг, 0,547 ммоль) суспендировали в сухом MeCN (10 мл). К суспензии добавляли 4-изопропилпиперидин (139 мг, 1,093 ммоль) и смесь перемешивали при температуре окружающей среды, получая в течение нескольких минут прозрачный раствор. Через ~1 час сформировался густой осадок. Летучие компоненты удаляли в вакууме, и остаток разделяли между водным 1н. раствором NaHCO3 (40 мл) и EtOAc (~100 мл). Водный слой насыщали твердым Na2CO3 и затем экстрагировали еще раз EtOAc (~50 мл). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество желтоватого цвета. Твердое вещество растирали с водой, фильтровали и затем промывали дополнительным количеством воды (~200 мл, общее количество). Оставшееся твердое вещество промывали гексанами (~1500 л, общее количество), высушивали отсасыванием и затем высушивали в вакуумном сушильном шкафу при 60°C, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((4-изопропилпиперидин-1-ил)метил)бензил)-окси)изоиндолин-1,3-дион в форме твердого вещества светло-желтого цвета (220 мг, 80%): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 6,86 мин (96,4%), Т. пл.: 220-222°C; 1H ЯМР (ДМСО-d6) δ 0,82 (с, 3Н, CH3), 0,85 (с, 3Н, СН3), 0,89-1,06 (м, 1Н, СНН), 1,08-1,26 (м, 2Н, СНН, СНН, СНН), 1,31-1,46 (м, 1Н, СНН), 1,48-1,66 (м, 2Н, СН2), 1,85 (т, J=10,7 Гц, 2Н, СН2), 1,95-2,13 (м, 1Н, СНН), 2,52-2,66 (м, 2Н, СНН, СНН), 2,72-3,00 (т, 3Н, СНН, СНН, СНН), 3,42 (с, 2Н, СН2), 5,09 (дд, J=5,5, 12,8 Гц, 1Н, CH), 5,35 (с, 2H, CH2), 7,25-7,38 (м, 2H, Ar), 7,40-7,52 (м, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,74-7,92 (м, 1H, Ar), 11,09 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 19,64, 21,93, 28,86, 30,90, 31,92, 41,84, 48,73, 53,65, 62,15, 69,98, 115,48, 116,56, 120,21, 127,20, 128,78, 133,26, 134,52, 136,97, 138,65, 155,53, 165,29, 166,75, 169,87, 172,71; LCMS: MH=504; Вычислено для C29H33N3O5+0,16 H2O; Вычислено для C, 68,77; H, 6,63; N, 8,30; Найдено: С, 68,77; H, 6,88; N, 8,22.
5.243 3-{4-[4-(1-БЕНЗИЛ-ПИПЕРИДИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
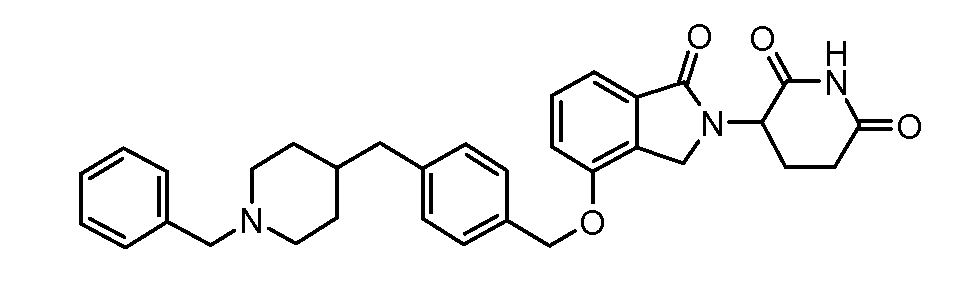
Стадия 1: Получение трет-бутилового эфира 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты
Трифенилфосфин (на полимерной подложке, 1,6 ммоль/г, 3,3 г) при 0°C добавляли к перемешиваемой белой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,444 г, 8,36 ммоль) в THF (100 мл). Через десять минут добавляли диизопропил-диазен-1,2-дикарбоксилат (2,470 мл, 12,54 ммоль) и перемешивали в течение 40 минут, и затем добавляли трет-бутил 4-(4-(гидроксиметил)бензил)пиперидин-1-карбоксилат (3,32 г, 10,87 ммоль) в THF (20 мл). Смесь перемешивали при 0°C и нагревали до температуры окружающей среды в течение ночи. Суспензию фильтровали, промывали MeOH (×20 мл), CH2Cl2 (2×30 мл), и фильтрат упаривали, получая масло, которое растворяли в CH2Cl2 (80 мл), промывали насыщ. NaHCO3 (50 мл), концентрировали и затем очищали на колонке с силикагелем, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты как пенистое масло (2,2 г, 45%-ый выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение метилового эфира 4-карбамоил-4-[1-оксо-4-(4-пиперидин-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 4-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пиперидин-1-трет-бутилкарбоксилата (2,2 г, 3,80 ммоль) в CH2Cl2 (10 мл) при температуре окружающей среды добавляли гидрохлорид (2 М в простом эфире) (10 мл, 38,0 ммоль). Через четыре часа суспензию фильтровали, промывали простым эфиром, и полученное твердое вещество желтого цвета высушивали, получая 2,02 г, 111%-ый сырой выход (соль HCl). Продукт использовали позднее на следующей стадии без дальнейшей очистки.
Стадия 3: Получение метилового эфира 4-{4-[4-(1-бензил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-4-карбамоил-масляной кислоты
К перемешиваемой смеси 5-амино-5-оксо-4-(1-оксо-4-(4-(пиперидин-4-илметил)бензилокси)изоиндолин-2-ил)метилпентаноат гидрохлорида (0,321 г, 0,622 ммоль) и N-этил-N-изопропилпропан-2-амина (0,411 мл, 2,488 ммоль) в ацетонитриле (10 мл) добавляли (бромметил)бензол (0,074 мл, 0,622 ммоль). Через 15 минут растворитель выпаривали, получая масло, которое перемешивали в воде (20 мл), насыщ. NaHCO3 (10 мл) и этилацетате (30 мл). Орг. фазу высушивали и упаривали, получая масло (0,33 г, 93%-ый выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение 3-{4-[4-(1-бензил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(4-(4-((1-бензилпиперидин-4-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,33 г, 0,579 ммоль) в THF (8 мл) в ванне воды со льдом добавляли 2-метилпропан-2-олат калия (0,065 г, 0,579 ммоль). Через десять минут смесь гасили 1н. HCl (до рН=1~2), нейтрализовали насыщ. NaHCO3 (до рН=7~8) и перемешивали в воде (10 мл) и CH2Cl2 (30 мл). Органическую фазу промывали водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4 и концентрировали до масла, которое очищали на колонке с силикагелем, получая 3-{4-[4-(1-бензил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (121 мг, 39%-ый выход); Т. пл.: 110-112°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 27/73 за 10 мин (CH3CN/0,1% H3PO4): 5,48 мин (96,8%). 1H ЯМР (ДМСО-d6) δ 1,10-1,30 (м, 2H, СН2), 1,39-1,60 (м, 3Н, СН2, СНН), 1,84 (т, J=11,4 Гц, 2Н, СН2), 1,92-2,03 (м, 1Н, СНН), 2,35-2,47 (м, 1Н, СНН), 2,57 (д, J=10,8 Гц, 1H, СНН), 2,69-2,81 (м, 2H, CH2), 2,82-3,00 (м, 1Н, СНН), 3,40 (с, 2H, CH2), 4,18-4,46 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,19 (с, 2H, CH2), 7,13-7,35 (м, 9H, Ar), 7,38 (д, J=8,1 Гц, 2H, Ar), 7,44-7,52 (м, 1H, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,20, 31,72, 37,30, 42,04, 45,09, 51,56, 53,17, 62,39, 69,49, 114,95, 115,19, 126,72, 127,68, 128,06, 128,61, 129,06, 129,81, 129,94, 133,29, 133,95, 138,72, 140,26, 153,54, 168,01, 170,96, 172,82. LC/MS m/e=538. Вычислено для C33H35N3O4 (+0,6 H2O): C, 72,27; H, 6,65; N, 7,66. Найдено: С, 72,10; H, 6,38; N, 7,49.
5.244 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((4-ФЕНИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
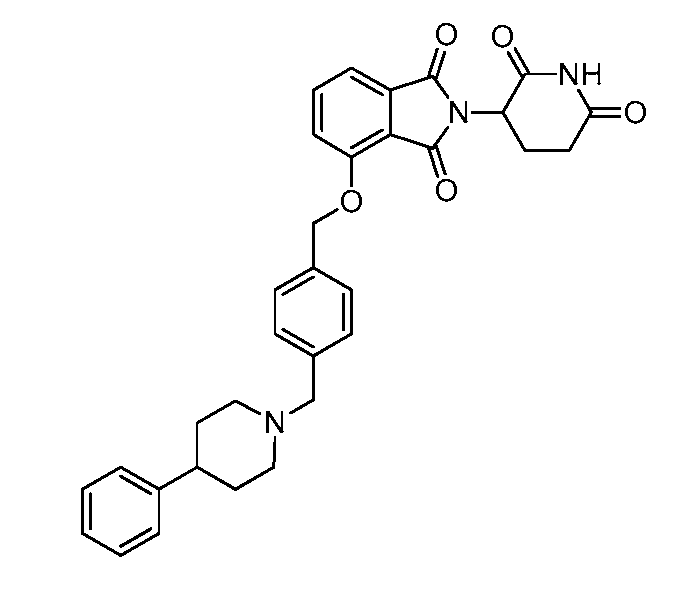
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 4-фенилпиперидина (93 мг, 0,574 ммоль) в сухом MeCN (10 мл) добавляли DIEA (0,143 мл, 0,820 ммоль), и полученную суспензию перемешивали при температуре окружающей среды. Через ~20 часов добавляли дополнительное количество 4-фенилпиперидина (10 мг, 0,06 ммоль), и перемешивание продолжали в течение 1 дня. Чтобы подтолкнуть реакцию к завершению, добавляли дополнительное количество DIEA (100 мкл), и смесь перемешивали при температуре окружающей среды в течение ночи. Сырую реакционную смесь обрабатывали дополнительным количеством DIEA (0,143 мл) и затем нагревали до 80°C в течение ~1 часа. Смеси давали медленно охладиться при мягком перемешивании. Через 2 часа суспензию фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Остаточное твердое вещество в реакционной ампуле промывали на воронке с минимальным количеством MeCN (~1 мл). Твердую корку на воронке промывали водой (3×10 мл). Оставшееся твердое вещество высушивали отсасыванием, затем далее высушивали в вакуумном сушильном шкафу при 60°C в течение 4 часов, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((4-фенилпиперидин-1-ил)метил)бензил)-окси)изоиндолин-1,3-дион как твердое вещество белого цвета (254 мг, 86%): ВЭЖХ: Waters Symmetry С-18 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 3,34 мин (99,6%); Т. пл.: 142-144°C; 1H ЯМР (ДМСО-d6) δ 1,52-1,83 (м, 4H, СНН, СНН, СНН, СНН), 1,93-2,17 (м, 3Н, СНН, СНН, СНН), 2,39-2,68 (м, 3Н, СНН, СНН, СНН), 2,77-3,02 (м, 3Н, СНН, СНН, СНН), 3,51 (с, 2Н, CH2N), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,36 (с, 2H, CH2), 7,08-7,33 (м, 5H, Ar), 7,33-7,42 (м, 2H, Ar), 7,47 (д, J=7,9 Гц, 3H, Ar), 7,61 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, 7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H,NH); 13C ЯМР(ДМСО-d6) δ 21,95, 30,90, 33,06, 41,81, 48,73, 53,60, 62,10, 69,98, 115,48, 116,56, 120,21, 125,92, 126,66, 127,23, 128,25, 128,92, 133,26, 134,63, 136,99, 138,45, 146,23, 155,55, 165,29, 166,75, 169,87, 172,72; LCMS: MH=538; Вычислено для C32H31N3O5+0,5 H2O: C, 70,31; H, 5,90; N, 7,69; Найдено: С, 70,39; H, 5,71; N, 7,65.
5.245 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((4-(МЕТИЛСУЛЬФОНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
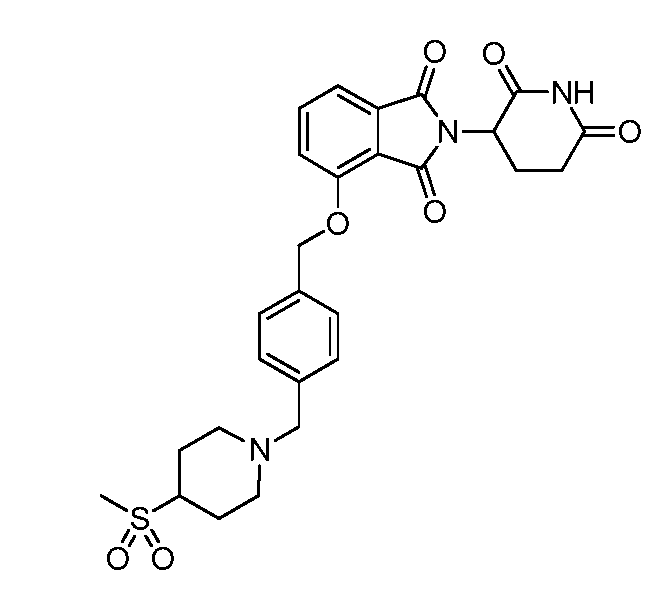
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 4-(метилсульфонил)пиперидина (98 мг, 0,601 ммоль) в MeCN (10 мл, 191 ммоль) добавляли DIEA (0,143 мл, 0,820 ммоль), и полученную смесь (белую суспензию) перемешивали при температуре окружающей среды. К реакционной смеси добавляли DIEA (0,143 мл, 0,820 ммоль), и суспензию нагревали до 80°C и сохраняли при этой температуре в течение ~1 часа, затем давали медленно охладиться до температуры окружающей среды при мягком перемешивании. Через 2 часа суспензию фильтровали. Твердую корку на воронке промывали водой (3×10 мл). Оставшееся твердое вещество высушивали отсасыванием, затем далее высушивали в вакуумном сушильном шкафу при 60°C в течение 4 часов, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((4-(метилсульфонил)пиперидин-1-ил)метил)бензил)окси)изоиндолин-1,3-дион как твердое вещество белого цвета (270 мг, 92%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 18/82 CH3CN/0,1% H3PO4, 4,85 мин (98,9%); Т. пл.: 204-206°C. 1H ЯМР (ДМСО-d6) δ 1,60 (кв.д, J=4,0, 12,6 Гц, 2H, СНН, CHH), 1,88-2,12 (м, 4H, СНН, СНН, CHH, CHH), 2,41-2,66 (м, 3H, CHH, CHH, CHH), 2,81-2,97 (м, 6H, CH3, CHH, CHH, CHH), 2,98-3,13 (м, 1H, CH), 3,49 (с, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,35 (с, 2H, CH2), 7,34 (д, J=8,1 Гц, 2H, Ar), 7,47 (дд, J=2,0, 7,6 Гц, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,3 Гц, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,95, 24,43, 30,90, 37,30, 48,73, 51,43, 58,73, 61,36, 69,95, 115,50, 116,56, 120,19, 127,29, 128,82, 133,26, 134,76, 136,97, 138,07, 155,53, 165,29, 166,75, 169,87, 172,72; LCMS: MH=540; Вычислено для C27H29N3O7S+0,6 H2O+0,3 MeCN: C, 58,91; H, 5,57; N, 8,21; S, 5,70; Найдено: C, 58,93; H, 5,41; N, 8,11; S, 5,61.
5.246 3-{4-[4-(1-ЦИКЛОПРОПИЛМЕТИЛ-ПИПЕРИДИН-4-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
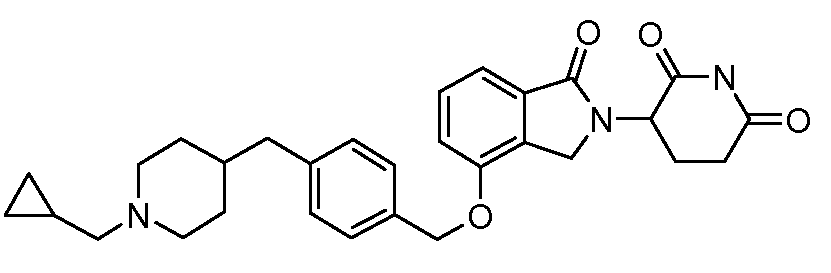
Стадия 1: Получение трет-бутилового эфира 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты
Трифенилфосфин (на полимерной подложке, 1,6 ммоль/г, 3,3 г) добавляли при 0°C к перемешиваемой белой суспензии 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (2,444 г, 8,36 ммоль) в THF (100 мл). Через десять минут добавляли диизопропил диазен-1,2-дикарбоксилат (2,470 мл, 12,54 ммоль) и перемешивали в течение 40 минут, и затем добавляли 4-(4-(гидроксиметил)бензил)пиперидин-1-трет-бутилкарбоксилат (3,32 г, 10,87 ммоль) в THF (20 мл). Смесь перемешивали при 0°C и нагревали до температуры окружающей среды в течение ночи. Суспензию фильтровали, промывали MeOH (2×20 мл), CH2Cl2 (2×30 мл), и фильтрат упаривали, получая масло, которое растворяли в CH2Cl2 (80 мл), промывали насыщ. NaHCO3 (50 мл), концентрировали и затем очищали на колонке с силикагелем, получая трет-бутиловый эфир 4-{4-[2-(1-карбамоил-3-метоксикарбонил-пропил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-бензил}-пиперидин-1-карбоновой кислоты как пенистое масло (2,2 г, 45%-ый выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Получение метилового эфира 4-карбамоил-4-[1-оксо-4-(4-пиперидин-4-илметил-бензилокси)-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемому раствору 4-(4-((2-(1-амино-5-метокси-1,5-диоксопентан-2-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пиперидин-1-трет-бутилкарбоксилата (2,2 г, 3,80 ммоль) в CH2Cl2 (10 мл) при температуре окружающей среды добавляли гидрохлорид (2 М в простом эфире) (10 мл, 38,0 ммоль). Через четыре часа суспензию фильтровали, промывали простым эфиром, и полученное твердое вещество желтого цвета высушивали, получая 2,02 г, 111%-ый сырой выход (соль HCl). Продукт использовали позднее на следующей стадии без дальнейшей очистки.
Стадия 3: Получение метилового эфира 4-карбамоил-4-{4-[4-(1-циклопропилметил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты
К перемешиваемой смеси 5-амино-5-оксо-4-(1-оксо-4-(4-(пиперидин-4-илметил)бензилокси)изоиндолин-2-ил)метилпентаноат гидрохлорида (0,325 г, 0,630 ммоль)) и N-этил-N-изопропилпропан-2-амина (0,416 мл, 2,52 ммоль) в ацетонитриле (10 мл) добавляли (бромметил)циклопропан (0,061 мл, 0,630 ммоль)). Смесь нагревали при 55°C в течение 5 часов и затем при температуре окружающей среды в течение ночи. Растворитель выпаривали, получая масло, которое перемешивали в воде (20 мл), насыщ. NaHCO3 (10 мл) и этилацетате (40 мл). Органическую фазу промывали водой (20 мл), солевым раствором (20 мл), высушивали и упаривали, получая метиловый эфир 4-карбамоил-4-{4-[4-(1-циклопропилметил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-масляной кислоты в форме масла (0,28 г, 83%-ый выход). Это масло использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение 3-{4-[4-(1-циклопропилметил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(4-(4-((1-(циклопропилметил)пиперидин-4-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,28 г, 0,525 ммоль) в THF (10 мл) в ванне воды со льдом добавляли 2-метилпропан-2-олат калия (0,059 г, 0,525 ммоль) и перемешивали в течение 10 минут. К смеси добавляли 1н. HCl (до рН=1), затем нейтрализовали насыщ. NaHCO3 (до рН=7). Добавляли воду (10 мл) и CH2Cl2 (20 мл), и смесь промывали водой (15 мл), солевым раствором (10 мл), высушивали над Na2SO4 и концентрировали до коричневого масла, которое очищали на колонке с силикагелем, получая 3-{4-[4-(1-циклопропилметил-пиперидин-4-илметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как пенистое твердое вещество (20 мг, 8%-ый выход); Т. пл.: Н/А. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 4,62 мин (98,7%), ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 27/73 за 10 мин (CH3CN/0,1% H3PO4): 4,58 мин (95,4%). 1H ЯМР (ДМСО-d6) δ 0,05-0,14 (м, 2H, СН2), 0,44-0,57 (м, 2Н, СН2), 0,78-0,96 (м, 1Н, СН), 1,28-1,46 (м, 2Н, СН2), 1,47-1,58 (м, 1Н, СН), 1,59-1,72 (м, 2Н, СН2), 1,86-2,01 (м, 2Н, СН2), 2,12-2,43 (м, 4Н, СН2, СН2), 2,57 (д, J=6,6 Гц, 2Н, СН2), 2,73-2,96 (м, 2Н, СН2), 3,09 (дт, J=3,1, 11,8 Гц, 2Н, СН2), 4,21-4,55 (м, 2Н, СН2), 5,10 (с, 2Н, СН2), 5,21 (дд, J=5,3, 13,2 Гц, 1Н, NCH), 7,06-7,21 (м, 3H, Ar), 7,31 (д, J=7,9 Гц, 2H, Ar), 7,38-7,56 (м, 2H, Ar), (протон NH слегка виден). 13C ЯМР (ХЛОРОФОРМ-d) δ 0,03, 4,05, 8,18, 23,49, 31,64, 31,72, 37,75, 42,79, 45,15, 51,86, 53,75, 63,90, 70,30, 114,61, 116,40, 127,58, 129,55, 129,90, 130,12, 133,17, 133,68, 140,88, 153,91, 169,39, 169,74, 171,41. LC/MS m/e=502.
5.247 3-(4-{4-[4-(4-ФТОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]- БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
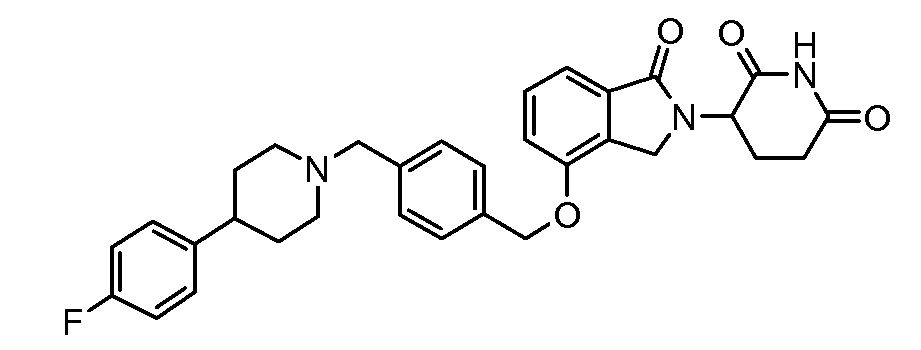
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,513 г, 1,157 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(4-фторфенил)пиперидин гидрохлорид (0,311 г, 1,736 ммоль) и N-этил-N-изопропилпропан-2-амин (0,574 мл, 3,47 ммоль). Мутную смесь перемешивали при температуре окружающей среды два часа. Растворитель CH3CN выпаривали, и к остатку добавляли воду (20 мл) и метиленхлорид (40 мл). Смесь промывали насыщенным раствором бикарбоната натрия (2×15 мл), водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4 и концентрировали до масла, которое очищали на колонке с силикагелем (MeOH/EtOAc), получая 3-(4-{4-[4-(4-фторфенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,315 г, 50%-ый выход); Т. пл.: 180-182°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% Н3Р04), 4,79 мин (95,7%). 1H ЯМР (ДМСО-d6) δ 1,51-1,80 (м, 4H, CH2, CH2), 1,89-2,12 (м, 3H, CH, CH2), 2,35-2,47 (м, 1H, CHH), 2,53-2,63 (м, 2H, CH, CHH), 2,83-2,99 (м, 3H, CHH, CH2), 3,50 (с, 2H, CH2), 4,19-4,48 (м, 2H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,04-7,15 (м, 2H, Ar), 7,22-7,39 (м, 6H, Ar), 7,41-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 33,16, 41,02, 45,09, 51,58, 53,55, 62,10, 69,45, 114,75, 115,03, 115,23, 127,62, 128,35, 128,45, 128,92, 129,82, 129,95, 133,31, 135,14, 138,44, 142,35, 153,51, 159,00, 162,19, 168,01, 170,98, 172,83. LC/MS m/e+=542. Вычислено для C32H32N3O4F: С, 70,96; H, 5,96; N, 7,76; F, 3,51. Найдено: С, 70,68; H, 5,90; N, 7,64; F, 3,54.
5.248 3-(4-{4-[4-(4-ФТОРБЕНЗИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
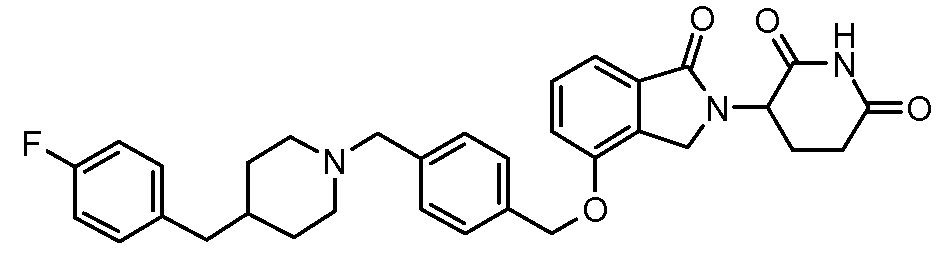
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,528 г, 1,191 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(4-фторбензил)пиперидин (0,345 г, 1,787 ммоль) и N-этил-N-изопропилпропан-2-амин (0,394 мл, 2,382 ммоль). Мутную смесь перемешивали при температуре окружающей среды два часа. Растворитель CH3CN выпаривали, и остаток перемешивали в смеси воды (20 мл), насыщенного раствора бикарбоната натрия (10 мл) и метиленхлорида (50 мл). Смесь промывали водой (2×20 мл), солевым раствором (10 мл), высушивали над сульфатом натрия и концентрировали до твердого вещества белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(4-{4-[4-(4-фторбензил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как белое пенистое твердое вещество (0,224 г, 34%-ый выход); Т. пл.: 148-150°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 за 5 мин (CH3CN/0,1% H3PO4), 4,86 мин (95,8%). 1H ЯМР (ДМСО-d6) δ 1,08-1,27 (м, 2H, СН2), 1,36-1,59 (м, 3Н, СНН, СН2), 1,77-1,91 (м, 2Н, СН2), 1,93-2,04 (м, 1Н, СНН), 2,35-(м, 2Н, СНН, СНН), 2,53-2,63 (м, 1Н, СНН), 2,70-2,81 (м, 2Н, СН2), 2,83-3,00 (м, 1Н, СНН), 3,41 (с, 2Н, СН2), 4,18-4,47 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,21 (с, 2H, CH2), 7,02-7,12 (м, 2H, Ar), 7,13-7,22 (м, 2H, Ar), 7,25-7,36 (м, 4H, Ar), 7,38-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 31,60, 37,32, 41,37, 45,09, 51,58, 53,15, 62,07, 69,45, 114,57, 114,85, 114,97, 115,21, 127,61, 128,73, 129,81, 129,94, 130,55, 130,65, 133,31, 135,04, 136,46, 138,66, 153,51, 158,98, 162,17, 168,01, 170,98, 172,83. LC/MS m/e+=556. Вычислено для C33H34N3O4F: C, 71,33; H, 6,17; N, 7,56. Найдено: С, 71,02; H, 5,84; N, 7,47.
5.249 3-(4-{4-[4-(3-ФТОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
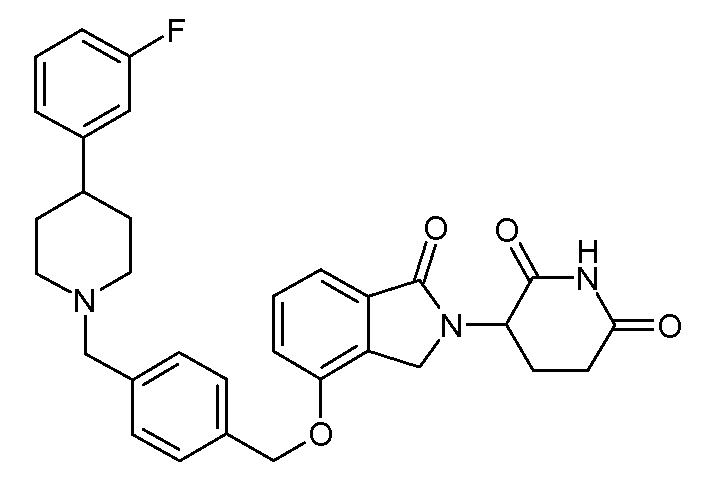
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,5 г, 1,128 ммоль) в CH2Cl2 добавляли 4-(3-фторфенил)пиперидин (0,101 г, 0,564 ммоль) и DIPEA (0,146 г, 1,13 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 2 часов. К смеси добавляли воду (15 мл) и экстрагировали. Органический слой концентрировали и очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH. Полученное твердое вещество перекристаллизовывали из CH3CN (5 мл), получая 3-(4-{4-[4-(3-фторфенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион (430 мг, 70%). Температура плавления: 200-202°C. LCMS m/e=542. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 6,95 мин (94,75%). 1НЯМР (ДМСО-d6) δ 1,38-1,80 (м, 4H, CH2, СН2), 1,86-2,15 (м, 3Н, СНН, СН2), 2,30-2,45 (м, J=4,2 Гц, 1Н, CHH), 2,55-2,68 (м, 1H, CHH), 2,76-3,05 (м, 3H, CHH, CH2), 3,50 (с, 2H, CH2), 4,09-4,53 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 6,79-7,19 (м, 3H, Ar), 7,24-7,60 (м, 8H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,38, 31,21, 32,80, 41,50, 45,09, 51,58, 53,46, 62,07, 69,45, 112,53, 112,81, 113,30, 113,58, 114,97, 115,23, 122,84, 127,62, 128,93, 129,82, 129,95, 130,06, 130,16, 133,32, 135,16, 138,41, 149,26, 149,34, 153,51, 160,69, 163,89, 168,01, 170,98, 172,83. Вычислено для C32H32FN3O4, C, 70,96%; H, 5,96%; N, 7,76%. Найдено: C, 70,57%; H, 6,01%; N, 7,67%.
5.250 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((4-(ТРИФТОРМЕТИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)-ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
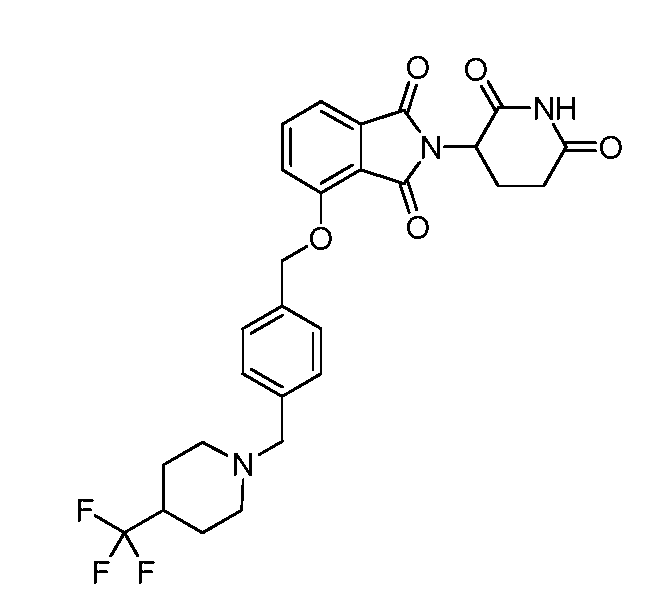
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 4-(трифторметил)пиперидин гидрохлорида (114 мг, 0,601 ммоль) в MeCN (10 мл) добавляли DIEA (0,334 мл, 1,914 ммоль), и полученную суспензию перемешивали при температуре окружающей среды в течение ~15 часов. Колпачок реакционной ампулы удаляли, и смесь нагревали до 80°C в течение ~4,5 часов. Концентрированную реакционную смесь (~5 мл) разделяли между EtOAc (~150 мл) и водой (~30 мл). Органический слой промывали 1н. NaHCO3 (2×30 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердый остаток. Добавляли MeCN (~3 мл) и воду ((~25 мл), и твердое вещество обрабатывали ультразвуком при температуре окружающей среды при перемешивании, пока не получали тонкодисперсную суспензию. Твердое вещество собирали на воронке из спеченного стекла со средним размером пор и высушивали в вакуумном сушильном шкафу при 60°C, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((4-(трифторметил)пиперидин-1-ил)метил)бензил)-окси)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (243 мг, 84%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 3,53 мин (99,2%); Т. пл.: 190-192°C; 1H ЯМР (ДМСО-d6) δ 1,36-1,55 (м, 2H, CHH, CHH), 1,66-1,83 (м, 2H, CHH, CHH), 1,87-2,14 (м, 3H, CHH, CHH, CHH), 2,15-2,38 (м, 1H, CH), 2,40-2,68 (м, 2H, CHH, CHH), 2,77-3,00 (м, 3H, CHH, CHH, CHH), 3,48 (с, 2H, CH2N), 5,09 (дд, J=5,5, 12,8 Гц, 1H, CH), 5,35 (с, 2H, CH2O), 7,25-7,40 (м, 2H, Ar), 7,44-7,53 (м, 3Н, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); остаточный EtOAc (~0,07 экв.); l3C ЯМР (ДМСО-d6) δ 21,95, 24,19, 30,90, 39,07, 48,73, 51,39, 61,61, 69,95, 115,50, 116,56, 120,19, 127,29, 128,84, 133,26, 134,73, 136,99, 138,12, 155,53, 165,29, 166,75, 169,87, 172,72; сигнал для CF3 и CCF3 частично скрыт ДМСО-d6; 19F ЯМР (ДМСО-d6) δ -72,35; LCMS: MH=530; Вычислено для C27H26F3N3O5+0,1 H2O+0,07 EtOAc: C, 60,96; H, 5,02; N, 7,82; F, 10,60: Найдено: C, 61,17; H, 4,98; N, 7,46; F, 10,24.
5.251 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-(ПИПЕРИДИН-1-ИЛМЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
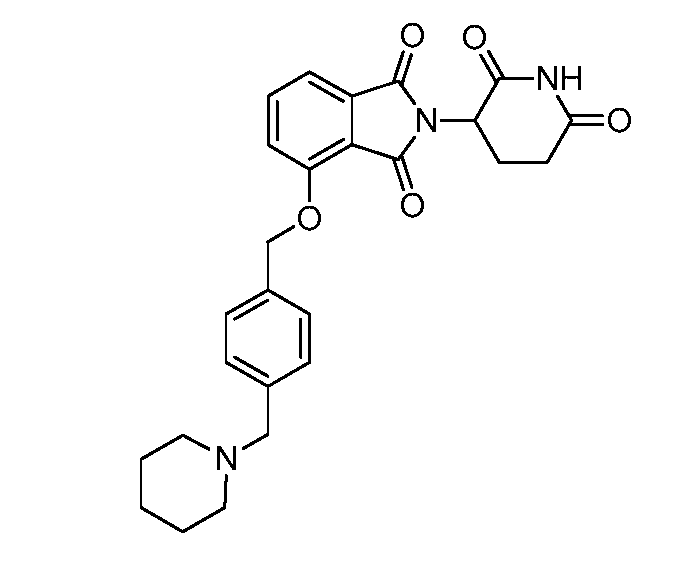
К суспензии 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (230 мг, 0,503 ммоль) и пиперидина (0,055 мл, 0,553 ммоль) в сухом MeCN (15 мл, 287 ммоль) добавляли DIEA (0,307 мл, 1,760 ммоль), и полученную суспензию перемешивали при температуре окружающей среды в течение 2,5 часов. Реакционную смесь концентрировали в вакууме до стекловидного твердого вещества. Растирание этого твердого вещества с раствором ~1:1 MeCN/Et2O (~10 мл) дало хорошо диспергированную суспензию. Твердое вещество отфильтровывали и промывали дополнительным количеством Et2O (40 мл). Остаток разделяли между EtOAc (~150 мл) и 1н. Na2CO3 (~30 мл). Органический слой промывали дополнительным количеством 1н. Na2CO3 (~30 мл) и солевым раствором, затем высушивали (Na2SO4) и концентрировали в вакууме до стекловидного твердого вещества. Это твердое вещество растирали с экстенсивной обработкой ультразвуком в растворе MeCN (~2 мл) и Et2O (~20 мл), пока не образовывалось тонкодисперсное твердое вещество. Это твердое вещество собирали на воронке из спеченного стекла со средним размером пор с отсасыванием, затем промывали дополнительным количеством Et2O (~20 мл). Корку высушивали в вакуумном сушильном шкафу в течение ночи при 50°C, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-(пиперидин-1-илметил)бензил)окси)изоиндолин-1,3-дион как твердое вещество желто-коричневого цвета (110 мг, 47%): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,47 мин (98,9%); Т. пл.: 153-155°C; 1H ЯМР (ДМСО-d6) δ 1,38 (д, J=4,7 Гц, 2H, CH2), 1,43-1,59 (м, 4H, CH2, CH2), 1,94-2,13 (м, 1H, CHH), 2,19-2,40 (м, 4H, CH2, CH2), 2,42-2,67 (м, 2H, CHH, CHH), 2,77-2,99 (м, 1H, CHH), 3,42 (с, 2H, CH2N), 5,09 (дд, J=5,4, 12,9 Гц, 1H, CH), 5,35 (с, 2H, CH2O), 7,26-7,37 (м, 2H, Ar), 7,40-7,53 (м, 3Н, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,3 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 23,96, 25,51, 30,90, 48,73, 53,85, 62,50, 69,98, 115,47, 116,56, 120,19, 127,19, 128,82, 133,24, 134,54, 136,97, 138,52, 155,53, 165,27, 166,75, 169,87, 172,71; LCMS: MH=462; Вычислено для C26H27N3O5+0,18 H2O: C, 67,19; H, 5,93; N, 9,04; Найдено: С, 67,18; H, 5,78; N, 8,84.
5.252 4-((4-((4,4-ДИМЕТИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИН-1,3-ДИОН
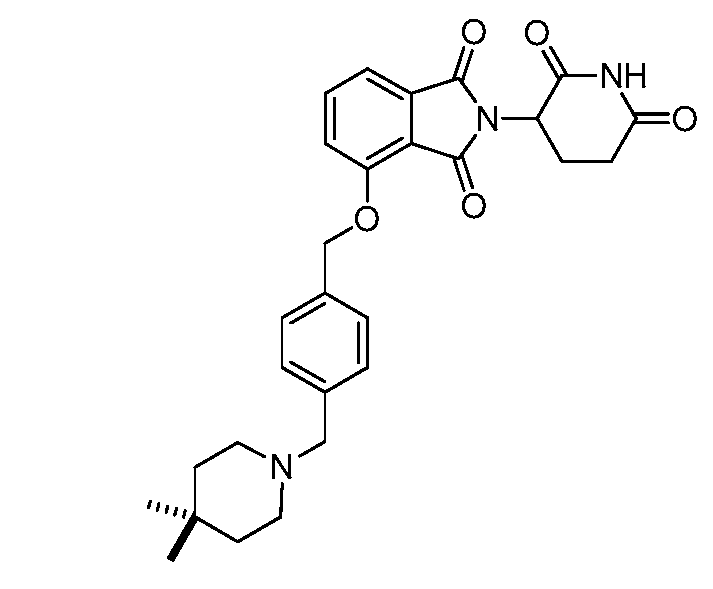
К смеси 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) и 4,4-диметилпиперидин гидрохлорида (90 мг, 0,601 ммоль) в сухом MeCN (10 мл) добавляли DIEA (0,334 мл, 1,914 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение 17 часов, тогда колпачок ампулы удаляли, и смесь нагревали до 75°C. Через ~2,5 часа ~1/2 объема оставалось в виде густой суспензии. Смесь охлаждали при мягком перемешивании и затем выдерживали при 4°C в течение ночи. К смеси добавляли DIEA (250 мкл) при перемешивании в течение 30 мин Суспензию фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием, и корку промывали водой (~30 мл). Собранное твердое вещество высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 50°C в течение 6 часов, получая 4-((4-((4,4-диметилпиперидин-1-ил)метил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион в форме твердого вещества грязно-белого цвета (230 мг, 86%): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 3,88 мин (97,8%); Т. пл.: 208-210°C; 1H ЯМР (ДМСО-d6) δ 0,89 (с, 6H, CH3, СН3), 1,19-1,41 (м, 4Н, СН2, СН2), 1,95-2,15 (м, 1Н, СНН), 2,20-2,42 (м, 4Н, СН2, СН2), 2,42-2,66 (м, 2Н, СНН, СНН), 2,79-2,98 (м, 1Н, СНН), 3,46 (с, 2Н, СН2), 5,09 (дд, J=5,5, 12,8 Гц, 1Н, CH), 5,34 (с, 2H, CH2O), 7,28-7,39 (м, 2H, Ar), 7,39-7,52 (м, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,82 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 28,04, 28,14, 30,90, 38,25, 48,73, 49,32, 62,03, 69,98, 115,48, 116,56, 120,19, 127,20, 128,81, 133,24, 134,57, 136,97, 138,68, 155,53, 165,27, 166,75, 169,87, 172,72; LCMS: MH=490; Вычислено для C28H31N3O5+0,3 H2O: C, 67,94; H, 6,43; N, 8,49; Найдено: С, 67,91; H, 6,42; N, 8,60.
5.253 3-[4-(4-БРОММЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
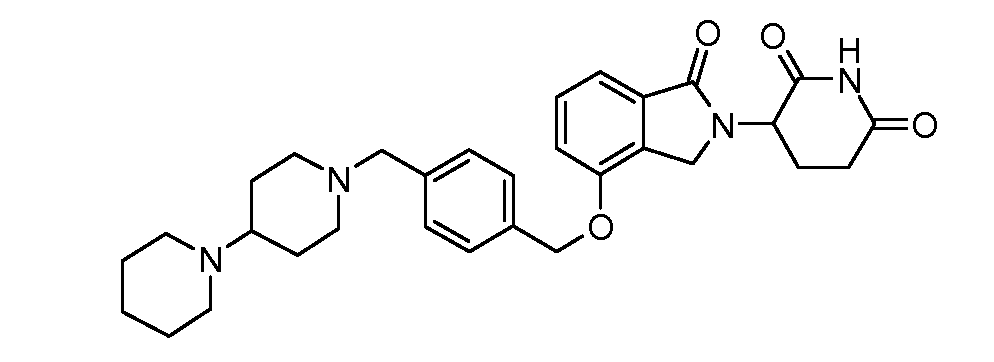
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,486 г, 1,096 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 1,4'-бипиперидин дигидрохлорид (0,397 г, 1,645 ммоль) и N-этил-N-изопропилпропан-2-амин (0,725 мл, 4,39 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение двух часов. Растворитель выпаривали, получая твердое вещество белого цвета, которое перемешивали в воде (20 мл) и метиленхлориде (40 мл). Это вещество промывали насыщенным раствором бикарбоната натрия (2×80 мл), солевым раствором (50 мл), высушивали над сульфатом натрия и концентрировали до белого пенистого твердого вещества (0,5 г), которое очищали препаративной ВЭЖХ (ацетонитрил/вода в 0,1% муравьиной кислоты), получая 3-[4-(4-бромметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,25 г, 43%-ый выход); Т. пл.: 202-204°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 3,64 мин (98,5%). 1H ЯМР (ДМСО-d6) δ 1,29-1,40 (м, 3Н, CH2, CH), 1,41-1,51 (м, 5Н, СН2, СН2, СН), 1,63 (дд, J=3,3, 12,0 Гц, 2Н, СН2), 1,81-1,93 (м, 2Н, СН2), 1,94-2,04 (м, 1Н, СНН), 2,08-2,21 (м, 1Н, СН), 2,35-2,48 (м, 5Н, СНН, СН2, СН2), 2,53-2,63 (м, 1Н, СНН), 2,75-2,99 (т, 3Н, СНН, СН2), 3,42 (с, 2Н, СН2), 4,19-4,48 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,22 (с, 2H, CH2), 7,26-7,36 (м, 3H, Ar), 7,39-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d3) δ 22,36, 24,58, 26,08, 27,54, 31,21, 45,09, 49,70, 51,56, 52,85, 61,84, 61,99, 69,44, 114,95, 115,21, 127,61, 128,82, 129,81, 129,94, 133,31, 135,09, 138,56, 153,51, 168,01, 170,98, 172,83. LC/MS m/e=531. Вычислено для C31H38N4O4 (+0,7 H2O): C, 68,54; H, 7,31; N, 10,31. Найдено: С, 68,29; H, 7,49; N, 10,16.
5.254 3-(4-{4-[4-(3-ХЛОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
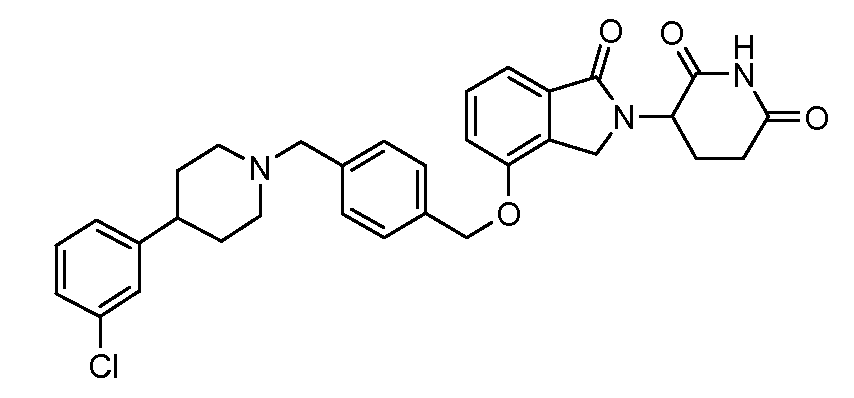
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,354 г, 0,799 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(3-хлорфенил)пиперидин гидрохлорид (0,278 г, 1,198 ммоль) и N-этил-N-изопропилпропан-2-амин (0,396 мл, 2,396 ммоль). Мутную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и остаток перемешивали в метиленхлориде (120 мл), промывали насыщенным раствором бикарбоната натрия (2×50 мл), солевым раствором (50 мл), высушивали над сульфатом натрия, концентрировали и очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(4-{4-[4-(3-хлорфенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,246 г, 55%-ый выход); Т. пл.: 218-220°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN)/1% Н3РО4), 5,63 мин (95,9%). 1H ЯМР (ДМСО-d6) δ 1,54-1,80 (м, 4H, СН2, СН2), 1,92-2,11 (м, 3Н, СНН, СН2), 2,36-2,48 (м, 1H, СНН), 2,53-2,64 (м, 1Н, СНН), 2,83-2,99 (м, 3Н, СНН, СН2), 3,50 (с, 2Н, СН2), 4,21-4,49 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,23 (с, 2H, CH2), 7,18-7,26 (м, 2H, Ar), 7,27-7,39 (м, 6H, Ar), 7,42-7,54 (м, 3H, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,38, 31,21, 32,78, 41,44, 45,10, 51,59, 53,43, 62,03, 69,45, 114,98, 115,23, 125,43, 125,96, 126,70, 127,62, 128,93, 129,82, 129,95, 130,16, 132,97, 133,32, 135,16, 138,41, 148,83, 153,53, 168,01, 170,96, 172,82. LC/MS m/e=558, 560. Вычислено для C32H32N3O4Cl (+0,3 H2O): C, 68,21; H, 5,83; N, 7,46. Найдено: С, 67,93; H, 5,64; N, 7,29.
5.255 3-{1-ОКСО-4-[4-(4-M-ТОЛИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
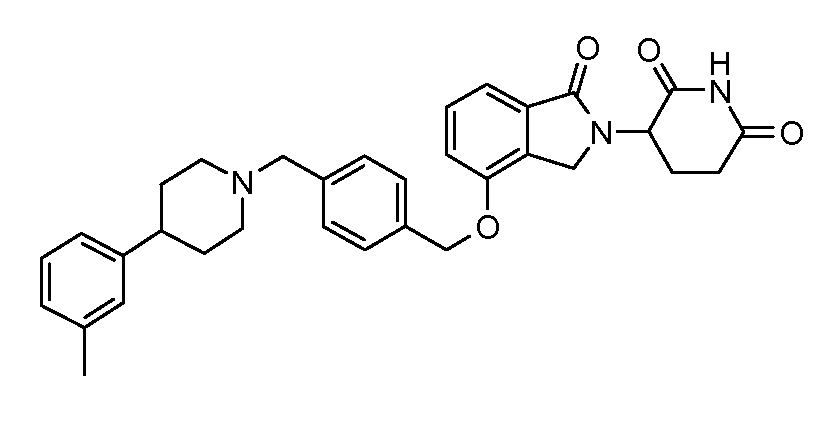
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,352 г, 0,794 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-м-толилпиперидин (0,209 г, 1,191 ммоль) и N-этил-N-изопропилпропан-2-амин (0,394 мл, 2,382 ммоль). Раствор стал мутным через ~5 минут, и его перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, получая твердое вещество грязно-белого цвета, которое перемешивали в метиленхлориде (120 мл), промывали насыщенным раствором бикарбоната натрия (2×50 мл), солевым раствором (50 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета. Это вещество очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{1-оксо-4-[4-(4-м-толил-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,272 г, 63%-ый выход); Т. пл.: 227-229°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 5,45 мин (98,6%). 1H ЯМР (ДМСО-d6) δ 1,54-1,78 (м, 4H, СН2, СН2), 1,92-2,11 (м, 3Н, СНН, СН2), 2,27 (с, 3Н, СН3), 2,36-2,48 (м, 2Н, СНН, СН), 2,53-2,63 (м, 1Н, СНН), 2,83-2,99 (м, 3Н, СНН, СН2), 3,50 (с, 2Н, СН2), 4,20-4,47 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,23 (с, 2H, CH2), 6,95-7,07 (м, 3H, Ar), 7,12-7,20 (м, 1H, Ar), 7,29-7,39 (м, 4H, Ar), 7,41-7,54 (м, 3H, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,06, 22,36, 31,21, 33,12, 41,79, 45,10, 51,59, 53,65, 62,12, 69,47, 114,98, 115,23, 123,69, 126,59, 127,40, 127,64, 128,18, 128,90, 129,82, 129,95, 133,32, 135,13, 137,23, 138,53, 146,17, 153,53, 168,01, 170,96, 172,82. LC/MS m/e=538. Вычислено для C33H35N3O4: C, 73,72; H, 6,56; N, 7,82. Найдено: С, 73,37; H, 5,53; N, 7,52.
5.256 3-{1-ОКСО-4-[4-(4-M-ТОЛИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
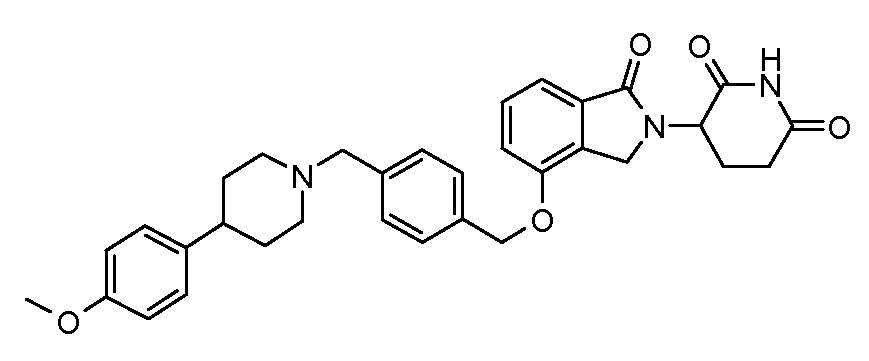
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,354 г, 0,799 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(4-метоксифенил)пиперидин (0,229 г, 1,198 ммоль) и N-этил-N-изопропилпропан-2-амин (0,396 мл, 2,396 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и полученное твердое вещество грязно-белого цвета перемешивали в метиленхлориде (100 мл), промывали насыщенным раствором бикарбоната натрия (2×80 мл), солевым раствором (50 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{1-оксо-4-[4-(4-м-толил-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,34 г, 77%-ый выход); Т. пл.: 189-191°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 5,42 мин (98,2%). 1H ЯМР (ДМСО-d6) δ 1,51-1,77 (м, 4H, CH2, CH2), 1,92-2,11 (м, 3Н, CHH, CH2), 2,34-2,48 (м, 2H, СНН, CH), 2,53-2,64 (м, 1H, CHH), 2,82-3,01 (м, 3H, CHH, CH2), 3,44-3,55 (м, 2H, CH2), 3,71 (с, 3H, CH3), 4,20-4,49 (м, 2H, CH2), 5,11 (дд, J= 5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 6,78-6,90 (м, 2H, Ar), 7,09-7,19 (м, 2H, Ar), 7,28-7,39 (м, 4H, Ar), 7,41-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 33,34, 40,93, 45,10, 51,59, 53,68, 54,96, 62,15, 69,47, 113,68, 114,97, 115,23, 127,52, 127,62, 128,90, 129,82, 129,95, 133,32, 135,13, 138,24, 138,51, 153,53, 157,49, 168,01, 170,96, 172,82. LC/MS m/e=554. Вычислено для C33H35N3O5: С, 71,59; H, 6,37; N, 7,59. Найдено: С, 71,29; H, 6,30; N, 7,57.
5.257 3-(4-{4-[4-(4-ХЛОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
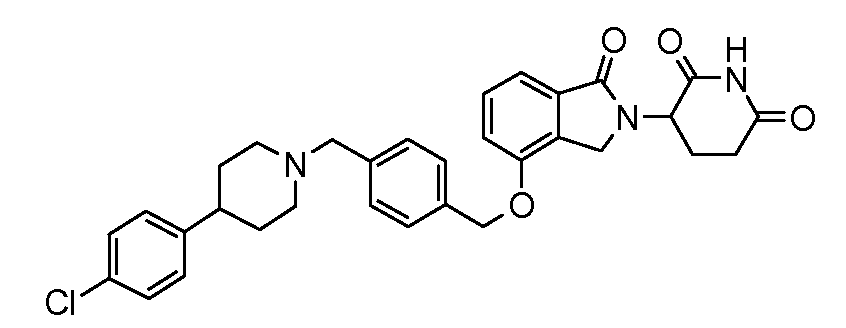
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,354 г, 0,799 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-(4-хлорфенил)пиперидин гидрохлорид (0,278 г, 1,198 ммоль) и N-этил-N-изопропилпропан-2-амин (0,396 мл, 2,396 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, получая твердое вещество грязно-белого цвета, которое перемешивали в метиленхлориде (100 мл), промывали насыщенным раствором бикарбоната натрия (2×80 мл), солевым раствором (80 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(4-{4-[4-(4-хлорфенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,286 г, 52%-ый выход); Т. пл.: 198-200°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 5,63 мин (98,9%). 1H ЯМР (ДМСО-d6) δ 1,52-1,78 (м, 4H, СН2, СН2), 1,92-2,11 (м, 3Н, СНН, СН2), 2,36-2,48 (м, 1Н, СНН), 2,53-2,64 (м, 1Н, СНН), 2,82-3,00 (м, 3Н, СНН, СН2), 3,50 (с, 2Н, СН2), 4,20-4,49 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,23 (с, 2H, CH2), 7,22-7,39 (м, 8H, Ar), 7,41-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH). l3C ЯМР (ДМСО-d6) δ 22,38, 31,21, 32,93, 41,12, 45,10, 51,58, 53,47, 62,07, 69,45, 114,98, 115,23, 127,62, 128,19, 128,60, 128,90, 129,82, 129,95, 130,45, 133,32, 135,14, 138,44, 145,20, 153,53, 168,01, 170,96, 172,82. LC/MS m/e=558. 560. Вычислено для C32H32N3O4Cl (+0,1 H2O): C, 68,65; H, 5,80; N, 7,51. Найдено: С, 68,44; H, 5,73; N, 7,41.
5.258 (S)-3-(4-((4-((4-ИЗОПРОПИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-3-МЕТИЛПИПЕРИДИН-2,6-ДИОН
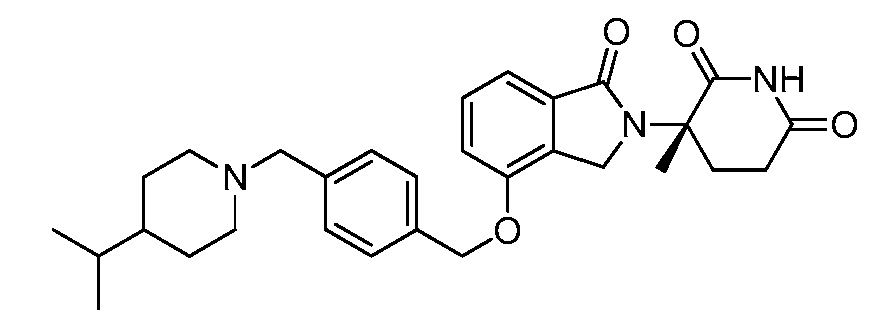
(S)-3-(4-(4-(Бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-дион (500 мг, 0,765 ммоль) растворяли в ацетонитриле (5 мл) и добавляли 4-изопропилпиперидин (107 мг, 0,842 ммоль) и DIEA (0,160 мл, 0,918 ммоль). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Затем смесь разделяли между водой (75 мл) и EtOAc (75 мл), и органическую фазу промывали водой (75 мл) и экстрагировали 1н. HCl (2×75 мл). Объединенные водные экстракты промывали EtOAc (2×75 мл), подщелачивали (твердый Na2CO3) и затем экстрагировали в EtOAc (2×75 мл). Объединенные экстракты промывали водой (75 мл), высушивали (MgSO4), получая продукт как твердое вещество белого цвета, 230 мг (60%-ый выход); Т. пл. 160-162°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 10/90-90/10 CH3CN/0,1% H3PO4 за 10 мин: 6,05 (96,32%). 1H ЯМР (ДМСО-d6) δ 0,84 (д, J=6,6 Гц, 6H), 0,91-1,07 (м, 1H), 1,13-1,26 (м, 2H), 1,31-1,46 (м, 1H), 1,49-1,63 (м, 2H), 1,68 (с, 3H), 1,76-1,97 (м, 3H), 2,52-2,91 (м, 5H), 3,43 (с, 2H), 4,55 (д, J=17,6 Гц, 1H), 4,67 (д, J=17,6 Гц, 1H), 5,24 (с, 2H), 7,22 (д, J=7,4 Гц, 1H), 7,26-7,37 (м, 3H), 7,39-7,52 (м, 3H), 10,84 (с, 1H). 13C ЯМР (ДМСО-d6) δ 19,66, 20,70, 27,77, 28,86, 29,01, 31,94, 41,82, 45,59, 53,65, 57,18, 62,13, 69,45, 114,79, 127,67, 128,82, 129,74, 129,97, 133,91, 135,06, 138,6, 138,7, 153,38, 167,00, 172,41, 173,49. Вычислено для C30H37N3O4: C, 71,54%; H, 7,40%; N, 8,34%; Найдено: С, 71,23%; H, 7,61%; N, 8,12%.
5.259 3-{1-ОКСО-4-[4-(4-ТРИФТОРМЕТАНСУЛЬФОНИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
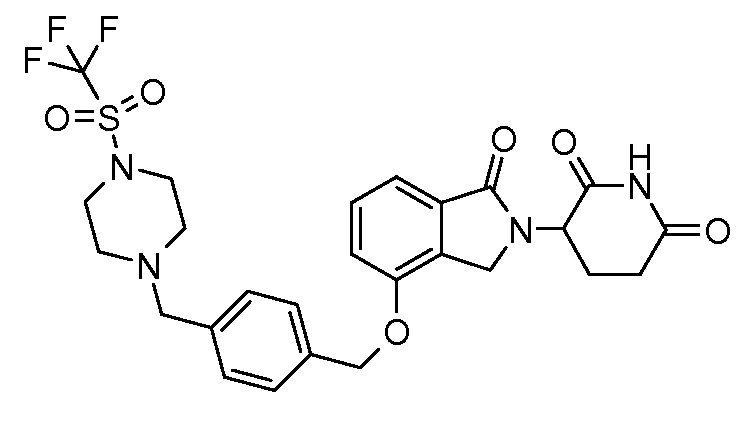
Стадия 1: Трет-бутиловый эфир 4-трифторметансульфонил-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (4,6 г, 24,7 ммоль) и триэтиламина (4,1 мл, 29,6 ммоль) в THF (50 мл) при 0°C добавляли трифторметансульфонил хлорид (3,1 мл, 29,6 ммоль) через шприц. Полученную суспензию перемешивали при 0°C в течение 2 часов. Реакционную смесь разбавляли EtOAc (100 мл) и промывали водой (50 мл), HCl (1н., водный раствор, 50 мл), NaHCO3 (насыщ. водный раствор, 50 мл) и солевым раствором (50 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая трет-бутиловый эфир 4-трифторметансульфонил-пиперазин-1-карбоновой кислоты как прозрачное масло (5,9 г, 87%-ый сырой выход). Это соединение использовали на следующей стадии без дальнейшей очистки; LCMS MH=319.
Стадия 2: 1-Трифторметансульфонил-пиперазин
К перемешиваемому раствору 4-(трифторметилсульфонил)пиперазин-1-трет-бутилкарбоксилата (5,9 г, 18,54 ммоль) в DCM (20 мл) при температуре окружающей среды добавляли TFA (10,00 мл, 130 ммоль). Сразу образовывались пузырьки, и реакционную смесь охлаждали на бане лед/вода. Реакционную смесь перемешивали при температуре окружающей среды в течение 17 часов, и к реакционной смеси добавляли простой диэтиловый эфир (100 мл) и перемешивали при температуре окружающей среды в течение 30 мин Суспензию фильтровали, и твердое вещество белого цвета промывали простым диэтиловым эфиром (2×25 мл). Твердое вещество (5,5 г) добавляли к NaHCO3 (водный раствор, насыщ., 35 мл) и EtOAC (80 мл). Смесь экстрагировали, и водный слой экстрагировали EtOAc (80 мл). Органические слои объединяли и высушивали MgSO4. Органический слой концентрировали под вакуумом, получая 1-трифторметансульфонил-пиперазин как светло-коричневое масло (1,9 г, 47%-ый выход). 1H ЯМР (ДМСО-d6) δ 2,76 (т, J=5,0 Гц, 4H, CH2, CH2), 3,36 (уш.с, 4H, CH2, CH2); LCMS MH=219.
Стадия 3: 3-{1-Оксо-4-[4-(4-трифторметансульфонил-пиперазин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (1 г, 2,2 ммоль) в DCM (10 мл) на бане лед/вода добавляли раствор 1-(трифторметилсульфонил)пиперазина (0,640 г, 2,9 ммоль) в DCM (10 мл), с последующим добавлением DIPEA (0,79 мл, 4,5 ммоль). Полученный раствор сохраняли в холодильнике в течение двух дней, и к реакционной смеси добавляли DCM (80 мл) и воду (30 мл). Смесь экстрагировали, и органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая твердое вещество белого цвета. Это твердое вещество очищали, после перемешивания в простом диэтиловом эфире (20 мл), получая 3-{1-оксо-4-[4-(4-трифторметансульфонил-пиперазин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (700 мг, 53%-ый выход). Т. пл.: 135-137°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04(м, 1H, CHH), 2,34-2,48 (м, 5H, CH2, СН2, СНН), 2,54-2,64 (м, 1Н, СНН), 2,82-3,01 (м, 1Н, СНН), 3,40-3,52 (м, 4Н, СН2, СН2), 3,55 (с, 2Н, СН2), 4,25 (д, J=17,6 Гц, 1Н, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,27-7,41 (м, 4H, Ar), 7,41-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,29, 31,11, 45,00, 46,33, 51,51, 51,80, 60,95, 69,28, 118,06 (кв, J=324,6 Гц, CF3), 114,90, 115,22, 127,62, 128,90, 129,73, 129,88, 133,24, 135,45, 137,25, 153,41, 167,92, 170,89, 172,74; LCMS MH=581.
Стадия 4: 3-(1-оксо-4-((4-((4-((трифторметил)сульфонил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид
К перемешиваемой смеси 3-(1-оксо-4-(4-((4-(трифторметилсульфонил)пиперазин-1-ил)метил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-диона (680 мг, 1,17 ммоль) в ацетонитриле (10 мл) добавляли HCl в простом диэтиловом эфире (2 М, 1,7 мл, 3,5 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение 7 часов, и смесь фильтровали. Твердое вещество белого цвета промывали ацетонитрилом (2×10 мл) и высушивали в вакуумном сушильном шкафу, получая 3-(1-оксо-4-((4-((4-((трифторметил)сульфонил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (650 мг, 90%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 6,53 мин (99,9%); Т. пл.: 228-230°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,05 (м, 1H, CHH), 2,41-2,47 (м, 1H, CHH), 2,54-2,65 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 3,12-3,42 (м, 4H, CH2, CH2), 3,67-4,09 (м, 4H, CH2, CH2), 4,22-4,50 (м, 4H, CHH, CHH, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,29 (с, 2H, CH2), 7,34 (д, J=7,6 Гц, 2H, Ar), 7,50 (т, J=7,9 Гц, 1H, Ar), 7,58 (д, J=7,9 Гц, 2H, Ar), 7,66 (д, J=8,1 Гц, 2H, Ar), 10,98 (с, 1H, CHH), 11,83 (с, уш., 1H, HCl); 13C ЯМР (ДМСО-d6) δ 22,30, 31,11, 43,11, 45,00, 49,90, 51,52, 58,21, 68,90, 114,86, 115,29, 119,34 (кв, J=321 Гц, CF3), 127,82, 128,95, 129,77, 129,89, 131,43, 133,27, 138,00, 153,28, 167,90, 170,90, 172,77; LCMS MH=581; Вычислено для C26H27F3N4O6S+HCl+2H2O: C, 47,82; H, 4,94; N, 8,58; Cl, 5,43; Найдено: C, 47,51; H, 5,01; N,8,37; Cl, 5,24.
5.260 3-{1-ОКСО-4-[4-(4-П-ТОЛИЛ-ПИПЕРИДИН-1-ИЛМЕТИЛ)- БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
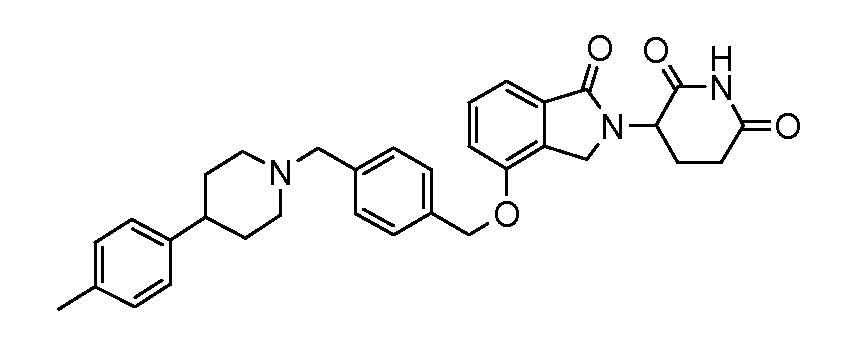
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,352 г, 0,794 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли 4-п-толилпиперидин (0,209 г, 1,191 ммоль) и N-этил-N-изопропилпропан-2-амин (0,394 мл, 2,382 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали, и полученное твердое вещество грязно-белого цвета перемешивали в метиленхлориде (100 мл), промывали насыщенным раствором бикарбоната натрия (2×80 мл), солевым раствором (50 мл), высушивали и концентрировали до твердого вещества грязно-белого цвета, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-{1-оксо-4-[4-(4-п-толил-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,144 г, 33%-ый выход); Т. пл.: 208-210°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 на 5 мин (CH3CN/0,1% Н3РО4), 5,60 мин (96,6%). 1H ЯМР (ДМСО-d6) δ 1,52-1,77 (м, 4H, CH2, CH2), 1,91-2,10 (м, 3H, CHH, CH2), 2,25 (с, 3H, CH3), 2,36-2,48 (м, 2H, CHH, CH), 2,53-2,63 (м, 1H, CHH), 2,82-3,00 (м, 3H, CHH, CH2), 3,49 (с, 2H, CH2), 4,20-4,48 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,04-7,15 (м, 4H, Ar), 7,30-7,39 (м, 4H, Ar), 7,41-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 20,57, 22,36, 31,21, 33,18, 41,39, 45,10, 51,58, 53,65, 62,13, 69,47, 114,98, 115,23, 126,50, 127,64, 128,83, 128,90, 129,82, 129,95, 133,32, 134,81, 135,13, 138,51, 143,19, 153,53, 168,01, 170,98, 172,82. LC/MS m/e=538. Вычислено для C33H35N3O4 (+0,2 H2O): C, 73,23; H, 6,59; N, 7,76. Найдено: С, 73,01; H, 6,38; N, 7,54.
261 3-{1-ОКСО-4-[4-(3',4',5',6'-ТЕТРАГИДРО-2'H-[3,4'] БИПИРИДИНИЛ-1'-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
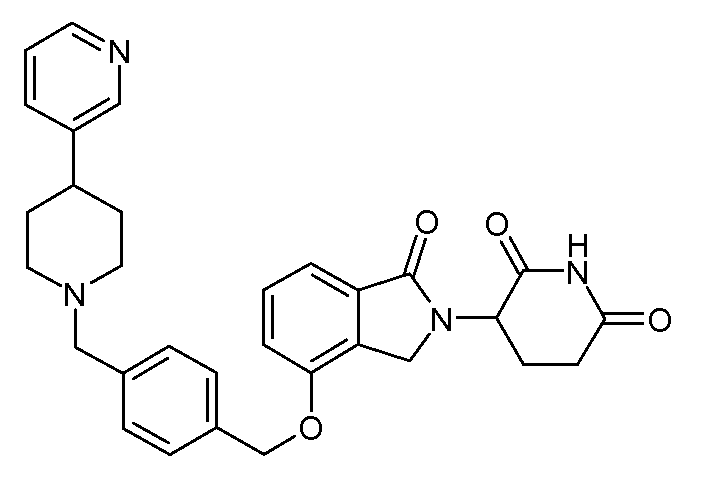
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,5 г, 1,128 ммоль) в CH2Cl2 добавляли 3-(пиперидин-4-ил)пиридин (0,192 г, 1,184 ммоль), затем DIPEA (0,591 мл, 3,38 ммоль). Смесь перемешивали при температуре окружающей среды в течение 5 часов, затем добавляли воду (15 мл). После экстракции органический слой концентрировали, получая твердое вещество желтого цвета. Это твердое вещество повторно кристаллизовали из CH3CN (5 мл), получая 3-{1-оксо-4-[4-(3',4',5',6'-тетрагидро-2'H-[3,4']бипиридинил-1'-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества (200 мг, 34%). Т.пл.: 161-163°C. LCMS m/e=525. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 5,11 мин (94%). 1H ЯМР (ДМСО-d6) δ 1,57-1,80 (м, 5H, CH2, CH2, СН), 1,89-2,15 (м, 3Н, СН2, СНН), 2,43-2,50 (м, 1Н, СНН), 2,55-2,65 (м, 1Н, СНН), 2,80-3,04 (т, 3Н, СНН, СН2), 3,51 (с, 2Н, СН2), 4,12-4,48 (м, 2Н, СН2), 5,11 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,23 (с, 2H, CH2), 7,23-7,39 (м, 5H, Ar), 7,40-7,54 (м, 3H, Ar), 7,67 (дт, J=1,9,7,7 Гц, 1H, Ar), 8,40 (дд, J=1,5, 4,7 Гц, 1H, Ar), 8,47 (д, J=1,9 Гц, 1H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 14,09, 21,30, 30,15, 31,60, 44,03, 50,52, 52,38, 61,01, 68,38, 113,93, 114,17, 122,41, 126,58, 127,89, 128,77, 128,90, 132,27, 133,06, 134,12, 137,34, 140,29, 146,32, 147,48, 152,46, 166,96, 169,93, 171,78. Вычислено для C31H32N4O4: C% 70,97, H% 6,15, N% 10,68. Найдено C% 68,36, H% 5,89, N% 10,08.
5.262 (S)-3-МЕТИЛ-3-(1-ОКСО-4-((4-((4-(ТРИФТОРМЕТИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
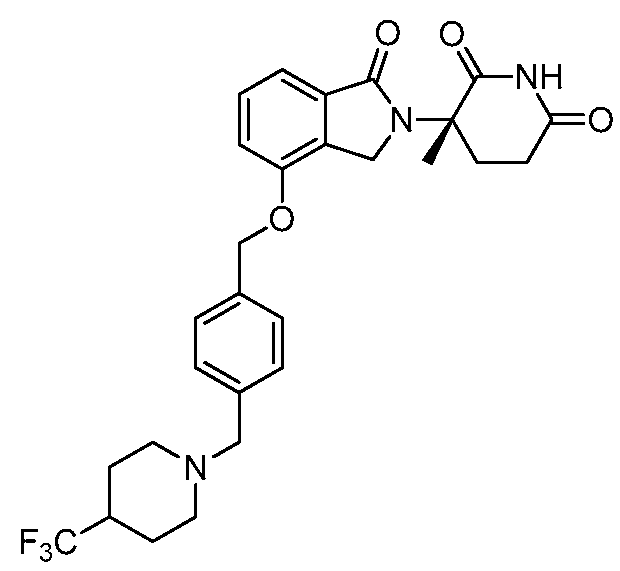
Стадия 1: (S)-3-(4-((4-(Гидроксиметил)бензил)окси)-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-дион
Смесь (S)-3-(4-гидрокси-1-оксоизоиндолин-2-ил)-3-метилпиперидин-2,6-диона (1,9 г, 6,93 ммоль), (4-(хлорметил)фенил)метанола (1,085 г, 6,93 ммоль), йодида калия (0,115 г, 0,693 ммоль) и карбоната калия (1,053 г, 7,62 ммоль) в DMF (50 мл) перемешивали при температуре окружающей среды в течение 9 дней. Смесь упаривали под вакуумом. К остатку добавляли воду (150 мл) и EtOAc (150 мл) и полученную суспензию перемешивали в течение 16 часов. Суспензию фильтровали, и фильтр промывали водой (50 мл) и EtOAc (2×50 мл). Органическую фазу промывали 10%-ым водным раствором карбоната натрия (2×75 мл), 1н. HCl (100 мл) и солевым раствором (100 мл), высушивали (MgSO4) и упаривали. Остаток объединяли с отфильтрованным твердым осадком, получая в общей сложности 2,09 г сырого продукта.
Стадия 2: (S)-4-(((2-(3-Метил-2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)окси)метил)бензил метансульфонат
Остаток суспендировали в 50 мл ацетонитрила, и смесь охлаждали до 0°C. Добавляли метансульфонил хлорид (0,538 мл, 6,93 ммоль) и DIEA (1,448 мл, 8,31 ммоль) и смесь перемешивали при 0°C в течение 30 мин Затем смесь гасили добавлением AcOH (0,5 мл) и затем воды (5 мл) и упаривали. Остаток разделяли между EtOAc (125 мл) и солевым раствором (125 мл). Твердое вещество, которое не растворялось ни в одной фазе, фильтровали, и фазы разделяли. Твердое вещество объединяли с органическим слоем и упаривали. Остаток хроматографировали, используя градиент метиленхлорид-ацетонитрил. Продукт элюировали в ~40% ACN. Выход после высушивания составил 1,3 г (40% за две стадии); 1H ЯМР (ДМСО-d6) δ 1,69 (с, 3Н), 1,82-1,95 (м, 1H), 2,52-2,83 (м, 3H), 3,24 (с, 3H), 5,27 (с, 2H), 5,30 (с, 2H), 7,17-7,35 (м, 2H), 7,39-7,62 (м, 5H), 10,85 (с, 1H).
Стадия 3: (S)-3-Метил-3-(1-оксо-4-((4-((4-(трифторметил)пиперидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион
Смесь (S)-4-((2-(3-метил-2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил метансульфонат (0,40 г, 0,847 ммоль) и 4-(трифторметил)пиперидин гидрохлорид (0,161 г, 0,847 ммоль) охлаждали до 0°C и затем добавляли DIEA (0,310 мл, 1,778 ммоль). Через 6 часов rxn выпаривали под вакуумом, и остаток растворяли и разделяли между EtOAc (50 мл) и водой (50 мл), и водную фазу экстрагировали EtOAc (50 мл). Объединенные органические фракции экстрагировали 1н. HCl (2×50 мл). Объединенные водные экстракты промывали EtOAc (50 мл) и затем подщелачивали с использованием 10%-го водного раствора карбоната натрия. Эту смесь затем экстрагировали EtOAc (2×50 мл), и объединенные экстракты промывали солевым раствором (100 мл), высушивали (MgSO4) и упаривали под вакуумом, получая 0,39 г как твердое вещество белого цвета, при 87%-ом выходе; Т. пл. 168-170°C. ВЭЖХ: Waters X-Terra, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 5/95-95/5 CH3CN-0,1% NH4(HCO2) за 5 мин, затем 10 мин 95/5 CH3CN-0,1% NH4(HCO2): 5,73 (100%). 1H ЯМР (ДМСО-d6) δ 1,33-1,54 (м, 2H), 1,68 (с, 3Н), 1,73-1,81 (м, 2H), 1,83-2,04 (м, 3Н), 2,16-2,35 (м, 1H), 2,51-2,80 (м, 3H), 2,81-2,95 (м, 2H), 3,48 (с, 2H), 4,56 (д, J=17,6 Гц, 1H), 4,68 (д, J=17,6 Гц, 1H), 5,24 (с, 2H), 7,23 (д, J=7,4 Гц, 1H), 7,27-7,37 (м, 3H), 7,40-7,52 (м, 3H), 10,85 (с, 1H). 13C ЯМР (ДМСО-d6) δ 20,68, 24,24, 27,77, 28,99, 38,93, (кв, J=38,9 Гц,), 45,59, 51,43, 57,18, 61,62, 69,41, 114,79, 114,81, 127,71, 127,87 (кв, J=278 Гц,), 128,82, 129,74, 129,97, 133,91, 135,22, 138,18, 153,38, 167,00, 172,39, 173,47. Вычислено для: C28H30F3N3O4+0,3 H2O: C, 62,87%; H, 5,77%; N, 7,85%; Найдено: С, 62,87%; H, 5,67%; N, 7,86%.
5.263 (S)-3-(4-((4-((4,4-ДИМЕТИЛПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)-3-МЕТИЛПИПЕРИДИН-2,6-ДИОН
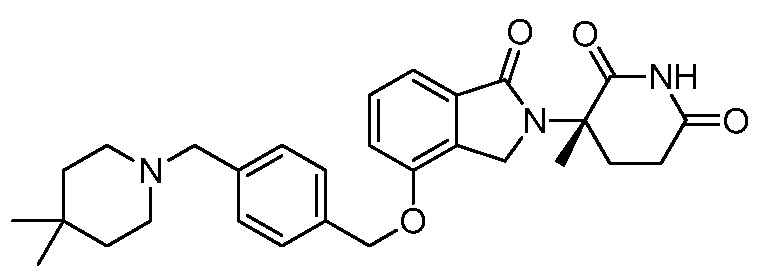
Смесь (S)-4-((2-(3-метил-2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил метансульфоната (0,33 г, 0,698 ммоль) и 4,4-диметилпиперидин гидрохлорида (0,105 г, 0,698 ммоль) охлаждали до 0°C и затем добавляли DIEA (0,255 мл, 1,467 ммоль). Через 16 часов смесь упаривали под вакуумом. Остаток разделяли между EtOAc (100 мл) и водой (100 мл), и водную фазу экстрагировали EtOAc (100 мл). Объединенные органические фазы экстрагировали 1н. HCl (2×75 мл), и объединенные экстракты промывали EtOAc (100 мл) и затем подщелачивали с использованием твердого карбоната натрия. Водную смесь затем экстрагировали EtOAc (2×75 мл), и объединенные экстракты промывали водой (100 мл), высушивали (MgSO4) и упаривали, получая продукт как твердое вещество белого цвета, 250 мг, при 73%-ом выходе; Т. пл. 158-160°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 CH3CN/0,1% H3PO4 за 10 мин, затем 90/10 CH3CN/0,1% H3PO4 на 5 мин: 5,79 (95,52%). 1H ЯМР (ДМСО-d6) δ 0,89 (с, 6H), 1,20-1,38 (м, 4H), 1,68 (с, 3H), 1,81-1,94 (м, 1H), 2,22-2,41 (м, 4H), 2,53-2,83 (м, 3H), 3,46 (с, 2H), 4,56 (д, J=17,6 Гц, 1H), 4,61-4,75 (м, J=17,8 Гц, 1H), 5,23 (с, 2H), 7,22 (д, J=7,4 Гц, 1H), 7,26-7,37 (м, 3H), 7,38-7,50 (м, 3H), 10,85 (с, 1H). 13C ЯМР (ДМСО-d6) δ 20,68, 27,77, 28,04, 28,18, 28,99, 38,32, 45,59, 49,38, 57,18, 62,09, 69,45, 114,78, 114,79, 127,67, 128,79, 129,72, 129,97, 133,89, 135,03, 138,76, 153,38, 167,00, 172,39, 173,47. Вычислено для C29H35N3O4+0,3 H2O: C, 70,36%; H, 7,25%; N, 8,49%; Найдено: C, 70,41%; H, 7,18%; N, 8,41%.
5.264 3-(4-((4-((4-ЭТИЛ-3-ОКСОПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
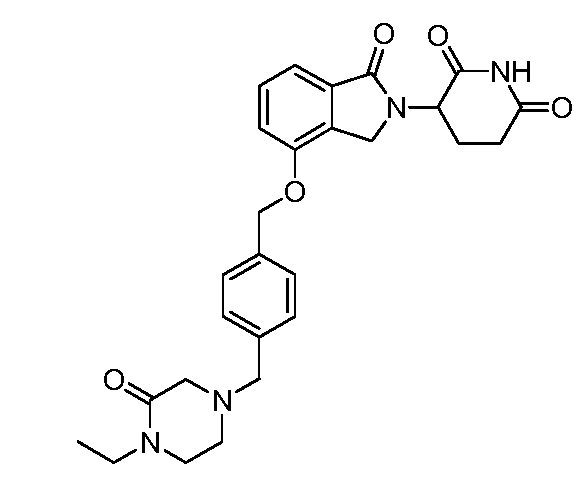
Раствор 1-этилпиперазин-2-он гидрохлорида (83 мг, 0,496 ммоль) и DIEA (0,276 мл, 1,579 ммоль) в сухом MeCN (5 мл, 96 ммоль) добавляли к 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диону (200 мг, 0,451 ммоль). Полученный раствор (светло-янтарного цвета) перемешивали при 40°C в течение 1 ч. Смесь экстрагировали этилацетатом и 1н. NaHCO3. Органический слой промывали солевым раствором и высушивали (Na2SO4), фильтровали и концентрировали в вакууме, получая 3-(4-((4-((4-этил-3-оксопиперазин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (169 мг, 76%-ый выход): ВЭЖХ: Waters Symmetry С-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 7,41 мин (99,5%); Т. пл.: 163-165°C; 1H ЯМР (ДМСО-d6) δ 1,01 (т, J=7,2 Гц, 3H, CH3), 1,87-2,08 (м, 1H, CHH), 2,34-2,48 (м, 1H, CHH), 2,52-2,68 (м, 3H, CH2, CHH), 2,81-3,02 (м, 1H, CHH), 2,94 (с, 2H, CH2), 3,17-3,31 (м, 4H, CH2, CH2), 3,53 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,24-7,40 (м, 4H, Ar), 7,41-7,61 (м, 3Н, Ar), 10,96 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 11,89, 22,33, 31,16, 45,07, 45,17, 48,86, 51,56, 56,81, 60,27, 69,36, 114,97, 115,22, 127,70, 128,95, 129,78, 129,93, 133,28, 135,52, 137,15, 153,48, 165,23, 167,97, 170,93, 172,78; один сигнал перекрыт ДМСО; LCMS: MH=491; Вычислено для C27H30N4O5+0,35 H2O: C, 65,27; H, 6,23; N, 11,28; Найдено: C, 65,27; H, 6,25; N, 11,06.
5.265 3-(4-((4-((4-БУТИЛ-3-ОКСОПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
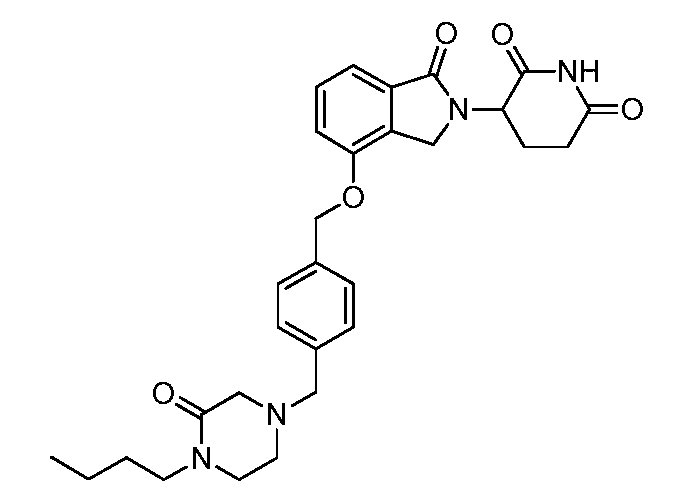
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) в сухом MeCN (5 мл, 96 ммоль) добавляли 1-бутилпиперазин-2-он (82 мг, 0,496 ммоль) и DIEA (0,158 мл, 0,902 ммоль). Желтоватый прозрачный раствор перемешивали при температуре окружающей среды в течение 3 ч. Сырую смесь в этилацетате экстрагировали 1н. NaHCO3, затем солевым раствором. Органический слой высушивали (Na2SO4), фильтровали и концентрировали в вакууме, получая 3-(4-((4-((4-бутил-3-оксопиперазин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (160 мг, 68%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 6,52 мин (99,5%); Т. пл.: 138-140°C; 1H ЯМР (ДМСО-d6) δ 0,88 (т, J=7,2 Гц, 3Н, СН3), 1,14-1,33 (м, 2H, CH2), 1,36-1,55 (м, 2Н, СН2), 1,88-2,05 (м, 1Н, СНН), 2,34-2,47 (м, 1H, CHH), 2,52-2,68 (м, 3H, CH2, CHH), 2,80-3,01 (м, 3H, CH2, CHH), 3,17-3,29 (м, 4H, CH2, CH2), 3,53 (с, 2H, CH2), 4,25 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,25-7,41 (м, 4H, Ar), 7,42-7,57 (м, 3H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 13,64, 19,44, 22,33, 28,41, 31,16, 44,85, 45,07, 45,73, 48,88, 51,56, 56,81, 60,27, 69,36, 114,97, 115,22, 127,70, 128,95, 129,78, 129,95, 133,30, 135,53, 137,13, 153,48, 165,48, 167,97, 170,95, 172,80; LCMS: MH=519; Вычислено для C27H30N4O5+0,6 H2O: C, 65,79; H, 6,70; N, 10,58; Найдено: С, 65,76; H, 6,59; N, 10,56.
5.266 3-(1-ОКСО-4-((4-((4-(ПИРИМИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
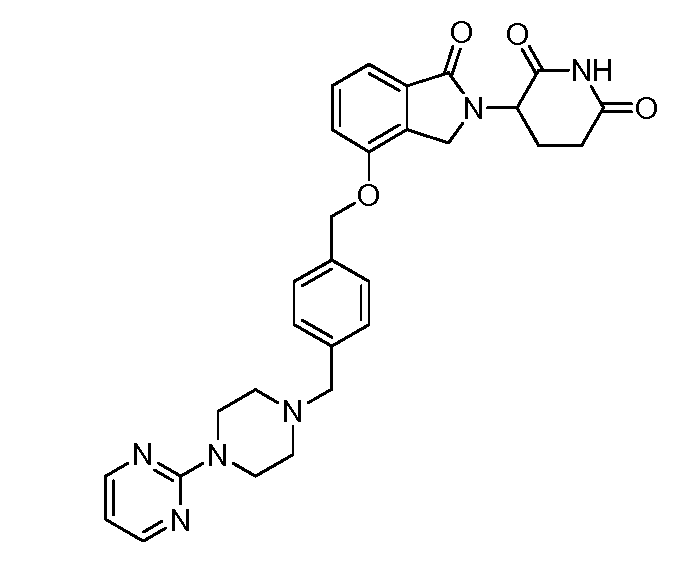
Смесь 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (205 мг, 0,462 ммоль) в MeCN (8 мл) перемешивали при температуре окружающей среды. К раствору добавляли 2-(пиперазин-1-ил)пиримидин (81 мг, 0,495 ммоль), затем DIEA (0,145 мл, 0,832 ммоль). Смесь сохраняли при температуре окружающей среды в течение 4 ч. Сырую rxn смесь разбавляли EtOAc. Органический слой промывали 1н. NaHCO3 (2×25 мл), солевым раствором и высушивали над Na2SO4. Растворитель удаляли в вакууме, получая 3-(1-оксо-4-((4-((4-(пиримидин-2-ил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (244 мг, 100%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,26 мин (97,3%), Т. пл.: 142-144°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,41 (т, J=4,9 Гц, 4H, CH2, CH2), 2,47 (уш.с, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 3,52 (с, 2H, CH2), 3,72 (т, J=4,7 Гц, 4H, CH2, CH2), 4,26 (д,J=17,6 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,24 (с, 2H, CH2), 6,61 (т, J=4,7 Гц, 1H, Pyr), 7,27-7,39 (м, 4H, Ar), 7,42-7,55 (м, 3Н, Ar), 8,34 (д, J=4,7 Гц, 2H, Pyr), 10,97 (с, 1H, NH), См. ~0,15 экв., EtOAc в H-ЯМР. 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 43,26, 45,07, 51,56, 52,35, 61,72, 69,39, 110,01, 114,96, 115,20, 127,64, 128,94, 129,78, 129,93, 133,30, 135,30, 137,89, 153,49, 157,82, 161,16, 167,97, 170,95, 172,80; LCMS: MH=527; Вычислено для C29H30N6O4+0,49 H2O+0,15 EtOAc: C, 64,80; H, 5,91; N, 15,32; Найдено: С, 64,80; H, 5,75; N, 15,32.
5.267 3-(1-ОКСО-4-((4-((3-ОКСО-4-(ПИРИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
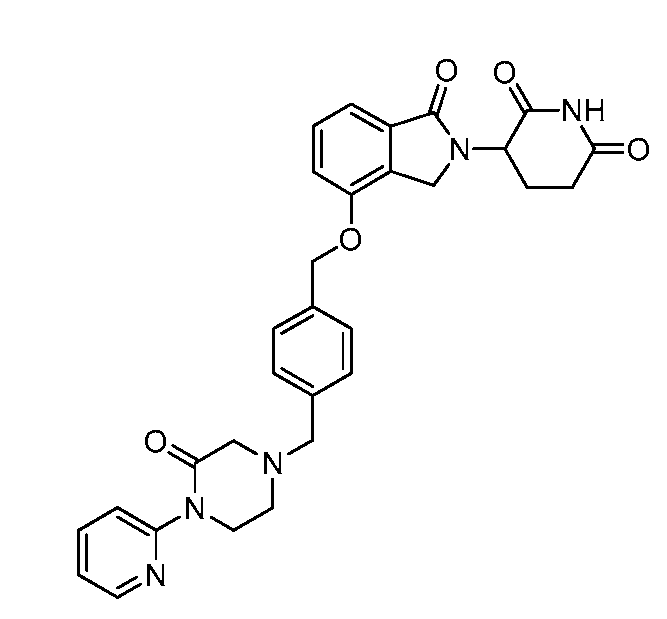
К суспензии (S)-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) и 1-(пиридин-2-ил)пиперазин-2-он дигидрохлорида (124 мг, 0,496 ммоль) в сухом MeCN (5 мл) добавляли DIEA (0,276 мл, 1,579 ммоль). Твердые частицы растворяли при перемешивании, получая желтый раствор, который нагревали до 40°C в течение 3 дней. Реакционную смесь разбавляли EtOAc (~150 мл) и промывали 1н. NaHCO3 (2×30 мл) и солевым раствором. Прозрачный органический слой высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая стекловидный остаток. Этот остаток обрабатывали водой (30 мл), и смесь экстенсивно обрабатывали ультразвуком, получая хорошо диспергированное твердое вещество, которое собирали фильтрацией и промывали дополнительным количеством воды (~45 мл). Корку суспендировали в Et2O, растирали шпателем и затем фильтровали. Этот процесс повторяли 4 раза (полный объем фильтрата Et2O ~125 мл). Корку высушивали отсасыванием и затем высушивали в вакуумном сушильном шкафу, получая твердое вещество грязно-белого цвета (143 мг). Это твердое вещество растворяли в DMF (10 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 80% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, и остаток обрабатывали водой и ультразвуком, получая белую суспензию. Твердое вещество отфильтровывали и затем высушивали в вакуумном сушильном шкафу при 50°C в течение ночи, получая 3-(1-оксо-4-((4-((3-оксо-4-(пиридин-2-ил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (72 мг, 30%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,98 мин (97,9%); Т. пл.: 224-226°C; 1H ЯМР (ДМСО-d6) δ 1,85-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,57 (д, J=18,3 Гц, 1H, CHH), 2,80 (т, J=5,0 Гц, 2H, CH2), 2,84-3,00 (м, 1H, CHH), 3,23 (с, 2H, CH2), 3,64 (с, 2H, CH2), 3,87 (т, J=5,4 Гц, 2H, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,25 (с, 2H, CH2), 7,22 (ддд, J=2,3, 4,9, 6,0 Гц, 1H, Ar), 7,33 (дд, J=1,6, 7,8 Гц, 2H, Ar), 7,37-7,44 (м, 2H, Ar), 7,44-7,55 (м, 3H, Ar), 7,74-7,88 (м, 2H, Ar), 8,44 (дт, J=1,4,4,7 Гц, 1H, Ar), 10,96 (с, 1H, NH); 13C ЯМР(ДМСО-d6) δ 22,33, 31,16, 45,07, 46,11, 48,89, 51,56, 57,64, 60,09, 69,38, 114,99, 115,23, 119,62, 120,83, 127,74, 129,01, 129,80, 129,95, 133,30, 135,62, 136,99, 137,31, 147,70, 153,07, 153,48, 166,92, 167,97, 170,95, 172,80,; LCMS: MH=540; Вычислено для C30H29N5O+0,49 H2O+0,15 EtOAc: C, 64,80; H, 5,91; N, 15,31; Найдено: С, 64,80; H, 5,75; N, 15,32.
5.268 3-(1-ОКСО-4-((4-((4-(2,2,2-ТРИФТОРЭТИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
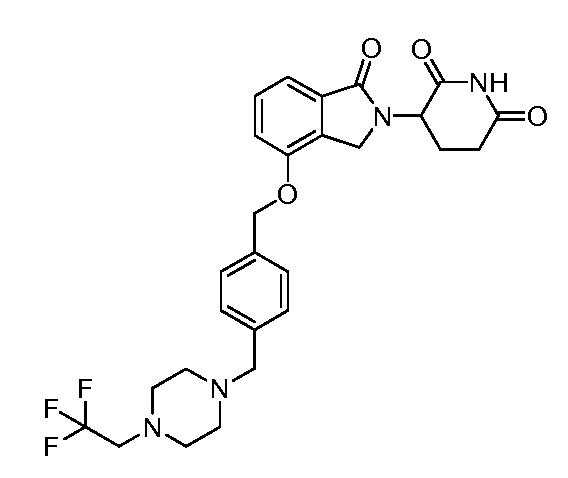
В реакционную ампулу на 20 мл загружали (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (307 мг, 0,693 ммоль), 1-(2,2,2-трифторэтил)пиперазин (170 мг, 0,706 ммоль) и каталитический тетрабутиламмония бромид (22,33 мг, 0,069 ммоль). К смеси добавляли сухой MeCN (5 мл), затем DIEA (0,423 мл, 2,424 ммоль). Перемешивание привело к прозрачному желтому раствору, который перемешивали при температуре окружающей среды в течение ночи. Сырую смесь разделяли между EtoAc (~150 мл) и 1н. NaHCO3 (~50 мл). Органический слой промывали еще дважды 1н. NaHCO3 (2×35 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая стекловидное твердое вещество. Добавляли Et2O (~30 мл) и смесь экстенсивно обрабатывали ультразвуком, пока не получали хорошо диспергированную суспензию. К смеси при периодической обработке ультразвуком добавляли н-гексаны (~30 мл), чтобы далее разбить оставшиеся твердые агрегаты. Смесь перемешивали при температуре окружающей среды в течение ночи и затем фильтровали на воронке из спеченного стекла со средним размером пор с отсасыванием. Остаточное твердое вещество в колбе переносили на воронку с большим количеством н-гексанов (~30 мл). Твердое вещество высушивали отсасыванием и затем растирали с H2O (20 мл). Оставшееся твердое вещество собирали на воронке с фильтром, и корку промывали водой (~250 мл), высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 50°C, получая 3-(1-оксо-4-((4-((4-(2,2,2-трифторэтил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион в форме твердого вещества светло-желтого цвета (262 мг, 71%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 22/78 CH3CN/0,1% H3PO4, 4,49 мин (94,7%); Т. пл.: 133-135°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,05 (м, 1H, CHH), 2,22-2,48 (м, 5H, CH2, CH2, CHH), 2,52-2,71 (м, 5H, CH2, CH2, CHH), 2,82-3,02 (м, 1H, CHH), 3,13 (кв, J=10,3 Гц, 2H, CH2CF3), 3,46 (с, 2H, CH2N), 4,25 (д, J=17,4 Гц, 1H, lactam CHH), 4,42 (д, J=17,6 Гц, 1H, lactam CHH), 5,11 (дд, J=4,9, 13,2 Гц, 1H, alpha-CH), 5,22 (с, 2H, CH2O), 7,26-7,39 (м, 4H, Ar), 7,40-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,06, 51,55, 52,42, 53,06, 56,81 (кв, J=29,7 Гц, CCF3), 61,56, 69,39, 114,96, 115,20, 125,90 (кв, J=280,6 Гц, CF3), 127,58, 128,85, 129,78, 129,93, 133,28, 135,21, 137,95, 153,49, 167,97, 170,95, 172,80, внешние сигналы квартета при 125,90 являются слишком слабыми для обнаружения, LCMS: MH=531; Вычислено для C27H29F3N4O4+0,24 H2O: C, 60,63; H, 5,56; N, 10,47; F, 10,66; Найдено: C, 60,64; H, 5,49; N, 10,20; F, 9,56.
5.269 3-(1-ОКСО-4-((4-(((S)-2-(ТРИФТОРМЕТИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
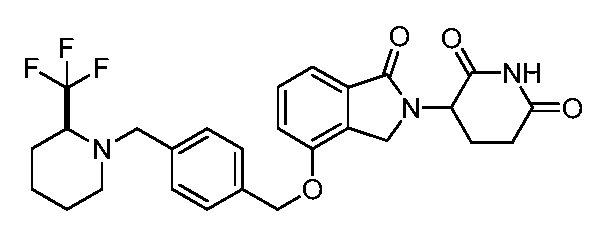
В реакционной ампуле на 20 мл (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (350 мг, 0,790 ммоль) растворяли в сухом MeCN (5 м). К раствору добавляли (S)-2-(трифторметил)пиперидин (140 мг, 0,916 ммоль), затем DIEA (0,345 мл, 1,974 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 часов и затем при 70°C в течение 8 часов в течение ночи. Реакционную смесь разделяли между EtOAc (~100 мл) и водой (~25 мл). Органический слой промывали 1н. NaHCO3 (~75 мл) и солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество белого цвета. Это твердое вещество растворяли в DMF (8 мл), пропускали через шприцевой фильтр, и фильтрат подвергали препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, от 5% до 95% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, чтобы удалить весь MeCN и большую часть воды, производя белую суспензию (~20 мл). Твердое вещество собирали фильтрацией, корку высушивали отсасыванием и затем высушивали в вакуумном сушильном шкафу при 50°C в течение 5 часов, получая 3-(1-оксо-4-((4-(((S)-2-(трифторметил)пиперидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (506 мг, 51%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 3,46 мин (97,6%); Т. пл.: 120-122; 1H ЯМР (ДМСО-d6) δ 1,38-1,63 (м, 4H, CH2, СН2), 1,67-1,90 (м, 2Н, СН2), 1,91-2,05 (м, 1Н, СНН), 2,36-2,48 (т, 2Н, СНН, СНН), 2,53-2,62 (м, 1Н, СНН), 2,64-2,78 (м, 1Н, СНН), 2,82-2,99 (м, 1Н, CHH), 3,46 (кв. т, J=4,9, 9,5 Гц, 1H, CHCF3), 3,84 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,2, 13,1 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,29-7,39 (м, 4H, Ar), 7,41-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 19,64, 22,31, 22,94, 31,16, 45,06, 46,15, 51,55, 58,03 (кв, J=24,2 Гц, CCF3), 57,84, 69,39, 114,94, 115,20, 126,02, 127,70, 128,14, 129,78, 129,87, 129,95, 133,28, 135,25, 139,12, 153,49, 167,97, 170,95, 172,80. Квартет CF3 не определен. Один сигнал углерода не обнаруживается, вероятно, перекрыт другим сигналом. LCMS: MH=516; Вычислено для C27H28F3N3O4+0,5 H2O: C, 61,83; H, 5,57; N, 8,01; F, 10,87; Найдено: C, 61,92; H, 5,48; N, 7,94; F, 10,08.
5.270 3-(4-{4-[4-(3,5-ДИФТОР-ФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН, ГИДРОХЛОРИД
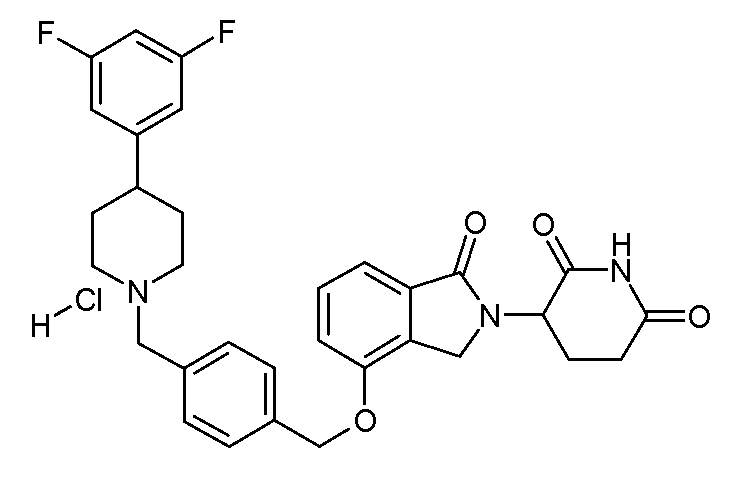
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,790 ммоль) в CH2Cl2 при температуре окружающей среды добавляли DIPEA (0,414 мл, 2,369 ммоль) и 4-(3,5-дифторфенил)пиперидин (156 мг, 0,790 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи, добавляли воду (20 мл) и экстрагировали. Органический слой концентрировали, и полученное твердое вещество очищали на колонке с силикагелем, элюируя CH2Cl2/MeOH, получая твердое вещество белого цвета. Это твердое вещество растворяли в CH2Cl2 (20 мл) и добавляли 3 мл HCl (2,0 M в простом эфире). Смесь перемешивали при температуре окружающей среды в течение 1 часа. Полученную суспензию фильтровали, получая 3-(4-{4-[4-(3,5-дифтор-фенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (0,27 г, 61%). Температура плавления: 281-283°C. LC-MS m/e=560. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 7,05 мин (98,6%). 1H ЯМР (ДМСО-d6) δ 1,89-2,14 (м, 5H, CH2, СН2, СНН), 2,36-2,45 (м, 1Н, СНН), 2,55-2,64 (м, 1Н, СНН), 2,79-2,95 (м, 2Н, СНН), 2,95-3,10 (м, J=18,5 Гц, 2Н, СН2), 3,42 (д, J=11,9 Гц, 2Н, СН2), 4,22-4,50 (м, 4Н, СН2, СН2), 5,12 (дд, J=5,1, 13,2 Гц, 1Н, NCH), 5,31 (с, 2H, CH2), 6,96 (дд, J=2,1, 8,9 Гц, 2H, Ar), 7,04-7,16 (м, 1H, Ar), 7,29-7,38 (м, 2H, Ar), 7,43-7,54 (м, 1H, Ar), 7,55-7,69 (м, 4H, Ar), 10,66 (уш.с, 1H, HCl), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,40, 29,02, 31,21, 38,24, 45,09, 51,30, 51,61, 58,65, 69,03, 101,73, 102,06, 102,40, 109,69, 109,79, 109,91, 110,01, 115,00, 115,39, 127,85, 128,03, 129,36, 129,85, 129,98, 131,09, 131,63, 133,38, 138,07, 148,79, 148,91, 153,37, 160,92, 164,00, 164,17, 167,96, 170,98, 172,83; Вычислено для C32H31F2N3O4·HCl+1,3 H2O, C: 62,04; H: 5,63%; N: 6,78%; Найдено: С: 61,73; H: 5,56%; N: 6,72%.
5.271 3-(4-{4-[4-(2,4-ДИФТОР-ФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН ГИДРОХЛОРИД
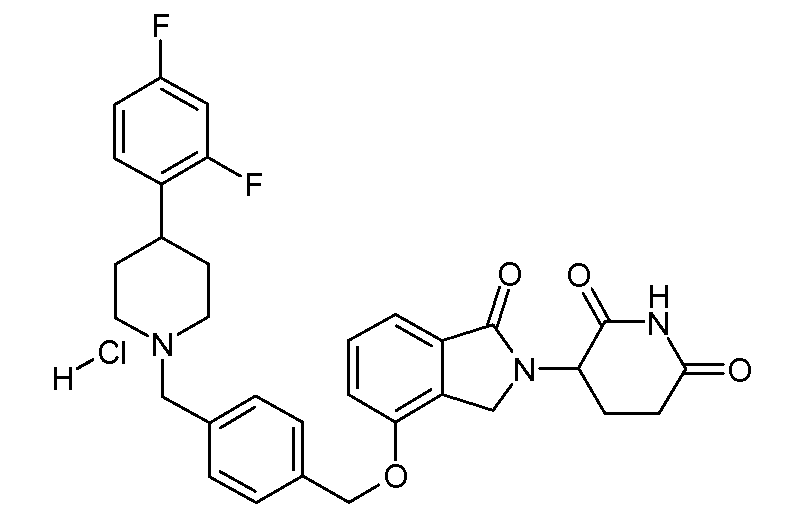
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,790 ммоль) и 4-(2,4-дифторфенил)пиперидина (171 мг, 0,869 ммоль) в CH2Cl2 добавляли N-этил-N-изопропилпропан-2-амин (0,422 мл, 2,369 ммоль). Смесь перемешивали при температуре окружающей среды в течение 4 часов. К реакционной смеси добавляли воду (15 мл) и экстрагировали. Органический слой концентрировали, и твердое вещество растворяли в CH2Cl2. К раствору добавляли HCl (2 мл, 2,0 М в простом эфире) и перемешивали в течение 1 часа. Суспензию фильтровали, получая 3-(4-{4-[4-(2,4-дифтор-фенил)-пиперидин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион гидрохлорид как твердое вещество белого цвета (0,18 г, 40%). Температура плавления: 274-276°C. LCMS m/e=560. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% Н3РО4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 7,03 мин (94%). lH ЯМР (ДМСО-d6) δ 1,81-2,21 (м, 5H, СН2, СН2, СН), 2,35-2,48 (м, 1Н, СНН), 2,53-2,66 (м, 1Н, СНН), 2,82-2,99 (м, 1Н, СНН), 3,09 (д, J=10,0 Гц, 3Н, СН2, СНН), 3,42 (д, J=11,7 Гц, 2Н, СН2), 4,22-4,50 (м, 4Н, СН2, СН2), 5,12 (дд, J=4,9, 13,2 Гц, 1Н, CHN),5,31 (с, 2H, CH2), 7,04-7,15 (м, 1H, Ar), 7,16-7,27 (м, 1H, Ar), 7,27-7,37 (м, 2H, Ar), 7,44-7,54 (м, 1H, Ar), 7,56-7,67 (м, 3H, Ar), 10,52 (уш.с, 1H, HCl), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,40, 28,37, 31,21, 32,04, 45,09, 51,48, 51,61, 58,84, 69,03, 103,60, 103,95, 104,30, 111,58, 111,83, 115,00, 115,39, 127,85, 128,73, 128,85, 128,93, 129,36, 129,85, 129,98, 131,62, 133,38, 138,09, 153,37, 161,62, 167,96, 170,98, 172,83; Вычислено для C32H31F2N3O4·HCl+0,8 H2O; C: 62,96%; H: 5,55%; N: 6,88%; Найдено: С: 62,83%, H: 5,38%; N: 6,87%.
5.272 3-(1-ОКСО-4-{4-[4-(2,2,2-ТРИФТОР-АЦЕТИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
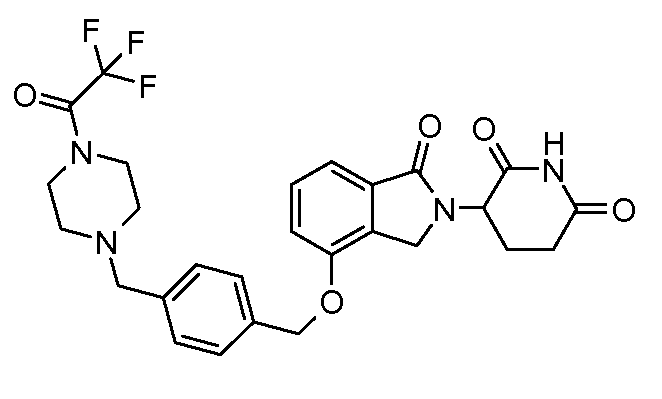
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,68 ммоль) в DCM (7 мл) при температуре окружающей среды добавляли раствор 2,2,2-трифтор-1-(пиперазин-1-ил)этанона (185 мг, 1,0 ммоль) в DCM (1 мл), с последующим добавлением DIPEA (0,236 мл, 1,4 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 7,5 часов, и реакция была по большей части закончена. К реакционной смеси добавляли DCM (30 мл) и воду (20 мл). Смесь экстрагировали. Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая твердое вещество белого цвета, которое далее очищали, после перемешивания в EtOAc (3 мл), получая 3-(1-оксо-4-{4-[4-(2,2,2-трифтор-ацетил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (180 мг, 49%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80, (CH3CN/0,1% H3PO4), 5,21 мин (99,9%); Т. пл.: 125-127°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,05 (м, 1H, CHH), 2,38-2,48 (м, 5H, CHH, CH2, CH2), 2,53-2,65 (м, 1Н, CHH), 2,85-3,01 (м, 1H, CHH), 3,47-3,70 (м, 6H, CH2, CH2, CH2), 4,17-4,55 (м, 2H, CHH, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (дд, J=4,1, 7,8 Гц, 4H, Ar), 7,40-7,56 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,82, 30,65, 42,42, 44,54, 44,81, 51,02, 51,14, 51,81, 60,57, 68,81, 114,43, 114,70, 127,15, 128,45, 129,28, 129,41, 132,78, 134,93, 136,90, 152,96, 167,46, 170,44, 172,29; LCMS MH=545; Вычислено для C27H27F3N4O5+0,3H2O: C, 58,97; H, 5,06; N, 10,19; Найдено: С, 58,85; H, 4,82; N, 10,03.
5.273 3-(4-{4-[4-(4-ФТОРФЕНИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН, ДИГИДРОХЛОРИД
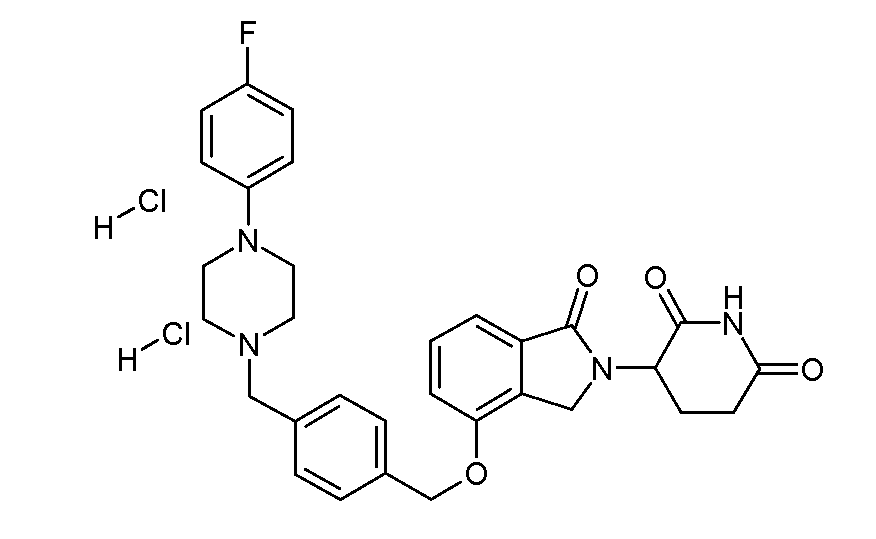
К раствору 3-(4-(4-((4-(4-фторфенил)пиперазин-1-ил)метил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,23 г, 0,424 ммоль) и 1-(4-фторфенил)пиперазина (142 мг, 0,790 ммоль) в CH2Cl2 добавляли N-этил-N-изопропилпропан-2-амин (422 мкл, 2,369 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду (15 мл) и экстрагировали. Органический слой концентрировали, и полученное твердое вещество растворяли в CH2Cl2 (35 мл) и добавляли по каплям 2M HCl в простом эфире. Смесь перемешивали при температуре окружающей среды в течение 2 часов. Суспензию фильтровали, получая 3-(4-{4-[4-(4-фторфенил)-пиперазин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион дигидрохлорид как твердое вещество белого цвета (230 мг, 54%). Т. пл: 191-193°C. LCMS m/e=543. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 6,67 мин (96%). 1H ЯМР (ДМСО-d6) δ 1,80-2,09 (м, 1H, CHH), 2,36-2,45 (м, J=4,3Гц, 1H, CHH), 2,58 (д, J=18,5 Гц, 1H, CHH), 2,81-3,00 (м, 1H, CHH), 3,16 (д, J=8,9 Гц, 4H, CH2, CH2), 3,34 (д, J=8,1 Гц, 2H, CH2), 3,63-3,80 (м, 2H, CH2), 4,15-4,62 (м, 4H, CH2, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CHN), 5,30 (с, 2H, CH2), 6,89-7,06 (м, 2H, Ar), 7,04-7,16 (м, 2H, Ar), 7,26-7,42 (м, 2H, Ar), 7,42-7,55 (м, 1H, Ar), 7,54-7,64 (м, 2H, Ar), 7,64-7,79 (м, 2H, Ar), 10,97 (с, 1H, nh), 11,46 (уш.с, 1H, HCl); 13C ЯМР (ДМСО-d6) δ 22,39, 31,21, 45,10, 45,91, 50,16, 51,61, 58,05, 69,03, 114,98, 115,36, 115,65, 117,78, 117,88, 127,85, 129,24, 129,85, 130,00, 131,69, 133,37, 138,06, 146,34, 153,37, 154,99, 158,12, 167,98, 170,96, 172,83; Вычислено для C31H31FN4O4+1,8 HCl+2H2O: C: 57,79%; H: 5,76%; N: 8,70%; Cl: 9,90%; Найдено: С: 57,61%, H: 5,64%; N: 8,60%, Cl: 9,54%.
5.274 3-(4-{4-[4-(4-ФТОРБЕНЗИЛА)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
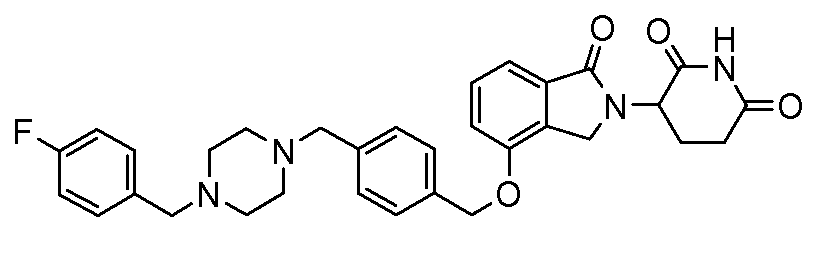
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,40 г, 0,902 ммоль) в CH3CN (10 мл) добавляли 1-(4-фторбензил)пиперазин (0,193 г, 0,993 ммоль) и N-этил-N-изопропилпропан-2-амин (0,298 мл, 1,805 ммоль). Раствор перемешивали при температуре окружающей среды в течение двух часов. К реакционному раствору добавляли воду (20 мл) и экстрагировали метиленхлоридом (2×30 мл), промывали солевым раствором, упаривали, и твердое вещество грязно-белого цвета очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-(4-{4-[4-(4-фторбензила)-пиперазин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (0,336 г, выход 66,9%); Т. пл.: 222-224°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/05 за 5 мин, изократический при 95/05 на 5 мин (CH3CN/0,1% H3PO4), 4,67 мин (97,01%). 1H ЯМР (ДМСО-d6) δ 1,92-2,04 (м, 1H, CHH), 2,20-2,47 (м, 8H, 2CHH, 3CH2), 2,55-2,66 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,30-3,35 (м, 2H, CH2), 3,45 (с, 2H, CH2), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,07-7,17 (м, 2H, Ar), 7,26-7,37 (м, 6H, Ar), 7,40-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,36, 31,21, 45,10, 51,59, 52,48, 52,58, 61,08, 61,71, 69,44, 114,68, 114,95, 115,23, 127,62, 128,86, 129,81, 129,95, 130,55 (д, JC-F=10), 133,31, 134,37, 135,19, 138,12, 153,51, 161,17 (д, JC-F=250), 168,01, 170,96, 172,82. LC/MS m/e=557. Вычислено для C32H33N4O4F: С, 69,05; H, 5,98; N, 10,07, Найдено: С, 68,93; H, 5,99; N, 10,01.
5.275 3-(1-ОКСО-4-{4-[4-(2,2,2-ТРИФТОР-ЭТАНСУЛЬФОНИЛ)- ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
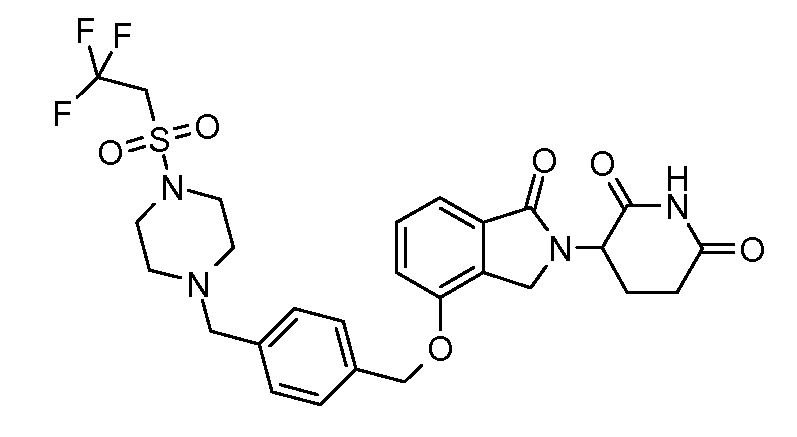
Стадия 1: трет-бутиловый эфир 4-(2,2,2-трифтор-этансульфонил)-пиперазин-1-карбоновой кислоты
К перемешиваемому раствору пиперазин-1-трет-бутилкарбоксилата (0,850 г, 4,56 ммоль) и TEA (0,76 мл, 5,48 ммоль) в THF (10 мл) при 0°C добавляли 2,2,2-трифторэтан сульфонил хлорид (1,0 г, 5,48 ммоль) в THF (0,5 мл). Полученную суспензию перемешивали при 0°C в течение 1,5 часов, и реакционную смесь разбавляли EtOAC (30 мл). Смесь промывали водой (15 мл), HCl (1н., водный раствор, 15 мл) и NaHCO3 (15 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом, получая трет-бутиловый эфир 4-(2,2,2-трифтор-этансульфонил)-пиперазин-1-карбоновой кислоты как твердое вещество белого цвета (1,3 г, 86%-ый выход). Это соединение использовали на следующей стадии без дальнейшей очистки. 1H ЯМР (ДМСО-d6) δ 1,41 (с, 9H, трет-бутил), 3,12-3,26 (м, 4H, CH2, CH2), 3,36-3,48 (м, 4H, CH2, CH2), 4,52 (кв, J=10,1 Гц, 2H, CH2); LCMS MH (без boc)=233.
Стадия 2: 1-(2,2,2-Трифтор-этансульфонил)- пиперазин
К перемешиваемому раствору 4-(2,2,2-трифторэтилсульфонил)пиперазин-1-трет-бутилкарбоксилата (1,3 г, 3,9 ммоль) в DCM (20 мл) при температуре окружающей среды добавляли TFA (3,0 мл, 39,1 ммоль). Полученный раствор перемешивали при температуре окружающей среды 15 часов, и реакционную смесь разбавляли DCM (30 мл) и медленно добавляли NaHCO3 (насыщ., водный раствор, 15 мл), чтобы контролировать выделение газа. Полученную смесь перемешивали при температуре окружающей среды в течение 10 минут и разделяли. Органический слой промывали NaHCO3 (насыщ., водный раствор, 5 мл) и солевым раствором (20 мл). Объединенный водный слой экстрагировали DCM (4×40 мл). Объединенные слои высушивали MgSO4 и концентрировали под вакуумом, получая 1-(2,2,2-трифтор-этансульфонил)-пиперазин как твердое вещество белого цвета (930 мг, 102%-ый сырой выход). 1H ЯМР (ДМСО-d6) δ 2,41 (уш.с, 1H, NH), 2,64-2,85 (м, 4H, CH2, CH2), 3,02-3,20 (м, 4H, CH2, CH2), 4,46 (кв, J=10,2 Гц, 2H, CH2); LCMS MH=233.
Стадия 3: 3-(1-Оксо-4-{4-[4-(2,2,2-трифтор-этансульфонил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион
К перемешиваемой смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,79 ммоль) и 1-(2,2,2-трифторэтилсульфонил)пиперазина (183 мг, 0,79 ммоль) в DCM (10 мл) добавляли DIPEA (0,28 мл, 1,56 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 3 дней. Реакционную смесь разбавляли DCM (30 мл), и раствор промывали водой (20 мл) и солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая стеклоподобное твердое вещество. Это твердое вещество далее очищали, после перемешивания в ацетонитриле (2 мл) и простом диэтиловом эфире, (30 мл), получая 3-(1-оксо-4-{4-[4-(2,2,2-трифтор-этансульфонил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (277 мг, 59%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 3,10 мин (99,2%); 213-215°C; 1H ЯМР (DMS0-d6) δ 1,91-2,05 (м, 1H, CHH), 2,45 (д, J=8,7 Гц, 5H, CH2, CH2, CHH), 2,53-2,63 (м, 1H, CHH), 2,83-2,99 (м, 1H, CHH), 3,17-3,27 (м, 4H, CH2, CH2), 3,53 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,36-4,58 (м, 3H, CH2, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CHH), 5,23 (с, 2H, CH2), 7,33 (д, J=7,6 Гц, 4H, Ar), 7,39-7,53 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 45,06, 45,15, 50,02 (кв, J=29,2 Гц, CF3), 51,56, 51,81, 61,10, 69,36, 114,97, 115,22, 123,22 (кв, J=275,2 Гц, CF3), 127,67, 128,91, 129,80, 129,93, 133,30, 135,43, 137,57, 153,48, 167,97, 170,96, 172,81; LCMS MH=595; Вычислено для C27H29F3N4O6S+0,5 H2O: C, 53,73; H, 5,01; N, 9,28; Найдено: С, 53,67; H, 5,03; N, 9,17.
5.276 3-(4-{4-[4-(4-ФТОР-БЕНЗОЛСУЛЬФОНИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
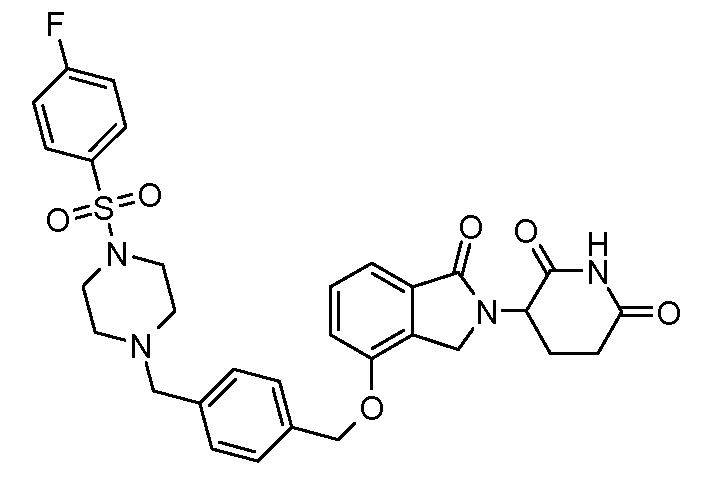
К перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (330 мг, 0,7 ммоль) в DCM (10 мл) добавляли 1-(4-фтор-фенилсульфонил)пиперазин (236 мг, 0,97 ммоль) и DIPEA (0,26 мл, 1,5 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 20 часов и затем добавляли DCM (20 мл) и воду (20 мл). Смесь экстрагировали, и органический слой промывали солевым раствором (20 мл). Органический слой высушивали MgSO4 и концентрировали под вакуумом. Остаток очищали ISCO, получая твердое вещество белого цвета. Это твердое вещество далее очищали, после перемешивания в ацетонитриле и простом диэтиловом эфире, получая 3-(4-{4-[4-(4-фторбензолсульфонил)-пиперазин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (245 мг, 54%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 4,70 мин (98,9%); Т. пл.: 192-194°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,34-2,47 (м, 5H, CH2, CH2, CHH), 2,53-2,63 (м, 1H, CHH), 2,82-3,01 (м, 5H, CHH, CH2, CH2), 3,47 (с, 2H, CH2), 4,24 (д, J=17,6 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,08 (дд, J=4,9, 8,1 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 7,25 (д, 2H, Ar), 7,29-7,34 (м, 2H, Ar), 7,40 (д, J=7,9 Гц, 2H, Ar), 7,44-7,56 (м, 3H, Ar), 7,73-7,87 (м, 2H, Ar), 10,96 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,04, 45,90, 51,33, 51,53, 60,95, 69,31, 114,93, 115,20, 116,60 (кв, J=23,25 Гц, Ar), 127,63, 128,79, 129,78, 129,90, 130,60 (кв, J=9,75 Гц, Ar), 131,17, 133,27, 135,34, 137,51, 153,45, 162,62 (кв, J=249,75 Гц, Ar), 167,97, 170,96, 172,81; LCMS MH=607; Вычислено для C31H31FN4O6S+0,6 H2O: C, 60,30; H, 5,26; N, 9,07; Найдено: С, 60,18; H, 5,18; N,9,09.
5.277 3-(4-{4-[4-(3,4-ДИФТОР-БЕНЗОЛСУЛЬФОНИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
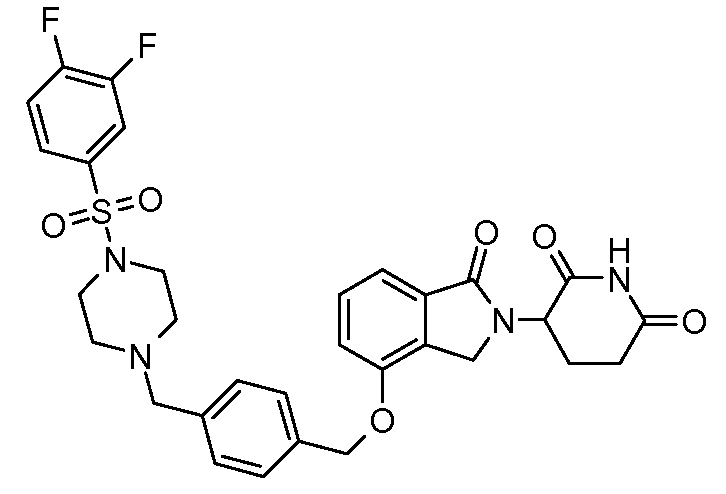
К перемешиваемой смеси 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (350 мг, 0,79 ммоль) и 1-(3,4-дифторфенилсульфонил)пиперазина (269 мг, 1,0 ммоль) в DCM (10 мл) добавляли DIPEA (0,25 мл, 1,6 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 3 дней. Реакционную смесь разбавляли DCM (30 мл) и раствор промывали водой (20 мл), солевым раствором (2×20 мл). Органический слой высушивали MgSO4 и фильтровали. Фильтрат концентрировали под вакуумом. И остаток очищали ISCO, получая твердое вещество белого цвета. Это твердое вещество далее очищали, после перемешивания в ацетонитриле и простом диэтиловом эфире, получая 3-(4-{4-[4-(3,4-дифтор-бензолсульфонил)-пиперазин-1-илметил]-бензилокси}-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (296 мг, 60%-ый выход). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75, (CH3CN/0,1% H3PO4), 6,70 мин (99,9%); Т. пл.: 225-227°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,04 (м, 1H, CHH), 2,35-2,47 (м, 5H, CHH, CH2, CH2), 2,53-2,63 (м, 1H, CHH), 2,82-3,02 (м, 5H, CHH, CH2, CH2), 3,48 (с, 2H, CH2), 4,24 (д, J=17,4 Гц, 1H, CHH), 4,40 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHH), 5,21 (с, 2H, CH2), 7,26 (д, J=7,9 Гц, 2H, Ar), 7,30 (д, J=3,0 Гц, 1H, Ar), 7,33 (д, J=2,1 Гц, 1H, Ar), 7,41 (д, J=8,1 Гц, 2H, Ar), 7,48 (т, J=7,7 Гц, 1H, Ar), 7,62 (дд, J=2,0, 4,1 Гц, 1H, Ar), 7,73 (дд, J=7,7, 10,2 Гц, 1H, Ar), 7,84 (ддд, J=2,1, 7,5, 9,7 Гц, 1H, Ar), 10,97 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,34, 31,16, 45,03, 45,90, 51,30, 51,53, 60,92, 69,31, 114,93, 115,20, 17,45 (д, J=19,5, CF), 118,84(д, J=17,2, CF), 125,43, 127,63, 128,81, 129,78, 129,90, 132,11, 133,28, 135,35, 137,50, 149,25 (дд, J=228,0 Гц, J=12,0 Гц,), 152,60 (дд, J=230,2 Гц, J=13,5 Гц,), 153,43, 167,97, 170,96, 172,83; LCMS MH=625; Вычислено для C31H30F2N4O6S: C, 59,61; H, 4,84; N, 8,97; Найдено: С, 59,34; H, 4,72; N, 8,88.
5.278 (S)-3-(1-ОКСО-4-((4-((4-(ТРИФТОРМЕТИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
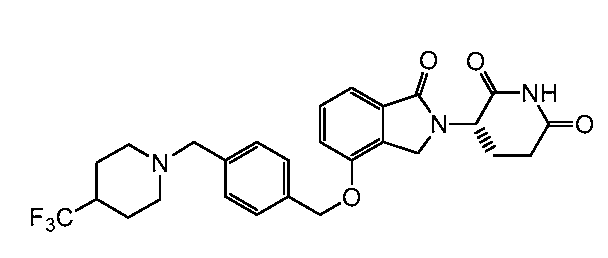
К суспензии (S)-3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (1 г, 2,256 ммоль) в MeCN (20 мл) при 0°C добавляли 4-(трифторметил)пиперидин гидрохлорид (0,470 г, 2,481 ммоль). Немедленно добавляли DIEA (0,788 мл, 4,51 ммоль) и полученную смесь перемешивали при 0°C в течение 3 часов. К реакционной смеси добавляли тетрабутиламмоний бромид (0,036 г, 0,113 ммоль), и перемешивание продолжали в течение 1 часа при 0°C, затем при температуре окружающей среды в течение ~18 часов. Реакционную суспензию концентрировали досуха под вакуумом, получая ~1,2 г твердого вещества желтого цвета. Это твердое вещество разделяли между EtOAc (~250 мл) и водным раствором 1н. NaHCO3 (~100 мл). Органический слой промывали другими 100 мл 1н. NaHCO3, водой (~25 мл) и солевым раствором (~50 мл). Раствор высушивали над Na2SO4, фильтровали и концентрировали на роторном испарителе до минимального объема EtOAc (~5-7 мл) при 40°C до первого признака мутности. Колбу удаляли из роторного испарителя и оставляли при температуре окружающей среды. Большее количество твердого вещества формировалось при отстаивании.
К суспензии добавляли равный объем MTBE (5-7 мл). Смесь перемешивали и затем фильтровали на воронке из спеченного стекла с мелким размером пор на 30 мл с отсасыванием. Дополнительный MTBE использовали, чтобы вымыть корку и переместить остаточное твердое вещество из колбы (~25 мл). Корку высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф на ночь при 50°C, получая 850 мг (73%-ый выход) твердого вещества, имеющего цвет от белого до светло-кремового. Чтобы удалить нежелательные остаточные растворители (EtOAc и MTBE), осуществляли вторую перекристаллизацию из теплой смеси MeCN/вода. Твердое вещество собирали на воронке из спеченного стекла с мелким размером пор, промывали водой (~25 мл), и корку высушивали в вакуумном сушильном шкафу при 60°C в течение ночи, получая (S)-3-(1-оксо-4-((4-((4-(трифторметил)пиперидин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (485 мг, 61%-ый выход): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 6,33 мин (99,0%); хиральная ВЭЖХ: Chiral Technologies, AGP аналитическая колонка, 99% ее по сравнению с ранее синтезированным рацемическим образцом; Т. пл.: 158-160; 1H ЯМР (ДМСО-d6) δ 1,33-1,56 (м, 2H, CHH, CHH), 1,67-1,84 (м, 2H, CHH, CHH), 1,86-2,09 (м, 3H, CHH, CH2), 2,14-2,34 (м, 1H, CH), 2,35-2,48 (м, 1H, CHH), 2,53-2,64 (м, 1H, CHH), 2,78-3,00 (м, 3H, CH2, CHH), 3,48 (уш.с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,23 (с, 2H, CH2), 7,25-7,39 (м, 4H, Ar), 7,40-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 24,21, 31,18, 45,06, 51,37, 51,56, 61,59, 69,38, 114,96, 115,22, 127,72 (кв, J=280,6 Гц, CF3), 127,64, 128,81, 129,78, 129,93, 133,30, 135,22, 138,12, 153,48, 167,97, 170,95, 172,80, CF3 перекрыт ДМСО и не обнаружен; LCMS: MH=516; Вычислено для C27H28F3N3O4+0,5 H2O: C, 61,83; H, 5,57; N, 8,01; F, 10,87; Найдено: С, 61,81; H, 5,40; N, 8,06; F, 10,51.
5.279 3-{1-ОКСО-4-[4-(4-ПИРИДИН-2-ИЛ-ПИПЕРАЗИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
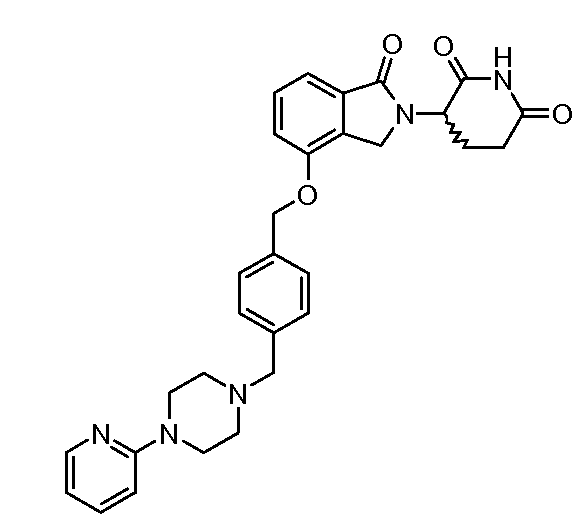
К суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,677 ммоль) в сухом MeCN (10 мл) добавляли 1-(пиридин-2-ил)пиперазин (116 мг, 0,711 ммоль), затем DIEA (0,236 мл, 1,354 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Густую суспензию затем нагревали до 50°C, получая прозрачный желтый раствор. После ~7 часов при 50°C нагревание прекращали, и раствор мягко перемешивали приблизительно в течение 1 часа и затем оставляли на ночь при температуре окружающей среды. Полученную суспензию мягко перемешивали и затем фильтровали на воронке из спеченного стекла со средним размером пор на 30 мл с отсасыванием. Остаточное твердое вещество, сохранившееся в реакционной ампуле, переносили на воронку с дополнительным количеством MeCN (~2 мл). Корку промывали несколькими частями Et2O (полный объем ~70 мл) и затем суспендировали в воде, и затем высушивали отсасыванием. Твердое вещество промывали небольшими частями воды (полный объем ~50 мл). Оставшееся твердое вещество белого цвета ресуспендировали в воде на воронке и затем высушивали отсасыванием. Твердое вещество промывали дополнительным количеством воды (полный объем ~50 мл) и затем помещали в вакуумный сушильный шкаф при 60°C на ночь, получая 3-{1-оксо-4-[4-(4-пиридин-2-ил-пиперазин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (260 мг, 73%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 13/87 CH3CN/0,1% H3PO4, 5,11 мин (99,2%); Т. пл.: 165-167°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,07 (м, 1H, CHH), 2,34-2,49 (м, 5H, CHH, СН2, СН2), 2,57 (д, J=18,7 Гц, 1H, CHH), 2,81-3,03 (м, 1H, CHH), 3,38-3,51 (м, 4H, CH2, CH2), 3,53 (уш.с, 2H, CH2), 4,26 (д, J=17,4 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,24 (с, 2H, CH2), 6,63 (дд, J=5,1, 6,8 Гц, 1H, Ar), 6,79 (д, J=8,7 Гц, 1H, Ar), 7,25-7,42 (м, 4H, Ar), 7,42-7,66 (м, 4H, Ar), 8,09 (дд, J=1,4, 4,8 Гц, 1H, Pyr), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 44,53, 45,07, 51,55, 52,29, 61,69, 69,36, 107,01, 112,94, 114,96, 115,22, 127,66, 129,03, 129,80, 129,93, 133,30, 135,33, 137,44, 137,86, 147,49, 153,48, 158,95, 167,99, 170,96, 172,83; LCMS: MH=526; Вычислено для C30H31N5O4+1,2 H2O: C, 65,87; H, 6,15; N, 12,80; Найдено: С, 65,87; H, 5,93; N, 12,68.
5.280 3-(1-ОКСО-4-{4-[4-(5-ТРИФТОРМЕТИЛ-[1,3,4]ТИАДИАЗОЛ-2-ИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ)-ПИПЕРИДИН-2,6-ДИОН
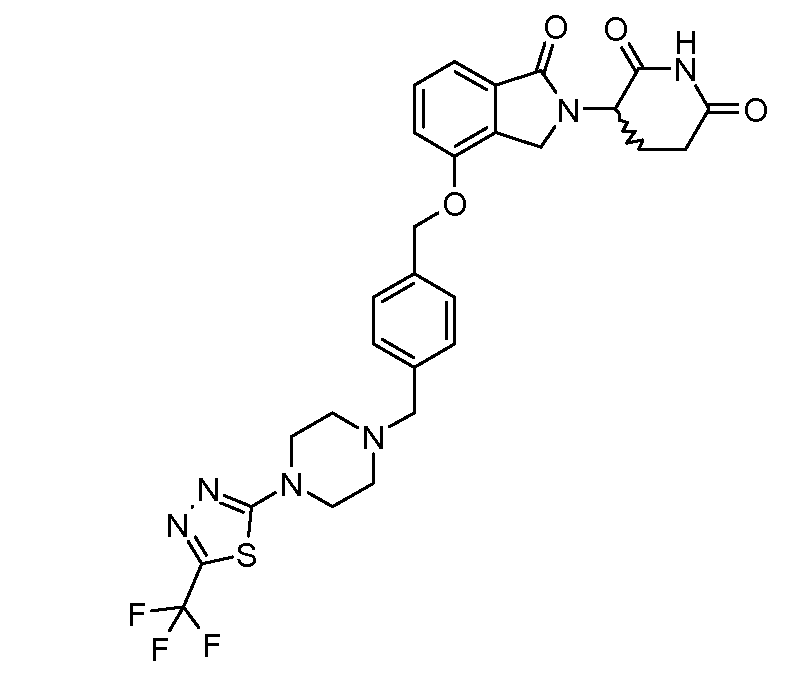
К суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,677 ммоль) в сухом MeCN (10 мл) добавляли 2-(пиперазин-1-ил)-5-(трифторметил)-1,3,4-тиадиазол (169 мг, 0,711 ммоль), затем DIEA (0,236 мл, 1,354 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь нагревали до 50°C в течение 8 часов и затем до 80°C в течение 1 часа. Реакционной смеси давали стоять в течение ночи при температуре окружающей среды, затем мягко перемешивали, чтобы повторно суспендировать твердые частицы на дне ампулы. Твердое вещество собирали на воронке из спеченного стекла со средним размером пор на 30 мл с отсасыванием. Остаточное твердое вещество в ампуле переносили на воронку с дополнительным количеством MeCN (~1 мл). Белую корку промывали несколькими частями Et2O (полный объем ~30 мл). Оставшееся твердое вещество белого цвета ресуспендировали в воде на воронке и затем высушивали отсасыванием. Твердое вещество промывали дополнительным количеством воды (полный объем ~50 мл) и затем помещали в вакуумный сушильный шкаф при 60°C на ночь, получая 3-(1-оксо-4-{4-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-илметил]-бензилокси}-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-дион как твердое вещество белого цвета (332 мг, 82%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 22/78 CH3CN/0,1% H3PO4, 7,89 мин (99,9%); Т. пл.: 160-162°C; 1Н ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,36-2,47 (м, 1H, CHH), 2,50-2,63 (м, 5H, CHH, pip CH2, CH2), 2,82-3,04 (м, 1H, CHH), 3,44-3,70 (м, 6H, CH2, pip CH2, CH2), 4,26 (д, J=17,6 Гц, 1H, CHH), 4,42 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,35 (т, J=8,3 Гц, 4H, Ar), 7,43-7,54 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 45,06, 49,58, 51,27, 51,55, 61,29, 69,35, 114,97, 115,23, 121,36, 127,69, 129,00, 129,80, 129,95, 133,30, 135,47, 137,48, 153,48, 167,99, 170,96, 172,81, 173,95.
Один углеродный сигнал отсутствует, возможно CF3 вследствие расщепления; LCMS: МН=601;
Анал. Вычислено для C28H27F3N6O4S+0,9 H2O: C, 54,52; H, 4,71; N, 13,62; F, 9,24; Найдено: C, 54,50; H, 4,57; N, 13,52; F, 9,24.
5.281 3-(4-((4-((4-(2-МЕТИЛ-6-(ТРИФТОРМЕТИЛ)ПИРИМИДИН-4-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
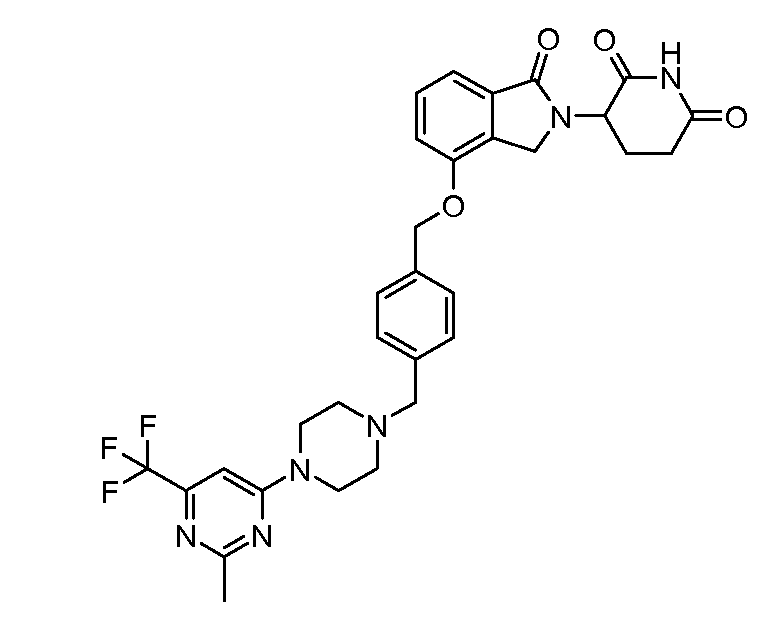
К суспензии 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (300 мг, 0,677 ммоль) в сухом MeCN (10 мл) добавляли 2-метил-4-(пиперазин-1-ил)-6-(трифторметил)пиримидин (175 мг, 0,711 ммоль), затем DIEA (0,236 мл, 1,354 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь нагревали до 50°C, пока она не стала прозрачным раствором, и затем давали охладиться до температуры окружающей среды при мягком перемешивании в течение ночи. Твердое вещество белого цвета формировалось при отстаивании. Смесь перемешивали, и твердое вещество собирали на воронке из спеченного стекла с мелким размером пор на 15 мл с отсасыванием. Твердое вещество промывали минимальным количеством MeCN (~1 мл) и несколькими частями Et2O (полный объем ~35 мл). Твердое вещество белого цвета высушивали отсасыванием и затем помещали в вакуумный сушильный шкаф при 60°C на ночь, получая 3-(4-((4-((4-(2-метил-6-(трифторметил)пиримидин-4-ил)пиперазин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (276 мг, 67%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 22/78 CH3CN/0,1% H3PO4, 7,59 мин (99,7%); Т. пл.: 165-167°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,07 (м, 1H, CHH), 2,38-2,48 (м, 8H, CH2, CH2, CHH, CH3), 2,53-2,65 (м, 1H, CHH), 2,79-2,99 (м, 1H, CHH), 3,53 (с, 2H, CH2), 3,59-3,91 (м, 4H, CH2, CH2), 4,26 (д, J=17,4 Гц, 1H, CHH), 4,43 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, CH2), 7,05 (с, 1H, Pyr), 7,28-7,40 (м, 4H, Ar), 7,42-7,55 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 25,65, 31,18, 43,53, 45,07, 51,56, 52,06, 61,43, 69,38, 96,73 (кв, J=3,3 Гц, CCCF3), 114,97, 115,22, 121,18 (кв, J=275,1 Гц, CF3), 127,66, 128,97, 129,78, 129,95, 133,30, 135,38, 137,66, 153,26 (кв, J=34,1 Гц, CF3), 153,49, 161,75, 167,64, 167,99, 170,96, 172,81, квартет CF3 при 121,18 м.д. наблюдается в виде дублета (внешние сигналы отсутствуют); LCMS: MH=609; Вычислено для C31H31F3N6O4+0,4 H2O: C, 60,46; H, 5,20; N, 13,65; F, 9,25; Найдено: C, 60,51; H, 5,13; N, 13,61; F, 8,97.
5.282 3-{1-ОКСО-4-[4-(4-ФЕНОКСИ-ПИПЕРИДИН-1-ИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
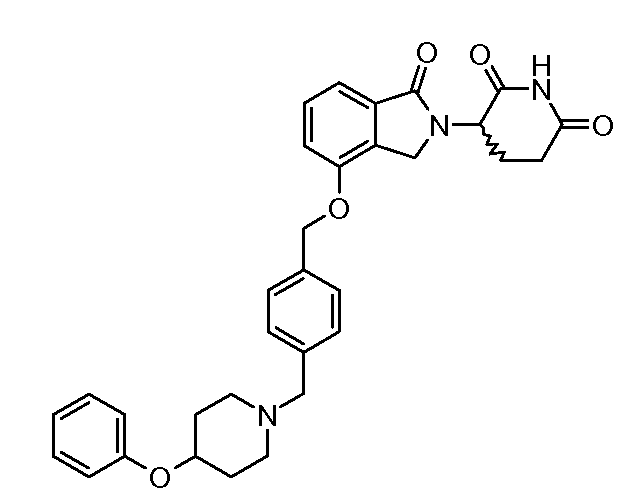
В реакционную ампулу на 20 мл загружали 3-(4-((4-(бромметил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (300 мг, 0,677 ммоль) и 4-феноксипиперидин (126 мг, 0,711 ммоль), добавляли сухой MeCN (10 мл), затем DIEA (0,236 мл, 1,35 ммоль). Полученную суспензию нагревали до 50°C, получая прозрачный раствор. Через ~30 минут, температуру повышали далее до 70°C, и реакционную смесь перемешивали в течение ~16 часов при 70°C. Смеси давали охладиться до температуры окружающей среды и затем оставляли при 4°C в течение ночи, получая твердое вещество белого цвета. Суспензию мягко перемешивали, и твердое вещество собирали на воронке из спеченного стекла со средним размером пор на 15 мл с отсасыванием. Корку промывали Et2O (~50 мл) и высушивали отсасыванием, получая твердое вещество желто-коричневого цвета. Это твердое вещество растирали и промывали водой (~50 мл), высушивали отсасыванием и затем высушивали далее в вакуумном сушильном шкафу при 50°C, получая 3-{1-оксо-4-[4-(4-фенокси-пиперидин-1-илметил)-бензилокси]-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество светло-желто-коричневого цвета (254 мг, 70%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 27/73 CH3CN/0,1% H3PO4, 4,54 мин (99,0%); Т. пл.: 180-182°C; 1H ЯМР (ДМСО-d6) δ 1,49-1,71 (м, 2H, CH2), 1,82-2,07 (м, 3H, CHH, CH2), 2,15-2,31 (м, 2H, CH2), 2,36-2,49 (м, 1H, CHH), 2,52-2,62 (м, 1H, CHH), 2,63-2,75 (м, 2H, CH2), 2,81-3,00 (м, 1H, CHH), 3,49 (с, 2H, CH2), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,32-4,49 (м, 2H, CHH, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,23 (с, 2H, CH2), 6,78-7,04 (м, 3H, Ar), 7,19-7,30 (м, 2H, Ar), 7,33 (дд, J=1,7, 7,7 Гц, 7,42-7,62 (м, 3H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,33, 30,62, 31,16, 45,07, 50,10, 51,55, 61,64, 69,41, 72,13, 114,96, 115,20, 115,76, 120,42, 127,61, 128,81, 129,46, 129,78, 129,93, 133,28, 135,15, 138,40, 153,49, 157,04, 167,97, 170,95, 172,80; LCMS: MH=540; Вычислено для C32H33N3O5+0,5 H2O: C, 70,06; H, 6,25; N, 7,66; Найдено: С, 70,11; H, 5,97; N, 7,62.
5.283 2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-4-{4-[4-(4-ФТОРФЕНИЛ)-ПИПЕРИДИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-ИЗОИНДОЛ-1,3-ДИОН
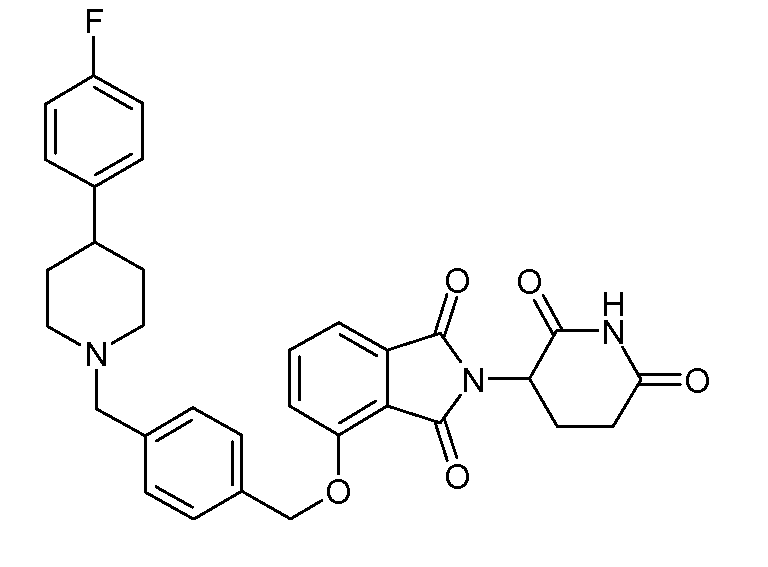
К суспензии 2-(2,6-диоксопиперидин-3-ил)-4-(4-((4-(4-фторфенил)пиперидин-1-ил)метил)бензилокси)изоиндолин-1,3-диона (170 мг, 0,306 ммоль, выход 56,0%) в CH2Cl2 добавляли 4-(4-фторфенил)пиперидин гидрохлорид (130 мг, 0,601 ммоль) и N-этил-N-изопропилпропан-2-амин (0,292 мл, 1,640 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли CH2Cl2 и воду и экстрагировали. Органический слой концентрировали. Полученное твердое вещество перемешивали в CH2Cl2 (5 мл), и суспензию фильтровали, получая твердое вещество белого цвета (170 мг, 56%). Температура плавления: 155-157°C. LCMS m/e=556. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 25/75 CH3CN/0,1% H3PO4 в H2O: tR=4,06 мин (98,5%); 1H ЯМР (ДМСО-d6) δ 1,53-1,76 (м, 4H, СН2, СН2), 2,03 (т, J=11,3 Гц, 3Н, CHH, СН2), 2,41-2,46 (м, 1Н, CHH), 2,54-2,65 (м, 2H, CHH, CH), 2,80-2,99 (м, 4H, CHH, CH2), 3,50 (с, 2H, CH2), 5,09 (дд, J=4,2, 13,4 Гц, 1H, CNH), 5,35 (с, 2H, CH2), 7,03-7,16 (м, 2H, Ar), 7,22-7,31 (м, 2H, Ar), 7,32-7,40 (м, 2H, Ar), 7,43-7,50 (м, 3H, Ar), 7,54-7,68 (м, 1H, Ar), 7,81 (д, J=7,2 Гц, 1H, Ar), 11,10 (уш.с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 33,13, 38,66, 41,00, 48,73, 53,51, 62,06, 69,99, 114,71, 114,99, 115,48, 116,58, 120,19, 127,23, 128,33, 128,43, 128,92, 133,26, 134,63, 136,97, 138,42, 142,34, 155,53, 158,96, 162,17, 165,27, 166,75, 169,85, 172,71; Вычислено для C32H30FN3O5+0,6 CH2Cl2: C: 64,55%; H: 5,10%; N: 6,93%, Найдено: С: 64,49%; H: 4,89%; N: 7,03%.
5.284 2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-4-{4-[4-(2,2,2-ТРИФТОР-ЭТИЛ)-ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-ИЗОИНДОЛ-1,3-ДИОН
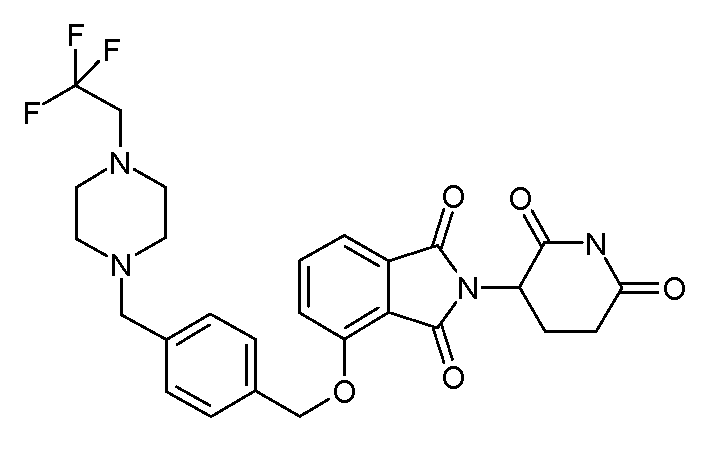
К раствору 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (250 мг, 0,547 ммоль) в CH2Cl2 добавляли 1-(2,2,2-трифторэтил)пиперазин гидрохлорид (123 мг, 0,601 ммоль) и N-этил-N-изопропилпропан-2-амин (292 мкл, 1,640 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли CH2Cl2 (15 мл) и воду (10 мл) и экстрагировали. Органический слой концентрировали и очищали на колонке с силикагелем, элюируя MeOH и CH2Cl2, получая 2-(2,6-диоксо-пиперидин-3-ил)-4-{4-[4-(2,2,2-трифтор-этил)-пиперазин-1-илметил]-бензилокси}-изоиндол-1,3-дион как твердое вещество белого цвета (170 мг, 57%). Температура плавления: 163-165°C. LCMS m/e=545. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 25/75 CH3CN/0,1% H3PO4 в H2O: tR=5,40 мин (99%); 1H ЯМР (ДМСО-d6) δ 1,96-2,10 (м, 1H, CHH), 2,37 (уш.с, 4H, CH2, CH2), 2,43-2,47 (м, OH, CHH), 2,52-2,66 (м, J=4,5 Гц, 6H, CH2, CH2, CH2, CH), 2,79-2,97 (м, 1H, CHH), 3,14 (д, J=10,2 Гц, 2H, CH2), 3,46 (с, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H,NCH), 5,35 (с, 2H, CH2), 7,33 (д, J=8,1 Гц, 2H, Ar), 7,46 (дд, J=4,1, 7,6 Гц, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,93, 30,90, 48,73, 52,45, 53,06, 56,23, 56,62, 57,39, 57,01, 61,58, 69,95, 115,48, 116,58, 120,19, 127,23, 127,80, 128,87, 133,26, 134,71, 136,96, 137,98, 155,52, 165,27, 166,75, 169,85, 172,71. Вычислено для C27H27F3N4O5,С: 59,56%; H: 5,00%; N: 10,29%. Найдено: С: 59,44%; H: 4,87%; N: 10,23%.
5.285 3-(4-((4-((4-(2,4-ДИФТОРФЕНИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
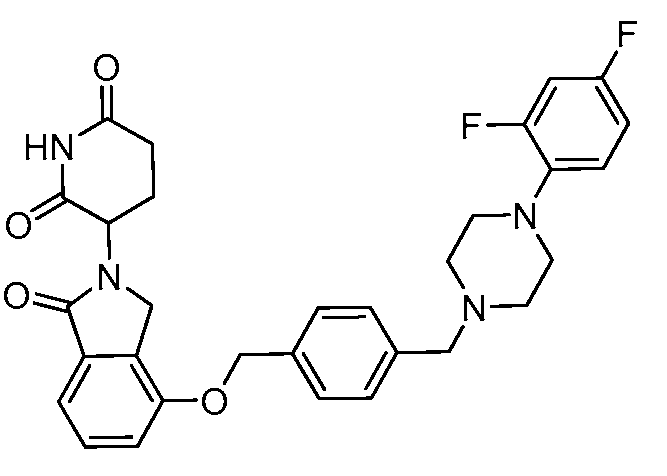
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,5 г, 1,128 ммоль) в CH2Cl2 добавляли 1-(2,4-дифторфенил)пиперазин (0,235 г, 1,184 ммоль) и N-этил-N-изопропилпропан-2-амин (0,602 мл, 3,38 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду (15 мл), экстрагировали и концентрировали, получая твердое вещество желтоватого цвета. Это твердое вещество перекристаллизовывали из CH3CN (10 мл), получая 3-(4-((4-((4-(2,4-дифторфенил)пиперазин-1-ил)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (330 мг, 52%). Температура плавления: 207-209°C. LCMS m/e=561. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 25/75 CH3CN/0,1% H3PO4 в H2O: 6,80 мин (98,8%). 1H ЯМР (ДМСО-d6) δ 1,90-2,06 (м, 1H, CHH), 2,36-2,45 (м, J=4,2 Гц, 1H, CHH), 2,53-2,59 (м, 5H, CHH, CH2, CH2), 2,83-3,01 (м, 5H, CH2, CH2, CHH), 3,54 (с, 2H, CH2), 4,05-4,58 (м, 2H, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,24 (с, 2H, CH2), 6,89-7,12 (м, 2H, Ar), 7,17 (ддд, J=2,8, 9,2, 12,4 Гц, 1H, Ar), 7,27-7,41 (м, 4H, Ar), 7,41-7,51 (м, 3H, Ar), 10,97 (с, 1H, Ar). 13C ЯМР (ДМСО-d6) δ 22,33, 31,16, 45,07, 50,44, 51,55, 52,52, 61,64, 69,39, 104,18, 104,52, 104,87, 110,80, 111,03, 114,96, 115,22, 119,86, 119,91, 127,63, 128,98, 129,80, 129,95, 133,30, 135,28, 137,88, 153,49, 167,99, 170,95, 172,80. Вычислено для C31H30F2N4O4: C%: 66,42, H%: 5,39, N%: 9,99. Найдено: C%: 65,08, H%: 5,02, N%: 9,66.
5.286 4-((4-((4-(2,4-ДИФТОРФЕНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИН-1,3-ДИОН
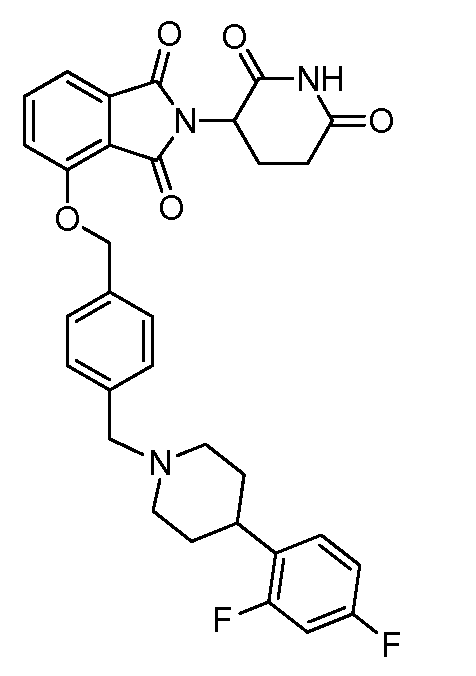
К суспензии 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,5 г, 1,093 ммоль) в CH2Cl2 добавляли 4-(2,4-дифторфенил)пиперидин (0,216 г, 1,093 ммоль) и N-этил-N-изопропилпропан-2-амин (0,584 мл, 3,28 ммоль). Суспензию перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли воду (10 мл), CH2Cl2 (10 мл), экстрагировали и концентрировали. Полученное масло очищали на колонке с силикагелем, элюируя MeOH и CH2Cl2, получая твердое вещество, которое перемешивали с CH2Cl2 (3 мл) и фильтровали, получая 4-((4-((4-(2,4-дифторфенил)пиперидин-1-ил)метил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион как твердое вещество белого цвета (50 мг, 8%). Температура плавления: 153-155°C. LCMS m/e=574. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4 в H2O: 4,69 мин (97,6%). 1H ЯМР (ДМСО-d6) δ 1,55-1,75 (м, 4H, СН2, СН2), 2,05 (д, J=2,1 Гц, 3H, CH2, CHH), 2,43-2,48 (м, 1H, CHH), 2,55-2,67 (м, 2H, CHH), 2,68-2,86 (м, 2H, CHH, CH), 2,82-2,82 (м, OH, M01), 2,86-2,99 (м, 3H, CHH, CH2), 3,51 (с, 2H, CH2), 4,89-5,18 (м, 1H, NCH), 5,36 (с, 2H, CH2), 6,91-7,08 (м, 1H, Ar), 7,09-7,23 (м, 1H, Ar), 7,27-7,54 (м, 7H, Ar), 7,61 (д, J=8,3 Гц, 1H, Ar), 7,74-7,95 (м, 1H, Ar), 11,10 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,93, 30,90, 31,63, 34,63, 48,73, 53,47, 62,01, 69,98, 103,20, 103,57, 103,90, 115,48, 116,58, 120,21, 127,25, 128,91, 129,09, 133,26, 134,65, 136,97, 138,40, 138,53, 155,53, 165,29, 166,75, 169,87, 172,71.
5.287 4-((4-((4-(4-ХЛОРФЕНИЛ)ПИПЕРИДИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)-2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИН-1,3-ДИОН
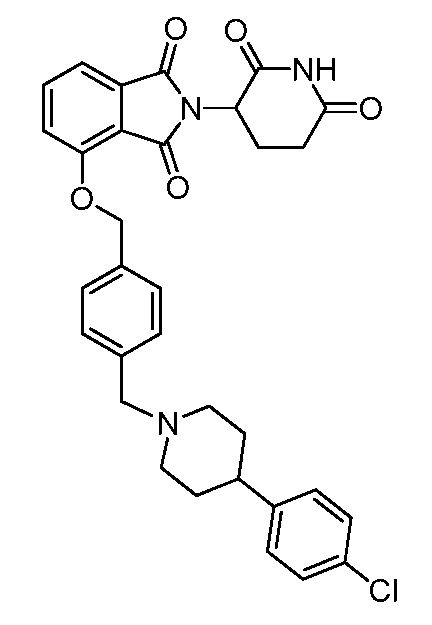
К суспензии 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,35 г, 0,765 ммоль) в CH2Cl2 добавляли 4-(4-хлорфенил)пиперидин (0,157 г, 0,804 ммоль) и N-этил-N-изопропилпропан-2-амин (0,409 мл, 2,296 ммоль). Суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь загружали на колонку с силикагелем и элюировали MeOH и CH2Cl2, получая 4-((4-((4-(4-хлорфенил)пиперидин-1-ил)метил)бензил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион как твердое вещество белого цвета (320 мг, 73%). Температура плавления: 236-238°C. LCMS m/e=572, 574. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4 в H2O: 6,17 мин (98,4%). 1H ЯМР (ДМСО-d6) δ 1,50-1,79 (м, 4H, CH2, СН2), 1,96-2,11 (м, 3Н, CHH, СН2), 2,46-2,66 (м, 3Н, СН, CHH, СНН), 2,79-2,99 (м, 3Н, СН2, СНН), 3,50 (с, 2Н, СН2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, NCH), 5,36 (с, 2H, CH2), 7,19-7,40 (м, 6H, Ar), 7,42-7,52 (м, 3H, Ar), 7,61 (д, J=8,5 Гц, 1H, Ar), 7,74-7,96 (м, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 32,88, 41,11, 48,73, 53,44, 62,03, 69,98, 115,48, 116,58, 120,19, 127,23, 128,15, 128,57, 128,91, 130,40, 133,26, 134,63, 136,97, 138,40, 145,21, 155,53, 165,27, 166,75, 169,85, 172,70. Вычислено для C32H30ClN3O5: C%: 67,19; H%: 5,29; N%: 7,35. Найдено: C%: 66,83; H%: 5,31; N%: 7,13.
5.288 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-4-((4-((4-((ТРИФТОРМЕТИЛ)СУЛЬФОНИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-1,3-ДИОН
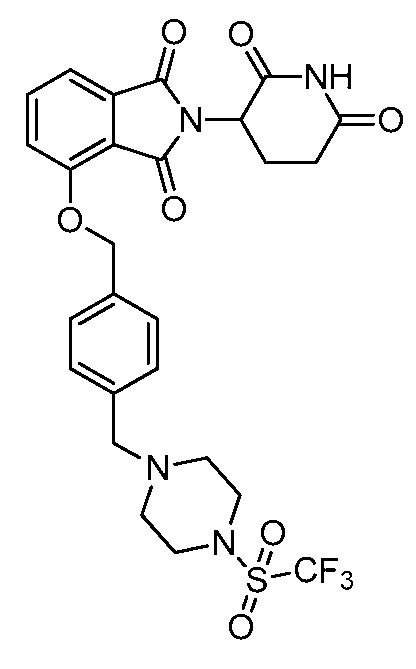
К раствору 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,25 г, 0,547 ммоль) в CH2Cl2 добавляли 1-(трифторметилсульфонил)пиперазин (0,143 г, 0,656 ммоль) и N-этил-N-изопропилпропан-2-амин (0,212 г, 1,640 ммоль). Суспензию перемешивали при температуре окружающей среды в течение ночи. К смеси добавляли воду (15 мл), CH2Cl2 (20 мл), экстрагировали, концентрировали, и полученное масло очищали на колонке с силикагелем, получая твердое вещество. Это твердое вещество очищали препаративной ВЭЖХ, получая 2-(2,6-диоксопиперидин-3-ил)-4-((4-((4-((трифторметил)сульфонил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-1,3-дион в форме твердого вещества (80 мг, 25%). Температура плавления: 229-231°C. LCMS m/e=595. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 30/70 CH3CN/0,1% H3PO4 в H2O: 3,79 (97%). 1H ЯМР (ДМСО-d6) δ 1,94-2,12 (м, 1H, CHH), 2,35-2,45 (м, 1H, CHH), 2,53-2,67 (м, 5H, CHH, CH2, CH2), 2,80-2,98 (м, 1H, CHH), 3,48 (уш.с, 4H, CH2, CH2), 3,56 (с, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, NCH), 5,35 (с, 2H, CH2), 7,27-7,42 (м, 2H, Ar), 7,48 (д, J=6,8 Гц, 3H, Ar), 7,60 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,3 Гц, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,95, 30,89, 46,38, 48,73, 51,87, 61,01, 69,90, 115,50, 120,18, 127,35, 128,97, 133,26, 133,75, 134,99, 136,97, 137,34, 155,50, 165,29, 166,79, 169,85, 172,71. Вычислено для C26H25F3N4O7S+1,1 H2O: C%: 51,17; H%: 4,30; N%: 9,12. Найдено: C%: 50,83; H%: 4,46; N%: 8,74.
5.289 2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-4-{4-[4-(4-ФТОРФЕНИЛ) -ПИПЕРАЗИН-1-ИЛМЕТИЛ]-БЕНЗИЛОКСИ}-ИЗОИНДОЛ-1,3-ДИОН
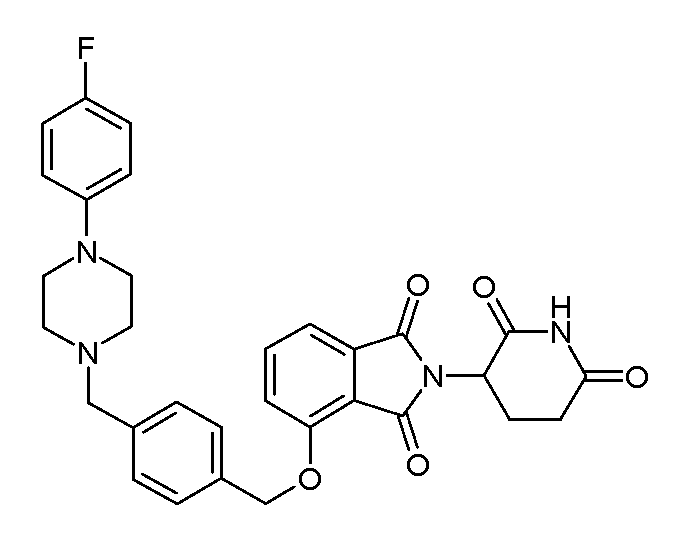
К суспензии 4-(4-(бромметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (0,25 г, 0,547 ммоль) в CH2Cl2 добавляли 1-(4-фторфенил)пиперазин (0,108 г, 0,601 ммоль) и N-этил-N-изопропилпропан-2-амин (0,212 г, 1,640 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду (10 мл) и CH2Cl2 (15 мл) и экстрагировали. Органический слой концентрировали, затем очищали на колонке с силикагелем, элюируя CHCl2 и MeOH, получая 2-(2,6-диоксо-пиперидин-3-ил)-4-{4-[4-(4-фторфенил)-пиперазин-1-илметил]-бензилокси}-изоиндол-1,3-дион как желтоватое твердое вещество (0,24 г, 79%). Температура плавления: 135-137°C. LCMS m/e=557. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический 25/75 CH3CN/0,1% H3PO4 в H2O: tR=7,07 мин (99%); 1H ЯМР (ДМСО-d6) δ 1,92-2,13 (м, 1H, CHH), 2,41-2,47 (м, 1H, CHH), 2,54-2,67 (м, 5H, CHH, CH2, CH2), 2,79-2,97 (м, 1H, CHH), 2,98-3,19 (м, 4H, CH2, CH2), 3,53 (с, 2H, CH2), 5,09 (дд, J=5,4, 12,7 Гц, 1H, NCH), 5,36 (с, 2H, CH2), 6,80-6,97 (м, 2H, Ar), 6,97-7,15 (м, 2H, Ar), 7,29-7,41 (м, 2H, Ar), 7,42-7,55 (м, 3H, Ar), 7,61 (д, J=8,5 Гц, 1H, Ar), 7,83 (дд, J=7,4, 8,5 Гц, 1H, Ar), 11,11 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 21,95, 30,90, 48,75, 48,97, 52,51, 61,65, 69,96, 115,03, 115,31, 115,50, 116,98, 117,09, 120,21, 127,28, 129,00, 133,26, 134,79, 136,97, 137,94, 147,92, 154,35, 155,53, 157,47, 165,29, 166,75, 169,87, 172,71; Вычислено для C31H29FN4O5+0,2 H2O: C: 66,47%; H: 5,29%; N: 10,00%; Найдено: С: 66,16%; H: 5,17%; N: 9,93%.
5.290 3-(4-БЕНЗО[D]ТИАЗОЛ-2-ИЛОКСИ-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
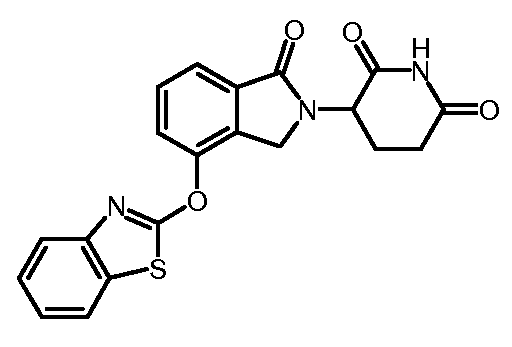
Стадия 1: Карбонат цезия (4,6 г, 14,1 ммоль) добавляли к перемешиваемому раствору 3-гидрокси-2-метилметилбензоата (2,0 г, 12,0 ммоль) и 2-хлорбензотиазола (3,1 г, 18,1 ммоль) в ацетонитриле (50 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали и промывали ацетонитрилом (25 мл), фильтрат концентрировали, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 1:9), получая 3-(бензо[d]тиазол-2-илокси)-2-метилметилбензоат (3,4 г, 93%-ый выход): 1H ЯМР (CDCl3) δ 2,52 (с, 3Н, CH3), 3,92 (с, 3Н, ОСН3), 7,23-7,43 (м, 4Н, Ar), 7,63-7,75 (м, 2Н, Ar), 7,86 (дд, J=1,2 и 7,8 Гц, 1H, Ar).
Стадия 2: N-Бромсукцинимид (2,2 г, 12,1 ммоль) добавляли к перемешиваемому раствору 3-(бензо[d]тиазол-2-илокси)-2-метилметилбензоата (3,3 г, 11,0 ммоль) в CCl4 (70 мл). Полученную смесь нагревали при 70°C на масляной бане с облучением реакционной смеси 300-Вт лампой в течение 2 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат промывали водой (2×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 1:9), получая 3-(бензо[d]тиазол-2-илокси)-2-(бромметил)метилбензоат (3,4 г, 81%-ый выход): 1H ЯМР (ДМСО-d6) δ 3,92 (с, 3Н, CH3), 4,98 (с, 2Н, СН2), 7,21-7,50 (м, 2Н, Ar), 7,56-7,76 (м, 2H), 7,79-7,93 (м, 2H,Ar), 7,99 (д, J=7,2 Гц, lH, Ar).
Стадия 3: Триэтиламин (2,0 г, 19,8 ммоль) добавляли к перемешиваемой суспензии 3-(бензо[d]тиазол-2-илокси)-2-(бромметил)метилбензоата (3,0 г, 7,9 ммоль) и α-аминоглутаримида гидрохлорида (1,3 г, 7,9 ммоль) в ацетонитриле (100 мл). После добавления смесь нагревали при 45°C в течение 3 часов, затем нагревали до 85°C в течение ночи. Реакционную смесь охлаждали и концентрировали. Остаток перемешивали с водой (50 мл), получая твердое вещество, которое ресуспендировали с ацетоном (20 мл), получая светло-голубое твердое вещество (1,5 г, 46%) 3-(4-бензо[d]тиазол-2-илокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион. Цвет удаляли растворением в ацетоне, обработкой обесцвечивающим углеродом и фильтрацией через Millpole (0,45 пкМ): Т. пл. 258-260°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,04 (м, 1H), 2,31-2,45 (м, 1H), 2,57 (уш., 1H), 2,78-2,99 (м, 1H), 4,33 (д, J=17,7 Гц, 1H), 4,48 (д, J=17,4 Гц, 1H), 5,12 (дд, J=5,1 и 13,2 Гц, 1H), 7,30-7,49 (м, 2H), 7,64-7,84 (м, 4H), 7,99 (д, J=7,2 Гц, 1H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,15, 31,07, 45,10, 51,66, 121,29, 121,43, 122,33, 124,42, 124,44, 126,56, 130,40, 131,94, 133,22, 134,39, 148,20, 148,92, 167,03, 170,52, 170,75, 172,73; Вычислено для: C20H15N3O4S: C, 61,06: H, 3,84; N, 10,68; S, 8,15, Найдено: C, 61,00; H, 3,72; N, 10,59; S, 8,20.
5.291 3-[4-(4-МЕТИЛ-ЦИКЛОГЕКСИЛМЕТОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
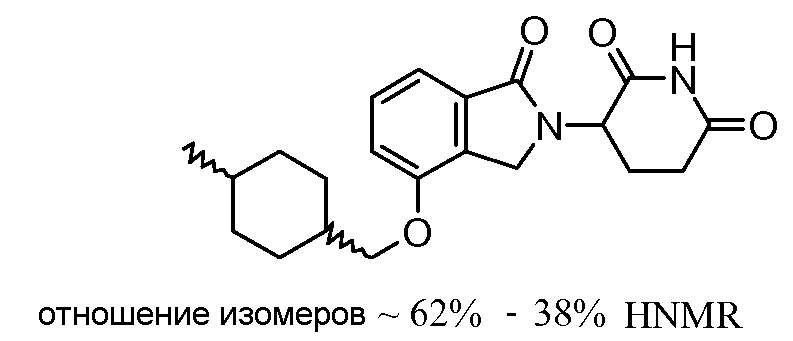
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 1,90 г, 2,36 ммоль) добавляли при 0°C к перемешиваемому раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,31 г, 1,07 ммоль) в THF (20 мл), с последующим добавлением диизопропил-диазен-1,2-дикарбоксилата (0,27 мл, 2,14 ммоль). После перемешивания в течение 30 минут добавляли (4-метил-циклогексил)-метанол (смесь цис и транс, 0,41 г, 1,85 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды, затем фильтровали, промывали метанолом (3×10 мл), затем метиленхлоридом (3×10 мл). Объединенный фильтрат упаривали в вакууме, получая масло, которое очищали на колонке с силикагелем (градиент MeOH/CH2Cl2 от 0% до 9% за 60 минут), получая метиловый эфир 4-карбамоил-4-[4-(4-метил-циклогексилметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты как прозрачное масло (0,35 г, 81%-ый выход). 1H ЯМР показал отношение 61%:39%. Это соединение использовали на следующей стадии без дальнейшей очистки.
Стадия 2: Трет-бутоксид калия (0,10 г, 0,87 ммоль) добавляли к перемешиваемому раствору метилового эфира 4-карбамоил-4-[4-(4-метил-циклогексилметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,35 г, 0,87 ммоль) в THF (10 мл) при 0°C. Смесь перемешивали в течение десяти минут и гасили 1н. HCl (3 мл), нейтрализовали насыщенным раствором бикарбоната натрия (4 мл до рН=7) и быстро экстрагировали этилацетатом (2×30 мл). Объединенные фазы этилацетата упаривали до твердого вещества грязно-белого цвета, которое очищали препаративной ВЭЖХ (0,1% муравьиной кислоты/вода, и 0,1% муравьиной кислоты/ацетонитрил), получая 3-[4-(4-метил-циклогексилметокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (0,03 г, 10%-ый выход); ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 40/60 за 10 мин (ацетонитрил/0,1% H3PO4), 4,68 мин (60,2%), 5,07 мин (37,3%); Т. пл.: N/A в связи с ограниченным размером доступного образца; 1H ЯМР (ДМСО-d6) δ 0,78-2,08 (м, 15H, СН3, 5CH2, СН, СНН), 2,38-2,46 (м, 1Н, СНН), 2,54-2,65 (м, 1Н, CHH), 2,80-3,01 (м, 1H, CHH), 3,87-4,08 (м, 2H, CH2 (62% до 38%)), 4,15-4,46 (м, 2H, ArCH2), 5,11 (дд, 1H, NCH), 7,16-7,34 (м, 2H, Ar), 7,41-7,54 (м, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 19,94, 22,35, 22,57, 24,87, 29,04, 29,39, 30,10, 31,20, 32,23, 34,10, 34,51, 36,82, 44,99, 51,58, 70,85, 73,02, 114,43, 114,54, 114,84, 129,71, 129,84, 133,18, 153,91, 168,08, 171,02, 172,85; LCMS MH=371.
5.292 3-[4-(2-БЕНЗОФУРАН-2-ИЛ-ЭТОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
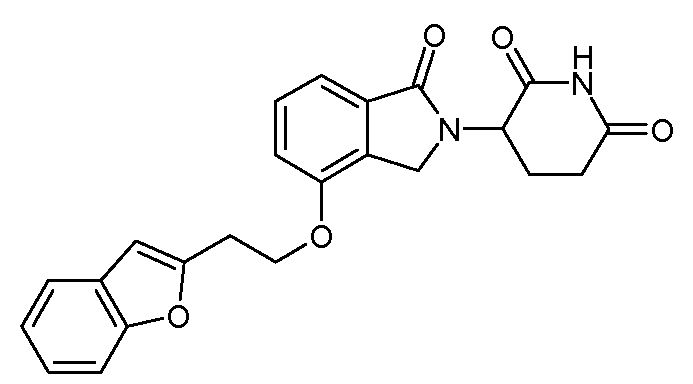
Стадия 1: К суспензии 2-йодфенила (0,22 г, 1 ммоль) в воде (3 мл) добавляли s-пролинол (0,29 мл, 3 ммоль), затем Pd на углероде (70 мг, 0,03 ммоль), трифенилфосфин (35 мг, 0,13 ммоль) и йодид меди (13 мг, 0,07 ммоль). Смесь перемешивали при температуре окружающей среды в течение 1 часа. Добавляли 3-бутин-1-ол (0,23 мл, 3 ммоль), и смесь перемешивали при 80°C в течение 3 часов. Смесь охлаждали до температуры окружающей среды и концентрировали на роторном испарителе. Полученную смесь очищали на колонке с силикагелем, элюируя этилацетатом и гексаном (градиент, продукт вышел в 6%-ом метаноле), получая 2-бензофуран-2-ил-этанол (0,1 г, 62%).
Стадия 2: К раствору метилового эфира 4-карбамоил-4-(4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты (0,54 г, 1,85 ммоль) в THF (10 мл) при 0°C добавляли трифенилфосфиновую смолу (2,4 г, загрузка 1,5 ммоль/г, 3,7 ммоль) и DIAD (0,72 мл, 3,7 ммоль). После перемешивания при 0°C в течение 10 минут, к смеси добавляли 2-бензофуран-2-ил-этанол (0,36 г, 2,2 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и фильтрат концентрировали и экстрагировали EtOAc (30 мл) и Na2CO3 (20 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл) и концентрировали. Полученное масло очищали на колонке с силикагелем, получая метиловый эфир 4-[4-(2-бензофуран-2-ил-этокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты (0,20 г, 21%).
Стадия 3: К раствору метилового эфира 4-[4-(2-бензофуран-2-ил-этокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты (0,7 г, 1,5 ммоль) в THF (10 мл) при 0°C добавляли трет-бутоксид калия (0,45 мл, 0,45 ммоль). Смесь перемешивали при 0°C в течение 10 минут и гасили 1н. HCl (5 мл, 5ммоль), затем насыщенным NaHCO3 (25 мл). Смесь экстрагировали EtOAc (50 мл×2). Органический слой промывали водой (30 мл) и солевым раствором (30 мл), высушивали над MgSO4 и концентрировали. Полученное твердое вещество очищали на колонке с силикагелем, элюируя CH2Cl2/MeOH, получая 3-[4-(2-бензофуран-2-ил-этокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,15 г, 83%). Т. пл.: 160-162°C; ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент до 95/5 ацетонитрил/0,1% H3PO4 за 5 мин: tR=5,01 мин (99%); 1H ЯМР (ДМСО-d6) δ 1,87-1,98 (м, 1H, CHH), 2,37 (кв.д, J=4,5, 13,2 Гц, 1H, CHH), 2,59 (д, J=1,9 Гц, 1H, CHH), 2,80-2,97 (м, 1H, CHH), 3,29 (т, J=6,2 Гц, 2H, CH2), 4,10-4,36 (м, 2H, CH2), 4,49 (т, J=6,3 Гц, 2H, CH2), 5,09 (дд, J=5,1, 13,4 Гц, 1H, NCH), 6,74 (с, 1H, Ar), 7,11-7,29 (м, 2H, Ar), 7,29-7,40 (м, 2H, Ar), 7,44-7,62 (м, 3H, Ar), 10,96 (с, 1H, NH), 13C ЯМР (ДМСО-d6) δ 22,33, 28,11, 31,18, 44,97, 51,56, 65,86, 103,43, 110,70, 115,01, 115,36, 120,52, 122,66, 123,52, 128,42, 129,84, 129,91, 133,31, 153,44, 153,99, 155,72, 167,95, 170,96, 172,80; LCMS: 405; Вычислено для C23H20N2O5+0,06 EtOAc: C, 68,13; H, 5,04; N, 6,84; Найдено: С, 67,73; H, 5,16; N, 6,75.
5.293 4-((2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)-1-ОКСОИЗОИНДОЛИН-4-ИЛОКСИ)МЕТИЛ)БЕНЗОНИТРИЛ
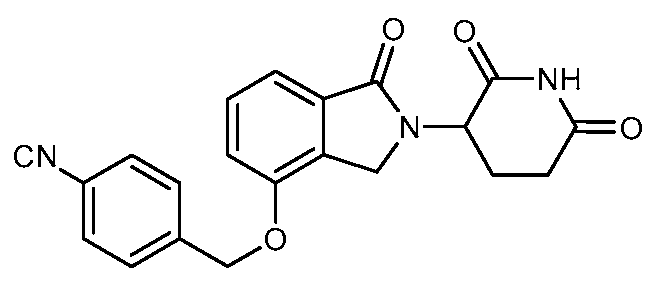
К смеси 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,25 г, 0,86 ммоль) и K2CO3 (0,38 г, 2,74 ммоль) в DMF (40 мл) медленно добавляли 4-(бромметил)бензонитрил (0,48 мл, 2,46 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли дополнительный K2CO3 (0,38 г, 2,74 ммоль), и реакционную смесь нагревали при 80°C в течение ночи. К реакционной смеси добавляли уксусную кислоту (5 капель). Растворитель выпаривали, и остаток разделяли между этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (100 мл). Твердое вещество, которое не входило в раствор, отфильтровывали и перемешивали в метаноле (400 мл). Твердое вещество затем отфильтровывали, промывали метанолом (100 мл) и высушивали, получая 4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензонитрил как твердое вещество белого цвета (0,31 г, 66%-ый выход): ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, ацетонитрил/0,1% H3PO4: градиент 10/90-90/10 за 15 мин; 5 мин при 90/10: 10,45 мин (98,49%); Т. пл.: 290-292°C; 1H ЯМР (ДМСО-d6) δ 1,85-2,12 (м, 1H, CHH), 2,34-2,47 (м, 1H, CHH), 2,54-2,70 (м, 1H, CHH), 2,78-3,07 (м, 1H, CHH), 4,13-4,39 (д, J=17,6 Гц, 1H, CHH), 4,47 (д, J=17,6 Гц, 1H, CHH), 5,12 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,37 (с, 2H, CH2), 7,32 (дд, J=7,6, 16,7 Гц, 2H, Ar), 7,41-7,57 (м, 1H, Ar), 7,69 (д, J=8,1 Гц, 2H, Ar), 7,88 (д, J=8,3 Гц, 2H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,37, 31,16, 45,03, 51,58, 68,49, 110,60, 114,93, 115,53, 118,67, 128,01, 129,83, 129,97, 132,41, 133,40, 142,41, 153,07, 167,90, 170,95, 172,81; LCMS MH=376; Вычислено для C21H17N3O4+0,1 H2O: C, 66,87, H, 4,60, N, 11,14; Найдено: С, 66,43, H, 4,47, N, 11,05.
5.294 3-[4-(4-ГЕКСИЛАМИНОМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
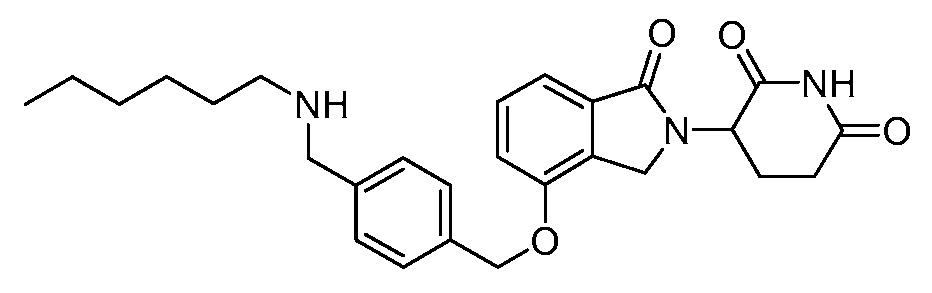
Стадия 1: К раствору метилового эфира 4-карбамоил-4-[4-(4-хлорметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,7 г, 1,62 ммоль) в ацетонитриле (20 мл) добавляли гексиламин (1,07 мл, 8,1 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали, и полученное масло использовали на следующей стадии без очистки.
Стадия 2: К раствору метилового эфира 4-карбамоил-4-[4-(4-гексиламинометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты (0,8 г, 1,62 ммоль) в DMF (10 мл) добавляли карбонат калия (0,22 г, 1,62 ммоль). Смесь перемешивали при 70°C в течение 9 часов. Смесь фильтровали. Фильтрат концентрировали на роторном испарителе. Полученную смесь очищали на колонке с силикагелем и элюировали CH2Cl2/MeOH, получая 3-[4-(4-гексиламинометил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (84 мг, 12%). Т. пл.: 155-157°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент ацетонитрил/0,1% H3PO4 в H2O от 5/95 до 100/0 за 5 мин и остановка при 100/0 на 5 мин: tR=5,09 мин (96%), 1H ЯМР (ДМСО-d6) δ 0,65-0,98 (м, 3Н, CH3), 1,11-1,33 (м, 6Н, СН2, СН2, СН2), 1,41 (д, J=6,8 Гц, 2H, CH2), 1,86-2,07 (м, 1Н, CHH), 2,35-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,78-3,09 (м, 1H, CHH), 3,71 (с, 2H, CH2), 4,17-4,53 (м, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 7,12-7,63 (м, 7H, Ar), 13C ЯМР (ДМСО-d6) δ 13,84, 21,99, 22,30, 26,35, 28,87, 31,13, 45,04, 48,35, 51,53, 52,28, 69,36, 114,94, 115,15, 127,56, 128,15, 129,73, 129,90, 133,24, 134,95, 139,89, 153,40, 167,94, 170,91, 172,7; LCMS MH=464, Вычислено для C27H33N3O4: С, 69,96; H, 7,18; N, 9,06; Найдено: С, 61,67; H, 6,22; N, 7,96.
5.295 4-[2-(2,6-ДИОКСО-ПИПЕРИДИН-3-ИЛ)-1-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-4-ИЛОКСИМЕТИЛ]-N-(2-МОРФОЛИН-4-ИЛ-ЭТИЛ)-БЕНЗАМИД
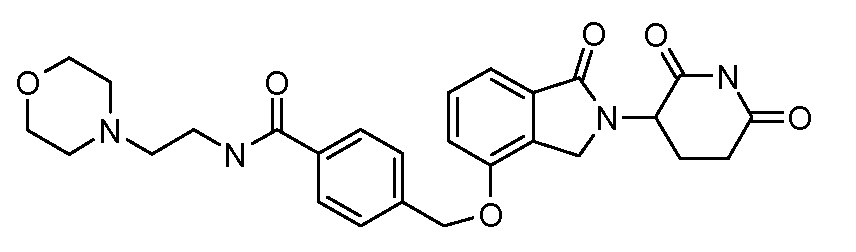
Стадия 1: 4-(Хлорметил)бензоил хлорид (1,452 г, 7,68 ммоль) добавляли к перемешиваемому раствору 2-морфолиноэтанамина (1 г, 7,68 ммоль) в ацетонитриле (25 мл). Полученный раствор перемешивали в течение 2 часов, и реакция была полной. Реакционную смесь концентрировали и очищали ISCO, получая 4-хлорметил-N-(2-морфолин-4-ил-этил)-бензамид как твердое вещество белого цвета (1,7 г, 78%-ый выход); LCMS MH=283, 285. 1H ЯМР (ДМСО-d6) δ 2,43 (д, J=14,5 Гц, 6H, CH2, CH2, CH2), 3,35-3,44 (м, 2H, CH2), 3,50-3,63 (м, 4H, CH2, CH2), 4,81 (с, 2H, CH2), 7,52 (д, J=8,1 Гц, 2H, Ar), 7,83 (д, J=8,3 Гц, 2H, Ar), 8,34-8,49 (м, 1H, NH).
Стадия 2: К перемешиваемому раствору 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (400 мг, 1,36 ммоль), 4-(хлорметил)-N-(2-морфолиноэтил)бензамида (387 мг, 1,36 ммоль) и K2CO3 (189 мг, 1,36 ммоль) в DMF (10 мл) при температуре окружающей среды добавляли DIPEA (0,24 мл, 1,36 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 21 часа и нагревали при 50°C в течение 4 дней. Затем смесь нагревали при 80°C в течение ночи и концентрировали для очистки ISCO, получая твердое вещество белого цвета, которое растирали в ацетонитриле (3 мл), получая 4-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-илоксиметил]-N-(2-морфолин-4-ил-этил)-бензамид как твердое вещество белого цвета (123 мг, выход 17,7%). ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5-50% за 10 мин (ацетонитрил/0,1% H3PO4), 7,28 мин (97,4%); Т. пл.: 193-195°C. 1H ЯМР (ДМСО-d6) δ 1,91-2,10 (м, 1H, CHH), 2,36-2,48 (м, 7H, CHH, CH2, CH2, CH2), 2,54-2,65 (м, 1H, CHH), 2,83-3,02 (м, 1H, CHH), 3,34-3,44 (м, 2H, CH2), 3,51-3,62 (м, 4H, CH2, CH2), 4,22-4,53 (м, 2H, CHH, CHH), 5,05-5,18 (м, 1H, CHN), 5,32 (с, 2H, CH2), 7,27-7,37 (м, 2H, Ar), 7,44-7,52 (м, 1H, Ar), 7,57 (д, J=8,3 Гц, 2H, Ar), 7,85 (д, J=8,3 Гц, 2H, Ar), 8,40 (с, 1H, NH), 10,98 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,34, 31,18, 36,51, 45,07, 51,58, 53,25, 57,29, 66,16, 68,97, 115,01, 115,35, 127,23, 127,29, 129,78, 129,97, 133,34, 134,16, 139,67, 153,27, 165,78, 167,94, 170,96, 172,81. LCMS MH=507. Вычислено для C27H30N4O6+1,2 H2O: C, 61,40; H, 6,18; N, 10,61; Найдено: С, 61,10; H, 6,11; N, 10,26.
5.296 3-(4-((6-((ДИЭТИЛАМИНО)МЕТИЛ)БЕНЗОФУРАН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
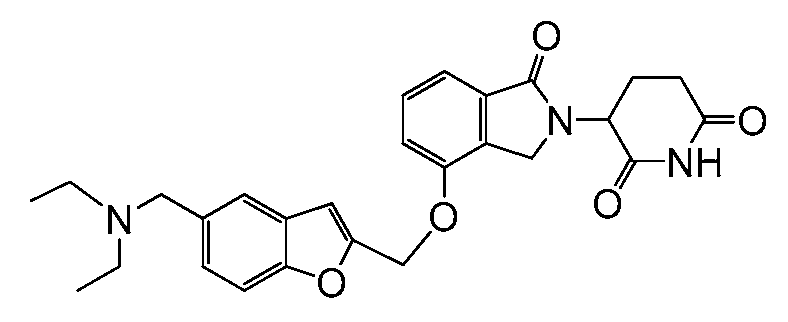
Стадия 1: Смесь 5-формилбензофуран-2-этилкарбоксилата (1,1 г, 4,8 ммоль), диэтиламина (0,4 г, 5,3 ммоль) и уксусной кислоты (0,3 г, 5,5 ммоль) в THF (45 мл) перемешивали при температуре окружающей среды в течение 30 минут. Добавляли натрий триацетоксиборгидрид (2,0 г, 9,6 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли EtOAc (70 мл) и водой (40 мл) и подщелачивали NH4OH до рН~11. Слои разделяли, и водный слой экстрагировали EtOAc (40 мл). Объединенный раствор EtOAc высушивали и концентрировали. Остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-(диэтиламинометил)бензофуран-2-этилкарбоксилат (0,9 г, 70%-ый выход): 1H ЯМР (CDCl3) δ 1,05 (т, J=6,9 Гц, 6H), 1,42 (т, J=7,2 Гц, 3H), 2,50-2,75 (кв, J=7,2 Гц, 4H), 3,64 (с, 2H), 4,40-4,47 (кв, J=7,2 Гц, 2H), 7,42-7,53 (м, 3H), 7,62 (д, J=0,9 Гц, 1H).
Стадия 2: Раствор 5-(диэтиламинометил)-бензофуран-2-этилкарбоксилата (0,9 г, 3,3 ммоль) в THF (15 мл) при 5°C медленно добавляли к перемешиваемому раствору LiAlH4/THF (1M, 4,3 мл, 4,3 ммоль) в THF (10 мл). Реакционную смесь перемешивали при 5°C в течение 30 минут, затем гасили насыщ. Na2CO3 (30 мл). Смесь перемешивали с CH2Cl2 (50 мл), и водный слой экстрагировали CH2Cl2 (3×40 мл). Объединенный раствор CH2Cl2 промывали солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая [5-(диэтиламинометил)бензофуран-2-ил]метанол (0,6 г, 87%); 1H ЯМР (CDCl3) δ 1,05 (т, J=7,2 Гц, 6H), 2,50-2,57 (кв, J=7,2 Гц, 4H), 2,93 (уш., 1H), 3,62 (с, 2H), 4,71 (с, 2H), 6,56 (д, J=0,3 Гц, 1H), 7,21-7,24 (дд, J=1,8 и 8,4 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,47 (д, J=1,2 Гц, 1H).
Стадия 3: Диизопропил азодикарбоксилат (0,8 г, 4,2 ммоль) добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,5 г, 4,4 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,8 г, 2,8 ммоль) и [5-(диэтиламинометил)бензофуран-2-ил]метанола (0,7 г, 2,8 ммоль) в THF (60 мл) добавляли при 3-6°C. После перемешивания при 3°C в течение 5 минут, смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали CH2Cl2 (40 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (40 мл), водой (40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((5-((диэтиламино)метил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,7, 47%-ый выход): 1H ЯМР (CDCl3) δ 1,05 (т, J=7,2 Гц, 6H), 2,12-2,44 (м, 4H), 2,50-2,57 (кв, J=7,2 Гц, 4H), 3,62-3,64 (м, 5H), 4,40 (д, J=17,4 Гц, 1H), 4,45 (д, J=17,4 Гц, 1H), 4,87-4,92 (дд, J=5,7 и 8,7 Гц, 1H), 5,23 (с, 2H), 5,49 (с, 1H), 6,40 (с, 1H), 6,77 (с, 1H), 7,15-7,18 (дд, J=2,4 и 6,6 Гц, 1H), 7,22-7,29 (м, 1H), 7,39-7,46 (м, 3H), 7,53 (д, J=0,9 Гц, 1H).
Стадия 4: Смесь 5-амино-4-(4-((5-((диэтиламино)метил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 1,3 ммоль) и K2CO3 (0,2 г, 1,3 ммоль) в DMF (10 мл) нагревали на масляной бане при 80°C в течение 6 часов. Реакционную смесь охлаждали и концентрировали. Остаток перемешивали с EtOAc (10 мл) и водой (20 мл). Твердое вещество собирали и очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97-5:95), получая 3-(4-((6-диэтиламино)метил)бензофуран-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 51%-ый выход): Т. пл. 193-195°C; 1H ЯМР (ДМСО-d6) δ 0,97 (т, J=6,9 Гц, 6H), 1,94-1,98 (м, 1H), 2,39-2,58 (м, 6H), 2,84-2,94 (м, 1H), 3,59 (с, 2H), 4,25 (д, J=17,7 Гц, 1H), 4,35 (д, J=17,7 Гц, 1H), 5,07-5,13 (дд, J=5,1 и 13,2 Гц, 1H), 5,41 (с, 2H), 7,07 (с, 1H), 7,26-7,29 (дд, J=1,2 и 8,4 Гц, 1H), 7,34-7,37 (дд, J=0,9 и 6,9 Гц, 1H), 7,46-7,56 (м, 4H), 10,96 (с, 1H); 13C ЯМР (ДМСО-d6) δ 11,59, 22,28, 31,16, 45,03, 45,96, 51,55, 56,73, 62,55, 107,05, 110,68, 115,11, 115,64, 121,08, 125,66, 127,40, 129,81, 129,94, 133,42, 134,69, 152,67, 152,98, 153,68, 167,88, 170,93, 172,79; Вычислено для C27H29N3O5+0,2 H2O: C, 67,68; H, 6,18; N, 8,77, Найдено: С, 67,70; H, 5,94; N, 8,63.
5.297 3-(4-((6-((ДИЭТИЛАМИНО)МЕТИЛ)БЕНЗО[B]ТИОФЕН-2-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
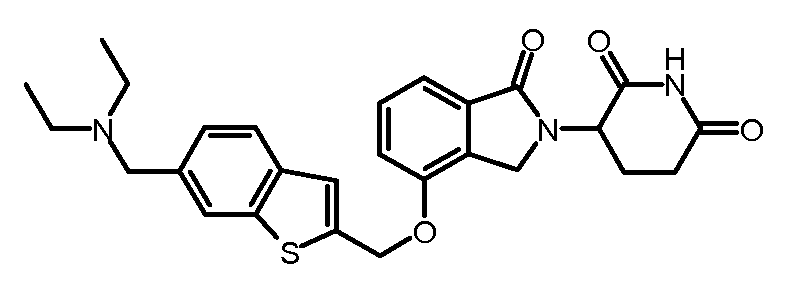
Стадия 1: Суспензию смеси роданина (6,0 г, 45 ммоль) и ацетата натрия (11,3 г, 137 ммоль) в ледяной уксусной кислоте (60 мл) нагревали при 75°C на масляной бане. Медленно добавляли п-толуилальдегид (5,8 г, 47,9 ммоль), и смесь нагревали при 120°C в течение 1 часа. Смесь охлаждали до температуры окружающей среды и вливали в воду со льдом (400 мл). После перемешивания в течение 30 минут, смесь фильтровали, получая 14 г твердого вещества оранжевого цвета. Это твердое вещество растворяли в 5%-ом NaOH (200 мл) и нагревали при 80°C на масляной бане в течение 1 часа, затем охлаждали до температуры окружающей среды. Смесь подкисляли концентрированной HCl, и твердое вещество собирали, получая 2-меркапто-3-п-толилакриловую кислоту (6,4 г, 73%-ый выход): 1H ЯМР (ДМСО-d6) δ 2,34 (с, 3H), 7,28-7,31 (д, J=8,1 Гц, 2H), 7,57-7,60 (д, J=8,1 Гц, 2H), 7,71 (с, 1H).
Стадия 2: Смесь 2-меркапто-3-п-толилакриловой кислоты (1,5 г, 7,7 ммоль) и I2 (2,9 г, 11,6 ммоль) в 1,4-диоксане (12 мл) облучали в микроволновом реакторе при 160°C в течение 12 минут. Смесь охлаждали до температуры окружающей среды и вливали насыщ. бисульфит натрия (300 мл). Твердое вещество собирали и высушивали, получая 6-метилбензо[b]тиофен-2-карбоновую кислоту (1,8 г, 100%). Это соединение использовали в следующей реакции без дальнейшей очистки.
Стадия 3: Концентрированную H2SO4 (5 мл) добавляли к перемешиваемой смеси 6-метилбензо[b]тиофен-2-карбоновой кислоты (4,4 г, 23,2 ммоль) в метаноле (100 мл). Полученную смесь нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали и концентрировали. Остаток растворяли в CH2Cl2 (150 мл) и промывали 2н. NaOH (40 мл), водой (2×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 1:9), получая 6-метилбензо[b]тиофен-2-метилкарбоксилат (2,9 г, 60%-ый выход): 1H ЯМР (CDCl3) δ 2,49 (с, 3Н), 3,93 (с, 3Н), 7,20-7,26 (м, 1Н), 7,65 (с, 1H), 7,74 (д, J=6 Гц, 1H), 8,01 (с, 1H).
Стадия 4: N-Бромсукцинимид (4,0 г, 22,5 ммоль) добавляли к перемешиваемому раствору 6-метилбензо[b]тиофен-2-метилкарбоксилата (3,6 г, 17,4 ммоль) в CCl4 (55 мл). Реакционную смесь нагревали на масляной бане при 75°C с облучением 300 Вт лампой в течение 17 часов. Реакционную смесь охлаждали и фильтровали, и фильтрат промывали водой (2×40 мл) и солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, EtOAc:Гексан 1:9), получая 6-(бромметил)бензо[b]тиофен-2-метилкарбоксилат (2,2 г, 44%-ый выход): 1H ЯМР (CDCl3) δ 3,90 (с, 3Н), 4,40 (с, 2Н), 7,39-7,44 (м, 4Н).
Стадия 5: Смесь диэтиламина (1,0 г, 13,7 ммоль), K2CO3 (3,5 г, 25,3 ммоль) и 18-crown-6 (каталитическое количество) в ацетоне (15 мл) нагревали при 35°C на масляной бане. Добавляли раствор 6-(бромметил)бензо[b]тиофен-2-метилкарбоксилата (1,6 г, 5,6 ммоль) в ацетоне (15 мл). Реакционную смесь перемешивали при 45°C на масляной бане в течение 3 часов и затем охлаждали до температуры окружающей среды. Смесь фильтровали, и фильтрат концентрировали. Остаток растворяли в EtOAc (70 мл) и промывали водой (2×30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 6-[(диэтиламино)метил]бензо[b]тиофен-2-метилкарбоксилат (1,3 г, 84%-ый выход): 1H ЯМР (CDCl3) δ 1,06 (т, J=6,9 Гц, 6H), 2,52-2,59 (кв, J=7,2 Гц, 4H), 3,68 (с, 2H), 3,93 (с, 3H), 7,38-7,41 (дд, J=1,2 и 8,4 Гц, 1H), 7,78-7,84 (м, 2H), 8,03 (с, 1H).
Стадия 6: Раствор 6-[(диэтиламино)метил]бензо[b]тиофен-2-метилкарбоксилата (1,3 г, 4,7 ммоль) в THF (20 мл) медленно добавляли к перемешиваемому раствору LiAlH4/THF (1M, 6 мл, 6 ммоль) в THF (10 мл) при 3-6°C. Полученный раствор перемешивали при 3°C в течение 30 минут и затем гасили водой (5 мл). Смесь перемешивали с CH2Cl2 (40 мл) и насыщ. NaHCO3 (20 мл). Водный слой экстрагировали CH2Cl2 (2×30 мл), и объединенный раствор CH2Cl2 промывали водой (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая [6-[(диэтиламино)метил]бензо[b]тиофен-2-ил]метанол (1,0 г, 84%-ый выход): 1H ЯМР (CDCl3) δ 1,05 (т, J=6 Гц, 6H), 2,51-2,58 (кв, J=6 Гц, 4H), 2,72 (уш., 1H), 3,65 (с, 2H), 4,87 (с, 2H), 7,13 (д, J=3 Гц, 1H), 7,29-7,32 (д, J=9 Гц, 1H), 7,61 (д, J=9 Гц, 1H), 7,77 (с, 1H).
Стадия 7: Диизопропил азодикарбоксилат (0,9 г, 4,3 ммоль) добавляли к перемешиваемой суспензии связки трифенилфосфин-полимер (3,4 г, 5,4 ммоль) в THF (40 мл) при 3-5°C. После перемешивания при 3°C в течение 10 минут, раствор 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,1 г, 3,6 ммоль) и [6-[(диэтиламино)метил]бензо[b]тиофен-2-ил]метанола (0,9 г, 3,6 ммоль) в THF (80 мл) медленно добавляли при 3-6°C. Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Смесь фильтровали, и твердое вещество промывали CH2Cl2 (40 мл). Фильтрат концентрировали, и остаток растворяли в CH2Cl2 (100 мл) и промывали насыщ. NaHCO3 (30 мл), водой (30 мл) и солевым раствором (30 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, CH3OH:CH2Cl2 3:97), получая 5-амино-4-(4-((6-((диэтиламино)метил)бензо[b]тиофен-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (0,7 г, 35%-ый выход).
Стадия 8: Ссмесь 5-амино-4-(4-((6-((диэтиламино)метил)бензо[b]тиофен-2-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,7 г, 1,2 ммоль) и K2CO3 (0,2 г, 1,2 ммоль) в DMF (10 мл) нагревали при 80°C на масляной бане в течение 3 часов. Реакционную смесь охлаждали и разбавляли EtOAc (80 мл) и промывали водой (3×35 мл) и солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток кристаллизовали из горячего EtOAc (10 мл), получая 3-(4-((6-((диэтиламино)метил)бензо[b]тиофен-2-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (0,3 г, 44%-ый выход): Т. пл. 190-192°C; 1H ЯМР (ДМСО-d6) δ 0,98 (т, J=6 Гц, 6H), 1,96-2,02 (м, 1Н), 2,43-2,60 (м, 6H), 2,90-2,93 (м, 1H), 3,32 (с, 2H), 4,29 (д, J=18 Гц, 1H), 4,38 (д, J=18 Гц, 1H), 5,08-5,14 (дд, J=3 и 12 Гц, 1H), 5,57 (с, 2H), 7,73-7,53 (м, 5H), 7,75-7,85 (м, 2H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 11,60, 22,31, 31,18, 45,04, 46,11, 51,59, 56,82, 65,28, 115,26, 115,62, 121,94, 123,35, 123,52, 125,56, 129,79, 130,05, 133,40, 137,83, 139,42, 152,87, 167,89, 170,95, 172,80; Вычислено для C27H29N3O4S+0,2 H2O: C, 65,49; H, 5,98; N, 8,49; S, 6,48, Найдено: С, 65,25; H, 5,82; N, 8,38; S, 6,63.
5.298 3-(4-(4-(8-ОКСА-3-АЗАБИЦИКЛО[3.2.1]ОКТАН-3-ИЛМЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
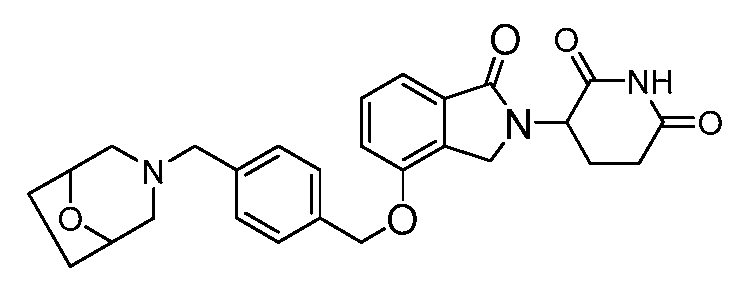
Стадия 1: Трифенилфосфин на полимерной подложке (1,6 ммоль/г, 14,2 г, 22,73 ммоль) добавляли при 0°C к перемешиваемой суспензии 5-амино-2-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (3,8 г, 11,36 ммоль) в THF (140 мл), с последующим добавлением диизопропил азодикарбоксилата (4,6 г, 22,73 ммоль). После перемешивания в течение 10 минут, добавляли (4-(хлорметил)фенил)метанол (2,67 г, 17,05 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи и фильтровали. Смолу промывали дихлорметаном (2×70 мл). Объединенные фильтраты концентрировали в вакууме, получая сироп, который разделяли между EtOAc (300 мл) и водой (100 мл). Органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая сырой продукт как желтое масло. Сырой продукт очищали ISCO (330 г колонка, градиент MeOH/CH2Cl2 от 0% до 5% за 50 минут), получая 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноат (4 г, 74%-ый выход); 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, CH3, CH3, CH3), 2,07 (д, J=1,1 Гц, 4H, CH2, CH2), 4,43 (с, 2H, CH2), 4,64-4,75 (м, 1H, CH), 4,78 (с, 2H, CH2), 5,27 (с, 2H, CH2), 6,67-6,86 (м, 1H, NHH), 7,17-7,27 (м, 1H, NHH), 7,32 (д, J=2,6 Гц, 2H, Ar), 7,49 (д, J=5,1 Гц, 5H, Ar).
Стадия 2: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (500 мг, 1,06 ммоль) в ацетонитриле (10 мл) добавляли 8-окса-3-азабицикло[3.2.1]октановый гидрохлорид (190 мг, 1,27 ммоль) и N,N-диизопропилэтиламин (410 мг, 3,17 ммоль). Образованную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали под вакуумом. Остаток забирали в этилацетате (100 мл), промывали водой (10 мл) и солевым раствором и высушивали над MgSO4. Растворитель выпаривали, получая 2-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат (560 мг, 96%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, CH3, СН3, СН3), 1,66-1,78 (м, 2Н, СН2), 1,82-1,92 (м, 2Н, СН2), 1,97-2,30 (м, 6Н, СН2, СН2, СН2), 3,44 (с, 2Н, СН2), 4,13-4,28 (м, 2Н, CH, СН), 4,42 (с, 2Н, СН2), 4,63-4,80 (м, 1Н, СН), 5,23 (с, 2Н, СН2), 6,65-6,87 (м, 1H, NHH), 7,15-7,27 (м, 1Н, NHH), 7,33 (д, J=9,3 Гц, 4H, Ar), 7,41-7,54 (м, 3Н, Ar).
Стадия 3: К суспензии 2-(4-(4-(8-окса-3-азабицикло[3.2.1] октан-3-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноата (560 мг, 1,019 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (137 мг, 1,223 ммоль). Смесь перемешивали при 0°C в течение 10 минут, нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь гасили уксусной кислотой (3 мл), THF удаляли под вакуумом, и остаток разделяли между этилацетатом (70 мл) и насыщенным раствором бикарбоната натрия (10 мл). Образовавшийся осадок фильтровали, и фильтрат промывали солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали, и сырой продукт очищали препаративной ВЭЖХ, получая 3-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (80 мг, 17%-ый выход); Т. пл.: 228-230°C; 1H ЯМР (ДМСО-d6) δ 1,58-2,31 (м, 6H, 6×CHH), 2,31-2,50 (м, 2H, CHH, CHH), 2,58 (д, J=18,3 Гц, 2H, CHH, CHH), 2,82-3,03 (м, 1H, CHH), 3,12 (уш.с, 1H, CHH), 3,39-3,60 (м, 2H, CH2), 3,92-4,76 (м, 4H, CH2, CH, CH), 5,11 (дд, J=5,0, 13,1 Гц, 1H, CH), 5,25 (уш.с, 2H, CH2), 7,12-7,84 (м, 7H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,34, 27,94, 31,16, 45,06, 51,56, 58,19, 60,95, 69,25, 73,58, 114,94, 115,26, 127,64, 129,80, 129,93, 133,30, 137,72, 153,43, 157,78, 158,20, 162,96, 167,97, 170,96, 172,81; LCMS MH=476; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, Градиент (ацетонитрил/0,1% HCOONH4) 5/95-95/5 за 5 мин, 95/5 10 мин: tR=5,26 (100%).
5.299 3-(4-(4-(8-ОКСА-3-АЗАБИЦИКЛО[3.2.1]ОКТАН-3-ИЛМЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
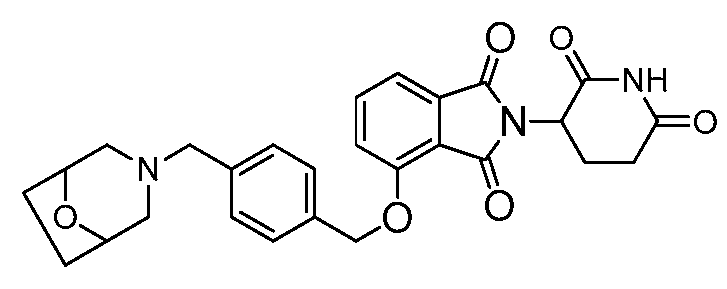
Стадия 1: К раствору 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (500 мг, 1,06 ммоль) в ацетонитриле (10 мл) добавляли 8-окса-3-азабицикло[3.2.1]октан гидрохлорид (190 мг, 1,27 ммоль) и N,N-диизопропилэтил-амин (410 мг, 3,17 ммоль). Сформированную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали под вакуумом. Остаток забирали в этилацетате (100 мл) и промывали водой (10 мл), солевым раствором, высушивали над MgSO4, растворитель выпаривали, получая 2-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат (560 мг, 96%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,39 (с, 9H, СН3, СН3, СН3), 1,66-1,78 (м, 2Н, СН2), 1,82-1,92 (м, 2Н, СН2), 1,97-2,30 (м, 6Н, СН2, СН2, СН2), 3,44 (с, 2H, СН2), 4,13-4,28 (м, 2Н, СН, СН), 4,42 (с, 2Н, СН2), 4,63-4,80 (м, 1H, СН), 5,23 (с, 2Н, СН2), 6,65-6,87 (м, 1H, NHH), 7,15-7,27 (м, 1H, NHH), 7,33 (д, J=9,3 , Гц, 4Н, Ar), 7,41-7,54 (м, 3Н, Ar).
Стадия 2: К суспензии 2-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноата (560 мг, 1,019 ммоль) в THF (20 мл) при 0°C добавляли трет-бутоксид калия (137 мг, 1,223 ммоль). Смесь перемешивали при 0°C в течение 10 минут, нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь гасили уксусной кислотой (3 мл), THF удаляли под вакуумом, остаток разделяли между этилацетатом (70 мл) и насыщенным раствором бикарбоната натрия (10 мл), сформированный осадок фильтровали, получая 2-((4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензил)окси)-6-((2,6-диоксопиперидин-3-ил)карбамоил)бензойную кислоту (210 мг, 38%-ый выход). 1H ЯМР (ДМСО-d6) δ 1,65-1,79 (м, 2H, CHH, CHH), 1,81-1,90 (м, 2H, CHH, CHH), 1,97 (д, J=3,4 Гц, 1H, CHH), 2,04 (уш.с, 1H, CHH), 2,16 (д, J=1,7 Гц, 1H, CHH), 2,20 (д, J=1,7 Гц, 1H, CHH), 2,41-2,50 (м, 2H, CHH, CHH), 2,57 (уш.с, 1H, CHH), 2,77 (с, 1H, CHH), 3,42 (с, 2H, CH2), 4,19 (дд, J=2,0, 4,2 Гц, 2H, CH, CH), 4,70 (с, 1H, CH), 5,16 (с, 2H, CH2), 7,17-7,35 (м, 4H, Ar), 7,35-7,53 (м, 3Н, Ar), 8,72 (д, J=8,5 Гц, 1H, NH), 10,85 (с, 1H, NH).
Стадия 3: Смесь 2-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-6-(2,6-диоксопиперидин-3-илкарбамоил)бензойной кислоты (210 мг, 0,41 ммоль) и триэтиламина (83 мг, 0,82 ммоль) в уксусной кислоте (5 мл) нагревали с обратным холодильником в течение ночи. Смесь охлаждали до температуры окружающей среды, уксусную кислоту удаляли под вакуумом, остаток разделяли между EtOAc (50 мл) и насыщенным раствором NaHCO3, органический слой промывали водой, солевым раствором, высушивали (MgSO4) и концентрировали в вакууме, получая сырой продукт. Сырой продукт ресуспендировали в простом эфире (2×5 мл) и фильтровали, получая 4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-илметил)бензилокси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион (120 мг, 78%-ый выход); Т.пл.: 196-198°C; 1H ЯМР (ДМСО-d6) δ 1,56-1,76 (м, 2H, CHH, CHH), 1,76-1,87 (м, 2H, CHH, CHH), 1,88-2,05 (м, 1H, CHH), 2,12 (д, J=10,6 Гц, 2H, CHH, CHH), 2,41 (уш.с, 2H, CHH, CHH), 2,45-2,63 (м, 2H, CHH, CHH), 2,79 (д, J=11,7 Гц, 1H, CHH), 3,37 (с, 2H, CH2), 4,12 (д, J=1,7 Гц, 2H, CH, CH), 5,02 (дд, J=5,4, 12,7 Гц, 1H, CH), 5,28 (с, 2H, CH2), 7,27 (д, J=7,9 Гц, 2H, Ar), 7,40 (дд, J=3,1, 7,6 Гц, 3H, Ar), 7,53 (д, J=8,5 Гц, 1H, Ar), 7,69-7,85 (м, 1H, Ar), 11,04 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,95, 28,29, 30,90, 48,73, 58,06, 61,11, 69,95, 73,69, 115,48, 116,56, 120,19, 127,28, 128,56, 133,24, 134,68, 136,97, 155,53, 165,29, 166,75, 169,87, 172,71; ВЭЖХ: Waters Xterra C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% HCOONH4 tR=3,97 (100%); Вычислено для C27H27N3O7+0,1 H2O; C, 66,00; H, 5,58; N, 8,55; Найдено: С, 65,96; H, 5,68; N, 8,27.
5.300 3-(4-(4-(3-ОКСА-8-АЗАБИЦИКЛО[3.2.1]ОКТАН-8-ИЛМЕТИЛ)БЕНЗИЛОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
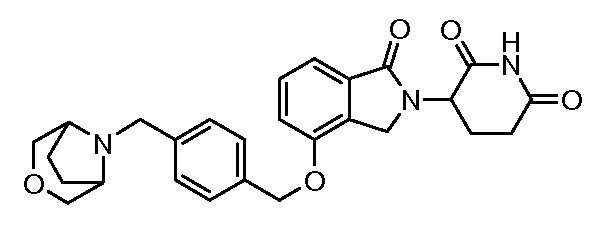
Стадия 1: 2-(4-(4-(3-Окса-8-азабицикло[3.2.1]октан-8-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат
К суспензии 5-амино-2-(4-(4-(хлорметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксо-трет-бутилпентаноата (500 мг, 1,06 ммоль) в MeCN (10 мл) добавляли (1R,5S)-3-окса-8-азабицикло[3.2.1]октан гидрохлорид (316 мг, 2,114 ммоль) и N,N-диизопропилэтиламин (0,41 мл, 2,33 ммоль). Смесь нагревали до 60°C и перемешивали в течение ночи. Через ~15 часов реакционную смесь концентрировали досуха, и твердый остаток разделяли между EtOAc (150 мл) и 1н. NaHCO3 (30 мл). Водный слой промывали дополнительным количеством EtOAc (150 мл). Органические слои объединяли, промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме и затем высушивали в вакуумном сушильном шкафу при 60°C, получая 2-(4-(4-(3-окса-8-азабицикло[3.2.1]октан-8-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат как твердое вещество белого цвета (580 мг, 100%-ый выход); LC/MS M+H=550. Это твердое вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 2: 2-(4-(4-(3-Окса-8-азабицикло[3.2.1]октан-8-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат
К охлажденному раствору 2-(4-(4-(3-окса-8-азабицикло[3.2.1]октан-8-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноата (580 мг, 1,06 ммоль) в THF (10 мл) в ванне со льдом добавляли KOtBu (154 мг, 1,38 ммоль) в форме твердого вещества в одной части. Ванну со льдом немедленно удаляли, и реакционную смесь перемешивали при температуре окружающей среды в течение 90 мин Реакционную смесь охлаждали в ванне со льдом и гасили добавлением уксусной кислоты (0,162 мл, 2,82 ммоль). Летучие компоненты удаляли в вакууме, получая твердое вещество белого цвета, которое разделяли между EtOAc (125 мл) и 1н. NaHCO3 (30 мл). Водный слой экстрагировали дополнительным количеством EtOAc (~75 мл). Объединенный органический слой промывали солевым раствором, высушивали (Na2SO4) и концентрировали в вакууме, получая твердое вещество грязно-белого цвета (сырой выход 400 мг). Твердое вещество растирали с Et2O (40 мл) при помощи обработки ультразвуком, собирали на воронке с фильтром и промывали дополнительным количеством Et2O. Подобное растирание проводили с водой (35 мл), и твердое вещество собирали на воронке с фильтром, высушивали отсасыванием, затем помещали в вакуумный сушильный шкаф при 60°C на несколько часов, получая 2-(4-(4-(3-окса-8-азабицикло[3.2.1]октан-8-илметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-амино-5-оксо-трет-бутилпентаноат как твердое вещество белого цвета (305 мг, 61%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 15/85 CH3CN/0,1% H3PO4, 6,81 мин (95,0%); Т. пл.: 243-245°C; 1H ЯМР (ДМСО-d6) δ 1,69-1,81 (м, 2H, CH2), 1,86-2,06 (м, 3H, 3×CHH), 2,33-2,48 (м, 1H, CHH), 2,52-2,64 (м, 1H, CHH), 2,81-3,02 (м, 3H, 3×CHH), 3,35-3,46 (м, 4H, CH2, CHH, CHH), 3,48-3,59 (м, 2H, CHH, CHH), 4,25 (д, J=17,4 Гц, 1H, CHH), 4,42 (д, J=17,6 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,22 (с, 2H, CH2), 7,27-7,55 (м, 7H, Ar), 10,97 (с, 1H, Ar); 13C ЯМР (ДМСО-d6) δ 22,33, 24,56, 31,18, 45,06, 51,55, 56,42, 59,89, 69,41, 72,51, 114,94, 115,19, 127,61, 128,60, 129,78, 129,93, 133,28, 134,99, 139,32, 153,49, 167,99, 170,96, 172,81; LC/MS M+H=476; Вычислено для C27H29N3O5+0,17 H2O+0,26 EtOAc: C, 67,15; H, 6,31; N, 8,38, Найдено: C, 67,15; H, 6,23; N,8,49.
5.301 3-[5-ХЛОР-4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
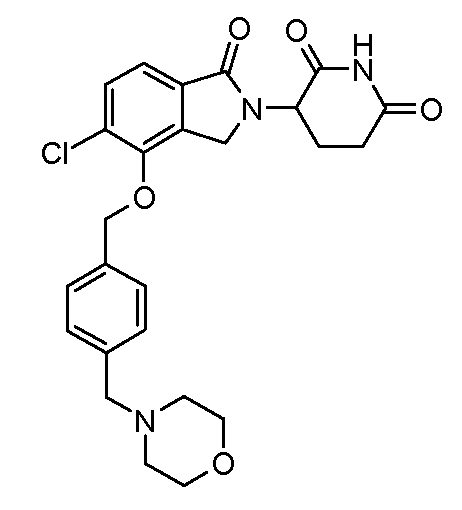
Стадия 1: Получение метилового эфира 4-хлор-3-гидрокси-2-метил-бензойной кислоты
К перемешиваемому раствору 4-хлор-3-гидрокси-2-метилбензойной кислоты (2,5 г, 13,40 ммоль) в MeOH (20 мл) добавляли серную кислоту (0,263 г, 2,68 ммоль). Полученный раствор вводили в реакцию при 62°C в течение двух дней. Реакционную смесь концентрировали, получая коричневый раствор (30 мл), к которым добавляли воду (80 мл). Смесь перемешивали и осаждали светло-коричневое твердое вещество. Смесь экстрагировали EtOAc (100 мл). Органический слой концентрировали и очищали на колонке с силикагелем (120 г EtOAc/Гексаны), получая метиловый эфир 4-хлор-3-гидрокси-2-метил-бензойной кислоты как твердое вещество белого цвета (6,9 г, 74%-ый выход). Его использовали на следующей стадии без дальнейшей обработки или очистки.
Стадия 2: Получение метилового эфира 3-(трет-бутил-диметил-силанилокси)-4-хлор-2-метил-бензойной кислоты
К перемешиваемому раствору 4-хлор-3-гидрокси-2-метилметилбензоата (6,34 г, 31,6 ммоль) и 1H-имидазола (5,38 г, 79 ммоль) в DMF (60 мл) в круглодонной колбе на 250 мл в ванне со льдом добавляли трет-бутилхлордиметилсилан (5,24 г, 34,8 ммоль). Через 20 минут ванну со льдом удаляли, и смесь перемешивали при температуре окружающей среды в течение 2 часов. К смеси добавляли воду со льдом (50 мл), полученный осадок экстрагировали этилацетатом (2×40 мл). Объединенные фазы EtOAc промывали водой (40 мл), солевым раствором (40 мл) и концентрировали до масла (14,08 г), которое очищали на колонке с силикагелем, получая метиловый эфир 3-(трет-бутил-диметил-силанилокси)-4-хлор-2-метил-бензойной кислоты в форме масла, 8,38 г, 84%-ый выход. Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 3: Получение метилового эфира 2-бромметил-3-(трет-бутил-диметил-силанилокси)-4-хлорбензойной кислоты
К раствору 3-(трет-бутилдиметилсилилокси)-4-хлор-2-метилметилбензоата (8,38 г, 26,6 ммоль) в метилацетате (50 мл, 26,6 ммоль) при температуре окружающей среды добавляли 1-бромпирролидин-2,5-дион (4,74 г, 26,6 ммоль). Смесь нагревали до 50°C в течение одного часа. Реакционную смесь охлаждали до температуры окружающей среды и промывали 50%-ым сульфитом натрия (Na2SO3, 50 мл), водой (50 мл) и солевым раствором (50 мл). Органическую фазу высушивали в MgSO4 и концентрировали до масла, которое очищали на колонке с силикагелем (120 г, 1%-ый EtOAc в градиенте гексанов до 5% за 18 минут), получая метиловый эфир 2-бромметил-3-(трет-бутил-диметил-силанилокси)-4-хлорбензойной кислоты в форме масла (9,53 г, 91%-ый выход). Продукт использовали на следующей стадии без дальнейшей очистки.
Стадия 4: Получение метилового эфира 4-[4-(трет-бутил-диметил-силанилокси)-5-хлор-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
К перемешиваемому раствору 2-(бромметил)-3-(трет-бутилдиметилсилилокси)-4-хлорметилбензоата (9,5 г, 24,13 ммоль) в ацетонитриле (90 мл) при температуре окружающей среды добавляли (S)-4,5-диамино-5-оксометилпентаноат гидрохлорид (5,22 г, 26,5 ммоль). К суспензии медленно добавляли N-этил-N-изопропилпропан-2-амин (8,37 мл, 50,7 ммоль). Суспензию нагревали при 40°C в течение 24 часов. Растворитель выпаривали, получая желтое масло, которое перемешивали в простом эфире (150 мл) в течение ночи. Суспензию фильтровали и промывали дополнительным количеством простого диэтилового эфира (50 мл), получая светло-желтое твердое вещество и фильтрат. Фильтрат промывали 1н. HCl (50 мл), насыщенным раствором бикарбоната натрия (80 мл), солевым раствором (50 мл). Эфирную фазу упаривали, получая метиловый эфир 4-[4-(трет-бутил-диметил-силанилокси)-5-хлор-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты в форме масла, 8,18 г, 76%-ый сырой выход. Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 5: Получение метилового эфира 4-карбамоил-4-(5-хлор-4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты
К перемешиваемому раствору (S)-5-амино-4-(4-(трет-бутилдиметилсилилокси)-5-хлор-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (8,16 г, 18,50 ммоль) в DMF (25 мл) и воде (10 мл) в ванне со льдом добавляли карбонат калия (1,279 г, 9,25 ммоль). Смесь перемешивали при температуре окружающей среды в течение одного часа. К коричневой смеси добавляли ацетонитрил (15 мл) и перемешивали при температуре окружающей среды в течение 10 минут. Растворитель выпаривали. Полученное масло очищали на колонке с силикагелем (MeOH/CH2Cl2, градиент от 0,5% до 8% за 60 минут), получая метиловый эфир 4-карбамоил-4-(5-хлор-4-гидрокси-1-оксо-1,3-дигидро-изоиндол-2-ил)-масляной кислоты в форме твердого вещества грязно-белого цвета (4,62 г, 76%-ый выход). Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 6: Получение метилового эфира 4-[4-(4-бромметил-бензилокси)-5-хлор-1-оксо-1,3-дигидро-изоиндол-2-ил]-4-карбамоил-масляной кислоты
Смесь 5-амино-4-(5-хлор-4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (4,6 г, 14,08 ммоль), 1,4-бис(бромметил)бензола (11,15 г, 42,2 ммоль) и карбоната калия (1,946 г, 14,08 ммоль) в ацетонитриле (70 мл) перемешивали при температуре окружающей среды в течение 10 минут, затем нагревали при 50°C в течение 5 часов. Реакционную смесь охлаждали до температуры окружающей среды, фильтровали и промывали ацетонитрилом, получая гелеподобное твердое вещество белого цвета. Фильтрат очищали на колонке с силикагелем (MeOH/CH2Cl2) до твердого вещества белого цвета (1,17 г, 16%-ый выход). Это вещество использовали на следующей стадии без дальнейшей очистки.
Стадия 7: Получение метилового эфира 4-карбамоил-4-[5-хлор-4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-масляной кислоты
К перемешиваемой суспензии 5-амино-4-(4-(4-(бромметил)бензилокси)-5-хлор-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,436 г, 0,855 ммоль) в ацетонитриле (10 мл) при температуре окружающей среды добавляли морфолин (0,745 мл, 8,55 ммоль) и перемешивали в течение одного часа. Растворитель выпаривали, получая масло, которое перемешивали в воде (15 мл) и EtOAc (20 мл). Смесь промывали водой (2×30 мл), солевым раствором (15 мл), высушивали и концентрировали, получая прозрачное масло (0,46 г, 104%-ый сырой выход). Его использовали на следующей стадии без дальнейшей очистки.
Стадия 8: Получение 3-[5-хлор-4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-диона
К перемешиваемому раствору 5-амино-4-(5-хлор-4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,44 г, 0,853 ммоль) в THF (10 мл) при 0°C в ванне со льдом добавляли 2-метилпропан-2-олат калия (0,192 г, 1,706 ммоль) и перемешивали в течение 10 минут. Реакционную смесь быстро гасили 1н. HCl до рН ~4 и нейтрализовали насыщенным NaHCO3 до рН ~7. Смесь экстрагировали EtOAc (2×30 мл), высушивали и упаривали до твердого вещества белого цвета, которое очищали на колонке с силикагелем, получая 3-[5-хлор-4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (72 мг, 17%-ый выход); Т. пл.: 224-226°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 95/5 за 5 мин, изократический при 95/5 за 5 мин (CH3CN/0,1% H3PO4), 4,62 мин (98,7%). 1H ЯМР (ДМСО-d6) δ 1,92-2,05 (м, 1H, СНН), 2,26-2,46 (м, 5H, СНН, CH2, CH2), 2,55-2,67 (м, 1Н, СНН), 2,83-3,01 (м, 1H, СНН), 3,47 (с, 2H, CH2), 3,52-3,62 (м, 4H, CH2, CH2), 4,39-4,66 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,21 (с, 2H, CH2), 7,29-7,39 (м, 2H, Ar), 7,41-7,53 (м, 3H, Ar), 7,66 (д, J=8,1 Гц, 1H, Ar), 11,02 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,30, 31,11, 45,79, 51,68, 53,14, 62,07, 66,17, 73,52, 118,96, 128,10, 128,95, 130,65, 132,74, 133,96, 135,16, 138,06, 149,42, 166,80, 170,69, 172,80, LC/MS (M+l)+=484; Вычислено для C25H26N3O5Cl: С, 62,05; H, 5,42; N, 8,68; Cl, 7,33, Найдено: С, 61,93; H, 5,42; N, 8,61; Cl, 7,22.
5.302 3-[5-МЕТИЛ-4-(4-МОРФОЛИН-4-ИЛМЕТИЛ-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
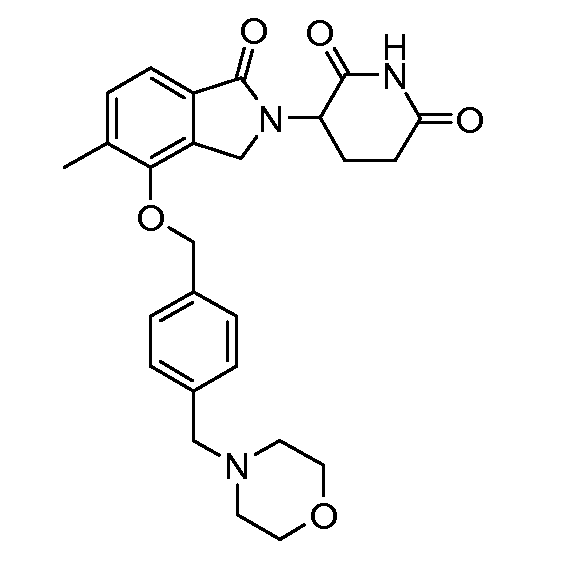
Смесь 3-(5-хлор-4-(4-(морфолинометил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,2 г, 0,413 ммоль), тетракис(трифенилфосфин)палладия(0) (0,096 г, 0,083 ммоль) промывали азотом и добавляли тетраметилстаннан (0,114 мл, 0,827 ммоль) в толуоле (3 мл) и DMF (1 мл). Смесь нагревали в микроволновой ампуле на 2-5 мл до 130°C с 12:20 в течение 2 часов. Смесь очищали препаративной ВЭЖХ (вода/MeCN, все с 0,1% HCOOH), получая 3-[5-метил-4-(4-морфолин-4-илметил-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (66 мг, 20%-ый выход); Т. пл.: 232-234°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 70/30 за 5 мин, изократический при 70/30 за 5 мин (CH3CN/0,1% H3PO4), 4,78 мин (96,3%). 1H ЯМР (ДМСО-d6) δ 1,90-2,07 (м, 1H, СНН), 2,23-2,48 (м, 8H, СНН, СН2, СН2, СН3), 2,55-2,67 (м, 1Н, СНН), 2,83-3,02 (м, 1Н, СНН), 3,42-3,50 (м, 2Н, СН2), 3,52-3,66 (м, 4Н, СН2, СН2), 4,35-4,64 (м, 2Н, СН2), 5,01-5,19 (м, 3H, NCH, СН2), 7,26-7,52 (м, 6Н, Ar), 11,00 (с, 1Н, NH). 13C ЯМР (ДМСО-d6) δ 16,47, 22,42, 31,18, 45,77, 51,55, 53,15, 62,13, 66,20, 72,82, 117,80, 127,97, 128,98, 131,30, 131,89, 133,74, 135,93, 137,80, 151,86, 167,74, 170,95, 172,90. LC/MS m/c=464. Вычислено для C26H29N3O5: С, 67,37; H, 6,31; N, 9,07. Найдено: С, 67,07; H, 6,24; N, 9,04.
5.303 3-(4-((3-((МЕТИЛАМИНО)МЕТИЛ)ИЗОКСАЗОЛ-5-ИЛ)МЕТОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
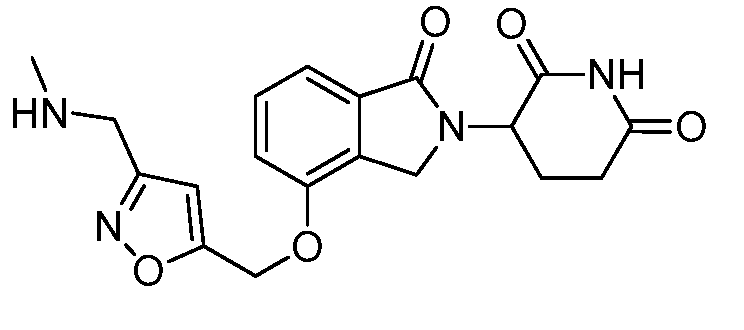
Стадия 1: (5-(((Трет-бутилдиметилсилил)окси)метил)изоксазол-3-ил)метанол
Боргидрид натрия (0,596 г, 15,77 ммоль) добавляли к перемешиваемой смеси 5-((трет-бутилдиметилсилилокси)метил)изоксазол-3-этилкарбоксилата (4,5 г, 15,77 ммоль) в этаноле (25 мл), и смесь перемешивали при температуре окружающей среды в течение 4 часов. Добавляли воду (50 мл) и смесь упаривали, чтобы удалить этанол. Оставшуюся водную фазу экстрагировали EtOAc (2×75 мл), и объединенные органические слои промывали солевым раствором (100 мл), высушивали (MgSO4) и упаривали, получая 3,67 г бесцветного масла; 1H ЯМР (CDCl3) 8 0,12 (с, 6H), 0,92 (с, 9Н), 4,70-4,82 (м, 4Н), 6,25 (с, 1Н).
Стадия 2: 3-(Бромметил)-5-(((трет-бутилдиметилсилил)окси)метил)изоксазол
Раствор (5-((трет-бутилдиметилсилилокси)метил)изоксазол-3-ил)метанола (3,47 г, 14,26 ммоль) в дихлорметане (25 мл) охлаждали до 0°C и добавляли трифенилфосфин (4,11 г, 15,68 ммоль) и тетрабромид углерода (4,49 г, 13,54 ммоль). Через 2 часа смесь упаривали под вакуумом, и остаток загружали непосредственно на колонку с силикагелем, работающую с градиентом гексаны-этилацетат, и элюировали продукт в 5%-ом EtOAc. Продукт получали как бесцветное масло, 3,7 г, при 85%-ом выходе; 1H ЯМР (CDCl3) δ 0,13 (с, 6H), 0,93 (с, 9Н), 4,41 (с, 2Н), 4,77 (с, 2Н), 6,29 (с, 1Н).
Стадия 3: ((5-(Гидроксиметил)изоксазол-3-ил)метил)метил)трет-бутилкарбамат
3-(Бромметил)-5-((трет-бутилдиметилсилилокси)метил)изоксазол (3,7 г, 12,08 ммоль) растворяли в 33%-ом (по весу) растворе метиламина в абсолютном этаноле (100 мл, 12,08 ммоль) (100 мл), и смесь перемешивали при температуре окружающей среды в течение 1 часа и затем упаривали досуха. Остаток растворяли в THF и добавляли ди-трет-бутил бикарбонат (5,80 г, 26,6 ммоль) и DIEA (6,94 мл, 39,9 ммоль). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Затем добавляли 5 мл буферного раствора с рН 7 и 1M TBAF в THF (20 мл), и смесь перемешивали при температуре окружающей среды в течение 3 часов. Затем смесь упаривали под вакуумом. Остаток разделяли между EtOAc (75 мл) и водой (100 мл). Водную фазу экстрагировали EtOAc (75 мл), и объединенные органические слои промывали водой (2×100 мл) и солевым раствором (100 мл), высушивали (MgSO4) и упаривали. Этот сырой продукт использовали непосредственно также на следующей стадии, без дальнейшей обработки или очистки.
Стадия 4: 5-Амино-4-(4-((3-(((трет-бутоксикарбонил)метиламино)метил)изоксазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат
Смесь 5-амино-4-(4-гидрокси-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (1,206 г, 4,13 ммоль) и (5-(гидроксиметил)изоксазол-3-ил)метил(метил)трет-бутилкарбамата (1 г, 4,13 ммоль) охлаждали до 0°C. Добавляли трифенилфосфин на полимерной подложке, 3 ммоль/г (2,75 г, 8,26 ммоль), затем DIAD (1,625 мл, 8,26 ммоль). Ванне со льдом давали растаять, и смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь фильтровали, и фильтрат упаривали. Остаток растворяли в EtOAc (100 мл) и промывали 10%-ым водным раствором Na2CO3 (2×100 мл) и водой (2×100 мл) и упаривали. Остаток хроматографировали, используя градиент метиленхлорид-ацетонитрил, элюируя продукт при 70-80% ацетонитрила и получая 0,50 г масла, при 24%-ом выходе.
Стадия 5: 3-(4-((3-((Метиламино)метил)изоксазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
Раствор 5-амино-4-(4-((3-((трет-бутоксикарбонил(метил)амино)метил)изоксазол-5-ил)метокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (0,5 г, 0,968 ммоль) в THF (100 мл) охлаждали до 0°C и добавляли трет-бутоксид калия (0,109 г, 0,968 ммоль). Перемешивание осуществляли при этой температуре, начиная в t=14:00. Через 30 минут смесь гасили AcOH (5 мл) и затем разделяли между насыщенным водным раствором NaHCO3 (100 мл) и EtOAc (100 мл), и водную фазу экстрагировали EtOAc (100 мл). Объединенные органические фазы промывали насыщенным водным раствором NaHCO3 (100 мл), водой (100 мл) и солевым раствором (100 мл), высушивали (MgSO4) и упаривали, получая 0,39 г масла. Остаток растворяли в CH2Cl2 (20 мл) при перемешивании при температуре окружающей среды и добавляли 2M HCl в Et2O (4 мл). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Затем смесь разделяли между водой (50 мл) и CH2Cl2 (50 мл), и водную фазу подщелачивали с использованием 10%-ого водного раствора карбоната натрия. Смесь экстрагировали в EtOAc (3×50 мл), и объединенные экстракты высушивали (MgSO4) и упаривали. После высушивания 160 мг были получены как твердое вещество белого цвета, при 43%-ом выходе; Т. пл. 220-222°C. ВЭЖХ: Waters X-Terra, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 5/95-95/5 CH3CN-0,1% NH4(HCO2) за 5 мин, затем 10 мин 95/5 CH3CN-0,1% NH4(HCO2): 3,70 (100%). 1H ЯМР (ДМСО-d6) δ 1,94-2,04 (м, 1H), 2,26 (с, 3H), 2,35-2,47 (м, 1H), 2,58 (д, J=17,8 Гц, 1H), 2,82-3,00 (м, 1H), 3,70 (с, 2H), 4,24 (д, J=17,6 Гц, 1H), 4,34-4,47 (м, J=17,6 Гц, 1H), 5,11 (дд, J=5,0, 13,1 Гц, 1H), 5,44 (с, 2H), 6,64 (с, 1H), 7,30-7,44 (м, 2H), 7,46-7,58 (м, 1H), 10,98 (с, 1H). 13C ЯМР (ДМСО-d6) δ 22,33, 31,20, 35,23, 45,02, 45,54, 51,62, 60,72, 103,86, 115,07, 115,96, 129,87, 129,94, 133,50, 152,68, 162,90, 166,98, 167,82, 170,94, 172,80. Вычислено для C19H20N4O5+0,5 H2O: C, 58,01%; Н, 5,38%; N, 14,24%; Найдено: С, 58,00%; H, 5,20%; N, 13,90%.
5.304 3-(1-ОКСО-4-((4-((4-(5-(2-ОКСОГЕКСАГИДРО-1Н-ТИЕНО[3,4-D]ИМИДАЗОЛ-4-ИЛ)ПЕНТАНОИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)БЕНЗИЛ)ОКСИ)ИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
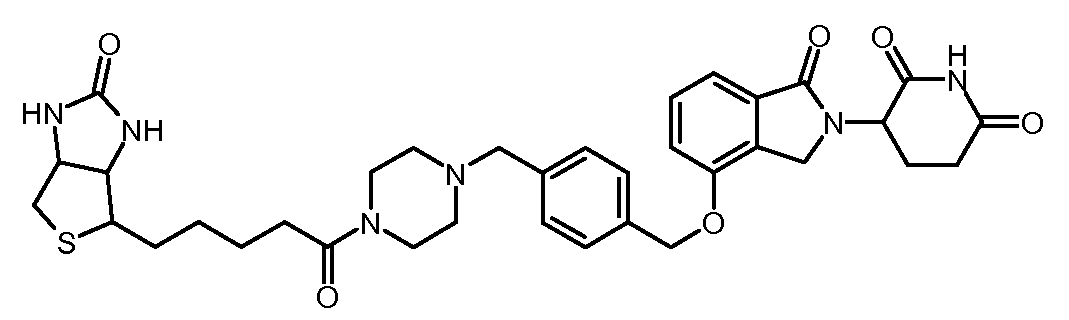
Стадия 1: Пиперазин-1-трет-бутилкарбоксилат (0,6 г, 3,2 ммоль) и N,N-диизопропилэтиламин (9,6 мл, 3,2 ммоль) добавляли к перемешиваемому раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,7 г, 1,6 ммоль) в CH2Cl2 (60 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь промывали водой (2×35 мл), солевым раствором (35 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 3%-ый CH3OH/CH2Cl2 в течение 15 минут, затем до 5% за 5 минут и поддерживали в течение 15 минут, затем до 10% за 5 минут и поддерживали в течение 15 минут), получая 4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пиперазин-1-трет-бутилкарбоксилат (0,7 г, 83%): 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H), 1,96-2,00 (м, 1H), 2,28-2,32 (м, 4H), 2,54-2,60 (м, 2H), 2,87-2,93 (м, 1H), 3,29-3,32 (м, 4H), 3,48 (с, 2H), 4,22-4,28 (д, J=18 Гц, 1H), 4,39-4,45 (д, J=18 Гц, 1H), 5,08-5,14 (дд, J=6 и 12 Гц, 1H), 5,23 (с, 2H), 7,31-7,51 (м, 7H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 28,00, 31,16, 45,06, 51,55, 52,30, 61,59, 69,36, 78,68, 114,94, 115,20, 127,63, 128,94, 129,78, 129,92, 133,27, 135,28, 137,72, 153,46, 153,74, 167,99, 170,95, 172,81.
Стадия 2: 4M HCL/диоксан (1,7 мл, 6,8 ммоль) добавляли к перемешиваемому раствору 4-(4-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-4-илокси)метил)бензил)пиперазин-1-трет-бутилкарбоксилата (0,7 г, 1,3 ммоль) в 1,4-диоксане (10 мл) и CH2Cl2 (10 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли 4M HCl/диоксан (1 мл) и смесь перемешивали в течение ночи. Добавляли простой эфир (20 мл), и твердое вещество собирали фильтрацией и высушивали, получая 3-(1-оксо-4-(4-(пиперазин-1-илметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,7 г, 100%): 1H ЯМР (ДМСО-d6) δ 1,97-2,01 (м, 1H), 2,42-2,62 (м, 2H), 2,86-2,98 (м, 1H), 3,35-3,37 (м, 8H), 4,25-4,48 (м, 4H), 5,09-5,15 (дд, J=6 и 12 Гц, 1H), 5,29 (с, 2H), 7,35-7,68 (м, 7H), 9,62 (уш., 2H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,36, 31,16, 45,06, 47,35, 51,58, 59,00, 66,30, 69,00, 114,96, 115,35, 127,83, 129,83, 129,95, 131,50, 133,34, 139,00, 153,35, 167,94, 170,96, 172,81.
Стадия 3: 3-(1-Оксо-4-(4-(пиперазин-1-илметил)бензилокси)изоиндолин-2-ил)пиперидин-2,6-дион (0,7 г, 1,3 ммоль) растворяли в DMF (10 мл). К этому раствору добавляли триэтиламин (0,4 г, 4,0 ммоль) и сложный эфир биотина и N-гидроксисукцинимида (0,4 г, 1,3 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали под вакуумом, и остаток растворяли в CH2Cl2 (120 мл). Раствор CH2Cl2 промывали водой (2×40 мл), солевым раствором (40 мл) и высушивали. Растворитель удаляли, и остаток очищали хроматографией (SiO2, 3% CH3OH/CH2Cl2 в течение 10 минут, затем до 10% за 10 минут и поддерживали в течение 10 минут, затем до 15% за 5 минут и поддерживали в течение 15 минут), получая 3-(1-оксо-4-((4-((4-(5-(2-оксогексагидро-1Н-тиено[3,4-d]имидазол-4-ил)пентаноил)пиперазин-1-ил)метил)бензил)окси)изоиндолин-2-ил)пиперидин-2,6-дион (0,5 г, 55%): Т. пл. 168-170°C; 1H ЯМР (ДМСО-d6) δ 1,35-1,63 (м, 5H), 1,98-2,09 (м, 1H), 2,25-2,60 (м, 9H), 2,82-2,85 (м, 2H), 3,05-3,15 (м, 1H), 3,37-3,49 (м, 7H), 4,11-4,45 (м, 4H), 5,08-5,14 (дд, J=6 и 15 Гц, 1H), 5,23 (с, 2H), 6,35 (с, 1H), 6,42 (с, 1H), 7,32-7,51 (м, 7H), 10,97 (с, 1H); 13C ЯМР (ДМСО-d6) δ 22,33, 24,82, 28,06, 28,23, 31,16, 32,04, 40,93, 45,07, 51,56, 52,50, 52,90, 55,41, 59,13, 60,98, 61,52, 69,36, 114,97, 115,22, 127,64, 128,95, 129,93, 133,28, 135,33, 137,72, 153,48, 162,63, 167,99, 170,44, 170,96, 172,83; Вычислено для C35H42N6O6S+1,0 H2O; C, 60,68; H, 6,40; N, 12,13, S, 4,68, Найдено: С, 60,32; H, 6,16; N, 11,68; S, 5,28.
5.305 3-(4-((4-((БИС(3,3,3-ТРИФТОРПРОПИЛ)АМИНО)МЕТИЛ)БЕНЗИЛ)ОКСИ)-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОН
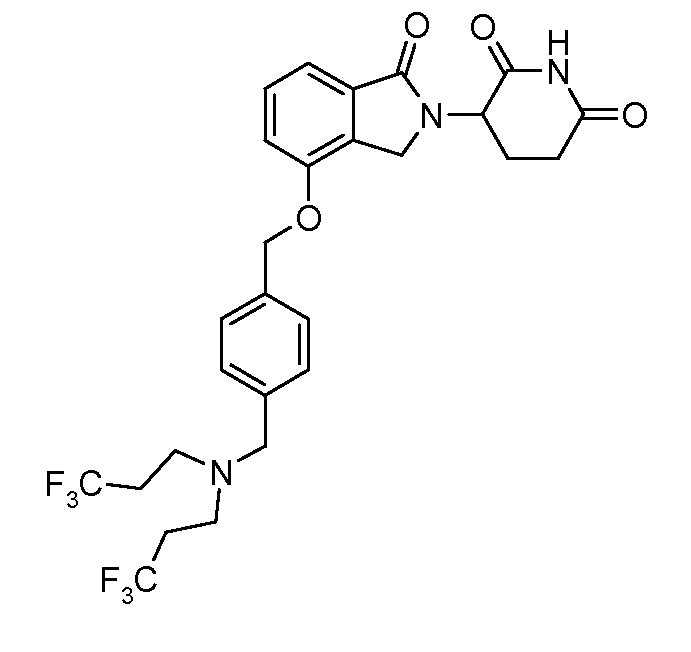
Стадия 1: 5-Амино-4-(4-((4-((бис(3,3,3-трифторпропил)амино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат
К раствору 5-амино-4-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноата (182 мг, 0,383 ммоль) в MeCN (5 мл) добавляли бис(3,3,3-трифторпропил)амин (80 мг, 0,383 ммоль) и DIEA (0,100 мл, 0,574 ммоль). Прозрачный раствор перемешивали при температуре окружающей среды в течение 2 часов и затем при 70°C в течение ночи. Через 24 часа реакционную смесь охлаждали до температуры окружающей среды и концентрировали в вакууме, получая 5-амино-4-(4-((4-((бис(3,3,3-трифторпропил)амино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат в форме масла. Сырой продукт использовали на следующей стадии без дальнейшей очистки, предполагая количественное превращение. LCMS: МН=604, ~95% область при 240 нм.
Стадия 2: 3-(4-((4-((Бис(3,3,3-трифторпропил)амино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион
Сырой продукт, полученный на Стадии 1, 5-амино-4-(4-(4-((бис(3,3,3-трифторпропил)амино)метил)бензилокси)-1-оксоизоиндолин-2-ил)-5-оксометилпентаноат (231 мг, 0,383 ммоль), растворяли в DMF (5 мл). К раствору добавляли безводный K2CO3 (159 мг, 1,148 ммоль). Смесь перемешивали в течение 20 часов при 85°C и затем давали стоять при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли EtOAc (~150 мл) и промывали 1н. водным раствором NaHCO3 (30 мл). Органический слой промывали водой (30 мл) и солевым раствором, высушивали над Na2SO4 и концентрировали в вакууме, получая желто-коричневое масло. Это масло растворяли в DMF (7 мл) и очищали с использованием препаративной ВЭЖХ с обратной фазой. Продукт элюировали с градиентом ацетонитрил/вода (0,1% муравьиной кислоты в обеих мобильных фазах, 30%-95% MeCN за 20 минут), и фракции собирали масс-триггером. Желаемые фракции объединяли и концентрировали в вакууме, пока не получали густую суспензию. Твердое вещество собирали на воронке из спеченного стекла, промывали дополнительным количеством воды и высушивали отсасыванием. Дальнейшее высушивание твердого вещества в вакуумном сушильном шкафу при 60°C дало 3-(4-((4-((бис(3,3,3-трифторпропил)амино)метил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион как твердое вещество белого цвета (57 мг, 26%-ый выход): ВЭЖХ: Waters Symmetry C-18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,77 мин (99,9%); Т. пл.: 107-109°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,06 (м, 1H, СНН), 2,34-2,49 (м, 5Н, СН2, СН2, СНН), 2,53-2,76 (м, 5Н, СН2, СН2, СНН), 2,82-3,03 (м, 1Н, СНН), 3,63 (уш.с, 2Н, СН2), 4,26 (д, J=17,6 Гц, 1Н, СНН), 4,43 (д, J=17,4 Гц, 1H, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 5,24 (с, 2H, СН2), 7,26-7,41 (м, 4Н, Ar), 7,41-7,60 (м, 3Н, Ar), 10,96 (с, 1H, NH); l3C ЯМР (ДМСО-d6) δ 22,33, 30,17 (кв, J=20,9 Гц, M02), 31,16, 45,07, 45,39, 51,58, 56,40, 69,35, 115,01, 115,22, 127,58, 128,62, 128,68, 128,92, 129,76, 129,96, 133,30, 153,46, 167,97, 170,93, 172,80.
CCF3 при 30,17 м.д. проявляется как дублет. CF3 не обнаружен, возможно вследствие расщепления; LCMS: МН=572; Анал. Вычислено для C27H27F6N3O4+0,6 H2O: C, 55,69; H, 4,88; N, 7,22; Найдено: C, 55,72; H, 4,83; N, 7,16.
5.306 3-{4-[4-(1H-БЕНЗОИМИДАЗОЛ-2-ИЛСУЛЬФАНИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
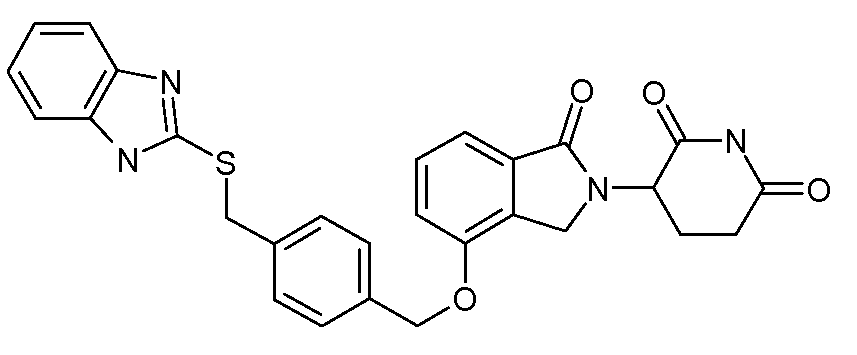
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,35 г, 0,790 ммоль) в CH2Cl2 добавляли 1H-бензо[d]имидазол-2-тиол (0,119 г, 0,790 ммоль) и DIPEA (0,276 мл, 1,579 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционная смесь 7545-071-B показала продукт и исходный материал. К смеси добавляли воду и CH2Cl2, затем экстрагировали. Органический слой очищали на колонке с силикагелем, элюируя CH2Cl2 и MeOH, получая 3-{4-[4-(1H-бензоимидазол-2-илсульфанилметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион как твердое вещество белого цвета (0,2 г, 49%). Температура плавления: 160-162°C. LCMS m/e=513. ВЭЖХ Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент 5/95-5/95 CH3CN/0,1% H3PO4 в H2O в течение 5 мин и остановка при 95/5 на 5 мин: 7,02 мин (97%), 1H ЯМР (ДМСО-d6) δ 1,81-2,03 (м, 1H, CHH), 2,26-2,47 (м, 1H, CHH), 2,53-2,63 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 4,13-4,47 (м, 2H, CH2), 4,58 (с, 2H, CH2), 5,09 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,20 (с, 2H, CH2), 7,04-7,18 (м, 2H, Ar), 7,26-7,34 (м, 2H, Ar), 7,37-7,63 (м, 7H, Ar), 10,95 (с, 1H, NH), 12,56 (уш.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,30, 31,16, 34,75, 45,06, 51,55, 69,22, 114,88, 115,22, 127,86, 128,92, 129,77, 129,95, 133,28, 135,66, 137,57, 149,59, 153,41, 167,97, 170,92, 172,80, Вычислено для C28H24N4O4S, C: 63,27%; H: 4,55%; N: 10,54%; Найдено: С: 62,94%; H: 4,59%; N: 10,40%.
5.307 3-[4-(4-{[ЭТИЛ-(2-ФЕНОКСИЭТИЛ)-АМИНО]-МЕТИЛ}-БЕНЗИЛОКСИ)-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ]-ПИПЕРИДИН-2,6-ДИОН
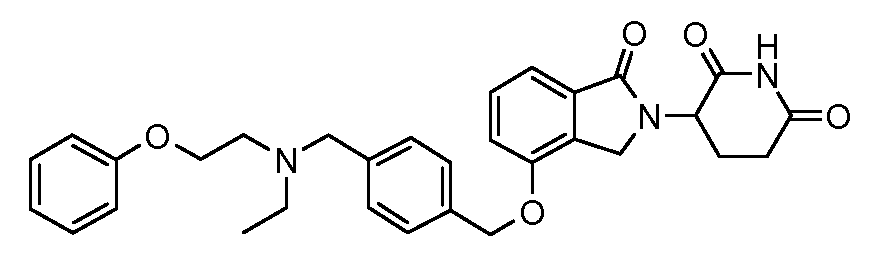
К раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (0,358 г, 0,808 ммоль) в CH3CN (10 мл) при температуре окружающей среды добавляли N-этил-2-феноксиэтанамин (0,160 г, 0,969 ммоль) и N-этил-N-изопропилпропан-2-амин (0,267 мл, 1,615 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение четырех часов. Растворитель выпаривали, и к остатку добавляли метиленхлорид (80 мл). Смесь промывали водой (2×50 мл), солевым раствором (50 мл), высушивали и концентрировали до масла, которое очищали на колонке с силикагелем (MeOH/CH2Cl2), получая 3-[4-(4-{[этил-(2-феноксиэтил)-амино]-метил}-бензилокси)-1-оксо-1,3-дигидро-изоиндол-2-ил]-пиперидин-2,6-дион как твердое вещество белого цвета (0,334 г, 78%-ый выход); Т. пл.: 94-96°C. ВЭЖХ: Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, градиент от 10/90 до 90/10 за 5 мин, изократический при 90/10 на 5 мин (CH3CN/0,1% H3PO4), 4,72 мин (96,2%). 1H ЯМР (ДМСО-d6) δ 1,01 (т, J=7,0 Гц, 3H, CH3), 1,91-2,05 (м, 1H, CHH), 2,35-2,48 (м, 1H, CHH), 2,52-2,64 (м, 3H, CHH, CH2), 2,80 (т, J=6,1 Гц, 2H, CH2), 2,84-2,99 (м, 1H, CHH), 3,66 (с, 2H, CH2), 4,03 (т, J=6,1 Гц, 2H, CH2), 4,19-4,47 (м, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 5,22 (с, 2H, CH2), 6,84-6,95 (м, 3H, Ar), 7,21-7,29 (м, 2H, Ar), 7,30-7,53 (м, 7H, Ar), 10,97 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 11,81, 22,36, 31,20, 45,09, 47,42, 51,37, 51,58, 57,50, 65,95, 69,47, 114,38, 114,97, 115,20, 120,39, 127,59, 128,61, 129,40, 129,79, 129,94, 133,29, 135,00, 139,65, 153,51, 158,40, 168,01, 170,95, 172,82. LC/MS MH=528. Вычислено для C31H33N3O5 (+0,1 H2O): C, 70,33; H, 6,32; N, 7,94. Найдено: С, 70,10; H, 6,22; N, 7,83.
5.308 3-{4-[4-(2-ДИЭТИЛАМИНО-ЭТИЛСУЛЬФАНИЛМЕТИЛ)-БЕНЗИЛОКСИ]-1-ОКСО-1,3-ДИГИДРО-ИЗОИНДОЛ-2-ИЛ}-ПИПЕРИДИН-2,6-ДИОН
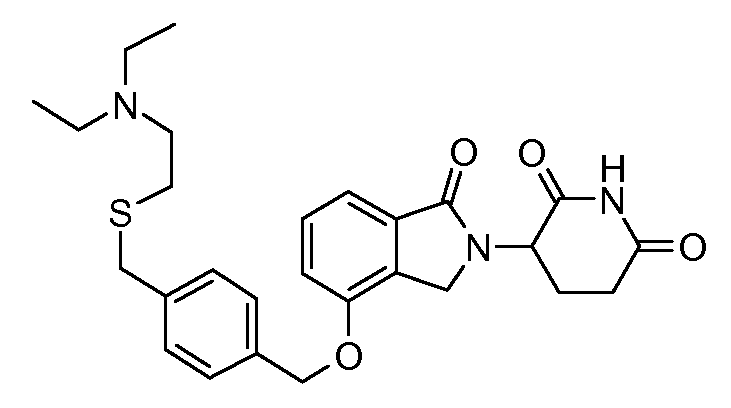
В 20-мл сцинт. ампуле 2-(диэтиламино)этантиол гидрохлорид (100 мг, 0,590 ммоль) добавляли к раствору 3-(4-(4-(бромметил)бензилокси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,451 ммоль) в ацетонитриле (5 мл, 96 ммоль). Все твердые частицы растворялись при перемешивании. К смеси добавляли N-этил-N-изопропилпропан-2-амин (0,197 мл, 1,128 ммоль), тетрабутиламмония бромид (29 мг, 0,09 ммоль), и желтоватый раствор перемешивали при температуре окружающей среды в течение ночи. Сырую смесь упаривали до масла, которое очищали препаративной ВЭЖХ, получая 3-{4-[4-(2-диэтиламино-этилсульфанилметил)-бензилокси]-1-оксо-1,3-дигидро-изоиндол-2-ил}-пиперидин-2,6-дион в форме твердого вещества грязно-белого цвета (69 мг, 30%-ый выход); Т. пл.: 135-137°C. ВЭЖХ (Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, изократический при 23%/77% MeCN/0,1% H3PO4): 3,99 мин (96,4%), ВЭЖХ (LC5 град): 4,69 мин (95,5%). 1H ЯМР (ДМСО-d6) δ 0,92 (т, J=7,2 Гц, 6H, 2CH3), 1,91-2,06 (м, 1H, CHH), 2,40-2,48 (м, 5H, CH2, CH2, CHH), 2,52-2,64 (м, 3H, CHH, CH2), 2,83-3,01 (м, 1H, CHH), 3,76 (с, 2H, CH2), 4,21-4,47 (м, 3H, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 5,23 (с, 2H, CH2), 7,29-7,38 (м, 4H, Ar), 7,41-7,53 (м, 3H, Ar), 8,21 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 11,53, 22,38, 28,21, 31,20, 34,96, 45,09, 46,17, 51,58, 52,12, 69,33, 115,00, 115,23, 127,77, 128,90, 129,78, 129,95, 133,31, 135,10, 138,67, 153,46, 163,65 (от HCOOH), 167,99, 170,95, 172,82. LC/MS m/e=496. Вычислено для C27H33N304S: C, 65,43; H, 6,71; N, 8,48.
5.309 ТЕСТЫ
5.309.1 Тест Ингибирования TNFα в hPMBC
Одноядерные клетки человеческой периферической крови (hPBMC) от нормальных доноров получали центрифугированием в градиенте плотности с использованием Ficoll Hypaque (Pharmacia, Piscataway, NJ, США). Клетки культивировали в RPMI 1640 (Life Technologies, Grand Island, NY, США), дополненной 10% AB+сыворотка человека (Gemini Bio-products, Woodland, CA, США), 2 мМ L-глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies).
PBMC (2×105 клеток) высевали в плоскодонные планшеты для культуры тканей Costar с 96 лунками (Corning, NY, США) в трех экземплярах. Клетки стимулировали ЛПС (от Salmonella abortus equi, Sigma кат. № L-1887, St.Louis, MO, США) с конечной концентрацией 1 нг/мл в отсутствие или в присутствии соединений. Соединения по изобретению растворяли в ДМСО (Sigma), и дальнейшее разбавление осуществляли в культуральной среде непосредственно перед использованием. Конечная концентрация ДМСО во всех тестах может составлять приблизительно 0,25%. Соединения добавляли к клеткам за 1 час до стимуляции ЛПС. Клетки затем инкубировали в течение 18-20 часов при 37°C в 5%-ом CO2, и супернатанты собирали, разбавляли культуральной средой и тестировали в отношении уровней TNFα с помощью ELISA (Endogen, Бостон, MA, США). IC50 вычисляли, используя нелинейную регрессию, сигмовидную кривую доза-ответ, ограничивая вершину значением 100% и основание - значением 0%, допуская переменный наклон (GraphPad Prism v3.02).
5.309.2 Продуцирование IL-2 и MIP-3α Т-клетками
PBMC очищали от адгерентных моноцитов, помещая 1×108 PBMC в 10 мл полной среды (RPMI 1640, дополненной 10% инактивированной высокой температурой эмбриональной бычьей сыворотки, 2 мМ L-глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина) на 10 см в чашку для культуры тканей, в инкубаторе с температурой 37°C, 5% CO2 в течение 30-60 минут. Чашку промывали средой, чтобы удалить все неадгерентные PBMC. Т-клетки очищали отрицательным отбором, используя следующее антитело (Pharmingen) и смесь Dynabead (Dynal) для каждых 1×108 неадгерентных PBMC: 0,3 мл гранул овечьего IgG против мыши, 15 мкл анти-CD16, 15 мкл анти-CD33, 15 мкл анти-CD56, 0,23 мл гранул анти-CD19, 0,23 мл гранул анти-HLA класс II и 56 мкл гранул анти-CD14. Клетки и смесь и гранулы/антитело центрифугировали в течение 30-60 минут при 4°C. Очищенные Т-клетки удаляли с гранул, используя магнит Dynal. Типичный выход составляет приблизительно 50% Т-клеток, 87-95% CD3+ на основании цитометрии потока.
Плоскодонные 96-луночные планшеты культуры тканей покрывали антителом анти-CD3 OKT3 в количестве 5 мкг/мл в PBS, 100 мкл на лунку, инкубировали при 37°C в течение 3-6 часов, затем промывали четыре раза полной средой 100 мкл/лунку непосредственно перед добавлением Т-клеток. Соединения разбавляли в 20 раз в круглодонном 96-луночном планшете для культуры тканей. Конечные концентрации составляли от приблизительно 10 мкМ до приблизительно 0,00064 мкМ. 10 мМ сток-раствора соединений по изобретению разбавляли 1:50 в полной среде для первого 20x разбавления 200 мкМ в 2%-ом ДМСО и последовательно разбавляли 1:5 в 2%-ом ДМСО. Соединение добавляли в 10 мкл в 200 мкл культуры, получая конечную концентрацию ДМСО 0,1%. Культуры инкубировали при 37°C, 5% CO2 в течение 2-3 дней, и супернатанты анализировали в отношении IL-2 и MIP-3α с помощью ELISA (R&D Systems). Уровни IL-2 и MIP-3α подвергали нормализации к количеству, продуцированному в присутствии некоторого количества соединения по изобретению, и EC50 вычисляли, используя нелинейную регрессию, сигмовидную кривую доза-ответ, ограничивая вершину значением 100% и основание - значением 0%, допуская переменный наклон (GraphPad Prism v3.02).
5.309.3 Тест пролиферации клеток
Линии клеток (например, Namalwa, MUTZ-5, UT-7 и различные линии клеток NHL) получали от Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Braunschweig, Германия). Линии клеток KG-1 получали от American Type Culture Collection (Manassas, VA, США). Пролиферацию клеток, индикатором которой является включение 3H-тимидина, измеряли на всех линиях клеток следующим образом.
Клетки высевали в планшеты с 96 лунками в плотности 6000 клеток на лунку в среде. Клетки предварительно обрабатывали соединениями в количестве приблизительно 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ в конечной концентрации ДМСО приблизительно 0,25%, в трех экземплярах при 37°C в увлажненном термостате при 5% CO2 в течение 72 часов. Один микрокюри 3H-тимидина (Amersham) добавляли в каждую лунку, и клетки снова инкубировали при 37°C в увлажненном термостате с 5% CO2 в течение 6 часов. Клетки собирали на фильтровальные пластины UniFilter GF/C (Perkin Elmer), используя клеточный харвестер (Tomtec), и планшетам давали высохнуть в течение ночи. Добавляли Microscint 20 (Packard) (25 мкл/лунка), и планшеты анализировали в TopCount NXT (Packard). Каждую лунку подсчитывали в течение одной минуты. Процент ингибирования пролиферации клеток вычисляли, усредняя все 3 экз. и подвергая нормализации к контролю ДМСО (ингибирование 0%). Каждое соединение проверяли на каждой линии клеток в трех отдельных экспериментах. Конечные IC50 вычисляли, используя нелинейную регрессию, сигмовидную кривую доза-ответ, ограничивая вершину значением 100% и основание - значением 0%, допуская переменный наклон (GraphPad Prism v3.02).
5.309.4 Иммунопреципитация и иммуноблоттинг
Клетки (например, различные линии клеток NHL) обрабатывали ДМСО или некоторым количеством соединения по изобретению в течение 1 часа, затем стимулировали с помощью 10 Ед/мл Epo (R&D Systems) в течение 30 минут. Получали лизаты клеток, и их либо подвергали иммунопреципитации с рецептором Epo Ab, либо отделяли немедленно с помощью SDS-PAGE. Иммуноблоты исследовали с Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS2, актином и IRF-1 Abs и анализировали на приборе для формирования изображений Storm 860, используя программное обеспечение ImageQuant (Molecular Dynamics).
5.309.5 Анализ клеточного цикла
Клетки обрабатывали ДМСО или некоторым количеством соединения по изобретению в течение ночи. Окрашивание пропидия йодидом для клеточного цикла осуществляли, используя CycleTEST PLUS (Becton Dickinson) согласно протоколу изготовителя. После окрашивания клетки анализировали поточным цитометром FACSCalibur, используя программное обеспечение ModFit LT (Becton Dickinson).
5.309.6 Анализ апоптоза
Клетки обрабатывали ДМСО или некоторым количеством соединения по изобретению в различные моменты времени, затем промывали моющим буфером аннексин-V (BD Biosciences). Клетки инкубировали с аннексин-V-связывающим белком и пропидия йодидом (BD Biosciences) в течение 10 минут. Образцы анализировали, используя цитометрию потока.
5.309.7 Люциферазный Тест
Клетки Namalwa трансфицировали 4 мкг AP1-люциферазы (Stratagene) в 1×106 клеток и 3 мкл реактива Lipofectamine 2000 (Invitrogen) согласно инструкциям изготовителя. Через шесть часов после трансфекции клетки обрабатывали ДМСО или некоторым количеством соединения по изобретению. Люциферазную активность тестировали, используя буфер для лизиса люциферазы и субстрат (Promega), и измеряли использованием люминометра (Turner Designs).
5.309.8 Ингибирование TNFα
Используя процедуры, в основном подобные приведенным выше в Разделе 5.309.1, определяли значения IC50 для некоторых соединений по изобретению в отношении ингибирования TNFα. Проверенные соединения включают соединения Примеров 5.2, 5.6-5.24, 5.29-5.46, 5.48-5.69, 5.71-5.133, 5.136-5.143, 5.151-5.155, 5.158-5.188, 5.193-5.201, 5.207, 5.224-5.289, 5.293-5.296 и 5.299-5.308.
Определенные значения IC50 составляли от приблизительно 0,02 нМ до приблизительно 2 мкМ. Эти результаты показывают, что соединения по изобретению могут быть использованы в качестве ингибиторов TNFα.
5.309.9 Продукция IL-2
Используя процедуры, в основном подобные описанным выше в Разделе 5.309.2, также определяли значения EC50 некоторых соединений по изобретению в отношении продукции IL-2. Проверенные соединения включают соединения Примеров 5.2, 5.6-5.24, 5.30-5.46, 5.48-5.57, 5.59-5.69, 5.71-5.133, 5.136-5.137, 5.139-5.143, 5.151-5.188, 5.194-5.201, 5.207, 5.216-5.289, 5.293-5.296, 5.300 и 5.303-5.308.
Определенные значения EC50 составляли от приблизительно 0,01 нМ до приблизительно 1,4 мкМ. Эти результаты показывают, что соединения по изобретению могут быть использованы в качестве стимуляторов продукции IL-2.
Варианты осуществления, описанные выше, служат только в качестве примеров, и специалисту понятно, что возможно, используя обычное экспериментирование, получить многочисленные эквиваленты специфических соединений, материалов и процедур. Все такие эквиваленты считаются находящимися в рамках заявленного объекта и охваченными приложенной формулой изобретения.
Все патенты, заявки на патент и публикации, упомянутые здесь, полностью включены в настоящее описание. Цитата или идентификация любой ссылки в этой заявке не означает, что такая ссылка доступна в качестве предшествующего уровня техники для заявленного объекта. Полный объем изобретения может быть лучше понят с помощью приложенной формулы изобретения.